Способ получения порошкообразных комплексных керамических материалов на основе тугоплавких металлов - RU2225837C2
Код документа: RU2225837C2
Чертежи







Описание
Изобретение относится к способу получениия определенных порошкообразных комплексных керамических материалов на основе тугоплавких металлов, в соответствии с которым окисел по меньшей мере одного из таких металлов смешивают с восстанавливающим металлом и с находящимся в твердой фазе полуметаллом, который может быть как в чистом виде, так и в соединении, и полученную смесь нагревают до некоторой пороговой температуры, при которой начинается самоподдерживающаяся химическая реакция, результатом которой является получение порошкообразного керамического материала.
Комплексные керамические материалы представляют собой такие соединения, которые содержат металлическую решетку из атомов тугоплавких металлов, внутри ячеек которой находятся атомы полуметаллов. Преимуществом таких соединений является то, что они сочетают свойства металлов и керамики. Благодаря своей твердости тугоплавкие металлы обладают особенно высокой износостойкостью, благодаря чему они находят применение, например, для режущих инструментов или для изделий, подлежащих полированию. С другой стороны, их устойчивость к химическим воздействиям и их хорошая электропроводность открывают возможность их применения в определенных отраслях химии, электроники и электрохимии.
Большинство таких керамических материалов получают в виде тонкослойных покрытий с использованием сложных и дорогих технологий, основанных на физическом или химическом осаждении из паровой фазы. Эти технологии позволяют измерять основные характеристики таких керамических материалов, однако, они не позволяют получать эти керамические материалы в промышленных количествах в виде субмикронных порошков, которые требуются для широкого спектра применений.
Используемые в настоящее время способы получения керамических материалов позволяют получать их в виде гранул сравнительно большого размера, которые затем приходится размалывать, однако, и после размалывания размер частиц в лучшем случае составляет несколько микрон.
В патенте Франции FR-2609461 раскрыт способ получения керамических композиций, образуемых полуметаллом и тугоплавким металлом. Согласно этому способу полуметалл подвергают реакции с некоторым восстанавливающим металлом в жидкой ванне, состоящей, хотя бы частично, из расплавленной соли этого восстанавливающего металла, в результате чего в растворе в ванне получают имеющее солевую природу промежуточное соединение между вышеупомянутым восстанавливающим металлом и вышеупомянутым полуметаллом. Затем в эту ванну в размельченном виде с непосредственным распределением по всей ванне вводят восстанавливающуюся соль тугоплавкого металла, в результате чего благодаря реакции между восстанавливающейся солью тугоплавкого металла и промежуточным соединением восстанавливающего металла получают порошок.
Используемая в этом способе технология требует больших вложений. Сам способ включает большое количество операций, и потому получение керамических композиций по этому способу обходится дорого. Кроме того, с помощью этого способа невозможно получать керамические материалы из окислов тугоплавких металлов, а именно в форме окислов дешевле всего было бы приобретать тугоплавкие металлы для получения таких керамических материалов. Это делает получаемые по этому способу керамические материалы еще дороже.
Кроме того, в статье "Preparation of TiC Powder from TiO2 by SHS Process" by Bok Suk Kang et al., J. of the Korean Instit of Met. and Mater., Vol. 31, No. 5, (1993) ("Приготовление порошка карбида титана (TiC) из двуокиси титана (ТiO2) с помощью процесса синтеза с саморазогреванием", авторы: Бок Сук Кан и др., Журнал Корейского Института металлов и материалов, N 5 (1993)) раскрыт способ получения порошка карбида титана (TiC) в виде частиц субмикронного размера из двуокиси титана (TiO2), смешиваемой с магнием (Мg) и углеродом (С), которые подвергают реакции по способу синтеза с саморазогреванием. В этой статье анализируется влияние пропорций магний-углерод на конечное качество продукта. В этой статье также определяется влияние размера частиц магния и времени перемешивания реагентов. Окись магния (МgО) и остаточный магний удаляются с помощью фильтрования в 20%-ном растворе соляной кислоты (НСl). Получаемый порошок представляет собой сферические частицы с размерами от 0,3 до 0,4 мкм с узкой кривой распределения.
Однако, как можно заметить, авторы этой статьи ограничиваются получением только карбида титана и только с использованием магния в качестве восстанавливающего металла. Использование магния является недостатком этого способа, так как этот металл имеет температуру кипения 1103°С, а по отношению к адиабатической температуре реакции это слишком низкая температура. Поэтому реакция является взрывоопасной, что делает промышленное применение этого способа проблематичным. Кроме того, плохая реакционная способность нагретого до высокой температуры магния ухудшает эффективность заключительного промывания порошка с помощью кислотного раствора.
Кроме того, в патенте США US 4459363 раскрыт способ получения нитридов, при котором окисел металла восстанавливают с помощью магния (Мg) или кальция (Са), а необходимый азот вводят в виде азидов, предпочтительно в виде азида натрия (NaN3). Однако использование азидов относится скорее к индустрии взрывчатых веществ, чем керамических материалов. Дело в том, что при этом способе риск взрыва слишком велик, чтобы его можно было без труда использовать в промышленных масштабах. Высокая степень нестабильности ионов N хорошо известна. Кроме того, при этом способе имеет место высвобождение натрия, которое отражено во всех приводимых в этом документе примерах. Это еще один недостаток этого способа, так как с точки зрения адиабатических температур предполагаемых реакций температура кипения этого элемента очень низка, в силу чего есть основания опасаться избыточного повышения давления.
Много реакций синтеза по способу синтеза с саморазогреванием было испытано экспериментально (см. статью IP Borovskaya in Pure and Applied Chamistry, Vol. 64, N 7, page 919 - 940, 1992 (Боровская И.П. Чистая и прикладная химия, том 64, N 7, с. 919 - 940, 1992)). Принцип проведения металлотермического восстановления окисла металла перед соединением его с другим элементом является вполне известным. Основные виды химических реакций, проводимых в соответствии с этим принципом, сведены в приводимой в вышеуказанной статье таблице 1. В качестве восстанавливающих элементов указаны магний или алюминий, но нет никакого упоминания о кальции. Для получения нитридов предлагается использовать азот, газообразный аммиак или соединения с очень высоким содержанием азота, которые весьма взрывоопасны. Для получения карбидов предпочтительно использовать такие существующие в газообразной форме соединения, как ацетилен (С2Н2), метан (CH4) или этилен (С2H4). Недостатком практически всех исследованных реакций является то, что для их проведения требуются емкости, способные выдерживать как высокие температуры, так и высокие давления. Неудивительно, что до промышленного применения могут дойти лишь немногие, если вообще такие найдутся, из этих реакций.
Целью предлагаемого изобретения является преодоление, хотя бы частичное, недостатков вышеуказанных способов, с тем чтобы сделать возможным контролируемое получение порошкообразных комплексных керамических материалов, с использованием реакции с саморазогреванием, из твердых исходных реагентов, которые промышленно доступны, и для которых не требуется емкостей, выдерживающих повышенное давление.
Предметом предлагаемого изобретения является обеспечивающий достижение вышеуказанной цели способ, раскрываемый в пункте 1 формулы изобретения.
Еще одним предметом предлагаемого изобретения является полученный по способу, который будет описан ниже, карбид, нитрид, карбонитрид, оксикарбид, оксинитрид, смешанный нитрид или смешанный карбид. Более конкретно и преимущественно, упомянутые смешанные карбиды представляют собой смесь карбида титана (TiC) и карбида гафния (HfC) в молярном соотношении от 40:60 до 50:50 соответственно.
Преимуществом использования тугоплавких металлов в виде окислов является низкая стоимость таких соединений, а также то, что эти соединения легко получить в виде очень тонкого порошка.
Было несколько причин предпочесть магнию кальций. Температура кипения кальция (1483 °С) заметно выше, чем температура кипения магния (1103°С), и хорошо согласуется с температурами, при которых протекают реакции. Кальций коммерчески доступен в виде порошка или в виде однородных сферических частиц, размер которых особенно хорошо согласуется с условиями протекания реакций. Наконец, образующаяся во время реакции окись кальция легко растворима в подкисленной воде, и ее можно очень легко удалить полосканием кислотным раствором.
Необходимый для получения карбидов углерод можно вводить или в чистом виде, в форме порошка, или в виде карбида кальция (СаС2), при этом использование данного соединения обеспечивает возможность одновременного введения полуметалла и некоторой части восстанавливающего металла, которые необходимы для реакции. И в том и в другом случае исходные углеродсодержащие реагенты весьма доступны по коммерчески очень выгодным ценам.
Угольный порошок имеет то преимущество, что его легко получить в виде частиц очень мелкого размера, благодаря чему возможно очень хорошее его перемешивание с другими реагентами. К недостаткам угольного порошка можно отнести то, что в случае его избыточного введения весьма проблематично полностью отделить остаточный угольный порошок от полученного в результате реакции порошкообразного керамического материала. Этот недостаток можно устранить путем добавления избыточного кальция, который вступает в соединение с углеродом.
Карбид кальция имеет то преимущество, что с его введением, в очень экономном виде, вводится часть необходимого для реакции кальция. Кроме того, в случае передозирования в конце реакции избыточный карбид кальция при полоскании кислотным раствором разлагается на газообразный этилен (С2Н4) и окись кальция (СаО), благодаря чему в полученном в результате реакции порошкообразном керамическом материале не остается посторонних остатков.
Азот, необходимый для получения нитридов, преимущественно вводится в виде нитрида кальция (Са3N2), который является порошкообразным продуктом, который может быть получен в виде тонкого порошка, простого в обращении, и который не является взрывоопасным. Это вещество легко получить в результате простой реакции между газообразным азотом и кальцием в печи при регулируемом температурном режиме. Кроме того, вместе с этим веществом вводится часть кальция, который используется в качестве восстанавливающего металла.
В случае получения карбонитридов кальций может быть введен в виде карбонитрида кальция (CaCN2), который также легко получить в виде порошка. Карбонитриды можно получать также путем смешивания карбида кальция (СаС2) и нитрида кальция (Са3N2), взятых в подходящих пропорциях. Ниже приводятся примеры реакций, осуществляемых в предпочтительных вариантах осуществления предлагаемого изобретения.
МO2+2Са+С → МС+2СаО;
2МO2+3Са+СаС2 → 2МС+4СаО;
2МO2+Са+Са3N2 → 2MN+4СаО;
М’O2+М"O2+4Са+2С → М’М"С2+4СаО;
М’O2+М"O2+Са+Ca3N2 → M’M"N2+4СаО;
3МO2+3Са+Ca2N2+С → <2MN/MC>+6СаО,
где М - тугоплавкий металл.
В каждой из вышеуказанных реакций единый окисел МО2 может быть заменен на смесь двух разных окислов тугоплавких металлов aM’O2+(1-а)М"O2, взятых в заданном молярном соотношении а:(1-а). Этим обеспечивается возможность получения смешанного керамического материала на основе двух тугоплавких металлов.
О том, что этот тип реакции дает преимущество с точки зрения свойств получаемых керамических материалов, известно из статьи "Material selection for hard coatings" by H. Holleck, Journal Vac. Sci. Technol., A4 (6), Nov/Dec (1986) (Холлек Х. Выбор материала для твердых покрытий. Журнал вакуумных научных технологий, A4 (6), ноябрь/декабрь 1986 г), в которой говорится, что смешанный карбид двух металлов обнаруживает существенно более высокую твердость, чем карбид каждого из металлов, смешанный карбид которых взят в отдельности, причем это увеличение твердости особенно заметно в том случае, когда эти два металла, участвующих в образовании смешанного карбида, титан (Ti) и гафний (Hf) (см. фиг.7).
В некоторых вариантах осуществления предлагаемого изобретения возможно достижение избыточно высоких температур, что может вредно влиять на ход реакции. Для регулирования температуры есть несколько средств.
Регулировать температуру реакции можно путем выбора формы и объема реактора. Так, превосходные результаты были получены при использовании трубообразного реактора, к которому обеспечивался доступ воздуха. Такой реактор можно при необходимости усовершенствовать, снабдив его внешним водяным охлаждением стенки реактора.
Регулировать температуру реакции можно также добавлением плавкой соли, например, хлористого натрия (NaCl), которая поглощает тепло при расплавлении. Было замечено, что добавление хлористого натрия (NaCl) повышает кинетику реакции. Кроме того, эта соль растворима в воде, поэтому ее можно удалять одновременно с образующейся во время реакции известью.
Наконец, контролировать температуру реакции можно добавлением к исходным реагентам в определенной пропорции продуктов, получающихся в результате реакции, например извести или керамического материала.
В том случае, когда желательно получить керамический материал в виде субмикронных частиц, рекомендуется, чтобы частицы взятого в качестве исходного материала окисла металла также были субмикронных размеров.
В некоторых применениях размер частиц получаемого керамического материала должен быть крупнее, и тогда можно использовать имеющиеся в изобилии дешевые окислы, например ильменит (титанистый железняк) или цирконовые пески. Для получения чистого керамического материала необходимо после реакции путем избирательного химического воздействия удалить окислы, которые образовал восстанавливающий металл. Но в некоторых случаях эти окислы можно и оставить, - если это будет сочтено полезным с точки зрения предполагаемого использования.
На прилагаемых чертежах иллюстрируются два варианта установки для осуществления способа, являющегося предметом предлагаемого изобретения, а также приводятся пояснительные графики и фотоснимки.
На фиг.1 изображен первый вариант установки для осуществления способа по предлагаемому изобретению.
На фиг.2 изображен второй вариант установки для осуществления способа по предлагаемому изобретению.
На фиг.3 и фиг.4 представлены сделанные с помощью сканирующего электронного микроскопа фотоснимки порошка керамического материала, полученного по предлагаемому способу.
На фиг.5 представлен рентгеновский дифракционный спектр, который позволяет путем анализа определить точный состав керамического порошка, такого как нитрид титана (TiN) и содержание в нем примесей.
На фиг.6 представлен рентгеновский дифракционный спектр смешанного карбида титата и гафния.
На фиг.7 графически представлены зависимости твердости смешанных карбидов от концентраций соответствующих двух металлов; эти графики взяты из упоминавшейся выше статьи X. Холлека.
Процесс осуществления способа по предлагаемому изобретению включает прежде всего стадию перемешивания до однородного состояния, с помощью промышленного смешивающего аппарата, взятых в стехиометрической пропорции порошкообразного окисла металла и, в зависимости от ситуации, угольного порошка или порошка карбида кальция, или же порошка нитрида кальция. Для того чтобы не допустить во время этого перемешивания химической реакции между перемешиваемыми компонентами, которая была бы несвоевременной, перед загрузкой в смешивающий аппарат нужно обеспечить, чтобы порошок окисла металла был совершенно сухим, что может быть достигнуто его прогреванием в сушильной камере при температуре 110 °С в течение одного часа. По завершении этого первого перемешивания к полученной смеси избыточно добавляют порошок кальция в количестве, превышающем приблизительно 10% от теоретического стехиометрического количества этого вещества, в результате чего получают окончательную смесь.
Реакция инициируется при умеренном подогревании всей массы смеси или ее части. Ограничиться подогреванием только части массы смеси можно потому, что реакция является в высшей степени экзотермической, и как только какая-то часть смеси будет доведена до пороговой температуры Тt, при которой начинается реакция, зона реакции начинает стремительно расширяться. Подогревание можно осуществлять с помощью печи, паяльной лампы, путем индукции или любым другим подходящим способом.
Нет принципиальных препятствий для того, чтобы проводить реакцию прямо в среде окружающего воздуха, для чего нужно только добавлять восстанавливающий металл в реагирующую систему в несколько избыточном количестве, однако, в целях предотвращения окисления материала реактора все же предпочтительно проводить реакцию в атмосфере нейтрального газа, например аргона.
Иллюстрируемый на фиг.1 вариант установки для осуществления способа по предлагаемому изобретению содержит тигель 1, выполненный из обычной стали марки ХС38 и предназначенный для размещения в нем смеси реагентов 2. Этот тигель 1 находится в закрытой камере 3, которая выполнена из тугоплавкой нержавеющей стали и с помощью трубки 4 сообщается с источником нейтрального газа (не показан), в качестве какового может использоваться азот в случае нитридов и аргон в случае карбидов. В дне тигля 1 выполнена выемка, в которой установлена термопара. Закрытая камера 3 помещена в муфель 5 электрической печи мощностью 3,3 кВт. В примерах, которые будут рассмотрены ниже, объем закрытой камеры 3 составляет 3 л, а объем тигля 1 составляет приблизительно 500 см3.
Первые испытания проводились с максимальными предосторожностями, так как были опасения, что произойдет взрывная реакция. Однако, напротив, было, к удивлению экспериментаторов, установлено, что химическая реакция начинается, когда температура в камере достигает, в зависимости от ситуации, величины от 450 до 800°С, и что зона реакции самопроизвольно распространяется по объему смеси реагентов без значительного повышения давления. Было обнаружено, что после охлаждения продукт реакции представляет собой легко размельчаемую порошкообразную массу.
После промывания раствором соляной кислоты, фильтрования через фильтр Бюхнера (Buechner) и просушивания в вакууме при температуре 60°С получались порошки с очень малым размером частиц, обычно порядка 0,35 мкм, что подтверждалось с помощью сканирующего электронного микроскопа. Химическая чистота полученного продукта составляла порядка 98% и, к удивлению экспериментаторов, агломераций зерен образовывалось очень мало, и они легко поддавались разматыванию. После этих первых успешных испытаний проводились эксперименты по осуществлению в упрощенном виде способа по предлагаемому изобретению, при этом использовалась установка, схематично изображенная на фиг.2. Реагентная загрузка 6 массой приблизительно 1 кг помещалась в выполненную из углеродистой стали изложницу 7 с размерами: ширина - 9 см, длина - 50 см, глубина - 3 см (объем изложницы таким образом составлял приблизительно 1350 см3), накрытую крышкой 8. Эта изложница 7 помещена внутрь имеющей форму параллелепипеда стальной камеры 9, которая закрыта крышкой 10. От одного конца камеры 9 отходит впускная трубка 11, которая соединена с источником нейтрального газа 12, в качестве нейтрального газа использовались азот или аргон. Поступающий нейтральный газ отклоняется по направлению к дну камеры 9 с помощью дефлектора 11а. С тем, чтобы обеспечить быстрое заполнение внутреннего пространства камеры 9 нейтральным газом и для обеспечения его течения, на другом конце этой камеры выполнено выпускное отверстие 13, которое расположено прямо над концом изложницы 7. Это выпускное отверстие 13 служит также для доступа к реагентной загрузке 6 для инициирования в ней химической реакции. Впоследствии, во время охлаждения, это выпускное отверстие можно, во избежание окисления деталей установки, закрыть. После инициирования химическая реакция распространялась по объему реагентной загрузки с той или иной скоростью, в зависимости от природы реагентов, от температурного режима изложницы 7 и от скорости течения нейтрального газа.
После охлаждения прореагировавшая заргузка постепенно выгружалась в выполненный из нержавеющей стали реактор с конической донной частью (не показан), который снабжен смешивающим аппаратом, содержащим приблизительно 10 л воды из водопроводной сети. После выхода газа смешивающий аппарат запускали и в него постепенно добавляли, при непрерывном отслеживании показателя рН, уксусную кислоту. По достижении нейтральной реакции раствора перемешивание прекращали, давая твердой фракции смеси осесть, после чего находящийся сверху раствор удаляли и вместо него заливали воду из водопроводной сети. При необходимости снова добавляли уксусную кислоту до достижения нейтральной реакции раствора. После перемешивания, которое выполняли в течение нескольких часов, смесь снова разделяли путем отстаивания, после чего воду, которая бралась из водопроводной сети, удаляли и заменяли ее деминерализованной водой. В этой деминерализованной воде порошок перемешивали в течение двух часов, затем давали порошку осесть, удаляли воду, находящуюся сверху, после чего через дно реактора удаляли порошок. После этого порошок окончательно фильтровали и подвергали просушке в реакторе в вакууме.
Пример 1.
Получали карбид титана (TiC) из двуокиси титана (ТiO2), кальция (Са) и углерода (С) с помощью следующей реакции:
TiO2+2Са+С → 2СаО+TiC.
Использовали 480 г двуокиси титана (TiO2) в виде порошка с субмикронным размером частиц, 72 г углерода (С) в виде сажи и 530 г кальция в виде шариков диаметром менее 500 мкм (таким образом, кальций был взят приблизительно с 10%-ным избытком по сравнению с теоретическим стехиометрическим количеством).
С помощью механического перемешивающего аппарата сначала подвергли перемешиванию двуокись титана (TiO2) и углерод, затем добавили кальций, и все подвергли перемешиванию. Полученную реагентную загрузку поместили в изложницу, и в среде потока аргона инициировали реакцию с одного конца реагентной загрузки с помощью паяльной лампы. Реакция протекала в течение приблизительно 3 мин. После охлаждения в атмосфере аргона порошкообразную смесь обработали как описано выше.
Было получено 349 г карбида титана (TiC) в виде субмикронного порошка с высокой степенью кристаллизации со средним размером частиц 0,7 мкм. Содержание кислорода составляло 0,6%.
Пример 2.
Получали карбид титана (TiC) из двуокиси титана (TiO2), кальция (Са) и карбида кальция (СаС2) с помощью следующей реакции:
2ТiO2+3Са+СаС2 → 2TiC+4СаО.
Использовали 450 г двуокиси титана (ТiO2), 225 г карбида кальция (СаС2) и 370 г кальция (Са).
Реакцию проводили как в предыдущем примере. Было получено 325 г карбида титана (ТiO2). Порошок по своим свойствам был идентичен порошку, полученному в примере 1, но содержание кислорода было выше и составляло 1,5%.
Пример 3.
Получали карбид гафния (HfC) из двуокиси гафния (НfO2), кальция (Са) и углерода (С) с помощью следующей реакции:
НfO2+2Са+С → HfC+2СаО.
Использовали 737 г двуокиси гафния (НfO2), 42 г углерода и 310 г кальция.
Реакцию проводили как в предыдущих примерах. Было получено 650 г карбида гафния (HfC) в виде порошка с высокой степенью кристаллизации со средним размером частиц 0,5 мкм.
Пример 4.
Получали нитрид титана (TiN) из двуокиси титана (ТiO2), кальция (Са) и нитрида кальция (Ca3N2) с помощью следующей реакции:
2ТiO2+Са+Ca3N2 → 2TiN+4СаО.
Использовали 448 г двуокиси титана (ТiO2); 415 г нитрида кальция (Ca3N2) и 130 г кальция (Са).
Реакцию проводили как в предыдущих примерах, за исключением того, что в качестве нейтрального газа использовали азот, и реакция протекала в потоке азота. Было получено 330 г нитрида титана (TiN). Полученный продукт показан на фотоснимке фиг.3, его дифракционный спектр показан на фиг.5. Химический анализ показал, что содержание кислорода в этом продукте составляло 0,7%.
Пример 5.
Получали нитрид циркония (ZrN) из двуокиси циркония (ZrO2), кальция (Са) и нитрида кальция (Ca3N2) с помощью следующей реакции:
2ZrO2+Са+Ca3N2 → 2ZrN+4СаО.
Использовали 555 г двуокиси циркония (ZrO2), 335 г нитрида кальция (Ca3N2) и 100 г кальция (Са).
Реакцию проводили как в примере 4 (в потоке азота). Было получено 460 г нитрида циркония (ZrN) в виде порошка со средним размером частиц 0,7 мкм.
Пример 6.
Получали нитрид гафния (HfN) из двуокиси гафния (НfO2), кальция (Са) и нитрида кальция (Са3N2) с помощью следующей реакции:
2НfO2+Са+Ca3N2 → 2HfN+4СаО.
Использовали 682 г двуокиси гафния (HfO2), 240 г нитрида кальция (Ca3N2) и 75 г кальция (Са).
Реакцию проводили как в примере 4 (в потоке азота). Было получено 602 г нитрида гафния (HfN) в виде порошка с размерами частиц менее 1 мкм.
Пример 7.
Получали смешанный карбид гафния и титана (Hf3Ti2C5) из двуокиси гафния (НfO2), двуокиси титана (ТiO2), углерода (С) и кальция (Са) с помощью следующей реакции:
3НfO2+2ТiO2+10Са+5С → Hf3Ti2C5+10СаО.
Использовали 442 г двуокиси гафния (НfO2), 192 г двуокиси титана (ТiO2), 54 г углерода (С) и 400 г кальция (Са). При приготовлении смеси реагентов сначала с особым тщанием приготовили однородную смесь порошков двух окислов.
Реакцию проводили как в примере 1. Было получено 530 г смешанного карбида гафния и титана (Hf3Ti2C5) в виде порошка со средним размером частиц 0,3 мкм. Фотоснимок полученного продукта представлен на фиг.4. Дифракционный спектр этого порошка, показанный на фиг.6, позволяет подсчитать, что параметр единичной ячейки у него составляет 4,52524

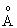
Этот результат позволяет сделать вывод, что образовалось единое вещество, смешанный карбид, в кристаллической структуре которого интегрированы два металла, в то время как можно было ожидать просто смеси кристаллов карбида гафния (HfC) и карбида титана (TiC). Этот неожиданный результат является большим преимуществом, так как позволяет очень легко получать смешанные карбиды, обладающие высокой твердостью.
Вероятно, при вышеописанных реакциях локальные температуры достигают таких значений, при которых элементы приобретают состояние в высшей степени реакционноспособного ионизированного газа, и в этом состоянии металлы и полуметаллы не отличаются друг от друга по свойствам, что дает основание предположить, что возможно получение любой комбинации из нескольких металлов и нескольких полуметаллов.
Окончательный состав определяется первоначальным составом реагентов. Это открывает возможности для синтеза не только смешанных карбидов, но также и карбонитридов в любых соотношениях.
Реферат
Изобретение предназначено для химической, электрохимической и керамической промышленности и может быть использовано при получении режущих инструментов, полировальных составов, химически стойких и электропроводных покрытий. Перемешивают 480 г окисла тугоплавкого металла, например, TiO2 с субмикронным размером частиц и 72 г неметалла - углерода в виде сажи. Добавляют 530 г (10% избыток от стехиометрии) восстанавливающего металла - кальция в виде шариков диаметром менее 500 мкм. Снова перемешивают. Смесь помещают в изложницу или трубообразный реактор, инициируют реакцию в потоке аргона. По окончании самораспространяющейся реакции продукт охлаждают в среде аргона. Образовавшуюся СаО растворяют в HCl или уксусной кислоте. Температуру реакции можно регулировать путем охлаждения стенки реактора. Получают субмикронный порошок TiC со средним размером частиц 0,7 мкм, содержащий 0,6% кислорода. В качестве окисла тугоплавкого металла можно использовать HfO2, ZrO2 или TiO2. Неметалл можно использовать в чистом виде или в виде кальцийсодержащего соединения, например, СаС2, Ca3N2 или CaCN2. Температуру реакции можно регулировать путем добавления к реакционной смеси плавкой соли, например, NaCl. Заявленный способ позволяет получать карбиды, нитриды, карбонитриды, оксикарбиды, оксинитриды, смешанные карбиды или нитриды. 2 с. и 9 з.п. ф-лы, 7 ил.

Комментарии