Материал на основе двуокиси кремния, способ получения материала, способ получения катализатора, способ алкилирования алифатического углеводорода, способ регенерации катализатора - RU2126295C1
Код документа: RU2126295C1
Чертежи
Описание
Изобретение относится к алкилированию алифатических углеводородов в присутствии кислотного катализатора и к самому катализатору.
Алкилирование алифатических углеводородов олефинами, катализируемое кислотой, является хорошо известным процессом при получении высокооктановых продуктов, которые добавляют к гадолинам для улучшения их свойств.
Эту реакцию можно проводить с использованием в качестве катализатора сильных минеральных кислот, в особенности концентрированной серной кислоты или безводной фтористоводородной кислоты. Эти кислоты используют в избытке по отношению к исходной смеси и в результате происходит образование олигомеров и большого количества фторированных и сульфированных побочных продуктов.
Кроме того, фтористоводородная кислота является низкокипящей жидкостью (температура кипения 19oC), которая в случае случайной утечки из резервуара может образовывать крайне коррозионные кислотные облака, которые являются трудноустранимыми. Серная кислота, которая требует реакционной температуры 10oC для поддержания достаточно высокого качества продукта, образует высоковязкие эмульсии, которые являются трудносмешиваемыми, и при ее использовании также образуется большое количество сульфинированных соединений, устранение которых является дорогостоящим.
Для устранения вышеупомянутых проблем были предложены для использования твердые катализаторы.
В частности, в патентах США N 3851004, 4384161, 3647916 и 5073665 описано использование Y и X-цеолитов, которые обмениваются с солями материалов, принадлежащих к лантановой группе. Эти катализаторы не показывают достаточно высокую производительность с точки зрения количества алкилированного продукта, для того, чтобы их можно было использовать в промышленном применении. К этому необходимо добавить короткий период каталитического цикла и ослабление каталитических свойств при последующих операциях регенерации.
В патенте Франции N 2631956 описано использование в качестве катализатора алкилирования β-цеолита в кислотной форме. Достигнутые в этом случае результаты не позволяют использовать указанные катализаторы на промышленном уровне. Предлагались также каталитические системы, основанные на кислотах Льюиса, главным образом AlCl3 и BF3, несомые на инертных оксидах (Патент США N 4918255, патент США N 4384161, заявка PCT N 900053, заявка PCT N 900054, патент США N 3855343, патент США N 4935577 и патент США N 5012039).
Наилучшие результаты были получены при использовании трифторида бора с добавлением следов воды, но проблемы, касающиеся устойчивости системы при рабочих условиях, оставались, главным образом, из-за потерь активной фазы.
Известно также использование в качестве катализатора трифторметансульфокислоты при алкилировании углеводородов олефинами.
В патенте США N 3970721, патенте США N 4118433, патенте Великобритании N 1463320 и патенте Канады N 1020590 описано использование этой кислоты в качестве добавки для серной кислоты или фтористоводородной кислоты для улучшения их каталитических свойств. Улучшение полученных результатов не является достаточным для компенсации возросшей стоимости, полученной в результате использования этого дорогостоящего реагента.
В EP N 433954 описан способ алкилирования углеводородов олефинами, в котором используют трифторметансульфокислоту, адсорбированную на заранее высушенной двуокиси кремния, используемой в качестве катализатора. Эта система дает возможность получить алкилат подходящего качества, но катализатор имеет со временем довольно низкую устойчивость из-за явления элюирования. Кроме того, присутствие свободной трифторметансульфокислоты можно легко привести к явлению коррозии.
Был найден катализатор для алкилирования углеводородов олефинами, которые проявляют не только превосходные каталитические свойства, превосходящие таковые при использовании трифторметансульфокислоты, адсорбируемой на двуокиси кремния, но также обладает значительной устойчивостью во времени и при этом его легко можно регенерировать.
Поэтому настоящее изобретение обеспечивает материал, основанный на двуокиси кремния, отличающийся тем, что поверхностные Si-OH группы упомянутой двуокиси кремния этерифицируют фторалкилсульфокислотой формулы CF3(CF2)n SO3H, где n представляет целое число между 0 и 11, при этом упомянутый материал имеет кислотность по Хаммету H0≤-11,4.
Материалы с кислотностью по Хаммету H0<-12 составляют предпочтительный аспект настоящего изобретения.
Предположительно материал настоящего изобретения несет на
поверхности двуокиси кремния заместители формулы /I/

В соответствии с ним при анализе29Si-MAS-ЯМР наблюдают сигнал при 110 ppm /част. на миллион/, /ссылка на TMS-тетраметилсилан/ типичный для объемной двуокиси кремния Si(OSi)4, и при -103 ppm, что характерно как для диоксида кремния с гидроксильным заместителем, Si-OH, так и для двуокиси кремния, связанной с O-S-заместителем, Si-O-S. Доказательство присутствия двух разновидностей сигнала при -103 ppm обеспечивалось использованием способа29Si-MAS-ЯМР в поперечной поляризации /CP/, в котором излучается сигнал ЯМР двуокиси кремния, пространственно близкий к водороду /тип Si-OH/.
Что касается сравнения спектра29Si-CP-MAS-ЯМР материалов настоящего изобретения с предшественником двуокиси кремния, то в спектре новых материалов отмечалось значительное понижение в присутствии разновидностей Si-OH, тогда как сигнал ЯМР не в CP при -103 ppm не снижался.
Это находится в соответствии с образованием химической связи между двуокисью кремния и фторалкилсульфокислотой, которая восстанавливает поверхностные разновидности /частицы/ /обнаруженные в CP/ до образования разновидностей /частиц/ кремний-кислород-сера Si-O-S /не обнаруженных в CP/.
Кроме того, материал настоящего изобретения показывает JP /инфракрасный/ сигнал при 1546 см-1 после обработки пиридином. Этот сигнал, свойственный взаимодействию пиридина с центром Bronsted, находится в соответствии с присутствием кислотной OH группы в формуле /1/. Материалы с кислотностью по Хаммету H0 между -11,4 и -12 также обеспечивают хорошую каталитическую характеристику.
Предпочтительно фторалкилсульфокислотой, которая этерифицирует поверхностные Si - OH группы двуокиси кремния, является кислота
формулы CF3/CF2/n SO3H, где n является целым числом между 0 и 5. Далее более предпочтительно используют трифторметансульфокислоту, CF3SO3H. В этом частном случае возможно, чтобы на поверхности двуокиси кремния присутствовали следующие заместители:
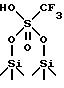
В соответствии с предпочтительным аспектом этот материал имеет кислотность по Хаммету между -13,5 и -14.
Настоящее изобретение также
обеспечивает способ получения вышеописанных новых материалов. Упомянутый способ включает
a) смешивание тетраэтоксисилана и фторалкансульфокислоты формулы CF3/CF2/n SO3H, где n - целое число между 0 и 11, в водном растворе при весовом соотношении CF3/CF2/nSO3H/Si /OEt/4 между 0,1 и 30% с
получением геля;
b) сушку полученного геля;
c) взаимодействие высушенного геля с тионилхлоридом при весовом соотношении SOCl2/гель между 100 и 1;
d) удаление
избытка тионилхлорида дистилляцией.
Стадию a), включающую гидролиз тетраэтоксисилана с помощью фторалкилсульфокислоты, проводят при температуре между окружающей и 100oC. Предпочтительным является разбавление фторалкилсульфокислоты дистиллированной водой, нагретой до выбранной температуры, и затем добавление тетраэтоксисилана.
Используемой фторалкилсульфокислотой является предпочтительно кислота формулы CF3(CF2)nSO3H, где n - целое число между 0 и 5. Далее более предпочтительно используют трифторметансульфокислоту, CF3SO3H (triflic кислота).
Время завершенного гелеобразования изменяется в зависимости от температуры и концентрации и обычно находится в диапазоне 0,5 - 24 часов.
Подходящее весовое отношение в реакционной смеси CF3(CF2)nSO3H/Si(OEt)4 выбирают в диапазоне 5 - 20%. Гель, образованный при последующем гидролизе, сушат на стадии b) под вакуумом при температуре между 20 и 80oC, предпочтительно 50 - 60oC в течение 12 - 48 часов.
Высушенный гель подвергают на стадии c) дегидратации тионилхлоридом. Реакцию проводят при температуре между 20 и 50oC в течение 4 - 12 часов. Затем тионилхлорид удаляют дистилляцией его под вакуумом предпочтительно при окружающей температуре.
Катализатор настоящего изобретения может быть подходяще получен способом термического типа.
Этот способ, который представляет еще один аспект настоящего изобретения, включает термообработку безводной двуокиси кремния и фторалкилсульфокислоты CF3(CF2)nSO3H, где n составляет между 0 и 11 при весовом соотношении CF3(CF2)nSO3H/SiO2, между 0,1 и 30%, предпочтительно между 5 и 20%, при температуре между 50 и 300oC, предпочтительно между 100 и 200oC в течение 12 - 48 часов.
Подходящими для работы являются температуры, близкие к температуре кипения кислоты.
Безводную двуокись кремния получают сушкой при температуре около 400oC в течение 12 - 48 часов. Используемой фторалкилсульфокислотой предпочтительно является кислота формулы CF3(CF2)nSO3H, где n - целое число между 0 и 5. Еще более предпочтительным является использование трифторметансульфокислоты. В соответствии с еще одним способом синтеза, который облегчает получение катализатора с однородным распределением активной фазы в соответствии с настоящим изобретением, фторалкилсульфокислоту растворяют в растворителе, смешанном с безводной двуокисью кремния при весовом отношении CF3(CF2)nSO3H/SiO2 между 0,1 и 30%, затем растворитель удаляют выпариванием, возможно под вакуумом, и систему подвергают термообработке при температуре между 50 и 300oC в течение 12 - 48 часов.
Растворителями, подходящими для этой цели, являются растворители, инертные как по отношению к фторалкилсульфокислоте, так и по отношению к двуокиси кремния и которые имеют температуру кипения ниже температуры кипения фторалкилсульфокислоты, с тем, чтобы их можно было легко удалить путем выпаривания при нагревании.
Подходящие растворители включают, например, воду, фреоны, трифторуксусную кислоту и трифторуксусный ангидрид. Предпочтительно используют фреон 1,1,2-трихлор-2,2,1-трифторэтан.
Катализатор настоящего изобретения является активным при алкилировании алифатических углеводородов олефинами, он имеет более высокие эксплуатационные качества, чем трифторметансульфокислота, адсорбированная на двуокиси кремния, катализатор является устойчивым со временем при реакционных условиях и его легко регенерировать.
Еще одним аспектом настоящего изобретения поэтому является способ алкилирования алифатических углеводородов олефинами в присутствии катализатора, основанного на двуокиси кремния, отличающийся тем, что поверхностные Si-OH группы упомянутой двуокиси кремния этерифицируют фторалкилсульфокислотой формулы CF3(CF2)nSO3H, где n является целым числом между 0 и 11, при этом упомянутый материал имеет кислотность по Хаммету H0≤-11,4.
Использование веществ с кислотностью по Хаммету H0<-12 составляет предпочтительный аспект настоящего изобретения.
Предпочтительно фторалкилсульфокислотой, используемой для этерификации поверхностных Si-OH групп двуокиси кремния, является кислота формулы CF3(CF2)nSO3H, где n является целым числом между 0 и 5.
Еще более предпочтительно использовать трифторметансульфокислоту (triflic кислоту) CF3SO3H.
Этот способ включает алкилирование основы алифатических углеводородов алкилирующим реагентом олефинового типа путем прохождение смеси углеводородов и олефина в условиях алкилирования через реактор с неподвижным слоем катализатора.
Реакцию алкилирования проводят при температуре между -20oC и 100oC при давлении между 5 и 40 атм и при часовой объемной скорости жидкости LHSV между 0,1 и 10 час-1. Рабочая температура близка к окружающей температуре, при этом объемная скорость составляет между 2 и 4 час-1, предпочтительно между 2 и 3 час-1.
Основа углеводорода состоит из C4-C10-изоалкана. Основой предпочтительно является изобутан.
Алкилирующим реагентом является C2-C10 олефин. Олефином предпочтительно является 1-бутен, 2-бутен или их смеси. Весовое отношение основы углеводорода к алкилирующему агенту в смеси, подаваемой в реактор, составляет между 5: 1 и 100:1. Продуктами, полученными этим способом, главным образом являются триметилпентаны (TMP), из которых продуктом, присутствующим в самой большой концентрации, является 2,2,4-триметилпентан (изооктан).
Катализатор настоящего изобретения можно легко регенерировать после
удаления из окружающей реакционной среды следующим образом:
1) путем промывки катализатора водой, полученной при гидролизе между двуокисью кремния и фторалкилсульфокислотой, и экстракции
фторалкилсульфокислоты в водную фазу,
2) путем регенерации двуокиси кремния термической обработкой в воздушной атмосфере при 400 - 700oC,
3) путем извлечения
фторалкилсульфокислоты из водной фазы дистилляцией и последующей сушки, затем взаимодействием ее с регенерированной двуокисью кремния при температуре между 50 и 300oC; предпочтительно 100
- 200oC, в течение 12 - 48 часов.
Последующие примеры представлены для иллюстрации настоящего изобретения.
Пример 1
Получение катализатора
В пробирку поместили 72 мл дистиллированной воды и нагрели до 60oC, после чего при перемешивании добавили 3 мл трифторметансульфокислоты. При поддержании указанной температуры добавили 42 г
тетраэтоксисилана. Законченного гелеобразования достигли приблизительно через 2 часа, полученный гель сушили при 50oC в течение 24 часов, после чего осуществляли взаимодействие его с 50 мл
тионилхлорида в течение 5 часов при 25oC. При окончании избыток тионилхлорида отгоняли под вакуумом при окружающей температуре. Получили катализатор, имеющий площадь поверхности 560 м2/г. Путем анализа методом ЯМР29Si и методикой поперечной поляризации было найдено, что в полученном продукте количество Si-OH групп, первоначально присутствующих на поверхности
двуокиси кремния, уменьшилось на 66% от их первоначального количества, поскольку образовались новые разновидности Si-O-S (34 %).
Пример 2
Получение катализатора
11
см3 двуокиси кремния 70 - 230 меш., которую предварительно сушили в течение 24 часов при 400oC, поместили в 14 мл бутылочку, изготовленную их высокотермостойкого стекла
(пирекса). Затем накапали 1 мл трифторметансульфокислоты, бутылочку герметически закрыли и сохраняли при 150oC в течение 48 часов.
Получили катализатор, имеющий площадь поверхности 500 м2/г. Используя анализ методом ЯМР29Si и методику поперечной поляризации, было найдено, что в полученном продукте количество Si-OH групп, первоначально присутствующих на поверхности двуокиси кремния, уменьшилось на 68% от их первоначального количества, поскольку образовались новые разновидности Si-O-S (32 %).
Пример 3
Получение катализатора
В предварительно нагретую пламенем колбу под азотом поместили 50 мл раствора, состоящего из 2 мл трифторметансульфокислоты в 48 мл безводного 1,1,2-трихлор-2,2,
1-трифторэтана и к этому раствору добавили 20 мл двуокиси кремния, 70 - 100 меш., предварительно обработанной при 400oC в течение 24 часов.
Систему сохраняли при перемешивании в течение 30 минут, после чего растворитель упаривали под вакуумом в течение 3 часов. После этого периода времени отметили полное исчезновение сигнала ЯМР, свойственного присутствию фтора в молекуле фреона.
Твердое, состоящее из двуокиси кремния и трифторметансульфокислоты, затем поместили в стеклянную бутылочку, которую герметично закрыли и сохраняли при 165oC в течение 24 часов.
Пример 4
Получение катализатора
Раствор, состоящий из 50 мл трифторуксусной кислоты и 2 мл трифторметансульфокислоты, поместили в 100 мл
колбу, предварительно нагретую пламенем и добавили 20 мл двуокиси кремния, предварительно обработанной при 400oC в течение 24 часов.
Затем раствор перемешивали в течение 30 минут, после чего отгоняли под вакуумом при 70oC в течение 5 часов трифторуксусную кислоту.
Затем на оставшемся твердом проводили ацидиметрическое титрование, обнаруженная концентрация кислотности составила 100% от содержания трифторметансульфокислоты.
Твердое, состоящее из двуокиси кремния и трифторметансульфокислоты, затем поместили в стеклянную бутылочку, которую герметически закрыли и сохраняли при 165oC в течение 24 часов.
Пример 5
Получение катализатора
Раствор, состоящий из 10 мл
дистиллированной воды и 2 мл трифторметансульфокислоты, поместили в 100 мл колбу и добавили 10 мл двуокиси кремния 70 - 100 меш.
Суспензию сушили под вакуумом при температуре 100oC в течение 12 часов. После этого периода времени получили продукт с H0=-11,4.
Пример 6
11 см3 катализатора, полученного в соответствии с примером
1, поместили в реактор диаметром 0,76 см и длиной 26 см.
Смесь, содержащую в качестве основы изобутан и в качестве алкилирующего реагента 1-бутен, при отношении бутан:1-бутен, равном 20:1, поместили в реактор при температуре 25oC, давлении 17 бар и скорости потока 0,9 мл/мин. Полученные результаты показаны в таблице 1, где % TMP показывает селективность триметилпентана; в вытекающем потоке трифторметансульфокислота не появилась.
Пример 7
11 см3 катализатора, полученного в соответствии с примером 2, поместили в реактор диаметром 0,
76 см и длиной 26 см.
Смесь, содержащую в качестве алкилирующего реагента 1-бутен, при отношении изобутан: 1-бутен, равном 20:1, поместили в реактор при температуре 25oC, давлении 17 бар и скорости потока 0,9 мл/мин. Полученные результаты показаны в таблице 2, где %TMP показывает селективность триметилпентана; в вытекающем потоке трифторметансульфокислота не появилась.
Пример 8
11 см3 катализатора, полученного в соответствии с примером 3, поместили в реактор диаметром 0,76 см и длиной 26 см.
Смесь, содержащую в качестве алкилирующего реагента 1-бутен, при отношении изобутан:1-бутен, равном 20:1, подали в реактор при температуре 25oC, давлении 24 бар и скорости потока 0,6 мл/мин.
Полученные результаты показаны в таблице 3,где %TMP показывает селективность триметилпентана; в вытекающем потоке трифторметансульфокислота не появилась.
Пример 9
10
см3 катализатора, полученного в соответствии с примером 4, поместили в реактор диаметром 0,76 см и длиной 26 см.
Смесь, содержащую в качестве основы изобутан и в качестве алкилирующего реагента 1-бутен при отношении изобутан:1-бутен, равном 20:1, поместили в реактор при температуре 25oC, давлении 24 бар и скорости потока 0,6 мл/мин.
Полученные результаты показаны в таблице 4,где %TMP показывает селективность триметилпентана; в течение 5 часов появление трифторметансульфокислоты не наблюдалось.
Пример 10
2,
2 см3 катализатора, полученного в соответствии с примером 5, поместили в реактор диаметром 0,76 см и длиной 26 см.
Смесь, содержащую в качестве основы изобутан и в качестве алкилирующего реагента 1-бутен при отношении изобутан:1-бутен, равном 20:1, поместили в реактор при температуре 25oC, давлении 20 бар и скорости потока 0,11 мл/мин.
Полученные результаты показаны в таблице 5,где %TMP показывает селективность триметилпентана; в течение 1 часа появление трифторметансульфокислоты не наблюдалось.
Пример 11 (Сравнительный). Следующий пример осуществляли в соответствии со способом, описанным в EP 433954, этот пример показывает, что трифторметансульфокислота, адсорбированная на двуокиси кремния, является менее активной в реакции алкилирования, чем катализатор настоящего изобретения. 11 см3 двуокиси кремния 70 - 230 меш поместили в реактор диаметром 0,76 см и длиной 26 см и нагревали в течение 2 часов в потоке сухого азота до 400oC. Затем его охлаждали под азотом, добавили 1 мл трифторметансульфокислоты и затем смесь, содержащую изобутан и 1-бутен при соотношении изобутан:1-бутен, равном 20:1, подавали в реактор при температуре 25oC, давлении 17 бар и скорости потока 0,9 мл/мин. Полученные результаты показаны в таблице 6,где TMP показывает селективность триметилпентана; в течение 3 часов 30 минут появление трифторметансульфокислоты не наблюдалось.
Наблюдаемое время элюирования зависит от длины слоя двуокиси кремния. Элюирование осуществлялось практически тотчас же, если трифторметансульфокислоту распределяли по всей двуокиси кремния, находящейся в реакторе.
Реферат
Способ алкилирования алифатических углеводородов олефинами, катализируемый материалом на основе двуокиси кремния, при этом поверхностные группы Si-ОН двуокиси кремния этерифицируют фторалкилсульфокислотой формулы CF3(CF2)nSO3H, где n - целое число от 0 до 11, при этом упомянутый материал имеет кислотность по Хаммету Ho ≤ -11,4. Указанный катализатор проявляет не только превосходные каталитические свойства, превосходящие таковые при использовании трифторметансульфокислоты, адсорбируемой на двуокиси кремния, но обладает также значительной устойчивостью во времени и при этом его легко можно регенерировать. 6 c. и 25 з.п.ф-лы, 6 табл.

Комментарии