Гетерогенные катализаторы окислительного дегидрирования алканов или окислительного сочетания метана - RU2708623C2
Код документа: RU2708623C2
Чертежи





















Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает преимущество предварительной заявки США №62/215879, поданной 9 сентября 2015 года, которая включена в настоящее описание посредством ссылки во всей ее полноте.
ЗАЯВЛЕНИЕ В ОТНОШЕНИИ ФИНАНСИРОВАНИЯ ИССЛЕДОВАНИЙ ИЛИ РАЗРАБОТОК ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА
N/A
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к способам катализа реакций, которые происходят в окислительных условиях, таких как окислительное дегидрирование алканов или окислительное сочетание метана, с использованием катализатора, содержащего бор и/или нитрид.
УРОВЕНЬ ТЕХНИКИ
С3 и С4 олефины, такие как пропилен (пропен), 1-бутен, изобутен и бутадиен, широко используют в качестве исходных веществ при промышленном синтезе различных важных химических продуктов. Основным промышленным способом получения С3 и С4 олефинов является паровой крекинг - нефтехимический процесс, в котором насыщенные углеводороды разлагают на более мелкие, часто ненасыщенные углеводороды. Продукты, получаемые при паровом крекинге, зависят от состава сырья, соотношения углеводород/пар, температуры крекинга и времени пребывания в печи. Например, исходная композиция, которая в основном содержит этан (этан-крекинг), приведет к высокому выходу этилена, тогда как исходная композиция, включающая более крупные углеводороды, такие как нафта (нафта-крекинг), приведет к большему выходу С3 и С4 олефинов.
За последнее десятилетие спрос на С3 и С4 олефины опередил производительность традиционных крекинг-установок, и эта тенденция, как ожидают, ускорится в течение следующего десятилетия. Например, нынешний мировой спрос на пропен составляет около 100 миллионов метрических тонн в год (МТА) и, как ожидают, он значительно возрастет в течение следующих пяти лет. Эту тенденцию объясняют прежде всего наличием дешевого сланцевого газа, что побудило многие химические компании реконструировать свои крекинг-установки по переработке нафты в крекинг-установки по переработке этана, что привело к увеличению производства этилена и уменьшению производства С3 и С4 олефинов с более длинной цепью. Соответственно, спрос на С3 и С4 олефины растет быстрее, чем он может быть обеспечен только за счет крекинга.
Поскольку производство С3 и С4 олефинов с помощью традиционного парового крекинга не удовлетворяло растущий спрос, были разработаны несколько альтернативных «целевых» технологий производства олефинов, с помощью которых можно превращать алканы с короткой цепью в соответствующие олефины. Примеры включают каталитическое дегидрирование (ДГ) алканов с короткой цепью, таких как пропан, в соответствующий олефин, такой как пропен, с использованием катализатора CrOx/Al2O3 на носителе («CATOFIN®» (Lummus)), сплава Pt/Sn, нанесенного на Al2O3 («OLEFLEX™» (UOP)) или Pt/Sn, нанесенных на алюминат цинка, с совместной подачей пара («STAR®» (Uhde)) (см. Sattler et al., Chem. Rev., 2014, 114 (20), 10613-10653).
Эти и другие применяемые в настоящее время целевые технологии дегидрирования являются энергоемкими, поскольку реакция дегидрирования является очень эндотермической. Кроме того, поскольку для них требуются высокие температуры, это приводит к значительной дезактивации катализатора вследствие образования кокса. Таким образом, необходима непрерывная регенерация катализатора. Кроме того, для этих процессов может потребоваться существенное снижение давления для смещения равновесия реакции дегидрирования в сторону образования желаемых продуктов, что дополнительно способствует повышению издержек производства, связанных с этими способами.
Окислительное дегидрирование (ОДГ), то есть каталитическое дегидрирование исходных алканов в присутствии кислорода, является представляющей интерес альтернативой традиционному дегидрированию, в которой преодолены все недостатки существующей технологии дегидрирования. Когда кислород совместно подают в качестве реагента, термодинамика реакции изменяется так, что полученная в результате реакция является экзотермической. Соответственно, реакция может протекать при гораздо более низких температурах, что приводит к снижению энергозатрат и повышению стабильности катализатора. За счет кислорода в подаваемом потоке также исключается образование кокса на поверхности катализатора и, следовательно, нет необходимости в регенерации катализатора.
Несмотря на эти предполагаемые преимущества, процессы окислительного дегидрирования в промышленном масштабе не были реализованы ввиду слабого контроля нежелательных побочных реакций (главным образом, это чрезмерное окисление олефина до СО и СО2), что приводит к низкой селективности образования олефинов при низких конверсиях, что в свою очередь препятствует промышленному внедрению. Например, при существующих катализаторах для окислительного дегидрирования пропана селективность образования пропена обычно составляет -50~60% при 10% конверсии пропана, причем побочные продукты в основном состоят из СО и СО2. В результате даже после более чем 30-летнего исследования по разработке катализатора окислительного дегидрирования (почти целиком сосредоточенного на нанесении оксида ванадия на подложки из аморфного оксида (например, SiO2, Al2O3, TiO2, СеО2, ZrO2) и структурированных оксидов (например, МСМ-41, SBA-15)) окислительное дегидрирование не было успешно использовано в промышленном масштабе при производстве С3 и С4 олефинов.
Соответственно, в данной области техники существует необходимость в усовершенствованных способах и катализаторах окислительного дегидрирования С3-С5 алканов в соответствующие олефины.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы изобретения раскрывают здесь новые и усовершенствованные способы катализа окислительного дегидрирования С2-С5 алканов или этилбензола до соответствующих С2-С5 олефинов или стирола, а также улучшенные способы катализа окислительного сочетания метана с образованием этана и/или этилена. В усовершенствованных способах используют катализаторы, содержащие бор, нитрид или как бор, так и нитрид, для существенного повышения селективности (и производительности) образования желаемого олефинового продукта реакции, при значительном уменьшении образования нежелательных побочных продуктов, таких как СО и СО2. В неограничивающем примере применение раскрытого катализатора для ОДГ пропана в пропен (ОДГП) обеспечило селективность образования пропена 77% при 17% конверсии пропана, причем побочные продукты состояли в основном из этилена с незначительным образованием СОх. Катализатор по примеру оставался активным в течение 8 дней без необходимости регенерационной обработки, демонстрируя заметное улучшение реакционной способности в течение этого периода времени.
Соответственно, изобретение относится к способу получения одного или более желаемых химических продуктов. Способ включает стадию приведения гетерогенного катализатора, содержащего бор, нитрид или оба эти вещества, в контакт с кислородом и одним или более жидкими или газообразными реагентами. Один или более желаемых химических продуктов образуются с помощью процесса, катализируемого гетерогенным катализатором. Процессы, которые могут быть катализированы гетерогенным катализатором, включают окислительное дегидрирование (ОДГ) или окислительное метановое сочетание (также известное как окислительное сочетание метана, ОСМ).
В некоторых воплощениях процесс, катализируемый гетерогенным катализатором, имеет ненулевой порядок по кислороду.
В некоторых воплощениях жидкий или газообразный реагент представляет собой алкан, а процесс, катализируемый гетерогенным катализатором, является окислительным дегидрированием, и один или более желаемых химических продуктов являются олефинами. В некоторых таких воплощениях алкан представляет собой С3-С5 алкан, включая С3-С5 н-алкан или изо-алкан, но не ограничиваясь ими. В некоторых таких воплощениях алкан представляет собой С4-С5 алкан, включая С3-С4 н-алкан или изо-алкан, но не ограничиваясь ими. В некоторых таких воплощениях С3-С4 алкан представляет собой пропан, н-бутан или изобутан, и один или более желаемых химических продуктов могут включать пропен, изобутен, 1-бутен, 2-бутен и/или бутадиен.
В некоторых воплощениях жидкий или газообразный реагент представляет собой углеводород, содержащий алкильную группу, а процесс, катализируемый гетерогенным катализатором, является окислительным дегидрированием, и один или более желаемых химических продуктов включают один или более углеводородов, содержащих алкенильную группу. В некоторых таких воплощениях углеводород, содержащий алкильную группу, представляет собой этилбензол, а один или более желаемых химических продуктов включают стирол.
В некоторых воплощениях способ обеспечивает селективность образования желаемых химических продуктов (например, олефинов), составляющую более 70% при конверсии алкана 10-20%. В некоторых таких воплощениях способ обеспечивает селективность образования олефина, составляющую более 77% при конверсии алкана 10-20%. В некоторых таких воплощениях способ обеспечивает селективность образования олефина, составляющую более 80% при конверсии алкана 10-20%.
В некоторых воплощениях алкан представляет собой пропан, а желаемые химические продукты включают пропен. В некоторых воплощениях алкан представляет собой н-бутан, а желаемые химические продукты включают 1-бутен и/или 2-бутен. В некоторых воплощениях алкан представляет собой изобутан, а желаемые химические продукты включают изобутен.
В некоторых воплощениях один или более желаемых химических продуктов дополнительно включают этилен. В некоторых таких воплощениях способ обеспечивает более высокую селективность образования этилена, чем нежелательных побочных продуктов СО или СО2. В некоторых таких воплощениях способ обеспечивает общую селективность образования пропена, этилена и других желаемых продуктов (например, других олефинов), составляющую более 90%.
В некоторых воплощениях один или более жидких или газообразных реагентов включают метан, гетерогенный катализатор катализирует окислительное сочетание метана, а один или более желаемых химических продуктов включают этан и/или этилен. В некоторых таких воплощениях гетерогенный катализатор приводят в контакт с природным газом.
В некоторых воплощениях гетерогенный катализатор включает борсодержащее или нитридсодержащее соединение.
В некоторых воплощениях гетерогенный катализатор включает нитридсодержащее соединение. В некоторых таких воплощениях нитридсодержащее соединение представляет собой В-нитрид, Si-нитрид, Ti-нитрид или Al-нитрид.
В некоторых воплощениях гетерогенный катализатор включает борсодержащее соединение. В некоторых таких воплощениях борсодержащее соединение представляет собой В-нитрид, В-карбид, Ti-борид, Ni-борид или Nb-борид.
В некоторых воплощениях бор- или нитридсодержащее соединение представляет собой нитрид бора. В некоторых таких воплощениях нитрид бора имеет площадь поверхности более 5 м2/г, более 10 м2/г, более 20 м2/г, более 30 м2/г, более 40 м2/г, более 50 м2/г, более 60 м2/г, более 70 м2/г, более 80 м2/г, более 90 м2/г, более 100 м2/г, более 110 м2/г, более 120 м2/г, более 130 м2/г, более 140 м2/г, более 150 м2/г, более 180 м2/г, более 200 м2/г, более 250 м2/г, более 300 м2/г, более 350 м2/г, более 400 м2/г, более 450 м2/г или более 500 м2/г. В некоторых таких воплощениях нитрид бора имеет площадь поверхности примерно от 5 м2/г до 550 м2/г, примерно от 9 м2/г до 550 м2/г, примерно от 50 м2/г до 550 м2/г, примерно от 100 м2/г до 500 м2/г или примерно от 100 м2/г до 200 м2/г. В некоторых примерах воплощения нитрид бора имеет площадь поверхности примерно 150 м2/г, примерно 180 м2/г, примерно 200 м2/г, примерно 250 м2/г, примерно 300 м2/г, примерно 350 м2/г, примерно 450 м2/г или примерно 500 м2/г.
В некоторых воплощениях нитрид бора находится в виде гексагонального нитрида бора (h-BN), нанотрубок из нитрида бора (BNNTs), нанолистов из нитрида бора (BNNSs), нанолент из нитрида бора (BNNRs) или наносетей из нитрида бора (h-BN наносети).
В некоторых воплощениях нитрид бора дополнительно включает атомы кислорода. В некоторых таких воплощениях атомы кислорода ковалентно связаны с атомами бора, азота и/или другими атомами кислорода. В некоторых воплощениях атомы кислорода могут быть связаны (функционализированы) с поверхностью нитрида бора.
В некоторых воплощениях гетерогенный катализатор включает оксинитрид.
В некоторых воплощениях гетерогенный катализатор одновременно не контактирует с азотом.
В некоторых воплощениях кислород и один или более жидких или газообразных реагентов находятся в потоке реагентов, который приводят в контакт с гетерогенным катализатором. В некоторых таких воплощениях поток реагентов включает от 0% до 70% азота по объему.
Дополнительные объекты, признаки и преимущества изобретения будут очевидны из последующего подробного описания, приведенного вместе с прилагаемыми чертежами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Описание изобретения будет лучше понятно, а признаки, аспекты и преимущества, отличные от изложенных выше, станут очевидными, когда они будут рассмотрены в следующем подробном описании. В этом подробном описании приведена ссылка на следующие чертежи.
На Фиг. 1 представлен график, показывающий зависимость селективности образования пропена от конверсии пропана при ОДГП с использованием нитрида бора (BN) и традиционных катализаторов. Катализатор BN показывает гораздо более стабильную селективность образования пропена с увеличением конверсии пропана, чем более традиционный оксиднованадиевый катализатор, нанесенный на SiO2 (V/SiO2) или SBA-15(V/SBA-15).
На Фиг. 2 представлена диаграмма, показывающая зависимость между селективностью образования продуктов и конверсией пропана при использовании оксида ванадия, нанесенного на SiO2 (V/SiO2), или при использовании катализатора BN. Селективность образования продуктов представлена столбцами и показана на левой оси, а конверсия пропана представлена черными ромбами и показана на правой оси.
На Фиг. 3 представлена диаграмма, на которой показаны результаты испытания на долговременную стабильность катализатора BN, с целью обнаружения каких-либо признаков дезактивации катализатора. Конверсия пропана и выход пропена (черный и белый квадраты, соответственно) показаны на левой оси, тогда как селективность образования пропена (круги) показана на правой оси.
На Фиг. 4 представлена диаграмма, на которой показана высокая селективность образования пропена при относительно высоких конверсиях пропана с использованием катализатора BN, предоставленного двумя отдельными поставщиками химических веществ.
На Фиг. 5 представлена диаграмма, на которой показаны селективность образования продуктов и конверсия пропана с использованием различных бор- или нитридсодержащих катализаторов, которые были подвергнуты тестированию на окислительное дегидрирование пропана (ОДГП). Селективность образования продуктов представлена заштрихованными столбцами и показана на левой оси, а конверсия пропана в процентах представлена черными ромбами и показана на правой оси.
На Фиг. 6 представлена диаграмма, показывающая зависимость селективности образования пропена от конверсии пропана при ОДГП с использованием различных катализаторов. Бор- и нитридсодержащие катализаторы показывают активность ОДГП.
На Фиг. 7А представлена сравнительная диаграмма, показывающая зависимость селективности образования пропена от конверсии пропана при ОДГП, на которой приведены известные данные для типичных катализаторов и данные для гексагонального нитрида бора (h-BN) и нанотрубок из нитрида бора (BNNT). Незакрашенные фигуры относятся к данным из других работ, процитированных на этом чертеже (1-7; 1: В. Frank, A. Dinse, О. Ovsitser, Е.V. Kondratenko, R. Schomaecker, Appl. Catal. A: Gen., 323, 66-76 (2007); 2: C.L. Pieck, M.A. Banares, J. L. G. Fierro, J. Catal, 224, 1-7 (2004); 3: A. Christodoulakis, M. Machli, A.A. Lemonidou, S. Boghosian, J. Catal, 222, 293-306 (2004); 4: P. Viparelli, P. Ciambelli, L. Lisi, G. Ruoppolo, G. Russo, J.C. Volta, Appl. Catal. A: Gen., 184, 291-301 (1999); 5: C. Carrero, M. Kauer, A. Dinse, T. Wolfram, N. Hamilton, A. Trunschke, R. Schlogl, R. Schomaecker, Catal. Sci. TechnoL., 4, 786-794 (2014); 6: E.V. Kondratenko, M. Cherian, M. Baerns, D. Su, R. Schlogl, X. Wang, I.E. Wachs, J. Catal, 234, 131-142 (2005); 7: B. Frank, J. Zhang, R. Blume, R. Schogl, D.S. Su, Angew. Chem. Int. Ed., 48, 6913-6917 (2009)). Время контакта газа (WHSV-1) варьируют для достижения диапазона конверсий, и оно отличается в зависимости от реакционной способности материала; V/SiO2: 5-15 кг-кат с моль C3H8-1; h-BN: 15-40; BNNT: 2-5; Т=490°С, PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм).
На Фиг. 7В показана сравнительная столбчатая диаграмма, на которой приведены селективности образования продукта при ОДГП для следующих катализаторов: V/SiO2 (XC3H8=5,8%), h-BN (XC3H8=5,4%) и BNNT (XC3H8=6,5%). Селективность образования продуктов изображена заштрихованными и закрашенными столбцами. Время контакта газа (WHSV-1) варьируют для достижения диапазона конверсии, и оно отличается в зависимости от реакционной способности материала; V/SiO2: 5-15 кг-кат с моль С3Н8-1; h-BN: 15-40; BNNT: 2-5; Т=490°С, PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм).
На Фиг. 7С представлена диаграмма, показывающая зависимость удельного выхода пропена при ОДГП (кг-С3Н6 кг-кат-1 час-1) от конверсии С3Н8 для катализаторов V/SiO2, h-BN и BNNT. Большая селективность образования пропена, обеспечиваемая содержащими нитрид бора материалами, в сочетании с повышенной активностью BNNT, приводит к превосходному удельному выходу при использовании BNNT. Время контакта газа (WHSV-1) варьируют для достижения диапазона конверсии, и оно отличается в зависимости от реакционной способности материала; V/SiO2: 5-15 кг-кат с моль С3Н8-1; h-BN: 15-40; BNNT: 2-5; Т=490°С, PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм).
На Фиг. 8 представлена диаграмма, показывающая зависимость селективности образования олефинов (пропен + этен) при ОДГП (закрашенные фигуры), а также зависимость конверсии кислорода (незакрашенные фигуры), от конверсии пропана, при этом можно сравнить графики для гексагонального нитрида бора (h-BN, квадраты) и нанотрубок из нитрида бора (BNNT, круги). При использовании содержащих нитрид бора материалов получают более высокую селективность образования олефинов, и при этом происходит более низкое последующее переокисление пропена (что соответствует наклону этих кривых), чем при использовании V/SiO2. Кислород остается даже при высокой конверсии пропана. Время контакта газа с этими катализаторами варьируют в зависимости от реакционной способности материала; h-BN: 15-40 (кг-кат с моль С3Н8-1); V/SiO2: 5-15 (кг-кат с моль С3Н8-1) BNNT: 2-5 (кг-кат с моль C3H8-1) Т=490°С, PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм) (баланс N2).
На Фиг. 9 показаны графики зависимости конверсии пропана при ОДГП и выход пропена от времени, в потоке, при использовании h-BN. Конверсия пропана (закрашенные фигуры) и выход пропена (незакрашенные фигуры) остаются стабильными по меньшей мере в течение 32 часов, когда эксперимент был прекращен. Т=490°С, WHSV-1 24 кг-кат с моль С3Н8-1, PO2=20 кПа (0,2 атм), PC3H8=30 кПа (0,3 атм) (баланс N2).
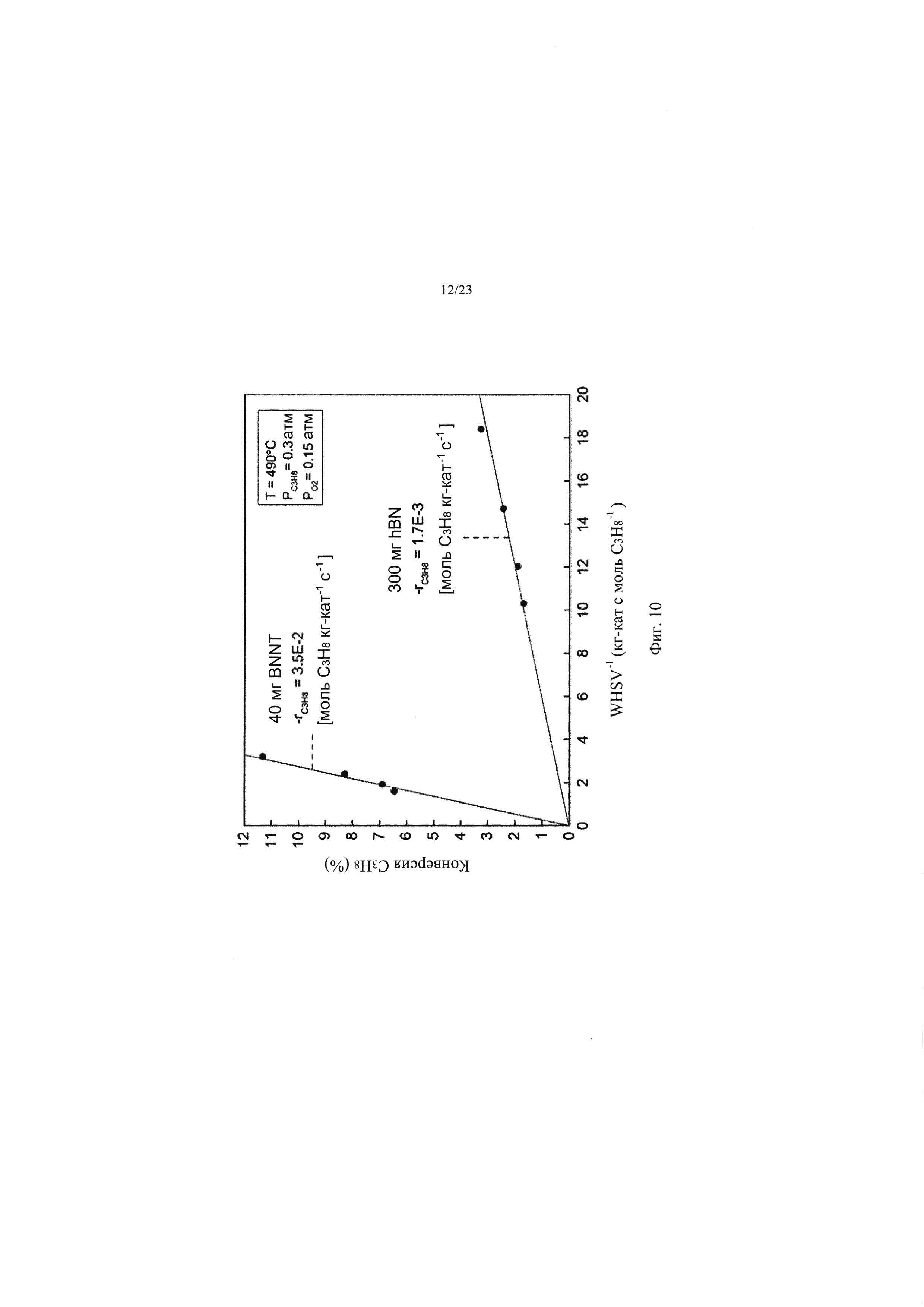
На Фиг. 10 показаны графики зависимости конверсии пропана при ОДГП от обратной среднечасовой скорости подачи пропана на единицу массы катализатора (WHSV-1, кг-кат с моль-С3Н8-1), при этом можно сравнить графики для h-BN (нижняя правая линия) и BNNT (верхняя левая линия). Наклон каждой из этих линий показывает скорость потребления пропана. Гораздо меньшее количество BNNT необходимо для достижения эквивалентных конверсий, чем при использовании h-BN, в результате превосходной реакционной способности материала из BNNT. Т=490°С, PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм) (баланс N2).
На Фиг. 11А и 11В показаны графики скорости потребления пропана при ОДГП с использованием h-BN в зависимости от (11А) PO2 (PC3H8 постоянно и составляет 30 кПа (0,3 атм)) и в зависимости от (11В) PC3H8 (PO2 постоянно и составляет 20 кПа (0,2 атм)). Графики построены в соответствии с кинетическим уравнением Или-Райдила (Eley-Rideal), которое учитывает адсорбцию О2 и является уравнением второго порядка относительно PC3H8. Сплошные линии построены по способу наименьших квадратов с учетом всех экспериментальных точек для соответствующих температур, используя уравнение скорости реакции, показанное на рисунке 11В.
На Фиг. 12 показана столбчатая диаграмма, на которой приведены обнаруженные примеси металлов в содержащих нитрид бора материалах от различных поставщиков (Sigma-Aldrich, Alfa-Aesar и BNNT, LLC), а также в двух партиях от Sigma-Aldrich (партия №1: Lot STBF0279V, партия №2: Lot STBF7843V). Был проведен анализ на дополнительные металлы (Ni, Pt, V, Cu, Zr, Ga, Mo, Ag и Na), но их количество всегда регистрировали ниже предела обнаружения.
На Фиг. 13 представлена диаграмма, на которой показана зависимость селективности образования пропена при ОДГП от конверсии пропана для h-BN, поставляемого Alfa-Aesar и Sigma-Aldrich (партия №1: Lot STBF0279V, круги; партия №2: Lot STBF7843V, треугольники), и для BNNT (BNNT, LLC, ромбы). Несмотря на небольшие различия в примесях металлов между партиями и в зависимости от поставщиков, селективность образования пропена при использовании различных образцов почти идентична (±5%). WHSV-1: 15-40 (кг-кат с моль С3Н8-1) [h-BN], 2-5 (кг-кат с моль С3Н8-1) [BNNT], Т=490°С, PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм) (баланс N2).
На Фиг. 14 представлена столбчатая сравнительная диаграмма, на которой показаны конверсия пропана при ОДГП (ромбы, правая ось) и селективность образования продукта (столбцы, левая ось) для BN от различных поставщиков (Sigma-Aldrich, Alfa-Aesar и BNNT, LLC), а также для двух партий h-BN от Sigma-Aldrich (партия №1: Lot STBF0279V, партия №2: Lot STBF7843V). Несмотря на небольшие различия в примесях металлов между партиями и в зависимости от поставщиков, селективность образования пропена при использовании различных образцов почти идентична (±5%). WHSV-1: 15-40 (кг-кат с моль С3Н8-1) [h-BN], 2-5 (кг-кат с моль С3Н8-1) [BNNT], Т=490°С, PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм) (баланс N2).
На Фиг. 15 показана диаграмма, из которой видно, что бор- и нитридсодержащие катализаторы, включая борид никеля (Ni-борид), проявляют активность в отношении окислительного дегидрирования пропана (ОДГП); Т=490°С, PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм).
На Фиг. 16 представлена диаграмма, показывающая конверсию н-бутана при ОДГ с использованием нанотрубок из нитрида бора (BN) (черные квадраты, правая ось) и селективность образования продуктов (столбцы, левая ось) в зависимости от температуры реакции. С4 обозначает общую селективность образования 1-бутена и 2-бутенов.
На Фиг. 17 представлена сравнительная диаграмма, показывающая селективность образования С4 (ось у) в зависимости от конверсии н-бутана при ОДГ (ось х) при использовании нанотрубок из нитрида бора (BN) и при использовании описанных в известном уровне техники катализаторов. p-o-CNT обозначает функционализированные углеродные нанотрубки. Нанотрубки из нитрида бора (BNNTs) показывают сравнимую селективность по сравнению с наиболее селективными описанными катализаторами. Незакрашенные фигуры относятся к данным по реакционной способности, взятым из других работ, приведенных на чертеже (1-3; 1: Zhang, J.; Liu, X.; Blume, R.; Zhang, A.; Schlogl, R.; Su, D.S. Science. 2008, 322 (5898), 73-77.; 2: Nieto, J. M. L.; Concepcion, P.; Dejoz, a; Knozinger, H.; Melo, F.; Vazquez, M. I.J. Catal. 2000, 189 (1), 147-157.; 3: Madeira, L.M.; Portela, M.F. Catal. Rev. 2002, 44 (2), 247-286).
На Фиг. 18 представлена сравнительная диаграмма, показывающая конверсию изобутана (ромбы, правая ось) и селективность образования продуктов (столбцы, левая ось) при использовании оксида ванадия, нанесенного на диоксид кремния (V/SiO2), гексагонального нитрида бора (h-BN) и нанотрубок из нитрида бора (BNNT) в качестве катализаторов ОДГ изобутана. Материалы BN показывают гораздо более высокую селективность образования олефинов, чем традиционный катализатор V/SiO2, который показывает высокую селективность образования СОх (~40%). WHSV-1: 16-48 (кг-кат с моль С4Н10-1) [V/SiO2]; 44-111 (кг-кат с моль С4Н10-1) [h-BN]; 4-12 (кг-кат с моль С4Н10-1) [BNNT]; Т=440°С, PO2=10 кПа (0,1 атм), PC4H10=10 кПа (0,1 атм) (баланс N2).
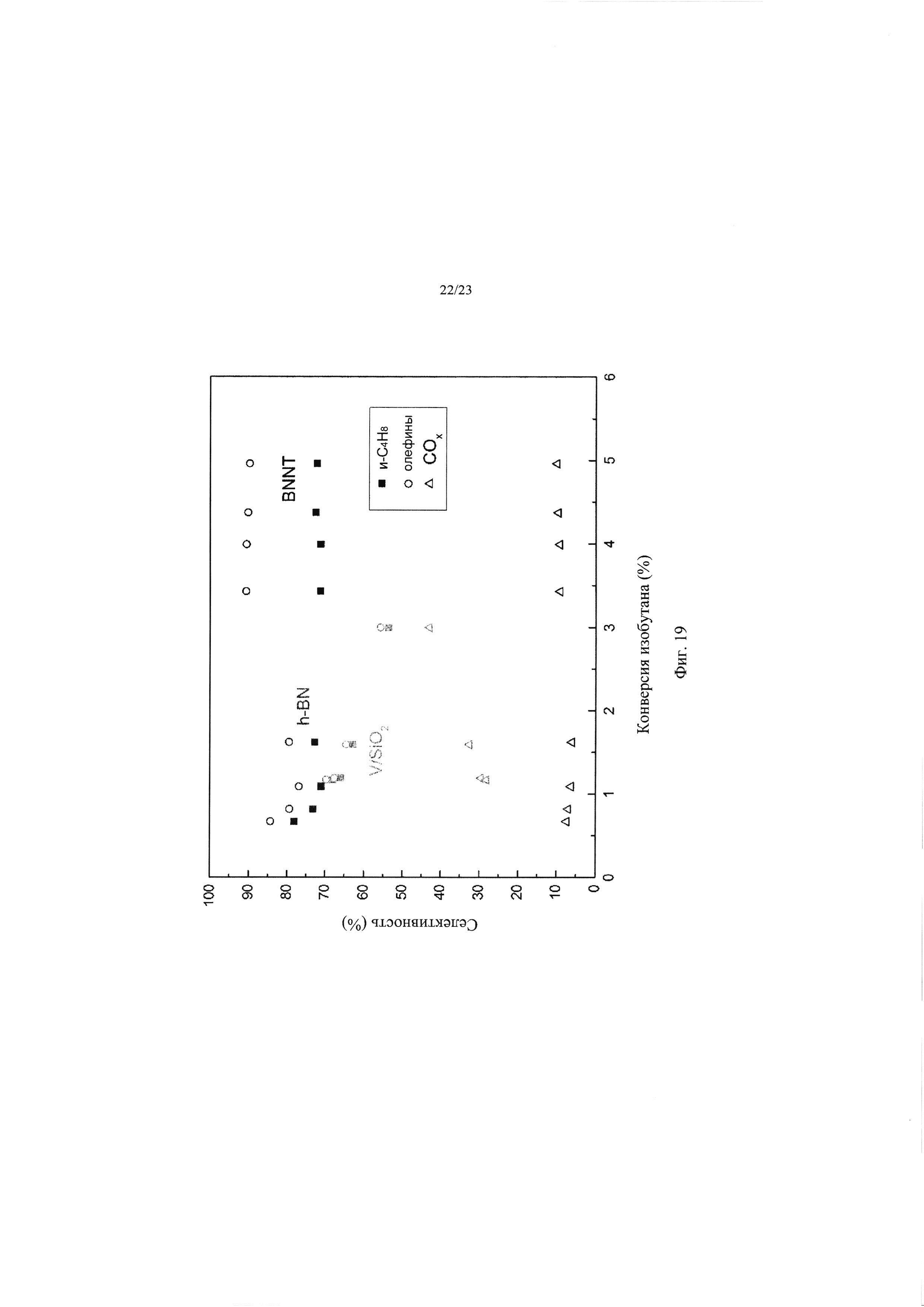
На Фиг. 19 представлена диаграмма, показывающая зависимость селективности образования продуктов (ось у) от конверсии изобутана (ось х) при использовании оксида ванадия, нанесенного на диоксид кремния (V/SiO2), гексагонального нитрида бора (h-BN) и нанотрубок из нитрида бора (BNNT) в качестве катализаторов ОДГ изобутана. WHSV-1: 16-48 (кг-кат с моль С4Н10-1) [V/SiO2]; 44-111 (кг-кат с моль С4Н10-1) [h-BN]; 4-12 (кг-кат с моль С4Н10-1) [BNNT]; Т=440°С, PO2=10 кПа (0,1 атм), PC4H10=10 кПа (0,1 атм) (баланс N2).
На Фиг. 20 представлена диаграмма, показывающая расход пропана при использовании необработанного h-BN (hBN) и функционализированного кислородом h-BN (hBN_HNO3) в качестве катализаторов ОДГП. При использовании функционализированного кислородом h-BN скорость расхода пропана примерно на 40% больше по сравнению с необработанным h-BN.
Хотя изобретение допускает различные модификации и альтернативные формы, конкретные воплощения по изобретению показаны в качестве примера на чертежах и подробно описаны здесь. Следует, однако, понимать, что описание здесь конкретных воплощений не предназначено для ограничения изобретения конкретными раскрытыми формами, но, напротив, цель состоит в том, чтобы охватить все модификации, эквиваленты и альтернативы, попадающие в сущность и объем изобретения, как определено в прилагаемой формуле изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. ОБЩЕЕ ОПИСАНИЕ
До того, как будут описаны представленные материалы и способы, следует понимать, что это изобретение не ограничивается описанными конкретной методологией, протоколами, материалами и реагентами, поскольку они могут различаться. Следует также понимать, что терминология, используемая в этом описании, предназначена только для описания конкретных воплощений, и не предназначена для ограничения объема настоящего изобретения, которое будет ограничено только языком прилагаемой формулы изобретения.
Как использовано в данном описании и в прилагаемой формуле изобретения, формы единственного числа включают формы множественного числа, если из контекста явно не следует иное. Термины «один или более» и «по меньшей мере один» могут быть использованы взаимозаменяемо. Термины «включающий», «содержащий» и «имеющий» также могут быть использованы взаимозаменяемо.
Если не указано иное, все технические и научные термины, используемые в этом описании, включая символы элементов, имеют те же значения, которые обычно известны специалисту в данной области техники. Названия химических соединений, которые обычно используют и которые признаны в данной области, используют взаимозаменяемо с эквивалентными названиями по номенклатуре IUPAC. Например, этен - это то же, что и этилен, пропен - то же, что и пропилен, бутен - то же, что и бутилен, 2-метилпропан - то же, что и изобутан, и 2-метилпропен - это то же, что и изобутен.
В настоящем описании используют следующие сокращения: BN - нитрид бора; BN наносеть (наносети) - наносеть (наносети) из нитрида бора; BNNS(s) - нанолист (нанолисты) из нитрида бора, BNNR(s) - нанолента (наноленты) из нитрида бора; BNNT(s) - нанотрубка (нанотрубки) из нитрида бора; ДГ - дегидрирование; h-BN - гексагональная форма нитрида бора; ОСМ - окислительное сочетание метана; ОДГ - окислительное дегидрирование; ОДГП - окислительное дегидрирование пропана; Р - парциальное давление данного газа; S - селективность для данного продукта; WHSV-1 - обратная среднечасовая скорость подачи сырья на единицу массы катализатора, % X -конверсия для данного реагента.
Все публикации и патенты, конкретно упомянутые в настоящем описании, включены посредством ссылки для всех целей, в том числе для описания и раскрытия химических веществ, инструментов, статистического анализа и методологии, о которых сообщают в публикациях, которые могут быть использованы в связи с раскрытыми способами и устройствами. Все ссылки, приведенные в этом описании, должны приниматься как квалификационный показатель уровня в данной области техники.
II. ИЗОБРЕТЕНИЕ
Это изобретение основано на открытии авторами изобретения того, что применение бор- или нитридсодержащего катализатора способствует улучшенному окислительному дегидрированию алканов, таких как пропан, до желаемых олефинов, таких как пропен. В частности, описанные способы демонстрируют повышенную селективность образования желаемого продукта при одновременном снижении образования нежелательных побочных продуктов, таких как СО и CO2. Кроме того, процесс происходит при относительно низких температурах, и катализатор стабилен с течением времени, поэтому он не нуждается в частой регенерации. Катализаторы также могут быть использованы для окислительного сочетания метана с получением этана и/или этилена.
Примеры форм нитрида бора
Нитрид бора (BN) является неограничивающим примером бор- или нитридсодержащего катализатора, который может быть использован в описанных способах. Катализатор на основе нитрида бора может быть изготовлен из любой доступной формы нитрида бора, включая, без ограничения, аморфный нитрид бора (а-BN), гексагональный нитрид бора (h-BN), кубический нитрид бора (c-BN), вюртцитный нитрид бора (w-BN), содержащие нитрид бора композиты, нанотрубки из нитрида бора (BNNTs), нанолисты из нитрида бора (BNNSs), наноленты из нитрида бора (BNNRs) и наносети из нитрида бора.
Гексагональный нитрид бора (h-BN) является устойчивой кристаллической формой нитрида бора (BN), имеет слоистую структуру, подобную графиту. Внутри каждого слоя атомы бора и азота связаны сильными ковалентными связями, тогда как слои удерживаются вместе слабыми силами Ван-дер-Ваальса.
Как будет показано более подробно в приведенных ниже примерах, авторы изобретения определили, что каталитическая активность нитрида бора (BN) может быть увеличена за счет увеличения площади поверхности нитрида бора (BN). Соответственно, формы нитрида бора (BN), имеющие увеличенную площадь поверхности, такие как нанотрубки из нитрида бора и наносети из нитрида бора, пригодны для использования в описанных способах.
Нанотрубки из нитрида бора (BNNTs) представляют собой цилиндрические структуры, образованные из «свернутых» листов чередующихся и ковалентно связанных атомов азота и бора. Типичные нанотрубки из нитрида бора (BNNTs) имеют диаметр от нескольких нанометров до сотен нанометров, а их длина составляет множество микрометров. Они структурно похожи на углеродные нанотрубки, которые состоят из «свернутых» графитовых листов углерода.
Наносети из нитрида бора представляют собой двумерные наноструктуры из нитрида бора, состоящие из одного слоя чередующихся и ковалентно связанных атомов бора и азота, которые самособираются, образуя высокорегулярную сеть. Структура наносетей из нитрида бора (BN) аналогична структуре графена, поскольку они образуют сборку из гексагональных пор. В неограничивающем примере расстояние между двумя центрами пор составляет 3,2 нм, а диаметр пор составляет ~2 нм, и они имеют глубину около 0,05 нм. Другие термины, используемые в литературе для этой формы нитрида бора, включают в себя монослои из гексагонального нитрида бора (h-BN), боронитрен, белый графен, нанолисты из нитрида бора, наноленты из нитрида бора и нанопластинки из нитрида бора.
Более подробную информацию о нанотрубках из нитрида бора (BNNT) и нанолистов из нитрида бора см., например, D. Golberg, Y. Bando, Y. Huang, Т. Terao, M. Mitome, С. Tang and С. Zhi, ACS Nano, 4 (6), 2979-2993 (2010).
Функционализация кислородом поверхности нитрида бора
Как будет показано более подробно в приведенных ниже примерах, авторы изобретения определили, что каталитическая активность нитрида бора (BN) может быть повышена путем функционализации поверхности нитрида бора (BN) кислородом.
Конкретный способ, используемый для функционализации поверхности нитрида бора (BN) кислородом ничем не ограничен и может включать любой из множества способов, известных в данной области техники. Например, Liao et al. (Liao et al.) (Liao, Y. et al., Set. Rep. 5, 14510; doi: 10.1038/srep14510 (2015)) сообщают о применении наночастиц серебра для окисления гексагонального нитрида бора (h-BN) в течение определенного времени и при определенных температурах, влияющих на процент атомарного кислорода, функционализирующего поверхность нитрида бора (BN). В данной области техники известно много других способов, включая обработку азотной кислотой, используемую в приведенном ниже примере 9.
Следующие примеры представлены только для иллюстративных целей и не предназначены для ограничения объема настоящего изобретения каким-либо образом. Действительно, различные модификации изобретения в дополнение к показанным и описанным здесь, станут очевидными для специалистов в данной области техники из предшествующего описания и следующих примеров, и они входят в объем прилагаемой формулы изобретения.
III. ПРИМЕРЫ
Пример 1: Значительно улучшенная селективности образования продукта при окислительном дегидрировании пропана до пропена с использованием катализатора из нитрида бора (BN).
В этом примере показано, что при использовании катализатора из нитрида бора существенно улучшается селективность окислительного дегидрирования пропана до пропена (ОДГП), особенно при более высоких конверсиях, по сравнению с использованием традиционных катализаторов ОДГП.
Сравнительные результаты ОДГП с использованием традиционных катализаторов и нитрида бора.
Было проведено ОДГП в газовой смеси, содержащей пропан (С3Н8), кислород (O2) и азот (N2), которую пропускали над катализатором BN, состоящим из нитрида бора, оксиднованадиевым катализатором с носителем из SiO2 (V/SiO2), или оксиднованадиевым катализатором, с носителем из SBA-15 (V/SBA-15). Рабочие условия для катализатора из нитрида бора (BN) и оксиднованадиевых катализаторов на носителе были следующими: PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм), PN2=55 кПа (0,55 атм), Т=490°С. Для катализатора из нитрида бора (BN): 200 мг частиц нитрида бора (BN) размером 600-710 мкм загрузили в кварцевый реактор с внутренним диаметром 9 мм и с общим входным расходом 40-120 мл мин-1, что эквивалентно обратной среднечасовой скорости (WHSV-1) в диапазоне 100-300 кг-кат с м-3. Для V/SiO2: 130 мг частиц V/SiO2 размером 600-710 мкм (вместе с 260 мг SiC в качестве инертного разбавителя с эквивалентным размером частиц) загрузили в кварцевый реактор с внутренним диаметром 9 мм и с общим входным расходом 60-140 мл мин-1, что эквивалентно WHSV-1 в диапазоне 55-130 кг-кат с м-3. Все углеродные балансы близки к ±5%. Для каждого катализатора изменяли входные расходы газовой смеси C3H8/O2/N2 для обеспечения диапазона конверсий пропана.
Селективность образования пропена, S, рассчитывают следующим образом:

где FC3H6,out = количество пропена, выходящего из реактора (моль с-1 г-кат-1)
Fcarbonprod = количество всех углеродсодержащих продуктов, выходящих из реактора (моль с-1 г-кат-1)
Конверсию пропана, X, рассчитывают следующим образом:

где Fcarbonprod = количество всех углеродсодержащих продуктов, выходящих из реактора (моль с-1 г-кат-1)
FC3H8,in = количество пропана, подаваемого в реактор (моль с-1 г-кат-1)
Обратную среднечасовую объемную скорость подачи газов на единицу массы катализатора, WHSV-1 (кг-кат с м-3), рассчитывают следующим образом:

где Mcat = масса катализатора, загруженного в реактор (мг)
Ftot = общий поток всех входящих газов (мл мин-1)
Как видно из Фиг. 1, при использовании катализатора из нитрида бора (BN) обеспечивается значительно более стабильная селективность образования пропена с увеличением конверсии пропана, чем при использовании более традиционного катализатора из нанесенного на SiO2 или SBA-15 оксида ванадия. В частности, катализатор из нитрида бора (BN) поддерживал 77% селективность образования пропена при 17% конверсии пропана, хотя даже при умеренной 13% конверсии пропана катализатор из нанесенного на SBA-15 оксида ванадия обеспечил селективность образования пропена, составляющую 48%.
Как видно из Фиг. 2, при использовании катализатора V/SiO2 (разбавленного инертным SiC) происходит сильное уменьшение селективности образования пропена, при этом конверсия пропана увеличивается всего примерно на 3%. Напротив, при использовании катализатора из нитрида бора (BN) происходит гораздо более постепенное снижение селективности образования пропена с увеличением конверсии пропана, при этом селективность образования пропена всегда является большей, чем при использовании катализатора V/SiO2 даже примерно при 17% конверсии пропана.
Дополнительно были количественно определены конкретные побочные продукты, образующиеся при ОДГП, при использовании катализатора V/SiO2+SiC и катализатора из нитрида бора (BN). Результаты показаны на Фиг 2. При использовании катализатора из нитрида бора (BN) основным побочным продуктом является этилен, который сам по себе является важным химическим строительным блоком. Напротив, при использовании катализатора V/SiO2 основными побочными продуктами являются СО и CO2. Это указывает на то, что катализатор из нитрида бора (BN) катализирует реакцию, имеющую совершенно другой механизм образования пропена, в отличие от V/SiO2.
В целом, этот пример демонстрирует, что может быть достигнута лучшая селективность и получена улучшенная смесь побочных продуктов при использовании нитрида бора для катализа ОДГ алканов с короткой цепью до соответствующих олефинов, чем при использовании традиционного оксида ванадия или других известных катализаторов.
Пример 2. Испытания, подтверждающие долговременную стабильность катализатора из нитрида бора (BN)
Испытание на долговременную стабильность было проведено с использованием катализатора из нитрида бора (BN) для обнаружения каких-либо признаков дезактивации катализатора. Результаты представлены на Фиг. 3. Рабочие условия были следующими: PO2=30 кПа (0,3 атм), PC3H8=30 кПа (0,3 атм), PN2=40 кПа (0,4 атм), Т=490°С. Все углеродные балансы близки к ±5%. Тестирование продолжалось в течение временного периода эксплуатации, составляющего 8,0 суток.
Как показано на Фиг. 3, конверсия пропана и выход пропена представлены как функция времени эксплуатации, a WHSV указана в течение различных временных периодов эксплуатации. По истечении примерно 1,5 суток эксплуатации стала увеличиваться конверсия пропана, при одновременном естественном снижении селективности образования пропена, что свидетельствовало о том, что катализатор из нитрида бора (BN) становился более активным. Вероятно, это связано с образованием дополнительных активных центров. Затем общий входной расход газа был увеличен с 40 до 50 мл мин-1 через 4 суток эксплуатации для уменьшения WHSV-1 с 294 до 234 кг-кат с м-3, чтобы конверсия пропана вернулась до исходного значения. Еще через сутки общий расход газа снова увеличили (56 мл мин-1), чтобы понизить WHSV-1 до 210 кг-кат с м-3. Конверсия пропана снова увеличилась через несколько дней, что свидетельствует о непрерывном создании дополнительных активных центров.
Эти результаты показывают, что катализатор из нитрида бора (BN) является стабильным при непрерывном использовании для окислительного дегидрирования в течение длительного периода времени. Соответственно, описанный способ является экономически выгодным для использования в промышленных масштабах.
Пример 3: ОДГП, катализируемое нитридом бора, полученным от нескольких поставщиков, показало улучшенную селективность образования пропена, при этом большая площадь поверхности нитрида бора (BN) способствовал более высоким показателям конверсии
В этом примере показано, что нитрид бора от двух разных поставщиков катализирует ОДГП с улучшенной селективностью образования пропена при относительно высоких конверсиях. Дальнейший анализ показал, что реакционная способность нитрида бора (BN) при ОДГП может быть пропорциональна площади поверхности катализатора из нитрида бора (BN).
Рабочие условия были следующими: PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм), PN2=55 кПа (0,55 атм), Т=490°С. 200 мг частиц нитрида бора (BN) размером 600-710 мкм загрузили в кварцевый реактор с внутренним диаметром 9 мм и с общим входным расходом 40-120 мл мин-1, что эквивалентно WHSV-1 в диапазоне 100-300 кг-кат с м-3. Все углеродные балансы близки к ±2%. Изменяли входной расход газовой смеси C3H8/O2/N2 для достижения диапазона конверсий пропана.
Применяемый нитрид бора (BN) был получен от двух отдельных поставщиков химических веществ: Sigma Aldrich и Alfa Aesar. Как показано на Фиг. 4, результаты приведены отдельно для каждого образца и сравнены с результатами, полученными с использованием V/SiO2. Интересно отметить, что при одинаковых общих входных расходах (40 мл мин-1), что эквивалентно 300 кг-кат с м-3, нитрид бора (BN) от компании Sigma Aldrich обеспечивал примерно 17% конверсию пропана, тогда как нитрид бора (BN) от компании Alfa Aesar обеспечивал примерно только 10% конверсию пропана. Это свидетельствует о том, что нитрид бора (BN) от компании Sigma Aldrich является более реакционноспособным в расчете на единицу массы, чем от компании Alfa Aesar.
Анализ площади поверхности этих двух материалов (анализ методом БЭТ (Брунауэр, Эммет и Тейлор)) показал, что у нитрида бора (BN) от компании Sigma Aldrich удельная площадь поверхности была в 1,8 раза больше, чем у нитрида бора (BN) от компании Alfa Aesar. Соответственно, реакционная способность нитрида бора (BN) при окислительном дегидрировании пропана может быть пропорциональна площади поверхности нитрида бора (BN), и поэтому ее можно улучшить с помощью синтеза материалов из нитрида бора (BN) с большей площадью поверхности.
Пример 4. Другие бор- или нитридсодержащие соединения являются активными катализаторами ОДГП, при этом борсодержащие соединения обеспечивают высокую селективность образования пропена и улучшенную смесь побочных продуктов
В этом примере продолжены испытания катализаторов ОДГП, описанных в предыдущих примерах, используя нитрид бора (BN) наряду с дополнительными бор- и нитридсодержащими соединениями. Результаты показывают, что, как и нитрид бора (BN), бор- или нитридсодержащие соединения могут катализировать ОДГП (и, вероятно, соответствующее ОДГ алканов с короткой цепью с образованием соответствующих олефинов). Кроме того, результаты показывают, что в целом, подобно нитриду бора (BN), борсодержащие соединения катализируют ОДГП (и, вероятно, соответствующее ОДГ алканов с короткой цепью с образованием соответствующих олефинов), обеспечивая значительно лучшую селективность по отношению к пропену и улучшенную смесь побочных продуктов.
Различные бор- или нитридсодержащие катализаторы подвергли тестированию на окислительное дегидрирование пропана (ОДГП), включая В-нитрид, Si-нитрид, Ti-нитрид, Al-нитрид, В-карбид, Ti-борид и Nb-борид. На Фиг. 5 показана селективность образования продуктов для исследованных катализаторов как функция конверсии пропана, а также соответствующие данные для традиционного катализатора V/SiO2. Рабочие условия были следующими: PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм), PN2=55 кПа (0,55 атм), Т=490°С. Ввиду различий в реакционной способности между катализаторами общий входной расход газа от катализатора к катализатору колебался между 40 и 140 мл мин-1, чтобы достичь примерно 5% конверсии пропана. Около 200 мг бор- или нитридсодержащих катализаторов с размером 600-710 мкм загрузили в кварцевый реактор с внутренним диаметром 9 мм. Все углеродные балансы близки к ±2%.
Как видно на Фиг. 5, все испытанные бор- или нитридсодержащие катализаторы показывают активность в отношении ОДГП. Кроме того, все испытанные борсодержащие катализаторы (В-нитрид, В-карбид, Ti-борид, Nb-борид) демонстрируют высокую селективность образования пропена, причем основным побочным продуктом является этилен. Напротив, нитридсодержащие катализаторы, отличные от нитрида бора (BN), (Si-нитрид, Ti-нитрид, Al-нитрид) демонстрируют заметно более низкую селективность образования пропена, чем борсодержащие альтернативные катализаторы, причем основными побочными продуктами являются CO2 и СО.
Входной расход газовой смеси С3Н8/О2/N2, пропускаемой над испытуемыми борсодержащим и нитридсодержащим катализаторами, а также над катализатором V/SiO2, затем изменяли для достижения диапазона конверсий пропана. Рабочие условия были следующими: PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм), PN2=55 кПа (0,55 атм), Т=490°С. Около 200 мг бор- или нитридсодержащих катализаторов с размером 600-710 мкм загрузили в кварцевый реактор с внутренним диаметром 9 мм и с общим входным расходом 40-140 мл мин-1, что эквивалентно WHSV-1, составляющей 100-300 кг-кат с м-3. Все углеродные балансы близки к ±5%.
Как показано на Фиг. 6, борсодержащие катализаторы поддерживали высокую селективность образования пропена даже при высоких конверсиях пропана. Нитридсодержащие катализаторы показали более низкую селективность образования пропена, но в случае Si-нитрида и Ti-нитрида селективность образования пропена не уменьшалась с увеличением конверсии пропана.
В целом, этот пример показывает, что различные бор- и нитридсодержащие катализаторы могут быть использованы для катализирования окислительного дегидрирования алканов с короткой цепью в соответствующие олефины.
Пример 5: Селективное окислительное дегидрирование пропана до пропена с использованием катализаторов из нитрида бора
В этом примере предоставлены расширенные результаты, касающиеся катализаторов ОДГ из нитрида бора (BN), описанные в предыдущих примерах, несколькими конкретными способами, с приведением дополнительных деталей. Во-первых, показано, что эффективные катализаторы ОДГ могут быть изготовлены из любых двух различных форм нитрида бора: гексагонального нитрида бора (h-BN) или нанотрубок из нитрида бора (BNNTs). Катализаторы из нанотрубок из нитрида бора (BNNT) обеспечивают более высокий выход пропена по сравнению с катализаторами из гексагонального нитрида бора (h-BN). Во-вторых, предложен механизм действия, который согласуется с полученными данными и который принципиально отличается от механизма действия при ОДГ при использовании традиционных катализаторов, таких как оксид ванадия на носителе.
Краткое изложение
Экзотермическая реакция пропана с кислородом, приводящая к образованию пропена и воды, может стать революционной технологией в химической промышленности. Однако даже после десятков лет исследований селективность образования пропена остается слишком низкой, чтобы реакция стала экономически привлекательной. Эта известная низкая селективность обусловлена фундаментальной научной проблемой: желаемый олефин гораздо более реакционноспособен, чем алкановый субстрат, и поэтому легко окисляется до СО2, что является термодинамически выгодным процессом.
В этом примере показано, что гексагональный нитрид бора (h-BN) и нанотрубки из нитрида бора (BNNTs) обладают уникальными каталитическими свойствами и обеспечивают беспрецедентную селективность образования пропена. Например, при 14% конверсии пропана авторы получили 77% селективность образования пропена и 13% селективность образования этена, который является еще одним желаемым алкеном. На основе экспериментальных результатов, полученных при катализе, в сочетании со спектроскопическими исследованиями и ab initio моделированием, авторы изобретения выдвинули механистическую гипотезу, в которой кресловидные (armchair) грани нитрида бора (BN) с концевым кислородом являются каталитически активными центрами.
Эксперименты, результаты и обсуждение
Здесь представлены на рассмотрение гексагональный нитрид бора (h-BN) и нанотрубки из нитрида бора (BNNTs) в качестве не содержащих металлов материалов, способных катализировать реакцию ОДГП. В то время как графен и фуллереновые материалы начинают использовать в качестве катализаторов частичного окисления алканов (D.R. Dreyer, Н.P. Jia, С.W. Bielawski, Angew. Chem., 122, 6965-6968 (2010); J. Zhang, X. Liu, R. Blume, A. Zhang, R. Schlogl, D.S. Su, Science, 322, 73-77 (2008); B. Frank, J. Zhang, R. Blume, R. Schogl, D.S. Su, Angew. Chem. Int. Ed., 48, 6913-6917 (2009)), материалы из нитрида бора (BN), одного из «неорганических аналогов» графена, еще не изучены в данной области техники на их собственную каталитическую активность. Примечательно, что нитрид бора (BN) - материал, который считается очень стабильным и инертным, - вообще имеет каталитическую активность.
В этой работе использовали оксид ванадия, нанесенный на оксид кремния (V/SiO2), для непосредственного сравнения с каталитическими характеристиками нитрида бора (BN). Эти материалы загружали в кварцевый трубчатый реактор и нагревали при 460-500°С в токе пропана, кислорода и азота в качестве инертного газа-носителя. Параметры реакции, такие как температура, масса катализатора, общий расход газа и парциальные давления пропана (PC3H8) и кислорода (PO2) варьировали, чтобы наблюдать изменения в составе продуктов, которые анализировали с помощью газовой хроматографии и масс-спектрометрии в режиме реального времени путем отбора проб потока выходящих из реактора газов. Время контакта газа с катализатором представлено в этой работе как обратная среднечасовая скорость подачи газа на единицу массы катализатора (WHSV-1, [кг-катализатор с моль C3H8-1]), которую варьировали в основном за счет изменения общего расхода газа.
Применение материалов из нитрида бора (BN) привело к достижению исключительной селективности образования пропена, которую не наблюдали ранее в условиях ОДГП. Например, гексагональный нитрид бора h-BN обеспечивает 77% селективность образования пропена при 14% конверсии пропана (Фиг. 7А). Между тем, традиционный катализатор V/SiO2 обеспечивает умеренную 61% селективность образования пропена только при 9% конверсии пропана (J.Т. Grant, С.A. Carrero, А.М. Love, R. Verel, I. Hermans, ACS Catal., 5, 5787-5793 (2015)). Полученные значения селективностей с использованием известных в данном уровне техники катализаторов окислительного дегидрирования пропана (ОДГП) (1-7; 1: В. Frank, A. Dinse, О. Ovsitser, Е.V. Kondratenko, R. Schomaecker, Appl. Catal. A: Gen., 323, 66-76 (2007); 2: C.L. Pieck, M.A. Banares, J. L. G. Fierro, J. Catal, 224, 1-7 (2004); 3: A. Christodoulakis, M. Machli, A.A. Lemonidou, S. Boghosian, J. Catal, 222, 293-306 (2004); 4: P. Viparelli, P. Ciambelli, L. Lisi, G. Ruoppolo, G. Russo, J.C. Volta, Appl. Catal. A: Gen., 184, 291-301 (1999); 5: C. Carrero, M. Kauer, A. Dinse, T. Wolfram, N. Hamilton, A. Trunschke, R. Schlogl, R. Schomaecker, Catal. Sci. TechnoL., 4, 786-794 (2014); 6: E.V. Kondratenko, M. Cherian, M. Baerns, D. Su, R. Schlogl, X. Wang, I.E. Wachs, J. Catal, 234, 131-142 (2005); 7: B. Frank, J. Zhang, R. Blume, R. Schogl, D.S. Su, Angew. Chem. Int. Ed., 48, 6913-6917 (2009)) можно сравнить на Фиг. 7А. Снижение селективности образования пропена с увеличением конверсии пропана свидетельствует о легко протекающем переокислении пропена до СОх.
Распределение продуктов также отличается при использовании материалов из нитрида бора и оксиднованадиевых катализаторов на носителе (Фиг. 7В). При использовании оксиднованадиевого катализатора на носителе основными побочными продуктами являются СОх, что составляет 33% от общей селективности образования продукта при 9% конверсии пропана. И, наоборот, при использовании материалов из нитрида бора (BN) основным побочным продуктом является этен, представляющий собой очень ценный олефин, а не СОх. Общая селективность образования пропена и этена составляет 90% при 14% конверсии пропана при использовании гексагонального нитрида бора (h-BN) (Фиг. 8). Кроме того, авторы изобретения установили, что каталитическая активность материала из нитрида бора (BN) остается стабильной в течение по меньшей мере 32 часов эксплуатации (Фиг. 9), что подтверждает стабильность катализатора.
При аналогичном распределении продуктов как для гексагонального нитрида бора (h-BN), так и для нанотрубок из нитрида бора (BNNTs), предполагается аналогичный механизм реакции для этих материалов из нитрида бора (BN). Однако при использовании нанотрубок из нитрида бора (BNNTs) скорость потребления пропана [моль С3Н8 кг-кат-1 с-1] более чем на один порядок выше, чем при использовании гексагонального нитрида бора (h-BN) (Фиг. 10). Более высокая активность нанотрубок из нитрида бора (BNNTs) по меньшей мере частично связана с более высокой площадью поверхности нанотрубок из нитрида бора (BNNTs), чем у гексагонального нитрида бора (h-BN) (BNNT: 97±5 м2 г-1, h-BN: 16±1 м2 г-1) (J. Kibsgaard, Z. Chen, В.N. Reinecke, Т.F. Jaramillo, Nat. Mater., 11, 963-969 (2012)); однако скорость потребления пропана при использовании нанотрубок из нитрида бора (BNNT) более чем в три раза выше, чем при использовании гексагонального нитрида бора (h-BN) при нормализации площади поверхности (BNNT: 3,6×10-7 моль С3Н8 с-1 м-2, h-BN: 1,1×10-7 моль C3H8 с-1 м-2). Такая высокая реакционная способность и селективность нанотрубок из нитрида бора (BNNTs) приводит в результате к существенному повышению наблюдаемого удельного выхода пропена [кг-С3Н8 кг-кат-1 час-1] (Фиг. 7С), сравнимого со значениями, которые считаются привлекательными для коммерческой реализации этой технологии получения пропена (С. Carrero, М. Kauer, А. Dinse, Т. Wolfram, N. Hamilton, A. Trunschke, R. Schlogl, R. Schomaecker, Catal. Sci. Technol., 4, 786-794 (2014); F. Cavani, N. Ballarini, A. Cericola, Catal. Today, 127, 113-131 (2007)).
Дальнейшие кинетические исследования состояли в изучении влияния концентраций реагентов (PO2, PC3H8) на скорость реакции. Учет кислорода в качестве реагента необходим при конверсии пропана с использованием материалов из нитрида бора (BN). Скорость потребления пропана при использовании гексагонального нитрида бора (h-BN) указывает на кислородную активацию на поверхности нитрида бора (h-BN) (Фиг. 11А), и зависимость второго порядка относительно PC3H8 (Фиг. 11В). Такое кинетическое поведение явно отличает нитрид бора от традиционных оксиднованадиевых катализаторов на носителе, которые описываются механизмом Марса ван Кревелена (Mars van Krevelen) (скорость определяющее окисление субстрата с последующим быстрым повторным окислением поверхности кислородом), что обычно приводит к зависимости нулевого порядка относительно PO2 и первого порядка относительно пропана (K. Chen, А. Khodakov, J. Yang, А.Т. Bell, Е. Iglesia, J. Catal., 186, 325-333 (1999)).
Удивительно, что нитрид бора (BN), материал, известный своей высокой устойчивостью в окислительных условиях (Z. Liu, Y. Gong, W. Zhou, L. Ma, J. Yu, J.C. Idrobo, J. Jung, A.H. MacDonald, R. Vajtai, J. Lou, P.M. Ajayan, Nat. Commun., 4, 2541 (2013); Y. Chen, J. Zou, S.J. Campbell, G.L. Caer, Appl. Phys. Lett., 84, 2430-2432 (2004)), вообще является каталитически активным. До сих пор его изучали по причине его уникальных электронных, термоэлектрических и механических свойств (Y. Lin, J.W. Connell, Nanoscale, 4, 6908-6939 (2012); N.G. Chopra, R.J. Luyken, K. Cherrey, V.H. Crespi, M.L. Cohen, S.G. Louie, A. Zettl, Science, 269, 966-967 (1995); A. Pakdel, Y. Bando, D. Golberg, Chem. Soc. Rev., 43, 934-959 (2014); A.L. Bezanilla, J. Huang, H. Terrones, B.G. Sumpter, J. Phys. Chem. C, 116, 15675-15681 (2012)). Сочетание интересных наблюдений, изложенных в этом примере, например, лучшая селективность образования олефинов и отличающаяся кинетика реакции, указывают на новый принципиально иной механизм реакции по сравнению с другими хорошо изученными катализаторами. Примеси металлов в материале вряд ли играют значительную роль. Действительно, различные образцы нитрида бора от разных поставщиков, содержащие различные примеси (Фиг. 12), демонстрируют почти идентичные каталитические характеристики (Фиг. 13-14).
На основании литературы по полупроводникам, в которой основное внимание уделяют кресловидным граням нитрида бора (BN) с концевым кислородом (A.L. Bezanilla, J. Huang, Н. Terrones, В.G. Sumpter, J. Phys. Chem. C, 116, 15675-15681 (2012)), а также предполагаемым активным центрам в графеновых и фуллереновых материалах, используемых для других реакций окисления (J. Zhang, X. Liu, R. Blume, A. Zhang, R. Schlogl, D.S. Su, Science, 322, 73-77 (2008); B. Frank, J. Zhang, R. Blume, R. Schogl, D.S. Su, Angew. Chem. Int. Ed., 48, 6913-6917 (2009)), авторы изобретения предполагают, что кресловидные грани нитрида бора (BN) с концевым кислородом (>B-O-O-N<) являются активным центром в реакции ОДГП. В соответствии с наблюдаемой кинетической зависимостью по кислороду авторы полагают, что молекула кислорода, связанная с одним атомом В и одним атомом N, действует как активный центр. Эти (>B-O-O-N<) центры можно рассматривать как неорганические пероксиды, способные участвовать в реакции окисления.
Зависимость второго порядка скорости по отношению к PC3H8 говорит о том, что для образования двух молекул воды необходимо две молекулы пропана в соответствии с общей стехиометрией реакции. Десорбция этих молекул воды формирует вакантные грани нитрида бора (BN), что позволяет уникальным образом активировать O2, что объясняет влияние площади поверхности, на которой адсорбируется кислород, на скорость потребления пропана.
Таким образом, этот пример показывает, что нитрид бора, который считался инертным, до сих пор не исследовали в качестве катализатора окисления. При окислительном дегидрировании пропана была получена исключительная селективность в отношении образования пропена.
Материалы и способы
Гексагональный нитрид бора (h-BN, Sigma-Aldrich и Alfa-Aesar) и нанотрубки из нитрида бора (BNNT, BNNT, LLC) использовали в состоянии поставки без дополнительной химической или термической обработки. Для обеспечения воспроизводимости использовали несколько партий гексагонального нитрида бора (h-BN) и разных поставщиков, чтобы подтвердить, что за катализ действительно ответственен материал из нитрида бора (BN), а не потенциальная металлическая примесь. Все поставщики гарантируют >99% чистоту гексагонального нитрида бора (h-BN) и нанотрубок из нитрида бора (BNNT), что подтверждается анализом на примеси металлов с использованием оптической эмиссионной спектроскопии с индуктивно-связанной плазмой (ICP-OES), проведенным авторами изобретения (Фиг. 12).
Кислотное расщепление материалов из нитрида бора (BN) выполняли путем кипячения с обратным холодильником примерно 10 мг нитрида бора (BN) в 6 мл царской водки (3:1 HCl:HNO3) в течение ночи с последующей гравитационной фильтрацией и разбавлением собранной кислоты 34 мл Н2О (18 мОм). Затем собранный раствор анализировали с использованием оптического эмиссионного спектрометра Optima 2000 DV (Perkin Elmer Instruments) на следующие металлы: Fe, Са, Al, Ti, Ni, Pt, V, Cu, Zr, Ga, Mo, Ag и Na. Хотя количество примесей металлов в образцах гексагонального нитрида бора (h-BN) варьируется между партиями от одного поставщика и партиями от разных поставщиков, каталитический отклик между ними отсутствует (Фиг. 13-14). Это говорит о том, что следовые количества примесей металлов не оказывают значительного влияния на катализ.
Катализатор из нанесенного на диоксид кремния оксида ванадия (V/SiO2, 4,5% масс, ванадия) был приготовлен с использованием хорошо известных процедур пропитки по влагоемкости, включающих нанесение окситриизопропоксида ванадия (Sigma-Aldrich), разбавленного изопропанолом (Sigma-Aldrich), на поверхность SiO2 (Aerosil200, Evonik) с последующим прокаливанием при 550°С. Объем раствора окситриизопропоксида ванадия в изопропаноле был эквивалентен объему пор SiO2. Рамановскую спектроскопию использовали, чтобы подтвердить, что была получена двумерная дисперсия видов оксида ванадия на поверхности, которая позволяет значительно повысить селективность образования пропена, по сравнению с материалом, содержащим трехмерные наночастицы V2O5.
Порошковые катализаторы из h-BN и V/SiO2 прессовали с помощью пресс-гранулятора (Pike Technologies) и просеивали, сбирая частицы диаметром 600-710 мкм, чтобы ограничить любые возможные эффекты массопереноса. Около 150 мг V/SiO2 и 300 мг инертных частиц SiC (теплопроводник) поместили в кварцевую трубку реактора (диаметр 9 мм), а около 300 мг h-BN поместили в трубку реактора без SiC. Около 40 мг BNNT (без прессования) были разбавлены примерно 100 мг инертных частиц SiO2 для обеспечения однородности слоя. Расходы пропана (технической чистоты, Airgas), кислорода (UHP, Airgas) и азота (UHP, Airgas) контролировали с использованием трех регуляторов массового расхода (Bronkhorst), которые калибровали для каждого отдельного газа, чтобы обеспечить общий расход 40-160 мл мин-1. Трубку реактора поместили в реакторную установку Microactivity-Effi, которая включает в себя трубчатую печь, способную поддерживать температуру до 1100°С, и сепаратор жидкость-газ для конденсации образовавшейся воды. Выходящий из реактора поток анализировали с помощью Shimadzu 2010 GC, оборудованного тремя колонками Restek (Rtx-1, RT-Msieve 5А и Rt-Q-Bond) и детектором теплопроводности (TCD), а также пламенно-ионизационным детектором (FID). Углеродный баланс для каждой экспериментальной точки близок в пределах 2%.
Уравнения
Конверсию пропана, X, рассчитывают следующим образом:
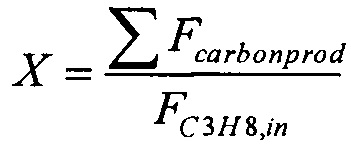
где Fcarbonprod = количество всех углеродсодержащих продуктов, выходящих из реактора (моль с-1 г-кат-1)
FC3H8,in = количество пропана, подаваемого в реактор (моль с-1 г-кат-1)
Селективность образования продукта, S, рассчитывают следующим образом:
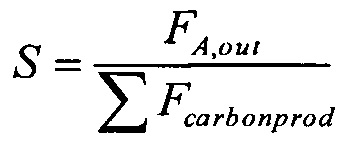
где FA,out = количество продукта А, выходящего из реактора (моль с-1 г-кат-1)
Fcarbonprod = количество всех углеродсодержащих продуктов, выходящих из реактора (моль с-1 г-кат-1)
Обратную среднечасовую объемную скорость подачи пропана на единицу массы катализатора, WHSV-1 (кг-кат с м-3), рассчитывают следующим образом:
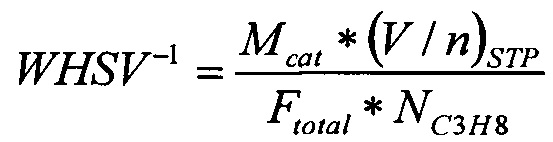
где Mcat = масса катализатора, загруженного в реактор (кг)
(V/n)STP = 24,5 (л/моль) при 298,15 К
(101,3 кПа(1 атм), R=8,206⋅10-2 л атм К-1 моль-1)
Ftotal = общее количество всех входящих газов (л с-1)
NC3H8 = молярный процент пропана в подаваемой газовой смеси (% мол.)
Пример 6: Борид никеля в качестве еще одного активного катализатора ОДГП
В этом примере продолжены исследования катализаторов ОДГП, описанные в примере 4, дополнительно включив Ni-борид. Как указано в примере 4, различные бор- или нитридсодержащие катализаторы подвергали тестированию для определения активности в отношении ОДГП, включая В-нитрид, Ti-нитрид, Al-нитрид, В-карбид, Ti-борид и Nb-борид. В этом примере также продемонстрирована каталитическая активность Ni-борида.
Рабочие условия были следующими: PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм), PN2=55 кПа (0,55 атм), Т=490°С. Ввиду различий в реакционной способности между катализаторами общий входной расход газа от катализатора к катализатору колебался между 40 и 140 мл мин-1, чтобы достичь примерно 5% конверсии пропана. Около 200 мг бор- или нитридсодержащих катализаторов размером 600-710 мкм загрузили в кварцевый реактор с внутренним диаметром 9 мм. Все углеродные балансы близки к ±5%.
Все испытуемые бор- или нитридсодержащие катализаторы, включая Ni-борид, показывают активность в отношении ОДГП. Кроме того, все испытуемые борсодержащие катализаторы, включая Ni-борид, демонстрируют высокую селективность образования пропена, причем основным побочным продуктом является этилен.
Входные расходы газовой смеси С3Н8/О2/N2, пропускаемой над испытуемыми борсодержащим и нитридсодержащим катализаторами, а также над катализатором V/SiO2, изменяли для достижения диапазона конверсии пропана. Рабочие условия были следующими: PO2=15 кПа (0,15 атм), PC3H8=30 кПа (0,3 атм), PN2=55 кПа (0,55 атм), Т=490°С. Около 200 мг бор- или нитридсодержащих катализаторов размером 600-710 мкм загрузили в кварцевый реактор с внутренним диаметром 9 мм и с общим входным расходом 40-140 мл мин-1, что эквивалентно WHSV-1, составляющей 100-300 кг-кат с м-3. Все углеродные балансы близки к ±5%.
Как показано на Фиг. 15, борсодержащие катализаторы, включая Ni-борид, поддерживали высокую селективность образования пропена даже при высоких конверсиях пропана. В целом, дополнительные данные в этом примере подтверждают вывод, сделанный в примере 4, что различные бор- и нитридсодержащие катализаторы могут быть использованы для катализирования окислительного дегидрирования алканов с короткой цепью в соответствующие олефины.
Пример 7: Селективное окислительное дегидрирование н-бутана в 1-бутен и 2-бутен с использованием нанотрубок из нитрида бора (BNNTs)
В этом примере продемонстрировано катализируемое нанотрубками из нитрида бора (BNNT) ОДГ, используя н-бутан в качестве исходного алкана, с получением смеси алкеновых продуктов, 1-бутена и 2-бутена. Эти результаты показывают, что описанные способы не ограничиваются ОДГП, но вместо этого могут быть применены для ОДГ других алканов с получением соответствующих алкенов.
При ОДГ н-бутана последний дегидрируют в присутствии кислорода, получая смесь 1-бутена и 2-бутена. Также при этом образуется вода. Как отмечалось ранее, в результате ОДГ образуются нежелательные побочные продукты, такие как СО; таким образом, катализаторы ОДГ, демонстрирующие лучшую селективность образования желаемых алкеновых продуктов (в данном случае С4 бутенов, 1-бутена и 2-бутена), являются предпочтительными.
Используя общие способы, описанные в предыдущих примерах (см. Пример 1 и Пример 5), была проанализирована каталитическая активность нанотрубок из нитрида бора (BNNTs) в отношении окислительного дегидрирования н-бутана, используя последний в качестве алканового реагента. Авторы определили полученный процент конверсии н-бутана при окислительном дегидрировании и селективность образования продукта в зависимости от температуры реакции (Фиг. 16, температура по оси х, значения конверсии н-бутана, изображенные в виде черных квадратов, показаны с правой стороны, значения селективности, изображенные в виде столбцов, показаны с левой стороны, С4 представляет собой смесь 1-бутена и 2-бутена). Как видно из Фиг. 17, нанотрубки из нитрида бора (BNNTs) обеспечивают благоприятную селективность по отношению к желаемым продуктам С4.
Были сравнены значения конверсии н-бутана и селективности образования С4, полученные при ОДГ с использованием нанотрубок из нитрида бора (BNNT), со значениями, приведенными и полученными для ранее описанных катализаторов ОДГ н-бутана (функционализированные углеродные нанотрубки (p-o-CNT), V/MgAl-Шпинель, V/MgAl-Гидротальцит и NiMoO4). Как видно из Фиг. 17, нанотрубки из нитрида бора (BNNT) показывают селективность (см. сплошную линию), сравнимую с наиболее селективными ранее описанными катализаторами окислительного дегидрирования н-бутана.
Пример 8: Селективное окислительное дегидрирование изобутана до изобутена с использованием гексагонального нитрида бора (h-BN) и нанотрубок из нитрида бора (BNNTs)
В этом примере описано катализируемое нитридом бора (BN) и нанотрубками из нитрида бора (BNNT) ОДГ при использовании изобутана в качестве алкенового реагента, с получением изобутена в качестве алкенового продукта. Эти результаты обеспечивают дополнительные данные, демонстрирующие, что описанные способы могут быть применены для ОДГ множества других алканов с получением соответствующих алкенов.
При ОДГ изобутана последний дегидрируют в присутствии кислорода, получая изобутен. Также при этом образуется вода. Как отмечалось ранее, в результате ОДГ образуются нежелательные побочные продукты, такие как СО и CO2; таким образом, катализаторы ОДГ, демонстрирующие лучшую селективность образования желаемых алкеновых продуктов (в данном случае изобутена), являются предпочтительными.
Используя общие способы, описанные в предыдущих примерах (см. Пример 1 и Пример 5), была проанализирована каталитическая активность гексагонального нитрида бора (h-BN) и нанотрубок из нитрида бора (BNNTs) в отношении ОДГ, а также V/SiO2, известного катализатора ОДГ изобутана, используя изобутан в качестве исходного алкана. Условия реакции были следующими: WHSV-1: 16-48 (кг-кат с моль С4Н10-1) [V/SiO2]; 44-111 (кг-кат с моль С4Н10-1) [h-BN]; 4-12 (кг-кат с моль С4Н10-1) [BNNT]; Т=440°С, PO2=10 кПа (0,1 атм), PC4H10=10 кПа (0,1 атм) (баланс N2).
Полученный в результате процент конверсии изобутана при ОДГ и селективность образования продуктов для каждого катализатора показаны на Фиг. 18 (используемый катализатор показан на оси х, значения конверсии изобутана, изображенные в виде черных квадратов, показаны с правой стороны, значения селективности, изображенные в виде столбцов, показаны с левой стороны). Как видно из Фиг. 18, оба материала из нитрида бора (h-BN и BNNT) показывают гораздо более высокую селективность образования олефинов, чем традиционный катализатор V/SiO2, который показывает нежелательную высокую селективность образования СОх (~40%).
Авторами изобретения были построены графики зависимости селективности образования продуктов от конверсии изобутана для трех катализаторов ОДГ. Результаты показаны на Фиг. 19. Опять же, результаты показывают, что оба катализатора h-BN и BNNT обеспечивают более высокую селективность образования желаемых олефиновых продуктов (включая изобутен, но не ограничиваясь им,) и более низкую селективность образования нежелательных продуктов СОх, чем традиционный катализатор.
Пример 9: Функционализации кислородом поверхности нитрида бора (BN), увеличивает активность катализатора
В этом примере показано, что активность катализаторов из нитрида бора (BN) в отношении ОДГ может быть увеличена путем связывания (то есть функционализации) кислорода с поверхностью нитрида бора (BN). Поверхность нитрида бора (BN) можно функционализировать кислородом, используя один или более способов, известных в данной области техники.
Одним из таких способов является приведение нитрида бора в контакт с азотной кислотой. Авторы кипятили с обратным холодильником гексагональный нитрида бора (h-BN) в концентрированной HNO3 в течение 2 часов. Полученный окисленный BN материал отфильтровали под вакуумом и сушили в печи в течение ночи. Затем исследовали каталитическую активность полученного функционализированного кислородом материала в реакции ОДГП, как описано в предыдущих примерах (см., например, Пример 5).
Как видно из Фиг. 20, функционализованный кислородом (обработанный HNO3) гексагональный нитрида бора (h-BN) показывает примерно 40% увеличение скорости потребления пропана, чем необработанный гексагональный нитрида бора (h-BN). Данные рентгеновской фотоэлектронной спектроскопии (XPS) подтверждают, что обработанная поверхность фактически функционализирована кислородом. В частности, обработанный HNO3 гексагональный нитрида бора (h-BN) содержит 3,83% (атомные проценты) поверхностного кислорода, тогда как необработанный гексагональный нитрида бора (h-BN) содержит только 2,51% (атомные проценты) поверхностного кислорода.
Таким образом, этот пример демонстрирует, что каталитическая активность бор- и нитридсодержащего катализатора при окислительном дегидрировании может быть дополнительно увеличена путем связывания кислорода (то есть, функционализации кислородом) с поверхностью катализатора.
Пример 10: Катализируемое нитридом бора (BN) окислительное дегидрирование этилбензола
В этом примере описано катализируемое нитридом бора (BN) ОДГ с использованием этилбензола в качестве реагента, содержащего алкильную группу, в результате которого получают стирол в качестве продукта, содержащего соответствующую алкенильную группу. Эти результаты обеспечивают дополнительные данные, демонстрирующие, что описанные способы могут быть применены для ОДГалкильных групп, присоединенных к ароматическому кольцу, с образованием соответствующих алкенильных групп.
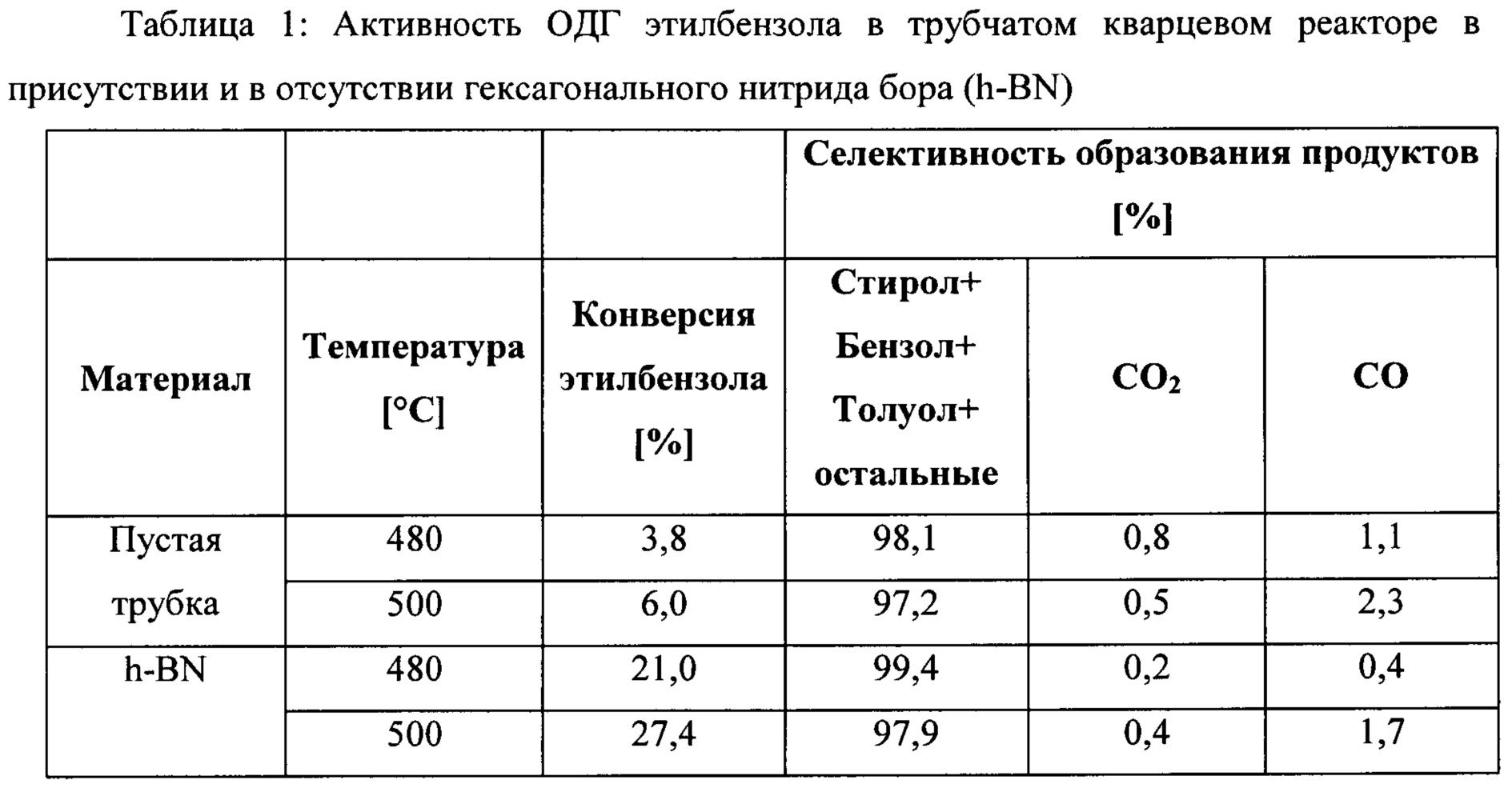
Авторам изобретения удалось получить насыщенный поток исходного этилбензола, подаваемый в кварцевый реактор, путем барботирования азота через сатуратор с этилбензолом, нагретый до 50°С. Температуру печи трубчатого кварцевого реактора можно было изменять в интервале 250-500°С, а окружающая атмосфера вокруг печи трубчатого кварцевого реактора была нагрета до 160°С. Трубы из нержавеющей стали, соединяющие жидкий сатуратор с реакторной установкой и реакторную установку с газовым хроматографом (ГХ), были нагреты до 220°С. Расход азота через сатуратор был постоянным и составлял 50 мл мин-1, в то время как расход O2 поддерживали при постоянном значении 5 мл мин-1, чтобы получить общие исходные концентрации O2 - 9%, этилбензола - 2,7% (баланс N2).
Конверсия этилбензола и селективность образования продуктов показаны в таблице 1. Для сравнения проводили газофазные реакции в пустом трубчатом кварцевом реакторе, содержащем только кварцевую вату, и в трубчатом кварцевом реакторе, содержащем гексагональный нитрид бора (h-BN). Даже при 500°С конверсия этилбензола была минимальной без присутствия гексагонального нитрида бора (h-BN) и увеличилась до 27% в присутствии гексагонального нитрида бора (h-BN), при этом селективность образования СОх была низкой, а селективность образования всех других важных продуктов (в основном стирола, бензола, толуола) - высокой.
Пример 11: Окислительное сочетание метана с использованием гексагонального нитрида бора (h-BN)
В этом примере использовали гексагональный нитрид бора (h-BN) качестве катализатора окислительного сочетания метана (ОСМ) с образованием этана и этиленовых продуктов. Из результатов видно, что описанные способы могут быть использованы для других типов окислений помимо ОДГ.
При ОСМ две молекулы метана соединяются с образованием этана и этилена. Во время этого процесса также образуется вода. Для активации метана требуются значительно более высокие температуры, чем для ОДГ, обычно составляющие выше 700°С. При таких высоких температурах происходит чрезмерное окисление продуктов реакции до СО и CO2. Таким образом, необходимы катализаторы, которые могут проявлять активность (то есть активировать метан) при минимальном образовании продуктов переокисления.
Используя аналогичные аналитические методы, как в предыдущих примерах, была проанализирована каталитическая активность гексагонального нитрида бора (h-BN) и сравнили ее с каталитической активностью инертных кварцевых стружек. Любая активность, наблюдавшаяся в ходе эксперимента при использовании кварцевых стружек, по-видимому, происходила вследствие активации метана в газовой фазе. Чтобы свести к нулю газофазные реакции, использовали кварцевую вату для заполнения пустот после слоя катализатора. Условия реакции были следующими: WHSV-1=9-14 (кг-кат с моль СН4-1); Т=750°С, 770°С; PO2=20 кПа (0,20 атм), РСН4=40 кПа (0,4 атм) (баланс N2).
Полученную конверсия при ОСМ и селективность образования продуктов сочетания (т.е. этана и этена) и продуктов СОх показаны в таблице 2. При одинаковых соответствующих расходах и температурах при использовании катализатора из гексагонального нитрида бора (h-BN) происходит увеличение конверсии метана до 55%, если сравнить с активностью, наблюдаемой при использовании кварцевых стружек. Более высокая способность катализатора из гексагонального нитрида бора (h-BN) активировать метан приводит к несколько более низкой селективности образования С2 продуктов вследствие переокисления этана и этиленовых продуктов. Несмотря на эту потерю селективности, общий выход С2 продуктов выше, чем при использовании кварцевых стружек.

Изобретение не ограничивается воплощениями, изложенными для иллюстрации в данном описании, но включает в себя все, что входит в объем формулы изобретения. Кроме того, все документы, процитированные в данном описании, включены в данное описание посредством ссылки во всей их полноте и для всех целей, как если бы они были полностью изложены в данном описании.
Реферат
Предложен способ получения одного или более желаемых химических продуктов, выбранных из группы, состоящей из пропена, изобутена, 1-бутена, 2-бутена и стирола, включающий приведение гетерогенного катализатора, содержащего соединение, выбранное из группы, состоящей из B-нитрида, B-карбида, Ti-борида, Ni-борида, Nb- борида, Si-нитрида, Ti-нитрида и Al-нитрида, в контакт с кислородом и одним или более жидкими или газообразными реагентами, выбранными из группы, состоящей из пропана, н-бутана, изобутана и этилбензола, причем гетерогенный катализатор катализирует окислительное дегидрирование (ОДГ) одного или более жидких или газообразных реагентов с образованием одного или более желаемых химических продуктов. Технический результат - предоставление усовершенствованного способа и катализатора окислительного дегидрирования С3-С5 алканов в соответствующие олефины. 16 з.п. ф-лы, 20 ил., 2 табл., 11 пр.

Комментарии