Способ получения кислых и среднего фосфатов кальция - RU2768022C1
Код документа: RU2768022C1
Описание
Использование: в производстве удобрений и химикатов.
Изобретение относится к способу получения кислых и среднего фосфатов кальция (дигидрофосфата, гидрофосфата и фосфата кальция) путем термической обработки соляно- или азотнокислых растворов, полученных путем взаимодействия растворов соляной или азотной кислоты с фосфатными рудами или отходами их переработки, содержащими фосфат кальция и нерастворимые в указанных кислотах примесями.
Предлагаемый способ позволяет из соляно- или азотнокислотных растворов, содержащих фосфорную кислоту, ионы кальция, нитрат или хлорид-ионы, а также соляную или азотную кислоту получить кислые или средний фосфаты кальция.
Цель изобретения: разработать способ получения кислых и среднего фосфатов кальция, которые можно использовать как минеральные удобрения, либо как реагенты для производства минеральных удобрений. Способ позволяет существенно снизить расход соляной или азотной кислоты, а также аммиака, используемых при производстве кислых фосфатов кальция соляно- или азотнокислым методом.
В известном соляно- или азотнокислотном методе [1] действием избытка раствора соляной или азотной кислоты на фосфатную руду, содержащую фосфат кальция, получают раствор, содержащий остаток соляной или азотной кислоты, хлорид или нитрат кальция и фосфорную кислоту:

Реакция (1) протекает в прямом направлении, поскольку соляная или азотная кислота являются сильными кислотами, а фосфорная кислота является кислотой средней силы.
Необходимо отметить, что в большинстве случаев в фосфатных рудах мольное отношение Са:Р больше, чем 1,5, что характерно для Са3(PO4)2, и обусловлено присутствием в руде примеси СаСО3.
После отделения нерастворимых примесей соляно- или азотнокислотный раствор подвергают взаимодействию с щелочными реагентами (чаще всего применяют газообразный аммиак, реже водный раствор аммиака гидроксида натрия или калия) для повышения рН до необходимых значений за счет нейтрализации кислоты, при которых осаждается малорастворимый гидрофосфат кальция, применяемый далее в качестве удобрения [1]:

Для извлечения соединений P(V) из руды, содержащей фосфат кальция, используют расход азотной (или соляной) кислоты, превышающий расход, задаваемый уравнением:

и тем более уравнением:

что связано с ограниченной растворимостью дигидрофосфата кальция Са(H2PO4)2 (растворимость 18 г/л [2]) и с необходимостью наиболее полного и быстрого извлечения соединений P(V) из руды, содержащей фосфат кальция, в производственных условиях.
Необходимо отметить, что минимальный расход азотной кислоты для получения гидрофосфата кальция CaHPO4 (растворимость 0,2 г/л [2]) определяется уравнением:

и этот расход в три раза меньше, чем по уравнению (3). Для получения CaHPO4 этот избыток азотной кислоты приходиться нейтрализовать, например, газообразным аммиаком или водным раствором аммиака, используя уравнение (2).
Предлагаемый метод получения кислых и среднего фосфатов кальция позволяет существенно сократить расход азотной или соляной кислоты и щелочных реагентов (раствора аммиака или гидроксида натрия или калия).
Сущность изобретения.
После действия избытка раствора соляной или азотной кислоты на природную руду, содержащую фосфат кальция, и отделения нерастворимых примесей (см. реакцию (1)), получают водный раствор, содержащий остаток соляной или азотной кислоты, хлорид или нитрат кальция и фосфорную кислоту. Полученный фильтрат подвергают нагреванию и кипячению, при этом соляная или азотная кислота отгоняется с водяным паром и конденсируется в виде соответствующего раствора кислоты, поскольку эти кислоты, в отличие от фосфорной кислоты, являются летучими кислотами:

Реакции (6), (7), (8) описывают последовательность процессов, а реакции (6), (9), (10) описывают итоговые реакции.
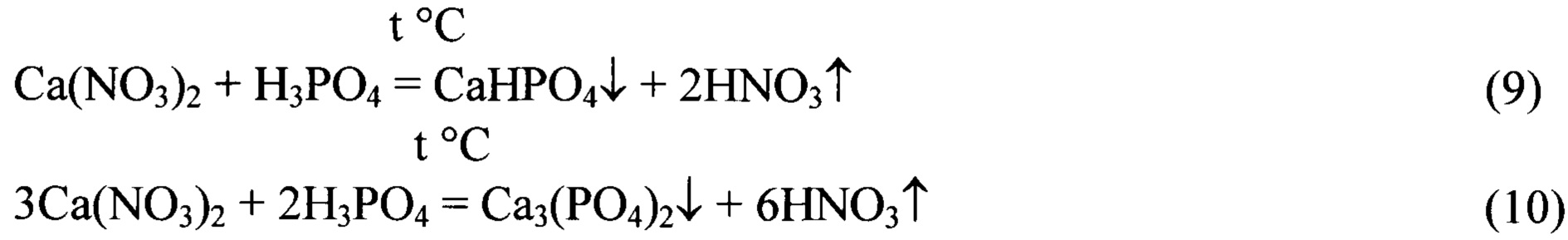
Для протекания реакций (6), (7), (8) рекомендуется использовать перемешивание. Конец реакций (6), (7), (8) определяют как по анализу реакционной смеси, так и по количеству отогнанной азотной (соляной) кислоты. Процесс можно прекратить (прервать) на любой стадии. Сконденсировавшийся раствор азотной или соляной кислоты используется повторно в реакции (1).
Необходимо отметить, что соляно- и азотнокислые растворы, полученные при обработке природных руд, содержащих фосфат кальция, будут содержать избыток ионов кальция, по отношению к ионам P(V), что будет благоприятно сказываться на смещении протекания реакций слева направо по уравнениям (6-8). При нагревании (кипячении) происходит концентрирование раствора по нитрату или хлориду кальция, и так как концентрированные растворы нитрата и, особенно, хлорида кальция имеют повышенную температуру кипения (большую, чем у воды и большую, чем температура кипения азеотропных растворов соляной и азотной кислот), то это также приведет к смещению протекания прямой реакции по уравнениям (6-8). Кроме того, согласно выполнению ионного равновесия, задаваемого значением произведения растворимости малорастворимых и нерастворимых веществ (ПР), концентрирование раствора по ионам кальция также приведет к смещению протекания реакций слева направо по уравнениям (6-8), т.к. дигидрофосфат кальция ограниченно растворимое вещество, гидрофосфат кальция малорастворимое, а фосфат кальция нерастворимое в воде вещество.
Реакцию (6) и (7) можно осуществить при нагреве (кипячении) водных растворов (смесей) при t=50-150°C (рекомендуется при t=120-130°C) (при пониженном, атмосферном и повышенном давлении), в том числе добавляя при перемешивании объем дистиллированной воды, равный объему испарившегося раствора, реакцию (6) и (7) также можно осуществить, нагревая смесь влажных солей (соединений) при t=100-200°C (рекомендуется при 140-160°С), а реакцию (8) рекомендуется проводить при интенсивном нагревании (прокаливании) смеси твердых сухих солей при t=150-600°C (рекомендуется при 350-450°С). Контролировать ход и завершение реакций (6-10) рекомендуется по количеству отогнанной азотной или соляной кислоты.
Если для протекания реакции используется водная среда, то после завершения соответствующей реакции осадки дигидрофосфата, гидрофосфата или фосфата кальция отделяют фильтрованием, промывают холодной водой и сушат. Фильтрат, содержащий нитрат (хлорид) кальция, в случае необходимости перерабатывают на другие соединения кальция, либо на другие соединения хлорид- или нитрат ионов, либо концентрируют для получения кристаллического хлорида или нитрата кальция.
Если для получения дигидрофосфата, гидрофосфата или фосфата кальция используется твердофазная реакция в смеси влажных или сухих солей, то полученный продукт, который сам по себе уже может служить хорошим фосфорно-азотнокислым удобрением (в случае использования для синтеза раствора, содержащего фосфат- и нитрат ионы), смешивается с необходимым количеством воды для отделения (растворения) хлорида или нитрата кальция. Осадок дигидрофосфата, гидрофосфата или фосфата кальция отделяют фильтрованием, промывают холодной водой и сушат. Фильтрат, содержащий нитрат (хлорид) кальция, в случае необходимости перерабатывают на другие соединения кальция, либо на другие соединения хлорид- или нитрат ионов, либо концентрируют для получения кристаллического хлорида или нитрата кальция.
С целью экономии тепловой и электрической энергии процесс отгонки паров азотной (соляной) кислоты при протекании реакций (6-10) можно проводить и при уменьшенном давлении, в том числе и с использованием принципа теплового насоса.
Предлагаемый способ позволяет получать кислые и средний фосфаты кальция из природной руды, загрязненной соединениями железа и алюминия, которые сильно мешают получению гидрофосфата кальция по соляно- и азотнокислому способу, указанному в [1].
Несмотря на возможность присутствия фосфатов железа и алюминия в получаемых по предлагаемому способу кислых и среднем фосфате кальция при переработке природной руды, содержащей фосфат кальция и загрязненной соединениями железа и алюминия, предлагаемый способ использует меньшее число операций, в отличие от способа получения гидрофосфата кальция, который можно получить, используя и сочетая патенты [3] и [4], либо используя данные, указанные в [1].
Необходимо отметить, что по предлагаемому способу достигается отсутствие, либо низкое содержание фторид-ионов в получаемых кислых и среднем фосфате кальция, так как фтористоводородная (плавиковая) кислота является летучей кислотой средней силы, и она будет удаляться при кипячении фильтрата (полученного по реакции (1)), либо при нагреве соответствующей смеси влажных или сухих солей, также как и соляная и азотная кислоты по реакциям (6-10), см. выше. При наличии заметного количества примеси плавиковой кислоты в получаемой азотной (соляной) кислоте рекомендуется их очистить, например, дробной перегонкой перед их повторным использованием в реакции (1).
Пример 1
100 мл раствора, содержащего 2М Са(NO3)2+1М Н3РО4+2М HNO3, нагревали при 95-110°С в колбе с газоотводной трубкой, снабженной холодильником, до тех пор, пока не отогнали с водяным паром 18,9 г HNO3, которую сконденсировали в виде водного раствора. Остаток в колбе смешали с 30 мл дистиллированной воды и профильтровали. Полученный осадок промыли на фильтре холодной водой. Отделенный с фильтра осадок содержит 11 г дигидрофосфата кальция.
Пример 2
100 мл раствора, содержащего 2М Са(NO3)2+1М Н3РО4+2М HNO3, нагревали при 100-125°С в колбе с газоотводной трубкой, снабженной холодильником, до тех пор, пока не отогнали с водяным паром 25,2 г HNO3, которую сконденсировали в виде водного раствора. Остаток в колбе смешали с 30 мл дистиллированной воды и профильтровали. Полученный осадок промыли на фильтре холодной водой. Отделенный с фильтра полученный осадок содержит 13,2 г гидрофосфата кальция.
Пример 3
100 мл раствора, содержащего 2М Са(NO3)2+1М Н3РО4+2М HNO3, нагревали до образования влажных солей, после чего грели еще в течение часа при 140-160°С. Полученный продукт содержит 16,4 г нитрата кальция и 13,6 г гидрофосфата кальция.
Пример 4
100 мл раствора, содержащего 2М Са(NO3)2+1М Н3РО4+2М HNO3, нагревали в колбе с газоотводной трубкой, снабженной холодильником до образования влажных солей, а далее еще грели в течение часа при 400°С до тех пор, пока не отогнали с водяным паром 31,5 г HNO3, которую сконденсировали в виде водного раствора. Остаток в колбе смешали с 30 мл дистиллированной воды и профильтровали. Полученный осадок промыли на фильтре холодной водой. Отделенный с фильтра полученный осадок содержит 15,4 г фосфата кальция.
Источники информации
1. Технология минеральных удобрений: учебное пособие / И.А. Петропавловский, Б.А. Дмитревский, Б.В. Левин, И.А. Почиталкина. - СПб.: Проспект Науки, 2018. - 312 с.
2. Краткий справочник по химии. Под редакцией академика АН УССР А.Т. Пилипенко. Киев, Наукова думка, 1987, с. 829.
3. Тураев Д.Ю., Почиталкина И.А. Способ получения растворимых фосфатов (натрия, калия и аммония) (варианты). Патент RU 2701320. Заявлено 23.11.18. Опубл. 25.09.19. Бюл. №27.
4. Тураев Д.Ю., Почиталкина И.А. Способ получения кислых фосфатов кальция. Патент RU 2720285. Заявлено 19.08.19. Опубл. 28.04.20. Бюл. №13.
Реферат
Изобретение относится к сельскому хозяйству. Способ получения дигидрофосфата, гидрофосфата и фосфата кальция в качестве удобрений характеризуется тем, что раствор, содержащий нитрат или хлорид кальция, фосфорную кислоту, азотную или соляную кислоту, подвергают нагреванию и кипячению при t=50-150°C, добавляя при перемешивании объем дистиллированной воды, равный объему испарившегося раствора, или сначала испаряют раствор, содержащий нитрат или хлорид кальция, фосфорную кислоту, азотную или соляную кислоту, до образования смеси влажных солей, а затем нагревают полученную смесь влажных солей при t=100-200°C, или раствор, содержащий нитрат или хлорид кальция, фосфорную кислоту, азотную или соляную кислоту, испаряют путем нагревания до образования смеси влажных солей, а затем эту смесь греют до образования сухих солей, которые далее нагревают-прокаливают при t=150-600°C, при этом пары азотной или соляной кислоты вместе с парами воды отгоняются и конденсируются с получением раствора азотной или соляной кислоты, который используется повторно, а оставшийся после перегонки остаток смешивается с водой, при этом образуется осадок умеренно растворимого дигидрофосфата кальция, плохо растворимого гидрофосфата кальция и нерастворимого фосфата кальция, который отделяется фильтрованием. Изобретение позволяет получить кислые и средние фосфаты кальция в качестве удобрений, а также существенно снизить расход соляной или азотной кислоты. 1 з.п. ф-лы, 4 пр.
Формула
Документы, цитированные в отчёте о поиске
Твердая фосфатная соль и способ ее получения

Комментарии