Смесь для грудных детей с пробиотиками и компонентами оболочек жировых шариков молока - RU2563355C2
Код документа: RU2563355C2
Чертежи










Описание
Область техники
Настоящее изобретение относится к питательной композиции, предпочтительно смеси для грудных детей, содержащей пробиотики и компоненты оболочек жировых шариков молока (MFGM) для стимулирования иммунного созревания и/или уменьшения воспаления.
Уровень техники
Материнское молоко рекомендуется всем грудным детям. Однако в некоторых случаях грудное вскармливание является неадекватным или безуспешным по медицинским показаниям, либо сама мать отказывается от кормления грудью. Для таких ситуаций разработаны смеси для грудных детей.
В недавнем прошлом некоторые штаммы бактерий привлекли повышенный интерес в связи с тем, что они при приеме их внутрь проявляют, как было установлено, ценные свойства для человека. В частности, было установлено, что определенные штаммы родов Lactobacilli и Bifidobacteria способны заселять слизистую кишечника, снижать способность патогенных бактерий к адгезии к кишечному эпителию, оказывать иммуномодулирующее действие и способствовать поддержанию хорошего самочувствия. Такие бактерии называются пробиотиками.
Экстенсивные исследования были проведены с целью идентификации новых пробиотических штаммов. Например, EP 0199535, EP 0768375, WO 97/00078, EP 0577903 и WO 00/53200 описывают определенные штаммы лактобацилл и бифидобактерий, и их полезное действие.
Считается, что непосредственно перед родоразрешением желудочно-кишечный тракт ребенка является стерильным. В процессе родоразрешения он сталкивается с бактериями из пищеварительного тракта и половых путей, а также кожи матери, и начинает быстро заселяться ими. Постнатальная колонизация желудочно-кишечного тракта комменсальными бактериями обеспечивает бактериальные стимулы, которые являются решающими для функционального развития ассоциированной с основными отделами кишечника лимфоидной ткани (GALT), включающей пейеровы (лимфоидные) бляшки (Т- и В-клетки, макрофаги, дендритные клетки), собственные пластинки слизистых оболочек (Т-клетки, IgA-секретирующие плазматические В-клетки, дендритные клетки, мастоциты (тучные клетки)) и интраэпителиальные лимфоциты (естественные клетки-киллеры, Т-клетки). Этот процесс ответственен большей частью за "охранную" функцию иммунных клеток кишечника, позволяющую им различать неопасные и опасные сигналы, и, как следствие этого, создавать систему толерантности или иммунитета.
В составе микробиоты кишечника существуют значительные различия, обусловленные типом вскармливания ребенка. Фекальная флора грудных детей на грудном вскармливании включает значительные популяции бифидобактерий наряду с некоторыми видами лактобацилл, в то время как грудные дети, вскармливаемые смесями, имеют более сложную микробиоту, в которой обычно присутствуют бифидобактерии, бактероиды, клостридии и стрептококки.
По этой и другим причинам было предложено добавлять пробиотики в смеси для грудных детей. Показано, что определенные пробиотические штаммы стимулируют иммунные защитные механизмы, являются антагонистами патогенных бактерий, благоприятствуют развитию здоровой микробиоты и подавляют иммуносвязанные расстройства, такие как аллергии или воспаление, у животных и человека. Способность определенных пробиотических бактериальных штаммов модулировать компоненты кишечной микробиоты хозяина - это только один механизм влияния указанных штаммов на иммунную систему. В дополнение к этому постулировалось также, что прямое взаимодействие с мукозальной иммунной системой проявляется в стимуляции образования иммунорегулирующих цитокинов; этот постулат подтверждается полученными в последнее время данными о возможной прямой выборке дендритными клетками люминальных бактерий, которые распространяют дендриты по всему кишечному эпителию.
Совсем недавно Benyacoub et al. продемонстрировали, что введение в рацион Lactobacillus rhamnosus CGMCC 1.3724 в раннем периоде жизни способно стимулировать мукозальную иммунную защиту и усиливать иммунный ответ на системную вакцину у неонатальной мышиной модели (J. Benyacoub, A. Zuercher, R. Bibiloni, K.-Y. Saudan, P. Serrant, G. Reuteler, I. Rochat, I. Segura-Roggero, F. Foata, K. Deiser, K. Vidal, F. Rochat, S. Blum. Early life feeding with low dose Lactobacillus rhamnosus CGMCC 1.3724 promotes immune development in gnotobiotic mice [Кормление в раннем периоде жизни низкой дозой Lactobacillus rhamnosus CGMCC 1.3724 стимулирует развитие иммунной системы у гнотобионтных мышей]. Acta Pasdiatrica 2007, 96 (Suppl. 456), pp. 12). Другие недавние достижения в области научных исследований доказывают, что женское грудное молоко содержит низкую дозу бактерий и/или бактериальных фракций, естественным образом происходящих из кишечника матери, которая, по всей вероятности, и переносится к ребенку (Pablo F. Perez, Joël Doré, Marion Leclerc, Florence Levenez, Jalil Benyacoub, Patrick Serrant, Iris Segura-Roggero, Eduardo J. Schiffrin, and Anne Donnet-Hughes. Bacterial Imprinting of the Neonatal Immune System: Lessons from Maternal Cells? [Бактериальный импринтинг неонатальной иммунной системы: уроки от материнских клеток?]. PEDIATRICS, vol. 119 (3), MarchPediatrics 2007; 119; 724-732). Выдвинута гипотеза, что этот инокулят после родоразрешения содействует раннему обучению иммунной системы младенца.
WO 2007/009187 А1 описывает использование сметаны (сквашенных сливок) или пахты с пробиотиками. Burn et al. (P. Burns, G. Vinderola, F. Molinary, J. Reinhemer. (2008) Suitability of whey and buttermilk for the growth and frozen storage of probiotic lactobacilli [Пригодность сыворотки и пахты для роста и морозильного хранения пробиотических лактобацилл], International Journal of Dairy Technology 61, TSSUE2, 156-164) раскрывает в резюме использование сыворотки или пахты в качестве питательной среды для роста и хранения пробиотических лактобацилл.
Rodas et al. (В.A. Rodas, J.О. Angulo, J. Cruz, H.S. Garcia (2002). Preparation of probiotic buttermilk with Lactobacillus reuteri [Приготовление пробиотической пахты с Lactobacillus reuteri]. Milchwissenschaft, 57 (1), 26-28) описывает использование Lactobacillus reuteri для приготовления пробиотической пахты.
UA 30063 раскрывает напиток, содержащий пахту или смесь пахты с подсырной сывороткой, или смесь пахты с обезжиренным молоком и подсырной сывороткой, в качестве молочной среды-носителя симбиотической пробиотической закваски из определенных бифидобактерий и лактобацилл.
Вышеописанные материалы обсуждают химические и физические (растворимость, вязкость, эмульгирующая и пенообразующая способность) свойства различных источников пахты или обсуждают использование сливок либо пахты в качестве носителей или в качестве среды хранения или роста пробиотиков, либо предлагают ферментированные продукты с улучшенными технологическими или органолептическими свойствами.
WO 2004/112509 обеспечивает приготовление смеси для грудных детей, содержащей MFGM и по меньшей мере один вид микроорганизмов для индуцирования созревания физического барьера, обеспечиваемого кишечником, таким путем, который аналогичен получению указанного барьера при грудном вскармливании.
US 2008/0003330 A1 описывает применение обогащенного сывороточно-белкового концентрата, содержащего MFGM, для обеспечения биоактивных липидов для развития головного мозга и когнитивного развития и функции у грудного ребенка.
FR 2908605 A1 раскрывает питательный продукт, содержащий MFGM в качестве источника липидов для использования в желудочно-кишечном тракте. Он также обсуждает применение определенных штаммов молочнокислых бактерий. Однако эти бактерии рассматриваются с точки зрения их технологических свойств, а не как пробиотики. Настоящее изобретение расширяет сферу применения MFGM до его использования вкупе с пробиотиком для получения особой выгоды для здоровья.
В рамках укрепления здоровья грудных детей, не полностью вскармливаемых грудным молоком, отмечается постоянно растущая потребность в создании детских смесей, максимально (насколько это возможно) приближенных по составу к женскому молоку в плане как питательных, так и биоактивных свойств.
Сущность изобретения
Изобретение относится к питательной композиции, содержащей пробиотический штамм Bifidobacterium lactis CNCM I-3446 и оболочки жировых шариков молока (MFGM). Причем MFGM усиливают биологическое действие указанного пробиотика. Питательная композиция является смесью для грудных детей, кашей для грудных детей, продуктом детского питания или оздоравливающим питательным продуктом для нуждающихся индивидов. При этом биологическое действие питательной композиции представляет собой стимулирование иммунного созревания, уменьшение воспаления и их сочетание.
Предпочтительно питательная композиция предназначена для недоношенных детей.
Предпочтительно, если пробиотический штамм происходит или выделен из источника человеческого происхождения, более конкретно - из женского молока.
Предпочтительно, если питательная композиция дополнительно содержит пробиотик, выбранный из перечня, включающего: Lactobacillus rhamnosus GG ATCC 53103, Lactobacillus rhamnosus CGMCC 1.3724, Bifidobacterium longum BB536, депонированный как ATCC BAA-999, Lactobacillus paracasei CNCM I-2116, Lactobacillus johnsonii CNCM I-1225, Lactobacillus helveticus CNCM I-4095, Bifidobacterium breve CNCM I-3865, Bifidobacterium longum CNCM I-2618 и их смесь. Это придает композиции дополнительные полезные свойства.
Предпочтительно, если MFGM содержат белки или биоактивные белки, способные связываться или биологически взаимодействовать с указанными пробиотиком.
Предпочтительно, если MFGM присутствуют в количестве от 0,1% до 10 масс. % общего белка, предпочтительно - от 0,5% до 5%.
Предпочтительно, если MFGM присутствуют в количестве от 0,01 г до 7 г MFGM из расчета на 100 г массы композиции.
Предпочтительно, если MFGM содержат ганглиозиды и/или фосфолипиды, способные связываться или биологически взаимодействовать с указанным пробиотиком, причем указанные ганглиозиды или фосфолипиды предпочтительно присутствуют в количестве от 0,03% до 5 масс. % общего белка.
Предпочтительно, если MFGM обработаны пищевым протеолитическим ферментом, таким как трипсин, химотрипсин, панкреатин, папаин, алкалаза, нейтраза или их комбинация.
Предпочтительно, если питательная композиция дополнительно содержит пребиотик, предпочтительно фруктоолигосахарид (FOS), галактоолигосахарид (GOS), олигосахариды коровьего молока (CMOS) и/или их комбинацию. Это придает композиции дополнительные полезные свойства.
Предпочтительно MFGM могут быть получены из пахты, фракций пахты, обезжиренной пахты, делактозированной пахты, фракции пахты, полученной микрофильтрацией или ультрафильтрацией, фракций, извлеченных из сывороточно-белкового концентрата, сладкой сыворотки, кислой сыворотки, подсырных сливок или ассоциированной с жиром фракции из сыворотки, содержащей фосфолипиды, и/или в которой указанные MFGM содержат сфингомиелин, фосфатидилэтаноламин, фосфатидилхолин, фосфатидилинозитол, фосфатидилсерин, холестерин, ганглиозиды, муцин-1 (MUC 1), ксантиноксидазу/дегидрогеназу, PAS IIII (реакция Шифф-йодная кислота), CD36, бутирофилин (BTN), адипофилин (ADPH), PAS 6/7, белок, связывающий жирные кислоты (FABP), лактоферрин, лактадерин, пептид ETTVFENLPEK (SEQ ID: 1), пептид SFQLFGSPPGQR (SEQ ID: 2), пептид GSNFQLDQLQGR (SEQ ID: 3), пептид FQFIQVAGR597 (SEQ ID: 4), пептид IFIGNVNNSGLK (SEQ ID: 5), пептид INLFDTPLETQYVR (SEQ ID: 6), пептид TPLPLAGPPR (SEQ ID: 7), пептид EGQEQEGEEMAEYR (SEQ ID: 8), пептид SELLVDQYLPLTK (SEQ ID: 9) или их комбинацию.
Предпочтительно питательная композиция применяется в способе стимулирования иммунного созревания, уменьшения воспаления или и того и другого у грудных детей, недоношенных детей, детей младшего возраста или у нуждающихся в этом индивидов.
Краткое описание фигур
Фиг. 1. Женское молоко от одной матери, 7 дней после родов; появление в поле зрения бактериальных ДНК (дорожки 1 и 2), в частности, в образцах 5 и 6, т.е. в сливочных фракциях, содержащих MFGM.
Фиг. 2. Женское молоко от двух матерей; появление в поле зрения бактериальных ДНК (дорожки, указанные в середине 2 стрелками), в частности, в образцах 2 и 3, т.е. в сливочных фракциях, содержащих MFGM).
Фиг. 3. Электронные микрограммы MFGM (NRC, F. Morgan), показывающие бактериальные структуры - одиночные или в виде цепочек (обозначены стрелками), ассоциируемые с MFGM.
Фиг. 4. Модель взаимодействий клеток слизистой кишечника.
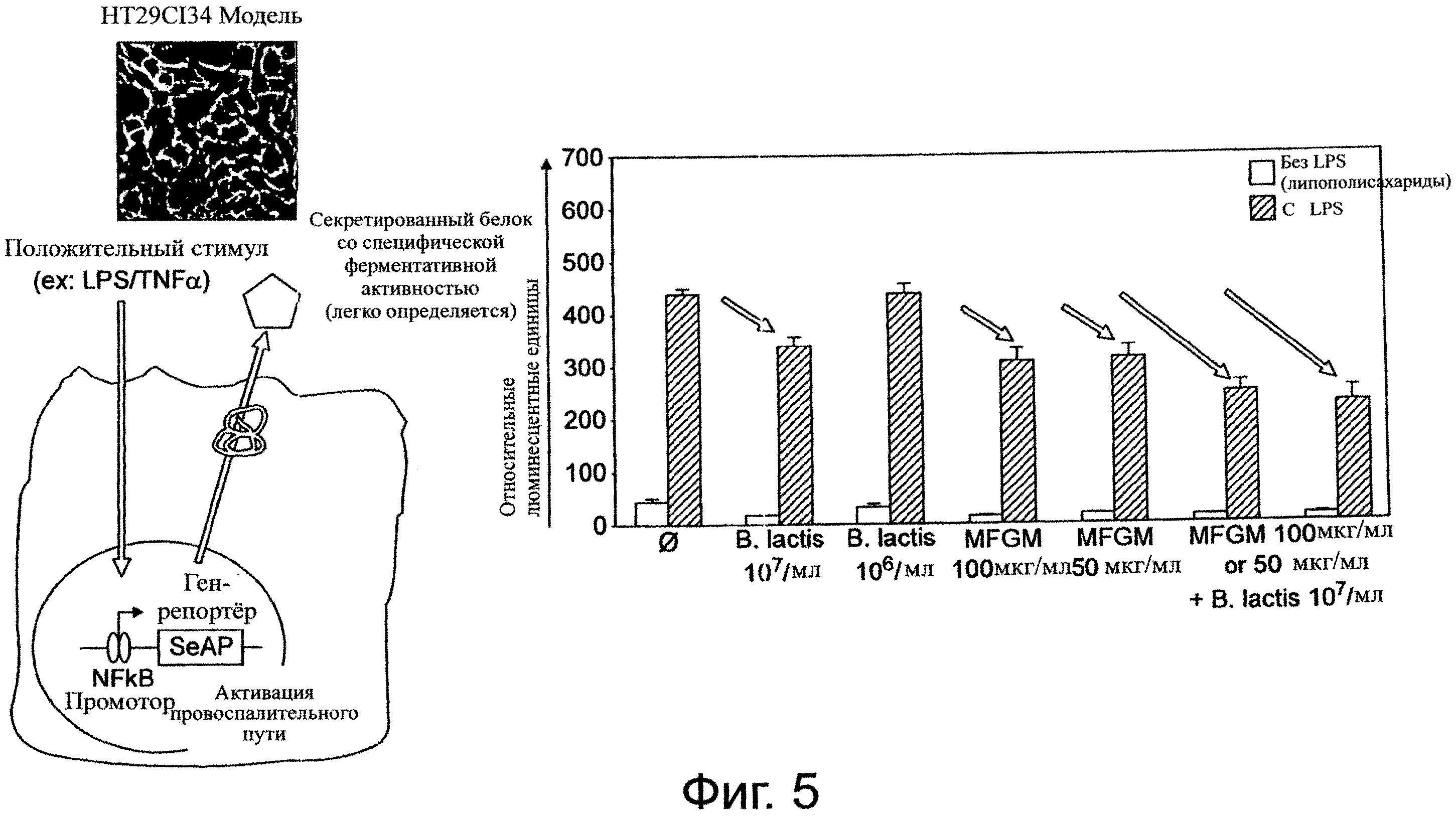
Фиг. 5. Ответная реакция эпителиальных клеток на LPS (липополисахариды). Пробиотик и MFGM снижают реактивность эпителиальных клеток по отношению к действию эндотоксинов (LPS) и связанную с этим воспалительную реакцию. В случае комбинации пробиотика с MFGM можно наблюдать кумулятивный эффект, что позволяет предположить наличие синергизма между этими двумя ингредиентами.
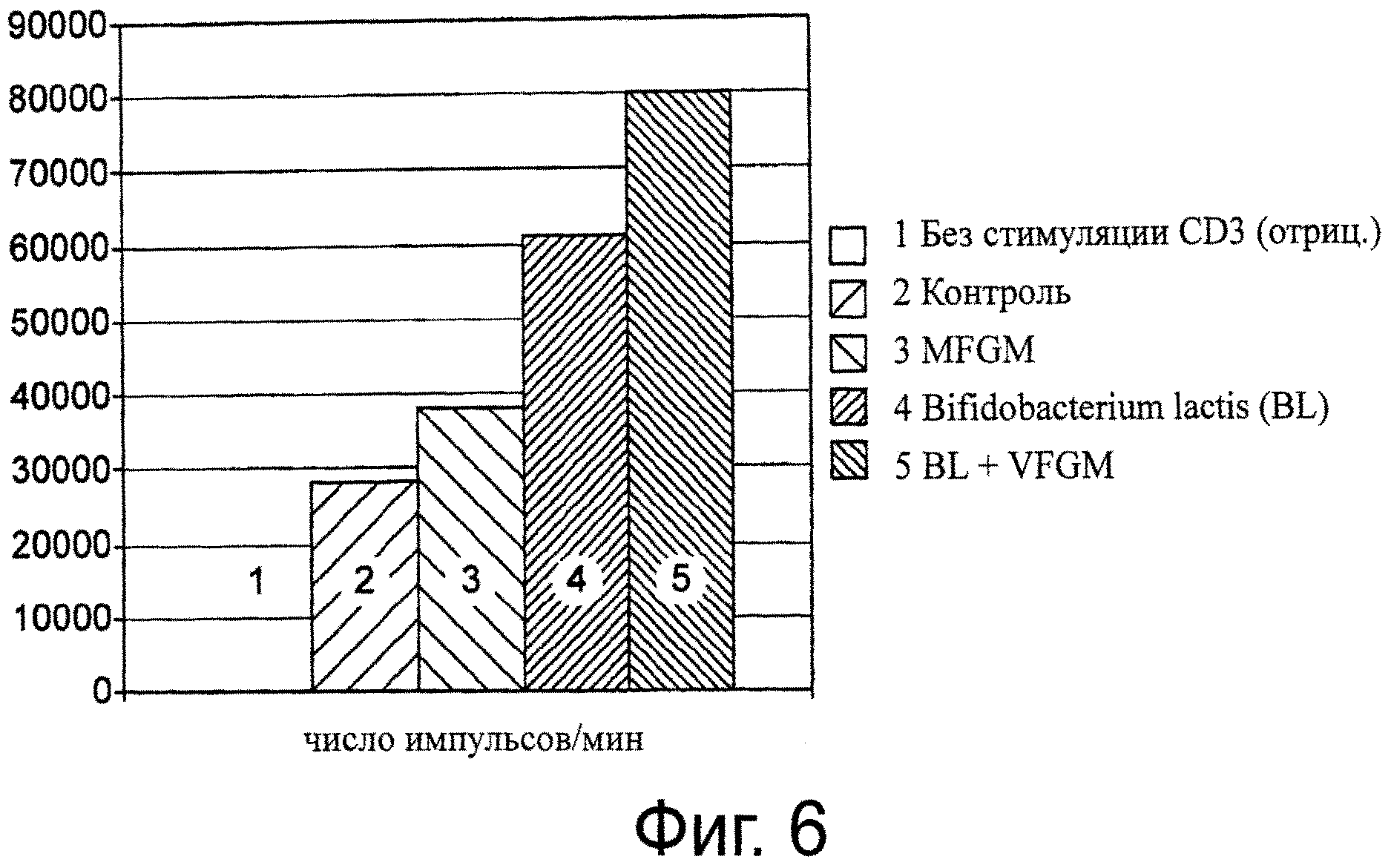
Фиг. 6. Активация Т-клеток. MFGM и пробиотик содействуют активации Т-клеток. Можно наблюдать синергизм между MFGM и В. lactis.
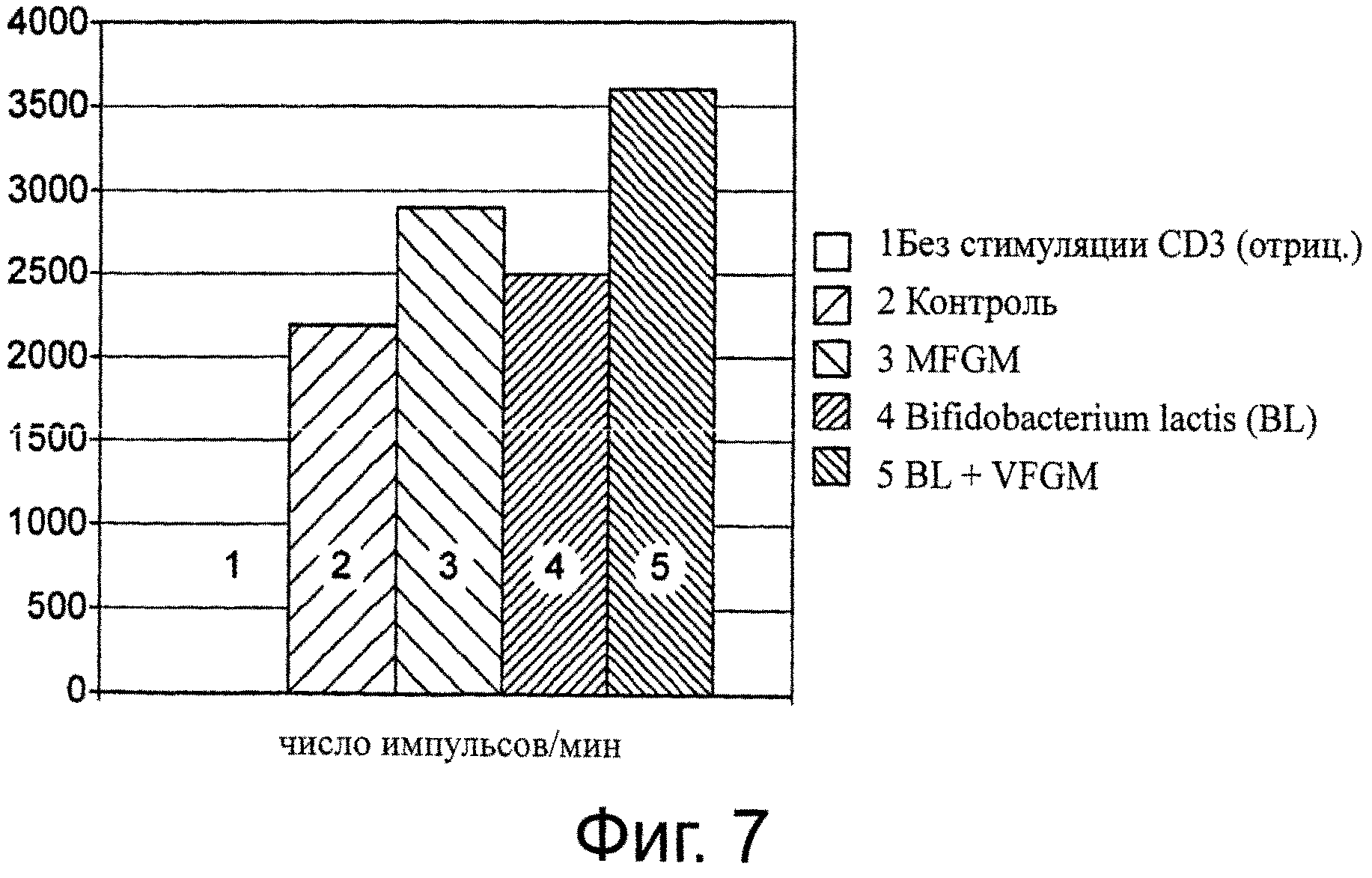
Фиг. 7. Активация В-клеток. MFGM содействуют активации В-лимфоцитов. Применение только пробиотика дает меньший эффект. Можно наблюдать синергизм между MFGM и пробиотиком.
Фиг. 8. Неспецифическое продуцирование кишечных IgA. Уровни IgA-секретирующих клеток, выделенных из пейеровых бляшек мышей, которым скармливались MFGM в течение 1 недели (А) и 4 недель (В).
Раскрытие изобретения
Терминология
В настоящем описании следующие термины имеют значение, раскрываемое ниже.
"Грудной ребенок" относится к ребенку в возрасте менее 36 месяцев.
"Смесь для грудных детей" означает пищевой продукт, предназначенный для полноценного питания детей в течение первых 12 месяцев жизни; в контексте изобретения более конкретно это относится к грудным детям в возрасте до 6 месяцев.
"Нуждающийся индивид" означает грудного ребенка, ребенка раннего возраста, ребенка младшего дошкольного возраста, подростка или взрослого, имеющего конкретные физиологические потребности, обусловленные рассматриваемыми здесь физиопатологическими состояниями, для которого предполагаемое изобретение предлагает улучшенное или альтернативное решение. Термин охватывает пациентов всех возрастов, страдающих такими физиопатологическими состояниями.
"Пребиотик" означает неусвояемый пищевой ингредиент, который благотворно влияет на хозяина, избирательно стимулируя рост и/или активность одного вида или ограниченного числа видов бактерий в толстой кишке и улучшая, тем самым, здоровье хозяина (Gibson and Roberfroid "Dietary Modulation of the Human Colonic Microbiota: Introducing the Concept of Prebiotics" [Модулирование микробиоты толстой кишки человека с помощью диеты: введение понятия "пребиотики"]. J. Nutr. 125: 1401-1412).
"Пробиотик" означает (в контексте бактериальных штаммов) препараты бактериальных клеток или компоненты бактериальных клеток, оказывающие полезное действие на здоровье или самочувствие хозяина. (Salminen S., Ouwehand A., Benno Y. et al. "Probiotics: how should they be defined" [Пробиотики: как следует интерпретировать этот термин]. Trend Food Sci. Technol. 1999: 10, 107-110).
"Первые несколько недель жизни ребенка" означает период с момента рождения до конца второго месяца жизни ребенка.
"Оболочки жировых шариков молока (MFGM)" представляют собой жировые фракции молока (в частности, коровьего молока или женского молока), как описано и определяется в Nutritional and technological aspects of milk fat globule membrane material [Питательные и технологические аспекты оболочечного материала жировых шариков молока], International Dairy Journal 18 (2008), 436-457, K. Dewettinck et al. Если говорить коротко, то термин охватывает оболочку и ассоциированные с оболочкой материалы, которые окружают жировые шарики в молоке млекопитающих, вместе с другими компонентами MFGM, обозначенными здесь "MFGM-компоненты". Для облегчения изложения термины "MFGM" и "MFGM-компоненты" в настоящем документе употребляются взаимозаменяемо.
Авторам настоящего изобретения удалось недавно наблюдать, что бактерии в женском молоке ассоциированы inter alia (среди прочего) со сливочной фракцией молока. Это открытие побудило авторов провести дополнительные исследования по изучению ассоциации бактерий и липидов, а также белковых компонентов в женском молоке, и воздействий этой ассоциации, которые и привели к настоящему изобретению.
В одном варианте осуществления настоящее изобретение предлагает питательную композицию, содержащую пробиотический бактериальный штамм Bifidobacterium lactis CNCM I-3446 ("или с дополнительными другими) в количестве, эквивалентном от 103 до 1012 КОЕ/г сухой смеси, и оболочки жировых шариков молока (MFGM) в количестве от 0,01 г до 0,1 г/100 г жидкой композиции или смеси, предпочтительно - от 0,03 г до 0,1 г/100 г жидкой композиции или смеси, и/или от 0,01 г до 0,8 г/100 г сухой композиции или смеси, предпочтительно - от 0,1 г до 0,5 г/100 г сухой композиции или смеси. В одном варианте воплощения композиция содержит MFGM в количестве от 0,1% до 10 масс. % общего белка, предпочтительно - 0,5% до 5%. В одном варианте воплощения питательная композиция содержит MFGM в количестве от 0,01 г до 7 г MFGM/100 г массы композиции.
В одном варианте осуществления изобретения источником получения MFGM является коровье молоко, молоко буйволиц, кобылье, козье и/или женское молоко.
Белковый состав оболочек жировых шариков женского молока большей частью еще неизвестен, хотя на его долю приходится от 2% до 4% общего содержания молочного белка (Stephania Quaranta et al. Human proteome enhancement: High-recovery method and improved two-dimensional map of colostral fat globule membrane proteins [Расширенное изучение протеома человека: метод, обеспечивающий высокий выход, и улучшенная двумерная карта белков оболочек жировых шариков женского молозива]. Electrophoresis 2001, 22, 1810-1818). Изобретение обеспечивает количество оболочек жировых шариков женского молока в диапазоне от 0,1% до 10% общего белка в композиции или смеси, предпочтительно - от 0,5% до 2% общего белка в композиции или смеси.
Изобретение распространяется также на применение пробиотического бактериального штамма Bifidobacterium lactis CNCM I-3446 и оболочек жировых шариков молока в производстве питательной композиции для стимуляции созревания иммунной системы новорожденного в первые несколько недель жизни.
Изобретение дополнительно распространяется на применение пробиотического бактериального штамма и оболочек жировых шариков молока в производстве питательной композиции для предупреждения или лечения патогенных инфекций у новорожденного в первые несколько недель жизни.
В следующем аспекте изобретение предлагает способ стимуляции созревания иммунной системы нуждающегося в этом новорожденного в первые несколько недель жизни.
Способ включает скармливание грудному ребенку терапевтического количества питательной композиции, содержащей пробиотические бактерии и оболочки жировых шариков молока.
В еще одном аспекте изобретение предлагает способ предупреждения или лечения патогенных инфекций у нуждающегося в этом новорожденного в первые несколько недель жизни. Способ включает скармливание ребенку терапевтического количества питательной композиции, содержащей пробиотические бактерии и оболочки жировых шариков молока.
В молоке млекопитающих жировая фаза в большинстве случаев составляет около 40 г/л и состоит главным образом из триглицеридов (96% общего жира), диглицеридов (2% общего жира) и сложных липидов (1% общего жира). Триглицериды, синтезируемые в гладком эндоплазматическом ретикулуме альвеолярной клетки молочной железы, соединяются в крупные капли, которые мигрируют к апикальной (верхушечной) плазматической мембране клетки. Затем липидные капли сталкиваются и постепенно ′укутываются′ в мембрану эпителиальных клеток молочной железы. Эти мембраны, окружающие молочные липиды, поскольку они секретируются клетками, называются оболочками жировых шариков молока. Оболочка жирового шарика молока содержит специфические гликопротеины, такие как лактоферрин, муцины, лактадерин и ксантиноксидазу, а также сложные полярные липиды, такие как глицерофосфолипиды и сфинголипиды. Многие из этих компонентов присутствуют в женском молоке в намного более высоких концентрациях, чем в коровьем молоке.
Первое взаимодействие пробиотика с хозяином происходит на уровне слизистой кишечника. Пробиотики, как было широко продемонстрировано, защищают хозяина от инфекций и потенциально улучшают специфический исход болезни. Одним из ключевых критериев, часто используемых для выбора пробиотических штаммов, является их способность к адгезии к слизистой кишечника. По-видимому, этот факт имеет важное значение для блокирования адгезии патогенов in vitro и для модулирования защитных иммунных функций.
В исследованиях по изучению взаимодействия оболочки жировых шариков коровьего молока с клетками кишечного эпителия (IEC) in vitro авторы настоящего изобретения разрушали оболочку жировых шариков молока. И хотя во фракциях интактных оболочек ими не были напрямую обнаружены бактерии, разрушение оболочек ультразвуком приводило к обсеменению IEC культур. По всей вероятности, бактерии происходят из MFGM, а не из IEC культур. В подтверждение этого электронные микроснимки MFGM коровьего молока выявили наличие бактериальных кокков в виде цепочек (см. фиг. 3). Не желая останавливаться на теории, авторы настоящего изобретения выдвинули предположение, что связывание или инкапсуляция бактерий и/или их компонентов в оболочку жировых шариков молока может облегчить прохождение бактериальных компонентов через желудочно-кишечную систему, обеспечить их доставку к соответствующим участкам мукозальных тканей новорожденного, вскармливаемого грудью, и модулировать, совместно с другими факторами оболочек жировых шариков молока, иммунологические процессы. Выдвинута гипотеза, что ассоциация MFGM и пробиотика приводит к потенцированию (синергизму) полезных воздействий, наблюдаемых при использовании только пробиотика или только оболочек жировых шариков молока.
Настоящее изобретение выявляет иммуномодулирующие свойства MFGM в ассоциации с пробиотиком, превосходящие результаты, которые могут достигаться при использовании указанных ингредиентов по отдельности. Ранее проведенные исследования показали, что, хотя полезное действие пробиотиков и пребиотиков на здоровье организма является общепризнанным фактом, их защитный эффект от диареи у грудных детей утрачивается в случае комбинированного применения этих двух ингредиентов (Chouraqui et al. 2007). Таким образом, сочетанное действие и/или синергизм между пробиотиком и MFGM, наблюдаемые в настоящем изобретении, невозможно было спрогнозировать.
Настоящее изобретение сообщает, что комбинация пробиотика с MFGM, с одной стороны, может ограничивать некоторые провоспалительные сигналы и, как таковая, может ограничивать повреждение тканей, а, с другой стороны, усиливает мукозальную защиту за счет увеличения продуцирования секреторных IgA клетками кишечника. Это позволяет предположить, что комбинирование пробиотика с MFGM ведет к физиологической синергии за счет стимулирования отдельных, но комплементарных механизмов, которые совместно обеспечивают улучшенную защиту хозяина. Кроме того, совместный прием пробиотика и MFGM может оказывать влияние на биологические ответные реакции в различных участках тканей или в различных видах клеток, отличающихся от тех, на которые нацелены указанные компоненты по отдельности. Например, в результате их совместного приема могут улучшиться выживаемость жизнеспособных пробиотиков в процессе прохождения через кишечник, а также хоминг (стремление клеток к родному для них микроокружению) пробиотиков и/или их прикрепление к определенным участкам кишечника.
Настоящее изобретение относится к применению MFGM и пробиотика к дополнительным аспектам созревания защитного барьера кишечника, таким как иммунное созревание. Кроме того, поскольку совместный прием пробиотика и MFGM может также влиять на противовоспалительные процессы, настоящее изобретение распространяется и на их комбинированное использование не только для грудных детей, но и для популяций повышенного риска, независимо от возраста. По существу вовсе необязательно, чтобы продукт, содержащий такие ингредиенты, был единственным источником питания в период приема.
Механистически можно предположить, например, что MFGM являются важным источником липидов для новорожденного и что некоторые бактерии способны усиливать экспрессию молекул, вовлеченных в абсорбцию липидов. Отсюда следует, что должна быть предусмотрена возможность достижения равноценного полезного эффекта от смесей, которыми вскармливается грудной ребенок, за счет дополнения этой смеси пробиотиком и оболочками жировых шариков молока. Пробиотик может предварительно смешиваться с MFGM перед добавлением в композицию изобретения либо оба препарата (пробиотик, MFGM) могут добавляться в композицию изобретения по отдельности.
Предпочтительно питательная композиция изобретения является смесью для грудных детей. Композиция может быть продуктом детского питания, жидкой, полужидкой или твердой, преимущественно для детей в возрасте от 0 до 7 лет или от 0 до 3 лет. Композиция может представлять собой кашу для детского питания. Композиция изобретения может быть также предназначена для подростков и взрослых, страдающих конкретными физиопатологическими расстройствами, особенно для тех, кто нуждается в этом и/или имеет ослабленную желудочно-кишечную систему, и/или ослабленную иммунную/защитную систему.
Основным пробиотическим штаммом является Bifidobacterium lactis CNCM I-3446, который может быть получен от Christian Hansen Company (Дания) под торговой маркой Bb12. Может также использоваться смесь пригодных для данной цели пробиотических молочнокислых бактерий и бифидобактерий.
Дополнительно вводимый пробиотический бактериальный штамм может быть любым видом молочнокислых бактерий или бифидобактерий с установленными пробиотическими характеристиками. Согласно изобретению он может представлять собой любой вид пробиотических бактерий или пробиотических микроорганизмов ("пробиотик"), преимущественно человеческого происхождения, в частности, может представлять собой пробиотик, который был получен или может происходить, обнаружен, экстрагирован или выделен из молока при экскреции, предпочтительно - из женского молока. Подходящие пробиотические молочнокислые бактерии включают Lactobacillus rhamnosus АТСС 53103, который может быть получен, inter alia, от Valio Oy (Финляндия) под торговой маркой LGG; Lactobacillus rhamnosus CGMCC 1.3724, Lactobacillus reuteri АТСС 55730 и Lactobacillus reuteri DSM 17938, которые могут быть получены от Biogaia; Lactobacillus fermentum VRI 003 и Lactobacillus paracasei CNCM I-2116, Lactobacillus johnsonii CNCM I-1225, Lactobacillus helveticus CNCM I-4095, Bifidobacterium breve CNCM I-3865, Bifidobacterium longum CNCM I-2618.
Дополнительные подходящие пробиотические штаммы бифидобактерий включают Bifidobacterium longum АТСС ВАА-999, реализуемый на рынке фирмой Morinaga Milk Industry Co. Ltd. (Япония) под торговой маркой ВВ536; штамм Bifidobacterium breve, реализуемый на рынке фирмой Danisco под торговой маркой Bb-03; штамм Bifidobacterium breve, реализуемый на рынке фирмой Morinaga под торговой маркой M-16V, и штамм Bifidobacterium breve, реализуемый на рынке Институтом Роселла (Institut Rosell, Германия) под торговой маркой R0070.
Пробиотик(-и) присутствует(-ют) в смеси в количестве, эквивалентном от 103 до 1012 КОЕ/г сухой композиции. Могут использоваться жизнеспособные, инактивированные или мертвые бактерии либо могут присутствовать даже фрагменты бактерий, такие как ДНК или материалы клеточных стенок. Другими словами, количество бактерий, которое содержит смесь, выражается в эквиваленте колониеобразующих единиц бактерий независимо от того, являются ли они (все или только часть) жизнеспособными, инактивированными, мертвыми или фрагментированными. Предпочтительно пробиотик присутствует в количестве, эквивалентном от 107 до 1012 КОЕ/г сухой композиции.
Множество MFGM-обогащенных ингредиентов имеется в продаже. MFGM может присутствовать в сливках, пахте и цельном молоке. Что касается использования MFGM в разработках продуктов, то наиболее часто используемым источником являются фракции пахты из-за относительно высокой концентрации MFGM-компонентов в них. Примеры доступных на рынке продуктов на основе пахты включают пахту (код продукта 26048) от Land O′Lakes, Inc. (США, шт. Миннесота); фракции концентрата белка пахты от Fonterra Cooperative Group (Окленд, Новая Зеландия); богатая фосфолипидами фракция, получаемая из MFGM, от Fonterra Cooperative Group Ltd. (Окленд, Новая Зеландия); пахта от Büllinger Butterei (Бюллинген, Бельгия), Foster Farms Dairy (Модесто, США, шт. Калифорния), Dairy America Inc. (Фресно, США, шт. Калифорния), Dairy Farmers of America (Канзас-Сити, США, шт. Миссури); First Milk Ingredients Limited, Paisley, Великобритания, и продукты Laban Up от Gulf & Safa Dairies, Объединенные Арабские Эмираты. Однако в продаже имеются и сывороточно-белковые фракции, обогащенные MFGM. Примеры включают LACPRODAN® MFGM-10 - обогащенную MFGM сывороточно-белковую фракцию, который выпускает Arla Food Ingredients amba (Дания). Другие примеры материала могут включать Promilk 602 Е, содержащий MFGM (по меньшей мере 1,5% MFGM-компонентов с возможностью регулирования количества MFGM по отношению к общему белку), от Ingredia Lacto prosperité AG (Ingredia SA, Arras, Франция) и от любых других поставщиков. В зависимости от соотношения сывороточный белок/казеин (50/50, 70/30) в смеси для грудных детей, один источник MFGM на основе казеина или на молочной основе, такой как пахта или Promilk 602Е, может смешиваться с сывороточным белком с учетом указанного соотношения.
MFGM могут содержать белки, ганглиозиды и/или фосфолипиды либо комбинацию перечисленного.
MFGM могут быть получены из пахты, фракций пахты, обезжиренной пахты, делактозированной пахты, фракции пахты, полученной микрофильтрацией или ультрафильтрацией, фракций, извлеченных из сывороточно-белкового концентрата, сладкой сыворотки, кислой сыворотки, подсырных сливок или ассоциированной с жиром фракции из сыворотки, содержащей фосфолипиды; и/или где указанные MFGM содержат сфингомиелин, фосфатидилэтаноламин, фосфатидилхолин, фосфатидилинозитол, фосфатидилсерин, холестерин, ганглиозиды, муцин-1 (MUC 1), ксантиноксидазу /дегидрогеназу, PAS III (реакция Шифф-йодная кислота), CD36, бутирофилин (BTN), адипофилин (ADPH), PAS 6/7, белок, связывающий жирные кислоты (FABP), лактоферрин, лактадерин, пептид ETTVFENLPEK (SEQ ID: 1), пептид SFQLFGSPPGQR (SEQ ID: 2), пептид GSNFQLDQLQGR (SEQ ID: 3), пептид FQFIQVAGR597 (SEQ ID: 4), пептид IFIGNVNNSGLK (SEQ ID: 5), пептид INLFDTPLETQYVR (SEQ ID: 6), пептид TPLPLAGPPR (SEQ ID: 7), пептид EGQEQEGEEMAEYR (SEQ ID: 8), пептид SELLVDQYLPLTK (SEQ ID: 9) или комбинацию перечисленного.
В одном варианте воплощения композиция изобретения содержит белки, способные связываться с пробиотиком.
MFGM и пробиотик изобретения могут взаимодействовать друг с другом на биологическом уровне. В частности, MFGM может усиливать или стимулировать биологическое действие пробиотика. В одном варианте осуществления изобретения пробиотик в присутствии MFGM может оказывать такое биологическое действие, какое он вряд ли мог бы оказывать в отсутствие MFGM. В одном варианте MFGM и пробиотик могут показывать синергетический эффект, в результате которого полезное биологическое действие пробиотика усиливается. Такое биологическое действие может проявляться во влиянии на созревание иммунной системы и/или кишечника, в стимулировании противоинфекционного действия и/или в уменьшении воспаления.
Пробиотик может усиливать или стимулировать биологическое действие MFGM. В одном варианте осуществления изобретения пробиотик способствует тому, что MFGM проявляет такое биологическое действие, какое они вряд ли могли оказывать в отсутствие пробиотика. В одном варианте пробиотик и MFGM могут показывать синергетический эффект, в результате которого полезное биологическое действие MFGM усиливается. Такое биологическое действие может проявляться во влиянии на созревание иммунной системы и/или кишечника, в стимулировании противоинфекционного действия и/или в уменьшении воспаления.
Смесь для грудных детей согласно настоящему изобретению может содержать источник белка в количестве не более 3,7 или 2,0 г/100 ккал, предпочтительно - от 1,8 до 2,0 г/100 ккал. Предполагается, что источник и вид белка (например, из сыворотки или из казеина, или из их смеси) в композиции изобретения (т.е. содержание белка, не происходящего из MFGM) не являются критическими в настоящем изобретении при условии, что они удовлетворяют минимальным требованиям к содержанию незаменимых аминокислот, и при условии, что они обеспечивают удовлетворительный рост. Однако в одном варианте осуществления изобретения предпочитается, чтобы более 50% или более 60 масс. % источника белка составляла сыворотка (т.е. поддерживался хорошо сбалансированный аминокислотный профиль). Таким образом, могут использоваться источники белка на основе сыворотки, казеина и их смесей, а также источники белка на основе сои. Что касается сывороточных белков, то источник этих белков может быть на основе кислой сыворотки или сладкой сыворотки либо их смесей и может включать альфа-лактальбумин и бета-лактоглобулин в любых требуемых соотношениях.
Однако предпочтительно, чтобы в качестве основного источника белка использовалась модифицированная сладкая сыворотка. Сладкая сыворотка является легкодоступным побочным продуктом сыроделия и часто используется в производстве смесей для грудных детей на основе коровьего молока. Однако сладкая сыворотка включает компонент, который, что нежелательно, богат треонином и беден триптофаном, называемый казеино-гликомакропептидом (CGMP). Удаление CGMP из сладкой сыворотки приводит к получению белка с содержанием треонина, близким к его содержанию в женском молоке. Эта модифицированная сладкая сыворотка может затем дополняться теми аминокислотами, которые присутствуют в ней в малых количествах (главным образом гистидином и триптофаном). Способ удаления CGMP из сладкой сыворотки описан в ЕР 880902, а смесь для грудных детей на основе такой модифицированной сладкой сыворотки описана в WO 01/11990. Использование модифицированной сладкой сыворотки в качестве основного белка в источнике белка позволяет обеспечить присутствие всех незаменимых аминокислот при содержании белка от 1,8 до 2,0 г/100 ккал. В исследованиях на животных и человеке было показано, что такие источники белка имеют коэффициент эффективности белка, коэффициент усвояемости азота, биологическую ценность и коэффициент использования чистого белка, сравнимые с такими же показателями стандартных адаптированных к сыворотке источников белка с намного более высоким содержанием белка/100 ккал, и обеспечивают удовлетворительный рост, несмотря на пониженное содержание белка в них. Если в качестве источника белка используется модифицированная сладкая сыворотка, то она предпочтительно дополняется свободным гистидином в количестве от 0,1% до 1,5 масс. % источника белка.
Белки могут быть интактными или гидролизованными либо могут представлять собой смесь интактных и гидролизованных белков. Может быть желательным использование частично гидролизованных белков (степень гидролиза от 2% до 20%), например, для грудных детей с предполагаемым риском развития аллергии на коровье молоко. Если требуются гидролизованные белки, то процесс гидролиза может проводиться любым желательным и известным из уровня техники методом. Например, сывороточно-белковый гидролизат может быть получен ферментативным гидролизом сывороточной фракции в одну или более стадий. Для получения экстенсивно гидролизованного белка сывороточные белки могут подвергаться тройному гидролизу с применением сначала алкалазы 2,4 л (ЕС 940459), потом нейтразы 0,5 л (может быть получена от Novo Nordisk Ferment AG) и затем панкреатина при 55°C. Альтернативно, для получения менее гидролизованного белка сыворотка может подвергаться двухступенчатому гидролизу трипсином, химотрипсином или панкреатином либо их смесями, как описано в ЕР 322589. Установлено, что, если в качестве исходного материала используется сывороточная фракция, не содержащая, в основном, лактозы, то лизин белка в этом случае будет блокироваться в намного меньшей степени в процессе гидролиза. Это обеспечит снижение степени блокировки лизина примерно с 15 масс. % общего лизина до менее 10 масс. % лизина, например, примерно до 7 масс. % лизина, что значительно улучшит питательное качество источника белка. В одном варианте осуществления изобретения MFGM-препарат подвергается такой же протеолитической обработке.
Смесь для грудных детей согласно настоящему изобретению может содержать источник углеводов. Может использоваться любой источник углеводов, традиционно присутствующий в смесях для грудных детей, такой как лактоза, сахароза, мальтодекстрин, крахмал и смеси перечисленного, хотя предпочтительным источником углеводов является лактоза. Предпочтительно источники углеводов составляют от 35% до 65% общего количества энергии в смеси.
Смесь для грудных детей согласно настоящему изобретению может содержать источник липидов, помимо липидов из MFGM-компонентов. Источник липидов может представлять собой любой липид или жир, пригодный для использования в смесях для грудных детей. Предпочтительные источники жира включают высокоолеиновое подсолнечное масло и высокоолеиновое сафлоровое масло. Могут также добавляться незаменимые жирные кислоты - линолевая и α-линоленовая кислоты, равно как и небольшие количества масел с высоким содержанием предварительно образовавшихся арахидоновой и докозагексаеновой кислот, таких как рыбий жир или микробные масла. В целом содержание жира предпочтительно является таким, какое способно обеспечивать от 30% до 55% общего количества энергии в смеси. Источник жира предпочтительно имеет отношение n-6 жирных кислот к n-3 жирным кислотам примерно от 5:1 до 15:1, например, примерно от 8:1 до 10:1.
Смесь для грудных детей может также содержать все витамины и минералы, которые считаются незаменимыми в повседневной диете, в питательно значимых количествах. Минимальные потребности в определенных витаминах и минералах регламентированы. Примеры минералов, витаминов и других нутриентов, необязательно присутствующих в смеси для грудных детей, включают витамин А, витамин В1, витамин В2, витамин В6, витамин В12, витамин Е, витамин K, витамин C, витамин D, фолиевую кислоту, инозит, ниацин, биотин, пантотеновую кислоту, холин, кальций, фосфор, йод, железо, магний, медь, цинк, марганец, хлорид, калий, натрий, селен, хром, молибден, таурин и L-карнитин. Минералы обычно добавляются в форме солей. Присутствие и количества специфических минералов и других витаминов будет варьировать в зависимости от популяции грудных детей, для которых указанная смесь предназначена.
При необходимости смесь для грудных детей может содержать эмульгаторы и стабилизаторы, такие как соевый лецитин, лимоннокислые эфиры моно- и диглицеридов и др. Это относится преимущественно к тому случаю, когда смесь приготовляется в жидкой форме.
Смесь для грудных детей может необязательно содержать другие вещества, которые способны оказывать полезное действие, такие как лактоферрин, нуклеотиды, нуклеозиды и др.
Предпочтительно смесь для грудных детей содержит также пребиотик. Подходящие пребиотики включают некоторые олигосахариды, такие как фруктоолигосахариды (FOS) и галактоолигосахариды (GOS). Может использоваться комбинация пребиотиков, состоящая из 90% GOS и 10% короткоцепочечных фруктоолигосахаридов, такая как продукт, реализуемый под торговой маркой Beneo® Р95, или 10% инулина, такая как продукт, реализуемый под торговой маркой Beneo® HP, ST или HSI.
Особенно предпочтительным пребиотиком является смесь из галактоолигосахарида(ов), N-ацетилированного олигосахарида(ов) и сиалилированного олигосахарида(ов), в которой N-ацетилированный олигосахарид(ы) составляет от 0,5% до 4,0% смеси олигосахаридов, галактоолигосахарид(ы) составляет от 92,0% до 98,5% смеси олигосахаридов и сиалилированный олигосахарид(ы) составляет от 1,0% до 4,0% смеси олигосахаридов. Эта смесь обозначается в настоящем описании как "предпочтительная пребиотическая смесь". Предпочтительно композиция для применения согласно изобретению содержит от 2,5% до 15,0 масс. % предпочтительной пребиотической смеси в пересчете на сухое вещество при условии, что композиция включает по меньшей мере 0,02 масс. % N-ацетилированного олигосахарида, по меньшей мере 2,0 масс. % галактоолигосахарида и по меньшей мере 0,04 масс. % сиалилированного олигосахарида.
Подходящие N-ацетилированные олигосахариды включают GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc. N-ацетилированные олигосахариды могут быть получены действием глюкозаминидазы и/или галактозаминидазы на N-ацетилглюкозу и/или N-ацетилгалактозу. Равным образом для этой цели могут использоваться N-ацетилгалактозилтрансферазы и/или N-ацетилгликозилтрансферазы. N-ацетилированные олигосахариды могут быть получены также технологией ферментации с использованием соответствующих ферментов (рекомбинантных или нативных ферментов) и/или микробной ферментацией. В последнем случае микроорганизмы могут либо экспрессировать вырабатываемые ими ферменты и субстраты, либо могут быть сконструированы таким образом, чтобы они могли продуцировать соответствующие субстраты и ферменты. Могут использоваться единичные культуры микроорганизмов или смешанные культуры. Образование N-ацетилированных олигосахаридов может быть инициировано акцепторными субстратами, начиная с любой степени полимеризации (DP) - с DP=1 и выше. Другой вариант - это химическая конверсия кетогексоз (напр., фруктозы) либо свободных, либо связанных с олигосахаридом (напр., лактулоза) в N-ацетилгексозамин или в N-ацетилгексозамин-содержащий олигосахарид, как описано Wrodnigg, Т.М.; Stutz, А.Е. в (1999) Angew. Chem. Int. Ed. 38: 827-828.
Подходящие галактоолигосахариды включают Galβ1,6Gal,Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc, Galβ1,3Galβ1,6Galβ1,4Glc, Galβ1,3Galβ1,3Galβ1,4Glc, Galβ1, 4Galβ1,4Glc и Galβ1,4Galβ1,4Galβ1,4Glc. Синтезированные галактоолигосахариды, такие как Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc и Galβ1,3Galβ1,6Galβ1,4Glc, Galβ1,4Galβ1,4Glc и Galβ1,4Galβ1,4Galβ1,4Glc и их смеси, реализуются на рынке под торговыми марками Vivinal® и Elix′or®. Другими поставщиками олигосахаридов являются Dextra Laboratories, Sigma-Aldrich Chemie GmbH и Kyowa Hakko Kogyo Co., Ltd. Альтернативно, для получения нейтральных олигосахаридов могут использоваться специфические гликозилтрансферазы, такие как галактозилтрансферазы.
Подходящие сиалилированные олигосахариды включают NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc. Эти сиалилированные олигосахариды могут быть выделены с помощью технологии хроматографии или фильтрации из натурального источника, такого как молоко животных. Альтернативно, они также могут быть получены биотехнологией с использованием специфических сиалилтрансфераз или технологией ферментации с применением ферментов (рекомбинантных или нативных ферментов), и/или технологией микробной ферментации. В последнем случае микроорганизмы могут либо экспрессировать вырабатываемые ими ферменты и субстраты, либо могут быть сконструированы таким образом, чтобы они могли продуцировать соответствующие субстраты и ферменты. Могут использоваться единичные культуры микроорганизмов или смешанные культуры. Образование сиалилолигосахаридов может быть инициировано акцепторными субстратами, начиная с любой степени полимеризации (DP) - с DP=1 и выше.
Смесь для грудных детей может приготовляться любым подходящим способом. Например, смесь для грудных детей может приготовляться путем смешивания в соответствующих пропорциях источника белка, источника углеводов и источника жира. На этой стадии в смесь могут вводиться эмульгаторы, если таковые используются. Витамины и минералы также могут добавляться в этот момент, но обычно они добавляются позднее во избежание их распада при нагревании. Липофильные витамины, эмульгаторы и др. могут предварительно растворяться в источнике жира перед смешиванием. Затем может подмешиваться вода, предпочтительно вода, подвергнутая обработке методом обратного осмоса, для получения жидкой смеси.
Полученная жидкая смесь может подвергаться тепловой обработке для снижения нежелательной жизнеспособной бактериальной нагрузки. Например, жидкая смесь может подвергаться кратковременной тепловой обработке при температуре примерно от 80°C до 110°C в течение примерно от 5 секунд до 5 минут. Это может осуществляться путем прямой инжекции пара или в теплообменнике, например, в пластинчатом теплообменнике.
Затем жидкая смесь может охлаждаться до температуры примерно от 60°C до 85°C, например, путем мгновенного охлаждения. После этого жидкая смесь может гомогенизироваться, например, в две стадии - при давлении примерно от 7 МПа до 40 МПа на первой стадии и примерно от 2 МПа до 14 МПа на второй стадии. Гомогенизированная смесь может охлаждаться далее для добавления в нее термочувствительных компонентов, таких как витамины и минералы. Величину pH и содержание сухих веществ в гомогенизированной смеси удобно стандартизировать именно в этот момент.
Гомогенизированная смесь подается в пригодную для этой цели сушильную установку, например, в распылительную сушилку или сублимационную сушилку и превращается в порошок. Порошок должен иметь содержание воды ниже примерно 5 масс. %.
Выбранный пробиотик(и) может культивироваться любым подходящим методом и подготовляться к добавлению в смесь для грудных детей, например, с применением сублимационной сушки или распылительной сушки. Альтернативно, бактериальные препараты могут закупаться в уже готовом виде у поставщиков-специалистов, таких как Christian Hansen и Morinaga, в пригодной для добавления в пищевые продукты, такие как смесь для грудных детей, форме.
Выбранный пробиотик может смешиваться перед сушкой с MFGM-препаратом. Эта смесь может подвергаться гомогенизации для улучшения ассоциации между MFGM и пробиотиком(ми). После сушки смесь может использоваться в качестве модуля (добавляемого в жидкую детскую смесь) либо MFGM могут подмешиваться к сухой детской смеси.
Порошок пробиотика и сухие MFGM могут смешиваться сухим способом смешивания с получением определенной смеси. Эта смесь может добавляться в готовую сухую смесь для грудных детей.
MFGM-препарат может также добавляться в процессе составления смеси перед ее гомогенизацией и пастеризацией/тепловой обработкой (от стерилизации до УВТ-обработки) при производстве жидкой смеси. После сушки может вводиться пробиотик способом сухого смешивания. MFGM-препарат может также рассматриваться как эффективный натуральный эмульгатор, что позволяет уменьшить количество эмульгаторов, традиционно используемых в смесях для грудных детей или питательных композициях. В одном варианте осуществления изобретения пробиотик и/или MFGM-препараты осторожно добавляются по отдельности или вместе в готовую для питья или в готовую для разбавления питательную композицию, такую как сухая смесь для грудных детей. Такое добавление(я) может осуществляться в ходе одной из последней стадии процесса производства/упаковки композиции или может проводиться непосредственно перед употреблением композиции тем пользователем, для которого она предназначена. В этом случае MFGM-препарат и/или препарат пробиотика могут упаковываться отдельно от сухой или жидкой питательной композиции.
Пример 1
Пример состава смеси для грудных детей согласно настоящему изобретению дается ниже (табл. 1). Этот состав приводится лишь с показательной целью.
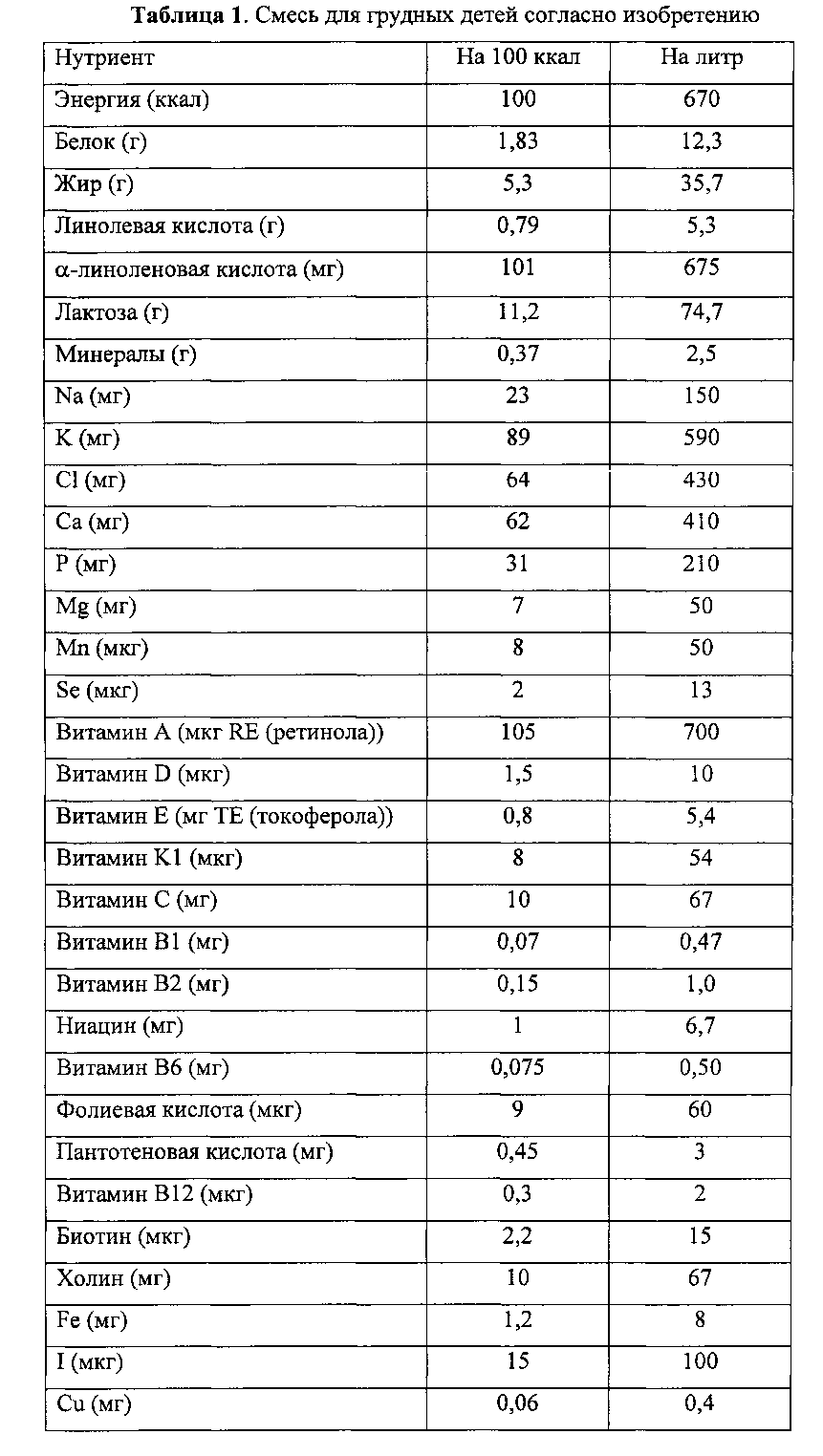

Альтернативно, в другом примере MFGM-ингредиент может использоваться в таком количестве, какое позволяет достигнуть отношения MFGM/общий белок, равного 0,5%.
Пример 2
Следующий пример представляет научные данные, раскрывающие и подтверждающие концепцию взаимодействий между пробиотиком и MFGM в молоке млекопитающих. Из них следует, что композиции, содержащие как MFGM, так и пробиотик, дают полезный эффект.
Из предшествующего уровня техники известно, что в женском молоке содержатся низкая доза микроорганизмов и набор бактериальных ДНК, которые ассоциированы с клеточным компонентом молока. Авторы изобретения выдвинули гипотезу, что бактерии в молоке могут ассоциироваться и с другими компонентами молока, помимо клеточного компонента. Например, они могут перемещаться внутрь MFGM или казеиновых мицелл. Авторы изобретения проанализировали наличие сигналов бактериальных ДНК в различных фракциях молока млекопитающих. На фиг. 1 и 2 показаны результаты гель-электрофореза с временно-температурным градиентом (TTGE). Эксперименты показали, что усиленные сигналы бактериальных ДНК обнаруживаются также в сливочной фракции молока (фиг. 1 и 2). Эти результаты подтверждают концепцию, что MFGM содержат бактериальные компоненты и/или что MFGM могут связываться с бактериями в молоке или ′укутывать′ их.
Помимо этого, авторы изобретения исследовали перемещение бактериальной нагрузки. Фиг. 3 показывает совместную локализацию бактериальных компонентов с MFGM. Авторы изобретения выдвинули гипотезу, что связывание или инкапсулирование бактерий и/или их компонентов внутрь MFGM может облегчить прохождение бактериальных компонентов через желудочно-кишечную систему. Авторы изобретения предполагают, что это может ускорить их доставку к соответствующим участкам мукозальных тканей новорожденного, вскармливаемого грудью. Совместно с другими содержащимися в MFGM факторами MFGM могут также модулировать иммунологические процессы.
Пример 3
Исследования в области протеомики MFGM женского молока как внутри, так и снаружи, позволили идентифицировать несколько белков, которые, как считается, влияют на бактериальный рост или выживаемость, вовлекаются в распознавание и/или отклик на бактерии либо их компоненты, или о которых известно, что они взаимодействуют с другими белками, проявляющими вышеперечисленные свойства. Например, Толл-подобные рецепторы (TLR) - это класс рецепторов клеточных мембран, которые распознают структурно консервативные молекулы, происходящие из микроорганизмов, и активируют иммунные ответы. Предполагается, что они играют ключевую роль во врожденной иммунной системе. MFGM содержат молекулы, которые являются корецепторами/молекулами TLR-сигнальных комплексов, а также потенциальными лигандами для этих комплексов.
Дифференциальные отклики на провоспалительные факторы наблюдались in vitro, что позволяет предположить, что MFGM и/или MFGM-фракции могут поддерживать иммунные защитные механизмы, не вызывая чрезмерно выраженных реакций (см. табл.2).

Если суммировать вышесказанное, то представляется вероятным, что доставка бактерий и/или бактериальных компонентов в присутствии MFGM может оказывать влияние на состав кишечной микробиоты. Она может также модулировать иммунные ответы в организме реципиента (хозяина) таким образом, чтобы обеспечивались толерантность к компонентам нормальной микробиоты и антигенам пищи и защита от потенциальных патогенов или сигналов опасности.
Комбинации MFGM и/или MFGM-фракций с пробиотическими организмами и/или бактериальными компонентами могут использоваться для обучения иммунной системы и обеспечения защиты от инфекций в раннем периоде жизни.
В целом, MFGM и/или MFGM-фракции, будучи ассоциированными с пробиотиками и/или пробиотическими компонентами, способны стимулировать взаимодействие пробиотиков с хозяином и модулировать заключительные процессы, вовлеченные в защитные механизмы. Авторы изобретения предполагают, что MFGM и/или MFGM-фракции в комбинации с пробиотиком и/или пробиотическими компонентами могут помочь в модуляции состава микробиоты новорожденного, поддержать иммунное развитие и вызвать эффективные защитные реакции организма (хозяина). Последние могут включать иммунные ответы на различные патогены или другую опасность, исходящую из окружающей среды. Вышесказанное может быть связано со способностью пробиотиков обеспечивать оптимальную доставку к хозяину и/или содействовать реактивности хозяина по отношению к экзогенным и эндогенным сигналам.
Пример / Экспериментальные данные 4
Взаимодействия MFGM-фракций с хозяином и потенциальное синергетическое действие с пробиотиком оценивались in vitro в системе, имитирующей слизистую кишечника (фиг. 4). Данные подтверждают полезное действие комбинации MFGM и пробиотика на защитные механизмы хозяина от инфекций и модуляцию воспалительных состояний.
Испытания системы HT29CI34 ген-репортер NFkB
Клеточная линия НТ-29 (эпителиальные клетки толстой кишки человека) экспрессирует эндогенные TLR (Толл-подобные рецепторы). TLR сигналинг активирует транскрипционный фактор NF-kB через адапторные белки - MyD88 или TRIF - и приводит к экспрессии генов, ответственных за воспаление. Клеточные линии НТ-29 были также трансфицированы репортерным конструктом таким образом, чтобы секретируемая щелочная фосфатаза (SeAP) экспрессировалась под контролем NF-kB-индуцируемого промотора. Эта трансфицированная клеточная линия (HT-29CI34) была создана в Nestlé Research Center. TLR-стимуляция этих клеток приводит к активации NF-kB и последующей секреции щелочной фосфатазы в супернатанты культур. Для оценки TLR-опосредованного воспаления использовалась система HT-29CI34 ген-репортер, в которой измерялись уровни активации NF-kB после предварительной обработки штаммом Bifidobacterium lactis NCC2818 (В. lactis) в количестве 10е6 или 10е7 КОЕ/мл и/или MFGM-препаратом до конечной концентрации 50 мкг/мл или 100 мкг/мл с последующей инкубацией с или без LPS (100 нг/мл). Активность SeAP оценивалась флуориметрическим методом и выражалась в относительных флуоресцентных единицах. Bifidobacterium lactis NCC2818 (В. lactis) выбран в качестве представителя тех видов бифидобактерий, которые играют важную роль в ранней колонизации кишечника грудного ребенка. Фиг. 5 показывает кумулятивный синергетический эффект, достигаемый за счет комбинирования MFGM с пробиотиком в этой модели. Использование только MFGM снижает реактивность эпителиальных клеток по отношению к воздействию эндотоксинов. MFGM + пробиотик (В. lactis) оказывает более сильное действие, чем MFGM или пробиотик по отдельности (фиг.5, верхняя и нижняя панели).
Анализ стимуляции В- и Т-клеток
Суспензии лимфоцитов готовили из объединенных брыжеечных и паховых лимфатических узлов, изъятых у мышей C57BL/6 в возрасте 6-8 недель. Клетки суспендировали в питательной IMDM-среде, дополненной 5×10-5 М β-меркаптоэтанола, 1 мМ глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 10% FCS (фетальная телячья сыворотка). Для стимуляции анти-CD3 (специфичных для Т-клеток) и анти-CD40 (специфичных для В-клеток) 96-луночные плоскодонные пластины покрывали 50 мкл фосфатного буфера (PBS), содержащего 2,5 мкг/мл анти-CD3 (клон: 2С11) или 5 мкг/мл анти-CD40 (клон: FGK-45), в продолжение 1-3 часов при 37°C. После экстенсивной промывки в каждую лунку добавляли серийные 3-кратные разбавления клеточных суспензий лимфоузлов. Спустя 3 суток, в каждую лунку в течение последних 18 часов перед сбором клеток добавляли по 1 мкКи (микрокюри) Н-тимидина. Затем в каждую лунку добавляли указанный штамм NCC2818 (В. lactis), полученный из стандартных культур, вместе с MFGM-препаратом при MOI (кратность заражений) 100 и/или до конечной концентрации 100 мкг/мл. Результаты анализа, полученные с проведением оптимального титрования лимфоидных клеток (111′000 клеток/лунку), представлены на фиг.6 и 7. Результаты подтверждают синергетический эффект пробиотика совместно с MFGM.
Пример 5
Взаимодействия MFGM-фракций с хозяином и потенциальный синергетический и продолжительный стойкий эффект в ассоциации с пробиотиком оценивались in vivo на мышиной модели неонатального созревания. Данные подтверждают полезное действие комбинации MFGM с пробиотиком на неспецифическую адаптивную защиту организма-хозяина от инфекций через увеличение секреторных мукозальных IgA.
Мышам - ранним отъемышам (возраст 28 дней) скармливали в течение 1 недели (А) и 4 недель (В) следующее:
Группа 1: плацебо (мальтодекстрин)
Группа 2: Bifidumbacterium lactis BL818 (108 КОЕ/день)
Группа 3: Bifidumbacterium lactis BL818 (108 КОЕ/день)+MFGM
Группа 4: MFGM.
MFGM давали ежедневно в дозе 0,6 мг/г массы тела. Ингредиенты - В. lactis и/или MFGM - вводили перорально. Животных-отъемышей использовали во избежание действия MFGM, от природы присутствующих в молоке мышей-самок.
Количества IgA-секретирующих клеток в суспензиях клеток пейеровых бляшек оценивались на 10 животных/группа с применением стандартного ELISPOT-протокола. Данные, полученные авторами изобретения (фиг. 8), показывают, что MFGM могут оказывать сильно выраженное действие на адаптивные иммунные В-клетки. В действительности, авторы изобретения наблюдали значительное увеличение количества кишечных IgA-секретирующих клеток, выделенных из пейеровых бляшек мышей, которым скармливались MFGM и/или пробиотик. Авторы изобретения с интересом наблюдали за тем, как комбинация MFGM и В. lactis значительно увеличивала количества IgA-секретирующих мукозальных В-клеток спустя 28 дней кормления и что эти количества превышали количества указанных клеток, наблюдавшиеся после скармливания указанных ингредиентов по отдельности. С еще большим интересом они наблюдали продолжительный стойкий иммунный бустерный эффект от скармливания MFGM и В. lactis. Если говорить более конкретно, то увеличение количества IgA-секретирующих мукозальных В-клеток сохранялось и фактически продолжало увеличиваться в течение 84 дней после прекращения скармливания указанных ингредиентов (на 112 день). Важно то, что эффект от комбинации пробиотика с MFGM значительно превышал эффект от скармливания этих ингредиентов по отдельности, что демонстрирует синергетическое действие скармливаемой комбинации пробиотика с MFGM.
Реферат
Предложена питательная композиция, содержащая штамм Bifidobacterium lactis CNCM I-3446 и оболочки жировых шариков молока (MFGM), в которой MFGM усиливают биологическое действие указанного штамма. Биологическое действие представляет собой стимулирование иммунного созревания, уменьшение воспаления и их сочетание. При этом питательная композиция является смесью для грудных детей, кашей для грудных детей, продуктом детского питания или оздоравливающим питательным продуктом для нуждающихся индивидов. Комбинация указанного штамма и MFGM в композиции эффективно воздействуют на защитные механизмы субъекта от инфекций и модуляцию воспалительных состояний. 11 з.п. ф-лы, 8 ил., 2 табл., 5 пр.

Комментарии