Способ окисления алюминия, катализатор окисления алюминия и наноматериал на основе оксида алюминия (варианты) - RU2692721C2
Код документа: RU2692721C2
Чертежи



Описание
Изобретение относится к неорганическим материалам на основе оксида алюминия, частицы которого имеют один из размеров менее 100 нм, (далее называемым наноразмерным оксидом алюминия), в том числе к волокнистым материалам на основе оксида алюминия с характерной толщиной волокна менее 100 нм и длиной волокна более 0,5 мкм (далее называемым наноразмерным волокнистым оксидом алюминия или нановолокнистым оксидом алюминия) или к пластинчатым материалам на основе оксида алюминия с характерной толщиной пластинки менее 100 нм и одним из линейных размеров более 0,5 мкм (далее называемым наноразмерным пластинчатым оксидом алюминия). Такие материалы могут быть использованы в качестве адсорбентов, носителей для катализаторов, в качестве наполнителей композиционных материалов или в качестве теплоизоляционного материала. Для обеспечения функциональных свойств, необходимых для их использования, поверхность наноразмерного волокнистого оксида алюминия может быть подвергнута химической или термохимической обработке, с целью создания на ней требуемых функциональных групп, например, методом, описанном в статье [Z. Guo, Т. Pereira, О. Choi, Y. Wang, Н.Т. Hahn, Surface functionalized alumina nanoparticle filled polymeric nanocomposites with enhanced mechanical properties. J. Mater. Chem. 16 (2006) 2800-2808] или другим известным методом.
По данным многих публикаций, например [А.В. Vorozhtsov, М. Lerner, N. Rodkevich, Н. Nie, A. Abraham, М. Schoenitz, E.L. Dreizin. Oxidation of nano-sized aluminum powders, Thermochimica Acta 636 (2016) 48-56], известно, что окисление металлического алюминия молекулярным кислородом при комнатной температуре ограничено образованием аморфной оксидной пленки толщиной менее 4 нм. Рост толщины оксидной пленки приводит к резкому увеличению энергии активации процесса до значений 200 кДж/моль и выше. При окислении алюминия при повышенной температуре, в том числе выше температуры плавления алюминия позволяет достичь толщины оксидной пленки до 50 нм, после чего процесс прекращается. Количество получаемого так оксида алюминия ничтожно мало и его отделение от металла затруднительно. В связи с этим, непосредственное термохимическое окисление алюминия молекулярным кислородом газовой фазы без использования дополнительных химических агентов, например, катализаторов, или физического воздействия не может быть использовано для получения наноматериалов на основе оксида алюминия.
Для получения наноразмерных оксидов алюминия предлагают использовать следующие методы: осаждение алюминия в мицеллах с использованием поверхностно-активных веществ, электрохимические методы, плазмохимические методы, методы с использованием наноструктурированных шаблонов и некоторые другие. Недостатками этих методов являются их технологическая сложность, очень низкий выход получаемого материала и, как следствие, его высокая стоимость.
В заявке на изобретение [US20130192517, С30 В9/00, 31.01 2012] описан метод синтеза монокристаллических нановолокон оксида алюминия управляемым жидкофазным окислением расплава, содержащего расплавленный алюминий. Описанный метод включает две стадии: на первой стадии проводят плавление металлического алюминия и вносят в расплав один или несколько из 26 перечисленных элементов: V, Cr, Mn, Fe, Со, Ni, Cu, Zn, Se, Si, S, Те, Се, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb или Lu в количестве от 1 ppm до 12% масс, каждый; на второй стадии проводят окисление полученного расплава в присутствии кислорода. В тексте заявки US 20130192517 указывается на желательность обеспечения на второй стадии постоянного и равномерного перемешивания расплава, в случае, если в него внесены добавки. В описании изобретения авторы отмечают управляемость процесса окисления расплава, содержащего алюминий, что, как они полагают, составляет существенное преимущество метода по сравнению с другими, требующими хорошего управления параметрами: влажностью, температурой, составом газовой фазы, - однако при этом заявляют необходимость управления содержанием кислорода в реакторе синтеза. Недостатком описанного метода является техническая сложность обеспечения управляемости процесса окисления, а также обеспечения постоянного и равномерного перемешивания расплава при сохранении невозмущенной его поверхности, на которой происходит рост нановолокон оксида алюминия. Необходимо отметить дороговизну и редкость ряда предлагаемых редкоземельных добавок, (в особенности, прометия, который в природе практически не встречается, и, к тому же, очень радиоактивен: период полураспада 17,7 лет для наиболее стабильного изотопа). Также необходимо отметить сложность предотвращения параллельного процесса окисления вносимых добавок (V, Cr, Mn, Fe, Со, Ni, Cu, Zn и других) и образования их совместных оксидов с алюминием, которые могут затруднить получение чистого продукта.
В патенте [US 8809436, C08K 3/22, 03.03.2013] заявлена композиция для покрытий, содержащая нановолокна оксида алюминия. В формуле изобретения и в описании патента близко воспроизведена заявка на патент US 20130192517 с тем отличием, что внесение хотя бы одной добавки из 26 перечисленных элементов в расплав алюминия в этом патенте является обязательным. В патенте [US 9303137, C08K 3/08, 02.03.2013] заявлен нанокомпозитный материал, усиленный нановолокнами оксида алюминия, приготовление которых осуществляется путем «управляемого жидкофазного окисления расплава». В описании патента в качестве метода получения оксида алюминия приводится процесс окисления из расплава алюминия, содержащего один или нескольких из перечисленных 26 элементов.
В патенте [US 9499673, C08K 7/02, 28.07.2013] заявлен метод получения нанокомпозитного материала, усиленного сонаправленно ориентированными предварительно диспергированными нановолокнами оксида алюминия. В описании изобретения процесс получения нановолокон оксида алюминия описывается как последовательность двух стадий: на первой стадии алюминий загружают в реактор, плавят его, вносят в расплав добавки в контролируемой кислородной среде и размешивают расплав до достижения гомогенного расплава; на второй стадии содержание кислорода в газовой фазе повышают и проводят процесс окисления алюминия до нановолокон оксида алюминия. В качестве добавок в описании изобретения указываются четыре элемента: Fe, Se, Те и Zr, в концентрации от 0,1 до 12% масс. каждая. При этом эти элементы могут вноситься как в металлическом виде, так и в виде композиций с кислородом с целью внесения кислорода в расплав на первой стадии процесса. Недостатком описанного в тексте патента метода получения нановолокон является трудность получения гомогенного расплава при внесении в жидкий алюминий вышеуказанных металлов и металлоидов, необходимость обеспечения интенсивного перемешивания расплава и сложность обеспечения гомогенности расплава в кислородсодержащей среде.
Наиболее близким к настоящему изобретению является описанный в статье [Q. Yang, Y. Deng, W. Hu, Synthesis of alumina nanofibers by a mercury-mediated method, Ceramics International 35(1) (2009) 531-535] процесс получения нановолокнистого оксида алюминия. Процесс описан следующим образом: полоску алюминия с чистотой 99.5% погружали в водный раствор 0,5 г HgCl2 в 100 мл дистиллированной воды на 5 минут, затем вынимали из раствора и выносили на воздух. Через некоторое время на поверхности полоски алюминия, смоченной раствором хлорида ртути (II), можно было наблюдать белый порошок оксида алюминия. Выращенный продукт был подвергнут термообработке при 850°С в течение 2 часов. В результате авторы получали нановолокна оксида алюминия, что было подтверждено методом электронной микроскопии. Авторы пришли к выводу, что на этапе, предваряющем окисление алюминия, сулема взаимодействует с алюминием с восстановлением ртути до металлического состояния и с образованием пленки металлической ртути. Процесс окисления алюминия протекает через промежуточное растворение алюминия в ртути с образованием соответствующей амальгамы. Металлическая ртуть не вступает в химическое взаимодействие с алюминием и в данном случае играет роль среды, обеспечивающей контакт металлического алюминия с газофазным молекулярным кислородом. Недостатком цитируемого метода является необходимость использования хлорида ртути, классифицируемого стандартом NPFA 704 как класс 4 (смертельно токсичный). Этот же недостаток можно отнести и к описанному еще в 1972 году [M.R. Pinnel, J.E. Bennet. Voluminous oxidation of aluminium by continuous dissolution in a wetting mercury film. J. Mater. Sci., 7 (1972) 1016-1026] методу получения волокнистого (размер волокон в статье не определяли) оксида алюминия путем окисления алюминия через смачивающую его поверхность пленку металлической ртути, токсичность которой по стандартам NPFA 704 относится к классу 3 (очень токсичный). Общей чертой этих методов и способа, описываемого настоящим изобретением, является наличие жидкой пленки, смачивающей поверхность алюминия, и отделяющей поверхность фазы металлического алюминия от непосредственного контакта с молекулярным кислородом.
Настоящее изобретение предлагает способ окисления алюминия, который осуществляют в присутствии жидкофазного катализатора окисления алюминия, содержащего оксид теллура и/или оксид висмута, при температуре выше 660 и ниже 1400°С.
При этом катализатор находится в контакте с жидкой фазой, содержащей металлический алюминий, газовой фазой, содержащей молекулярный кислород, и фазой оксида алюминия (продукта реакции).
Помимо оксида теллура и/или оксида висмута катализатор может дополнительно содержать по меньшей мере, один оксид металла из ряда: оксид бора, оксид натрия, оксид алюминия, оксид цинка, оксид галлия, оксид германия, оксид ниобия, оксид бария.
Предлагаемый многофазный каталитический процесс позволяет окислять металлический алюминий молекулярным кислородом с образованием наноразмерного оксида алюминия. Для осуществления данного процесса необходимо, чтобы в реакционный объем поместили жидкую фазу (I), содержащую металлический алюминий, жидкую фазу (II), содержащую катализатор окисления алюминия, не смешивающуюся с алюминий-содержащей жидкой фазой (I), смачивающую фазу (I) и формирующую пленку на поверхности фазы (I), и сквозь реакционный объем над поверхностью жидкой фазы (И) пропустили поток газовой фазы, содержащей кислород. Фазой (I) может являться расплав алюминия или расплав, содержащий алюминий и другие элементы, при условии, что эти элементы не препятствуют окислению алюминия и образованию наноразмерного оксида алюминия. Жидкая фаза (II) - это катализатор окисления алюминия или расплав, содержащий катализатор окисления алюминия и другие вещества, при условии, что эти вещества не препятствуют окислению алюминия и образованию наноразмерного оксида алюминия. Предпочтительным является, чтобы при реализации данного способа был полностью исключен прямой контакт фазы (I) и газовой фазы, содержащей молекулярный кислород, то есть, чтобы жидкая фаза (II), содержащая катализатор, полностью покрывала поверхность фазы (I), содержащей алюминий. В качестве катализатора окисления алюминия может быть использован оксид металла или металлоида с электроотрицательностью по Полингу более, чем 1.8, способный вступать в промежуточное взаимодействие с металлическим алюминием, обладающим электроотрицательностью по Полингу 1.61, и окислять его до оксида алюминия:
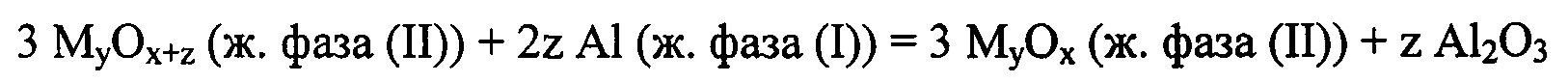
где х, у и z - целые числа, зависящие от химической природы используемого в качестве катализатора оксида.
Восстановленная форма катализатора вступает во взаимодействие с молекулярным кислородом, замыкая каталитический цикл:
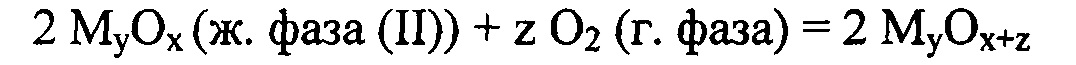
Представленные выше реакции приведены в целях иллюстрации и не обязательно отражают механизм каталитического процесса. В каталитическом цикле могут участвовать как высшие, так и низшие оксиды, а также соединения, не содержащие кислород. Не исключено, что при использовании в качестве катализаторов оксида металлоида, окисление алюминия может протекать через промежуточное образование соединений AlxMy, например, халькогенидов алюминия, в частности теллурида алюминия.
Для предлагаемого способа существенно важным является, чтобы катализатор окисления алюминия находился в жидкой фазе, что обеспечивает возможность взаимодействия окисленной формы катализатора с алюминием, восстановленной формы катализатора с кислородом и быстрый массоперенос внутри фазы катализатора. Поэтому предпочтительно, чтобы катализатор окисления алюминия являлся оксидом металла или металлоида, температура плавления достаточно низка для практического использования метода, например, ниже 1200°С, предпочтительно ниже 1000°С и, лучше всего, если температура плавления этого оксида ниже 800°С. С другой стороны, предпочтительно, чтобы катализатор окисления алюминия являлся оксидом металла или металлоида, температура кипения/сублимации которого выше 1000°С; предпочтительно, выше 1200°С, предпочтительно выше 1600°С. Предпочтительно также, чтобы вязкость катализатора окисления алюминия не превышала 1000 сПз, так как высокая вязкость ограничивает диффузионную подвижность молекул оксида в расплаве и ограничивает скорость массопереноса в жидкой фазе (II). В целях обеспечения оптимального сочетания физико-химических, теплофизических, гидродинамических и каталитических свойств, катализатор может представлять собой расплав нескольких оксидов, как проявляющих собственную каталитическую активность в процессе окисления алюминия, так и неактивных. В том числе, катализатор может представлять собой эвтектическую смесь двух оксидов, хотя бы один из которых проявляет каталитическую активность в процессе окисления алюминия.
В результате взаимодействия алюминия с кислородом, протекающего при участии катализатора, образуется фаза кристаллического оксида алюминия, все или значительная часть частиц которого имеют хотя бы один линейный размер менее 100 нм. В некоторых условиях частицы оксида алюминия имеют волокнистую морфологию с характерной толщиной волокон от 7 до 40 нм и длиной более 0,5 мкм, что позволяет характеризовать их как наноразмерные волокна или нановолокна, а получаемый материал - как нановолокнистый оксид алюминия. Длина волокон определяется временем проведения процесса и может достигать нескольких сантиметров.
В других условиях частицы оксида алюминия имеют волокнистую морфологию с характерной толщиной волокон от 7 до 20 нм и длиной более 0,5 мкм, что позволяет характеризовать их как наноразмерные волокна или нановолокна, а получаемый материал - как нановолокнистый оксид алюминия. Длина волокон определяется временем проведения процесса и может достигать нескольких сантиметров.
В других условиях частицы оксида алюминия имеют морфологию пластин с характерной толщиной пластин от 10 до 50 нм и одним из линейных размеров более 0,5 мкм, что позволяет характеризовать их как наноразмерные пластины, а получаемый материал - как наноразмерный пластинчатый оксид алюминия.
Также при некоторых условиях возможно получение наночастиц оксида алюминия с морфологией весла.
Текстура нановолокнистого оксида алюминия зависит от состава используемого катализатора и от условий проведения процесса. При соблюдении некоторых условий, нановолокна в получаемом материале могут в большинстве своем быть прямыми и сонаправлены в направлении перпендикулярном поверхности фазы (I). В некоторых условиях материал может содержать извилистые нановолокна, преимущественно сонаправленные и переплетенные между собой. В других условиях материал может состоять из волокон с текстурой в форме щетки, составленной из радиально направленных от оси волокна нановолокон, или волокон со сложной иерархической текстурой, имеющих предпочтительную ориентацию в направлении, перпендикулярном поверхности фазы (I). В других условиях материал может содержать смесь нановолокон и наноразмерных пластин неправильной формы с толщиной от 10 до 50 нм.
Предлагаемый способ может быть осуществлен в широком диапазоне температур, давлений и парциального давления кислорода в газовой фазе, удовлетворяющих условию одновременного существования жидкой фазы (I) и жидкой фазы (II), например, выше 660°С и ниже 1400°С. В случае использования жидких фаз сложного состава, температурный диапазон сосуществования двух жидких фаз, необходимых для осуществления процесса, может быть расширен за счет более низкой температуры их кристаллизации или, в случае стеклующегося расплава катализатора, - стеклования.
Способом допускается значительный локальный разогрев и обусловленный им градиент температур, как следствие протекания экзотермической реакции окисления алюминия на границе раздела жидких фаз (I) и (II). Предпочтительным, однако, является, чтобы локальная температура на границе раздела фаз (I) и (II) была значительно ниже температуры кипения катализатора, чтобы снизить испарение катализатора и унос его потоком газовой фазы. Предпочтительно, чтобы температуры в реакторе находились в диапазоне между 730 и 1200°С, а оптимальным с точки зрения практического осуществления процесса является реализация в реакционном объеме поля температур в диапазоне от 800 до 1000°С. Для управления температурой могут применяться стандартные методы (теплообменники, размещенные в жидкой фазе (I)), а также локальный разогрев может быть снижен путем уменьшения скорости химической реакции, например, за счет понижения парциального давления кислорода в газовой фазе.
В предлагаемом способе управление морфологией и текстурой получаемого наноразмерного оксида алюминия и скоростью процесса можно осуществлять выбором состава фаз (I) и (II), а в ходе проведения процесса - варьированием температуры процесса, парциальным давлением кислорода в газовой фазе и толщиной слоя (пленки) фазы (II), содержащей катализатор окисления алюминия. Толщина слоя фазы (II), покрывающего поверхность фазы (I), может составлять от 100 нм до 3 миллиметров. В зависимости от толщины слоя фазы (II), возможно получение наноразмерного оксида алюминия различной морфологии и текстуры.
Один из вариантов предлагаемого способа предусматривает периодическое варьирование одного или нескольких параметров, управляющих морфологией и текстурой оксида алюминия, во время осуществления процесса: температуры, парциального давления кислорода или толщины слоя фазы (II). В том числе толщину фазы (II) можно варьировать возбуждением колебаний (волн) на поверхности фазы (I), содержащей металлический алюминий. В условиях проведения процесса верхняя поверхность фазы (II) ограничена слоем образовавшегося продукта и колебания (волны) нижней ее поверхности, разделяющей фазу (I) и фазу (II), обусловливают колебания толщины слоя фазы (II) в диапазоне от менее чем 20 мкм до более чем 30 мкм. При проведении процесса в таком нестационарном режиме возможно получения частиц с морфологией, меняющейся по длине частицы от волокна до пластины, называемой для удобства «формой весла», как иллюстрирует один из приведенных ниже Примеров.
В ходе проведения процесса окисления активный компонент катализатора медленно испаряется. Кроме того, часть катализатора может удаляться с поверхности жидкой фазы (I) при извлечении продукта - наноразмерного оксида алюминия. Это приводит к уменьшению толщины слоя жидкой фазы (II), покрывающей поверхность фазы (I), и к изменению морфологии образующегося наноразмерного оксида алюминия. В связи с этим, один из вариантов предлагаемого способа предусматривает повторное или многократное добавление катализатора окисления алюминия в жидкую фазу (II), содержащую катализатор окисления алюминия. После каждого добавления катализатора окисления алюминия, толщина слоя жидкой фазы (II) увеличивается пропорционально количеству добавленного катализатора, что позволяет поддерживать ее в требуемом для получения продукта желаемой морфологии диапазоне.
Преимуществом предлагаемого способа по сравнению с известными ранее является его относительная простота и возможность получения больших количеств наноразмерного оксида алюминия выбранной морфологии без использования высокотоксичных материалов и химических соединений.
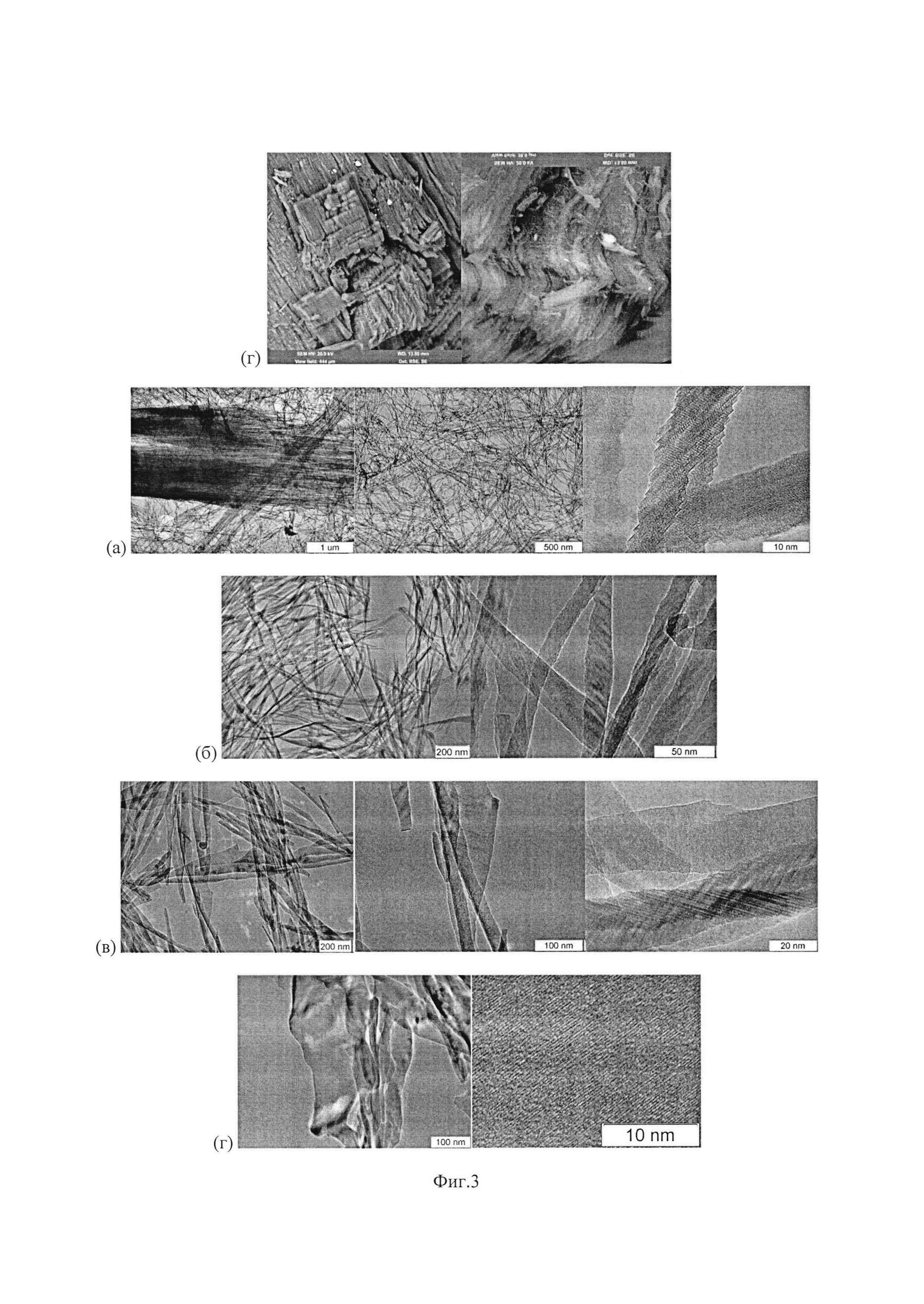
Изобретение иллюстрируется следующими рисунками: Фиг. 1 иллюстрирует внешний вид нановолокнистого оксида алюминия. На Фиг. 1б стандартная канцелярская скрепка (28 мм) приведена для указания масштаба Фиг. 2 иллюстрирует морфологию, определенную метод сканирующей электронной микроскопии, оксида алюминия, получаемого способу, описанному в Примерах 1-4. Фиг 3 иллюстрирует морфологию, определенную методом просвечивающей электронной микроскопиии, оксида алюминия, получаемого по способу, описанному в Примерах 2-5. Фиг. 4 иллюстрирует морфологию, определенную метод сканирующей электронной микроскопии, оксида алюминия, получаемого способу, описанному в Примерах 5-9.
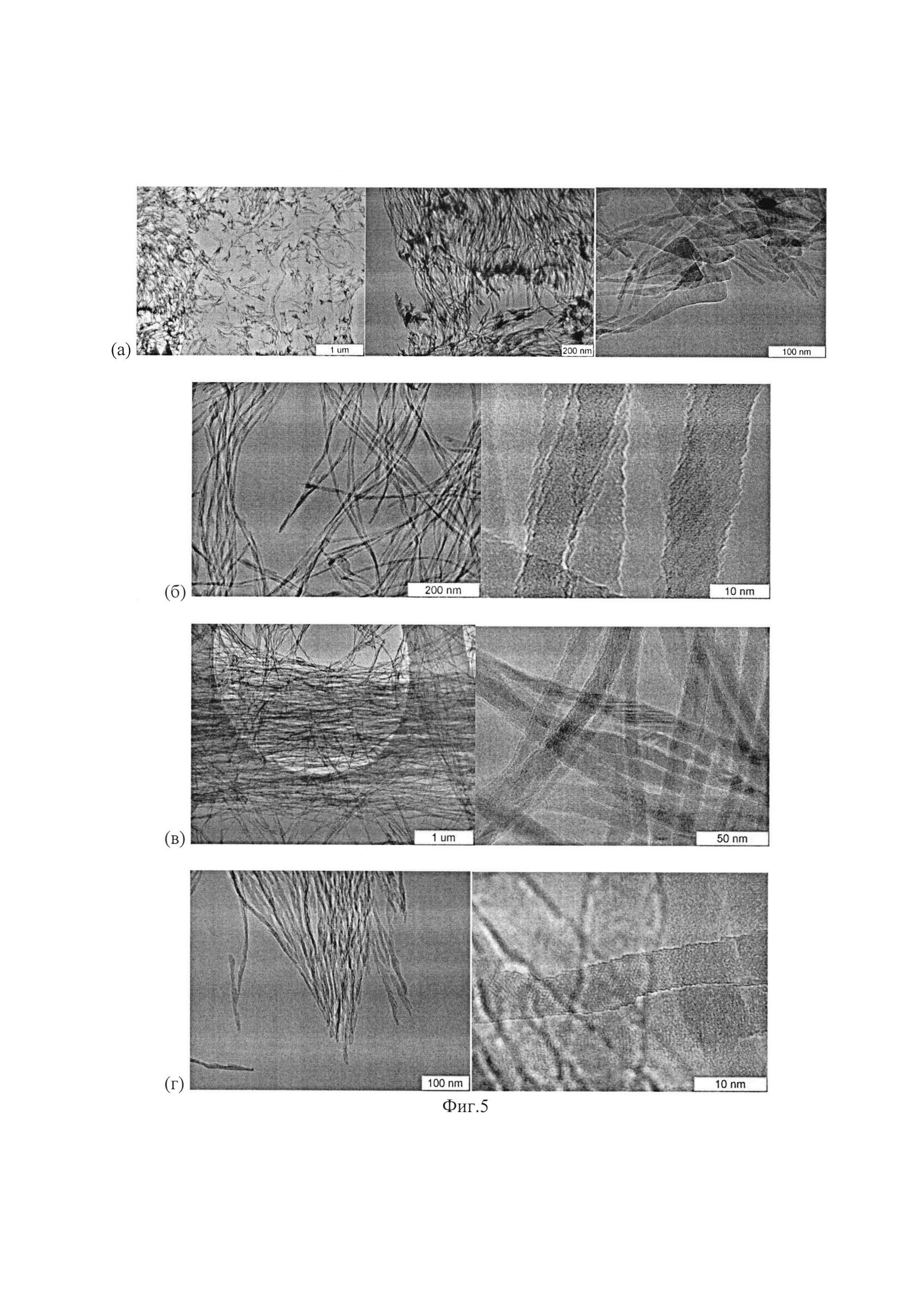
Фиг. 5 иллюстрирует морфологию, определенную методом просвечивающей электронной микроскопии, оксида алюминия, получаемого по способу, описанному в Примерах 6-9
Также изобретение иллюстрируют приведенные ниже примеры.
Пример 1.
Металлический алюминий в количестве 320 г поместили в керамический тигель диаметром 100 мм, нагрели до 850°С в муфельной печи в атмосфере инертного газа (аргона) и механически (при помощи стального шпателя) удалили оксидную пленку с поверхности расплава. В качестве катализатора использовали оксид висмута, Bi2O3, т.е. оксид металла с электроотрицательностью по Полингу 2.02, температурой плавления 817°С и температурой кипения 1790°С. На поверхность расплава поместили порошок катализатора, представляющего собой оксид висмута, Bi2O3, в количестве 10 г и в объем муфельной печи направили поток синтетического воздуха (смеси азота и кислорода в соотношении 4:1), нагретого до 850°С. Оксид висмута расплавился и образовал на поверхности металла «лужицы», удерживаемые силой поверхностного натяжения на поверхности расплава алюминия, при этом вся поверхность алюминия оказалась смоченной пленкой оксида висмута, что хорошо определялось визуально из-за темного цвета расплава оксида висмута. Оценка средней толщины пленки, исходя из плотности расплава оксида висмута составляет порядка 0,15 мм. После этого в тигле присутствовали две жидких фазы: жидкая фаза металлического алюминия (I) и жидкая фаза (II), представляющая собой оксид висмута. В течение 2 часов на поверхности наблюдается процесс образования и нарастания неровного твердого слоя, смоченного расплавом оксида висмута, толщина которого по прошествии 2 часов составила около 1 мм. Слой образовавшегося материала в механически отделили от непрореагировавшего расплава алюминия, охладили и исследовали. Микроанализ методом энергодисперсионной спектроскопии (ЭДС) показал, что этот слой состоит из оксида висмута (области 1 и 4 на Фиг. 2а) и оксида алюминия (области 2 и 3 на Фиг. 2а). По данным сканирующей электронной микроскопии (Фиг. 2а), материал содержит хорошо ограненные кристаллы оксида алюминия в форме тригональных пирамид и гексагональных пирамид и бипирамид (темные области на микрографии), характерных для корунда, α-Al2O3. Размер кристаллов оксида алюминия составляет от 20 нм до 3 мкм, с значительной (более 5%) долей частиц с размером менее 100 нм. В связи с этим данный материал необходимо описать, как наноматериал. Необходимо отметить, что окисление алюминия в присутствии и при участии жидкофазного катализатора, оксида висмута, не приводит к образованию аморфной оксидной пленки толщиной 20-50 нм, препятствующей дальнейшему окислению алюминия, как это происходит в ходе окисления алюминия без катализатора. Напротив, при проведении процесса с жидкофазным катализатором, оксидом висмута, возможно получение монокристаллов оксида алюминия, значительная часть которых имеет размер менее 100 нм.
Пример 2.
Металлический алюминий в количестве 306 г поместили в керамический тигель диаметром 100 мм, нагрели до 750°С в муфельной печи в атмосфере инертного газа (аргона) и механически (при помощи стального шпателя) удалили оксидную пленку с поверхности расплава. В качестве катализатора использовали оксид теллура, ТеО2, т.е. оксид металлоида с электроотрицательностью по Полингу 2.10, температурой плавления 732°С и температурой кипения 1245°С. На поверхность расплава помещали порошок катализатора, в количестве 3 г, повысили температуру муфеля до 800°С и повторно сняли шлак с поверхности зеркала. После этого в тигле находились две жидких фазы: жидкая фаза металлического алюминия (I) и жидкая фаза (II), полностью покрывающая поверхность жидкой фазы (I). Оценка толщины слоя фазы (И) составляет около 60 мкм. Присутствие пленки жидкой фазы (II) оксида теллура хорошо визуально определяется из-за характерного красного цвета его расплава. В объем муфельной печи направили поток синтетического воздуха (смеси азота и кислорода в соотношении 4:1) и в течение 2 часов провели процесс окисления алюминия, в результате которого на верхней поверхности жидких фаз образовался толстый (толщиной 44 мм) слой белого пористого материала, массой 32 г. Температура расплава, определенная термопарой, в ходе окисления алюминия составляла 830°С. Слой образовавшегося материала механически отделили от непрореагировавшего расплава алюминия, охладили и исследовали. Фотография материала представлена на Фиг. 1. На внешней (верхней) поверхности материал имеет белый цвет, внутренняя область материала опалесцирует голубоватым цветом. Внешняя (нижняя поверхность) покрыта пленкой застеклованного катализатора, с толщиной пленки около 10 мкм. Материал легко механически разделяется на волокна в направлении, перпендикулярном его внешней поверхности. По данным химического анализа материал представляет собой оксид алюминия Al2O3. По данным сканирующей (Фиг. 2б) и просвечивающей электронной микроскопии (Фиг. а) материал содержит пучки нановолокон, разделяющихся на индивидуальные волокна при диспергировании в изопропаноле ультразвуком (диспергирование проводили в ходе подготовки образца к исследованию методом ПЭМ). Толщина волокон варьируется в диапазоне от 6 до 20 нм.
Длина волокон превышает 0,5 мкм. Таким образом, полученный материал может быть охарактеризован, как нановолокнистый оксид алюминия.
Еще через 1,5 часа после удаления описанного выше материала в результате окисления алюминия в тех же условиях на верхней поверхности жидких фаз образовался толстый (толщиной 25 мм) слой белого пористого материала, массой 25 г. Визуально, по данным химического анализа и по данным электронной микроскопии вторая порция образовавшегося материала не отличается от первой.
Пример 3.
Металлический алюминий в количестве 251 г поместили в керамический тигель диаметром 100 мм, нагрели до 780°С в муфельной печи в атмосфере инертного газа (аргона) и механически (при помощи стального шпателя) удалили оксидную пленку с поверхности расплава. В качестве катализатора использовали оксид теллура, ТеО2, т.е. оксид металлоида с электроотрицательностью по Полингу 2.10, температурой плавления 732°С и температурой кипения 1245°С. На поверхность расплава помещали порошок катализатора, в количестве 3 г, повысили температуру муфеля до 830°С и повторно сняли шлак с поверхности зеркала. После этого в тигле находились две жидких фазы: жидкая фаза металлического алюминия (I) и жидкая фаза (II), полностью покрывающая поверхность жидкой фазы (I). Оценка толщины слоя фазы (II) составляет около 60 мкм. Присутствие пленки жидкой фазы (II) оксида теллура хорошо визуально определяется из-за характерного красного цвета его расплава. В объем муфельной печи направили поток 95 л/ч воздуха, и в течение 50 минут провели процесс окисления алюминия, в результате которого на верхней поверхности жидких фаз образовался толстый (толщиной 7 мм) слой белого пористого материала, массой 13,4 г. В ходе процесса температура расплава, определенная термопарой, составляла 890°С. Слой образовавшегося материала механически отделили от непрореагировавшего расплава алюминия, охладили и исследовали. На внешней (верхней) поверхности материал имеет белый цвет, внутренняя область материала опалесцирует голубоватым цветом. Материал легко механически разделяется на волокна в направлении, перпендикулярном его внешней поверхности. По данным химического анализа материал представляет собой оксид алюминия Al2O3. По данным сканирующей (Фиг. 2в) и просвечивающей электронной микроскопии (Фиг. 3б) материал содержит пучки нановолокон, разделяющихся на индивидуальные волокна при диспергировании в изопропаноле ультразвуком (диспергирование проводили в ходе подготовки образца к исследованию методом ПЭМ). Толщина волокон варьируется в диапазоне от 10 до 25 нм. Длина волокон превышает 0,5 мкм. Таким образом, полученный материал может быть охарактеризован, как нановолокнистый оксид алюминия.
Пример 4.
Металлический алюминий в количестве 220 г поместили в керамический тигель диаметром 100 мм, нагрели до 780°С в муфельной печи в атмосфере инертного газа (аргона) и механически (при помощи стального шпателя) удалили оксидную пленку с поверхности расплава. В качестве катализатора использовали оксид теллура, ТеО2, т.е. оксид металлоида с электроотрицательностью по Полингу 2.10, температурой плавления 732°С и температурой кипения 1245°С. На поверхность расплава помещали порошок катализатора, в количестве 3 г, повысили температуру муфеля до 850°С и повторно сняли шлак с поверхности зеркала. После этого в тигле находились две жидких фазы: жидкая фаза металлического алюминия (I) и жидкая фаза (II), полностью покрывающая поверхность жидкой фазы (I). Оценка толщины слоя фазы (II) составляет около 60 мкм. Присутствие пленки жидкой фазы (II) оксида теллура хорошо визуально определяется из-за характерного красного цвета его расплава. В объем муфельной печи направили поток 95 л/ч воздуха и в течение 35 минут провели процесс окисления алюминия, в результате которого на верхней поверхности жидких фаз образовался слой белого пористого материала толщиной 3,5 мм, массой 11,8 г. В ходе процесса температура расплава, определенная термопарой, составляла 910°С. Слой образовавшегося материала механически отделили от непрореагировавшего расплава алюминия, охладили и исследовали. Материал имеет белый цвет.По данным элементного анализа материал представляет собой оксид алюминия Al2O3. По данным сканирующей (Фиг. 2г) и просвечивающей электронной микроскопии (Фиг. 3в) материал содержит нановолокона и нанопластинки. Толщина волокон варьируется в диапазоне от 15 до 40 нм. Длина волокон превышает 0,5 мкм. Толщина пластинок не превышает 50 нм, ширина отдельных пластинок превышает 1 мкм. Таким образом, полученный материал может быть охарактеризован, как наноразмерный оксид алюминия со смешанной морфологией (нановолокна и нанопластинки).
Пример 5.
Металлический алюминий в количестве 465 г поместили в керамический тигель диаметром 120 мм, нагрели до 780°С в муфельной печи в атмосфере инертного газа (аргона) и механически (при помощи стального шпателя) удалили оксидную пленку с поверхности расплава. В качестве катализатора использовали оксид теллура, ТеО2, т.е. оксид металлоида с электроотрицательностью по Полингу 2.10, температурой плавления 732°С и температурой кипения 1245°С. На поверхность расплава помещали порошок катализатора, в количестве 1 г, повысили температуру муфеля до 810°С и повторно сняли шлак с поверхности зеркала. После этого в тигле находились две жидких фазы: жидкая фаза металлического алюминия (I) и жидкая фаза (II), полностью покрывающая поверхность жидкой фазы (I). Оценка толщины слоя фазы (II) составляет около 10 мкм. Такая относительно тонкая пленка жидкой фазы (II) оксида теллура наблюдается визуально как желто-бурый налет на поверхности зеркала. В объем муфельной печи направили поток 65 л/ч воздуха и в течение 2 часов провели процесс окисления алюминия, в результате которого на верхней поверхности жидких фаз образовался слой белого пористого материала толщиной 2,5 мм, массой 12,5 г. В ходе процесса температура расплава, определенная термопарой, составляла 840°С. Слой образовавшегося материала механически отделили от непрореагировавшего расплава алюминия, охладили и исследовали. Материал представляет собой плотную хрупкую корку белого цвета. По данным химического анализа материал представляет собой оксид алюминия Al2O3. По данным сканирующей (Фиг. 4а) и просвечивающей электронной микроскопии (Фиг. 3г) материал содержит преимущественно нанопластинки. Толщина пластинок не превышает 50 нм, ширина отдельных пластинок превышает 1 мкм. Таким образом, полученный материал может быть охарактеризован, как наноразмерный оксид с морфологией нанопластинок.
Пример 6.
Металлический алюминий в количестве 255 г поместили в керамический тигель диаметром 100 мм, нагрели до 780°С в муфельной печи в атмосфере инертного газа (аргона) и механически (при помощи стального шпателя) удалили оксидную пленку с поверхности расплава. В качестве катализатора использовали оксид теллура, ТеО2, т.е. оксид металлоида с электроотрицательностью по Полингу 2.10, температурой плавления 732°С и температурой кипения 1245°С. На поверхность расплава помещали порошок катализатора, в количестве 1 г, повысили температуру муфеля до 810°С и повторно сняли шлак с поверхности зеркала. После этого в тигле находились две жидких фазы: жидкая фаза металлического алюминия (I) и жидкая фаза (II), полностью покрывающая поверхность жидкой фазы (I). Оценка исходной толщины слоя фазы (И) составляет около 60 мкм. Присутствие пленки жидкой фазы (II) оксида теллура хорошо визуально определяется из-за характерного красного цвета его расплава. В объем муфельной печи направили поток 65 л/ч воздуха. К муфельной печи приложили вибрацию частотой 5 Гц с целью создать периодическое изменение толщины слоя фазы (II). В этих условиях в течение 4 часов провели процесс окисления алюминия, в результате чего на верхней поверхности жидких фаз образовался слой белого пористого материала толщиной 35 мм, массой 36 г. В ходе процесса температура расплава, определенная термопарой, составляла 840°С. Слой образовавшегося материала механически отделили от непрореагировавшего расплава алюминия, охладили и исследовали. По данным химического анализа материал представляет собой оксид алюминия Al2O3. По данным сканирующей (Фиг. 4б) микроскопии материал представляет собой волокнистый оксид с регулярным чередованием плотности в направлении, перпендикулярном направлению волокон, с периодом около 0,5 мкм, что соответствует частоте 5 Гц изменения толщины слоя фазы (II). По данными просвечивающей электронной микроскопии (Фиг. 5а) материал содержит наноразмерные частицы оксида алюминия сложной формы, которую можно сравнить с формой листа гинко билоба или с формой весла. Диаметр «черенка весла» составляет от 7 до 15 нм. Толщина пластины «лопасти нановесла» не превышает 20 нм, ширина пластины в наиболее широком месте достигает 70 нм. Таким образом, полученный материал может быть охарактеризован, как наноразмерный оксид с морфологией в форме «нановесел».
Пример 7.
Металлический алюминий в количестве 162 г поместили в керамический тигель диаметром 45 мм, нагрели до 700°С в муфельной печи в атмосфере инертного газа (аргона) и механически (при помощи стального шпателя) удалили оксидную пленку с поверхности расплава. В качестве катализатора использовали предварительно измельченную в планетарной мельнице смесь оксид теллура, TeO2 и оксида бора (элемента с атомным номером 5), В2О3 в массовом соотношении TeO2:В2О3=7, которое близко к эвтектическому составу с температурой плавления 680°С. На поверхность расплава помещали порошок катализатора, в количестве 1.7 г, повысили температуру муфеля до 820°С и повторно сняли шлак с поверхности зеркала. После этого в тигле находились две жидких фазы: жидкая фаза металлического алюминия (I) и жидкая фаза (II), полностью покрывающая поверхность жидкой фазы (I). Оценка толщины слоя фазы (II) составляет около 1.5 мм. Присутствие желто-оранжевого слоя жидкой фазы (II) хорошо визуально определяется. В объем муфельной печи направили поток 15 л/ч воздуха и в течение 1 часа провели процесс окисления алюминия, в результате которого на верхней поверхности жидких фаз образовался толстый (толщиной 9 мм) слой белого пористого материала, массой 6,2 г. В ходе процесса температура расплава, определенная термопарой, составляла 840°С. Слой образовавшегося материала механически отделили от непрореагировавшего расплава алюминия, охладили и исследовали. Материал имеет синеватый белый цвет, нижняя (входившая в контакт с жидкой фазой (II)) поверхность покрыта слоем застеклованного катализатора толщиной около 0.5 мм. Материал легко механически разделяется на волокна в направлении, перпендикулярном его внешней поверхности. По данным химического анализа материал представляет собой оксид алюминия Al2O3. По данным сканирующей (Фиг. 4в) и просвечивающей электронной микроскопии (Фиг. 5б) материал содержит макроволокона со сложной текстурой, которую можно охарактеризовать как щетку из нановолокон, радиально направленных от оси волокна, разделяющихся на индивидуальные нановолокна при диспергировании в изопропаноле ультразвуком (диспергирование проводили в ходе подготовки образца к исследованию методом ПЭМ). Толщина нановолокон варьируется в диапазоне от 7 до 15 нм. Длина нановолокон превышает 0,5 мкм. Таким образом, полученный материал может быть охарактеризован, как нановолокнистый оксид алюминия.
Пример 8.
Металлический алюминий в количестве 162 г поместили в керамический тигель диаметром 45 мм, нагрели до 700°С в муфельной печи в атмосфере инертного газа (аргона) и механически (при помощи стального шпателя) удалили оксидную пленку с поверхности расплава. В качестве катализатора использовали предварительно измельченную в планетарной мельнице смесь оксид теллура, TeO2 и оксида алюминия (элемента с атомным номером 13), Al2O3 в массовом соотношении TeO2:AlO3=6.5, которое близко к эвтектическому составу с температурой плавления 630°С. На поверхность расплава помещали порошок катализатора, в количестве 1 г, повысили температуру муфеля до 820°С и повторно сняли шлак с поверхности зеркала. После этого в тигле находились две жидких фазы: жидкая фаза металлического алюминия (I) и жидкая фаза (II), полностью покрывающая поверхность жидкой фазы (I). Оценка толщины слоя фазы (II) составляет около 1 мм. Присутствие розового слоя жидкой фазы (II) оксида теллура хорошо визуально определяется. В объем муфельной печи направили поток 50 л/ч воздуха и в течение 1 часа провели процесс окисления алюминия, в результате которого на верхней поверхности жидких фаз образовался толстый (толщиной 15 мм) слой белого пористого материала, массой 10,5 г. В ходе процесса температура расплава, определенная термопарой, составляла 830°С. Слой образовавшегося материала механически отделили от непрореагировавшего расплава алюминия, охладили и исследовали. Материал имеет белый цвет, дымчатый в области толщиной 3-5 мм от поверхности контакта с жидкой фазой (II). Материал легко механически разделяется на волокна в направлении, перпендикулярном его внешней поверхности. По данным химического анализа материал представляет собой оксид алюминия Al2O3. По данным сканирующей (Фиг. 4г) и просвечивающей электронной микроскопии (Фиг. 5в) материал имеет сложную иерархическую текстуру, в том числе содержит пучки волокон, состоящие из последовательных слоев с текстурой в виде щетки из нановолокон, разделяющихся на индивидуальные нановолокна при диспергировании в изопропаноле ультразвуком (диспергирование проводили в ходе подготовки образца к исследованию методом ПЭМ). Кристаллические нановолокна, полученные в данном примере, покрыты тонким слоем (2-5 нм) аморфного оксида алюминия. Толщина волокон варьируется в диапазоне от 7 до 15 нм. Длина волокон превышает 0,5 мкм. Таким образом, полученный материал может быть охарактеризован, как нановолокнистый оксид алюминия.
Пример 9
Металлический алюминий в количестве 162 г поместили в керамический тигель диаметром 45 мм, нагрели до 680°С в муфельной печи в атмосфере инертного газа (аргона) и механически (при помощи стального шпателя) удалили оксидную пленку с поверхности расплава. В качестве катализатора использовали предварительно измельченную в планетарной мельнице смесь оксид теллура, TeO2 и оксида висмута (элемента с атомным номером 83), Bi2O3 в массовом соотношении ТеО2:Bi2O3=2.4, которое близко к эвтектическому составу с температурой плавления 580°С. На поверхность расплава помещали порошок катализатора, в количестве 1.3 г, повысили температуру муфеля до 820°С и повторно сняли шлак с поверхности зеркала. После этого в тигле находились две жидких фазы: жидкая фаза металлического алюминия (I) и жидкая фаза (II), полностью покрывающая поверхность жидкой фазы (I). Оценка толщины слоя фазы (II) составляет около 1 мм. Присутствие темного слоя жидкой фазы (II) хорошо определяется визуально. В объем муфельной печи направили поток 10 л/ч воздуха и в течение 1 часа провели процесс окисления алюминия, в результате которого на верхней поверхности жидких фаз образовался толстый (толщиной 8 мм) слой белого пористого материала, массой 4,2 г. В ходе процесса температура расплава, определенная термопарой, составляла 845°С. Слой образовавшегося материала механически отделили от непрореагировавшего расплава алюминия, охладили и исследовали. Материал имеет белый цвет, переходящий в бежевый в области толщиной 3-5 мм от поверхности контакта с жидкой фазой (II). Материал легко механически разделяется на волокна в направлении, перпендикулярном его внешней поверхности. По данным химического анализа материал представляет собой оксид алюминия Al2O3 с примесью катализатора. По данным сканирующей (Фиг. 4д) и просвечивающей электронной микроскопии (Фиг. 5г) материал содержит макроволокона со сложной текстурой, которую можно охарактеризовать как щетку из нановолокон, радиально направленных от оси волокна, разделяющихся на индивидуальные нановолокна при диспергировании в изопропаноле ультразвуком (диспергирование проводили в ходе подготовки образца к исследованию методом ПЭМ). Толщина волокон варьируется в диапазоне от 7 до 15 нм. Длина волокон превышает 0,5 мкм. Таким образом, полученный материал может быть охарактеризован, как нановолокнистый оксид алюминия.
Реферат
Изобретение может быть использовано при получении адсорбентов, носителей для катализаторов, наполнителей композиционных материалов, теплоизоляционных материалов. Способ получения наноразмерного оксида алюминия включает стадию окисления алюминия в присутствии жидкофазного катализатора, содержащего оксид теллура и/или оксид висмута. Окисление алюминия осуществляют при температуре выше 660°С и ниже 1400°С при одновременном сосуществовании в реакторе газовой фазы, содержащей кислород, жидкой фазы (I), содержащей алюминий, и жидкой фазы (II), содержащей катализатор окисления алюминия. При этом жидкая фаза (II) не смешивается с алюминийсодержащей жидкой фазой (I) и образует пленку на ее поверхности. Изобретение позволяет упростить получение большого количества наноразмерного оксида алюминия выбранной морфологии без использования высокотоксичных материалов и химических соединений. 6 н. и 13 з.п. ф-лы, 5 ил., 9 пр.

Комментарии