Способ получения фторангидридов кислот из хлорангидридов кислот - RU2230731C2
Код документа: RU2230731C2
Описание
Настоящее изобретение относится к способу получения фторангидридов кислот из хлорангидридов кислот при контактировании с фтористоводородными аддуктами гидрофторидов азотистых оснований.
Фторангидриды кислот, например фторангидриды карбоновых кислот и сульфурилфторид, представляют интерес в качестве продуктов, которые могут использоваться как таковые либо как промежуточные продукты. Так, например, сульфурилфторид может применяться в качестве десинсекционного средства (фумиганта) против вредителей, например, в деревянных строениях, в церквях, музеях, силосных башнях и зданиях, а также против вызывающих изменение окраски ферментов, против грибов и возбудителей болезней в еще не использованной, например, свежезаготовленной древесине. Фторангидриды карбоновых кислот являются ценными промежуточными продуктами в химическом синтезе.
Из сульфурилхлоридфторида по соответствующей реакции можно получать сульфурилфторид.
В заявке DE-OS 2823969 описано получение фторкарбонильных соединений из хлоркарбонильных соединений, например хлордифторацетилфторида из хлордифторацетилхлорида и НF-аддуктов гидрофторидов органических азотистых оснований в качестве фторирующих агентов. При использовании НF-аддуктов к HF-связи добавляют амин или же используют растворители, обладающие достаточной основностью по отношению к HF-связи.
R. Franz в Journ. Fluorine Chem. 15, стр. 423-434 (1980) указывает на возможность использования уже известных трисгидрофторидов третичных аминов в качестве фторирующих агентов при нуклеофильном замещении атомов хлора и брома. Таким путем можно получать, например, дифторфосген, оксалилфторид, цианурфторид и тетрафторид серы.
В основу настоящего изобретения была положена задача разработать более совершенный способ фторирования, предназначенный для получения фторангидридов кислот из хлорангидридов кислот. Указанная задача решается с помощью предлагаемого в изобретении способа.
Согласно изобретению получают сульфурилфторид, сульфурилхлоридфторид или фторангидриды карбоновых кислот общей формулы (I):
RC(O)F, (I)
где R обозначает С1-С7алкил; замещенный по меньшей мере одним атомом хлора и/или замещенный по меньшей мере одним атомом фтора С1-С7алкил, путем контактирования хлорангидридов кислот и фтористоводородных аддуктов гидрофторида аммония либо гидрофторидов органических азотистых оснований без добавления HF-связывающего основания или HF-связывающего растворителя, при этом
а) фтористоводородный аддукт служит в качестве фторирующего реагента и не подвергается дегидрофторированию вне стадии гидрофторида аммония или гидрофторида органического азотистого основания или
б) используют по меньшей мере 1 моль HF на моль заменяемого атома хлора, а фтористоводородные аддукты служат катализатором обменной реакции между хлорангидридами кислот и HF, или
в) фтористоводородные аддукты регенерируют с целью удалить присутствующий НСl.
При этом, в отличие от уровня техники, работают таким образом, что исключается необходимость в добавлении основания, связывающего HF. Не добавляют также никакого HF-связывающего растворителя. Если же, как это предусматривается согласно описанному ниже варианту выполнения, добавляют кислоту, такую, например, как трифторуксусная кислота, то эту кислоту либо часть этой кислоты можно нейтрализовать за счет основания, вводя его в требуемом количестве до, во время или после добавления указанной кислоты. Но и в этом случае не происходит связывания HF.
Для осуществления контактирования помимо HF-аддуктов фторида аммония могут использоваться указанные в упомянутой заявке DE-OS 2823969 НF-аддукты гидрофторидов органических азотистых оснований, которые можно представить следующей формулой: B·(HF)х, где В представляет собой органическое азотистое основание, а x обозначает целое или дробное число от >1 до 4, предпочтительно от 2 до 3.
В качестве органических азотистых оснований В могут использоваться все возможные первичные, вторичные и/или третичные амины, включая N-гетероциклы. Если представить эти амины в виде формулы R1R2R3N, то расшифровать ее можно следующим образом:
R1 обозначает алкильный радикал предпочтительно с 1-10, прежде всего с 1-6 С-атомами, циклоалкильный радикал предпочтительно с 5-7 С-атомами, аралкильный радикал предпочтительно с 6-10 С-атомами или арильный радикал предпочтительно также с 6-10 С-атомами;
R2 и R3 обозначают водород, алкильные, циклоалкильные, аралкильные и арильные радикалы того же типа, что и указанные для R1.
Радикалы R2 и R3 могут быть идентичными или разными. Два из радикалов R1 и R2 либо R3 могут образовывать также замкнутое циклоалифатическое кольцо, которое необязательно может быть разорвано еще другими гетероатомами, например атомами кислорода. Возможен и иной вариант, в котором все три радикала R1 , R2 и R3 являются звеном гетероциклического кольца, благодаря чему в таких случаях образуются соответствующие N-гетероциклы. Предпочтительными органическими азотистыми основаниями являются первичные, вторичные и/или третичные амины, содержащие в общей сложности вплоть до 12 С-атомов, при этом особенно предпочтительны вторичные и/или третичные алифатические амины.
Конкретно в качестве примеров оснований В можно назвать: N-бутиламин, N-дециламин, диэтиламин, ди-н-октиламин, триметиламин, триэтиламин, три-н-пропиламин, изопропилдиэтиламин, три-н-бутиламин, циклогексиламин, N-метиланилин, N,N-диметиланилин, пирролидин, пиперидин, N-метилпиперидин, морфолин, пиридин, хинолин и т.д.
HF-аддукты гидрофторидов азотистых оснований В можно простым путем получать из оснований В и фтористого водорода; они представляют собой низкоплавкие или жидкие при комнатной температуре вещества, способные выдерживать значительную термическую нагрузку. Трисгидрофториды можно подвергать даже вакуумной перегонке без опасности их разложения.
Предпочтительно применять HF-аддукты гидрофторидов первичных, вторичных или третичных аминов, содержащих вплоть до 15 С-атомов, прежде всего гидрофториды вторичных и третичных аминов. Наиболее пригодными являются HF-аддукты гидрофторида три-н-пропиламина, гидрофторида триизопропиламина, гидрофторида три-н-бутиламина, гидрофторида пиридина, гидрофторида пиперидина или гидрофторида N,N-диметиламина.
Реакцию осуществляют в жидкой фазе.
Предлагаемый в изобретении способ можно осуществлять в периодическом или непрерывном режиме. При работе в непрерывном режиме наряду с фторируемым хлорангидридом кислоты можно вводить также HF, свежий НF-аддукт или же и тот и другой. В соответствии с этим затем проводят разделение реакционной смеси или отгоняют газообразные продукты реакции либо выводят их в газообразном виде.
При создании изобретения было установлено, что в ходе реакции концентрация НС1 в реакционной смеси повышается. Если периодически или непрерывно не вводить дополнительно HF, то содержание последнего в реакционной смеси, соответственно в HF-аддукте снижается. Было установлено, что HF-аддукт удается регенерировать путем обработки гидрофторидом при необходимости при повышенной температуре (в интервале от 80 до 120°С) и повышенном давлении (например, при самопроизвольно устанавливающемся давлении в автоклаве). При этом согласно опытным данным отпадает необходимость в полном удалении присутствующего НСl. Вполне приемлемо его остаточное содержание, например менее 5 мас.%, предпочтительно менее 2 мас.%.
Согласно одному из вариантов выполнения изобретения сульфурилфторид получают в виде фторангидрида кислоты из сульфурилхлорида или диоксида серы и хлора (в последнем случае под давлением с целью сжижения). В этом случае для высвобождения НСl добавляют соответствующую кислоту, например галогенированную карбоновую кислоту, такую как трифторуксусная кислота. С целью (частично) нейтрализовать эту добавленную кислоту можно добавлять азотистое основание. При этом целесообразно, чтобы такое основание соответствовало основанию, содержащемуся в гидрофториде.
Сульфурилфторид можно получать также из сульфурилхлорфторида, каковой процесс может проводиться в две стадии. Первая стадия включает получение сульфурилхлоридфторида из сульфурилхлорида. Соотношение между амином (соответственно NH3) и HF в реакционной смеси на этой стадии строго не регламентировано; эффективность реакции не нарушается и при очень высоком содержании HF, например при соотношении амин:НF от 1:3 до 1:10 или даже выше. При проведении второй стадии - фторировании сульфурилхлоридфторида до сульфурилфторида - предусматривается более определенное соотношение между амином и HF, а именно более 1:3, например от 1:2 до 1:3. Это условие касательно максимального содержания HF в реакционной смеси справедливо также в тех случаях, когда требуется достичь высокого выхода SO2F2 и при одностадийном процессе получения SO2F2 из SO2Cl2. Предполагается, что при соотношении амин:НF менее 1:3 происходит изменение реакционной способности (нуклеофильности) аниона F- .
Двухстадийный механизм получения сульфурилфторида позволяет использовать особый вариант предлагаемого способа. Как было установлено, во время фторирования SO2Cl2 до SO2ClF одновременно реализуется возможность регенерировать HF-аддукт (о чем уже говорилось выше). Согласно указанному варианту в реактор совместно загружают SO2Cl2(причем SO2Cl2 и SO2/Cl2 являются взаимозаменяемыми, см., например, патент US 4003984), избыток HF и регенерируемый HF-аддукт. При повышенном давлении (например, при самопроизвольно устанавливающемся в автоклаве давлении) одновременно образуются SO2ClF и регенерированный HF-аддукт. Образующийся газообразный НСl отделяют (например, за счет сброса избыточного давления и пропускания инертного газа, такого как N2 ). Затем с целью поддержать содержание HF в указанных выше пределах (амин:НF>1:3) избыточный HF выпаривают. После этого можно приступить к проведению второй стадии получения собственно SO2F2. При проведении первой и второй стадий в одном и том же реакторе обеспечивается тем самым возможность непосредственного перехода ко второй стадии, уже располагая рефторированным HF-аддуктом.
Согласно другому варианту осуществления способа получают фторангидриды карбоновых кислот формулы (I):
RC(O)F,
где R обозначает С1 -С7алкил; замещенный по меньшей мере одним атомом хлора и/или замещенный по меньшей мере одним атомом фтора С1-С7алкил. Особенно предпочтительными значениями R являются С1-С3алкил либо замещенный по меньшей мере одним атомом хлора и/или по меньшей мере одним атомом фтора C1-С3алкил. Наиболее предпочтительно R обозначает СН3, С2Н5, СF3, CF2Cl, CFCl2, ССl3, CHF2, С2F5 или С3F7. Кроме того, R может представлять собой ароматические радикалы, такие как фенил или толил.
Замещение хлором-фтором согласно настоящему изобретению предпочтительно осуществлять при температуре в интервале от температуры окружающей среды (порядка 20°С) до 150°С. Если на каждый аддукт хлорангидрида кислоты предусматривается замещение одним Cl-атомом, то молярное соотношение между HF-аддуктом гидрофторида, в пересчете на содержащееся в нем основание, и хлорангидридом кислоты составляет предпочтительно от 1:0,01 до 1:1 (в этом случае соотношение 1 моль R3N·2,6НF/1 моль хлорангидрида кислоты равно 1:1). При замещении из расчета на одну молекулу несколькими атомами хлора гидрофторид целесообразно применять в двойном, тройном и т.д. количестве. При работе в непрерывном режиме вышеуказанное соотношение может составлять от 1:0,01 до 1:100.
В ходе реакции по получению фторангидридов карбоновых кислот может происходить спонтанное высвобождение хлористого водорода. Этот хлористый водород можно отводить из реактора, например, с помощью отрегулированного соответствующим образом предохранительного клапана для сброса избыточного давления. При получении SO2F2 с целью высвобождения НСl необходимо добавлять соответствующую кислоту, например трифторуксусную кислоту. При проведении опытов было установлено, что добавлять, например, трифторуксусную кислоту во многих случаях целесообразно сразу же в начале реакции фторирования, поскольку таким образом удается предотвратить или снизить выпадение в осадок твердых веществ (которые впоследствии снова растворяются). Так, в частности, достаточны добавки кислоты в количестве 10 мол.% в пересчете на 100 мол.% рассчитанного ониевого HF-аддукта.
Было далее установлено, что с помощью аммониевых солей с тремя С1- или С2алкильными радикалами без проблем удается высвобождать образующийся НСl, но, поскольку эти соли проявляют тенденцию к образованию твердых веществ, предпочтительно добавлять, как указывалось выше, например, трифторуксусную кислоту. Ониевые соли с С3алкильными радикалами или с таковыми с более длинной цепью хотя и не отверждаются, тем не менее высвобождать из них НСl не так легко, как из замещенных ониевых солей с более короткой цепью. В подобных случаях особенно целесообразны добавки кислоты, поскольку благодаря этому удается эффективнее удалять НСl.
Согласно одному из вариантов гидрофторидный аддукт выполняет роль фторирующего реагента. В этом случае его применяют в таком количестве, чтобы предотвратить насколько возможно его дегидрофторирование, не минуя в результате стадию ониевого моногидрофторида. Если применять, например, аддукт формулы R3N·2, 6НF, то необходимо предусмотреть лишь такой расход HF, который обеспечит наличие в реакционной смеси R3N·zHF при z=l или z>l. Образование соответствующего гидрохлорида можно предотвратить, если избежать при этом в течение предельно возможного по длительности промежутка времени регенерирования под давлением с использованием HF. При таком подходе достаточно добавлять только HF.
Если, например, в том или ином соединении предусматривается замена атома хлора на атом фтора, то на 1,6 моля исходного соединения применяют по меньшей мере 1 моль аддукта R3N·2,6НF. При применении иных эдуктов (например, SO2Cl2) или ониевых солей с другим содержанием HF следует соответственно адаптировать и стехиометрию реакции.
Согласно еще одному варианту гидрофторидный аддукт выполняет функцию катализатора. В этих случаях в качестве фторирующего реагента в реакцию дополнительно вводят определенное количество HF. Это количество HF составляет в рассматриваемом варианте предпочтительно по меньшей мере 1 моль HF на заменяемый атом хлора. Если предусматривается получение SO2F2 из SO2Cl2 или SO2FCl, то соотношение между суммарным количеством свободного и связанного в аддукте HF и заменяемым атомом хлора может варьироваться, например, в пределах порядка от 1:1 до 1:3. Если же HF выполняет роль растворителя, то при получении фторангидридов карбоновых кислот или SO2FCl указанное соотношение может быть еще выше. Вместе с тем можно применять и менее 1 моля HF на заменяемый атом хлора; в этих случаях используют HF, содержащийся в обладающем каталитической активностью HF-аддукте, однако при этом снижается выход требуемого продукта.
В отличие от известных способов гидрофторид аммиака соответственно органического азотистого основания действует в рассматриваемом варианте не в качестве фторирующего реагента и сокомпонента реакции, а в качестве катализатора, что дает возможность тем самым работать в непрерывном режиме. Высвобождающийся хлористый водород при необходимости можно непрерывно отводить из реакционной системы либо удалять при регенерировании. При этом отпадает необходимость в использовании растворителя.
Таким образом, преимущество способа согласно изобретению состоит в том, что существенно удается упростить переработку, избежать образование гидрохлорида амина в качестве побочного продукта и исключить необходимость отделять от раствора.
Еще одним объектом изобретения
является композиция, обладающая фторирующим действием.
Получить ее можно путем смешения НF-аддуктов формулы B1-mHF и соответствующей кислоты. Эффективность этой композиции проявляется таким
образом, что при получении SO2F2
под ее действием из реакционной смеси высвобождается НСl. При необходимости можно добавлять еще и основание В1 в количестве, меньшем
по сравнению с количеством, необходимым для
нейтрализации кислоты. В1 обозначает NH3 или основание В из числа вышеуказанных, m обозначает 1
Ниже изобретение более подробно поясняется на примерах, которые никоим образом не ограничивают его объем. В примерах 1-6 поясняется применение НF-аддуктов в качестве фторирующих реагентов (предположительно автокаталитического действия), в примерах 7-8 поясняется их применение в качестве катализатора.
Пример 1
Получение хлордифторацетилфторида (ХДФАФ) из хлордифторацетилхлорида (ХДФАХ) с использованием комплекса трибутиламин·2,6НF
ClF2C-COCl+(СН3-СН2-СН2-СН2)3N·2,6HF→СlF2С-СОF+НСl
Смесь
0,90 моля хлордифторацетилхлорида (ХДФАХ) 134,0 г
0,56 моля комплекса трибутиламин·2,6НF 133,5 г
0,50 моля хлордифторуксусной кислоты 74,5 г
Оборудование и технология
В трехгорлую колбу объемом 250 мл, снабженную обратным холодильником, датчиком температур и капельной воронкой, предварительно загружали трибутиламин·2,6НF. В обратный холодильник подавали охлажденный пропусканием через криомат до -20°С рассол. За обратным холодильником размещался счетчик пузырьков, на основании показаний которого определяли выделение газообразных продуктов. С целью улавливания продуктов реакции за обратным холодильником был подсоединен стальной цилиндр объемом 300 мл с погружной трубкой, термостатированный в сосуде Дьюара с СО2/метанолом до -78°С.
При комнатной температуре медленно и при интенсивном перемешивании в раствор добавляли по каплям ХДФАХ. Реакция была слабо экзотермической, температура при этом не превышала 31°С. Сразу же после начала добавления наблюдалось газовыделение. По истечении 15 мин отбирали первую пробу после выхода из холодильника. В ходе реакции отбирали несколько таких проб, и анализ примерно двух третей стехиометрии показал также наличие в потоке отходящего газа НСl. По истечении 1 ч температуру криомата устанавливали на уровне -30°С, поскольку ХДФАХ выделялся в чрезмерно большом количестве. По окончании процесса добавления ХДФАХ’а перемешивание продолжали до завершения газовыделения (по показаниям счетчика пузырьков). Затем с целью окончательного и полного удаления продуктов реакции температуру в водяной бане поддерживали на уровне 50°С до того момента, пока показания счетчика пузырьков не подтверждали завершение указанного процесса удаления продуктов реакции. И затем для полного удаления НСl добавляли еще ХДФА.
Анализ результатов
В начале реакции пробы газа показывали, что содержание в нем хлордифторацетилфторида составляет 91%, а в количестве 7% содержится увлеченный потоком хлордифторацетилхлорид (проценты, отнесенные к единице площади, определение согласно ГХ), при отсутствии на этом этапе НСl. После добавления по каплям ХДФАХ’а в суммарном количестве 0,6 моля начиналось также высвобождение из реакционного раствора образующегося НСl, что подтверждала ГХ-МС. В стальном цилиндре находилась смесь из 91,7% ХДФАФ и 6,9% увлеченного из реакции ХДФАХ наряду с 1,4% НСl (вследствие слишком низкой для HCl-конденсации температуры образовавшийся НСl в стальном цилиндре не конденсировался). Выход выделенных ХДФАФ и ХДФАХ составлял 89,5% от теории.
Примеры получения SO2F2 из SO2Cl2 с использованием комплексов трибутиламин·2,6НF и трибутиламин·ТФУК·2,6НF
SO2Cl2+2(СН3-СН2-СН2-СН2)3N·2,6НF+ТФУК→SO2F2+2НСl
Пример 2
Дополнительное добавление ТФУК с целью высвобождения НСl
Смесь
0,30 моля сульфурилхлорида (SO2 Cl2) 40,5 г
0,375 моля комплекса трибутиламин·2,6НF 71,2 г
0,375 моля трифторуксусной кислоты 42,8 г
Описанные в данном примере оборудование и технологию использовали также во всех последующих примерах.
В трехгорлую колбу объемом 250 мл, снабженную обратным холодильником, датчиком температур и капельной воронкой, предварительно загружали трибутиламиновый комплекс. В обратный холодильник подавали охлажденный пропусканием через криомат до -30°С рассол. По показаниям размещенного за обратным холодильником счетчика пузырьков определяли выделение проходящих через этот холодильник продуктов реакции. С целью улавливания реакционных продуктов за холодильником был подсоединен стальной цилиндр объемом примерно 300 мл с погружной трубкой и выпускным отверстием для газов, термостатированный в сосуде Дьюара с СО2/метанолом до -78°С.
При комнатной температуре медленно и при интенсивном перемешивании в раствор добавляли по каплям SO2Cl2. Реакция была слабоэкзотермической. Вскоре после начала добавления наблюдалось газовыделение. ГХ-анализ газа после выхода из обратного холодильника показал, что он включает 85,6% SO2F2 и 14,3% SO2FCl при отсутствии НСl. В начале реакции окраска раствора в колбе изменилась, став более темной, однако по истечении некоторого времени раствор снова стал светлым, почти бесцветным. Поскольку на этот момент в отходящем газе не было обнаружено присутствие НСl (необходимого при использовании для каталитического фторирования), по завершении газовыделения из реакционного раствора (наблюдение с помощью счетчика пузырьков) осторожно добавляли по каплям трифторуксусную кислоту, после чего сразу же начиналось высвобождение НСl, а также дополнительных количеств SO2F2. С целью обеспечить удаление продуктов реакции и более эффективное протекание реакции температуру раствора поддерживали на уровне 50°С до того момента, пока показания счетчика пузырьков не подтверждали, что процесс газовыделения завершен. Выход выделенных продуктов в цилиндре вследствие недостаточного охлаждения составлял лишь 48%.
Пример 3
Опыт с использованием ТФУК/NBu3 в соотношении 1:1/Немедленное применение Bu3 N/HF/TOУK в качестве каталитической смеси
Смесь
0,23 моля SО2Cl2 31,7 г
0,20 моля комплекса трибутиламин·2,6НF 47,5 г
0,123 моля трибутиламина 22,8 г
0,323 моля трифторуксусной кислоты 36,8 г
Оборудование и технология
Аналогично примеру 2.
Получение фторирующей композиции
Из HF-аддукта трибутиламина и трибутиламина приготавливали смесь, после чего медленно добавляли по каплям трифторуксусную кислоту.
Проведение фторирования
Медленно добавляли по каплям SO2Cl2. В отходящем газе сразу же обнаруживали НСl, а также SO2F2 и SO2 FCl.
Пример 4
Опыт с использованием NBu3/TФУK в соотношении 1:0,1
Смесь
0,35 моля SO2Cl2 47,2 г
0,30 моля комплекса трибутиламин·2,6НF 71,2 г
0,03 моля трибутиламина 5,6 г
0,03 моля трифторуксусной кислоты 3,4 г
Оборудование и технология
Аналогично примеру 3.
При первом добавлении по каплям SO2Cl2 отходящий газ имел следующий состав: 73,4% SO2F2 и 25, 1% SO2FCl при отсутствии вначале НСl. По истечении некоторого промежутка времени состав газа изменился в пользу сульфурилфторида, достигнув 97,2% SO2F2, тогда как количество SO2FCl снизилось до 2,0%, кроме того, было обнаружено 0,3% НСl. Баланс по массе не определяли.
Пример 5
Опыт с использованием NBu3/ТФУК в соотношении 1:0,23
Смесь
0,35 моля SO2Cl2 47,2 г
0,30 моля комплекса трибутиламин·2,6НF 71,2 г
0,09 моля трибутиламина 16,7 г
0,09 моля трифторуксусной кислоты 10,34 г
Оборудование и технология
Аналогично примеру 3.
В этом эксперименте в целях определения баланса по массе используемый стальной цилиндр охлаждали жидким азотом.
В начале добавления по каплям SO2Cl2 отходящий газ имел следующий состав: 85,1% SO2F2 и 14,8% SO2FCl, а также 0,6% НСl. Конденсированная в стальном цилиндре смесь содержала в своем составе 82% SO2F2 и 18% SO2FCl, a также следы НСl и SO2. Это соответствует теоретическому выходу 90,3% в пересчете на выделенные количества SO2F2 и SO2FCl.
Пример 6
Получение трифторацетилфторида (ТФАФ) из трифторацетилхлорида (ТФАХ) с использованием комплекса трибутиламин·2,6НF в качестве катализатора
Смесь
104,2 г комплекса трибутиламин·2, 6НF 0,44 моля
151,0 г трифторацетилхлорида 1,14 моля
Оборудование и технология
В многогорлую колбу объемом 250 мл, снабженную мешалкой в виде рыбьего хвоста, датчиком температур и холодильником (t=50°C) в виде насадки, а также счетчиком пузырьков на выходе, предварительно загружали трибутиламин·2,6НF и при перемешивании при комнатной температуре подавали ТФАХ. Реакция была слабоэкзотермической (tмакс 32°С). При этом наблюдалось спонтанное газовыделение. В ходе реакции окраска раствора изменялась от светло-коричневой до несколько более темной. По завершении опыта в зоне днища наблюдались следы коррозии на стекле. Проба отходящего газа, взятая после выхода из счетчика пузырьков, содержала 88,3% ТФАФ, а также ТФАХ и НСl. Баланс по массе не определяли.
Примеры 7 и 8
Опыты по применению комплекса NBu3·2,6HF в качестве катализатора фторирования
Пример 7
Непрерывный способ с использованием комплекса трибутиламин·6НF (без ТФУК) в качестве катализатора
Смесь
0,74 моля сульфурилхлорида (SO2Cl2) 100,00 г
0,40 моля комплекса трибутиламин·2,6НF 94,9 г
0,46 моля 1,1,1,3,3-пентафторбутана (S365mfc) 68,3 г
1,48 моля HF 29,6 г
Оборудование и технология (использовавшиеся в нижеследующем примере)
В промывную ПФА-склянку объемом 250 мл предварительно загружали S365mfc и сульфурилхлорид и охлаждали льдом. Затем осторожно при перемешивании подавали HF. В трехгорлую колбу объемом 250 мл, снабженную обратным холодильником, датчиком температур и капельной воронкой, предварительно помещали трибутиламиновый комплекс. В обратный холодильник подавали охлажденный пропусканием через криомат до -30°C рассол. При комнатной температуре медленно и при интенсивном перемешивании смесь из HF/S365/SO2Cl2 по каплям добавляли к маслянистому светло-коричневому раствору. Реакция носила слабоэкзотермический характер (Δt=22 К). Внутренняя температура поднималась до температуры кипения соединения S365mfc (41°С). Это соединение с помощью конденсатора удерживали в реакционной колбе. Вскоре после начала добавления по каплям указанной выше смеси наблюдалось газовыделение, при этом наряду с НСl происходило высвобождение SO2F2 и преимущественно SO2FCl. Баланс по массе не определяли.
Пример 8
Непрерывный способ с использованием комплекса трибутиламин·2,6НF с ТФУК в качестве катализатора
Смесь
0,80 моля сульфурилхлорида (SO2Cl2) 107,98 г
0,20 моля комплекса трибутиламин·2,6НF 47,74 г
1,60 моля HF 32,0 г
0,77 моля S365mfc 113,3 г
0,02 моля трибутиламина 3,7 г
0,02 моля трифторуксусной кислоты 2,3 г
Оборудование и технология
См. выше.
Вскоре после начала добавления по каплям наблюдалось газовыделение, при этом наряду с НСl высвобождались SO2F2 и преимущественно SO2FCl. Соединение S365mfc с помощью конденсатора практически полностью удерживали в реакционной колбе. Высвобождение НС1 происходило несколько раньше, чем в предыдущем опыте. Баланс по массе не определяли.
Пример 9
Использование NЕt3·2,6НF в качестве катализатора фторирования при получении SO2F2
NЕt3·2,6НF+SO2Cl2 → SO2F2
Смесь

Технология
В трехгорлую колбу со стеклянным холодильником (t~0°C) и с подсоединенным счетчиком пузырьков предварительно загружали триэтиламин·2,6НF и при перемешивании при комнатной температуре добавляли по каплям SO2Cl2. В начале добавления SO2Cl2состав отходящего газа после выхода из холодильника включал 63% SO2F2 и 37% SO2 FCl. К концу реакции содержание SO2F2 снизилось до 56%. Баланс по массе не определяли.
Пример 10
Получение SO2FCl из SO2 Cl2 с использованием комплекса трибутиламин·4,5НF
SO2Cl2+(СН3-СН2-СН2-СН2)3N·4, 5НF→SO2FCl+НСl
Смесь
0,24 моля сульфурилхлорида (SO2Cl2) 47,2 г
0,24 моля комплекса трибутиламин·4,5НF 68,4 г
Оборудование и технология
В трехгорлую колбу объемом 250 мл, снабженную обратным холодильником со счетчиком пузырьков, датчиком температур и капельной воронкой, предварительно помещали трибутиламин. В обратный холодильник подавали охлажденный пропусканием через криомат до приблизительно 0°С рассол. При комнатной температуре медленно и при интенсивном перемешивании по каплям добавляли SO2Cl2 к маслянистому светло-коричневому раствору. Реакция носила слабоэкзотермический характер (Δt=10 К). Вскоре после начала добавления SO2Cl2 наблюдалось газовыделение. В целях контроля за протеканием реакции в процессе указанного добавления по каплям из потока отходящего газа после его выхода из счетчика пузырьков отбирали ГХ-пробы. В начале добавления SO2Cl2 состав отходящего газа включал 55,2% НСl и 42,07% SO2FCl, кроме того, был обнаружен и SO2. По завершении процесса добавления SO2Cl2 состав отходящего газа оставался практически идентичным. Баланс по массе не определяли.
Пример 11
Получение ацетилфторида из ацетилхлорида с использованием комплекса триэтиламин·2,6НF в качестве катализатора
Смесь
61,3 г комплекса триэтиламин·2,6НF 0,40 моля
50,2 г ацетилхлорида 0,64 моля
Оборудование и технология
В трехгорлую колбу объемом 250 мл, снабженную обратным холодильником, датчиком температур и капельной воронкой, предварительно загружали триэтиламиновый комплекс. В обратный холодильник подавали охлажденный пропусканием через криомат до -15°С рассол. При комнатной температуре медленно и при интенсивном перемешивании по каплям добавляли ацетилхлорид к маслянистому светло-коричневому раствору. Реакция носила слабоэкзотермический характер, и газовыделение происходило спонтанно. По завершении процесса добавления ацетилхлорида с целью обеспечить большую эффективность реакции и удалить возможно нерастворившийся ацетилфторид раствор в течение еще 1 ч нагревали до 80°С.
Анализ результатов
В начале добавления ацетилхлорида состав отходящего газа включал 10,98% НСl, 80,97% ацетилфторида, 6,59% непрореагировавшего ацетилхлорида и 1,46% уксусной кислоты (предположительно образовавшейся в результате наличия в цилиндре, из которого отбирали пробы, влаги; данные указаны соответственно в % на основе ГХ-анализа). По завершении процесса добавления состав отходящего газа включал 9,57% НСl, 27,53% ацетилфторида, 58,01% непрореагировавшего ацетилхлорида и 4,89% уксусной кислоты.
Пример 12
Получение ацетилфторида из ацетилхлорида с использованием комплекса трибутиламин·4,0НF в качестве катализатора
Смесь
79,6 г комплекса трибутиламин·4,0НF 0, 30 моля
70,7 г ацетилхлорида 0,90 моля
Оборудование и технология
В трехгорлую колбу объемом 250 мл, снабженную обратным холодильником (и счетчиком пузырьков), датчиком температур и капельной воронкой, предварительно помещали трибутиламиновый комплекс. В обратный холодильник подавали охлажденный пропусканием через криомат до -15°С рассол. При комнатной температуре медленно и при интенсивном перемешивании по каплям добавляли ацетилхлорид к маслянистому светло-коричневому раствору.
Реакция носила слабоэкзотермический характер, и газовыделение происходило спонтанно. По завершении процесса добавления с целью повысить эффективность реакции и удалить возможно нерастворившийся ацетилфторид раствор еще в течение 1 ч нагревали до 80°С.
Анализ результатов
В начале добавления ацетилхлорида состав отходящего газа включал 50,63% НСl, 37,80% ацетилфторида, 8,15% непрореагировавшего ацетилхлорида и 3,43% уксусной кислоты (образовавшейся в результате наличия в цилиндре, из которого отбирали пробы, влаги; данные указаны соответственно в % на основе ГХ-анализа). По завершении процесса добавления состав отходящего газа включал 31,57% НС1, 45,96% ацетилфторида, 19,98% непрореагировавшего ацетилхлорида и 2,50% уксусной кислоты.
Примеры 11 и 12 подтверждают возможность получения ацетилфторида и при использовании аддуктов с более высоким содержанием HF.
В примерах 13-19 поясняется регенерирование ("возвращение в технологический цикл") загрязненного хлористым водородом HF-аддукта.
Пример 13
Регенерирование NBu3·1,7НС1 с получением NBu3·yНСl с применением небольшого количества HF
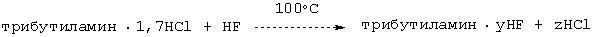

В лабораторный автоклав предварительно помещали трибутиламин·1,7 НСl. После герметизации автоклава добавляли 50 г HF и приблизительно в течение 3 ч кипятили при внутренней температуре реактора 100°С. Затем автоклав охлаждали до его внутренней температуры порядка 60°С и газовую фазу вплоть до достижения в автоклаве атмосферного давления направляли в промывочную склянку с водой. Согласно данным анализа хлорида и фторида в промывочной склянке было установлено, что состав оставшегося в автоклаве катализатора включал трибутиламин·0,62НСl·7,3НF.
Этот пример подтверждает возможность регенерирования HF-аддукта даже при его полном расходе с образованием гидрохлорида. Регенерированный аддукт возвращали в технологический цикл и повторно применяли в реакции фторирования. Следующий пример показывает, что возможно дальнейшее снижение содержания НСl в этом продукте.
Пример 14
Дальнейшее снижение содержания НСl в NBu3·0,62HCl·7,3HF с получением NBu3·yHF при использовании избытка HF
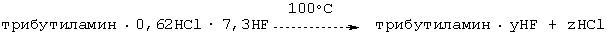

К оставшейся в автоклаве смеси трибутиламин·0,62НСl·7,3НF из примера 13 повторно добавляли 107 г HF и при температуре порядка 100°С кипятили в течение ночи. Затем автоклав охлаждали до его внутренней температуры приблизительно 60°С и газовую фазу вплоть до достижения атмосферного давления направляли в промывочную склянку с водой. Согласно данным анализа хлорида и фторида в промывочной склянке был выявлен состав оставшегося в автоклаве катализатора, который включал трибутиламин·0,005НСl·4,89HF. Этот же состав был подтвержден непосредственным анализом образовавшегося в автоклаве остатка. Это означало практически полное удаление НСl. Продуктов разложения амина не было обнаружено. Полученная композиция зарекомендовала себя с самой лучшей стороны при последующем использовании в качестве фторирующего реагента и катализатора фторирования.
Пример 15
Регенерирование NEt3·1,0HCl с получением NEt3·yHF при использовании избытка HF
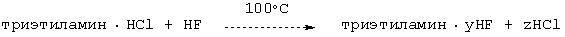

Технология
В лабораторный автоклав предварительно помещали гидрохлорид триэтиламина и автоклав закрывали. После этого добавляли HF и в течение ночи кипятили при внутренней температуре реактора 100°С. Затем при температуре реактора 100°С газовую фазу вплоть до достижения атмосферного давления направляли в наполненную водой склянку для промывки. Согласно данным анализа хлорида и фторида в промывочной склянке был выявлен состав оставшегося в автоклаве катализатора, который включал триэтиламин·0,09НСl·5,35НF. Этот же состав был подтвержден непосредственным анализом образовавшегося в автоклаве остатка. Это означало практически полное удаление НСl. Продуктов разложения амина не было обнаружено.
Пример 16
Установление соотношения между амином и HF, равного 2,8, при использовании каталитической смеси из примера 15
Технология
Полученной в примере 15 смесью триэтиламин·0,09НСl·5,35НF заполняли ПФА-склянку с фриттой и с помощью сухого азота удаляли избыточный HF. После выдержки веса склянки в течение 30 мин на постоянном уровне в течение последующих 10 мин создавали давление в 10-3 мбар с целью полного удаления остаточных количеств HF. Состав полученного таким путем катализатора согласно данным анализа хлорида, фторида и амина включал триэтиламин·2,8HF. Присутствие НСl не было обнаружено. Тем самым была подтверждена регенерируемость катализатора.
Благодаря выбранному соотношению между амином и HF удается восстановить нуклеофильные свойства аддукта, что позволяет исключительно эффективно использовать его в качестве реагента при получении SO2F2 из SO2Cl2.
Примеры 17 и 18
Вариант продолжительности регенерирования
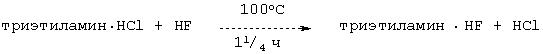
Смесь
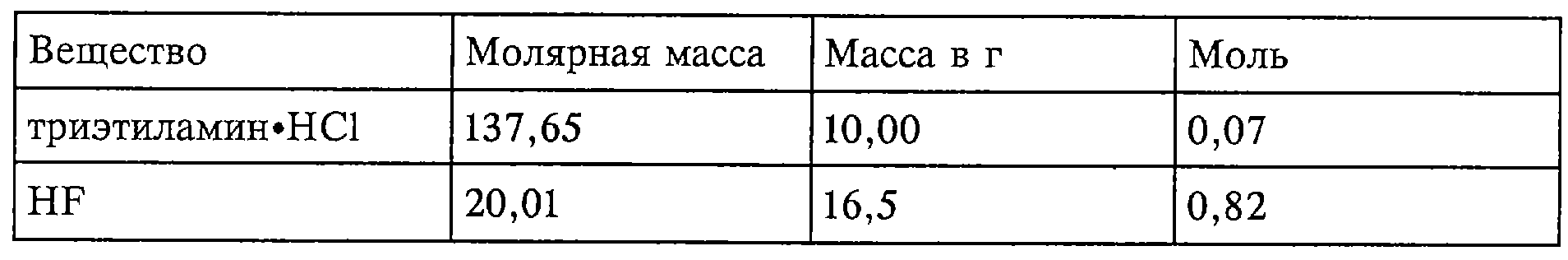
Технология
В лабораторный автоклав предварительно помещали гидрохлорид триэтиламина и автоклав закрывали. После этого добавляли HF и в течение 11/4 ч кипятили при температуре реактора 100°С (с предварительным 15-минутным нагревом автоклава). По истечении этого времени газовую фазу в течение 15 мин, когда автоклав находился в масляной бане, отбирали и анализировали (проба 1). Содержимое реактора (18,07 г) помещали затем в ПФА-склянку и в течение 5 мин промывали азотом (18, 02 г). Из этого раствора отбирали 1,54 г и доводили дистиллированной водой до объема 1 л, после чего проводили гидрохимический анализ (анализ мокрым способом) (проба 2).
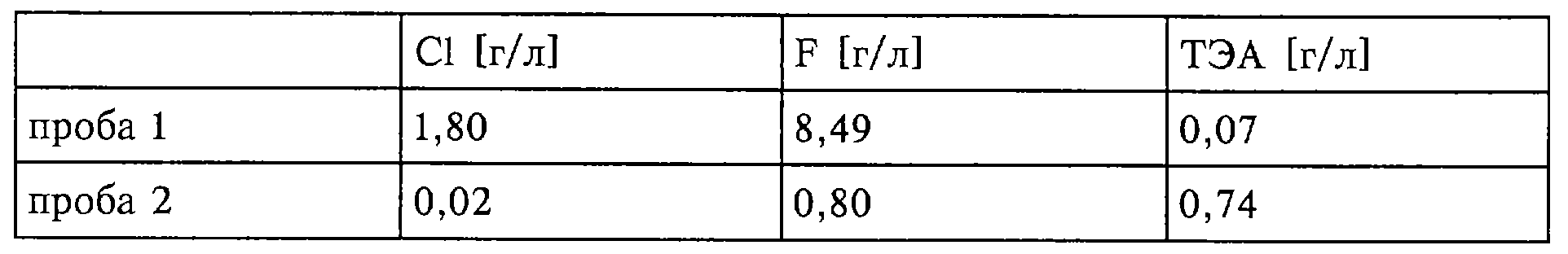
ТЭА означает триэтиламин
Согласно данным анализа получают каталитическую композицию следующего состава: NЕt3·5,75НF·0,08НСl.
Пример 19
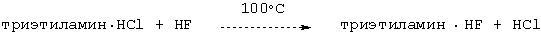
Смесь

Технология
В лабораторный автоклав предварительно загружали гидрохлорид триэтиламина и автоклав закрывали. После этого добавляли HF и в течение 30 мин кипятили при температуре реактора 100°С (с предварительным 15-минутным нагревом автоклава). По истечении этого времени автоклав удаляли из масляной бани и газовую фазу в течение 15 мин отбирали и анализировали (проба 1). Содержимое реактора (20,96 г) помещали затем в ПФА-склянку и в течение 5 мин промывали азотом (20,64 г). Из этого раствора отбирали 1,1 г и дистиллированной водой доводили до объема 1 л, после чего проводили анализ методом ионной хроматографии (проба 2).
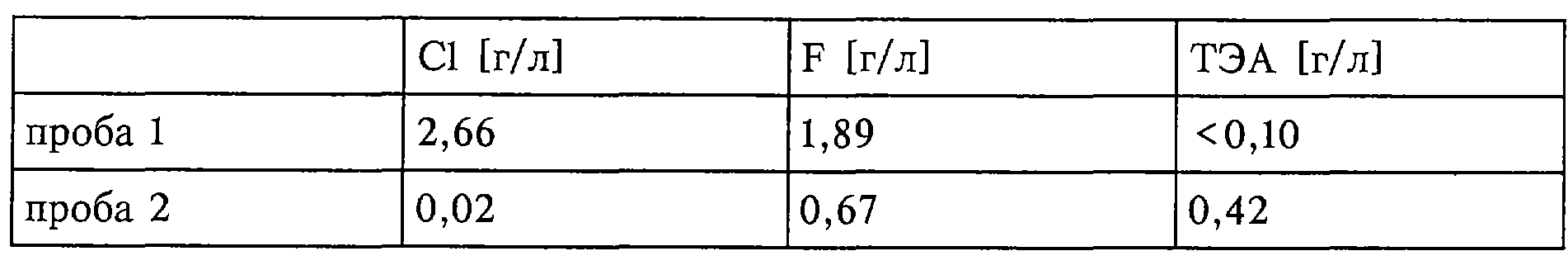
Согласно данным анализа получают каталитическую композицию следующего состава: триэтиламин·8,48НF·0,14НСl.
Реферат
Изобретение относится к усовершенствованному
способу получения сульфурилфторида, сульфурилхлоридфторида или
фторангидрида карбоновой кислоты общей формулы (I): RC(O)F, где R означает С1-С7алкил или С1-С7алкил, замещенный по меньшей мере одним атомом хлора и/или по
меньшей мере одним атомом фтора, без добавления основания или растворителя, связывающего HF, взаимодействием соответствующего
хлорангидрида карбоновой кислоты а) с аддуктом из фтористого водорода и
гидрофторида аммония или гидрофторида пиридина, или гидрофторида пиперидина, или аддуктом из фтористого водорода и гидрофторида
вторичного или третичного апифатического амина формулы B·mHF, где
В означает вторичный или третичный алифатический амин, a m имеет значение 1

Комментарии