Катализатор, способ приготовления катализатора и способы окислительной конверсии углеводородов, гидрирования оксидов углерода и углеводородов - RU2659078C1
Код документа: RU2659078C1
Описание
Изобретение относится к катализатору и процессам каталитической окислительной конверсии углеводородов и гидрирования оксидов углерода и углеводородов. В частности, такие реакции, как паровая, углекислотная конверсии, парциальное окисление или автотермический риформинг углеводородов с получением синтез-газа, лежат в основе большинства крупнотоннажных процессов химической и нефтехимической промышленности.
Усовершенствование катализаторов и оптимизация параметров проведения этих процессов всегда имели стратегическое значение, способствуя ресурсо- и энергосбережению.
В последнее время большое внимание также стало уделяться проблеме утилизации оксидов углерода, в первую очередь улавливанию и вовлечению в оборот углекислого газа - одного из основных парниковых газов, приводящих к глобальному потеплению. Каталитическая конверсия СО2 в топливо (например, получение синтетического природного газа, метанола, диметилового эфира, синтез-газа) рассматривается как перспективный подход по его утилизации. В частности, каталитическая конверсия может применяться при переработке биогаза, одновременно содержащего метан и углекислый газ. В этой связи разработка активных, селективных и стабильных гетерогенных катализаторов, позволяющих минимизировать капитальные затраты и операционные издержки при проведении вышеперечисленных процессов, является крайне важной задачей.
В настоящее время известны катализаторы и способы проведения каталитических реакций окислительной конверсии углеводородов с применением нанесенных рутениевых, платиновых, родиевых, кобальтовых, никелевых катализаторов (Р.K. Cheekatamarla, C.M. Finnerty, Reforming catalysts for hydrogen generation in fuel cell applications // Journal of Power Sources, V. 160 Is. 1,2006, 490-499; EP 1586 535 A2; CN 102949994 (A); US 7449168, B01J 23/78, C01B 3/26, 11.11.2009). Недостатками известных катализаторов являются невысокая активность, зауглероживание катализаторов и спекание дисперсных металлических частиц в условиях протекания каталитической реакции.
Известны также катализаторы и способы проведения гидрирования оксидов углерода и углеводородов (RU 2409878, Н01М 8/06, 20.01.2011; SU №780881, B01J 37/02, 1980). В частности, известны способы каталитической конверсии углекислого газа, где в качестве катализатора используются переходные металлы, например, Ru, Rh, Pt, Ni, Co, нанесенные на оксид алюминия (О.В. Крылов, А.Х. Мамедов, Гетерогенно-каталитические реакции диоксида углерода // Успехи химии, 1995, том 64, номер 9, страницы 935-959). Недостатками известных катализаторов являются невысокая конверсия углекислого газа, зауглероживание и снижение активности.
В основном, эти недостатки вызваны структурой используемого в катализаторах носителя, обычно представляющего собой агломераты из сферически подобных наноразмерных частиц, которые не обеспечивают сохранение высокой дисперсности, оптимального фазового состава нанесенных металлических частиц в процессе приготовления катализатора и в условиях протекания каталитических реакций.
В качестве прототипа был выбран 5 вес. % Rh/Al2O3 катализатор (J. Yu, Z. Zhang, F. Dallmann, J. Zhang, D. Miao, H. Xu, A. Goldbach, R. Dittmeyer, Facile synthesis of highly active Rh/Al2O3 steam reforming catalysts with preformed support by flame spray pyrolysis // Applied Catalysis B: Environmental 198 (2016) 171-179).
Недостатками являются невысокая конверсия углекислого газа, зауглероживание и снижение активности.
Задачей, на решение которой направлено настоящее изобретение, является повышение эффективности каталитической окислительной конверсии углеводородов и гидрирования оксидов углерода и углеводородов за счет разработки более эффективных катализаторов.
Технический результат - высокая активность, стабильность катализатора при проведении данных каталитических процессов.
Задача решается благодаря использованию катализатора, содержащего в качестве активного компонента переходные металлы Периодической системы, преимущественно не менее одного переходного металла, выбранного из VIII группы Периодической системы, в количестве не менее 0,01 мас. %, и носителя, представляющего собой монокристаллические нановолокна оксида алюминия, преимущественно имеющих диаметр более 3 нм и длину более 100 нм (US Patent Application 2013/0192517 A1, C30B 9/00, 01.08.2013), которые в своем составе могут содержать переходные металлы и лантаноиды.
Задача решается также способом приготовления катализатора окислительной конверсии углеводородов и гидрирования оксидов углерода и углеводородов нанесением комплексных соединений переходных металлов, преимущественно не менее одного переходного металла, выбранного из VIII группы Периодической системы, в количестве не менее 0,01 мас. %, на носитель, представляющий собой монокристаллические нановолокна оксида алюминия, преимущественно имеющие диаметр более 3 нм и длину более 100 нм, которые в своем составе могут содержать переходные металлы и лантаноиды.
Задача решается также способом окислительной конверсии углеводородов в присутствии катализатора, описанного выше, при температуре выше 20°С, при давлении выше 0,1 атм. В качестве окислителя преимущественно используют воду, и/или углекислый газ, и/или кислород, который может находиться в смеси с азотом, в качестве основных продуктов реакции могут образовываться водород, вода, монооксид углерода, углекислый газ, метан.
Задача решается также способом гидрирования оксидов углерода и углеводородов в присутствии катализатора, описанного выше, при температуре выше 20°С, при давлении выше 0,1 атм. Для проведения гидрирования преимущественно используют водород, а основным продуктом является метан.
На прототипе при 650°С даже при потоке 196000 см3г-1ч-1 не достигалось равновесное распределение продуктов и конверсия метана в ходе проведения реакции паровой конверсии метана. На катализаторе, приготовленном по примеру 2, достигалось равновесное распределение продуктов при потоках до 270000 см3г-1ч-1. Результат достигается за счет высокой активности и стабильности катализатора, что иллюстрируется примерами 11 и 12.
Сущность изобретения иллюстрируется следующими примерами по приготовлению катализаторов и примерами, описывающими результаты испытаний катализаторов в окислительной конверсии углеводородов и гидрирования оксидов углерода и углеводородов.
I. Приготовление катализаторов
Пример 1.
Получение образца 0.3 мас. % Rh/Нановолокна оксида алюминия.
0,100 г нитрата родия (III) гидрата растворяют в 75 мл воды, далее в раствор помещают 10 г нановолокон оксида алюминия, высушивают при 110°С и прокаливают при 400°С.
Пример 2.
Получение образца 37 мас. % Ni/Нановолокна оксида алюминия.
5,7 г [Ni(NO3)2⋅6H2O] и 1,2 г глицина растворяют в 15 мл воды. В полученный раствор помещают 2 г нановолокон оксида алюминия, после чего на 30 мин помещают в печь, разогретую до 400°С. Далее восстанавливают при 700°С в токе 10%Н2 в Ar в течение 4 ч.
Пример 3.
Получение образца 37 мас. % Ni/Нановолокна оксида алюминия с содержанием церия.
5,7 г [Ni(NO3)2⋅6H2O] и 1,2 г глицина растворяют в 15 мл воды. В полученный раствор помещают 2 г нановолокон оксида алюминия, содержащие в своем составе 0,1 мас. % церия, после чего на 30 мин помещают в печь, разогретую до 400°С. Далее восстанавливают при 500°С в токе 10%Н2 в Ar в течение 4 ч.
Пример 4.
Получение образца 20 мас. % Ni/Нановолокна оксида алюминия.
2,7 г [Ni(NO3)2⋅6H2O] растворяют в 15 мл воды. В полученный раствор помещают 2 г нановолокон оксида алюминия, после чего на 30 мин помещают в печь, разогретую до 400°С. Далее восстанавливают при 500°С в токе 10%Н2 в Ar в течение 4 ч.
Пример 5.
Получение образца 15 мас. % Ni/Нановолокна оксида алюминия с содержанием хрома.
1,8 г [Ni(NO3)2⋅6H2O] растворяют в 50 мл воды. В полученный раствор помещают 2 г нановолокон оксида алюминия, содержащие 1 мас. % хрома, и по каплям прикапывают 17 мл 1 моль/л раствора гидроксида натрия. После этого нановолокна извлекают из раствора и на 30 мин помещают в печь, разогретую до 400°С. Далее восстанавливают при 500°С в токе 10%H2 в Ar в течение 4 ч.
Пример 6.
Получение образца 0.3 мас. % Pt-0.3 мас. %Со/Нановолокна оксида алюминия.
0,080 г гексахлороплатината натрия и 0,10 г нитрата кобальта (II) растворяют в 75 мл воды, далее в раствор помещают 10 г нановолокон оксида алюминия, высушивают при 110°С и прокаливают при 400°С.
II. Испытание катализаторов
Пример 7.
Окислительная конверсия углеводородов иллюстрируется на примере паровой конверсии метана. Процесс проводят с катализатором, приготовленным в соответствии с примером 2, при температуре 650°С, при скорости 135000 см3г-1ч-1 и атмосферном давлении. Реакционная газовая смесь состоит из: 33.3 об. % СН4 и 66.7 об. % H2O. Полученные результаты приведены в таблице 1.

Пример 8.
Процесс гидрирования углекислого газа в присутствии метана проводят с катализатором, приготовленным в соответствии с примером 3, при температуре 410°С, при скорости 34000 см3г-1ч-1 и атмосферном давлении. Реакционная газовая смесь состоит из: 8,2 об. % CO2, 38,2 об. % Н2, 2 об. % СН4, 51,6 об. % N2. Полученные результаты приведены в таблице 2.

Пример 9.
Процесс гидрирования углекислого газа проводят с катализатором, приготовленным в соответствии с примером 3, при температуре 395°С, при скорости 34000 см3г-1ч-1 и атмосферном давлении. Реакционная газовая смесь состоит из: 8,2 об. % СО2, 38,2 об. % Н2, 53,6 об. % N2 Полученные результаты приведены в таблице 3.

Пример 10.
Процесс гидрирования пропана проводят с катализатором, приготовленным в соответствии с примером 3, при температуре 400°С, при скорости 25000 см3г-1ч-1 и атмосферном давлении. Реакционная газовая смесь состоит из: 10 об. % C3H8, 50 об. % СН4, 30 об. % Н2, 10 об. % N2. Полученные результаты приведены в таблице 4.

Таким образом, как видно из примеров и таблиц, предлагаемое изобретение позволяет эффективно осуществлять процессы окислительной конверсии углеводородов и гидрирования оксидов углерода и углеводородов.
Пример 11, который доказывает достижение высокой стабильности катализатора по сравнению с прототипом
Пример 11.
Стабильность катализатора иллюстрируется на примере паровой конверсии метана в течение 90 ч. Процесс проводят с катализатором, приготовленным в соответствии с примером 2, при температуре 650°С, при скорости 135000 см3г-1ч-1 и атмосферном давлении. Реакционная газовая смесь состоит из: 33.3 об. % СН4 и 66.7 об. % H2O Полученные результаты приведены в таблице 5.
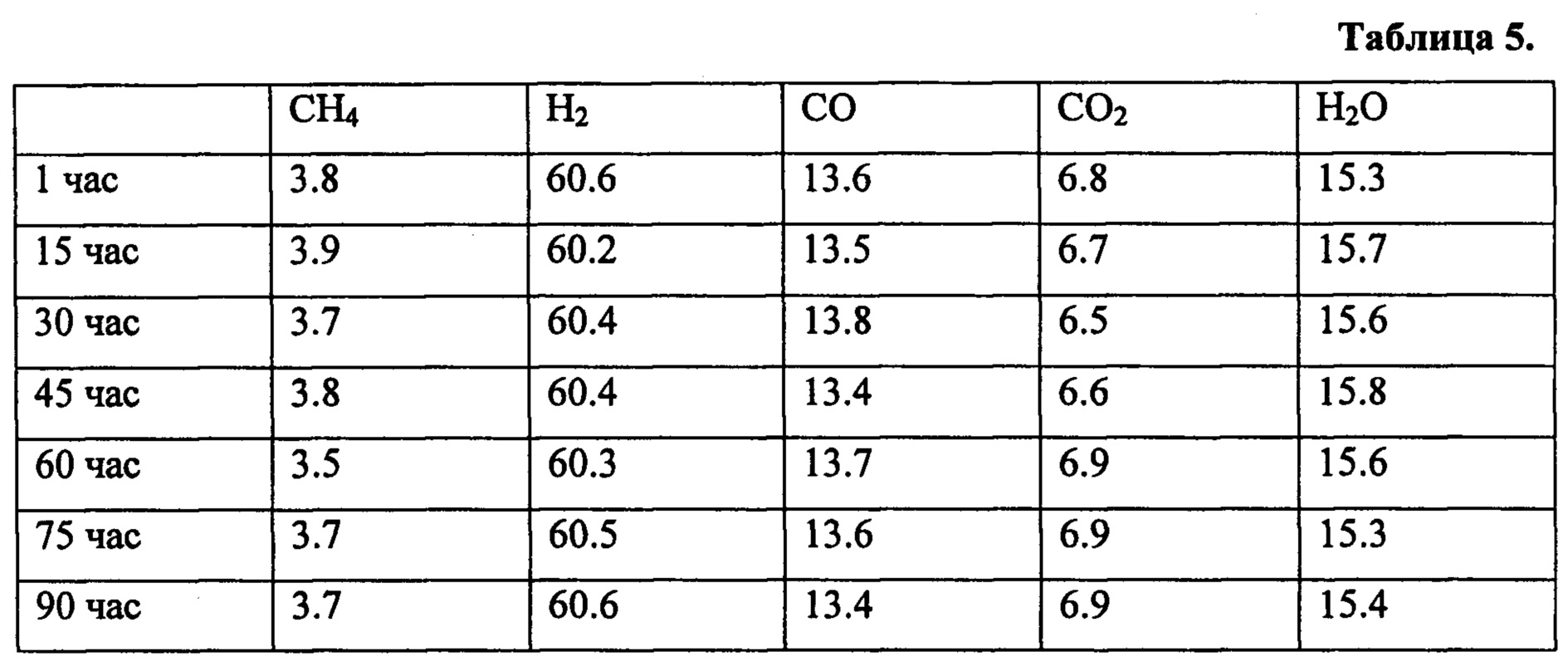
Примеры 12 и 13 доказывают высокую активность катализатора в гидрировании оксидов углерода
Пример 12.
Процесс гидрирования моноксида углерода проводят с катализатором, приготовленным в соответствии с примером 3, при температуре 300°С, при скорости 29000 см3г-1ч-1 и атмосферном давлении. Реакционная газовая смесь состоит из: 2 об. % СО, 98 об. % Н2. Полученные результаты приведены в таблице 6.

Пример 13.
Процесс гидрирования моноксида и диоксида углерода проводят с катализатором, приготовленным в соответствии с примером 3, при температуре 300°С, при скорости 29000 см3г-1ч-1 и атмосферном давлении. Реакционная газовая смесь состоит из: 1 об. % СО, 1 об. % CO2, 98 об. % Н2. Полученные результаты приведены в таблице 7.

Таким образом, как видно из примеров и таблиц, предлагаемое изобретение позволяет эффективно осуществлять процессы окислительной конверсии углеводородов и гидрирования оксидов углерода и углеводородов.
Реферат
FIELD: chemistry; metallurgy.SUBSTANCE: invention relates to the conversion catalyst. Catalyst for the oxidative conversion of hydrocarbons and the hydrogenation of carbon oxides and/or hydrocarbons contains, as an active component, transition metals of the Periodic Table and the carrier, it is characterized in that, as a carrier, it contains monocrystalline alumina nanofibers, which have the diameter more than 3 nm and the length more than 100 nm. Method for the catalyst preparation, the method for the oxidative conversion of hydrocarbons, the method for hydrogenating carbon monoxide and/or carbon dioxide and/or hydrocarbons is claimed.EFFECT: high activity, stability of the catalyst when carrying out these catalytic processes.15 cl, 7 tbl, 13 ex
Формула
Документы, цитированные в отчёте о поиске
Наночастицы волокон оксида кремния с развитой поверхностью
Катализатор для синтеза углеводородов из со и h2 и способ его получения
Нанесение и закрепление наноактивного материала

Комментарии