Устройство для стерилизации изделия пероксидом водорода, способ стерилизации изделия паром пероксида водорода (варианты), способ стерилизации изделия плазмой пероксида водорода (варианты), способ стерилизации изделия пероксидом водорода (варианты), спосо - RU2152803C2
Код документа: RU2152803C2
Чертежи
























Описание
Эта заявка является заявкой с частичным продолжением заявки на патент США серии N 08/234738, поданной 28 апреля 1994, на описание которой имеется ссылка.
Это изобретение относится к устройству и способу использования паров пероксида водорода для стерилизации изделий, таких как медицинские инструменты, и в частности, использования неводного источника пара пероксида водорода для такого способа. Это изобретение обеспечивает также парофазный способ получения органических и неорганических неводных комплексов пероксида водорода.
Медицинские инструменты традиционно стерилизуют, используя либо нагревание, такое, которое обеспечивается паром, либо химикат, такой как формальдегид или этиленоксид в газообразном состояния или в состоянии пара. Каждый из этих способов имеет недостатки. Многие медицинские устройства, такие как волоконно-оптические устройства, эндоскопы, электрические инструменты и т.п. , чувствительны к нагреванию, влаге или к тому и другому. Формальдегид и этиленоксид оба являются токсичными газами, которые представляют собой потенциальную опасность для здоровья рабочих. Проблемы с этиленоксидом особенно тяжелы, поскольку его использование требует длительного времени аэрации для удаления газа из изделий, которые подвергаются стерилизации. Это делает цикл стерилизации нежелательно длительным. Кроме того, как формальдегид, так и этиленоксид требуют присутствия в системе значительного количества влаги. Так, устройства, подвергаемые стерилизации, должны быть увлажнены до ведения химиката, или химикат и влага должны быть введены одновременно. Влага играет определенную роль в стерилизации наряду с целым рядом других химикатов в газовом состоянии или в состоянии пара, в дополнение к этиленоксиду и формальдегиду, как представлено в таблице 1.
1. Bruch, C.W. Gaseous Sterilization, Ann. Rev. Microbiology 15 : 245 - 262 (1961).
2. Janssen, D.W. and Scheneider, P.M. Overview of Ethylene Oxide Alternative Sterilization Technologies, Zentralsterilisation 1 : 16 - 32 (1993).
3. Bovallius, A. and Anas, P. Surface - Decontaminating Action of Glutaraldehyde in the Gas - Aerosol Phase, Applied and Environment Microbiology, 129 - 134 (Aug. 1977).
4. Knapp, J.E. et al. Chlorine Dioxide As a Gaseous Sterilant, Medical Device & Diagnostic Industry, 48 - 51 (Sept. 1986).
5. Portner, D.M. and Hoffman, R.K. Sporicidal Effect of Peracetic Acid Vapor, Applied Microbiology 16 : 1782 - 1785 (1968).
Показано, что стерилизация с использованием пара пероксида водорода имеет несколько преимуществ по сравнению с другими способами химической стерилизации (см. , например, патент США NN 4169123 и 4169124), а комбинация пероксида водорода с плазмой обеспечивает дополнительные преимущества, раскрываемые в патенте США 4643876, выданному 17 февраля 1987. Jacobs et al. Согласно этим патентам, пар пероксида водорода генерируется из водного раствора пероксида водорода, который обеспечивает присутствие влаги в данной системе. Эти данные, наряду с данными, суммированными в таблице 1, указывают на то, что для пероксида водорода, чтобы быть эффективным или демонстрировать максимальную спорицидную активность в паровой фазе, требуется влага. Однако использование водных растворов пероксида водорода для генерирования пара пероксида водорода для стерилизации вызывает ряд проблем. При более высоких давлениях, таком как атмосферное давление, избыточная вода в системе может вызвать конденсацию. Таким образом, следует уменьшить относительную влажность в кожухе для стерилизации до введения водяного пара пероксида водорода.
Стерилизация изделий, содержащих диффузионно-ограниченные области, такие как длинные узкие люмены, заключается в специальном введении пара
пероксида водорода, который генерируется из водного раствора пероксида водорода, поскольку:
1. Вода имеет более высокое давление пара, чем пероксид водорода, и должна испаряться быстрее, чем
пероксид водорода, из водного раствора.
2. Вода имеет более низкую молекулярную массу, чем пероксид водорода, и должна диффундировать в состоянии пара быстрее, чем пероксид водорода.
Вследствие этого, когда испаряется водный раствор пероксида водорода, вода достигает деталей, подвергаемый стерилизации, первой и более высокой концентрации. Поэтому водяной пар становится барьером для проникновения пара пероксида водорода в диффузионно-ограниченные области, такие как маленькие щели и длинные узкие люмены. Проблему нельзя решить путем удаления воды из водного раствора и использования более концентрированного пероксида водорода, поскольку концентрированные растворы пероксида водорода, т.е. выше, чем 65% по весу, могут быть опасными вследствие окисляющей природы раствора.
Два патента, патент США 4642165 и патент США 4744951, выданные Bier and Cumming et al соответственно, посвящены решению этой проблемы. Bier попытался решить эту проблему путем дозирования малых приращений раствора пероксида водорода на нагреваемую поверхность, чтобы гарантировать, что каждое приращение испарялось до добавления следующего приращения. Это позволяет устранить различие в давлении пара и летучести между пероксидом водорода и водой, но это не устраняет тот факт, что вода диффундирует быстрее, чем пероксид водорода в состоянии пара.
Cumming et al описывает способ концентрирования пероксида водорода из относительно разбавленного раствора пероксида водорода и воды и подачи концентрированного пероксида водорода в форме пара в камеру стерилизации. Способ включает испарение основной части воды из раствора и удаление водяного пара, полученного до инъецирования пара концентрированного пероксида водорода в камеру для стерилизации. Для пероксида водорода предпочтительной является область концентраций от 50% до 80% по весу. Этот способ имеет недостаток, связанный с работой с растворами, которые находятся в опасной области: т.е. выше, чем 65% пероксид водорода, и также не удаляет всю воду из парового состояния. Поскольку вода все еще присутствует в растворе, она будет испаряться первой, диффундировать быстрее и достигать предметов, подлежащих стерилизации первой. Это действие должно быть особенно заметным для длинных узких люменов.
В патенте США 4943414, озаглавленном "Method for Vapor Sterilization of Articles Having Lumens" и выданном Jacobs et al., описывает способ, в котором сосуд, содержащий небольшое количество раствора жидкого стериланта, способного к парообразованию, присоединяют к люмену, и стерилант испаряется и течет непосредственно в канал изделия, по мере того как давление уменьшается во время цикла стерилизации. Эта система имеет преимущество, заключающееся в том, что вода и пар пероксида водорода проходят через люмен благодаря разнице давления, которая существует, увеличивая скорость стерилизации люменов, но этот способ имеет недостаток, заключающийся в том, что требуется сосуд, который следует прикрепить к каждому люмену, подлежащему стерилизации. Кроме того, вода испаряется быстрее и предшествует пару пероксида водорода в люмене.
Merianos раскрывает в патенте США N 5008106, что в основном безводный комплекс PVP и H2O2 используется для уменьшения содержания микробов на поверхностях. Комплекс, в форме тонкого белого порошка, используют для получения противомикробных растворов, гелей, мазей и т.п. Его можно применять для металлической сетки, тампонов из хлопка, губчатых материалов и т.п. H2O2 освобождается при контакте с водой, присутствующей на поверхностях, содержащих микроорганизмы. Таким образом, этот способ также требует присутствия влаги для осуществления стерилизации.
Nikolskaya et al. раскрывает в патенте СССР N 1681860, что поверхности могут быть обеззаражены, хотя необязательно стерилизованы, используя пероксогидрат фторида аммония (NH4F, H2O2). Однако этот неорганический пероксидный комплекс обеспечивает обеззараживание только внутри очень узкого диапазона температур 70-86oC. Даже внутри этого диапазона время обеззараживания достаточно продолжительно, требующее, по крайней мере, двух часов. Кроме того, известно, что фторид аммония разлагается до аммиака и фтористоводородной кислоты при температурах выше 40oC. Вследствие своей токсичности и реакционноспособности, фтористоводородная кислота нежелательна для большинства систем стерилизации. Однако Nikolskaya et al. указывает на то, что несмотря на 90% выделение пероксида водорода при 60oC, NH4F•H2O2 неэффективен при обеззараживании поверхностей при этой температуре. Таким образом, по-видимому, существует фактор, помимо пероксида водорода, ответственный за обеззараживание.
Пероксид водорода способен образовывать комплексы как с органическими, так и неорганическими соединениями. Связывание в этих комплексах приписывают образованию водородной связи между функциональными группами, обогащенными электронами, в комплексующем соединении, и пероксидом водорода. Комплексы используют в коммерческих и промышленных применениях, таких как отбеливающие агенты, дезинфицирующие средства, стерилизующие средства, окисляющие реагенты в органических синтезах, и катализаторы для свободно-радикально-инициируемых реакций полимеризации.
Обычно, эти типы соединений получают путем кристаллизации комплекса из водного раствора. Например, комплекс мочевина-пероксид водорода был получен Lu, Hughes, and Giguere (J. Amer. Chem. Soc. 63 (1) : 1507 - 1513 (1941)) в жидкой фазе путем добавления раствора мочевины к раствору пероксида водорода и осуществления кристаллизации комплекса при соответствующих условиях. Gates et al. (Патент США N 2986448) получил комплекс карбонат натрия - пероксид водорода путем обработки насыщенного водного раствора Na2CO3 раствором от 50 до 90% H2O2 в закрытой циклической системе при от 0 до 5oC в течение от 4 до 12 часов. Совсем недавно, Hall et al. (патент США N 3870783) получил комплекс карбонат натрия - пероксид водорода путем взаимодействия водных растворов пероксида водорода и карбоната натрия в ванне или непрерывном катализаторе. Кристаллы отделяют путем фильтрации или центрифугирования и жидкости используют для получения еще раствора карбоната натрия. Эти методы работают хорошо для пероксидных комплексов, которые образуют стабильные, кристаллические сыпучие продукты из водного раствора.
Shiraeff (патенты США NN 3376110 и 3480557) раскрывает получение комплекса пероксида водорода с полимерным N-винилгетероциклическим соединением (PVP) из водного раствора. Полученные комплексы содержали переменные количества пероксида водорода и значительные количества воды. Merianos в патенте США N 5008093 сообщает о том, что сыпучие, стабильные в основном безводные комплексы PVP и H2O2 могут быть получены путем взаимодействия суспензии PVP и раствора H2O2 в безводном органическом растворителе, подобном этилацетату. Совсем недавно, Biss (патент США N 5077047) раскрывает коммерческий способ получения продукта PVP-пероксида водорода путем добавления тонко разделенных капель от 30% до 80% по весу водного раствора пероксида водорода к флюидизированному слою PVP, поддерживаемому при температуре окружающей среды до 60oC. Установлено, что полученный продукт является стабильным, в основном безводным, сыпучим порошком с концентрацией пероксида водорода от 15 до 24%.
Moschner, et al. (патент США N 5030380) получил твердый полимерный комплекс с пероксидом водорода путем сначала образования комплекса в водном растворе и затем сушки реакционного продукта под вакуумом или высушиванием распылением при температуре, достаточно низкой для того, чтобы предотвратить термическую деградацию продукта.
Все эти способы получения комплексов пероксида водорода предшествующего уровня техники используют растворы пероксида водорода. Либо комплекс образуется в растворе, содержащем пероксид водорода, либо капли раствора пероксида водорода распыляют на флюидизированный слой реагента.
Реакция в паровой фазе и газовой фазе являются хорошо известными способами синтеза. Например, Roetheli (патент США N 2812244) раскрывает твердо-газовый способ дегидрирования, термического крекинга, деметанилирования, Fujimoto et al. (Journal of Catalysis, 133 : 370 - 382 (1992) раскрывает парофазное карбонилирование метанола. Zellers et al. (Analytical Chemistry, 62 : 1222 - 1227 (1990) описывает взаимодействие паров стирола с квадратно-планарным платиноорганическим комплексом. Однако эти паро- и газофазные реакции не используют для получения комплексов пероксида водорода.
Одним из аспектов настоящего изобретения является устройство для стерилизации изделия с помощью пероксида водорода. Устройство включает контейнер для удерживания изделия, подлежащего стерилизации, и источник пара пероксида водорода, расположенный внутри контейнера. Источник включает в основном неводный органический комплекс пероксида водорода, и он выполнен таким образом, что пар может контактировать с изделием, осуществляя стерилизацию. В одном варианте воплощения изобретения, контейнер может включать барьер, способный пропускать газы. Используемый комплекс может быть любым из ряда органических комплексов пероксида водорода, таких как мочевина-пероксидный комплекс, поливинилпирролидон-пероксидный комплекс, найлон 6-пероксидный комплекс или 1,3-диметилмочевина-пероксидный комплекс. В некоторых вариантах воплощения изобретения, комплекс является нестабильным в вакууме, такой как глицин ангидрид-пероксидный комплекс. Устройство может также включать нагреватель, расположенный внутри контейнера, при помощи которого комплекс помещают на нагреватель и нагревают, чтобы облегчить выделение пара из комплекса. Устройство в некоторых вариантах воплощения изобретения включает кожух, расположенный снаружи контейнера, в который помещают комплекс, и вход, обеспечивающий газовую связь между контейнером и кожухом, такую что пар, выделяемый из комплекса, движется в направлении входа и в контейнер для осуществления стерилизации. В других некоторых вариантах воплощения изобретения, устройство включает перекрываемый вентиль, расположенный у входа, так что когда вентиль закрыт, кожух изолирован от контейнера. Устройство может также включать вакуумный насос в газовой линии с контейнером для вакуумирования контейнера. Вакуумный насос в газовой линии с контейнером в кожухе может также включаться, наряду с перекрываемым вентилем, расположенным между насосом и контейнером, и между насосом и кожухом, и между кожухом и контейнером, так что кожух и контейнер могут быть вакуумированы независимо или одновременно. Может быть также включен электрод внутри контейнера для генерирования плазмы вокруг изделия. В предпочтительном варианте воплощения изобретения комплекс представляет собой твердую фазу. Устройство может включать нагреватель, приспособленный для нагревания указанного комплекса.
Другим аспектом настоящего изобретения является способ стерилизации изделия паром пероксида водорода. Этот способ включает стадию помещения изделия в контейнер и стадию контактирования изделия с паром пероксида водорода, выделяемого из в основном неводного органического комплекса пероксида водорода, для контакта и стабилизации изделия. В одном предпочтительном варианте воплощения изобретения, пар выделяется из комплекса, имеющего не более чем около 10% воды. Комплекс может быть нагрет для облегчения выделения пара из комплекса. Произвольно, можно использовать пульсацию давления для усиления стерилизации. В некоторых вариантах воплощения изобретения, контейнер вакуумируют до введения пара в контейнер. Способ может также включать стадию генерирования плазмы в контейнере после введения пара в контейнер.
Следующим аспектом настоящего изобретения является разработка способа стерилизации изделия плазмой пероксида водорода. Этот способ включает помещение изделия в контейнер, контактирование изделия с паром пероксида водорода, выделяемом из в основном неводного органического комплекса пероксида водорода, для контакта с изделием, генерирование плазмы внутри контейнера вокруг изделия и поддержание изделия в плазме в течение времени, достаточного для осуществления стерилизации изделия и/или удаления остаточного пероксида водорода из изделия. В одном варианте воплощения изобретения, пероксидная обработка происходит в одном сосуде, а плазменная обработка - в другом.
Очередным аспектом настоящего изобретения является также способ стерилизации изделия плазмой пероксида водорода. Этот способ включает помещение изделия внутрь контейнера, контактирование изделия с паром пероксида водорода, выделяемым из в основном неводного органического комплекса пероксида водорода, для контакта с изделием, генерирование плазмы в месте, которое расположено вне изделия, течение плазмы в контейнер, который содержит изделие, и выдерживание изделия в плазме в течение времени, достаточном для осуществления стерилизации изделия и/или удаления остаточного пероксида водорода из изделия. Обработку плазмой можно проводить либо в той же самой камере, либо в другой камере, чем та камера, в которой происходит пероксидная обработка.
Дополнительным объектом настоящего изобретения является способ стерилизации изделия пероксидом водорода, который включает помещение изделия в кожух, содержащий в основном неводный комплекс пероксида водорода, герметизацию кожуха и выдерживание кожуха при около атмосферном давлении и при температуре ниже около 70oC, более предпочтительно ниже около 40oC, в течение времени, достаточном для выделения в основном неводного пара пероксида водорода из комплекса, осуществляя тем самым стерилизацию изделия. Кожух может быть выдержан при давлении меньшем, чем атмосферное давление, и/или нагрет до температуры более чем 23oC для облегчения выделения пара. Кожух может представлять собой мешок, контейнер, камеру или комнату. Комплекс пероксида водорода может быть в виде порошка или таблетки. Стадия герметизации может включать герметизацию кожуха с помощью газопроницаемого материала, такого как TYVEKTM, CSP обертка или бумага.
Другой аспект изобретения относится к герметизированному кожуху, содержащему стерильный продукт и в основном неводный комплекс пероксида водорода, способный выделять пар пероксида водорода.
Очередной аспект изобретения относится к способу стерилизации с помощью пероксида водорода изделия, имеющего экстерьер и узкий люмен в нем. Этот способ включает присоединение сосуда, содержащего в основном неводный комплекс пероксида водорода, к люмену изделия, помещение изделия внутрь контейнера, вакуумирование контейнера и контактирование люмена изделия с паром пероксида водорода, выделяемом из в основном неводного комплекса пероксида водорода, при температуре менее чем около 70oC. В предпочтительном варианте осуществления изобретения способ может также включать контактирование экстерьера изделия со вторым источником стериланта, таким как стерилант, который выделяет пар пероксида водорода. Этот пар пероксида водорода от второго источника стериланта может выделяться из второго в основном неводного комплекса пероксида водорода. В этом варианте воплощения изобретения, второй в основном неводный комплекс пероксида водорода может быть тем же самым или другим комплексом, таким как комплекс пероксида водорода, упоминаемый в стадии присоединения. Способ может также включать генерирование плазмы внутри контейнера, окружая изделие, и выдерживание изделия в плазме в течение времени, достаточном для осуществления стерилизации изделия. Далее, способ может включать генерирование плазмы внутри контейнера, для того чтобы окружить изделие, и выдерживание изделия в плазме в течение времени, достаточном для удаления остаточного пероксида водорода из изделия.
Следующий аспект настоящего изобретения относится к способу получения в основном неводного комплекса пероксида водорода. Этот способ включает стадии (а) вакуумирования камеры, которая содержит вещество, и (b) введение пара пероксида водорода в камеру, посредством чего пар пероксида водорода реагирует с веществом, образуя комплекс. Вещество может представлять собой спирт, простой эфир, кетон, кислоту, аминокислоту, сложный эфир, органическую соль, амин, амид, мочевину, биурет, полиамид, карбонат щелочного металла, гидроксид или тетранатрий пирофосфат. К некоторым особенно предпочтительным веществам относятся поли(виниловый)спирт), поли(винил метиловый эфир), поли(винил метил кетон), поли(акриловая кислота), глицин, L-гистидин, поли(винилацетат), ацетат целлюлозы, альгинат натрия, сульфат целлюлозы (натриевая соль), гистамин, глицин ангидрид, пропионамид, полиакриламид, поливинилпирролидон, поли(4-винилпиридин), найлон 6, пленка найлона 6,6, полиэфирполиуретан, карбонат натрия, карбонат калия, карбонат рубидия, бикарбонат натрия, гидроксид кальция и 1,3-диметилмочевина. В некоторых вариантах воплощения изобретения, пар пероксида водорода является в основном безводным.
К дополнительным аспектам настоящего изобретения относится комплекс поли(виниловый спирт)-пероксид водорода, комплекс поли(винил метиловый эфир)-пероксид водорода, комплекс поли(винил метилкетон)-пероксид водорода, комплекс поли(акриловая кислота)-пероксид водорода, комплекс поли(винилацетат)-пероксид водорода, комплекс ацетат целлюлозы-пероксид водорода, комплекс альгинат натрия-пероксид водорода, комплекс сульфат целлюлозы, натриевая соль, пероксид водорода, комплекс глицин-пероксид водорода, комплекс поли(4-винилпиридин)-пероксид водорода, комплекс гистамин-пероксид водорода, комплекс пропионамид-пероксид водорода, комплекс 1,3-диметилмочевина-пероксид водорода, комплекс биурет-пероксид водорода, комплекс полиакриламид-пероксид водорода, комплекс найлон 6-пероксид водорода, комплекс пленка найлона 6,6-пероксид водорода, комплекс полиэфирполиуретан-пероксид водорода и комплекс карбонат рубидия-пероксид водорода.
Другим аспектом изобретения является способ стерилизации паром пероксида водорода изделия, в котором изделие помещают в контейнер, и затем это изделие приводят в контакт с паром пероксида водорода для стерилизации изделия. В этом аспекте изобретения, пар выделяется из в основном неводного комплекса пероксида водорода, который не разлагается с выделением гидрогалоидной кислоты. Гидрогалоидная кислота определена здесь как кислота, состоящая из атома водорода и атома галоида, такая как HCl, HF, HBr и т.д.
Фиг. 1 представляет собой схему устройства для стерилизации паром настоящего изобретения.
Фиг. 2 представляет собой схему устройства для стерилизации паром настоящего изобретения, которое включает электрод, который произвольно используют для генерации плазмы.
Фиг. 3A представляет собой схему устройства, которое может быть использовано для нагревания пероксидных комплексов.
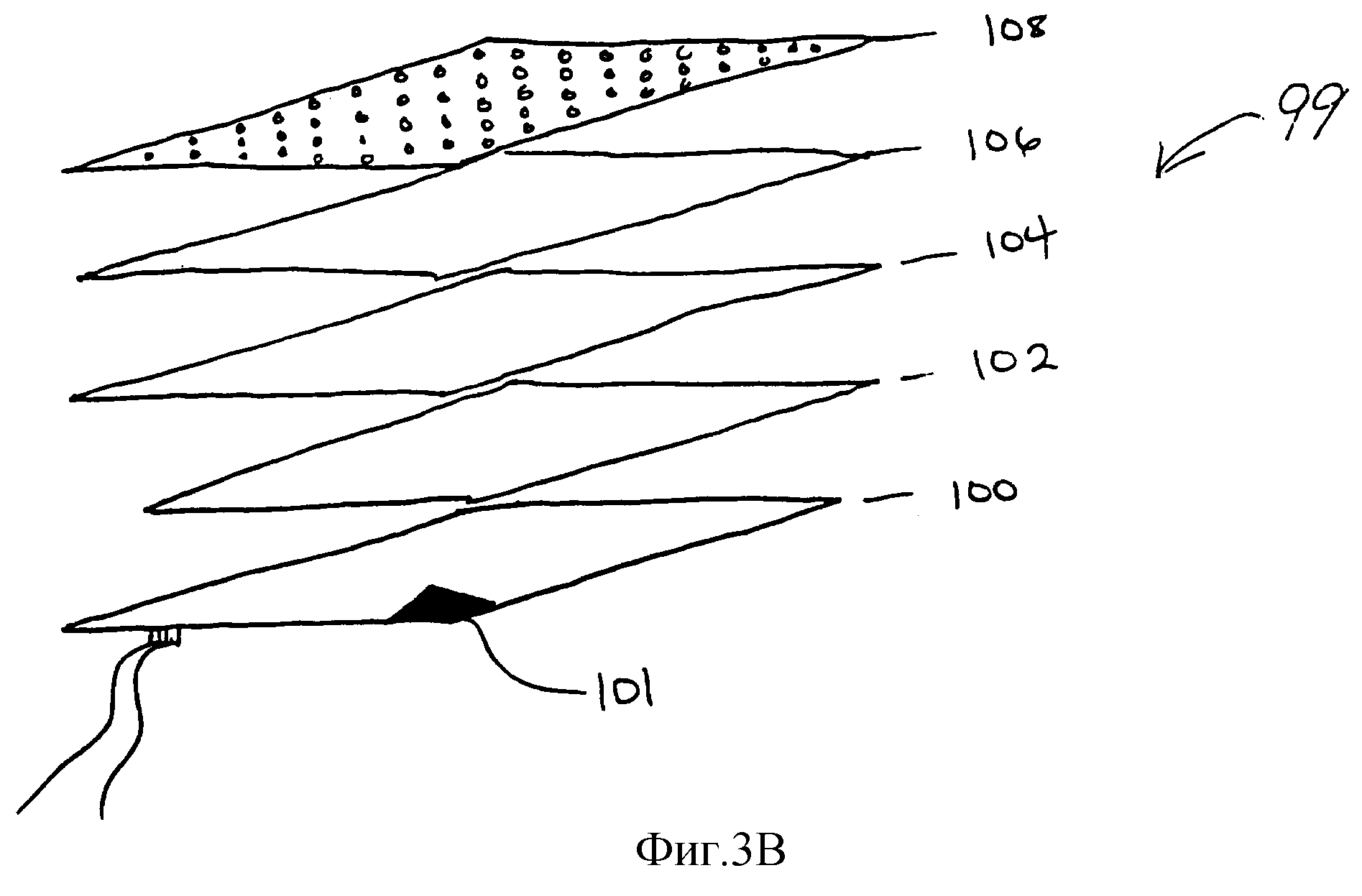
Фиг. 3B представляет собой схему предпочтительного контейнера для удержания источника пероксида для стерилизации, согласно данному изобретению.
Фиг. 4 представляет собой график выделения пара пероксида водорода из вакуумированного комплекса пероксида водорода.
В стерилизаторах с пероксидом водорода, которые использовали в прошлом, неизменно использовали водный раствор пероксида водорода как источник стериланта. Эти стерилизаторы имеют недостатки, вызванные присутствием воды в системе. При более высоком давлении, таком как атмосферное давление, избыток воды в системе может вызвать конденсацию. Это требует проведения экстрастадии для уменьшения относительной влажности атмосферы в кожухе, подвергаемом стерилизации, до приемлемого уровня, перед тем как вводить водный пар пероксида водорода. Эти стерилизаторы имеют также недостатки, вызванные теми фактами, что вода, имеющая более высокое давление пара, испаряется более быстро, чем пероксид водорода из водного раствора; и вода, имеющая более низкую молекулярную массу, диффундирует быстрее, чем пероксид водорода. Когда медицинское устройство или подобное ему помещают в стерилизатор, первоначальный стерилант из источника пероксида водорода, который достигает устройства, является разбавленным в сравнении с концентрацией источника. Разбавленный стерилант может быть барьером для стериланта, который прибывает позднее, в частности, если устройство, подлежащее стерилизации, представляет собой изделие такое, как эндоскоп, который имеет узкие люмены. Использование концентрированного раствора пероксида водорода в качестве источника в попытке преодолеть эти недостатки является неудовлетворительным, потому что такие растворы являются опасными.
В настоящем изобретении, недостатки стерилизаторов с пероксидом водорода предшествующего уровня техники преодолевают путем использования в основном неводного (т.е. в основном безводного) источника пероксида водорода, который выделяет пар в основном неводного пероксида водорода. В предпочтительном варианте воплощения изобретения, пар в основном неводного пероксида водорода получают прямо из в основном неводного комплекса пероксида водорода. Однако пар в основном неводного пероксида водорода может быть также генерирован из водного комплекса, который получают во время выпаривания для удаления воды, например, с помощью вакуумирования. Так, при проведении способа настоящего изобретения, в случае когда используют водный комплекс пероксида водорода, этот водный комплекс превращают в основном в неводный комплекс пероксида водорода. Предпочтительно в основном неводные комплексы пероксида водорода содержат менее чем около 20% воды, более предпочтительно не более чем около 10% воды, еще более предпочтительно не более чем около 5% воды и наиболее предпочтительно не более чем около 2% воды.
Как видно из предусмотренных выше предпочтительных процентных содержаний воды в в основном неводных комплексах пероксида водорода, используемых в настоящем изобретении, наиболее предпочтительными являются в основном свободные от воды комплекс пероксида водорода и пероксидный пар, генерируемый из него. Тем не менее, как также видно из этих чертежей, некоторое количество воды может присутствовать в системе. Некоторое количество этой воды может получаться при разложении пероксида водорода с образованием воды и кислорода в качестве побочных продуктов, и может происходить частичное водородное связывание этой воды в комплексе.
Влияние воды было определено в серии испытаний, когда камеру для стерилизации выдерживали при различных относительных влажностях. Условия испытаний были такими, как описано в примере 1, ниже, когда споры помещали на пластины из нержавеющей стали в 3 мм x 50 см люмены нержавеющей стали. Как показано в таблице 2, в условиях испытаний, 5% относительная влажность не оказывает влияния на эффективность, а 10% относительная влажность уменьшает скорость стерилизации. Этот пример показывает, что небольшие количество влаги допустимы в данной системе, когда пероксид водорода генерируется из неводного пероксидного комплекса и присутствие воды в системе можно преодолеть при помощи увеличения времени экспозиции.
Основным критерием для вещества источника пероксида водорода является взаимосвязь между его стабильностью и скоростью испарения пероксида водорода как функции температуры и давления. В зависимости от параметров процесса стерилизации, например давление, температура и т.д., более высокая или более низкая скорость испарения пероксида может быть предпочтительной, и нагревание источника пероксида может потребоваться, а может и не потребоваться. Потребность в нагревании пероксидного комплекса зависит от давления пара комплекса. Некоторые пероксидные комплексы имеют достаточно высокое давление пара, такое, что значительное количество пара пероксида водорода может выделиться без нагревания комплекса. В общем нагревание комплекса повышает давление пара пероксида водорода и ускоряет выделение пероксида водорода из комплекса.
Чтобы обеспечить желаемую высокую скорость испарения, источник должен предпочтительно иметь большую площадь поверхности. Так, источник может представлять собой тонкий порошок или покрытие на материале, который имеет большую площадь поверхности. Конечно, безопасность, доступность, стоимость материала также являются важными критериями. Было оценено выделение пероксида водорода из комплексов пероксида водорода с мочевиной, поливинилпирролидоном, найлоном-6, глицин ангидридом и 1,3-диметилмочевиной. Комплексы пероксида водорода с мочевиной, поливинилпирролидоном, найлоном-6 и глицин ангидридом представляют собой твердые вещества. 1, 3-диметилмочевина-пероксидный комплекс является жидкостью. 1,3-диметилмочевина-пероксидный комплекс менее стабильный комплекс при пониженном давлении, чем другие изученные комплексы, и в условиях вакуума большая часть пероксида водорода может выделиться из комплекса без надобности дополнительного нагревания. Комплекс мочевина-пероксид водорода доступен в таблеточной форме от Fluka Chemical Corp., Ronkonkoma, N 4 и в форме порошка от Aldrich Chemical Ca, Milwaukеe, WI. Этот комплекс известен как мочевина пероксид, комплекс мочевина-пероксид водорода, пероксидная мочевина, пероксид мочевиновый аддукт, мочевина пероксидный аддукт, перкарбамид, карбамид пергидрат и карбамид пероксид. Используемый здесь термин "пероксид мочевины" распространяется на все вышеприведенные термины.
Комплекс поливинилпирролидон-пероксид водорода (PVP • H2O2) может быть получен по способу, раскрытому в International Application Pub. N WO 92/17158 (публикации Международной заявки N WO 92/17158). Альтернативно, комплексы с PVP, с найлоном-6, с 1,3-диметилмочевиной и с глицин ангидрином, так же как и с другими органическими и неорганическими соединениями, могут быть получены по способу, раскрытому подробно ниже.
Достижение приемлемых скоростей испарения безводного пероксидного пара до источника можно облегчить с помощью повышенных температур и/или с помощью пониженного давления. Так, нагреватель для пероксидного источника и/или вакуумный насос для вакуумирования стерилизационной камеры предпочтительно представляют собой часть стерилизатора. Предпочтительно, источник покрывают слоем газопроницаемого материала, таким как TYVEKTM нетканое полиэтиленовое волокно, нетканый полипропилен, такой как SPUNGUARDTM, или подобным материалом, который позволяет пероксидному пару проходить, но не позволяет проходить веществу, комплексующему пероксид. Перфорированный алюминий или другой приемлемый перфорированный материал может быть также использован в качестве покрытия.
Чертеж 3A представляет устройство 80, которое может быть использовано для определения выделения пероксида водорода из комплексов пероксида водорода в условиях различных температур. В этом устройстве, алюминиевая ванночка 90 покрыта газопроницаемым слоем 92, таким как слой медицинского сорта TYVEKTM. Ванночку 90 помещают сверху нагреваемой подкладки 94, которую помещают в ванночку из пирекса 96. Термопарный термометр 98 помещают снаружи ванночки 90 приблизительно в 1 см от ее дна.
На фиг. 3B представлен предпочтительный контейнер 99 для удерживания пероксидного источника. Контейнер 99 включает металлическую тарелку 100, например алюминиевую тарелку, с необязательно прикрепленным нагревателем, используемым для нагревания твердого пероксидного комплекса. Регулятор температуры 101, такой как термометр, может быть помещен на тарелке 100 для контроля температуры. Пероксидный комплекс размещают непосредственно на тарелке 100. Альтернативно, для того чтобы обеспечить равномерное нагревание всего пероксидного комплекса, пероксидный комплекс можно разместить между одним или более алюминиевыми экранами 102, 104, расположенными сверху тарелки 100. Алюминиевые экраны 102, 104 обеспечивают более высокую площадь поверхности и одинаковое нагревание комплекса, когда требуется использовать комплекс в большем количестве. Пероксидный комплекс, или экран, или экраны 102, 104 затем покрывают газопроницаемым слоем 106, таким как слой медицинского сорта TYVEKTM или SPUNGUARDTM, так, чтобы пероксид водорода, выделяемый из комплекса, проходил через покрытие 106 перед диффузией в остальную часть камеры. Перфорированную алюминиевую тарелку 108 произвольно располагают сверху "TYVEKTM" или "SPUNGUARD" слоя 106, чтобы обеспечить давление, которое удерживает комплекс в контакте с нагреваемой тарелкой 100, и чтобы гарантировать одинаковое нагревание пероксидного комплекса.
Только что описанное устройство обеспечивает равномерное нагревание комплекса, что приводит к повышенному количеству пара пероксид водорода, способному выделиться из пероксидного комплекса.
Фиг. 1 изображает схему устройства стерилизации паром пероксида водорода настоящего изобретения. Камера 10 удерживает изделие 12, которое подлежит стерилизации, и которое, для удобства, помещают на полку 14. Дверца 16 обеспечивает доступ во внутреннюю часть камеры. Неводный источник пероксида водорода 18 изображен на дополнительном нагревателе 20, который контролируется при помощи регулятора температуры 22. Концентрацию пероксида можно контролировать при помощи дополнительного монитора 24. При необходимости, камеру 10 можно вакуумировать, используя насос 26; однако стерилизацию можно проводить и при атмосферном давлении.
Контейнер, который удерживает изделия, подлежащие стерилизации, может быть обычной камерой для стерилизации, которую вакуумируют, или он не может быть контейнером (или комнатой) при атмосферном давлении.
Время, необходимое для стерилизации изделий, зависит от природы, количества и упаковки изделий и их размещения в камере. Альтернативно, это может быть камера сама по себе (или целая комната), которая подлежит стерилизации. В любом случае, оптимальные времена стерилизации могут быть определены эмпирически.
Использование пульсации давления для улучшения проникновения и повышения противомикробной активности стерилизующих газов, что хорошо известно в области стерилизации, может быть также применено к способу с неводным пероксидом водорода. Как детально описано ниже, плазма может быть также использована для дополнительного повышения активности.
По завершении способа стерилизации избыток пероксида водорода может быть удален из устройств, которые имеют сродство к пероксиду, путем замещения воздухом, вводимым в контакт с устройствами. Это может быть осуществлено путем пропускания теплого воздуха через устройства в течение продолжительного времени или путем вакуумирования камеры.
Изделия, которые прежде были стерилизованы путем воздействия паром пероксида водорода, могут быть также экспонированы в плазме для удаления остаточного пероксида водорода, который мог остаться на изделиях. Поскольку пероксид водорода разлагается на нетоксичные продукты во время обработки плазмой, стерилизуемые изделия можно использовать без необходимости в каких-либо дополнительных стадиях.
Желательно изолировать пероксидный источник от стерилизатора после того, как выделится пероксидный пар, для того чтобы избежать повторной абсорбции пара или, когда используют плазму, чтобы избежать воздействия плазмы на источник. Изолирование также полезно, когда используемый комплекс нестабилен под вакуумом. Изолирование можно осуществить, используя вентили или другие устройства, хорошо известные в данной области техники.
На фиг. 2 изображена схема системы стерилизации плазмой пероксида водорода настоящего изобретения. Стерилизацию можно выполнить с или без использования плазмы. Плазму можно использовать для повышения спорицидной активности пероксида пара и/или для удаления какого-либо остаточного пероксида водорода, оставшегося на стерилизованных изделиях.
Стерилизацию выполняют в камере 30, которая содержит дверцу или окно 32, через которое могут быть введены изделия, подлежащие стерилизации. Камера 30 имеет выходное отверстие 34 к вакуумному насосу 36, посредством которого камеру можно вакуумировать. Выходное отверстие 34 содержит вентиль 38 для изоляции камеры от вакуумного насоса 36. Камера 30 также имеет входное отверстие 40, связанное с кожухом 42, который содержит комплекс пероксида водорода. Входное отверстие 40 имеет вентиль 44, который дает возможность кожуху 42 быть изолированным от камеры. Система для стерилизации также имеет входное отверстие 41, которое соединяет кожух 42 и вакуумный насос 36, который имеет вентиль 43. Эта система позволяет проводить одновременное вакуумирование как кожуха 42, так и камеры 30, или независимое вакуумирование либо кожуха 42, либо камеры 30. Вакуумирование контролируют путем открытия или закрытия вентилей 38, 44 и 43. Как очевидно для специалиста средней квалификации в данной области, два насоса, по одному для каждой камеры, могут быть также использованы в данной системе.
Кожух 42 содержит
дополнительный нагреватель 49, связанный с регулятором температуры 46 для контроля температуры комплекса пероксида водорода. Концентрацию комплекса пероксида водорода в паровом состоянии можно
контролировать при помощи дополнительного пероксидного монитора 48. Внутренняя часть камеры содержит радиочастотный (РЧ) электрод 50, к которому прикреплена спаренная сетка 52 и РЧ блок питания 54.
Удобной формой для электрода является перфорированный цилиндр, окружающий образцы и открытый с обоих концов. Обычный принцип действия настоящего изобретения выглядит следующим образом:
1.
Изделия 56, подлежащие стерилизации, помещают в камеру 30.
2. Камера 30 может находиться при атмосферном давлении или, альтернативно, может быть вакуумирована для облегчения проникновения пероксида водорода. Вакуумирование осуществляют путем открытия вентиля 38 и поворота на вакуумный насос 36. Альтернативно, как камера 30, так и кожух 42 могут быть вакуумированы путем открытия вентилей 38 и 44 и/или 43.
3. Вентили 38 и 43 закрывают, чтобы изолировать вакуумный насос 36 от камеры 30 и кожуха 42, и открывают вентиль 44. Пар пероксида водорода выделяется в камеру 30 из источника пероксида водорода, который может быть нагрет для облегчения выделения пара пероксида водорода. Произвольно, можно также добавить воздух или инертный газ.
4. Изделия 56, подлежащие стерилизации, либо обрабатывают паром пероксида водорода пока не стерилизуют, или предварительно обрабатывают паром пероксида водорода в камере 30, до того как генерируют плазму достаточной мощности для стерилизации. При необходимости, камера 30 может быть вакуумирована в это время, чтобы облегчить генерирование плазмы. Продолжительность периода преплазменного выдерживания зависит от типа используемой упаковки, природы и количества предметов, подлежащих стерилизации, и размещения предметов в камере. Оптимальные времена могут быть определены эмпирически.
5. Изделие 56 подвергают обработке в плазме, используя питание от РЧ источника питания 54 для РЧ электрода 50. Используемая РЧ энергия для генерирования плазмы может быть пульсирующей или непрерывной. Изделия 56 остаются в плазме в течение периода времени, достаточного для осуществления полной стерилизации и/или удаления остаточного пероксида водорода. В некоторых вариантах воплощения изобретения, используют плазму от 5 до 30 минут. Однако оптимальные времена могут быть определены эмпирически.
При использовании в настоящем описании и формуле изобретения, полагают, что термин "плазма" включает в себя любую часть газа или пара, которая содержит электроны, ионы, свободные радикалы, диссоциированные и/или возбужденные атомы или молекулы, полученные в результате приложенного электрического поля, включая любую сопутствующую радиацию, которая может быть получена. Приложенное поле может покрывать широкий частотный диапазон; однако обычно используют радиочастоту или микроволны.
Неводная система выделения пероксида водорода, раскрываемая в настоящем изобретении, может быть также использована с плазмами, генерированными по способу, раскрытому в ранее упомянутом патенте США 4643876. Альтернативно, она может быть использована с плазмами, описанными в патенте США 5115166 или 5087418, в которых изделие, подлежащее стерилизации, размещают в камере, которая отделена от источника плазмы.
Только что описанное устройство особенно полезно при использовании комплексов пероксида водорода, которые нестабильны в вакууме. Существуют, по крайней мере, два возможных способа, которые могут быть использованы для того, чтобы минимизировать потерю пероксида во время стадии вакумирования. Во-первых, небольшую камеру можно вакуумировать независимо. Во-вторых, если используют достаточно небольшую камеру, то нет необходимости небольшую камеру вакуумировать совсем.
Одним таким нестабильным неводным пероксидным комплексом является глициновый ангидрид-пероксид. Это соединение выделяет пар пероксида водорода, будучи помещенным в вакуум. Фиг. 4 представляет собой график, иллюстрирующий выделение пара пероксида водорода из глицинового ангидрид-пероксидного комплекса в вакууме. Используемая методика выделения пероксида водорода из комплекса с глициновым ангидридом выглядит следующим образом: (1) Главный сосуд 30 вакуумируют, когда вентили 43 и 44 закрыты. (2) Камеру, содержащую комплекс пероксида водорода 42, вакуумируют, когда вентили 38 и 44 закрыты и вентиль 43 открыт. (3) Вентиль 43 закрывают и вентиль 44 открывают, и пару пероксида водорода дают возможность диффундировать в камеру 30.
Как показано на графике, пар пероксида водорода выделяется из комплекса, по мере того как давление падает, даже без дополнительного нагревания. Как показано на фиг. 4, выделение пероксидного пара существенно возрастает при нагревании комплекса до более высокой температуры. Таким образом, даже нестабильные пероксидные комплексы используют в способе стерилизации настоящего изобретения.
Настоящее изобретение обеспечивает, по
крайней мере, четыре преимущества перед более ранними системами стерилизации с помощью пероксида водорода:
1. Обходят использование концентрированных, потенциально опасных растворов пероксида
водорода.
2. Устраняют необходимость понижать заранее относительную влажность площадей, подлежащих стерилизации, для того, чтобы предотвратить конденсацию.
3. Вода в основном удаляется из системы, так что имеет место незначительная конкуренция между водой и пероксидом водорода для диффузии в длинные узкие люмены.
4. Часто может быть исключена необходимость присоединения специального сосуда для доставки стерилизующих газов в длинные узкие люмены.
То, что стерилизацию можно осуществить, используя пар пероксида водорода при существенном отсутствии влаги, представляет собой одно из удивительных открытий настоящего изобретения. Предшествующий уровень техники указывает на то, что требуется присутствие воды для выполнения стерилизации в способах стерилизации химического газа или в паре. Полезно, что настоящее изобретение в основном устраняет воду из системы, что приводит к более быстрой, более экономичной и более эффективной стерилизации.
Эффективность стерилизации различных неводных комплексов пероксида водорода определяют, как описано ниже в примерах 1-4.
Пример 1
Данные по эффективности получают с паром пероксида водорода, выделяемом из в основном безводного мочевина-пероксидного комплекса, используя споры Bacillus subtilis var. (niger) в металлических и
TEFLONTM пластиковых люменах в качестве биологического контрольного заражения.
A. Методики испытания
1. Оборудование
Четыре грамма измельченной таблетки
аддукта пероксид водорода-мочевина (Fluka Chemical Corp., Ronkonkoma, NY) помещают в алюминиевую ванночку 90, как описано на фиг. 3A. Сверху ванночку 90 покрывают медицинского сорта TYVEKTM
92 (способная пропускать газы штапельная клееная полиэтиленовая ткань), так что любой пероксид водорода, выделяемый из комплекса,
вынужден был проходить через TYVEKTM покрытие
перед диффундированием в остальную камеру. Алюминиевую ванночку 90 помещают на нагревательную подкладку 94 в диске из пирекса 96, расположенного на дне алюминиевой стерилизационной камеры (см. фиг.
1). Стерилизационная камера, которая имеет объем приблизительно 173 литра, также содержит:
Монитор пероксида водорода для измерения концентрации пероксида водорода в паровой фазе.
Датчик температуры для контроля температуры нагревательной подкладки.
Инжекционный порт, через который жидкий пероксид водорода может быть введен в камеру.
Металлическая полка, на которую помещают пластиковый поднос, содержащий устройства с люменами для испытания.
Электрические резистные нагреватели на внутренних стенках камеры, которые поддерживают температуру в камере при 45oC во время проведения испытаний.
2. Биологическое контрольное заражение и испытание
Для оценки эффективности неводной
пероксидной системы подачи биологическое контрольное заражение, состоящее из 1,04 • 106 B. Subtilis var. (niger) спор, на лезвии скальпеля из нержавеющей стали помещают на равном
расстоянии от каждого конца люмена из нержавеющей стали размерами 3 мм ВД x 40 см в длину, 3 мм ВД x 50 см в длину и 1 мм ВД x 50 см в длину. Эти ВД и длины типичны для металлических люменов,
используемых в медицинских устройствах. Камера в середине каждого люмена, которая содержала кусочек биологического теста, имела размеры 13 мм ВД x 7,6 см в длину. В биологическом тестировании с
металлическими люменами оценивали всего 9 люменов на тест. Они включали 3 люмена от каждой из 3 различных серий ВД и длин, имеющихся в распоряжении.
Аналогичные испытания проводили с биологическим контрольным заражением, состоящем из 4,1 • 105 B. Subtilis var. (niger) спор на бумажной полоске (6 мм x 4 мм Whatman # 1 хроматографическая бумага), расположенной на равном расстоянии от концов TEFLONTM люменов размерами 1 мм ВД x 1 метр в длину, 1 мм ВД x 2 метра в длину, 1 мм ВД x 3 метра в длину и 1 мм ВД x 4 метра в длину. Центральная камера этих люменов, которая содержала биологический тестовый кусок, имела размеры 16 мм ВД x 7,6 см в длину. В биологическом тестировании с TEFLONTM люменами оценивали всего 12 люменов на тест, 3 люмена от каждого из 4 различных длин, имеющихся в распоряжении.
Люмены, содержащие биологические тестовые пробы, помещают на пластиковый поддон, который затем помещают на полку стерилизационной камеры. Затем дверцу камеры закрывают и камеру вакуумируют до давления 0,2 Торр с помощью вакумного насоса. Алюминиевую ванночку, содержащую аддукт пероксид водорода-мочевина, затем нагревают до температуры от 80 до 81oC в течение периода 5 минут, измеряемой термопарным термометром, помещенным на боковой стенке алюминиевой ванночки приблизительно в 1 см от дна ванночки. В течение этого времени концентрация пероксида водорода в камере, измеряемая с помощью пероксидного монитора, увеличивается до 6 мг/л.
Биологические тестовые пробы подвергают воздействию пара пероксида водорода на протяжении периода времени 5, 10, 15, 20 и 25 минут. После воздействия пара пероксида водорода биологические тестовые пробы асептически переносят в 15 мл trypticase соевого бульона, содержащего 277 единиц каталазы для нейтрализации остатков пероксида водорода, которые могут остаться на пробах для испытания. Все пробы инкубируют в течение 7 дней при 32oC и наблюдают в течение роста.
Проводят также сравнительные исследования, при которых 50% водный раствор пероксида водорода инъецируют в стерилизационную камеру и испаряют из нагреваемого инжектора (нагреваемая металлическая поверхность). Инъецируемый объем раствора пероксида водорода дает концентрацию пероксида водорода в паровой фазе 6 мг/л. Тестовые люмены и используемые в этих испытаниях биологические пробы для испытания идентичны люменам и биологическим пробам, используемым в испытаниях с неводным пероксидом водорода. Манипулирование биологическими тестовыми пробами после воздействия на них пероксида водорода также было аналогичным.
B. Результаты испытаний
Результаты этих испытаний с люмена из нержавеющей стали и
TEFLONTM, которые представлены в таблицах 3 и 4 соответственно, иллюстрируют преимущества неводной системы поставки пероксида водорода как в случае с металлическими люменами, так и с
неметаллическими люменами. Полное уничтожения бактериальных спор достигается в пределах 5 минут в случае неводной системы доставки пероксида водорода для люменов с самым маленьким ВД и наиболее
длинным. В то же самое время для случая 50% раствора пероксида водорода полного уничтожения бактериальных спор не достигается даже после 25-минутного времени диффузии.
Факт, что быстрая стерилизация может быть проведена в отсутствии существенных количеств воды удивителен, в свете того факта, что влага обычно присутствует во время химической газо/парофазной стерилизации с помощью различных стерилантов, отличных от пероксида водорода. Так как парофазные системы стерилизации пероксидом водорода используют водные растворы пероксида водорода, влага присутствует в этих системах также.
Чтобы испытать эффективность стерилизации различных других пероксидных комплексов, проводят следующие эксперименты.
Примеры 2, 3, и 4
Устройства примера 1 используют для тестирования эффективности комплекса поливинилпирролидон-пероксид водорода (пример 2), комплекса найлон 6-пероксид водорода (пример 3), комплекса 1,
3-диметилмочевина-пероксид водорода (пример 4). Эти соединения синтезируют согласно способу, раскрываемому ниже в примерах 12 и 13. Параметры испытания приведены в табл. А.
В каждом случае, подложки для опор представляли собой 6 мм x 4 мм бумажные субстраты в пластиковых люменах и лезвия из нержавеющей стали в люменах из нержавеющей стали. Результаты этого испытания на эффективность представлены ниже в таблице 5.
Результаты, представленные в таблице 5, показывают, что каждый из тестируемых комплексов пероксида водорода генерирует пероксидный пар, который обеспечивает эффективную стерилизацию только после пяти минутной экспозиции.
Температура, требуемая для выделения пара пероксида водорода из твердого комплекса, которая показана выше, представляет собой температуру, измеренную термопарой, расположенной снаружи алюминиевой ванночки, приблизительно в 1 см от дна ванночки. Дальнейшее испытание с использованием термометра, такого как fluoroptic термометр, помещенный на внутренней поверхности дна ванночки, показало, что температура на дне ванночки была приблизительно на 30-35oC выше, чем описано в примере 5 ниже. Таким образом, в предыдущем номере температура на дне ванночки была приблизительно 110-115oC, в то время как термопара показывала 80oC, и температура на дне ванночки была приблизительно 140-145oC, в то время как термопара показывала 110oC.
Пример 5
Чтобы определить температуру на дне алюминиевой ванночки,
используемой для удержания твердого пероксидного комплекса, fluoroptic термометр приклеивают лентой на наружную поверхность дна алюминиевой ванночки. OmegaTM термопарный термометр помещают
снаружи алюминиевой ванночки, приблизительно в 1 см от дна ванночки. Проводили три замера температуры. Каждый раз ванночку нагревают до требуемой температуры, показываемой термометром, расположенным
на стороне ванночки, дают возможность охладиться и затем вновь нагревают до требуемой температуры. Регистрируемые температуры представлены в табл. B.
Эти результаты показывают, что температура на дне алюминиевой ванночки была приблизительно на 30-35oC выше, чем температура, указанная термопарным термометром, расположенным на стороне ванночки.
Кроме того, проводят испытание, чтобы сравнить данные по эффективности, получаемые с использованием водного и неводного источника пероксида в открытой (не-люменовой) системе. Эксперименты описаны детально ниже.
Пример 6
Устройство примера 1 используют с биологическим контрольным заражением, которое состоит из 6,8 • 105 B. subtilis var. (niger) спор на 6 мм x 4
мм полоске Whatman # 1 хроматографической бумаги, упакованной в TYVEKTM/MYLARTM оболочку. (TYVEKTM представляет собой газопроницаемое волокно, изготовленное из
полиэтилена. MYLARTM представляет собой газонепроницаемый полиэфирный материал.) Упакованные полоски с контрольным биологическим заражением помещают спереди, в середине и сзади поддона из
полифениленоксида, который содержит гибкий волоконно-оптический сигмоидоскоп. Поддон помещают в контейнер из полифениленоксида, который имеет одно отверстие в верхней части и два отверстия на дне для
диффузии. Отверстия с 4-дюймовым диаметром покрывают способным пропускать газы полипропиленовым упаковочным материалом (SPUNGUARDTM Heavy Duty Sterilization Wrap, Kimberly-Clark, Dallas.
TX') для поддержания стерильности содержимого контейнера после стерилизации. Контейнер помещают в устройство примера 1 и понижают давление в камере до 0,2 Торр. Затем алюминиевую ванночку, содержащую
2 грамма аддукта пероксид водорода-мочевина (Fluka Chemical Corp.), нагревают до температур от 80 до 81oC, измеряемой с помощью термопарного термометра, помещенного снаружи алюминиевой
ванночки приблизительно в 1 см от дна алюминиевой ванночки, в течение 5 минут, для того чтобы обеспечить в камере 3 мг/л пара пероксида водорода. Биологические тестовые пробы подвергают воздействию
пара пероксида водорода в течение 5 и 10 минут. После экспозиции тестовые образцы подвергают той же самой обработке, как в примере 1.
Проводят также сравнительные исследования, в которых 50% водный раствор пероксида водорода инъецируют в стерилизационную камеру и испаряют из нагреваемого инжектора. Объем инъецируемого раствора пероксида водорода дает концентрацию пара 3 мг/л. Конфигурация при испытании, состав биологических тестовых проб и обработка биологических тестовых проб после экспозиции были идентичны аналогичным параметрам, используемым в испытаниях с неводным пероксидом водорода. Результаты этих испытаний представлены в таблице 6.
Результаты этих испытаний указывают на более высокую эффективность неводного способа по сравнению со способом с водным пероксидом водорода в "открытой" системе, в которой биологическую пробу не помещают в люмен. Снова, неожиданно обнаружено, что неводная система обеспечивает превосходную стерилизацию, даже когда не требуется диффузия пероксида водорода в длинный и узкий люмен. Это подтверждает, что способ действия пероксида водорода не является тем же самым для систем с и без воды.
Далее проводились испытания по определению эффективности пара неводного пероксида при нормальном, непониженном давлении. Это испытание детализировано ниже.
Пример 7
Проводят
испытания на эффективность пара пероксида водорода, выделяемого из мочевина-пероксидного комплекса в открытой системе при атмосферном давлении. В этом испытании хирургические лезвия из нержавеющей
стали с биологическим контрольным заражением 1,04 • 106 B. subtilis var. (niger) спорами упаковывают в TYVEKTM/MYLARTM оболочку. Упакованные лезвия с
биологическим контрольным заражением помещают спереди, в середине и сзади поддона из полифениленоксида. Поддон помещают в устройство примера 1 и дверцу камеры закрывают. Алюминиевую ванночку,
содержащую 4,0 г пероксида мочевины (Fluka Chemical Corp.) нагревают до температуры от 80oC до 81oC, измеряемой термопарным термометром, помещенным на стороне алюминиевой
ванночки приблизительно в 1 см от дна ванночки, в течение времени, отведенного испытанию. Биологические тестовые пробы подвергают воздействию пара пероксида водорода на протяжении периода 5, 10, 20 и
30 минут. После экспозиции тестовые пробы подвергают обработке тем же самым путем, как в примере 1. Результаты этих испытаний представлены в таблице 7 и демонстрируют эффективность способа с неводным
пероксидом в открытой системе при атмосферном давлении.
Далее были проведены испытания, чтобы определить приблизительное количество пероксида, выделяемого из пероксид-мочевинового комплекса при различных температурах. Это испытание описано в примере 8.
Пример 8
Порошок пероксида мочевины, полученный измельчением коммерчески доступных таблеток (Fluka
Chemical Corp.), помещают между двумя алюминиевыми экранами в устройство согласно фиг. 3В, имеющее размеры 12,7 см x 12,7 см. Затем алюминиевую тарелку нагревают и температуру контролируют, используя
термометр, расположенный вблизи угла алюминиевой тарелки. В таблице 8 приводится приблизительный процент выделившегося пероксида при различных температурах после нагревания в течение пяти минут.
Результаты показывают, что приблизительно 100% пероксида выделяется из комплекса при температуре 140oC. При более низких температурах выделяется меньшее процентное содержание пероксида.
Способность выделять пар пероксида водорода при комнатной температуре и атмосферном давлении дает возможность пероксидным комплексам, таким как мочевина-пероксидный комплекс, быть эффективными при использовании их в различных стерилизационных применениях. Они могут быть использованы не только в стерилизационном устройстве настоящего изобретения, описанного выше, соединения настоящего изобретения могут быть также использованы как часть самостерилизующих упаковочных материалов или могут применяться на подложках, таких как марля, губка, вата и тому подобное. Соединения предусматриваются для стерилизации герметичных упаковок при комнатной температуре или при повышенных температурах и, в частности, используются для стерилизации упаковочных медицинских или хирургических продуктов.
Конкретные применения соединений настоящего изобретения описаны в примерах, следующих ниже. Пероксидный комплекс, используемый в последующих примерах, представляет собой пероксид мочевины в форме таблетки (Fluka Chemical Corp.) или в виде порошка, полученного измельчением таблеток.
Пример 9
Самостерилизующийся мешок
монтируют следующим образом: Хирургический скальпель, имеющий 3,8 • 105 B. subtilis var. niger спор на своей поверхности, помещают на стерильную чашку Петри. Чашку Петри помещают на
большую чашку Петри вместе с 1 г мочевина-пероксидного комплекса в форме либо таблетки, либо порошка. Чашку Петри большего размера затем помещают в мешок, сделанный из TYVEKTM/MYLARTM (газопроницаемый, таблица 9), MYLARTM/MYLARTM (газонепроницаемый, таблица 10) или Бумага/MYLARTM ( газонепроницаемый, таблица 10). Затем мешок
герметизируют.
Каждый мешок подвергают воздействию различных температур в течение различных периодов времени, как представлено в таблицах 9 и 10 ниже. Биологические тестовые пробы оценивают в стерилизации, как описано в примере 1. Результаты представлены в таблицах 9 и 10, причем "+" знак указывает на бактериальный рост.
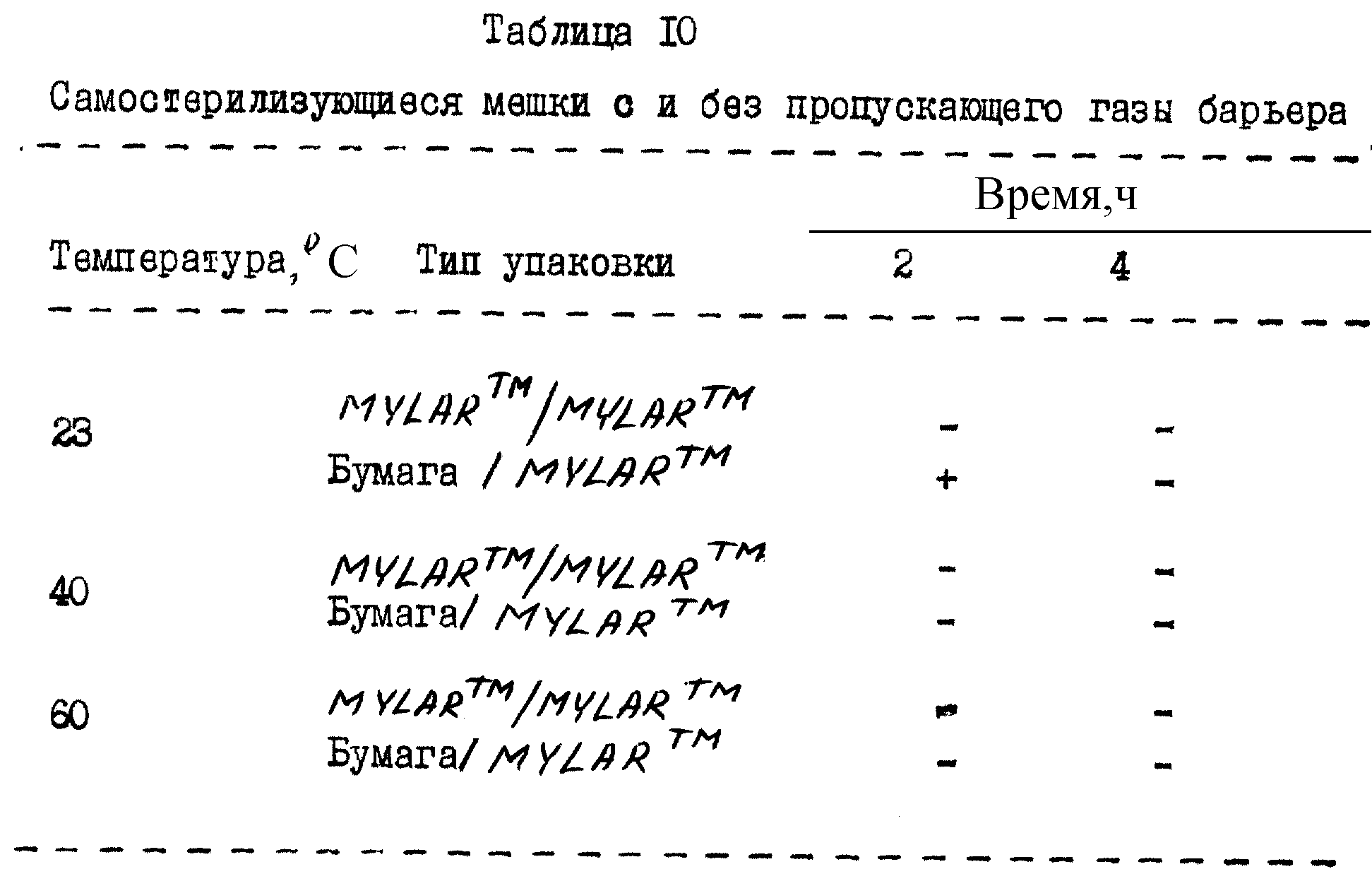
Таблица 10 иллюстрирует данные по эффективности для самостерилизующихся мешков с (Бумага/MYLARTM) и без (MYLARTM/MYLARTM) пропускающего газы барьера. Мешки конструировали так же, как описано выше, однако источником пероксидного пара был пероксид мочевины только в виде порошка.
Результаты этого испытания демонстрируют, что мочевина-пероксидный комплекс настоящего изобретения, включенный в мешок с и без пропускающего газы барьера, обеспечивает эффективную стерилизацию изделия внутри мешка в отсутствии влаги при комнатной температуре и атмосферном давлении только после от 2 до 3 часов. При более высоких температурах стерилизация осуществляется только после одного часа.
Для определения эффективности стерилизационной системы настоящего изобретения в закрытом контейнере был проведен следующий эксперимент.
Пример 10
Самостерилизующийся контейнер монтируют следующим образом: Подложку из нержавеющей стали, имеющую 3,8
• 105 B. subtilis var, niger спор на своей поверхности (таблица 11) или имеющую 9,2 • 105 B. subtilis var. niger спор на своей поверхности (таблица 12), помещают
внутрь маленькой полиэтиленовой (PE)пробирки, имеющей 20 отверстий (размером 3/16 дюйма) на своей поверхности. Пробирку помещают в PE пробирку большего размера, которую покрывают либо воздушно-плотным
колпачком или газопроницаемым слоем SPUNGUARDR (CSR обертки). Вторую PE пробирку, которая также имеет 20 отверстий (размером 3/16") на своей поверхности, также заключают в большую пробирку.
Эта пробирка содержит 1 грамм пероксида мочевины либо в виде порошка, либо в виде таблетки, и ее герметизируют либо в SPUNGUARDTM (CSR обертка), либо TYVEKTM мешке.
Каждый контейнер подвергают воздействию различных температур в течение различных периодов времени, как показано в таблицах 11 и 12 ниже. Биологические тестовые пробы оценивают в стерилизации, как описано в примере 1. Результаты включены в таблицы 11 и 12, причем "+" знак указывает на бактериальный рост.
Результаты этого испытания демонстрируют, что неводный комплекс пероксида мочевины, включенный в контейнер с и без пропускающего газы барьером, обеспечивает эффективную стерилизацию при комнатной температуре только после 3-4 часов. При более высоких температурах стерилизация осуществляется уже после получаса.
Установлено, что неводные пероксидные комплексы, которые выделяют пероксидный пар, полезны для стерилизации изделий при комнатной температуре и более эффективны при более высоких температурах. Эти комплексы можно поместить в мешок, контейнер, камеру, комнату или какое-либо пространство, способное стать герметизированным, где они выделяют пероксидный пар, который эффективно стерилизует изделия. Комплексы можно нагревать для облегчения выделения пара и для обеспечения стерилизации за более короткое время, чем время, требуемое для стерилизации при комнатной температуре. Поэтому соединения настоящего изобретения используют в целом ряде применений, где требуется стерилизация. Стерилизации можно достигнуть просто путем помещения комплексов в герметизированное пространство, содержащее изделие или изделия, подлежащие стерилизации. В противоположность способам предшествующего уровня техники, нет необходимости контакта с влагой для обеспечения активации пероксида водорода.
Для подтверждения того, что, используя неводные пероксидные комплексы, стерилизацию можно осуществить за более короткое время при более низких давлениях, был проведен следующий эксперимент.
Пример 11
Самостерилизующийся контейнер монтируют следующим образом: Подложку из
нержавеющей стадии, имеющую 9,2 и 105 B. subtilis var. niger спор на своей поверхности, помещают во внутреннюю часть маленькой PE пробирки, имеющей 20 отверстий (размером 3/16 дюйма) на
своей поверхности. Пробирку помещают в PE пробирку большего размера, которую покрывают газопроницаемым слоем из CSR обертки (SPUNGUARDTM). Вторую PE пробирку, также имеющую 20 отверстий
(размером 3/16 дюйма) на своей поверхности, также включают в пробирку большего размера. Эта пробирка содержала 1 грамм пероксида мочевины либо в виде порошка, либо в форме таблетки. Затем подложку
герметизируют в CSR обертке или TYVEKTM мешке.
Большие пробирки помещают либо в 4,5 л камеру для стерилизации, либо 173 л камеру для стерилизации. Каждый контейнер выдерживают при давлении 100 Торр и температуре 23oC в течение 2 часов, как представлено в таблице 13. Биологические тестовые пробы оценивают в стерилизации, как описано в примере 1. Результаты представлены в таблице 13.
Эти результаты показывают, что неводный мочевина-пероксидный комплекс, включенный в контейнер с пропускающим газы барьером, обеспечивает эффективную стерилизацию при 100 Торр и комнатной температуре только после 2 часов. Эти результаты, при сравнении с результатами в таблице 12, демонстрируют, что пероксидные комплексы настоящего изобретения обеспечивают стерилизацию при пониженных давлениях за более короткое время, чем время, требуемое для осуществления стерилизации при атмосферном давлении.
Таким образом, комплексы пероксида водорода настоящего изобретения могут обеспечить эффективную стерилизацию за значительно более короткие периоды времени. Кроме того, как указано выше, для повышения стерилизационной активности пара пероксида водорода может быть также использована плазма. Изделия, подлежащие стерилизации, подвергают воздействию плазмы после воздействия пероксидного пара и остаются в плазме в течение периода времени, достаточного для того, чтобы осуществить полную стерилизацию.
Изделия, которые подвергаются стерилизации воздействием пара пероксида водорода, могут быть подвергнуты воздействию плазмы для удаления остаточного пероксида водорода, остающегося на изделиях. Поскольку остаточный пероксид водорода разлагается на нетоксичные продукты во время обработки плазмой, стерилизуемые изделия всегда готовы для использования после обработки, без необходимости каких-либо дополнительных стадий.
Неводные пероксидные комплексы являются полезными для целого ряда применений, включая как компонент самостерилизующихся упаковок. Кроме того, комплексы пригодны для использования в различных способах паровой стерилизации изделий, таких как способ, раскрытый в патенте США N 4943414. Этот патент раскрывает способ, в котором сосуд, содержащий небольшое количество способного давать пар раствора жидкого стериланта, присоединяют к люмену, и стерилант испаряется и проникает непосредственно в люмен изделия, когда давление понижается во время стерилизационного цикла. Способ, раскрытый в патенте, может быть модифицирован, предусматривая использование неводного пероксидного соединения. Соединение помещают в сосуд и присоединяют к люмену изделия, подлежащего стерилизации. Затем изделие помещают внутрь контейнера и контейнер вакуумируют. Люмен изделия и внутренняя часть изделия контактируют с паром пероксида водорода, выделенного из неводного соединения. Плазма может дополнительно генерироваться и использоваться для улучшения стерилизации и/или удаления остаточного пероксида водорода из изделия.
Использование только что описанных неводных пероксидных комплексов в системе преодолевает недостаток, заключающийся в том, что вода в водном растворе испаряется и предшествует пару пероксида водорода в люмене. Таким образом, достигается более эффективная стерилизация, и требуется более короткое время для осуществления стерилизации. Комплексы пероксида водорода, такие как с глициновым ангидридом, особенно полезны, поскольку они выделяют значительное количество пероксида водорода при пониженном давлении без необходимости в дополнительном нагревании комплекса.
Синтез неводных комплексов пероксида водорода
Кроме того, настоящее изобретение обеспечивает разработку
способа получения неводных комплексов пероксида водорода, которые используют в качестве источника в стерилизаторе паром пероксида водорода или в качестве компонента самостерилизующейся упаковки, как
было описано выше. Конечно, комплексы пероксида водорода могут быть использованы для других применений, таких как отбеливающие средства, растворы для контактных линз, катализаторы и другие применения,
которые могут быть хорошо известны специалисту средней квалификации в данной области.
Наиболее близким по назначению и технической сущности к заявленному является способ получения комплекса пероксида водорода, включающий введение паров пероксида водорода в камеру с комплексующим реагирующим веществом (Авторское свидетельство СССР N 394 296, кл. C 01 B 15/055, 1974).
Способ является трудоемким при отсутствии возможностей точного регулирования соотношения реагентов и ограниченном количестве получаемых комплексов.
Целью изобретения является устранение указанных недостатков.
Обычная методика получения комплексов пероксида водорода данного изобретения заключается в следующем:
(1) Поместить реагирующее
вещество в камеру
Вещество, подлежащее взаимодействию с пероксидом водорода, может быть твердым веществом в различных формах (например, порошок, кристалл, пленка и т. п. , предпочтительно
имеющие высокую площадь поверхности для увеличения скорости реакции). Реагирующее вещество может также присутствовать в виде раствора в воде или другом растворителе, если время достаточно для того,
чтобы дать возможность испариться растворителю, после того как давление в камере понизится. Вещество может быть также жидкостью, точка кипения которой выше, чем точка кипения пероксида водорода
(150oC). Поскольку скорости реакции более высокие при повышенных температурах, камеру предпочтительно нагревают либо до, либо после того, как введут реагирующее вещество. Однако температура
не должна быть так высока, чтобы реагирующее вещество закипело или испарилось.
Реагирующее вещество может быть помещено в любой контейнер, который обеспечивает доступ к пероксидному пару. Если оно в форме порошка или другой формы, которая может развеяться, когда камеру вакуумируют, то в таком случае реагирующее вещество может сохраняться в проницаемом контейнере, который позволяет пероксиду водорода диффундировать в контейнер.
(2) Вакуумировать камеру
Предпочтительно, камеру вакуумируют до давления, которое ниже давления пар пероксида
водорода (которое зависит от его концентрации и температуры), для того чтобы гарантировать, чтобы весь пероксид находился в паровой фазе. Давление пара увеличивается с повышением температуры и
уменьшается с увеличением концентрации пероксида. Для большинства экспериментов, камеру вакуумируют до приблизительно 0,2 Торр, и температура близка к температуре окружающей среды или выше.
(3) Генерировать пар пероксида водорода
Пар пероксида водорода можно генерировать из раствора пероксида водорода или из в основном безводного комплекса пероксида водорода.
Последний дает сухой пероксид водорода в паровом состоянии, что является преимуществом, если либо вещество, подлежащее взаимодействию с паром, либо комплекс, подлежащий образованию, является
гигроскопичным. Другое преимущество генерирования пара пероксида водорода из в основном свободного от воды комплекса заключается в том, что процент пероксида водорода в образуемом комплексе выше, чем
если пар генерируется из водного раствора H2O2. Возможно это обусловлено конкуренцией между молекулами воды и молекулами Н2O2 за места связывания на
комплексе, когда водный раствор используют для генерирования H2O2 пара.
Пероксидный пар может генерироваться внутри той же самой камеры, которая заключает реагирующее вещество, или в другой камере, отделенной от первой вакуумным вентилем.
(4) Осуществить взаимодействие реагирующего вещества с пероксидом водорода
Время,
требуемое для реакции, зависит, конечно, от скорости реакции реагирующего вещества с пероксидом водорода. Его можно определить путем контролирования давления, которое уменьшается во время связывания
пероксида с регулирующим веществом. Обычно, время реализации составляет около 5-30 минут. Концентрация испаряемого пероксида водорода и масса исходного вещества определяют весовое процентное
содержание пероксида в конечном реакционном продукте. Когда весовое отношение реагирующего вещества к пероксиду водорода увеличивается, весовое процентное содержание пероксида водорода в комплексе
уменьшается. Реакцию можно многократно повторять, чтобы увеличить концентрацию пероксида водорода в комплексе.
(5) Вакуумировать камеру снова
В конце реакционного периода
камеру дополнительно вакуумируют до около 2 Торр для удаления какого-либо непрореагировавшего пероксида водорода.
(6) Вентилировать камеру и восстановить комплекс пероксида
водорода
Механизм, согласно которому пероксид водорода образует комплекс с реагирующим веществом, полностью не установлен. Полагают, что образование комплекса включает образование водородной
связи между пероксидом водорода и обогащенными электроном функциональными группами, содержащими кислород и/или азот в реагирующем веществе. Неизвестно, если это единственный способ связывания; однако
установлено, что вещества с широким диапазоном функциональных групп образуют комплексы с пероксидом водорода.
Преимущества парофазной реакции над более ранними способами образования
комплекса пероксида водорода заключаются в следующем:
1. Отношение пероксида водорода к реагирующему веществу можно точно контролировать путем варьирования количества пероксида водорода,
присутствующего в паровом состоянии, или путем варьирования количества реагирующего вещества, подвергаемого воздействию пара.
2. Устранена необходимость удаления растворителя из реакционного продукта.
3. Можно получать пероксидные комплексы, которые представляют собой жидкость или твердые вещества, такие как порошки, кристаллы, пленки и т.п.
4. Можно получать пероксидные комплексы гигроскопичных веществ.
Далее в последующих примерах описывается синтез неводных пероксидных комплексов согласно настоящему изобретению. Многие из этих соединений используют как катализаторы, в дополнение к использованиям, описанным подобно здесь, что может быть легко оценено специалистами средней квалификации в данной области. Примеры представляют варианты воплощения композиций и способов данного изобретения, но, как подразумевается, эти примеры не ограничивают объема данного изобретения.
Пример 12
Комплекс пероксида водорода с глициновым ангидридом получают следующим образом: 1,0 грамм образца глицинового ангидрида (Aldrich Chemical Co., Milwaukee, WI) помещают на алюминиевый поддон в
173-литровой камере, поддерживаемой при температуре 45oC. Верх алюминиевого поддона покрывают TYVEKTM нетканым волокном, которое препятствует выходу глицинового ангидрида с
поддона, когда давление в камере понижается, но которое способно пропускать газы и не абсорбирует пероксид водорода. Дверцу камеры закрывают и давление в камере понижают до 0,2 Торр путем
вакуумирования камеры с помощью вакуумного насоса. Концентрацию пероксида водорода 10 мг/л создают испарением соответствующего объема 70% водного раствора пероксида водорода (FMC Corp., Philadelphia,
PA) в камере. Пар пероксида водорода поддерживают в контакте с глициновым ангидридом в течение 20 минут. По окончании периода реакции давление в камере понижают до 2 Торр и затем возвращают к
атмосферному давлению. Реакционный продукт удаляют из камеры и анализируют на содержание пероксида водорода в весовых процентах путем следующих реакций иодометрического титрования.
H2O2 + 2KI + H2SO4 ---> I2 + K2SO4 + 2H2O;
I2 + 2Na2S2O3 ---> Na2S4O6 + 2NaI.
В реакции титрования иода натрий тиосульфатом для улучшения цветового перехода в конечной точке используют
крахмальный индикатор. Весовое процентное содержание пероксида водорода рассчитывают с помощью следующего уравнения:
Вес. % H2O2 = [(мл Na2S2O3)* (нормальность Na2S2O3)* 1,71] / (вес пробы в граммах)
Найдено, что весовое процентное содержание пероксида водорода в
комплексе с глициновым ангидридом составляет 24,3%.
Пример 13
Используя методику примера 12, получают комплексы пероксида водорода широкого ряда органических и неорганических
комплексов. В каждом случае, условия реакции были аналогичны условиям реакции в примере 12, за исключением того, что вместо глицинового ангидрида используют 1,0 грамм каждого одного из соединений,
представленных в таблице 14.
Полученные органические комплексы охватывают следующий диапазон функциональных групп, которые способны образовывать водородные связи с пероксидом водорода: спирты, простые эфиры, кетоны, кислоты, аминокислоты, сложные эфиры, органические соли, амины, амиды, полиамиды, полиуретаны, мочевины и биурет. Неорганические комплексы включают карбонаты с катионами натрия, калия и рубидия, а также бикарбонат натрия. Кроме того, также получены пероксид водородные комплексы гидроксида кальция и тетранатрий пирофосфата. Исходные вещества представляют собой тонко измельченные порошки или незначительно более крупные кристаллические вещества, за исключением найлона 6,6, который полуют в виде пленки толщиной 0,12 мм, и поливинилметилового эфира, который представляет собой 50% по весу водный раствор.
Комплексы пероксида водорода, полученные с этими веществами, в условиях испытания представляют собой твердые вещества, за исключением поливинилпирролидона, гистамина, поли(винилметилового эфира), поли(винилметилкетона), пропионамида и 1,3-диметилмочевины. 1,3-диметилмочевина и пропионамид-пероксид водорода комплексы представляют собой свободно текучие жидкости, которыми легко манипулировать при пирофазном способе получения, поскольку не требуется растворитель, который следует удалять, чтобы получить конечный продукт. Комплексы гистамина, поливинилпирролидона, поли(винилметиловый эфира) и поли(винилметилкетона) представляют собой липкие вещества, которые нелегко обрабатывать.
Примеры 14 и 15 описывают дополнительные исследования с поливинилпирролидоном при различных условиях способа, чтобы получить пероксидный комплекс в виде сыпучего твердого продукта.
Пример 14
Получают комплексы пероксида водорода с поливинилпирролидоном, в которых процент пероксида водорода в комплексе с поливинилпирролидоном варьируют путем изменения отношения веса
поливинилпирролидона к концентрации пероксида водорода в паровом состоянии. Условия в этих испытаниях были идентичными условиям в примере 12, за исключением того, что вес поливинилпирролидона
увеличивают от 1,0 грамма до 3,0 граммов до 5,0 грамма. В этих испытаниях концентрация пероксида водорода поддерживают постоянной при 10 мг/литр объема камеры. Результаты этих испытаний представлены в
таблице 15.
Пример 15
Получают комплекс пероксида водорода с PVP, в котором пероксид водорода поставляют из комплекса пероксида водорода с мочевиной. Когда пероксид водорода
поставляют таким способом, то он в основном свободен от воды. В этом испытании 5 грамм PVP помещают в реакционную камеру и 10 мг H2O2/литр объема камеры поставляют в реакционную
камеру при нагревании около 7 грамм 35% комплекса H2O2 с мочевиной до температуры около 110oC в течение приблизительно 5 минут. Остальные условия в этом испытании были
теми же самыми, как в примере 12. Процентное содержание пероксида водорода в PVP комплексе и физическое состояние комплекса представлены в таблице 15.
Результаты этих испытаний демонстрируют, что сыпучее твердое вещество может быть получено в случае комплекса PVP - пероксид водорода путем контролирования отношения PVP к пероксиду водорода в паровом состоянии и, альтернативно, путем использования в основном свободного от воды источника пара пероксида водорода.
Реферат
Описывается устройство для стерилизации изделия пероксидом водорода, содержащее контейнер для удерживания изделия, подлежащего стерилизации, отличающийся тем, что содержит источник пара пероксида водорода, локализованный внутри указанного контейнера, причем указанный источник включает в основном неводный органический комплекс пероксида водорода, источник сконструирован так, чтобы мог контактировать с изделием, осуществляя стерилизацию. Описывается также способ стерилизации изделия паром пероксида водорода (варианты), способ стерилизации изделия плазмой пероксида водорода, способ стерилизации изделия пероксидом водорода (варианты). Технический результат - упрощение процесса и повышение его безопасности. 12 с. и 61 з.п. ф-лы, 4 ил., 17 табл.


Комментарии