Варианты химозина с улучшенными свойствами - RU2764544C2
Код документа: RU2764544C2
Чертежи



Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к вариантам химозина с улучшенными свойствами αS1-казеина и С/Р расщепления.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Химозин (ЕС 3.4.23.4) и пепсин (ЕС 3.4.23.1), молокосвертывающие ферменты желудка млекопитающих, представляют собой аспарагиновые протеазы, принадлежащие к большому классу пептидаз.
При продуцировании в клетках слизистой желудка химозин и пепсин образуются в виде ферментативно неактивного предшественника прохимозина и предшественника пепсиногена соответственно. При выведении химозина, N-концевой пептидный фрагмент, пре-фрагмент (сигнальный пептид) отщепляется с получением прохимозина, включающего про-фрагмент. Прохимозин является по существу неактивной формой фермента, который, однако, активируется в кислых условиях в активный химозин посредством автокаталитического удаления про-фрагмента. Эта активация происходит in vivo в просвете желудка при подходящем рН или in vitro в кислых условиях.
Подробно изучены структурные и функциональные характеристики бычьего, то есть Bos taurus, пре-прохимозина, прохимозина и химозин. Предварительная часть молекулы пре-прохимозина быка содержит 16 ак (аминокислотных) остатков и про-часть соответствующего прохимозина имеет длину 42 ак остатков. Активный бычий химозин содержит 323 ак.
Химозин продуцируется естественным образом в таких видах млекопитающих, как крупный рогатый скот, верблюды, козы, буйволы, овцы, свиньи, люди, обезьяны и крысы.
Бычий и верблюжий химозин в течение ряда лет были доступны в продаже для молочной промышленности.
Ферментативная коагуляция молока посредством молокосвертывающих ферментов, таких как химозин и пепсин, является одним из наиболее важных процессов в производстве сыров. Ферментативная коагуляция молока представляет собой двухфазный процесс: первая фаза, где протеолитический фермент, химозин или пепсин, воздействует на κ-казеин, что приводит к метастабильному состоянию структуры мицеллы казеина, и вторая фаза, где молоко затем свертывается и образует коагулят (ссылка 1). Кроме облегчения коагуляции молока путем расщеплением κ-казеина, химозины расщепляют альфаS1-казеин (αS1-казеин), главным образом между Phe23 и Phe24 (Moynihan et al. 2014), что приводит к образованию пептида αS1(1-23).
Было описано, что образование пептида αS1(1-23) содействует смягчению текстуры сыра (Creamer & Olsen, 1982). Например, была найдена корреляция обоих параметров при сравнении химозинов из Bos taurus и Camelus dromedarius. В тоже время бычий химозин быстрее расщепляет αS1 казеин между Phe23 и Phe24 (Creamer & Olsen, 1982, Bansal et al. 2009) по сравнению с верблюжьим химозином, и он дает более мягкие сыры с большей пластификацией текстуры, например чеддер (Creamer & Olsen, 1982, Bansal et al. 2009) и моцарелла (Moynihan et al. 2014).
Доступ к сырным коагулянтам с различной степенью образования пептида αS1 (1-23) может позволить сыровару добиваться различного уровня мягкости матрицы сыра. Таким образом, варианты химозина с повышенным или уменьшенным образованием пептида αS1 (1-23) при производстве сыра представляют большой промышленный интерес. Коагулянты с тонко настроенным протеолизом αS1-казеина могут облегчать производство широкого разнообразия сыров с оптимальной твердостью сырного зерна.
Ссылки, перечисленные непосредственно ниже, могут в настоящем контексте рассматриваться, как ссылки, описывающие мутанты химозина:
- в WO 02/36752A2 (Chr. Hansen) описано рекомбинантное получение верблюжьего химозина.
- в WO 2013/174840A1 (Chr. Hansen) описаны мутанты/варианты бычьего и верблюжьего химозина.
- в WO 2013/164479А2 (DSM) описаны мутанты бычьего химозина.
- Suzuki et al: Site directed mutagenesis reveals functional contribution of Thr218, Lys220 and Asp304 in chymosin, Protein Engineering, vol. 4, January 1990, pages 69-71;
- Suzuki et al: Alteration of catalytic properties of chymosin by site-directed mutagenesis, Protein Engineering, vol. 2, May 1989, pages 563-569;
- van den Brink et al: Increased production of chymosin by glycosylation, Journal of biotechnology, vol. 125, September 2006, pages 304-310;
- Pitts et al: Expression and characterisation of chymosin pH optima mutants produced in Trichoderma reesei, Journal of biotechnology, vol. 28, March 1993, pages 69-83;
- M.G. Williams et al: Mutagenesis, biochemical characterization and X-ray structural analysis of point mutants of bovine chymosin, Protein engineering design and selection, vol. 10, September 1997, pages 991-997;
- Strop et al: Engineering enzyme subsite specificity: preparation, kinetic characterization, and x-ray analysis at 2.0 ANG resolution of Val111phe site mutated calf chymosin, Biochemistry, vol. 29, October 1990, pages 9863-9871;
- Chitpinityol et al: Site-specific mutations of calf chymosin В which influence молокосвертывающая активность, Food Chemistry, vol. 62, June 1998, pages 133-139;
- Zhang et al: Functional implications of disulfide bond, Cys45-Cys50, in recombinant prochymosin, Biochimica et biophysica acta, vol. 1343, December 1997, pages 278-286.
Ни одна из указанных выше ссылок на предшествующий уровень техники не описывает прямо и однозначно ни один из вариантов химозина с измененной частотой расщепления αS1-казеина и повышенным значением С/Р по сравнению с родительским веществом, из которого этот вариант получен, как описано ниже.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задача, решаемая настоящим изобретением, состоит в том, чтобы предложить варианты химозина, которые, по сравнению с родительским полипептидом, имеют либо более низкую, либо более высокую частоту расщепления αS1-казеина и повышенное значение С/Р.
Благодаря отданным усилиям и применению многомерной стратегии исследования, авторы настоящего изобретения обнаружили одиночные мутации, а также комбинации мутаций, которые позволяют создавать отдельные варианты полипептидов химозина, отличающиеся тем, что:
(а) выделенный вариант полипептида химозина имеет значение С/Р, которое составляет по меньшей мере 200% от значения С/Р выделенного верблюжьего химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2; и
(б) выделенный вариант полипептида химозина расщепляет αS1-казеин с частотой менее 80% частоты расщепления αS1-казеина выделенным верблюжьим химозином, характеризующимся зрелым полипептидом SEQ ID NO: 2, где расщепление αS1-казеина определяют посредством количественного определения пептидов αS1-казеина, полученных посредством инкубации обезжиренного молока с вариантом химозина или с верблюжьим химозином, где количественное определение выполняют с помощью RP-HPLC (обращенно-фазовая высокоэффективная жидкостная хроматография), в сочетании с ESI-Q-TOF (времяпролетная масс-спектрометрия с ионизацией электрораспылением)
Кроме того, авторы настоящего изобретения обнаружили одиночные мутации, а также комбинации мутаций, которые позволяют разработать отдельные варианты полипептида химозина, отличающиеся тем, что:
(а) выделенный вариант полипептида химозина имеет значение С/Р, которое составляет по меньшей мере 200% от значения С/Р выделенного верблюжьего химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2; и
(б) выделенный вариант полипептида химозина расщепляет αS1-казеин с частотой, составляющей по меньшей мере 115% от частоты расщепления αS1-казеина выделенным верблюжьим химозином, характеризующимся зрелым полипептидом SEQ ID NO: 2, где расщепление αS1-казеина определяют посредством количественного определения пептидов αS1-казеина, полученных путем инкубации обезжиренного молока с вариантом химозина или с верблюжьим химозином, где количественное определение осуществляют с помощью RP-HPLC в сочетании с масс-спектрометром ESI-Q-TOF.
Кроме того, в настоящем изобретении предложены способы получения выделенных вариантов полипептида химозина, где способ включает следующие стадии:
(а): внесение модификация в одно или более положений в последовательности ДНК, кодирующей зрелый полипептид SEQ ID NO: 2 (верблюжий химозин), где модификация включает замену, удаление или вставку по меньшей мере в одном аминокислотном положении, соответствующем Y11I, Y11V, L12M, K19T, V51L, R61S, H76Q, E83S, I96L, L105E, D144Q, Q162S, S164G, М165Е, L166V, L180I, V203A, L221I, S226T, T239S, R242E, G251D, G251W, L253I, V260T, I263L, R266V, S273Y, Q288E, G289S, E294Q, Y307F, V309I, R316L и/или V317L, или альтернативно V32L, 145V, N50K, G70D, G70N, D98V, N100Q, V136I, M142I, H146R, S154A, V155F, M157L, D158S, V198I, I200V, F223V, K231N, G244D, V248I, R254S, M256L, V259I, Е262Т, D267Q, D279E, T284S, N291Q N292H, L295K и/или K321P,
(б): получение и выделение модифицированного полипептида со стадии (а)
В связанном аспекте настоящее изобретение также относится к способу получения выделенного варианта полипептида химозина, имеющего измененную частоту расщепления αS1-казеина по сравнению с родительским полипептидом, включающему стадии:
(а): осуществление модификации в одном или более положениях родительского полипептида, где модификация включает замену, удаление или вставку по меньшей мере в одном аминокислотном положении, соответствующем любому из положений: Y11I, Y11V, L12M, K19T, V51L, R61S, H76Q, E83S, I96L, L105E, D144Q, Q162S, S164G, М165Е, L166V, L180I, V203A, L222I, S226T, T239S, R242E, G251D, G251W, L253I, V260T, I263L, R266V, S273Y, Q288E, G289S, E294Q, Y307F, V309I, R316L, V317L, V32L, I45V, N50K, G70D, G70N, D98V, N100Q,_V136I, M142I, H146R, S154A, V155F, M157L, D158S, V198I, I200V, F223V, K231N, G244D, V248I, R254S, M256L, V259I, Е262Т, D267Q, D279E, T284S, N291Q N292H, L295K и/или K321P,
(б): получение и выделение модифицированного полипептида со стадии (а),
и где:
(1): аминокислотное положение в родительском полипептиде определяют посредством выравнивания родительского полипептида со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин); и
(2): родительский полипептид имеет по меньшей мере 65% идентичность последовательности со зрелым полипептидом SEQ ID NO: 1 (бычий химозин) и/или по меньшей мере 65% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин).
Кроме того, настоящее изобретение также относится к конкретным комбинациям замен, как описано ниже в воплощениях изобретения.
Настоящее описание также относится к пищевым продуктам или кормовым продуктам, содержащим выделенные варианты полипептида химозина, а также к использованию выделенных вариантов полипептида химозина в способе получения сыра.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
На основе сравнительного анализа разных вариантов авторы настоящего изобретения идентифицировали ряд положений аминокислот, которые имеют важное значение в том смысле, что варианты с одним или более такими положениями могут привести к получению улучшенного варианта химозина с более низкой или более высокой частотой расщепления αS1-казеина и повышенным значением С/Р.
Следовательно, как указано выше, в настоящем изобретении предложены выделенные варианты полипептидов химозина, отличающиеся тем, что:
(а) выделенный вариант полипептида химозина имеет значение С/Р, которое составляет по меньшей мере 200% значения С/Р выделенного верблюжьего химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2; и
(б) выделенный вариант полипептида химозина расщепляет αS1-казеин с частотой, которая составляет менее 80% или по меньшей мере 115% частоты расщепления αS1-казеина выделенным верблюжьим химозином, характеризующимся зрелым полипептидом SEQ ID NO: 2, где расщепление αS1-казеина определяют посредством количественного определения пептидов αS1-казеина, полученных путем инкубации обезжиренного молока с вариантом химозина или с верблюжьим химозином, где количественное определение выполняют с помощью RP-HPLC в сочетании с масс-спектрометром ESI-Q-TOF.
Более конкретно, в одном аспекте настоящего изобретения предложены выделенные варианты полипептида химозина, отличающиеся тем, что:
(а) выделенный вариант полипептида химозина имеет значение С/Р, которое составляет по меньшей мере 200% от значения С/Р выделенного верблюжьего химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2;
(б) выделенный вариант полипептида химозина расщепляет αS1-казеин с частотой, которая менее 80% частоты расщепления αS1-казеина выделенным верблюжьим химозином, характеризующимся зрелым полипептидом SEQ ID NO: 2, где расщепление αS1-казеина определяют посредством количественного определения пептидов αS1-казеина, полученных путем инкубации обезжиренного молока с вариантом химозина или верблюжьим химозином, где количественное определение выполняют с помощью RP-HPLC в сочетании с масс-спектрометром ESI-Q-TOF.
В близком аспекте выделенный вариант полипептида химозина по настоящему изобретению, который расщепляет αS1-казеин с частотой, составляющей менее 80% частоты расщепления αS1-казеина выделенным верблюжьим химозином характеризующимся зрелым полипептидом SEQ ID NO: 2, включает одну или более следующих замен, где замены указана в отношении аминокислотной последовательности зрелого полипептида SEQ ID NO: 2: Y11I, Y11V, L12M, K19T, V51L, R61S, H76Q, E83S, I96L, L105E, D144Q, Q162S, S164G, M165E, L166V, L180I, V203A, L221I, S226T, T239S, R242E, G251D, G251W, L253I, V260T, I263L, R266V, S273Y, Q288E, G289S, E294Q, Y307F, V309I, R316L и/или V317L.
Вышеуказанные мутации могут составлять часть комбинаций мутаций для создания вариантов или мутантов, содержащих множественные замены. В частности и в качестве связанного аспекта, выделенный вариант полипептида химозина, имеющий уменьшенную частоту расщепления aS1-казеина, может содержать одну или более комбинаций следующих замен и где каждая замена указана в отношении аминокислотной последовательности зрелого полипептида SEQ ID NO: 2:
Y21S+H76Q+Y307F+V317L,
R61S+L166V+T239S,
V32L+E294Q+R316L+V317L,
S226T+G244D+I263L+G289S,
V203A+V248I+G251W+L253I+Y268F,
D59N+L222I+G251D+E83S+Q162S,
D59N+L222I+G251D+Y21S+L215V+L105E,
D59N+L222I+G251D+H76Q+L105E+V260T,
D59N+L222I+G251D+V203A+R266V+F223A,
L12M+D59N+H76Q+S154A+M165E+V203A+L222I+G251D+V309I,
L12M+V51L+H76Q+M165E+G251D,
L12M+V51L+D59N+H76Q+L166V+L222I+G251D,
L12M+D59N+H76Q+D144Q+M165E+V203A+L222I,
L12M+K19T+D59N+H76Q+S154A+M165E+V198I+L222I+G251D,
L12M+V51L+D59N+F66Y+H76Q+M165E+V203A+L222I+G251W,
V51L+D59N+H76Q+M165E+L180I+L222I+G251D+E262T,
L12M+D59N+H76Q+M165E+G251D+Q288E+V309I+K321P,
D59N+H76Q+I96L+L130I+S164G+L222I+R242E+G251D,
H76Q+I96L+S164G+L222I+R242E+G251D+S273Y,
K19T+D59N+H76Q+I96L+S164G+L166V+L222I+G251D+S273Y,
H76Q+S164G+L166V+L222I+R242E+G251D+S273Y,
Y21S+H76Q+S164G+L222I+R242E+G251D+S273Y,
D59N+H76Q+I96L+S132A+S164G+L222I+S226T+G251D+S273Y,
D59N+H76Q+I96L+S132A+S164G+L166V+L222I+G251D+S273Y,
K19T+D59N+H76Q+S164G+L222I+N249D+S273Y,
H76Q+S164G+L222I+N249D+G251D+S273Y+V309I,
H76Q+I96L+S164G+G251D+S273Y+V309I,
K19T+D59N+H76Q+S164G+R242E+N249D+G251D+S273Y,
Y21S+D59N+H76Q+S164G+L222I+S226T+G251D+S273Y+V309I
D59N+H76Q+I96L+S164G+L222I+S226T+N249D+G251D+S273Y,
H76Q+S164G+L166V+L222I+S226T+S273Y,
D59N+H76Q+L130I+S164G+L166V+L222I+G251D+S273Y+V309I,
D59N+H76Q+S164G+L222I+S226T+R242E,
K19T+D59N+I96L+S164G+L222I+G251D,
D59N+H76Q+I96L+S164G+L222I+S226T+G251D+S273Y+V309I,
D59N+H76Q+L130I+S164G+G251D+V309I,
D59N+H76Q+L130I+L166V+L222I+N249D+G251D+S273Y,
Y21S+D59N+H76Q+I96L+S164G+L222I+N249D+G251D+S273Y,
K19T+D59N+S164G+L166V+L222I+S226T+G251D+S273Y,
D59N+H76Q+L130I+S132A+S164G+L222I+R242E+G251D+S273Y,
K19T+Y21S+H76Q+S164G+L222I+G251D+S273Y,
D59N+H76Q+S164G+L222I+R242E+S273Y+V309I,
K19T+Y21S+D59N+H76Q+S132A+S164G+L222I+G251D+S273Y,
K19T+D59N+H76Q+L130I+S164G+L222I+S226T+G251D+S273Y,
D59N+H76Q+S164G+L166V+L222I+N249D+G251D+S273Y+V309I,
K19T+Y21S+D59N+H76Q+L130I+S164G+L222I+S273Y,
Y21S+D59N+S164G+L222I+R242E+G251D+S273Y+V309I,
K19T+D59N+H76Q+L166V+L222I+R242E+G251D+S273Y,
D59N+S132A+S164G+L222I+R242E+N249D+G251D+S273Y,
D59N+H76Q+I96L+L130I+S164G+L222I+N249D+G251D+S273Y,
Y21S+D59N+H76Q+S164G+L166V+N249D+G251D+S273Y,
H76Q+S132A+S164G+L222I+N249D+G251D,
D59N+H76Q+S132A+S164G+L166V+S273Y,
K19T+D59N+H76Q+S132A+L222I+G251D+S273Y+V309I,
H76Q+L130I+L222I+S226T+G251D+S273Y,
Y21S+D59N+H76Q+I96L+L222I+S273Y,
Y11I+K19T+D59N+E83S+I96L+S164G+L222I+N249D,
Y11I+K19T+I96L+S164G+L222V+R242E+G251D,
Y11V+K19T+I96L+S164G+L166V+L222I+R242E,
Y11V+E83S+I96L+S164G+L222I+R242E+G251D+L253I+I263L,
Y11V+I96L+S164G+L222I+R242E+N249D+L253I+I263L,
K19S+I96L+S164G+L166V+L222I+R242E,
K19T+I96L+S164G+L166V+L222I+R242E+N249D+I263L,
Y11V+K19T+D59N+I96L+S164N+L166I+L222I+G251D,
H76Q+I96L+S164G+L222I+R242E+G251D+S273Y,
Y11V+K19T+E83S+I96L+S164G+L166V+L222I+R242E+G251D,
Y11V+E83S+I96L+S164G+L222I+R242E+L253I+I263L,
Y11V+K19T+D59N+I96L+S164G+L166V+L222I+R242E+G251D+L253I,
K19T+D59N+I96V+S164G+L166V+L222I+R242E+I263L,
Y11V+D59N+I96L+S164G+L222I+G251D+L253V,
I96L+S164G+L166V+L222I+R242E+N249D+I263L,
K19S+D59N+I96L+S164G+L222I+R242E+N249E+G251D,
H76Q+I96L+S164G+L222I+R242E+G251D,
Y11I+K19T+D59N+S164G+L222I+G251D+I263V,
K19T+I96L+S164G+L166V+L222I+R242E+N249D+G251D+I263V,
K19T+E83S+I96L+S164G+L222I+R242E+G251D+L253I,
I96L+S164G+L222I+R242E+N249D+G251D+I263L,
K19T+D59N+I96L+S164G+L166V+L222I+R242D+G251D+L253I,
D59N+I96L+S164G+L222I+R242E+L253I+I263L,
K19T+I96L+S164G+L166V+L222I+N249D+I263L,
K19T+D59N+I96L+S164G+L166I+L222I+R242D+G251D+I263V,
K19T+D59N+I96L+S164G+L222V+R242E+N249D+L253I,
K19T+D59N+I96L+S164G+L166I+L222I+R242E+N249D,
K19T+E83S+I96L+S164G+L222I+R242E+N249D+G251D+L253I,
I96L+S164G+L222I+R242E+G251D+S273Y,
K19T+E83T+I96L+S164G+L222I+R242E+L253V,
K19T+I96L+S164G+R242E+L253I,
K19T+D59N+I96L+S164G+L222I+N249E+G251D+L253V+I263L,
K19T+D59N+I96L+S164G+L222V+N249E+G251D+I263V,
I96L+S164G+L222I+R242E+G251D,
K19T+I96L+S164N+L222I+R242E+I263L,
K19T+E83S+I96L+S164G+L166V+L222I+R242E+N249D+G251D+L253I,
K19T+D59N+E83T+S164G+L166V+L222I+R242D+G251D,
K19T+D59N+I96L+S164G+L222I+G251D,
D59N+I96L+L166V+L222I+R242E+G251D,
Y11I+K19T+D59N+I96V+L222I+R242D+G251D,
K19T+I96V+S164G+L222I+N249D+G251D+L253I,
H76Q+N100Q+N291Q,
R67Q+L130I+M157L+D158S+R242E+N291Q,
V32L+R67Q+L130I+M157L+K231N+M256L,
R67Q+V136I+M157L+L222I+V248I,
Y11V+R67Q+L130I+M157L+L222I+R242E,
R67Q+I96L+N100Q+L130I+M157L+N292H.
Y11I+D59N+I96L+S164G+L166V+L222V+R242E+G251D+L253I,
Y11I+D59N+I96L+S164G+L166V+L222V+R242E+G251D,
Y11I+D59N+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11I+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11V+K19T+I96L+L166V+L222V+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222V+R242E+N249E+G251D+L253I,
Y11I+K19T+D59N+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166V+L222I+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166V+L222V+R242E+N249E+L253I,
Y11V+K19T+D59N+I96L+L166V+L222V+R242E+N249E+G251D+L253I,
Y11V+K19T+D59N+I96L+S164G+L166V+L222I+R242E+N249E,
Y11V+K19T+D59N+I96L+S164G+L166V+L222V+R242E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166V+R242E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166I+L222I+R242E+G251D,
Y11V+K19T+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166I+L222V+R242E+N249E+G251D,
Y11V+D59N+I96L+S164G+L166I+L222I+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+I96L+S164G+L222I+R242E,
Y11I+K19T+I96L+S164G+L166V+R242E+N249E+G251D,
Y11I+I96L+S164G+L222I+R242E,
Y11I+K19T+D59N+I96L+S164G+L222I+R242E+N249E+G251D,
Y11V+D59N+I96L+S164G+L166I+L222V+R242E+G251D+L253I,
Y11I+K19T+D59N+I96L+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222I+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L222I+R242E+N249E+G251D,
Y11I+D59N+I96L+S164G+L222I+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+R242E+N249E+G251D+L253I,
Y11I+D59N+I96L+S164G+L222V+R242E+N249E+G251D,
Y11I+K19T+S164G+L1661+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+S164G+L166V+L222I+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166V+R242E,
Y11I+K19T+D59N+I96L+S164G+L222V+R242E+N249E,
Y11V+K19T+D59N+I96L+S164G+L222V+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222V+R242E+G251D,
Y11I+I96L+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+S164G+L166I+L222V+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+L222V+R242E+G251D,
Y11V+K19T+D59N+S164G+L166I+L222I+R242E+G251D,
Y11V+K19T+D59N+LI66V+L222I+R242E+N249E+G251D+L253I,
Y11V+K19T+I96L+L222V+R242E+N249E+G251D или
Y11I+K19T+L222V+R242E+N249E+G251D.
Соответственно, настоящее изобретение также включает выделенные варианты полипептида химозина, отличающиеся тем, что:
(а) выделенный вариант полипептида химозина имеет значение С/Р, составляющее по меньшей мере 200% от значения С/Р выделенного верблюжьего химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2; и
(б) выделенный вариант полипептида химозина расщепляет αS1-казеин с частотой, составляющей по меньшей мере 115% частоты расщепления αS1-казеина выделенным верблюжьим полипептидом химозином, характеризующимся зрелым полипептидом SEQ ID NO: 2, где расщепление αS1-казеина определяют посредством количественного определения пептидов αS1-казеина, полученных путем инкубации обезжиренного молока с вариантом химозина или с верблюжьим химозином, где количественное определение выполняют с помощью RP-HPLC в сочетании с масс-спектрометром ESI-Q-TOF.
В близком аспекте вариант полипептида химозина по настоящему изобретению, который расщепляет αS1-казеин с частотой, составляющей по меньшей мере 115% от частоты расщепления αS1-казеина выделенным полипептидом верблюжьего химозина, характеризующимся зрелым полипептидом SEQ ID NO: 2, содержит одну или более следующих замен, где замена указана в отношении аминокислотной последовательности зрелого полипептида SEQ ID NO: 2: V32L, I45V, N50K, G70D, G70N, D98V, N100Q, V136I, M142I, H146R, S154A, V155F, M157L, D158S, V198I, I200V, F223V, K231N, G244D, V248I, R254S, M256L, V259I, Е262Т, D267Q, D279E, T284S, N291Q N292H, L295K и/или K321P.
В другом связанном аспекте выделенный вариант полипептида химозина, имеющий повышенную частоту расщепления αS1-казеина, содержит одну или более комбинаций следующих замен, и где каждая замена указана в отношении аминокислотной последовательности зрелого полипептида SEQ ID NO: 2:
G70D+S74F+D158S+R254S+S277N,
L130I+M142I+I200V+V259I+E294Q,
Y21S+R61S+H146R,
R61S+G163E+M256L+S277N,
D59N+S271P+T284S,
V248I+S226T+E294Q,
S74F+G244D+S271P,
V221K+V248I+S255Y,
V183I+G251W+M256L,
R61Q+VI361+Y268F+T284S+Y307F,
N50K+D158S+V203A+E294Q,
D98V+G251D+M256L+V259I,
VI831+V248I+G244D+T284S,
N50K+R61S+Y127F+G244D+G251D,
I96L+F223V+G244D+R254S+M256L,
H146R+D158S+S273Y,
S74F+V259I+Y268F,
G70N+D98V+V136I,
I96L+M142I+R145Q+H146R,
V32L+G163E+T186S+Q188E+L295K,
R61Q+VI16I+Y268F+T284S+Y307F,
S132A+Q188E+F223V,
I200V+G251D+G289S,
N50K+D158S+V203A+E294Q,
F223V+G251W+S273Y+D279E,
D59N+L222I+G251D+V32L+L12M+T284S,
D59N+L222I+G251D+V155F+E262T+V32L,
D59N+L222I+G251W+S154A+V203A,
D59N+L222I+G251D+V32L+K321P+V260T,
D59N+L222I+G251D+VI981+V203A+K321P,
D59N+L222I+G251D+S273Y+T284S+D267Q
V32L+N100Q+N291Q,
N292H+N100Q+N291Q,
V221K+N100Q+N291Q,
I297A+N100Q+N291Q,
R67Q+N100Q+L130I+M157L+L222I+K231N,
R67Q+L130I+V248I+M256L+N292H,
V32L+R67Q+L130I+K231N+N292H,
L130I+M157L+V248I+M256L+N291Q,
V32L+R67Q+V136I+M157L+N291Q,
R67Q+L130I+K231N+V248I+N291Q,
V32L+R67Q+G70D+N100Q+M157L,
R67Q+N100Q+L130I+D158S+V248I,
R67Q+N100Q+L130I+M157L+K231N+N291Q,
R67Q+N100Q+L130I+M157L+V248I+N291Q и/или
N100Q+L130I+S132A+M157L+K231N.
В настоящем изобретении, кроме того, предложены способы получения выделенных вариантов полипептида химозина, способы получения пищевого или кормового продукта с использованием выделенных вариантов полипептида химозина, пищевые и кормовые продукты, содержащие эти варианты, а также использование этих вариантов для получения пищевых и кормовых продуктов.
Кроме того, настоящее изобретение относится к использованию вариантов полипептида химозина по настоящему изобретению для приготовления сыра, такого как, например, вытяжной сыр, чеддер, сыр континентального типа, мягкий сыр или белый рассольный сыр.
Определение положения аминокислот интересующего химозина
Нумерация аминокислот, используемая в данном описании изобретения для характеристики варианта, основана на зрелом пептиде.
Как известно в данной области - разные природные последовательности полипептида химозина дикого типа, полученные из разных видов млекопитающих (таких как, например, крупный рогатый скот, верблюды, овцы, свиньи или крысы) имеют относительно высокое(ую) сходство/идентичность последовательности. В данном контексте - полученный естественным образом химозин дикого типа (такой как бычий химозин или верблюжий химозин) может здесь являться примером родительского полипептида - то есть родительского полипептида, в котором производят модификация с получением варианта полипептида химозина по настоящему изобретению.
Как указано в данном описании изобретения, в качестве эталонной последовательности для определения положения аминокислот родительского интересующего полипептида химозина (например верблюдов, овец, коров и т.д.), здесь используют последовательность SEQ ID NO: 2 общеизвестного зрелого химозина Camelius dromedarius. Он может быть альтернативно назван в данном описании изобретения верблюжьим химозином. Зрелая полипептидная последовательность SEQ ID NO: 2 приведена в данном описании изобретения в качестве примера как SEQ ID NO: 4.
Альтернативно, аминокислотная последовательность другого полипептида химозина может быть выровнена со зрелым полипептидом, раскрытым в SEQ ID NO: 1, и на основании выравнивания номер положения аминокислоты, релевантный здесь любому аминокислотному остатку в зрелом полипептиде, раскрытом в SEQ ID NO: 1, определяют, используя алгоритм ClustalW, или как описано в рабочем Примере 1 в данном описании изобретения.
Основываясь на вышеуказанных хорошо известных компьютерных программах, квалифицированный специалист легко может определить аминокислотное положение в релевантном здесь интересующем полипептиде химозина (например верблюдов, овец, коров и т.д.).
Определение молокосвертывающей активности
Молокосвертывающая активность может быть определена с использованием метода REMCAT, который является стандартным методом, разработанным Международной федерацией молочных продуктов (метод IDF).
В этом методе молокосвертывающую активность определяют исходя из времени, необходимого для видимой флокуляции стандартного молочного субстрата, полученного из сухого обезжиренного молоко низкотемпературного сгущения и распылительной сушки с 0,5 г на литр раствора хлорида кальция (рН≈6,5). Время свертывания образца сычужного фермента сравнивают со временем свертывания эталонного стандарта, имеющего известную молокосвертывающую активность и имеющего такой же ферментный состав по IDF Standard 110В, в качестве образца. Образцы и эталонные стандарты измеряют в одинаковых химических и физических условиях. Образцы вариантов доводят до концентрации примерно 3 IMCU (Международная молокосвертывающая единица)/мл, используя 84 мМ уксуснокислый буфер, рН 5,5. Затем 200 мкл ферментного препарата добавляют к 10 мл предварительно нагретого молока (32°С) в стеклянной пробирке, помещенной на водяную баню, способной поддерживать постоянную температуру 32°С±1°С при постоянном помешивании. Альтернативно, 20 мкл ферментного препарата добавляют к 1 мл предварительно нагретого молока, как описано выше.
Общую молокосвертывающую активность (эффективность) сычужного фермента рассчитывают в Международных молокосвертывающих единицах (IMCU) на мл относительно стандарта, имеющего такой же ферментный состав, что и образец, в соответствии с формулой:

Sstandard: Молокосвертывающая активность международного эталонного стандарта для сычужного фермента.
Tstandard: Время свертывания в секундах, полученное для стандартного разбавления.
Dsample: Коэффициент разбавления для образца
Dstandard: Коэффициент разбавления для стандарта
Tsample: Время свертывания в секундах, полученное для разбавленного образца сычужного фермента, от момента добавления фермента до времени флокуляции.
Альтернативно, метод μIMCU может быть использован вместо метода REMCAT. По сравнению с REMCAT, время флокуляции для вариантов химозина в анализе μIMCU определяют путем измерения OD (оптической плотности) в 96-луночных планшетах для микротитрования при 800 нм в УФ/VIS(видимая область спектра) планшет-ридере. Стандартную кривую для различных разведений эталонного стандарта с известной эффективностью свертывания регистрируют для каждого планшета. Образцы получают путем разбавления фермента в 84 мМ ацетатном буфере, 0,1% тритона Х-100, рН 5,5. Реакцию при 32°С начинают путем добавления 250 мкл стандартного молочного субстрата, содержащего 4% (масс./масс.) сухого обезжиренного молока низкотемпературного сгущения и распылительной сушки и 7,5% (масс./масс.) хлорида кальция (рН≈6,5), к 25 мкл образца фермента. Затем определяют молокосвертывающую активность вариантов химозина в Международных молокосвертывающих единицах (IMCU) на мл на основании времени флокуляции относительно стандартной кривой.
Определение общего содержания белка
Предпочтительно, общее содержание белка определяют с использованием набора Pierce ВСА Protein Assay Kit от Thermo Scientific в соответствии с инструкциями поставщиков.
Расчет удельной свертывающей активности
Удельную активность свертывания (IMCU/мг общего белка) можно определить путем деления свертывающей активности (IMCU/мл) на общее содержание белка (мг общего белка на мл).
Обозначение вариантов
При описании вариантов по настоящему изобретению, обозначения, описанные ниже, адаптируют для удобства пользования. Используют принятые IUPAC однобуквенные или трехбуквенные сокращения названий аминокислот.
Конкретные варианты, обсуждаемые в данном разделе "обозначений" ниже, могут не являться релевантными вариантами по настоящему изобретению - то есть этот раздел "обозначений" предназначен только для описания используемых в настоящем описании обозначений как таковых. Как указано выше, нумерация аминокислот, используемая для указания вариантов полипептида химозина по настоящему изобретению, основана на аминокислотном положении в последовательности зрелого полипептида химозина.
Замены. Для аминокислотной замены используют следующее обозначение: Исходная аминокислота, положение, замещенная аминокислота. Соответственно, теоретическое замещение треонина аланином в положении 226 обозначают как "Thr226Ala" или "Т226А". Множественные мутации разделяют добавлением меток ("+"), например "Gly205Arg + Ser411Phe" или "G205R + S411F" представляют замены в положениях 205 и 411 глицина (G) аргинином (R) и серина (S) фенилаланином (F) соответственно. Замена, например обозначенная "226А", относится к замещению родительской аминокислоты (например Т, Q, S или другой родительской аминокислоты) аланином в положении 226.
Удаления. Для удаления аминокислоты используют следующее обозначение: Исходная аминокислота, положение, *. Соответственно, удаление глицина в положении 195 обозначают как "Gly195*" или "G195*". Множественные удаления разделяют добавлением меток ("+"), например "Gly195*+Ser411*" или "G195*+S411*".
Вставки. Для вставок аминокислот используют следующее обозначение: Исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота. Соответственно, вставка лизина после глицина в положении 195 обозначают, как "Gly195GlyLys" или "G195GK". Вставку нескольких аминокислот обозначают [Исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота #1, вставленная аминокислота #2; и т.д.]. Например, вставку лизина и аланина после глицина в положении 195 обозначают как "Gly195GlyLysAla" или "G195GKA".
В таких случаях вставленный(е) аминокислотный(е) остаток(и) нумеруют путем добавления строчных букв к номеру положения аминокислотного остатка, предшествующего вставленному(ым) аминокислотному(ым) остатку(ам). В приведенном выше примере последовательность выглядит следующим образом:

Множественные модификаиия. Варианты, содержащие множественные модификация, разделяют путем добавления меток ("+"), например "Arg170Tyr+Gly195Glu" или "R170Y+G195E" представляют замену тирозина и глутаминовой кислоты аргинином и глицином в положениях 170 и 195 соответственно.
Разные замены. Если в одно положение могут быть введены разные замены, то эти разные замены разделяют запятой, например "Arg170Tyr,Glu" или "R170Y,E" представляет замену аргинина тирозином или глутаминовой кислотой в положении 170. Таким образом, "Tyr167Gly,Ala + Arg170Gly,Ala" или "Y167G,A + R170G,A" обозначает следующие варианты:
"Tyr167Gly+Arg170Gly", "Tyr167Gly+Arg170Ala", "Tyr167Ala+Arg170Gly", и "Tyr167Ala+Arg170Ala".
Предпочтительные варианты:
Как указано в данном описании изобретения, авторы настоящего изобретения сделали ряд предпочтительных вариантов полипептида химозина, которые расщепляют αS1-казеин с разными желательными частотами по сравнению с соответствующим родительским полипептидом при увеличении значения С/Р этого варианта по меньшей мере в 2 раза по сравнению с выделенным верблюжьим химозином, характеризующимся зрелым полипептидом SEQ ID NO: 2.
Предпочтительные варианты с уменьшенной активностью расщепления αS1-казеина
Предпочтительные варианты полипептида химозина по настоящему изобретению включают варианты, отличающиеся тем, что (а) выделенный вариант полипептида химозина имеет значение С/Р, составляющее по меньшей мере 200% от значения С/Р выделенного верблюжьего химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2; и (б) выделенный вариант полипептида химозина, который расщепляет αS1-казеин с частотой менее 80% частоты расщепления αS1-казеина выделенным верблюжьим химозином, характеризующимся зрелым полипептидом SEQ ID NO: 2, где расщепление αS1-казеина определяют посредством количественного определения пептидов αS1-казеина, полученных путем инкубации обезжиренного молока с вариантом химозина или верблюжьим химозином, где количественное определение выполняют с помощью RP-HPLC в сочетании с масс-спектрометром ESI-Q-TOF.
В предпочтительных аспектах выделенные варианты полипептида химозина расщепляют αS1-казеин с частотой менее 80%, менее 50%, менее 40%, менее 30% или менее 20% от частоты расщепления αS1-казеина выделенным верблюжьим химозином, характеризующимся зрелым полипептидом SEQ ID NO: 2. Выделенные варианты полипептида химозина по настоящему изобретению имеют значение С/Р, которое составляет по меньшей мере 200% от значения С/Р выделенного верблюжьего полипептида химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2, включая значение С/Р, которое составляет по меньшей мере 200%, по меньшей мере 300%, по меньшей мере 500%, по меньшей мере 900%, по меньшей мере 1200% или по меньшей мере 1400% от значения С/Р выделенного верблюжьего полипептида химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2.
Родительский полипептид может иметь по меньшей мере 80%, такую как, например, по меньшей мере 80%), 85%, 95%, 97%, 98%, 99% идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин) или со зрелым полипептидом SEQ ID NO: 1 (бычий химозин).
В близком аспекте выделенный вариант полипептида химозина характеризуется тем, что (а) этот выделенный вариант полипептида химозина имеет значение С/Р, составляющее по меньшей мере 200% от значения С/Р выделенного верблюжьего химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2; и (б) выделенный вариант полипептида химозина расщепляет αS1-казеин с частотой, составляющей менее 80%) частоты расщепления αS1-казеина выделенным верблюжьим химозином, характеризующимся зрелым полипептидом SEQ ID NO: 2, где расщепление αS1-казеина определяют посредством количественного определения пептидов αS1-казеина, полученных путем инкубации обезжиренного молока с вариантом химозина или верблюжьим химозином, где количественное определение выполняют с помощью RP-HPLC в сочетании с масс-спектрометром ESI-Q-TOF, и который содержит одну или более следующих замен, где замена указана в отношении аминокислотной последовательности зрелого полипептида SEQ ID NO: 2: Y11I, Y11V, L12M, K19T, V51L, R61S, H76Q, E83S, I96L, L105E, D144Q, Q162S, S164G, M165E, L166V, L180I, V203A, L221I, S226T, T239S, R242E, G251D, G251W, L253I, V260T, I263L, R266V, S273Y, Q288E, G289S, E294Q, Y307F, V309I, R316L и/или V317L.
Кроме того, выделенный полипептид химозина с уменьшенной активностью расщепления αS1-казеина, описанный непосредственно выше, может содержать одну или более комбинаций следующих замен и где каждая замена указана в отношении к аминокислотной последовательности зрелого полипептида SEQ ID NO: 2:
Y21S+H76Q+Y307F+V317L,
R61S+L166V+T239S,
V32L+E294Q+R316L+V317L,
S226T+G244D+I263L+G289S,
V203A+V248I+G251W+L253I+Y268F,
D59N+L222I+G251D+E83S+Q162S,
D59N+L222I+G251D+Y21S+L215V+L105E,
D59N+L222I+G251D+H76Q+L105E+V260T,
D59N+L222I+G251D+V203A+R266V+F223A,
L12M+D59N+H76Q+S154A+M165E+V203A+L222I+G251D+V309I,
L12M+V51L+H76Q+M165E+G251D,
L12M+V51L+D59N+H76Q+L166V+L222I+G251D,
L12M+D59N+H76Q+D144Q+М165Е+V203A+L222I,
L12M+K19Т+D59N+H76Q+S154A+М165Е+V198I+L222I+G251D,
L12M+V51L+D59N+F66Y+H76Q+М165Е+V203A+L222I+G251W,
V51L+D59N+H76Q+M165E+L180I+L222I+G251D+E262T,
L12M+D59N+H76Q+M165E+G251D+Q288E+V309I+K321P,
D59N+H76Q+I96L+L130I+S164G+L222I+R242E+G251D,
H76Q+I96L+S164G+L222I+R242E+G251D+S273Y,
K19T+D59N+H76Q+I96L+S164G+L166V+L222I+G251D+S273Y,
H76Q+S164G+L166V+L222I+R242E+G251D+S273Y,
Y21S+H76Q+S164G+L222I+R242E+G251D+S273Y,
D59N+H76Q+I96L+S132A+S164G+L222I+S226T+G251D+S273Y,
D59N+H76Q+I96L+S132A+S164G+L166V+L222I+G251D+S273Y,
K19T+D59N+H76Q+S164G+L222I+N249D+S273Y,
H76Q+S164G+L222I+N249D+G251D+S273Y+V309I,
H76Q+I96L+S164G+G251D+S273Y+V309I,
K19T+D59N+H76Q+S164G+R242E+N249D+G251D+S273Y,
Y21S+D59N+H76Q+S164G+L222I+S226T+G251D+S273Y+V309I
D59N+H76Q+I96L+S164G+L222I+S226T+N249D+G251D+S273Y,
H76Q+S164G+L166V+L222I+S226T+S273Y,
D59N+H76Q+L130I+S164G+L166V+L222I+G251D+S273Y+V309I,
D59N+H76Q+S164G+L222I+S226T+R242E,
K19T+D59N+I96L+S164G+L222I+G251D,
D59N+H76Q+I96L+S164G+L222I+S226T+G251D+S273Y+V309I,
D59N+H76Q+L130I+S164G+G251D+V309I,
D59N+H76Q+L130I+L166V+L222I+N249D+G251D+S273Y,
Y21S+D59N+H76Q+I96L+S164G+L222I+N249D+G251D+S273Y,
K19T+D59N+S164G+L166V+L222I+S226T+G251D+S273Y,
D59N+H76Q+L130I+S132A+S164G+L222I+R242E+G251D+S273Y,
K19T+Y21S+H76Q+S164G+L222I+G251D+S273Y,
D59N+H76Q+S164G+L222I+R242E+S273Y+V309I,
K19T+Y21S+D59N+H76Q+S132A+S164G+L222I+G251D+S273Y,
K19T+D59N+H76Q+L130I+S164G+L222I+S226T+G251D+S273Y,
D59N+H76Q+S164G+L166V+L222I+N249D+G251D+S273Y+V309I,
K19T+Y21S+D59N+H76Q+L130I+S164G+L222I+S273Y,
Y21S+D59N+S164G+L222I+R242E+G251D+S273Y+V309I,
K19T+D59N+H76Q+L166V+L222I+R242E+G251D+S273Y,
D59N+S132A+S164G+L222I+R242E+N249D+G251D+S273Y,
D59N+H76Q+I96L+L130I+S164G+L222I+N249D+G251D+S273Y,
Y21S+D59N+H76Q+S164G+L166V+N249D+G251D+S273Y,
H76Q+S132A+S164G+L222I+N249D+G251D,
D59N+H76Q+S132A+S164G+L166V+S273Y,
K19T+D59N+H76Q+S132A+L222I+G251D+S273Y+V309I,
H76Q+L1301+L222I+S226T+G251D+S273Y,
Y21S+D59N+H76Q+I96L+L222I+S273Y,
Y11I+K19T+D59N+E83S+I96L+S164G+L222I+N249D,
Y11I+K19T+I96L+S164G+L222V+R242E+G251D,
Y11V+K19T+I96L+S164G+L166V+L222I+R242E,
Y11V+E83S+I96L+S164G+L222I+R242E+G251D+L253I+I263L,
Y11V+I96L+S164G+L222I+R242E+N249D+L253I+I263L,
K19S+I96L+S164G+L166V+L222I+R242E,
K19T+I96L+S164G+L166V+L222I+R242E+N249D+I263L,
Y11V+K19T+D59N+I96L+S164N+L166I+L222I+G251D,
H76Q+I96L+S164G+L222I+R242E+G251D+S273Y,
Y11V+K19T+E83S+I96L+S164G+L166V+L222I+R242E+G251D,
Y11V+E83S+I96L+S164G+L222I+R242E+L253I+I263L,
Y11V+K19T+D59N+I96L+S164G+L166V+L222I+R242E+G251D+L253I,
K19T+D59N+I96V+S164G+L166V+L222I+R242E+I263L,
Y11V+D59N+I96L+S164G+L222I+G251D+L253V,
I96L+S164G+L166V+L222I+R242E+N249D+I263L,
K19S+D59N+I96L+S164G+L222I+R242E+N249E+G251D,
H76Q+I96L+S164G+L222I+R242E+G251D,
Y11I+K19T+D59N+S164G+L222I+G251D+1263V,
K19T+I96L+S164G+L166V+L222I+R242E+N249D+G251D+I263V,
K19T+E83S+I96L+S164G+L222I+R242E+G251D+L253I,
I96L+S164G+L222I+R242E+N249D+G251D+I263L,
K19T+D59N+I96L+S164G+L166V+L222I+R242D+G251D+L253I,
D59N+I96L+S164G+L222I+R242E+L253I+I263L,
K19T+I96L+S164G+L166V+L222I+N249D+I263L,
K19T+D59N+I96L+S164G+L166I+L222I+R242D+G251D+I263V,
K19T+D59N+I96L+S164G+L222V+R242E+N249D+L253I,
K19T+D59N+I96L+S164G+L166I+L222I+R242E+N249D,
K19T+E83S+I96L+S164G+L222I+R242E+N249D+G251D+L253I,
I96L+S164G+L222I+R242E+G251D+S273Y,
K19T+E83T+I96L+S164G+L222I+R242E+L253V,
K19T+I96L+S164G+R242E+L253I,
K19T+D59N+I96L+S164G+L222I+N249E+G251D+L253V+I263L,
K19T+D59N+I96L+S164G+L222V+N249E+G251D+1263V,
I96L+S164G+L222I+R242E+G251D,
K19T+I96L+S164N+L222I+R242E+I263L,
K19T+E83S+I96L+S164G+L166V+L222I+R242E+N249D+G251D+L253I,
K19T+D59N+E83T+S164G+L166V+L222I+R242D+G251D,
K19T+D59N+I96L+S164G+L222I+G251D,
D59N+I96L+L166V+L222I+R242E+G251D,
Y11I+K19T+D59N+I96V+L222I+R242D+G251D,
K19T+I96V+S164G+L222I+N249D+G251D+L253I,
H76Q+N100Q+N291Q,
R67Q+L130I+M157L+D158S+R242E+N291Q,
V32L+R67Q+L130I+M157L+K231N+M256L,
R67Q+VI361+M157L+L222I+V248I,
Y11V+R67Q+L130I+M157L+L222I+R242E,
R67Q+I96L+N100Q+L130I+M157L+N292H.
Y11I+D59N+I96L+S164G+L166V+L222V+R242E+G251D+L253I,
Y11I+D59N+I96L+S164G+L166V+L222V+R242E+G251D,
Y11I+D59N+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11I+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11V+K19T+I96L+L166V+L222V+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222V+R242E+N249E+G251D+L253I,
Y11I+K19T+D59N+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166V+L222I+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166V+L222V+R242E+N249E+L253I,
Y11V+K19T+D59N+I96L+L166V+L222V+R242E+N249E+G251D+L253I,
Y11V+K19T+D59N+I96L+S164G+L166V+L222I+R242E+N249E,
Y11V+K19T+D59N+I96L+S164G+L166V+L222V+R242E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166V+R242E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166I+L222I+R242E+G251D,
Y11V+K19T+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166I+L222V+R242E+N249E+G251D,
Y11V+D59N+I96L+S164G+L166I+L222I+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+I96L+S164G+L222I+R242E,
Y11I+K19T+I96L+S164G+L166V+R242E+N249E+G251D,
Y11I+I96L+S164G+L222I+R242E,
Y11I+K19T+D59N+I96L+S164G+L222I+R242E+N249E+G251D,
Y11V+D59N+I96L+S164G+L166I+L222V+R242E+G251D+L253I,
Y11I+K19T+D59N+I96L+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222I+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L222I+R242E+N249E+G251D,
Y11I+D59N+I96L+S164G+L222I+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+R242E+N249E+G251D+L253I,
Y11I+D59N+I96L+S164G+L222V+R242E+N249E+G251D,
Y11I+K19T+S164G+L166I+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+S164G+L166V+L222I+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166V+R242E,
Y11I+K19T+D59N+I96L+S164G+L222V+R242E+N249E,
Y11V+K19T+D59N+I96L+S164G+L222V+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222V+R242E+G251D,
Y11I+I96L+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+S164G+L166I+L222V+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+L222V+R242E+G251D,
Y11V+K19T+D59N+S164G+L166I+L222I+R242E+G251D,
Y11V+K19T+D59N+LI66V+L222I+R242E+N249E+G251D+L253I,
Y11V+K19T+I96L+L222V+R242E+N249E+G251D or
Y11I+K19T+L222V+R242E+N249E+G251D.
Предпочтительные варианты с повышенной активностью расщепления αS1-казеина
Предпочтительные выделенные варианты полипептида химозина по настоящему изобретению включают варианты, характеризующиеся тем, что (а) выделенный вариант полипептида химозина имеет значение С/Р, составляющее по меньшей мере 200% от значения С/Р выделенного верблюжьего химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2; и (б) выделенный вариант полипептида химозина расщепляет αS1-казеин с частотой, составляющей более 115% от частоты расщепления αS1-казеина выделенным верблюжьим полипептидом химозина, характеризующимся зрелым полипептидом SEQ ID NO: 2, где расщепление αS1-казеина определяют посредством количественного определения пептидов αS1-казеина, полученных путем инкубации обезжиренного молока с вариантом химозина или верблюжьим химозином, где количественное определение выполняют с помощью RP-HPLC в сочетании с масс-спектрометром ESI-Q-TOF.
В предпочтительных аспектах выделенные варианты полипептида химозина расщепляют αS1-казеин с частотой, составляющей по меньшей мере 125%, по меньшей мере 130%, по меньшей мере 140%, по меньшей мере 145% или по меньшей мере 150% от частоты расщепления αS1-казеина выделенным зрелым верблюжьем химозином, характеризующимся зрелым полипептидом SEQ ID NO: 2. Выделенные варианты полипептида химозина, имеющие повышенную активность расщепления αS1-казеина, имеют значение С/Р, которое составляет по меньшей мере 200% от значения С/Р для выделенного верблюжьего полипептида химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2, включая значение С/Р, которое составляет по меньшей мере 200%), по меньшей мере 300%, по меньшей мере 500%, по меньшей мере 900%, по меньшей мере 1200% или по меньшей мере 1400% от значения С/Р выделенного верблюжьего полипептида химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2. Родительский полипептид может иметь по меньшей мере 80%, такую как, например, по меньшей мере 80%, 85%, 95%, 97%, 98%, 99% идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин) или со зрелым полипептидом SEQ ID NO: 1 (бычий химозин).
В близком аспекте выделенный вариант полипептида химозина, характеризующийся тем, что (а) этот выделенный вариант полипептида химозина имеет значение С/Р, составляющее по меньшей мере 200% от значения С/Р выделенного верблюжьего химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2; и (б) выделенный вариант полипептида химозина расщепляет αS1-казеин с частотой более 115% от частоты расщепления αS1-казеина выделенным верблюжьим полипептидом химозина, характеризующимся зрелым полипептидом SEQ ID NO: 2, где расщепление αS1-казеина определяют посредством количественного определения пептидов αS1-казеина, полученных путем инкубации обезжиренного молока с вариантом химозина или верблюжьим химозином, где количественное определение выполняют с помощью RP-HPLC в сочетании с масс-спектрометром ESI-Q-TOF, содержит одну или более следующих замен, где замена указана в отношении аминокислотной последовательности зрелого полипептида SEQ ID NO: 2: V32L, I45V, N50K, G70D, G70N, D98V, N100Q, V136I, M142I, H146R, S154A, V155F, M157L, D158S, V198I, I200V, F223V, K231N, G244D, V248I, R254S, M256L, V259I, Е262Т, D267Q, D279E, T284S, N291Q N292H, L295K и/или K321P.
Альтернативно, выделенный полипептид химозина с повышенной активностью расщепления αS1-казеина, описанный выше, может содержать одну или более комбинаций следующих замен, и где каждая замена указана в отношении аминокислотной последовательности зрелого полипептида SEQ ID NO: 2:
G70D+S74F+D158S+R254S+S277N,
L130I+M142I+I200V+V259I+E294Q,
Y21S+R61S+H146R,
R61S+G163E+M256L+S277N,
D59N+S271P+T284S,
V248I+S226T+E294Q,
S74F+G244D+S271P,
V221K+V248I+S255Y,
V183I+G251W+M256L,
R61Q+V136I+Y268F+T284S+Y307F,
N50K+D158S+V203A+E294Q,
D98V+G251D+M256L+V259I,
V183I+V248I+G244D+T284S,
N50K+R61S+Y127F+G244D+G251D,
I96L+F223V+G244D+R254S+M256L,
H146R+D158S+S273Y,
S74F+V259I+Y268F,
G70N+D98V+V136I,
I96L+M142I+R145Q+H146R,
V32L+G163E+T186S+Q188E+L295K,
R61Q+V136I+Y268F+T284S+Y307F,
S132A+Q188E+F223V,
I200V+G251D+G289S,
N50K+D158S+V203A+E294Q,
F223V+G251W+S273Y+D279E,
D59N+L222I+G251D+V32L+L12M+T284S,
D59N+L222I+G251D+V155F+E262T+V32L,
D59N+L222I+G251W+S154A+V203A,
D59N+L222I+G251D+V32L+K321P+V260T,
D59N+L222I+G251D+V198I+V203A+K321P,
D59N+L222I+G251D+S273Y+T284S+D267Q
V32L+N100Q+N291Q,
N292H+N100Q+N291Q,
V221K+N100Q+N291Q,
I297A+N100Q+N291Q,
R67Q+N100Q+L130I+M157L+L222I+K231N,
R67Q+L130I+V248I+M256L+N292H,
V32L+R67Q+L130I+K231N+N292H,
L130I+M157L+V248I+M256L+N291Q,
V32L+R67Q+V136I+M157L+N291Q,
R67Q+L130I+K231N+V248I+N291Q,
V32L+R67Q+G70D+N100Q+M157L,
R67Q+N100Q+L130I+D158S+V248I,
R67Q+N100Q+L130I+M157L+K231N+N291Q,
R67Q+N100Q+L130I+M157L+V248I+N291Q и/или
N100Q+L130I+S132A+M157L+K231.
Выделенные варианты полипептида химозина по настоящему изобретению сохраняют высокую общую идентичность последовательности с природным полипептидом химозином. Например, варианты полипептида по настоящему изобретению предпочтительно обладают по меньшей мере 80% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 2, включая по меньшей мере 85%, 95%, 97%, 98% или 99% идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин).
Как обсуждается выше - на основе, например, компьютерной программы выравнивания последовательностей, обсуждаемой в данном документе - определение релевантного в данном случае положения аминокислоты релевантного здесь полипептида интересующего химозина (например верблюда, овцы, крупного рогатого скота и т.д.). является рутинной работой для квалифицированного специалиста.
В частности, вариант верблюжьего химозина, например с 5-10 модификациями (например заменами) по сравнению с верблюжьим полипептидом химозина дикого типа, имеющего SEQ ID NO: 2, будет по-прежнему являться родительским полипептидом, который имеет по меньшей мере 65% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюд).
Другими словами, релевантный здесь выделенный вариант полипептида химозина может иметь дополнительные модификации (например замены) в другом положении, чем заявленные здесь положения.
Как понятно специалисту в данном контексте - релевантные здесь проценты идентичности последовательности химозина, например взрослой овцы, верблюда бактриана, верблюда, свиньи или крысы, со зрелым полипептидом SEQ ID NO: 1 (бычий химозин - то есть аминокислотные положения 59-381 в SEQ ID NO: 1) относительно сходны с вышеуказанными процентными значениями идентичности.
В предпочтительном воплощении родительский полипептид имеет по меньшей мере 92% идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин), более предпочтительно, родительский полипептид имеет по меньшей мере 95% идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин) и еще более предпочтительно, родительский полипептид имеет по меньшей мере 97% идентичностью последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин). Может быть предпочтительным, что родительский полипептид представляет собой зрелый полипептид SEQ ID NO: 2 (верблюжий химозин).
Может быть предпочтительным, чтобы выделенный вариант верблюжьего химозина содержал менее 30 аминокислотных модификаций (например замен) по сравнению со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин), или может быть предпочтительным, чтобы выделенный вариант верблюжьего химозина содержал менее 20 аминокислотных модификаций (например замен) по сравнению со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин), или может быть предпочтительным, чтобы выделенный вариант верблюжьего химозина содержал менее 10 аминокислотных модификаций (например замен) по сравнению со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин), или может быть предпочтительным, чтобы выделенный вариант верблюжьего химозина содержал менее 5 аминокислотных модификаций (например замен) по сравнению со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин).
Как понятно специалисту в настоящем контексте, указанный выше термин "выделенный вариант полипептида имеет менее чем 100% идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин)" относится к тому, что описанный в данном описании изобретения выделенный вариант верблюжьего химозина не должен иметь полипептидную последовательность, которая на 100% идентична общеизвестной последовательности зрелого верблюжьего химозина дикого типа, имеющего SEQ ID NO: 2.
Может быть предпочтительным, чтобы по меньшей мере одна модификация представляла собой замещение, то есть релевантное в данном документе предпочтительное воплощение относится к варианту выделенного полипептида химозина, где модификация включает замещение в по меньшей мере одном аминокислотном положении, соответствующем любому из заявленных здесь положений.
Предпочтительно, родительский полипептид имеет по меньшей мере 80%, например 85%, 90%, 95%, 97%, 98% или 99% идентичность последовательности со зрелым полипептидом SEQ ID NO: 1 (бычий химозин) и/или SEQ ID NO: 2 (верблюжий химозин).
Только в качестве примера, подходящий здесь релевантный родительский полипептид может, например, представлять собой бычий химозин А - как известно в данной области техники, бычий химозин А может здесь отличаться только одной аминокислотой по сравнению с бычьим химозином В, имеющим SEQ ID NO: 1.
Как понятно специалисту в данном контексте, релевантный здесь родительский полипептид, имеющий химозиновую активность, может уже, например, быть вариантом, например соответствующего химозина дикого типа.
Например, вариант бычьего химозина, например с 5-10 модификациями (например заменами) по сравнению со зрелым полипептидом бычьего химозина дикого типа, имеющим SEQ ID NO: 1, по-прежнему является родительским полипептидом, который имеет по меньшей мере 95% идентичность последовательности со зрелым полипептидом SEQ ID NO: 1 (бычий химозин).
Другими словами и в общем случае, релевантный здесь выделенный вариант полипептида химозина может содержать модификации (например замены) в других положениях, чем заявленные здесь положения.
Как понятно специалисту в настоящем контексте, выделенный вариант химозина может содержать модификации (например замены) в других аминокислотных положениях, чем представленные выше.
Например, вариант бычьего химозина, например с 5-10 модификациями (например заменами) по сравнению с полипептидом бычьего химозина дикого типа, имеющим SEQ ID NO: 1, по-прежнему является родительским полипептидом, который имеет по меньшей мере 95% идентичность последовательности со зрелым полипептидом SEQ ID NO: 1 (бычий химозин).
Может быть предпочтительным, чтобы выделенный вариант бычьего химозина содержал менее 30 аминокислотных модификаций (например замен) по сравнению со зрелым полипептидом SEQ ID NO: 1 (бычий химозин), или может быть предпочтительным, чтобы выделенный вариант бычьего химозина содержал менее 20 аминокислотных модификаций (например замен) по сравнению со зрелым полипептидом SEQ ID NO: 1 (бычий химозин), или может быть предпочтительным, чтобы выделенный вариант бычьего химозина содержал менее 10 аминокислотных модификаций (например замен) по сравнению со зрелым полипептидом SEQ ID NO: 1 (бычий химозин), или может быть предпочтительным, чтобы выделенный вариант бычьего химозина содержал менее 5 аминокислотных модификаций (например замен) по сравнению со зрелым полипептидом SEQ ID NO: 1 (бычий химозин).
Другими словами - зрелый полипептид родительского химозина (например овцы или свиньи), который имеет по меньшей мере 65% идентичность последовательности со зрелым бычьим химозином, считается достаточно структурно идентичным, например, бычьему или верблюжьему химозину, для того чтобы быть релевантным здесь, то есть в данном контексте, зрелому полипептиду родительского химозина (например овцы или крысы), который имеет по меньшей мере 80% идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин), может здесь считаться достаточно структурно соответствующим, например, бычьему или верблюжьему химозину, чтобы быть улучшенным путем получения варианта по любому из аминокислотных положений, как описано в данном документе.
Полипептид верблюжьего химозина SEQ ID NO: 2 имеет 84% идентичность последовательности с бычьим полипептидом SEQ ID NO: 1 (то есть полным SEQ ID NO: 1 от положения 1 до положения 381, который включает пре- и про-последовательность).
Способ получения выделенного варианта полипептида химозина
Настоящее изобретение также относится к способу получения выделенного варианта полипептида химозина, отличающегося тем, что (а) этот выделенный вариант полипептида химозина имеет значение С/Р, составляющее по меньшей мере 200% от значения С/Р выделенного верблюжьего химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2; и (б) выделенный вариант полипептида химозина расщепляет αS1-казеин с частотой менее 80% от частоты расщепления αS1-казеина выделенным верблюжьим химозином, характеризующимся зрелым полипептидом SEQ ID NO: 2, где расщепление αS1-казеина определяют посредством количественного определения пептидов αS1-казеина, полученных путем инкубации обезжиренного молока с вариантом химозина или верблюжьим химозином, где количественное определение выполняют с помощью RP-HPLC в сочетании с масс-спектрометром ESI-Q-TOF, включающему следующие стадии:
(а): модификацию в одном или более положениях последовательности ДНК, кодирующей зрелый полипептид SEQ ID NO: 2, где модификация включает одну или более следующих замен, где замена указана по отношению к аминокислотной последовательности зрелого полипептида SEQ ID NO: 2: Y11I, Y11V, L12M, K19T, V51L, R61S, H76Q, E83S, I96L, L105E, D144Q, Q162S, S164G, M165E, LI66V, L180I, V203A, L222I, S226T, R242E, G251W, L253I, V260T, I263L, R266V, S273Y, T239S, G251D, Q288E, G289S, E294Q, Y307F, V309I, R316L, V317L;
(б): получение и выделение модифицированного полипептида со стадии (а).
В родственном аспекте настоящее изобретение также относится к способу получения выделенного варианта полипептида химозина, характеризующегося тем, что (а) этот выделенный вариант полипептида химозина имеет значение С/Р, составляющее по меньшей мере 200% от значения С/Р выделенного верблюжьего химозина, характеризующегося зрелым полипептидом SEQ ID NO: 2; и (б) выделенный вариант полипептида химозина расщепляет αS1-казеин с частотой, превышающей 115% частоты расщепления αS1-казеина выделенным полипептидом верблюжьего химозина, характеризующимся зрелым полипептидом SEQ ID NO: 2, где расщепление αS1-казеина определяют посредством количественного определения пептидов αS1-казеина, полученных путем инкубации обезжиренного молока с вариантом химозина или верблюжьим химозином, где количественное определение выполняют с помощью RP-HPLC в сочетании с масс-спектрометром ESI-Q-TOF, включающему следующие стадии:
(а): модификацию одного или более положений в последовательности ДНК, кодирующей зрелый полипептид SEQ ID NO: 2, где модификация включает одну или более следующих замен, где замена указана по отношению к аминокислотной последовательности зрелого полипептида SEQ ID NO: 2: V32L, I45V, N50K, G70D, G70N, D98V, N100Q, V136I, M142I, H146R, S154A, V155F, M157L, D158S, V198I, I200V, F223V, K231N, G244D, V248I, R254S, M256L, V259I, E262T, D267Q, D279E, T284S, N291Q N292H, L295K и/или K321P;
(б): получение и выделение модифицированного полипептида со стадии (а).
Как обсуждалось выше, как известно в данной области, специалист в данной области может, на основании общих знаний, обычным способом получать и очищать химозин и варианты химозина.
Другими словами, при наличии у специалиста релевантного здесь родительского полипептида, имеющего интересующую химозиновую активность (например из крупного рогатого скота, верблюдов, овец, свиней или крыс) и раскрытого в данном описании изобретения руководства, получение варианта такого родительского интересующего химозина является рутинной работой для специалиста.
Примером подходящего способа получения и выделения химозина (варианта или родительского) может являться, например, хорошо известная технология на основе грибковой рекомбинантной экспрессии/производства, как, например, описано в WO 02/36752A2 (Chr. Hansen).
Также для специалиста в данной области рутинной работой является модификация одного или более положений родительского полипептида, имеющего химозиновую активность, где модификация включает замену, удаление или вставку по меньшей мере в одном аминокислотном положении, как описано в данном описании. Как известно специалисту в данной области, это может быть получено, например, посредством так называемого сайт-направленного мутагенеза и технологии на основе рекомбинантной экспрессии/продуцирования.
Для квалифицированного специалиста также является рутинной работой определение наличия или отсутствия химозиновой активности у релевантного здесь родительского полипептида (например верблюжьего или бычьего химозина дикого типа) и/или у релевантного здесь варианта химозина.
Как известно в данной области, специфичность химозина может быть определена по так называемому значению С/Р, которое определяют путем деления удельной свертывающей активности (С) на протеолитическую активность (Р). Как известно в данной области техники, более высокое значение С/Р подразумевает, как правило, что потеря белка во время, например, производства сыра из-за снижения неспецифического разрушения белка понижена, то есть выход сыра улучшен.
Как известно в данной области техники, расщепление αS1-казеина и образование αS1-казеина (в том числе αS1(1-23)) можно определить, используя стандартные методы, доступные специалисту в данной области.
Дополнительные способы представлены в примерах.
Способ изготовления молочного продукта
Как обсуждалось выше, выделенный вариант полипептида химозина, как описано здесь, можно использовать в соответствии с уровнем техники, например для получения интересующего молочного продукта (такого как, например, сырный продукт).
Как обсуждалось выше, один аспект изобретения относится к способу получения пищевого или кормового продукта, включающему добавление эффективного количества выделенного варианта полипептида химозина, как описано в данном описании изобретения, к пищевому(ым) или кормовому(ым) ингредиенту(ам) и осуществление дальнейших стадий получения пищевого или кормового продукта.
Предпочтительно, пищевой или кормовой продукт представляет продукт на основе молока, и способ включает добавление эффективного количества выделенного варианта полипептида химозина, как описано в данном описании изобретения, в молоко и осуществление дальнейших стадий производства с получением продукта на основе молока.
Например, вариант полипептида химозина по настоящему изобретению может быть добавлен к молочному продукту после ферментации молока. В одном аспекте вариант полипептида химозина по настоящему изобретения добавляют для коагуляции ферментированного молочного продукта, как часть способа получения сыра.
Молоко может представлять собой, например, соевое молоко, овечье молоко, козье молоко, буйволиное молоко, молоко яка, молоко ламы, верблюжье молоко или коровье молоко.
Продукт на основе молока может, например, представлять собой ферментированный молочный продукт, такой как творог кварк или сыр.
Пищевые и кормовые продукты
В настоящем изобретении также предложены пищевые и кормовые продукты, содержащие вариант полипептида химозина по настоящему изобретению или вариант полипептида химозина, получаемый согласно способу по настоящему изобретению. Пищевой и кормовой продукт предпочтительно представляет собой ферментированный пищевой продукт, такой как ферментированный молочный продукт, включая сыр и творог кварк.
В альтернативном, но еще родственном аспекте, изобретение относится к аспектам, перечисленным ниже:
Аспект 1. Способ получения выделенного варианта полипептида химозина, имеющего измененную частоту расщепления αS1-казеина по сравнению с родительским полипептидом, включающий стадии:
(а): осуществление модификации в одном или более положениях родительского полипептида, где модификация включает замену, удаление или вставку по меньшей мере в одном аминокислотном положении, соответствующем любому из положений: Y11I, Y11V, L12M, K19T, V51L, R61S, H76Q, E83S, I96L, L105E, D144Q, Q162S, S164G, М165Е, L166V, L180I, V203A, L222I, S226T, T239S, R242E, G251D, G251W, L253I, V260T, I263L, R266V, S273Y, Q288E, G289S, E294Q, Y307F, V309I, R316L, V317L, V32L, I45V, N50K, G70D, G70N, D98V, N100Q,_V136I, M142I, H146R, S154A, V155F, M157L, D158S, V198I, I200V, F223V, K231N, G244D, V248I, R254S, M256L, V259I, Е262Т, D267Q, D279E, T284S, N291Q N292H, L295K и/или K321P,
(б): получение и выделение модифицированного полипептида со стадии (а),
и где:
(1): аминокислотное положение в родительском полипептиде определяют посредством выравнивания родительского полипептида со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин); и
(2): родительский полипептид имеет по меньшей мере 65% идентичность последовательности со зрелым полипептидом SEQ ID NO: 1 (бычий химозин) и/или по меньшей мере 65% идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин).
Аспект 2. Способ согласно аспекту 1, где выделенный вариант полипептида химозина имеет:
- химозиновую активность, обеспечивающую более низкую частоту расщепления αS1-казеина по сравнению с частотой расщепления αS1-казеина бычьим химозином, содержащим зрелый полипептид SEQ ID NO: 1, и/или
- химозиновую активность, обеспечивающую более низкую частоту расщепления αS1-казеина по сравнению с частотой расщепления αS1-казеина верблюжьим химозином, содержащим зрелый полипептид SEQ ID NO: 2.
Аспект 3. Способ получения выделенного варианта полипептида химозина по п. 2, где модификация представляет собой одну или более замен: Y11I, Y11V, L12M, K19T, V51L, R61S, H76Q, E83S, I96L, L105E, D144Q, Q162S, S164G, М165Е, L166V, L180I, V203A, L222I, S226T, T239S, R242E, G251D, G251W, L253I, V260T, I263L, R266V, S273Y, Q288E, G289S, E294Q, Y307F, V309I, R316L и/или V317L.
Аспект 4. Способ согласно любому из аспектов 2 и 3, где выделенный вариант полипептида химозина содержит модификацию в одной или более комбинациях положений, включающих положения, соответствующие:
Y21S+H76Q+Y307F+V317L,
R61S+L166V+T239S,
V32L+E294Q+R316L+V317L,
S226T+G244D+I263L+G289S,
V203A+V248I+G251W+L253I+Y268F,
D59N+L222I+G251D+E83S+Q162S,
D59N+L222I+G251D+Y21S+L215V+L105E,
D59N+L222I+G251D+H76Q+L105E+V260T,
D59N+L222I+G251D+V203A+R266V+F223A,
L12M+D59N+H76Q+S154A+М165Е+V203A+L222I+G251D+V309I,
L12M+V51L+H76Q+М165Е+G251D,
L12M+V51L+D59N+H76Q+L166V+L222I+G251D,
L12M+D59N+H76Q+D144Q+М165Е+V203A+L222I,
L12M+K19T+D59N+H76Q+S154A+М165Е+V198I+L222I+G251D,
L12M+V51L+D59N+F66Y+H76Q+М165Е+V203A+L222I+G251W,
V51L+D59N+H76Q+M165E+L180I+L222I+G251D+E262T,
L12M+D59N+H76Q+M165E+G251D+Q288E+V309I+K321P,
D59N+H76Q+I96L+L130I+S164G+L222I+R242E+G251D,
H76Q+I96L+S164G+L222I+R242E+G251D+S273Y,
K19T+D59N+H76Q+I96L+S164G+L166V+L222I+G251D+S273Y,
H76Q+S164G+L166V+L222I+R242E+G251D+S273Y,
Y21S+H76Q+S164G+L222I+R242E+G251D+S273Y,
D59N+H76Q+I96L+S132A+S164G+L222I+S226T+G251D+S273Y,
D59N+H76Q+I96L+S132A+S164G+L166V+L222I+G251D+S273Y,
K19T+D59N+H76Q+S164G+L222I+N249D+S273Y,
H76Q+S164G+L222I+N249D+G251D+S273Y+V309I,
H76Q+I96L+S164G+G251D+S273Y+V309I,
K19T+D59N+H76Q+S164G+R242E+N249D+G251D+S273Y,
Y21S+D59N+H76Q+S164G+L222I+S226T+G251D+S273Y+V309I
D59N+H76Q+I96L+S164G+L222I+S226T+N249D+G251D+S273Y,
H76Q+S164G+L166V+L222I+S226T+S273Y,
D59N+H76Q+L130I+S164G+L166V+L222I+G251D+S273Y+V309I,
D59N+H76Q+S164G+L222I+S226T+R242E,
K19T+D59N+I96L+S164G+L222I+G251D,
D59N+H76Q+I96L+S164G+L222I+S226T+G251D+S273Y+V309I,
D59N+H76Q+L130I+S164G+G251D+V309I,
D59N+H76Q+L130I+L166V+L222I+N249D+G251D+S273Y,
Y21S+D59N+H76Q+I96L+S164G+L222I+N249D+G251D+S273Y,
K19T+D59N+S164G+L166V+L222I+S226T+G251D+S273Y,
D59N+H76Q+L130I+S132A+S164G+L222I+R242E+G251D+S273Y,
K19T+Y21S+H76Q+S164G+L222I+G251D+S273Y,
D59N+H76Q+S164G+L222I+R242E+S273Y+V309I,
K19T+Y21S+D59N+H76Q+S132A+S164G+L222I+G251D+S273Y,
K19T+D59N+H76Q+L130I+S164G+L222I+S226T+G251D+S273Y,
D59N+H76Q+S164G+L166V+L222I+N249D+G251D+S273Y+V309I,
K19T+Y21S+D59N+H76Q+L130I+S164G+L222I+S273Y,
Y21S+D59N+S164G+L222I+R242E+G251D+S273Y+V309I,
K19T+D59N+H76Q+L166V+L222I+R242E+G251D+S273Y,
D59N+S132A+S164G+L222I+R242E+N249D+G251D+S273Y,
D59N+H76Q+I96L+L130I+S164G+L222I+N249D+G251D+S273Y,
Y21S+D59N+H76Q+S164G+L166V+N249D+G251D+S273Y,
H76Q+S132A+S164G+L222I+N249D+G251D,
D59N+H76Q+S132A+S164G+L166V+S273Y,
K19T+D59N+H76Q+S132A+L222I+G251D+S273Y+V309I,
H76Q+L130I+L222I+S226T+G251D+S273Y,
Y21S+D59N+H76Q+I96L+L222I+S273Y,
Y11I+K19T+D59N+E83S+I96L+S164G+L222I+N249D,
Y11I+K19T+I96L+S164G+L222V+R242E+G251D,
Y11V+K19T+I96L+S164G+L166V+L222I+R242E,
Y11V+E83S+I96L+S164G+L222I+R242E+G251D+L253I+I263L,
Y11V+I96L+S164G+L222I+R242E+N249D+L253I+I263L,
K19S+I96L+S164G+L166V+L222I+R242E,
K19T+I96L+S164G+L166V+L222I+R242E+N249D+I263L,
Y11V+K19T+D59N+I96L+S164N+L166I+L222I+G251D,
H76Q+I96L+S164G+L222I+R242E+G251D+S273Y,
Y11V+K19T+E83S+I96L+S164G+L166V+L222I+R242E+G251D,
Y11V+E83S+I96L+S164G+L222I+R242E+L253I+I263L,
Y11V+K19T+D59N+I96L+S164G+L166V+L222I+R242E+G251D+L253I,
K19T+D59N+I96V+S164G+L166V+L222I+R242E+I263L,
Y11V+D59N+I96L+S164G+L222I+G251D+L253V,
I96L+S164G+L166V+L222I+R242E+N249D+I263L,
K19S+D59N+I96L+S164G+L222I+R242E+N249E+G251D,
H76Q+I96L+S164G+L222I+R242E+G251D,
Y11I+K19T+D59N+S164G+L222I+G251D+I263V,
K19T+I96L+S164G+L166V+L222I+R242E+N249D+G251D+I263V,
K19T+E83S+I96L+S164G+L222I+R242E+G251D+L253I,
I96L+S164G+L222I+R242E+N249D+G251D+I263L,
K19T+D59N+I96L+S164G+L166V+L222I+R242D+G251D+L253I,
D59N+I96L+S164G+L222I+R242E+L253I+I263L,
K19T+I96L+S164G+L166V+L222I+N249D+I263L,
K19T+D59N+I96L+S164G+L166I+L222I+R242D+G251D+I263V,
K19T+D59N+I96L+S164G+L222V+R242E+N249D+L253I,
K19T+D59N+I96L+S164G+L166I+L222I+R242E+N249D,
K19T+E83S+I96L+S164G+L222I+R242E+N249D+G251D+L253I,
I96L+S164G+L222I+R242E+G251D+S273Y,
K19T+E83T+I96L+S164G+L222I+R242E+L253V,
K19T+I96L+S164G+R242E+L253I,
K19T+D59N+I96L+S164G+L222I+N249E+G251D+L253V+I263L,
K19T+D59N+I96L+S164G+L222V+N249E+G251D+I263V,
I96L+S164G+L222I+R242E+G251D,
K19T+I96L+S164N+L222I+R242E+I263L,
K19T+E83S+I96L+S164G+L166V+L222I+R242E+N249D+G251D+L253I,
K19T+D59N+E83T+S164G+L166V+L222I+R242D+G251D,
K19T+D59N+I96L+S164G+L222I+G251D,
D59N+I96L+L166V+L222I+R242E+G251D,
Y11I+K19T+D59N+I96V+L222I+R242D+G251D,
K19T+I96V+S164G+L222I+N249D+G251D+L253I,
R67Q+L130I+M157L+D158S+R242E+N291Q,
V32L+R67Q+L130I+M157L+K231N+M256L,
R67Q+V136I+M157L+L222I+V248I,
Y11V+R67Q+L130I+M157L+L222I+R242E,
R67Q+I96L+N100Q+L130I+M157L+N292H,
H76Q+N100Q+N291Q,
Y11I+D59N+I96L+S164G+LI66V+L222V+R242E+G251D+L253I,
Y11I+D59N+I96L+S164G+L166V+L222V+R242E+G251D,
Y11I+D59N+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11I+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11V+K19T+I96L+L166V+L222V+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222V+R242E+N249E+G251D+L253I,
Y11I+K19T+D59N+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166V+L222I+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166V+L222V+R242E+N249E+L253I,
Y11V+K19T+D59N+I96L+L166V+L222V+R242E+N249E+G251D+L253I,
Y11V+K19T+D59N+I96L+S164G+L166V+L222I+R242E+N249E,
Y11V+K19T+D59N+I96L+S164G+L166V+L222V+R242E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166V+R242E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166I+L222I+R242E+G251D,
Y11V+K19T+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166I+L222V+R242E+N249E+G251D,
Y11V+D59N+I96L+S164G+L166I+L222I+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+I96L+S164G+L222I+R242E,
Y11I+K19T+I96L+S164G+L166V+R242E+N249E+G251D,
Y11I+I96L+S164G+L222I+R242E,
Y11I+K19T+D59N+I96L+S164G+L222I+R242E+N249E+G251D,
Y11V+D59N+I96L+S164G+L166I+L222V+R242E+G251D+L253I,
Y11I+K19T+D59N+I96L+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222I+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L222I+R242E+N249E+G251D,
Y11V+D59N+I96L+S164G+L222I+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+R242E+N249E+G251D+L253I,
Y11I+D59N+I96L+S164G+L222V+R242E+N249E+G251D,
Y11I+K19T+S164G+L166I+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+S164G+L166V+L222I+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166V+R242E,
Y11I+K19T+D59N+I96L+S164G+L222V+R242E+N249E,
Y11V+K19T+D59N+I96L+S164G+L222V+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222V+R242E+G251D,
Y11I+I96L+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+S164G+L166I+L222V+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+L222V+R242E+G251D,
Y11V+K19T+D59N+S164G+L166I+L222I+R242E+G251D,
Y11V+K19T+D59N+L166V+L222I+R242E+N249E+G251D+L253I,
Y11V+K19T+I96L+L222V+R242E+N249E+G251D or
Y11I+K19T+L222V+R242E+N249E+G251D.
Аспект 5. Способ согласно аспекту 1, где выделенный вариант полипептида химозина обладает:
- химозиновой активностью, обеспечивающей более высокую частоту расщепления αS1-казеина по сравнению с частотой расщепления αS1-казеина бычьим химозином, содержащим зрелый полипептид SEQ ID NO: 1, и/или
- химозиновой активностью, обеспечивающей более высокую частоту расщепления αS1-казеина по сравнению с частотой расщепления αS1-казеина верблюжьим химозином, содержащим зрелый полипептид SEQ ID NO: 2.
Аспект 6. Способ получения выделенного варианта полипептида химозина по п. 5, где модификация представляет собой одну или более замен: V32L, I45V, N50K, G70D, G70N, D98V, N100Q, V136I, M142I, H146R, S154A, V155F, M157L, D158S, V198I, I200V, F223V, K231N, G244D, V248I, R254S, M256L, V259I, Е262Т, D267Q, D279E, T284S, N291Q N292H, L295K и/или K321P.
Аспект 7. Способ согласно любому из аспектов 5 и 6, где выделенный вариант полипептида химозина содержит модификацию в одной или более комбинациях положений, содержащих положения, соответствующие:
G70D+S74F+D158S+R254S+S277N,
L130I+M142I+I200V+V259I+E294Q,
Y21S+R61S+H146R,
R61S+G163E+M256L+S277N,
D59N+S271P+T284S,
V248I+S226T+E294Q,
S74F+G244D+S271P,
V221K+V248I+S255Y,
V183I+G251W+M256L,
R61Q+V136I+Y268F+T284S+Y307F,
N50K+D158S+V203A+E294Q,
D98V+G251D+M256L+V259I,
V183I+V248I+G244D+T284S,
N50K+R61S+Y127F+G244D+G251D,
I96L+F223V+G244D+R254S+M256L,
H146R+D158S+S273Y,
S74F+V259I+Y268F,
G70N+D98V+V136I,
I96L+M142I+R145Q+H146R,
V32L+G163E+T186S+Q188E+L295K,
R61Q+V136I+Y268F+T284S+Y307F,
S132A+Q188E+F223V,
I200V+G251D+G289S,
N50K+D158S+V203A+E294Q,
F223V+G251W+S273Y+D279E,
D59N+L222I+G251D+V32L+L12M+T284S,
D59N+L222I+G251D+V155F+Е262Т+V32L,
D59N+L222I+G251W+S154A+V203A,
D59N+L222I+G251D+V32L+K321P+V260T,
D59N+L222I+G251D+V198I+V203A+K321P,
D59N+L222I+G251D+S273Y+T284S+D267Q,
V32L+N100Q+N291Q,
N292H+N100Q+N291Q,
V221K+N100Q+N291Q,
I297A+N100Q+N291Q,
R67Q+N100Q+L130I+M157L+L222I+K231N,
R67Q+L130I+V248I+M256L+N292H,
V32L+R67Q+L130I+K231N+N292H,
L130I+M157L+V248I+M256L+N291Q,
V32L+R67Q+V136I+M157L+N291Q,
R67Q+L130I+K231N+V248I+N291Q,
V32L+R67Q+G70D+N100Q+M157L,
R67Q+N100Q+L130I+D158S+V248I,
R67Q+N100Q+L130I+M157L+K231N+N291Q,
R67Q+N100Q+L130I+M157L+V248I+N291Q и/или
N100Q+L130I+S132A+M157L+K231.
Аспект 8. Способ получения выделенного варианта полипептида химозина по любому из аспектов 1-7, где родительский полипептид имеет по меньшей мере 95% идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин).
Аспект 9. Выделенный вариант полипептида химозина, содержащий модификацию в одном или более положениях по сравнению с родительским полипептидом, имеющим химозиновую активность, где модификация включает замещение по меньшей мере в одном аминокислотном положении, соответствующем любому из положений Y11I, Y11V, L12M, K19T, V51L, R61S, H76Q, E83S, I96L, L105E, D144Q, Q162S, S164G, М165Е, L166V, L180I, V203A, L222I, S226T, T239S, R242E, G251D, G251W, L253I, V260T, I263L, R266V, S273Y, Q288E, G289S, E294Q, Y307F, V309I, R316L и/или V317L, где
(1): аминокислотное положение в родительском полипептиде определяют посредством выравнивания родительского полипептида со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин) и
(2): родительский полипептид имеет по меньшей мере 65% идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин);
где выделенный вариант полипептида химозина расщепляет αS1-казеина с более низкой частотой, чем соответствующий родительский полипептид.
Аспект 10. Выделенный вариант полипептида химозина согласно аспекту 9, где родительский
полипептид имеет по меньшей мере 80%, такую как, например, по меньшей мере 80%, 85%, 95%, 97%, 98%, 99% идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин).
Аспект 11. Выделенный вариант полипептида химозина по любому из аспектов 9-10, который содержит модификацию в одной или более комбинациях положений, включающих положения, соответствующие:
Y21S+H76Q+Y307F+V317L,
R61S+L166V+T239S,
V32L+E294Q+R316L+V317L,
S226T+G244D+I263L+G289S,
V203A+V248I+G251W+L253I+Y268F,
D59N+L222I+G251D+E83S+Q162S,
D59N+L222I+G251D+Y21S+L215V+L105E,
D59N+L222I+G251D+H76Q+L105E+V260T,
D59N+L222I+G251D+V203A+R266V+F223A,
L12M+D59N+H76Q+S154A+M165E+V203A+L222I+G251D+V309I,
L12M+V51L+H76Q+M165E+G251D,
L12M+V51L+D59N+H76Q+L166V+L222I+G251D,
L12M+D59N+H76Q+D144Q+M165E+V203A+L222I,
L12M+K19T+D59N+H76Q+S154A+M165E+V198I+L222I+G251D,
L12M+V51L+D59N+F66Y+H76Q+M165E+V203A+L222I+G251W,
V51L+D59N+H76Q+M165E+L180I+L222I+G251D+E262T,
L12M+D59N+H76Q+M165E+G251D+Q288E+V309I+K321P,
D59N+H76Q+I96L+L130I+S164G+L222I+R242E+G251D,
H76Q+I96L+S164G+L222I+R242E+G251D+S273Y,
K19T+D59N+H76Q+I96L+S164G+L166V+L222I+G251D+S273Y,
H76Q+S164G+L166V+L222I+R242E+G251D+S273Y,
Y21S+H76Q+S164G+L222I+R242E+G251D+S273Y,
D59N+H76Q+I96L+S132A+S164G+L222I+S226T+G251D+S273Y,
D59N+H76Q+I96L+S132A+S164G+L166V+L222I+G251D+S273Y,
K19T+D59N+H76Q+S164G+L222I+N249D+S273Y,
H76Q+S164G+L222I+N249D+G251D+S273Y+V309I,
H76Q+I96L+S164G+G251D+S273Y+V309I,
K19T+D59N+H76Q+S164G+R242E+N249D+G251D+S273Y,
Y21S+D59N+H76Q+S164G+L222I+S226T+G251D+S273Y+V309I
D59N+H76Q+I96L+S164G+L222I+S226T+N249D+G251D+S273Y,
H76Q+S164G+L166V+L222I+S226T+S273Y,
D59N+H76Q+L130I+S164G+L166V+L222I+G251D+S273Y+V309I,
D59N+H76Q+S164G+L222I+S226T+R242E,
K19T+D59N+I96L+S164G+L222I+G251D,
D59N+H76Q+I96L+S164G+L222I+S226T+G251D+S273Y+V309I,
D59N+H76Q+L130I+S164G+G251D+V309I,
D59N+H76Q+L130I+L166V+L222I+N249D+G251D+S273Y,
Y21S+D59N+H76Q+I96L+S164G+L222I+N249D+G251D+S273Y,
K19T+D59N+S164G+L166V+L222I+S226T+G251D+S273Y,
D59N+H76Q+L130I+S132A+S164G+L222I+R242E+G251D+S273Y,
K19T+Y21S+H76Q+S164G+L222I+G251D+S273Y,
D59N+H76Q+S164G+L222I+R242E+S273Y+V309I,
K19T+Y21S+D59N+H76Q+S132A+S164G+L222I+G251D+S273Y,
К19Т+D59N+H76Q+L130I+S164G+L222I+S226T+G251D+S273Y,
D59N+H76Q+S164G+L166V+L222I+N249D+G251D+S273Y+V309I,
K19T+Y21S+D59N+H76Q+L130I+S164G+L222I+S273Y,
Y21S+D59N+S164G+L222I+R242E+G251D+S273Y+V309I,
K19T+D59N+H76Q+L166V+L222I+R242E+G251D+S273Y,
D59N+S132A+S164G+L222I+R242E+N249D+G251D+S273Y,
D59N+H76Q+I96L+L130I+S164G+L222I+N249D+G251D+S273Y,
Y21S+D59N+H76Q+S164G+L166V+N249D+G251D+S273Y,
H76Q+S132A+S164G+L222I+N249D+G251D,
D59N+H76Q+S132A+S164G+L166V+S273Y,
K19T+D59N+H76Q+S132A+L222I+G251D+S273Y+V309I,
H76Q+L130I+L222I+S226T+G251D+S273Y,
Y21S+D59N+H76Q+I96L+L222I+S273Y,
Y11I+K19T+D59N+E83S+I96L+S164G+L222I+N249D,
Y11I+K19T+I96L+S164G+L222V+R242E+G251D,
Y11V+K19T+I96L+S164G+L166V+L222I+R242E,
Y11V+E83S+I96L+S164G+L222I+R242E+G251D+L253I+I263L,
Y11V+I96L+S164G+L222I+R242E+N249D+L253I+I263L,
K19S+I96L+S164G+L166V+L222I+R242E,
K19T+I96L+S164G+L166V+L222I+R242E+N249D+I263L,
Y11V+K19T+D59N+I96L+S164N+L166I+L222I+G251D,
H76Q+I96L+S164G+L222I+R242E+G251D+S273Y,
Y11V+K19T+E83S+I96L+S164G+L166V+L222I+R242E+G251D,
Y11V+E83S+I96L+S164G+L222I+R242E+L253I+I263L,
Y11V+K19T+D59N+I96L+S164G+L166V+L222I+R242E+G251D+L253I,
K19T+D59N+I96V+S164G+L166V+L222I+R242E+I263L,
Y11V+D59N+I96L+S164G+L222I+G251D+L253V,
I96L+S164G+L166V+L222I+R242E+N249D+I263L,
K19S+D59N+I96L+S164G+L222I+R242E+N249E+G251D,
H76Q+I96L+S164G+L222I+R242E+G251D,
Y11I+K19T+D59N+S164G+L222I+G251D+I263V,
K19T+I96L+S164G+L166V+L222I+R242E+N249D+G251D+I263V,
K19T+E83S+I96L+S164G+L222I+R242E+G251D+L253I,
I96L+S164G+L222I+R242E+N249D+G251D+I263L,
K19T+D59N+I96L+S164G+L166V+L222I+R242D+G251D+L253I,
D59N+I96L+S164G+L222I+R242E+L253I+I263L,
K19T+I96L+S164G+L166V+L222I+N249D+I263L,
K19T+D59N+I96L+S164G+L1661+L222I+R242D+G251D+I263V,
K19T+D59N+I96L+S164G+L222V+R242E+N249D+L253I,
K19T+D59N+I96L+S164G+L166I+L222I+R242E+N249D,
K19T+E83S+I96L+S164G+L222I+R242E+N249D+G251D+L253I,
I96L+S164G+L222I+R242E+G251D+S273Y,
K19T+E83T+I96L+S164G+L222I+R242E+L253V,
K19T+I96L+S164G+R242E+L253I,
K19T+D59N+I96L+S164G+L222I+N249E+G251D+L253V+I263L,
K19T+D59N+I96L+S164G+L222V+N249E+G251D+I263V,
I96L+S164G+L222I+R242E+G251D,
K19T+I96L+S164N+L222I+R242E+I263L,
K19T+E83S+I96L+S164G+L166V+L222I+R242E+N249D+G251D+L253I,
K19T+D59N+E83T+S164G+L166V+L222I+R242D+G251D,
K19T+D59N+I96L+S164G+L222I+G251D,
D59N+I96L+L166V+L222I+R242E+G251D,
Y11I+K19T+D59N+I96V+L222I+R242D+G251D,
K19T+I96V+S164G+L222I+N249D+G251D+L253I,
H76Q+N100Q+N291Q,
R67Q+L130I+M157L+D158S+R242E+N291Q,
V32L+R67Q+L130I+M157L+K231N+M256L,
R67Q+VI361+M157L+L222I+V248I,
Y11V+R67Q+L130I+M157L+L222I+R242E,
R67Q+I96L+N100Q+L130I+M157L+N292H.
Y11I+D59N+I96L+S164G+L166V+L222V+R242E+G251D+L253I,
Y11I+D59N+I96L+S164G+L166V+L222V+R242E+G251D,
Y11I+D59N+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11I+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11V+K19T+I96L+L166V+L222V+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222V+R242E+N249E+G251D+L253I,
Y11I+K19T+D59N+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166V+L222I+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166V+L222V+R242E+N249E+L253I,
Y11V+K19T+D59N+I96L+L166V+L222V+R242E+N249E+G251D+L253I,
Y11V+K19T+D59N+I96L+S164G+L166V+L222I+R242E+N249E,
Y11V+K19T+D59N+I96L+S164G+L166V+L222V+R242E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166V+R242E+G251D,
Y11I+K19T+D59N+I96L+S164G+LI661+L222I+R242E+G251D,
Y11V+K19T+I96L+S164G+L166V+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+I96L+S164G+L166I+L222V+R242E+N249E+G251D,
Y11V+D59N+I96L+S164G+L166I+L222I+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+I96L+S164G+L222I+R242E,
Y11I+K19T+I96L+S164G+L166V+R242E+N249E+G251D,
Y11I+I96L+S164G+L222I+R242E,
Y11I+K19T+D59N+I96L+S164G+L222I+R242E+N249E+G251D,
Y11V+D59N+I96L+S164G+L166I+L222V+R242E+G251D+L253I,
Y11I+K19T+D59N+I96L+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222I+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L222I+R242E+N249E+G251D,
Y11I+D59N+I96L+S164G+L222I+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+R242E+N249E+G251D+L253I,
Y11I+D59N+I96L+S164G+L222V+R242E+N249E+G251D,
Y11I+K19T+S164G+L166I+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+S164G+L166V+L222I+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166V+R242E,
Y11I+K19T+D59N+I96L+S164G+L222V+R242E+N249E,
Y11V+K19T+D59N+I96L+S164G+L222V+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L166I+L222V+R242E+G251D,
Y11I+I96L+L222V+R242E+N249E+G251D,
Y11I+K19T+D59N+S164G+L166I+L222V+R242E+G251D,
Y11V+K19T+D59N+I96L+S164G+L222V+R242E+N249E+G251D,
Y11V+K19T+D59N+I96L+L222V+R242E+G251D,
Y11V+K19T+D59N+S164G+L166I+L222I+R242E+G251D,
Y11V+K19T+D59N+L166V+L222I+R242E+N249E+G251D+L253I,
Y11V+K19T+I96L+L222V+R242E+N249E+G251D или
Y11I+K19T+L222V+R242E+N249E+G251D.
Аспект 12. Выделенный вариант полипептида химозина, содержащий модификацию в одном или более положениях по сравнению с родительским полипептидом, имеющим химозиновую активность, где модификация включает замену по меньшей мере в одном аминокислотном положении, соответствующим любому из положений V32L, I45V, N50K, G70D, G70N, D98V, N100Q, V136I, M142I, H146R, S154A, V155F, M157L, D158S, V198I, I200V, F223V, K231N, G244D, V248I, R254S, M256L, V259I, Е262Т, D267Q, D279E, T284S, N291Q N292H, L295K и/или K321P, где
(1): аминокислотное положение в родительском полипептиде определяют посредством выравнивания родительского полипептида со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин), и
(2): родительский полипептид имеет по меньшей мере 65% идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин);
где выделенный вариант полипептида химозина расщепляет αS1-казеин с более высокой частотой по сравнению с соответствующим родительским полипептидом.
Аспект 13. Выделенный вариант полипептида химозина по п. 12, где родительский полипептид имеет по меньшей мере 80%, такую как, например, по меньшей мере 80%, 85%, 95%, 97%, 98%, 99% идентичность последовательности со зрелым полипептидом SEQ ID NO: 2 (верблюжий химозин).
Аспект 14. Выделенный вариант полипептида химозина по любому из аспектов 12-13, где выделенный вариант полипептида химозина содержит модификацию в одной или более комбинациях положений, включающих положения, соответствующие:
G70D+S74F+D158S+R254S+S277N,
L130I+M142I+I200V+V259I+E294Q,
Y21S+R61S+H146R,
R61S+G163E+M256L+S277N,
D59N+S271P+T284S,
V248I+S226T+E294Q,
S74F+G244D+S271P,
V221K+V248I+S255Y,
V183I+G251W+M256L,
R61Q+V136I+Y268F+T284S+Y307F,
N50K+D158S+V203A+E294Q,
D98V+G251D+M256L+V259I,
V183I+V248I+G244D+T284S,
N50K+R61S+Y127F+G244D+G251D,
I96L+F223V+G244D+R254S+M256L,
H146R+D158S+S273Y,
S74F+V259I+Y268F,
G70N+D98V+V136I,
I96L+M142I+R145Q+H146R,
V32L+G163E+T186S+Q188E+L295K,
R61Q+V136I+Y268F+T284S+Y307F,
S132A+Q188E+F223V,
I200V+G251D+G289S,
N50K+D158S+V203A+E294Q,
F223V+G251W+S273Y+D279E,
D59N+L222I+G251D+V32L+L12M+T284S,
D59N+L222I+G251D+V155F+E262T+V32L,
D59N+L222I+G251W+S154A+V203A,
D59N+L222I+G251D+V32L+K321P+V260T,
D59N+L222I+G251D+V198I+V203A+K321P,
D59N+L222I+G251D+S273Y+T284S+D267Q,
V32L+N100Q+N291Q,
N292H+N100Q+N291Q,
V221K+N100Q+N291Q,
I297A+N100Q+N291Q,
R67Q+N100Q+L130I+M157L+L222I+K231N,
R67Q+L130I+V248I+M256L+N292H,
V32L+R67Q+L130I+K231N+N292H,
L130I+M157L+V248I+M256L+N291Q,
V32L+R67Q+V136I+M157L+N291Q,
R67Q+L130I+K231N+V248I+N291Q,
V32L+R67Q+G70D+N100Q+M157L,
R67Q+N100Q+L130I+D158S+V248I,
R67Q+N100Q+L130I+M157L+K231N+N291Q,
R67Q+N100Q+L130I+M157L+V248I+N291Q и/или
N100Q+L130I+S132A+M157L+K231.
Аспект 15. Способ получения пищевого или кормового продукта, включающий добавление эффективного количества выделенного варианта полипептида химозина по любому из аспектов 9-14 к пищевому(ым) или кормовому(ым) ингредиенту(ам) и осуществление дальнейших стадий производства с получением пищевого и кормового продукта.
Аспект 16. Способ по п. 15, где пищевой или кормовой продукт представляет собой продукт на основе молока.
Аспект 17. Применение варианта полипептида химозина по любому из аспектов 9-12 в способе получения сыра.
Аспект 18. Применение варианта полипептида химозина по любому из аспектов 9-14 в способе получения вытяжного сыра, чеддера и сыров континентального типа.
Аспект 19. Применение варианта полипептида химозина по любому из аспектов 9-14 в способе получения мягкого сыра или белого рассольного сыра.
Еще один родственный аспект настоящего изобретения касается способа получения пищевого или кормового продукта, включающего добавление эффективного количества выделенного варианта полипептида химозина, как описано в данном документе, к пищевому(ым) или кормовому(ым) ингредиенту(ам) и осуществление дальнейших стадий производства с получением пищевого и кормового продукта, в частности, когда пищевой или кормовой продукт представляет собой продукт на основе молока.
Настоящее изобретение также включает применение варианта полипептида химозина, как описано в данном описании изобретения, в способе получения сыра. Более конкретно, применение варианта полипептида химозина, имеющего более низкую частоту расщепления αS1-казеина, чем его соответствующий родительский пептид в способе получения вытяжного сыра, чеддера и сыров континентального типа, и/или применение варианта полипептида химозина, имеющего более высокую частоту расщепления αS1-казеина, чем его соответствующий родительский пептид в способе получения мягкого сыра, белого рассольного сыра и длительно созревающего сыра Гауда.
ОПРЕДЕЛЕНИЯ
Все определения релевантных здесь терминов соответствуют тому, что очевидно специалисту в отношении релевантного здесь технического контекста.
Термин "αS1-расщепление" или "расщепление αS1-казеина" означает любое ферментативное расщепление αS1-казеина. Такое как, например, расщепление между Phe23 и Phe24, приводящее к образованию αS1(1-23) пептида.
В одном аспекте αS1-расщепление определяют посредством количественного определения αS1-расщепления пептида 1-23, полученного путем инкубации обезжиренного молока с вариантом химозина или верблюжьим химозином, где количественное определение выполняют с помощью RP-HPLC в сочетании с масс-спектрометром ESI-Q-TOF. Все подробности предпочтительного способа определения расщепления αS1-казеина описаны в Примерах.
Термин "химозин" относится к ферменту класса ЕС 3.4.23.4. Химозин обладает высокой специфичностью и преимущественно створаживает молоко посредством расщепления одной 104-Ser-Phe-⎜-Met-Ala-107 связи в κ-цепи казеина. В качестве побочной активности химозин также расщепляет α-казеин в основном между Phe23 и Phe24 (ссылки 2,3). Полученный пептид αS1(1-23) в дальнейшем подвергается расщеплению протеазами из микробных культур, добавленных к созревающему сыру (ссылка 4). Альтернативным названием химозина, используемым в данной области техники, является реннин.
Термин "химозиновая активность" относится к химозиновой активности фермента химозина, как понятно специалисту в настоящем контексте.
Специалисту в данной области понятно, как определить релевантную здесь химозиновую активность.
Термин "специфическая свертывающая активность" описывает молокосвертывающую активность полипептида химозина и может быть определена в соответствии с хорошо известными в данной области анализами. Предпочтительным методом определения специфической свертывающей активности в единицах IMCU/мг белка является стандартный метод, разработанный Международной федерацией по молочному животноводству (метод IDF), который включает стадии, на которых молокосвертывающую активность определяют исходя из времени, необходимого для видимой флокуляции молочного субстрата и время свертывания образца сравнивают с эталонным стандартом, имеющим известную молокосвертывающую активность и такой же ферментный состав по IDF Standard 110В в качестве образца. Образцы и эталонные стандарты измеряют в одинаковых химических и физических условиях. Все подробности метода IDF описаны в Примерах.
Как известно в данной области техники, релевантное здесь так называемое значение С/Р определяют путем деления удельной свертывающей активности (С) на протеолитическую активность(Р).
Как известно в данной области техники, более высокое значения С/Р подразумевает, как правило, что потеря белка во время, например, производства сыра из-за неспецифической деградации белка снижена, то есть выход сыра улучшен. Различия в значениях С/Р могут быть определены в процентах. Например, значение С/Р 20 будет соответствовать 50% от значения С/Р 40.
Термин "выделенный вариант" означает вариант, который модифицирован силами человека. В одном аспекте вариант является по меньшей мере на 1% чистым, например по меньшей мере на 5% чистым, по меньшей мере на 10% чистым, по меньшей мере на 20% чистым, по меньшей мере на 40% чистым, по меньшей мере на 60% чистым, по меньшей мере на 80% чистым и по меньшей мере на 90% чистым, как определено посредством SDS PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия)
Нумерацию аминокислот, используемую в данном описании изобретения для конкретизации вариантов полипептида химозина по настоящему изобретению, осуществляют в соответствии с нумерацией зрелого пептида. В перечне последовательностей, представленном с настоящей заявкой:
SEQ ID NO: 1 представляет собой полную последовательность полипептида бычьего пре-прохимозина;
SEQ ID NO: 2 представляет собой полную последовательность полипептида верблюжьего пре-прохимозина;
SEQ ID NO: 3 представляет собой последовательность полипептида зрелого бычьего химозина;
SEQ ID NO: 4 представляет собой последовательность полипептида зрелого верблюжьего химозина.
Другими словами, SEQ ID NO: 3 и 4 соответствуют аминокислотам 59-381 в SEQ ID NO: 1 и 2 соответственно. Все конкретные замены, указанные здесь, указаны по отношению к положению в последовательности зрелого химозина, то есть по отношению к нумерации аминокислот в SEQ ID NO: 3 или 4. Если положение указано по отношению к нумерации аминокислот в SEQ ID NO: 1 или 2, то необходимо добавить 58 остатков для идентификации положения в SEQ ID NO: 1 или 2.
Термин "зрелый полипептид" означает пептид в его окончательной форме после трансляции и любых посттрансляционных модификаций, таких как N-концевой процессинг, С-концевое усечение, гликозилирование, фосфорилирование и т.д. В настоящем контексте релевантный здесь зрелый полипептид химозина может быть представлен как активная последовательность полипептида химозина, то есть без последовательностей пре-части и/или про-части. Релевантными здесь примерами зрелого полипептида являются, например, зрелый полипептид SEQ ID NO: 1 (бычий химозин), который охватывает от аминокислотного положения 59 до аминокислотного положения 381 в SEQ ID NO: 1 или зрелый полипептид SEQ ID NO: 2 (верблюжий химозин), который охватывает от аминокислотного положения 59 до аминокислотного положения 381 в SEQ ID NO: 2.
Термин "родительский" или "родительский полипептид, имеющий химозиновую активность" означает полипептид, в котором осуществлена модификация с получением вариантов ферментов по настоящему изобретению. Родительский полипептид может представлять собой природный (дикого типа) полипептид или его вариант.
Термин "идентичность последовательности" относится к сходству двух аминокислотных последовательностей или двух нуклеотидных последовательностей.
Применительно к настоящему изобретению, степень идентичности последовательности у двух аминокислотных последовательностей может быть определена с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), реализованного в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al, 2000, Trends Genet. 16: 276-277), предпочтительно версии 3.0.0 или позже. Возможными используемыми параметрами являются штраф за открытие гэпа - 10, штраф за удлинение гэпа - 0,5 и матрица замен EBLOSUM62 (EMBOSS версия BLOSUM62). Результат Needle, отмеченный как "наиболее длинная идентичность" (полученный с использованием опции - nobrief), используют в качестве процента идентичности и рассчитывают следующим образом:
(Идентичные остатки × 100)/(Длина выравнивания - общее количество гэпов при выравнивании)
Применительно к настоящему изобретению, степень идентичности последовательности у двух дезоксинуклеотидных последовательностей определяют с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, выше), реализованного в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al, 2000, Trends Genet. 16: 276-277), предпочтительно версии 3.0.0 или позже. Возможными используемыми параметрами являются штраф за открытие гэпа - 10, штраф за удлинение гэпа - 0,5 и матрица замен EDNAFULL (EMBOSS версия NCBI NUC4.4). Результат Needle, отмеченный как "наиболее длинная идентичность" (полученный с использованием опции - nobrief), используют в качестве процента идентичности и рассчитывают следующим образом:
(Идентичные дезоксирибонуклеотиды × 100)/(Длина выравнивания - общее количество гэпов при выравнивании).
Термин "вариант" означает пептид, обладающий химозиновой активностью и содержащий модификацию, то есть замену, вставку и/или удаление в одном или более (нескольких) положениях. Замена означает замену аминокислоты, занимающей некоторое положение другой аминокислотой; делеция означает удаление аминокислоты, занимающей некоторое положение; и вставка означает добавление 1-3 аминокислот, смежных с аминокислотой, занимающей некоторое положение.
Аминокислота может быть природной или неприродной аминокислотой, например, замена, например, в частном случае D-изомерами (или D-формами), например D-аланином может быть теоретически возможной.
Термин пептид "дикого типа" относится к нуклеотидной последовательности или пептидной последовательности, которая встречается в природе, то есть к нуклеотидной последовательности или пептидной последовательности, которые не были подвергнуты целевым мутациям силами человека.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1:
3D-структура верблюжьего химозина (PDB: 4АА9) с моделью связанного αS1-казеина, показанного синим цветом. αS1-казеин размещен в субстратсвязывающей щели химозина с расщепляемой связью между остатками 23 и 24. Остатки верблюжьего химозина R266, V51, Е83, I263, L253, L105, I96 и L180 выделены зеленым цветом.
Фиг. 2:
3D-структура верблюжьего химозина (PDB: 4АА9) с моделью связанного αS1-казеина, показанного синим цветом. αS1-казеин размещен в субстратсвязывающей щели химозина с расщепляемой связью между остатками 23 и 24. Остатки верблюжьего химозина V32, Н76, F119, L130, S132, Y190, V221, R242, S273, G289, N292, L295 и I297 выделены зеленым цветом.
Фиг. 3:
3D-структура верблюжьего химозина (крупно, PDB: 4АА9). Остатки Y11, L12 и D13 N-конца белка, а также потенциальное взаимодействие Y11 с партнером D290 выделены пурпурным цветом.
ПРИМЕРЫ
ПРИМЕР 1: выравнивание и нумерация в белковых последовательностях химозина и последовательностях вариантов
Последовательности белка химозина выравнивали, используя алгоритм ClustalW, представленный EBI (EBI, инструменты, множественное выравнивание последовательностей, CLUSTALW", http://www.ebi.ac.uk/Tools/msa/clustalw2/), и как описано в Larkin MA, Blackshields G, Brown NP, Chenna R, McGettigan PA, McWilliam H, Valentin F, Wallace IM, Wilm A, Lopez R, Thompson JD, Gibson TJ, Higgins DG (2007). Bioinformatics 23(21), 2947-2948.
Установки ClustalW2 для множественного выравнивания последовательностей были следующими: матрица сравнения аминокислот = BLOSUM, открытие гэпа = 10, удлинение гэпа = 0,05, расстояние между гэпами = 8, бесконечные гэпы, итерация = нет, максимальное количество итераций = 1, группировка = NJ
В качестве эталонной последовательности использовали бычий химозин В препрохимозин (Genbank регистрационный номер Р00794 - раскрытый в данном описании изобретения как SEQ ID NO: 1), где N-концевой метионин имеет номер 1 (MRCL …) и С-концевой изолейцин (в белковой последовательности … LAKAI) имеет номер 381.
ПРИМЕР 2: Конструирование вариантов химозина
Варианты химозина конструировали с использованием различных стратегий. Когда упоминается верблюжий химозин, речь в данном документе идет о верблюжьем химозине, содержащем зрелый полипептид с SEQ ID NO: 2.
Верблюжий химозин с SEQ ID NO: 2 можно рассматривать как релевантный здесь родительский полипептид, имеющий химозиновую активность и используемый для получения вариантов верблюжьего химозина.
Когда упоминается бычий химозин, речь в данном документе идет о бычьем химозине, содержащем полипептид с SEQ ID NO: 1.
Бычий химозин с SEQ ID NO: 1 можно рассматривать, как релевантный здесь родительский полипептид, имеющий химозиновую активность и используемый для получения вариантов бычьего химозина.
Варианты 1-269 и 367-461 верблюжьего химозина были сконструированы на основе выравнивания большой совокупности общеизвестных аспарагиновых протеазных последовательностей, имеющих идентичность 25% или более по сравнению с бычьим химозином В.
Вариации обычно вводили в области с высоким уровнем вариации аминокислот между видами, в то время как консервативные области не изменяли. Аминокислотные замены выбирали на основе филогенетической, структурной и экспериментальной информации для идентификации изменений с высокой вероятностью для демонстрации положительных эффектов на расщепление альфа-казеина. В каждую вариантную конструкцию были введены множественные вариации, гарантирующие присутствие каждой одиночной мутации в нескольких вариантных конструкциях, чтобы минимизировать эффект ковариации между различными заменами. Использовали машинное обучение и статистический анализ для определения относительных вкладов аминокислотных замен на измеряемые характеристики коагуляции для вариантов химозина (ссылки 14, 15).
Варианты 270-366 были сконструированы на основании детального структурного анализа бычьего химозина (код PDB: 4АА8) и верблюжьего химозина (код PDB: 4АА9). Вариации выбирали, исходя из химической природы соответствующих боковых цепей аминокислот и их ожидаемого воздействия либо на связывание казеинового субстрата, либо на общие ферментные свойства. Большинство аминокислотных замен в вариантах 270-346 осуществляли в положениях последовательности либо внутри, либо в непосредственной структурной близости к субстратсвязывающей щели, или во вторичных структурных элементах, которые контактируют со связанным казеиновым субстратом. Кроме того, изменения были осуществлены в положениях на поверхности белка, которые изменяют профиль заряда этих областей (ссылка 5) и поэтому, как ожидается, оказывают влияние на характеристики фермента. Варианты 347-336 были сделаны на основе другой структурной конформации N-концевой последовательности в бычьем и верблюжьем химозине. Аминокислотные замены были сделаны в положениях в субстратсвязывающей щели, которые взаимодействуют с N-концом верблюжьего химозина.
ПРИМЕР 3: Получение ферментного вещества варианта химозина Все варианты химозина синтезировали как синтетические гены и клонировали в грибной экспрессионный вектор, такой как, например, pGAMpR-C (описанный в WO 02/36752 А2).
Векторы трансформировали в Е. coli, и плазмидную ДНК очищали, используя стандартные протоколы молекулярной биологии, известные специалисту в данной области.
Варианты плазмид индивидуально трансформировали в штамм Aspergillus niger или Aspergillus nidulans, и белок продуцировали по существу так, как описано в WO 02/36752 А2, и очищали, используя стандартные хроматографические методы.
Как известно в данной области, специалист в данной области может, на основе своих общих знаниях, получать и очищать химозин и варианты химозина, такие как описанные в данном описании изобретения варианты бычьего и верблюжьего химозина.
ПРИМЕР 4: Определение удельной химозиновой активности
4.1 Определение молокосвертывающей активности
Молокосвертывающую активность определяли, используя метод REMCAT, который представляет собой стандартный метод, разработанный Международной федерацией по молочному животноводству (метод IDF).
Молокосвертывающую активность определяли, исходя из времени, необходимого для видимой флокуляции стандартного молочного субстрата, полученного из сухого обезжиренного молока низкотемпературного сгущения и распылительной сушки с раствором хлорида кальция 0,5 г на литр (рН≈6,5). Время свертывания для образца сычужного фермента сравнивали со временем свертывания эталонного стандарта, имеющего известную молокосвертирующую активность и имеющего такой же ферментный состав согласно стандарту IDF 110В в качестве образца. Образцы и эталонные стандарты измеряли в одинаковых химических и физических условиях. Образцы вариантов доводили до примерно 3 IMCU/мл, используя 84 мМ уксуснокислый буфер, рН 5,5. Затем 200 мкл ферментного препарата добавляли к 10 мл предварительно нагретого молока (32°С) в стеклянной аналитической пробирке, помещенной на водяную баню, способную поддерживать постоянную температуру 32°С±1°С, при постоянном перемешивании. Альтернативно, 20 мкл ферментного препарата добавляли к 1 мл предварительно нагретого молока, как описано выше.
Общую молокосвертывающую активность (эффективность) сычужного фермента рассчитывали в Международных молокосвертывающих единицах (IMCU) на мл по сравнению со стандартом, содержащим такой же ферментный состав, что и образец, согласно формуле:
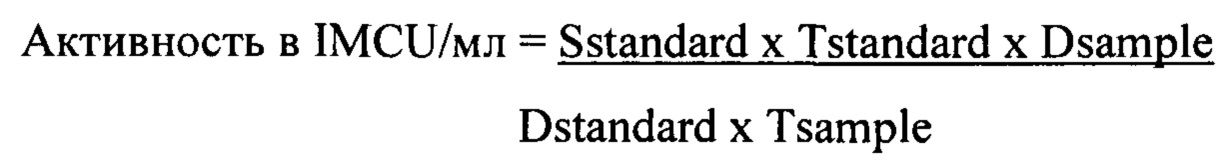
Sstandard: молокосвертывающая активность международного эталонного стандарта для сычужного фермента.
Tstandard: Время свертывания в секундах, полученное для стандартного разбавления.
Dsample: коэффициент разбавления для образца
Dstandard: коэффициент разбавления для стандарта
Tsample: Время свертывания в секундах, полученное для разбавленного образца сычужного ферменты с момента добавления фермента до момента флокуляции.
Для определения свертывающей активности библиотек 1, 3, 4 и 6 с множественными заменами, а также вариантов 270-366, использовали метод μIMCU вместо метода REMCAT. По сравнению с REMCAT, время флокуляции для вариантов химозина в анализе μIMCU определяли посредством измерения OD (оптической плотности) в 96-луночных планшетах при 800 нм в УФ/VIS планшет-ридере. Стандартная кривая различных разведений эталонного стандарта с известной активностью свертывания была зафиксирована для каждого планшета. Образцы готовили путем разбавления фермента 84 мМ ацетатным буфером, 0,1% тритона Х-100, рН 5,5 Взаимодействие при 32°С начиналось при добавлении 250 мкл стандартного молочного субстрата, содержащего 4% (масс./масс.) сухого обезжиренного молоко низкотемпературного сгущения и распылительной сушки и 7,5% (масс./масс.) хлорида кальция (рН≈6,5) до 25 мкл образца фермента. Молокосвертывающую активность вариантов химозина в Международных молокосвертывающих единицах (IMCU) на мл определяли на основании времени флокуляции для образца по сравнению со стандартной кривой.
4.2 Определение общего содержания белка.
Общее содержание белка определяли с использованием набора Pierce ВСА Protein Assay Kit от Thermo Scientific в соответствии с инструкциями поставщиков.
4.3 Вычисление удельной свертывающей активности
Удельную свертывающую активность (IMCU/мг общего белка) определяли путем деления свертывающей активности (IMCU/мл) на общее содержания белка (мг общего белка на мл).
ПРИМЕР 5 Определение расщепления αS1-казеина
Определение активности гидролиза αS1-казеина
Химозин-опосредованный протеолиз молочных белков характеризовали путем определения профилей водорастворимых пептидов, экстрагированных при рН 4,6. Для исследования использовали модель сыра, не содержащего культуру, изготовленная в 96-луночных планшетах. В кратком изложении, к 750 мкл обезжиренного молока из

Профили растворимых при рН 4,5 пептидов определяли, используя RP-HPLC в сочетании с масс-спектрометром ESI-Q-TOF. Анализ проводили, используя жидкостную хроматографическую систему (Agilent 1290 infinity, Agilent Technologies A/S, Santa Clara, California, USA), соединенную с масс-спектрометром (G6540A Q-TOF, Agilent Technologies A/S, Santa Clara, California, USA). Колонкой в LC системе была Ascentis Express Peptide ES-C18m, 2,7 мкм, 100×2,1 мм (Supelco, Sigma-Aldrich, St. Louis, USA). Подвижная фаза состояла из элюента А (0,1% муравьиной кислоты в воде) и элюента В (ацетонитрил: 0,1% муравьиная кислота в воде, 9: 1). После уравновешивания колонки с помощью 2% В, вносили образец объемом 10 мкл. Пептиды разделяли посредством градиентного элюирования, полученного путем увеличения элюента В от 2% до 50% за 15 объемов колонки. Скорость потока составляла 0,44 мл/мин. Пептиды обнаруживали путем постоянного измерения УФ-поглощения при 214 нм. Масс-спектры собирали путем сканирования MS от 100 до 2000 m/z (отношение массы к заряду). Анализ посредством MS/MS выполняли для двух наиболее интенсивных ионов из каждого сканирования. Готовили образец MIX, состоящий из равного объема всех анализируемых образцов, и этот образец анализировали в отношении каждого из 12 образцов. Данные MS были преобразованы из Agilent.d формата в .mzml файлы с использованием MSConvert ver. 3.0.6618. Все дальнейшие анализы данных осуществляли с использованием R 3.1.3. Пептиды идентифицировали исходя из MS/MS-спектров с использованием R-пакета "MSGFplus" версии 1.05. Поисковая база данных для идентификации пептидов была ограничена белками коровьего молока: αs1-казеином, αs1-казеином, β-казеином, κ-казеином, β-лактоглобулином, α-лактальбумином, лактопероксидазой и лактоферрином. Фосфорилирование серина и окисление метионина были включены как вариабельные модификации. R пакет 'xcms' v. 1.42.0 использовали для обнаружения и группировки пиков в различных образцах в совокупности образцов согласно Smith et al. (2006). Для обнаружения пика использовали метод Massifquant и группировка пиков была основана на методе плотности. Сгруппированные пики идентифицировали, что привело к количественным таблицам для примерно 200 идентифицированных пептидов, включая αS1-казеин (1-23).
Статистический анализ эффектов положения и мутации на расщепление αS1-казеина
Для определения эффектов всех одиночных мутаций, присутствующих в вариантах библиотек со множественными заменами 1-3, 4, 5, 6 и 7, на расщепление αS1-казеина между аминокислотами Phe23 и Phe24, использовали статистической подход с машинным обучением анализа и РСА-анализ.
Результаты
Библиотека 1 множественных замен
Получали варианты верблюжьего химозина, каждый из которых имел множественные замены по сравнению с диким типом, и анализировали, как описано выше. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину (зрелый полипептид SEQ ID NO: 2), за исключением вариаций, указанных в таблице. Коровий и верблюжий химозин были включены в качестве эталонов.
Активности свертывания определяли, используя метод μIMCU.



В Таблице 1 показаны варианты верблюжьего химозина с данными о расщеплении αS1-казеина между Phe23 и Phe24. Так как все варианты фермента использовали в экспериментах в нормализованной концентрации 0,05 IMCU/мл, уменьшенное расщепления αS1-казеина указывает на повышенную специфичность соответствующего варианта в отношении расщепления a-казеина между Phe105 и Met106 по сравнению с расщеплением αS1-казеина между Phe23 и Phe24, а не на уменьшение общей ферментативной активности. И наоборот, повышенное расщепление αS1-казеина указывает на снижение специфичности соответствующего варианта в отношении расщепления κ-казеина между Phe105 и Met106 по сравнению с расщеплением αS1-казеина между Phe23 и Phe24, а не на увеличение общей ферментативной активности.
Библиотека 2 множественных замен
Другой набор вариантов верблюжьего химозина, каждый из которых имел множественные замены по сравнению с диким типом, был получен и проанализирован, как описано. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину, за исключением вариаций, указанных в таблице. Бычий и верблюжий химозин были включены в качестве эталонов. Активности свертывания определяли, используя метод REMCAT.


В Таблице 2 показаны варианты верблюжьего химозина с данными о расщеплении αS1 -казеина между Phe23 и Phe24. Поскольку все варианты ферментов использовали в экспериментах в нормализованной концентрации 0,05 IMCU/мл, уменьшение расщепления αS1-казеина указывает на повышенную специфичность соответствующего варианта в отношении расщепления κ-казеина между Phe105 и Met106 по сравнению с расщеплением αS1-казеина между Phe23 и Phe24, а не на снижение общей ферментативной активности. И наоборот, увеличение расщепления αS1-казеина указывает на снижение специфичности соответствующего варианта в отношении расщепления κ-казеина между Phe105 и Met106 над расщеплением αS1-казеина между Phe23 и Phe24, а не на увеличение общей ферментативной активности
Библиотека 3 множественных замен
Третий набор вариантов верблюжьего химозина, каждый из которых имел множественные замены по сравнению с диким типом, был получен и проанализирован, как описано. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину, за исключением вариантов, указанных в таблице. Бычий и верблюжий химозин были включены в качестве эталонов. Активности свертывания определяли, используя метод μIMCU.

В Таблице 3 показаны варианты верблюжьего химозина с данными о расщеплении αS1-казеина между Phe23 и Phe24. Поскольку все варианты ферментов использовали в экспериментах в нормализованной концентрации 0,05 IMCU/мл, уменьшение расщепления αS1-казеина указывает на повышенную специфичность соответствующего варианта в отношении расщепления κ-казеина между Phe105 и Met106 по сравнению с расщеплением αS1-казеина между Phe23 и Phe24, а не на снижение общей ферментативной активности. Напротив, повышенное расщепление αS1-казеина указывает на снижение специфичности соответствующего варианта в отношении расщепления κ-казеина между Phe105 и Met106 по сравнению с расщеплением αS1-казеина между Phe23 и Phe24, а не на увеличение общей ферментативной активности
Мутационный анализ библиотек 1-3 со множественными заменами.
Статистический анализ позиционных и мутационных эффектов на расщепление αS1-казеина проводили на основе протеолитических данных для библиотек 1-3. Наиболее полезные мутации для уменьшения расщепления αS1-казеина приведены в таблице 4.

На основании полученных результатов, сделан вывод, что мутации, показанные в таблице 4, обнаруживают ингибирующий эффект на расщепление αS1-казеина между Phe23 и Phe24. Поскольку мутации, показанные в таблице 4, вызывают меньшее образование αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, которые требуют меньшего размягчения сырного сгустка во время созревания. Промышленно значимые примеры включают вытяжной сыр, чеддер и сыр континентального типа с улучшенной твердостью сгустка для оптимизированных процессов нарезки и дробления.
8 мутаций с наиболее сильным ингибирующим влиянием на расщепление αS1-казеина между Phe23 и Phe24 (R266V, V51L, E83S, I263L, L253I, L105E, I96L, L180I) расположены вдали от субстратсвязывающей щели верблюжьего химозина (Фиг. 1). Следовательно, можно сделать вывод о непрямом влиянии этих мутаций на расщепление αS1-казеина.
Наиболее полезные мутации для увеличения расщепления αS1-казеина показаны в таблице 5.

На основании полученных результатов сделан вывод, что мутации, показанные в таблице 5, вызывают более высокое расщепление αS1 -казеина между Phe23 и Phe24. Поскольку мутации, показанные в таблице 5, вызывают более значительное образование αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, которые требуют большей мягкости сырного сгустка при созревании. Промышленно значимые примеры включают мягкий сыр и белый рассольный сыр.
Четыре из пяти мутаций с наибольшим влиянием на увеличение расщепления αS1-казеина между Phe23 и Phe24 расположены в связывающей щели верблюжьего химозина (V221K, F223V, V32L, L295K, Фиг. 2) и могут, таким образом, оказывать прямое влияние на связывание αS1-казеина во время созревания сыра. Три из этих мутаций (V221K, F223V, V32L) вводят аминокислоты бычьего химозина (CHY-MAX) в соответствующие положения, что демонстрирует повышенное расщепление αS1-казеина между Phe23 и Phe24 по сравнению с верблюжьим химозином (CHY-MAX М; Таблицы 1-3).
Библиотека 4 множественных замен
Другой набор вариантов верблюжьего химозина, каждый из которых имел множественные замены по сравнению с диким типом, был получен и проанализирован, как описано выше. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину (SEQ ID NO: 2), за исключением вариаций, указанных в таблице. Верблюжий химозин (CHY-MAX М) включен в качестве эталона.
Активности свертывания определяли, используя метод μIMCU.

В Таблице 6 показаны варианты верблюжьего химозина с данными о расщеплении αS1-казеина между Phe23 и Phe24. Все варианты обнаружили сниженную на 11%-65% протеолитическую активность по сравнению с верблюжьим химозином дикого типа.
Мутационный анализ библиотеки 4 множественных замен
Статистический анализ позиционных и мутационных эффектов на расщепление αS1-казеина проводили на основе протеолитических данных для вариантов библиотеки 4. Наиболее полезные мутации для повышенного или уменьшенного расщепления αS1-казеина показаны в таблице 7.

На основании результатов, показанных в таблице 7, был сделан вывод, что мутации K19T, H76Q, I96L, S164G, L166V, L222I и R242E приводят к уменьшенному расщеплению αS1-казеина между Phe23 и Phe24. Поскольку эти мутации вызывают меньшее образование αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, где требуется меньшая мягкость сырного сгустка при созревании. Мутации Y21S, D59N и S132A приводят к повышенному расщеплению αS1-казеина между Phe23 и Phe24. Поскольку эти мутации вызывают более значительное образование αS1 (1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, где требуется большее размягчение сырного сгустка при созревании.
Библиотека 5 множественных замен
Другой набор вариантов верблюжьего химозина, каждый из которых имел множественные замены по сравнению с диким типом, был получен и проанализирован, как описано выше. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину (SEQ ID NO: 2), за исключением вариаций, указанных в таблице. Верблюжий химозин (CHY-MAX М) включен в качестве эталона. Активность свертывания определяли, используя метод REMCAT.


В таблице 8 показаны варианты верблюжьего химозина с данными о расщеплении αS1-казеина между Phe23 и Phe24. Из 47 вариантов библиотеки у 44 выявили сниженную на 11%-60% протеолитическую активность по сравнению с верблюжьим химозином дикого типа.
Мутационный анализ библиотеки 5 множественных замен
Статистический анализ позиционных и мутационных влияний на расщепление αS1-казеина выполняли на основании протеолитических данных для вариантов библиотеки 5. Наиболее полезные мутации для повышенного или уменьшенного расщепления αS1-казеина показаны в таблице 9.

На основании результатов, показанных в таблице 9, сделан вывод, что мутации Y11I, Y11V, K19S, H76Q, I96L, S164G, S164N, L166V, L222I, L222V, R242E, I263L и S273Y приводят к уменьшенному расщеплению αS1-казеина между Phe23 и Phe24. Поскольку эти мутации вызывают меньшее образование αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, которые требуют меньшего размягчения сырного сгустка при созревании. Мутации L253V и G251D приводят к повышенному расщеплению αS1-казеина между Phe23 и Phe24. Поскольку эти мутации вызывают более значительное образование αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, которые требуют большего размягчения сырного сгустка при созревании.
Структурные вариации в верблюжьем химозине
Варианты верблюжьего химозина (SEQ ID NO: 2) получали посредством замены аминокислот в положениях, определенных посредством структурного анализа белка (Таблица 10). Мутации N100Q и N291Q были введены в оба сайта N-гликозилирования этих вариантов и эталонного верблюжьего химозина (CamUGly) с получением негликозилированных, гомогенных образцов белка.
Активности свертывания определяли, используя метод μIMCU.

На основании результатов, показанных в таблице 10, был сделан вывод, что мутации K19T, H76Q, F119Y, Y190A, R242E, R242Q, S273Y и G289S уменьшали расщепление αS1-казеина между Phe23 и Phe24 более чем на 10%. Поскольку эти мутации вызывают меньшее образование αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, которые требуют меньшего размягчения сырного сгустка при созревании. V32L, L130I, S132A, V221K, N292H, L295K и 1297А увеличивали расщепление αS1-казеина между Phe23 и Phe24 по меньшей мере на 10%. Поскольку эти мутации вызывают более значительное образование αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, которые требуют большего размягчения сырного сгустка при созревании. Аналогичный эффект мутаций H76Q, S273Y, R242E и V32L, S132A, V221K, L295K на уменьшенное и повышенное расщепление αS1-казеина, соответственно, был определен посредством мутационного анализа библиотек 1-6 с множественными заменами (таблицы 5, 7, 9).
Четырнадцать из 15 вариантов из таблицы 10, которые показали более чем 10% уменьшение или увеличение расщепления αS1-казеина между Phe23 и Phe24, несут мутации (H76Q, F119Y, Y190A, R242E, R242Q, S273Y, G289S, V32L, L130I, S132A, V221K, N292H, L295K, 1297А) внутри или в структурной близости к субстратсвязывающей щели (Фиг. 2), свидетельствуя о непосредственном воздействии этих мутаций на связывание β-казеина.
Структурные вариации в бычьем химозине
Варианты бычьего химозина (SEQ ID NO: 1) получали с помощью замен аминокислот в положениях, определенных посредством структурного анализа белка (Табл. 11). Мутации N252Q и N291Q вводили в оба сайта N-гликозилирования этих вариантов и эталонного бычьего химозина (BovUGly) с получением негликозилированных, гомогенных образцов белка.
Активности свертывания определяли, используя метод μIMCU.

Мутации K71E, V113F и А117 уменьшали расщепление αS1-казеина между Phe23 и Phe24 более чем на 10%, как показано в таблице 11. Поскольку эти мутации вызывают меньшее образование αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, которые требуют меньшего размягчения сырного сгустка при созревании. Мутации Q83T и E133S увеличивали расщепление αS1-казеина между Phe23 и Phe24 по меньшей мере на 10%. Поскольку эти мутации вызывают более значительное образование αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, которые требуют большего размягчения сырного сгустка при созревании.
Вариации N-конца верблюжьего химозина
Варианты верблюжьего химозина (SEQ ID NO: 2) получали путем замены аминокислот в положениях, определенных посредством белкового структурного анализа молекулярных взаимодействий N-концевой последовательности Y11-D13 в субстратсвязывающей щели (Табл. 12). Мутации N100Q и N291Q вводили в оба сайта N-гликозилирования этих вариантов и эталонного верблюжьего химозина (CamUGly) с получением негликозилированных, гомогенных образцов белка.
Активности свертывания определяли, используя метод μIMCU.

Анализ структуры верблюжьего химозина сопровождал вариации в N-концевой последовательности Y11-D13, а также в положении D290, потенциального партнера взаимодействия Y11 (Фиг. 3). Поскольку казеиновые субстраты конкурируют с N-концевой последовательностью химозина за связывание в связывающей щели, замены аминокислот, которые изменяют взаимодействия между связывающей щелью и мотивом Y11-D13, как ожидается, оказывают влияние на ферментативную активность в отношении различных казеиновых субстратов и, таким образом, на расщепление αS1-казеина. Мутации Y11I и Y11V, а также комбинация Y11R и D290E уменьшали расщепление αS1-казеина между Phe23 и Phe24 более чем на 10%, как показано в таблице 12. Поскольку эти мутации вызывают меньшее образование αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, которые требуют меньшего размягчения сырного сгустка при созревании. Поскольку ни Y11R (вариант 349, Табл. 12), ни D290E (вариант 272, Табл. 10) по отдельности не оказывают существенного влияния на расщепление αS1-казеина, измененная протеолитическая активность варианта 351, скорее всего, вызвана синергическим эффектом обеих мутаций.
Мутации L12M, D13N, D13S, D13T и D13V увеличивали расщепление αS1-казеина между Phe23 и Phe24 по меньшей мере на 10%. Поскольку эти мутации вызывают более существенное образование αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, которые требуют большего размягчения сырного сгустка при созревании
Библиотека 6 множественных замен
Другой набор вариантов верблюжьего химозина, каждый из которых имел множественные замены по сравнению с диким типом, был получен и проанализирован, как описано выше. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину (SEQ ID NO: 2), за исключением вариаций, указанных в таблице. Верблюжий химозин (CHY-MAX М) включен в качестве эталона.
Активности свертывания определяли, используя метод μIMCU.


В таблице 13 показаны варианты верблюжьего химозина с данными о расщеплении αS1-казеина между Phe23 и Phe24. Из 50 вариантов библиотеки, 10 обнаружили сниженную на 12%-48% протеолитическую активность по сравнению с верблюжьим химозином дикого типа. Другие 18 вариантов показали повышенную на 11%-48% протеолитическую активность по сравнению с верблюжьим химозином дикого типа.
Мутационный анализ библиотеки 6 множественных замен
Статистический анализ позиционных и мутационных влияний на расщепление αS1-казеина выполняли на основании протеолитических данных для вариантов библиотеки 6. Наиболее полезные мутации для повышенного или уменьшенного расщепления αS1-казеина показаны в таблице 14.

На основании результатов, показанных в таблице 14, был сделан вывод, что мутации Y11V, R242E, G70D, R67Q и L222I приводят к уменьшенному расщеплению αS1-казеина между Phe23 и Phe24. Поскольку эти мутации вызывают меньшее количество αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, которые требуют меньшего размягчения сырного сгустка при созревании. Мутации N100Q, N291Q, V32L, L130I, V136I, K231N, V248I и M256L приводят к повышенному расщеплению αS1-казеина между Phe23 и Phe24. Поскольку эти мутации вызывают большее образование αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, которые требуют большего размягчения сырного сгустка при созревании
Библиотека 7 множественных замен
Другой набор вариантов верблюжьего химозина, каждый из которых имел множественные замены по сравнению с диким типом, был получен и проанализирован, как описано выше. Все варианты имеют аминокислотную последовательность, идентичную верблюжьему химозину (SEQ ID NO: 2), за исключением вариаций, указанных в таблице. Верблюжий химозин (CHY-MAX М) включен в качестве эталона. Активности свертывания определяли, используя метод REMCAT.


В таблице 15 показаны варианты верблюжьего химозина с данными о расщеплении αS1-казеина между Phe23 и Phe24, а также специфическими активностями свертывания (С), общими протеолитическими активностями (Р) и значениями С/Р. Все варианты обнаруживают сниженное на 33%-82% расщепление αS1-казеина.
Мутационный анализ библиотеки 7 множественных замен
Статистический анализ позиционных и мутационных влияний на расщепление αS1-казеина был выполнен на основании протеолитических данных для вариантов библиотеки 7. Наиболее полезные мутации для уменьшенного расщепления αS1-казеина показаны в таблице 16.

На основании результатов, показанных в таблице 16, был сделан вывод, что мутации I96L, L166V, R242E, Y11I, L222I, L222V, S164G, L166I, L253I и Y11V приводят к уменьшенному расщеплению αS1-казеина между Phe23 и Phe24. Поскольку эти мутации вызывают меньшее образование αS1(1-23), они представляют собой предпочтительные мутации в вариантах химозина для процессов производства сыра, которые требуют меньшего размягчения сырного сгустка при созревании.
ССЫЛКИ
1. A. Kumar, S. Grover, J. Sharma, V.K. Batish, Crit. Rev. Biotechnol. 2010, 30, 243-258.
2. M.W.



3. K. Kastberg Mailer, F.P. Rattray, Y.

4. P. L.H. McSweeney, Int. J. Dairy Technol. 2004, 57, 127-144.
5. J. Langholm Jensen, A.


6. S. Chitpinityol, D. Goode, M.J.C. Crabbe, Food Chem. 1998, 62, 133-139.
7. G.L. Gilliland, E.L. Winborne, J. Nachman, A. Wlodawer, Proteins 1990, 8, 82-101.
8. D.S. Palmer, A.U. Christensen, J.


9. J.


10. I. Schechter, A. Berger, Biochem. Biophys. Res. Commun. 1967, 425, 497-502.
11. L.K. Creamer, N.F. Olsen, J. Food Sci. 1982, 47:631-636
12. N. Bansal, M.A. Drake, P. Piraino, M.L. Broe, M. Harboe, P.F. Fox, P.L.H. McSweeney, Int. Dairy J. 2009, 19:510-517.
13. A.C. Moynihan, S. Govindasamy-Lucey, J.J. Jaeggi, M.E. Johnson, J.A. Lucey, P.L.H. McSweeney, J. Dairy Sci. 2014, 97:85-96.
14. J. Ehren, S. Govindarajan, B. Moron, J. Minshull, C. Khosla, Prot. Eng. Des. Sel. 2008, 21, 699-707.
15. S. Govindarajan, B. Mannervik, J.A. Silverman, K. Wright, D. Regitsky, U. Hegazy, T.J. Purcell, M. Welch, J. Minshull, C. Gustafsson, ACS Synth. Biol. 2015, 4, 221-227.
16. M. Newman, M. Safro, C. Frazao, G. Khan, A. Zdanov, I.J. Tickle, T.L. Blundell, N. Andreeva, J. Mol. Biol. 1991, 221, 1295-1309.
17. E. Gustchina, L. Rumsh, L. Ginodman, P. Majer, N. Andreeva, FEBS Lett. 1996, 379, 60-62.
18. S. Visser, C.J. Slangen, P.J. van Rooijen, Biochem. J. 1987, 244, 553-558.
--->
SEQUENCE LISTING
<110> Chr. Hansen A/S
<120> Variants of chymosins with improved proerties
<130> P5946PC00
<160> 4
<170> BiSSAP 1.3.6
<210> 1
<211> 381
<212> PRT
<213> Bos
<400> 1
Met Arg Cys Leu Val Val Leu Leu Ala Val Phe Ala Leu Ser Gln Gly
1 5 10 15
Ala Glu Ile Thr Arg Ile Pro Leu Tyr Lys Gly Lys Ser Leu Arg Lys
20 25 30
Ala Leu Lys Glu His Gly Leu Leu Glu Asp Phe Leu Gln Lys Gln Gln
35 40 45
Tyr Gly Ile Ser Ser Lys Tyr Ser Gly Phe Gly Glu Val Ala Ser Val
50 55 60
Pro Leu Thr Asn Tyr Leu Asp Ser Gln Tyr Phe Gly Lys Ile Tyr Leu
65 70 75 80
Gly Thr Pro Pro Gln Glu Phe Thr Val Leu Phe Asp Thr Gly Ser Ser
85 90 95
Asp Phe Trp Val Pro Ser Ile Tyr Cys Lys Ser Asn Ala Cys Lys Asn
100 105 110
His Gln Arg Phe Asp Pro Arg Lys Ser Ser Thr Phe Gln Asn Leu Gly
115 120 125
Lys Pro Leu Ser Ile His Tyr Gly Thr Gly Ser Met Gln Gly Ile Leu
130 135 140
Gly Tyr Asp Thr Val Thr Val Ser Asn Ile Val Asp Ile Gln Gln Thr
145 150 155 160
Val Gly Leu Ser Thr Gln Glu Pro Gly Asp Val Phe Thr Tyr Ala Glu
165 170 175
Phe Asp Gly Ile Leu Gly Met Ala Tyr Pro Ser Leu Ala Ser Glu Tyr
180 185 190
Ser Ile Pro Val Phe Asp Asn Met Met Asn Arg His Leu Val Ala Gln
195 200 205
Asp Leu Phe Ser Val Tyr Met Asp Arg Asn Gly Gln Glu Ser Met Leu
210 215 220
Thr Leu Gly Ala Ile Asp Pro Ser Tyr Tyr Thr Gly Ser Leu His Trp
225 230 235 240
Val Pro Val Thr Val Gln Gln Tyr Trp Gln Phe Thr Val Asp Ser Val
245 250 255
Thr Ile Ser Gly Val Val Val Ala Cys Glu Gly Gly Cys Gln Ala Ile
260 265 270
Leu Asp Thr Gly Thr Ser Lys Leu Val Gly Pro Ser Ser Asp Ile Leu
275 280 285
Asn Ile Gln Gln Ala Ile Gly Ala Thr Gln Asn Gln Tyr Gly Glu Phe
290 295 300
Asp Ile Asp Cys Asp Asn Leu Ser Tyr Met Pro Thr Val Val Phe Glu
305 310 315 320
Ile Asn Gly Lys Met Tyr Pro Leu Thr Pro Ser Ala Tyr Thr Ser Gln
325 330 335
Asp Gln Gly Phe Cys Thr Ser Gly Phe Gln Ser Glu Asn His Ser Gln
340 345 350
Lys Trp Ile Leu Gly Asp Val Phe Ile Arg Glu Tyr Tyr Ser Val Phe
355 360 365
Asp Arg Ala Asn Asn Leu Val Gly Leu Ala Lys Ala Ile
370 375 380
<210> 2
<211> 381
<212> PRT
<213> Camelus
<400> 2
Met Arg Cys Leu Val Val Leu Leu Ala Ala Leu Ala Leu Ser Gln Ala
1 5 10 15
Ser Gly Ile Thr Arg Ile Pro Leu His Lys Gly Lys Thr Leu Arg Lys
20 25 30
Ala Leu Lys Glu Arg Gly Leu Leu Glu Asp Phe Leu Gln Arg Gln Gln
35 40 45
Tyr Ala Val Ser Ser Lys Tyr Ser Ser Leu Gly Lys Val Ala Arg Glu
50 55 60
Pro Leu Thr Ser Tyr Leu Asp Ser Gln Tyr Phe Gly Lys Ile Tyr Ile
65 70 75 80
Gly Thr Pro Pro Gln Glu Phe Thr Val Val Phe Asp Thr Gly Ser Ser
85 90 95
Asp Leu Trp Val Pro Ser Ile Tyr Cys Lys Ser Asn Val Cys Lys Asn
100 105 110
His His Arg Phe Asp Pro Arg Lys Ser Ser Thr Phe Arg Asn Leu Gly
115 120 125
Lys Pro Leu Ser Ile His Tyr Gly Thr Gly Ser Met Glu Gly Phe Leu
130 135 140
Gly Tyr Asp Thr Val Thr Val Ser Asn Ile Val Asp Pro Asn Gln Thr
145 150 155 160
Val Gly Leu Ser Thr Glu Gln Pro Gly Glu Val Phe Thr Tyr Ser Glu
165 170 175
Phe Asp Gly Ile Leu Gly Leu Ala Tyr Pro Ser Leu Ala Ser Glu Tyr
180 185 190
Ser Val Pro Val Phe Asp Asn Met Met Asp Arg His Leu Val Ala Arg
195 200 205
Asp Leu Phe Ser Val Tyr Met Asp Arg Asn Gly Gln Gly Ser Met Leu
210 215 220
Thr Leu Gly Ala Ile Asp Pro Ser Tyr Tyr Thr Gly Ser Leu His Trp
225 230 235 240
Val Pro Val Thr Leu Gln Gln Tyr Trp Gln Phe Thr Val Asp Ser Val
245 250 255
Thr Ile Asn Gly Val Ala Val Ala Cys Val Gly Gly Cys Gln Ala Ile
260 265 270
Leu Asp Thr Gly Thr Ser Val Leu Phe Gly Pro Ser Ser Asp Ile Leu
275 280 285
Lys Ile Gln Met Ala Ile Gly Ala Thr Glu Asn Arg Tyr Gly Glu Phe
290 295 300
Asp Val Asn Cys Gly Asn Leu Arg Ser Met Pro Thr Val Val Phe Glu
305 310 315 320
Ile Asn Gly Arg Asp Tyr Pro Leu Ser Pro Ser Ala Tyr Thr Ser Lys
325 330 335
Asp Gln Gly Phe Cys Thr Ser Gly Phe Gln Gly Asp Asn Asn Ser Glu
340 345 350
Leu Trp Ile Leu Gly Asp Val Phe Ile Arg Glu Tyr Tyr Ser Val Phe
355 360 365
Asp Arg Ala Asn Asn Arg Val Gly Leu Ala Lys Ala Ile
370 375 380
<210> 3
<211> 323
<212> PRT
<213> Bos
<400> 3
Gly Glu Val Ala Ser Val Pro Leu Thr Asn Tyr Leu Asp Ser Gln Tyr
1 5 10 15
Phe Gly Lys Ile Tyr Leu Gly Thr Pro Pro Gln Glu Phe Thr Val Leu
20 25 30
Phe Asp Thr Gly Ser Ser Asp Phe Trp Val Pro Ser Ile Tyr Cys Lys
35 40 45
Ser Asn Ala Cys Lys Asn His Gln Arg Phe Asp Pro Arg Lys Ser Ser
50 55 60
Thr Phe Gln Asn Leu Gly Lys Pro Leu Ser Ile His Tyr Gly Thr Gly
65 70 75 80
Ser Met Gln Gly Ile Leu Gly Tyr Asp Thr Val Thr Val Ser Asn Ile
85 90 95
Val Asp Ile Gln Gln Thr Val Gly Leu Ser Thr Gln Glu Pro Gly Asp
100 105 110
Val Phe Thr Tyr Ala Glu Phe Asp Gly Ile Leu Gly Met Ala Tyr Pro
115 120 125
Ser Leu Ala Ser Glu Tyr Ser Ile Pro Val Phe Asp Asn Met Met Asn
130 135 140
Arg His Leu Val Ala Gln Asp Leu Phe Ser Val Tyr Met Asp Arg Asn
145 150 155 160
Gly Gln Glu Ser Met Leu Thr Leu Gly Ala Ile Asp Pro Ser Tyr Tyr
165 170 175
Thr Gly Ser Leu His Trp Val Pro Val Thr Val Gln Gln Tyr Trp Gln
180 185 190
Phe Thr Val Asp Ser Val Thr Ile Ser Gly Val Val Val Ala Cys Glu
195 200 205
Gly Gly Cys Gln Ala Ile Leu Asp Thr Gly Thr Ser Lys Leu Val Gly
210 215 220
Pro Ser Ser Asp Ile Leu Asn Ile Gln Gln Ala Ile Gly Ala Thr Gln
225 230 235 240
Asn Gln Tyr Gly Glu Phe Asp Ile Asp Cys Asp Asn Leu Ser Tyr Met
245 250 255
Pro Thr Val Val Phe Glu Ile Asn Gly Lys Met Tyr Pro Leu Thr Pro
260 265 270
Ser Ala Tyr Thr Ser Gln Asp Gln Gly Phe Cys Thr Ser Gly Phe Gln
275 280 285
Ser Glu Asn His Ser Gln Lys Trp Ile Leu Gly Asp Val Phe Ile Arg
290 295 300
Glu Tyr Tyr Ser Val Phe Asp Arg Ala Asn Asn Leu Val Gly Leu Ala
305 310 315 320
Lys Ala Ile
<210> 4
<211> 323
<212> PRT
<213> Camelus
<400> 4
Gly Lys Val Ala Arg Glu Pro Leu Thr Ser Tyr Leu Asp Ser Gln Tyr
1 5 10 15
Phe Gly Lys Ile Tyr Ile Gly Thr Pro Pro Gln Glu Phe Thr Val Val
20 25 30
Phe Asp Thr Gly Ser Ser Asp Leu Trp Val Pro Ser Ile Tyr Cys Lys
35 40 45
Ser Asn Val Cys Lys Asn His His Arg Phe Asp Pro Arg Lys Ser Ser
50 55 60
Thr Phe Arg Asn Leu Gly Lys Pro Leu Ser Ile His Tyr Gly Thr Gly
65 70 75 80
Ser Met Glu Gly Phe Leu Gly Tyr Asp Thr Val Thr Val Ser Asn Ile
85 90 95
Val Asp Pro Asn Gln Thr Val Gly Leu Ser Thr Glu Gln Pro Gly Glu
100 105 110
Val Phe Thr Tyr Ser Glu Phe Asp Gly Ile Leu Gly Leu Ala Tyr Pro
115 120 125
Ser Leu Ala Ser Glu Tyr Ser Val Pro Val Phe Asp Asn Met Met Asp
130 135 140
Arg His Leu Val Ala Arg Asp Leu Phe Ser Val Tyr Met Asp Arg Asn
145 150 155 160
Gly Gln Gly Ser Met Leu Thr Leu Gly Ala Ile Asp Pro Ser Tyr Tyr
165 170 175
Thr Gly Ser Leu His Trp Val Pro Val Thr Leu Gln Gln Tyr Trp Gln
180 185 190
Phe Thr Val Asp Ser Val Thr Ile Asn Gly Val Ala Val Ala Cys Val
195 200 205
Gly Gly Cys Gln Ala Ile Leu Asp Thr Gly Thr Ser Val Leu Phe Gly
210 215 220
Pro Ser Ser Asp Ile Leu Lys Ile Gln Met Ala Ile Gly Ala Thr Glu
225 230 235 240
Asn Arg Tyr Gly Glu Phe Asp Val Asn Cys Gly Asn Leu Arg Ser Met
245 250 255
Pro Thr Val Val Phe Glu Ile Asn Gly Arg Asp Tyr Pro Leu Ser Pro
260 265 270
Ser Ala Tyr Thr Ser Lys Asp Gln Gly Phe Cys Thr Ser Gly Phe Gln
275 280 285
Gly Asp Asn Asn Ser Glu Leu Trp Ile Leu Gly Asp Val Phe Ile Arg
290 295 300
Glu Tyr Tyr Ser Val Phe Asp Arg Ala Asn Asn Arg Val Gly Leu Ala
305 310 315 320
Lys Ala Ile
<---
Реферат
Изобретение относится к области биотехнологии, конкретно к получению полипептида химозина, имеющего одну или более следующих замен: S164G, L12M, V51L, R61S, E83S, L105E, D144Q, Q162S, M165E, L180I, V203A, L221I, S226T, T239S, R242E, G251D или G251W, V260T, I263L, R266V, S273Y, Q288E, G289S, E294Q, Y307F, V309I, R316L и/или V317L; или одну или более следующих замен: V32L, I45V, N50K, G70D или G70N, D98V, N100Q, V136I, M142I, H146R, S154A, V155F, M157L, D158S, V198I, I200V, F223V, K231N, G244D, V248I, R254S, M256L, V259I, E262T, D267Q, D279E, T284S, N291Q, N292H, L295K и/или K321P относительно верблюжьего химозина. Полученный химозин имеет значение C/P, составляющее по меньшей мере 200% от значения C/P выделенного верблюжьего химозина, и может быть использован для получения кормового или пищевого продукта, а также для получения сыра. 9 н. и 7 з.п. ф-лы, 3 ил., 16 табл., 5 пр.

Комментарии