Применение пропионовокислых бактерий для образования пропионовой кислоты и/или пропионатов в ободочной кишке - RU2225215C2
Код документа: RU2225215C2
Чертежи

Описание
Область применения настоящего изобретения касается применения пропионовокислых бактерий с целью создания оптимальных условий для образования пропионовой кислоты и/или пропионатов, а также, в случае необходимости, уксусной кислоты и/или ацетатов на уровне ободочной кишки.
В течение нескольких лет диетологи рекомендуют своим пациентам питание, богатое волокнами, что, по их мнению, может оказывать благотворное физиологическое и метаболическое воздействие на состояние здоровья.
Известно, что пищевые волокна устойчивы к расщеплению ферментами в тонком кишечнике, их расщепление и усвоение происходит только на уровне ободочной кишки, т.е. на конечном участке кишечника. Упомянутое выше благотворное воздействие может, таким образом, оказываться лишь при том условии, что упомянутые расщепление и усвоение будут максимально полными на данном предпоследнем участке (т.е. на участке ободочной кишки).
Кроме того, было установлено, что указанные выше биологические реакции происходят в результате анаэробной ферментации пищевых волокон под воздействием микроорганизмов в ободочной кишке. В результате данной ферментации образуются жирные кислоты с короткой цепочкой (AGCC), водород, двуокись углерода и биомасса.
Упомянутые жирные кислоты с короткой цепочкой являются преимущественно уксусной кислотой, пропионовой кислотой и масляной кислотой; в здоровом организме они могут образовываться только на уровне ободочной кишки, с учетом того, что это единственная часть человеческого организма, где имеют место строго анаэробные условия, обеспечивающие упомянутую ферментацию в процессе их синтеза, за исключением уксусной кислоты, очень незначительное количество которой может образовываться на уровне печени.
Следует также отметить, что различные исследования подтвердили важность указанных жирных кислот с короткой цепочкой, оказывающих благотворное воздействие на состояние здоровья.
После изучения соответствующей научной литературы создается впечатление, что по физиологическому значению упомянутые три жирные кислоты с короткой цепочкой различаются между собой: действительно, уксусная и пропионовая кислоты непосредственно подводятся к печени, где упомянутая пропионовая кислота полностью метаболизируется, тогда как часть уксусной кислоты далее поступает к другим тканям, а масляная кислота в большей степени используется на уровне внутренней стенки кишечника.
Таким образом, синтез жирных кислот с короткой цепочкой обусловливает присутствие в ободочной кишке, с одной стороны, субстрата на основе волокон, которые могут легко попадать в указанное место вместе с пищей, а с другой стороны - уравновешенной и адаптированной бактериальной флоры, имеющей оптимальный и неизменный состав.
Упомянутая бактериальная флора может образовываться либо в самом организме - эндогенная персистирующая флора каждого индивидуума, либо поступать с пищей.
Действительно, хорошо известно, что содержимое пищеварительного тракта человека, свое для каждого индивидуума и соответствующее примерно 1-1,5 кг перевариваемой пищи, включает большую популяцию микроорганизмов, состоящую из смеси многочисленных видов, оценочное количество которых в ободочной кишке может оцениваться от 1011 до 1012 клеток на грамм; упомянутая популяция образует бактериальную массу, имеющую определенный вес, при этом ее состав, плохой или хороший, с большим трудом может быть изменен радикальным образом и, особенно, на длительное время только за счет повседневно принимаемой пищи.
Кроме того, ежедневно употребляемая пища не является стерильной и, следовательно, в большей или в меньшей степени содержит бактерии (молоко, кисломолочные продукты, сыр, сидр, вино, пиво, колбасные изделия и т.д.). Изменение кишечной флоры вследствие употребления упомянутых бактерий может быть только временным.
Одновременно с этим следует отметить, что уже предлагались попытки изменить популяцию микробов кишечного тракта путем введения, в частности, поедания клеток бактерий, которые по общему признанию оказывают благотворное воздействие на состояние здоровья (так называемые пробиотные бактерии), в том числе молочнокислые бактерии или бифидобактерии.
Введение в организм значительной популяции упомянутых выше бактерий либо с особого рода пищей, либо путем непосредственного употребления микробных клеток, в частности было предложено с целью ограничения развития патогенных и гнилостных видов: действительно, известно, что эндогенная микрофлора кишечника делится на различные группы бактерий, одни из которых безобидны или даже полезны, тогда как другие, в частности, клостридии и гнилостные бактерии, вызывают образование токсинов и оказывают негативное влияние на состояние здоровья.
Идея, лежащая в основе настоящего изобретения, заключается в регулярном пероральном введении в организм значительного количества микрофлоры пробиотных бактерий, способствующих регулярному синтезу жирных кислот с короткой цепочкой на уровне ободной кишки.
Среди различных микроорганизмов, которые могут использоваться в указанных целях, молочнокислые бактерии мало удовлетворяют сформулированным требованиям, так как из-за присущих им свойств они в основном вызывают образование молочной кислоты и лишь очень незначительное количество уксусной кислоты, при этом не образуется пропионовой и масляной кислоты.
Вместе с тем другие бактерии - пропионовокислые - обладают способностью образовывать в большом количестве пропионовую кислоту и уксусную кислоту, то есть обе жирные кислоты с короткой цепочкой, необходимые для питания тканей, в процентном отношении, например, 2/3 пропионовой кислоты и 1/3 уксусной кислоты. Упомянутые выше бактерии присутствуют в человеческой пище на протяжении веков, в частности, в твердых сортах сыра; более того, они лучше, чем молочнокислые бактерии, подходят для условий ободной кишки, в условиях полной анаэробности; кроме того, эти бактерии более устойчивы к технологическому воздействию, чем молочнокислые бактерии и бифидобактерии.
Следует отметить, что в научной литературе уже предлагалось употреблять пропионовокислые бактерии, в частности, для стимуляции образования бифидобактерии в кишечнике (документ WO-97/19689) или для высвобождения моноокиси азота в пищеварительном тракте человека или животного (документ WO-97/27991). Тем не менее до настоящего времени не была представлена идея использования упомянутых бактерий для получения жирных кислот с короткой цепочкой на уровне ободочной кишки.
Таким образом, настоящее изобретение касается применения пропионовокислых бактерий (выбор которых обусловлен их слабой подверженностью автолизу и их способностью противостоять воздействию желчных солей) для получения из употребляемой человеком или животным обычной пищи, диетического или медикаментозного составов, подобранных таким образом, чтобы обеспечить по меньшей мере частичную защиту упомянутых бактерий от желудочного сока, и содержащих по меньшей мере 106 клеток на грамм данных бактерий, способных в значительной мере стимулировать и усилить синтез пропионовой кислоты и/или пропионата, а в случае необходимости уксусной кислоты и/или ацетата на уровне ободочной кишки путем бактериальной анаэробной ферментации.
Для того чтобы упомянутые бактерии могли оказать ожидаемое благотворное воздействие, необходимо выбрать штаммы со слабой подверженностью автолизу, способные без негативных последствий достигнуть ободочной кишки, где должно происходить их развитие и получение при этом достаточного количества пропионовой кислоты.
Хорошо известно, что два основных воздействия, которым подвергаются бактерии при их прохождении в верхней части пищеварительного тракта, связаны, с одной стороны, с кислотностью в среде желудка (рН от 4 до 1) и, с другой стороны, с наличием желчных солей в тонком кишечнике (порядка 15 ммоль/л максимально на уровне двенадцатиперстной кишки).
Кроме того, было установлено, что бактерии в кислотной среде желудочной области теряют свои защитные свойства и уже не способны противостоять воздействию желчных солей; это происходит даже при том условии, если они сохраняют жизнеспособность после выхода из желудка.
Таким образом, согласно настоящему изобретению необходимо подвергнуть пропионовокислые бактерии обработке, позволяющей противостоять воздействию компонентов среды желудка и соответствующей в общем виде их инкапсулированию, которое может осуществляться как искусственным, так и естественным путем (как в случае с пищей, подобной сырам).
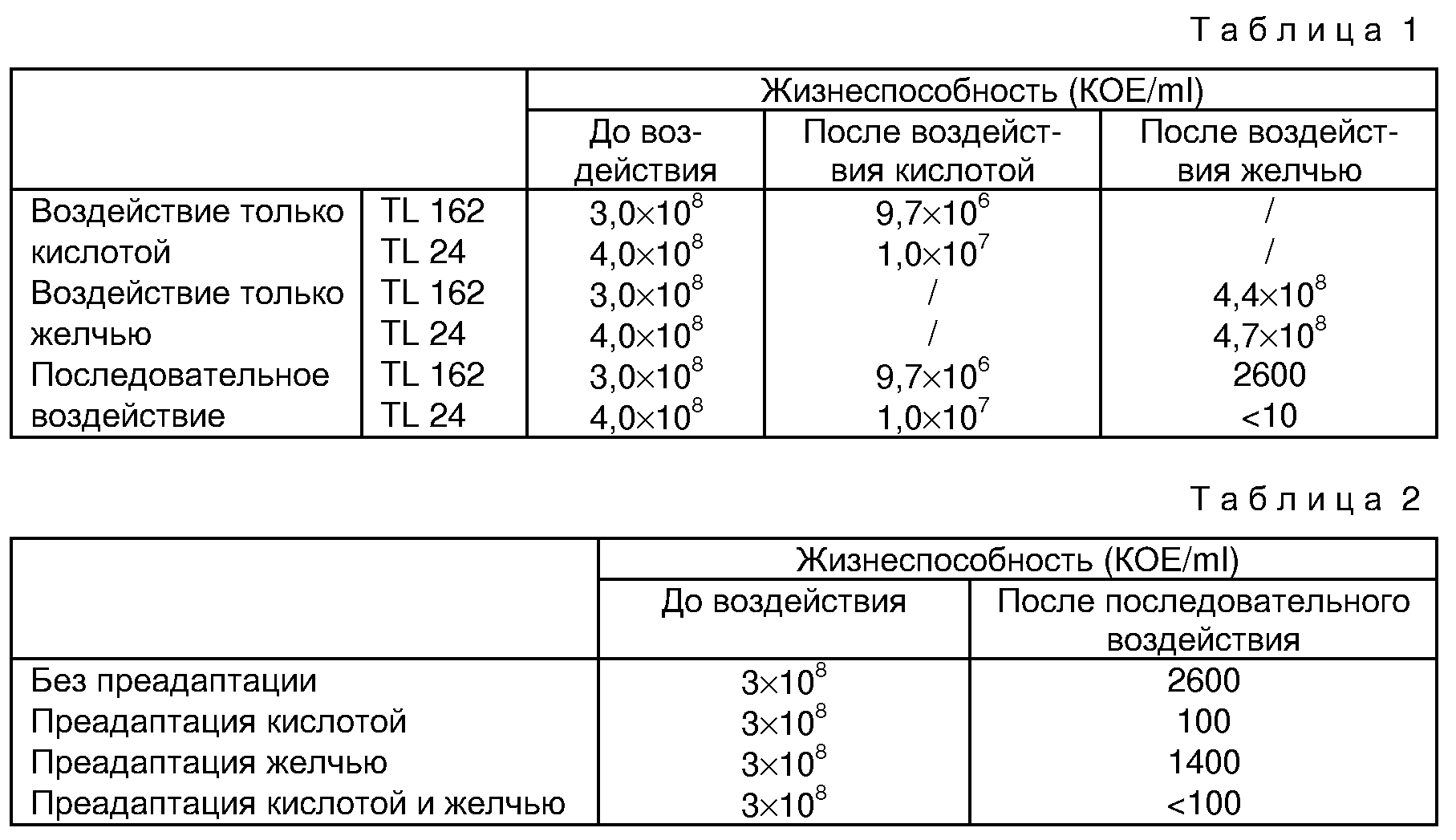
Указанный факт был обнаружен в результате эксперимента, в ходе которого оценивалось последовательное и индивидуальное воздействие рН кислоты и желчных солей на живучесть двух штаммов молочных пропионовокислых бактерий из коллекции TL LRTL (лаборатории исследования молочных технологий в INRA, Rennes), а именно штаммы TL 162 и TL 24, принадлежащие к виду Р. freu-denreichii subsp shermanii.
Ниже приводятся результаты упомянутого теста.
Указанные бактерии культивировались при температуре 30o в среде YEL в течение 2 дней (начало стационарной фазы). Оптическая плотность при 650 нм была соответственно 2,28 и 2,64 для TL 162 и TL 24.
Кислотное воздействие
Упомянутые культуры были разбавлены в соотношении 1/10 в среде S
(триптон-лактат) с рН 2,5 (рН конечная 3,0). После процесса инкубации при температуре 37oС в течение 45 мин упомянутые культуры были подвергнуты центрифугированию, и далее бактерии вновь
были помещены в тот же объем YEL. Соответствующие количественные измерения были сделаны до и после инкубации, и возобновление роста сопровождалось измерениями оптической плотности в течение 5 дней при
температуре 37oС.
Воздействие желчью
Первоначальные культуры были подвергнуты центрифугированию, и бактерии были помещены в объем YEL, в 10 раз превосходящий
предыдущий объем и содержащий 0,3% бычьей желчи (около 50% желчных солей). После инкубации при температуре 37oС в течение 90 мин культуры были подвергнуты центрифугированию и бактерии вновь
были помещены в тот же объем YEL. Соответствующие количественные измерения были сделаны до и после инкубации, и возобновление роста сопровождалось измерениями оптической плотности в течение 5 дней при
температуре 37oС.
Последовательное воздействие кислотой и желчью
Указанные выше бактерии подвергались кислотному воздействию, как описывалось выше, однако после
центрифугирования исследуемые клетки были помещены в объем YEL, содержащий 0,3% желчи. После второй инкубации при температуре 37oС в течение 90 мин упомянутые культуры были подвергнуты
центрифугированию и бактерии были помещены в тот же объем YEL. Соответствующие количественные измерения были сделаны до и после инкубации, и возобновление роста сопровождалось измерениями оптической
плотности в течение 5 дней при температуре 37oС.
Полученные результаты отражены, с одной стороны, в приведенной таблице 1, показывающей воздействие кислоты и/или желчи на жизнеспособность бактерий, и, с другой стороны, на чертеже, где схематично показано возобновление роста после различных воздействий.
Таким образом, было установлено, что
- кислотная среда приводит к гибели значительного количества бактерий (96,8% для TL 162 и 97,5% для TL 24), что объясняет достаточно длительную задержку в возобновлении роста (см. чертеж);
- желчь не приводит к гибели бактерий, что объясняет очень быстрое возобновление роста;
- когда бактерии подвергают воздействию желчью, предварительно подвергнув их воздействию кислотой, то
это приводит к практически полной их гибели. Этот совершенно неожиданный результат показывает, следовательно, что бактерии, подвергнутые кислотному воздействию и сохранившие тем не менее
жизнеспособность, становятся полностью чувствительны к воздействию желчи; тогда как без предварительного кислотного воздействия эти же самые бактерии абсолютно нечувствительны к воздействию клеток
желчи.
Учитывая изложенные выше обстоятельства, были проведены исследования по преадаптации с целью усиления сопротивляемости бактерий. Действительно, известно, что предварительное воздействие кислотой (рН 4,5-5) эффективно предохраняет клетки от кислотного воздействия (рН 2).
Так, на культуре TL 162 были проведены три опыта по адаптации:
- предварительное испытание кислотой: предварительная инкубация клеток при температуре 37o в течение 30 минут при рН 5;
- предварительное испытание желчью: инкубация в течение 30
минут в присутствии 0,08% желчи;
- предварительное испытание кислотой и желчью: инкубация в течение 30 минут при рН 5 и в присутствии 0,08% желчи.
При использовании описанного выше порядка действий были получены результаты, сведенные в приведенную таблицу 2.
В результате опытов было установлено, что преадаптация кислотой еще более ослабляет клетки, тогда как преадаптация желчью эффекта не имеет.
Приведенные выше результаты, таким образом, со всей очевидностью показали необходимость последовательного воздействия, а не отдельного, как описано в большинстве исследований, проведенных в данной области.
Можно, однако, предположить, что в живом организме условия для бактерий менее жесткие (буфферный эффект пищи в желудке, очень незначительное бактерицидное воздействие желчных солей в виде мицелл с фосфолипидами).
С учетом изложенного выше для увеличения количества живых бактерий недостаточно только увеличить их стойкость к кислотному рН воздействию, так как упомянутые бактерии остаются чувствительны к воздействию желчных солей.
Однако при изучении защиты исследуемых бактерий от кислотного воздействия, в частности при употреблении их вовнутрь в гастростойкой желатиновой капсуле, в фекалиях обнаруживаются бактерии, имеющие естественную устойчивость к воздействию желчи и обладающие повышенной жизнеспособностью.
С учетом имеющихся результатов был проведен дополнительный опыт, имеющий целью сравнить способность различных штаммов пропионовокислых бактерий производить значительные количества пропионовой кислоты после контакта с желчными солями.
В указанном опыте сравнивались 33 штамма пропионовокислых молочных бактерий из коллекции TL
LRTL (INRA, Rennes) на предмет исследования их жизнеспособности в среде, содержащей желчь, и после этого их способности синтезировать пропионовую кислоту:
- 20 штаммов, принадлежащих к виду
Р. freudenreichii subsp shermanii;
- 6 штаммов, принадлежащих к виду Р. freudenreichii subsp freudenreichii;
- 7 штаммов, принадлежащих к виду Р. acidipropionici.
Последовательность операций была следующей.
Культуры в начале стационарной фазы (культуры находились от 2 до 3 дней в среде YEL и их инкубация осуществлялась при температуре 30oС) были подвергнуты разведению в соотношении 1/10 в среде YEL, содержащей 0,6% бычьей желчи (примерно 7-8 ммоль/л желчных солей). Указанная концентрация желчи была выбрана для обозначения наилучшего различия штаммов между собой, кроме того, она соответствует содержанию желчных солей того же порядка, что и в двенадцатиперстной кишке.
Инкубация исследуемых разведений проводилась при температуре 37oС в течение 90 минут, после чего они подвергались центрифугированию. Далее бактерии были вновь помещены в среду YEL (первоначальный объем) и дальнейшая инкубация проводилась при температуре 37oС.
После 24 часов инкубации была измерена оптическая плотность при 650 нм для оценки возобновления роста. Далее был отобран супернатант, который в последующем был заморожен для оценки уровня содержания жирных кислот.
Для отдельных штаммов опыт был возобновлен для подтверждения полученных результатов.
Величины оптических плотностей при 650 нм до воздействия желчью и 24 часа после окончания воздействия сведены в прилагаемую таблицу 3.
Следует отметить, что для некоторых штаммов конечная оптическая плотность выше первоначальной, что может объясняться возобновлением роста при 37oС, а не при первоначальных 30oС.
В зависимости от
полученных результатов можно схематично выделить три группы штаммов:
- штаммы, отличающиеся быстрым возобновлением роста при незначительной смертности клеток под воздействием желчи (к таким
штаммам относятся TL 34, TL 160, TL 63, TL 33, TL 15, TL 3, TL 162);
- штаммы, отличающиеся очень малой степенью устойчивости к воздействию желчи, показывающие очень слабое или нулевое
возобновление роста (TL 148, TL 4, TL 64, TL 47);
- штаммы, занимающие промежуточное положение и отличающиеся умеренной смертностью под воздействием желчи (TL 146, TL 147, TL 167, TL 168, TL
14, TL 17, TL 22, TL 24, TL 61, TL 40, TL 54).
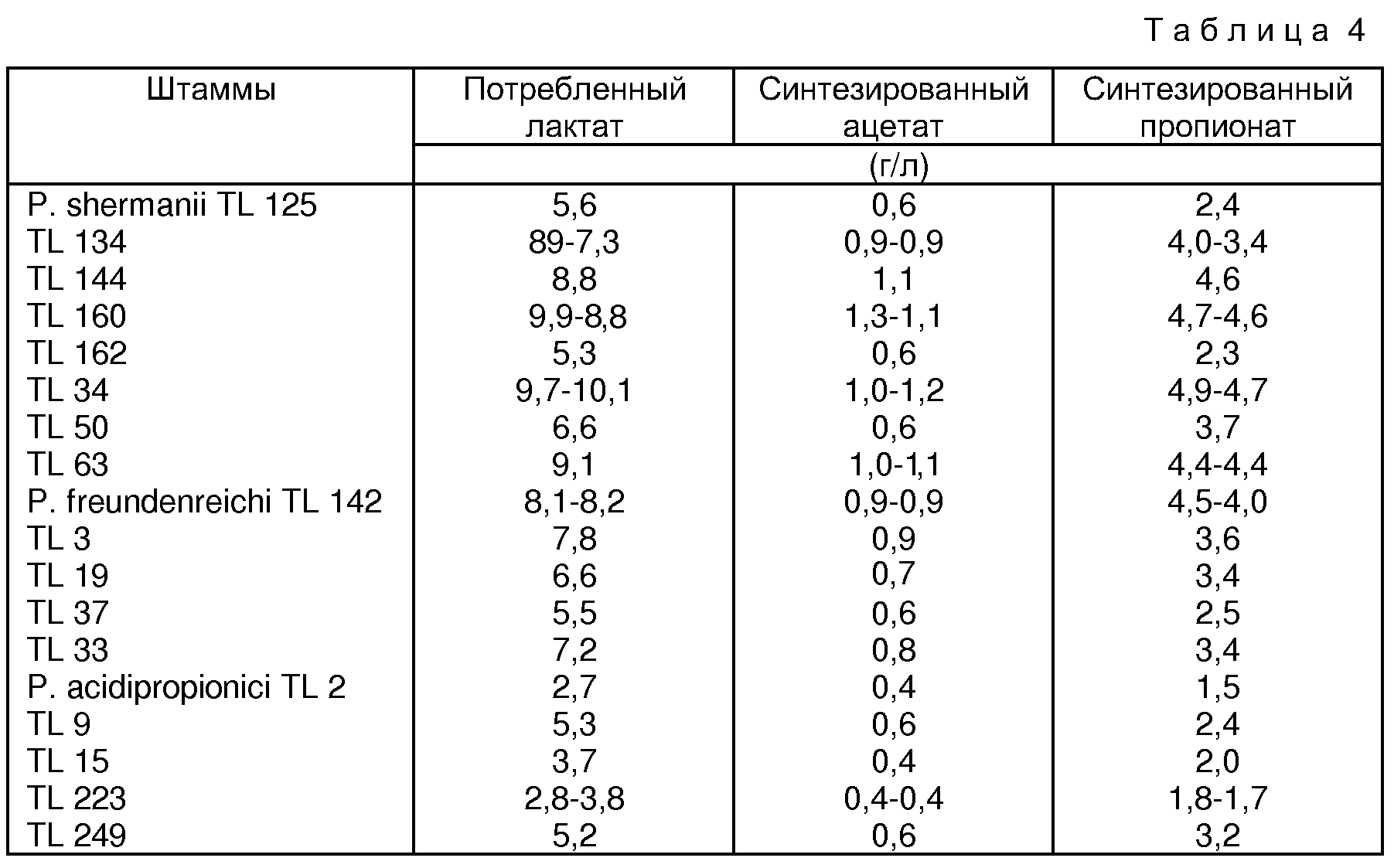
Только лишь штаммы, имеющие соотношение [(Оптическая плотность после 24 ч. /Первоначальная оптическая плотность)•100] , превосходящее 60% (данный порог был выбран произвольно), были отобраны для измерения лактатов, ацетатов, и пропионатов методом HPLC в замороженном супернатанте. Первоначальное содержание лактата в среде YEL составляло 11,4 г/л.
Величины, показывающие концентрацию лактатов, ацетатов и пропионатов в супернатанте, отобранном после 24 часов инкубации, сведены в прилагаемую таблицу 4.
Таблица 4 со всей очевидностью показывает, что количество синтезированного пропионата коррелирует со степенью использования лактата.
В общем случае штаммы, принадлежащие к виду Р.acidipropionici, синтезируют меньше пропионовой кислоты, чем штаммы вида Р.freundenreichii за 24 часа.
Приведенные выше результаты показывают, что некоторые
штаммы наилучшим образом подходят с точки зрения синтеза пропионата после воздействия желчи. Речь идет о штаммах, синтезирующих по меньшей мере 2 г/л пропионата при описанных выше условиях:
TL 134, TL 50, TL 3, TL 19, TL 33, TL 249;
и предпочтительно, синтезирующих более 4 г/л пропионата:
TL 160, TL 144, TL 34, TL 63, TL 142.
Кроме того, на добровольцах с нормальным состоянием здоровья был проведен эксперимент с целью проверки благотворного влияния устойчивых к воздействию желудочного сока желатиновых капсул для улучшения выживаемости в кишечнике штамма пропионовокислых сыроваренных бактерий, употребляемых вовнутрь в лиофилизированном виде (TL 162).
Эксперимент был проведен всего на 7 пациентах, в нем было предусмотрено 3 периода лечения по 4 недели, разделенных трехнедельным интервалом.
Период лечения 1 предусматривал употребление в течение 2 недель бактерий в желатиновых капсулах, неустойчивых к воздействию желудочного сока, из расчета 5•109 КОЕ/день.
Период лечения 2 предусматривал употребление в течение 2 недель бактерий в желатиновых капсулах, неустойчивых к воздействию желудочного сока, из расчета 5•1010 КОЕ/день.
Период лечения 3 предусматривал употребление в течение 2 недель бактерий в желатиновых капсулах, устойчивых к воздействию желудочного сока, из расчета 5•109 КОЕ/день.
Для каждого из упомянутых периодов лечения производились 4 отбора каловых проб для обнаружения
пропионовокислых бактерий с использованием специальной селективной среды (Palpropiobac®, Standa Industrie с добавлением 4 мг/л метронидазола). Отбор проб производился в следующие
сроки:
- S1: непосредственно перед периодом употребления;
- S2: одна неделя после начала употребления;
- S3: две недели после начала употребления;
- S4: одна неделя
после окончания периода употребления;
- HP (для периода 3): 3 недели после окончания периода употребления.
В течение всего эксперимента добровольцы не употребляли сыр, содержащий значительное количество пропионовых бактерий (Эмменталь, Конте, Леердаммер, Грюйер Сюисс,...), за исключением плавленых сыров.
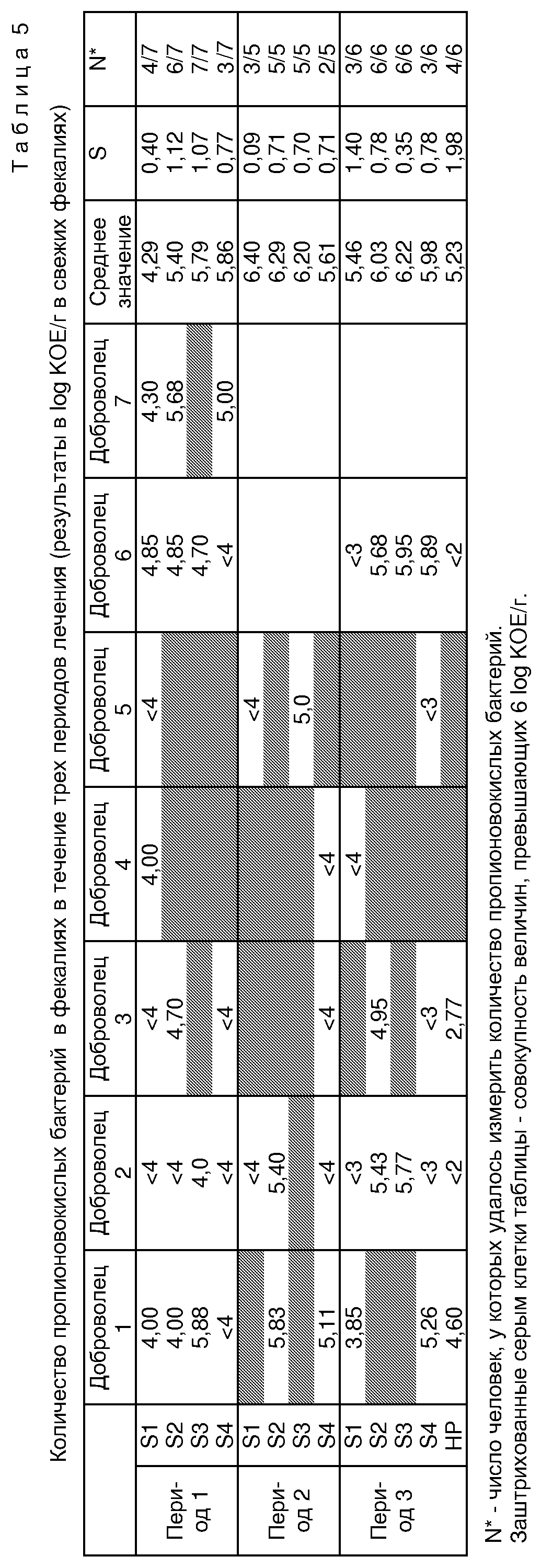
В таблице 5 сведены результаты жизнеспособности пропионовокислых бактерий в фекалиях.
В случае с классическими желатиновыми капсулами доза 5•109 КОЕ/день (период 1) оказалась недостаточной для обнаружения достаточного количества живых бактерий у добровольцев. Напротив, при использовании дозы 5•1010 КОЕ/день (период 2) у всех добровольцев содержалось более 5 log КОЕ/грамм живых пропионовокислых бактерий в фекалиях, начиная с первой недели лечения. При этом максимальный уровень жизнеспособности, наблюдаемый с использованием упомянутых доз, лежит в одних и тех же пределах (около 7 log).
Использование устойчивых к воздействию желудочного сока желатиновых капсул (период 3) улучшает жизнеспособность пропионовокислых бактерий в фекалиях, в частности, у тех добровольцев, у которых их было обнаружено мало в течение первого периода (добровольцы 1, 2 и 6). В действительности, по сравнению с периодом 2 полученные уровни жизнеспособности в среднем эквивалентны.
- при базовом значении 5•109 КОЕ/день использование устойчивых к воздействию желудочного сока желатиновых капсул, таким образом, оправдано для
определенного количества добровольцев (добровольцы 1, 2, 6), для остальных указанная величина не улучшает жизнеспособность либо улучшает ее незначительно (добровольцы 3, 4, 5);
- при
проведении исследований при указанных выше условиях получаются примерно те же результаты, что и при применении классических желатиновых капсул, содержащих 5•1010 КОЕ.
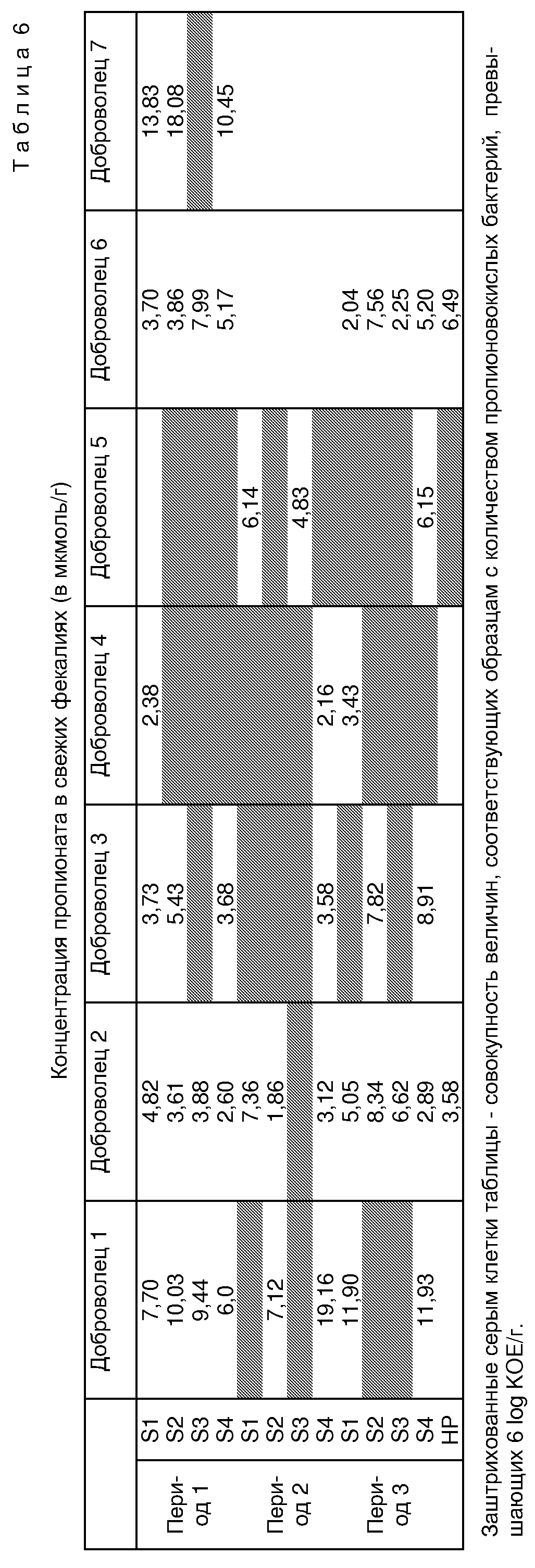
В исследуемых фекалиях методом газовой хроматографии были измерены AGCC. Количество пропионата в фекалиях показано в таблице 6. Для статистического анализа производилось попарное сравнение двух групп величин: значения, соответствующие тем фекалиям, где пропионовокислые бактерии не были обнаружены (<4 log) для всех периодов лечения и смешанных периодов, сравнивались со значениями, соответствующими тем фекалиям, где измеренное количество пропионовокислых бактерий превышало 6 log КОЕ/г. В первом случае среднее количество пропионата составляет 5,06±2,56 мкмоль/г (n=25), во втором случае оно составляет 7,19±3,18 мкмоль/г (n=30). Упомянутые две величины значительно различаются между собой при р<0,02 (тест Стьюдента). Для других AGCC не было обнаружено существенных различий. Данный эксперимент показывает, таким образом, что присутствие значительного количества (> 6 log KOE/г) пропионовокислых бактерий в ободочной кишке вследствие употребления вовнутрь TL 162 значительно увеличивает количество пропионата в фекалиях. Однако штамм TL 162 не самым лучшим образом подходит для оптимизации синтеза пропионовой кислоты в ободочной кишке (см. критерии отбора in vitro); очевидно, что полученные результаты могут быть улучшены при использовании штамма, отобранного с учетом сформулированных выше критериев.
С учетом изложенного выше и в соответствии с предпочтительной характеристикой настоящего изобретения отбор используемых пропионовокислых бактерий осуществляют среди штаммов, способных синтезировать пропионовую кислоту в физиологически значимых количествах, в частности, среди штаммов, синтезирующих по меньшей мере 2 г/л пропионовой кислоты и/или пропионатов; предпочтительно более 4 г/л пропионовой кислоты и/или пропионатов после культивации в течение 2-3 дней при температуре 30oС в среде YEL, содержащей примерно 11,4 г/л лактата, с последующим разведением в соотношении 1/10 в среде YEL, содержащей 0,6% бычьей желчи, инкубации при 37oС в течение 90 минут, центрифугирования, помещения в среду YEL и повторной инкубации при температуре 37oС в течение 24 часов.
Другим критерием отбора, который может быть принят во внимание согласно настоящему изобретению, является способность упомянутых штаммов удерживаться на колоноцитах: штаммы с хорошей способностью закрепляться или удерживаться имеют преимущество, так как они остаются более длительное время в ободочной кишке и, следовательно, имеют больше времени для синтеза пропионовой кислоты; более того, штаммы, обладающие способностью удерживаться, могут занять место патогенных агентов.
Следует отметить, что требуемого эффекта нельзя достичь непосредственно за счет употребления пропионовой кислоты в чистом виде, так как она не может попасть в ободочную кишку, принимая во внимание порядок обмена веществ в человеческом организме, более того, было доказано, что ее употребление в больших дозах вредно для желудка.
Среди благотворных эффектов, которыми обладают жирные кислоты с короткой цепочкой, синтезированные на уровне ободочной кишки, и, в частности, уксусная кислота и прежде всего пропионовая кислота, следует выделить ту роль, которую они играют в усвоении основных минералов, в частности кальция, железа, цинка и магния; в действительности было установлено, что пропионовая кислота и в меньшей степени уксусная кислота могут способствовать абсорбции на уровне ободочной кишки упомянутых минералов и дальнейшему их использованию организмом.
В рассматриваемом случае речь идет об особенно интересном явлении, так как указанное усвоение минералов сопровождается функциональными эффектами, например коррекцией анемии для железа или же костной минерализацией для кальция.
Проведенные экспериментальные и клинические исследования позволили получить определенное количество не противоречащих друг другу аргументов в пользу благотворного воздействия пропионовой кислоты и пропионатов и в меньшей степени уксусной кислоты и ацетатов на метаболизм минералов; данное благотворное воздействие, по всей видимости, особенно важно в случае плохих условий для процесса пищеварения, так как позволяет перенести значительное количество минералов, которые не были усвоены на уровне тонкого кишечника на уровень ободочной кишки (особенно, когда организм испытывает повышенную потребность в этих минералах).
Наличие связи между жирными кислотами с короткой цепочкой и метаболизмом минералов, в частности, изучалось в ходе опытов, где использовались растворимые волокна. Так, было установлено, что полисахариды или олигосахариды, не переваренные пищеварительными ферментами и преобразованные в жирные кислоты с короткой цепочкой (в частности, пропионаты) флорой ободочной кишки, увеличивают усвоение минералов, таких как кальций, железо или цинк, и что данное увеличение усваиваемости наиболее ярко проявляется при наличии патологий (недостаточности, гастроэктомия ...).
Изучение перфузии на уровне ободочной кишки и, напротив, отсутствие эффекта у отобранных пациентов позволили подтвердить локализацию активных участков на уровне ободочной кишки.
Кроме того, было показано, что упомянутые процессы сопровождаются понижением уровня рН и синтезом жирных кислот с короткой цепочкой, все это позволяет предположить, что упомянутые кислоты воздействуют посредством ферментации; это подкрепляется также и тем, что, как было установлено, нерастворимые волокна, не подверженные ферментации, не оказывают воздействия. Кроме того, было установлено, что при этом гипертрофируется слепая кишка и наблюдается прилив крови на уровне ободочной кишки, что в свою очередь подтверждает наличие трофического эффекта.
Несмотря на небольшое количество клинических исследований, проведенных на пациентах, можно утверждать, что воздействие от растворимых волокон, было получено за счет ферментации на уровне ободочной кишки, кроме того, было непосредственно продемонстрировано влияние жирных кислот с короткой цепочкой на абсорбцию минералов.
Среди упомянутых выше исследований можно назвать публикацию "Trinidad TP, Wolever TMS, Thomson LU, Effect of acetate and propionate on calcium absorption from the rectum and distal côlon of humans. Am J C1in Nutr 1996, 63/574-578", в которой описываются опыты, в которых осуществлялась прямая перфузия уксусной кислоты, пропиононой кислоты или их смеси в физиологической концентрации в периферическую ободочную кишку здоровых пациентов; таким образом было установлено, что уменьшение кальция в просвете ободочной кишки усиливалось под воздействием обеих жирных кислот с короткой цепочкой, но в значительно большей степени под воздействием пропионовой кислоты; данное исследование также продемонстрировало на основе ненасыщаемой системы абсорбции эффект дозы. Авторы предположили, что большая липофильность пропионовой кислоты по сравнению с уксусной кислотой способствует абсорбции первой и высвобождению в колоноцитах протонов, прохождение которых в просвет кишечника способствует абсорбции кальция.
С учетом изложенного выше, настоящее изобретение также касается применения пропионовокислых бактерий, отобранных на основании их слабой подверженностью автолизу и их способности противостоять воздействию желчных солей, для получения пищевой композиции, или диетической, или медикаментозной композиции, употребляемых человеком или животным, приготовленных таким образом, чтобы упомянутые бактерии были защищены, по меньшей мере частично, от воздействия кислоты, содержащейся в желудочном соке, и содержащих по меньшей мере 106 клеток/грамм упомянутых бактерий, способных оказывать благоприятное воздействие на усвоение основных минералов, в частности кальция, и/или железа, и/или цинка, и/или магния на уровне ободочной кишки.
Согласно одному из вариантов осуществления изобретения предлагается применить настоящее изобретение для получения композиции, обладающей противогрибковыми свойствами на уровне ободочной кишки и, в частности, способной замедлить в указанной части организма развитие патогенных грибков типа candida/молочница.
Действительно, упомянутое выше применение позволяет использовать замечательные противогрибковые свойства пропионовой кислоты, в частности, для лечения кандидозов, вызванных применением антибиотиков.
Следует отметить, что композиция, используемая согласно настоящему изобретению, может содержать другие бактерии, в частности молочнокислые бактерии и/или бифидобактерии, которые могут действовать синергически с пропионовокислыми бактериями таким образом, чтобы при этом усиливался указанный выше эффект, поставляя лактат в качестве субстрата, подверженного ферментативному расщеплению.
Композиция, используемая согласно настоящему изобретению, может состоять из сухого или гидратированного препарата в виде индивидуальных фракций, вес которых составляет примерно от 100 мг до 1 г, предпочтительно от 200 до 500 мг, предпочтительно содержащих по меньшей мере 108 клеток; она может, в частности, находиться предпочтительно в виде желатиновых капсул или капсул, устойчивых к воздействию желудочного сока.
Согласно другой отличительной характеристике настоящего изобретения указанная композиция может состоять из переработанного препарата, в котором пропионовокислые бактерии добавляются или ассоциируются с подверженным ферментному расщеплению субстратом, в частности с пищевыми волокнами, или же добавляются или входят в состав пищи в жидком, пастообразном или твердом виде.
В указанном выше препарате пропионовокислые бактерии могут играть двойную роль, а именно технологическую на первом этапе, участвуя в ферментативном расщеплении пищи, и функциональную на втором этапе, так как после употребления вовнутрь они попадают в ободочную кишку, где играют указанную выше пробиотную роль, в частности оптимизируют синтез пропионовой кислоты и усвоение минералов.
Реферат
Пищевая, диетическая или медикаментозная композиция, содержащая пропионово-кислые бактерии, выбранные на основании их незначительной приверженности автолизу, а также их устойчивости к воздействию желчных солей, приготовленная таким образом, чтобы обеспечивалась по меньшей мере частичная защита от воздействия желудочного сока, и содержащая, по меньшей мере, 10 клеток/г упомянутых бактерий, способная оказывать значительное стимулирующее и усиливающее воздействие на синтез пропионовой кислоты и/или пропионата, а в случае необходимости, уксусной кислоты и/или ацетата на уровне ободочной кишки путем бактериальной анаэробной ферментации. 8 з.п. ф-лы, 1 ил., 6 табл.


Комментарии