Продуцент монооксида азота в пищевой, или диетической, или медикаментозной композиции, диетическая или медикаментозная композиция - RU2204400C2
Код документа: RU2204400C2
Чертежи







Описание
Настоящее изобретение относится к пищевой композиции или диетической или медикаментозной композиции, для приема внутрь, содержащей пропионовые бактерии, способные выделять физиологически значимые количества монооксида азота в пищеварительный тракт человека или животного.
В течение многих десятилетий абсолютно не был известен тот факт, что монооксид азота является одним из элементов, необходимых для жизни и ее поддержания, и только последние четыре или пять лет исследователи обратили внимание на то, что этот оксид очень полезен, как в области медицины, так и в области питания и физиологии.
Только в последнее время за монооксидом азота признали значительное количество физиологических функций и была выдвинута гипотеза, что этот газ может участвовать в роли основного фактора в таких разнообразных функциях, как регуляция артериального давления, неспецифическая цитотоксическая функция макрофагов, агрегация тромбоцитов, нервная проводимость или регуляция моторики пищеварительного тракта.
На основе этих предположений ученые провели большое количество исследований, относящихся к монооксиду азота, в результате которых была подтверждена важность этого газа.
Известно, что монооксид азота, который является очень нестойким газом (период полураспада меньше 5 с в биологических системах), образуется путем биосинтеза внутри организма человека или животного из L-аргинина через группы ферментов, названных NO-синтетазы (NOS), среди которых выделяют два основных типа, а именно, с одной стороны NOS конституционные, которые синтезируются, в частности, в эндотелиальных клетках, тромбоцитах и нейронах, а с другой стороны, NOS индуцируемые, которые синтезируются, в основном, некоторыми клетками иммунной системы (макрофаги и, в частности, гранулоциты), гладкими мышечными клетками сосудов и эндотелиальными клетками.
Нужно отметить, что NOS индуцируемые продуцируют на несколько порядков больше NO, чем NOS конститутивные, но в обоих случаях продукция NO остается относительно небольшой.
Учитывая вышеуказанную полезную роль монооксида азота, желательно иметь возможность увеличивать его продукцию, в частности, используя естественный путь пищевого метаболизма.
Но до сих пор не было предложено таких средств, которые позволили бы достигнуть желаемого результата.
Цель данного изобретения - заполнить этот пробел.
Согласно изобретению, цель была достигнута благодаря неожиданному обнаружению того, что особый тип бактерий, а именно, пропионовые бактерии, способны продуцировать монооксид азота, и что среди этих бактерий определенные виды и определенные штаммы этих видов продуцируют его в больших количествах.
Здесь речь идет о пропионовых бактериях, которые, хотя и не относятся к группе молочнокислых или к бифидобактериям, обычно вводимым в организм человека посредством молочных десертов или других молочнокислых продуктов, тем не менее присутствуют в пище человека уже много веков: именно они способствуют получению дырок при изготовлении сыра, называемого эмментальским, который в конце созревания содержит приблизительно 109 клеток/г пропионовых бактерий.
Нужно отметить, что эти бактерии в процессе брожения продуцируют также пропионовую кислоту, уксусную кислоту и диоксид углерода.
Вышеуказанный факт тем более удивителен, что удалось установить, что молочнокислые бактерии, бифидобактерии и/или дрожжи, широко используемые в агропродовольственной области, не продуцируют монооксид азота.
Изобретение относится, следовательно, к применению пропионовых бактерий для получения пищевой композиции или диетической, или медикаментозной абсорбируемой композиции, способной выделять физиологически значимые количества монооксида азота в пищеварительный тракт человека или животного.
Согласно изобретению, эта композиция может состоять из обработанного и/или представленного в жидкой форме, в частности, ферментированной жидкой форме, в обезвоженной форме или промежуточной влажности препарата.
Нужно заметить, что не выходя за рамки изобретения, композиция может представлять собой:
- либо форму
специфического препарата, имеющего одну физиологическую конечную цель, а именно: прием внутрь пропионовых бактерий, способных выделять физиологически значимые количества монооксида азота,
- либо форму обработанного пищевого препарата, имеющего параллельно другую конечную цель, в частности, энергетическую или функциональную; в этом случае пропионовые бактерии могут быть добавлены или
включены в сами продукты, в частности, в сыры, в пищевые волокна, такие как злаковые хлопья, или в молочнокислые продукты, сливочные десерты, пирожные и/или оздоровительные напитки и т.д.
Согласно изобретению, пропионовые бактерии могут быть введены в форме биомассы или в форме закваски, способной размножаться in situ.
Если композиция является обезвоженной, то она находится преимущественно в форме индивидуальных фракций, содержащих дозу бактерий для регулярного приема.
Эти фракции могут быть введены в желудок непосредственно или предварительно растворены в жидкости; они могут быть представлены в форме, позволяющей облегчить их прием: таблетки, жидкость или пакетики гранулированного порошка.
Было подтверждено, что концентрация пропионовых бактерий в таких обезвоженных концентрированных препаратах при хранении в течение одного года при +4oС, снижается менее чем на 1 Log.
Опыт показал, что гастрорезистентные или нет желатиновые капсулы - это наиболее предпочтительная форма упаковки.
Согласно другой характеристике изобретения, каждая отдельная фракция содержит большое количество бактерий, предпочтительно больше 109 бактерий.
Различные эксперименты (кратко изложенные ниже) позволили подтвердить особую способность разных штаммов пропионовых бактерий продуцировать NO во время их выращивания. Проверяли сначала косвенно исходя из замера нитритных ионов NO2 затем непосредственно путем масс-спектрического анализа в анаэробной среде.
Во время этих экспериментов сначала изучали концентрацию нитритов в средах, богатых аргинином и обедненных нитратами (50 мкМ), и пришли к выводу, что аргинин не является определяющим элементом в образовании NO.
Затем исследовали среды с добавлением нитратов. Полученные в этом случае результаты выявили нитратный характер, зависимый от образования монооксида азота.
1. Предварительные сравнительные тесты
Разные бактерийные штаммы (inoculum yaourt, бифидобактерии, lactobacillus) были выращены в присутствии
восстановленной молочной среды (100 мл), дополненной дрожжевым экстрактом (10 г/л), затем инкубированы при 37oС.
Измеряли аккумуляцию нитритов на протяжении времени.
Эти предварительные тесты были выполнены в следующих условиях:
- инкубация при 37oС в течение 0, 4, 7 или 10 ч,
- 3 повтора,
- дозирование нитритов по
системе Bran-Luebbe.
Принимая во внимание природу анализируемых экстрактов, стадию очистки образцов проводили последовательно путем двойного центрифугирования (2•10 мин, 4oС, 15000 об/мин), за которым следовала ультрафильтрация на фильтрах miniprep 10 (удержание протеинов с мол. масс. >10 kD), затем частичная очистка на смоле Waters C18 (55-105 мкм).
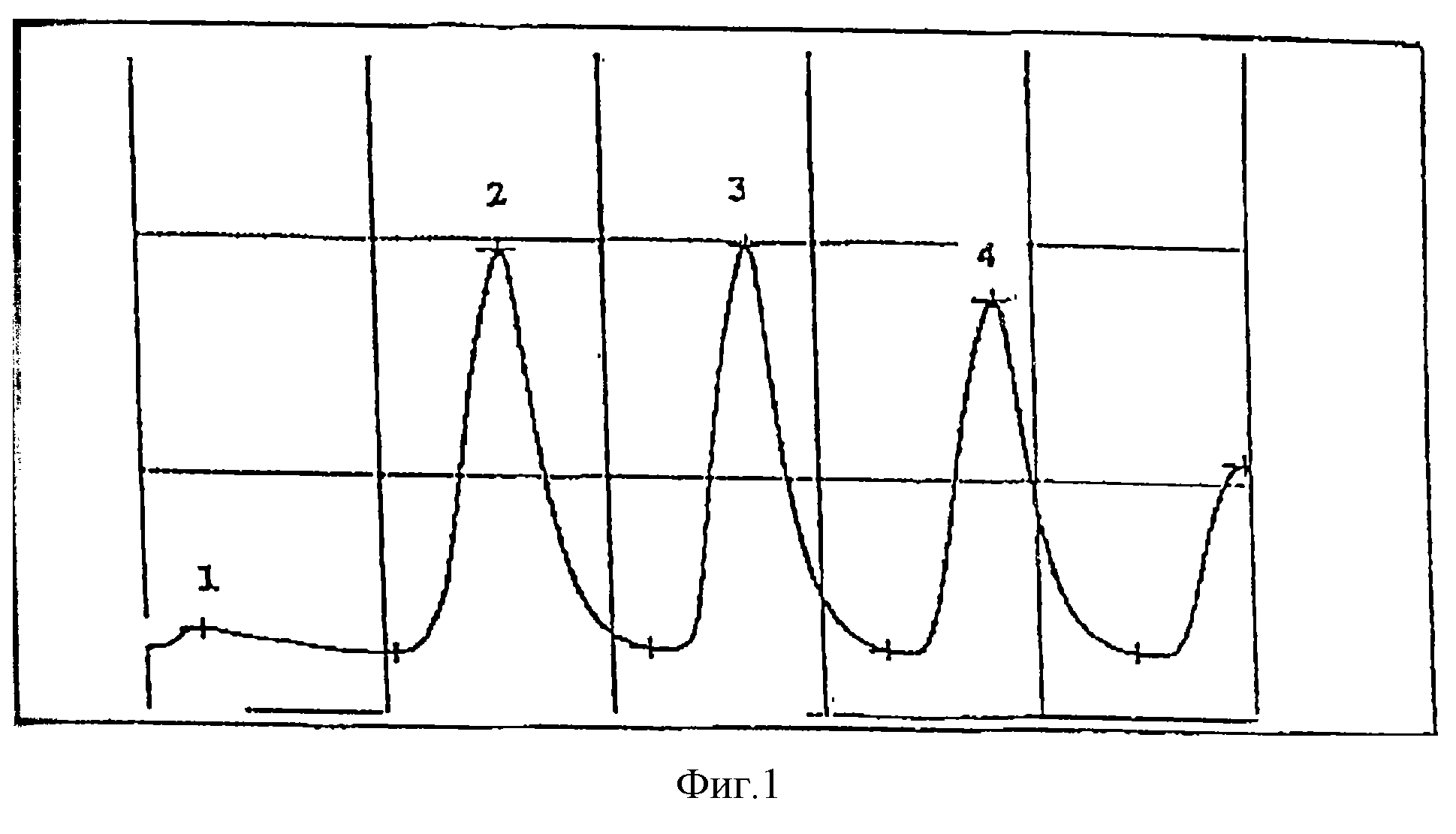
Этот метод тестировался сначала на эталонных нитритных образцах (фиг. 1), затем на экстрактах культуры Lactobacillus, инкубированных в течение 7 ч, к которым добавляли или не добавляли известное количество нитрита (фиг. 2).
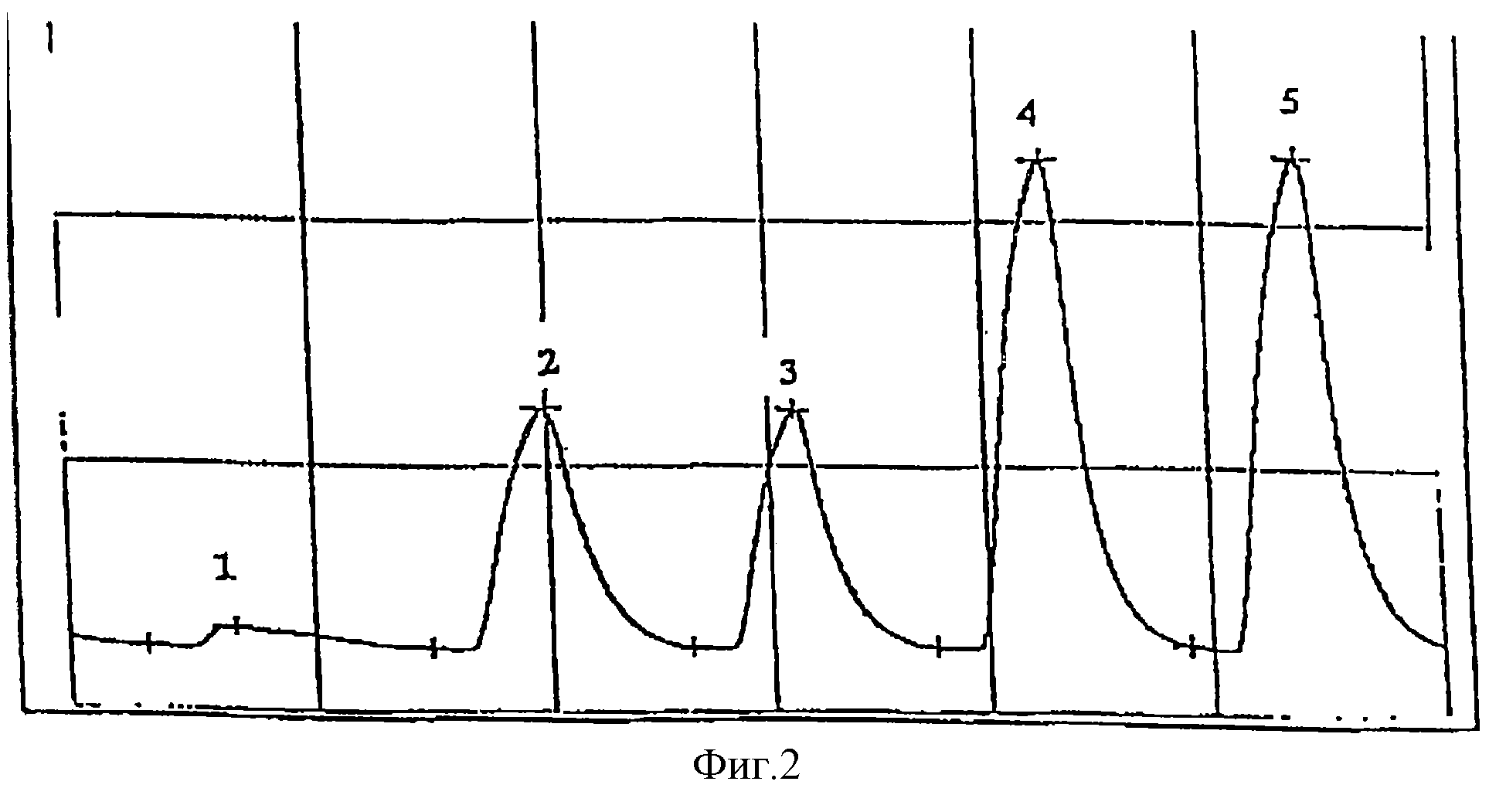
На фиг. 1 представлены колориметрические профили, полученные методом автоматического анализа Bran-Luebbe:
(1) - питательной среды
бифидобактерий после 10 ч инкубации,
(2) - стандартного раствора нитрита,
(3) - этого же самого раствора, ультрафильтрованного,
(4) - этого же самого раствора,
ультрафильтрованного и очищенного на смоле C18.
На фиг. 2 представлены колориметрические профили, полученные методом автоматического анализа Bran-Luebbe:
(1) - питательной
среды Lactobacillus после 10 ч инкубации при 37oС,
(2) (3) стандартного раствора, содержащего 410 мкг/л нитрата,
(4) (5) питательной среды Lactobacillus после 10 ч
инкубации при 37oС, к которой было добавлено известное количество нитрита с целью получения раствора с концентрацией 820 мкг/л нитрита.
Эти образцы были очищены центрифугированием, ультрафильтрацией и на смоле С18 в условиях, описанных выше.
Согласно этим тестам никакой аккумуляции нитрита не было обнаружено ни в йогуртовом инокуляте, ни в бифидобактериях, ни в Lactobacillus при любой продолжительности инкубационного периода (0, 4, 7 или 10 ч).
2. Выявление аккумуляции нитрита культурами пропионовых бактерий
Предварительно исследовали возможное присутствие нитрата или нитрита в среде YEL путем колориметрического дозирования (набор Boerhinger) и смогли выявить значительное количество нитрата (концентрация
порядка 50 на 100 мкМ), источником которого может быть дрожжевой экстракт, используемый для получения этой среды; что же касается нитрита, то среда YEL была полностью его лишена.
Были протестированы культуры пропионовых бактерий (1 г лиофилизата на 100 мл среды YEL).
Тесты проводились в следующих условиях:
- инкубация при 30oС в течение 24, 48
или 72 ч,
- 3 повтора для инкубации 24 ч,
- прекращение инкубации путем кипения,
- очистка продукта путем центрифугирования и пересев экстракта на смолу С18,
- количественное определение нитритов в среде путем анализа по системе Bran-Luebbe.
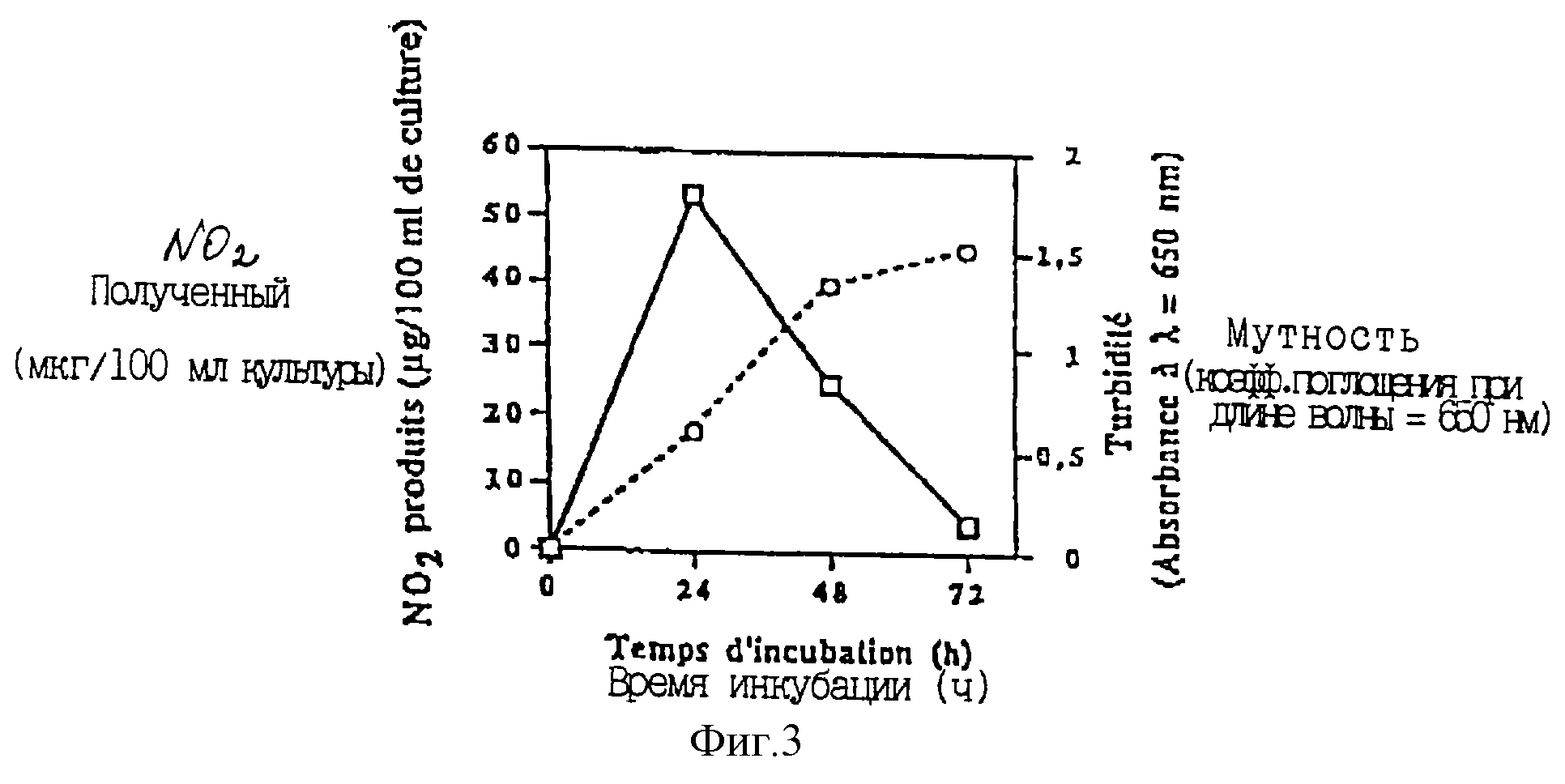
Количество нитритов, аккумулированных пропионовыми бактериями, определяли с целью установить кинетику аккумуляции нитритов в зависимости от времени инкубации бактерий на среде YEL.
Фиг. 3 представляет, с одной стороны, изменения количества полученного нитрита (в мкг/100 мл культуры) в зависимости от времени инкубации (в часах) (D), и, с другой стороны, изменения мутности (коэффициент поглощения при длине волны = 650 нм) также в зависимости от времени инкубации (О).
Эта фигура показывает, что количество нитрита является максимальным при 24-часовой инкубации, затем она значительно уменьшается после 48 и 72 ч инкубации.
Разумно предположить, что это уменьшение является результатом восстановления нитрита до NO, N2О или других соединений нитритредуктазой.
Согласно изобретению, было доказано, что аккумуляция NO2 зависит от видов или штаммов используемых пропионовых бактерий.
Это было проверено тестами, описанными ниже:
3. Выявление и сравнение аккумуляции
нитрита в культуральной среде в случае использования 9 штаммов 4 разных видов пропионовых бактерий.
Согласно этому тесту изучали штаммы Р20, Р23, 2408, 2410, 2500 и 2501 вида Р. freudenreichii и штаммы TL221, TL223 и TL207, принадлежащие соответственно видам Р. thoenii, P. acidipropionici и Р. jensenii. Следует отметить, что штаммы TL (молочная технология) являются штаммами, относящимися к INRA-LRTL, в то время как штамм Р23 (или ITG23) был зарегистрирован в Государственной Коллекции Культур Микроорганизмов (CNCM) Института Пастера под номером I - 1804 датой 18.12.96.
Разные штаммы пропионовых бактерий (1 г лиофилизата или 5 мл свежей культуры) были культивированы в 100 мл среды YEL, содержащей приблизительно 50 мкМ нитрата, в следующих условиях:
- инкубация при 30oС в течение 12, 24, 36 или 48 ч,
- 3 повтора,
- прекращение инкубации кипячением,
- очистка продукта путем центрифугирования и пересев
экстракта на смолу С18,
- аккумуляцию нитрита в среде измеряли анализом по системе Bran-Luebbe,
- оценка брожения в каждой культуре путем расшифровки коэффициента поглощения при
длине волны = 650 нм.
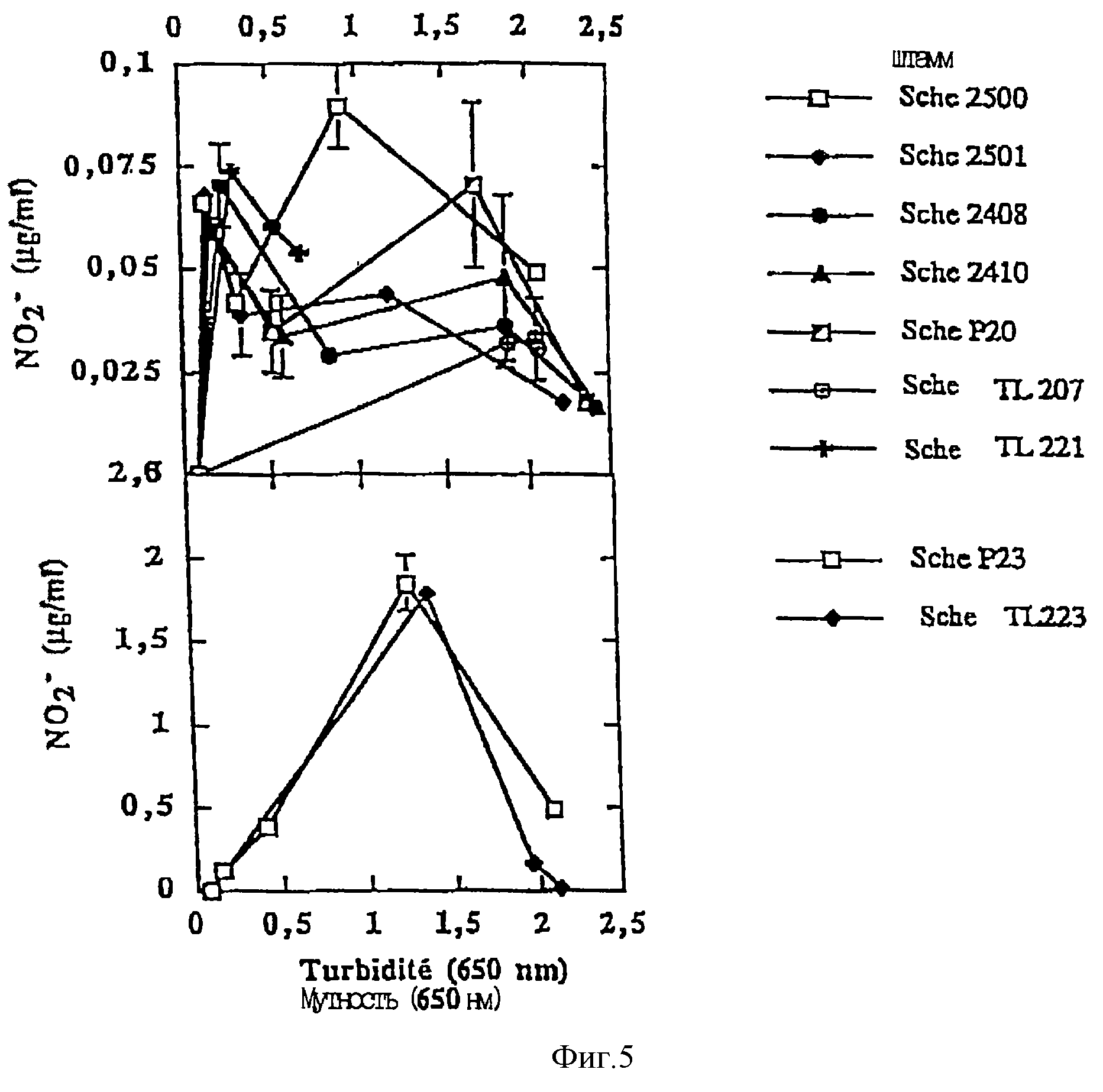
Результаты, полученные для каждого штамма, собраны на фиг. 4.
Фиг. 4 представляет, в каждом случае, изменения аккумуляции нитрита (□) и мутности культуральной среды (О) в зависимости от продолжительности инкубации. Каждая величина соответствует средней величине ± стандартное отклонение от средней при н = 3.
Следует отметить, что масштабы аккумуляции нитрита оказываются в 25 раз больше в случае штаммов Р23 и TL223.
Эти результаты доказывают, что рост бактерий, определяемый по увеличению мутности культуральной среды, очень близок у всех изученных штаммов, и достигает приблизительно 2-2,5 ед. ОП после 48 ч инкубации, за исключением штамма TL221, для которого мутность достигает только 0, 6 ед. ОП после 2 дней инкубации.
Зато существуют очень значительные различия в отношении аккумуляции нитрита в зависимости от времени.
На самом деле, штаммы 2500, 2408, Р20, 2501, 2410 TL207 и TL221 аккумулируют относительно небольшое количество нитрита, причем максимальное количество (0,1 мкг NO2-/мл) было достигнуто соответственно после 36, 12, 36, 12, 12, 24 и 24 ч инкубации.
И наоборот, наибольшее накопление нитрита было получено со штаммами Р23 и TL223, которые аккумулируют до 1,8 мкг NO2-/мл после, соответственно, 36 и 24 ч инкубации.
Следует отметить, что штамм пропионовых бактерий, изученный во втором вышеуказанном тесте (фиг. 3), имеет промежуточное положение относительно максимальной аккумуляции NO2-, которая составляет приблизительно 0,5 мкг/мл.
Эти тесты позволили установить, что существуют значительные различия между количествами нитрита, которые могут продуцировать разные штаммы пропионовых бактерий четырех разных видов; причем эти различия не зависят от роста данных штаммов.
Вышеуказанные результаты были подтверждены путем изучения для каждого штамма увеличения концентрации нитрита в культуральной среде в зависимости от ее мутности, и, следовательно, приблизительно от роста бактерий.
Результаты этих последних тестов отражены на фиг. 5, где каждая величина соответствует средней величине ± стандартное отклонение от средней величины при н = 3.
Целью вышеуказанных тестов было установить, что среди изученных штаммов штамм TL223 является наиболее мощным накопителем нитритов, причем эти нитриты исчезают через 12 ч. Этот штамм был оставлен для дополнительных исследований, касающихся прямого измерения продукции монооксида азота путем масс-спектрометрического анализа в анаэробной среде.
4.
Предварительное измерение продукции NO штаммом TL223 в атмосфере гелия
Согласно тестам культуры были получены в пробирках емкостью 10 мл, содержащих 5 мл среды YEL, в которой присутствует
приблизительно 50 мкМ нитрата, и 0,25 мл свежей культуры штамма TL223.
Атмосфера пробирок была сразу удалена струей гелия (100 мл/мин) в течение 100 с.
Аккумуляция NO в
атмосфере пробирок измерялась по ходу времени в следующих условиях:
- инкубация при 30oС в течение 24, 48 или 72 ч,
- 4 повтора,
- измерение аккумуляции NO путем
масс-спектрометрического анализа,
- оценка брожения каждой культуры путем измерения коэффициента поглощения при длине волны = 650 нм.
При предварительном тесте система очистки газа (Roboprep G+) - масс-спектрометр (Twenty - Twenty) была выверена с помощью увеличивающихся количеств монооксида азота.
Этот газ был генерирован из NaNO2 в присутствии раствора KI и H2SO4.
Идентификация и количественная оценка монооксида азота осуществлялась через его массу: 30 для14N16O и 31 для15N16O и14N17O. Эта идентификация была подтверждена измерением изотопного соотношения: 31/30=[15N16O+14N17O] /14N16O. Следует отметить, что теоретическое изотопное соотношение 31/30 NO равно 0,00367 при отсутствии изотопа17О.
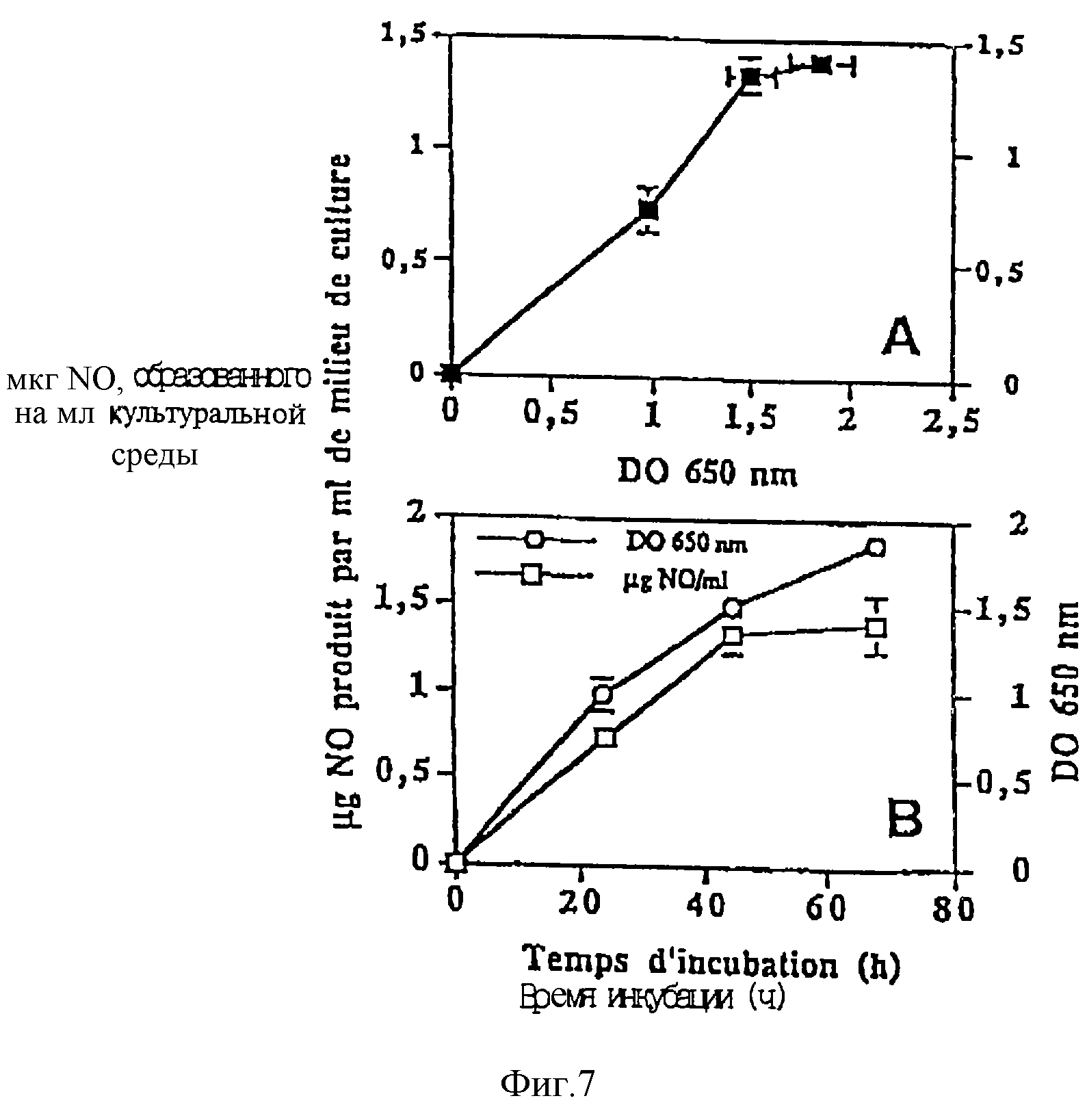
Результаты этого предварительного теста показаны на фиг. 6, на которой левая часть (А) соответствует эталонированной кривой масс-спектрометра, используемого для определения количества монооксида азота, в то время как правая часть (В) соответствует измерению изотопного соотношения 31/30.
Результаты по существу этого теста отражены на фиг. 7.
Точнее, фиг. 7А представляет изменение аккумуляции NO в атмосфере пробирок в зависимости от мутности среды, в то время как фиг. 7В представляет изменение этой аккумуляции в зависимости от времени инкубации.
Вертикальные или горизонтальные линии, если они шире, чем условное обозначение, показывают стандартное отклонение от средней величины при н = 4.
Сравнение фиг. 7В (которая представляет эволюцию мутности культуральной среды в атмосфере гелия на протяжении времени) с фиг. 4 (которая представляет эту же эволюцию в атмосфере воздуха) показывает, что рост штамма TL223 существенно не меняется в атмосфере, состоящей из гелия.
Также удалось установить, что скорость аккумуляции монооксида азота в атмосфере постоянна в течение приблизительно первых 45 ч инкубации, затем снижается (фиг. 7В), что соответствует мутности, близкой к 1,5 ед. ОП (фиг. 7А).
После приблизительно 65 ч инкубации в атмосфере гелия (мутность выше 1,7 ед. ОП), было аккумулировано приблизительно 1,5 мкг NO на 1 мл культуральной среды.
Порядок полученной величины сравним с содержаниями нитрита, измеренными в среде для культур, контактирующих с воздухом.
В этом последнем случае было показано (фиг. 5), что штамм TL223 накапливает до 1,8 мкг NО2-/мл при мутности 1,5 ед. ОП, что соответствует приблизительно 1,2 мкг NО/мл.
Основываясь на этом предварительном прямом измерении продукции NO, штаммом TL223, стремились, согласно изобретению, подтвердить путь синтеза этого монооксида азота и пришли к мысли исследовать, не стимулируется ли продукция монооксида азота добавлением нитрита или нитрата.
Такая стимуляция была подтверждена благодаря описанным ниже тестам.
5. Изучение стимуляции
продукции NO добавлением нитрита или нитрата
Чтобы определить, возможно ли образование NO с помощью пропионовых бактерий из NO2- или NО3-, проверяли, увеличивается ли продукция NO штаммом TL223 в присутствии 1 мM KNO2 или KNO3 (с и без метки изотопом15N).
Исследование проводилось
в следующих условиях:
- штамм TL223 был высеян в количестве 1% в чистую среду YEL (контрольная), или с добавлением 1 мМ KNO2, КNО3 или К15NО3 с
508-й меткой изотопом15N,
- инкубация при 30oС в течение 24, 48 и 72 ч,
- 3 повтора для каждого образца и каждого вида обработки,
- аккумуляция NO и
определение изотопного соотношения с помощью масс-спектрометрии,
- оценка брожения каждой культуры (мутности) путем измерения коэффициента поглощения при длине волны = 650 нм,
- дозирование нитрата и нитрита после рекуперации бактерийных сред, центрифугирования и замера с помощью набора Boerhinger.
Исследовали также аккумуляцию NO в зависимости от концентрации NO3- (100, 150, 350, 650 и 1050 мкМ) или NO2- (50, 100, 400, 800, 1000 мкМ) после инкубации в течение 72 ч при 30oС (штамм TL223, высеянный в количестве 1% в среду YEL).
Исследуемые образцы были помещены в пробирки для анализа NO, атмосфера которых была сразу удалена струей гелия в течение 150 с с целью получить строго анаэробные условия.
Эффект, оказываемый гелиевой струей на возможное определение NO с помощью масс-спектрометра, было изучено на стерильной среде YEL: эта среда YEL, предварительно промытая гелием, была инкубирована при 30oС в течение 72 ч. После 0, 24, 48 и 72 ч инкубации (3 повтора) не обнаружили никакого образования NO, а величины мутности остались равными нулю.
Таким образом были подтверждены качество обработки гелием, отсутствие бактерий и отсутствие влияния обработки гелием на замер NO путем масс-спектрометрии.
Вышеуказанные тесты позволили получить результаты, приведенные на фиг. 8, относящиеся к кинетике аккумуляции NO в присутствии нитрита или нитрата.
Более точно:
- фиг. 8А представляет изменения аккумуляции NO в зависимости от времени,
- фиг. 8В представляет изменения мутности в зависимости от времени,
- фиг. 8С представляет изменения
изотопного соотношения [масса 31/(массы 30 + 31)] в зависимости от времени,
- фиг. 8D представляет изменения продукции NO в зависимости от мутности.
Каждая из этих фигур касается штамма TL223, культивированного в чистой среде YEL, в этой среде, но в присутствии 1 мМ нитрата (15NO3- с 50%-ной меткой и14NO3-) и в присутствии 1 мМ нитрита.
Вертикальные линии представляют ± стандартное отклонение от средней величины при н = 3, если они больше, чем условное обозначение.
Эти фигуры доказывают, что аккумуляция NO штаммом TL223, культивированным на 1 мМ КNO3 (меченого азотом 15 или не меченого) или на 1 мМ KNO2 составляет приблизительно 7 мкг NO/мл после 48 ч инкубации при 30oС; эта величина в 3,5 раза больше продукции NO в случае среды YEL, недополненной нитратом или нитритом (фиг. 8А). Эти различия не являются следствием изменений роста, связанных с составом среды, так как мутность в конце роста на среде YEL равна 4,5 ед. ОП после 72 ч и на той же среде, но с добавлением нитрата или нитрита равна приблизительно 5 ед. ОП после 72 ч (фиг. 8В и 8), т.е. мутность на обеих средах является величиной одного и того же порядка.
Фиг. 8С показывает, что добавление K15NO3 меченого на 50% позволяет получить NO меченого на приблизительно 40% после 48 ч инкубации: азот с массой 15, добавленный в форме нитрата, находится таким образом в NO, синтезированном штаммом TL223.
Кроме того, заметили, что если штамм TL223 культивирован на K15NO3, профиль пика массы 31 (15N16O) очень сильно увеличивается по отношению к NO, исследуемому на среде YEL, содержащей немеченый нитрат, что позволяет подтвердить эту ситуацию.
К тому же, добавления 1 мМ немеченого KNO3 или KNO2 приводит к образованию NO с изотопным соотношением, равным 0,75% (48 ч инкубации - фиг. 8С), что очень близко к величинам природного изотопного соотношения NO (приблизительно 0,4%).
Эти последние наблюдения подтверждают, что газом, анализируемым масс-спектрометрией, действительно является NO.
Этим тестом таким образом позволили констатировать, что штамм TL223 способен синтезировать NO непосредственно из нитрита или в присутствии нитрата после восстановления его до нитрита.
На основе величин изотопного соотношения, полученных на среде YEL, дополненной 1 мМ К15NО3 с 50%-ной меткой, можно вычислить процент конверсии нитрата в нитрит: так, приблизительно, 20% добавленного К15NО3 трансформируется в монооксид азота штаммом TL223.
Нитрат, изначально присутствующий в стерильной среде YEL, объясняет наблюдаемую продукцию NO штаммом TL223 (порядка 2 мкг NО/мл после 72 ч инкубации - фиг. 7).
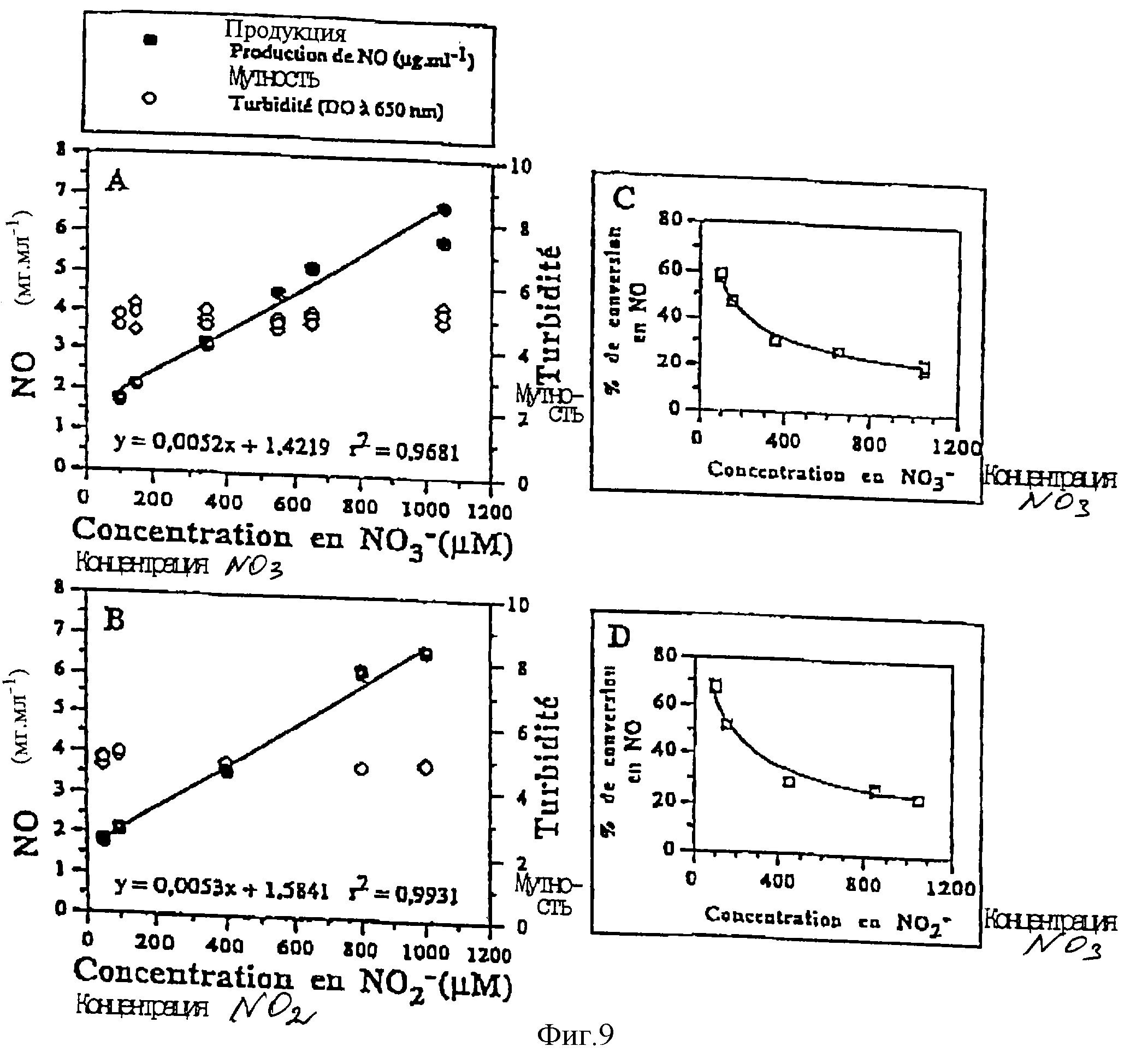
Изменения продукции NO в зависимости от концентрации нитрита или нитрата представлены на фиг.9. Более точно:
- фиг. 9А представляет изменения продукции NO и эволюцию мутности в зависимости от начальной концентрации нитрата, у штамма TL223, культивированного на среде YEL после 72 ч инкубации,
- фиг.
9В представляет колебания продукции NO и эволюцию мутности в зависимости от начальной концентрации нитрита, у штамма TL223, культивированного на среде YEL после 72 ч инкубации,
- фиг. 9С
представляет изменения процента конверсии нитрата в NO, в зависимости от начальной концентрации нитрата,
- фиг. 9D представляет изменения процента конверсии нитрита в NO, в зависимости от
начальной концентрации нитрита.
На этих фигурах концентрация нитрата корректировалась с учетом присутствия приблизительно 50 мкМ нитрата в среде YEL без добавок, они таковы: 100, 150, 350, 550, 650 и 1050 мкМ.
Концентрации нитрита следующие: 50, 100, 400, 800 и 1000 мкМ.
Эти фигуры показывают, что для выбранных гамм образование монооксида азота с помощью штамма TL223 пропорционально начальной концентрации нитрата (фиг. 9А) или нитрита (фиг. 9В) в среде YEL. Это линейная зависимость.
В обоих случаях не наблюдалось никакой фазы плато. Это заставляет предположить, что используемые концентрации нитрита или нитрата не позволяют получить максимальный уровень аккумуляции NO пропионовой бактерией TL223.
Также нужно заметить, что присутствие больших концентраций нитрата или нитрита не влияет на рост бактерий, так как величины мутности за 72 ч очень близки для всех исследованных концентраций.
К тому же нужно подчеркнуть, что прямые, полученные на фиг. 9А и 9В, совпадают. Это позволяет доказать, что образованный NO происходит непосредственно из нитрита или нитрата через восстановление последнего до нитрата.
Эти результаты показывают также, что у штамма TL223 этап восстановления нитрата до нитрита не ограничивается концентрациями нитрата, использованных в этом эксперименте.
Также важно подчеркнуть, что показатели конверсии NO3- (фиг. 9С) и NO2- (фиг. 9) эволюционируют в зависимости от количества имеющегося субстрата, переходя от 20 к 60%, когда концентрация NО3- или NO2- меняется от 1000 до 100 мкМ.
Это наводит на мысль, что продукция NO в значительной степени регулируемо и что оно приоритетно по отношению к использованию нитратного азота для синтезов азотных соединений.
На основании вышеуказанных заключений исследовали продукцию NO у 12 штаммов пропионовых бактерий двух разных видов. Результаты этих тестов указаны ниже.
6. Исследование продукции NO у разных
пропионовых штаммов
Согласно этому тесту были изучены следующие штаммы пропионовых бактерий:
Р. freudenreichii: LS410, LS2501, LS2502, ITG 23, CNRZ89, CNRZ277, CNRZ87.
Р. acidipropionici: TL223, NCDО1072, PR75, CNRZ80, CNRZ86, CNRZ87.
Нужно заметить, что штаммы CNRZ80, CNRZ81, CNRZ86, CNRZ89, CNRZ277 и CNRZ287 принадлежат общественной коллекции INRA-CNRZ, в то время как штамм NCDО1072 принадлежит британской National Collection of Dairy Organisms; другие штаммы принадлежат частным коллекциям.
Сразу после высеивания на среду YEL в присутствии 550 мкМ нитрата бактерийные культуры распределили по 5 мл в герметичные и обработанные гелием пробирки (анаэробные условия).
Затем пропионовые штаммы
подверглись следующим экспериментальным условиям:
- инкубация при 30oС в течение 24, 48 и 72 ч,
- 3 повтора,
- накопление NO в атмосфере и определение изотопного
соотношения масс-спектрометрией,
- оценка брожения каждой культуры путем измерения коэффициента поглощения при длине волны, равной 650 нм,
- дозирование нитрата и нитрита после
рекуперации бактерийных сред, центрифугирования и измерения набором
Boerhinger.
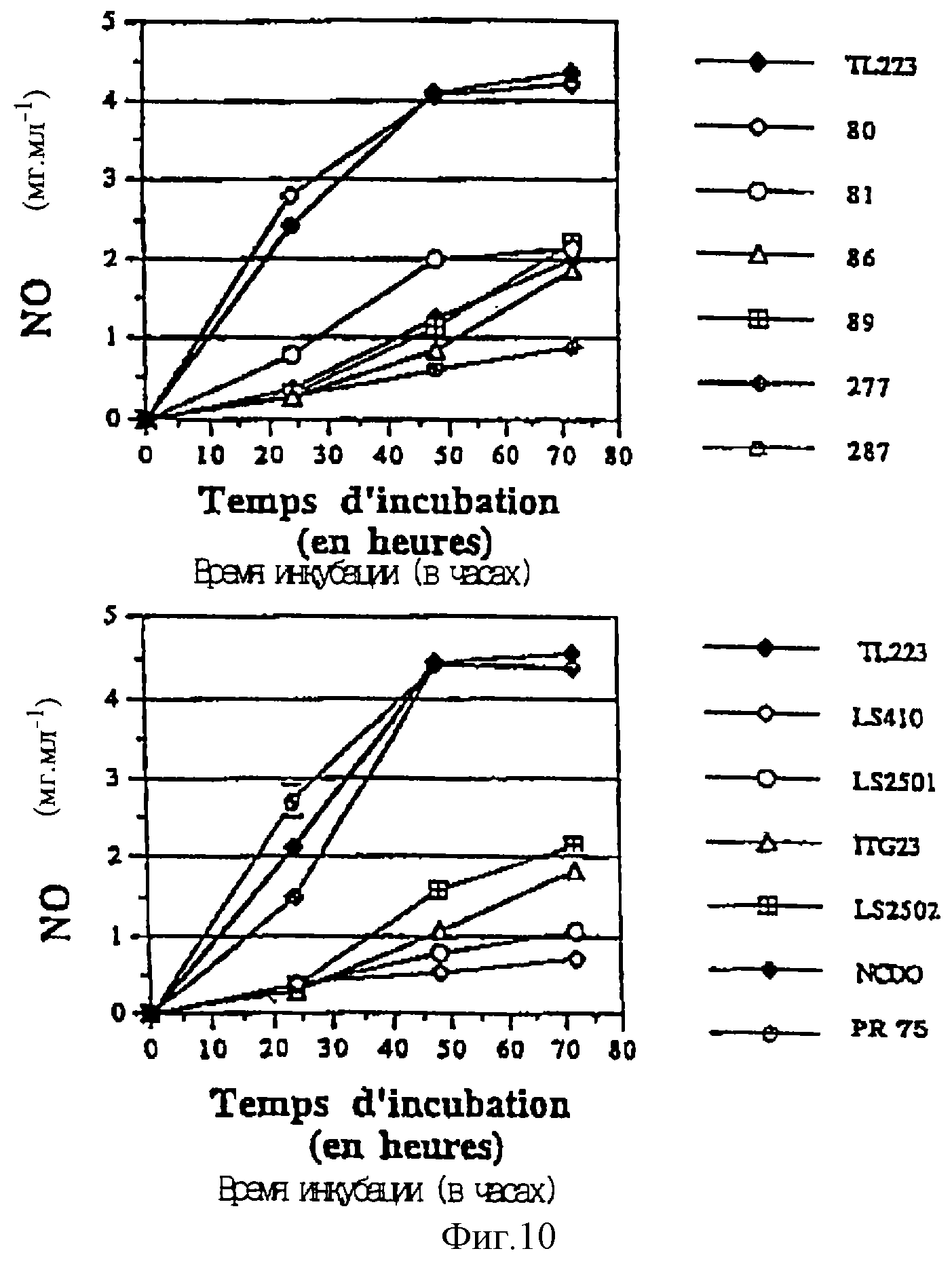
Фиг. 10 представляет изменения накопления NO в зависимости от времени у штамма TL223 и 12 других штаммов пропионовых бактерий, культивированных на среде YEL в присутствии 550 мкМ нитрата. Штамм TL223 был представлен в каждом случае для сравнения.
Вертикальные линии означают ± стандартное отклонение от средней величины при н = 3, когда они больше условного обозначения.
Фиг. 10 показывает, что существуют значительные различия между пропионовыми штаммами.
Сравнивая уровни продукции NO после 72 ч инкубации, можно классифицировать штаммы по трем категориям:
- штаммы, способные продуцировать от 4 до 4,5 мкг NO/мл: TL223;
CNRZ80, NCDО1072 и PR75. Изотопное соотношение NO, синтезированного этими штаммами, равно 2-2,5% (Т=72 ч),
- штаммы, способные продуцировать приблизительно 2 мкг NO/мл: CNRZ81, CNRZ86,
CNRZ89, CNRZ277, LS2502, ITG23. Изотопное соотношение NO, синтезированного этими штаммами, равно 4-5,5% (Т-72 ч),
- штаммы, продуцирующие менее 1 мкг NO/мл: LS410, LS 2501 и CNRZ287. Несмотря
на присутствие в питательной среде 550 мкМ нитрата, эти штаммы продуцировали очень малые количества NO, и изотопное соотношение было порядка 10-13% (Т= 72 ч). Эти величины наводят на мысль, что
массовые пики 30 и 31, определенные у этих бактерий, могут не соответствовать монооксиду азота.
Следует отметить, что у штаммов, относящихся к двум первым категориям, количество синтезированного NO не уменьшается в конце роста, и кажется, что он не используется повторно пропионовыми бактериями: следовательно, имеет место аккумуляция NO.
Фиг. 11 представляет изменение продукции NO в зависимости от мутности у 13 вышеуказанных штаммов пропионовых бактерий, культивированных на среде YEL в присутствии 550 мкМ нитрата. Штамм TL223 был представлен в каждом случае для сравнения.
Вертикальные линии представляют стандартное отклонение от средней величины при н = 3, когда они больше, чем символ.
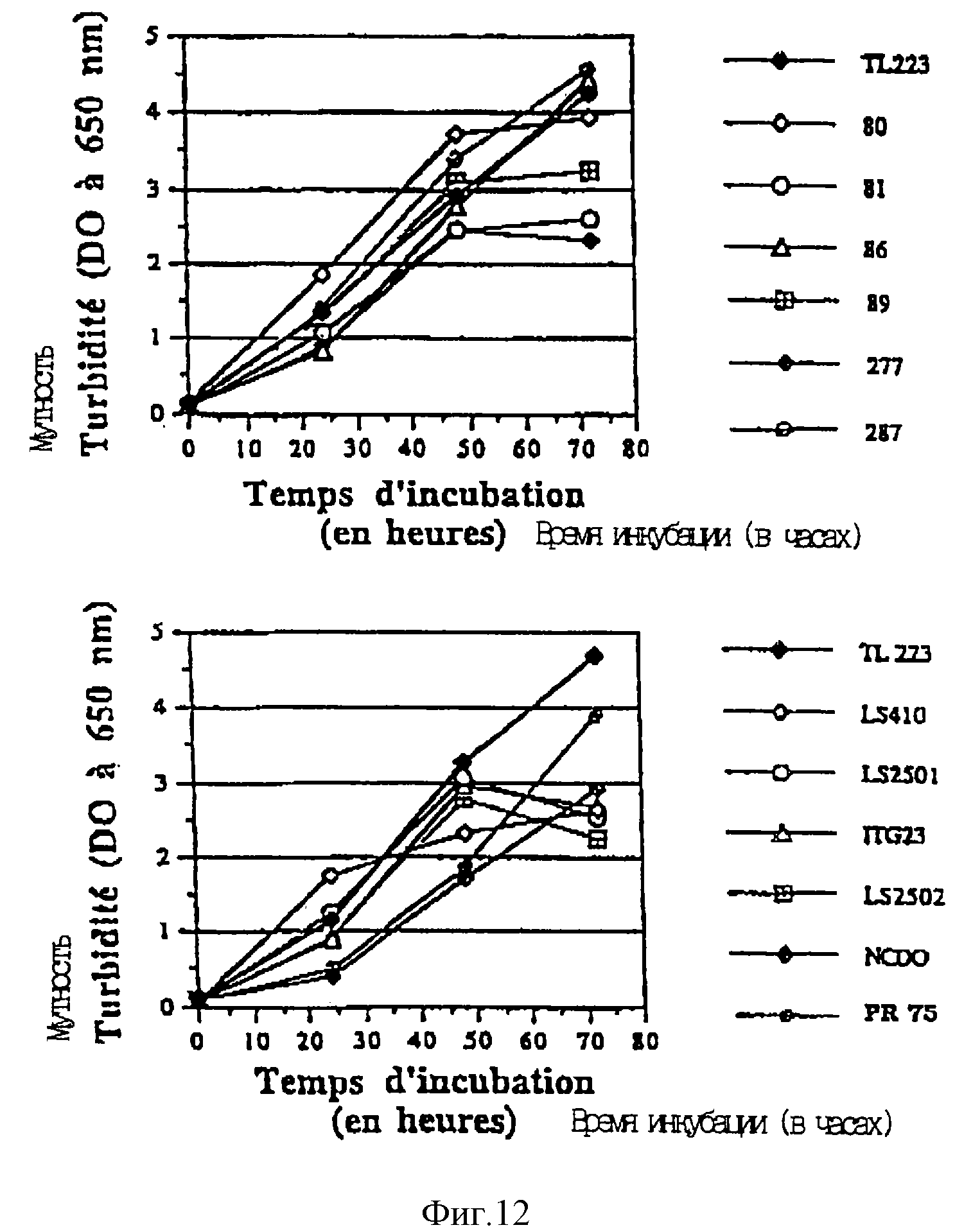
Фиг. 12 показывает изменение мутности (ОП при 650 нм) в зависимости от времени для 13 исследованных штаммов пропионовых бактерий, культивируемых на среде YEL в присутствии 550 мкМ нитрата. Штамм TL223 представлен в каждом случае для сравнения.
Вертикальные линии отображают стандартное отклонение от среднего значения при н = 3, когда они больше условного знака.
Штаммы с наибольшим образованием NO (TL223, CNRZ80, NDCО1072 и PR75) все достигают высоких величин мутности (4-5 ед. ПО после 72 ч инкубации).
Следует отметить, что бактерии NCDО1072 и PR75 растут медленнее, чем TL223, но способны очень быстро аккумулировать большие концентрации NO.
Так, PR75 образует 2,8 мкг NO/мл при мутности в 0,5 ед. ОП. Максимальная продукция NO зарегистрирована при величинах мутности, равных приблизительно 1,5 ед. ОП у штамма NCDО1072 и у штамма PR75, у штамма же TL223 величина мутности равна 3,4 ед. ОП.
Чтобы дополнить эти результаты, проанализировали эволюцию концентраций NO, нитрата и нитрита в культуральных средах 13 изученных штаммов пропионовых бактерий в зависимости от времени инкубации.
Полученные результаты собраны в таблицу, в которой концентрации выражены в мкМ (см. в конце описания). Для каждого штамма замеры были сделаны в пробирке после удаления бактерий путем центрифугирования.
Эта
таблица позволяет сделать следующие выводы:
- штаммы, продуцирующие 4 мкг NO/мл, способны полностью восстанавливать имеющийся нитрат (550 мкМ) после 24 ч инкубации. Кроме того, они могут
полностью восстанавливать нитрит, полученный в течение первых 48 ч инкубации,
- штаммы LS410 и CNRZ287, являющиеся очень слабыми продуцентами NO, не способны абсорбировать в больших
количествах нитрат, присутствующий в среде,
- у штаммов, занимающих промежуточное положение по аккумуляции NO, можно наблюдать большие различия в эволюции содержания нитрата и нитрита,
отражающие очень разные скорости абсорбции NO3- и/или восстановления NO3- и NO2-. Так, штамм CNRZ81 способен
восстановить весь нитрат после 24 ч инкубации. После 48 ч CNRZ81 осуществляет также полное восстановление NO2-, полученного путем восстановления NO3-. И наоборот, штамм CNRZ277 имеет еще 246 мкМ NO3- и 85 мкМ NO2- после 72 ч инкубации.
Описанные выше тесты позволили обнаружить, что некоторые пропионовые штаммы способны восстанавливать нитрат культуральной среды и производить таким образом нитрит, необходимый для синтеза NO.
Следует отметить, что все пропионовые штаммы, которые продуцируют наибольшее количество NO (TL223, CNRZ80, NCDО1072 и PR75), принадлежат к виду Р. acidipropionici и обладают к тому же нитратредуктазной активностью.
И наоборот, штаммы, продуцирующие меньшее количество NO или совсем не продуцирующие (ниже порога чувствительности масс-спектрометра), являются бактериями, которые не обладают известной нитратредуктазной активностью (LS410, LS2501 и CNRZ287).
У некоторых пропионовых штаммов кинетика продукции NO не связана непосредственно с нитратредуктазной активностью.
Учитывая эти результаты, объектом изобретения является также диетическая и медикаментозная композиция для приема внутрь, отличающаяся тем, что она состоит из препарата, содержащего значительное количество, преимущественно больше 109 клеток/г штаммов пропионовых бактерий, выбранных на основании их способности выделять и/или накапливать монооксид азота из расчета по меньшей мере 1 мкг/мл среды YEL, содержащей 550 мкМ нитрата.
Согласно другой характеристике изобретения, эта композиция содержит пропионовые бактерии, принадлежащие, по меньшей мере, одному из штаммов TL223, CNRZ80, CNRZ86 и NCDО1072 вида Р. acidipropionici.
Среди этих штаммов штамм TL223 оказался наиболее предпочтительным.
Следует отметить также, что штамм CNRZ 80 представляет особый интерес с точки зрения "продуктивности", потому что он способен очень быстро аккумулировать значительную концентрацию NO (при относительно небольших величинах мутности).
Согласно другой характеристике изобретения, эта композиция содержит пропионовые бактерии по меньшей мере одного из штаммов ITG23, CNRZ81, CNRZ89, CNRZ277 и LS2502 вида Р. freudenreichii.
Следует отметить, что согласно другой характеристике изобретения композиция может также содержать другие бактерии, такие как бифидобактерии и/или молочнокислые бактерии.
Чтобы дополнить полученные выше результаты, провели тесты с двумя типами непропионовых бактерий: Е. coli и Lactobacillus farciminis, известными своей способностью восстанавливать нитриты.
Результаты этих тестов приведены ниже:
7. Изучение продукции NO штаммами Е. coli и L. farciminis
Эти дополнительные тесты
осуществлялись, в основном, с учетом публикации "Результаты гем-зависимого и гем-независимого нитритного восстановления молочнокислыми бактериями в различных N-содержащих продуктах", Gudrun Wulf, Elke
К. Arendt, Ute Pfdhkerl и Walter P. Hammes - Международный Журнал Пищевой Микробиологии, 10 (1990) 323-330), в которой показано, что некоторые молочнокислые бактерии (L. farciminis) способны
продуцировать монооксид азота из нитрита.
Предварительные опыты показали, что после 5 ч 30 мин роста штамма L. farciminis в среде MRS, дополненной 1 мМ нитрата, в культуральной среде не обнаруживалось больше ни нитрата, ни нитрита.
Та же констатация была сделана в отношении штамма Е. coli после 7 ч 30 мин роста на среде BHI, дополненной 1 мМ нитрата.
Известно, что в ходе своего роста штамм L. farсiminis окисляет среду MRS (после 5-6 ч выращивания рН 5 (приблизительно)).
Однако на основании тестов, проведенных на среде YEL, удалось установить, что нитриты преобразуются в NO в кислой среде.
Эти тесты были проведены в следующих экспериментальных условиях:
- окисление среды YEL с помощью HCl,
- добавление нитрита в концентрации 400 мкМ,
- автоклавирование сред,
- три повтора.
Полученные результаты собраны на фиг. 13, которая представляет изменение продукции NO в зависимости от рН в среде YEL, дополненной нитритами, после 24-часовой инкубации при 37oС.
Фиг. 13 доказывает, что имеет место значительная продукция NO из нитрита среды, когда она кислая, причем его продукция возрастает при снижении рН.
Затем осуществляли сравнительные тесты на продукцию NO штаммом L. farciminis и штаммом Е. coli, который по общему мнению не является продуцентом NO (Brittan T, Blackmore R, Greenwood С & Thomson AJ (1992) - Бактерийные нитрит-восстанавливающие ферменты - Eur. J. Bio. Chem., 209, 793-802).
Эти тесты проводились в следующих условиях:
- инкубация при 37oС на среде BHI (E.coli) или MRS (L. farciminis),
- добавление нитрата
в среду в концентрации 1 мМ,
- удаление атмосферы каждой пробирки гелием в течение 100 с,
- три повтора,
- замер мутности в конце инкубации.
Эти тесты
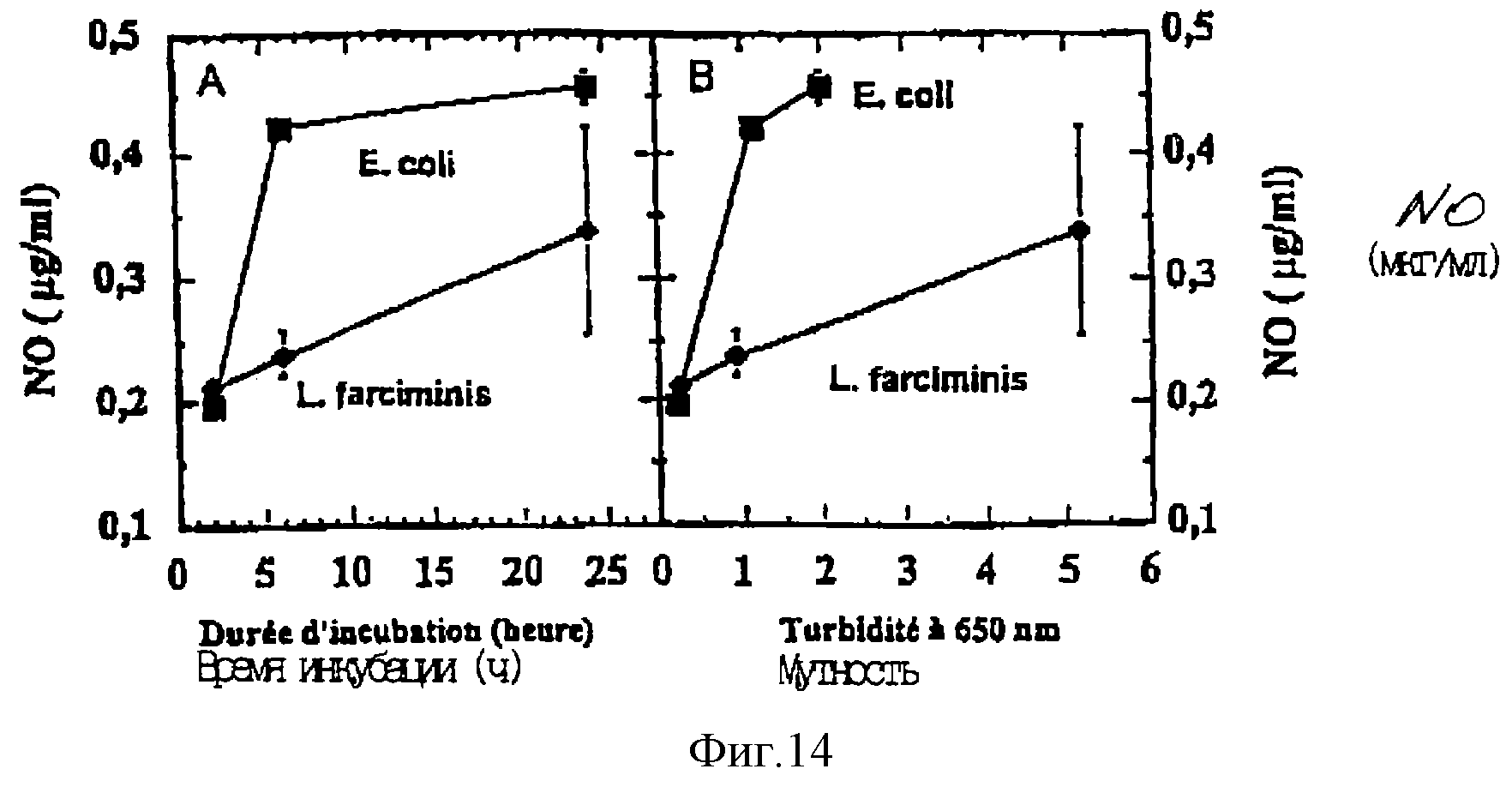
позволили получить результаты, вынесенные на фиг. 14. Более точно:
- фиг. 14А представляет изменения продукции NO в зависимости от времени инкубации,
- фиг. 14В представляет
изменения продукции NO в зависимости от мутности среды.
Следует отметить, что все полученные показатели продукции NO составляют менее 1 мкг/мл, величины, которая рассматривалась выше как показательная: отсюда вытекает, что в пробирках со средой не происходит аккумуляции NO.
Эти результаты показывают, что отсутствие нитрата и нитрита, наблюдаемое в предварительном эксперименте после соответственно 5 ч 30 мин (L. farciminis) и 7 ч 30 мин (E.coli) инкубации, не компенсируется аккумуляцией NO, которая может иметь либо химическое происхождение (связанное с подкислением среды), либо бактерийное происхождение.
Эти результаты были, в случае штамма L. farciminis, подтвержденных тестами, проведенными на бактериях, находящихся в форме
покоящейся клетки, рН которых отрегулирован до 6,5 с помощью фосфатного буфера, содержащего лактат. Тесты проводились в следующих операционных условиях:
- инкубация при 37oС,
- добавление нитрита в концентрации 400 мкМ,
- удаление атмосферы из каждой пробирки гелием в течение 100 с,
- три повтора,
- замер мутности в конце инкубации.
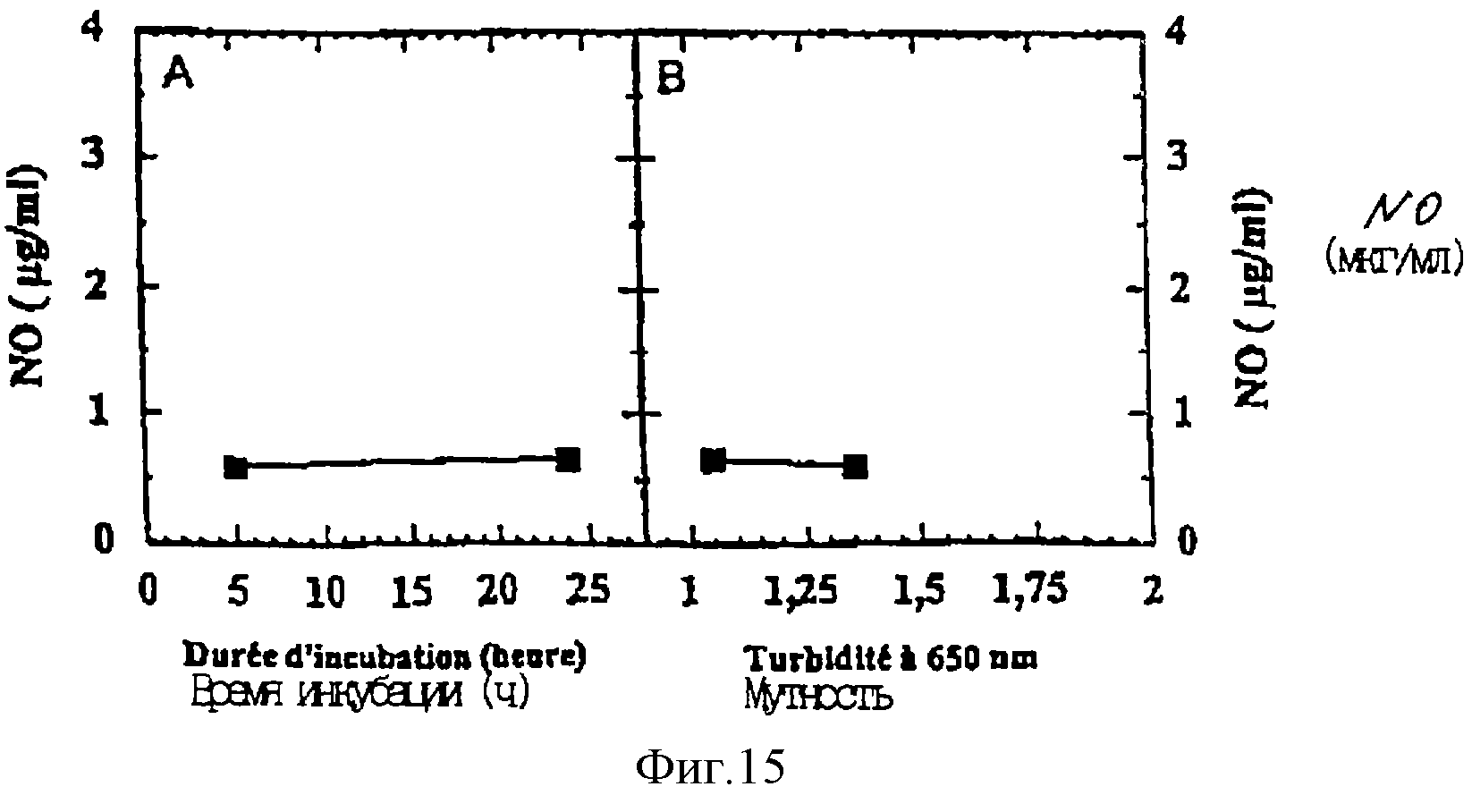
Этот анализ позволил получить результаты, показанные на фиг. 15:
- фиг. 15А представляет изменения продукции NO в зависимости от времени инкубации,
- фиг. 15В представляет
изменения продукции NO в зависимости от мутности среды.
Эти результаты подтверждают результаты, полученные ранее, а именно, что количества образовавшегося NO слишком малы, чтобы быть показательными, и что следовательно штамм L. farciminis не способен аккумулировать монооксид азота. Однако, возможно, что этот штамм продуцирует монооксид азота в начале роста, и что возможно образовавшийся NO повторно используется бактерией.
Дополнительные тесты были проведены на штаммах TL223 и CNRZ80 в форме покоящейся клетки после инкубации при 30oС и при 37oС.
8. Изменение продукции NO пропионовыми бактериями в форме покоящихся клеток
Эксперимент осуществлялся в следующих условиях:
- покоящиеся клетки,
суспендированные в фосфатном буферном растворе, содержащем лактат, рН которого равен 6,5,
- инкубация при 30oС или при 37oС,
- добавление нитрита в концентрации
400 мкМ,
- удаление атмосферы из каждой пробирки гелием в течение 100 с,
- три повтора,
- замер мутности в конце инкубации.
Следует отметить, что во время тестов в случае инкубации при 30oС кроме штаммов TL223 и CNRZ80 исследовали штамм CNRZ81 с удвоенной концентрацией бактерий.
Этот эксперимент позволил получить результаты,
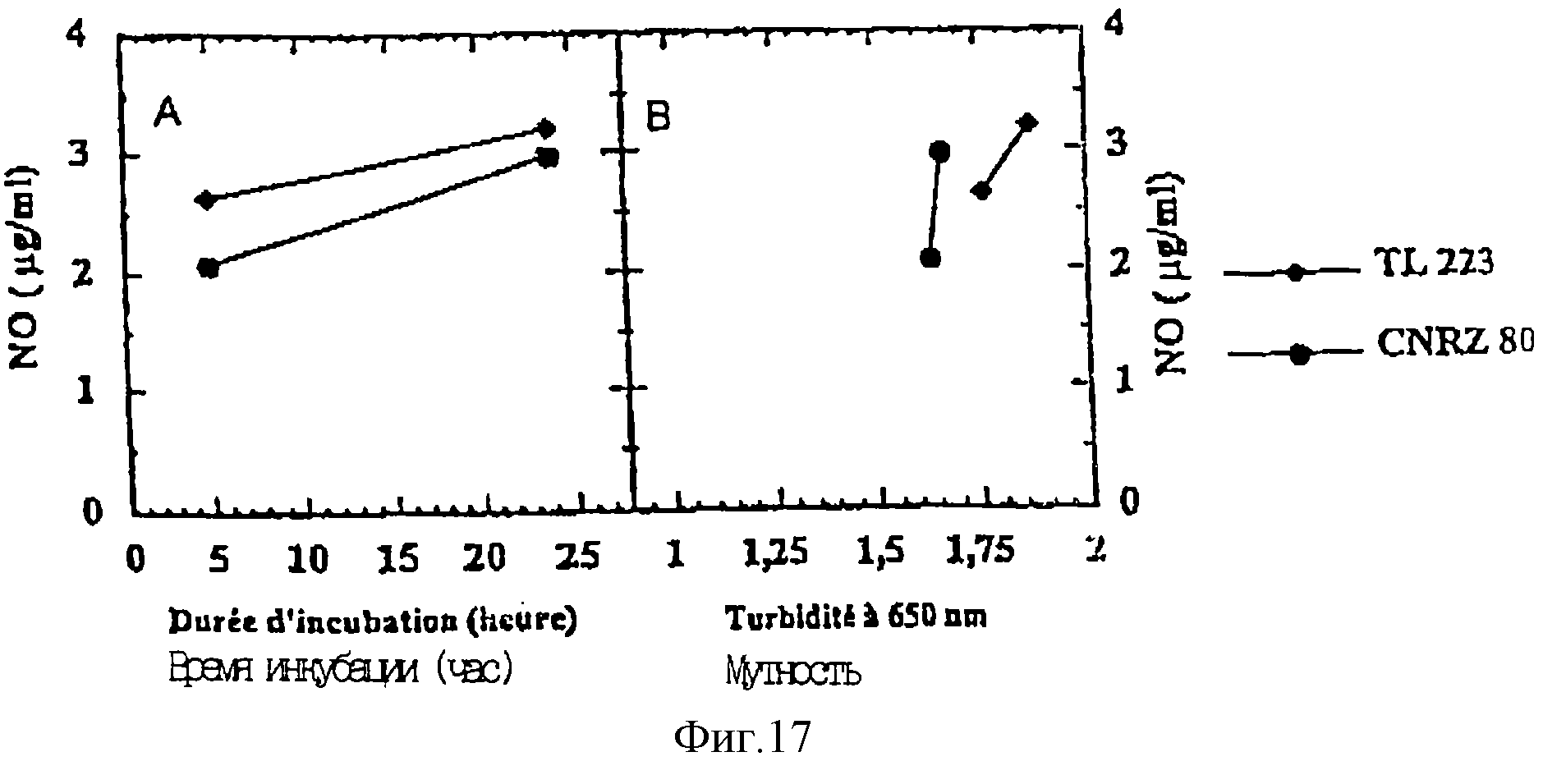
показанные на фиг. 16 и 17. Более точно:
- фиг. 16А представляет изменения продукции NO покоящимися клетками при 30oС в зависимости от времени инкубации,
- фиг. 16В
представляет изменения продукции NO покоящимися клетками при 30oС в зависимости от мутности среды,
- фиг. 17А представляет изменения продукции NO покоящимися клетками при 37oС в зависимости от продолжительности инкубации,
- фиг. 17В представляет изменения продукции NO покоящимися клетками при 37oС в зависимости от мутности среды.
Эти результаты доказывают, что имеет место последовательная продукция NO покоящимися клетками не только в случае двух штаммов вида Р. acidipropionici (TL223 и CNRZ80), но также в случае штамма вида Р. freundenreichii (CNRZ81). Штамм TL223 наиболее продуктивен.
В сущности, при одинаковых концентрациях бактерий, продукция NO покоящимися клетками составляет величину того же порядка, как и в случае бактерий, выращенных на среде YEL.
Продукция NO покоящимися клетками имеет место, в основном, первые 5 ч инкубации; по истечении этого периода продукция снижается.
Так наблюдали, что при 37oС продукция NO протекает идентично (TL223) или немного более активно (CNRZ 80), чем при 30oС.
Преимущества, связанные с введением пропионовых бактерий, были проверены также путем исследований, проведенных in vivo на здоровом человеке.
9. Изучение действия введенных пропионовых бактерий на проводимость
кишечника у здорового человека
Исследование проводили в стационаре на 19 здоровых добровольцах мужского пола.
В начале исследования каждому добровольцу ежедневно вводили 10 рентгеноконтрастных маркеров в течение 8 дней, в соответствии с протоколом, описанным в публикациях Arhan Р, Devroede G, Jehannin В et coll. Dis Colon Rectum 1981; 24:625-9. Et Bouchoucha M, Devroede G. Arhan P et coll. Die Colon Rectum 1992; 35:773-82.
Согласно этому протоколу, изучение проводимости осуществляли путем подсчета рентгеноконтрастных маркеров в разных участках брюшной полости, распределенных на обзорной рентгенографии брюшной полости. Эти участки (ободочная кишка правая, ободочная кишка левая и ректосигмовидная) определены с помощью фиктивных линий, примыкающих к 5-му поясничному позвонку в контуре тазовой полости. Время прохождения подсчитывали по формуле Т = 1/N. n. Δt; N равно 10 маркерам, n означает число маркеров, подсчитанных в одной области, a Δt равно 24 ч.
На 9-й день провели обзорную рентгенографию брюшной полости,
Начиная со следующего дня, т.е. с 10-го дня, каждому добровольцу ежедневно в
течение 2-х недель перорально вводили капсулу, содержащую 5•1010 пропионовых бактерий из банка штаммов, используемых в сыроваренной промышленности, т.е. абсолютно безвредных для
человека.
Второе исследование времени прохождения, подобное первому, осуществляли в течение второй недели, т.е. начиная с 17-го дня по 26-й день.
Исследование выявило значительное замедление прохода через левую ободочную кишку (Р<0,05 согласно статистическому тесту Wilcoxon Matched-Paired Signed-Ranks Test. ); длительности прохода через правую ободочную кишку и ректосигмовидную кишку не претерпели значительных изменений в связи с введением пропионовых бактерий.
Таким образом, это исследование позволило доказать, что введение пропионовых бактерий оказывает влияние на моторику кишечника; можно предположить, что эти результаты связаны с синтезом монооксида азота пропионовыми бактериями.
Реферат
Изобретение относится к биотехнологии, может быть использовано в пищевой промышленности для получения композиций, содержащих пропионовокислые бактерии, способные выделять физиологически значимые количества монооксида азота в пищеварительный тракт человека или животного. Используют штаммы Propionibacterium acidipropionici и/или Propionibacterium freudenreichii, способные высвобождать и аккумулировать в культуральной пробирке по меньшей мере 1 мкг/мл монооксида азота при культивировании в 5 мл среды YEL, содержащей 550 мкмоль/л нитрита, в течение 72 ч при 30oС в атмосфере гелия. Диетическая или медикаментозная композиция содержит препарат из штаммов пропионовокислых бактерий, обозначенных выше. Применение продуцентов монооксида азота - пропионовокислых бактерий - оказывает благоприятное влияние на моторику кишечника. 2 с. и 10 з.п. ф-лы, 17 ил., 1 табл.

Комментарии