Платформа для обнаружения и анализа терапевтических агентов - RU2724998C2
Код документа: RU2724998C2
Чертежи







Описание
ОБЛАСТЬ ТЕХНИКИ
В общем, настоящее изобретение относится к обнаружению агентов (например, небольших молекул, белков или клеток), имеющих применение в медицине, сельском хозяйстве и промышленности, и, в частности, к платформам для скрининга (массового исследования) потенциальных агентов для такого применения.
В настоящее время для проведения высокопроизводительного скрининга с целью обнаружения лекарственных средств применяют множество этапов и платформ для массового исследования крупных библиотек, составленных из небольших молекул, которые позволили бы обнаружить "свидетельства" или "находки", демонстрирующие эффективность и обладающие специфичным действием по отношению к определенной мишени, а также благоприятный профиль токсичности в отношении группы молекулярных мишеней.
При выполнении первого этапа способа, библиотеку небольших молекул подвергают высокопроизводительному массовому исследованию на активность по отношению к заранее заданной мишени. Такие библиотеки обычно содержат порядка сотен тысяч соединений. Доступные в настоящее время высокопроизводительные методики могут быть автоматизированы. В результате развития робототехники и автоматизации с помощью дорогостоящего оборудования могут быть проанализированы 100000 молекул/сутки при использовании объемов вводимых реагентов, которые составляют менее микролитра. Исследования могут быть проведены как в гомогенной, так и гетерогенной среде, причем первый вариант относительно проще и доступнее, а второй вариант отличается большей чувствительностью, но при этом и большей сложностью, продолжительностью и более высокой стоимостью.
Несмотря на то, что первоначальные скрининговые исследования небольших молекул позволяют идентифицировать "находки" или "свидетельства", эти исследования обычно представляют собой всего лишь первый этап. Такие свидетельства или находки обычно дополнительно анализируют на генную токсичность, фармакологическую токсичность, клеточную токсичность и органическую цитотоксичность с помощью исследований профилей воздействия на хорошо известные мишени с целью исключения кандидатов, которые могут оказывать негативное клиническое влияние. Каждое из таких исследований проводят независимо, с применением множества разнообразных платформ и оснащенных исследований, в которых используют независимые потоки операций, которые тщательно подбирают, а также исследуют закономерности в базах данных, для составления выводов о полезности находки или свидетельства.
Методы эволюции белка представляют собой другой тип методик скрининга. Эти методики позволяют обнаруживать огромное количество разнообразных пермутаций. В то время как производительность, скорость и низкая стоимость этих методик делает их выбор привлекательным для быстрой эволюции белка, эти способы часто оказываются сложными и полными "подводных камней". Например, при скрининге эмульсий возникают сложности при слиянии/смешивании капель (при мультиплексном скрининге), сложности при разрушении эмульсий (для выделения интересующих компонентов), проблемы, обусловленные изменениями концентрации из-за изменяющихся размеров капель, и перекрестное загрязнение капель.
Клеточные терапии (терапии на основе клеток) обладают терапевтическими возможностями, которые потенциально превосходят терапии с использованием небольших молекул или белков. Их основные преимущества заключаются в следующем: клетки могут чувствовать внешние сигналы, перемещаться к определенным участкам в организме, интегрировать множество раздражителей и создавать сложное ответное поведение (например, высвобождать специальные эффекторные молекулы). Полному раскрытию потенциала терапевтических средств на клеточной основе будет способствовать точное конструирование терапевтических клеток таким образом, чтобы их "поведение" можно было контролировать в пространстве и времени.
Доступные в настоящее время последовательности рабочих операций клеточной инженерии обычно включают следующие этапы: (i) конструкцию внутриклеточных сигнальных контуров, ответственных за обнаружение, интеграцию и ответ на внешние воздействия; (ii) сложное генное конструирование для введения генов, ответственных за осуществление этих функций в клетке; и (iii) способы скрининга для идентификации из всех клеток, находящихся в библиотеке, клетки, несущие набор генов, которые лучше выполняют требуемую функцию. Сложность требуемого клеточного поведения делает доступные в настоящее время способы скрининга неидеальными. Например: способы сортировки клеток с активацией флуоресценции (англ. fluorescence activated cell sorting, сокращенно FACS) являются высокопроизводительными, но отражают лишь отдельные моменты клеточного поведения. С другой стороны, флуоресцентная микроскопия может подробно отследить динамику клеточного поведения, но обладает низкой производительностью.
Таким образом, имеется необходимость в создании платформ и способов для скрининга небольших молекул, белков, клеток и других агентов с целью обнаружения у них полезных свойств. Настоящее изобретение решает эту задачу и предоставляет другие преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу характеристики потенциальных агентов. Способ может включать следующие этапы (а) предоставление библиотеки потенциальных агентов, где каждый потенциальный агент присоединен к маркеру-нуклеиновой кислоте, содержащей последовательность маркера; (b) приведение библиотеки потенциальных агентов в контакт с твердой подложкой для присоединения потенциальных агентов к твердой подложке, в результате чего на твердой подложке образуется массив потенциальных агентов, включающих индивидуальные элементы, каждый из которых присоединен к индивидуальному потенциальному агенту из библиотеки; (с) приведение массива потенциальных агентов в контакт с агентом для скрининга, при котором один или более из потенциальных агентов массива реагирует с агентом для скрининга; (d) исследование массива во время или после контакта массива с агентом для скрининга для установления того, что по меньшей мере один потенциальный агент, находящийся в массиве, реагирует с агентом для скрининга; (е) секвенирование маркеров-нуклеиновых кислот в массиве для определения последовательности маркера, который присоединен к каждому из потенциальных агентов; и (f) идентификацию по меньшей мере одного потенциального агента в массиве, который реагирует с агентом для скрининга, на основании последовательности маркера, который присоединен к по меньшей мере одному потенциальному агенту.
Кроме того, настоящее изобретение относится к способу получения массива белков. Способ может включать следующие этапы: (а) предоставление библиотеки молекул кДНК (комплементарных ДНК), которые присоединены к твердой подложке; (b) амплификацию молекул кДНК на твердой подложке, приводящую к образованию кластеров, где каждый кластер включает множество копий конкретной молекулы кДНК из библиотеки; (с) транскрипцию множества копий на кластерах с целью получения множества молекул мРНК (матричной РНК), присоединенных к каждому из кластеров; и (d) трансляцию молекул мРНК на кластерах с целью получения множества белков, присоединенных к каждому из кластеров.
Настоящее изобретение также относится к способу получения массива белков, который включает следующие этапы: (а) предоставление библиотеки молекул мРНК, причем находящиеся в библиотеке индивидуальные молекулы мРНК включают целевую последовательность и последовательность маркера; (b) получение из библиотеки первой подбиблиотеки, где первая подбиблиотека включает нуклеиновые кислоты, имеющие последовательности маркера или их комплементы, и нуклеиновые кислоты присоединены к индивидуальным элементам, находящимся на твердой подложке; (с) получение из библиотеки второй подбиблиотеки, где вторая подбиблиотека включает нуклеиновые кислоты, содержащие целевые последовательности и последовательности маркера или их комплементы; (d) приведение второй подбиблиотеки в контакт с первой подбиблиотекой, и присоединение таким образом нуклеиновых кислот из второй подбиблиотеки к твердой подложке посредством гибридизации последовательностей маркера и их комплементов; и (е) трансляцию целевых последовательностей на твердой подложке с целью получения массива белков, присоединенных к индивидуальным элементам.
Настоящее изобретение также относится к способу скрининга клеток. Способ может включать следующие этапы: (а) предоставление множества различных клеток, где каждая из различных клеток включает маркер-нуклеиновую кислоту, содержащую последовательность маркера; (b) приведение смеси различных клеток в контакт с твердой подложкой, приводящий к образованию массива клеток, присоединенных к твердой подложке; (с) скрининг массива клеток на твердой подложке для определения по меньшей мере одной оптической характеристики, причем реакция скрининга включает обнаружение индивидуальных клеток, которые присоединены к твердой подложке; (d) секвенирование последовательностей маркера маркеров-нуклеиновых кислот, которые присоединены к твердой подложке; и (е) идентификацию по меньшей мере одной клетки в массиве как клетки-кандидата на основании оптической характеристики и последовательности маркера клетки-кандидата.
Настоящее изобретение относится к массиву, который включает: (а) твердую подложку; (b) библиотеку из различных молекул кДНК, присоединенных к твердой подложке, где каждая из различных молекул кДНК присоединена к индивидуальному элементу на твердой подложке, и где каждый элемент включает множество копий конкретной молекулы кДНК; (с) молекулы мРНК, присоединенные к молекулам кДНК, где каждая молекула кДНК комплементарна соответствующей присоединенной молекуле мРНК; и (d) молекулы белка, присоединенные к молекулам мРНК, где каждая молекула белка кодируется соответствующей присоединенной молекулой мРНК.
Кроме того, настоящее изобретение относится к массиву, который включает: (а) библиотеку молекул мРНК, причем индивидуальные молекулы мРНК, содержащиеся в библиотеке, включают целевую последовательность и последовательность маркера; (b) твердую подложку, включающую нуклеиновые кислоты, содержащие комплементы последовательностей маркера, где нуклеиновые кислоты присоединены к индивидуальным элементам, находящимся на твердой подложке, где последовательности маркера индивидуальных молекул мРНК гибридизованы с соответствующими комплементарными последовательностями маркера на индивидуальных элементах, находящихся на твердой подложке, и где белки, полученные трансляцией молекул мРНК, присоединены к соответствующим молекулам мРНК.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
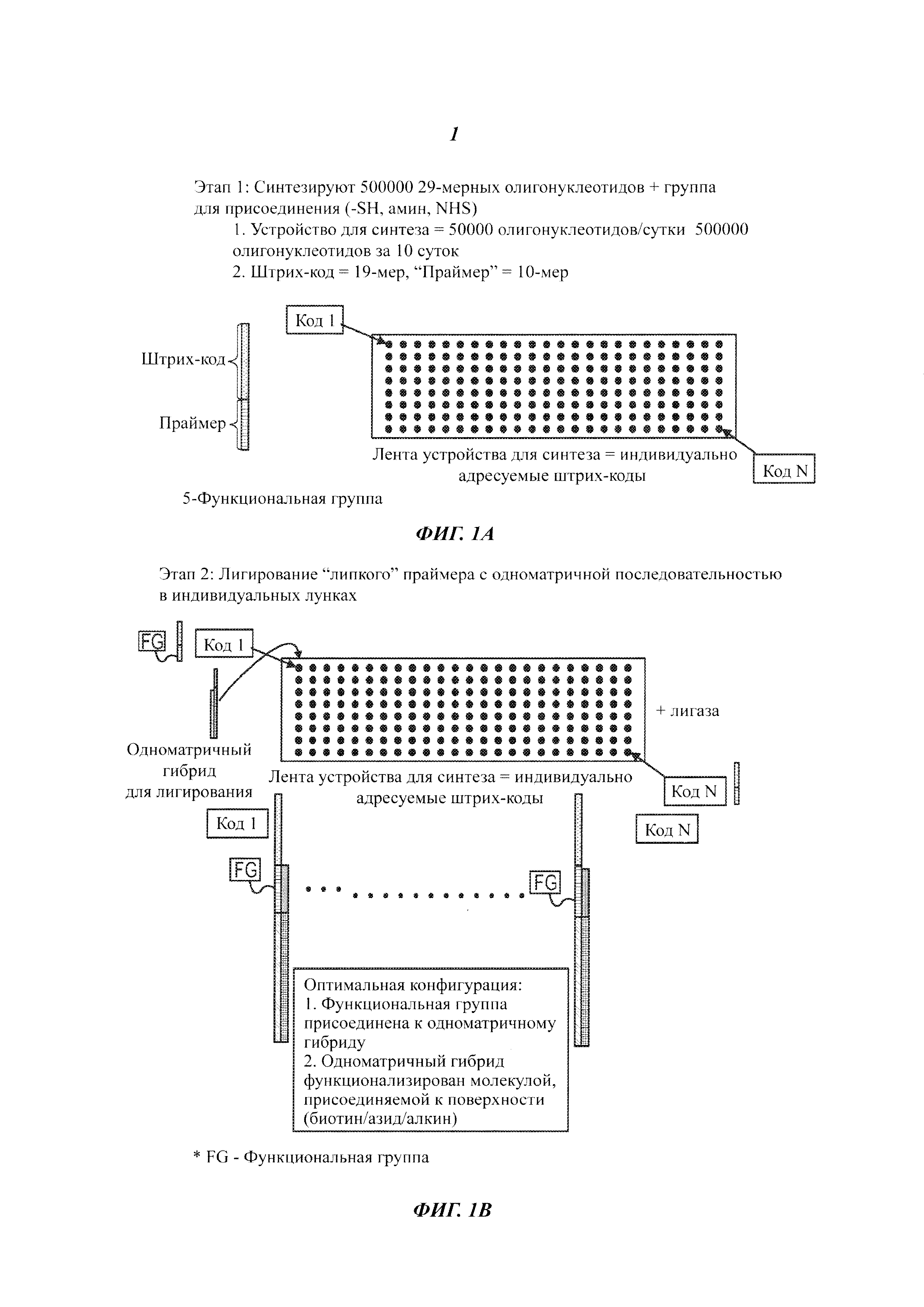
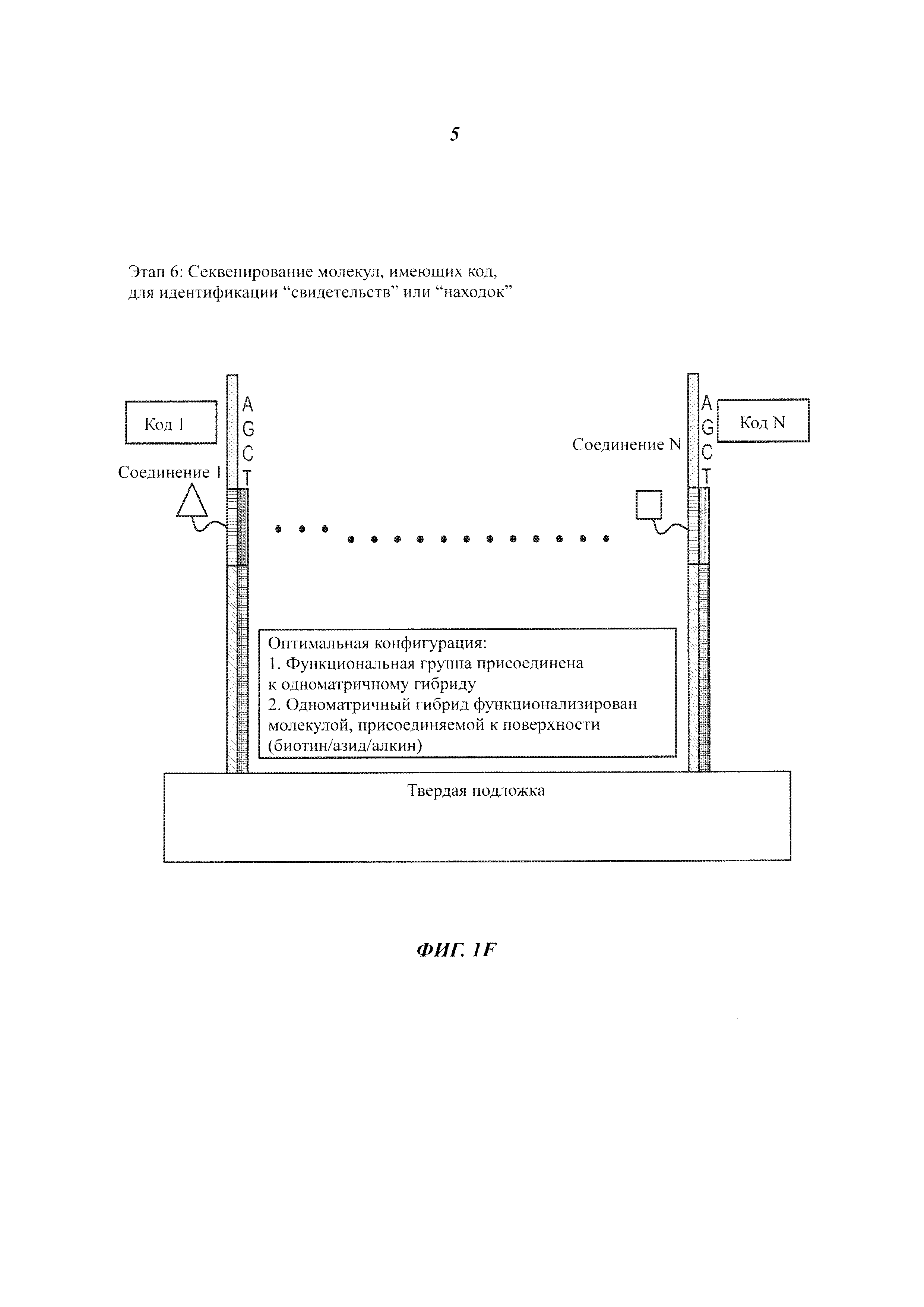
На Фиг. 1A-1F представлены этапы способа высокопроизводительного скрининга потенциальных агентов.
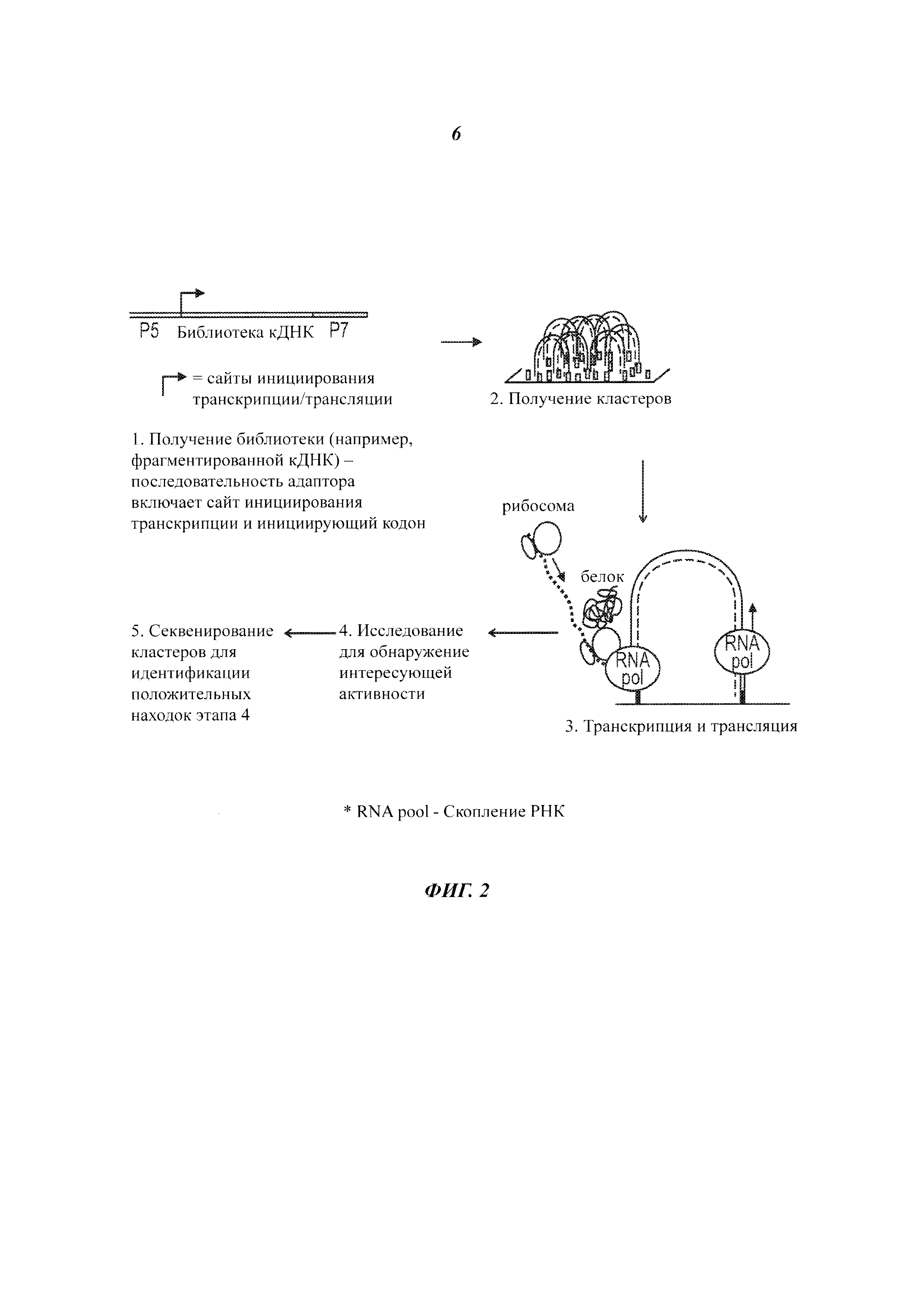
На Фиг. 2 представлен способ высокопроизводительного синтеза и скрининга потенциальных белковых агентов.
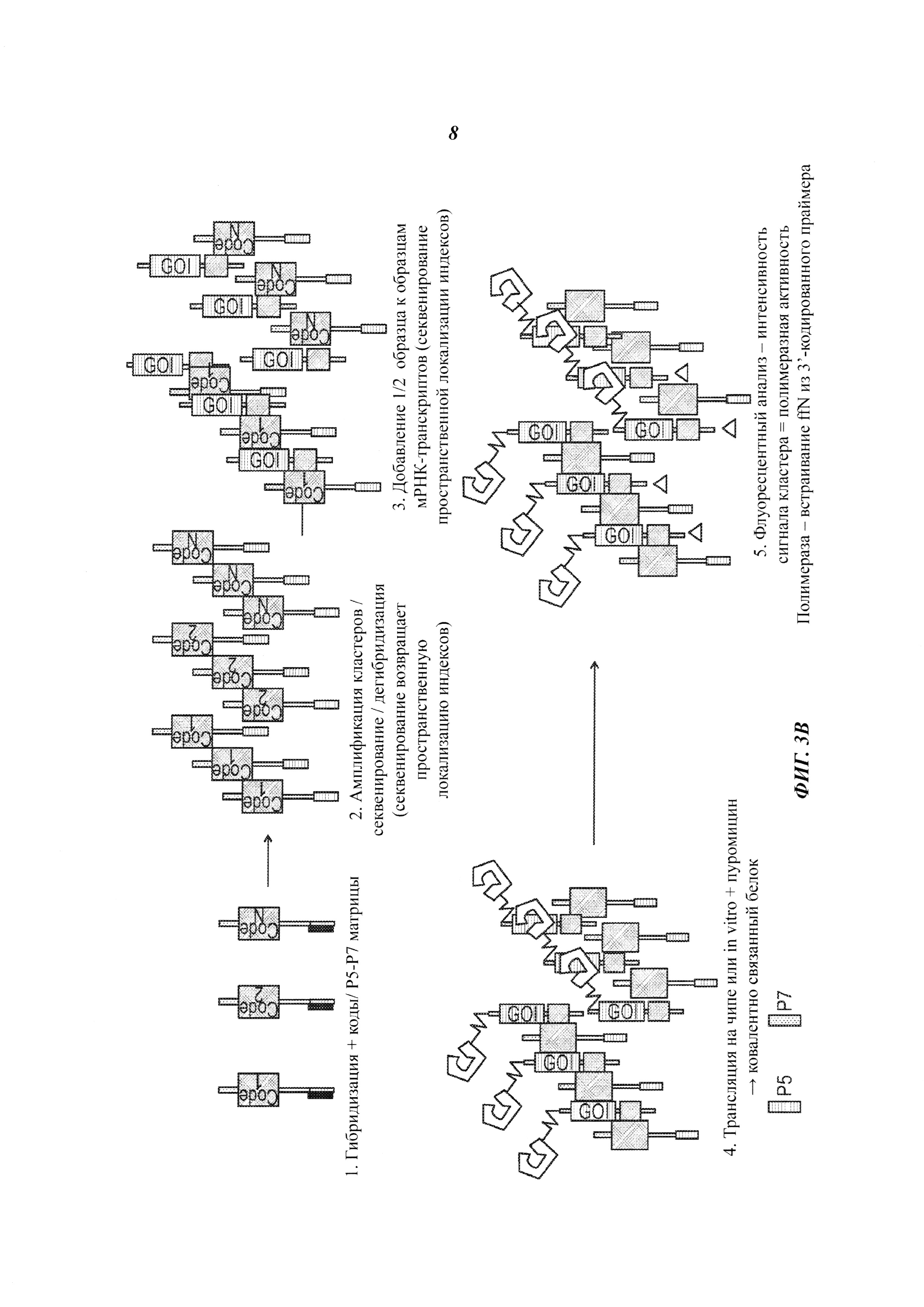
На Фиг. 3А и Фиг. 3В представлен способ высокопроизводительного мечения, синтеза и скрининга потенциальных белковых агентов.
На Фиг. 4 представлено действие агента для скрининга на клетки, которые присоединены к проточной ячейке, и графики зависимости флуоресценции от времени, ожидаемые для откликов различных клеток в ответ на действие агента для скрининга.
На Фиг. 5 представлены клетки, рассортированные по индивидуальным микролункам, которые затем метят специфичными для каждой микролунки маркерами.
На Фиг. 6 представлена расшифровка кода положения клетки на твердой подложке с помощью закодированных гранул.
На Фиг. 7 представлена расшифровка кода положения клетки на твердой подложке с помощью маркеров-нуклеиновых кислот.
На Фиг. 8 представлен перенос маркеров-нуклеиновых кислот из клетки на участок, находящихся на твердой подложке, и секвенирование маркера-нуклеиновой кислоты на твердой подложке.
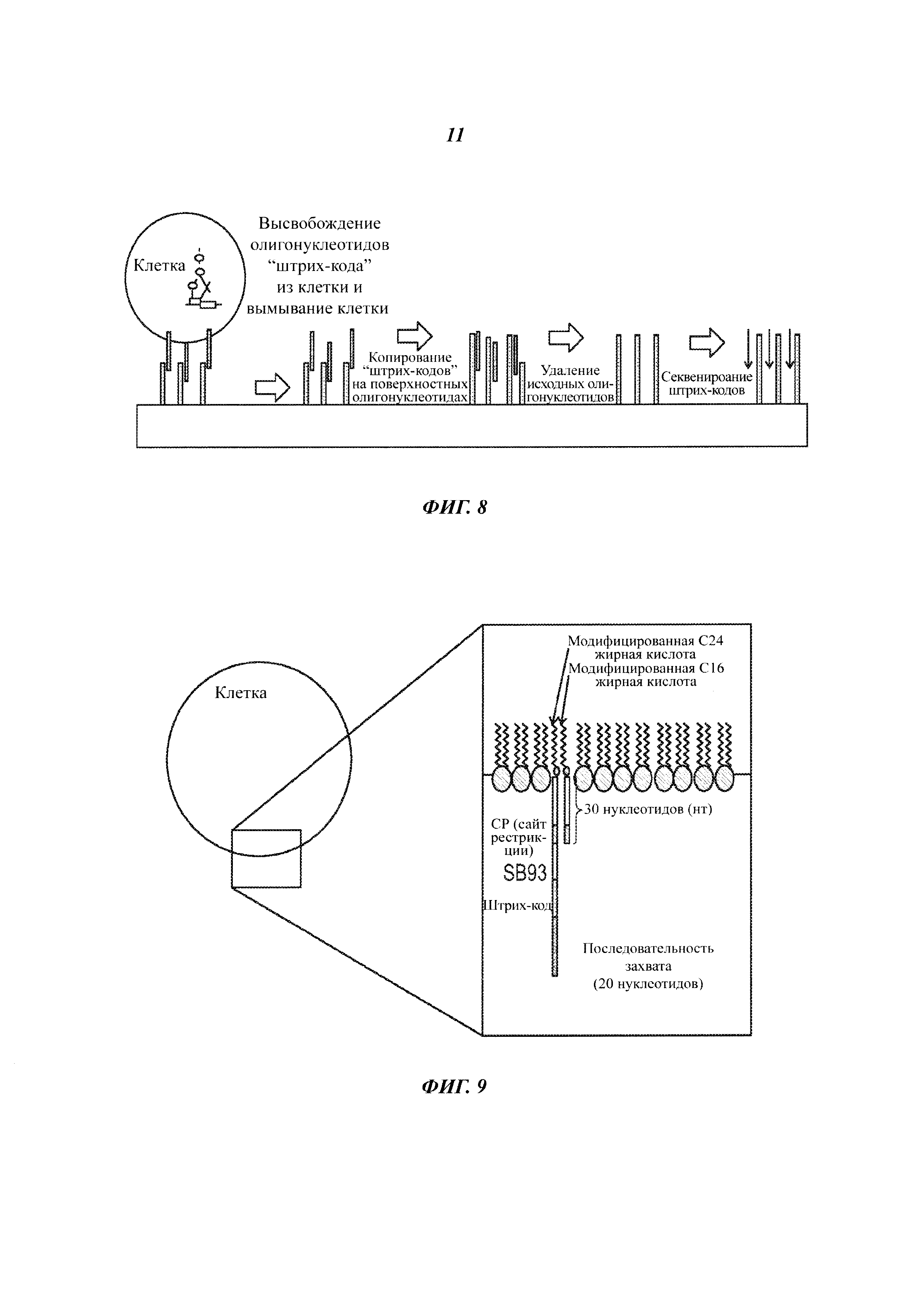
На Фиг. 9 представлены клетки, меченные посредством присоединения пары нуклеиновых кислот к жирным кислотам, находящимся в клеточной мембране.
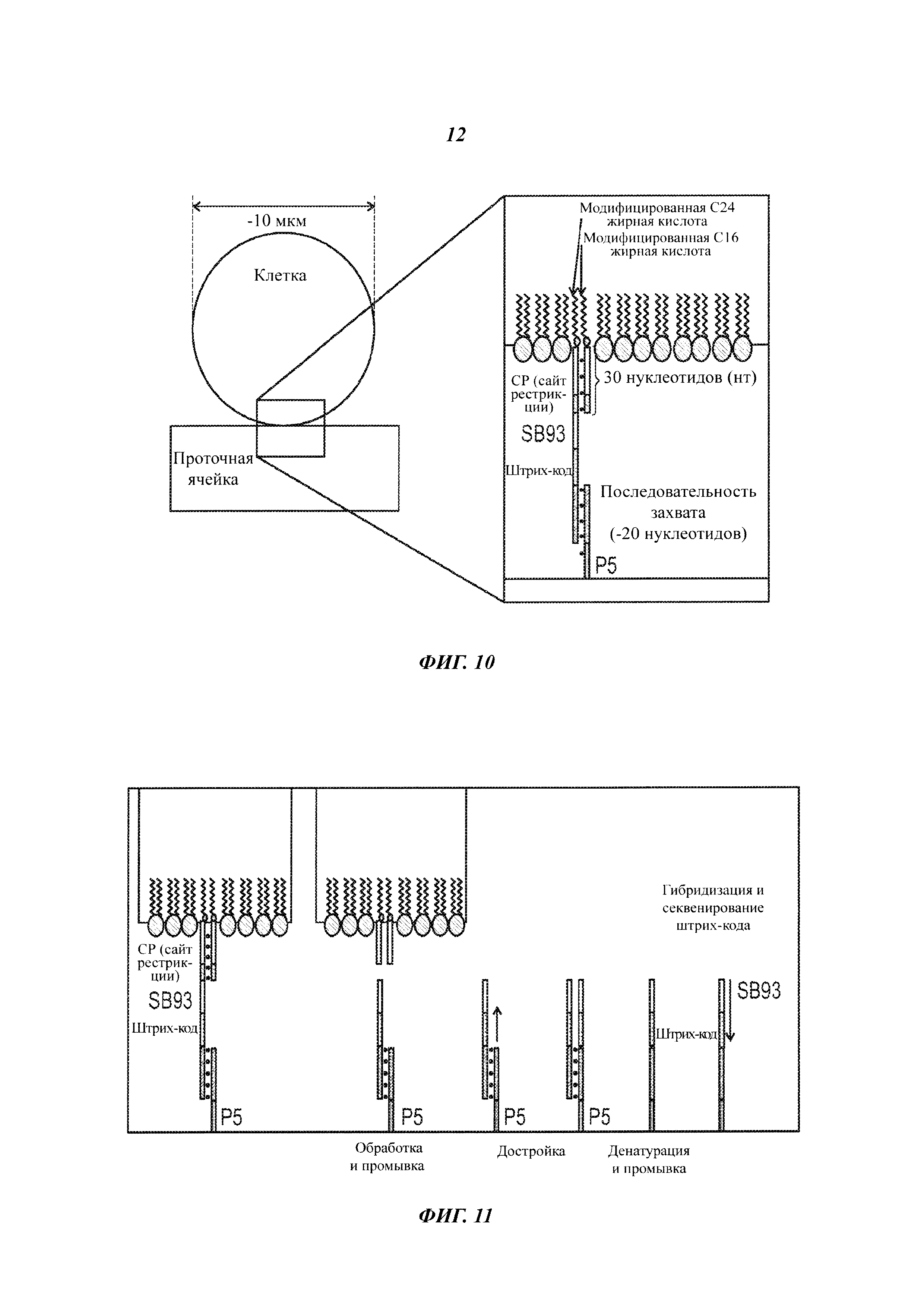
На Фиг. 10 представлен захват клетки, меченной нуклеиновой кислотой, на поверхности проточной ячейки.
На Фиг. 11 представлен отрыв клеток с поверхности проточной ячейки при отщеплении маркера-нуклеиновой кислоты под действием рестрикционной эндонуклеазы.
На Фиг. 12 представлена идентификация клеток на поверхности проточной ячейки на основании локализации декодированных маркеров, находящихся в емкостях, из которых были получены клетки.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к установке и способам высокопроизводительного скрининга потенциальных агентов, таких как кандидаты для терапевтического применения. В частных примерах осуществления, рассмотренных в настоящей работе, с успехом применяют методики и установку для секвенирования нуклеиновых кислот. Преимуществом применения методик и установки секвенирования, рассмотренных в настоящей работе, является возможность упорядоченно располагать в пространстве большое количество различных потенциальных агентов таким образом, что нуклеиновые кислоты, связанные с каждым потенциальным агентом, могут быть распознаны, и таким образом, что ответная реакция каждого потенциального агента на конкретный раздражитель (стимул) может быть индивидуально обнаружена на твердой подложке.
В частных примерах осуществления множество различных потенциальных агентов собирают в библиотеку, в которой каждый потенциальный агент присоединен (или иным образом ассоциирован) с уникальным маркером-нуклеиновой кислотой. Потенциальные агенты могут представлять собой любые из множества объектов, примеры которых включают, без ограничений, нуклеиновые кислоты, белки, клетки и небольшие молекулы. Такие меченые потенциальные агенты могут быть присоединены к твердой подложке таким образом, что индивидуальные члены образуют массив пространственно разделенных потенциальных агентов. Затем массив потенциальных агентов может быть проанализирован посредством воздействия на него агента для скрининга (или другого раздражителя), и на пространственно разделенных участках, находящихся на твердой подложке, могут быть обнаружены реакции потенциального агента. Местонахождение одной или более "находок" может быть идентифицировано на основании пространственно разрешенного обнаружения ожидаемых, требуемых или уникальных сигналов от массива. Для идентификации каждого маркера относительно его местонахождения в массиве, на массиве также может быть проведена реакция секвенирования (либо до, либо после этапа скрининга). Потенциальный агент может быть идентифицирован сопоставлением местонахождения "находки" с идентификационными данными маркера в этой локализации.
Некоторые потенциальные агенты, применяемые в способе или установке, рассмотренных в настоящей работе, представляют собой соединения на основе нуклеиновых кислот, которые включают, например, белки и клетки. В тех примерах осуществления(в которых используют белки, для того, чтобы отличать один белок от другого могут быть определены последовательности молекул ДНК или РНК, кодирующих белки. Кроме того, аминокислотная последовательность индивидуального белка может быть выведена из последовательности РНК на основании известного генетического кода. Однако в некоторых примерах осуществления ни белки, ни нуклеиновые кислоты, кодирующие белки, секвенировать не нужно. Напротив, к каждому белку может быть присоединен (или иным образом связан) маркер, который a priori коррелируется с последовательностью белка. Таким образом, секвенирование маркера может быть достаточным для отличия одного белка от другого. Аналогично, потенциальные агенты на клеточной основе содержат нуклеиновые кислоты, которые могут быть секвенированы для идентификации индивидуальных клеток в популяции. Кроме того, для определения полезных характеристик индивидуальных клеток могут быть проанализированы последовательности нуклеиновых кислот. Также, применение маркеров или a priori созданные маркеры дают возможность определять характеристики клетки без секвенирования других компонентов клетки.
Несмотря на то, что в настоящем описании рассмотрение способов и установки согласно настоящему изобретению посвящено скринингу потенциальных агентов для обнаружения терапевтической функции, следует понимать, что может быть проведен скрининг других функциональных или структурных характеристик. Например, способы и установка могут быть применены для скрининга с целью обнаружения токсичности, возможности применения в сельском хозяйстве (например, в качестве пестицидов, факторов роста, гормонов и т.д.), применения в промышленности (например, в качестве катализаторов, красителей, полимеров и т.д.), для обнаружения питательных качеств (например, в качестве вкусовых добавок, консервантов и т.д.), для очистки окружающей среды или в подобных целях. В общем, способы и установка могут быть применены для скрининга с целью обнаружения биологических или небиологических функций.
Преимущество способов и установки, рассмотренных в настоящей работе, состоит в возможности проводить количественные измерения в процессе высокопроизводительного скрининга. Например, коммерчески доступные платформы секвенирования, такие как платформы, внедренные в коммерческое применение Illumina, Inc. (San Diego, CA), включают точную оптику, имеющую относительно широкий динамический диапазон, предназначенную для количественного определения флуоресцентных сигналов. Дополнительным преимуществом является возможность отслеживать временную динамику реакции скрининга на множестве локальных участков в массиве потенциальных агентов. Напротив, способы флюидной (жидкостной) сортировки, которые применяют во множестве традиционных методик скрининга, предоставляют лишь мгновенную картину пропускаемого потенциального агента, ограничивая измерения одним моментом времени. Способы и установка, рассмотренные в настоящей работе, обеспечивают такую же или более высокую производительность в сравнении с методиками флюидной сортировки, но при этом дают возможность проводить временные определения результатов скрининга. Дополнительным преимуществом установки и способов, рассмотренных в настоящей работе, является возможность обнаружения результатов скрининга и обнаружения маркеров способом, позволяющим отследить пространственную корреляцию между маркерами и результатами скрининга, позволяющую идентифицировать "находки" среди результатов скрининга.
Следует понимать, что, если не указано иное, то термины, используемые в настоящем описании, имеют значение, обычно приписываемое им в соответствующей области техники. Некоторые употребляемые в настоящем описании термины и их значения приведены ниже.
Используемый в настоящем описании термин "ампликон", относящийся к нуклеиновой кислоте, означает продукт копирования нуклеиновой кислоты, причем продукт имеет нуклеотидную последовательность, совпадающую или комплементарную по меньшей мере части нуклеотидной последовательности нуклеиновой кислоты. Ампликон может быть получен любым из множества способов амплификации, в которых в качестве матрицы (образца, англ. template) используют нуклеиновую кислоту или ее ампликон, и которые включают, например, полимеразное удлинение, полимеразную цепную реакцию (ПЦР), амплификацию по типу катящегося кольца (также называемую рамификацией, англ. rolling circle amplification, сокращенно RCA), амплификацию с множественным вытеснением цепи (англ. multiple displacement amplification, сокращенно MDA), удлинение лигированием или цепную реакцию лигирования. Ампликон может представлять собой молекулу нуклеиновой кислоты, содержащую единственную копию определенной нуклеотидной последовательности (например, продукт ПЦР) или множество копий нуклеотидной последовательности (например, конкатамерный продукт RCA). Первый ампликон целевой нуклеиновой кислоты обычно представляет собой комплементарную копию. Последующие ампликоны представляют собой копии, которые создаются после генерации первого ампликона из целевой нуклеиновой кислоты или из ампликона. Последующий ампликон может иметь последовательность, по существу комплементарную целевой нуклеиновой кислоте или по существу идентичную целевой нуклеиновой кислоте.
Используемый в настоящем описании термин "массив" относится к популяции элементов или локальных сайтов (участков), которые могут быть отличены друг от друга по относительному местонахождению. Различные молекулы или другие объекты, находящиеся в различных сайтах массива, можно отличить друг от друга по локализации сайтов в массиве. Индивидуальный сайт массива может включать одну или более молекул (или других объектов) конкретного типа. Например, сайт может включать единственную молекулу нуклеиновой кислоты, содержащую конкретную последовательность, или сайт может включать несколько молекул нуклеиновых кислот, содержащих одинаковую последовательность (и/или комплементарную ей последовательность). Сайтами массива могут быть различные элементы, локализованные на одной подложке (субстрате). Примеры элементов включают, без ограничений, лунки в подложке, гранулы (или другие частицы) в или на подложке, выступы на подложке, выступающие ребра на подложке или каналы в подложке. Сайты массива могут представлять собой отдельные подложки, на каждой из которых находится определенная молекула (или другой объект). Различные объекты, присоединенные к отдельным подложкам, могут быть идентифицированы по местонахождениям подложек на твердой подложке, с которой эти подложки связаны, или по местонахождениям подложек в жидкости или геле. Примеры массивов, в которых отдельные подложки расположены на твердой подложке, включают, без ограничений, подложки, содержащие гранулы в лунках.
Используемый в настоящем описании термин "присоединенный" означает состояние двух предметов, которые объединены, скреплены, склеены, соединены или связаны друг с другом. Например, аналит (т.е. анализируемое вещество), такое как нуклеиновая кислота, может быть присоединен к материалу, такому как гель или твердая подложка, ковалентной или нековалентной связью. Ковалентная связь характеризуется обобществлением пар электронов между атомами. Нековалентная связь представляет собой химическую связь, которая не включает обобществления пар электронов и может включать, например, водородные связи, ионные связи, ван-дер-Ваальсовы силы, гидрофильные взаимодействия и гидрофобные взаимодействия. В некоторых примерах осуществления присоединение может происходить с помощью агента захвата. Агент захвата может включать, например, антитело, рецептор, нуклеиновую кислоту, лиганд, лектин, углевод, авидин, биотин или их аналоги.
Используемый в настоящем описании термин "потенциальный агент" означает объект, который предположительно имеет определенную структуру или функцию. Примеры объектов включают, без ограничений, молекулы, клетки и субклеточные компоненты. Молекулы необязательно могут быть биологически активными молекулами, такими как белки, аминокислоты, нуклеиновые кислоты (например, ДНК или РНК), нуклеотиды, полисахариды, сахариды, метаболиты, витамины, кофакторы ферментов или подобные объекты. Другие потенциальные агенты включают макроциклы, циклические пептиды, сплавляемые молекулы (например, получаемые сплавлением нуклеиновая кислота-белок) или дисплейные конструкции (например, пептиды на фаге). Примеры функций, которые ожидаются от потенциального агента, включают, без ограничений, активацию другого агента, ингибирование другого агента, химическую модификацию другого агента, разрушение другого агента, синтез другого агента, где другой агент необязательно может представлять собой любой объект или более объектов, примеры которых приведены выше в качестве потенциальных агентов. Структура потенциального агента может представлять собой любую известную или предположительную структуру указанных выше объектов или других объектов, известных в данной области техники.
Используемый в настоящем описании в отношении нуклеиновых кислот термин "различный" означает, что нуклеиновые кислоты содержат неодинаковые нуклеотидные последовательности. Две или более нуклеиновые кислоты могут иметь нуклеотидные последовательности, различающиеся на протяжении всей их длины. В альтернативном варианте две или более нуклеиновые кислоты могут иметь нуклеотидные последовательности, различающиеся на существенной части их длины. Например, две или более нуклеиновые кислоты могут иметь целевые части нуклеотидных последовательностей, которые различны для двух или более молекул, но при этом также имеют универсальную часть последовательности, одинаковую для двух или более молекул. Термин может быть по аналогии применен к белкам, которые отличаются друг от друга на основании различий в аминокислотных последовательностях.
Используемый в настоящем описании в отношении группы объектов термин "каждый" предназначен для идентификации индивидуального объекта в группе, но не обязательно означает каждый объект в группе. Исключения относятся к тем случаям, если из описания или контекста очевидно иное.
Используемый в настоящем описании в отношении нуклеиновой кислоты термин "удлинять" (достраивать означает добавление к нуклеиновой кислоте по меньшей мере одного нуклеотида или олигонуклеотида. В частных примерах осуществления один или более нуклеотидов могут быть добавлены к 3'-концу нуклеиновой кислоты, например, при каталитическом действии полимеразы (например, ДНК-полимеразы, РНК-полимеразы или обратной транскриптазы). Для добавления одного или более нуклеотида к 3'- или 5'-концу нуклеиновой кислоты могут быть использованы химические или ферментативные способы. Один или более олигонуклеотидов могут быть добавлены к 3'- или 5'-концу нуклеиновой кислоты, например, химическими или ферментативными способами (например, при каталитическом действии лигазы). Нуклеиновая кислота может быть достроена в соответствии с матрицей, и полученный продукт достройки будет комплементарен матричной нуклеиновой кислоте, гибридизованной с достраиваемой нуклеиновой кислотой.
Используемый в настоящем описании термин "элемент" означает локальный участок в массиве, предназначенный для конкретных видов молекул или клеток. Элемент может содержать только одну молекулу (или клетку), или он может содержать популяцию из нескольких молекул (или клеток) одного вида. В некоторых примерах осуществления перед присоединением молекулы или клетки элементы находятся на твердой подложке. В других примерах осуществления элемент создается присоединением молекулы или клетки к твердой подложке. Элементы массива обычно дискретны. Дискретные элементы могут быть расположены непрерывно, или между ними может иметься расстояние. Размер элементов и/или расстояние между элементами может быть различным; в результате массивы могут иметь высокую плотность, среднюю плотность или низкую плотность. В массивах с высокой плотностью сайты расположены на расстоянии, составляющем менее приблизительно 15 мкм. В массивах со средней плотностью сайты расположены на расстоянии, составляющем приблизительно от 15 до 30 мкм, в то время как в массивах с низкой плотностью сайты расположены на расстоянии, составляющем более 30 мкм. Массив, подходящий для осуществления настоящего изобретения, может содержать, например, сайты, расположенные на расстоянии, составляющем менее 100 мкм, 50 мкм, 10 мкм, 5 мкм, 1 мкм или 0,5 мкм. Установка или способ согласно настоящему изобретению могут быть применены для обнаружения массивов с разрешением, достаточным для того, чтобы различить сайты при указанных выше плотностях или в указанных диапазонах плотностей.
Используемый в настоящем описании термин "проточная ячейка" означает емкость, имеющую камеру, в которой может быть проведена реакция, впускное отверстие для подачи в камеру реагентов и выпускное отверстие для извлечения реагентов из камеры. В некоторых примерах осуществления камера приспособлена для обнаружения протекающей в камере реакции. Например, камера может включать одну или более прозрачных поверхностей, которые позволяют производить в камере оптическое обнаружение массивов, оптически меченых молекул или подобных объектов. Примеры проточных ячеек включают, без ограничений, ячейки, применяемые в установках для секвенирования нуклеиновых кислот, такие как проточные ячейки для платформ Genome Analyzer®, MiSeq®, NextSeq® или HiSeq®, внедренных в коммерческое применение Illumina, Inc. (San Diego, CA); или для платформы секвенирования SOLiD™ или Ion Torrent™, внедренной в коммерческое применение Life Technologies (Carlsbad, СА). Пример проточных ячеек и способов их изготовления и применения также рассмотрены, например, в международной патентной работе WO 2014/142841 А1, в патентной работе US 2010/0111768 А1 и в патенте US 8951781; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки.
Используемый в настоящем описании термин "библиотека" означает группу, которая включает несколько различных объектов. Объекты в группе могут различаться по структуре и/или функции. Например, группа может включать нуклеиновые кислоты, имеющие различные нуклеотидные последовательности, или группа может включать белки, имеющие различные первичные структуры (т.е. аминокислотную последовательность), вторичные структуры, третичные структуры или четвертичные структуры. Однако, следует понимать, что в библиотеке могут оказаться излишние объекты. Например, в библиотеке, которая, тем не менее, включает огромное множество различных нуклеиновых кислот или белков, может находиться множество копий конкретной нуклеиновой кислоты или белка. Примеры типов объектов, которые могут находиться в библиотеке, включают объекты, рассмотренные в настоящей работе при описании потенциальных агентов или агентов для скрининга.
Используемый в настоящем описании термин "люминесцентный" относится к объекту, испускающему излучение в холодном состоянии. Этот термин используют для того, чтобы отличить люминесценцию от температурного излучения, которое представляет собой излучение, испускаемое материалом в результате нагревания. В общем, люминесценция появляется, если под действием источника энергии электрон в атоме переходит с самого низкого, основного энергетического уровня на более высокий энергетический уровень, т.е. в состояние возбуждения; после этого электрон испускает энергию в виде излучения и может вернуться в исходное основное состояние. Особенно полезный тип люминесцентного объекта - это объект, который испускает излучение в холодном состоянии, если энергия передается посредством возбуждающего излучения (излучения накачки). Такие объекты называются "флуоресцентными" или "фотолюминесцентными". Флуоресценция или фотолюминесценция могут проявляться как испускание объектом излучения с некоторой длиной волны в результате облучения этого объекта излучением с другой длиной волны.
Используемые в настоящем описании термины "нуклеиновая кислота" и "нуклеотид" имеют значения, соответствующие их значениям в данной области техники, и включают встречающиеся в природе (нативные) виды или их функциональные аналоги. Особенно полезные функциональные аналоги нуклеиновых кислот способны гибридизоваться с нуклеиновыми кислотами в соответствии с последовательностью или могут применяться в качестве матрицы для репликации конкретной нуклеотидной последовательности. Встречающиеся в природе (нативные) нуклеиновые кислоты обычно имеют основную цепь, содержащую сложные фосфодиэфирные связи. В структуре аналога могут находиться альтернативные связи основной цепи, включающие любые из множества связей, известных в данной области техники. Встречающиеся в природе нуклеиновые кислоты обычно имеют дезоксирибозный сахар (например, находящийся в дезоксирибонуклеиновой кислоте (ДНК)) или рибозный сахар (например, находящийся в рибонуклеиновой кислоте (РНК)). Нуклеиновая кислота может содержать нуклеотиды, содержащие любой из множества аналогов указанных частиц Сахаров, известные в данной области техники. Нуклеиновая кислота может включать природные (нативные) или не встречающиеся в природе (ненативные) нуклеотиды. В этом отношении, природная дезоксирибонуклеиновая кислота может содержать одно или более оснований, выбранных из группы, состоящей из аденина, тимина, цитозина или гуанина, а рибонуклеиновая кислота может содержать одно или более оснований, выбранных из группы, состоящей из урацила, аденина, цитозина или гуанина. Подходящие не встречающиеся в природе основания, которые могут быть включены в нуклеиновую кислоту или нуклеотид, известны в данной области техники.
Используемый в настоящем описании в отношении элементов массива термин "шаг" означает расстояние от центра до центра соседних элементов. Схема расположения элементов может характеризоваться средним шагом. Может быть создана схема расположения с небольшим коэффициентом вариации среднего шага, или схема расположения может быть неупорядоченной, и в этом случае коэффициент вариации может быть относительно большим. В любом случае средний шаг может составлять, например, по меньшей мере приблизительно 10 нм, 0,1 мкм, 0,5 мкм, 1 мкм, 5 мкм, 10 мкм, 100 мкм или более. В альтернативном варианте или дополнительно средний шаг может составлять, например, не более приблизительно 100 мкм, 10 мкм, 5 мкм, 1 мкм, 0,5 мкм 0,1 мкм или менее. Разумеется, средний шаг в конкретной схеме расположения элементов может составлять величину, находящуюся между одним из самых малых значений и одним из самых больших значений, выбранных из приведенных выше диапазонов.
Используемые в настоящем описании термины "белок" или "аминокислота" имеют значения, обычно приписываемые им в данной области техники, и включают встречающиеся в природе виды или их функциональные аналоги. Обычно встречающиеся в природе белки имеют основную цепь, содержащую пептидные связи. В структуре аналога могут находиться альтернативные связи основной цепи, включающие любые из множества связей, известных в данной области техники. Обычно встречающиеся в природе белки содержат природные аминокислоты, выбранные из аргинина, гистидина, лизина, аспарагиновой кислоты, глутаминовой кислоты, серина, треонина, аспарагина, глутамина, цистеина, глицина, пролина, аланина, валина, изолейцина, лейцина, метионина, фенилаланина, тирозина, триптофана и их встречающихся в природе модификаций. Некоторые встречающиеся в природе модификации включают фосфорилирование (например, серина, треонина, гистидина, аспарагиновой кислоты и глутаминовой кислоты), пренилирование, изопренилирование, ацилирование, алкилирование, гликозилорование, биотинилирование, убиквитинирование или подобные модификации. Белок может включать природные аминокислоты, содержащие не встречающиеся в природе частицы. Белок может включать природные или не встречающиеся в природе аминокислоты.
Используемый в настоящем описании в отношении первого агента и второго агента термин "реагировать" означает процесс модификации химической структуры одного или обоих агентов, образование одной или более ковалентных связей между двумя агентами, каталитическое действие одного из реагентов в процессе модификации химической структуры другого агента или специфическое связывание двух агентов (например, через нековалентные взаимодействия). Примеры реакций включают, без ограничений, химические реакции, такие как восстановление, окисление, присоединение, отщепление, перегруппировку, образование сложного эфира, амидирование, образование простого эфира, циклизацию или замещение; связывающие взаимодействия, в которых первый агент связывается со вторым агентом со специфичным сродством; реакции диссоциации, в которых два или более агента отщепляются друг от друга; флуоресценцию; люминесценцию; хемилюминесценцию; и биологические реакции, такие как репликация нуклеиновой кислоты, амплификация нуклеиновой кислоты, гибридизация нуклеиновой кислоты, лигирование нуклеиновой кислоты, фосфорилирование, ферментативный катализ, связывание рецептора или связывание лиганда.
Используемый в настоящем описании термин "рекомбинантный" означает не встречающуюся в природе генетическую конструкцию. Примером такой конструкции является продукт объединения генетического материала, полученного из более чем одного источника. Примеры рекомбинантных молекул включают, без ограничений, ДНК, РНК и белок. Источники происхождения рекомбинантной молекулы могут включать, например, аналогичные генетические элементы, полученные от различных организмов, различные генетические элементы, полученные от одного организма, различные генетические элементы, полученные от различных организмов, синтетические генетические элементы или комбинации синтетических и природных генетических элементов.
Используемый в настоящем описании термин "агент для скрининга" означает объект, который имеет структуру или функцию, селективную по отношению к первому потенциальному агенту по сравнению со вторым потенциальным агентом. Во множестве примеров осуществления структура или функция агента для скрининга известна до его применения в способе или композиции согласно настоящему изобретению. Примеры объектов включают, без ограничений, молекулы, клетки и субклеточные компоненты. Молекулы необязательно могут представлять собой биологически активные молекулы, такие как белки, аминокислоты, нуклеиновые кислоты (например, ДНК или РНК), нуклеотиды, полисахариды, сахариды, метаболиты, витамины, кофакторы ферментов или подобные молекулы. Примеры селективных функций включают, без ограничений, активацию другого агента, ингибирование другого агента, химическую модификацию другого агента, разрушение другого агента, синтез другого агента, причем другой агент может представлять собой любой из одного или более объектов, примеры которых приведены выше в качестве потенциальных агентов. Структура агента для скрининга может быть любой известной или предположительно известной структурой указанных выше объектов или других объектов, известных в данной области техники.
Используемый в настоящем описании термин "селективная" манипуляция первого предмета по сравнению со вторым предметом означает, что манипуляция оказывает более сильное воздействие на первый предмет по сравнению с воздействием, оказываемым на второй предмет. Манипуляция не обязательно оказывает воздействие на второй предмет. Манипуляция может оказывать воздействие на первый предмет, которое по меньшей мере на 1%, 10%, 50%, 90% или 99% более эффективно, чем воздействие на второй предмет. Манипуляция может оказывать воздействие на первый предмет, которое по меньшей мере в 2 раза, 5 раз, 10 раз, 100 раз, 1×103 раз, 1×104 раз или 1×106 раз более эффективно, чем воздействие на второй предмет. Манипуляция может включать, например, модификацию, контакт, обработку, изменение, расщепление (например, химической связи), фотохимическое расщепление (например, химической связи), образование (например, химической связи), фотохимическое образование (например, химической связи), ковалентную модификацию, нековалентную модификацию, разрушение, фотоабляцию, удаление, синтез, полимеризацию, фотополимеризацию, амплификацию (например, нуклеиновой кислоты), копирование (например, нуклеиновой кислоты), удлинение (например, нуклеиновой кислоты), лигирование (например, нуклеиновой кислоты) или другие манипуляции, рассмотренные в настоящей работе или известные в данной области техники.
Используемый в настоящем описании термин "небольшая молекула" означает соединение, молекулярная масса которого составляет менее приблизительно 1000 Дальтон. В частных примерах осуществления небольшая молекула не является полимером. Однако в других примерах осуществления небольшая молекула может представлять собой димер или тример. Также следует понимать, что небольшая молекула может представлять собой мономер, который может быть встроен в полимер. Особенно подходящими небольшими молекулами являются органические соединения. Подходящие небольшие молекулы могут иметь молекулярную массу, составляющую менее 900, 800, 600, 400, 200 или 100 Дальтон.
Используемый в настоящем описании термин "твердая подложка" относится к жесткой подложке, которая нерастворима в водной жидкости. Подложка может быть непористой или пористой. Подложка необязательно может быть способна впитывать жидкость (например, из-за наличия пористости), но обычно она достаточно жесткая и по существу не набухает при впитывании жидкости и по существу не сжимается после удаления жидкости сушкой. Обычно непористая твердая подложка непроницаема для жидкостей или газов. Примеры материалов твердых подложек включают, без ограничений, стекло и модифицированное или функционализированное стекло, полимеры (например, акриловые полимеры, полистирол и сополимеры стирола и других материалов, полипропилен, полиэтилен, полибутилен, полиуретаны, тефлон (Teflon™), циклические олефины, полиимиды и т.д.), нейлон, керамику, смолы, цеонор (Zeonor), оксид кремния или материалы на основе оксида кремния, включающие кремний и модифицированный кремний, углерод, металлы, неорганические стекла, жгуты оптического волокна и полимеры. Особенно подходящими для некоторых примеров осуществления являются твердые подложки, представляющие собой компоненты проточной ячейки или компоненты, находящиеся в установке с проточной ячейки. Примеры проточных ячеек более подробно рассмотрены ниже.
Используемый в настоящем описании термин "подбиблиотека" означает группу (набор), содержащую представительную выборку, которая включает объекты из библиотеки или копии объектов из библиотеки. Представительная выборка в подбиблиотеке может быть полной или частичной по сравнению с выборкой библиотеки. Подбиблиотека может быть получена отделением по меньшей мере некоторых объектов из библиотеки или созданием копий по меньшей мере некоторых объектов библиотеки.
Используемый в настоящем описании термин "последовательность маркера" означает серию нуклеотидов в нуклеиновой кислоте, которая может быть использована для идентификации или характеристики агента, присоединенного к (или связанного с) нуклеиновой кислоте. Последовательность маркера может представлять собой встречающуюся в природе последовательность или последовательность, которая не встречается в природе в организме, из которого была получена нуклеиновая кислота. В частных примерах осуществления одна или более последовательностей маркера, которую используют в биологическом образце, встречается в природном геноме, транскриптоме или других нуклеиновых кислотах биологического образца. Например, последовательности маркера могут иметь менее 80%, 70%, 60%, 50% или 40% идентичности последовательности с последовательностями нуклеиновой кислоты, находящейся в конкретном биологическом образце.
Используемый в настоящем описании термин "универсальная последовательность" относится к серии нуклеотидов, одинаковой для двух или более молекул нуклеиновых кислот, даже если молекулы также содержат различающиеся области последовательностей. Универсальная последовательность, которая присутствует в различных членах группы молекул, позволяет улавливать множество различных нуклеиновых кислот с помощью популяции универсальных нуклеиновых кислот захвата, которые комплементарны универсальной последовательности. Аналогично, универсальная последовательность, которая присутствует в различных членах группы молекул, позволяет производить репликацию или амплификацию множества различных нуклеиновых кислот с помощью популяции универсальных праймеров, которые комплементарны универсальной последовательности. Таким образом, универсальная нуклеиновая кислота захвата или универсальный праймер включает последовательность, которая может специфично гибридизоваться с универсальной последовательностью.
Рассмотренные ниже и раскрытые в пунктах формулы изобретения примеры осуществления могут быть лучше поняты на основании приведенных выше определений.
Настоящее изобретение относится к способу характеристики потенциальных агентов. Способ может включать следующие этапы: (а) предоставление библиотеки потенциальных агентов, в которой каждый потенциальный агент присоединен к маркеру-нуклеиновой кислоте, имеющей последовательность маркера; (b) приведение библиотеки потенциальных агентов в контакт с твердой подложкой для присоединения потенциальных агентов к твердой подложке, в результате чего на твердой подложке образуется массив потенциальных агентов, включающих индивидуальные элементы, каждый из которых присоединен к индивидуальному потенциальному агенту из библиотеки; (с) приведение массива потенциальных агентов в контакт с агентом для скрининга, при котором один или более из потенциальных агентов массива реагирует с агентом для скрининга; (d) исследование массива во время или после контакта массива с агентом для скрининга для установления того, что по меньшей мере один потенциальный агент, находящийся в массиве, реагирует с агентом для скрининга; (е) секвенирование маркеров-нуклеиновых кислот в массиве для определения последовательности маркера, который присоединен к каждому из потенциальных агентов; и (f) идентификацию по меньшей мере одного потенциального агента в массиве, который реагирует с агентом для скрининга, на основании последовательности маркера, который присоединен к по меньшей мере одному потенциальному агенту.
Любой из множества потенциальных агентов может быть использован в способе, рассмотренном в настоящей работе. В некоторых примерах осуществления потенциальные агенты выбраны из группы, состоящей из белков, нуклеиновых кислот, клеток или небольших молекул. Следует понимать, что в некоторых примерах осуществления из применяемых потенциальных агентов исключают один или более типов объектов, таких как белки, нуклеиновые кислоты, клетки или небольшие молекулы. Примеры объектов такого типа, которые могут быть включены или исключены из способа или композиции, приведены в настоящем описании.
Полезные потенциальные агенты могут представлять собой молекулы, имеющие или предположительно имеющие биологическую активность. Примеры биологической активности включают, без ограничений, терапевтическую активность, токсичность, гормональную активность, активацию биологических молекул или клеток, ингибирование биологических молекул или клеток, антибиотическую активность, противовирусную активность, пестицидную активность, воздействие на организм или его органы, такое как психофармакологическое воздействие или иммунологическое воздействие или подобные виды воздействий. Особенно подходящие типы потенциальных агентов представляют собой ингибиторы ферментов или активаторы ферментов, включающие, например, агенты, действие которых нацелено на ферменты, рассмотренные в настоящей работе. Также подходящими являются потенциальные активаторы клеточной сигнализации или потенциальные ингибиторы клеточной сигнализации. Однако в некоторых примерах осуществления потенциальные агенты не должны иметь биологической активности или предположительно не должны иметь биологической активности. В некоторых случаях потенциальный агент будет иметь или предположительно будет иметь небиологическую активность. Примеры активности, которая может быть небиологической, включают, без ограничений, промышленный катализ, консервацию пищевых продуктов, обработку нефти, синтез полимеров или подобные виды действия.
Потенциальные агенты могут быть полимерными или неполимерными. Особенно подходящие полимеры включают, без ограничений, белки, нуклеиновые кислоты, полисахариды, белковые нуклеиновые кислоты (англ. protein nucleic acid, сокращенно PNA) и пластмассы (пластики). Подходящие неполимерные молекулы включают, например, липиды, аминокислоты, нуклеотиды, кофакторы ферментов, метаболиты, моносахариды и другие небольшие молекулы.
Примеры белков, подходящих в качестве потенциальных агентов включают, без ограничений, антитела; ферменты, такие как оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы, киназы, фосфатазы, полимеразы, протеазы, нуклеазы, целлюлазы, лигниназы, амилазы, липазы, маннаназы, амилазы, глюканазы, ферменты, модифицирующие папаин, ренин, гистон, или эстеразы; или рецепторы, такие как связанные с G-белком рецепторы, рецепторы клеточной поверхности, иммунорецепторы, чувствительные рецепторы и ядерные гормональные рецепторы.
Другим особенно подходящим типом потенциального агента является клетка, включающая, например, клетку организма, который включает, без ограничений, млекопитающее, такое как грызун, мышь, крыса, кролик, морская свинка, копытное, лошадь, овца, свинья, коза, корова, кошка, собака, примат (т.е. примат-человек или примат-нечеловек); растение, такое как Arabidopsis thaliana, кукуруза, сорго, овес, пшеница, рис, канола или соевые бобы; водоросли, такие как Chlamydomonas reinhardtii; нематоду, такую как Caenorhabditis elegans; насекомое, такое как Drosophila melanogaster, комар, плодовая мушка, медоносная пчела или паук; рыбу, такую как данио; рептилию; амфибию, такую как лягушка или Xenopus laevis; dictyostelium discoideum; грибки, такие как Pneumocystis carinii, Takifugu rubripes, дрожжи, Saccharamoyces cerevisiae или Schizosaccharomyces pombe; или Plasmodium falciparum. Другие организмы включают прокариоты, такие как бактерии, Escherichia coli, Staphylococci или Mycoplasma pneumoniae; простейшие; вирусы, такие как вирус гепатита С или вирус иммунодефицита человека; или вироиды. Клетки могут быть получены из гомогенной культуры или популяции перечисленных выше организмов или в альтернативном варианте из группы нескольких различных организмов, например, в смешанной культуре, сообществе или экосистеме.
Потенциальные агенты, применяемые согласно изобретению, могут встречаться в природе, например, могут быть отобраны из природной популяции. Например, потенциальные агенты могут быть генетически натуральными клетками, выделенными из многоклеточного организма или сообщества. Аналогично, могут быть использованы белки, нуклеиновые кислоты или другие биологические молекулы, полученные из одной или более генетически натуральных клеток или организмов. В альтернативном варианте потенциальные агенты могут быть синтетическими, или они могут представлять собой сконструированные варианты встречающегося в природе агента. Например, в способе, рассмотренном в настоящей работе, могут быть использованы генетически сконструированные клетки, белки или нуклеиновые кислоты. Клетки или клеточные компоненты, применяемые в качестве потенциальных агентов, могут быть получены из одноклеточных организмов или многоклеточных организмов. В частных примерах осуществления изобретения в качестве потенциальных агентов могут быть использованы стволовые клетки, иммунные клетки или биологические компоненты, полученные из одной или более клеток этого типа.
В некоторых примерах осуществления маркеры-нуклеиновые кислоты могут быть синтезированы параллельно с синтезом потенциальных агентов. Например, при помощи методик комбинаторной химии может быть синтезирована библиотека потенциальных агентов, и может быть добавлен специфичный нуклеотид (или последовательность нуклеотидов) для индикации каждой из множества различных химических частиц, добавленных к каждому члену библиотеки. Соответственно, последовательность нуклеотидов в маркере, присоединенном к конкретному потенциальному агенту, указывает на историю синтеза конкретного потенциального агента, т.е. представляет собой информацию, которая необязательно может быть использована для определения химической структуры этого конкретного потенциального агента. Химические частицы, используемые для присоединения и комбинаторного синтеза, рассмотрены, например, в патентах US 5565324, US 5573905 или US 6060596, содержание каждого из которых включено в настоящее описание посредством ссылки.
Частные примеры осуществления способов, рассмотренных в настоящей работе, могут включать этап комбинаторного синтеза библиотеки потенциальных агентов, в котором индивидуальные реакции комбинаторного синтеза, которые проводят на каждом потенциальном агенте, отслеживают путем добавления уникальной сигнатуры одного или более нуклеотидов к маркеру-нуклеиновой кислоте, которая присоединена к каждому из потенциальных агентов, в результате чего получают библиотеку потенциальных агентов, в которой каждый потенциальный агент присоединен к уникальному маркеру-нуклеиновой кислоте.
Маркеры-нуклеиновые кислоты могут быть присоединены к потенциальным агентам множеством химических способов, известных в данной области техники, которые подходят для обработки нуклеиновых кислот и конкретного используемого потенциального агента. В частных примерах осуществления маркеры-нуклеиновые кислот присоединяют к потенциальным агентам ковалентной связью. В тех случаях, когда потенциальный агент представляет собой нуклеиновую кислоту или кодируется нуклеиновой кислотой, непрерывная нуклеиновая кислота может включать последовательность маркера и последовательность потенциального агента. Также возможно применение химических способов для ковалентного присоединения маркера-нуклеиновой кислоты к другой нуклеиновой кислоте, которая является потенциальным агентом или кодирует потенциальный агент. Химические вещества, подходящие для присоединения маркера-нуклеиновой кислоты к потенциальному агенту (независимо от того, является ли потенциальный агент нуклеиновой кислотой или другим веществом), включают, например, сложные эфиры N-гидроксисукцинимида (сложные эфиры NHS, от англ. N-hydroxysuccinimide), сложные имидоэфиры, гидразины, карбодиимиды, имиды малеиновой кислоты, галогеноацетилы, пиридинилдисульфиды, диазирины, агенты клик-химии (см., например, патенты US 6737236, US 7427678, US 7375234, US 7763736 или US 8129542, содержание каждого из которых включено в настоящее описание посредством ссылки) или сульфгидрилы. Другие полезные химические вещества включают вещества, применяемые для присоединения нуклеиновых кислот к гранулам или другим твердым подложкам, как это рассмотрено в патенте US 7259258 или патенте US 7504499, содержание каждого из которых включено в настоящее описание посредством ссылки.
Последовательности маркера могут иметь различные длины. Обычно более длинные последовательности могут быть подходящими для множества различных маркеров для популяции. Обычно все зонды во множестве имеют маркеры одной длины (но с различными последовательностями); но при этом в различных зондах также можно использовать маркеры различных длин. Длина последовательности маркера может составлять по меньшей мере 2, 4, 6, 8, 10, 12, 15, 20 или более нуклеотидов. В альтернативном варианте или дополнительно длина последовательности маркера может составлять не более 20, 15, 12, 10, 8, 6, 4 или менее нуклеотидов. Примеры последовательностей маркера, которые могут быть использованы, рассмотрены, например, в патентной публикации US 2014/0342921 А1 и патенте US 8460865; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки.
Способ согласно настоящему изобретению может включать этап приведения библиотеки потенциальных агентов в контакт с твердой подложкой для присоединения потенциальных агентов к твердой подложке. В результате на подложке может быть сформирован массив потенциальных агентов, который включает индивидуальные элементы, каждый из которых присоединен к индивидуальному потенциальному агенту из библиотеки.
Возможно использование любой из множества твердых подложек. Особенно подходящими твердыми подложками являются подложки, применяемые для массивов нуклеиновых кислот. Примеры материалов подложек включают стекло, модифицированное стекло, функционализированное стекло, неорганические стекла, микросферы (например, инертные и/или магнитные частицы), полимеры, полисахариды, нейлон, нитроцеллюлозу, керамику, смолы, оксид кремния, материалы на основе оксида кремния, углерод, металлы, оптическое волокно или жгуты из оптического волокна, полимеры и мультилуночные (например, микролитровые) планшеты. Примеры полимеров включают акриловые полимеры, полистирол, сополимеры стирола и других материалов, полипропилен, полиэтилен, полибутилен, полиуретаны и тефлон (Teflon™). Примеры материалов на основе оксида кремния включают кремний и различные формы модифицированного кремния.
В частных примерах осуществления твердая подложка может находиться внутри или быть частью емкости, такой как лунка, пробирка, канал, кювета, чашка Петри, бюкс или подобной емкости. Особенно подходящей емкостью является проточная ячейка, например, рассмотренная в международной патентной заявке WO 2014/142841 А1; патентной заявке US 2010/0111768 А1 и в патенте US 8951781 или в публикации Bentley с соавт., Nature 456:53-59 (2008), где содержание каждой из публикаций включено в настоящее описание посредством ссылки. Примеры проточных ячеек представляют собой ячейки, коммерчески предоставляемые Illumina, Inc. (San Diego, CA) для применения с платформой секвенирования, такой как платформа Genome Analyzer®, MiSeq®, NextSeq® или HiSeq®. Другой особенно подходящей емкостью является лунка мультилуночного планшета или микролитрового планшета.
Необязательно, твердая подложка может включать покрытие из геля. Присоединение нуклеиновых кислот к твердой подложке через гель имеет место, например, в проточных ячейках, коммерчески поставляемых Illumina Inc. (San Diego, CA), или рассмотренных в патентных публикациях US 2011/0059865 А1, US 2014/0079923 А1 или US 2015/0005447 А1 или в международной патентной заявке РСТ WO 2008/093098, содержание каждой из которых включено в настоящее описание посредством ссылки. Примеры гелей, которые могут быть использованы в способах и установке, рассмотренных в настоящей работе, включают, без ограничений, гели, имеющие коллоидную структуру, такие как агарозные гели; полимеры с сетчатой структурой, такие как желатин; или сшитые полимерные структуры, такие как полиакриламид, SFA (от англ. silane-free acrylamide - не содержащий силана акриламид) (см., например, опубликованную патентную заявку US 2011/0059865 А1, содержание которой включено в настоящее описание посредством ссылки) или PAZAM (от англ. poly(N-(5-azidoacetamidylpentyl)acrylamide-co-acrylamide - сополимер (N-(5-азидо-ацетамидилпентил)акриламида с акриламидом) (см., например, опубликованные патентные заявки US 2014/0079923 А1 или US 2015/0005447 А1, содержание каждой из которых включено в настоящее описание посредством ссылки). Гель может быть использован для непосредственного прикрепления потенциальных агентов (например, при образовании ковалентных связей между гелем и потенциальными агентами) или посредством гибридизации присоединенной к гелю нуклеиновой кислоты с комплементарными нуклеиновыми кислотами, уже присоединенными к потенциальным агентам.
В некоторых примерах осуществления твердая подложка может быть сконструирована в виде массива элементов, к которому могут быть присоединены нуклеиновые кислоты и/или потенциальные агенты. В частных примерах осуществления каждый элемент может разместить не более одного потенциального агента или может иметь конструкцию, позволяющую содержать единственный вид определенной смеси потенциальных агентов. Элементы могут присутствовать в любом из множества требуемых форматов. Например, элементы могут представлять собой лунки, ямки, каналы, выступы, приподнятые области, шпильки, столбики или подобные элементы. В некоторых примерах осуществления элементы могут содержать гранулы. Однако в частных примерах осуществления элементы не должны содержать гранулу или частицу. Примеры элементов включают лунки, имеющиеся в подложках, применяемых в коммерческих платформах секвенирования, коммерчески предоставляемых 454 LifeSciences (дочернее предприятие Roche, Базель, Швейцария) или Ion Torrent (дочернее предприятие Life Technologies, Карлсбад, Калифорния). Другие подложки, имеющие лунки, включают, например, протравленную волоконную оптику и другие подложки, рассмотренные в патентах US 6266459, US 6355431, US 6770441, US 6859570, US 6210891, US 6258568, US 6274320, опубликованных патентных заявках US 2009/0026082 A1, US 2009/0127589 A1, US 2010/0137143 A1, US 2010/0282617 A1 или международной патентной заявке WO 00/63437, где содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки. В некоторых примерах осуществления лунки подложки могут содержать гелевый материал (содержащий или не содержащий гранулы), как указано в опубликованной патентной заявке US 2014/0243224 А1, содержание которой включено в настоящее описание посредством ссылки.
Элементы на твердой подложке могут представлять собой металлические элементы на неметаллической поверхности, такой как стекло, полимер или другие материалы, примеры которых приведены выше. Примеры твердых подложек, включающих металлические элементы, и способы их изготовления, приведены в патенте US 8895249 или в опубликованной патентной заявке US 2014/0243224 А1; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки.
Элементы могут располагаться на твердой подложке в виде сетки из точек или пятен. Элементы могут быть расположены в виде повторяющейся схемы расположения или в виде нерегулярной, неповторяющейся схемы расположения. Особенно подходящими повторяющимися схемами расположения являются гексагональные схемы расположения, прямолинейные схемы расположения, сетчатые схемы расположения, схемы расположения с зеркальной симметрией, схемы расположения с симметрией относительно оси вращения или подобные схемы. Также могут быть использованы асимметричные схемы расположения. Шаг между различными парами соседних элементов может быть одинаковым, или шаг между различными парами соседних элементов может быть переменным.
Массивы с высокой плотностью имеют средний шаг (между соседними элементами), составляющий менее приблизительно 15 мкм. Массивы со средней плотностью имеют средний шаг, составляющий приблизительно от 15 до 30 мкм, в то время как массивы с низкой плотностью имеют средний шаг, составляющий более 30 мкм. Массивы, подходящие для осуществления изобретения, могут иметь средний шаг, составляющий менее 100 мкм, 50 мкм, 10 мкм, 5 мкм, 1 мкм или 0,5 мкм. Указанные выше или далее в настоящем описании величины среднего шага и их диапазоны применимы к упорядоченным массивам или неупорядоченным массивам.
В частных примерах осуществления каждый из элементов на твердой подложке может иметь площадь, превышающую приблизительно 100 нм2, 250 нм2, 500 нм2, 1 мкм2, 2,5 мкм2, 5 мкм2, 10 мкм2, 100 мкм2 или 500 мкм2 или более. В альтернативном варианте или дополнительно каждый из элементов может иметь площадь, составляющую менее приблизительно 1 мм2, 500 мкм2, 100 мкм2, 25 мкм2, 10 мкм2, 5 мкм2, 1 мкм2, 500 нм2 или 100 нм2 или менее. Вышеуказанные диапазоны могут описывать кажущиеся площади гранул или других частиц, расположенных на твердой подложке, при рассмотрении или изображении.
В частных примерах осуществления твердая подложка может включать группу (набор) гранул или других частиц. Примеры массивов, содержащих расположенные на поверхности гранулы, включают массивы, в которых гранулы расположены в лунках, такие как массив BeadChip™ (Illumina Inc., San Diego, CA), подложки, применяемые в платформах секвенирования, поставляемых 454 LifeSciences (дочернее предприятие Roche, Базель, Швейцария), или подложки, применяемые в платформах секвенирования, поставляемых Ion Torrent (дочернее предприятие Life Technologies, Карлсбад, Калифорния). Другие твердые подложки с расположенными на поверхности гранулами рассмотрены в патентах US 6266459, US 6355431, US 6770441, US 6859570, US 6210891, US 6258568 или US 6274320; опубликованных патентных заявках US 2009/0026082 A1, US 2009/0127589 A1, US 2010/0137143 A1 или US 2010/0282617 A1 или международной патентной заявке WO 00/63437; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки. В некоторых из приведенных выше документах рассмотрены способы присоединения нуклеиновых кислот к гранулам перед загрузкой гранул в или на твердую подложку. Как таковая, группа гранул может включать различные гранулы, к каждой из которых присоединена уникальная нуклеиновая кислота. Однако, следует понимать, что могут быть получены гранулы, включающие универсальные праймеры, и затем гранулы могут быть загружены в массив с образованием универсальных массивов, которые применяют в способе, рассмотренном в настоящей работе. Потенциальные агенты могут быть присоединены к гранулам до или после загрузки гранул на твердую подложку. Как было указано выше, твердые подложки, обычно применяемые для массивов гранул, могут быть использованы без гранул. Например, нуклеиновые кислоты (такие как зонды или праймер) или потенциальные агенты могут быть присоединены непосредственно к лункам или к гелевому материалу, находящемуся в лунках. Таким образом, в приведенных выше документах представлены иллюстрации материалов, композиций или установки, которые могут быть адаптированы для применения в способах и композициях, рассмотренных в настоящей работе.
Соответственно, твердая подложка, применяемая в способе, рассмотренном в настоящей работе, может включать массив гранул, причем различные потенциальные агенты или различные нуклеиновые кислоты присоединены к различным гранулам, содержащимся в массиве. В этом примере осуществления каждая гранула может быть присоединена к отдельному потенциальному агенту или нуклеиновой кислоте, и гранулы могут быть неупорядоченным образом распределены на твердой подложке, что позволяет эффективно присоединять к твердой подложке различные нуклеиновые кислоты. Необязательно, твердая подложка может включать лунки, размеры которых позволяют располагать в них не более одной гранулы или одного потенциального агента. В такой конфигурации гранулы могут быть присоединены к лункам за счет сил, обеспечиваемых "посадкой" гранул в лунках. Для удержания гранул в лунках также могут быть использованы химические способы присоединения или клеящие вещества.
Твердая подложка может включать множество нуклеиновых кислот или потенциальных агентов или может быть получена способами, рассмотренными в настоящей работе и предназначенными для присоединения множества нуклеиновых кислот или потенциальных агентов. Например, твердая подложка может включать по меньшей мере 10, 100, 1×103, 1×104, 1×105, 1×106, 1×107, 1×108, 1×109 или более различных нуклеиновых кислот или потенциальных агентов. В альтернативном варианте или дополнительно твердая подложка может включать не более 1×109, 1×108, 1×107, 1×106, 1×105, 1×104, 1×103, 100, 10 или менее различных нуклеиновых кислот или потенциальных агентов. Следует понимать, что каждая из нуклеиновых кислот или каждый из потенциальных агентов может присутствовать в виде нескольких копий, например, если компоненты нуклеиновых кислот, содержащихся в потенциальных агентах, были амплифицированы с образованием кластера. Таким образом, приведенные выше диапазоны могут относиться к нескольким кластерам различных потенциальных агентов или нуклеиновых кислот, находящимся на твердой подложке. Также следует понимать, что приведенные выше диапазоны могут относиться к нескольким различным маркерам или другим элементам последовательностей, рассмотренным в настоящей работе и уникальным для конкретных нуклеиновых кислот или потенциальных агентов. В альтернативном варианте или дополнительно диапазоны могут относиться к нескольким достроенным нуклеиновым кислотам или модифицированным потенциальным агентам, созданным на твердой подложке способом согласно изобретению.
Элементы могут присутствовать на твердой подложке до контакта твердой подложки с нуклеиновыми кислотами или потенциальными агентами. Например, в тех примерах осуществления, в которых нуклеиновые кислоты или потенциальные агенты присоединены к подложке посредством гибридизации с праймерами, праймеры могут быть зафиксированы на элементах, в то время как промежуточные области снаружи элементов по существу не содержат праймеров. Нуклеиновые кислоты или потенциальные агенты могут быть захвачены предварительно созданными на твердой подложке элементами и необязательно амплифицированы на твердой подложке способами, рассмотренными в патентах US 8895249, US 8778849 или в опубликованной патентной заявке US 2014/0243224 А1; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки.
В некоторых примерах осуществления элементы создают во время или после присоединения маркеров-нуклеиновых кислот и/или потенциальных агентов к твердой подложке. Например, на твердой подложке может быть образован "газон" (т.е. сплошной слой объектов, созданный на поверхности) из праймеров, или, в напртив, подложка может не содержать элементов. В этом случае элемент может быть образован посредством присоединения нуклеиновой кислоты или потенциального агента к твердой подложке. Необязательно, захваченная нуклеиновая кислота может быть амплифицирована на твердой подложке, и полученный кластер становится элементом. Несмотря на то, что выше присоединение определено как захват, происходящий между праймером и комплементарной частью другой нуклеиновой кислоты, следует понимать, что на предварительно созданных элементах или в виде газона могут присутствовать частицы захвата, отличные от праймеров. Другие примеры частиц захвата включают, без ограничений, химические частицы, способные реагировать с нуклеиновой кислотой или потенциальным агентом с образованием ковалентной связи, или рецепторы, способные нековалентно связываться с лигандом, находящимся на нуклеиновой кислоте или потенциальном агенте.
В частных примерах осуществления к твердой подложке присоединяют праймеры нуклеиновых кислот. Библиотека потенциальных агентов с присоединенными к ним маркерами-нуклеиновыми кислотами может присоединяться к твердой подложке посредством гибридизации маркеров-нуклеиновых кислот с присоединенными праймерами нуклеиновых кислот. Например, маркеры-нуклеиновые кислоты могут включать последовательность, связывающую универсальный праймер, праймеры нуклеиновых кислот могут включать последовательность универсального праймера, и потенциальные агенты могут присоединяться к твердой подложке посредством гибридизации последовательности, связывающей универсальный праймер, с последовательностью универсального праймера. В качестве альтернативы универсальным праймерам твердая подложка может включать мишень-специфичные праймеры, которые гибридизуются с последовательностями специфичных маркеров.
Присоединение потенциальных агентов к твердой подложке позволяет создать массив, в котором на один элемент приходится один потенциальный агент. Соответственно, каждый из одного или более элементов, находящихся на твердой подложке, может включать единственный потенциальный агент (например, единичную молекулу, единичную клетку или другой единичный объект). В некоторых примерах осуществления элементы могут иметь такую структуру, которая позволяет вмещать не более одного потенциального агента конкретного типа. Однако, независимо от того, один потенциальный агент может вмещать элемент или более, элемент, тем не менее, может включать не более одного потенциального агента, не более одного маркера-нуклеиновой кислоты или не более и одного потенциального агента, и одного маркера-нуклеиновой кислоты. В альтернативном варианте индивидуальный элемент может включать множество потенциальных агентов и/или маркеров-нуклеиновых кислот. Например, индивидуальный элемент может включать совокупность молекул нуклеиновых кислот и/или совокупность белков, имеющих одинаковую последовательность. В частных примерах осуществления совокупность может быть получена амплификацией из единственной матрицы нуклеиновой кислоты, в результате чего получают ампликоны, например, в виде кластера, присоединенного к каждому из элементов.
В способе, рассмотренном в настоящей работе, может быть использована любая из множества методик амплификации. Примеры методик, которые могут быть использованы, включают, без ограничений, полимеразную цепную реакцию (ПЦР), амплификацию по типу катящегося кольца (RCA), амплификацию с множественным вытеснением цепи (MDA) или амплификацию со случайным праймером (англ. random prime amplification, сокращенно RPA). В некоторых примерах осуществления амплификация может быть проведена в растворе. Предпочтительно амплификацию согласно методике, применяемой в способе согласно настоящему изобретению, проводят на твердой фазе. В частности, при проведении амплификации может быть достроен один или более видов праймеров (например, универсальные праймеры для одного или более сайта связывания универсального праймера, присутствующего в маркере-нуклеиновой кислоте), которые присоединены к твердой подложке и которые гибридизуются с маркером-нуклеиновой кислотой. Если, например, в примере осуществления выполняют твердофазную ПЦР, то один или оба праймера, применяемые для амплификации, могут быть присоединены к твердой подложке (например, с помощью геля). Форматы, в которых применяют два вида праймеров, присоединенных к твердой подложке, часто называют мостиковой амплификацией, поскольку двухцепочечные (двухнитевые) ампликоны образуют мостикоподобную структуру между двумя присоединенными к твердой подложке праймерами, которые фланкируют копируемую матричную последовательность. Примеры реагентов и условий, которые могут быть использованы при мостиковой амплификации, рассмотрены, например, в патентах US 5641658, US 7115400 или US 8895249 или в опубликованных патентных заявках US 2002/0055100 А1, US 2004/0096853 А1, US 2004/0002090 А1, US 2007/0128624 A1 или US 2008/0009420 A1; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки. Твердофазная ПЦР амплификация также может быть проведена с использованием одного из праймеров амплификации, который присоединен к твердой подложке, и второго праймера, находящегося в растворе. Примером формата, в котором применяют комбинацию праймера, присоединенного к твердой подложке, и растворимого праймера, является формат, применяемый при проведении ПЦР в эмульсии, рассмотренный, например, в публикации Dressman с соавт., Proc. Natl. Acad. Sci. USA 100:8817-8822 (2003), в патентном документе WO 05/010145 или в опубликованной патентной заявке US 2005/0130173 А1 или US 2005/0064460 А1; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки. ПЦР в эмульсии является иллюстрацией названного формата, и следует понимать, что для выполнения задач способов согласно настоящему изобретению применение эмульсии необязательно, и, действительно, в некоторых примерах осуществления эмульсию не применяют.
Методики RCA (рамификации) могут быть модифицированы для применения в способе согласно настоящему изобретению. Примеры компонентов, которые могут быть использованы в реакции RCA, и принципы получения ампликонов посредством RCA рассмотрены, например, в публикации Lizardi с соавт., Nat. Genet. 19:225-232 (1998) и опубликованной патентной заявке US 2007/0099208 А1, содержание каждой из которых включено в настоящее описание посредством ссылки. Праймеры, применяемые для проведения RCA, могут находиться в растворе или быть присоединены к твердой подложке. Праймеры могут представлять собой один или более из универсальных праймеров, рассмотренных в настоящей работе.
Методики MDA (амплификации с множественным вытеснением цепи) могут быть модифицированы для применения в способе согласно настоящему изобретению. Некоторые основные принципы и подходящие условия MDA рассмотрены, например, в публикациях Dean с соавт., Proc Natl. Acad. Sci. USA 99:5261-66 (2002); Lage с соавт., Genome Research 13:294-307 (2003); Walker с соавт., Molecular Methods for Virus Detection, Academic Press, Inc., 1995; Walker с соавт., Nucl. Acids Res. 20:1691-96 (1992); US 5455166, US 5130238 и US 6214587; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки. Праймеры, применяемые для проведения MDA, могут находиться в растворе или быть присоединены к твердой подложке на сайте амплификации. В этом случае также праймеры могут представлять собой один или более из универсальных праймеров, рассмотренных в настоящей работе.
В частных примерах осуществления может быть использована комбинация упоминаемых выше методик амплификации. Например, может быть использована комбинация RCA и MDA, в то время как RCA применяют для получения конкатамерного ампликона в растворе (например, применяя праймеры в растворе). Затем в качестве матрицы для MDA может быть использован ампликон с использованием праймеров, присоединенных к твердой подложке (например, универсальных праймеров). В этом примере ампликоны, полученные после проведения объединенных этапов RCA и MDA, присоединяют к твердой подложке.
Способ согласно настоящему изобретению может включать этап приведения массива потенциальных агентов в контакт с агентом для скрининга или раздражителем. Один или более потенциальных агентов, содержащихся в массиве, может необязательно реагировать с агентом для скрининга или создавать ответную реакцию на раздражитель. В результате один или более потенциальных агентов могут считаться находками.
В некоторых примерах осуществления агент для скрининга реагирует с одним или более потенциальными агентами массива посредством связывания с одним или более потенциальными агентами или посредством блокирования связывания между потенциальным агентом и аналитом, имеющим сродство к потенциальному агенту. Массив может быть проанализирован для идентификации элементов, к которым присоединен агент для скрининга. Например, агент для скрининга может генерировать обнаруживаемый сигнал, создаваемый, например, благодаря присутствию метки на агенте для скрининга.
В некоторых примерах осуществления агент для скрининга модифицирует один или более элементов массива, на которых имеется потенциальный агент. Например, агент для скрининга может реагировать с потенциальным агентом, химически модифицируя потенциальный агент, с химической модификацией агента для скрининга или обоих этих агентов. Массив может быть проанализирован для идентификации элементов, в области которых произошла модификация. В частности, в результате модификации может генерироваться обнаруживаемый сигнал, например, с помощью метки, присоединенной к элементу, на котором находится потенциальный агент. Примеры модификаций включают добавление метки к элементу, на котором находится потенциальный агент; добавление аффинного компонента (т.е. компонента, обладающего сродством) к элементу, на котором находится потенциальный агент, при котором аффинный компонент связывается с меткой; удаление гасителя флуоресценции с элемента, на котором находится потенциальный агент, причем при удалении гасителя возникает люминесцентный сигнал; добавление донора или акцептора ферстеровского резонансного переноса энергии (англ. Forster resonance energy transfer, сокращенно FRET) к элементу, на котором находится потенциальный агент, причем это добавление изменяет наблюдаемую длину волны люминесценции, излучаемой элементом; удаление метки из элемента, на котором находится потенциальный агент; удаление аффинного компонента из элемента, на котором находится потенциальный агент, где аффинный компонент связывается с меткой; удаление донора или акцептора ферстеровского резонансного переноса энергии (FRET) из элемента, на котором находится потенциальный агент, причем это удаление изменяет наблюдаемую длину волны люминесценции, излучаемой элементом, или подобные модификации.
В некоторых примерах осуществления агент для скрининга реагирует с одним или более потенциальными агентами массива с образованием аналита. Массив может быть проанализирован для идентификации элементов, в которых был образован аналит. Например, аналит может генерировать обнаруживаемый сигнал. Примеры аналитов, которые могут быть получены, включают люминесцентную метку, лиганд для обнаруживаемого рецептора, субстрат, который используется ферментом для образования обнаруживаемого продукта, или подобные объекты.
В некоторых примерах осуществления агент для скрининга необязательно должен находиться в непосредственном контакте с библиотекой потенциальных агентов. Напротив, с агентом для скрининга может контактировать агент захвата, в результате чего образуется продукт захвата, и затем продукт захвата может быть приведен в контакт с группой потенциальных агентов. В другом примере осуществления агент захвата может контактировать с группой потенциальных агентов, в результате чего образуется продукт захвата, и затем продукт захвата может быть приведен в контакт с агентом для скрининга. Как показано в примерах осуществления, в которых применяют продукт захвата, агент для скрининга необязательно должен находиться в непосредственном контакте с потенциальным агентом для того, чтобы с помощью агента для скрининга можно было определить требуемую или предположительную структуру или функцию потенциального агента.
Способ, рассмотренный в настоящей работе, может дополнительно включать этап анализа массива потенциальных агентов во время или после контакта массива с агентом для скрининга для установления того, что по меньшей мере один потенциальный агент, находящийся в массиве, реагирует с агентом для скрининга. Твердая подложка, к которой присоединен массив, может находиться в любом из множества состояний, рассмотренных в настоящей работе. Например, твердая подложка может включать потенциальные агенты вместе с маркерами-нуклеиновыми кислотами, которые к ним присоединены. В альтернативном варианте твердая подложка может не включать маркеры-нуклеиновые кислоты, а, напротив, находиться в состоянии, которое достигается после удаления маркеров-нуклеиновых кислот из потенциальных агентов. При проведении этапа обнаружения нуклеиновые кислоты (например, маркеры и/или потенциальные агенты на основе нуклеиновых кислот) могут находиться в виде единственной молекулы или в виде совокупности молекул. В дополнительных примерах осуществления твердая подложка может не включать потенциальные агенты, а, напротив, находиться в состоянии, которое достигается после удаления потенциальных агентов. Соответственно, обнаружение может быть произведено во множестве моментов времени при выполнении способа, рассмотренного в настоящей работе.
При проведении этапа скрининга, рассмотренного в настоящей работе, может быть зарегистрирован любой из множества сигналов, которые включают, например, оптический сигнал, такой как поглощение излучения, эмиссия люминесценции, время жизни люминесценции, поляризация люминесценции или подобный сигнал; рассеяние Рэлея и/или Ми; магнитные свойства; электрические свойства; заряд; массу; радиоактивность или подобные свойства. Примеры меток, которые могут быть обнаружены при выполнении способа, рассмотренного в настоящей работе, включают, без ограничений, флуорофор, люминофор, хромофор, наночастицу (например, золото, серебро, углеродные нанотрубки), тяжелый атом, радиоактивный изотоп, массовую метку, зарядовую метку, спиновую метку, рецептор, лиганд или подобные объекты.
В частных примерах осуществления применяют методики визуализации (получения изображений). Изображение может быть получено с помощью устройств для обнаружения, известных в данной области техники. Их примеры включают микроскопы, предназначенные для получения оптического (светового) изображения, для проведения микроскопии способом светлого поля, микроскопии способом темного поля, фазово-контрастной визуализации, флуоресцентной визуализации, получения изображения в отраженном свете, интерференционного изображения или конфокального изображения. В частных примерах осуществления для обнаружения агента для скрининга (или другого аналита), обладающего флуоресценцией, например, за счет флуоресцентной метки, может быть использован флуоресцентный микроскоп (например, конфокальный флуоресцентный микроскоп). Изображения флуоресцентных образцов также могут быть получены с помощью устройства для секвенирования нуклеиновых кислот, имеющего оптические элементы для обнаружения флуоресценции, такие как устройства платформ Genome Analyzer®, MiSeq®, NextSeq® или HiSeqr®, внедренных в коммерческое применение Illumina, Inc. (San Diego, CA), или платформы секвенирования SOLiD™, внедренной в коммерческое применение Life Technologies (Carlsbad, CA). Другие оптические элементы для визуализации, которые могут быть использованы, включают элементы устройств для обнаружения, рассмотренных в следующих публикациях: Bentley с соавт., Nature 456:53-59 (2008), РСТ WO 91/06678, WO 04/018497 или WO 07/123744, патентах US 7057026, US 7329492, US 7211414, US 7315019 или US 7405281 и опубликованной патентной заявке US 2008/0108082; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки.
Изображение твердой подложки может быть получено при требуемом разрешении, например, достаточном для визуализации потенциальных агентов в массиве на твердой подложке. Соответственно, разрешение может быть достаточным для визуализации элементов массива, разделенных расстоянием, составляющим по меньшей мере 0,5 мкм, 1 мкм, 5 мкм, 10 мкм, 50 мкм, 100 мкм, 500 мкм, 1 мм или более. В альтернативном варианте или дополнительно разрешение может быть установлено на уровне, достаточном для визуализации элементов массива, разделенных расстоянием, составляющим не более 1 мм, 500 мкм, 100 мкм, 50 мкм, 10 мкм, 5 мкм, 1 мкм, 0,5 мкм или менее.
Способ согласно настоящему изобретению может включать этап секвенирования маркера-нуклеиновой кислоты для определения последовательности маркера, который присоединен к потенциальным агентам на твердой подложке (например, в массиве). Во множестве примеров осуществления потенциальные агенты расположены в массиве неупорядоченным образом, и реакция секвенирования предоставляет информацию для локализации каждого из различных потенциальных агентов. Секвенирование может быть выполнено на твердой подложке, к которой присоединен потенциальный агент и его маркер-нуклеиновая кислота. Таким образом, маркер-нуклеиновую кислоту не нужно удалять с твердой подложки для того, чтобы определить ее последовательность. В некоторых случаях потенциальные агенты могут быть необязательно удалены с твердой подложки перед проведением реакции секвенирования маркера-нуклеиновой кислоты.
В некоторых примерах осуществления потенциальный агент представляет собой нуклеиновую кислоту, или потенциальный агент присоединен к нуклеиновой кислоте, кодирующей его. В таких примерах осуществления для определения последовательности потенциального агента может быть использована методика секвенирования. Секвенирование может быть проведено на твердой подложке, к которой присоединен потенциальный агент. Потенциальный агент и его маркер-нуклеиновая кислота могут быть подвергнуты секвенированию совместно (например, в виде непрерывного прочтения секвенирования) или по отдельности (например, между секвенированием маркера и секвенированием потенциального агента может быть выполнен этап, не включающий секвенирования).
В способе согласно настоящему изобретению может быть использовано обнаружение с отсчетом времени или кинетический анализ массива потенциальных агентов. Таким образом, анализ массива может включать сбор сигналов от одного или более индивидуальных элементов массива в определенные моменты времени. В анализе с отсчетом времени или кинетическом анализе может быть произведено обнаружение любых из множества сигналов и меток, рассмотренных в настоящей работе.
Способ согласно настоящему изобретению может включать этап секвенирования маркера-нуклеиновой кислоты для определения последовательности маркера, который присоединен к потенциальному агенту массива. В некоторых примерах осуществления потенциальный агент представляет собой нуклеиновую кислоту, потенциальный агент кодируется нуклеиновой кислотой, к которой он присоединен (например, белковый потенциальный агент, присоединенный к мРНК или кДНК), или потенциальный агент содержит нуклеиновую кислоту (например, клетка, которая содержит нуклеиновые кислоты). Особенно подходящими для осуществления способа являются такие методики секвенирования, как методики секвенирования синтезом (англ. sequencing-by-synthesis, сокращенно SBS).
SBS может быть проведено следующим образом. Для инициирования первого цикла SBS, один или более меченых нуклеотидов, ДНК полимераза, праймеры SBS и т.д. могут быть приведены в контакт с одним или более элементами, находящимися на твердой подложке (например, тем элементом (элементами), где нуклеиновые кислоты присоединены к твердой подложке). Те элементы, в которых при достройке праймера SBS происходит встраивание меченого нуклеотида, могут быть обнаружены. Необязательно, нуклеотиды могут включать компонент для обратимой терминации, который прекращает дальнейшую достройку праймера после добавления к SBS праймеру нуклеотида. Например, к праймеру может быть таким образом добавлен нуклеотидный аналог, включающий обратимый терминатор, что последующее удлинение не может произойти без добавления деблокирующего агента, который удаляет терминатор. Таким образом, в тех примерах осуществления, в которых применяют обратимую терминацию, к твердой подложке может быть доставлен деблокирующий реагент (до или после обнаружения). Между различными этапами доставки могут быть выполнены этапы промывки. Затем цикл может быть повторен n раз для достройки праймера n нуклеотидами, что приводит к обнаружению последовательности, имеющей длину n. Примеры процедур SBS, системы для жидкостной динамики (флюидные системы) и платформы для обнаружения, которые могут быть легко адаптированы для применения композиции, установки или способа согласно настоящему изобретению, рассмотрены, например, в публикации Bentley с соавт., Nature 456:53-59 (2008), в международных патентных заявках WO 91/06678, WO 04/018497 или WO 07/123744, в патентах US 7057026, US 7329492, US 7211414, US 7315019 или US 7405281 и в опубликованной патентной заявке US 2008/0108082; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки.
Могут быть использованы другие процедуры секвенирования, в которых применяют циклические реакции, такие как пиросеквенирование. Пиросеквенирование позволяет обнаруживать высвобождение неорганического пирофосфата (PPi) по мере встраивания определенных нуклеотидов в строящуюся цепочку нуклеиновой кислоты (Ronaghi с соавт., Analytical Biochemistry 242(1), 84-9 (1996); Ronaghi, Genome Res. 11(1), 3-11 (2001); Ronaghi с соавт. Science 281(5375), 363 (1998); или патенты US 6210891, US 6258568 или US 6274320; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки). При проведении пиросеквенирования высвобождаемый PPi может быть обнаружен посредством его немедленного превращения в аденозинтрифосфат (АТФ) под действием АТФ-сульфурилазы, и уровень генерируемого АТФ может быть обнаружен по количеству фотонов, полученных при действии люциферазы. Таким образом, реакцию секвенирования можно отслеживать с помощью системы обнаружения люминесценции. При пиросеквенировании нет необходимости в использовании источников возбуждающего излучения, используемых в системах, основанных на обнаружении флуоресценции. Подходящие для установки, композиций или способов согласно настоящему изобретению флюидные системы, детекторы и процедуры, которые могут быть использованы для проведения пиросеквенирования, рассмотрены, например, в опубликованной международной патентной заявке WO 2012/058096, опубликованной патентной заявке US 2005/0191698 А1 или патентах US 7595883 или US 7244559; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки.
Также подходят для целей изобретения реакции секвенирования лигированием, которые включают, например, реакции, рассмотренные в публикации Shendure с соавт. Science 309:1728-1732 (2005), или в патентах US 5599675 или US 5750341; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки. Некоторые примеры осуществления могут включать процедуры секвенирования гибридизацией, рассмотренные, например, в публикациях Bains с соавт., Journal of Theoretical Biology 135(3), 303-7 (1988); Drmanac с соавт., Nature Biotechnology 16, 54-58 (1998); Fodor с соавт., Science 251(4995), 767-773 (1995) или в опубликованной международной патентной заявке WO 1989/10977; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки. И в процедурах секвенирования лигированием, и в процедурах секвенирования гибридизацией, присутствующие на сайтах массива нуклеиновые кислоты вводят в многократно повторяемые циклы доставки олигонуклеотидов и обнаружения. Композиции, установка или способы, рассмотренные в настоящей работе или в цитируемых в настоящем описании документах, могут быть легко адаптированы для секвенирования лигированием или секвенирования гибридизацией. Обычно олигонуклеотиды являются меченными флуоресцентными метками и могут быть обнаружены с помощью датчиков флуоресценции, аналогичных датчикам, рассмотренным в настоящем описании при рассмотрении процедур SBS или в цитируемых в настоящем описании документах.
В некоторых примерах осуществления секвенирования могут быть использованы способы, включающие мониторинг активности ДНК-полимеразы в режиме реального времени. Например, встраивание нуклеотидов может быть обнаружено в результате резонансного переноса энергии флуоресценции (FRET) между содержащей флуорофор полимеразой и нуклеотидами, меченными γ-фосфатом, или с помощью волноводов с нулевой модой (англ. zeromode waveguide, сокращено ZMW). Методики и реагенты для проведения секвенирования с использованием FRET рассмотрены, например, в публикациях Levene с соавт. Science 299, 682-686 (2003), Lundquist с соавт. Opt. Lett. 33, 1026-1028 (2008) и Korlach с соавт. Proc. Natl. Acad. Sci. USA 105, 1176-1181 (2008), содержание каждой из которых включено в настоящее описание посредством ссылки.
Некоторые примеры осуществления секвенирования включают обнаружение протона, высвобождаемого при встраивании нуклеотида в продукт достройки. Например, в секвенировании, основанном на обнаружении высвобожденных протонов, может быть использован электрический детектор и соответствующие методики, коммерчески предоставляемые Ion Torrent (Guilford, СТ, дочернее предприятие Thermo Fisher), или способы и системы секвенирования, рассмотренные в опубликованных патентных заявках US 2009/0026082 А1, US 2009/0127589 А1, US 2010/0137143 А1 или US 2010/0282617 А1; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки.
Способ согласно настоящему изобретению может дополнительно включать этап удаления одного или более потенциальных агентов с твердой подложки. В частных примерах осуществления потенциальные агенты могут быть удалены с элемента массива до проведения секвенирования маркера-нуклеиновой кислоты на элементе. Это может быть полезным, если потенциальный агент мешает выполнению секвенирования, или если необходимо защитить потенциальный агент от реагентов, применяемых в методике секвенирования. В некоторых примерах осуществления один или более потенциальных агентов, которые при скрининге были идентифицированы как находки, могут быть селективно извлечены из массива.
В некоторых примерах осуществления потенциальный агент может быть удален отщеплением закрепляющей структуры, которая соединяет его с твердой подложкой. Например, потенциальный агент может быть прикреплен к твердой подложке через маркер-нуклеиновую кислоту, к которой он присоединен. В тех случаях, в которых маркерная нуклеиновая кислота присоединена к подложке гибридизацией с комплементарной нуклеиновой кислотой, удаление может быть произведено денатурацией гибридизованного комплекса. В альтернативном варианте маркер-нуклеиновая кислота может включать сайт расщепления, расположенный между точкой присоединения к потенциальному агенту и последовательностью маркера. Как таковой, потенциальный агент может быть отделен от последовательности маркера при проведении реакции расщепления, направленной на сайт расщепления. В некоторых способах сайт расщепления может быть встроен в нуклеиновую кислоту при проведении этапа амплификации или модификации. Например, сайт расщепления может быть встроен в достраивающийся праймер при проведении этапа достройки (удлинения).
Примеры сайтов расщепления включают, без ограничений, фрагменты, которые могут подвергаться химическому, ферментативному или физическому воздействию, в результате которого происходит разрыв связи. Например, он может быть расположен в нуклеотидной последовательности, которую распознает эндонуклеаза. Подходящие эндонуклеазы и их последовательности распознавания хорошо известны в данной области техники и во многих случаях даже коммерчески доступны (например, их поставляет New England Biolabs, Beverley MA; ThermoFisher, Waltham, MA, или Sigma Aldrich, St. Louis, МО). Особенно подходящая эндонуклеаза разрывает связь в цепочке нуклеиновой кислоты на участке, который на 3' удален от сайта ее связывания в нуклеиновой кислоте; примеры таких эндонуклеаз включают рестрикционные эндонуклеазы типа II или типа IIS.
Фотолабильный фрагмент представляет собой подходящий сайт расщепления. Примеры фотолабильных фрагментов включают, без ограничений сложный (1-(4,5-диметокси-2-нитрофенил)этиловый) эфир (англ. (1-(4,5-dimethoxy-2-nitrophenyl)ethyl) ester, сокращенно DMNPE) и сложный (1-(2-нитрофенил)этиловый) эфир (англ. (1-(2-nitrophenyl)ethyl) ester, сокращено NPE). См. публикацию Meth. Enzymol. 291:307-347 (1998), содержание которой включено в настоящее описание посредством ссылки. Другие фотолабильные фрагменты, а также способы их синтеза и применения рассмотрены в опубликованной международной патентной заявке WO 91/06678 или опубликованной патентной заявке US 20100092957 А1, содержания которых включены в настоящее описание посредством ссылки. Фотолабильный фрагмент может быть с успехом использован для целенаправленного отщепления потенциального агента от индивидуального элемента. Для воздействия на индивидуальный элемент, к которому через фотолабильный фрагмент прикреплен конкретный потенциальный агент, может быть использовано излучение с пространственным разрешением (например, излучение лазера, сфокусированного источника света и/или с применением пространственного фильтра/маски). В результате конкретный потенциальный агент может быть селективно удален (в отличие от потенциальных агентов на других элементах того же массива).
В некоторых примерах осуществления сайт расщепления представляет собой участок с удаленными азотистыми основаниями или нуклеотид, содержащий основание, которое может быть удалено с образованием участка с удаленным азотистым основанием. Примеры нуклеотидов, которые могут быть удалены с образованием участка с удаленными азотистыми основаниями, включают урацил и 8-оксогуанин. В одном из частных примеров осуществления применяют реагент USER™, предоставляемый New England Biolabs. Другие примеры сайтов расщепления и способов, которые могут быть использованы для расщепления нуклеиновых кислот, рассмотрены, например, в патенте US 7960120, содержание которого включено в настоящее описание посредством ссылки.
Кроме того, настоящее изобретение относится к способу получения массива белков. Способ может включать следующие этапы: (а) предоставление библиотеки молекул кДНК, которые присоединены к твердой подложке; (b) амплификацию молекул кДНК на твердой подложке, приводящую к образованию кластеров, где каждый кластер включает множество копий конкретной молекулы кДНК из библиотеки; (с) транскрипцию множества копий на кластерах с целью получения множества молекул мРНК, присоединенных к каждому из кластеров; и (d) трансляцию молекул мРНК на кластерах с целью получения множества белков, присоединенных к каждому из кластеров.
Настоящее изобретение также относится к способу получения массива белков, где способ включает следующие этапы: (а) предоставление библиотеки молекул мРНК, причем находящиеся в библиотеке индивидуальные молекулы мРНК включают целевую последовательность и последовательность маркера; (b) создание из библиотеки первой подбиблиотеки, где первая подбиблиотека включает нуклеиновые кислоты, имеющие последовательности маркера или их комплементы, и нуклеиновые кислоты присоединены к индивидуальным элементам, находящимся на твердой подложке; (с) создание из библиотеки второй подбиблиотеки, где вторая подбиблиотека включает нуклеиновые кислоты, содержащие целевые последовательности и последовательности маркера или их комплементы; (d) приведение второй подбиблиотеки в контакт с первой подбиблиотекой и присоединение таким образом нуклеиновых кислот из второй подбиблиотеки к твердой подложке посредством гибридизации последовательностей маркера и их комплементов; и (е) трансляцию целевых последовательностей на твердой подложке с целью получения массива белков, присоединенных к индивидуальным элементам.
Библиотека из молекул геномной ДНК (гДНК), матричной (информационной) РНК (мРНК) или комплементарной ДНК (кДНК) может быть получена из одного или более организмов, которые экспрессируют один или более из интересующих белков. Например, библиотека может быть получена из организма, который предположительно экспрессирует требуемый белок или белок с требуемой активностью. Может быть выбран любой организм, известный в данной области техники, такой как организмы, рассмотренные в настоящей работе. Организм может представлять промышленный, терапевтический, диагностический или прогнозируемый интерес. Например, библиотека может быть получена из организма человека и подвергнута скринингу в целях прогноза или диагностики. В альтернативном варианте организм может предположительно экспрессировать ген, который оказывает терапевтический эффект или который имеет промышленное применение. В некоторых примерах осуществления библиотеку получают не из организма человека или из организма нечеловеческого происхождения.
В некоторых вариантах применения библиотека молекул гДНК, мРНК или кДНК включает варианты одного гена, которые экспрессированы в библиотеке рекомбинантных организмов. Такие варианты могут быть получены с помощью известных методик конструирования белка, примеры которых включают, без ограничений, методики, рассмотренные в публикациях Sambrook с соавт., Molecular Cloning: A Laboratory Manual, третье изд., Cold Spring Harbor Laboratory, New York (2001), и Ausubel с соавт., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Md. (1999), содержания которых включены в настоящее описание посредством ссылки. Например, варианты могут быть получены случайным мутагенезом всего гена или его части. Также могут быть использованы методики полупроизвольного (полуслучайного) мутагенеза.
Гены, экспрессируемые (например, в виде мРНК, кДНК или белка) в способе согласно настоящему изобретению, могут быть выбраны из группы, состоящей из антител, ферментов, рецепторов, киназ, фосфатаз, полимераз, протеаз, эстераз, ядерных гормональных рецепторов, ферментов, модифицирующих гистоны, и других объектов, примеры которых приведены в настоящей работе. Гены могут быть рекомбинантными, например, экспрессироваться в организме, отличающемся от природного источника гена, или могут иметь модификации, не встречающиеся в этом гене в природе. В частных примерах осуществления библиотека гДНК, мРНК, кДНК или белка может быть выделена из бактерий, дрожжей, насекомого, млекопитающего или другой клеточной системы, обычно применяемой для клонирования или экспрессии.
Библиотека из различных нуклеиновых кислот (например, гДНК, мРНК или кДНК) может быть сконструирована таким образом, чтобы каждый индивидуальный член библиотеки включал последовательность, кодирующую белок, и последовательность маркера. Последовательность маркера может быть определена к каждой последовательности, кодирующей белок, как неупорядоченным образом, так и систематическим образом (т.е. известный маркер a priori ассоциирован с известным вариантом). Например, маркеры могут быть введены неупорядоченным образом посредством встраивания случайных нуклеотидов в одно или более положений области маркера в процессе синтеза конструкции нуклеиновой кислоты, которая также кодирует белок. В другом примере популяция различных маркеров-нуклеиновых кислот может быть неупорядоченным образом связана с популяцией различных нуклеиновых кислот, кодирующих белок, таким образом, чтобы в среднем каждая нуклеиновая кислота, кодирующая белок, была связана с уникальной последовательностью маркера. В качестве примера систематического мечения можно отметить следующий: специфичный маркер может быть введен при синтезе в конструкцию нуклеиновой кислоты таким образом, что он a priori коррелирует с мутацией или вариацией в последовательности, кодирующей белок, которая находится в конструкции.
Способ, рассмотренный в настоящей работе, может включать этап получения первой и второй подбиблиотек из библиотеки. В некоторых примерах осуществления подбиблиотеки получают удалением из библиотеки частей или физическим разделением библиотеки. В общем, библиотека представляет собой жидкость, которая включает множество копий каждого потенциального агента. Может быть использован любой из множества потенциальных агентов, такой как гДНК, мРНК, кДНК, макроциклы, циклические пептиды, сплавленные молекулы (например, сплавлением нуклеиновая кислота-белок), дисплейные конструкции (например, пептиды на фаге) или белки или подобные агенты. Предполагается, что, как таковые, подбиблиотеки, полученные фракционированием или разделением жидкости, имеют приблизительно такой же состав. В некоторых случаях для создания множества копий может быть проведена амплификация библиотеки нуклеиновых кислот (например, библиотеки ДНК или РНК).
Библиотека гДНК, мРНК, кДНК или белков может быть присоединена к твердой подложке способами, рассмотренными в настоящей работе. В одном из частных примеров осуществления применяют библиотеку молекул мРНК, в которой каждая молекула мРНК включает последовательность, которая кодирует потенциальный агент, а также последовательность маркера. Первую подбиблиотеку получают способом, который включает приведение молекул мРНК из библиотеки в контакт с твердой подложкой с целью присоединения молекул мРНК к твердой подложке. Например, на твердой подложке могут находиться присоединенные праймеры нуклеиновых кислот, и молекулы мРНК могут присоединяться к твердой подложке посредством гибридизации с праймерами нуклеиновых кислот. В более специфичном примере молекулы мРНК могут включать последовательность, связывающую универсальный праймер, праймеры нуклеиновых кислот могут включать последовательность универсального праймера, и молекулы мРНК могут присоединяться к твердой подложке посредством гибридизации последовательности, связывающей универсальный праймер, с последовательностью универсального праймера. Затем присоединенные молекулы мРНК могут быть скопированы или амплифицированы на твердой подложке с образованием комплементов последовательностей маркера. Затем вторая подбиблиотека, получаемая из той же библиотеки, что и первая подбиблиотека, может быть приведена в контакт с ампликонами (или копиями) из первой подбиблиотеки, в результате чего нуклеиновые кислоты из второй подбиблиотеки присоединяются к твердой подложке посредством гибридизации последовательностей маркера и их комплементов. Таким образом происходит модификация твердой подложки, в результате которой она включает библиотеку молекул мРНК, которая доступна для проведения реакции скрининга или для трансляции с целью получения библиотеки белков, экспрессируемых молекулами мРНК второй подбиблиотеки.
В некоторых примерах осуществления либо первая подбиблиотека нуклеиновых кислот, либо вторая подбиблиотека нуклеиновых кислот может быть скопирована или амплифицирована в растворе. При этом амплифицированная или скопированная подбиблиотека будет включать комплементарные последовательности маркера, которые могут быть гибридизованы с последовательностями маркера, находящимися в другой подбиблиотеке. Любая из подбиблиотек может быть присоединена к твердой подложке, и другая подбиблиотека может быть гибридизована с образованием твердой подложки, включающей библиотеку молекул нуклеиновых кислот, доступную для проведения реакции скрининга, реакции транскрипции с образованием мРНК и/или реакции трансляции с образованием библиотеки белков.
В тех примерах осуществления, в которых применяют библиотеку мРНК, первая подбиблиотека может быть получена способом, который включает обратную транскрипцию некоторых или всех индивидуальных молекул мРНК, находящихся в библиотеке, с образованием кДНК. Обратная транскрипция может быть проведена в растворе или на твердой подложке. Полученные молекулы кДНК затем могут быть подвергнуты амплификации в растворе или на твердой подложке. Таким образом, могут быть получены молекул кДНК, имеющие комплементы последовательностей маркера, которые находились в библиотеке. В некоторых случаях молекулы кДНК могут включать не более чем часть молекул мРНК, например, часть, которая экспрессирует конкретный домен или подгруппу доменов мультимерного белка.
Способ согласно изобретению может включать этап транскрипции кДНК в мРНК. Транскрипция может быть проведена с использованием известных смесей, таких как смеси, рассмотренные в публикациях Sambrook с соавт., Molecular Cloning: A Laboratory Manual, третье изд., Cold Spring Harbor Laboratory, New York (2001), и Ansubel с соавт., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Md. (1999), содержание которых включено в настоящее описание посредством ссылки, или коммерчески доступные смеси. В частных примерах осуществления проводят транскрипцию присоединенных к подложке молекул кДНК. Полученные в результате реакции транскрипции мРНК могут быть присоединены к элементам, на которых они были получены. Например, присоединение может быть произведено с помощью методик, рассмотренных ниже в Примере II. Также может быть полезно присоединять белки к молекулам ДНК, которые кодируют эти белки (например, непосредственным присоединением или совместной локализацией в каплях эмульсии). Белки также могут быть присоединены к молекулам ДНК, которые кодируют эти белки (например, в виде массива белков, программируемого нуклеиновыми кислотами, англ. nucleic acid programmable protein array, сокращенно NAPPA).
Способ согласно изобретению может включать этап трансляции мРНК в белок. Трансляция может быть проведена с использованием известных смесей, таких как смеси, рассмотренные в публикациях Sambrook с соавт., Molecular Cloning: A Laboratory Manual, третье изд., Cold Spring Harbor Laboratory, New York (2001), и Ansubel с соавт., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Md. (1999), содержание которых включено в настоящее описание посредством ссылки, или коммерчески доступные смеси. В частных примерах осуществления проводят трансляцию присоединенных к подложке молекул мРНК. Полученные в результате реакции трансляции белки могут быть присоединены к элементам, на которых они были получены. Например, присоединение может быть произведено с помощью методик, рассмотренных ниже в Примере II.
Способы, представленные в настоящей работе для получения массива белков, могут быть применены в способах скрининга белков. Способ может включать следующие этапы: (i) получение массива белков; (ii) приведение массива белков в контакт с агентом для скрининга, в результате чего один или более содержащихся в массиве белков реагируют с агентом для скрининга (или раздражителем); и (iii) анализ массива белков во время или после контакта с агентом для скрининга (или раздражителем) для определения того, что по меньшей мере один белок в массиве реагирует с агентом для скрининга (или раздражителем).
В частных примерах осуществления агент для скрининга реагирует с одним или более белками, связываясь с одним или более белками или блокируя связывания между белком и аналитом, имеющим сродство к белку. Исследование массива может включать обнаружение агента для скрининга, который связан с одним или более белками. Например, агент для скрининга может быть люминесцентным веществом, и обнаружение может включать обнаружение люминесценции в массиве.
В некоторых примерах осуществления агент для скрининга реагирует с одним или более белками, химически модифицируя один или более белков. В этом случае исследование массива может включать обнаружение одного или более модифицированных белков. Например, один или более модифицированных белков могут проявлять люминесценцию, и исследование может включать обнаружение люминесценции в массиве.
В некоторых примерах осуществления агент для скрининга реагирует с одним или более белками с образованием анализируемого продукта. В этом случае исследование массива включает обнаружение анализируемого продукта. Например, анализируемый продукт может проявлять люминесценцию, и исследование может включать обнаружение люминесценции в массиве.
Как было отмечено выше, исследование массива может включать регистрацию в определенные моменты времени сигналов от одного или более индивидуальных элементов массива.
Последовательности маркера, которые представляют собой часть молекул гДНК, кДНК или мРНК, могут быть подвергнуты секвенированию способами, рассмотренными в настоящей работе или известными в данной области техники. Например, реакция секвенирования может быть проведена на той же твердой подложке, на которой проводили, проводят или будут проводить скрининг. Таким образом, способ, рассмотренный в настоящей работе, может включать этап секвенирования последовательностей маркера или их комплементов на твердой подложке, что позволяет определять локализацию последовательностей маркера или их комплементов на индивидуальных элементах твердой подложки. Такие способы могут дополнительно включать этап идентификации в массиве по меньшей мере одного белка, который реагирует с агентом для скрининга, на основании последовательности маркера, который присоединен к по меньшей мере одному белку.
Способ, рассмотренный в настоящей работе, может дополнительно включать этап секвенирования перспективных гДНК, кДНК или мРНК на твердой подложке. Таким образом, на твердой подложке могут быть проведены одна или более реакций секвенирования для определения идентификационных данных последовательности маркера и/или идентификационных данных потенциальной последовательности, с определением, таким образом, локализации нужных потенциальных агентов на индивидуальных элементах твердой подложки.
В некоторых случаях длина гДНК, кДНК или мРНК может превышать среднюю длину прочтения в способе секвенирования. В таких случаях перспективные нуклеиновые кислоты могут быть подвергнуты секвенированию в несколько циклов (проходов), в каждом из которых применяют отдельный праймер. Например, в первом цикле секвенирования может быть использован праймер, который гибридизуется с универсальной инициирующей (примирующей) последовательностью, которую обычно применяют в методиках секвенирования и платформах, рассмотренных в настоящей работе или в цитируемых документах. Следующий цикл секвенирования может быть проведен с использованием второго праймера секвенирования, который гибридизуется далее по ходу транскрипции относительно локализации первого, уже гибридизованного праймера секвенирования. Праймеры могут быть пространственно разнесены в соответствии с ожидаемой длиной прочтения в цикле секвенирования таким образом, чтобы прочтения в матричной нуклеиновой кислоте перекрывались или стыковались. Для того, чтобы достаточное количество праймеров секвенирования перекрывало требуемую область (области) перспективной нуклеиновой кислоты, могут быть проведены несколько циклов секвенирования.
Если длина перспективной нуклеиновой кислоты превышает среднюю длину прочтения в способе секвенирования, то другой вариант состоит в применении кассетного подхода. При использовании кассетного подхода, в перспективных нуклеиновых кислотах мутации или модификации подвергают небольшую область или домен нуклеиновой кислоты. Длина кассеты (группы сцепленных локусов) может быть выбрана достаточно небольшой для прочтения за один цикл секвенирования. Если область перспективной нуклеиновой кислоты, находящаяся выше (против хода транскрипции) кассеты, одинакова во всех членах библиотеки, то она может успешно служить универсальным сайтом примирования, и праймер секвенирования может гибридизоваться с этой областью, обеспечивая локализованное секвенирование на кассете.
В некоторых примерах осуществления перспективные гДНК, кДНК или мРНК секвенировать не нужно. Напротив, последовательность маркера может быть a priori ассоциирована с известной последовательностью перспективной нуклеиновой кислоты таким образом, что для идентификации перспективной нуклеиновой кислоты достаточно маркера секвенирования. Сведения о присутствии маркера а priori на конкретном элементе могут быть сопоставлены с сигналами, считываемыми с элемента при проведении этапа скрининга для идентификации перспективной нуклеиновой кислоты, белка, который она кодирует, или для идентификации свойств белка.
В некоторых примерах осуществления перспективная нуклеиновая кислота (например, гДНК, кДНК или мРНК) или белок может быть удален отщеплением закрепляющей структуры, которая присоединяет нуклеиновую кислоту или белок к твердой подложке. Например, такие потенциальные агенты могут быть прикреплены к твердой подложке через последовательность маркера. Сайт расщепления может быть расположен между точкой присоединения к потенциальному агенту и последовательностью маркера. Как таковой, потенциальный агент может быть отделен от последовательности маркера при проведении реакции расщепления, направленной на сайт расщепления. Примеры сайтов расщепления включают, без ограничений, сайты, рассмотренные в настоящей работе или известные в данной области техники.
Соответственно, способ согласно настоящему изобретению может включать этап селективного удаления молекул гДНК, кДНК, мРНК или белка, которые были присоединены к одному или более элементам массива. Селективное удаление может включать опосредуемое светом расщепление фотолабильной связи, которая присоединяет молекулы к элементам, например, с помощью реагентов и способов, рассмотренных в настоящей работе.
Настоящее изобретение относится к массиву, который включает: (а) твердую подложку; (b) библиотеку из различных молекул кДНК, присоединенных к твердой подложке, где каждая из различных молекул «ДНК присоединена к индивидуальному элементу на твердой подложке, и где каждый элемент включает множество копий конкретной молекулы кДНК; (с) молекулы мРНК, присоединенные к молекулам кДНК, где каждая молекула кДНК комплементарна соответствующей присоединенной молекуле мРНК; и (d) молекулы белка, присоединенные к молекулам мРНК, где каждая молекула белка кодируется соответствующей присоединенной молекулой мРНК.
Кроме того, настоящее изобретение относится к массиву, который включает: (а) библиотеку молекул мРНК, причем индивидуальные молекулы мРНК, содержащиеся в библиотеке, включают целевую последовательность и последовательность маркера; (b) твердую подложку, включающую нуклеиновые кислоты, содержащие комплементы последовательностей маркера, причем нуклеиновые кислоты присоединены к индивидуальным элементам, находящимся на твердой подложке, где последовательности маркера индивидуальных молекул мРНК гибридизованы с соответствующими комплементарными последовательностями маркера на индивидуальных элементах, находящихся на твердой подложке, и где белки, полученные трансляцией молекул мРНК, присоединены к соответствующим молекулам мРНК.
Массив согласно настоящему изобретению может включать компоненты, полученные при проведении одного или более этапов способа, рассмотренного в настоящей работе. Например, нуклеиновые кислоты, такие как гДНК, кДНК или мРНК, могут быть присоединены к твердой подложке в соответствии со способами, рассмотренными в настоящей работе. Аналогично, белки могут быть присоединены к твердой подложке в соответствии со способами, рассмотренными в настоящей работе. В частных примерах осуществления кДНК может быть присоединена к твердой подложке, кодируемая мРНК может быть присоединена к кДНК, и кодируемый белок может быть присоединен к мРНК, как указано в Примерах II и III. Как показано в этих примерах, присоединение через кДНК необязательно; вместо этого мРНК может быть присоединена к твердой подложке (например, посредством гибридизации с комплементарным маркером или другими способами присоединения), и кодируемый белок может быть присоединен к мРНК.
Молекула мРНК необязательно может быть присоединена к кодирующей ее молекуле кДНК через комплекс, образованный с РНК-полимеразой. Присоединение может быть осуществлено через образование ковалентных поперечных связей между входящими в комплекс кДНК, мРНК и РНК-полимеразой. Аналогично, молекула белка может быть присоединена к кодирующей ее мРНК через комплекс, образованный с рибосомой. Присоединение может быть осуществлено через образование ковалентных поперечных связей между входящими в комплекс мРНК, белком и рибосомой.
В массиве согласно настоящему изобретению могут находиться любые из множества агентов для скрининга, меток или продуктов этапа скрининга, рассмотренных в настоящей работе. Например, элементы, на которых локализованы белки, могут быть помечены люминесцентными метками, необязательно, путем специфичного нековалентного связывания люминесцентной молекулы (такой как агент для скрининга) с белками или посредством ковалентного присоединения люминесцентных частиц к белкам. Мечение всех элементов необязательно. Напротив, подгруппа элементов, содержащих белки с требуемой или выбранной активностью, может быть селективно помечена, в то время как другие элементы остаются немечеными. Например, в зависимости от содержимого библиотеки и типа скрининга может быть помечено менее 50%, 25%, 10%, 5% или 1% элементов.
Любые из множества потенциальных агентов и/или маркеров-нуклеиновых кислот, рассмотренных в настоящей работе, могут находиться в массиве согласно настоящему изобретению. Количество различных объектов в массиве, плотность элементов, содержащих объекты, в массиве или количество каждого вида объектов, присоединенных к конкретному элементу, может находиться в диапазоне, рассмотренном в настоящей работе при раскрытии способов получения и использования массивов.
Настоящее изобретение также относится к способу скрининга клеток. Способ может включать следующие этапы: (а) предоставление множества различных клеток, где каждая из различных клеток включает маркер-нуклеиновую кислоту, содержащую последовательность маркера; (b) приведение смеси различных клеток в контакт с твердой подложкой, приводящий к образованию массива клеток, присоединенных к твердой подложке; (с) скрининг массива клеток на твердой подложке для определения по меньшей мере одной оптической характеристики, причем реакция скрининга включает обнаружение индивидуальных клеток, которые присоединены к твердой подложке; (d) секвенирование последовательностей маркера маркеров-нуклеиновых кислот, которые присоединены к твердой подложке; и (е) идентификацию по меньшей мере одной клетки в массиве как клетки-кандидата на основании оптической характеристики и последовательности маркера клетки-кандидата.
В частных примерах осуществления в способе, рассмотренном в настоящей работе, в качестве потенциальных агентов применяют клетки. Клетки могут представлять собой природные клетки, выделенные из многоклеточного организма, природные клетки, которые включают одноклеточные организмы, генетически сконструированные клетки, полученные из многоклеточного организма, или генетически сконструированные одноклеточные организмы. Клетки, применяемые в способе или композиции, рассмотренных в настоящей работе, могут быть получены из природного источника, или они могут быть получены из культуры ex vivo.
Особенно подходящими являются клетки, которые могут быть скопированы, подвергнуты культивированию или размножены ex vivo. Например, до или после проведения этапа скрининга может оказаться полезным создание одной или более копий клетки-кандидата. Таким образом, клетка, идентифицированная при скрининге как находка (или клон клетки), может быть выделена из предварительно созданной линии или снята с твердой подложки, применяемой в скрининге. Выделенная клетка может быть использована или обработана в дальнейшем, например, для получения более полной характеристики клетки или для использования клетки в терапевтической процедуре.
В тех примерах осуществления, в которых применяют генетически модифицированные клетки, генетическая модификация может представлять собой любую из множества модификаций, известных в данной области техники, примеры которых включают модификации, приводящие к экспрессии не встречающегося в природе рекомбинантного белка, экспрессии мутантного рекомбинантного белка, делеции всей или части кодирующей последовательности встречающегося в природе белка, ингибированию экспрессии встречающегося в природе белка, усилению экспрессии встречающегося в природе белка, получению не встречающегося в природе аналита или ингибированию выработки природного аналита. Например, последовательности, кодирующие один или более генов в библиотеке клеток-кандидатов, могут содержать точечные мутации, делеции (например, удаление целой последовательности, кодирующей белок, домена или другой части белка) или инсерции (например, химеры).
Клетки-кандидаты, находящиеся в библиотеке, могут включать маркеры-нуклеиновые кислоты. Некоторые примеры способов мечения клеток рассмотрены в Примере IV и/или ниже.
В некоторых примерах осуществления маркеры-нуклеиновые кислоты могут быть ковалентно присоединены к поверхности клеток. В целом, применяют способы мечения каждой клетки в библиотеке только одной последовательностью маркера-нуклеиновой кислоты (несмотря на то, что в каждой клетке или на каждой клетке может находиться множество молекул нуклеиновых кислот, каждая из которых имеет копию одной и той же последовательности маркера). Например, клетки могут быть выделены физически таким образом, что каждая клетка может по отдельности реагировать с молекулой маркера-нуклеиновой кислоты. Способы физического разделения клеток включают, например, отделение каждой клетки и помещение в индивидуальную емкость, в лунку на микропланшете, на элемент массива, гранулу, каплю жидкости, находящуюся в устройстве для манипуляций с каплями, каплю жидкости в эмульсии или пузырек.
Особенно подходящие способы создания капель, к которым могут быть доставлены маркеры-нуклеиновые кислоты, включают, например, способы, внедренные в коммерческое использование RainDance Technologies (Billerica, MA) или рассмотренные в патентах US 9017623 или US 8857462, содержание которых включено в настоящее описание посредством ссылки. Дополнительные способы создания и присоединения маркеров к каплям внедрены в коммерческое использование 10Х Genomics или рассмотрены в опубликованных патентных заявках US 2014/0155295 А1, US 2014/0206554 А1, US 2014/0227684 А1 или US 2014/0378322 А1, содержание которых включено в настоящее описание посредством ссылки. Эти способы могут быть модифицированы следующим образом: клетки (или другие потенциальные агенты, рассмотренные в настоящей работе) помещают в индивидуальные капли, и капли с содержимым взаимодействуют с жидкостями, которые содержат маркеры-нуклеиновые кислоты в таком количестве, чтобы в каждой капле содержался один вид маркера-нуклеиновой кислоты и один вид потенциального агента. Разумеется, в индивидуальной капле может находиться множество копий одного вида нуклеиновой кислоты или множество копий одного вида потенциального агента. В некоторых примерах осуществления маркеры-нуклеиновые кислоты присоединены к гранулам, которые доставляют к индивидуальным каплям. Маркеры-нуклеиновые кислоты могут присоединяться к поверхности клеток химическими способами присоединения, рассмотренными в настоящей работе, например, в Примере IV.
Особенно подходящим устройством для манипуляций с каплями, которое может быть использовано для разделения клеток (или других потенциальных агентов), например, для мечения клеток, является исполнительное устройство для манипуляций с каплями, рассмотренное, например, в патенте US 8637242, в патенте US 6911132, озаглавленном "Apparatus for Manipulating Droplets by Electrowetting-Based Techniques (Устройство для манипуляций с каплями с помощью методик, основанных на эффекте электрохимического смачивания)", выданном 28 июня 2005 г.; в патентной публикации US 20060194331, Pamula с соавт., озаглавленной "Apparatuses and Methods for Manipulating Droplets on a Printed Circuit Board (Устройства и способы манипуляций с каплями на печатной монтажной плате)", опубликованной 31 августа 2006 г.; в международной патентной заявке WO/2007/120241, Pollack с соавт., озаглавленной "Droplet-Based Biochemistry (Биохимия на капельной основе)", опубликованной 25 октября 2007 г.; в патенте US 6773566, Shenderov, озаглавленном "Electrostatic Actuators for Fluidics and Methods for Using Same (Электростатические исполнительные механизмы для струйных систем и способы их применения)", выданном 10 августа 2004 г.; в патенте US 6565727, Shenderov, озаглавленном "Actuators for Fluidics Without Moving Parts (Исполнительные механизмы для струйных систем, не имеющие движущихся частей)", выданном 20 мая 2003 г.; в патентной публикации US 20030205632, Kim с соавт., озаглавленной "Electrowetting-driven Micropumping (Микронасосы с приводом на основе электрохимического смачивания)", опубликованной 6 ноября 2003 г.; в патентной публикации US 20060164490, Kim с соавт., озаглавленной "Method and Apparatus for Promoting the Complete Transfer of Liquid Drops from a Nozzle (Способ и устройство для полного выпуска капель жидкости из сопла)", опубликованной 27 июля 2006 г.; в патентной публикации US 20070023292, Kim с соавт., озаглавленной "Small Object Moving on Printed Circuit Board (Перемещение мелких объектов по печатной монтажной плате)", опубликованной 1 февраля 2007 г.; в патентной публикации US 20090283407, Shah с соавт., озаглавленной "Method for Using Magnetic Particles in Droplet Fluidics (Способ применения магнитных частиц в капельно-жидкостной методике)", опубликованная 19 ноября 2009 г.; в патентной публикации US 20100096266, Kim с соавт., озаглавленной "Method and Apparatus for Real-time Feedback Control of Electrical Manipulation of Droplets on Chip (Способ и устройство для контроля обратной связи электрических манипуляций с каплями на чипе в режиме реального времени)", опубликованной 22 апреля 2010 г.; в патенте US 7547380, Velev, озаглавленном "Droplet Transportation Devices and Methods Having a Liquid Surface (Способы и устройства для транспортировки капель, имеющие жидкостную поверхность)", выданном 16 июня 2009 г.; в патенте US 7163612, Sterling с соавт., озаглавленном "Method, Apparatus and Article for Fluidic Control via Electrowetting, for Chemical, Biochemical and Biological Assays and the Like (Способ, устройство и изделие для контроля жидкости с применением электрохимического смачивания для химических, биохимических и биологических анализов и подобных методик)", выданном 16 января 2007 г.; в патенте US 7641779, Becker с соавт., озаглавленном "Method and Apparatus for Programmable Fluidic Processing (Способ и устройство для программируемой обработки жидкостей)", выданном 5 января 2010 г.; в патенте US 6977033, Becker с соавт., озаглавленном "Method and Apparatus for Programmable Fluidic Processing (Способ и устройство для программируемой обработки жидкостей)", выданном 20 декабря 2005 г.; в патенте US 7328979, Deere с соавт., озаглавленном "System for Manipulation of a Body of Fluid (Система для манипуляций с объемом жидкости)", выданном 12 февраля 2008 г.; в патентной публикации US 20060039823, Yamakawa с соавт., озаглавленной "Chemical Analysis Apparatus (Устройство для химического анализа)", опубликованной 23 февраля 2006 г.; в международной патентной заявке WO/2009/003184, Wu, озаглавленной "Digital Fluidics Based Apparatus for Heat-exchanging Chemical Processes (Устройство на основе цифровой жидкодинамической технологии для теплообменных химических способов)", опубликованной 31 декабря 2008 г.; в патентной публикации US 20090192044, Fouillet с соавт., озаглавленной "Electrode Addressing Method (Способ, относящийся к электроду)", опубликованной 30 июля 2009 г.; в патенте US 7052244, Fouillet с соавт., озаглавленном "Device for Displacement of Small Liquid Volumes Along a Micro-catenary Line by Electrostatic Forces (Устройство для перемещения небольших объемов жидкости вдоль микроцепной линии под действием электростатических сил)", выданном 30 мая 2006 г.; в патентной публикации US 20080124252, Marchand с соавт., озаглавленной "Droplet Microreactor (Капельный микрореактор)", опубликованной 29 мая 2008 г.; в патентной публикации US 20090321262, Adachi с соавт., озаглавленной "Liquid Transfer Device (Устройство для перемещения жидкости)", опубликованной 31 декабря 2009 г.; в патентной публикации US 20050179746, Roux с соавт., озаглавленной "Device for Controlling the Displacement of a Drop Between Two or Several Solid Substrates (Устройство для регулирования перемещения капли между двумя или несколькими твердыми подложками)", опубликованной 18 августа 2005 г.; и в публикации Dhindsa с соавт., "Virtual Electrowetting Channels: Electronic Liquid Transport with Continuous Channel Functionality (Виртуальные каналы электросмачивания: Электронный транспорт жидкости при непрерывном функционировании канала)", Lab. Chip, 10:832-836 (2010). Содержание каждой из приведенных выше публикаций полностью включено в настоящее описание посредством ссылки.
В частных примерах осуществления клетки, содержащиеся в библиотеке, могут быть генетически модифицированы для включения маркера-нуклеиновой кислоты. Например, индивидуальные клетки популяции могут нести плазмиду, кодирующую последовательность маркера, или геном индивидуальных клеток может быть модифицирован так, чтобы он включал последовательность маркера. В некоторых случаях последовательность маркера кодируется в конструкции нуклеиновой кислоты, которая также включает генетический вариант, который должен быть подвернут скринингу способом, рассмотренным в настоящей работе.
Библиотека различных клеток может быть сконструирована таким образом, чтобы каждая индивидуальная клетка приобретала последовательность маркера, присоединяемую неупорядоченным образом, или каждая клетка может быть модифицирована так, чтобы она включала известную последовательность маркера. Например, может быть проведено случайное (неупорядоченное) мечение посредством встраивания случайных нуклеотидов в одно или более положений маркерной области во время синтеза конструкции нуклеиновой кислоты, которая также будет кодировать генетический вариант, предназначенный для скрининга. В другом примере популяция различных маркеров-нуклеиновых кислот может быть неупорядоченным образом присоединена к популяции различных вариантов кодирующих нуклеиновых кислот таким образом, чтобы в среднем каждый вариант нуклеиновой кислоты был сшит с уникальной последовательностью маркера. Конструкции затем могут быть присоединены к клеткам, находящимся в библиотеке. Аналогично, популяция различных маркеров-нуклеиновых кислот может быть ковалентно присоединена к популяции различных клеток таким образом, чтобы в среднем каждая клетка была присоединена к уникальной последовательности маркера.
В других примерах осуществления библиотека различных клеток может быть сконструирована таким образом, чтобы к каждой индивидуальной клетке был присоединен известный маркер, который a priori ассоциирован с известной клеткой. Как пример мечения a priori, специфичный маркер может быть введен при синтезе в конструкцию нуклеиновой кислоты таким образом, чтобы он коррелировал с мутацией или вариантом в такой конструкции. В некоторых примерах осуществления клетки физически отделяют друг от друга, и нуклеиновые кислоты с известными последовательностями маркера приводят в контакт с клетками, что приводит к образованию ковалентного соединения маркера одного типа с одной клеткой.
В одном из определенных примеров осуществления маркер-нуклеиновая кислота может быть присоединена к грануле, и гранула может связываться с клеткой. Необязательно, гранула может быть присоединена к антителу, имеющему специфичное сродство к связыванию, или к клетке. Однако для присоединения гранул к клеткам могут быть использованы другие методики присоединения, включающие, например, методики, рассмотренные в настоящем описании для присоединения нуклеиновых кислот к потенциальным агентам или твердым подложкам.
В некоторых примерах осуществления маркер-нуклеиновая кислота может быть присоединена к клетке посредством ковалентного присоединения маркера-нуклеиновой кислоты к липиду плазматической мембраны или жирной кислоте клетки. В альтернативном варианте маркер-нуклеиновая кислота может быть присоединена к клетке посредством ковалентного присоединения к белку, находящемуся в липиде плазматической мембраны клетки. В примере, альтернативном ковалентному присоединению, маркер-нуклеиновая кислота может включать рецептор, который связывает лиганд, находящийся на клеточной поверхности, или маркер-нуклеиновая кислота может включать лиганд, который связывает рецептор, находящийся на клеточной поверхности. Примеры способов присоединения представлены ниже в Примере IV.
Библиотека клеток может быть присоединена к массиву одним или более способами, рассмотренными в настоящей работе для присоединения других типов потенциальных агентов к твердой подложке. Например, твердая подложка может включать праймеры нуклеиновых кислот, и клетки могут прикрепляться к твердой подложке посредством гибридизации маркеров-нуклеиновых кислот с праймерами нуклеиновых кислот. В некоторых случаях маркеры-нуклеиновые кислоты могут включать последовательность, связывающую универсальный праймер, праймеры нуклеиновых кислот могут включать последовательность универсального праймера, и потенциальные агенты могут присоединяться к твердой подложке посредством гибридизации последовательности, связывающей универсальный праймер, с последовательностью универсального праймера.
Способ согласно настоящему изобретению может включать этап достройки праймеров, присоединенных к твердой подложке, с которыми гибридизованы нуклеиновые кислоты, такие как маркеры-нуклеиновые кислоты. Получаемые достроенные праймеры включают последовательности маркера и другие последовательности из нуклеиновых кислот (но в комплементарной форме). Таким образом, достроенные праймеры представляют собой пространственно меченые версии нуклеиновых кислот, находящихся в потенциальных агентах. Следует понимать, что элементы последовательности, не являющиеся последовательностями маркера, которые находятся в нуклеиновой кислоте, также могут быть включены в достроенные праймеры. Такие элементы включают, например, сайты связывания праймера, сайты расщепления, последовательности других маркеров (например, маркеров идентификации образца), последовательности захвата, сайты распознавания белков, связывающих нуклеиновые кислоты, или ферменты нуклеиновых кислот или подобные элементы.
Достройка праймеров может быть произведена способами согласно изобретению или способами, известными в данной области техники и предназначенными для амплификации нуклеиновых кислот или секвенирования нуклеиновых кислот. В частных примерах осуществления один или более нуклеотидов могут быть добавлены к 3'-концу праймера, например, при полимеразном катализе (например, под действием ДНК-полимеразы, РНК-полимеразы или обратной транскриптазы). Для добавления одного или более нуклеотида к 3'- или 5'-концу праймера могут быть использованы химические или ферментативные способы. Один или более олигонуклеотидов могут быть добавлены к 3'- или 5'-концу праймера, например, химическими или ферментативными (например, при лигазном катализе) способами. Праймер может быть достроен в соответствии с матрицей, так чтобы продукт достройки был комплементарен матричной нуклеиновой кислоте, гибридизованной с праймером. В некоторых примерах осуществления ДНК праймер достраивается обратной транскриптазой с использованием РНК-матрицы, что приводит к получению кДНК. Таким образом, достроенный зонд, получаемый в способе, рассмотренном в настоящей работе, может представлять собой молекулу ДНК, полученную обратной транскрипцией. Примеры способов достройки нуклеиновых кислот представлены в опубликованной патентной заявке US 2005/0037393 А1 или в патентах US 8288103 или US 8486625; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки.
При достройке может быть скопирована вся нуклеиновая кислота или часть нуклеиновой кислоты, гибридизованная с праймером. Например, достроенный зонд может включать по меньшей мере 1, 2, 5, 10, 25, 50, 100, 200, 500, 1000 или более нуклеотидов, скопированных с нуклеиновой кислоты. Длину продукта достройки можно регулировать, например, применяя в реакции достройки нуклеотиды с обратимой терминацией и выполняя ограниченное количество циклов достройки. Циклы могут быть выполнены в соответствии с примерами методик SBS, и применение меченых нуклеотидов необязательно. Соответственно, достроенный праймер, полученный способом, рассмотренным в настоящей работе, может включать не более 1000, 500, 200, 100, 50, 25, 10, 5, 2 или 1 нуклеотида, которые скопированы с нуклеиновой кислоты. Разумеется, достроенные зонды могут иметь любую длину, соответствующую представленным выше диапазонам, или выходящую за пределы представленных выше диапазонов.
Библиотека клеток, присоединенная к массиву, может быть подвергнута скринингу способами, рассмотренными в настоящей работе при описании скрининга других потенциальных агентов. В частных примерах осуществления скрининг массива клеток может включать этап обработки клеток агентом для скрининга. В результате агент для скрининга может связываться с по меньшей мере одной клеткой-кандидатом массива. Необязательно, агент для скрининга представляет собой люминесцентное вещество, и реакцию скрининга проводят с обнаружением люминесценции по меньшей мере одной клетки-кандидата.
В некоторых примерах осуществления агент для скрининга, нанесенный на массив, модифицирует по меньшей мере одну клетку-кандидата, содержащуюся в массиве. Например, агент для скрининга может стимулировать по меньшей мере одну клетку-кандидата, содержащуюся в массиве. В альтернативном варианте агент для скрининга может ингибировать или даже убивать по меньшей мере одну клетку-кандидата, содержащуюся в массиве.
Агент для скрининга, который контактирует с массивом клеток, может снижать или повышать люминесценцию по меньшей мере одной клетки-кандидата, и реакция скрининга может включать этапы обнаружения люминесценции по меньшей мере одной клетки-кандидата.
Как указано в настоящей работе, этап обнаружения может включать кинетические измерения или измерения с временным разрешением. Например, исследование массива клеток может включать этап сбора сигналов, поступающих от одного или более индивидуальных элементов массива, в определенные моменты времени.
Маркеры-нуклеиновые кислоты, присоединенные к клеткам или находящиеся в клетках, могут быть подвергнуты секвенированию при осуществлении способа, рассмотренного в настоящей работе. Нуклеиновые кислоты, присоединенные к клеткам, могут быть подвергнуты секвенированию на клетках. В альтернативном варианте нуклеиновые кислоты могут быть перенесены на твердую подложку, например, посредством достройки праймера способами, рассмотренными, например, в Примере IV, и на твердой подложке может быть произведено секвенирование областей достроенных праймеров, которые содержат последовательность маркера (или ее комплемент). Способы согласно настоящему изобретению для секвенирования нуклеиновых кислот, присоединенных к твердой подложке, могут быть использованы для секвенирования маркеров-нуклеиновых кислот, которые присоединены к клеткам или к элементам, находящимся вблизи клеток, из которых получены маркеры-нуклеиновые кислоты.
В некоторых случаях может быть желательно удалить клетки с твердой подложки, оставляя маркеры-нуклеиновые кислоты (или копии маркеров) присоединенными к твердой подложке. Затем последовательности маркера могут быть подвергнуты секвенированию в отсутствие клеток.
В тех примерах осуществления, в которых маркеры-нуклеиновые кислоты находятся в клетке, клетки могут быть подвергнуты лизису на поверхности массива, что приводит к высвобождению содержимого клеток и локализованному захвату маркеров-нуклеиновых кислот. Маркеры-нуклеиновые кислоты могут включать области универсальной последовательности, которые комплементарны праймерам, находящимся на твердой подложке. Таким образом, маркеры-нуклеиновые кислоты могут быть захвачены на твердой подложке в формате, подходящем для амплификации и/или секвенирования. Нуклеиновые кислоты, захваченные на твердой подложке, необязательно могут быть амплифицированы. Нуклеиновые кислоты, захваченные на твердой подложке, или полученные из них ампликоны могут быть подвергнуты секвенированию на твердой подложке способами, рассмотренными в настоящей работе.
Способ согласно настоящему изобретению может включать этап удаления одной или более клеток из массива. Например, одна или более клеток, которые были идентифицированы как находки в этапе скрининга, могут быть селективно удалены. Необязательно могут быть созданы условия, обеспечивающие жизнеспособность клеток. Таким образом, удаленная клетка (клетки) может быть подвергнута культивированию, копированию или достройке. Клетка (клетки) может быть удалена с помощью методик и реагентов, представленных в настоящей работе для других потенциальных агентов. Например, для извлечения и отделения определенной клетки от других клеток массива особенно подходящим может быть использование фотолабильных линкеров и световых пучков, пропущенных через пространственные световые фильтры.
В некоторых примерах осуществления жизнеспособные клетки не обязательно должны быть удалены из массива после проведения этапа скрининга. Напротив, последовательность маркера может быть ассоциирована с известной клеткой a priori, так что маркера секвенирования достаточно для идентификации клетки, которую при этом не нужно извлекать или анализировать. Для идентификации клетки, имеющиеся a priori сведения о маркере, который присутствует на конкретном элементе, могут быть сопоставлены с сигналами, поступающими от элемента при выполнении этапа скрининга.
Приведенные ниже примеры представлены для иллюстрации настоящего изобретения и не ограничивают его объем.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ ПРИМЕР I
Скрининг небольших молекул
Платформы секвенирования нового поколения, такие как платформы, внедренные в коммерческое применение Illumina (San Diego, CA), обеспечивают фундамент для построения интегрированной высокопроизводительной платформы для скрининга, нацеленного на обнаружение лекарственных средств. Модификация нуклеиновых кислот функциональными группами, которая обеспечивает присоединение целевых молекул, позволяет использовать проточную ячейку для секвенирования в качестве подложки для создания массивов для высокопроизводительного скрининга соединений. Множество скрининговых исследований может быть проведено на одной платформе при смене лишь присоединяемых мишеней. Пример способа скрининга небольших молекул на платформе секвенирования изображен на Фиг. 1A-1F и рассмотрен ниже.
На Фиг. 1А представлен первый этап, в котором 50000 различных молекул нуклеиновых кислот, каждая из которых составлена из 29 нуклеотидов, синтезировали с помощью устройства для синтеза на ленточной основе. Лента включает индивидуально адресуемые сайты, на которых соответственно синтезируются индивидуальные нуклеиновые кислоты. Молекулы нуклеиновых кислот также имеют на 5'-конце функциональную группу (FG, от англ. functional group), такую как сульфгидрильная группа, аминогруппа или N-гидроксисукцинимидная группа. 5'-Область нуклеиновых кислот включает 10 нуклеотидов, которые кодируют универсальный праймер (одинаковый для всех 50000 нуклеиновых кислот), а 3'-область кодирует одну из 50000 различных последовательностей маркера (также называемых "кодовыми" последовательностями). Пример устройства на ленточной основе для синтеза ДНК рассмотрен в опубликованной патентной заявке US 2011/0178285 А1, содержание которой включено в настоящее описание посредством ссылки.
На Фиг. 1В представлен второй этап, в котором одноматричную гибридную нуклеиновую кислоту присоединяют (лигируют) к нуклеиновым кислотам, находящимся в каждой лунке ленты для синтеза для получения универсального "липкого" праймера. Как показано на схеме, лигирование производят после гибридизации последовательности универсального праймера различных нуклеиновых кислот с "липким" концом одноматричного гибрида. Необязательно, перед проведением лигирования различные нуклеиновые кислоты могут быть удалены с ленты (например, для очистки или модификации нуклеиновых кислот). Другие необязательные конфигурации включают присоединение функциональной группы к одноматричному гибриду, а не к различным нуклеиновым кислотам. В альтернативном варианте или дополнительно к поверхности одноматричного гибрида могут быть присоединены частицы, такие как группы биотина, азида или алкина.
Как показано на Фиг. 1С, третий этап заключается в автоматическом добавлении определенного потенциального агента (например, "соединения") в каждую из индивидуальных лунок ленты устройства для синтеза. Каждый из потенциальных агентов включает реакционноспособную группу, которая реагирует с функциональной группой, содержащейся в различных нуклеиновых кислотах. В результате каждый из потенциальных агентов присоединяется к конкретному маркеру-нуклеиновой кислоте, находящейся на ленте устройства для синтеза, что приводит к образованию кодированных потенциальных агентов.
Как показано на Фиг. 1D, этап 4 проводят для иммобилизации потенциальных агентов с присвоенным кодом на распознаваемых сайтах на поверхности проточной ячейки. Иммобилизация может происходить посредством гибридизации одноматричных частей нуклеиновых кислот с комплементарными универсальными праймерами, которые находятся на поверхности проточной ячейки. Праймеры могут быть присоединены к поверхности проточной ячейки с помощью геля PAZAM или другого гидрогеля, как показано, например, в опубликованной патентной заявке US 2011/0059865 А1 или в патенте US 9012022; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки.
Как показано на Фиг. 1Е, в этапе 5 агент для скрининга (также называемый "целевой молекулой") приводят в контакт с иммобилизованными содержащими коды потенциальными агентами, находящимися на поверхности проточной ячейки. Агент для скрининга включает флуоресцентную метку, которая может быть обнаружена с помощью оптического устройства, такого как устройство для секвенирования Illumina. Изображения могут быть получены, например, в режиме реального времени; они позволяют определять кинетику связывания агента для скрининга на каждом из распознаваемых сайтов. В примере, представленном на Фиг. 1Е, потенциальный агент, присоединенный к коду N, представляет собой "находку", определяемую по требуемому профилю кинетики связывания.
Как показано на Фиг. 1F, последовательность для кода N может быть определена на основании протокола секвенирования, выполненного в проточной ячейке. Последовательность для кода N может быть сопоставлена с той локализацией на ленте устройства для синтеза, где она была синтезирована, и, в свою очередь, идентификационные данные "находки" могут быть определены на основании информации о потенциальном агенте, который был доставлен к тому участку на ленте устройства для синтеза, где был синтезирован код N.
ПРИМЕР II
Скрининг белка
Твердофазные способы амплификации позволяют производить высокоэффективное мультиплексное представление нуклеиновых кислот. Особенно подходящий способ твердофазной амплификации представляет собой мостиковую амплификацию (также называемую образованием кластеров), которая может быть проведена, как указано, например, в патенте US 5641658, в опубликованной патентной заявке US 2002/0055100, в патенте US 7115400, в опубликованной патентной заявке US 2004/0096853, в опубликованной патентной заявке US 2004/0002090, в опубликованной патентной заявке US 2007/0128624 и в опубликованной патентной заявке US 2008/0009420; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки.
В этом примере рассмотрено применение кластеров нуклеиновых кислот, получаемых в результате твердофазной амплификации с образованием массива белков на проточной ячейке. Некоторые основные преимущества этой методики состоят в следующем: (а) она обеспечивает создание на поверхности большого количества содержащих белок элементов относительно небольшого размера, но при этом оптически различимых, и при этом может быть проведен скрининг активности огромного множества различных белков; и (b) элементы содержат нуклеиновые кислоты, которые кодируют белок, и при этом нуклеиновые кислоты подходят для секвенирования, в результате которого может быть идентифицирован белок на каждом элементе проточной ячейки.
Как показано на Фиг. 2, конструируют библиотеку кДНК, которая включает адапторы с сайтами Р5 и Р7 связывания праймера, а также с сайтами транскрипции и трансляции. Библиотеку присоединяют к проточной ячейке, и члены библиотеки подвергают мостиковой амплификации на поверхности проточной ячейки, что приводит к образованию кластеров. Описание последовательностей Р5 и Р7 связывания праймера, способов получения библиотек нуклеиновых кислот, содержащих адапторы, и способов получения кластеров имеется, например, в документах, цитируемых выше при рассмотрении методик мостиковой амплификации, в публикации Bentley с соавт., Nature 456:53-59 (2008), в опубликованной патентной заявке US 2011/0059865 А1 и в патенте US 7741463; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки.
Полученные кластеры кДНК транскрибируют в мРНК в присутствии РНК-полимеразы. мРНК удерживается вблизи кластера кДНК, с которого она была транскрибирована, (а) за счет отсутствия сайта прекращения транскрипции на конце конструкции кДНК, в результате чего РНК-полимераза прекращает свое действие (stalls), и мРНК транскрипт остается связанным с кДНК, (b) за счет использования известных сайтов остановки транскрипции (например, из оперона Trp организма Е. coli), которые также прекращают действие РНК-полимеразы, (с) применением химических способов остановки транскрипции (например, добавлением бицикломицина) или (d) благодаря наличию комплементарной последовательности в кластере кДНК, с которой гибридизуется транскрибированная РНК.
мРНК, которая локализована у кластера кДНК, с которого она была транскрибирована, затем транслируется с образованием белка. Этому способствует находящийся в мРНК инициирующий кодон (который может быть введен наряду с последовательностью, инициирующей транскрипцию, в адаптор на 5'-конце конструкции библиотеки кДНК). Кроме того, мРНК не имеет терминирующего кодона на 3'-конце. Как показано на Фиг. 2, отсутствие терминирующуго кодона приводит к остановке (блокировке) рибосомы на конце мРНК, так что белок остается присоединенным к мРНК через рибосому (мРНК, в свою очередь, присоединена к кластеру кДНК остановленной РНК-полимеразой). В альтернативном варианте рибосомы могут быть остановлены химическими средствами (например, добавлением хлорамфеникола/пуромицина). Сопряженные транскрипция и трансляция могут быть выполнены с использованием доступных систем, включающих лизат ретикулоцитов кролика, бактериальный S30 или экстракт из зародышей пшеницы.
При альтернативном подходе белки могут быть образованы в растворе и затем присоединены к проточной ячейке или другой поверхности. Несмотря на то, что этот подход не включает проведение амплификации на поверхности, он может быть подходящим, если методики с использованием раствора более доступны или применимы к анализируемому белку. Полученный массив белков подвергают скринингу с применением агента для скрининга или другого стимулятора для идентификации находок. Находящуюся в кластерах кДНК секвенируют для идентификации белковых находок.
ПРИМЕР III
Скрининг белка с использованием маркеров
Платформы секвенирования нового поколения, такие как платформы, внедренные в коммерческое использование Illumina (San Diego, CA), обеспечивают базис для создания интегрированных высокопроизводительных скрининг-платформ для эволюции белка. Пример такого способа схематично представлен на Фиг. 3А и Фиг. 3В.
На первом этапе создают библиотеку векторов, имеющих случайные или полуслучайные мутации относительно целевого белка и случайные маркеры (также называемые "кодами"). Векторы сконструированы для экспрессии мРНК, которая включает кодирующую последовательность белка и маркер. Количество различных случайных маркеров превышает количество вариантов белка в библиотеке, и, таким образом, каждый вариант мРНК с высокой вероятностью будет включать уникальный маркер. Например, рандомизированная последовательность из 10 нуклеотидов обеспечивает получение 106 различных маркеров, а рандомизированная последовательность из 20 нуклеотидов обеспечивает получение 1012 различных маркеров.
В случае, альтернативном случайному введению мутаций и использованию случайных маркеров, проведение первого этапа может включать получение заранее заданных мутаций, которые ассоциируют с известными маркерами.
При проведении второго этапа производят культивирование библиотеки бактерий, которые были трансформированы векторами, в результате чего получают мРНК из соответствующих векторов. Библиотеку подвергают лизису для высвобождения из различных векторов, имеющихся в библиотеке, смеси мРНК-транскриптов (т.е. библиотеки мРНК).
При проведении третьего этапа библиотеку мРНК разделяют на две подбиблиотеки. Библиотека включает множество копий каждого элемента, то есть после разделения библиотеки в обеих подбиблиотеках будут находиться одинаковые элементы. При этом к последовательности каждого белкового варианта присоединена уникальная последовательность маркера.
Как показано на Фиг. 3В, при проведении четвертого этапа первую подбиблиотеку присоединяют к проточной ячейке, амплифицируют на проточной ячейке, и производят секвенирование кодирующих последовательностей и соответствующих маркеров полученных ампликонов. Таким образом локализуют сайт, в котором каждый элемент закреплен. Затем элементы (члены) второй подбиблиотеки приводят в контакт с проточной ячейкой, что позволяет элементам второй подбиблиотеки гибридизироваться с ампликонами, полученными из идентичных элементов (членов) первой подбиблиотеки за счет комплементарности последовательностей маркера. В таком варианте на основании результатов секвенирования и ожидаемой гибридизации между маркерами и их комплементами может быть получен сайт, в котором находится каждый элемент (член) второй подбиблиотеки. Элементы (члены) второй подбиблиотеки, которые были зафиксированы на проточной ячейке, затем подвергают трансляции для экспрессирования целевых белков на проточной ячейке. Каждый белок экспрессируется таким образом, что он остается присоединенным к РНК, с которой он транслировался. Например, присоединение может быть произведено способами, рассмотренными в Примере II. Затем белки подвергают скринингу с использованием агента для скрининга или другого стимулятора, что позволяет идентифицировать требуемую функцию высокопроизводительным способом. В результате получают сигнал активности белка, который локализован на том участке (сайте) проточной ячейки, который коррелирует с РНК последовательностью, кодирующей белок.
Эта методика может обеспечить высокую производительность, составляющую 30 миллионов белков на одну дорожку проточной ячейки или более. В этом способе скрининга отсутствуют проблемы, встречающиеся при скрининге в эмульсии. Например, с помощью устройства для секвенирования Illumina от каждого элемента на поверхности проточной ячейки могут быть получены количественные и кинетические данные, позволяющие проводить скрининг с более точными и более селективными критериями по сравнению с доступными в настоящее время традиционными эмульсионными методиками.
ПРИМЕР IV
Скрининг клеток
В этом примере рассмотрена методика скрининга клеток, которая сочетает в себе преимущество высокой производительности сортировки клеток с активацией флуоресценции (англ. fluorescence activated cell sorting, сокращенно FACS) с возможностью отслеживать динамические процессы в режиме реального времени - преимуществом, которое обычно связывают с флуоресцентной микроскопией, а также с дополнительными преимуществами секвенирования нового поколения, позволяющего идентифицировать индивидуальные клетки в популяции. В результате способы, рассмотренные в настоящей работе, позволяют извлекать клетки и получать характеристики клеток, демонстрирующих требуемое поведение. В частности, в данном примере показана адаптация платформы секвенирования нового поколения, созданной Illumina Inc. (San Diego, CA), для отслеживания флуоресценции, для отслеживания со сверхвысокой производительностью фенотипического поведения (например, определяемого из экспрессии флуоресцентных репортеров) индивидуальных клеток в ответ на специфичные раздражители с последующим секвенированием маркеров, располагаемых на поверхности каждой отдельной клетки, для последующей идентификации и извлечения. Эта платформа может стать стандартным способом высокопроизводительного скрининга в клеточной инженерии.
Клетки имеют потенциальные терапевтические возможности, которые отличаются от терапевтических возможностей небольших молекул и белков, а во многих случаях их превосходят. Клетки могут активно перемещаться к определенным участкам организма, они могут чувствовать множество внешних раздражителей, и они могут интегрировать множество источников информации для создания точной ответной реакции. Кроме того, ответные реакции на клеточной основе могут включать комплексное динамическое поведение, которое может контролироваться заранее запрограммированными функциями или наличием внешних факторов. В настоящее время клеточные терапии исследуются для обнаружения возможности лечения ряда заболеваний, от применения сконструированных микроорганизмов для лечения болезни Крона до применения иммунных клеток человека, созданных для конкретного пациента, для лечения рака. Важно отметить, что как микроорганизмы, так и человеческие клетки могут быть сконструированы таким образом, что они оказывают терапевтически полезное действие.
Схема проведения операций клеточной инженерии
Клеточная инженерия (с использованием как микробных, так и человеческих клеток) является сложным процессом, в котором имеется множество разнообразных факторов, которые нужно учитывать. Так, вместо применения единственной конструкции полезно создать библиотеки клеток-кандидатов, которые затем могут быть отобраны или подвергнуты скринингу. В частности, клеточная инженерия может включать следующие этапы: (1) конструирование генетических контуров, которые могут включать один или более датчиков (сенсоров), воспринимающих внешние сигналы, информационную интегрирующую цепь и сигнал-зависимую ответную реакцию (ответная реакция часто включает экспрессию гена); (2). модификацию одной или более генетических мишеней для указанных выше компонентов во всей библиотеке клеток-кандидатов (например, с помощью методики для направленного редактирования геномов CRISPR-Cas9, от англ. clustered regularly interspaced short palindromic repeats - короткие палиндромные повторы, регулярно расположенные группам); и (3) высокопроизводительный скрининг для идентификации находок среди множества различных клеток-кандидатов, которые имеют требуемое клеточное поведение.
Надежная и высокопроизводительная методика скрининга может принести значительную пользу клеточной инженерии, поскольку количество клеток, которые необходимо исследовать, велико (часто исследуют тысячи различных конструкций), и в результате модификаций, вводимых при конструировании, может быть обнаружено огромное множество разнообразных вариантов клеточного поведения. Также желательно создать методику скрининга, которая позволила бы отслеживать сложную временную динамику и при этом оставалась бы высокопроизводительной. Этими преимуществами обладает методика скрининга, рассмотренная в настоящей работе.
Способ скрининга клеток включает следующие два этапа:
Этап 1: Фенотипический мониторинг. Библиотеку из живых сконструированных клеток, снабженных подходящими флуоресцентными репортерами, загружают в проточную ячейку платформы секвенирования (например, платформы Illumina MiSeq®, NextSeq®, HiSeq® или Genime Analyzer®), как показано на Фиг. 4. Индивидуальные клетки распределяют случайным образом и фиксируют на поверхности проточной ячейки (с помощью специальным способов химического присоединения, которые зависят от конкретного типа анализируемых клеток). Флуоресценцию каждой индивидуальной клетки регистрируют через определенные промежутки времени, сканируя поверхность проточной ячейки в соответствии с методикой, в настоящее время используемой в проточных ячейках Illumina во время секвенирования. Следует отметить, что средние размеры индивидуальных клеток сравнимы с (или превышают) создаваемые в настоящее время кластеры секвенирования, что делает разрешение платформы секвенирования вполне подходящим для проведения скрининга. Кроме того, клетки могут нести тысячи флуоресцентных репортерных молекул, то есть интенсивности сигналов будут аналогичны (или превышать) интенсивности сигналов, в настоящее время обнаруживаемые платформами секвенирования. В определенные моменты времени клетки подвергают воздействию агентов для скрининга (или других раздражителей), после чего определяют ответную реакцию клеток (например, отражаемую в изменениях экспрессии репортерных генов или изменениях интенсивности флуоресценции клетки-репортера любого типа - такую как изменение концентрации кальция в цитоплазме, тушение флуорофора в результате изменений в субклеточной локализации и т.д.). Мониторинг изменений во флуоресцентных репортерах в течение периода времени позволяет определять временную динамику фенотипических изменений ответной реакции на различные раздражители (или комбинации раздражителей).
Этап 2: Идентификация единичной клетки посредством расшифровки кода индивидуальных маркеров. Каждой клетке в популяции присваивают маркер. Три различные методики мечения клеток рассмотрены ниже. В первом этапе маркеры присоединяют к индивидуальным клеткам. Независимо от типа маркера (например, гранула, присоединяемая к мембране нуклеиновая кислота и т.д.), клетки сначала сортируют по индивидуальным емкостям (например, микролункам) так, чтобы в каждой емкости находилась одна клетка. Затем каждой клетке в каждой емкости присваивают уникальный маркер, как показано на Фиг. 5.
2.1 Штрих-кодирование единичной клетки с помощью гранул. Каждую клетку в популяции (например, диаметром ~ 10 мкм для Т клеток) метят гранулами в количестве от 1 до 10 штук. Диаметр гранулы может составлять приблизительно 1-2 мкм. Подходящие гранулы включают, например, гранулы, применяем в методике BeadArray Компании Illumina или рассмотренные в патенте US 7622294 или патенте US 8741630, содержание которых включено в настоящее описание посредством ссылки. Каждую клетку метят гранулами, кодирующими единственный маркер, помещая предварительно индивидуальные клетки в индивидуальные емкости и добавляя в каждую емкость гранулы, имеющие одинаковый уникальный маркер (для достижения известного соответствия между каждой емкостью и каждым маркером). Мечение клеток может быть произведено несколькими способами, например, посредством образования ковалентной связи между гранулами и антителами, которые распознают специфичные эпитопы, от природы имеющиеся на поверхности целевых клеток. Следует отметить, что при таком мечении, несмотря на то, что каждая меченная гранулами клетка случайным образом распределена по поверхности проточной ячейки, каждая клетка будет иметь совместную локализацию в пространстве со своей гранулой (гранулами) (Фиг. 6). Таким образом, после проведения этапа 1 идентификационные данные каждой клетки можно определить расшифровкой кода гранулы (гранул), имеющейся в проточной ячейке, и присвоением клетке идентифицированных маркеров, находящихся в близком соседстве с соответствующей гранулой (гранулами). Находящиеся на гранулах маркеры могут быть декодированы с помощью методики секвенирования синтезом (см., например, публикацию Bentley с соавт., Nature 456:53-59 (2008), опубликованные международные патентные заявки WO 91/06678, WO 04/018497 или WO 07/123744, патенты US 7057026, US 7329492, US 7211414, US 7315019 или US 7405281 и опубликованную патентную заявку US 2008/0108082 А1; содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки) или методики расшифровки кода, рассмотренной в патенте US 8460865 или в публикации Gunderson с соавт., Genome Research 14:870-877 (2004), где содержание каждого из цитируемых документов включено в настоящее описание посредством ссылки.
2.2 Идентификация единичной клетки с помощью маркеров последовательности. В альтернативном варианте или дополнительно к мечению гранулами применяют уникальные идентификаторы последовательности, проявляющиеся непосредственно на поверхности каждой клетки. Для этого каждую клетку в популяции перед загрузкой клетки в проточную ячейки (например, перед проведением этапа 1) модифицируют индивидуальными однонитевыми (одноцепочечными) ДНК маркерами, проявляющимися на поверхности. Химический способ присоединения маркера-нуклеиновой кислоты зависит от типа конкретной клетки. Например, как показано в публикации Sleden с соавт., J Am Chem Soc 134: 765-8 (2012), содержание которой включено в настоящее описание посредством ссылки, человеческие клетки можно метить молекулами однонитевой ДНК, ковалентно связанными с липидами плазматической мембраны. В другом примере клетки дрожжей могут быть помечены молекулами однонитевой ДНК, ковалентно связанными с белками HaloTag, проявленными на комплексах стенок клеток Ада1-Aga2.
Каждый индивидуальный маркер состоит из по меньшей мере трех областей. Область 1 соединена с присоединенной частицей (например, липидом или белком, в зависимости от типа клетки). Область 2 состоит из определенного числа оснований, которое зависит от требуемой плексности (используя все 4 нуклеотида можно получить 4n комбинаций для последовательности длиной "n"; например, последовательность длиной 4 основания будет охватывать маркеры для идентификации 256 различных индивидуальных клеток, 5 оснований позволят создать 1024 различных маркера и т.д.). Таким образом, при наличии последовательности маркера длиной всего 9 оснований можно индивидуально идентифицировать более 250000 различных клеток. Область 3 состоит из последовательности ДНК, комплементарной праймеру секвенирования. Следует отметить, что каждую клетку метят нуклеиновыми кислотами, кодирующими единственный маркер; процедура мечения включает помещение индивидуальных клеток в емкости и добавление в каждую емкость нуклеиновых кислот, имеющих одну и ту же уникальную последовательность маркера (как было указано выше, соответствие между каждой емкость и каждым маркером известно).
В отдельном этапе (проводимом до или после получения фенотипических данных) определяют идентификационные данные каждой индивидуальной клетки, например, одним из двух способом, рассмотренных ниже.
2.2.1 Секвенирование in situ конкретного маркера, присоединенного к одной клетке. Каждая клетка демонстрирует множество копий определенного маркера. Таким образом, сигнал легко обнаруживается устройством для секвенирования (см. Фиг. 7). Кроме того, длина прочтения для идентификации каждого маркера относительно невелика (например, для идентификации более 250000 маркеров достаточно 9 оснований), гораздо меньше длин прочтения, составляющих сотни нуклеотидов, типичных для коммерчески доступных устройств для секвенирования.
Секвенирование маркера in situ может быть произведено несколькими способами. Одна из возможностей состоит в секвенировании непосредственно на поверхности живых клеток. Другая возможность состоит в фиксации клеток перед секвенированием (в том случае, если нуклеотиды, выделяющиеся из живых клеток, мешают проведению реакции секвенирования). Третья возможность состоит в отделении и захвате маркеров-нуклеиновых кислот из каждой клетки. Для этого поверхность проточной ячейки модифицируют зондом захвата (например, праймером секвенирования), содержащим область, комплементарную области, общей для всех присоединенных к клеткам нуклеиновых кислот, обеспечивающую первоначальное присоединение клеток к поверхности и облегчающую захват отделенных нуклеиновых кислот перед проведением секвенирования. Необязательно, клетки могут быть удалены после фиксации маркеров-нуклеиновых кислот на поверхности.
2.2.2. Секвенирование in situ копий маркеров, присоединенных к проточной ячейке. Как показано на Фиг. 8, находящиеся на поверхности клетки маркеры-нуклеиновые кислоты гибридизуют с присоединенными к поверхности проточной ячейки праймерами (с частично комплементарными последовательностями). Находящиеся на клеточной поверхности маркеры-нуклеиновые кислоты отделяют от клеток обработкой специальным рестрикционным ферментом, и клетки затем вымывают из проточной ячейки. Затем присоединенные к поверхности проточной ячейки маркеры-нуклеиновые кислот подвергают достройке, эффективно создавая копии исходных клеточных маркеров, которые затем подвергают секвенированию. Во многих случаях проведение мостиковой амплификации копий не требуется, поскольку после клетки с большой вероятностью остается "пятно" диаметром приблизительно 1 мкм, состоящее из тысяч нуклеиновых кислот. Однако, при необходимости может быть проведена мостиковая амплификация (в этом случае к маркерам-нуклеиновым кислотам могут быть добавлены подходящие сайты связывания праймера, и праймер второго типа может быть присоединен к поверхности проточной ячейки).
В некоторых случаях маркер может быть присоединен к индивидуальной клетке с помощью заякоренной на мембране нуклеиновой кислоты, как показано на Фиг. 9. Заякоренная на мембране нуклеиновая кислота включает линкерную область, сайт рестрикции (англ. restriction site, сокращенно RE), сайт связывания праймера секвенирования (SBS3), последовательность маркера (штрих-код) и последовательность захвата. Затем клетки могут быть зафиксированы на поверхности с помощью присоединенных к поверхности нуклеиновых кислот, последовательности которых комплементарны последовательности захвата, как указано в публикации Sleden с соавт., J Am Chem Soc 134: 765-8 (2012), содержание которой включено в настоящее описание посредством ссылки, или как показано на Фиг. 10.
После регистрации сигналов флуоресценции, указывающих на фенотипическое поведение клетки в этапе скрининга (например, измерения флуоресценции репортера в течение некоторого периода времени в определенных среде и условиях), маркеры-нуклеиновые кислоты могут быть скопированы на поверхности проточной ячейки, после чего клетки могут быть удалены промывкой. Как показано на Фиг. 11, находящиеся на поверхности копии эффективно сохраняют пространственную информацию, относящуюся к тому месту на поверхности проточной ячейки, на котором находились клетки.
Регистрация пространственного нахождения каждой клетки на поверхности позволяет идентифицировать с помощью маркеров каждую из зарегистрированных временных серий флуоресценции, эффективно связывая, таким образом, фенотипические ответные реакции с идентификацией клетки. Эти идентификационные данные затем могут быть использованы либо для идентификации индивидуальных клонов в одной емкости (в которой клетки были изначально помечены, как показано на Фиг. 12), либо для извлечения выбранных клеток из клеточных смесей посредством аффинной адсорбции с нуклеиновыми кислотами, которые комплементарны маркерам, присутствующим на поверхности выбранных клеток.
В тексте настоящей работы были упомянуты различные публикации, патенты или патентные заявки. Содержания этих публикаций полностью включены в настоящее описание посредством ссылки для более полного описания состояния области техники, к которой относится настоящее изобретение.
Термин "включающий" имеет неограничивающее значение, включающее не только упоминаемые элементы, но также дополнительно охватывающее любые дополнительные элементы.
Несмотря на то, что изобретения было раскрыто с помощью приведенных выше примеров, следует понимать, что оно может включать различные модификации, не выходящие за пределы объема изобретения. Соответственно, объем изобретения ограничен лишь прилагаемыми пунктами формулы изобретения.
Реферат
Изобретение относится к биотехнологии. Описан способ идентификации потенциальных агентов, включающий: (a) предоставление библиотеки потенциальных агентов, в которой каждый потенциальный агент присоединен к уникальному маркеру-нуклеиновой кислоте, имеющей последовательность маркера, где потенциальные агенты выбраны из группы, состоящей из белков, нуклеиновых кислот, клеток и небольших молекул, где небольшие молекулы выбраны из группы, состоящей из потенциальных ингибиторов ферментов, потенциальных антибиотиков, потенциальных противовирусных агентов, потенциальных пестицидов, потенциальных гормонов, потенциальных активаторов клеточной сигнализации, потенциальных ингибиторов клеточной сигнализации и потенциальных активаторов ферментов; (b) присоединение библиотеки потенциальных агентов к твердой подложке, включающей праймеры нуклеиновых кислот, посредством гибридизации маркеров-нуклеиновых кислот с праймерами нуклеиновых кислот с образованием массива потенциальных агентов; (c) приведение массива потенциальных агентов в контакт с агентом для скрининга, при котором один или более из потенциальных агентов массива реагирует с агентом для скрининга, где агент для скрининга реагирует с одним или более потенциальными агентами посредством связывания с одним или более потенциальными агентами или блокировки связывания между потенциальным агентом и аналитом, имеющим сродство к потенциальному агенту; (d) исследование массива во время или после контакта массива с агентом для скрининга для установления того, что по меньшей мере один потенциальный агент, находящийся в массиве, реагирует с агентом для скрининга, где исследование массива включает обнаружение агента для скрининга, который связан с одним или более потенциальными агентами, где агент для скрининга является люминесцентным, а обнаружение представляет собой обнаружение люминесценции от массива; (e) секвенирование маркеров-нуклеиновых кислот в массиве для определения последовательности маркера, который присоединен к каждому из потенциальных агентов; и (f) идентификацию по меньшей мере одного потенциального агента в массиве, который реагирует с агентом для скрининга, на основании определенной последовательности маркера. Изобретение расширяет арсенал способов идентификации потенциальных агентов. 17 з.п. ф-лы, 12 ил., 4 пр.
Формула
Документы, цитированные в отчёте о поиске
Композиция для иммобилизации биологических макромолекул в гидрогелях, способ приготовления композиции, биочип, способ проведения пцр на биочипе

Комментарии