Способ изготовления носителя с иммобилизованным зондом - RU2386136C2
Код документа: RU2386136C2
Чертежи



Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу изготовления носителя с иммобилизованным зондом, имеющего зонд, иммобилизованный на субстрате, и способного выявлять вещество-мишень.
УРОВЕНЬ ТЕХНИКИ
В качестве одной из технологий быстрого и точного определения последовательности оснований нуклеиновой кислоты, детекции нуклеиновой кислоты, имеющей в образце конкретную последовательность оснований-мишень, и идентификации видов бактерий предложено применение носителя с иммобилизованным зондом (матрицы с зондом), имеющего множество зондов, помещенных на твердофазную подложку. Как используют в настоящем описании, термин "зонд" означает вещество, специфично связывающееся с нуклеиновой кислотой-мишенью в реакции гибридизации, которое, когда вещество представляет собой нуклеиновую кислоту, может быть обозначено как нуклеиновая кислота-зонд. В качестве способов, используемых для иммобилизации зондов на твердофазной подложке, известны различные способы. Конкретно, например, существует иллюстративный способ иммобилизации зондов посредством последовательного синтеза зондов на твердофазной подложке (т.е. способ "на чипе") и способ иммобилизации ранее полученных зондов посредством нанесения их на субстрат с использованием пинов, штампа или сходных с ними. В патенте США No. 5143854 описан способ, посредством которого из выбранной области субстрата с помощью активатора удаляют защитные группы, а затем с областью многократно связывают мономер, имеющий удаляемую защитную группу, для синтеза полимеров, имеющих различные последовательности на субстрате. Кроме того, например, в японской патентной заявке, опубликованной под No. H08-023975, описан способ, посредством которого материал для иммобилизации зонда, состоящий из субстрата и материала для иммобилизации, изготовленного из имеющего карбодиимидную группу полимерного соединения, нанесенного на субстрат, приводят в контакт с биологически активным веществом, обладающим реакционной способностью в отношении карбодиимидной группы, для иммобилизации посредством этого зонда на субстрате. Кроме того, например, в японской патентной заявке, опубликованной под No. 2001-178442, описан способ, посредством которого фрагмент ДНК, имеющий на своем конце тиольную группу, приводят в контакт в жидкой фазе с твердофазным носителем, на поверхности которого иммобилизована линейная молекула, имеющая на одном конце реакционно-способную группу, способную реагировать и ковалентно связываться с тиольной группой. Посредством этого фрагмент ДНК можно иммобилизовывать на поверхности твердофазного носителя, поскольку ДНК и линейная молекула могут ковалентно связываться друг с другом. Кроме того, например, в японской патентной заявке, опубликованной под No. 2000-295990, описан способ, посредством которого для стабилизации связывания фрагмента ДНК с поверхностью твердофазного носителя, водный раствор, полученный растворением или диспергированием фрагмента ДНК и гидрофильного полимера в водной среде, наносят в виде пятен на поверхность твердофазного носителя.
Главным образом, желательно, чтобы матрица с зондом, полученная как описано выше, обладала высокой чувствительностью. Причина этого заключается в том, что, вследствие снижения соотношения S/N и т.д., могут возникнуть сомнения относительно надежности результатов детекции, когда концентрация вещества-мишени, подлежащего выявлению посредством матрицы с зондом, является низкой. Таким образом, были предприняты попытки повышения чувствительности матрицы с зондом в способе посредством повышения концентрации зонда с увеличением, таким образом, количества зонда, подлежащего иммобилизации на субстрате.
Однако для матрицы с зондом, полученной таким способом, как описано выше, количество связавшегося зонда может оказаться насыщающим по отношению к реакционно-способным группам, которые могут связываться с зондом на субстрате. В результате, в содержащей зонд капле жидкости, нанесенной на субстрат, в действительности может оставаться не вступивший в реакцию зонд. Кроме того, когда каплю жидкости в таком состоянии удаляют обработкой жидкой фазой с водой/детергентом, или сходными с ними, не вступивший в реакцию зонд может вытекать в область, отличную от области, на которую нанесены не вступившие в реакцию зонды ("область пятна"). В результате, зонд может быть иммобилизован на реакционно-способной группе, которая расположена в области ("области фона"), отличной от области пятна на субстрате, что, таким образом, приводит к неспецифичной адсорбции. Термин "неспецифичная адсорбция" отражает адсорбцию или связывание нуклеиновых кислот-мишеней в положениях, которые не связаны с детекцией, независимо от способа адсорбции и связывания. Кроме того, когда нанесенную каплю жидкости удаляют в жидкой фазе с оставшимся в ней не вступившим в реакцию зондом, вытекший зонд может загрязнить область соседнего пятна. В результате, область пятна, в которой должен быть иммобилизован только один вид зонда, может загрязняться другим видом зонда.
В дополнение к этим фактам, сам субстрат, с которым может связываться зонд, обладает фактором, приводящим к неспецифической адсорбции к нему зонда, в связи с чем могут возникать трудности. Иными словами, когда вещество-мишень неспецифично адсорбируется на полностью фоновую область матрицы с зондом, становится невозможным найти границу между областью фона и пятна, что приводит к невозможности определения наличия или отсутствия сигнала детекции. Эта проблема возникает, например, когда реакционно-способная группа, обладающая положительным зарядом в водном растворе, такая как аминогруппа, находящаяся на субстрате, электростатически адсорбирует отрицательный заряд нуклеиновой кислоты-мишени.
Традиционно, для решения этих проблем предпринимали способ предотвращения неспецифичной адсорбции вещества-мишени в области фона матрицы с зондом.
Для предотвращения неспецифичной адсорбции вещества-мишени в области фона известным способом обработки матрицы с зондом является проведение блокирующей обработки матрицы с зондом с использованием снятого молока или сходных с ним. Также известно, что можно проводить такую блокирующую обработку, при которой после иммобилизации на субстрате зонд погружают в водный раствор полимера. Например, как описано в японском патенте No. 2794728, существует способ проведения блокирующей обработки посредством иммобилизации зонда на нитроцеллюлозную пленку с последующим погружением пленки в раствор, содержащий PVA и/или PVP.
Однако даже если использовать любое из таких блокирующих средств, блокирующее средство связывается с твердофазной подложкой посредством адсорбции, но не посредством образования химических связей. Таким образом, блокирующий эффект не обязательно является достаточным, так что результаты не всегда являются воспроизводимыми. Кроме того, в этом способе нельзя избежать неспецифической адсорбции не вступившего в реакцию зонда на стадии получения матрицы для зонда.
Напротив, в качестве примера блокирования посредством химической связи описан способ блокирования покрытого поли-L-лизином покровного стекла янтарным ангидридом (см., например, P.O. Brown et al., Genome Res., 6: 639-645, 1996). Этот способ представляет собой попытку устранения заряда из аминогруппы на покровном стекле посредством связывания аминогруппы с янтарным ангидридом. Однако даже в этом способе, когда не вступивший в реакцию зонд остается в капле жидкости, нанесенной на твердофазную подложку на стадии получения матрицы с зондом, в ходе реакции блокирования не вступивший в реакцию зонд может вытекать в область фона, так что блокирующее средство может конкурентно реагировать с вытекшим зондом, приводя, таким образом, к неспецифичной адсорбции.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу изготовления носителя с иммобилизованным зондом, который выявляет вещество-мишень (мишень), где при изготовлении носителя с иммобилизованным зондом предотвращают загрязнение пятна другим пятном и где предотвращают неспецифичную адсорбцию зонда в области фона, и где, даже после формирования матрицы, не может происходить неспецифической адсорбции.
Иными словами, настоящее изобретение относится к способу изготовления носителя с иммобилизованным зондом, в котором используется субстрат, содержащий реакционно-способную группу для иммобилизации на ней зонда, включающему стадии:
(i) нанесения капли жидкости, содержащей зонд, на субстрат;
(ii) инактивации реакционно-способной группы, находящейся в области, отличной от области нанесения на субстрате; и
(iii) удаления не вступившего в реакцию зонда, находящегося в нанесенной капле жидкости.
Общепринятый способ блокирования может привести к неспецифичной адсорбции, поскольку нанесенная ДНК вытекает в ходе реакции блокирования. В противоположность этому, настоящее изобретение делает возможной инактивацию области фона без изменения формы капли жидкости после нанесения капли жидкости. Другие признаки и преимущества настоящего изобретения станут понятными из представленного ниже описания совместно с прилагаемыми чертежами, в которых сходными условными обозначениями обозначены одинаковые или сходные их части на всех фигурах.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
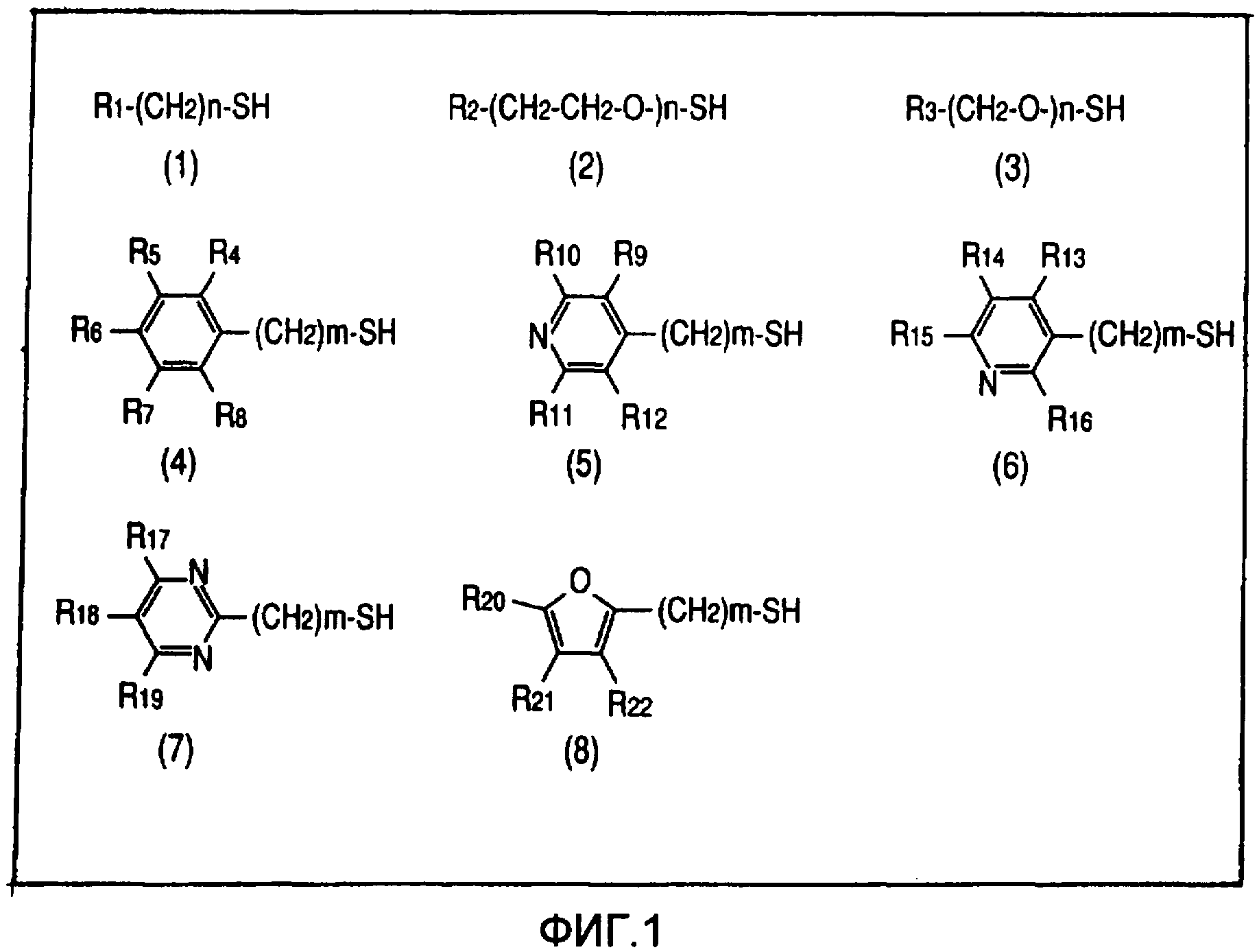
На фиг.1 представлены иллюстративные блокирующие соединения при использовании меченого тиолом зонда.
На фиг.2 представлены иллюстративные блокирующие соединения при использовании амино-меченого зонда.
На фиг.3 представлена диаграмма, на которой показаны эффекты 1-пропантиола относительно концентрации зонда.
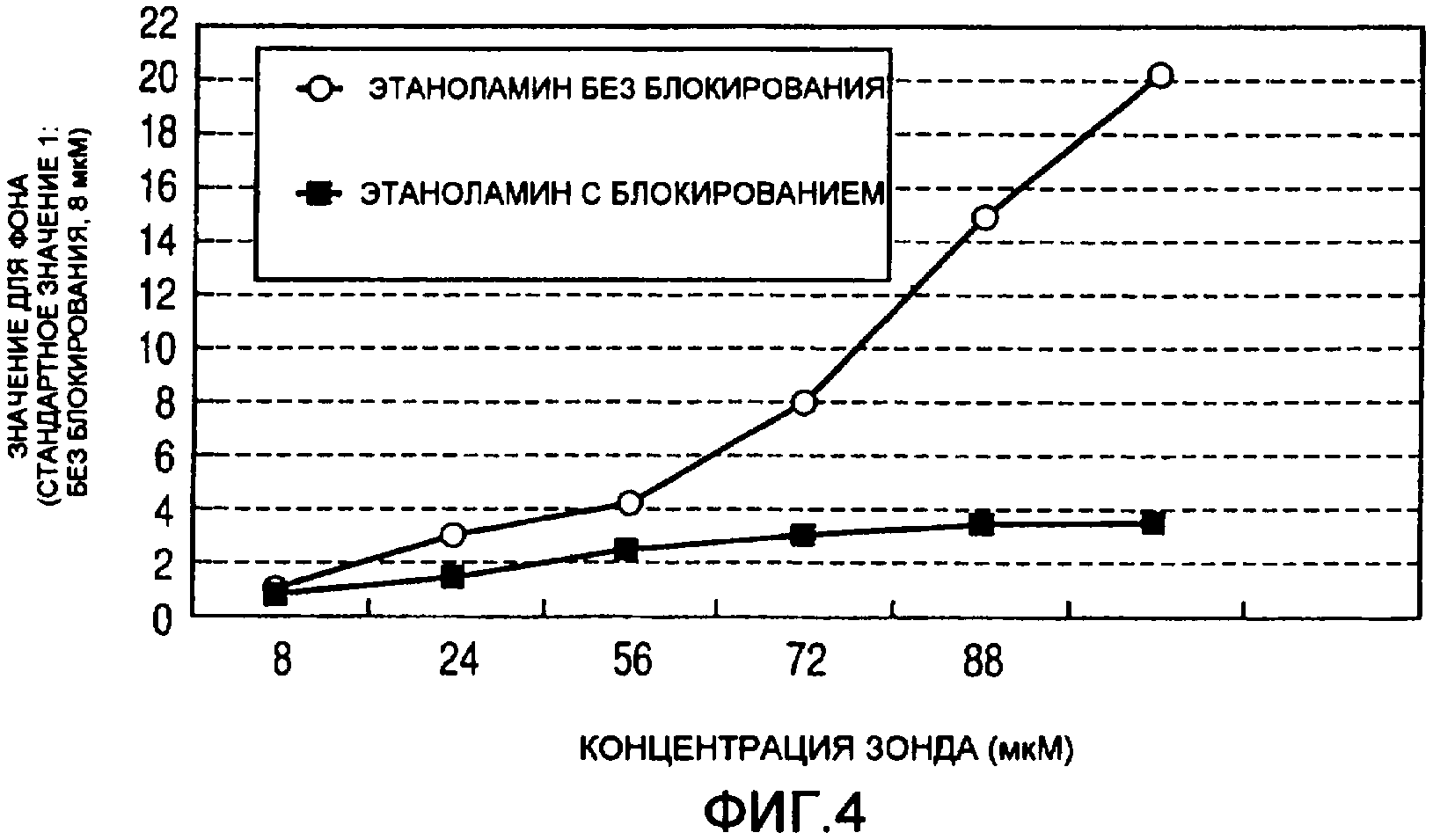
На фиг.4 представлена диаграмма, на которой показаны блокирующие эффекты этаноламина относительно концентрации зонда.
НАИЛУЧШИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ЭТОГО ИЗОБРЕТЕНИЯ
Предпочтительные варианты осуществления настоящего изобретения далее подробно описаны в соответствии с прилагаемыми чертежами.
Настоящее изобретение относится к способу изготовления носителя с иммобилизованным зондом, в котором используют субстрат, содержащий реакционно-способную группу, для иммобилизации на нем зонда, включающему стадии:
(i) нанесения капли жидкости, содержащей зонд, на субстрат;
(ii) инактивации реакционно-способной группы, находящейся в области, отличной от области нанесения субстрата; и
(iii) удаления не вступившего в реакцию зонда, находящегося в нанесенной капле жидкости.
Указанное выше нанесение предпочтительно проводят посредством нанесения капли жидкости. В этом случае характерным признаком настоящего изобретения является проведение инактивации способами, которые сохраняют форму нанесенной капли жидкости. Конкретно характерным признаком настоящего изобретения является инактивация реакционно-способной группы, которая может связываться с зондом в области (области фона), находящейся снаружи области нанесения (области пятна), при сохранении исходной формы капли жидкости, нанесенной на субстрат.
В этом случае указанная выше стадия (ii) может включать процесс проведения инактивации блокирующим соединением. Иллюстративными способами блокирования блокирующим соединением без изменения формы нанесенной капли жидкости могут быть обработка газообразной фазой, обработка распылением или сходные с ними. Обработка газообразной фазой является особенно эффективной, когда используют блокирующее соединение, которое испаряется при нормальной температуре или при нагревании посредством устройства для нагревания, или сходные с ним (например, низкомолекулярное соединение), и, таким образом, реакционно-способную группу можно инактивировать, герметично закрывая как носитель с иммобилизованным зондом, на котором проведено нанесение, так и блокирующее соединение, в закрытой камере или закрытой камере с устройством для нагревания, и оставляя их в течение определенного периода времени. Обработка распылением является особенно эффективной, когда используют блокирующее соединение, которое не может испаряться при нормальной температуре (например, высокомолекулярное соединение, или полярное соединение с сильным межмолекулярным притяжением). Обработку распылением можно проводить посредством растворения блокирующего соединения в пригодном растворителе с получением раствора блокирующего соединения, превращения раствора блокирующего соединения в аэрозоль посредством устройства для распыления, такой как поддающийся распылению раствор, и распыления раствора блокирующего соединения на носитель с иммобилизованным зондом, на который проведено нанесение.
Альтернативно инактивацию испаряющимся блокирующим соединением можно проводить в вакуумном испарителе или в упрощенном вакуумном испарителе, изготовленном из поликарбоната, и предпочтительно ее проводят в устройстве, способном образовывать вакуумное пространство. В случае применения блокирующего соединения в твердой форме или в жидкой форме, имеющей высокую температуру кипения, для снижения температуры кипения используют вакуумное пространство, обеспечивая, таким образом, возможность испарения блокирующего соединения даже при сравнительно низких температурах. Таким образом, этот способ может быть эффективным для чувствительного к температуре блокирующего соединения.
Кроме того, обработку распылением предпочтительно проводят, например, в процессе конструирования производственной линии, в которой устанавливают насадку для распыления и распыляют раствор блокирующего соединения из насадки для распыления, так чтобы покрыть твердофазную подложку, на которую нанесена капля жидкости. Предпочтительно, после этого раствор блокирующего соединения, выпущенный из насадки для распыления в форме аэрозоля, обладает размером капель приблизительно от 10 мкм до 20 мкм, в идеальном случае, от 1 мкм до 5 мкм. Если размер его капель превышает диапазон, можно выявить след аэрозоля и его можно визуально отбраковать. Кроме того, поскольку капля жидкости, содержащая нанесенный зонд, обладает диаметром приблизительно от 50 мкм до 500 мкм, нанесенная капля жидкости может физически деформироваться, когда диаметр капель в аэрозоле является приблизительно одинаковым с размером капли жидкости, содержащей зонд для нанесения. Таким образом, этот размер капель аэрозоля не является желательным с точки зрения целей настоящего изобретения.
Альтернативно существуют способы блокирования при сохранении формы капли жидкости целой, без использования блокирующего соединения. Например, после образования капли жидкости на субстрате над субстратом можно подвесить маску, имеющую профиль, соответствующий форме капли жидкости с промежутками размером несколько сотен микрометров, с последующей инактивацией реакционно-способной группы на области фона посредством облучения электромагнитным излучением или корпускулярным излучением с высокой энергией, таким как рентгеновское излучение, α-излучение, β-излучение, γ-излучение, нейтронное излучение высокой энергии, электронное излучение, вакуумное ультрафиолетовое излучение или ультрафиолетовое излучение.
Кроме того, стадия удаления не вступившего в реакцию зонда, находящегося в нанесенной капле жидкости в соответствии с настоящим изобретением, представляет собой удаление капли жидкости жидкофазной обработкой водой, детергентом или сходными с ними. Высушивание после жидкофазной обработки можно проводить таким образом, чтобы влага удалялась из субстрата с помощью сжатого воздуха или посредством центрифугирования субстрата, с последующим естественным высушиванием или высушиванием посредством нагревания, или сходными с ними.
Кроме того, зонды для применения по настоящему изобретению включают, но не ограничиваются конкретно ими, при условии, что вещество способно специфично связываться со стандартным веществом, биологические макромолекулы, такие как белки (включая комплексные белки), нуклеиновые кислоты, цепи сахаров (включая комплексные сахара) и липиды (включая комплексные липиды). Конкретные их примеры включают ферменты, гормоны, феромоны, антитела, антигены, гаптены, пептиды, синтетические пептиды, ДНК, синтетические ДНК, РНК, синтетические РНК, ПНК, синтетические ПНК, ганглиозиды и лектины. В частности, предпочтительными являются олигонуклеотиды, полинуклеотиды или пептидные нуклеиновые кислоты. Кроме того, также они включают нуклеотидные производные или их аналоги.
Кроме того, когда в зонд введена тиольная группа, например, когда в качестве зонда используют автоматически синтезированную ДНК, для синтеза посредством автоматического устройства для синтеза ДНК можно использовать Thiol-Modifier (производимый Glen Research Corp.). Однако устройство не ограничивается конкретно им при условии, что можно эффективно встраивать тиольную группу.
С другой стороны, когда в зонд встроена аминогруппа, например, когда в качестве зонда используют автоматически синтезированную ДНК, для синтеза посредством автоматического устройства для синтеза ДНК можно использовать Amino-Modifier (изготовленный Glen Research Corp.), но устройство конкретно не ограничивается им, при условии, что можно эффективно встраивать аминогруппу.
Кроме того, способы нанесения на твердофазную подложку для иммобилизации зонда могут представлять собой способы нанесения раствора, при которых зонд растворяют или диспергируют в водном растворе посредством любого из способа бесконтактной печати, способа пинов, способа пинов с кольцом и т.п.
Среди упомянутых выше способов, способ бесконтактной печати является пригодным способом нанесения, поскольку с его помощью можно проводить точное нанесение с высокой плотностью. Способ бесконтактной печати представляет собой способ, в котором содержащий зонд раствор помещают в сверхтонкую насадку, в область конца насадки быстро подают давление или тепло для точного выпуска из конца насадки крайне низкого объема содержащего зонд раствора, давая ему возможность, таким образом, пролететь через пространство и прикрепляться к поверхности субстрата. Для нанесения способом бесконтактной печати компоненты, содержащиеся в растворе с зондом, не ограничиваются конкретными компонентами, при условии, что они по существу не влияют на зонд, когда их выпускают в качестве компонентов растворителя с зондом, и соответствуют требованиям для компонентов растворителей, которые обычно могут выпускаться на субстрат с использованием головки для бесконтактной печати. Например, когда головка для бесконтактной печати представляет собой головку для капельного напыления, имеющую механизм выпуска растворителя с применением тепловой энергии, предпочтительный компонент, предназначенный для включения в растворитель с зондом, представляет собой жидкость, содержащую глицерин, тиодигликоль, изопропиловый спирт и ацетиленовый спирт. Кроме того, для применения в качестве среды для зонда является пригодной, в частности, жидкость, содержащая от 5 до 10 мас.% глицерина, от 5 до 10 мас.%. тиодигликоля и от 0,5 до 1 мас.% ацетиленового спирта. Кроме того, когда головка для бесконтактной печати представляет собой пьезоголовку, которая выпускает раствор с использованием пьезоэлектрического элемента, предпочтительным компонентом, предназначенным для включения в растворитель с зондом, является жидкость, содержащая этиленгликоль и изопропиловый спирт. Более конкретно для применения в качестве растворителя для зонда является пригодной жидкость, содержащая от 5 до 10 мас.% этиленгликоля и от 0,5 до 2 мас.% изопропилового спирта.
Когда происходит выпуск раствора с зондом, полученного как описано выше, из головки для бесконтактной печати и прикрепление к субстрату, форма пятна является кругообразной и не происходит распространения области, на которую был выпущен раствор с зондом. Кроме того, объединение с соседним пятном может быть эффективно предотвращено, даже когда раствор с зондом наносят с высокой плотностью. В этом случае характерные признаки раствора с зондом по настоящему изобретению не ограничиваются признаками, описанными выше.
Кроме того, способ пинов, описанный выше, представляет собой способ, посредством которого зонд наносят на субстрат с использованием контактного пина, таким образом, зонд можно иммобилизовывать с помощью простого оборудования. Таким образом, полезно проводить оценку применимости зонда. Кроме того, субстраты по настоящему изобретению могут включать неорганические материалы и полимерные материалы, но не ограничиваться конкретно ими, при условии, что они ни препятствуют детекции подлежащего детекции вещества (вещества-мишени) с использованием субстрата с иммобилизованным зондом, полученным посредством иммобилизации зонда на субстрате. Предпочтительно, любой из этих субстратов может обладать реакционно-способной группой, такой как аминогруппа, малеинимидная группа, акриламидная группа, группа N-гидросукцинимидильного сложного эфира, формильная группа, карбоксильная группа или эпоксигруппа, которая встроена в его поверхность, или его можно выбирать из материалов, первоначально содержащих эти реакционно-способные группы, но не ограничивающихся этими реакционно-способными группами.
Когда для субстрата, в частности, используют неорганический материал, субстрат, поверхность которого обрабатывают сшивающим веществом на основе силана, имеющим, например, аминогруппу, является предпочтительным для внесения в него основной группы. В этом случае, материалы, которые могут подвергаться эффективной обработке сшивающим веществом на основе силана, такие как кварц, стекло, диоксид кремния, оксид алюминия, тальк, глина, алюминий, гидроксид алюминия, железо, слюда и т.п., являются особенно предпочтительными, и также можно использовать оксиды, такие как оксид титана, оксид цинка и оксид железа. Бесщелочное стекло, не содержащее щелочных компонентов и т.п., или кристаллический материал субстрата являются особенно предпочтительными с учетом выявления веществ-мишеней и их универсальности в качестве материала. Примеры сшивающего вещества на основе силана, имеющего аминогруппу, включают N-β-(аминоэтил)-γ-аминопропилтриалкоксисилан, N-β-(аминоэтил)-γ-аминопропилметилдиалкоксисилан, γ-аминопропилтриалкоксисилан и γ-аминопропилметилдиалкоксисилан. В случае алкоксисилильной группы предпочтительными являются способные к быстрому гидролизу метоксисилильная группа или этоксисилильная группа.
Кроме того, полимерные материалы включают, предпочтительно, материалы, имеющие основные группы, такие как аминогруппа, или группы, в которые можно легко встраивать основные группы. Например, приводится способ использования полиамида, имеющего аминогруппу на своем конце и способ удаления защитной группы посредством обеспечения сополимеризации защищенной аминогруппы с веществом, имеющим винильную группу.
В этом случае, сшивающее вещество на основе силана по настоящему изобретению относится к любому из соединений, имеющих органическую функциональную группу, которая может вступать в реакцию с органическим соединением, таким как смола, и фрагмент, который может быть связан с неорганическим соединением, таким как стекло, через силоксановую связь. Форма субстрата не ограничена, однако, например, предпочтительной формой субстрата может быть ДНК-чип, вследствие его универсальности в способах детекции, устройствах и т.д. Кроме того, материал субстрата предпочтительно представляет собой материал с высокой равномерностью поверхности. В частности, предпочтительно он представляет собой субстрат с размерами приблизительно 1 дюйм x 3 дюйма и толщиной приблизительно от 0,7 до 1,5 мм.
Кроме того, блокирующее соединение по настоящему изобретению предпочтительно представляет собой соединение, которое содержит в молекуле, ту же реакционно-способную группу, что и зонд, подлежащий вступлению в реакцию с субстратом. Таким образом, при наличии в молекуле блокирующего соединения такой же реакционно-способной группы, что и в зонде, такое блокирующее соединение обладает преимуществом в том, что его можно легко контролировать, поскольку реакцию блокирования области фона можно проводить тем же механизмом, что и в случае способа связывания для иммобилизации зонда на субстрате. Кроме того, предпочтительно, чтобы блокирующее соединение по настоящему изобретению обладало основным химическим остовом, который не адсорбируется к веществу-мишени. Кроме того, для предотвращения взаимодействия блокирующего соединения с веществом-мишенью после завершения реакции блокирования блокирующее соединение предпочтительно может обладать одной реакционно-способной группой в молекуле. Однако можно использовать блокирующее соединение, имеющее в молекуле две или более активных групп, при условии, что активные группы практически не взаимодействуют с веществом-мишенью.
Для конкретного блокирующего соединения, когда реакционно-способная группа зонда представляет собой тиольную группу, желательным является соединение, имеющее основную химическую структуру, как показано на фиг.1. На фиг.1, n=от 0 до 100, m=от 0 до 25, каждый из от R1 до R22 независимо выбраны из группы, состоящей из H, OH, CH3, NH2, CH2-CH3, CH=CH3, X, CH2X, CHX2, CH2-CH2X, CX3, CX2-(CX2)m-CX3, O-(CH2)m-CH3, (CH2)m-OH, (CH2)m-C(=0)-OH, (CH2)m-NH2, (CH2)m-SH и C(=0)-(CH2)m-CH3, и каждый X выбран из галогенов; при условии, что каждая группа, соответствующая (CX2)m и (CH2)m, может быть разветвленной с учетом каждой из CX2-(CX2)m-CX3, O-(CH2)m-CH3, (CH2)m-OH, (CH2)m-C(=O)-OH, (CH2)m-NH2 и (CH2)m-SH, и каждый из разветвленных концов выбран из группы, состоящей из CX3, CH3, OH, C(=O)-OH, C(=O)-H, NH2 и SH.
Кроме того, когда реакционно-способная группа зонда представляет собой аминогруппу, желательным является соединение, имеющее основную химическую структуру, как показано на фиг.2. На фиг.2, n=от 0 до 100, m=до 0 до 25, каждый из от R23 до R95 независимо выбраны из группы, состоящей из H, OH, CH3, NH2, CH2-CH3, CH=CH3, X, CH2X, CHX2, CH2-CH2X, CX3, CX2-(CX2)m-CX3, O-(CH2)m-CH3, (CH2)m-OH, (CH2)m-C(=O)-OH, (CH2)m-NH2, (CH2)m-SH, и C(=O)-(CH2)m-CH3, и каждый из X выбран из галогенов; при условии, что каждая группа, соответствующая (CX2)m и (CH2)m, может быть разветвленной с учетом каждой из CX2-(CX2)m-CX3, O-(CH2)m-CH3, (CH2)m-OH, (CH2)m-C(=O)-OH, (CH2)m-NH2 и (CH2)m-SH, и каждый из разветвленных концов выбран из группы, состоящей из CX3, CH3, OH, C(=O)-OH, C(=0)-H, NH2 и SH.
Кроме того, реакцию любого из этих блокирующих соединений с поверхностью субстрата можно подтвердить с помощью способа анализа поверхности, посредством которого в двумерном профиле отображают показатель детекции фрагмента из TOF-SIMS (время прохождения - масс-спектрометрия вторичных ионов) или сходные с ним, а затем анализируют. Конкретно носитель с иммобилизованным зондом, на котором проведена реакция блокирования, промывают очищенной водой, а затем сушат продувкой N2 или сходными с ней. Затем полученный продукт подвергают анализу поверхности с помощью TOF-SIMS. Сосредотачивая внимания на атоме серы (S) в отношении сочетания меченого тиолом зонда с блокирующим соединением, содержащим тиольную группу, и сосредотачивая внимания на атоме азота (N) в отношении сочетания меченого посредством амино зонда с блокирующим соединением, содержащим аминогруппу, показатели детекции фрагмента для носителей с иммобилизованным зондом отображают в двумерных профилях и анализируют соответственно. В результате, определяют показатели детекции для атома S или N в области пятна и вне области пятна, так чтобы разница между показателями детекции снижалась по сравнению с показателями неблокированных носителей с иммобилизованным зондом. Кроме того, в этом способе анализа, если реакционно-способная группа зонда является такой же, как и группа блокирующего соединения, внимание можно сосредотачивать на фрагменте, специфичном для реакционно-способной группы, и анализировать, не ограничиваясь атомом серы (S) или азота (N).
Примеры
<Пример 1>Блокирование в случае применения меченого тиолом ДНК-зонда
(i) Синтез зонда и синтез флуоресцентно меченого вещества-мишени (мишени)
В качестве зонда, способного специфично связываться с веществом-мишенью, использовали одноцепочечный ДНК-зонд. Одноцепочечную нуклеиновую кислоту SEQ ID No. 1 синтезировали с использованием автоматического устройства для синтеза ДНК. Кроме того, в случае синтеза с помощью автоматического устройства для синтеза ДНК, на конец одноцепочечной ДНК с SEQ ID No. 1 встраивали группу меркапто (SH) с использованием устройства Thiol-Modifier (произведенного Glen Research Corp.). Затем проводили обычный процесс удаления защитной группы, затем выделяли и очищали ДНК с использованием высокоэффективной жидкостной хроматографии, а затем проводили эксперименты, описанные ниже.
SEQ ID No. 1:
5'-HS-(CH2)6-O-PO2-O-ACTGGCCGTCGTTTTACA-3'
Кроме того, синтезировали немеченую одноцепочечную ДНК, имеющую последовательность оснований, комплеметнарную одноцепочечному ДНК-зонду SEQ ID No. 1, описанному выше, посредством автоматического устройства для синтеза ДНК, а затем к 5'-концу одноцепочечного ДНК-зонда присоединяли Cy3, с получением, таким образом, меченой одноцепочечной ДНК (мишени).
(ii) Получение носителя с иммобилизованный зондом [Промывание основного планшета]
В качестве субстрата для носителя с иммобилизованным зондом использовали основной планшет, изготовленный из синтетического кварцевого стекла площадью один дюйм на три дюйма. Основной планшет из кварцевого стекла промывали следующим образом: промывание очищенной водой с помощью щетки, промывание очищенной водой, ультразвуковая очистка с помощью щелочного детергента, промывание очищенной водой, ультразвуковая очистка очищенной водой, промывание очищенной водой, и высушивание продувкой N2 проводили в соответствии с общепринятыми способами, получая, таким образом, основной планшет из кварцевого стекла, имеющий очищенную поверхность.
[Обработка поверхности]
Сшивающее вещество на основе аминосилана (торговое название: KBM-603, изготавливаемое Shin-Etsu Chemical Co., Ltd.) растворяли до концентрации 1 мас.%, а затем перемешивали в течение 30 минут для обеспечения гидролиза метоксигруппы. В полученный водный раствор погружали покровное стекло на 30 минут (нагретое до 80°C на горячей бане), а затем извлекали и промывали очищенной водой с последующей сушкой в течение 1 часа при 120°C в сушильной печи. Затем взвешивали 2,7 мг N-малеимидокапроилоксисукцинимида (изготавливаемого DOJINDO LABORATORIES., в дальнейшем в данном описании сокращаемого как EMCS) и растворяли в растворе диметилсульфоксида (DMSO)/этанол (1:1) до конечной концентрации 0,3 мг/мл, получая, таким образом, раствор EMCS. Основной планшет из кварцевого стекла с внесенной аминогруппой, который подвергали сушке, погружали в раствор EMCS на 2 часа при комнатной температуре для встраивания группы малеинимида на поверхность основного планшета. После обработки раствором EMCS основной планшет последовательно промывали раствором смеси DMSO/этанол и этанолом, а затем сушили в атмосфере азота.
[Иммобилизация зонда]
Фрагмент одноцепочечного ДНК-зонда (SEQ ID No. 1), синтезированный, как в указанном выше п.(i), растворяли в водном растворе, содержащем 7,5 мас.% глицерина, 7,5 мас.% мочевины, 7,5 мас.% тиодигликоля, и 1,0 мас.% ацетиленового спирта (торговое название: Ацетиленол E100, изготавливаемый Kawaken Fine Chemicals Co., Ltd.). Получали пять различных типов указанного выше водного раствора так, чтобы концентрация зонда в них составляла 8,75, 26,25, 43,75, 61,25, и 87,5 мкМ соответственно. В этом случае известно, что насыщающая концентрация меченого тиолом зонда в реакционной смеси составляет приблизительно 50 мкМ, с учетом количества группы малеинимида на основном планшете. Емкость для жидкости для нанесения принтера для капельного нанесения (торговое название: BJF-850, производимый Canon Inc.) заполняли содержащим зонд раствором, а затем устанавливали головку принтера. В этом случае используемый принтер для капельного нанесения модифицируют таким образом, чтобы он был способен к бесконтактной печати на плоском планшете. Кроме того, модифицированный принтер для капельного нанесения способен наносить приблизительно 5-пл каплю раствора ДНК с расстоянием приблизительно 120 мкм посредством введения параметров печати в принтер в соответствии с определенным способом создания файлов. Затем модифицированный принтер для капельного нанесения используют для нанесения раствора ДНК-зонда на поверхность основного планшета из стекла. Затем основной планшет оставляют в термогидростате для обеспечения прохождения реакции с основным планшетом для иммобилизации на нем с получением, таким образом, носителя с иммобилизованным зондом.
(iii) Блокирование носителя с иммобилизованным зондом
Блокирующее вещество исследовали с использованием 1-пропантиола, соединения (1), представленного на фиг.1, где R1=CH3 и n=2.
Для блокирования чашку Петри, содержащую 10 мл 1-пропантиола, помещали в закрытую камеру. Затем в кассету устанавливали носитель с иммобилизованным зондом, на котором оставался нанесенный раствор, полученный, как указано выше в п.(ii), а затем кассету помещали и закрывали в указанной выше закрытой камере. После нахождения в течение 1 часа при нормальной температуре в этих условиях, проводили реакцию блокирования в области пятна посредством обработки газовой фазой. Затем носитель с иммобилизованным зондом промывали 1 М NaCl/50 мМ фосфатно-солевым буфером (pH 7,0), а затем быстро промывали очищенной водой с последующим высушиванием продувкой азотом с получением, таким образом, носителя с иммобилизованным зондом для гибридизации. Кроме того, для сравнения получали другой носитель с иммобилизованным зондом без блокирующей обработки. В этом случае носитель с иммобилизованным зондом, на который нанесен раствор, полученный, как указано выше в п.(ii), промывали 1 М NaCl/50 мМ фосфатно-солевым буфером (pH 7,0). Затем его быстро промывали очищенной водой, а затем высушивали продувкой азотом.
(iv) Гибридизация и флуоресцентная оценка
Флуоресцентно меченое вещество-мишень, синтезированное, как указано выше в п.(i), растворяли в 1 М NaCl/50-мМ фосфатно-солевом буфере (pH 7,0) до конечной концентрации 5 нМ. В этот раствор погружали промытый носитель с иммобилизованным зондом, а затем проводили гибридизацию в течение 2 часов при температуре 45°C. После обработки носитель с иммобилизованным зондом промывали 1 М NaCl/50 мМ фосфатно-солевым буфером (pH 7,0) для удаления негибридизованной одноцепочечной ДНК. Затем ее быстро промывали очищенной водой, а затем после удаления соли высушивали продувкой N2. Интенсивность флуоресценции пятна на носителе с иммобилизованным зондом определяли с использованием флуоресцентного сканнера (торговое название: GenePix 4000B, производимый Axon Instruments, Inc.). В этом случае использовали одинаковые условия измерения как в образцах, так и в сравнительных образцах (измерение интенсивности флуоресценции при длине волны 532 нм).
(v) Результаты
Результаты, представленные на фиг.3, получали посредством построения графиков уровней средней яркости, полученной из яркости флуоресценции в вокруг пятна (фон) в присутствии или отсутствие блокирования 1-пропантиолом относительно концентрации зонда (стандартный уровень фона определяли в условиях, в которых зонд обладал наименьшей концентрацией, составляющей 8,75 мкМ в отсутствие блокирования).
В условиях отсутствия блокирования можно выявить резкое возрастание для фона при концентрации 61,25 мкМ, которая является не меньшей, чем насыщающая концентрация зонда (на флуоресцентном изображении это подтверждается тем, что из пятна произошла интенсивная утечка). С другой стороны, в условиях наличия блокирования не было выявлено возрастания фона даже при концентрации 61,25 мкМ или более, которая является не меньшей, чем насыщающая концентрация зонда. Иными словами, показано, что была достигнута инактивация (блокирование) способами, которые не изменяют форму нанесенного зонда по настоящему изобретению.
<Пример 2>Блокирование при применении амино-меченого ДНК-зонда
(i) Синтез зонда, зонда с комплементарной ему цепью, и синтез флуоресцентно меченого вещества-мишени (мишени)
В качестве зонда, способного специфично связываться с веществом-мишенью, использовали одноцепочечный ДНК-зонд. Одноцепочечную нуклеиновую кислоту SEQ ID No 2 синтезировали с использованием автоматического устройства для синтеза ДНК. Кроме того, при синтезе посредством автоматического устройства для синтеза ДНК в конец одноцепочечной ДНК SEQ ID No. 2 встраивали аминогруппу (NH2) с использованием Amino-Modifier (изготовленного Glen Research Corp.). Затем проводили обычный процесс удаления защитной группы, а затем выделяли и очищали ДНК с использованием высокоэффективной жидкостной хроматографии, с последующим проведением экспериментов, описанных ниже.
SEQ ID No. 2: 5'-NH2-(CH2)S-O-PO2-O-ACTGGCCGTCGTTTTACA-3'
Кроме того, посредством автоматического устройства для синтеза ДНК синтезировали одноцепочечный ДНК-зонд, имеющий последовательность оснований, комплементарную одноцепочечному ДНК-зонду с SEQ ID No. 2, описанному выше, а затем к 5'-концу одноцепочечного ДНК-зонда присоединяли Cy3 с получением, таким образом, меченой одноцепочечной ДНК (мишени).
(ii) Изготовление носителя с иммобилизованным зондом
[Промывание основного планшета]
В качестве субстрата для носителя с иммобилизованным зондом использовали основной планшет, изготовленный из синтетического кварцевого стекла площадью один дюйм на три дюйма. Основной планшет из кварцевого стекла промывали следующим образом: промывание очищенной водой с помощью щетки, промывание очищенной водой, ультразвуковая очистка с помощью щелочного детергента, промывание очищенной водой, ультразвуковая очистка очищенной водой, промывание очищенной водой и высушивание продувкой N2 проводили в соответствии с общепринятыми способами, получая, таким образом, основной планшет из кварцевого стекла, имеющий очищенную поверхность.
[Обработка поверхности]
50 мас.% водный раствор этанола, содержащий 1 мас.% сшивающего вещества на основе силана (торговое название: KBM403, изготавливаемый Shin-Etsu Chemical Co., Ltd.), включающего соединение силана (γ-глицидоксипропилтриметоксисилан), присоединенное к эпоксисмоле, перемешивали в течение 3 часов при комнатной температуре для обеспечения гидролиза метоксигруппы в соединении силана. Затем раствор наносили на поверхность указанного выше основного планшета с использованием устройства для нанесения покрытий с вращением, нагревали до 100°C в течение 5 минут и сушили с получением поверхности основного планшета с эпоксигруппой.
[Иммобилизация зонда]
В раствор TE (pH 8), содержащий NaCl в концентрации 50 мМ, растворяли как амино-меченые ДНК-зонды, так и немеченые одноцепочечные ДНК-зонды, до конечной концентрации 200 мкМ, получая, таким образом, раствор амино-меченого ДНК-зонда и немеченого одноцепочечного ДНК-зонда. Затем к 100 мкл раствора, содержащего амино-меченый ДНК-зонд, добавляли 100 мкл раствора, содержащего немеченый одноцепочечный ДНК-зонд, а затем смешивали. Полученный смешанный раствор линейно охлаждали от 90°C до 25°C в течение 2 часов с получением, таким образом, гибрида между каждым ДНК-зондом и каждой одноцепочечной нуклеиновой кислотой. Затем раствор, содержащий гибрид амино-меченого ДНК-зонда SEQ ID No. 2, описанного выше, добавляли к водному раствору, содержащему 7,5 мас.% глицерина, 7,5 мас.% мочевины, 7,5 мас.% тиодигликоля, и 1,0 мас.% ацетиленового спирта (торговое название: Ацетиленол EH, изготавливаемый Kawaken Fine Chemicals Co., Ltd.) до конечной концентрации гибрида 8, 24, 40, 56, 72, 88 и 104 мкМ (т.е. исследование проводили при семи различных концентрациях). В этом случае было известно, что насыщающая концентрация амино-меченого зонда в реакционной смеси составляет приблизительно 65 мкМ относительно количества эпоксигрупп на основном планшете.
Содержащий зонд раствор наносили на основной планшет тем же способом, что и в примере 1, а затем помещали на 12 часов в термогидростат для обеспечения реакции аминогруппы зонда с эпоксигруппой основного планшета, чтобы произошла иммобилизация на нем, получая, таким образом, носитель с иммобилизованным зондом. В этом случае аминогруппа основания зонда образует гибрид с полностью комплементарной одноцепочечной ДНК, так что она не может реагировать с эпоксигруппой основного планшета.
(iii) Блокирование носителя с иммобилизованным зондом
Блокирующее вещество исследовали с использованием этаноламина соединения (9), представленного на фиг.2, где R23=CH3 и n=2.
Для блокирования чашку Петри, содержащую 10 мл этаноламина, помещали в закрытую камеру, оставляя чашку Петри на горячей плите. Затем в кассету устанавливали носитель с иммобилизованным зондом, на котором оставался нанесенный раствор, полученный как указано выше в п.(ii), а затем кассету помещали и закрывали в указанной выше закрытой камере. Затем нагревательную плитку устанавливали на 60°C для испарения этаноламина из чашки Петри, а затем оставляли в таком виде в течение 6 часов для реакции блокирования вокруг пятна. Затем основной планшет промывали очищенной водой при 80°C в течение 10 минут для диссоциации комплементарной цепи, гибридизованной с зондом, связанным с основным планшетом, смывая ее, и затем сушили продувкой азотом с получением, таким образом, носителя с иммобилизованным зондом для гибридизации. Кроме того, для сравнения получали другой носитель с иммобилизованным зондом без блокирования. В этом случае носитель с иммобилизованным зондом, нанесенным в растворе для нанесения, полученном, как указано выше в п.(ii), промывали очищенной водой при 80°C в течение 10 минут для диссоциации комплементарной цепи, гибридизованной с зондом, связанным с основным планшетом, смывая ее, а затем высушивали продувкой азотом.
(iv) Гибридизация и флуоресцентная оценка
Флуоресцентно меченое вещество-мишень, синтезированное, как указано выше в п.(i), растворяли в 1 М NaCl/50-мМ фосфатно-солевом буфере (pH 7,0) до конечной концентрации 5 нМ. В этот раствор погружали промытый носитель с иммобилизованным зондом, а затем проводили гибридизацию в течение 2 часов при температуре 45°C. После обработки носитель с иммобилизованным зондом промывали 1 М NaCl/50 мМ фосфатно-солевым буфером (pH 7,0) для удаления негибридизованной одноцепочечной ДНК, а затем ее быстро промывали очищенной водой с последующим удалением соли и высушиванием продувкой азотом.
Интенсивность флуоресценции пятна на носителе с иммобилизованным зондом определяли с использованием флуоресцентного сканнера (торговое название: GenePix 4000B, изготовленный Axon Instruments, Inc.). В этом случае использовали одинаковые условия измерения как в образцах, так и в сравнительных образцах (измерение интенсивности флуоресценции при длине волны 532 нм).
(v) Результаты
Результаты, представленные на фиг.4, получали посредством построения графиков уровней средней яркости, полученной из яркости флуоресценции в вокруг пятна (фон) в присутствии или отсутствие блокирования этаноламином относительно концентраций зонда (стандартный уровень фона определяли в условиях, в которых зонд обладал наименьшей концентрацией, составляющей 8 мкМ в отсутствие блокирования).
Исходя из результатов, в условиях отсутствия блокирования выявляется кратковременное возрастание фона при концентрации 72 мкМ, которая является не меньшей, чем насыщающая концентрация зонда (на флуоресцентном изображении это подтверждает утечку из пятна). С другой стороны, в условиях наличия блокирования не наблюдается возрастания фона даже при концентрации 72 мкМ или более, которая является не меньшей, чем насыщающая концентрация зонда. Таким образом, показано, что достигнута инактивация (блокирование) способами, которые не изменяют форму нанесенного зонда по настоящему изобретению.
Как очевидно из описанных выше примеров, способ изготовления по настоящему изобретению является особенно пригодным, когда зонд иммобилизуют на определенный период с высокой плотностью. Иными словами, если зонд иммобилизуют с высокой плотностью, то количество зонда в подлежащей нанесению капле жидкости должно быть повышено (т.е. он должен быть значительно более концентрированным). Однако может быть получен избыток количества зонда, который не вступает в реакцию с реакционно-способной группой основного планшета и он может связываться с периферией, вызывая, таким образом, проблему возрастания фона. Эту проблему можно устранить посредством настоящего изобретения.
Кроме того, вариант осуществления носителя с иммобилизованным зондом, изготовленного в соответствии с настоящим изобретением, содержит первую область на поверхности носителя, на которой иммобилизована нуклеиновая кислота-зонд, и вторую область, имеющую блокирующее вещество снаружи, на периферии первой области. Первую область конструируют по существу без размещения зонда, фиксированного на первой области, в то время как вторую область конструируют на первой области по существу в отсутствие нуклеиновой кислоты-зонда, фиксированной на первой области.
Таким образом, можно получить пригодный носитель с иммобилизованным зондом, имеющий высокую чувствительность детекции, где по существу нет неспецифичной адсорбции стандартной нуклеиновой кислоты на окружающую область, а также высокой чувствительности детекции.
Настоящее изобретение не ограничивается указанными выше вариантами осуществления и можно проводить различные изменения и модификации сущности и объема настоящего изобретения. Таким образом, для предоставления обществу объема настоящего изобретения приведена следующая формула изобретения.
По данной заявке испрашивается приоритет по японской патентной заявке No. 2005-170777, поданной 10 июня 2005 года, которая включена в настоящее описание в качестве ссылки.
Реферат
Изобретение относится к биохимии и молекулярной биологии. Предложен способ изготовления носителя с иммобилизованным зондом для детекции вещества-мишени. Используют субстрат, содержащий реакционно-способную группу для иммобилизации на нем зонда и проводят стадии: (i) нанесения капли жидкости, содержащей зонд, на субстрат; (ii) инактивации реакционно-способной группы, находящейся в области, отличной от области нанесения на субстрате, и (iii) удаления не вступившего в реакцию зонда, находящегося в нанесенной капле жидкости. Способ позволяет предотвратить загрязнение пятна другим пятном, предотвратить неспецифичную адсорбцию к области фона при изготовлении носителя с иммобилизованным зондом и неспецифичную адсорбцию после образования матрицы. 15 з.п. ф-лы, 4 ил.
Формула
(i) нанесения капли жидкости, содержащей зонд, на субстрат;
(ii) инактивации реакционно-способной группы, находящейся в области, отличной от области нанесения, на субстрате; и
(iii) удаления не вступившего в реакцию зонда, находящегося в нанесенной капле жидкости;
где зонд представляет собой зонд на основе нуклеиновой кислоты, включающий олигонуклеотид, полинуклеотид, ДНК, РНК, ПНК.

Комментарии