Способ разложения воды с утилизацией диоксида углерода и выделением водорода - RU2540313C2
Код документа: RU2540313C2
Чертежи


Описание
Изобретение относится к способам разложения воды и может быть использовано в энергетике для утилизации диоксида углерода и получения водорода.
Интерес к получению водорода из воды в последние годы неуклонно растет. Объясняется это тем, что водород является неисчерпаемым и экологически чистым носителем энергии. При сжигании водорода, в отличие от органических топлив, не образуется экологически вредный диоксид углерода (CO2), влияющий на глобальное потепление климата. Сегодня промышленные выбросы CO2 в атмосферу принимают катастрофические размеры. Поэтому вопрос об утилизации CO2 является очень актуальным и своевременным.
Известно, что в 1 литре воды содержится 111.11 г водорода и 888.89 г кислорода. При этом 1 литр водорода при нормальных условиях весит 0.0846 г, а один литр кислорода - 1.47 г. Тем самым из 1 литра воды можно получить 111.11/0.0846=1313.36 л газообразного водорода и 888.89/1.47=604.69 л кислорода. Из этого также следует, что 1 г воды содержит 1.31 л водорода и 0.60 л кислорода. Затраты энергии на получение 1 л водорода из воды методом электролиза сейчас составляют 4 Втч [2]. Так как из 1 г воды образуется 1.31 л водорода, то на получение водорода из 1 г воды расходуется 1.31×4=5.25 Втч. По тем же данным, при сжигании 1 л водорода выделяется 3.55 Втч энергии.
Таким образом, затраты энергии на получение водорода из воды в 1.5 раза превышают энергию, выделяющуюся при его сжигании.
Существует ряд способов и устройств, позволяющих улучшить это соотношение.
С. Мэйером (США) запатентовано устройство, названное «электрической ячейкой» (Patent US 4936961 "Метод для производства топливного газа"), которое позволяет разлагать воду на водород и кислород с гораздо меньшей затратой энергии, чем требуется при обычном электролизе. В отличие от обычного электролиза воды, требующего тока порядка нескольких ампер, данное устройство производит тот же эффект при токе в несколько миллиампер. Устройство работает в импульсном режиме на частоте, возбуждающей собственные колебания химической связи водорода с кислородом в молекуле воды. Подстройка частоты осуществляется схемой накачки с использованием импульсного генератора с напряжением в импульсе десятки тысяч вольт, который ступенчато поднимает потенциал на электродах устройства. Продолжительная работа прибора в режиме резонанса приводит к тому, что уровень колебательной энергии молекул воды возрастает с каждым импульсом. В некоторый момент электрическая связь в молекуле ослабляется настолько, что сила внешнего электрического поля превосходит энергию связи, и атомы кислорода и водорода освобождаются как самостоятельные газы.
Ф.М. Канаревым создан низкоамперный электролизер иной конструкции (Патент РФ RU 2277138 "Устройство для получения водорода и кислорода"), также работающий в импульсном режиме. Эксперименты показали, что при электролизе воды с использованием данного устройства расход энергии на грамм воды, перешедшей в газы, удается уменьшить почти в 2000 раз. Электролизер работает на частоте 208.3 Гц при длительности импульсов 0.29 мс. Средняя амплитуда напряжения и тока в импульсе соответственно составляли 2 В и 20 мА. По мнению автора, данное устройство с энергетической точки зрения позволяет приблизить процесс электролиза воды к естественному процессу фотосинтеза. В этом устройстве фактически также реализуется резонансный механизм разложения воды на водород и кислород, но при существенно меньшем напряжении в импульсе, чем в электрической ячейке С. Мэйера.
Наиболее близким аналогом к настоящему изобретению по эффективности и назначению является способ электролиза воды (Patent US 2010/0133111 A1), осуществляющий деструкцию молекул воды под действием световой энергии и технически позволяющий эффективно разделять воду на кислород и водород в присутствии специально подобранных каталитических материалов, фотоанодов и фотоэлектрических ячеек.
Степень реализуемости указанных решений для производства водорода в промышленных масштабах оценить трудно.
Во-первых, приводимые в патентах результаты лабораторных экспериментов проведены в стационарных условиях, тогда как промышленное производство требует динамического разложения воды в потоке.
Во-вторых, промышленное производство водорода предполагает использование реакторов во много раз больших размеров. При этом могут возникнуть сложности, как при возбуждении в воде резонанса, так и при воздействии на поток воды световой энергии.
Основной задачей, положенной в основу предложенного изобретения, было создать эффективный способ утилизации диоксида углерода с использованием воды и с обеспечением экономичного получения водорода.
Для решения поставленной задачи предложен способ разложения воды с утилизацией диоксида углерода и выделением водорода, согласно которому:
Под давлением подают исходные реагенты: вода и диоксид углерода, по меньшей мере в один реактор, выполненный в виде герметичной емкости, содержащей катализатор. Исходные реагенты могут быть в виде готовой карбонизированной воды или в виде отдельно подаваемых и смешиваемых компонентов, например, емкость может быть заполнена водой, а диоксид углерода подаваться для получения карбонизированной воды. Предпочтительно использовать пресную воду, но можно и морскую с или без обработки до требуемого содержания солей. Кроме того, степень насыщения воды диоксидом углерода можно регулировать, что создает дополнительные преимущества для контроля проведения химической реакции. Целью данной стадии является утилизация диоксида углерода посредством получения карбонизированной воды для последующей химической реакции.
Проводят химическую реакцию смеси исходных реагентов в присутствии катализатора. Требования к катализатору рассмотрены ниже по тексту.
Образовавшиеся в ходе химической реакции водород, кислород и другие продукты поступают после реактора по меньшей мере в один сепаратор.
Отделяют продукты реакции в сепараторе от исходных реагентов и промежуточных продуктов реакции, с выделением из газообразной фазы водорода.
В качестве катализатора могут быть использованы металлы, сплавы, окислы, минералы или растворы, обеспечивающие разложение карбонизированной воды в ходе химической реакции без приложения дополнительной энергии извне.
Предпочтительно использование нескольких реакторов с различными или одинаковыми катализаторами. Предложенный способ может быть реализован в виде одно- или многокаскадного процесса. Целесообразно, чтобы каждый реактор был соединен с по меньшей мере одним сепаратором. Можно использовать несколько сепараторов. При этом возможно, чтобы каждый сепаратор служил для выделения по меньшей мере одного продукта реакции. Как правило, сепаратор дополнительно содержит по меньшей мере два фильтра, обеспечивающих разделение газообразных и жидких конечных продуктов реакции на компоненты. Продукты реакции включают углеводороды, водород и кислород.
В предложенном изобретении предлагается использовать обнаруженный авторами природный механизм разложения воды. Этот механизм, как и фотосинтез, широко распространен в природе. Но в отличие от других способов для его осуществления не требуется приложения дополнительной энергии.
Известно [3], что во многих процессах, происходящих в верхней части земной коры, имеет место деструкция молекул подземных вод с образованием больших количеств водорода и кислорода. Водород активно замещает металлы в структуре первичных минералов, образуя глины, тогда как кислород обычно поглощается карбонатами. Параллельно протекают и противоположные процессы - синтез воды из водорода и кислорода, а также ее высвобождение при литогенезе осадочных пород и разложении карбонатов с выделением CO2.
Экспериментально доказано, что в условиях земной коры может происходить восстановление углерода из карбонатов и CO2 и водорода из воды с образованием широкого ряда углеводородов газонефтяного ряда [4]. По мнению авторов данной работы, главную роль в этих процессах играют свободные электроны, возникающие при тектоно-сейсмической деформации пород на границах зерен минералов с разными электрохимическими свойствами. Эксперименты проводились на двух установках, механически активизировавших физико-химические процессы в геологической среде. В одной установке активизация достигалась путем создания в модельной среде слабых упругих деформаций, а во второй - циркуляцией через модель морской воды. Активизировались образцы, содержащие сидерит, пирит, кварц и др. минералы, типичные для осадочных пород. Объем моделей не указан. Исследования велись при атмосферном давлении и температурах от 20 до 90°С в течение времени от 1 до 200 суток. В продуктах реакции были обнаружены газообразные (CH4, С2Н6 и C3H8) и жидкие (С11-С31) углеводороды. При десятисуточной механической активизации выход углеводородов на 1 кг исходного материала, по данным авторов работы [4], составил около 200 см3 для газов и 20 г для жидких компонентов. Образование углеводородов ускоряло циркуляцию воды через образец и повышение температуры.
Анализируя результаты этих экспериментов и другие известные факты, авторы настоящего изобретения пришли к заключению, что необходимым условием синтеза углеводородов в земной коре является распад молекул воды. При этом деструкция воды в геологических средах может происходить и без подвода дополнительной энергии извне.
Для обоснования этого вывода, положенного в основу настоящего изобретения, был проведен комплекс экспериментов. В отличие от работ других авторов эксперимент преследовал цель доказать, что в земной коре распад молекул карбонизированной воды с образованием водорода и углеводородов происходит всегда. И этот процесс можно технически использовать для их получения без подвода дополнительной энергии.
Чертежи, поясняющие изобретение
Фиг.1 - схематичное изображение экспериментальной установки.
Фиг.2 - графики изменения со временем давления в реакторе, заполненном железной стружкой.
Фиг.3 - графики изменения массы распавшейся в стационарных экспериментах (фиг.2) воды, рассчитанной по количеству образовавшегося газа.
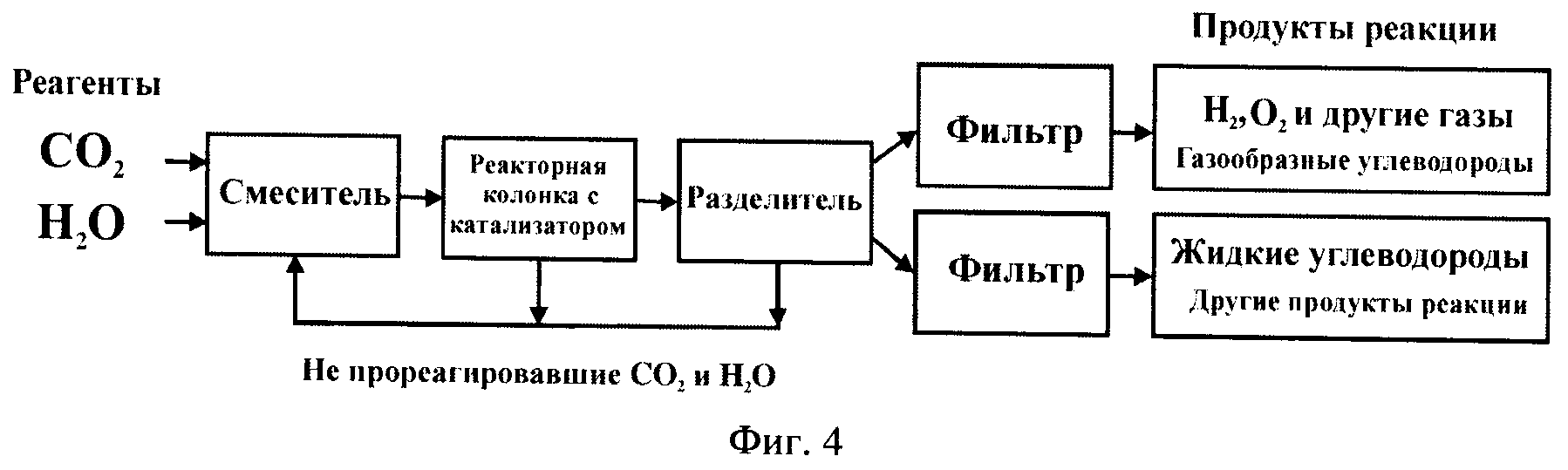
Фиг.4 - блок-схема установки разложения карбонизированной воды предлагаемым способом.
Экспериментальное обоснование изобретения, примеры осуществления
Эксперименты проводились на установке, схематично показанной на фиг.1.
Эксперимент состоял в заполнении герметичной емкости с находящейся в ней насыпной средой, моделировавшей осадочную горную породу, насыщенной CO2 водой, эмитировавшей карбонизированные подземные воды.
Эксперимент заключался в следующем:
1) измерение роста давления в емкости со временем, что указывало на разрушение в ней воды, и
2) определение химического состава возникавших при этом газообразных продуктов.
Установка включала реакционную колонку 1, заполненную насыпной модельной средой, выполнявшей роль катализатора, на вход которой из смесителя 2 подавалась карбонизированная вода с определенной концентрацией растворенного диоксида углерода. Из реакционной колонки жидкость поступала в сепаратор-накопитель 3, где происходило отделение от нее газообразных продуктов реакции, которые анализировались газоанализатором 4. В отдельных экспериментах газообразные продукты пропускались через раствор щелочи, позволявший связывать поступавший из реактора не прореагировавший CO2.
Смесителем служил бак емкостью 20 л, выдерживавший давление 15 атм. Для приготовления карбонизированной воды использовался баллон с диоксидом углерода 5. Концентрация CO2 в воде регулировалась давлением и временем насыщения этим газом воды, залитой в смеситель. На приготовление карбонизированной воды отводилось от одного до нескольких часов.
Реакционная колонка представляла собой отрезок пластиковой трубы длиной 1 м и внутренним диаметром 19 мм. С внешней стороны трубки для нагревания в отдельных экспериментах размещалась изолированная электрическая спираль. Газоанализатором служил полевой хроматограф «Хромопласт-001», предназначенный для измерения содержания водорода, метана, этана, пропана, изобутана, бутана, изопентана и пентана в газовой смеси в промысловых условиях.
В качестве модельной среды, выполнявшей роль катализатора, использовались типичные осадочные породы, содержавшие SiO2, а также железо и его главные окислы FeO, Fe3O4 и Fe2O3. Наибольший эффект наблюдался при заполнении реактора стальной стружкой. Предпочтительно использовать пористые материалы в качестве катализаторов. Объем пустотного пространства в реакторной колонке определялся по количеству заливавшейся в реактор карбонизированной воды и составлял 0.4±0.05 л.
Эксперименты заключались в измерении при закрытых кранах 7 нарастания со временем давления в реакторной колонке, после заполнения ее карбонизированной водой, и последующего определения химического состава новообразованных газов, скапливающихся в сепараторе-накопителе 3. Давление измерялось по показаниям манометра 8. Продолжительность экспериментов составляла от 5 часов до двух суток. Эксперименты проводились при температуре окружающей среды (20-23°С).
Результаты экспериментов
На фиг.2 приведены графики изменения со временем давления в реакторе, заполненном железной стружкой, в условиях стационарного эксперимента при разных начальных давлениях растворенного в воде CO2: а - 2 атм, b - 4 атм, с - 6 атм и d - 10 атм.
В таблице представлены результаты хроматографического анализа состава накапливавшихся при этом в реакторе газов после их щелочной очистки для типичного опыта.
Во всех экспериментах содержание водорода в новообразованных газах резко доминировало. В газовой фазе обязательно присутствовали углеводороды, представленные метаном и его низшими гомологами. Наличие в пробах азота авторы изобретения объясняют не полным удалением из реактора воздуха, а кислорода с содержанием относительно азота более низким, чем в воздухе - участием этого газа в окислении железной стружки.
Продукты реакции практически не отличаются от полученных авторами патента (US 2010/01333111 А1) при разрушении карбонизированной воды под действием света в присутствии специального катализатора. В отличие от этого патента специальным подбором катализаторов авторы предложенного изобретения не занимались, а для заполнения реактора использовали железосодержащие среды, хорошо зарекомендовавшие себя в экспериментах [4].
На фиг.2 хорошо видно, что во всех опытах давление в реакторе со временем возрастало и тем сильнее, чем больше начальное давление CO2, которое варьировалось от атмосферного до 10 атм. Рост давления является показателем массы распавшейся в реакторе воды.
Масса распавшейся воды оценивалась на основании измерения объема газа, накапливавшегося после очистки в сепараторе. Согласно данным таблицы этот газ был в основном представлен водородом. В проведенных опытах в зависимости от условий эксперимента объем образовавшегося газа V варьировался от 0.1 до 0.5 л. Объем газа определялся при атмосферном давлении. Полагая, что газ состоит из водорода, плотность которого при атмосферном давлении ρH=5·10-4 г/см3, масса образовавшегося водорода находилась как mH=ρH·V и составляла mH=0.05÷0.25 г. Так как в молекуле H2O содержание H2 составляет 11.1%, масса распавшейся в реакторе воды рассчитывалась как МН2О=mH/0.111.
Масса распавшейся в стационарных экспериментах (фиг.2) воды, рассчитанная по количеству образовавшегося газа, показана на фиг.3. Результаты измерений пересчитаны на объем воды в реакторе, равный 1 литру. Обозначение кривых такое же, как на фиг.2.
Наибольший темп разрушения воды имел место на начальной стадии каждого опыта. В серии опытов (фиг.2) в начальный момент времени вода разрушалась со скоростью МН2О/t=0.2-0.3 г/л в час. Что соответствует темпу образования водорода ~140 мл/час в реакторе с объемом воды 1 л. При увеличении емкости реактора выход водорода пропорционально растет.
В результате проведенных экспериментов авторы пришли к заключению, что разложение воды с участием CO2 и образованием водорода и углеводородов может быть представлено следующей химической реакцией:
где
n - число атомов углерода в молекуле нормальных алканов,
k - рациональное число ≥0.
Реакция (1) принадлежит широкому классу поликонденсационных реакций синтеза углеводородов из окисей углерода и водорода, носящих экзотермический характер. Эта реакция приведена для случая синтеза нормальных алканов, отвечающих химической формуле CnH2n+2. Аналогичные выражения могут быть записаны и для других реакций синтеза углеводородов газонефтяного ряда, сопровождающихся образованием водорода.
Проведенные теоретические и практические исследования процесса разложения подземных вод в земной коре проливают свет на две крупные научные проблемы.
Первая проблема связана с так называемым явлением «водородной дегазации», происходящим в настоящее времени на нашей планете в огромных масштабах [5, 6]. Оно состоит в том, что из земных недр в атмосферу ежегодно выбрасывается большое количество газов, представленных главным образом водородом, а также метаном и углекислым газом. Разгрузка этих газов идет повсеместно. Но наиболее интенсивная дегазация происходит через разломы в литосферных плитах, особенно, в зонах срединных океанических хребтов. Метан и другие газы в дальнейшем включаются в геохимический круговорот и остаются на Земле. Легкий же водород достигает стратосферы и частично уходит в космос, образуя вокруг нашей планеты обширную водородную корону и шлейф. Без этого подтока атмосфера Земли полностью лишилась бы водорода за несколько лет.
За неимением лучшей идеи дегазацию объясняют поступлением Н2 и СН4 из ядра планеты, где они сохранились с момента образования Земли [6]. Такое объяснение, однако, противоречит современным представлениям космохимии и физики Земли об условиях формирования нашей планеты и ее внутреннем строении [7]. Разложение в земной коре воды с образованием водорода и углеводородов позволяет отказаться от наличия этих газов в ядре Земли, как физически неадекватной гипотезы. Оценки показывают, что наблюдаемые масштабы современной разгрузки через земную поверхность Н2, CO2 и СН4 вполне могут быть объяснены разрушением воды в земной коре.
Вторая проблема касается происхождения на Земле нефти и газа. Интенсивно происходящее на нашей планете разрушение подземных вод с выделением водорода и синтезом углеводородов вполне может явиться источником образования нефти и газа. При этом, как справедливо отмечают авторы [4], для объяснения причин нахождения нефти и природного газа в верхних горизонтах земной коры нет необходимости привлекать механизмы подтока этих углеводородов из мантии.
Блок-схема установки разложения воды предлагаемым способом показана на фиг.4.
Промышленное производство водорода новым способом существенно эффективнее, чем при использовании других известных способов получения водорода путем разрушения молекул воды, требующих много больших затрат энергии.
В экспериментах в качестве катализаторов использованы железосодержащие наполнители. За счет окисления железа (Fe) они поглощали образующийся кислород, что создавало благоприятные условия для выделения водорода.
Следует ожидать, что использование катализаторов из других материалов [1], включающих кроме металлов (железа, кобальта, молибдена, никеля и других) также SiO2, Al2O3, глины, фосфаты и цеолиты, позволит увеличить их эффективность и срок службы. Одновременно откроется возможность наряду с водородом и углеводородными газами получать также кислород. Для их разделения можно воспользоваться известными способами, применяемыми при разложении воды на водород и кислород, в том числе использующие современные нанофильтры.
Список процитированных источников:
1. Ионе К.Г. О роли водорода в техногенной эволюции Земли (Является ли Земля каталитическим реактором?). Новосибирск, 2003, 68 с.
2. Канарев Ф.М., Тлишев А.И. Устройство для получения водорода и кислорода. Патент РФ RU 2277138. Начало действия патента 2004.02.02.
3. Шварцев С.Л. Разложение и синтез воды в процессе литогенеза // Геология и геофизика, 1975, №5, 60-69. Shvartsev S.L., 1975, Gyeologiya i gyeofizika, №5, p.60-69.
4. Черский Н.В., Царев В.П. Механизмы синтеза углеводородов из неорганических соединений в верхних горизонтах земной коры // Доклады АН. Т.279. №3, 730-735. Chersky N.V, Tsarev V.P., 1984, Doklady akademii nauk, V.279, №3, p.730-735.
5. Syvorotkin V.L. 2002, Deep-seated degassing of the Earth and global catastrophe. Moscow, Geoinformtsentr, (in Russian).
6. Маракушев А.А., Маракушев С.А. Водородное дыхание Земли - его происхождение, геологические и биологические следствия // International Scientific Journal for Alternative Ecology 2008, №1(57), p.156-174.
7. Brown G.C., Mussett A.E., 1981, The inaccessible Earth, London, George Alien & UNWIN.
Реферат
Изобретение может быть использовано в химии и энергетике. Исходные реагенты - воду и диоксид углерода, через смеситель 2 подают в реактор 1, выполненный в виде герметичной емкости, содержащей катализатор, при этом концентрацию диоксида углерода в воде регулируют, чтобы получить карбонизированную воду, посредством давления и времени насыщения воды диоксидом углерода. В реакторе 1 проводят химическую реакцию с образованием водорода, кислорода и сопутствующих продуктов химической реакции, которые подают в сепаратор 3 с выделением из газообразной фазы водорода. Сепаратор 3 может дополнительно содержать по меньшей мере два фильтра. Изобретение обеспечивает эффективную утилизацию диоксида углерода и экономичное получение водорода. 7 з.п. ф-лы, 4 ил., 1 табл.
Формула
- под давлением подают исходные реагенты: вода и диоксид углерода, через смеситель, по меньшей мере в один реактор, выполненный в виде герметичной емкости, содержащей катализатор, при этом концентрацию диоксида углерода в воде регулируют, чтобы получить карбонизированную воду с определенной концентрацией диоксида углерода;
- проводят химическую реакцию смеси исходных реагентов в присутствии катализатора с образованием в ходе химической реакции водорода, кислорода и сопутствующих продуктов химической реакции, которые поступают после реактора по меньшей мере в один сепаратор;
- отделяют продукты химической реакции в сепараторе от исходных реагентов и промежуточных продуктов химической реакции, с выделением из газообразной фазы водорода.
Документы, цитированные в отчёте о поиске
Способ получения водорода

Комментарии