Способ получения стабильного водного раствора диоксида хлора - RU2567937C2
Код документа: RU2567937C2
Чертежи
Описание
Изобретение относится к способу получения очень чистого водного раствора диоксида хлора, стабильного при хранении в течение долгого времени и, следовательно, транспортабельного, включающего стадии получения хлорита, получения пероксодисульфата и соединения хлорита и пероксодисульфата в водной системе при мольном отношении пероксодисульфата к хлориту [S2O82-]/[ClO2-] больше 1 с образованием водного раствора диоксида хлора, где для получения водного раствора диоксида хлора не добавляется дополнительного буфера. Кроме того, настоящее изобретение относится к соответствующим растворам диоксида хлора, к применению этих растворов диоксида хлора, а также к устройству для получения растворов диоксида хлора.
Водные растворы диоксида хлора (ClO2) благодаря высокой окислительной силе диоксида хлора, находят применение для отбеливания, дезинфекции и дезодорирования, в частности, в технологиях водоподготовки. Однако растворы диоксида хлора считаются обычно сложными в обращении, так как газообразный диоксид хлора легко улетучивается из растворов и в высоких концентрациях является взрывоопасным. Поэтому растворы диоксида хлора для вышеназванных приложений обычно не продают как готовые растворы, но готовят свежими только по потребности, т.е. непосредственно на месте, и используют.
При этом известны различные способы получения водных растворов диоксида хлора.
Так, водный раствор диоксида хлора можно получать, например, путем реакции раствора хлорита натрия с раствором соляной кислоты (так называемый способ соляная кислота-хлорит). Этот способ имеет, наряду с другими, тот недостаток, что диоксид хлора в таких растворах нестабилен и в течение короткого времени распадается на хлорат и хлорид. Поэтому полученные этим способом растворы не могут храниться, но должны использоваться сразу.
В так называемом хлор-хлоритном способе раствор хлорита натрия приводят в реакцию с хлором или с хлорноватистой кислотой. Однако это способ имеет тот недостаток, что газообразный хлор и хлорноватистая кислота очень неудобны в обращении. Кроме того, в этом способе образуется значительная доля хлората как нежелательного побочного продукта, который снижает выход диоксида хлора и тем самым окислительную силу раствора.
Как альтернатива обоим вышеназванным способам предлагалось получать раствор диоксида хлора путем окисления хлорита в пероксодисульфат. Документ WO-A-96/33947 описывает, например, способ получения водного раствора диоксида хлора, в котором раствор хлорита приводят в реакцию с не содержащим галогена окислителем при значении pH в интервале от 5,5 до 9,5 при комнатной температуре до тех пор, пока хлорит по существу полностью не превратится в диоксид хлора. Предпочтительно в качестве окислителя применяется пероксодисульфат, причем в этом документе, равно как и в остальном уровне техники, описывается следующее суммарное уравнение (1) для превращения хлорита в пероксодисульфат:
Исходя из этого суммарного уравнения, обычно принимается, что один эквивалент пероксодисульфата окисляет два эквивалента хлорита. Поэтому в WO-A-96/33947 предлагается применять пероксодисульфат в количестве, которое составляет от одного до двух количеств, требующихся для стехиометрического окисления хлорита. Таким образом, в WO-A-96/33947 описано мольное отношение пероксодисульфата к хлориту [S2O82-]/[ClO2-] в диапазоне от 0,5 до 1,0.
Соответствующий способ описан также в патенте US 2323593, где в примерах этого патента описываются мольные отношения пероксодисульфата к хлориту [S2O82-]/[ClO2-] 0,57 или 0,78. Кроме того, в патенте US 2323593 заявляется, что отношения пероксодисульфата к хлориту [S2O82-]/[ClO2-] меньше 0,5 невыгодны, так как при них снижается скорость реакции.
В EP-A-1787953 также описан способ получения растворов диоксида хлора путем реакции хлорита с пероксодисульфатом, где растворы диоксида хлора предназначены для дезинфекции кожи или твердых поверхностей. Поэтому документ EP-A-1 787953 сфокусирован на быстром приготовлении ультраразбавленных растворов диоксида хлора (2-300 ч./млн) на месте применения (получение в "point of use"). Кроме этого, используется мольное отношение пероксодисульфата к хлориту [S2O82-]/[ClO2-] больше 2, где раствор пероксодисульфата, а также раствор хлорита содержат буфер.
Однако вышеописанные способы имеют ряд недостатков, которые затрудняют их применение.
В частности, стабильность растворов при хранении ограничена коротким периодом времени, максимум несколько недель, так что применение старых растворов проблематично, что касается их действующих веществ и продуктов разложения. Кроме того, продажа готовых растворов в большинстве случаев невозможна. Поэтому обычно рекомендуется получение "point of use" (ср., например, EP-A-1 787953). При этом получение соответствующего раствора диоксида хлора оставляется за потребителем, который должен сам получать раствор диоксида хлора путем смешения соответствующих предварительных растворов. Однако это требует компетентности в отношении определения степени превращения и образования побочных продуктов.
Кроме того, способы, известные из уровня техники, имеют тот недостаток, что для контролируемого превращения необходимы температуры выше комнатной температуры или, альтернативно, большое время реакции. Следующие проблемы распространенных до сих пор способов являются систематически колеблющиеся, сильно зависящие от температуры продолжительность реакции и выход, а также получающиеся в результате этого разные степени чистоты. К тому же, в большинстве случаев необходима стабилизация величины pH различными буферными системами, а также добавление ускорителей реакции (соли серебра и меди, кислота Каро), которые еще больше снижают чистоту применяющихся растворов диоксида хлора.
Таким образом, в основе настоящего изобретения стоит задача создать раствор диоксида хлора, который имеет высокую стабильность при хранении и который поэтому не требуется готовить на месте, но можно продавать также как готовый раствор. Далее, в основе настоящего изобретения стоит задача разработать способ получения этого раствора диоксида хлора, позволяющий простым способом получить стабильный раствор диоксида хлора в мягких реакционных условиях.
Эта задача решена вариантами осуществления, указанными в формуле изобретения.
В частности, разработан способ получения водного раствора диоксида хлора, который включает следующие стадии:
(a) получение хлорита,
(b) получение пероксодисульфата,
(c) соединение хлорита и пероксодисульфата в водной системе при мольном отношении пероксодисульфата к хлориту [S2O82-]/[ClO2-] больше 1 с образованием водного раствора диоксида хлора,
где для получения водного раствора диоксида хлора никакого дополнительного буфера не добавляют.
При этом стадии (a) и (b) можно осуществлять в произвольном порядке.
На стадии (a) способа согласно изобретению готовят хлорит (ClO2-). Хлорит согласно изобретению можно использовать в форме хлористой кислоты HClO2 или подходящей соли. Предпочтительно хлориты выбирают из группы, состоящей из хлоритов щелочных металлов, в частности, хлорита лития, хлорита натрия и хлорита калия, хлоритов щелочноземельных металлов, в частности, хлорита магния и хлорита кальция, хлоритов аммония, в частности, хлорита аммония (NH4ClO2) и тетраалкиламмонийхлоритов, как тетраметиламмонийхлорит, тетраэтиламмонийхлорит и тетрабутиламмонийхлорит, а также их смесей. Особенно предпочтительно выбирать хлорит из группы, состоящей из хлорита натрия, хлорита калия и их смесей.
Хлорит можно использовать в виде твердого вещества или в форме раствора, в частности, в форме водного раствора. Предпочтительно использовать как можно более чистый хлорит, так как примеси обычно могут препятствовать реакции хлорита с пероксодисульфатом в диоксид хлора и могут снизить стабильность получаемого диоксида хлора. Тем не менее, можно также использовать, например, твердый хлорит натрия, который имеется в продаже и помимо хлорита натрия может содержать до примерно 25% вес. хлорида натрия, предпочтительно до примерно 20% вес. хлорида натрия, особенно предпочтительно до примерно 10% вес. хлорида натрия, так как хлорид натрия не препятствует превращению диоксида хлора и не влияет отрицательно на стабильность диоксида хлора. В одном предпочтительном варианте осуществления способа по изобретению хлорит готовят в твердой форме как формовку, таблетку, капсулу или гранулу.
На стадии (b) способа согласно изобретению готовят пероксодисульфат. Пероксодисульфат согласно изобретению можно использовать в форме надсерной кислоты, H2S2O8 или как подходящую соль. Предпочтительно пероксодисульфаты выбирать из группы, состоящей из пероксодисульфатов щелочных металлов, в частности, пероксодисульфата лития, пероксодисульфата натрия и пероксодисульфата калия, пероксодисульфатов щелочноземельных металлов, в частности, пероксодисульфата магния и пероксодисульфата кальция, пероксодисульфатов аммония, в частности, пероксодисульфата аммония ((NH4)2S2O8) и теталкиламмонийпероксодисульфатов, как тетраметиламмонийпероксодисульфат, тетраэтиламмонийпероксодисульфат и тетрабутиламмонийпероксодисульфат, а также их смесей. Особенно предпочтительно выбирать пероксодисульфат из группы, состоящей из пероксодисульфата натрия, пероксодисульфата калия и их смесей.
Пероксодисульфат можно использовать в виде твердого вещества или в форме раствора, в частности, в форме водного раствора. Предпочтительно использовать как можно более чистый пероксодисульфат, так как примеси могут препятствовать реакции хлорита с пероксодисульфатом в диоксид хлора и могут снизить стабильность получаемого диоксида хлора. В одном предпочтительном варианте осуществления способа по изобретению пероксодисульфат готовят в твердой форме как формовку, таблетку, капсулу или гранулу.
Кроме того, можно также готовить хлорит и пероксодисульфат вместе, например, как двухфазную бинарную смесь твердых веществ или как формовку, таблетку, капсулу или гранулу, в которых оба компонента содержатся по отдельности и растворяются с задержкой во времени.
Если хлорит и/или пероксодисульфат готовят в форме раствора, то это делают предпочтительно в форме водного раствора. При этом в качестве растворителя можно применять любую подходящую воду, как, например, водопроводная вода. Однако предпочтительно использовать деминерализованную или дистиллированную воду. Водные растворы могут также содержать дополнительные подходящие сорастворители, как, например, галогенированный или негалогенированный органический растворитель. В одном предпочтительном варианте осуществления дополнительный растворитель представляет собой подходящий, инертный в реакции, водорастворимый растворитель, предпочтительно выбранный из группы, состоящей из метанола, этанола, н-пропанола, изопропанола, бутанола и их смесей. Особенно предпочтительно использовать смешиваемый с водой растворитель. Дополнительный растворитель можно использовать, например, в количестве до 80% об., предпочтительно до 50% об., особенно предпочтительно до 10% об., в высшей степени предпочтительно до 5% об.
Стадия (c) способа согласно изобретению включает соединение хлорита и пероксодисульфата в водной системе с образованием водного раствора диоксида хлора. Это соединение можно осуществить любыми подходящими способами, известными из уровня техники. Предпочтительно соединение обоих компонентов проводится при смешении. Смешение также можно осуществлять любым подходящим способом, известным специалисту. Например, в лабораторном масштабе смешение можно проводить в лабораторной мешалке. В промышленных масштабах перемешивание можно осуществлять, например, в баке с мешалкой. Предпочтительно проводить соединение таким образом, чтобы получался гомогенный раствор обоих компонентов, который по существу больше не включает твердых веществ. Перемешивание с применением смесительного устройства выгодно тем, что ускоряется превращение хлорита и пероксодисульфата в диоксид хлора.
В одном предпочтительном варианте осуществления способа по изобретению хлорит и пероксодисульфат на стадиях (a) и (b) готовят в твердой форме или в форме водных растворов, где на стадии (c):
(c1) оба компонента перед соединением растворяют в воде, если оба компонента приготовлены в твердой форме, или
(c2) оба компонента в твердой форме одновременно или по очереди вводят в водный растворитель, или
(c3) оба раствора соединяют, если оба компонента приготовлены в форме водных растворов, или
(c4) оба компонента готовят в водных растворах и одновременно или по очереди вводят в водный растворитель,
чтобы получить водный раствор диоксида хлора.
Предпочтительно соединение на стадии (c1) осуществляют так, что оба компонента вместе, одновременно или по очереди, растворяют в воде, когда оба компонента приготовлены в твердой форме. Если хлорит и пероксодисульфат приготовлены, например, как бинарная смесь твердых веществ или как формовка, то можно просто растворить эту смесь твердых веществ или эту формовку в воде и затем оба полученных так раствора соединить по существу одновременно или же по очереди в мольном отношении согласно изобретению.
На стадии (c2) оба компонента, предпочтительно в твердой форме, по очереди вводят в водный растворитель. В частности, в этом случае предпочтительно сначала ввести пероксодисульфат в водный раствор, а затем хлорит, добавляется ли он в твердой форме или в водном растворе.
На стадии (c3) оба раствора предпочтительно соединяют одновременно в мольном отношении согласно изобретению. Однако можно также сначала приготовить водный раствор с пероксодисульфатом, а затем добавить раствор хлорита.
На стадии (c4) оба компонента предпочтительно готовят в водном растворе и по очереди вводят в водный растворитель. В этом случае последовательность добавления несущественна, и можно сначала вводить либо водный раствор пероксодисульфата, либо раствор хлорита, и затем добавлять соответствующий другой раствор.
При этом предпочтителен способ согласно пункту (c3), в котором оба компонента сначала по отдельности растворяют в водном растворителе, а затем оба раствора соединяют и перемешивают.
Особенно предпочтительно взять сначала водный растворитель, особенно предпочтительно деминерализованную или дистиллированную воду, в желательном количестве и затем отобрать из нее желаемые количества для получения водных растворов обоих компонентов, приготовить растворы и снова добавить в водный растворитель.
В случаях (c1)-(c4) водные растворы могут содержать хлорит в любой подходящей концентрации вплоть до концентрации насыщения соответствующей хлоритной соли. При этом концентрация насыщения не является неизменной величиной, но она зависит, например, от применяемой температуры и от природы конкретной хлоритной соли. Например, хлорит натрия имеет концентрацию насыщения примерно 64,5% вес. при 20°C. Однако предпочтительно устанавливать концентрацию хлорита в водном растворе не выше примерно 5% вес., предпочтительно не выше 2% вес. и, в частности, не выше 1% вес. Концентрация пероксодисульфата в водном растворе может составлять вплоть до его концентрации насыщения. При этом соответствующая концентрация насыщения не является неизменной величиной, но она зависит, например, от применяемой температуры и природы конкретной пероксодисульфатной соли. Например, пероксодисульфат натрия имеет концентрацию насыщения примерно 54,5% вес. при 20°C.
Вода, применяемая для получения раствора диоксида хлора согласно изобретению, может быть любой подходящей водой, как, например, водопроводная вода. Однако предпочтительно использовать деминерализованную или дистиллированную воду, так как в таком случае раствор включает меньше посторонних веществ, что выгодно с точки зрения лучшей реакции хлорита и пероксодисульфата в диоксид хлора и повышенной стабильности получаемого таким образом диоксида хлора. Кроме того, один из вышеописанных сорастворителей можно также использовать в вышеописанных предпочтительных количествах.
После соединения хлорита и пероксодисульфата образуется диоксид хлора. Так как это превращение осуществляется в водной системе, образованный диоксид хлора находится в форме водного раствора.
После получения диоксида хлора в водном растворе можно также добавить не смешиваемый с водой растворитель, такой, как органический растворитель, в частности, дихлорметан, хлороформ и/или тетрахлорметан, и перевести диоксид хлора в органическую фазу. В результате получаются стабильные растворы диоксида хлора в органических растворителях.
Неожиданно было обнаружено, что при этом превращении, вопреки вышеописанному суммарному уравнению (1), при поддержании рекомендованного изобретением мольного отношения пероксодисульфата к хлориту больше 1, один эквивалент пероксодисульфата реагирует с одним эквивалентом хлорита с образованием стабильного раствора диоксида хлора. Предполагается, не связывая себя этой теорией, что при этой реакции образуется гидросульфатный радикал, который оказывает стабилизирующее действие на образованный диоксид хлора. Эта реакция представлена следующим суммарным уравнением (2):
При этом HS2O8- автокаталитически образуется из S2O82-. Следовательно, при реакции одного эквивалента хлорита с одним эквивалентом пероксодисульфата, помимо радикала диоксида хлора ClO2•, образуется также гидросульфатный радикал HSO4•. Оба этих радикала стабилизируют друг друга ассоциативно, что показано радикальной парой [ClO2••HSO4•]. Это представление является лишь примерным. Можно также представить, что такая пара радикалов образует ассоциат с водой формы [ClO2• •H2O•HSO4•]. Сам гидросульфатный радикал до настоящего времени считался нестабильным.
Кроме того, предполагается, не связывая себя теорией, что стабилизация радикального комплекса [ClO2••HSO4•] может быть обоснована следующими наблюдениями:
1) Раствор диоксида хлора благодаря протону гидросульфатного радикала имеет очень кислый pH (предпочтительно в диапазоне от 2,5 до 3). Тем самым, каждый радикал диоксида хлора находится в слабокислой среде, и предполагается, что это способствует стабилизации радикала диоксида хлора.
2) В результате ассоциации с гидросульфатным радикалом может произойти усиление образования гидратов, что повысило бы растворимость в воде. Кроме того, вследствие ассоциации может снижаться давление пара радикала.
3) В результате ассоциации, возможно, снижается также тенденция к восстановлению радикала диоксида хлора в хлорит.
4) Принимается, что вследствие нулевого заряда обоих радикалов в ассоциате отсутствует влияние на его подвижность или прохождение через мембраны, такие как мембраны обратного осмоса (RO), наномембранные фильтры и т.д., которые в ином случае были бы непроницаемы для солей.
5) Далее, принимается, что гидросульфатный радикал имеет возможность реагировать с водой с образованием гидромоноперсульфата или гидросульфата или сульфата. В этой реакции диоксид хлора реагирует с образованием хлорита или хлората. Таким образом, разложение радикального комплекса [ClO2••HSO4•] ведет к неопасным продуктам разложения. В окислительных реакциях радикальный комплекс реагирует с образованием экологически безопасных хлоридного и сульфатного анионов. В противоположность этому обычные, то есть нестабилизированные растворы диоксида хлора при разложении склонны взрываться из-за образования хлора и кислорода.
6) Концентрация радикала диоксида хлора является определяющей величиной для образования радикальной пары.
Образование вышеописанной ассоциированной пары радикалов подкреплено экспериментальными исследованиями, которые показывают, что эта ассоциированная пара радикалов перегоняется как одно целое и, тем самым, может переходить в газовую фазу, а также проходит через мембраны. Кроме того, ассоциированная пара радикалов [ClO2••HSO4•] имеет измененные по сравнению с радикалом диоксида хлора физические свойства, например, измененное давление пара и измененную растворимость. Потенциал окисления гидросульфатного радикала полностью находится в распоряжении как потенциал окисления с другим электронным эквивалентом, и тем самым не имеется потери окислительного потенциала. Это было обосновано методами фотометрии и титрования. В итоге, в распоряжении имеется шесть электронных эквивалентов: пять для восстановления диоксида хлора в хлорид, а также один для восстановления гидросульфатного радикала в сульфат. Исследования показали, что в воде сначала реагирует радикал диоксида хлора, и только потом гидросульфатный радикал.
С учетом приведенных выше научных выводов, способ согласно изобретению отличается тем, что по сравнению со способами, известными из уровня техники, он исходит из другой стехиометрии для реакции хлорита и пероксодисульфата в диоксид хлора.
Таким образом, на стадии (c) способа согласно изобретению хлорит и пероксодисульфат используют в мольном отношении пероксодисульфата к хлориту [S2O82-]/[ClO2-] больше 1. Таким образом, один эквивалент хлорита реагирует с молярным избытком пероксодисульфата, тогда как в традиционных способах на один эквивалент хлорита применялось, как правило, всего примерно 0,5 эквивалента пероксодисульфата.
В одном предпочтительном варианте осуществления настоящего изобретения исходные вещества используются в мольном отношении пероксодисульфата к хлориту от 1 до 2 (1<[S2O82-]/[ClO2-]<2). При этом пероксодисульфат используется лишь в небольшом избытке по отношению к хлориту, что ведет к тому, что при полном превращении хлорита в растворе диоксида хлора остается менее одного эквивалента не прореагировавшего пероксодисульфата (в расчете на образованный диоксид хлора). Так как стабильность диоксида хлора в растворе в присутствии дополнительных компонентов обычно снижается (хотя в случае пероксодисульфата лишь в незначительной степени) благодаря вышеописанному мольному отношению от 1 до 2 получают раствор диоксида хлора, который имеет повышенную стабильность.
В другом предпочтительном варианте осуществления настоящего изобретения исходные вещества применяются в мольном отношении пероксодисульфата к хлориту больше 2, особенно предпочтительно больше 4, еще более предпочтительно больше 10. Далее, можно использовать отношение пероксодисульфата к хлориту до примерно 100. В этом варианте осуществления пероксодисульфат используется в повышенном избытке к хлориту, чтобы таким образом достичь более быстрого или полного превращения используемого хлорита в диоксид хлора.
Благодаря соблюдению мольного отношения согласно изобретению реакция протекает ускоренно и почти количественно. Особенно предпочтительно в способе согласно изобретению достигается выход выше примерно 80%, в частности, выше примерно 90%, особенно предпочтительно выше примерно 95%, в расчете на количество используемого хлорита. При реакционных условиях согласно изобретению не наблюдается также никаких побочных реакций.
Далее, было установлено, что для эффективного превращения хлорита и пероксодисульфата в диоксид хлора не нужно устанавливать определенное значение pH реакционного раствора добавлением буфера. Напротив, было найдено, что из-за добавления буфера в водные растворы вносятся дополнительные посторонние вещества, которые снижают скорость реакции образования диоксида хлора, и стабильность диоксида хлора в растворах. В соответствии с этим, согласно изобретению для получения водного раствора диоксида хлора никакого буфера не добавляют. Таким образом, при получении дополнительного буфера не добавляют. Однако это не означает, что полученный раствор не включает никакого буфера. Так, например, во время реакции может образоваться гидросульфатный/сульфатный буфер из образующегося в реакции сульфата.
Обыкновенно использующимся буфером для стабилизации диоксида хлора является смесь по меньшей мере одной слабой кислоты и сопряженного ей основания. В качестве слабой кислоты в контексте настоящего изобретения предусматриваются кислоты, которые имеют показатель pKα в воде в диапазоне от примерно -2 до примерно 12. Добавлением буфера величину pH водного раствора удерживают в пределах диапазона pH почти постоянной. Тем самым, каждая буферная система имеет диапазон pH, в пределах которого значение pH при добавлении сильной кислоты существенно не изменяется. Сильные кислоты - это такие кислоты, которые находятся в водном растворе полностью диссоциированными.
В частности, согласно изобретению не используется никакой буфер, выбранный из группы, состоящей из ацетатного буфера, фосфатного буфера, боратного буфера, цитратного буфера и карбонатного буфера. В частности, согласно изобретению не применятся гидрокарбонат или карбонат.
Особенно предпочтительно не добавлять в водный раствор хлорита, приготовленный на стадии (a), буфера, который устанавливает диапазон pH раствора от 9 до 12. Предпочтительно также не добавлять в водный раствор пероксодисульфата, приготовленный на стадии (b), буфер, который устанавливает диапазон pH раствора от 3 до 9.
В одном предпочтительном варианте осуществления настоящего изобретения раствор диоксида хлора получают, соединяя раствор хлорита с раствором пероксодисульфата. При этом предпочтительно использовать раствор пероксодисульфата такой концентрации, чтобы он имел pH в интервале от примерно 4 до примерно 8. В одном предпочтительном варианте осуществления pH раствора пероксодисульфата составляет от примерно 4 до примерно 6, в другом предпочтительном варианте осуществления pH составляет от примерно 6 до примерно 8. Далее, раствор хлорита предпочтительно используется в такой концентрации, чтобы он имел pH в интервале от примерно 10 до примерно 12. Особенно предпочтительно раствор пероксодисульфата имеет pH примерно 5, а раствор хлорита имеет pH примерно 11.
Когда вышеописанные водные растворы хлорита и пероксодисульфата соединяют друг с другом, то величину pH раствора устанавливают во время реакции хлорита и пероксодисульфата в диоксид хлора предпочтительно на значение от примерно 2 до примерно 4, т.е. значение pH водного раствора стабилизируется при возрастающей полноте реакции хлорита и пероксодисульфата в диоксид хлора на значении в диапазоне от примерно 2 до примерно 4. Особенно предпочтительно устанавливать pH в диапазоне от примерно 2,5 до примерно 3. Еще более предпочтительно хлорит и пероксодисульфат используют в таком количестве и концентрации, чтобы величина pH соединенных растворов во время реакции стабилизировалась на значении примерно 2,5.
В полученный раствор диоксида хлора после его получения можно добавлять буфер, предпочтительно буфер, который устанавливает pH в диапазоне примерно от 2 до 4.
Способ согласно изобретению может проводиться при любой подходящей температуре. Однако выгодно, когда реакция хлорита и пероксодисульфата проводится при сравнительно низких температурах, в диапазоне от примерно 0°C до примерно 25°C. В отличие от этого, в традиционных способах обычно необходимы более высокие температуры, выше 25°C, чтобы достичь ускоренного превращения хлорита и пероксодисульфата в диоксид хлора. В одном предпочтительном варианте осуществления настоящего изобретения соединение пероксодисульфата и хлорита проводится при температуре в диапазоне от примерно 0°C до примерно 25°C, особенно предпочтительно в диапазоне от примерно 2°C до примерно 20°C. В высшей степени предпочтительно стадия (c) соединения проводится при температуре в диапазоне от примерно 5°C до примерно 15°C. Оказалось, что при более высоких температурах (то есть, выше примерно 25°C) возникают побочные реакции, которые ведут к нежелательным побочным продуктам. Образование побочных продуктов нежелательно, так как они снижают стабильность раствора диоксида хлора согласно изобретению.
При этом выгодно, кроме того, чтобы температурный диапазон выдерживался не только при соединении хлоритного компонента с пероксодисульфатным компонентом, но до тех пор, пока реакция хлорита с пероксодисульфатом в диоксид хлора не пройдет по существу полностью. Кроме того, предпочтительно довести используемые водные растворы перед соединением до соответствующей температуры и затем выдерживать их в этом температурном диапазоне до тех пор, пока превращение в диоксид хлора не пройдет по существу полностью. Наряду с выдерживанием температуры используемых растворов выгодно, кроме того, выдерживать температурный режим окружающей среды в вышеописанном предпочтительном диапазоне во время соединения и до завершения реакции. Это можно осуществить, например, в холодильном шкафу, холодильном складе или рефрижераторном контейнере. В одном особенно предпочтительном варианте осуществления способа по изобретению раствор хлорита и раствор пероксодисульфата соединяют в условиях охлаждения при температуре в диапазоне от примерно 5°C до примерно 15°C, а затем оставляют реагировать в этом температурном диапазоне до полного превращения в диоксид хлора.
В следующем предпочтительном варианте осуществления раствор диоксида хлора, полученный способом по изобретению, по завершении реакции держат или хранят в этом температурном диапазоне. Чистый диоксид хлора имеет точку кипения 11°C при 1013 мбар. Поэтому водный раствор диоксида хлора, полученный способом по изобретению, предпочтительно хранят при температуре ниже примерно 11°C, в частности, при температуре в диапазоне от примерно 0°C до примерно 11°C.
Если соединение хлорита и пероксодисульфата проводить в предпочтительном температурном режиме от примерно 0°C до примерно 25°C, предпочтительно от выше 0°C до примерно 11°C, то появление побочных реакций и, тем самым, нежелательных побочных продуктов, таких как хлор, гипохлорит и хлорат, при образовании диоксида хлора по существу предотвращается. Поэтому раствор диоксида хлора, полученный способом по изобретению, включает меньше посторонних веществ, что еще больше повышает стабильность раствора диоксида хлора согласно изобретению.
Предпочтительно осуществлять способ согласно изобретению при исключении света. Так, было обнаружено, что в присутствии УФ-излучения или солнечного света возможно образование побочных продуктов. Образование побочных продуктов нежелательно, так как было найдено, что побочные продукты или посторонние вещества дестабилизируют раствор диоксида хлора согласно изобретению. Чем меньше побочных продуктов находится в реакционной смеси, тем в продолжение большего времени стабилен полученный раствор.
В результате соединения хлорита и пероксодисульфата на стадии (c) способа по изобретению возникает реакция между обоими этими компонентами, в которой образуется диоксид хлора (ср. вышеуказанное суммарное уравнение (2)). Благодаря способу согласно изобретению можно достичь в пределах примерно 72 часов почти количественного превращения хлорита в диоксид хлора (т.е., степени превращения выше 95%). Предпочтительно почти количественное превращение достигается уже через 48 часов, особенно предпочтительно уже через 24 часа. В частности, для растворов концентрацией 0,3-0,6% вес. почти количественное превращение достигается уже через 48 часов, предпочтительно уже через 24 часа. Для более высококонцентрированных растворов (например, для концентраций 1% вес. или выше) время реакции до достижения количественного выхода можно сократить до нескольких минут, предпочтительно до 30 минут или меньше, особенно предпочтительно до 15 минут или меньше. При постоянной температуре и постоянном отношении пероксодисульфат/хлорит реакция идет тем быстрее, чем выше концентрация хлорита. При постоянной концентрации хлорита и пероксодисульфата реакция протекает тем быстрее, чем выше температура. Наконец, повышение отношения пероксодисульфата к хлориту при постоянной температуре также ведет к более быстрому превращению.
В противоположность этому, в уровне техники (ср., например, WO-A-96/33947) для получения более концентрированных растворов диоксида хлора описано время реакции для количественного выхода примерно 12 дней.
Предпочтительно способ согласно изобретению после стадии (c) включает следующую стадию продолжения реакции хлорита с пероксодисульфатом до тех пор, пока хлорит по существу полностью (т.е. более 95% используемого хлорита) не превратится в диоксид хлора. В одном особенно предпочтительном варианте осуществления способ по изобретению включает после стадии (c) следующую стадию продолжения реакции хлорита с пероксодисульфатом в продолжении по меньшей мере 12 часов, предпочтительно по меньшей мере 24 часа, еще более предпочтительно продолжительностью по меньшей мере 36 часов. В другом, особенно предпочтительном варианте осуществления способ по изобретению включает после стадии (c) следующую стадию продолжения реакции хлорита с пероксодисульфатом продолжительностью от 12 до 48 часов, предпочтительно от 24 до 36 часов.
Способом согласно изобретению можно получить растворы диоксида хлора с любой желаемой или подходящей концентрацией. Предпочтительно способом по изобретению получают растворы диоксида хлора с концентрацией до примерно 2% вес., предпочтительно примерно 1% вес. Более концентрированные растворы диоксида хлора из-за ограниченной растворимости диоксида хлора в воде получить затруднительно, но все же можно. При использовании более высоких концентраций хлорита для получения раствора диоксида хлора согласно изобретению, в частности, при использовании концентраций хлорита в диапазоне предельной растворимости соответствующей хлоритной соли, можно получить водные растворы диоксида хлора с концентрацией до примерно 4,5% вес. При этом величина примерно 4,5% вес. представляет собой определенный на практике предел насыщения диоксида хлора в воде при 5°C и нормальном давлении. При повышенном давлении можно достичь даже свободной фазы диоксида хлора в воде. Такие смеси содержат типично от более примерно 4,5 до примерно 12% вес. диоксида хлора, в расчете на полное количество диоксида хлора и воды. На растворимость диоксида хлора в воде решающее влияние оказывают растворенные в воде примеси, которые снижают растворимость диоксида хлора. Это означает, что растворимость диоксида хлора в воде тем выше, чем меньше примесей включается в растворе. Так как способом согласно изобретению можно получить растворы диоксида хлора с пониженным содержанием посторонних веществ, растворимость диоксида хлора в растворах согласно изобретению выше, чем в обычных растворах диоксида хлора.
Кроме того, сами растворы диоксида хлора согласно изобретению при сравнительно высоких концентрациях до примерно 12% вес., и предпочтительно до примерно 2% вес. диоксида хлора, легки в использовании и не обнаруживают никакой взрывоопасности из-за спонтанного разложения. Однако из соображений безопасности способом по изобретению предпочтительно получают растворы диоксида хлора с концентрацией до примерно 2,5% вес., особенно предпочтительно до примерно 1% вес. и, в частности, примерно 0,6% вес. диоксида хлора. В противоположность этому в уровне техники описано, что растворы диоксида хлора тем стабильнее, чем более они разбавлены. Поэтому в уровне техники в большинстве случаев описываются концентрации не выше 0,3% вес. Тем не менее, само собой разумеется, что способом по изобретению при желании можно получать также растворы с более низкой концентрацией диоксида хлора. Это можно осуществить, например, также тем, что сначала способом согласно изобретению получают более концентрированные растворы диоксида хлора с концентрациями предпочтительно в диапазоне от примерно 0,5 до примерно 4,5% вес., а затем разбавляют их до желательных более низких концентраций, например, в диапазоне от примерно 0,003 до примерно 1% вес.
Таким образом, в рамках настоящего изобретения предпочтительно получают растворы с концентрацией диоксида хлора в диапазоне от примерно 0,003% вес. до примерно 4,5% вес., предпочтительнее в диапазоне от примерно 0,03% вес. до примерно 2,5% вес., еще более предпочтительно в диапазоне от примерно 0,1% вес. до 1% вес., в высшей степени предпочтительно в диапазоне от свыше примерно 0,3% вес. до примерно 0,6% вес. и, в частности, от примерно 0,5% вес. до примерно 0,6% вес. Соответствующие растворы с концентрацией диоксида хлора от более примерно 0,3% вес. до примерно 0,6% вес. особенно выгодны, потому что они заметно концентрированнее, чем обычные растворы диоксида хлора, и все еще стабильны при хранении, а также легки в использовании. При этом подходящая концентрация существенно зависит от предусмотренного применения, и может выбираться специалистом в соответствии с этим. Менее концентрированные растворы могут, как уже описано выше, также быть без затруднений получены из растворов с более высокой концентрацией диоксида хлора путем соответствующего разбавления.
Способом согласно изобретению можно получать диоксид хлора либо непрерывно в проточном режиме, либо партиями в периодическом режиме. Если способ согласно изобретению проводится в проточном режиме, то особенно предпочтительно готовить хлорит, а также пероксодисульфат в форме водных растворов.
В следующем предпочтительном варианте осуществления настоящего изобретения раствор, полученный после соединения на стадии (c), заливают в резервуар, в котором раствор может храниться и/или транспортироваться. Когда раствор наливают в резервуар, превращение в диоксид хлора должно быть еще не закончено. А именно, можно также, чтобы завершение реакции хлорита и пероксодисульфата в диоксид хлора происходило только после того, как раствор был перелит в резервуар, предусмотренный для его хранения или транспортировки. Поэтому стадия наполнения может проводиться до или после факультативной следующей стадии продолжения реакции хлорита с пероксодисульфатом. В другом предпочтительном варианте осуществления соединение проводится на стадии (c) уже в резервуаре, предусмотренном для хранения или транспортировки раствора. Этот вариант особенно выгоден, так как при этом не нужно переливать готовый раствор диоксида хлора еще раз. Подходящие резервуары еще будут описаны ниже.
Предлагаемый изобретением способ получения раствора диоксида хлора и полученные этим способом растворы диоксида хлора имеют много преимуществ по сравнению с уровнем техники. Так, способ согласно изобретению позволяет получить раствор диоксида хлора в ультрамягких реакционных условиях (в частности, при низкой температуре) с применением всего двух компонентов. Кроме того, требуются лишь незначительные затраты на аппаратуру, так как, например, никакого нагревания реакционной смеси не требуется. Далее, способом согласно изобретению можно при сравнительно короткой продолжительности реакции достичь почти количественного превращения хлорного компонента, не добавляя активатора или катализатора (в основном солей тяжелых металлов), или без необходимости применения определенной буферной системы.
Благодаря простому и полному превращению результирующий раствор почти не включает дополнительных компонентов или посторонних веществ (как например, не прореагировавшие исходные вещества, нежелательные побочные продукты, буферы, активаторы или катализаторы), но включает почти исключительно диоксид хлора. Неожиданно было обнаружено, что это отсутствие посторонних веществ в растворе диоксида хлора значительно улучшает стабильность раствора диоксида хлора. Так, было установлено, что стабильность раствора диоксида хлора тем выше, а склонность к разложению раствора диоксида хлора тем ниже, чем выше чистота раствора диоксида хлора. Отсюда следует, что повышенная стабильность раствора диоксида хлора достигается, когда диоксид хлора получают с как можно меньшим использованием химикатов, что становится возможным, благодаря способу по изобретению. Было обнаружено, что добавки определенно ведут к дестабилизации раствора.
В растворе диоксида хлора согласно изобретению благодаря исключительно селективному превращению присутствуют лишь очень малые количества, если вообще присутствуют, гипохлорита, хлора и хлората в качестве посторонних веществ. Поэтому опасность разложения диоксида хлора из-за возможных окислительно-восстановительных реакций с этими компонентами существенно снижается. Благодаря этому раствор диоксида хлора согласно изобретению пригоден для длительного хранения, в частности в течение по меньшей мере одного года, без обнаружения достойного упоминания разложения диоксида хлора. Поэтому добавления стабилизатора в раствор диоксида хлора по изобретению также не требуется.
Чтобы гарантировать повышенную чистоту раствора диоксида хлора, в способе согласно изобретению не используется никакого буфера для получения раствора диоксида хлора. В одном предпочтительном варианте осуществления способ по изобретению ограничивается, кроме того, использованием хлоритного компонента, а также пероксодисульфатного компонента, где для получения раствора диоксида хлора не применяется, т.е. не добавляется в исходные вещества или в получаемый раствор диоксида хлора, никаких других компонентов, выбранных из группы, состоящей из активаторов, катализаторов и стабилизаторов. Активаторы могут быть, например, радикальными инициаторами. В одном особенно предпочтительном варианте осуществления в способе по изобретению не применяется никаких катализаторов. Катализаторами могут быть, в частности, соли переходных металлов, как, например, соли серебра, марганца, меди и железа, или галогениды щелочных и щелочноземельных металлов. Оказалось, в частности, что добавление бромидов и иодидов щелочных и щелочноземельных металлов нежелательно, так как это ведет к разложению диоксида хлора через образование брома и иода. Стабилизаторы могут быть, например, солями EDTA. В следующем предпочтительном варианте осуществления в способе по изобретению не используется также никаких вспомогательных веществ, таких, например, как сорбит, крахмал, полиэтиленгликоль, бензоат натрия или отдушки. В одном особенно предпочтительном варианте осуществления способа по изобретению указанный способ ограничивается, кроме того, применением хлоритного компонента, а также пероксодисульфатного компонента, где никакие дополнительные компоненты для получения раствора диоксида хлора не применяются.
Напротив, в уровне техники описано, что только высокие концентрации диоксида хлора ускоряют разложение и что для повышения стабильности требуются буферные добавки или стабилизаторы. Теперь это предубеждение удалось опровергнуть.
Благодаря этой повышенной стабильности растворы диоксида хлора согласно изобретению можно не только хранить длительное время, но предлагаются также транспортабельные растворы. В отличие от уровня техники со способом по изобретению больше не нужно готовить раствор диоксида хлора только непосредственно перед запланированным применением на месте. Напротив, раствор диоксида хлора теперь можно также получать в больших количествах и фасовать, и только потом транспортировать в предусмотренное место применения.
Кроме того, возможно беспроблемное и безопасное применение способа по изобретению в любом масштабе, а именно, в количестве от миллиграммов до крупномасштабного применения в диапазоне нескольких тысяч кубических метров.
По окончания предлагаемого изобретением процесса получения растворы готовы к непосредственному применению, и дальнейшая обработка, например, в абсорбционных колоннах, удаление солей, смешение с другими растворами и т.д., не требуется.
Настоящее изобретение относится, кроме того, к водному раствору диоксида хлора, который получен вышеописанным способом.
Настоящее изобретение относится, кроме того, к водному раствору диоксида хлора, который включает диоксид хлора в количестве от примерно 0,1% вес. до примерно 12% вес., предпочтительно от примерно 0,3% вес. до примерно 4,5% вес., где значение pH водного раствора составляет от примерно 2 до примерно 4, и раствор не включает буфера. В одном особенно предпочтительном варианте осуществления водный раствор включает диоксид хлора в количестве от примерно 0,3 до примерно 1% вес., где величина pH раствора составляет от примерно 2 до примерно 4, и раствор не включает буфера. Еще более предпочтителен раствор диоксида хлора с концентрацией диоксида хлора в диапазоне от свыше примерно 0,3 до примерно 0,6% вес. Раствор согласно изобретению особенно выгоден, так как он заметно более концентрирован, чем обычные растворы диоксида хлора, и все же стабилен при хранении, а также легок в использовании.
Настоящее изобретение относится, кроме того, к водному раствору диоксида хлора, который включает диоксид хлора вместе с гидросульфатным радикалом в форме ассоциированной пары радикалов, где раствор не включает буфера. В одном предпочтительном варианте осуществления этот раствор диоксида хлора согласно изобретению не включает никаких дополнительных компонентов, выбранных из группы, состоящей из активаторов, катализаторов и стабилизаторов.
Эти растворы диоксида хлора имеют вышеописанные преимущества: повышенную стабильность даже при высоких концентрациях и связанную с этим более длительную стойкость при хранении, а также транспортабельность.
Кроме того, растворы диоксида хлора согласно изобретению благодаря их слабокислому значению pH не склонны к коррозии и имеют, кроме того, по сравнению с обычными растворами диоксида хлора, для защиты раствора дополнительный окислительный потенциал, благодаря дополнительно содержащимся в растворах гидросульфатным радикалам (ср. приведенное выше суммарное уравнение (2)) или получаемому из них производному продукту.
Растворы диоксида хлора согласно изобретению являются долговременно (по меньшей мере один год) пригодными для хранения или стабильными, т.е. в пределах этого периода не наблюдается достойного упоминания разложения диоксида хлора. Предпочтительно растворы диоксида хлора согласно изобретению имеют неограниченный срок хранения. Чтобы повысить стабильность при хранении растворов диоксида хлора согласно изобретению, их предпочтительно хранят в холодном месте, предпочтительно при температуре в диапазоне от выше 0°C до примерно 25°C, особенно предпочтительно от примерно 2°C до примерно 20°C, в высшей степени предпочтительно от примерно 5°C до примерно 15°C.
Далее, выгодно хранить растворы диоксида хлора согласно изобретению при исключении света. Поскольку неожиданно было установлено, что диоксид хлора в водном растворе заметно устойчивее к УФ-облучению или солнечному свету, чем в газовой фазе, то согласно одному предпочтительному варианту осуществления достаточно защитить от потока света находящуюся над раствором газовую фазу внутри резервуара, в котором хранятся растворы. Для этого можно, например, использовать светонепроницаемую пленку, или же светонепроницаемый резервуар, или светонепроницаемую бочку.
Водные растворы диоксида хлора согласно изобретению являются истинными растворами диоксида хлора в воде, в которых диоксид хлора не гидролизован. Давление пара раствора подчиняется закону Генри, т.е. сумма парциальных давлений дает полное давление. Давление пара диоксида хлора зависит от температуры и возрастает с повышением температуры. Диоксид хлора в чистой неводной форме имеет при 1013 мбар точку кипения 11°C. В воде диоксид хлора растворим в неожиданно высоких концентрациях, не реагируя с водой. При повышении температуры окружающей среды растворимость в воде снижается, и диоксид хлора все в большей степени ведет себя в газовой фазе, как идеальный газ, где диоксид хлора в газовой фазе над водным раствором диоксида хлора ведет себя, тем более реально, как идеальный газ, чем больше приближается температура окружающей среды к точке кипения или даже превышает ее.
Однако по различным причинам желательно держать давление пара над раствором диоксида хлора согласно изобретению как можно ниже. Так, высокое давление пара над диоксидом хлора ведет к тому, что часть диоксида хлора улетучится из раствора, что снижает концентрацию применяемого диоксида хлора. Это может привести, в частности, к значительным потерям диоксида хлора, если, например, емкость для хранения раствора диоксида хлора согласно изобретению, например, вентилируется или открыта. Таким образом, диоксид хлора может все больше и больше переходить из раствора в газовую фазу и затем улетучиваться из резервуара. Кроме того, диоксид хлора в газовой фазе менее стоек к УФ-облучению или солнечному свету, чем в растворенной форме. Следовательно, при повышении содержания диоксида хлора в газовой фазе дело может дойти до усиления реакций разложения, что снижает концентрацию и чистоту диоксида хлора в растворах по изобретению. Кроме того, диоксид хлора в газовой фазе из-за его взрывоопасности заметно опаснее и, тем самым, сложнее в обращении.
Поэтому выгодно хранить водные растворы диоксида хлора при температурах ниже его температуры кипения 11°C, в частности, при температуре в диапазоне от свыше 0°C до 11°C, особенно предпочтительно при температуре от 5°C до 11°C.
Но для снижения давления паров диоксида хлора выгодно также применение избыточного давления. Например, к растворам диоксида хлора согласно изобретению можно прикладывать избыточное давление от примерно 0,01 до примерно 10 бар, при необходимости в атмосфере инертного газа, как азот или подобное, предпочтительно в диапазоне от примерно 0,1 до примерно 1 бар, в результате чего можно еще больше понизить давление паров диоксида хлора. Однако повышенное давление при температурах выше точки кипения ведет к аналогичному результату. Таким образом, растворы согласно изобретению можно также хранить при температурах до 40°C, если приложить к растворам одновременно подходящее избыточное давление, чтобы уменьшить количество диоксида хлора в газовой фазе.
Таким образом, согласно изобретению выявилось, что растворы диоксида хлора как согласно изобретению, так и обычные, выгодно хранить в резервуаре под давлением. Давление предпочтительно составляет от 0,01 до примерно 10 бар, предпочтительно от примерно 0,1 до примерно l бар.
В одном особенно предпочтительном варианте осуществления растворов диоксида хлора согласно изобретению их хранят при температуре в диапазоне от более 0°C до примерно 15°C при одновременном приложении давления в диапазоне от примерно 0,1 бар до примерно 1 бар.
В следующем предпочтительном варианте осуществления настоящего изобретения растворы диоксида хлора можно хранить в инертной атмосфере.
В качестве подходящего резервуара рассматриваются, например, обычные пластмассовые или металлические канистры, склянки с защелкивающейся крышкой, бочки, стеклянные бутылки и т.п. Что касается материала, нет никаких ограничений, если только он является инертным по отношению диоксиду хлора и очень коррозионностойким. Предпочтительно применять резервуары из стекла, металла или пластмассы, в частности, из ПЭВП, ПЭНП, ПВХ, ПТФЭ или сополимеров. В одном предпочтительном варианте осуществления настоящего изобретения резервуары, предусмотренные для перемешивания, перевозки и/или хранения, являются светонепроницаемыми.
Что касается резервуара для хранения растворов диоксида хлора согласно изобретению следует также принимать во внимание закон Генри, который описывает зависимость от температуры отношений растворимостей диоксида хлора в газовой фазе и в жидкости после установления равновесия. В частности, согласно чистому расчету, при пониженных уровнях заполнения, например, после частичного расхода раствора диоксида хлора согласно изобретению, в резервуаре находится больше диоксида хлора в газовой фазе, чем в жидкости. Этим объясняются, как правило, также основные потери активного вещества в растворах диоксида хлора. Негерметичность резервуаров для хранения ведет к постоянной подстройке равновесия и, тем самым, к полной потере активного вещества. Скорость установления равновесия зависит также от имеющейся поверхности, где переход диоксида хлора из жидкости в газовую фазу зависит от поверхности раствора и, в частности, от свободного объема над ней. Если поверхность в остальном закрытого резервуара укрыть, например, более или менее ограниченно лежащим поплавком, то скорость установления равновесия диоксида хлора в газовой фазе с жидкостью существенно снижается. Поэтому резервуар, предусмотренный для хранения и/или транспортировки растворов согласно изобретению, предпочтительно включает поплавок. Этим можно уменьшить поверхность раствора диоксида хлора при низком уровне наполнения настолько, чтобы давление пара диоксида хлора оставалось низким и чтобы можно было также надежно пользоваться остальным уровнем наполнения.
Величина pH растворов диоксида хлора согласно изобретению в одном варианте осуществления лежит в диапазоне от примерно 2 до примерно 4, предпочтительно в диапазоне от примерно 2,5 до 3. Этот диапазон pH особенно выгоден с точки зрения стабильности растворов по изобретению. В противоположность этому, классические растворы диоксида хлора обычно имеют pH больше 4, где это значение pH достигается с помощью подходящей буферной системы. Согласно одному варианту осуществления настоящего изобретения этот раствор диоксида хлора не включает никакого буфера. В одном предпочтительном варианте осуществления этот раствор диоксида хлора согласно изобретению не включает никаких дополнительных компонентов из группы, состоящей из активаторов, катализаторов и стабилизаторов.
В следующем варианте осуществления раствора диоксида хлора согласно изобретению он включает наряду с диоксидом хлора по меньшей мере один другой радикал. Предпочтительно этот раствор диоксида хлора по изобретению получен вышеописанным способом. При этом, как следует из суммарного уравнения (2), предполагается, что для реакции одного эквивалента хлорита с одним эквивалентом пероксодисульфата образуется, помимо одного эквивалента диоксида хлора, также один эквивалент гидросульфатного радикала, как описано выше. В соответствии с этим согласно настоящему изобретению следующий радикал предпочтительно является гидросульфатным радикалом или его производным продуктом, который был получен реакцией с гидросульфатным радикалом.
Благодаря присутствующему в растворе дополнительному радикалу указанный раствор диоксида хлора согласно изобретению включает дополнительный сильный окислитель и имеет, тем самым, дополнительное окислительное действие, посредством которого подавляется или снижается автокаталитическое разложение. Вследствие этого указанный раствор диоксида хлора согласно изобретению выгоден по сравнению с обычными растворами диоксида хлора.
Кроме того, настоящее изобретение относится к набору, который помимо раствора диоксида хлора согласно изобретению включает отдельный подходящий восстановитель, как отдельный сульфитный, дисульфитный, тиосульфатный, сульфидный или нитритный раствор. Предпочтительно сульфитный раствор является раствором сульфита натрия. Альтернативно может также применяться твердый сульфит. Растворы диоксида хлора согласно изобретению можно просто и надежно ликвидировать за короткое время добавкой достаточного количества сульфита. Добавление водного раствора сульфита натрия к раствору диоксида хлора согласно изобретению мгновенно ликвидирует содержащийся в водной и воздушной фазе диоксид хлора. Применение набора согласно изобретению упрощает транспортировку, обращение, а также ликвидацию диоксида хлора и позволяет безопасное обращение с раствором диоксида хлора согласно изобретению. Набор для ликвидации позволяет, кроме того, применять растворы с повышенными концентрациями диоксида хлора с последующим определенным обеззараживанием. Следующим преимуществом ликвидации диоксида хлора является то, что образуется только неядовитый хлорид, а в случае использования сульфита - неядовитый сульфат.
Далее, настоящее изобретение относится к применению вышеописанного водного раствора диоксида хлора как дезинфицирующего средства, как окислителя или отбеливателя и/или как дезодорирующего средства. При этом растворы диоксида хлора согласно изобретению могут использоваться, например, для дезинфекции воздуха, почвы и воды, как питьевая вода, вода для купания, сточная вода, техническая вода и т.д., в медицине, в фильтрах или от биопленок. Кроме того, растворы диоксида хлора согласно изобретению могут применяться в качестве окислителя или отбеливателя, например, в различных технических процессах, таких как производство бумаги, производство пищевых продуктов и т.д., в обработке отходов и шламов после осветления, или в чистящих средствах. Растворы диоксида хлора согласно изобретению могут, кроме того, применяться как дезодорирующие средства, например, для борьбы с запахами, например, в канализационных коллекторах, в промышленных процессах, в быту и т.д., в виде твердых веществ, суспензий и в чистящих средствах. Однако вышеназванные применения не должны рассматриваться как окончательный список. Напротив, растворы диоксида хлора согласно изобретению могут применяться в любых подходящих областях, в которых полезно их дезинфицирующее, окислительное и дезодорирующее действие.
Кроме того, раствор диоксида хлора согласно изобретению может применяться, чтобы количественно перевести диоксид хлора из итого раствора путем экстракции органическими растворителями, как простые эфиры, углеводороды и т.д., в органический растворитель. Тем самым диоксид хлора доступен для других реакций, ограниченных подходящими органическими растворителями. Таким образом, он может применяться в сферах деятельности, где вода мешает или является контрпродуктивной (например, из-за коррозии, вызванной влагой воздуха и т.д.).
Далее, настоящее изобретение относится к применению водного раствора диоксида хлора для дезинфекции питьевой воды и воды для купания или для очистки технической воды и сточных вод, где раствор диоксида хлора получен способом, который включает стадии получения хлорита, получения пероксодисульфата и соединения хлорита и пероксодисульфата в водной системе в мольном отношении пероксодисульфата к хлориту [S2O82-]/[ClO2-] больше 1 с образованием водного раствора диоксида хлора.
Далее, настоящее изобретение относится к применению водного раствора диоксида хлора для дезинфекции питьевой воды и воды для купания, для очистки технической воды и сточных вод или для эффективной борьбы с биопленками, где раствор включает диоксид хлора вместе с гидросульфатным радикалом в форме ассоциированной пары радикалов.
Далее еще раз указываются особенно предпочтительные применения растворов диоксида хлора согласно изобретению или полученных способом согласно изобретению. Так, растворы диоксида хлора согласно изобретению могут применяться в технических процессах.
Называемые в качестве иллюстрации технические процессы включают неразрушающую санацию (стерилизацию) мембранных установок, например установок обратного осмоса, также в области медицины; удаление мха любой природы с производственного материала; удаление налета, например, на автомобилях, кораблях, самолетах; дезодорация в производственных процессах; очистка промышленных сточных вод путем обеззараживания сточных вод, физико-химическое обезвоживание и повторное использование остатков; защита от коррозии в системах канализации сточных вод; поверхностная защита лаков, покрытий любого рода, пластмасс, древесины, металла, керамики, камня; удаление микроорганизмов с длительным действием; обеззараживание поверхностей и объемов (газовая фаза); поддержание чистоты воздушной среды; применение в косметике или медицине, например, в качестве полоскания для рта, для лечения бородавок, для удаления клещей, для направленного разрушения клеток, для внутреннего и наружного применения или для применения против патогенных микробов, для окисления остатков (медикаменты, рентгеноконтрастные препараты, продукты окисления, цианиды и т.д.) в отработанной воде (AOP) после очистных установок; для окисления газообразных продуктов (H2S, NO, NO2, а также органических веществ); а также для стерилизации при низких температурах, например, операционного материала. Растворы диоксида хлора согласно изобретению могут также применяться для окислительной очистки от тяжелых металлов.
Далее, растворы диоксида хлора согласно изобретению могут применяться для обработки питьевой воды, например, на водопроводных станциях для непрерывного обеззараживания питьевой воды, для разложения биопленок в водопроводах в форме стационарной дезинфекции или в форме перманентной дезинфекции. Кроме того, растворы диоксида хлора могут применяться для экстренного хлорирования или дезинфекции питьевой воды, например, после сильного дождя, после инфекционной атаки (например, после заражения резервуаров питьевой воды бактериями из грунтовой, поверхностной или болотной воды, и для устранения патогенных микроорганизмов, например, сибирская язва, холера и т.д.) или после стихийных бедствий, чтобы создать, таким образом, продезинфицированную питьевую воду, или чтобы поддерживать снабжение питьевой водой также из поверхностных вод худшего качества. Наконец, растворы диоксида хлора могут применяться в зданиях (например, клиниках, больницах, домах престарелых, административных зданиях, офисах, жилых домах), плавательных бассейнах, транспортных средствах (например, автомобили, железные дороги, корабли, самолеты) для дезинфекции водопроводов горячей и холодной воды, кондиционеров, установок водоподготовки, бойлеров, канализационных систем или воды для купания в бассейнах, чтобы таким образом удалять, в частности, бактерии легионеллы и другие микроорганизмы, а также биопленки, или чтобы подавить образование биопленок. Предпочтительно раствор диоксида хлора согласно изобретению применяется в форме стационарной дезинфекции или в форме перманентной дезинфекции для удаления биопленок, легионелл или других микробов в водопроводах питьевой воды, установках кондиционирования воздуха, установках водоподготовки, бойлерах или бассейнах.
Другими подходящими применениями в этой области являются замена для экстренной дезинфекции, дезинфекция подземных и надземных резервуаров, дезинфекция оснащения и трубопроводов, дезинфекция после прорыва труб, экстренная дезинфекция после повторного загрязнения, борьба с биопленками и профилактика образования биопленок, очистка сточных вод от остатков лекарств, а также уничтожение мультирезистентных микробов.
В установках кондиционирования воздуха и градирнях растворы диоксида хлора согласно изобретению могут применяться для устранения биопленок из теплообменников и трубопроводов, для устранения заражения, например, легионеллами, для стационарного, непрерывного или ударного обеззараживания и для защиты от коррозии.
В производстве пищевых продуктов растворы диоксида хлора согласно изобретению могут применяться для очистки технологической воды и промывной воды, для поддержания гигиены в производственном процессе, для обеззараживания транспортных средств, для разведения животных, для устранения, борьбы и профилактики очагов инфекции и для поддержания гигиены на бойнях, например, при обработке, упаковке или очистке.
Для плодов, фруктов и семенного материла растворы диоксида хлора согласно изобретению могут применяться для поддержания гигиены в фазах выращивания, во время и после сбора урожая, для поддержания гигиены во время обработки, упаковки для увеличения лежкости, для поддержания гигиены семенного материала при хранении, для задержки прорастания семян, для дезинфекции или стерилизации с длительным действием.
На железных дорогах, самолетах или кораблях растворы диоксида хлора согласно изобретению могут применяться для поддержания гигиены санитарно-гигиенических помещений, кондиционеров, для удаления запаха, для продолжительного экологического удаления растительности, например, в зонах рельсов, указателей и т.д., для дезинфекции судов, для очистки сточных вод, для обработки серых, желтых или черных сточных вод, для стерилизации балластных вод и для получения питьевой воды из морской воды.
Особенно хорошо подходят растворы диоксида хлора согласно изобретению для дезодорирования, например, канализационных систем для отвода сточных вод, а также каналов. В этих системах отвода сточных вод они служат, кроме того, как защита от коррозии, так как стабильно прекращают процесс гниения. Удаление биопленок с помощью этих растворов может очень хорошо применяться как защита поверхности для лаков, покрытий любого рода, пластмасс, древесины, металла, керамики, камня. При этом применяющиеся растворы отличаются особенно продолжительной эффективностью с пролонгированным действием. Пролонгированное действие есть результат полного удаления биопленок с поверхности. Растворы могут в равной мере применяться для обеззараживания поверхностей и объемов (газовая фаза), а также для поддержания чистоты воздуха. Раствор диоксида хлора может использоваться для долговременной очистки, дезинфекции, а также стерилизации мембран. Стабильные радикалы позволяют, кроме того, применение в области медицины, например, как полоскание для рта, для лечения бородавок, для удаления клещей, для целенаправленного разрушения клеток, и вообще для внешней дезинфекции и для уничтожения возбудителей болезней.
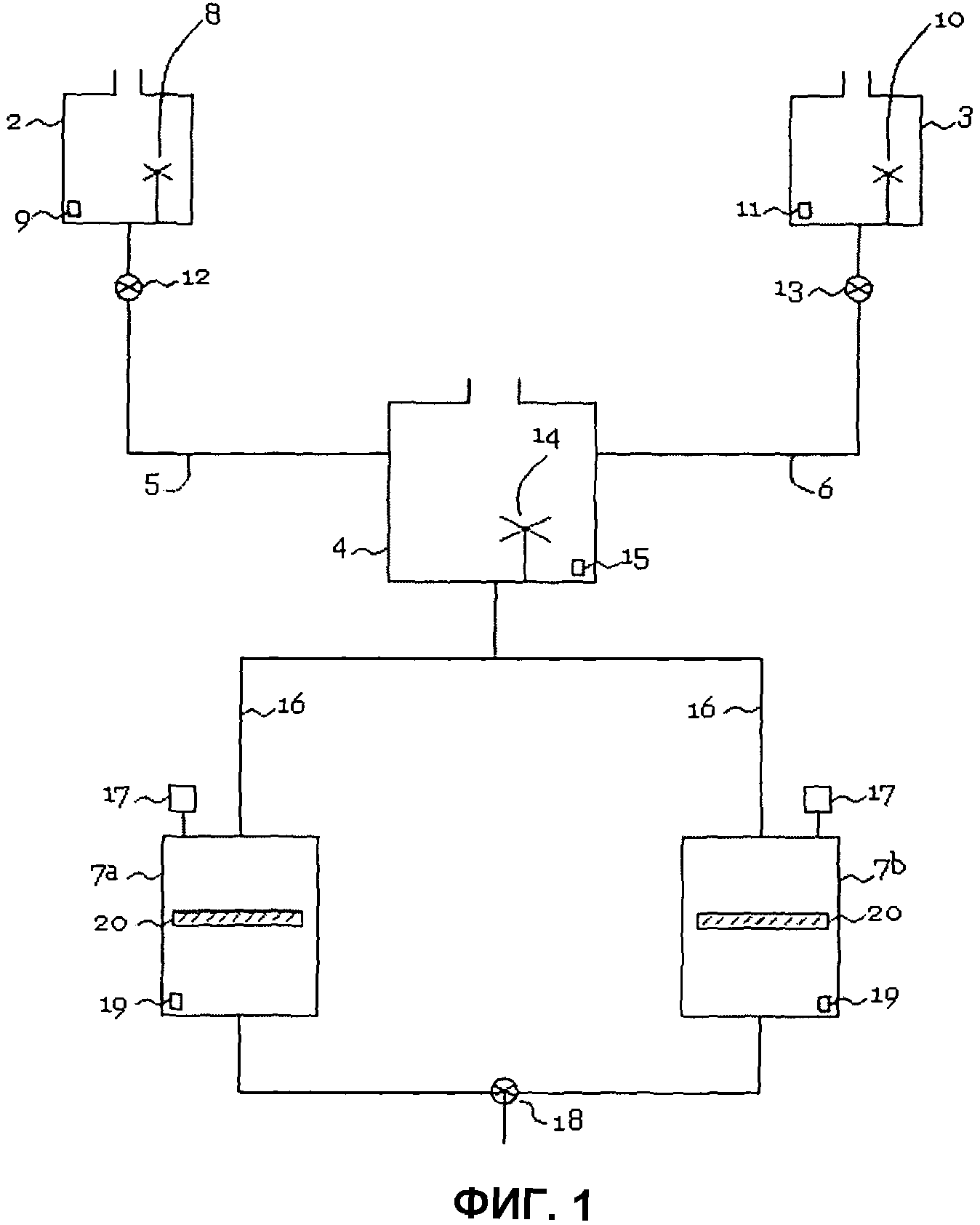
Далее, настоящее изобретение относится к устройству для получения вышеописанного раствора диоксида хлора. В основе этого устройства получения раствора диоксида хлора, согласно изобретению лежит идея, что предлагаемый изобретением способ получения раствора диоксида хлора может проводиться не только в промышленном масштабе, но и подходит также для применения в меньших масштабах. Таким образом, можно предусмотреть соответствующее устройство для осуществления способа по изобретению, например, также в одно- или многоквартирных домах, чтобы там, в непрерывном режиме предоставлять необходимое количество диоксида хлора, например, для дезинфекции питьевой воды и воды для купания.
По этой причине устройство (1) согласно изобретению для получения раствора диоксида хлора согласно изобретению включает
(a) по меньшей мере один резервуар (2) с запасом хлоритного компонента,
(b) по меньшей мере один резервуар (3) с запасом пероксодисульфатного компонента,
(c) по меньшей мере один смеситель (4), который через линию (5) подвода хлоритного компонента соединен с по меньшей мере одним резервуар (2) с запасом хлоритного компонента, и который через линию (6) подвода пероксодисульфатного компонента соединен с по меньшей мере одним резервуаром (3) с запасом пероксодисульфатного компонента,
(d) по меньшей мере один сборник (7) для раствора диоксида хлора, который через по меньшей мере одну линию (16) подвода раствора диоксида хлора соединен или может быть соединен со смесителем (4), и
(e) дозатор (18), который установлен на по меньшей мере одном сборнике (7) для раствора диоксида хлора.
Далее устройство по изобретению описывается на примерах с обращением к приложенному чертежу, показывающему один предпочтительный вариант осуществления, так как задачи, отличительные признаки и преимущества устройства по изобретению будет легче понять из следующего подробного описания, а также приложенного чертежа. При этом следует понимать, что представленный на чертеже вариант осуществления показывает только предпочтительные отличительные признаки, которые не должны обязательно присутствовать.
Фиг.1 показывает один предпочтительный вариант осуществления устройства согласно изобретению для получения раствора диоксида хлора.
При этом устройство 1 включает резервуар 2 с запасом хлоритного компонента. Этот резервуар 2 выполнен так, чтобы он мог хранить хлоритный компонент, например, в твердой форме и как водный раствор. В одном предпочтительном варианте осуществления устройства по изобретению резервуар 2 может содержать смесительное или перемешивающее устройство 8, чтобы в резервуаре 2 можно было создать водный раствор хлоритного компонента путем растворения твердого хлорита в воде, где это растворение облегчается смесительным или перемешивающим устройством 8. В следующем предпочтительном варианте осуществления резервуар 2 включает одну или несколько измерительных ячеек 9, которые предназначены для определения количества или концентрации хлорита в резервуаре 2. Это могут быть, например, ячейки, подходящие для измерения проводимости, величины pH, окислительно-восстановительного потенциала, амперометрические измерительные ячейки или их комбинации.
Устройство 1 включает, кроме того, резервуар (3) с запасом пероксодисульфатного компонента. Этот резервуар 3 выполнен так, чтобы он мог хранить пероксодисульфатный компонент, например, в твердой форме и как водный раствор. В одном предпочтительном варианте осуществления устройства по изобретению резервуар 3 может содержать смесительное или перемешивающее устройство 10, чтобы в резервуаре 3 можно было создать водный раствор пероксодисульфатного компонента путем растворения твердого пероксодисульфата в воде, где это растворение облегчается смесительным или перемешивающим устройством 10. В следующем предпочтительном варианте осуществления резервуар 3 включает одну или несколько измерительных ячеек 11, которые подходят для определения количества или концентрации пероксодисульфата в резервуаре 3. Это могут быть, например, измерительные ячейки, подходящие для измерения проводимости, величины pH, окислительно-восстановительного потенциала, амперометрические измерительные ячейки или их комбинации.
Устройство 1 включает, кроме того, смесительный резервуар 4, который через линию 5 подачи хлоритного компонента соединен или может быть соединен с по меньшей мере одним сборником для хлоритного компонента 2, и который через линию 6 подачи пероксодисульфатного компонента соединен или может быть соединен с по меньшей мере одним резервуаром 3 с запасом пероксодисульфатного компонента. Подводящие линии 5 и 6 способны подавать хлоритный или пероксодисульфатный компонент из резервуаров 2 и 3 в смесительный резервуар 4. В одном предпочтительном варианте осуществления подводящие линии 5 и 6 снабжены дозаторами 12 и 13, которые предназначены регулировать количество подводимого хлорита или пероксодисульфата, а также полностью прекращать подвод хлорита или пероксодисульфата. В одном особенно предпочтительном варианте осуществления подводящие линии 5 и 6 снабжены дозаторами 12 и 13, которые предназначены для регулирования количества подводимого хлорита и пероксодисульфата таким образом, чтобы пероксодисульфат и хлорит подводились в смесительный резервуар 4 в отношении [S2O82-]/[ClO2-] больше 1.
Смесительный резервуар 4 предпочтительно включает смесительное или перемешивающее устройство 14, которое предназначено для смешивания друг с другом подводимого хлоритного и пероксодисульфатного компонентов. Кроме того, смесительный резервуар 4 предпочтительно включает одну или несколько измерительных ячеек 15, которые предназначены для определения количества или концентрации диоксида хлора и/или хлорита и пероксодисульфата в смесительном резервуаре 4. Благодаря соответствующей измерительной ячейке 15 можно отслеживать ход превращения хлорита и пероксодисульфата в диоксид хлора. Кроме того, смесительный резервуар 4 предпочтительно выполнен так, чтобы в него можно было подводить воду. Это особенно важно, когда оба компонента подаются в смесительный резервуар 4 в твердой форме.
Далее, устройство 1 согласно изобретению включает один или несколько сборников (7) для раствора диоксида хлора. В одном предпочтительном варианте осуществления устройство 1 согласно изобретению включает по меньшей мере два сборника для раствора диоксида хлора, 7a и 7b. По меньшей мере один сборник 7 через по меньшей мере одну подводящую линию 16 соединен или может быть соединен со смесительным резервуаром 4. По меньшей мере один сборник 7 предназначен для хранения раствора диоксида хлора, полученного способом по изобретению, пока он не потребуется для конкретного применения. В одном предпочтительном варианте осуществления устройства по изобретению по меньшей мере один сборник 7 снабжен регулятором давления 17, который предназначен для измерения давления в по меньшей мере одном сборнике 7, а также для приложения давления к по меньшей мере одному сборнику 7. Это выгодно в отношении снижения давления паров раствора диоксида хлора. В одном особенно предпочтительном варианте осуществления по меньшей мере один сборник 7 включает, кроме того, поплавок 20, предназначенный покрывать поверхность раствора диоксида хлора в сборнике 7. Это выгодно, в частности, при низком уровне наполнения сборника с точки зрения снижения давления паров раствора диоксида хлора.
Далее, устройство 1 согласно изобретению включает дозатор 18, который установлен по меньшей мере на одном сборнике 7 для раствора диоксида хлора. Этот дозатор 18 способен регулировать отбор раствора диоксида хлора из по меньшей мере одного сборника 7. Дозатор 18 может быть, например, дозирующим насосом. Поскольку устройство 1 включает по меньшей мере два сборника для раствора диоксида хлора, 7a и 7b, то выгодно, чтобы дозатор 18 был выполнен так, чтобы с его помощью можно было отбирать раствор диоксида хлора либо из сборника 7a, либо из сборника 7b. Далее, сборник 7 предпочтительно включает одну или несколько измерительных ячеек 19, которые предусмотрены для определения количества или концентрации диоксида хлора и/или хлорита и пероксодисульфата в сборнике 7. Благодаря этому можно в любой момент определить концентрацию диоксида хлора, а также его чистоту в растворе диоксида хлора.
Устройство согласно изобретению позволяет получать и держать наготове раствор диоксида хлора в переменных количествах. Хранение в по меньшей мере двух разных сборниках 7a и 7b позволяет, кроме того, непрерывный отбор готового раствора диоксида хлора. Так, например, при отборе раствора из сборника 7a сборник 7b снова наполняется, и наоборот.
В одном предпочтительном варианте осуществления устройство по изобретению включает, кроме того, камеру созревания, которая расположена между смесительным резервуаром 4 и сборником 7. Эта камера созревания предпочтительно выполнена так, чтобы принимать соединенные в смесительном резервуаре 4 растворы и содержать их до тех пор, пока реакция хлорита и пероксодисульфата в диоксид хлора не пройдет полностью. В одном особенно предпочтительном варианте осуществления камера созревания включает также регулятор давления.
Кроме того, устройство согласно изобретению предпочтительно включает автоматизированный блок управления процессом, который соединен или может быть соединен, например, с измерительными ячейками 9, 11, 15 и 19, регуляторами давления 17, а также дозаторами 12 и 13. Благодаря этому блоку управления процессом можно, например, регулировать количество и концентрацию получаемого раствора диоксида хлора через управление подводимыми количествами хлорита и пероксодисульфата.
В следующем предпочтительном варианте осуществления устройство 1 согласно изобретению выполнено так, чтобы получение, а также хранение раствора диоксида хлора проходило при исключении света. Это можно осуществить, например, так, чтобы выполнить резервуар и подводящие линии, не пропускающими свет. Но можно также поместить устройство 1 в коробку или ящик, которые не пропускают свет.
В следующем предпочтительном варианте осуществления в устройстве 1 согласно изобретению можно поддерживать равномерную температуру. Особенно предпочтительно выполнить устройство 1 таким образом, чтобы, в частности, перемешивание обоих исходных продуктов, а также хранение готовых растворов диоксида хлора могло осуществляться при температурах в диапазоне от примерно 0°C до примерно 25°C. Это можно осуществить, например, с помощью подходящих охлаждающих устройств, которые охлаждают единственный смеситель или сборный резервуар. Но можно также, чтобы все устройство 1 находилось в чем-то вроде холодильного шкафа.
В следующем предпочтительном варианте осуществления устройство 1 согласно изобретению устроено так, чтобы производить раствор диоксида хлора непрерывно в проточном режиме. В другом предпочтительном варианте осуществления устройство 1 согласно изобретению устроено так, чтобы производить раствор диоксида хлора порциями в периодическом режиме.
В одном предпочтительном варианте осуществления устройство согласно изобретению предусмотрено для применения в качестве маломощной установки в одно- или многоквартирном доме. Это выгодно, например, чтобы непрерывно или периодически создавать там по потребности, необходимое количество диоксида хлора для дезинфекции питьевой воды и воды для купания. В следующем предпочтительном варианте осуществления предлагаемое изобретением устройство для получения раствора диоксида хлора выполнено транспортабельным, тем, что оно помещено в корпус. Корпус может быть любым подходящим для перевозки корпусом, например, металлическим или пластмассовым корпусом. Предпочтительно транспортабельное устройство является устройством весом менее 500 кг, особенно предпочтительно менее 100 кг. Таким образом, устройство согласно изобретению можно перевозить и, как результат, способ по изобретению можно применять только на месте использования раствора диоксида хлора. Это может быть, например, маломощная установка в одно- или многоквартирном доме.
В другом предпочтительном варианте осуществления устройство согласно изобретению предназначено для применения в качестве крупной промышленной установки, например, как резервуарный танк. Это выгодно, например, чтобы получать раствор диоксида хлора согласно изобретению в больших количествах, а затем при необходимости разливать в меньшие резервуары и продавать или транспортировать. Это выгодно тем, что используется раствор диоксида хлора согласно изобретению, произведенный не на месте.
В завершение, настоящее изобретение относится также к ассоциированной паре радикалов, которая включает по меньшей мере один радикал диоксида хлора, а также один гидросульфатный радикал. Предпочтительно эта ассоциированная пара радикалов включает дополнительно по меньшей мере одну молекулу воды и при необходимости еще дополнительные радикальные соединения. Этими дополнительными радикальными соединениями могут быть, например, подходящие радикальные промежуточные ступени, такие как OH•, SO4• или ClO•, которые были образованы, исходя из диоксида хлора или гидросульфатного радикала. В одном предпочтительном варианте осуществления ассоциированная пара радикалов согласно изобретению является стабильной, т.е. она стабильна при хранении по меньшей мере 1 час. В одном особенно предпочтительном варианте осуществления она стабильна один день, еще более предпочтительно 1 год. В следующем предпочтительном варианте осуществления ассоциированная пара радикалов согласно изобретению находится в отсутствие буфера.
Далее изобретение подробнее поясняется на примерах.
Примеры
Методика анализа
Концентрацию диоксида хлора в растворах диоксида хлора согласно изобретению можно определить различными методами. В частности, концентрацию диоксида хлора можно определить амперометрически, фотометрически, иодометрически, титрование раствора диоксида хлора раствором сульфита или методом ионной хроматографии.
Методы анализа подробно описаны в рабочих стандартах Немецкой ассоциации фирм по газо- и водоснабжению (DVGW) W224 (февраль 2010), S. 18ff со ссылкой на стандарт DIN 38408-5.
В следующих примерах применялась, в частности, фотометрия для определения концентрации диоксида хлора, а также ионная хроматография для определения содержаний других веществ, как хлорит, хлорат, перхлорат, гипохлорит и диоксид хлора.
В случае фотометрии неограниченно справедлив закон Ламберта-Бера. Для определения концентрации диоксида хлора фотометрией измерения проводятся на длине волны 360 нм. Молярный коэффициент экстинкции составляет 1100±50 [л/моль·см].
С помощью ионной хроматографии устанавливают содержание хлорита, хлората, перхлората, гипохлорита и диоксида хлора в комбинации. Условия известны из уровня техники и описаны, например, в диссертации Petra Hübenbecker (Bonn, 2010): "Исследование образования побочных продуктов дезинфекции при очистке питьевой воды на борту плавучей морской установки в условиях применения".
Пример 1: Получение 60 литров водного раствора диоксида хлора концентрацией около 0,6%
В 60-литровую канистру отвешивали 56,530 г деминерализованной воды. Отдельно в разных сосудах отвешивали 1970 г технического 24,5%-ного раствора хлорита натрия и 1,500 г пероксодисульфата натрия (99%-ного). Пероксид и хлорит по отдельности растворяли в достаточном количестве воды из канистры. После внесения раствора хлорита натрия приливали раствор пероксодисульфата натрия и оставляли на 24-48 ч при 12°C. Выход диоксида хлора составлял от 88 до 98% в расчете на используемый хлорит натрия.
Пример 2: Получение раствора диоксида хлора с концентрацией около 0,6% (50 склянок с защелкивающейся крышкой, каждая по 0,2 л)
В 10-литровое ведро наливали 9,65 литров деминерализованной воды. Отдельно отвешивали 100 г порошкообразного 80%-ного хлорита натрия (включающего 20% хлорида натрия) и отдельно 250 г пероксодисульфата натрия (99%-ного). Оба твердых вещества растворяли отдельно друг от друга в достаточном количестве воды из ведра. Раствор хлорита натрия добавляли в оставшуюся в ведре воду и при недолгом перемешивании смешивали с раствором пероксида.
Готовую смесь разливали в склянки и хранили закрытой 2-3 дня в холодильнике при температуре 5-10°C. Выход диоксида хлора составлял от 85 до 99% в расчете на используемый хлорит натрия.
Пример 3: получение одного литра 0,3%-ного раствора диоксида хлора
500 мг хлорита натрия (80%-ного) растворяли в 500 мл деминерализованной воды и смешивали с раствором 2500 мг пероксодисульфата натрия в 497 мл деминерализованной воды. Бутыль закрывали, и оставляли в холодильном шкафу на 24 ч. Выход составляет >85% в расчете на используемый хлорит натрия.
Пример 4: Получение одного литра 0,6%-ного раствора диоксида хлора
10,00 г хлорита натрия (80%-ного) растворяли в 100 мл деминерализованной воды. Растворяли также 105,00 г пероксодисульфата натрия (99%-ного) в 100 мл деминерализованной воды. Оба раствора вводили в 685 мл деминерализованной воды. Бутыль закрывали и оставляли в холодильном шкафу на 3 ч. Выход составляет >95% в расчете на используемый хлорит натрия.
Пример 5: Получение одного литра 0,6%-ного раствора диоксида хлора
10,00 г хлорита натрия (80%-ного) растворяли в 40 мл деминерализованной воды. Растворяли также 330 г пероксодисульфата натрия (99%-ного) в 620 мл деминерализованной воды. Бутыль закрывали и оставляли в холодильном шкафу на 30 минут. Выход составляет >98% в расчете на используемый хлорит натрия.
Было установлено, что все растворы диоксида хлора, полученные в примерах 1-5, стабильны при хранении, т.е. что через один год не наблюдается никакого достойного упоминания (>5%) разложения диоксида хлора. Кроме того, оказалось, что растворы тем стабильнее, чем меньше побочных продуктов находится в реакционной смеси.
Было найдено, что готовый продукт как ассоциированная пара радикалов способен проходить через мембрану и эта ассоциированная пара радикалов имеет измененные физические свойства (давление пара, растворимость и т.д.).
Для давления пара 0,6%-ного раствора диоксида хлора были определены следующие величины:
Согласно литературе (DVGW W224/1986 S.5), начиная с концентрации ClO2-100 мбар (=10% об., 300 г ClO2/м3) предупреждают о взрывоопасности раствора.
В противоположность этому было найдено, что растворы согласно изобретению являются легкими в использовании и не имеют никакой склонности к самопроизвольному разрушению или взрыву. Даже при высоких температурах 50°C продукт превращается в хлорат очень медленно, а при температурах 80-90°°C быстро. При этом растворы никогда не были воспламеняющимися. Это было проверено также с концентрациями диоксида хлора до 4,5% вес. Если производить растворы диоксида хлора с концентрациями выше 2,5% вес., это ведет к повышению давления в реакционном сосуде, которое следует рассчитывать по уравнению идеального газа. При концентрациях выше примерно 4,5% вес. диоксид хлора выпадает в осадок в виде маслянистой жидкости.
Если растворы с концентрациями активного вещества диоксида хлора от 0,01 до 4,5% привести в контакт с горящими предметами или открытым пламенем, то сами эти предметы тухнут в 4,5%-ном растворе ClO2-, однако при этом газовая фаза разлагается. В случае растворов с концентрацией ClO2<1%, реакции с газовой фазой неощутимы.
Список позиций для ссылок
Реферат
Изобретение может быть использовано в производстве дезинфицирующих и дезодорирующих средств, отбеливателей, при дезинфекции воды. Способ получения водного раствора диоксида хлора включает стадии получения хлорита, получения пероксодисульфата, соединения хлорита и пероксодисульфата в водной системе при мольном отношении пероксодисульфата к хлориту [SO ]/[ClO ] больше 1. При этом не добавляют дополнительного буфера. Изобретение позволяет упростить процесс с получением высокочистого, стабильного при хранении водного раствора диоксида хлора. 8 н. и 10 з.п. ф-лы, 1 ил., 5 пр.
Формула
(a) получение хлорита,
(b) получение пероксодисульфата,
(c) соединение хлорита и пероксодисульфата в водной системе при мольном отношении пероксодисульфата к хлориту [S2O82-]/[ClO2-] больше 1 с образованием водного раствора диоксида хлора,
где для получения водного раствора диоксида хлора не добавляют дополнительного буфера.
(c1) оба компонента перед соединением растворяют в воде, если оба компонента приготовлены в твердой форме, или
(с2) оба компонента в твердой форме одновременно или по очереди вводят в водный растворитель, или
(c3) оба раствора соединяют, если оба компонента приготовлены в форме водных растворов, или
(с4) оба компонента готовят в водных растворах и одновременно или по очереди вводят в водный растворитель,
чтобы получить водный раствор диоксида хлора.
(a) по меньшей мере один резервуар (2) с запасом хлоритного компонента,
(b) по меньшей мере один резервуар (3) с запасом пероксодисульфатного компонента,
(c) по меньшей мере один смеситель (4), который через линию (5) подвода хлоритного компонента соединен с по меньшей мере одним резервуаром (2) с запасом хлоритного компонента и который через линию (6) подвода пероксодисульфатного компонента соединен с по меньшей мере одним резервуаром (3) с запасом пероксодисульфатного компонента,
(d) по меньшей мере один резервуар (7) для раствора диоксида хлора, который через по меньшей мере одну линию (16) подвода раствора диоксида хлора соединен или может быть соединен со смесителем (4), и
(е) дозатор (18), который установлен на по меньшей мере одном резервуаре (7) для раствора диоксида хлора.

Комментарии