Белковые гидролизаты на молочной основе и детские смеси и питательные композиции, приготовленные из них - RU2612008C2
Код документа: RU2612008C2
Чертежи



Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к композициям, содержащим белковый гидролизат на молочной основе, полученный путем обработки раствора белкового материала на молочной основе ферментами из микробного источника. Композиции можно встраивать в детские смеси и пищевые добавки для взрослых. Изобретение касается двух различных типов белковых гидролизатов, предназначенных для профилактики аллергии и лечения аллергии. В первом случае грудные дети являются здоровыми, но подвержены риску аллергии из-за наличия аллергии в семейном анамнезе. Во втором случае, грудные дети или взрослые страдают аллергией.
Уровень техники
Человеческое грудное молоко и грудное вскармливание представляют несомненный золотой стандарт в питании грудных детей. Детские смеси, которые служат заменой или дополнением к грудному молоку человека, должны удовлетворять диетическим требованиям для грудных детей, иметь приемлемый вкус, и быть гипоаллергенными и толерогенными (т.е. способными к стимуляции пероральной толерантности), будучи предназначенными для грудных детей, подверженных риску аллергии. Стимуляция перпероральной толерантности к коровьему молоку описана в EP 0827697. Известно, что аллергии на коровье молоко и детские смеси, содержащие белки коровьего молока, обусловлены тем, что белки коровьего молока отличаются от белков материнского молока, и могут быть аллергенами для человека. Основными известными аллергенами коровьего молока является альфа-лактальбумин (αЛА), бета-лактоглобулин (βЛГ) и бычий сывороточный альбумин (БСА). Бычий сывороточный белок и/или казеин часто применяют в качестве источников молочного белка в детских смесях. Для снижения аллергенности белки коровьего молока гидролизуют ферментами, и таким образом редуцируют до пептидов. Современные гипоаллергенные смеси, состоящие из таких гидролизатов белков коровьего молока, предназначенные для профилактики аллергии, также содержат другие нутриенты, такие как животные жиры, растительные масла, крахмал, мальтодекстрин, лактозу и сахарозу. Эти белковые гидролизаты могут быть также включены в молочный напиток или биологически активные добавки к пище для взрослых.
Процесс гидролиза, используемый для получения этих гидролизатов, нужно тщательно контролировать так, чтобы готовый продукт гидролизат сохранял свою питательную ценность и необходимые физические свойства, но был гипоаллергенным и толерогенным.
Гидролизаты могут быть охарактеризованы как «частичные» или «экстенсивные» в зависимости от степени, до которой проведена реакция гидролиза. В настоящее время нет согласованного законного/клинического определения высокогидролизованных продуктов в соответствии с указаниями WAO (Всемирной организации по аллергии) в отношении аллергии на белки коровьего молока (CMA), но признано, что в соответствии с WAO гидролизованные рецептуры являются пригодным и широко применяемым источником белка для детей, страдающих аллергией на белки коровьего молока. В настоящем изобретении частичным гидролизатом является гидролизат, в котором 60% от совокупности белков/пептидов имеет молекулярную массу менее 1000 Дальтон, в то время как экстенсивным гидролизатом является гидролизат, в котором по меньшей мере 95% от совокупности белков/пептидов имеет молекулярную массу менее 1000 Дальтон. Эти определения в настоящее время применяются в промышленности. Частичные гидролизаты считаются гипоаллергенными (ГА), в то время как экстенсивные гидролизаты считаются не аллергенными.
Многие группы проводили исследования для оптимизации процесса гидролиза. Условия реакции гидролиза, включая температуру и объем реакции, число циклов гидролиза, выбор белкового субстрата, тип и концентрацию фермента(ов), являются некоторыми из многих факторов, влияющих на реакцию гидролиза, и таким образом, физические, химические, и наконец, биологические свойства готового продукта. В EP 0353122, смеси трипсина и химотрипсина с отношением активности трипсина/химотрипсина от 0,33 до 0,66 используют для приготовления гипоаллергенных гидролизатов сывороточного белка. WO 9304593 A1 и US 5039532 А также раскрывают способ гидролиза с применением трипсина и химотрипсина, включающий двухэтапную реакцию гидролиза с этапом тепловой денатурации в промежутке, чтобы гарантировать, что окончательный гидролизат полностью свободен от интактных аллергенных белков. Трипсин и химотрипсин, используемые в этих способах, являются препаратами, полученными путем экстракции из поджелудочной железы свиньи. Ряд продуктов, содержащих белковые гидролизаты, приготовленные на основе этих способов, имеется в продаже. Например, детская смесь Nestlé HA® может быть приготовлена с гидролизатом, полученным с применением трипсина и химотрипсина, экстрагированных из поджелудочной железы животных, и ее гипоаллергенные характеристики хорошо изучены и документированы. Опубликованы три основных статьи о результатах большого рандомизированного интервенционного исследования, проведенного в Германии, целью которого было сравнение эффекта гидролизованных рецептур по сравнению со стандартной рецептурой из коровьего молока для профилактики проявлений аллергии, в особенности атопической астмы, у подверженных риску грудных детей. Эти публикации перечислены далее:
«The effect of hydrolyzed cow’s milk formula for allergy prevention in the first year of life: the German Infant Nutritional Intervention Study, a randomized double-blind trial» von Berg A., Koletzko S., Grübl A., Filipiak-Pittroff B., Wichmann H.E., Bauer C.P., Reinhardt D., Berdel D.; German Infant Nutritional Intervention Study Group. J Allergy Clin Immunol. 2003 Mar; 111:533-40 («Влияние рецептуры из гидролизованного коровьего молока на профилактику аллергии в течение первого года жизни: Диетическое интервенционное исследование у грудных детей в Германии, рандомизированное двойное слепое испытание»).
«Certain hydrolyzed formulas reduce the incidence of atopic dermatitis but not that of asthma: three-year results of the German Infant Nutritional Intervention Study». von Berg A., Koletzko S., Filipiak-Pittroff B., Laubereau B., Grübl A., Wichmann H.E., Bauer C.P., Reinhardt D., Berdel D.; German Infant Nutritional Intervention Study Group. J Allergy Clin Immunol. 2007 Mar; 119:718-25 («Некоторые гидролизованные рецептуры снижают частоту атопического дерматита, но не астмы: результаты трехлетнего Диетического интервенционного исследования у грудных детей в Германии»),
((Preventive effect of hydrolyzed infant formulas persists until age 6 years: long-term results from the German Infant Nutritional Intervention Study (GINI Study)». von Berg A., Filipiak-Pittroff B., Krämer U., Link E., Bollrath C, Brockow I., Koletzko S., Grübl A., Heinrich J., Wichmann H.E., Bauer C.P., Reinhardt D., Berdel D.; GINIplus study group, J Allergy Clin Immunodol 2008; 121:1442-7 («Профилактический эффект гидролизованных детских смесей отмечается до 6-летнего возраста: долговременные результаты для Диетического интервенционного исследования у грудных детей в Германии»).
Заключение последнего исследования GINI состоит в том, что раннее диетическое вмешательство с детской смесью от Nestlé H.A., NAN HA®, у детей с высоким риском, оказывает долговременное профилактическое влияние в отношении атопического дерматита до 6-летнего возраста, что указывает на реальное снижение частоты заболевания, а не на задержку проявления заболевания.
Долговременный профилактический эффект означает профилактический эффект, продолжающийся значительно дольше периода вскармливания NAN HA®, демонстрирующий стимуляцию перпероральной толерантности, хотя иммунные механизмы, вовлеченные в эту индукцию толерантности, не изучены в GINI исследовании.
Помимо наличия гипоаллергенности, также необходимо, чтобы детская смесь, предназначенная для использования в качестве дополнения или замены грудного молока, обладала способностью к стимуляции перпероральной толерантности у грудных детей. Перпероральная толерантность является специфической супрессией клеточной и/или гумпероральной иммунной реактивности на антиген перед применением антигена пероральным способом. Она является важной частью развития иммунной системы в первые месяцы жизни, и позволяет ребенку употреблять пищу без побочной реакции. Неспособность к установлению пероральной толерантности ведет к аллергии. Развитие пероральной толерантности связано с обучением иммунной системы, приводящим к снижению реакции на пищевые антигены. Считается, что некоторые пептиды, которые могут специфически присутствовать в частично гидролизованной детской смеси, обладают способностью к взаимодействию с иммунной системой и к стимуляции пероральной толерантности. Считается, что эти пептиды должны иметь конкретные свойства, включая относительно малый размер, для лучшей поддержки обучения иммунной системы, без действия в качестве аллергенов. Также считается, что последовательности специфических пептидов могут играть значительную роль. Определенные пептидные профили гидролизатов могут действительно быть основой стимуляции пероральной толерантности.
В настоящее время отмечается широко распространенная тенденция перехода от применения ферментов животного происхождения к применению ферментов из микробных источников. Отмечается значительный прогресс за последние 20 лет в области производства ферментов посредством генной инженерии. Это сделало возможным воспроизводимое получение больших количеств высококачественного фермента с высокой чистотой за относительно короткий период времени. По этим причинам необходимо сделать возможным применение ферментов из микробного источника для получения гидролизатов молочного белка, предназначенных для использования в детской смеси. Кроме того, необходимо, чтобы эти гидролизаты молочного белка обладали способностью к стимуляции пероральной толерантности у грудных детей.
Таким образом, для сохранения гипоаллергенных свойств гидролизатов, полученных с помощью ферментов млекопитающих, гидролизаты, полученные с микробными ферментами, должны обладать схожими химическими, физическими и биологическими свойствами. Далее, любая новая детская смесь в продаже подчиняется строгим регуляторным требованиям, например, используемым в Европейском руководстве 2006/141/EC. Таким образом, необходимо, чтобы каждый новый продукт имел очень схожий пептидный профиль с профилем уже аттестованного продукта, изготовленного с ферментами млекопитающих, для сохранения эффекта в отношении профилактики аллергии. Далее, необходимо, чтобы гидролизаты молочного белка обладали способностью к стимуляции пероральной толерантности у грудных детей.
Подобным образом, необходимо стимулировать снижение аллергий или побочного эффекта, усилить абсорбцию белков или аминокислот, повысить утилизацию белков или аминокислот и/или модулировать воспалительные процессы у пациентов, в особенности путем обеспечения частичных белковых гидролизатов в полных питательных композициях.
Имеется потребность в гидролизате из белков молочного происхождения, приготовленном под действием ферментов не от млекопитающих, предпочтительно микробных ферментов, обладающем низкой аллергенностью со способностью к стимуляции пероральной толерантности.
Имеется потребность в таком гидролизате для предпочтительного включения в детскую смесь и/или питательную композицию, предназначенную для индивидуумов, подверженных риску аллергии.
Имеется потребность в таких композициях, снижающих риск или тяжесть аллергий в последующем периоде жизни, и модулирующих частоту аллергических симптомов.
Имеется потребность в получении гидролизатов на основе бактериальных ферментов с пептидным профилем, разделяющим некоторое сходство с гидролизатами, полученными с ферментами млекопитающих, и кроме того, обладающих способностью стимуляции свойств пероральной толерантности в последующем периоде жизни, с демонстрируемой профилактикой аллергических симптомов.
Имеется потребность в применении указанных выше ферментов в приготовлении питательных композиций для больных или ослабленных пациентов.
Также как и для производства «частичных» гидролизатов, эти микробные ферменты можно также применять для получения «экстенсивных» белковых гидролизатов, представленных в терапевтической рецептуре, такой как те, что предназначаются для вскармливания грудных детей и детей более старшего возраста с аллергией на коровье молоко. В этом случае, целевой популяцией будут больные (страдающие аллергией) грудные дети и дети более старшего возраста, уже сенсибилизированные к белкам коровьего молока.
Эти микробные ферменты также можно использовать для получения любого типа белковых гидролизатов, применяемых продуктах для грудных детей, детей более старшего возраста или взрослых, нацеленных на иные полезные эффекты, чем те, что связаны с аллергией, такие как облегчение пищеварения, усиление абсорбции и метаболизма аминокислот, пептидов и белков, стимуляция выздоровления, оптимизированная утилизация источников азота, стимуляция построения ткани и накопления энергии.
Для решения этой проблемы авторы разработали интенсивную программу исследований, и сравнили ряд микробных ферментов в качестве потенциальных кандидатов выполнения реакции гидролиза. Они контролировали параметры, включая эффективность реакции гидролиза, специфичность ферментов и профиль молекулярной массы пептидов, и установили, что ряд определенных смесей ферментов обеспечивает гидролизаты с необходимыми физическими, химическими и биологическими свойствами. Гидролизаты молочного белка, раскрытые здесь, можно получить эффективным и воспроизводимым образом, они имеют приемлемый вкус, обладают необходимой питательной ценностью, и являются гипоаллергенными. Далее, гидролизаты в соответствии с настоящим изобретением могут стимулировать пероральную толерантность.
Сущность изобретения
Настоящее изобретение касается композиций, содержащих белковые гидролизаты на молочной основе, полученные путем обработки раствора белкового материала на молочной основе:
a) по меньшей мере одной трипсиноподобной эндопептидазой, продуцируемой микроорганизмом, и
b) по меньшей мере одной химотрипсиноподобной эндопептидазой, продуцируемой микроорганизмом.
При характеристике по профилю молекулярной массы пептидов, профилю пептидной последовательности (специфичности эндопептидазы), и эффективности гидролиза эндопептидаз, гидролизаты в соответствии с настоящим изобретением обладают свойствами, подобными свойствами гидролизатов на основе молочного белка, полученных с помощью ферментов млекопитающих.
Гидролизаты из настоящего изобретения обладают лечебным и профилактическим эффектом, и могут применяться в особенности для стимуляции пероральной толерантности у грудных детей или нуждающихся в них пациентов, или для снижения риска аллергии у грудных детей и нуждающихся в них пациентов, или для снижения тяжести аллергии во время грудного возраста или в последующем периоде жизни, особенно у грудных детей или нуждающихся в них пациентов.
Гидролизаты могут быть включены в начальную детскую смесь, последующую смесь, смесь для детского питания, и в детскую смесь на основе злаков или молочную смесь для детей 1-3 лет; или в питательную композицию для взрослых, или напиток на основе молочного белка для взрослых, для индивидуумов, нуждающихся в лечении; и предпочтительно, указанная композиция является стартовой детской смесью.
В одном аспекте настоящего изобретения по меньшей мере одну трипсиноподобную эндопептидазу получают из штамма Fusarium, предпочтительно Fusarium oxysporum, или из штамма Kutzneria, предпочтительно Kutzneria albida.
В другом аспекте изобретения по меньшей мере одну химотрипсиноподобную эндопептидазу получают из штамма Nocardiopsis, предпочтительно Nocardiopsis Sp. или Metarhizium, предпочтительно Metarhizium anisopliae, или Brachysporiella, предпочтительно Brachysporiella gayana.
В другом аспекте изобретения массовое соотношение трипсиноподобной эндопептидазы к химотрипсиноподобной эндопептидазе находится в диапазоне от 5:1 до 35:1, предпочтительно от 20:1 до 30:1, более предпочтительно 27:1.
В другом аспекте изобретения массовое соотношение трипсиноподобной эндопептидазы к химотрипсиноподобной эндопептидазе составляет 9:1, где трипсиноподобная эндопептидаза получена из штамма Fusarium, а химотрипсиноподобная эндопептидаза получена из штамма Nocardiopsis.
Краткое описание чертежей
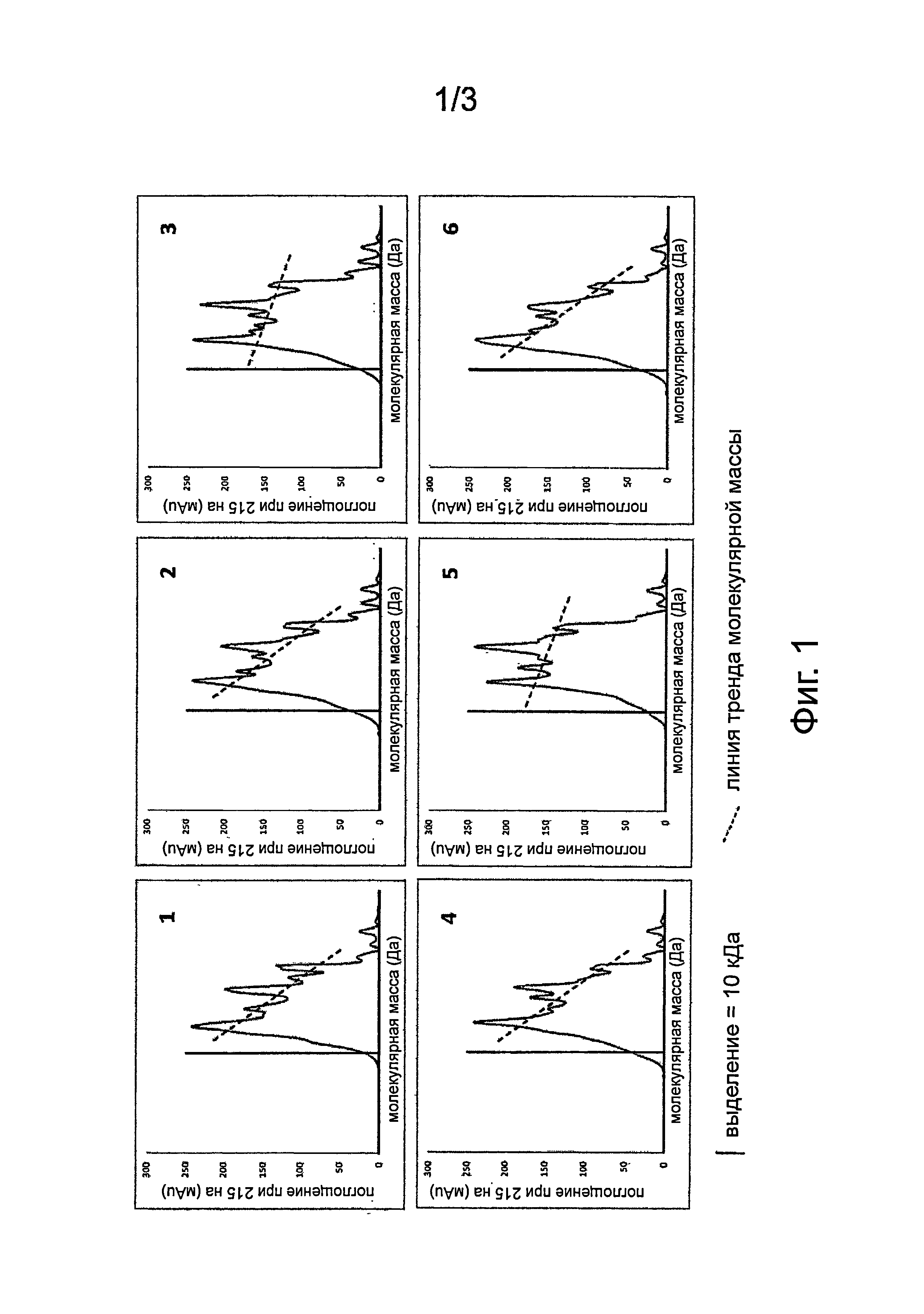
Фиг.1. Разделение пептидной эксклюзионной хроматографией гидролизатов из Примера 1. Пептиды разделяли на основе молекулярной массы (М.м.) с применением эксклюзионной хроматографической колонки (Superdex Peptide 10/300 GL от GE). Элюцию пептидов контролировали с помощью УФ при 215 нм. Результаты показали, что распределение по размеру комбинаций 2, 4 и 6 было очень схожим с эталонным PTN (эксперимент 1, см. текст), как показано постепенным снижением от высокой к низкой молекулярной массе, по сравнению с комбинациями 3 и 5, для которых скорее наблюдается плато (см. линию тренда). Эти результаты позволили предположить, что ферментативная эффективность в экспериментах 2, 4 и 6 обеспечивает совокупность пептидов, очень схожих по размеру, в то время как в экспериментах 3 и 5 совокупности более обогащены малыми пептидами, по сравнению с эталоном.
Фиг.2. Анализ специфичности ферментов в гидролизатах из Примера 1. Пептидные. последовательности идентифицировали посредством ЖХ-MC/MC (LTQ-Orbitrap MS с ВЭЖХ насосами Allegro от Thermo Scientific). Для каждой идентифицированной последовательности экстрагировали пять аминокислот до и после участка расщепления (положение 1), и строили график частоты (или график сохранения последовательности). Аминокислоты указывали на графике от наивысшей (верх) до наименьшей (низ).частоты, где их вертикальный размер пропорционален их частоте. Результаты показали, что смеси ферментов, используемые в примерах 4 и 6, обладали ферментативной специфичностью, сопоставимой с эталоном PTN (эксперимент 1).
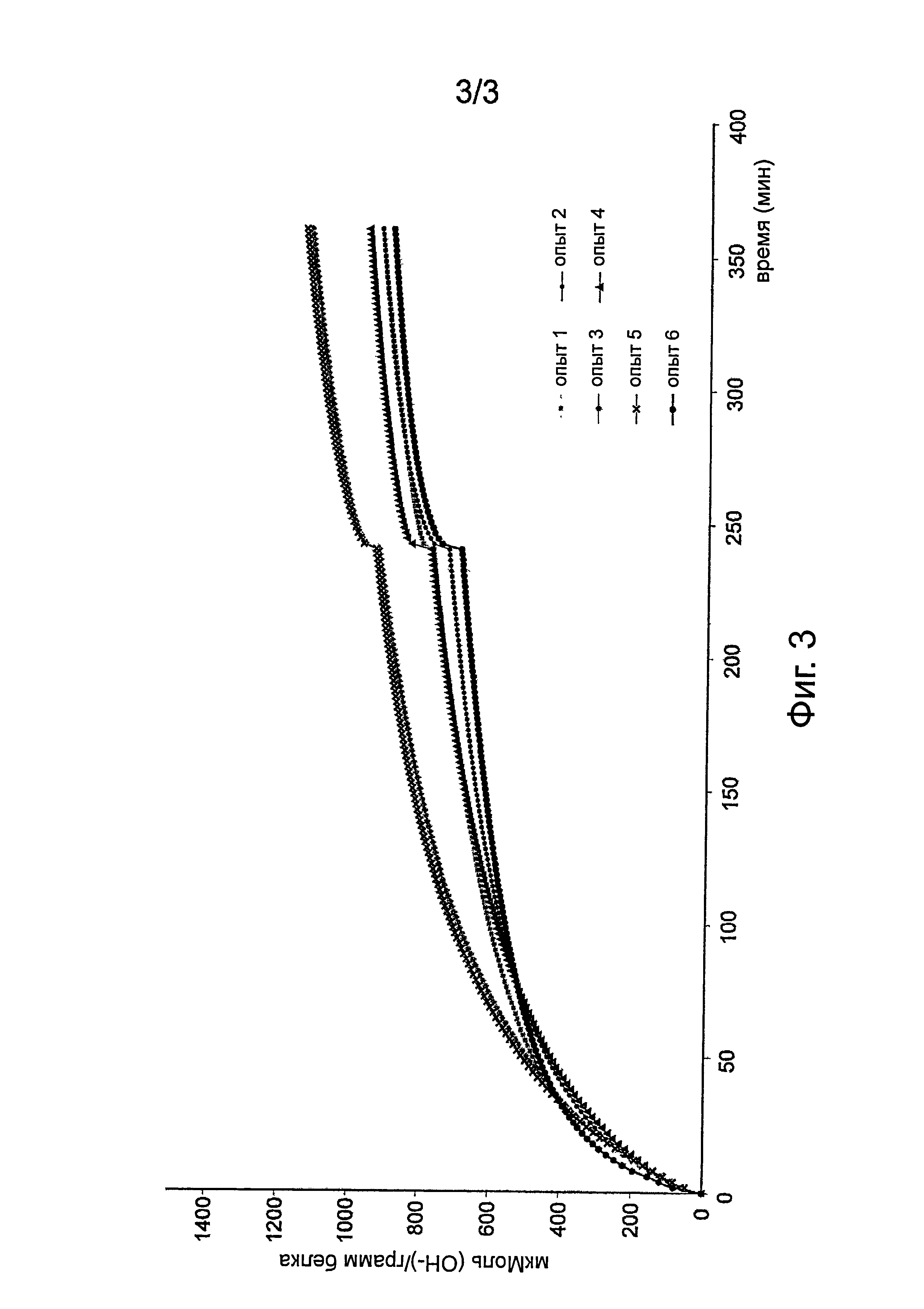
Фиг.3. Кинетика потребления OH- при реакциях гидролиза из примера 1 (в мкмоль потребляемого OH- на грамм белка).
Раскрытие изобретения
Белковые гидролизаты на молочной основе из настоящего изобретения получали путем обработки раствора белкового материала на молочной основе трипсиноподобной эндопептидазой и химотрипсиноподобной эндопептидазой из микробного источника.
Белковый материал на молочной основе
В композициях в соответствии с настоящим изобретением исходным материалом является белковый материал на молочной основе. Он может быть белковым материалом на основе сыворотки, казеином или смесями белкового материала на основе сыворотки и казеина. Источник казеина может быть кислым казеином или сухим обезжиренным молочным остатком. Белковый материал на основе сыворотки может быть сывороткой от изготовления сыра, в частности сладкой сывороткой, такой как полученная при коагуляции казеина сычужным ферментом, кислой сывороткой от коагуляции казеина кислотой, или ацидифицирующими ферментами, или даже смешанной сывороткой, полученной при коагуляции кислотой и сычужным ферментом. Этот исходный материал может быть сывороткой, деминерализованной ионным обменом и/или электролизом, и известной как деминерализованный сывороточный белок (ДОБ). В предпочтительном варианте осуществления источником такого белкового материала на основе сыворотки является сладкая сыворотка, из которой казеино-глико-макропептид (КГМП) полностью или частично удален. Это называется модифицированной сладкой сывороткой (МСС). Удаление КГМП из сладкой сыворотки приводит к белковому материалу с содержаниями треонина и триптофана, близкими к грудному молоку человека. Способ удаления КГМП из сладкой сыворотки описан в EP 880902.
Исходным материалом может быть смесь ДСП и МСС. Он может быть концентратом сывороточных белков с 35-80% белка (КСБ) или изолятом, если концентрация сывороточного белка составляет более 95% белка (ИСБ). Примером КСБ является WPC 87 Lacprodan®, поставляемый Aria Foods, Дания, а примером ИСБ является Bipro® от Davisco Foods International (Миннесота, США).
Белковый материал на молочной основе может быть в растворе или суспензии, и присутствует в концентрации 2-30 масс.% от массы белкового материала, более предпочтительно 5-20 масс.%, более предпочтительно 6-10 масс.%.
Исходный материал может быть даже комбинацией вышеупомянутых исходных материалов и лактозы. Лактоза может присутствовать как часть концентрата сывороточного белка, или может быть добавлена. Добавление лактозы к исходному материалу для гидролиза обладает тем преимуществом, что гидролизуется любой остаточный белок, содержащийся в лактозе. Лактоза может присутствовать в концентрациях от 0,05-30 масс.%, предпочтительно 0,10-20 масс.%, или в случаях когда необходимо более низкое содержание лактозы, 0,10-1 масс.%, предпочтительно 0,10-0,20 масс.%. В последнем случае готовый продукт может быть предназначен для грудных детей или взрослых с низкой переносимостью лактозы. Лактозу можно удалить, например, путем ультрафильтрации (получая УФ сыворотку), факультативно с последующим диализом.
Исходный материал может быть в форме истинного или коллоидного водного раствора, или в форме порошка. В последнем случае порошок растворяют предпочтительно в деминерализованной воде до получения водного раствора.
Ферменты, продуцируемые микроорганизмом
Трипсиноподобная эндопептидаза и химотрипсиноподобная эндопептидаза в соответствии с настоящим изобретением может быть получена из микроорганизма любого рода. «Получена» означает здесь получение ферментацией из клетки определенного организма. Последние ферменты могут быть нативными по отношению к организму, из которого они получены, или созданы генно-инженерным путем в организме носителя путем вставки нуклеотидной последовательности, кодирующей эндопептидазу. Трипсиноподобная эндопептидаза
Трипсин (EC 3.4.21.4) является сериновой протеазой, находящейся в пищеварительной системе многих позвоночных, где он гидролизует белки. Он вырабатывается в поджелудочной железе в виде неактивного профермента трипсиногена. Трипсин расщепляет пептидные цепи или связи главным образом в карбоксильной части аминокислот лизина или аргинина, за исключением тех случаев, если за ними следует пролин. «Трипсиноподобная эндопептидаза» в настоящем изобретении означает фермент, обладающий активностью, подобной активности трипсина млекопитающих, например, трипсина, выделенного из ткани поджелудочной железы свиней. «Трипсиноподобная эндопептидаза» также означает эндопептидазу, преимущественно разрушающую пептиды или белки в C-концевом участке L-изомера аргинина и/или лизина, предпочтительно аргинина и лизина. Трипсиноподобная эндопептидаза может быть получена из грамположительного бактериального штамма, такого как Bacillus, Clostridium, Enterococcus, Geobacillus, Kutzneria, Lactobacillus, Lactococcus, Oceanobacillus, Staphylococcus, Streptococcus, или Streptomyces, или грамотрицательного бактериального штамма, такого как Campylobacter, Escherichia (предпочтительно, E. coli), Flavobacterium, Fusobacterium, Helicobacter, Ilyobacter, Neisseria, Pseudomonas, Salmonella, или Ureaplasma, или грибкового штамма, такого как Saccharomyces, Kluyveromyces, Pichia, Candida, Aspergillus, Penicillium, Fusarium, и Claviceps. В предпочтительном варианте осуществления трипсиноподобная эндопептидаза является грибковой эндопептидазой, предпочтительно из штамма Fusarium, более предпочтительно Fusarium oxysporum, который имеет последовательность, зарегистрированную под наименованием SWISSPROT №P35049. Трипсиноподобная эндопептидаза может иметь по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% последовательности, идентичной SWISSPROT № P35049. Описан фермент, кодируемый указанной последовательностью (US 5,288,627; US 5,693,520).
В другом предпочтительном варианте осуществления трипсиноподобная эндопептидаза получена из грамположительной бактерии, предпочтительно штамма Kutzneria, более предпочтительно из Kutzneria albida. В другом предпочтительном варианте осуществления, трипсиноподобная эндопептидаза имеет последовательность, идентичную зрелому полипептиду с SEQ ID NO: 1 по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, или 100%.
Концентрация трипсиноподобной эндопептидазы может составлять 100-500,000 трипсиновых единиц Фарм. США Фарм. США на грамм пищевого белка, например, 250-250,000 или 500-100,000. Одна трипсиновая единица по Фарм. США является активностью, вызывающей изменение поглощения при 253 нм на 0,003 при pH 7,6 и 25°C, при использовании N-бензоил-L-аргинин этилового эфира гидрохлорида (BAEE) в качестве субстрата.
Если выразить иначе, в мг белка фермента с чистотой более 95% на мл, это означает, что концентрация трипсиноподобной эндопептидазы может быть в диапазоне от 0,5 до 4, предпочтительно от 1 до 3,5, и более предпочтительно от 1,5 до 3 мг на грамм молочного белка. Это не зависит от присутствия химотрипсиноподобной эндопептидазы.
Ферменты: Химотрипсиноподобная эндопептидаза
Химотрипсин (EC 3.4.21.4) является сериновой протеазой, предпочтительно расщепляющей пептидные амидные связи, где карбоксильная часть амидной связи (в P1 положении) является тирозином, триптофаном или фенилаланином. Химотрипсин также гидролизует другие амидные связи с более низкой скоростью, предпочтительно связи, содержащие лейцин в P1 положении. «Химотрипсиноподобная эндопептидаза» означает фермент, обладающий активностью, подобной химотрипсину млекопитающих, например, химотрипсину, выделенному из ткани поджелудочной железы свиней. Она также означает фермент, обладающий большей специфичностью при расщеплении на карбокси-концевом участке тирозиновых, фенилаланиновых, триптофановых, лейциновых, метиониновых и гистидиновых остатков, чем при расщеплении на карбокси-концевом участке аргинина и лизина.
Химотрипсиноподобная эндопептидаза в соответствии с настоящим изобретением может быть получена из грамположительного бактериального штамма, такого как Bacillus, Clostridium, Enterococcus, Geobacillus, Kutzneria, Lactobacillus, Lactococcus, Oceanobacillus, Staphylococcus, Streptococcus, или Streptomyces, или грамотрицательного бактериального штамма, такого как Campylobacter, Escherichia (предпочтительно E. coli), Nocardiopsis, Flavobacterium, Fusobacterium, Helicobacter, Ilyobacter, Neisseria, Pseudomonas, Salmonella, или Ureaplasma, или грибкового штамма, такого как Saccharomyces, Kluyveromyces, Pichia, Candida, Aspergillus, Penicillium, Fusarium, и Claviceps. Предпочтительно, химотрипсиноподобная эндопептидаза из настоящего изобретения может быть получена из грамположительного или грамотрицательного бактериального штамма. В более предпочтительном варианте осуществления химотрипсин получен из штамма Nocardiopsis, предпочтительно из Nocardiopsis sp. EMBL CDS CAI94179 (ранее описанного, например, в WO 88/03947). В другом предпочтительном варианте осуществления химотрипсиноподобная эндопептидаза имеет последовательность, идентичную полипептиду EMBL CDS CAI94179 по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%», по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, или 100%.
В другом более предпочтительном варианте осуществления, химотрипсиноподобная эндопептидаза получена из Metarhizium, предпочтительно Metarhizium anisopliae, например, имеющая аминокислотную последовательность зрелого полипептида с последовательностью TREMBL: Q9Y843. В другом предпочтительном варианте осуществления химотрипсиноподобная эндопептидаза имеет последовательность, идентичную полипептиду TREMBL: Q9Y843, по меньшей мере на 70%, по меньшей мере на 75%), по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, или 100%. по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере «а 90%, по меньшей мере на 95%, по меньшей мере на 96%), по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, или 100%. В другом более предпочтительном варианте осуществления, химотрипсиноподобная эндопептидаза получена из Brachysporiella, предпочтительно Brachysporiella gayana, CGMCC 0865, с аминокислотами 1-186, раскрыта в WO 2004/072279. В другом предпочтительном варианте осуществления, химотрипсиноподобная эндопептидаза имеет последовательность, идентичную последнему полипептиду из ссылки, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%», по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%), по меньшей мере на 99%, или 100%.
Концентрация химотрипсиноподобной эндопептидазы составляет предпочтительно 100-100,000 химотрипсиновых единиц Фарм. США на грамм белка на молочной основе, более предпочтительно 500-50,000, и наиболее предпочтительно 1,000-20,000. Одна химотрипсиновая единица по Фарм. США является активностью, вызывающей изменение поглощения при 237 нм на 0,0075 при pH 7,0 и 25°C, с применением N-ацетил-L-тирозин этилового эфира (АТЕЕ) в качестве субстрата. Если выразить иначе, в мг белка фермента с чистотой более 95% на мл, это означает, что концентрация химотрипсиноподобной эндопептидазы может быть в диапазоне от 0,05 до 2, предпочтительно от 0,1 до 1, и более предпочтительно от 0,15 до 0,4 мг на грамм молочного белка. Это не зависит от присутствия трипсиноподобной эндопептидазы.
Во время процесса гидролиза ферменты используют вместе в качестве смеси. Например, трипсиноподобную эндопептидазу, полученную из Kutzneria albida, можно объединить с химотрипсиноподобной эндопептидазой из Nocardiopsis sp., или из Metarhizium anisopliae, или из Brachysporiella gayana. Например, трипсиноподобную эндопептидазу, полученную из Fusarium oxysporum, можно объединить с химотрипсиноподобной эндопептидазой из Nocardiopsis sp, или из Metarhizium anisopliae, или из Brachysporiella gayana.
Авторы изобретения установили, что массовое соотношение трипсиноподобной эндопептидазы и химотрипсиноподобной эндопептидазе (отношение ТУХ) должно быть в диапазоне от 5:1 до 35:1, предпочтительно от 20:1 до 30:1, более предпочтительно 27:1. Далее, если трипсиноподобная эндопептидаза получена из штамма Fusarium, а химотрипсиноподобная эндопептидаза получена из штамма Nocardiopsis, то предпочтительный диапазон для соотношения T/X составляет от 8:1 до 11:1, более предпочтительно 9:1.
Это особенно справедливо для трипсиноподобной эндопептидазы (Т) из Fusarium oxysporum в сочетании с химотрипсиноподобной эндопептидазой (X) из Nocardiopsis в отношении T/X 9:1, трипсиноподобной эндопептидазы (T) из Kutzneria albida в сочетании с химотрипсиноподобной эндопептидазой (X) в отношении T/X 27:1, и трипсиноподобной эндопептидазы (T) из Fusarium oxysporum в сочетании с химотрипсиноподобной эндопептидазой (X) из Nocardiopsis в отношении T/X 27:1.
Способ гидролиза
Типичные условия для выполнения гидролиза описаны в предшествующем уровне техники. Температура может быть в диапазоне примерно от 40°C до 60°C, предпочтительно 50°C, время реакции от 1 до 6 часов, предпочтительно 4 часа, а значения pH могут быть в диапазоне от 6,5 до 8,5, предпочтительно от 7,0 до 8,0. Значение pH можно регулировать хорошо известными агентами, например, Ca(OH)2. В документах US 5039532 или EP 0631731 A1 описана двухэтапная реакция с этапом тепловой денатурации между этапами, чтобы обеспечить полное освобождение готового гидролизата от белковых молочных аллергенов. Этап тепловой денатурации предпочтительно проводят при 95°C в течение 5 минут.
Факультативно, раствор или суспензию белка на молочной основе можно предварительно нагреть (например, до 80-100°C в течение 5-30 минут, или до 130°C в течение примерно 30-60 секунд) для обеспечения денатурации сывороточных белков, например, α-лактальбумина, β-лактоглобулина и сывороточного альбумина (БСА).
Независимо от того, как проведен гидролиз, продукт гидролиза подвергают тепловой обработке, которая инактивирует фермент, осуществляющий гидролиз. Эта тепловая обработка включает предварительное нагревание гидролизата до температуры 75°C или выше, и выдерживание при этой температуре (предпочтительно, 75°C-85°C) в течение примерно 0,1-30 минут для стимуляции ауторасщепления фермента, эта обработка предпочтительно сопровождается стерилизацией, предпочтительно при ультравысокой температуре, например 125°C-135°C в течение 30 секунд - 3 минут, путем инжекции пара или в теплообменнике.
Полученный таким образом гидролизат можно осветлять, фильтровать или подвергать ультрафильтрации. Его также модно концентрировать. Затем его можно высушить, например, путем лиофилизации, распылительной сушки, или сублимационной сушки для различных приложений, или можно дополнительно обработать. В последнем случае фермент можно инактивировать во время последующей обработки.
Гидролизаты в соответствии с настоящим изобретением могут иметь степень гидролиза, характеризующуюся НБА/ОА, %. НБА/ОА% означает отношение небелкового азота к общему азоту, в процентах. Небелковый азот является аминным азотом, свободным для реакции с тринитробензолсульфоновой кислотой (ТНБС). Отношение НБА/ОА можно измерить, как описано в Adler-Nissen J-, 1979, J. Agric. Food Chem., 27 (6), 1256-1262. В целом, экстенсивные гидролизаты характеризуются НБА/ОА% более 95%, в то время как частично гидролизованный гидролизат характеризуется НБА/ОА в диапазоне 75-85%. В предпочтительном варианте осуществления гидролизаты в соответствии с настоящим изобретением имеют НБА/ОА% в диапазоне 70-90%, предпочтительно 75-85%. Последние гидролизаты являются «частичными» гидролизатами. Эти гидролизаты можно также охарактеризовать тем, что 60-70% от их совокупности белков/пептидов имеет молекулярную массу <1000 Дальтон.
В другом предпочтительном варианте осуществления, где необходимы «экстенсивные» гидролизаты, гидролизаты из настоящего изобретения имеют НБА/ОА% в диапазоне более 95%. Эти гидролизаты можно также охарактеризовать тем, что по меньшей мере 95% от их совокупности белков/пептидов имеет молекулярную массу <1000 Дальтон.
Гидролизаты из настоящего изобретения могут иметь степень гидролиза, характеризующуюся НБА/ОА%. Отношение небелкового азота к общему азоту широко используют в качестве меры растворимых пептидов, образованных с помощью ферментативного гидролиза. Этот метод анализа, применяемый для измерения НБА, эквивалентен методу АОАС 991.21. В 100% гидролизатах на основе сыворотки содержание НБА/ОА обычно находится в диапазоне 70-90%. В предпочтительном варианте осуществления гидролизаты из настоящего изобретения имеют значение НБА/ОА% в диапазоне 70-90%, предпочтительно 75-85%). В другом предпочтительном варианте осуществления, где необходим экстенсивно гидролизованный гидролизат, гидролизаты в соответствии с настоящим изобретением имеют НБА/ОА% в диапазоне более 95%.
Распределение по молекулярной массе для пептидов в полученном белковом гидролизате можно определить, например, эксклюзионной хроматографией (ЭХ). В предпочтительном варианте осуществления, гидролизат в соответствии с настоящим изобретением является частичным гидролизатом и содержит пептиды, менее 1 масс.% которых имеют молекулярную массу более 20,000 Дальтон. В более предпочтительном варианте осуществления гидролизаты из настоящего изобретения имеют распределение пептидов по массе, подобное тому, что получают с помощью фермента млекопитающих, в частности, свиного фермента, например, PTN 6.0 S® (также известного как PTN) от Novozyme (Дания) (см. Пример 1, Фигура 1). Этот эталонный фермент является трипсином, выделенным из поджелудочной железы свиней, содержащим трипсин в качестве основного компонента, но также остаточный химотрипсин. Он имеет активность трипсина 1350 трипсиновых единиц Фарм. США/грамм, и активность химотрипсина 80 химотрипсиновых единиц Фарм. США/грамм. Это обеспечивает отношение T7X 16 на основе активности.
Ферментативная специфичность в смеси ферментов, используемых при гидролизе, можно оценить путем секвенирования пептидов, содержащихся в полученном гидролизате. Пептидные последовательности идентифицируют посредством ЖХ-МС/МС. В более предпочтительном варианте осуществления гидролизаты из настоящего изобретения имеют ферментативную специфичность, близкую к специфичности, полученной с ферментом млекопитающих, в частности свиным ферментом, например, PTN 6.0S, описанным выше (см. Пример 1, Фигуру 2).
Эффективность гидролиза можно оценить путем измерения потребления щелочи (ОН) при гидролизе. В более предпочтительном варианте осуществления гидролизаты из настоящего изобретения имеют эффективность гидролиза, близкую к той, что получена для фермента млекопитающих, в частности, свиного фермента, например, PTN, описанного выше (см. Пример 1, Фигуру 3).
Остаточную антигенность гидролизатов можно оценить с применением стандартных иммуноанализов, таких как ИФА анализы. Предпочтительно, гидролизаты из настоящего изобретения содержат остаточный β-лактоглобулин βЛГ) менее 3 мг эквивалента βЛГ/грамм белкового эквивалента, более предпочтительно менее 2 мг эквивалента βЛГ/грамм белкового эквивалента, наиболее предпочтительно менее 1 мг эквивалента βЛГ/грамм белкового эквивалента (см. Пример 1).
Гидролизаты из настоящего изобретения можно включить в детскую смесь, смесь для подрастающих детей, смесь для детского питания, в детскую смесь на основе зерновых, в молочную смесь для детей 1-3 лет, биологически активную добавку к пище для грудных детей или детей более старшего возраста, или в питательную композицию для взрослых, т.е. во все препараты, предназначенные для профилактики или лечения аллергии, а также нацеленные на другие полезные эффекты, которые белковые гидролизаты могут обеспечить у человека, и предпочтительно, указанная композиция является стартовой детской смесью.
В одном варианте осуществления настоящего изобретения гидролизаты применяют в комбинации с избранными пробиотиками, например, в детской смеси. Избранные пробиотики могут быть любыми пробиотиками, обычно используемыми в детской смеси. Предпочтительно, пробиотиками являются те, что способны обеспечить дополнительный или синергетический эффект в отношении аллергии и/или стимуляции пероральной толерантности и/или воспалительных процессов.
Примеры подходящих пробиотических микроорганизмов, которые можно применять в настоящем изобретении, включают дрожжи, такие как Saccharomyces, Debaromyces, Candida, Pichia и Torulopsis, плесневые грибы, такие как Aspergillus, Rhizopus, Mucor, и Penicillium и Torulopsis, и бактерии, такие как представители рода Bifidobacterium, Bacteroides, Clostridium, Fusobacterium, Melissococcus, Propionibacterium, Streptococcus, Enterococcus, Lactococcus, Staphylococcus, Peptostrepococcus, Bacillus, Pediococcus, Micrococcus, Leuconostoc, Weissella, Aerococcus, Oenococcus и Lactobacillus. Конкретными примерами подходящих пробиотических микроорганизмов являются: Saccharomyces cereviseae, Bacillus coagulans, Bacillus licheniformis, Bacillus subtilis, Bifidobacterium bifidum, Bifidobacterium infantis, Bifidobacterium longum, Enterococcus faecium, Enterococcus faecalis, Lactobacillus acidophilus, Lactobacillus alimentarius, Lactobacillus casei subsp.casei, Lactobacillus casei Shirota, Lactobacillus curvatus, Lactobacillus delbruckii subsp. lactis, Lactobacillus farciminus, Lactobacillus gasseri, Lactobacillus helveticus, Lactobacillus johnsonii, Lactobacillus reuteri, Lactobacillus rhamnosus (Lactobacillus GG), Lactobacillus sake, Lactococcus lactis, Micrococcus varians, Pediococcus acidilactici, Pediococcus pentosaceus, Pediococcus acidilactici, Pediococcus halophilus, Streptococcus faecalis, Streptococcus thermophilus, Staphylococcus carnosus, и Staphylococcus xylosus.
Предпочтительные пробиотические бактериальные штаммы включают Lactobacillus rhamnosus АТСС 53103, поставляемый Valio Oy из Финляндии под торговой маркой LGG, Lactobacillus rhamnosus CGMCC 1.3724, Lactobacillus paracasei CNCM 1-2116, Lactobacillus reuteri ATCC 55730 и Lactobacillus reuteri DSM 17938, поставляемый BioGaia AB, Bifidobacterium lactis CNCM 1-3446, поставляемый, среди прочего, компанией Christian Hansen из Дании под торговой маркой ВЬ 12, и Bifidobacterium longum АТСС BAA-999, поставляемый Morinaga Milk Industry Co. Ltd., из Японии, под торговой маркой BB536.
Пробиотики, если они входят в состав композиций из настоящего изобретения, предпочтительно присутствуют в количестве от 103 до 1012 KOE/г, более предпочтительно от 106 до 1011 KOE/г, еще более предпочтительно от 104 до 109 КОЕ/г, наиболее предпочтительно от 107 до 109 KOE/г композиции, или на мл композиции.
Примеры
Пример 1
Проводили серию реакций гидролиза с применением одного и того же белкового субстрата и набора из 6 растворов ферментов, состоящих из одного стандартного раствора PTN и пяти различных смесей трипсино- и химотрипсиноподобных эндопептидаз в соответствии с Таблицей 1. Исходным материалом было 500 мл 8% раствора субстрата молочного белка MWP28/DWP28 в соотношении 83/17 к массе белка. Окончательная композиция для субстрата содержала 27,7% общего сухого остатка, 8% белка, и 18,48% лактозы.
Белковый субстрат растворяли в 8% растворе м/о в воде. Для реакции использовали общий объем 500 мл. Температуру уравновешивали до 55°C. Значение pH подводили до 7,4 с применением 10% раствора Ca(OH)2. После добавления фермента (половины от общего используемого фермента на 1-м этапе гидролиза), значение pH поддерживали постоянным при 7,4, путем добавления 0,25 M NaOH, с применением автоматического устройства для титрования Autotitrator DL50 Graphix (Mettler Toledo) в течение 4 часов при 55°C. Гидролизат нагревали в течение 5 минут при 93°C. После уравновешивания при температуре 55°C, добавляли дополнительное количество фермента (половину от общего количества фермента для 2-го этапа гидролиза), и поддерживали pH, как указано выше. Спустя 2 часа гидролиза, ферментативную реакцию останавливали путем тепловой обработки (5 мин при 85°C) для инактивации ферментов.
В Таблице 1 показаны серии экспериментов, проведенных с различными соотношениями ферментов. TL1 и TL2 обозначают трипсиноподобные эндопептидазы из Fusarium oxysporum, и Kutzneria albida, соответственно. CTL2 и CTL3 обозначают химотрипсиноподобные эндопептидазы из Metarhizium anisopliae и Nocardiopsis sp., соответственно.
Шесть полученных гидролизатов анализировали с применением трех различных способов, пептидной эксклюзионной хроматографии, анализа специфичности ферментов, и остаточной антигенности. Эффективность гидролиза в шести реакциях оценивали путем мониторинга потребления OH-. Результаты показаны на Фигурах 1-3, соответственно.
Антигенность: Остаточную антигенность гидролизатов анализировали с применением коммерческого иммуноанализа для ферментов (RIDASCREEN β-Лактоглобулин (BLG), r-Biopharm), сконструированного для количественного определения нативного и обработанного остаточного бета-лактоглобулина в продуктах питания. Ячейки микропланшета для титрования были покрыты бета-лактоглобулином. Добавляли растворы эталонов, образцов и анти-BLG антител. Свободный и иммобилизованный BLG конкурировали за участки связывания с антигеном. После отмывания добавляли вторичные антитела, меченные пероксидазой, для связывания с комплексами BLG-антитело. Затем удаляли какие-либо не связавшиеся конъюгаты фермента с помощью этапа отмывания. В ячейки добавляли субстрат фермента и хромоген. Связанный конъюгат фермента превращал бесцветный хромоген в окрашенный продукт. Измерения проводили фотометрически, поглощение обратно пропорционально концентрации BLG в образце.
Во всех шести гидролизатах, анализируемых в примере 1, присутствовал остаточный β-лактоглобулин (BLG) в количестве менее 0,85 мг BLG-эквивалента на грамм белкового эквивалента. Это значительно ниже уровня, при котором детскую смесь можно считать гипоаллергенной, как указано в Европейском руководстве 2006/125/CE по детским смесям, опубликованном 5 декабря 2006, JO 6.12.2006 L339/16. В руководстве требуется, чтобы содержание иммунореактивного белка было менее 1% от общего количества азотсодержащих веществ. Это эквивалентно 3 мг остаточного β-лактоглобулина (BLG/r белкового эквивалента). BLG составляет примерно от 30% до 50% от общего иммунореактивного материала в сыворотке. Таким образом, уровень BLG ниже 3 мг остаточного β-лактоглобулина/г белкового эквивалента указывает, что продукт содержит не более 1% иммунореактивного белка. Такой уровень соответствует Приложению IV к Руководству Европейской комиссии 2006/125/CE, также устанавливающему определенные условия для детской смеси, предназначенной для снижения риска аллергии.
Заключение
Было установлено, что ряд смесей трипсиноподобных эндопептидаз и химотрипсиноподобных эндопептидаз из микробных источников является пригодным для производства гидролизатов молочного белка со свойствами, подобными свойствам молочных гидролизатов, полученных с помощью ферментов млекопитающих. Авторы изобретения провели ряд экспериментов для оценки оптимального отношения ферментов, для обеспечения гидролизатов с необходимыми физическими, химическими и биологическими свойствами. Использовали разные варианты бактериального источника и соотношения трипсиноподобных эндопептидаз к химотрипсиноподобным эндопептидазам (к массе ферментов), а также соотношения белка к субстрату, и температуры.
Было установлено, что смесь трипсиноподобной эндопептидазы от Fusarium oxysporum или Kutzneria albida в сочетании с химотрипсиноподобной эндопептидазой от Nocardiopsis sp или Metarhizium anisopliae являются хорошими кандидатами для замены ферментов млекопитающих, используемых в настоящее время. Смеси в соответствии с настоящим изобретением, особенно при использовании трипсиноподобной эндопептидазы и химотрипсиноподобной эндопептидазы в определенных соотношениях, как было ясно продемонстрировано, обеспечивают пептидные профили, очень схожие с теми, что получены с применением ферментов млекопитающих.
Это особенно справедливо для трипсиноподобной эндопептидазы (T) из Fusarium oxysporum в сочетании с химотрипсиноподобной эндопептидазой (X) из Nocardiopsis в массовом соотношении Т/Х 9:1, и для трипсиноподобной эндопептидазы (T) из Kutzneria albida в сочетании с химотрипсиноподобной эндопептидазой (X) из Nocardiopsis в массовом соотношении T/X 27:1, и для трипсиноподобной эндопептидазы (T) из Fusarium oxysporum в сочетании с химотрипсиноподобной эндопептидазой (X) из Nocardiopsis в массовом соотношении T/X 27:1.
Гидролизаты, полученные таким способом, обладают низкой аллергенностью. Они могут снижать риск развития аллергии в последующей жизни, и могут быть пригодными для включения в детскую смесь и/или в питательную композицию, предназначенную для здоровых индивидуумов, подверженных риску аллергии. Они пригодны для включения в любой вид биологически активных добавок к пище для взрослых или детей, или для младенцев. Они также могут обладать способностью к стимуляции пероральной толерантности.
Помимо аспекта профилактики аллергии, смеси трипсина и химотрипсина из микробных источников можно применять для получения лечебных продуктов, таких как те, что предназначены для употребления в пищу субъектами, страдающими аллергией. Их можно также применять для получения любого вида белковых гидролизатов, предназначенных для получения иных полезных эффектов, чем профилактика/лечение аллергии.
Реферат
Группа изобретений относится к медицине и касается композиции для стимуляции пероральной толерантности у грудных детей или нуждающейся в ней субъектов, содержащей белковый гидролизат на молочной основе, полученный путем обработки раствора белкового материала на молочной основе по меньшей мере одной трипсиноподобной эндопептидазой, полученной из микроорганизма Kutzneria albida, и по меньшей мере одной химотрипсиноподобной эндопептидазой, полученной из микроорганизма Nocardiopsis Sp. или Metarhizium anisopliae. Группа изобретений также касается композиции для снижения риска аллергии у грудных детей или нуждающейся в ней субъектов, содержащей белковый гидролизат на молочной основе; композиции для снижения тяжести или частоты аллергии во время грудного возраста или в последующем периоде жизни у грудных детей или нуждающейся в ней субъектов, содержащей белковый гидролизат на молочной основе. Группа изобретений обеспечивает получение гидролизатов, которые обладают уменьшенной остаточной антигенностью и низкой аллергенностью. 3 н. и 6 з.п. ф-лы, 1 пр., 3 ил., 1 табл.

Комментарии