Детское питание для улучшения чувствительности к инсулину в дальнейшей жизни - RU2694827C1
Код документа: RU2694827C1
Чертежи



Описание
Область техники
Настоящее изобретение относится к питательной композиции для применения в профилактике и/или снижении риска развития расстройства, связанного с метаболическим синдромом, причем питательная композиция содержит казеин.
Уровень техники
В настоящее время хорошо известно, что субоптимальное питание в критические периоды развития может вызывать долгосрочные изменения в строении или функциях органов, что может определять предрасположенность людей к последующим хроническим заболеваниям (1-5). Данная концепция, известная как раннее программирование, в значительной степени подтверждается несколькими обширными эпидемиологическими и клиническими исследованиями, демонстрирующими связь между маркерами питания в раннем возрасте (рост при рождении, рост в грудном возрасте, скорость роста в раннем возрасте) и риском развития гипертензии, диабета, коронарной болезни сердца и ожирения впоследствии во взрослом возрасте (4; 6; 7).
Таким образом, в настоящее время пренатальный и ранний постнатальный периоды признаны критическими периодами для раннего программирования, причем интерес направлен на рост при рождении (2; 7; 8), грудное вскармливание и его продолжительность (9-13), динамику роста в раннем возрасте (6; 14-16) и- с недавнего времени - на содержание белка в детской смеси (17).
Учитывая, что пренатальное и раннее постнатальное питание играет роль в формировании восприимчивости к развитию одного или более расстройств, связанных с метаболическим синдромом, в дальнейшей жизни, существует очевидная необходимость во вмешательстве на этих стадиях, которое снижало бы риск развития расстройств в дальнейшей жизни.
Таким образом, питательная композиция для вскармливания на ранних этапах жизни, снижающая риск развития расстройств, связанных с метаболическим синдромом, в дальнейшей жизни будет иметь преимущества.
Существует конкретная потребность в особых питательных композициях, которые можно вводить в конкретные интервенционные периоды на ранних этапах жизни детей грудного возраста и которые могут обладать способностью снижать риск, предотвращать или снижать тяжесть субоптимальных состояний здоровья, которые обычно связывают с метаболическими синдромами, такими как избыточная масса тела, ожирение, диабет или даже сердечно-сосудистые заболевания.
У этих детей грудного возраста, имеющих повышенный риск развития таких субоптимальных состояний, например, вследствие генетической наследственности, состояния здоровья родителей, сложностей при развитии на ранних этапах, существует еще более выраженная потребность.
Сущность изобретения
Авторы настоящего изобретения неожиданно обнаружили, что у крыс, которых в возрасте детенышей кормили в соответствии с диетой, содержащей белок казеин, имеется защитный эффект в отношении чувствительности к инсулину, когда их подвергали воздействию адипогенной диеты во взрослом возрасте. Напротив, крысы, которых в возрасте детенышей кормили в соответствии с диетой, содержащей сывороточный белок, не имели защиты от воздействия адипогенной диеты во взрослом возрасте. Вместо этого крысы, которых в возрасте детенышей кормили в соответствии с диетой на основе молочной сыворотки, демонстрировали нарушенную чувствительность к инсулину, которая проявляется повышенным значением индекса HOMA-IR.
HOMA-IR (гомеостатическая модельная оценка резистентности к инсулину) представляет собой способ, используемый для количественного определения резистентности к инсулину и функции бета-клеток. Впервые способ описан Matthews et al. в 1985 г. под названием НОМА (Diabetologia 28 (7): 412-9). Повышенное значение HOMA-IR является индикатором повышенной резистентности к инсулину/пониженной чувствительности к инсулину.
Ранее было представлено (WO 2010/112430), что композиции, содержащие коровьи казеиновые белки (родственные молочной сыворотке), улучшают чувствительность к инсулину в конкретных случаях при низком весе при рождении и при нормальном весе при рождении, когда у ребенка наблюдается ускоренный рост (догоняющий рост) после энергетического ограничения. Однако долгосрочное воздействие раннего введения белка на чувствительность к инсулину в нормальных условиях достаточного веса при рождении и нормального роста (без ограничений питания и в отсутствие догоняющего роста) было неизвестно.
Авторы настоящего изобретения неожиданно обнаружили, что кормление казеином на ранних этапах жизни может улучшать толерантность к глюкозе в краткосрочной перспективе и улучшать чувствительность к инсулину в долгосрочной перспективе в дальнейшей жизни. Это особенно проявляется, когда субъекты подвергаются нагрузке в виде адипогенной диеты во взрослом возрасте в дальнейшей жизни.
Данное наблюдение неожиданно, поскольку известно, что состояния субъектов в предыдущем исследовании уже характеризуются симптомами сниженной чувствительности к инсулину. Однако настоящее исследование показывает, что даже в отсутствие каких-либо отрицательных факторов чувствительность субъекта к инсулину можно улучшить. Более того, улучшение может наблюдаться даже в дальнейшей жизни.
В соответствии с этим первый аспект настоящего изобретения относится к питательной композиции для применения в лечении, профилактике и/или снижении риска развития расстройства, связанного с метаболическим синдромом, в дальнейшей жизни, причем а) композиция содержит более 70 мас. % казеина в расчете на общее содержание белка в композиции, и b) композиция предназначена для введения ребенку грудного возраста или ребенку младшего возраста от рождения до возраста 36 месяцев.
В одном варианте осуществления этого аспекта настоящее изобретение относится к питательной композиции для применения в лечении, профилактике и/или снижении риска развития расстройства, связанного с метаболическим синдромом, в дальнейшей жизни, причем: а) композиция содержит более 70 мас. % казеина в расчете на общее содержание белка в композиции; b) композиция предназначена для введения ребенку грудного возраста или ребенку младшего возраста от рождения до возраста 36 месяцев, и причем общее содержание белка в питательной композиции составляет по меньшей мере 0,5 г белка/100 ккал.
Другой аспект настоящего изобретения относится к использованию казеина для приготовления питательной композиции для применения в лечении, профилактике или снижении риска развития расстройства, связанного с метаболическим синдромом, в дальнейшей жизни индивида, причем: а) композиция содержит более 70 мас. % казеина в расчете на общее содержание белка в композиции; b) композиция предназначена для введения ребенку грудного возраста от рождения до возраста 36 месяцев.
В настоящем изобретении также предложен способ лечения, профилактики и/или снижения риска того, что у ребенка грудного возраста или ребенка более старшего возраста в дальнейшем в жизни разовьется расстройство, связанное с метаболическим синдромом, в частности при нагрузке в виде адипогенной диеты, причем указанный способ включает этап введения питательной композиции, содержащей более 70 мас. % казеина в расчете на общее содержание белка в композиции.
Краткое описание фигур
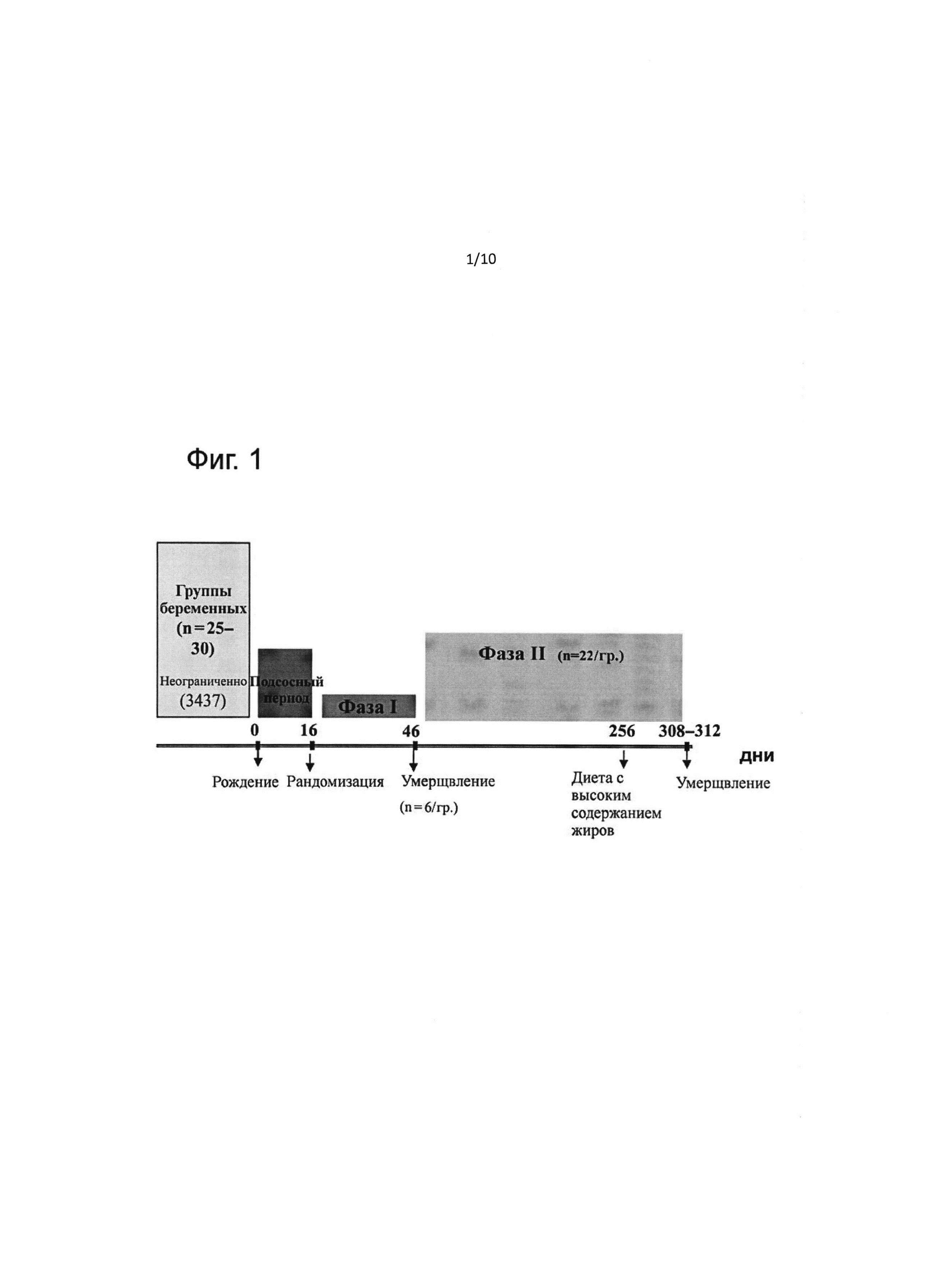
На фиг. 1 представлено схематическое изображение схемы эксперимента, включающей все вмешательства.
На фиг. 2 представлено общее поступление энергии на фазе I (А), фазе II (В) и в течение всего исследования (фаза I и фаза II) (С). Результаты выражены как медиана ± стандартная ошибка медианы. * - значимое различие при Р<0,05; # - значимое различие при Р<0,01.
На фиг. 3 представлена масса тела во время экспериментальной диеты (фаза I) (А) и масса тела в течение всего исследования (В). Данные представлены как медиана ± стандартная ошибка медианы.
$ - значимое различие между казеином 20 Е% и казеином 36 Е%;
& - значимое различие между казеином 20 Е% и молочной сывороткой 20 Е%;
* - значимое различие между молочной сывороткой 36 Е% и казеином 36 Е%.
° Все группы отличаются.
На фиг. 4 представлено содержание жировой массы в процентах от массы тела (МТ). Данные представлены как медиана ± стандартная ошибка медианы. $ - значимое различие (Р<0,05) между казеином 20 Е% и казеином 36 Е%; § - значимое различие (Р<0,05) между молочной сывороткой 20 Е% и молочной сывороткой 36 Е%; * - значимое различие (Р<0,05) между молочной сывороткой 36 Е% и казеином 36 Е%.
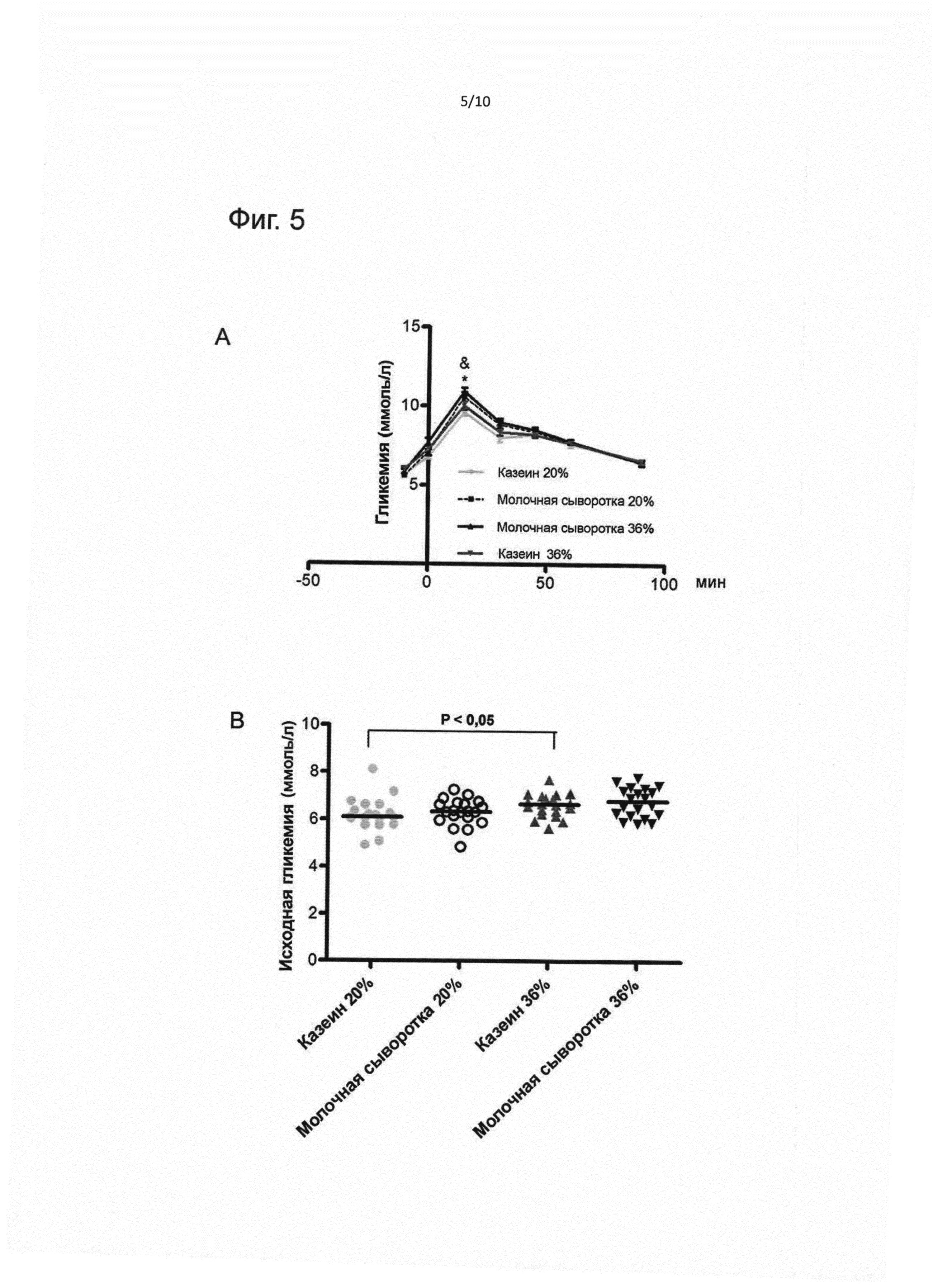
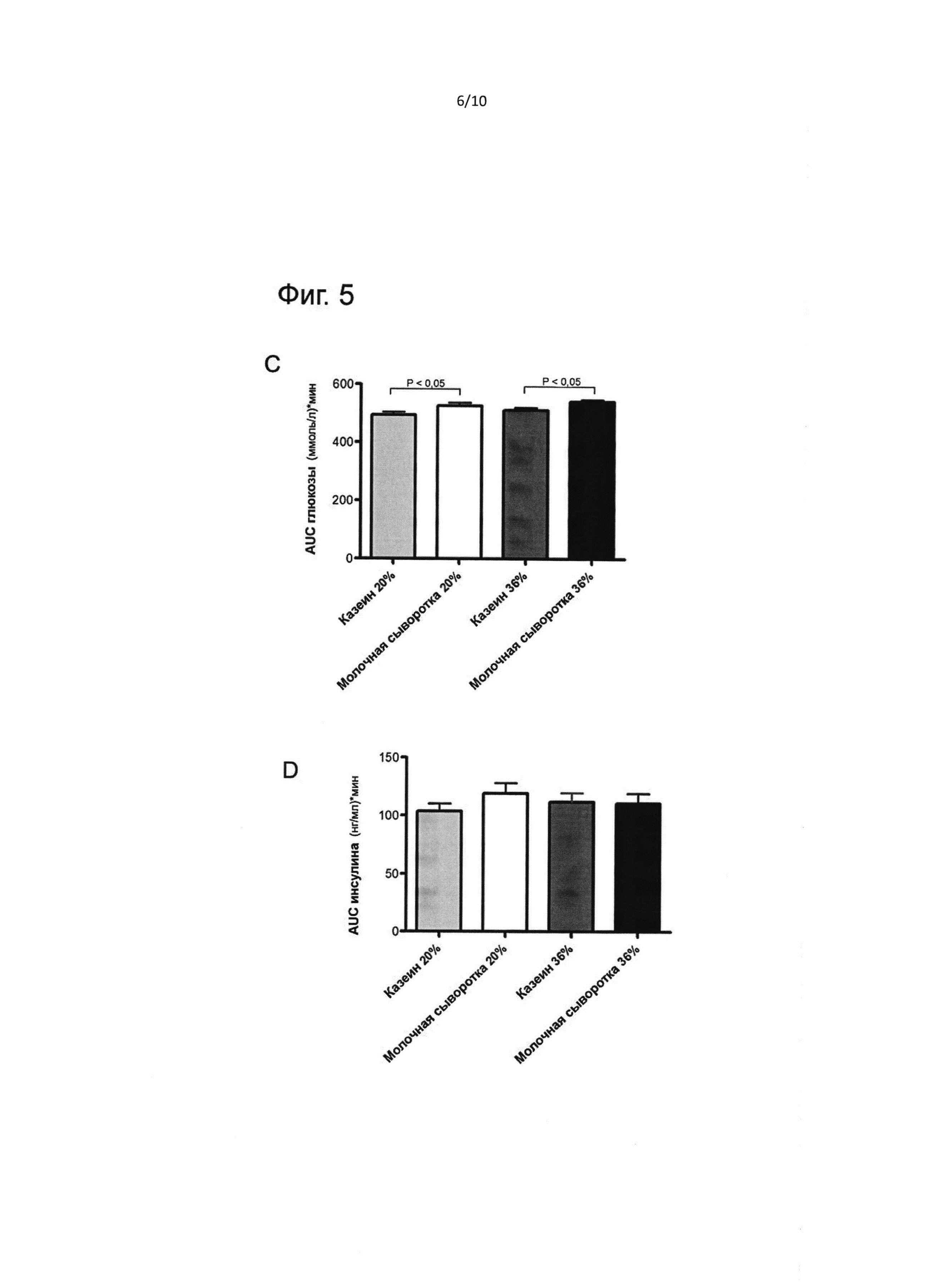
На фиг. 5 представлены результаты орального теста на толерантность к глюкозе в конце экспериментальной диеты (т.е. фазы I) (возраст 42 дня). (А), исходная гликемия (В), площадь под кривой глюкозы (С), площадь под кривой инсулина (D). Результаты выражены как медиана ± стандартная ошибка медианы. & - значимое различие (Р<0,05) между казеином 20 Е% и молочной сывороткой 20 Е%, * - значимое различие (Р<0,05) между молочной сывороткой 36 Е% и казеином 36 Е%.
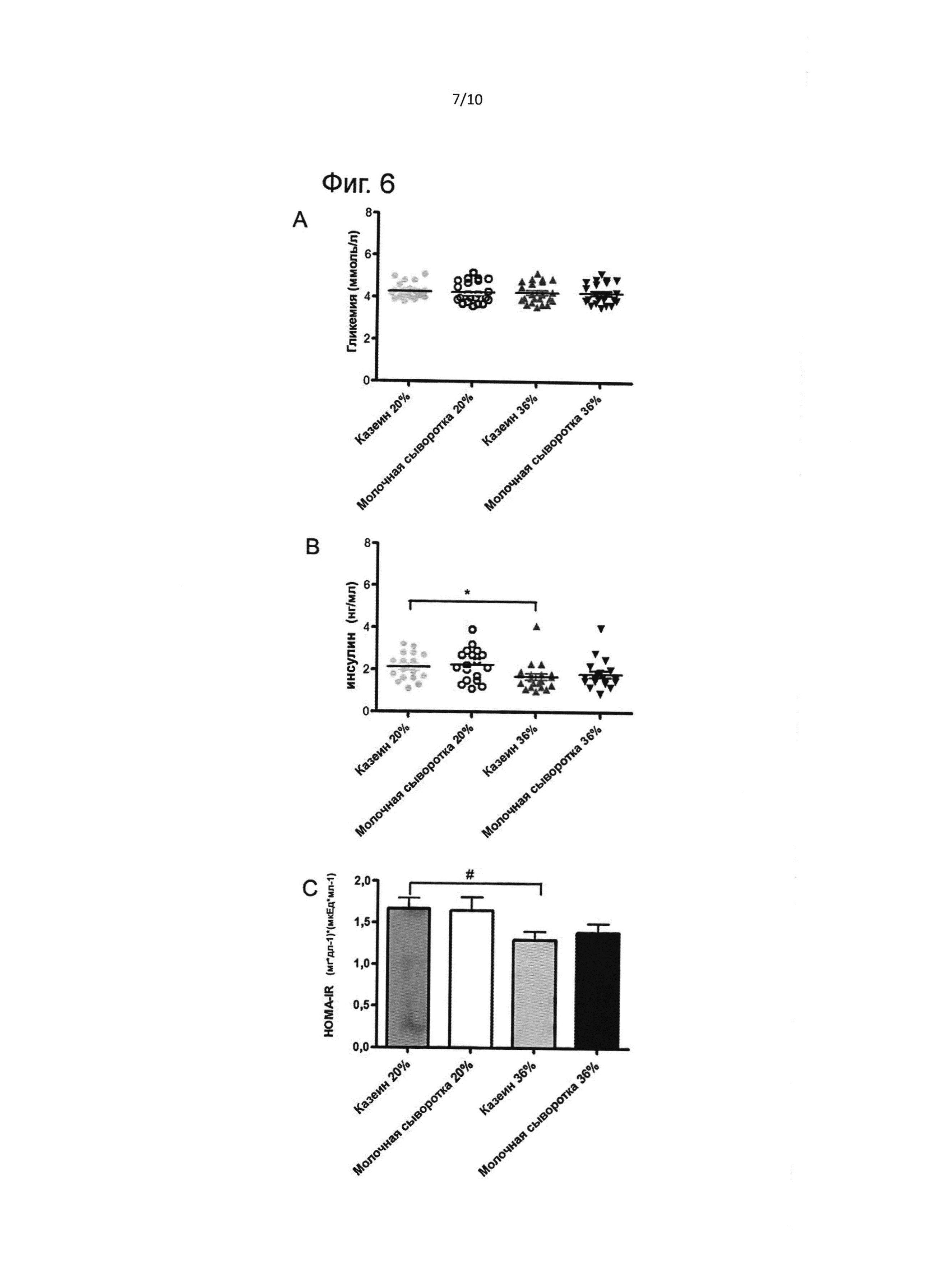
На фиг. 6 представлен гомеостаз глюкозы натощак в конце кормовой диеты (т.е. в конце фазы II: А) (возраст 165 дней). Гликемия натощак (А), инсулинемия натощак (В), HOMA-IR (С). Результаты выражены как медиана ± стандартная ошибка медианы. * - значимое различие при Р<0,05; # - значимое различие при Р<0,01.
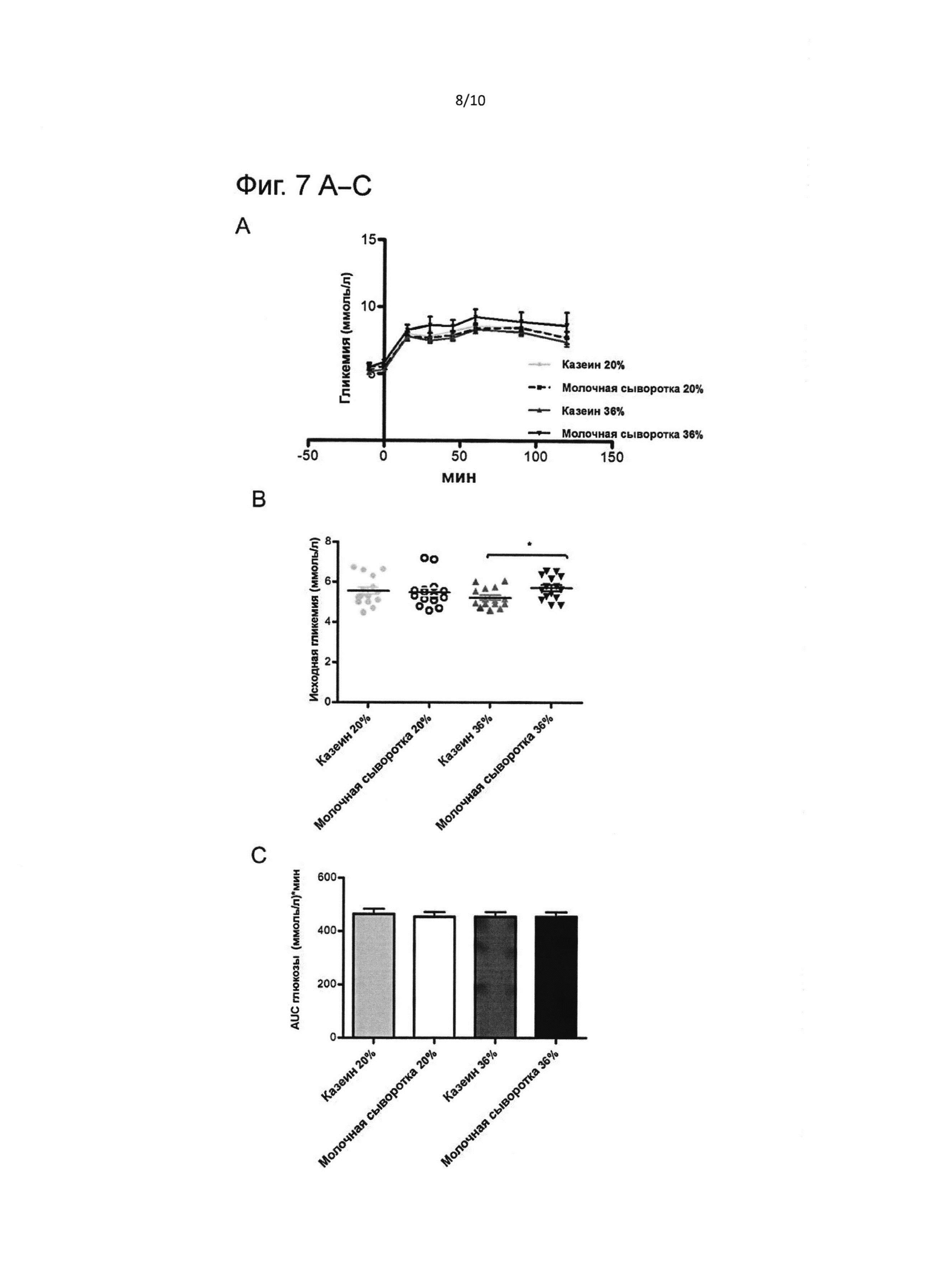
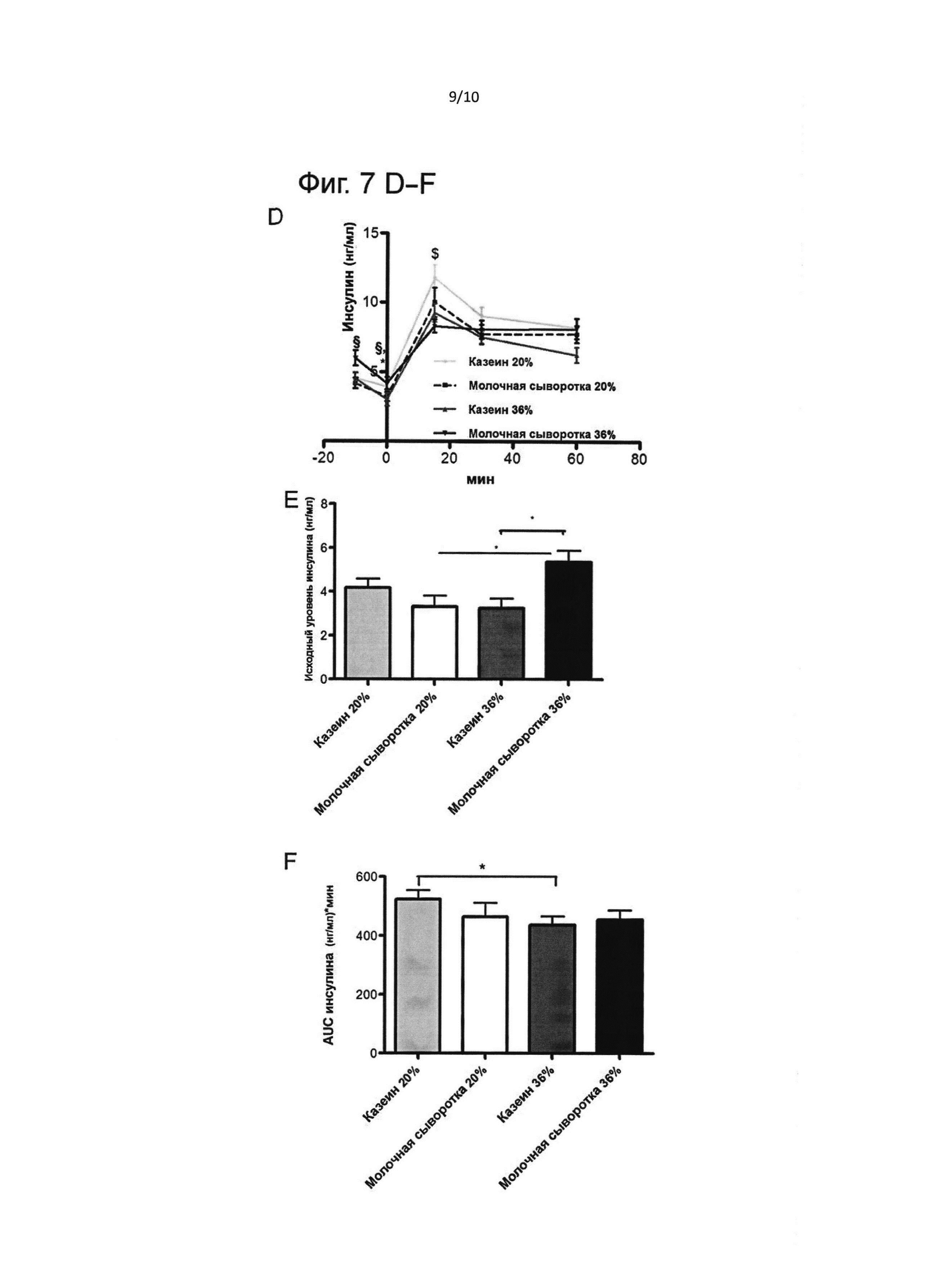
На фиг. 7 представлены результаты орального теста на толерантность к глюкозе в конце исследования, т.е. в конце фазы II: В (возраст 287 дней). Гликемический ответ на глюкозную нагрузку (А); исходная гликемия (В); площадь под кривой глюкозы (С); инсулиновый ответ на глюкозную нагрузку (D); исходная инсулинемия (Е); площадь под кривой инсулина (F). Результаты выражены как медиана ± стандартная ошибка медианы. $ - значимое различие (Р<0,05) между казеином 20 Е% и казеином 36 Е%; * - значимое различие (Р<0,05) между молочной сывороткой 36 Е% и казеином 36 Е%; § - значимое различие (Р<0,05) между молочной сывороткой 20 Е% и молочной сывороткой 36 Е%; значимое различие при Р<0,05.
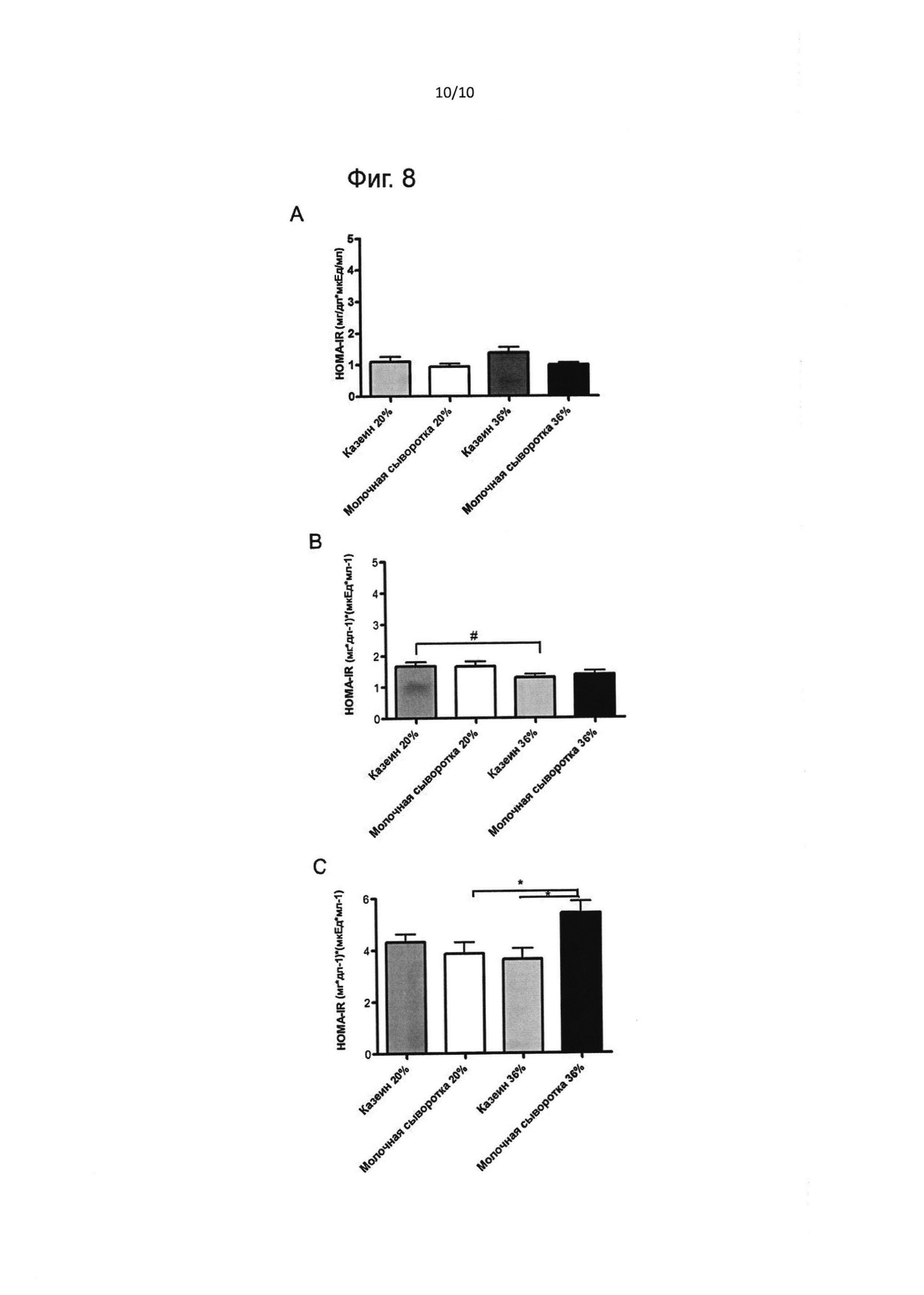
На фиг. 8 приведены уровни HOMA-IR во время исследования. В конце экспериментальной диеты (фаза I, возраст 42 дня) (А); на фазе II кормовой диеты (фаза II: А, возраст 165 дней) (В); в конце исследования для диеты с высоким содержанием жиров (HFD) (фаза II: В, возраст 287 дней) (С). Результаты выражены как медиана ± стандартная ошибка медианы. * - значимое различие при Р<0,05; # - значимое различие при Р<0,01.
Определения
До более подробного описания настоящего изобретения будут приведены определения указанных ниже терминов и условных обозначений.
В контексте настоящего изобретения, если не указано иное, упомянутые процентные значения представляют собой массовое процентное содержание (мас. %/мас. %).
Термин «и/или», используемый в контексте «X и/или Y», следует интерпретировать как «X» или «Y», или «X и Y».
Предполагается, что числовые диапазоны в настоящем документе включают в себя все числа и подмножества чисел, содержащихся в пределах этого диапазона, независимо от того, раскрыты ли они конкретно. Кроме того, эти числовые диапазоны следует рассматривать как подтверждение пункта формулы изобретения, который относится к любому числу или подмножеству чисел в этом диапазоне. Например, описание «от 1 до 10» следует рассматривать как подтверждающее диапазон «от 1 до 8», «от 3 до 7», «от 4 до 9», «от 3,6 до 4,6», «от 3,5 до 9,9» и т.д.
Все ссылки на характеристики или ограничения настоящего изобретения, приведенные в единственном числе, должны включать в себя соответствующую характеристику или ограничение во множественном числе и наоборот, если не указано иное или если в контексте, в котором дана ссылка, явно не подразумевается противоположное.
Все используемые в настоящем документе технические и научные термины, если не дано иное их определение, имеют общепринятое значение, понятное среднему специалисту в данной области.
Термин «ребенок грудного возраста» означает ребенка в возрасте до 12 месяцев.
Термин «ребенок младшего возраста» означает ребенка старше 12 месяцев и до возраста 3 года.
Термин «снижение риска» означает, что событие имеет меньшую вероятность наступления по сравнению с подходящим и обычно используемым эталоном (например, общей популяцией или детьми грудного возраста или детьми младшего возраста с нормальной массой).
Термин «профилактика» означает, что либо полностью, либо частично предотвращается наступление события или расстройства (т.е. событие наступает в более легкой форме и/или наступает позже). Термин «профилактика» также включает в себя снижение степени тяжести события или расстройства (или состояния здоровья), или снижение частоты наступления таких событий или расстройств, или задержку воздействия на такие события или расстройства.
Термины «нормальная масса/избыточная масса/дефицит массы» относятся к международно признанным таблицам массы тела для детей грудного возраста, детей младшего возраста и детей более старшего возраста и, в частности, зависят от возраста субъекта.
Композиция для применения
В первом аспекте изобретение относится к питательной композиции для применения в лечении, профилактике и/или снижении риска развития расстройства, связанного с метаболическим синдромом, в дальнейшей жизни, причем: а) композиция содержит более 70 мас. % казеина в расчете на общее содержание белка в композиции; b) композиция предназначена для введения ребенку грудного возраста или ребенку младшего возраста от рождения до возраста 36 месяцев.
Казеин в контексте настоящей заявки относится к семейству родственных белков, которые обнаружены в молоке млекопитающих.
Казеин может быть получен из любого подходящего источника или комбинации источников молока млекопитающего. Примеры источников включают в себя, например, корову, козу, бизона, овцу и т.д. Один вариант осуществления относится к композиции для применения в соответствии с настоящим изобретением, в которой казеин представляет собой коровий казеин. Коровий казеин доступен в продаже.
Питательная композиция в соответствии с настоящим изобретением содержит более 70 мас. % казеина в расчете на общее содержание белка в композиции. Таким образом, в одном варианте осуществления настоящее изобретение относится к питательной композиции в соответствии с настоящим изобретением, причем композиция содержит, например, по меньшей мере 75 мас. %, по меньшей мере 80 мас. %, по меньшей мере 85 мас. %, по меньшей мере 90 мас. %, по меньшей мере 95 мас. %, по меньшей мере 99 мас. %, приблизительно 100 мас. % казеина в расчете на общее содержание белка в композиции.
В других вариантах осуществления питательная композиция содержит по меньшей мере 85 мас. % казеина в расчете на общее содержание белка в композиции, например, по меньшей мере 90%, например, по меньшей мере 95 мас. %, например, по меньшей мере 99 мас. % или, например, 100 мас. % казеина в расчете на общее содержание белка в композиции.
В дополнительном варианте осуществления 100% белка, присутствующего в питательной композиции для применения в соответствии с настоящим изобретением представляет собой казеин.
Общее содержание белка в питательной композиции в соответствии с настоящим изобретением может составлять, например, по меньшей мере 5 г/л, например, по меньшей мере 6 г/л, например, по меньшей мере 7 г/л, например, по меньшей мере 8 г/л, например, по меньшей мере 9 г/л, например, по меньшей мере 10 г/л, по меньшей мере 11 г/л, например, по меньшей мере 12 г/л, например, по меньшей мере 15 г/л, или, например, 18 г/л; или же может составлять, например, приблизительно 9 или приблизительно 10 г/л.
В других примерах общее содержание белка в питательной композиции для применения в соответствии с настоящим изобретением может составлять от 3 г/л до 33 г/л готовой к употреблению композиции, например, от 3 г/л до 25 г/л, например, 5-20 г/л, например, 8-20 г/л.
Государственный орган по контролю за пищевыми продуктами может требовать, чтобы общее количество белка в питательной композиции в соответствии с настоящим изобретением, в частности в детских смесях, соответствовало определенным спецификациям, определяющим количество белка.
В примерах питательных композиций, которые предназначены для детей грудного возраста, общее содержание белка может составлять, например, от 3 г/л до 15 г/л готовой к употреблению смеси, например, 5-15 г/л, например, 3-10 г/л.
Общее содержание белка также можно выражать как г белка на ккал питательной композиции.
Таким образом, в тех случаях, когда питательная композиция настоящего изобретения представляет собой питательную композицию для детей грудного возраста, такую как, например, детская смесь, общее количество белка может составлять, например, не более чем 5 г/100 ккал готовой к употреблению смеси, например, от 1 до 4 г/100 ккал, например, от 1 до 3,5 г/100 ккал, например, от 1,5 до 2,5 г/100 ккал, например, от 1,6 до 2,2 г/100 ккал. Один конкретный вариант осуществления относится к питательной композиции для применения в соответствии с настоящим изобретением, в которой общее содержание белка составляет 1,8 г/100 ккал готовой к употреблению смеси.
Дополнительный конкретный вариант осуществления настоящего изобретения относится к детской смеси, в которой общее содержание белка составляет от 1,6 до 2,2 г/100 ккал, например 1,8 г/100 ккал, и в которой более 70% общего содержания белка составляет казеин.
Еще один дополнительный конкретный вариант осуществления настоящего изобретения относится к детской смеси, в которой содержание казеина составляет по меньшей мере 0,45 г казеина/100 ккал готовой к употреблению смеси.
Питательные композиции настоящего изобретения, которые предназначены для детей младшего возраста, могут иметь такое же содержание белка, что и питательные композиции, предназначенные для детей грудного возраста, или же могут содержать более высокие или более низкие концентрации белка.
Например, питательная композиция для детей младшего возраста может иметь более низкое общее содержание белка, например, 0,5-5 г/100 ккал, например, от 0,5 до 3,5 г/100 ккал, например, от 1 до 2,5 г/100 ккал; или, например, от 0,5 до 1,5 г/100 ккал общего содержания белка.
Белок
Белки могут быть интактными или гидролизованными или могут представлять собой смесь интактных и гидролизованных белков. Гидролизованные белки могут быть полностью гидролизованными или частично гидролизованными.
Питательная композиция настоящего изобретения содержит более 70% казеина в расчете на общее содержание белка в композиции. Остальная часть белка может включать в себя один или более белков, подходящих для употребления детьми грудного возраста или детьми младшего возраста, при условии, что выполняются минимальные требования по содержанию незаменимых аминокислот.
Например, общее содержание белка в композиции может состоять из смеси казеина и сывороточных белков, например, из смеси коровьего казеина и коровьих сывороточных белков. Если используются сывороточные белки, они могут быть представлены кислой сывороткой или сладкой сывороткой, или их смесями, и могут включать в себя альфа-лактальбумин и бета-лактоглобулин в любых требуемых пропорциях. К источнику белка могут дополнительно добавляться свободные аминокислоты, если это необходимо для обеспечения соответствия минимальным требованиям к содержанию незаменимых аминокислот. Эти требования опубликованы, например, в Директиве ЕС 2006/14/ЕС.
В других примерах общее содержание белка в композиции может состоять из казеина и одного или более немолочных белков, которые выбирают, например, из группы, состоящей из мяса, рыбы, яйца и/или источников растительного белка, например гороха, риса и т.д.
Соотношение казеина к остальному белку может составлять от 70:30 до 100:0 (казеин: остальной белок). Примерами соотношений являются 70:30, 80:20, 85:15, 90:10, 95:5, 100:0 (казеин : остальной белок).
Как указано выше, источником белка может быть смесь казеина и сывороточных белков. Сывороточный белок может представлять собой изолят сывороточного белка, кислую сыворотку, сладкую сыворотку или сладкую сыворотку, из которой удален казеиногликомакропептид (модифицированная сладкая сыворотка). Однако сывороточный белок предпочтительно представляет собой модифицированную сладкую сыворотку. Сладкая сыворотка представляет собой легкодоступный побочный продукт при производстве сыра и часто используется в производстве питательных композиций на основе коровьего молока. Однако сладкая сыворотка включает в себя компонент под названием казеиногликомакропептид (CGMP), который богат треонином и беден триптофаном, что нежелательно. Удаление CGMP из сладкой сыворотки приводит к получению белка с содержанием треонина, которое ближе к его содержанию в человеческом молоке. Процесс удаления CGMP из сладкой сыворотки описан в ЕР 880902.
Если в качестве сывороточного белка используется модифицированная сладкая сыворотка в смеси 60% молочной сыворотки и 40% казеина, к источнику белка можно добавить свободный триптофан, изолейцин, гистидин и фенилаланин в количествах до 0,34% для триптофана, 0,92% для изолейцина, 0,19% для гистидина и 2,2% для фенилаланина (в каждом случае процент указан по массе в расчете на общее содержание белка). Если в качестве сывороточного белка используется интактная сладкая сыворотка в смеси 60% молочной сыворотки и 40% казеина, к источнику белка можно добавлять свободный триптофан, лейцин, гистидин и фенилаланин в количествах до 0,5% для триптофана, 0,37% для лейцина, 0,3% для гистидина и 2,5% для фенилаланина (в каждом случае процент указан по массе в расчете на общее содержание белка). К источнику белка также при необходимости можно добавить аминокислоты, богатые серой, такие как цистеин и метионин.
Композиции для применения: расстройства
Авторы изобретения показали, что взрослые крысы, которых в возрасте детенышей кормили в соответствии с диетой, в которой основным источником белка был казеин, демонстрируют улучшенный индекс HOMA-IR при нагрузке в виде адипогенной диеты во взрослом возрасте по сравнению с крысами, которых в возрасте детенышей кормили диетой, в которой основным источником белка была молочная сыворотка.
Таким образом, настоящее изобретение относится к питательной композиции для применения в лечении, профилактике и/или снижении риска развития расстройства, связанного с метаболическим синдромом, в дальнейшей жизни, причем а) композиция содержит более 70 мас. % казеина в расчете на общее содержание белка в композиции, и b) композиция предназначена для введения ребенку грудного возраста или ребенку младшего возраста от рождения до возраста 36 месяцев.
Используемый в настоящем документе термин «расстройство, связанное с метаболическим синдромом» относится к одному или более расстройствам, связанным с метаболическим синдромом. Эти расстройства обычно являются результатом дисрегуляции гомеостаза глюкозы. Примеры таких расстройств включают в себя диабет, такой как сахарный диабет, нарушение толерантности к глюкозе, нарушение уровня глюкозы натощак, резистентность к инсулину, гипертензию, дислипидемию, избыточную массу тела, ожирение (особенно центральное ожирение) и микроальбуминурию.
Таким образом, в одном варианте осуществления настоящее изобретение относится к композиции для применения в соответствии с настоящим изобретением, причем расстройство выбирают из группы, состоящей из сахарного диабета, нарушения толерантности к глюкозе, нарушения уровня глюкозы натощак, резистентности к инсулину, гипертензии, дислипидемии, избыточной массы тела, ожирения (особенно центрального ожирения) и микроальбуминурии.
В других вариантах осуществления настоящее изобретение относится к композиции для применения в соответствии с настоящим изобретением, причем использование предназначено для улучшения чувствительности к инсулину, достижения нормальной массы тела и/или профилактики избыточной массы тела в дальнейшей жизни.
Без намерения ограничить теорией предполагается, что ранняя диета приводит к программированию, которое, в свою очередь, обеспечивает защитный эффект, который проявляется в дальнейшей жизни и в особенности при нагрузке в виде адипогенной диеты в дальнейшей жизни.
Таким образом, настоящее изобретение относится к питательной композиции для применения в лечении, профилактике и/или снижении риска развития расстройств, связанных с метаболическим синдромом, в дальнейшей жизни.
Термин «в дальнейшей жизни» в контексте настоящего изобретения относится к периоду времени после детства, то есть после возраста 12 лет. В вариантах осуществления настоящего изобретения расстройство, связанное с метаболическим синдромом, проявляется после возраста 12 лет или, например, после возраста 15 лет, например, после возраста 18 лет, например, после возраста 25 лет, после возраста 30 лет, после возраста 35 лет.
Экспериментальные данные показывают, что если взрослых крыс подвергали нагрузке в виде диеты с высоким содержанием жиров (т.е. адипогенной), то взрослые особи, которых в возрасте детенышей кормили диетой с казеином 36 Е%, демонстрировали более низкие показатели HOMO-IR (показатель лучшей чувствительности к инсулину) по сравнению с теми взрослыми особями, которых в возрасте детенышей кормили диетой с молочной сывороткой 36 Е%.
Таким образом, дополнительный вариант осуществления настоящего изобретения относится к композиции для применения в соответствии с настоящим изобретением, причем использование предназначено для лечения, предотвращения и/или снижения риска развития расстройства, связанного с метаболическим синдромом, проявляющегося в дальнейшей жизни при нагрузке в виде адипогенной диеты.
В контексте настоящего изобретения термин «адипогенная диета» относится к диете, которая приводит к увеличению жировой массы у индивида. Как правило, к увеличению жировой массы приводит избыток поступления энергии. Таким образом, одним примером адипогенной диеты является диета, при которой поступление калорий превышает потребность индивида в калориях. Другие примеры адипогенной диеты включают в себя типичную западную диету, также известную как диета западного образца или стандартная американская диета. Другим примером адипогенной диеты является диета, которая характеризуется таким содержанием жиров, которое превышает рекомендованное диетологами значение 30% энергии, получаемой из жиров, диета с высоким содержанием сахаров и/или диета, при которой поступление калорий превышает потребность индивида в калориях.
Таким образом, представляется, что композиция для применения в соответствии с настоящим изобретением при введении на ранних этапах жизни (например, ребенку грудного возраста или ребенку младшего возраста) будет защищать данного индивида, если и когда указанный индивид в дальнейшей жизни (например, во взрослом возрасте или, например, после 18, после 20, после 25, после 30 лет жизни) будет придерживаться адипогенной диеты. Под защитой имеется в виду, что гомеостаз глюкозы и/или чувствительность к инсулину не нарушается или не нарушается в такой же степени. Без привязки к теории была предложена гипотеза, что использование композиции настоящего изобретения во время вскармливания модулирует метаболические пути. Такая модуляция обеспечивает специфическую метаболическую реакцию, когда субъект подвергается воздействию адипогенной диеты в дальнейшей жизни. Такая модуляция может затрагивать всех субъектов, у которых используется композиция настоящего изобретения, и может не зависеть от того, проявлялись ли у субъектов конкретные метаболические сигналы «немедленных стрессовых пищевых потребностей». Например, такая модуляция может отличаться от немедленной модуляции у субъектов, у которых уже выработались метаболические сигналы на момент употребления композиции (например, у субъектов с догоняющим ростом или у детей грудного возраста с низким весом при рождении, т.е. у ребенка грудного возраста с немедленными стрессовыми пищевыми потребностями). Если на момент употребления присутствуют стрессовые пищевые сигналы, для ответа на эти стрессовые сигналы активируются специфические метаболические пути. В контексте настоящего изобретения активируются некоторые другие метаболические пути, и они индуцируют долгосрочный эффект, особенно при воздействии адипогенной диеты в дальнейшей жизни.
Также было сделано наблюдение, что казеиновая диета приводит к лучшей толерантности к глюкозе в краткосрочной перспективе (см. фиг. 8А, В и С).
Таким образом, в одном аспекте настоящее изобретение относится к питательной композиции для применения в лечении, профилактике и/или снижении риска развития расстройства, связанного с метаболическим синдромом, причем а) композиция содержит более 70 мас. % казеина в расчете на общее содержание белка в композиции, и b) композиция предназначена для введения ребенку грудного возраста или ребенку младшего возраста от рождения до возраста 36 месяцев.
В других вариантах осуществления настоящее изобретение относится к композиции для применения в соответствии с настоящим изобретением, причем применение предназначено для улучшения чувствительности к инсулину, достижения нормальной массы тела и/или профилактики избыточной массы тела.
Композиция для применения: целевые группы
Композиция для применения в соответствии с настоящим изобретением предназначена для введения ребенку грудного возраста или ребенку младшего возраста.
В одном варианте осуществления ребенок грудного возраста или ребенок младшего возраста, например, рожден матерью, которая сама страдала или страдает от одного или более расстройств, связанных с метаболическим синдромом, например, от одного или более расстройств, которые выбирают из группы, состоящей из сахарного диабета, нарушения толерантности к глюкозе, нарушения уровня глюкозы натощак, резистентности к инсулину, гипертензии, дислипидемии, избыточной массы тела, ожирения (особенно центрального ожирения) и микроальбуминурии, или гестационного диабета.
В дополнительном варианте осуществления предполагается, что ребенок грудного возраста или ребенок младшего возраста подвержен риску развития одного или более расстройств, связанных с метаболическим синдромом, например, вследствие риска, связанного с наследственным риском, например семейным анамнезом.
В одном варианте осуществления композиция для применения предназначена для введения ребенку грудного возраста или ребенку младшего возраста независимо от веса при рождении.
В другом варианте осуществления настоящего изобретения композиция для применения в соответствии с настоящим изобретением предназначена для введения ребенку грудного возраста или ребенку младшего возраста, чей вес при рождении был нормальным. В другом варианте осуществления вес при рождении ребенка грудного возраста или ребенка младшего возраста был выше нормы.
В дополнительном варианте осуществления настоящее изобретение относится к композиции в соответствии с настоящим изобретением, причем композиция предназначена для введения ребенку грудного возраста или ребенку младшего возраста, у которого не наблюдается догоняющий рост после периода ограничения роста.
В еще одном дополнительном варианте осуществления настоящее изобретение относится к композиции для применения в соответствии с настоящим изобретением, причем композиция предназначена для введения ребенку грудного возраста или ребенку младшего возраста, который был рожден с нормальным весом и имел неограниченное потребление пищи и нормальный рост в грудном и/или в младшем возрасте.
Режим дозирования
Настоящее изобретение относится к неожиданному открытию того, что вскармливание ребенка грудного возраста или ребенка младшего возраста питательными композициями на основе казеина может защищать его от расстройств, связанных с метаболическим синдромом, в дальнейшей жизни.
Композиция для применения в соответствии с настоящим изобретением предназначена для введения ребенку грудного возраста или ребенку младшего возраста в период времени от рождения до 36 месяцев. В других вариантах осуществления вскармливание приходится на период времени от рождения до 36 месяцев или 24 месяцев, например, до 18 месяцев, например, до 12 месяцев.
В одном варианте осуществления настоящего изобретения композицию для применения в соответствии с настоящим изобретением вводят ребенку грудного возраста или ребенку младшего возраста в период отлучения от груди.
Период отлучения от груди означает период в жизни ребенка грудного возраста или ребенка младшего возраста, когда его переводят с молочного вскармливания (например, грудного вскармливания) на твердую пищу. Этот период зависит от индивидуальных особенностей ребенка грудного возраста или ребенка младшего возраста, но, как правило, приходится на диапазон от 4 месяцев до 18 месяцев, например, от 6 до 18 месяцев.
В одном варианте осуществления настоящего изобретения композицию для применения в соответствии с настоящим изобретением вводят ребенку грудного возраста или ребенку младшего возраста в период отлучения от груди, а не до него (т.е. начиная с периода отлучения от груди). В варианте осуществления вскармливание начинается незадолго до периода отлучения от груди (например, за 1 месяц до начала отлучения от груди).
В этот период времени (который в соответствии с вышеизложенным может быть, например, периодом отлучения от груди, или от рождения до 36 месяцев, от рождения до 24 месяцев, от рождения до 18 месяцев, или от рождения до 12 месяцев) вскармливание может быть, например, периодическим в указанный период, или, например, может осуществляться в среднем один раз в день в указанный период, или, например, один раз через день в указанный период, или, например, по меньшей мере один раз в день в указанный период.
В другом варианте осуществления настоящего изобретения вскармливание композицией предназначено для более короткого периода времени в пределах периода времени, упомянутого выше, например, в среднем один раз ежедневно в течение по меньшей мере шести недель в пределах указанного периода времени; например, в среднем один раз ежедневно в течение 3, 6, 8, 9 месяцев в пределах указанного периода времени.
Альтернативно, вскармливание может осуществляться, например, в среднем один раз через день в течение периода по меньшей мере шесть недель в период от рождения до 36 месяцев, например, в среднем один раз через день за период 3, 6, 8 или 9 месяцев в пределах указанного периода времени.
В других вариантах осуществления настоящее изобретение относится к применению в соответствии с настоящим изобретением, причем композицию вводят по меньшей мере один раз в день в течение по меньшей мере 1 месяца.
Формы питательной композиции
Лечебное питание представляет собой специальный класс питательных композиций, разработанный для обеспечения контроля определенных состояний при помощи диеты. Лечебное питание соответствует определенным критериям, которые устанавливаются и регулируются разделом 5 [360ee](b)(2)(D) Закона об орфанных препаратах от 1983 г. Лечебное питание может быть представлено в любой подходящей форме, как описано ниже.
Таким образом, один вариант осуществления настоящего изобретения относится к питательной композиции в соответствии с настоящим изобретением, причем питательная композиция представляет собой лечебное питание.
Питательная композиция в соответствии с настоящим изобретением может быть в любой подходящей форме.
Форма питательной композиции для применения в соответствии с настоящим изобретением может быть адаптирована к возрасту ребенка грудного возраста или ребенка младшего возраста, которому ее вводят.
Примеры форм питательных композиций, подходящих для детей грудного возраста, включают в себя детскую смесь, детскую смесь второго уровня, молоко для детей старше 1 года, обогатитель грудного молока. Детская смесь может представлять собой, например, смесь с полным составом питательных веществ.
Примеры форм, подходящих для детей грудного возраста и/или детей младшего возраста, включают в себя готовые к употреблению композиции, жидкие продукты питания, молочные напитки, молочные коктейли, молочные печенья, йогурты, супы, десерты, пудинги, батончики, такие как батончики со злаками, каши, напитки и детское питание.
В предпочтительных вариантах осуществления форма питательной композиции представляет собой форму на основе молочных продуктов, таких как, например, молоко и молочные напитки, молочные коктейли, молочные печенья, йогурты и другие кисломолочные продукты, мороженое и сыры.
Другие формы питательной композиции включают в себя продукты, содержащие молочные продукты, например хлебобулочные изделия, молочные продукты, десерты, кондитерские изделия, батончики со злаками, готовые завтраки.
Детская смесь
В одном предпочтительном варианте осуществления питательная композиция для применения в соответствии с настоящим изобретением представляет собой детскую смесь.
Детская смесь, используемая в соответствии с настоящим изобретением, может содержать, помимо источника белка, как описано выше, также источник углеводов и источник липидов.
Можно использовать любой источник углеводов, традиционно присутствующий в детских смесях, такой как лактоза, сахароза, мальтодекстрин, крахмал и их смеси, хотя предпочтительным источником углеводов является лактоза. Предпочтительно содержание углеводов в детской смеси находится в диапазоне от 9 до 14 г/100 ккал.
Детская смесь, используемая в соответствии с настоящим изобретением, также может содержать источник липидов. Источником липидов может быть любой липид или жир, который подходит для применения в детских смесях. Подходящие источники жиров включают в себя пальмовый олеин, подсолнечное масло с высоким содержанием олеиновой кислоты, льняное масло и сафлоровое масло с высоким содержанием олеиновой кислоты, хотя предпочтительной является комбинация льняного масла и сафлорового масла с высоким содержанием олеиновой кислоты. Можно включать небольшие количества масел, содержащих высокие концентрации предварительно подготовленной арахидоновой кислоты (ARA) и докозагексаеновой кислоты (DHA), например рыбьих жиров или микробных масел. Общее содержание липидов может находиться в диапазоне от 4,4 до 6 г/100 ккал. Предпочтительно соотношение линолевая кислота (С18:2n-6): [альфа]-линоленовая кислота (С18:3n-3) в источнике липидов составляет менее 7:1, более предпочтительно от 7:1 до 5:1.
Детская смесь может также содержать все витамины и минералы, которые, как известно, являются обязательными в ежедневной диете, в значимых с точки зрения питания количествах. Для некоторых витаминов и минералов установлены минимальные требования. Примеры минералов, витаминов и других питательных веществ, необязательно присутствующих в детской смеси, включают в себя витамин А, витамин В1, витамин В2, витамин В6, витамин В12, витамин Е, витамин K, витамин С, витамин D, фолиевую кислоту, инозитол, ниацин, биотин, пантотеновую кислоту, холин, кальций, фосфор, йод, железо, магний, медь, цинк, марганец, хлорид, калий, натрий, селен, хром, молибден, таурин и L-карнитин. Минералы обычно добавляют в форме соли. Присутствие и количества конкретных минералов и других витаминов зависят от целевой популяции детей грудного возраста. При необходимости детская смесь может содержать эмульгаторы и стабилизаторы, такие как соевый лецитин, эфиры лимонной кислоты и моно- и диглицеридов и т.п.
Детская смесь может необязательно содержать другие вещества, которые могут оказывать благоприятное воздействие, такие как пробиотические молочнокислые бактерии, пребиотические олигосахариды, лактоферрин, нуклеотиды, нуклеозиды и т.п.
Формулу можно получить любым подходящим способом. Например, ее можно получать путем смешивания вместе белка, источника углеводов и источника жиров в соответствующих пропорциях. В случае использования в смесь на данном этапе можно включать эмульгаторы. На данном этапе можно добавлять витамины и минералы, но обычно их добавляют позднее для предотвращения термического разложения. Перед смешиванием в источнике жиров можно растворять любые липофильные витамины, эмульгаторы и т.п. Затем можно примешивать воду, предпочтительно воду, очищенную обратным осмосом, с образованием жидкой смеси. Температура воды составляет условно от приблизительно 50°С до приблизительно 80°С для обеспечения диспергирования ингредиентов. Для образования жидкой смеси можно использовать доступные в продаже ожижители. Затем жидкую смесь гомогенизируют, например, в две стадии.
После этого жидкую смесь можно термически обработать для снижения бактериальных нагрузок путем быстрого нагревания жидкой смеси до температуры в диапазоне от приблизительно 80°С до приблизительно 150°С, например, в течение от приблизительно 5 секунд до приблизительно 5 минут. Это можно осуществлять путем нагнетания пара, автоклавирования или с помощью теплообменника, например, пластинчатого теплообменника.
Затем жидкую смесь можно охладить до приблизительно 60°С или до приблизительно 85°С, например, путем резкого охлаждения. Затем жидкую смесь можно повторно гомогенизировать, например, в две стадии: под давлением от приблизительно 10 МПа до приблизительно 30 МПа на первой стадии и от приблизительно 2 МПа до приблизительно 10 МПа на второй стадии. Затем гомогенизированную смесь можно также охладить для добавления любых термочувствительных компонентов, таких как витамины и минералы. На данном этапе для удобства регулируют рН и содержание твердых веществ в гомогенизированной смеси.
Гомогенизированную смесь переносят в подходящий сушильный аппарат, такой как распылительная сушилка или сублимационная сушилка, и превращают в порошок. Содержание влаги в порошке должно составлять менее чем приблизительно 5 мас. %. Если предпочтительным является жидкий продукт, гомогенизированную смесь можно стерилизовать и затем асептически залить в подходящие контейнеры, либо сначала распределить в контейнеры, а затем автоклавировать.
Способ лечения
Настоящее изобретение в дополнительном аспекте относится к способу лечения, профилактики и/или снижения риска развития расстройства, связанного с метаболическим синдромом, в частности резистентности к инсулину, причем указанный способ включает в себя введение ребенку грудного возраста или ребенку младшего возраста питательной композиции в соответствии с настоящим изобретением.
Комбинация описаний
Следует отметить, что варианты осуществления и признаки, описанные в контексте одного из аспектов настоящего изобретения, также применимы к другим аспектам изобретения.
Композиции, используемые в соответствии с настоящим изобретением, описаны в настоящем документе с использованием различных параметров, таких как ингредиенты, формы питательной композиции, использование, целевые группы и т.д. Следует отметить, что варианты осуществления и признаки, описанные в контексте одного из параметров композиции для применения в соответствии с настоящим изобретением, также можно комбинировать с другими вариантами осуществления и признаками, описанными в контексте другого параметра, если явно не указано иное.
Все патентные и непатентные ссылки, цитируемые в настоящей заявке, настоящим полностью включены путем ссылки.
Настоящее изобретение будет дополнительно подробно описано в представленных ниже примерах, не имеющих ограничительного характера.
Примеры
Методология и испытания
Краткое описание схемы эксперимента представлено на фиг. 1.
Приняты следующие сокращения: D = день (дни), Н = час(-ы), г = грамм(-ы)


Условия спаривания и период гестации
Программированные спаренные крысы Спрег-Доули (SD, n=38) в возрасте 10-11 недель с приведенными ниже характеристиками приобретали в компании Charles River (Франция). Неплодных самок крыс SD с близкими значениями массы тела 250±30 г в течение астрального цикла спаривали с самцами крыс SD, которые характеризовались однородной массой тела и возрастом (371±11 г, возраст 9-11 недель). Возможность спаривания ограничивали только 20 ч. Отбирали тридцать восемь животных с отторгнутыми копулятивными пробками и на 3-й день после спаривания отправляли в NRC.
После прибытия самок крыс содержали в индивидуальных вольерах и кормили неограниченно лабораторной кормовой диетой (kliba 3437) до родов.
Подсосный период
После родов в исследование включали только матерей и их детенышей, причем в помете были по меньшей мере 8 детенышей с минимум 3-4 самцами. Число детенышей в каждом помете ограничивали 8, предпочтение отдавали детенышам-самцам. В лактационный период всех матерей неограниченно кормили кормовой диетой для крыс (Kliba 3437). Детенышей оставляли с матерью до возраста 16 дней (2 дня после открытия глаз). В этот период им позволяли сосать матерей неограниченно.
Период отлучения от груди (фаза I)
Детенышей отделяли от матерей и такое же число детенышей-самцов из каждого помета (сиблингов) случайным образом распределяли в одну из следующих четырех групп исследования на основе массы тела:
a) группа казеина 20 Е% (казеин 20 Е%);
b) группа молочной сыворотки 20 Е% (молочная сыворотка 20 Е%);
c) группа казеина 36 Е% (казеин 36 Е%);
d) группа молочной сыворотки 36 Е% (молочная сыворотка 36 Е%).
Детенышей кормили одной из следующих экспериментальных диет, различающихся по типу белка (казеин или молочная сыворотка) или уровню белка (20 Е% или 36 Е% белка), начиная с возраста 16 дней и до возраста 45 дней. Диеты были изоазотистыми для одного уровня белка и изоэнергетическими во всех группах. Избыток белка в высокобелковых группах (белок 36 Е%) заменяли углеводами (кукурузным крахмалом). Состав экспериментальной диеты приведен в таблице 2.
Шесть детенышей на группу умерщвляли в конце фазы I (42-45-й день) обезглавливанием, как описано ниже.


В этот период все группы получали одинаковую диету. Сначала всех животных кормили коммерческой кормовой диетой с низким содержанием жиров (KLIBA 3437, 13% энергии от жиров) до 255-го дня, затем все группы подвергали нагрузке в виде коммерческой диеты с высоким содержанием жиров (KLIBA 2126,45% энергии от жиров) до конца исследования (возраст 308-311 дней). Оставшихся животных умерщвляли на 308-311-й день.
Условия содержания
Сначала животных содержали в клетках вместе (5/клетка) в течение несколько дней (с 16-го дня по 20-21-й день), затем разделяли и содержали в клетках индивидуально до конца исследования. Во время исследования их содержали при одинаковой температуре 23±3°С, относительной влажности 55% и 12-часовом цикле свет/темнота.
Измерения и анализ
Физиологические измерения и отбор образцов
• Массу тела детенышей регистрировали три раза в неделю, а потребление пищи измеряли в течение всех рабочих дней с 16-го дня по 45-й день (фаза I). После этого массу тела и потребление пищи измеряли один раз в неделю до конца исследования (фаза II).
• Состав тела измеряли с помощью ядерного магнитного резонанса (ЯМР) на 17, 37, 104, 162, 224 и 252-й дни.
• После 6 ч голодания образцы крови отбирали с помощью пункции хвоста на день 164±1, глюкозу измеряли с помощью глюкометра (Ascensia Elite XL, г. Дублин, Ирландия) и кровь центрифугировали для получения плазмы.
• Оральный тест на толерантность к глюкозе (ОГТТ) выполняли после 6 часов воздержания от пищи в течение дня (с 7:30 до 13:30) у 20 детенышей на группу в возрасте 42±3 и 287±3 дня.
Во время ОГТТ из хвостовой вены отбирали два образца крови для определения исходного уровня с по меньшей мере 10-минутным интервалом между отборами (время - 10 и 0) с последующим пероральным введением раствора глюкозы через зонд (30 мас. %/об.) в дозе 2 г/кг массы тела. Затем после введения глюкозы отбирали дополнительные образцы крови из надреза хвоста на 15, 30, 45, 60, 90 и 120-й мин. Все образцы крови непосредственно анализировали на уровень глюкозы в крови с использованием глюкометров Ascensia Elite XL (Bayer AG, г. Цюрих, Швейцария). Для всех временных точек образцы крови также отбирали в пробирки, покрытые ЭДТА, плазму отделяли и хранили так, как описано ниже, для анализов на инсулин.
• Шесть детенышей на группу умерщвляли на 42-45-й день обезглавливанием. Образцы крови отбирали в пробирки, содержащие ЭДТА. После отбора крови плазму отделяли через 10 минут центрифугирования при 2200 об/мин. Образцы плазмы хранили замороженными в сухом льду и хранили при -80°С до анализа. Печень, поджелудочную железу, икроножную мышцу и жировые ткани (ретроперитонеальные, эпидидимальные и подкожные) взвешивали и сразу же замораживали. Такую же процедуру повторяли для остальных животных, которых умерщвляли на дни 308-311.
Анализ на гормоны и метаболиты
Инсулин в плазме измеряли методом ИФА с использованием наборов компании Crystal Chem. Inc (штат Иллинойс, США). Содержание в плазме триглицеридов (TG), свободных жирных кислот, глюкозы и холестерина измеряли при умерщвлении с использованием автоматического химического анализатора (СОВAS C111, Roche) с использованием следующих наборов: ферментативного набора для триглицеридов (Roche Diagnostics, г. Роткройц, Швейцария), ферментативного набора для свободных жирных кислот (Wako Chemicals GmbH, г. Нойс, Германия), ферментативного набора для холестерина (Roche Diagnostics, г. Роткройц, Швейцария), IGF-1 (IDS, LTD, Великобритания).
Для определения панкреатического инсулина поджелудочную железу гомогенизировали с кислым этанолом (раствор об./об.: 75% этанола, 1,5% 37%-й HCl и 23,5% дистиллированной воды) и инкубировали при -20°С в течение ночи. Содержание инсулина в супернатанте измеряли методом ИФА с использованием наборов компании Crystal Chem. Inc (штат Иллинойс, США).
На основе значений глюкозы и инсулина натощак рассчитывали гомеостатическую модельную оценку резистентности к инсулину (HOMA-IR). Этот проверенный индекс чувствительности к инсулину у крыс (31) рассчитывали следующим образом:

ОТ-ПЦР
Экстракцию мРНК из печеночной, подкожной и ретроперитонеальной жировой ткани выполняли с помощью набора Agencourt RNA advanced tissue kit (Beckman Coulter, США). РНК количественно определяли на спектрофотометре ND-1000 (NanoDrop Technologies, США). Обратную транскрипцию выполняли с использованием набора для синтеза 1-й цепи кДНК для ОТ-ПЦР (AMV Roche, Германия). Праймеры разрабатывали с помощью программного обеспечения Primer Express версии 3.30 (Applied Biosystems, США), в качестве конститутивного гена использовали β-актин.
Статистический анализ
В зависимости от типа выходного параметра выполняли два вида статистических анализов:
- для массы тела и прироста массы тела (данные продольного анализа) на каждой фазе исследования (фаза I экспериментальной диеты; фаза II коммерческой кормовой диеты; фаза II диеты с высоким содержанием жиров) использовали смешанную модель. В этих линейных смешанных моделях в качестве фиксированных эффектов использовали переменные группы, дня, дня в квадрате и парных взаимодействий группы и дня, а также случайный эффект дня и дня в квадрате.
Для другого выходного параметра, измеряемого в уникальную временную точку (или для шкалы изменения состава тела), был разработан непараметрический подход с использованием двусторонних критериев суммы рангов Уилкоксона.
Значения Р этих критериев приведены для всех отличных выходных параметров.
Результаты
Фаза I относится к той фазе диеты, когда экспериментальную диету скармливали детенышам. На второй фазе, фазе II, все детеныши получали одинаковую диету. В начальной части фазы II (фаза II: А) детенышей кормили обычной коммерческой диетой. Во второй части, фазе II: В, детенышей подвергали нагрузке в виде диеты с высоким содержанием жиров.
Поступление энергии
На фиг. 2 показано общее поступление энергии.
Группа казеина 20 Е% имела существенно более высокое поступление энергии по сравнению как с группой молочной сыворотки 20 Е%, так и с группой казеина 36 Е% на фазе I (калорийность: 1088±12; 982,4±25; 932±12 соответственно, Р≤0,0001), а также на фазе II (когда все группы кормили одинаковой диетой), и, таким образом, в течение всего периода исследования (фаза I + фаза II) (р<0,05). Группа молочной сыворотки 20 Е% и группа молочной сыворотки 36 Е% имели аналогичное поступление энергии на обеих фазах исследования и, таким образом, в течение всего периода исследования (р>0,05 во всех случаях).
Группа казеина 36 Е% и группа молочной сыворотки 36 Е% имели аналогичное поступление энергии на фазе I. Хотя на фазе II группа молочной сыворотки 36 Е% характеризовалась более высоким поступлением энергии, чем группа казеина 36 Е%, это отличие было статистически значимым только в период нагрузки высоким содержанием жиров (р<0,05), а не всей фазы II или всего периода исследования (р>0,05).
Животные, которых кормили низкоказеиновой диетой (группа казеина 20 Е%) после отлучения от груди, имели существенно более высокое поступление энергии (больше ели) по сравнению с животными, которых кормили молочной сывороткой 20 Е%, казеином 36 Е% и молочной сывороткой 36 Е%, при измерении в конце диеты фазы I.
Масса тела и прирост массы тела
На фиг. 3 и 4 представлены значения массы тела и прироста массы тела.
В период экспериментальной диеты (фаза I) казеиновые группы с обеими концентрациями белка (20 Е% и 36 Е%) имели больший прирост массы тела (р<0,0001), чем соответствующие группы, получавшие молочную сыворотку, что приводило к более высокой массе тела (р<0,0001) (см. Фиг. 3А). При нормальной концентрации белка (20 Е%) по отношению к высокой концентрации (36 Е%) крысы, получавшие казеин, имели больший прирост массы тела (казеин 20 Е%: 156±2,4 г; казеин 36 Е%: 144±1,6 г; р<0,02), что приводило к большей массе тела на 42-й день (казеин 20 Е%: 196±2,3 г; казеин 36 Е%: 184±2,6 г; р<0,02). Наоборот, крысы, которых кормили большим количеством сывороточного белка (группа молочной сыворотки 36 Е%), демонстрировали на 12% более высокий прирост массы тела (молочная сыворотка 20 Е%: 113±3,6 г; молочная сыворотка 36 Е%: 127±2,7 г; р=0,001), что приводило к тому, что масса тела была на 6,5% больше (молочная сыворотка 20 Е%: 153±3,8 г; молочная сыворотка 36 Е%: 163±3,7 г; р<0,05).
На фазе II (фиг. 3В) группа казеина 20 Е% оставалась тяжелее, чем группа казеина 36 Е%, тогда как прирост массы тела для всех 4 групп был аналогичным в период кормовой диеты с низким содержанием жиров. Однако в период нагрузки в виде диеты с высоким содержанием жиров группа казеина 20 Е% имела больший прирост массы, чем как группа казеина 36 Е%, так и группа молочной сыворотки 20 Е% (выше на 10% и 8%, р<0,01 и р<0,05, соответственно, фиг. 4В). Эта особенность сохранялась в течение всей продолжительности исследования.
Состав тела
Результаты показали, что кормление животных разным количеством и качеством белка в составе диеты влияло на состав тела. Действительно, во время экспериментальной диеты как казеиновый, так и сывороточный белок при 36 Е% приводил к некоторому, но существенно более низкому содержанию жира в теле в %, чем при концентрации белка 20 Е% (Фиг. 4; казеин 20 Е%: 10±0,2%; казеин 36 Е%: 9±0,3%; молочная сыворотка 20 Е%: 11±0,4%; молочная сыворотка 36 Е%: 10±0,3%, р<0,05). Что касается влияния качества белка (казеин по сравнению с молочной сывороткой) на фазе I, то при 20 Е% между группами не было установлено различий, однако крысы, которых кормили казеиновой диетой при 36 Е%, имели меньше жира, чем крысы, которых кормили молочной сывороткой 36 Е%. Эти различия исчезали во время кормления кормовой диетой, однако с более позднего возраста 225 дней до конца исследования группа казеина 20 Е% снова набирала больше жира, чем группа казеина 36 Е% (содержание жира в теле на 13% выше, чем на 283-й день, р=0,01).
В таблице 3 представлены изменения состава тела. В соответствии с отмеченными изменениями состава тела повышение содержания жира в группе казеина 20 Е% отражается существенно более высоким приростом жира, чем в группе казеина 36Е%, как на фазе II, так и во время всего исследования (р=0,005 и р<0,01 соответственно), что приводит к росту соотношения массы жира и мышечной ткани (индекс ожирения).


Гомеостаз глюкозы после фазы I
Гомеостаз глюкозы оценивали в разные периоды времени в течение исследования либо путем проведения орального теста на толерантность к глюкозе, либо путем измерения значения натощак (описано выше в разделе «Материалы и способы»).
Как показано на Фиг. 8, экспериментальная диета фазы I влияла на толерантность к глюкозе. В конце фазы I группы, получавшие молочную сыворотку, демонстрировали как более высокое значение AUC глюкозы (р<0,05), так и более высокие значения Cmax глюкозы (р<0,05), чем группы, получавшие казеин, что свидетельствует о более низкой толерантности к глюкозе в ответ на диету с молочной сывороткой. Кроме того, группа казеина 36 Е% имела более высокие значения гликемии натощак, чем группа казеина 20 Е% (соответственно 6,7±0,14 и 6,1±0,15 ммоль/л, р<0,05).
Когда животным вводили глюкозу, группы, получавшие молочную сыворотку, демонстрировали существенно более высокий пик уровня глюкозы в крови в ответ на введение глюкозы, а также существенный рост AUC глюкозы. Этот факт демонстрирует, что они обладали меньшей способностью выводить глюкозу, чем животные, которых кормили казеиновой диетой (Фиг. 8А), что свидетельствует о более низкой толерантности к глюкозе.
Группа казеина 20 Е% имела более низкую исходную гликемию, чем группа казеина 36 Е% (уровень глюкозы в крови натощак измеряли перед нагрузкой глюкозой). Обе группы, получавшие казеин, имели лучшую толерантность к глюкозе непосредственно в конце фазы I.
Гомеостаз глюкозы после фазы II: А
После 17 недель на кормовой диете измеряли гликемию и инсулинемию натощак. Результаты представлены на Фиг. 6. Исходная гликемия не имела различий между группами, но группа казеина 20 Е% имела более высокий уровень инсулина, чем группа казеина 36 Е% (на 23% выше, р=0,02), что давало более высокое значение НОМА-ГО.. Результаты в целом подчеркивают меньшую чувствительность к инсулину в группе казеина 20 Е%, чем в группе казеина 36 Е%, в возрасте 165 дней.
В конце фазы II: А, то есть после получения нормальной кормовой диеты, проводили другой оральный тест на толерантность к глюкозе. В этот момент не было различий в исходной гликемии (Фиг. 6А). Однако группа казеина 20 Е% демонстрировала существенно более высокие концентрации инсулина, чем группа казеина 36 Е% (Фиг. 6В), что является показателем меньшей чувствительности к инсулину (более высокое значение HOMA-IR).
Гомеостатическая модельная оценка резистентности к инсулину (HOMA-IR) была описана Matthews et al. (Diabetologia 28: 412-419, 1985) как показатель базальной чувствительности к инсулину. HOMA-IR рассчитывали как произведение концентраций FPG (глюкоза в плазме натощак) и FPI (инсулин в плазме натощак), поделенное на константу, предположив, что у контрольных молодых взрослых крыс среднее значение HOMA-IR составляет 1, что аналогично предположениям, используемым при разработке показателя НОМА-IR у людей (q.v.). Уравнение было следующим: HOMA-IR=(FPG×FPI)/2430, где FPI представлено в микроединицах на миллилитр, a FPG - в миллиграммах на децилитр (Cacho et al, American Journal of Physiology - Endocrinology and Metabolism 2008: 295).
Гомеостаз глюкозы после фазы II: В
Оральный тест на толерантность к глюкозе также выполняли в возрасте 287 дней после 5 недель на диете с высоким содержанием жиров. Результаты представлены на Фиг. 7.
Группа молочной сыворотки 36 Е% имела как существенно более высокую исходную гликемию и инсулинемию, чем группа казеина 36 Е% (р<0,05), так и более высокую инсулинемию, чем группа молочной сыворотки 20 Е% (р<0,05). После глюкозной нагрузки кривая ответа инсулина показывала, что группа казеина 20 Е% имела более высокое значение Cmax инсулина, чем группа казеина 36 Е% (р<0,01), а также более высокую AUC инсулина (р<0,05).
Рост как базального уровня глюкозы в плазме, так и инсулина указывает на то, что группа молочной сыворотки 36 Е% имела нарушение уровня глюкозы натощак и базальную резистентность к инсулину.
Кроме того, рост AUC инсулина в группе казеина 20 Е% по сравнению с группой казеина 36 Е% также является показателем резистентности к инсулину.
Индекс чувствительности к инсулину
Индекс чувствительности к инсулину (HOMA-IR) в течение всего исследования представлен на Фиг. 8. В период экспериментальной диеты не было обнаружено различий в HOMA-IR между всеми группами (Фиг. 8А). Позднее, в возрасте 165 дней (при кормовой диете с низким содержанием жиров), группа казеина 20 Е% имела более высокое значение HOMA-IR, чем группа казеина 36 Е% (р<0,01), что свидетельствует о более низкой чувствительности к инсулину, но это различие в дальнейшем не проявлялось. В конце периода с высоким содержанием жиров (возраст 287 дней) группа молочной сыворотки 36 Е% демонстрировала самое высокое значение HOMA-IR, что свидетельствует о снижении чувствительности к инсулину во взрослой жизни в условиях, ведущих к развитию ожирения (фиг. 8С).
В фазе I не было установлено различий в HOMA-IR. После фазы II: А группа казеина 20 Е% имела существенно более высокий индекс HOMA-IR, чем группа казеина 36%, но другие группы не демонстрировали существенных отличий. Однако в конце фазы II: В (после нагрузки в виде диеты с высоким содержанием жиров) группа молочной сыворотки 36 Е% имела существенно более высокие показатели HOMA-IR, чем обе группы казеина 36 Е%.
Литература
1. Barker DJ et al Horm Res 42, 223-230. 1994.
2. Lucas А. CIBA Foundation Symposium 156. Whiley, Chichester, UK. 38-55. 1991.
3. Lucas A et al. BMJ 319: 245-249 2012.
4. Barker et al. Lancet, 938-941. 1993.
5. Lanigan J et al Proc Nutr Soc. 68, 422-429. 2009.
6. Hales CN et al. BMJ 303, 1019-1022. 1991.
7. McCance. BMJ 308, 942-945. 1994.
8. Okosun et al, Int J Obes. Related Metab Disord 24, 479-484. 2000.
9. Perrie F. O'Tierney et al. The journal of Nutrition 139, 422-425. 2009.
10. Owen CG et al. Pediatrics 115, 1367-1377. 2005.
11. Harder The et al. Am J Epidemiol. 162, 397-403. 2005.
12. KB Michels et al. International Journal of Obesity 31, 1078-1085. 2007.
13. Kramer MS et al. Am J Clin Nutr 86, 1717-1721. 2007.
14. Law CM et al. J Epidemiol Community Health 46, 184-188. 1992.
15. Eriksson JG et al. Diabetes Care 26, 3006-3010. 2003.
16. Forsen TJ et al. Ann Med. 2004; 36:389-92. Ann Med. 2004.
17. Berthold et al. The American Journal of Clinical Nutrition 89, 1836-1845. 2009.
Реферат
Группа изобретений касается лечебного питания. Предложена питательная композиция, содержащая по меньшей мере 90 мас.% казеина в расчете на общее содержание белка в композиции и представляющая собой детскую смесь, детскую смесь второго уровня, молоко для детей старше 1 года или обогатитель грудного молока, для профилактики и/или снижения риска развития расстройства, связанного с метаболическим синдромом, проявляющегося в дальнейшей жизни при нагрузке в виде адипогенной диеты, причем композиция предназначена для введения ребенку грудного возраста или ребенку младшего возраста от рождения до возраста 36 месяцев, и при этом композицию вводят ребёнку грудного возраста, чей вес при рождении был нормальным или выше нормы. Предложен соответствующий способ профилактики и/или снижения риска развития указанного расстройства. Технический результат состоит в снижении нарушения чувствительности к инсулину и в поддержании гомеостаза глюкозы на фоне адипогенной диеты. 2 н. и 8 з.п. ф-лы, 8 ил., 3 табл.
Формула
Документы, цитированные в отчёте о поиске
Добавка к материнской диете

Комментарии