Способ извлечения металлов из полиметаллического сырья с регенерацией основного (nh) и кислого (hcl) реагентов - RU2640552C2
Код документа: RU2640552C2
Чертежи


Описание
Извлечение металлов из полиметаллического сырья относится к области гидропроцессов и может быть использовано в процессах растворения, выщелачивания, выделения металлов и их соединений из водных растворов, синтеза и т.п.
Для выщелачивания рудных компонентов применяют растворы кислот, щелочей и солей с окислителями и восстановителями [А.Н. Зеликман, Б.Г. Коршунов. Металлургия редких металлов. Металлургия, 1991].
Выбор растворителей определяется селективностью их действия, влиянием на скорость растворения определенных минералов крупности частиц, концентраций реагентов, температуры растворов и продолжительностью выщелачивания. Реагенты, как правило, составляют основную долю расходов в гидрометаллургическом переделе и определяют рентабельность применения химических технологий.
Наиболее близким техническим решением является способ извлечения ценного металла, выбранного из группы, включающей Zn, Ti, Al, Cr, Ni, Co, Cu, Mn, Fe, Pb, Na, К, Ca, Ag, металлы платиновой группы и золото, из содержащей его руды, в котором осуществляют выщелачивание руды в присутствии хлористо-водородной кислоты с образованием хлорида металла в растворе для выщелачивания, добавляют диоксид серы в раствор для выщелачивания в присутствии ионов трехвалентного железа для регенерации хлористо-водородной кислоты, извлекают твердый сульфат металла или сульфит металла из раствора и одновременно осуществляют регенерацию хлористо-водородной кислоты [Патент 2395594, опубл. 2010, Бюл. №21].
Недостатками способа являются накопление растворимых солей хлоридов и сульфатов, дороговизна и сложность процесса.
Задачей изобретения является создание эффективного, экономичного способа извлечения ценных металлов из руд с регенерацией всех исходных реагентов. Ценный металл выбирают из группы, включающей W, Mo, Zn, Ti, Al, Cr, Ni, Co, Cu, Mn, Fe, Pb, Na, К, Ca, металлы платиновой группы и золото.
Технический результат, который может быть достигнут при осуществлении изобретения, заключается в создании высокоэффективных, экономичных, с высокой степенью извлечения компонентов технологий.
Этот технический результат достигается тем, что в известном способе извлечения металлов из полиметаллического сырья выщелачиванием солянокислым раствором осаждение металлов из солянокислых растворов осуществляют аммиаком, из раствора кристаллизуют соль NH4Clтв, а раздельное получение газообразных основного (NH3) и кислого (HCl) реагентов осуществляют из солей (NH4)2SO4 и NH4Cl по схеме

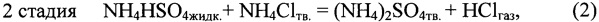
при этом процесс осуществляют циклически с регенерацией (NH4)2SO4 по реакции 2 и NH4Cl в технологических циклах, использующих указанные газообразные реагенты.
Сущность способа поясняется приведенными технологическими схемами фиг. 1 и 2 и уравнениями 1 и 2 химических превращений исходных солей (NH4)2SO4 и NH4Cl с образованием газообразных реагентов NH3 и HCl с последующей регенерацией исходных солей, как это показано на схеме фиг. 1 и 2.
Выщелачиванию подвергается полиметаллическое сырье, содержащее W, Mo, Zn, Ti, Al, Cr, Ni, Co, Cu, Mn, Fe, Pb, Na, К, Ca, металлы платиновой группы и золото.
Используя основной (NH3) и кислый (HCl) реагенты, полученные по реакциям 1 и 2 из смеси солей (NH4)2SO4 и NH4Cl, можно осуществить извлечение ионов металлов из полиметаллического сырья с регенерацией исходных солей (NH4)2SO4 и NH4Cl.
Пример 1 (фиг. 1)
Гетит Fe2O3⋅H2O, гематит Fe2O3, магнетит FeO⋅Fe2O3 и другие минералы, содержащие растворимые в соляной кислоте соли железа (III), растворяют в соляной кислоте:
Fe2O3+6HCl=2FeCl3+3H2O,
FeO⋅Fe2O3+8HCl=2FeCl2+2FeCl3+4H2O.
Железо (III) осаждают из раствора в виде практически нерастворимого аморфного осадка гидроксида железа (III) действием аммиака:
FeCl3+3NH3⋅H2O=Fe(OH)3+3NH4Cl.
При осаждении раствором аммиака необходимо, чтобы железо в растворе было в окисленной форме. Ион железа (II) количественно не осаждается аммиаком, поскольку наряду с образованием труднорастворимого гидроксида образуются также растворимые комплексы железа (II). В связи с этим железо (II) окисляют до железа (III).
Регенерацию исходных солей (NH4)2SO4 и NH4Cl осуществляют, как это показано на схеме фиг. 1.
Пример 2 (фиг. 2)
Разложению подвергается шеелит CaWО4 с получением чистого оксида вольфрама WO3 и регенерированных исходных солей (NH4)2SO4 и NH4Cl.
Шеелит поступает на разложение соляной кислотой:
CaWО4+2HCl=H2WО4+CaCl2.
Полученная техническая вольфрамовая кислота содержит 0,2-0,3% примесей. В результате прокаливания кислоты при 500-600°С получают триоксид вольфрама, пригодный для производства твердых сплавов на основе карбида вольфрама. Однако для производства вольфрама необходим триоксид более высокой чистоты с суммарным содержанием примесей не более 0,05%.
Общепринят аммиачный способ очистки вольфрамовой кислоты. Она легко растворяется в аммиачной воде, при этом большая часть примесей остается в осадке: кремнезем, гидроксиды железа и марганца и кальций (в виде CaWО4). Однако аммиачные растворы могут содержать примесь молибдена и солей щелочных металлов.
Из аммиачного раствора выделяют, в результате выпаривания и последующего охлаждения, кристаллический осадок паравольфрамата аммония ПВА (NH4)10H2W12O42⋅4Н2О:
12(NH4)2WО4=(NH4)10H2W12O42⋅4Н2О+14NH3+2Н2О.
Обычно в кристаллы выделяют 75-80% вольфрама. Более глубокую кристаллизацию проводить нежелательно во избежание загрязнения кристаллов примесями. Существенно, что большая часть примеси молибдена (70-80%) остается в маточном растворе. Из маточного раствора, обогащенного примесями, вольфрам осаждают в виде технической кислоты H2WО4, возвращаемой на соответствующую стадию технологической схемы.
Кристаллы ПВА отжимают на фильтре, затем на центрифуге, промывают холодной водой и сушат.
Триоксид вольфрама получают термическим разложением ПВА:
(NH4)10H2W12O42⋅4Н2О=12WО3+10NH3+10Н2О.
В триоксиде вольфрама, предназначенном для производства вольфрама, содержание WО3 должно быть не ниже 99,95%, для производства твердых сплавов - не ниже 99,9%.
Кальций хлористый, образующийся при разложении шеелита соляной кислотой, можно использовать в металлургии для высадки тяжелых металлов из растворов. Кальций используют и в металлургии меди, никеля, специальных сталей, сплавов цветных металлов и бронз как раскислитель, в качестве наполнителя для порошковой проволоки, добавляя его в расплавленный металл для связывания растворенного кислорода, как легирующий элемент при производстве сплавов цветных металлов, для получения металлического кальция электролизом расплава кальциевых солей, для производства кальциевых сплавов и баббитов и для других целей.
Регенерацию исходных солей (NH4)2SO4 и NH4Cl осуществляют, как это показано на схеме фиг. 2.
Предлагаемый способ универсален и может использоваться в самых разнообразных технологических процессах.
Как показали эксперименты, предлагаемый способ по сравнению с прототипом высокоэффективен, экономичен, процессы осуществляются быстро. Помимо кислого реагента (HCl) в предлагаемом способе получают и основной реагент (NH3), что и определяет возможности широкого использования данного способа в разнообразных процессах с высокими показателями извлечения ценных компонентов.
Реферат
Изобретение может быть использовано в процессах растворения, выщелачивания, выделения металлов и их соединений из водных растворов. Для осуществления способа проводят извлечение металлов из полиметаллического сырья выщелачиванием солянокислым раствором, осаждение металлов из солянокислых растворов осуществляют аммиаком и из раствора кристаллизуют соль NHCl. Раздельное получение газообразных основного (NH) и кислого (HCl) реагентов осуществляют взаимодействием солей (NH)SOи NHCl по схемепри этом процесс осуществляют циклически с регенерацией соли (NH)SOпо реакции 2 и NHCl в технологических циклах, использующих указанные газообразные реагенты. Способ обеспечивает эффективную и экономичную технологию с высокой степенью извлечения металлов с одновременной регенерацией использующихся реагентов. 2 ил., 2 пр.
Формула
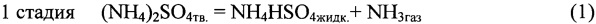
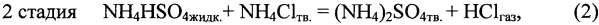

Комментарии