Способ концентрирования и отделения хлоридов металлов в/из содержащего хлорид железа (iii) раствора соляной кислоты - RU2615527C2
Код документа: RU2615527C2
Чертежи



Описание
Настоящее изобретение относится к способу концентрирования и отделения хлоридов металлов в/из содержащего хлорид железа (III) раствора соляной кислоты.
Железосодержащие растворы соляной кислоты образуются при самых разнообразных процессах, в т.ч. при травлении в сталелитейной промышленности, при котором окалина удаляется с помощью химической реакции с соляной кислотой. Также железосодержащие растворы соляной кислоты образуются в цветной металлургии, в которой самые разные руды растворяют в соляной кислоте и в последующем гидрометаллургическом процессе получают цветные металлы. Поскольку в рудах практически всегда содержится железо, то в этом случае образуются железосодержащие растворы соляной кислоты. Для отделения хлоридов металлов от содержащих хлорид железа (III) растворов имеются самые разные причины и необходимость.
По соображениям рентабельности целью операторов производственных установок, на которых хлориды железа служат отходами, является извлечение соляной кислоты процессом регенерации и, следовательно, создание замкнутого хлоридного контура по месту нахождения производственной установки.
Образующиеся при промышленных процессах железосодержащие растворы соляной кислоты обычно присутствуют не в чистом виде. В железосодержащих растворах соляной кислоты, образовавшихся при травлении в сталелитейной промышленности, указанный раствор соляной кислоты загрязнен содержащимися в стали легирующими элементами, например, марганцем, цинком, никелем и др. Здесь целью оператора является удаление указанных легирующих элементов из замкнутого хлоридного контура на участке между производственной установкой и местом проведения регенерации для недопущения накопления примесей. При гидрометаллургических процессах задача стоит несколько иная, поскольку здесь примеси, присутствующие в железосодержащем растворе соляной кислоты в незначительных количествах, представляют собой ценные вещества, подлежащие экстрагированию.
Распространенные способы регенерации хлористого водорода из железосодержащих растворов соляной кислоты разделяют на пирогидролитические и гидротермальные способы.
Двумя известными пирогидролитическими способами являются, с одной стороны, способ Рутнера (Ruthner), известный также как способ распылительного обжига, и способ Лурги, известный также как способ с псевдоожиженным слоем. По существу оба эти способа работают по одному принципу, причем различаются между собой главным образом конструкцией обжигового устройства. Образующийся раствор хлорида железа непосредственно подается в отапливаемую топливом печь, в которой содержащаяся в растворе хлорида железа вода выпаривается и хлорид железа вступает в реакцию с водой - а в случае с хлоридом железа (II) и с кислородом - с образованием оксида железа в виде гематита, который непрерывно выгружается из реактора, и хлористого водорода, который в виде газа вместе с водяным паром и продуктами сгорания отводится из реактора. В устройстве распылительного обжига раствор хлорида железа тонко распыляется сверху внутрь реактора, образующийся порошок хлорида железа падает вниз и там отводится. Обычно температура обжигового газа на выходе задается равной около 400°С.
В способе Лурги в качестве обжиговой печи используют печь с псевдоожиженным слоем. При этом в качестве ожижающего агента используются продукты сгорания, необходимого для процесса. В качестве материала слоя служит произведенный гранулят оксида железа. Раствор хлорида железа с помощью фурм безнапорно подают на псевдоожиженный слой. При этом гранулят оксида железа смачивают раствором хлорида железа, этот раствор подвергается воздействию обжига, при котором образуются оксид железа в виде гематита и соляная кислота. Вследствие высокой температуры, достигающей 850°С, происходит спекание вновь образовавшегося слоя из оксида железа с основным материалом, и гранулят из оксида железа нарастает. Гранулят из оксида железа непрерывно выводится из реактора для поддержания постоянной высоты постели. Аналогично способу Рутнера образовавшийся хлористый водород вместе с водяным паром и продуктами сгорания выводится в газообразном состоянии из реактора.
При обоих способах обжиговые газы прежде всего, охлаждают в испарителе Вентури, при этом используется в качестве хладагента раствор хлорида железа, который концентрируется вследствие выпаривания. Полученный в результате концентрированный раствор хлорида железа подается в обжиговое устройство.
Из охлажденного обжигового газа хлористый водород вымывают путем многостадийной абсорбционной очистки. При этом образуется соляная кислота, которую можно снова использовать в первоначальном производственном процессе.
При пирогидролитических способах регенерации гидролиз не протекает в водной фазе. В реактор вводят кислоту, вода выпаривается и хлориды металлов, присутствующие в железосодержащем растворе соляной кислоты, выкристаллизовываются и подвергаются обжигу. Это означает, что хлориды металлов реагируют с водой в атмосфере печи с образованием оксидов металла и выделяют хлористый водород. Преимущество таких способов состоит в том, что большая часть присутствующих в железосодержащем растворе соляной кислоты примесей обжигается в этих условиях и таким образом выводится из замкнутого хлоридного контура. Даже элементы, которые не могут быть подвергнуты обжигу, как, например, калий, кальций, натрий, выводятся в виде хлоридных примесей в оксиде.
Хлориды металлов с низкой температурой сублимации, как, например, ZnCl2 или FeCl3, не пригодны для данного способа, так как эти хлориды отводятся в виде паров из реактора, конденсируются на более прохладных участках установки и образуют мелкие частицы, создающие отложения и забивания в дымоходе.
В AT 315603 В (Способ регенерации цинксодержащих растворов соляной кислоты для травления железа) описан способ, в котором железосодержащий раствор соляной кислоты с примесью хлорида цинка, такой, как травильный раствор, используемый в гальванических процессах, обрабатывают добавлением серной кислоты в устройство распылительного обжига, при этом в произведенном оксиде железа цинк присутствует в виде сульфата цинка.
Другим способом обработки растворов хлорида железа является гидротермальная регенерация, при которой гематит осаждается непосредственно из раствора хлорида железа (III). Это означает, что растворенный хлорид железа (III) реагирует с водой и образует гематит и хлористый водород. В результате выпаривания из раствора происходит удаление хлористого водорода. Поскольку постоянно происходит удаление хлористого водорода из равновесного состояния реакции, то обеспечивается реакция гидролиза хлорида железа (III).
В US 3682592 В раскрыт гидролиз хлорида железа (III) путем так называемого процесса PORI. При этом проводится концентрирование раствора хлорида железа (II), происходящего из процессов травления стали, на первом этапе способа и после этого проводится окисление кислородом с образованием раствора хлорида железа (III). Энергия, необходимая для выпаривания в реакторе гидролиза, обеспечивается продуктами сгорания. Поступление энергии в реактор достигается посредством прямого контакта между раствором хлорида железа (III) и горячими продуктами сгорания. В газоочистителе хлористый водород вымывается из отходящего газа и регенерируется соляная кислота.
В JP 2006-137118 описан способ регенерации растворов хлорида железа по гидротермальному принципу, в котором гидролиз проводят при температуре от 120 до 150°С и пониженном давлении для снижения температуры кипения раствора хлорида железа (III). В отличие от процесса PORI необходимая для выпаривания энергия подводится в реактор гидролиза косвенно через теплообменник. Однако опытным путем было установлено, что осажденный из раствора оксид железа не обладает требуемым качеством. В результате применения пониженного давления для снижения температуры кипения раствора хлорида железа (III) в реакторе гидролиза упомянутый раствор хлорида железа (III) благодаря парожидкостному равновесию имеет высокую концентрацию хлорида железа (III), вследствие чего из-за недостатка воды вместо гематита образуется неблагоприятный оксихлорид железа.
В способе согласно WO 2009/153321 реактор гидролиза эксплуатируют при атмосферном давлении, подвод энергии осуществляют опосредственно от теплообменника. Гидролизу предшествуют два других технологических этапа. Сначала проводится концентрирование раствора хлорида железа, причем необходимая для этого энергия обеспечивается за счет энергии конденсации паров из реактора гидролиза. Благодаря эффективному использованию внутреннего технологического тепла может быть наполовину снижен расход энергии при гидротермальной регенерации по сравнению с пирогидролитическим способом.
Присутствующие в железосодержащем растворе соляной кислоты примеси, например, Mn, Zn, Са, K, Mg, Na и др., как правило, не подвержены гидролизу в водном растворе, что ведет к тому, что перечисленные элементы концентрируются в реакторе гидролиза. С ростом концентрации не гидролизуемых металлов изменяется также парожидкостное равновесие, вследствие чего концентрация не гидролизуемых металлов допустима лишь до определенного предела.
Как правило, легирующие элементы, присутствующие в железосодержащем растворе соляной кислоты, происходящем от раствора для травления стали, используются не рентабельно. Отсюда недостаток по сравнению с пирогидролитическим способом регенерации, при котором указанные легирующие элементы могут выводиться из замкнутого хлоридного контура и повторно использоваться. В настоящее время часть гидролизного раствора постоянно выбрасывается для поддержания концентрации не гидролизуемых металлов. При этом также выбрасывается ценный хлорид железа (III), из-за чего снижается степень регенерации хлористого водорода. Чем выше концентрация не гидролизуемых металлов в железосодержащем растворе соляной кислоты внутри реактора гидролиза, тем меньше доля выбрасываемого железосодержащего раствора соляной кислоты. Несмотря на меньшую степень регенерации хлористого водорода по сравнению с пирогидролитическим способом регенерации гидротермальная регенерация является рентабельной благодаря энергетической эффективности.
Целью гидрометаллургических способов является извлечение присутствующих в железосодержащем растворе соляной кислоты хлоридов металлов в качестве ценного вещества, например, таких, как Li, Be, Al, Sc, Ti, V, Cr, Mn, Co, Ni, Cu, Zn, Ga, Ge, As, Rb, Sr, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd, In, Sn, Sb, Те, Cs, Ba, La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Hf, Та, W, Re, Os, Ir, Pt, Au, Hg, Tl, Pb, Bi, Po, Fr, Ra, Ac, Th, Pa, U, Np, Pu. При этом путем гидролиза хлорида железа (III) в водном растворе растворенное железо может быть переведено в осадок в виде его оксида, предпочтительно гематита, из водного раствора, не гидролизуемые металлы в виде хлоридов останутся растворенными в водном растворе.
В данном изобретении речь идет о способе концентрирования и отделения хлоридов металлов в/из содержащего хлорид железа (III) раствора соляной кислоты, при этом железо в виде его оксида, предпочтительно гематита, осаждается из указанного раствора, отфильтровывается в фильтрующем устройстве и концентрированные, не гидролизуемые хлориды металлов удаляются из по меньшей мере части фильтрата соляной кислоты. Концентрация не гидролизуемых хлоридов металлов в концентрированном железосодержащем растворе соляной кислоты составляет не более 30 вес. %, предпочтительно не более 20 вес. %, при этом концентрация хлорида железа (III) в указанном растворе составляет от 30 до 80 вес. %, предпочтительно от 40 до 75 вес. %.
Способ согласно изобретению может проводиться непрерывно или периодически, ниже в целях упрощения речь пойдет о непрерывном способе. Средний специалист в состоянии легко превратить такой непрерывный способ путем соответствующих изменений в периодический. Смешанный с хлоридами металлов железосодержащий раствор соляной кислоты, причем растворенное железо является большей частью трехвалентным, подают в реактор гидролиза. В нем протекает реакция гидролиза, в ходе которой присутствующий в железосодержащем растворе соляной кислоты хлорид железа (III) реагирует с водой с образованием хлористого водорода и оксида железа, предпочтительно гематита. Данная реакция гидролиза является равновесной и поэтому для ее поддержания хлористый водород должен постоянно отводиться из раствора. Парожидкостное равновесие изменяется вследствие присутствия не гидролизуемых хлоридов металлов (см. примеры 1 и 2) и поэтому условия эксплуатации в реакторе гидролиза следует рассматривать с новой точки зрения. При этом реактор гидролиза эксплуатируют при температуре от 150 до 300°С, предпочтительно от 160 до 200°С, и давлении от -0,8 до 20 бар, предпочтительно от -0,5 до 10 бар. Концентрация хлористого водорода в гидролизном паре составляет от 10 до 40 вес. %, предпочтительно от 15 до 35 вес. %.
В результате подвода тепловой энергии вода и хлористый водород выпапариваются во время работы. Часть раствора отбирается из реактора гидролиза, выпавший из раствора в осадок оксид железа, предпочтительно, гематит, отфильтровывается в фильтрующем устройстве. На последующей технологической стадии концентрированные, не гидролизуемые хлориды металлов удаляются из по меньшей мере части железосодержащего фильтрата соляной кислоты. При этом присутствует возможность охлаждения и/или разбавления водой упомянутого железосодержащего раствора соляной кислоты перед последующей технологической стадией с целью предупреждения неконтролируемой кристаллизации хлорида железа (III). Согласно варианту выполнения изобретения еще до фильтрации осажденного оксида железа, предпочтительно гематита, указанный железосодержащий раствор соляной кислоты может быть охлажден и/или разбавлен водой. Оставшаяся не обработанной часть фильтрата подается насосом обратно в реактор гидролиза (или на другую предшествующую технологическую стадию).
Согласно предпочтительному варианту осуществления настоящего изобретения для удаления концентрированных, не гидролизуемых оксидов металлов от отфильтрованного железосодержащего раствора соляной кислоты из реактора отдельные хлориды металлов селективно извлекают посредством экстракции растворителем. Оставшаяся часть железосодержащего раствора соляной кислоты подается насосом обратно в реактор гидролиза или на другую предшествующую технологическую стадию. В процессе реэкстракции упомянутые хлориды металлов экстрагируют обратно из органической фазы, например, в водную фазу. Органическую фазу регенерируют и используют для последующей экстракции растворителем.
Благодаря этому способу стало возможным увеличить степень регенерации хлористого водорода при гидротермальной кислотной регенерации, так как железосодержащий раствор соляной кислоты больше не выбрасывается. Другое решающее преимущество данного способа состоит в том, что концентрация не гидролизуемых хлоридов металлов в железосодержащем растворе соляной кислоты при известных условиях является чрезвычайно малой и благодаря данному изобретению вообще стало возможным концентрировать такие хлориды металлов в железосодержащем растворе соляной кислоты и извлекать их посредством экстракции растворителем.
Также предпочтительно, чтобы в способе согласно изобретению для каждого экстрагируемого из железосодержащего раствора соляной кислоты хлорида металла последовательно использовался индивидуальный процесс экстракции растворителем.
Согласно другому предпочтительному варианту осуществления настоящего изобретения присутствующий в железосодержащем растворе соляной кислоты хлорид железа (III) непосредственно извлекают посредством экстракции растворителем и затем из полученного, не содержащего железо раствора избирательно извлекают отдельные не гидролизуемые хлориды металлов путем экстракции растворителем.
Согласно еще одному альтернативному варианту осуществления настоящего изобретения для удаления концентрированных, не гидролизуемых хлоридов металлов от отфильтрованного железосодержащего раствора соляной кислоты из реактора отдельные хлориды металлов селективно извлекают с помощью ионообменной смолы.
Предпочтительно в способе согласно изобретению концентрированные, не гидролизуемые хлориды металлов осаждают из железосодержащего раствора соляной кислоты путем повышения концентрации свободного хлористого водорода в растворе. Если на растворимость хлорида железа (III) в водном растворе с повышением концентрации свободного хлористого водорода почти не оказывается влияния, то растворимость не гидролизуемых хлоридов металлов, как, например, никеля или цинка, снижается. Осажденный таким способом хлорид металла отфильтровывают и при необходимости промывают концентрированной соляной кислотой, полученный фильтрат и промывочная жидкость могут быть направлены обратно в реактор гидролиза или на другую предшествующую технологическую стадию.
Согласно варианту осуществления способа по изобретению, при котором не гидролизуемые хлориды металлов кристаллизуются при повышении концентрации свободной соляной кислоты в железосодержащем растворе соляной кислоты, оказалось особо оптимальным присутствие хлорида железа (III) в указанном растворе. Высокая концентрация хлорида железа (III) в железосодержащем растворе соляной кислоты снижает растворимость не гидролизуемых хлоридов металлов в зависимости от свободной соляной кислоты по сравнению с чистой системой "хлорид металла/вода/хлористый водород" (см. пример 5).
Это означает, что для упомянутого варианта способа согласно изобретению потребуется существенно меньшая концентрация соляной кислоты, в результате чего, с одной стороны, становится возможной кристаллизация хлоридов металлов за счет повышения количества хлористого водорода и, с другой стороны, снижается количество обрабатываемой чистой соляной кислоты, вследствие чего соответственно уменьшается энергопотребление в ходе всего процесса.
Кристаллизация согласно изобретению проводится при температуре от 10 до 200°С, предпочтительно от 20 до 150°С, и давлении от -0,8 до 30 бар, предпочтительно от -0,5 до 20 бар, при этом в железосодержащем растворе соляной кислоты присутствует от 10 до 70 вес. %, предпочтительно от 20 до 60 вес. % хлорида железа (III). Концентрация свободного хлористого водорода в этом растворе повышается не более чем до 50 вес. %, предпочтительно не более чем до 40 вес. %.
Также целесообразно, чтобы для отделения не гидролизуемых хлоридов металлов посредством процесса кристаллизации от раствора соляной кислоты указанный раствор смешивался с хлоридом железа (III) для обеспечения кристаллизации путем повышения количества свободной соляной кислоты согласно варианту способа по изобретению. Кроме того, в растворах соляной кислоты, содержащих двухвалентное железо, хлорид двухвалентного железа может быть переведен путем окисления в хлорид трехвалентного железа для обеспечения гидролиза хлорида трехвалентного железа в оксид железа, предпочтительно, гематит.
Важным моментом в этом варианте осуществления способа согласно изобретению является необходимый для кристаллизации хлоридов металлов хлористый водород. Для этого производят отбор части полученного при гидролизе регенерата и на стадии концентрирования из регенерата получают чистый хлористый водород с концентрацией не менее 70 вес. %, предпочтительно 80 вес. %, который используют в целях кристаллизации. Для компенсации водного баланса воду, отделенную от хлористого водорода на стадии концентрирования, снова направляют в реактор гидролиза. В результате во время процесса создается хлоридный контур, проходящий от реактора гидролиза через стадию концентрации до стадии кристаллизации и через фильтрат обратно в реактор гидролиза.
Для проведения стадии концентрирования, т.е. для производства очищенного хлористого водорода с чистотой не менее 70%, предпочтительно 80%, имеются разные способы. Во-первых, очищенный хлористый водород с чистотой не менее 70%, предпочтительно 80%, может производиться путем относительно энергоемкой ректификации переменного давления. Другая возможность состоит в том, что соляную кислоту приводят в контакт с высококонцентрированной серной кислотой. Поскольку серная кислота является сильно гигроскопичной, то содержащаяся в соляной кислоте или в регенерате вода связывается серной кислотой, а газообразный чистый хлористый водород может быть отведен. В целях повышения эффективности способ может проводиться в несколько стадий в противотоке. Разбавленная серная кислота может быть регенерирована в ректификационной колонне.
Существенным преимуществом упомянутого последнего способа производства хлористого водорода по сравнению с прямой ректификацией переменного давления хлористого водорода является то, что во время ректификации серной кислоты не требуется прохождения через азеотропную точку, поскольку азеотропная точка серной кислоты составляет 96%. Это обеспечивает преимущества как в отношении аппаратного оформления, так и в отношении расхода энергии. Однако в этом случае возможна также дистилляция с добавлением разделяющего агента, при которой используются другие хлориды металлов, например, CaCl2.
Другая возможность концентрирования обеспечивается мембранной дистилляцией, которая может применяться как непосредственно с использованием чистой хлористоводородной кислоты, так и косвенно с использованием серной кислоты или других хлоридов металлов, например, CaCl2 в качестве разделяющего агента.
В последующем этот способ может быть модифицирован для повышения энергетической эффективности. При этом раствор соляной кислоты, полученный при фильтрации хлоридов металлов, подается в предварительный испаритель, в котором большая часть содержащегося в растворе хлористого водорода удаляется с подводом энергии и регенерируется в виде регенерата. Затем концентрированный раствор подается насосом из предварительного испарителя в реактор гидролиза для создания замкнутого контура во время процесса. Необходимая для испарения в предварительном испарителе энергия может быть обеспечена за счет высвобождающейся энергии при конденсации содержащих хлористый водород паров из реактора гидролиза. В результате удаления свободной соляной кислоты из железосодержащего раствора соляной кислоты перед поступлением в реактор гидролиза нагрузка по хлориду в реакторе гидролиза снижается, вследствие чего, в свою очередь, может уменьшиться добавка воды при регулировке концентрации солей и парожидкостного равновесия. По сравнению с этим в WO 2009/153321 свободный хлористый водород расходуется до реактора гидролиза в ходе предшествующей реакции окисления. Обрабатываемый железосодержащий раствор соляной кислоты, образующийся на промышленном предприятии, может быть направлен либо в предварительный испаритель, либо непосредственно в реактор гидролиза.
Далее можно указать на вариант способа согласно изобретению, при котором снижаются затраты на производство очищенной соляной кислоты и который, следовательно, является экономически более эффективным. Этот вариант способа согласно изобретению предполагает, что концентрация хлористого водорода в содержащем хлористый водород паре из реактора гидролиза лежит в сверхазеотропной области.
При этом содержащий хлористый водород пар из реактора гидролиза со сверхазеотропной концентрацией хлористого водорода разделяется в процессе концентрации на две фракции, т.е. на фракцию с содержанием хлористого водорода не менее 70%, предпочтительно не менее 80%, и другую фракцию с содержанием хлористого водорода не менее 10%, предпочтительно не менее 15 вес. %, которая в виде регенерированной кислоты поступает обратно прямо в производственный процесс для замыкания хлоридного контура. Наряду с уже упоминавшимися способами концентрирования хлористого водорода может также непосредственно применяться сверхазеотропная ректификационная колонна. При этом в качестве головного продукта получают высококонцентрированный хлористый водород с концентрацией не менее 70 вес. %, предпочтительно 80 вес. %. В качестве кубового продукта образуется хлористоводородная кислота, минимальная концентрация которой соответствует азеотропной концентрации при рабочем давлении. Азеотропная колонна эксплуатируется при рабочем давлении в диапазоне не более чем до 50 бар, предпочтительно при 30 барах.
Содержащий хлористый водород пар из реактора гидролиза, с одной стороны, конденсируют и в жидком виде или, с другой стороны, непосредственно в виде пара направляют на концентрирование. Этот вариант способа согласно изобретению является в энергетическом отношении особо оптимальным, так как при концентрации соляной кислоты работа ведется не выше азеотропной точки.
В сверхазеотропной области температура конденсации содержащего хлористый водород пара резко падает с повышением концентрации хлористого водорода. При атмосферном давлении температура кипения азеотропной смеси, содержащей около 20 вес. % хлористого водорода, составляет 108°С, температура конденсации чистого хлористого водорода составляет -70°С. Поэтому при конденсации содержащих хлористый водород паров с применением сверхазеотропных смесей требуются хладагенты со сравнительно низкими температурами для полной конденсации содержащих хлористый водород паров. Для полной конденсации содержащих хлористый водород паров при концентрации хлористого водорода 35 вес. % требуется температура 71°С. Если высвобождающаяся энергия конденсации во время процесса используется для работы предварительного испарителя, то такой уровень температуры в известных условиях является слишком низким, так как в последующем потребуется, кроме того, отвести энергию от конденсации паров из упомянутого предварительного испарителя водой. В этом случае необходимо учитывать во время процесса дополнительный низкий температурный уровень. В том случае, когда имеющийся температурный уровень применяемого хладагента является слишком низким для полной конденсации содержащих хлористый водород паров из реактора гидролиза, необходимо дополнительно подать в указанные пары из реактора гидролиза воду, предпочтительно технологическую воду процесса, для исключения разбавления регенерированной кислоты и для концентрирования содержащих хлористый водород паров из реактора гидролиза в сторону азеотропной точки. В результате снижения концентрации хлористого водорода в указанных парах, например, с 35% до 27%, происходит подъем температуры для полной конденсации с 71-107 до 100-108°С. Поскольку технологически концентрирование хлористого водорода в содержащем его паре из реактора гидролиза проводится не in situ, то не возможна автоматическая регулировка подачи воды для снижения концентрации хлористого водорода в указанном паре. Для ведения процесса в варианте способа согласно изобретению, при котором производится очищенный хлористый водород с чистотой не менее 70%, предпочтительно не менее 80%, с помощью сверхазеотропной колонны является обязательным условием, чтобы несмотря на разбавление содержащего хлористый водород пара из реактора гидролиза происходило сверхазеотропное концентрирование хлористого водорода.
Поэтому целесообразно, чтобы производилась сверхазеотропная соляная кислота для получения чистого хлористого водорода в соответствии с вариантом способа согласно изобретению, причем конденсация содержащих хлористый водород паров из реактора гидролиза проводится в два этапа, в результате чего существенно упрощается управление процессом. На первом этапе конденсации сверхазеотропный пар из реактора гидролиза частично конденсируется при низкой температуре и направляется на упомянутое концентрирование хлористого водорода. Не сконденсированные на первом этапе конденсации, содержащие хлористый водород пары из реактора гидролиза, конденсируются на последующем этапе конденсации. Для этого в гидролизный пар подается дополнительная вода. Концентрирование хлористого водорода смещается при этом в направлении азеотропной точки, за счет чего повышается температура конденсации содержащих хлористый водород паров. Предпочтительно применяется технологическая вода процесса для исключения влияния на водный баланс процесса, что ведет к разбавлению регенерированной кислоты.
В области гидрометаллургии в результате растворения руд соляной кислотой получают металлы из руды. Состав разных руд различается от одного месторождения к другому и часто, как правило, концентрация ценных веществ, например, редких земель, лежит в диапазоне частей на миллион, а основным компонентом выступает железо. Также иногда содержатся другие не гидролизуемые хлориды металлов, например, CaCl2, MgCl2, NaCl, KCl, при этом концентрация лежит в диапазоне нескольких весовых процентов.
Кроме того, Harris и др. описывают в "The Jaguar Inc. Sechol Laterite Project Atmospheric Chloride Leach Process", International Laterite Nickel Symposium; 2004" способ выщелачивания руд, при котором добавляются соли хлоридов металлов, например, хлорид магния, в большой концентрации для увеличения активности свободной соляной кислоты во время процесса выщелачивания. Также и в этом случае ценное вещество, которым в данном случае выступает никель, перекрывается по концентрации другим не гидролизуемым хлоридом металла, т.е. хлоридом магния.
Для извлечения ценных веществ из железосодержащего раствора соляной кислоты, концентрация которых в этом растворе является малой по отношению к другим не гидролизуемым хлоридам металлов, необходимо проводить концентрирование не гидролизуемых хлоридов металлов путем гидролиза трехвалентного железа и избирательную кристаллизацию согласно изобретению повышением концентрации свободного хлористого водорода в этом растворе в несколько стадий.
Железосодержащий раствор соляной кислоты направляется в реактор гидролиза, в котором в результате гидролиза трехвалентного железа образуется оксид железа, предпочтительно гематит, и хлористый водород. При этом концентрируются не гидролизуемые хлориды металлов. Концентрация не гидролизуемых хлоридов металлов в концентрированном железосодержащем растворе соляной кислоты составляет не более 30 вес. %, предпочтительно не более 20 вес. %, причем концентрация хлорида железа (III) в названном растворе составляет от 30 до 80 вес. %, предпочтительно от 40 до 75 вес. %. При этом реактор гидролиза эксплуатируется при температурах от 150 до 300°С, предпочтительно от 160 до 200°С, и давлении от -0,8 до 20 бар, предпочтительно от -0,5 до 10 бар. Концентрация хлористого водорода в гидролизном паре составляет от 10 до 40 вес. %, предпочтительно от 15 до 35 вес. %.
Часть концентрированного железосодержащего раствора соляной кислоты отбирается из реактора гидролиза, а осажденное железо в виде его оксида, предпочтительно гематита, отфильтровывается. При этом имеется возможность охлаждения и при необходимости разбавления указанного железосодержащего раствора соляной кислоты перед последующими технологическими стадиями, такими, как фильтрация или кристаллизация, для предупреждения неконтролируемой кристаллизации хлорида железа (III). Отфильтрованный железосодержащий раствор соляной кислоты полностью или частично направляется на кристаллизацию. Оставшаяся часть этого раствора насосом подается обратно в реактор гидролиза или на предшествующую технологическую стадию, например, в предварительный испаритель. В реакторе кристаллизации не гидролизуемые хлориды металлов избирательно кристаллизуются путем повышения концентрации свободного хлористого водорода в железосодержащем растворе соляной кислоты и таким образом отделяются от железа. Кристаллизация проводится при температуре от 10 до 200°С, предпочтительно от 20 до 150°С, и давлении от -0,8 до 30 бар, предпочтительно от -0,5 до 20 бар. В железосодержащем растворе соляной кислоты содержится от 10 до 70 вес. %, предпочтительно от 20 до 60 вес. %, хлорида железа (III). Концентрация свободного хлористого водорода в этом растворе повышается не более чем до 50 вес. %, предпочтительно не более чем до 40 вес. %.
Растворимость не гидролизуемых хлоридов металлов непрерывно понижается с повышением концентрации. Предпочтительно концентрация свободного хлористого водорода на первой стадии кристаллизации выбирается такой, чтобы на этой стадии кристаллизации осаждались предпочтительно не гидролизуемые хлориды металлов, содержащие множественные концентрации ценных веществ, причем предел растворимости этих ценных веществ не достигается при имеющейся концентрации свободного хлористого водорода в указанном растворе.
После фильтрации кристаллизованных не гидролизуемых хлоридов металлов железосодержащий раствор соляной кислоты, обогащенный не гидролизуемыми хлоридами металлов, подается во второй реактор гидролиза, в котором дополнительно концентрируются не гидролизуемые хлориды металлов. Регулирование концентрации солей и, следовательно, парожидкостного равновесия в реакторе гидролиза проводится водой, при этом предпочтительна технологическая вода процесса по причине водного баланса. Из второго реактора гидролиза снова отбирается часть железосодержащего раствора соляной кислоты, оксид железа, предпочтительно, гематит, отфильтровывается и на второй стадии кристаллизации кристаллизуются и фильтруются не гидролизуемые хлориды металлов в результате повышения концентрации свободного хлористого водорода.
Является фактом, что более концентрированные хлориды металлов, содержащиеся в первоначальном железосодержащем растворе соляной кислоты, на первой стадии кристаллизации не могут полностью кристаллизоваться и, следовательно, поступают на вторую технологическую стадию. Если показатели концентрации не гидролизуемых хлоридов металлов и ценных веществ существенно разнятся, например, CaCl2: в диапазоне от 1 до 5%, хлориды редкоземельных металлов в диапазоне от 1 до 1000 ч./млн., то при определенных условиях двухстадийный способ оказывается не достаточным для концентрирования указанных ценных веществ, например, редкоземельных металлов, на второй стадии гидролиза настолько, чтобы эти ценные вещества могли кристаллизоваться на второй стадии кристаллизации в результате повышения концентрации свободного хлористого водорода. В этом случае гидролиз и кристаллизацию проводят многократно. После последней стадии кристаллизации отфильтрованный железосодержащий раствор соляной кислоты отводят обратно на одну из предыдущих технологических стадий.
Ниже настоящее изобретение подробнее поясняется с помощью приложенных чертежей, которыми оно не ограничивается. На фиг. 1 представлен способ согласно изобретению, в котором присутствующие в железосодержащем растворе соляной кислоты не гидролизуемые хлориды металлов концентрируются в железосодержащем растворе соляной кислоты и затем на последующей технологической стадии непосредственно и избирательно извлекаются из него.
Железосодержащий раствор соляной кислоты подается по подводящему трубопроводу (1) в реактор 1 гидролиза, в котором протекает реакция гидролиза. При этом находящийся в растворе хлорид железа (III) реагирует с водой с образованием хлористого водорода и оксида железа, предпочтительно гематита, выпадающего в осадок из раствора. Таким образом, концентрируются не гидролизуемые хлориды металлов в железосодержащем растворе соляной кислоты. Часть раствора отбирается из реактора 1 гидролиза и подается по циркуляционному трубопроводу (4) в наружный теплообменник 4, работающий, например, на паре или масле-теплоносителе. При этом раствор перегревается в теплообменнике 4 и выпускается в реактор 1 гидролиза, в результате этого происходит испарение воды и хлористого водорода. Этот гидролизный пар отводится по отводящему трубопроводу (2) из реактора 1 гидролиза и конденсируется в конденсаторе 5. Образующийся регенерат выводится из процесса по отводящему трубопроводу (3) и снова используется на производственном предприятии, в результате чего хлоридный контур замыкается.
Перед собственно отделением не гидролизуемых хлоридов металлов из железосодержащего раствора соляной кислоты путем экстракции растворителем отобранный из реактора 1 гидролиза железосодержащий раствор соляной кислоты подается по подводящему трубопроводу (5) в фильтрующее устройство 2. Осажденный из железосодержащего раствора соляной кислоты оксид железа, предпочтительно гематит, отфильтровывается и по отводящему трубопроводу (6) выводится из процесса. Полученный при этом железосодержащий фильтрат соляной кислоты по меньшей мере частично подается по подводящему трубопроводу (8) в устройство 3 для экстракции растворителем. Оставшийся фильтрат подается по перепускному трубопроводу (7) обратно в реактор 1 гидролиза.
В устройстве 3 железосодержащий раствор соляной кислоты приводится в прямой контакт с одной или несколькими не смешиваемыми с ним органическими фазами. Не гидролизуемые хлориды металлов избирательно экстрагируются из железосодержащего фильтрата соляной кислоты в органическую или органические фазы. Освобожденный от не гидролизуемых хлоридов металлов железосодержащий раствор соляной кислоты подается затем из устройства 3 по перепускному трубопроводу (9) обратно в реактор 1 гидролиза. Образующийся органический раствор, содержащий экстрагированные хлориды металлов, по подводящему трубопроводу 10 подается в устройство 6 для реэкстрагирования органической фазы. По подводящему трубопроводу (12) вода подается в устройство 6 для реэкстрагирования органической фазы. Экстрагированные хлориды металлов экстрагируют из органической фазы в водную фазу, водная фаза, содержащая хлориды металлов, по отводящему трубопроводу (13) подается далее для извлечения металлов. Освобожденная от не гидролизуемых хлоридов металлов органическая фаза отводится обратно из устройства 6 по перепускному трубопроводу (11) в устройство 3 для экстракции растворителем.
На фиг. 2 показан другой вариант осуществления способа согласно изобретению, в котором присутствующие в железосодержащем растворе соляной кислоты не гидролизуемые хлориды металлов концентрируются и затем на последующей технологической стадии железо избирательно извлекается посредством экстракции растворителем непосредственно из железосодержащего раствора соляной кислоты. Не упомянутые явно трубопроводы и устройства с такими же номерами позиций поясняются в описании фигуры 1.
В принципе этот способ аналогичен представленному на фиг. 1 способу, при этом в устройстве 3 для экстракции растворителем остаточное, содержащееся в растворе железо также экстрагируют из водной фазы в органическую. Оставшиеся в водной фазе хлориды металлов направляются по отводящему трубопроводу (13) на другие стадии обработки. Содержащая железо фаза подается по подводящему трубопроводу (10) в устройство 6 для реэкстрагирования органической фазы и приводится в контакт с водой, подаваемой по подводящему трубопроводу (12) в устройство 6. Содержащееся в органической фазе железо экстрагируется в водную фазу и по перепускному трубопроводу (9) подается обратно в реактор 1 гидролиза.
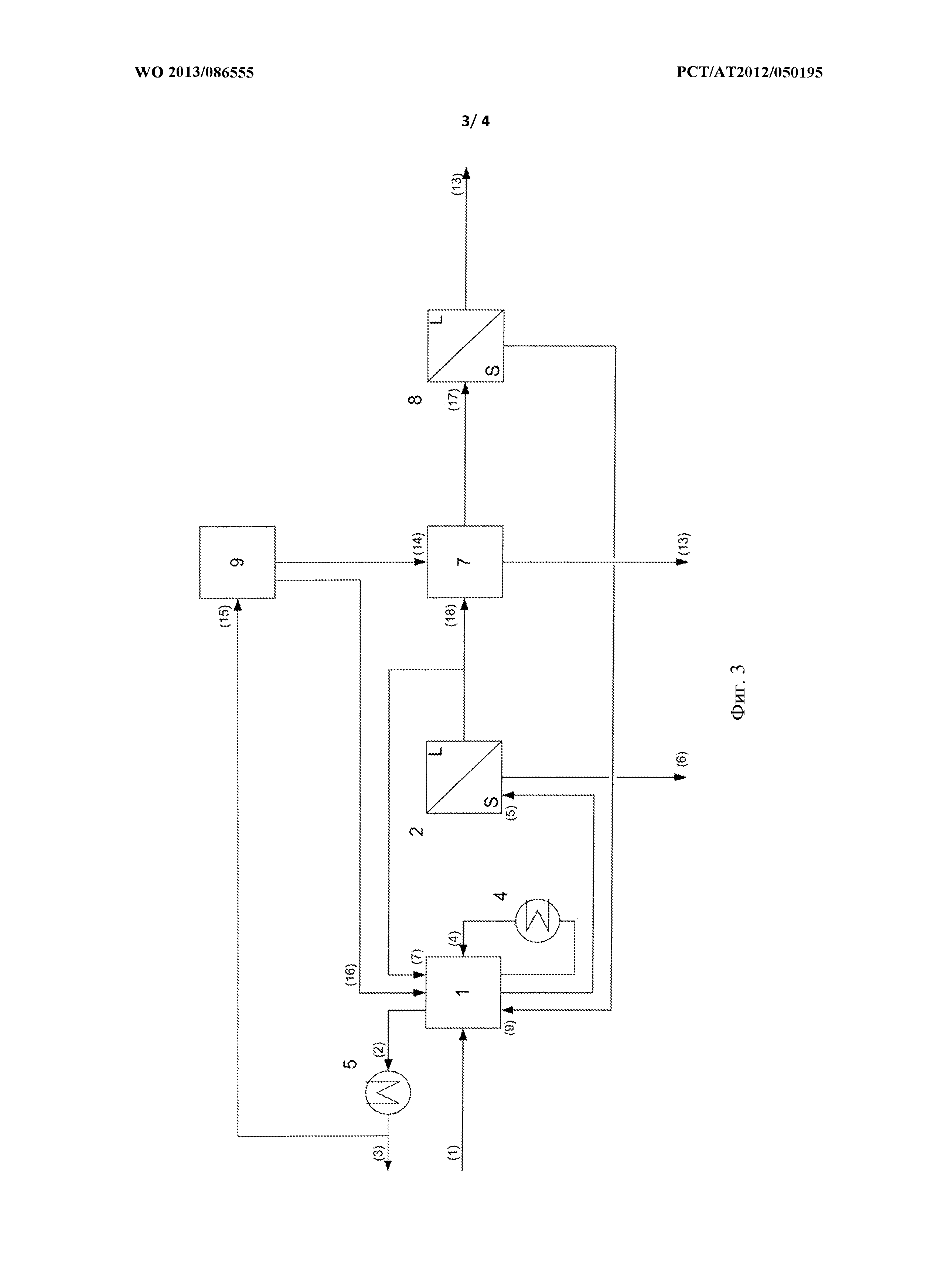
На фиг. 3 представлен еще один вариант осуществления способа согласно изобретению, в котором присутствующие в железосодержащем растворе соляной кислоты не гидролизуемые хлориды металлов концентрируют в этом растворе и затем на следующей технологической стадии эти не гидролизуемые хлориды металлов в виде солей хлоридов металлов переводят в осадок путем повышения концентрации соляной кислоты в концентрированном железосодержащем растворе соляной кислоты. Не упомянутые явно трубопроводы и устройства с такими же номерами позиций поясняются в описании фиг. 1.
Хлориды металлов, присутствующие в обрабатываемом железосодержащем растворе соляной кислоты, концентрируют, аналогично обоим описанным выше вариантам способа, в реакторе 1 гидролиза. После фильтрации оксида железа, предпочтительно гематита, в фильтрующем устройстве 2 железосодержащий фильтрат соляной кислоты перекачивается по подводящему трубопроводу (18) в реактор 7 кристаллизации. По подводящему трубопроводу (14) регенерированный хлористый водород поступает из устройства 9 для концентрирования хлористого водорода в реактор 7 кристаллизации, в котором благодаря низкой растворимости не гидролизуемых хлоридов металлов последние в виде солей хлоридов металлов выпадают в осадок из раствора. По подводящему трубопроводу (17) этот железосодержащий раствор соляной кислоты вместе с осажденными солями хлоридов металлов перекачивается в устройство 8 для фильтрации солей металлов. По перепускному трубопроводу (9) фильтрат перекачивается обратно в реактор гидролиза, соли хлоридов металлов отводятся по отводящему трубопроводу (13).
Для получения необходимого для кристаллизации хлористого водорода часть произведенного в конденсаторе 5 регенерата подается по подводящему трубопроводу (15) в устройство 9 для концентрирования хлористого водорода. По перепускному трубопроводу (16) вода, образовавшаяся при концентрировании хлористого водорода, подается для компенсации водного баланса обратно в реактор 1 гидролиза.
Другой вариант осуществления настоящего изобретения приведен на фиг. 4. Смешанный с не гидролизуемыми хлоридами металлов железосодержащий раствор соляной кислоты поступает по подводящему трубопроводу (20) в предварительный испаритель 10. Кроме того, перепускной трубопровод (9) для железосодержащего раствора соляной кислоты сообщен с предварительным испарителем 10, но может быть также сообщен в возможном варианте осуществления с реактором 1 гидролиза. В предварительном испарителе 10 указанный железосодержащий раствор соляной кислоты концентрируется. Необходимая для этого энергия обеспечивается за счет конденсации содержащих хлористый водород паров из реактора 1 гидролиза. В качестве возможного варианта осуществления через конденсатор 5 проведен циркуляционный трубопровод (19) предварительного испарителя. Таким образом, железосодержащий раствор соляной кислоты в предварительном испарителе 10 служит хладагентом для конденсируемых в конденсаторе 5, содержащих хлористый водород паров из реактора 1 гидролиза.
Из предварительного испарителя 10 пары отводятся по отводящему трубопроводу (21) и конденсируются в конденсаторе 11 предварительного испарителя.. Образующийся при этом дистиллят собирают и подают по перепускному трубопроводу для воды 16 для использования в процессе. С одной стороны, вода требуется для реактора 1 гидролиза для регулирования концентрации железосодержащего раствора соляной кислоты. С другой стороны, вода требуется для разбавления отобранного из реактора 1 гидролиза железосодержащего раствора соляной кислоты после его фильтрации для исключения не контролируемой кристаллизации хлорида железа (III) при охлаждении этого раствора. Избыточная вода вместе с соляной кислотой, образовавшейся в устройстве 9 для получения хлористого водорода, выводится из процесса по отводящему трубопроводу (3).
Здесь необходимо отметить, что этот вариант способа согласно изобретению имеет замкнутый водный баланс. Важно по возможности исключить, чтобы извне в процесс не поступала вода. При рассмотрении пределов баланса отмечается, что вода и хлориды в процесс поступают исключительно по трубопроводу (20), при этом несмотря на потери хлоридов вследствие удаления не гидролизуемых хлоридов металлов из процесса по отводящему трубопроводу (13), хлориды и вода в качестве регенерата выводятся из процесса по отводящему трубопроводу (3). Таким образом автоматически устанавливается та концентрация хлористого водорода в регенерате, которая первоначально была применена в производственном процессе. Вода, дополнительно поступающая извне в процесс, неизбежно приводит к разбавлению регенерата.
По подводящему трубопроводу (1) концентрированный железосодержащий раствор соляной кислоты поступает из предварительного испарителя 10 в реактор 1 гидролиза. В этом реакторе 1 гидролиза происходит гидролиз, при котором хлорид железа (III) непосредственно в растворе с помощью воды превращается в оксид железа, предпочтительно гематит, выпадающий в осадок из раствора, и хлористый водород. Вода и хлористый водород путем испарения выводятся из реактора 1 гидролиза по отводящему трубопроводу (2). Подвод энергии производится снаружи, при этом в циркуляционный трубопровод (4) реактора гидролиза встроен теплообменник 4. Этот теплообменник 4 работает на паре или масле-теплоносителе или на других передающих энергию средах.
Одновременно в реакторе 1 гидролиза происходит концентрирование не гидролизуемых хлоридов металлов, так как они остаются в растворе, в то время как железо в виде его оксида, предпочтительно, гематита, осаждается из раствора, а вода и хлористый водород удаляются из раствора.
Для регулирования концентрации хлоридов металлов в железосодержащем растворе соляной кислоты в реакторе 1 гидролиза часть сконденсированных паров из предварительного испарителя подается по перепускному трубопроводу (16) в реактор 1 гидролиза.
Парожидкостное равновесие в реакторе 1 гидролиза имеет решающее значение для параметров процесса. Важным фактором парожидкостного равновесия служит наряду с концентрацией хлорида железа (III) в железосодержащем растворе соляной кислоты в реакторе 1 гидролиза также концентрация не гидролизуемых хлоридов металлов.
Содержащие хлористый водород пары со сверхазеотропной концентрацией хлористого водорода конденсируются в конденсаторе 5. Высвобождающееся при конденсации тепло используется для обогрева предварительного испарителя 10. В данном примере температурный уровень используемого хладагента, железосодержащего раствора соляной кислоты, в предварительном испарителе 10 является достаточно низким для достижения полной конденсации содержащих хлористый водород паров из реактора 1 гидролиза. Теперь полностью сконденсированные, содержащие хлористый водород пары из реактора 1 гидролиза поступают по подающему трубопроводу (15) в устройство 9 для получения хлористого водорода. Устройство 9 для получения хлористого водорода может быть выполнено в виде сверхазеотропной колонны в том случае, когда концентрация хлористого водорода в содержащем его паре из реактора 1 гидролиза является сверхазеотропным. В качестве головного продукта концентрированный хлористый водород при концентрации не менее 70 вес. %, предпочтительно не менее 80 вес. %, поступает по подводящему трубопроводу (14) в реактор 7 кристаллизации. Концентрация хлористого водорода в кубовом продукте сверхазеотропной колонны характеризуется по меньшей мере азеотропным составом при рабочем давлении в сверхазеотропной ректификационной колонне. Невозможно путем сверхазеотропной ректификации пройти через азеотропную точку. Упомянутый кубовый продукт вместе с остатками сконденсированных паров из предварительного испарителя 10 в виде регенерата выводится из процесса по отводящему трубопроводу (3).
Из реактора 1 гидролиза часть железосодержащего раствора соляной кислоты подается по подводящему трубопроводу (5) в фильтрующее устройство 2. Образовавшийся в реакторе 1 гидролиз 1 оксид железа, предпочтительно гематит, отфильтровывается из железосодержащего раствора соляной кислоты и выводится по отводящему трубопроводу (6) из процесса. По меньшей мере часть фильтрата подается по подводящему трубопроводу (18) из фильтрующего устройства 2 в реактор 7 кристаллизации. Остальная часть фильтрата перекачивается обратно по перепускному трубопроводу (7) для фильтрата в реактор 1 гидролиза. В целях исключения неконтролируемой кристаллизации хлорида железа (III) при охлаждении фильтрата последний разбавляют водой. При этом в данном примере сконденсированный пар из предварительного испарителя подается по перепускному трубопроводу (16) и смешивается перед реактором 7 кристаллизации с фильтратом. Упомянутый перепускной трубопровод (16) может быть подключен непосредственно после места отбора железосодержащего раствора соляной кислоты из реактора 1 гидролиза или в любом другом месте.
В реакторе 7 кристаллизации не гидролизуемые хлориды металлов кристаллизуются из раствора вследствие повышения концентрации свободного хлористого водорода в железосодержащем растворе. Обработанный хлористый водород поступает из устройства для производства хлористого водорода по подводящему трубопроводу (14) в реактор 7 кристаллизации. По подводящему трубопроводу (17) железосодержащий раствор соляной кислоты, содержащий выпавшие в осадок не гидролизуемые хлориды металлов, подается в устройство 8 для фильтрации хлоридов металлов. Твердые хлориды металлов отфильтровываются в устройстве 8 для фильтрации хлоридов металлов, по отводящему трубопроводу (13) выводятся из процесса и дополнительно обрабатываются на других технологических стадиях. По перепускному трубопроводу (9) фильтрат поступает в предварительный испаритель.
Пример 1
В примере 1 речь идет об определении парожидкостного равновесия хлорида марганца в качестве не гидролизуемого элемента в концентрированном растворе хлорида железа (III) при атмосферно давлении. На обогреваемом снаружи стеклянном реакторе установлен обратный холодильник. Исследуемая жидкость помещается в реактор и доводится до кипения. Температура постоянно записывается. После установления равновесия анализируется состав концентрированного раствора хлорида железа (III) в стеклянном реакторе и дистилляте. Температура кипения записывается также в момент отбора пробы.
Была выбрана опытная матрица, в которой общая концентрация солей металлов (хлорида марганца и хлорида железа (III)) составляла 76 вес. %. Очевидно концентрация хлорида железа (III) понижается с увеличением концентрации хлорида марганца в растворе.
С увеличением концентрации хлорида марганца понижается концентрация хлористого водорода в паровой фазе, а также снижается температура кипения.
Приведенные результаты показывают, что на парожидкостное равновесие существенное влияние оказывает присутствие не гидролизуемых хлоридов металлов.
Пример 2
При последующем опыте определяли давление пара хлорида никеля в растворе

хлорида железа (III). Опыты проводились при общей концентрации солей 75 вес. %.

В противоположность парожидкостным опытам с хлоридом марганца температура кипения хлорида никеля возрастает с увеличением концентрации, при этом концентрация хлористого водорода в паровой фазе падает.
Пример 3
При повышении общей концентрации солей температура кипения и концентрация хлористого водорода в паровой фазе повышаются. Концентрированный водный раствор хлорида железа (III) с содержанием хлорида железа (III) 72,8 вес. % и никеля 4,6 вес. % имел точку кипения 184°С. Концентрация хлористого водорода в паре составила 27,6 вес. %.
Пример 4
В примере 4 проводился полунепрерывный гидролиз. В обогреваемый стеклянный реактор поместили чистый синтетический раствор хлорида железа (III) при содержании 75 вес. %. Пар подавали через дистилляционный мостик и конденсировали. Конденсат собирали. Раствор в реакторе гидролиза довели до кипения. По достижении температуры кипения подключили питание к реактору гидролиза. Состав питающего раствора: 30 вес. % хлорида железа (III) и 2 вес. % хлорида никеля. Количество питающего раствора регулировали, в результате чего температура кипения в стеклянном реакторе сохранялась постоянной и равной 170°С. Опыт проводился в течение 3 часов, концентрация хлорида никеля в железосодержащем гидролизном растворе соляной кислоты составила 1,1 вес. % в конце опыта. В целом было произведено около 200 г оксида железа. С помощью масс-спектроскопии тлеющего разряда (GDMS=glow discharge mass spectroscopy) определили концентрацию никеля в оксиде железа, которая составила 200 ч./млн. Этот опыт показал, что никель не гидролизуется и поэтому может концентрироваться в реакторе гидролиза.
Пример 5
В примере 5 проводились опыты по кристаллизации при осаждении хлорида никеля из железосодержащего раствора соляной кислоты. В реактор кристаллизации поместили синтетический раствор из хлорида железа (III) и хлорида никеля. В начале опыта раствор содержал 47 вес. % хлорида железа (III) и 11 вес. % хлорида никеля. В реактор подали чистый хлористый водород и растворили в железосодержащем растворе соляной кислоты. Опыты проводили при 60°С. Термостатирование проводилось снаружи с помощью термостатов.

В таблице показано, как концентрация хлорида никеля и хлорида железа меняется с повышением концентрации хлористого водорода. В начале в растворе снижается концентрация как хлорида никеля, так и хлорида железа. В результате растворения хлористого водорода в растворе «разбавляются» оба хлорида металлов. При концентрации свободного хлористого водорода от 5 вес. % достигается предел растворимости хлорида никеля и происходит кристаллизация. Поскольку потеря массы в железосодержащем растворе соляной кислоты вследствие кристаллизации хлорида никеля не компенсируется прибавлением массы при растворении хлористого водорода, то с этого момента снова повышается концентрация хлорида железа (III). После того, как хлорид никеля почти полностью выпал в осадок из раствора, концентрация хлорида железа (III) снова падает из-за увеличения концентрации свободного хлористого водорода.
По окончании опыта раствор отфильтровали. Кек растворили в воде и анализировали с помощью ICP-OES (оптической эмиссионной спектроскопии с индуктивно связанной плазмой). При этом следует учитывать, что для анализа кек не промывали. В кеке содержалось 37% никеля, 5,7% железа и 45% хлора. Остальное - кристаллизационная вода.
Опыт показал, что возможно избирательно кристаллизовать не гидролизуемый хлорид металла из раствора хлорида железа (III).
Для сравнения в последующей таблице приведена растворимость хлорида никеля в системе NiCl2-HCl-H2O при 80°С (Solubilities on Inorganic and Metalorganic Compounds (Растворимость неорганических и металлоорганических компонентов); Seidell и Linke; 1965).


При концентрации хлористого водорода 26,2 вес. % в системе NiCl2-HCl-H2O растворимость хлорида никеля составила 8,63 вес. %. Т.е. предел растворимости хлорида никеля снизился из-за присутствия хлорида железа (III). Для сравнения растворимость хлорида никеля составляет 0,3 вес. % при содержании 39,2 вес. % хлорида железа (III) и 20,4 вес. % свободного хлористого водорода.
Пример 6
Был проведен дополнительный опыт по кристаллизации, при котором использовался железосодержащий раствор соляной кислоты, содержащий два не гидролизуемых хлорида металлов, а именно хлорид никеля и хлорид кобальта.

Результаты показывают, что отделение не гидролизуемых хлоридов металлов от раствора хлорида железа (III) путем кристаллизации возможно также при наличии двух не гидролизуемых хлоридов металлов. Не промытый кек в конце опыта содержал в себе 9,2% железа, 8,5% кобальта, 15,2% никеля и 45% хлора. Остальное - присутствующая кристаллизационная вода.
Пример 7
Был проведен еще один опыт на кристаллизацию хлорида церия (III).

Не промытый кек, полученный по окончании опыта, содержал 3,5 вес. % железа, 34,2 вес. % церия и 32 вес. % хлора. Остальное - кристаллизационная вода.
Этот опыт показал, что хлориды редкоземельного металла церия могут быть отделены от железосодержащего хлористоводородного раствора избирательной кристаллизацией с помощью хлористого водорода. Пример 8
В примере 8 показан баланс варианта осуществления способа согласно изобретению, представленного на фиг. 4, при котором обрабатывался железосодержащий раствор соляной кислоты, смешанный с не гидролизуемыми хлоридами металлов, а именно с хлоридом никеля. Присутствующий в железосодержащем растворе соляной кислоты хлорид никеля сначала подвергся концентрированию в реакторе гидролиза и на последующей технологической стадии этот хлорид никеля кристаллизовали повышением концентрации свободного хлористого водорода в железосодержащем растворе соляной кислоты в реакторе кристаллизации и таким образом отделили от железа.
Способ позволяет обрабатывать в час 1000 кг железосодержащего раствора соляной кислоты, поступавшего по подводящему трубопроводу (20) предварительного испарителя в предварительный испаритель 10. Этот железосодержащий раствор соляной кислоты состоял из 25 вес. % хлорида железа (III) и 1 вес. % хлорида никеля. В предварительном испарителе 10 происходило концентрирование железосодержащего раствора соляной кислоты путем выпаривания. Необходимая для этого энергия, 500 кВт, обеспечивалась за счет конденсации содержащих хлористый водород паров из реактора 1 гидролиза. Выпаривание проводилось при пониженном давлении с тем, чтобы можно было понизить точку кипения в предварительном испарителе 10 до около 60°С. С предварительным испарителем 10 был сообщен перепускной трубопровод (9) для железосодержащего раствора соляной кислоты из устройства 8 для фильтрации хлоридов металлов. Массовый поток этого технологического перепускного трубопровода составлял 450 кг/ч и состоял из 44 вес. % хлорида железа (III), 0,5 вес. % хлорида никеля и 15 вес. % хлористого водорода.
Из предварительного испарителя 10 по отводному трубопроводу (21) предварительного испарителя отводилось 775 кг/ч паров, содержащих около 6 вес. % хлористого водорода, которые конденсировались в конденсаторе 11 предварительного испарителя. Высвобождающаяся при конденсации энергия в количестве 510 кВт отводилась с помощью охлаждающей воды. Сконденсированные пары подавались во время процесса по перепускному трубопроводу (16) для воды в реактор 1 гидролиза для регулирования концентрации солей (515 кг/ч) и в реактор 7 кристаллизации для разбавления (125 кг/ч). Остаточная вода (135 кг/ч) поступала в отводящий трубопровод (16) для регенерата и смешивалась с соляной кислотой, отводимой из устройства 9 для производства хлористого водорода.
Здесь необходимо отметить, что этот способ имеет замкнутый водный баланс.
Привнесение воды извне неизбежно автоматически приводит к разбавлению регенерата. Вода и хлориды, связанные в хлориды металлов, подаются в процесс исключительно в виде железосодержащего раствора соляной кислоты по подводящему трубопроводу предварительного испарителя 10. Несмотря на потери хлоридов из-за удаления хлорида никеля из процесса по отводящему трубопроводу (13) для хлоридов металлов, хлориды и вода в виде соляной кислоты отводятся из процесса по отводящему трубопроводу (3) для регенерата. Таким образом, автоматически обеспечивается та концентрация хлористого водорода в регенерате, которая применялась в производственном процессе.
Из предварительного испарителя 10 по подводящему трубопроводу (1) для реактора гидролиза перекачивается около 675 кг/ч концентрированного железосодержащего раствора соляной кислоты в реактор 1 гидролиза. В данном железосодержащем растворе соляной кислоты содержится около 66 вес. % хлорида железа (III), 1,9 вес. % хлорида никеля и 3 вес. % свободного хлористого водорода.
В реакторе 1 гидролиза происходит гидролиз, при котором хлорид железа (III) вступает в реакцию с водой и образует оксид железа, предпочтительно, гематит, и хлористый водород. Образовавшийся в результате реакции гидролиза хлористый водород и вода удаляются из железосодержащего раствора соляной кислоты выпариванием. Необходимая для этого тепловая энергия составляет 590 кВт. Поскольку хлорид никеля в реакторе 1 гидролиза не гидролизуется, но одновременно при гидролизе из железосодержащего раствора соляной кислоты выпадает в осадок железо в виде его оксида, предпочтительно гематита, причем вода и хлористый водород выпариваются, то происходит концентрирование хлорида никеля в реакторе 1 гидролиза. Железосодержащий раствор соляной кислоты в реакторе 1 гидролиза содержит 73 вес. % хлорида железа (III) и 4,6 вес. % хлорида никеля. Состав содержащего хлористый водород пара зависит от парожидкостного равновесия над железосодержащим раствором соляной кислоты в реакторе 1 гидролиза. Важными факторами наряду с концентрацией хлорида железа (III) являются также показатели концентрации не гидролизуемых хлоридов металлов. Равновесная концентрация хлористого водорода в паре над упомянутым выше железосодержащим раствором соляной кислоты составляет 27,6 вес. % при температуре кипения 183°С. Для обеспечения возможности поддержания постоянной концентрации солей в реакторе 1 гидролиза необходимо дополнительно подавать 515 кг/ч воды по перепускному трубопроводу (16) для воды в реактор 1 гидролиза.
Из реактора 1 гидролиза 790 кг/ч содержащих хлористый водород паров по отводному трубопроводу (2) реактора гидролиза поступает в теплообменник 5, в котором они полностью конденсируются. Высвобождающаяся при конденсации энергия, 500 кВт, используется для обогрева предварительного испарителя 10. Для полной конденсации содержащих хлористый водород паров из реактора 1 гидролиза с концентрацией хлористого водорода 27,6 вес. % конденсация проводится при температуре от 107,6 до 101°С. Температура кипения в предварительном испарителе 10 понижается до 60°С за счет создания пониженного давления для обеспечения теплопередачи в теплообменнике 5.
После теплообменника 5 полностью сконденсированные, содержащие хлористый водород пары из реактора 1 гидролиза подаются по подводящему трубопроводу (15) для подачи регенерата к устройству для концентрирования хлористого водорода в устройство 9 для производства хлористого водорода. В данном примере указанное устройство 9 для производства хлористого водорода выполнено в виде сверхазеотропной ректификационной колонны. В качестве головного продукта получают 70 кг/ч хлористого водорода с чистотой 95 вес. %, направляемого по подводящему трубопроводу (14) для хлористого водорода в реактор 7 кристаллизации. В качестве кубового продукта производится 720 кг/ч соляной кислоты с концентрацией хлористого водорода 21 вес. %. Упомянутая концентрированная хлористоводородная кислота смешивается с не требующимися для процесса конденсированными парами из предварительного испарителя 10 (135 кг/ч) и выводится из процесса в виде регенерированной кислоты по отводящему трубопроводу (3) для регенерата. Процесс позволяет производить 860 кг/ч соляной кислоты с концентрацией 19 вес. %.
Необходимая для работы сверхазеотропной ректификационной колонны тепловая мощность при обработке хлористого водорода составляет 40 кВт, необходимая холодильная мощность в головной части колонны составляет 10 кВт.
Из реактора 1 гидролиза отбирается 400 кг/ч железосодержащего раствора соляной кислоты, который подается по подводящему трубопроводу (5) для фильтрующего устройства в фильтрующее устройство 2, в котором из железосодержащего раствора соляной кислоты отфильтровывается 120 кг/ч оксида железа, который выводится из процесса по отводящему трубопроводу (6) для оксида железа.
Из фильтрующего устройства 2 270 кг/ч фильтрата поступают по подводящему трубопроводу (18) фильтрующего устройства в реактор 7 кристаллизации. Для предупреждения неконтролируемой кристаллизации хлорида железа (III) при охлаждении фильтрата последний смешивают с конденсированными парами из предварительного испарителя 10 (15 кг/ч). Разбавленный фильтрат содержит 50 вес. % хлорида железа (III) и 3,2 вес. % хлорида никеля.
В реактор 7 кристаллизации по подводящему трубопроводу (14) для хлористого водорода подают 70 кг/ч концентрированного хлористого водорода. Реактор 7 кристаллизации работает при 60°С. При этом концентрацию свободного хлористого водорода в железосодержащем растворе соляной кислоты увеличивают в реакторе 7 кристаллизации до 15 вес. %. В таких рабочих условиях растворимость хлорида никеля составляет 0,6 вес. %.
Хлорид никеля кристаллизуется в виде дигидрата и отфильтровывается в устройстве для фильтрации хлоридов металлов из железосодержащего раствора соляной кислоты. По отводящему трубопроводу (13) для хлоридов металлов из процесса выводится с помощью хлорида железа (III) 14 кг/ч хлорида никеля с 10 вес. % примесей, который поступает на дополнительные технологические стадии для обработки.
Фильтрат из устройства (8) для фильтрации хлоридов металлов отводится обратно по перепускному трубопроводу (9) для железосодержащего раствора соляной кислоты в предварительный испаритель 10. Массовый поток составляет 450 кг/ч и состоит из 44 вес. % хлорида железа (III), 0,6 вес. % хлорида никеля и 15% свободного хлористого водорода.
Перечень позиций
УСТРОЙСТВА
1 реактор гидролиза
2 фильтрующее устройство
3 устройство для экстракции растворителем
4 теплообменник
5 конденсатор
6 устройство для реэкстракции органической фазы
7 реактор кристаллизации
8 устройство для фильтрации хлоридов металлов
9 устройство для производства хлористого водорода
10 предварительный испаритель
11 конденсатор предварительного испарителя
ТРУБОПРОВОДЫ
(1) подводящий трубопровод реактора гидролиза
(2) отводящий трубопровод реактора гидролиза
(3) отводящий трубопровод для регенерата
(4) циркуляционный трубопровод в реакторе гидролиза
(5) подводящий трубопровод фильтрующего устройства
(6) отводящий трубопровод для оксида железа
(7) перепускной трубопровод для фильтрата
(8) подводящий трубопровод устройства для экстракции растворителем
(9) перепускной трубопровод для железосодержащего раствора соляной кислоты
(10) подводящий трубопровод устройства для реэкстракции органической фазы
(11) перепускной трубопровод для органической фазы
(12) подводящий трубопровод для воды
(13) отводящий трубопровод для хлоридов металлов
(14) подводящий трубопровод для хлористого водорода
(15) подводящий трубопровод для регенерата, подаваемого в устройство для концентрирования хлористого водорода
(16) перепускной трубопровод для воды
(17) подводящий трубопровод устройства для фильтрации хлоридов металлов
(18) подводящий трубопровод реактора кристаллизации
(19) циркуляционный трубопровод предварительного испарителя
(20) подводящий трубопровод предварительного испарителя
(21) отводящий трубопровод предварительного испарителя.
Реферат
Изобретение может быть использовано в химической промышленности. Для концентрирования и отделения хлоридов металлов в/из содержащего хлорид железа (III) раствора соляной кислоты хлорид железа (III) превращают путем гидролиза в гематит и осаждают его из указанного раствора. Гематит отфильтровывают в фильтрующем устройстве с получением фильтрата соляной кислоты. Концентрированные негидролизуемые хлориды металлов осаждают из железосодержащего фильтрата соляной кислоты путем повышения концентрации свободного хлористого водорода в растворе. Изобретение позволяет уменьшить концентрацию соляной кислоты и энергопотребление в ходе процесса, увеличить степень регенерации хлористого водорода. 8 з.п. ф-лы, 4 ил., 6 табл., 8 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ получения водной хлоридной жидкости для выщелачивания и устройство для его осуществления

Комментарии