Способ хлорирования и дегидрирования этана - RU2679911C1
Код документа: RU2679911C1
Описание
Уровень техники
Область техники, к которой относится изобретение
Настоящее изобретение относится к технической области химического производства и к способу дегидрирования этана и, в частности, к способу хлорирования и дегидрирования этана.
Описание предшествующего уровня техники
Этан в основном присутствует и его получают путем отделения от нефтяного газа, природного газа, коксового газа и газа, возникающего при пиролизе нефти. Этан в настоящее время наиболее широко используется в производстве этилена, который в качестве сырья для крекинга при получении этилена является более экономичным, чем более тяжелое сырье. Способ производства этилена с помощью этана по большей части включает паровой пиролиз и окислительную дегидратацию.
Паровой пиролиз является обычным способом получения этилена с помощью этана. Однако паровой пиролиз имеет недостатки в виде высокого потребления энергии, низкой утилизации тепла, строгих требованиях к материалу для оборудования и высоких производственных издержках. Более того, продукт также содержит другие тяжелые олефины, такие как пропилен, бутадиен и ароматические углеводороды, что снижает выход этилена.
По сравнению с процессом парового пиролиза при окислительном дегидрировании этана до этилена условия реакции более мягкие. Однако введение кислорода в технологию окислительного дегидрирования увеличивает количество кислородсодержащих побочных продуктов, а трудность в последующем разделении и очистке, а также селективность и выход этилена являются низкими. В частности, трудоемким является приготовление катализатора, используемого в технологии каталитического окислительного дегидрирования. Например, в Европейской Патентной Заявке № ЕР 20030704717 раскрыт способ каталитического окислительного дегидрирования этана, в котором по меньшей мере оксид Мо, Те, V и Nb связывается с элементом Cu, Та, Sn, Se, W, Ti, Fe, Co, Ni, Cr, Zr, Sb и Bi для получения с помощью ряда процедур катализатора, используемого в окислительном дегидрировании этана. В этом способе превращения этана за один проход составляет 40-60%, а выход этилена 20-60%. В Китайской Патентной Заявке №2012100126547 представлен катализатор для окислительного дегидрирования этана до этилена при низкой температуре. Катализатор содержит газ HCl в качестве основного активного компонента и TiO2 в качестве промотора. Основной активный компонент газа HCl смешивают с сырьевыми газами (воздух и этан) и подают в реактор, где температуру реакции контролируют при 440-550°С, а выход этилена составляет 45-75%.
Раскрытие изобретения
Ввиду технических дефектов, существующих в предшествующем уровне техники, настоящее изобретение предлагает новый способ хлорирования и дегидрирования этана. В настоящем изобретении в качестве сырья для хлорирования и дегидрирования используют хлорид металла с низкой температурой плавления, а в качестве промежуточной среды используют металл с низкой температурой плавления, полученный после реакции. Способ характеризуется простотой процесса, низкой стоимостью и высоким выходом. Кроме того, по желанию на производстве некоторые ацетилены и винилхлориды могут быть получены в виде побочных продуктов одновременно для получения этилена путем контроля соотношения этана к хлориду.
Настоящее изобретение осуществляют с помощью следующих технических решений.
Предложен способ хлорирования и дегидрирования этана, включающий: смешивание и взаимодействие хлорида металла с низкой температурой плавления с С2Н6 так, что хлорид металла с низкой температурой плавления восстанавливают до металла с низкой температурой плавления в жидком состоянии, а С2Н6 хлорируют и дегидрируют, получая смешанный газ, содержащий HCl, С2Н6, С2Н4, С2Н2 и C2H3Cl.
Предпочтительно, хлорид металла с низкой температурой плавления находится в газообразном состоянии при температуре реакции и может быть восстановлен Н2 при температуре реакции для получения металла с низкой температурой плавления в жидком состоянии и хлороводород.. Более предпочтительно, хлорид металла с низкой температурой плавления представляет собой BiCl3 или SnCl2.
Предпочтительно, температура реакции составляет 500-800°С. Более предпочтительно, температура реакции составляет 550-650°С. Температура реакции может составлять 500-600°С, 600-650°С, 650-700°С или 700-800°С.
Предпочтительно, молярное соотношение элементарного хлора в хлориде металла с низкой температурой плавления к С2Н6 составляет 1-4:1.
Молярное соотношение элементарного хлора в хлориде металла с низкой температурой плавления к С2Н6 может составлять 1-2:1, 2-3:1 или 3-4:1. Предпочтительно, время реакции контролируют таким образом, чтобы скорость превращения С2Н6 составляла до 50-99,9%.
Контроль над временем реакции проводят так, что скорость превращения С2Н6, составляющую до 50-99,9%, достигают посредством способа, описанного ниже. Количество непрореагировавшего этана определяют в дегидрированном отработанном газе, собранном за единицу времени, из которого удалили хлоро водород, а скорость превращения С2Н6 рассчитывают по формуле, приведенной ниже. Если скорость превращения С2Н6 менее 50%, то скорость превращения можно увеличить, увеличив время реакции за счет снижения скорости потока этана. Если скорость превращения С2Н6 более 99,9%, то скорость превращения можно уменьшить, уменьшив время реакции за счет увеличения скорости потока этана.
Скорость превращения С2Н6 равна 100% - Молярная концентрация этана в дегидрированом отработанном газе, из которого была удалена хлороводород.
Предпочтительно, способ дополнительно включает: взаимодействие металла с низкой температурой плавления для получения хлорида металла с низкой температурой плавления, а также обратную подачу для смешивания и взаимодействия хлорида металла с низкой температурой плавления с С2Н6.
Более предпочтительно, способ взаимодействия металла с низкой температурой плавления для получения хлорида металла с низкой температурой плавления выбирают среди одного из:
способа 1: взаимодействие металла с низкой температурой плавления с хлором для получения хлорида металла с низкой температурой плавления;
способа 2: взаимодействие металла с низкой температурой плавления с кислородом или воздухом для получения оксида металла; и поглощение HCl, полученного после хлорирования и дегидрирования С2Н6 оксидом металла, для получения хлорида металла с низкой температурой плавления; а также
способа 3: когда хлорид металла с низкой температурой плавления представляет собой SnCl2, взаимодействие Sn с низкой температурой плавления, полученного в результате восстановления SnCl2, с соляной кислотой для получения хлорида металла с низкой температурой плавления, то есть SnCl2, и Н2.
Предпочтительно, данный способ дополнительно включает использование HCl в смешанном газе, содержащем HCl, С2Н6, C2H4, С2Н2 и C2H3Cl с помощью любого из:
способа 1: поглощение HCl водой для получения соляной кислоты как продукта;
способа 2: применение HCl при окислении и хлорировании С2Н4 для получения дихлорэтана; и
способа 3: каталитическое окисление HCl кислородом или воздухом в Cl2 и обратная подача для взаимодействия с металлом с низкой температурой плавления для получения хлорида металла с низкой температурой плавления.
Предпочтительно, смешанный газ, из которого отделяют HCl, дополнительно разделяют для получения С2Н4, С2Н2 и C2H3Cl как продукта соответственно. Смешанный газ, из которого отделен HCl, может быть дополнительно разделен традиционным способом, таким как ректификация, для получения С2Н4, С2Н2 и C2H3Cl соответственно. Основным принципом, лежащим в основе способа хлорирования и дегидрирования этана в соответствии с настоящим изобретением, является:
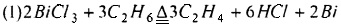
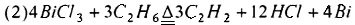
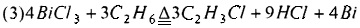
или
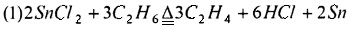
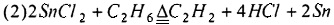
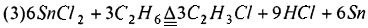
Настоящее изобретение имеет по меньшей мере один из следующих полезных эффектов.
(1) Хлорид металла с низкой температурой плавления используют в качестве дегидрирующего материала для хлорирования и дегидрирования этана реакцией в газовой фазе. Реакция протекает быстро, ее эффективность высокая, и реакция может быть завершена моментально за несколько секунд. Поэтому этот способ применим и для использования в массовом промышленном производстве.
(2) Промежуточное соединение реакции представляет собой металл с низкой температурой плавления в жидком состоянии, который легко транспортировать и отделять, и механизм реакции является простым и практически осуществимым.
(3) Различные пропорции С2Н4, С2Н2 и C2H3Cl могут быть получены путем контроля скорости превращения С2Н6 за один проход. Скорость превращения С2Н6 за один проход может составлять до 98% или выше. Когда этилен является целевым продуктом, селективность для этилена может достигать до 95% или выше. При использовании глубокого дегидрирования можно получить 10% или более С2Н2 или C2H3Cl. Таким образом, настоящий способ является эффективным способом для прямого синтеза C2H3Cl.
(4) Тепло, выделяемое при окислении и хлорировании металла, может быть непосредственно использовано при испарении хлорида и дегидрировании этана, в результате чего энергия сохраняется.
Подробное описание предпочтительных воплощений
Технические решения настоящего изобретения теперь будут описаны с помощью конкретных примеров. Следует понимать, что один или несколько стадий процесса, упомянутых в настоящем изобретении, не исключают наличия других стадий процесса, идущих до или после комбинированных стадий, или другие стадии процесса также могут быть добавлены между упомянутыми стадиями. Следует понимать, что эти примеры являются просто иллюстрацией настоящего изобретения и не ограничивают объем его настоящего изобретения. Если не указано иное, нумерация каждой стадии способа предоставлена только для удобства идентификации стадий этого процесса, а не для ограничения порядка стадий процесса или ограничения объема реализации настоящего изобретения, и изменение или корректировка относительной взаимосвязи между ними без существенного изменения технической составляющей предусмотрена в объеме реализации настоящего изобретения.
Пример 1:
(1) Пары BiCl3 смешивали с С2Н6 и контролировали время реакции, так что скорость превращения С2Н6 составляла 50%. Молярное соотношение элемента хлора в BiCl3 к С2Н6 составляло 1:1, а температура реакции составляла 500°С. С2Н6 хлорировали и дегидрировали для получения смешанного газа, содержащего HCl, С2Н6, С2Н4, С2Н2 и C2H3Cl, a BiCl3 восстанавливали до жидкого состояния Bi.
(2) Хлор барботировали через расплав металла Bi, полученный на стадии 1) для превращения Bi в BiCl3 для непрерывной реакции с этаном.
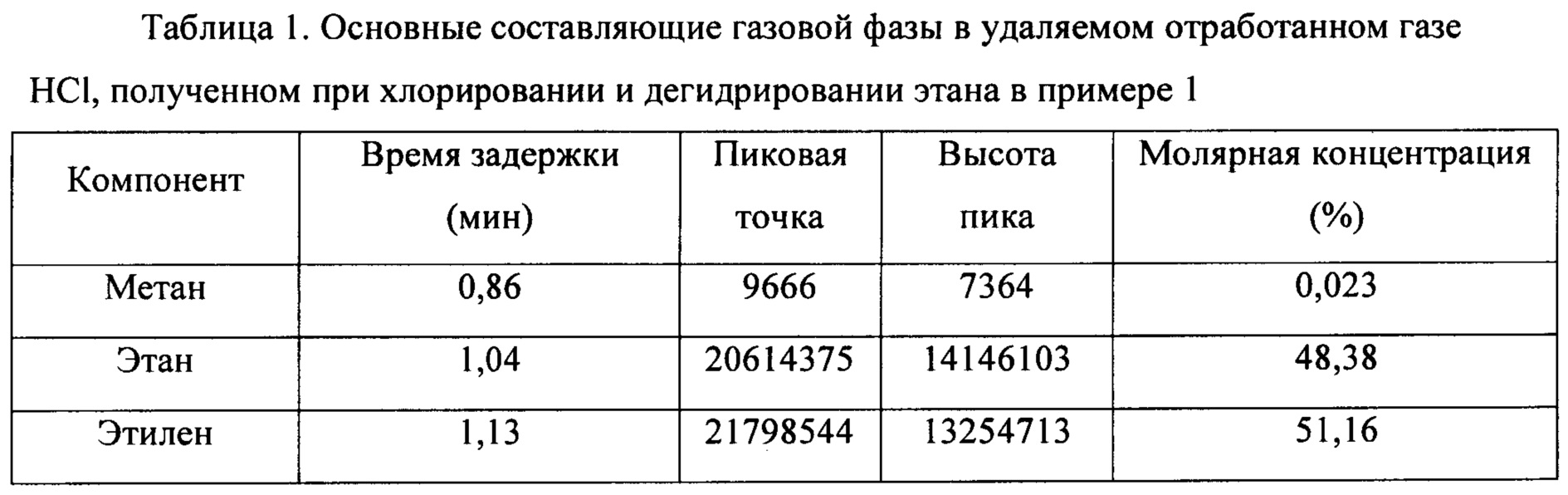
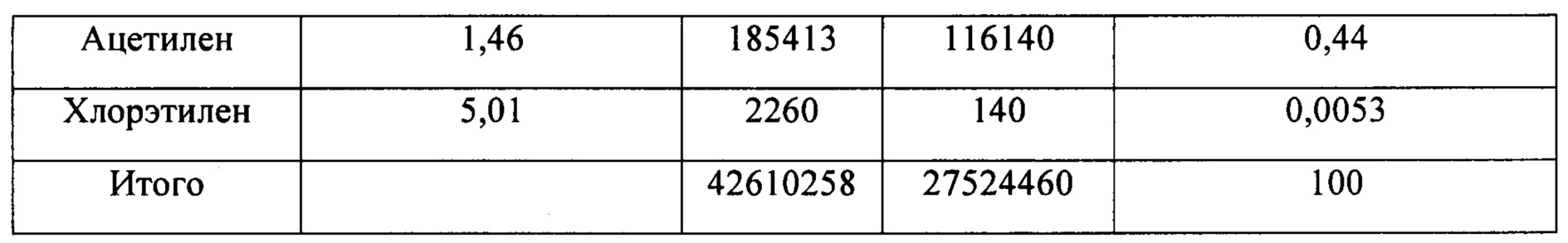
(3) HCl в смешанном газе, содержащем HCl, С2Н6, С2Н4, С2Н2 и C2H3Cl, полученном на стадии 1), абсорбировали водой для получения смешанного газа, содержащего С2Н6, С2Н4, С2Н2 и C2H3Cl и т.д, и соляной кислоты как побочного продукта. Основные составляющие содержащего HCl удаляемого отработанного газа, полученного при хлорировании и дегидрировании этана, показаны в таблице 1.
Пример 2
(1) Пары BiCl3 смешивали с С2Н6, и время реакции контролировали так, что скорость превращения С2Н6 составляла 74%. Контролировали, что молярное соотношение элемента хлора в BiCl3 к С2Н6 составляло 2:1, а температура реакции составляла 600°С. С2Н6 хлорировали и дегидрировали для получения смешанного газа, содержащего HCl, С2Н6, С2Н4, С2Н2 и C2H3Cl, a BiCl3 восстановливали до жидкого состояния Bi.
(2) Кислород барботировали через расплав металла Bi, полученный на стадии 1), чтобы превратить Bi в Bi2O3, а HCl, полученный на стадии (1), впоследствии абсорбировали Bi2O3, чтобы получить BiCl3 для непрерывной реакции с этаном.
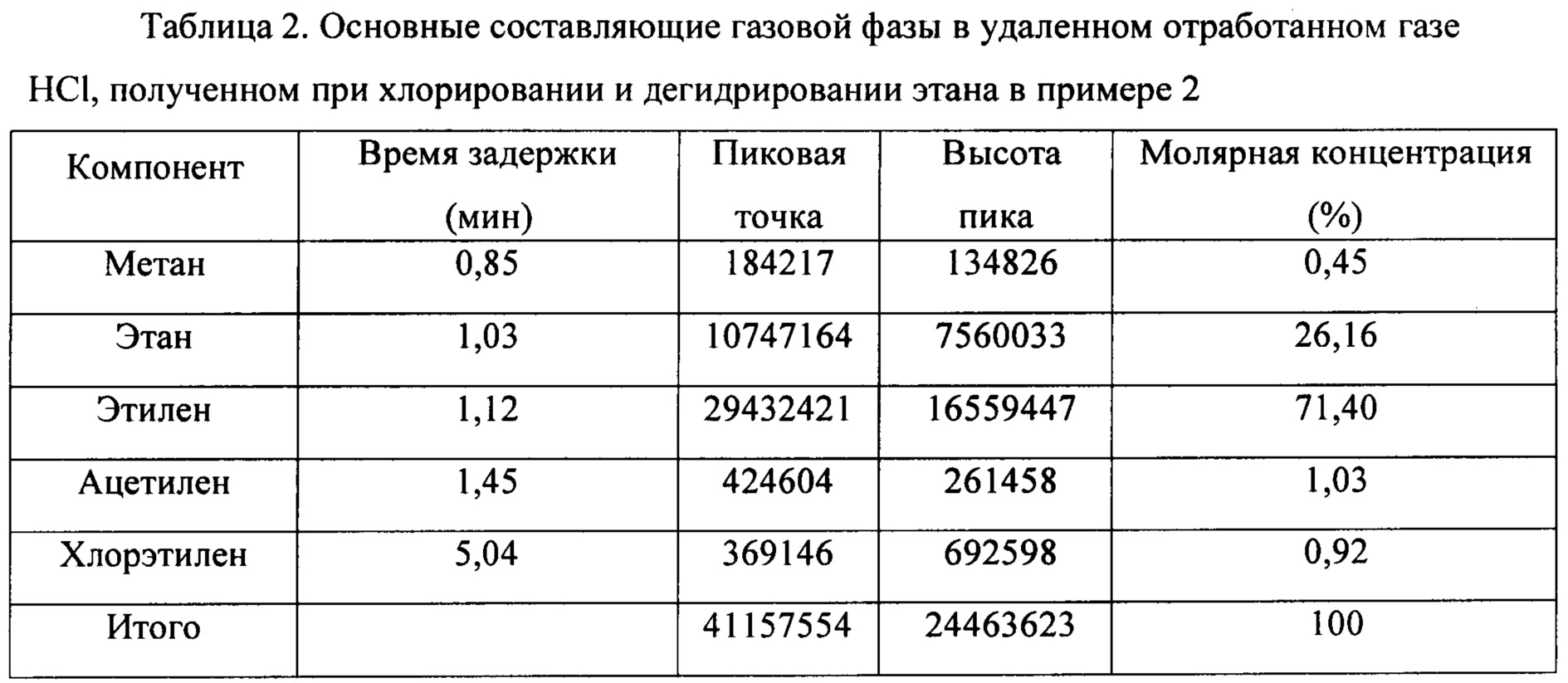
(3) HCl в смешанном газе, содержащем HCl, С2Н6, С2Н4, С2Н2 и C2H3Cl, полученном на стадии 1), абсорбировали слоем Bi2O3 для получения смешанного газа, содержащего С2Н6, С2Н4, С2Н2 и C2H3Cl и т.д. Основные составляющие в удаленном отработанном газе HCl, полученном при хлорировании и дегидрировании этана, показаны в таблице 2.
Пример 3
(1) Пары BiCl3 смешивали с С2Н6 и контролировали время реакции так, что скорость превращения С2Н6 составляла 97%. Молярное соотношение элемента хлора в BiCl3 к С2Н6 составляло 3:1, а температура реакции составляла 650°С. С2Н6 хлорировали и дегидрировали для получения смешанного газа, содержащего HCl, С2Н6, С2Н4, С2Н2 и C2H3Cl, a BiCl3 восстановливали до жидкого состояния Bi.
(2) Хлор барботировали через расплав металла Bi, полученный на стадии 1), чтобы превратить Bi в BiCl3 для непрерывной реакции с этаном.
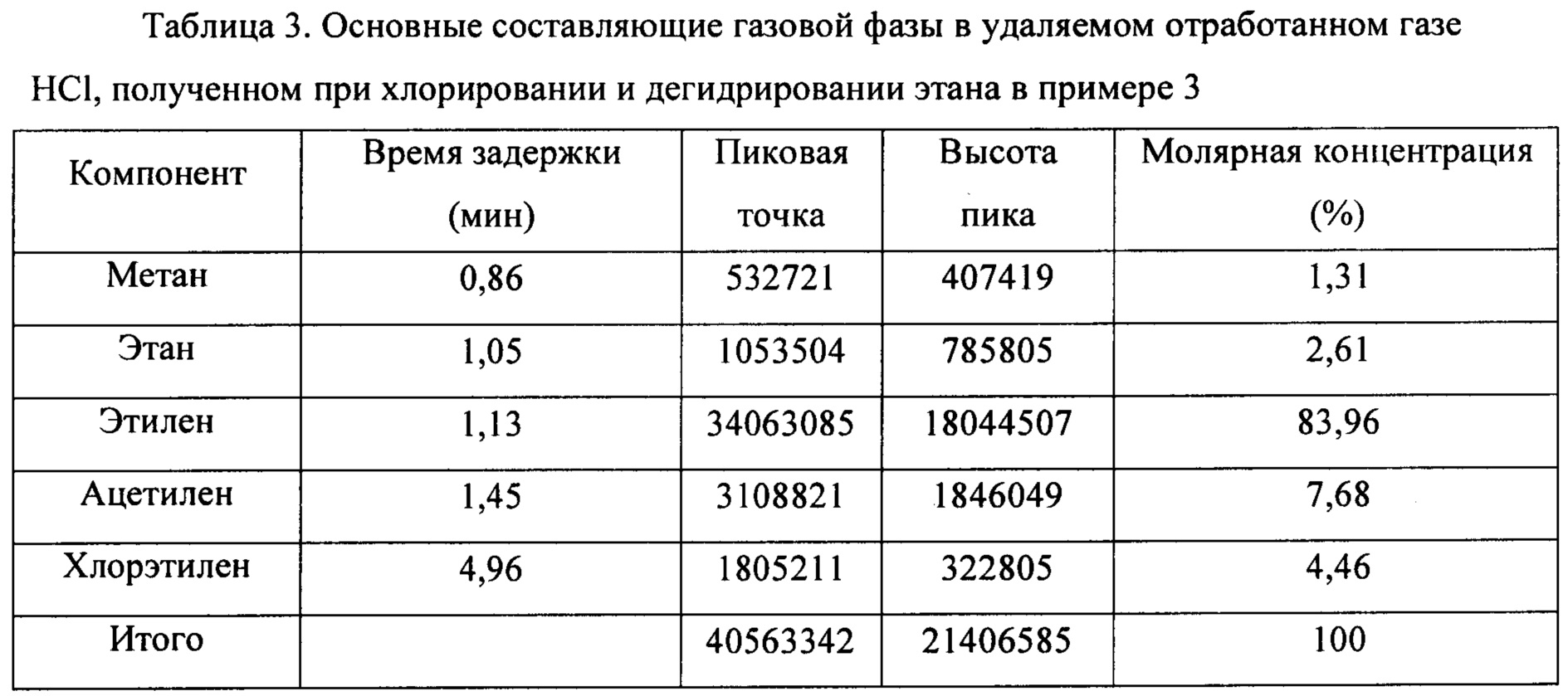
(3) HCl в смешанном газе, содержащем HCl, С2Н6, С2Н4, С2Н2 и C2H3Cl, полученном на стадии 1), абсорбировали водой, чтобы получить смешанный газ, содержащий С2Н6, С2Н4, С2Н2 и C2H3Cl и т.д., с соляной кислотой как побочный продукт. Основные составляющие удаленного отработанного газа HCl, полученного при хлорировании и дегидрировании этана, показаны в таблице 3.
Пример 4
(1) Пары BiCl3 смешивали с С2Н6, и время реакции контролировали таким образом, чтобы скорость превращения С2Н6 составляла 98%. Молярное соотношение элемента хлора в BiCl3 к С2Н6 составляло 4:1, а температура реакции составляла 700°С. С2Н6 хлорировали и дегидртровали для получения смешанного газа, содержащего HCl, С2Н6, С2Н4, С2Н2 и C2H3Cl, a BiCl3 восстановливали до жидкого состояния Bi.
(2) Кислород барботировали через расплав металла Bi, полученный на стадии 1), чтобы превратить Bi в Bi2O3, а HCl, полученный на стадии (1), впоследствии абсорбировали Bi2O3, чтобы получить BiCl3 для непрерывной реакции с этаном.
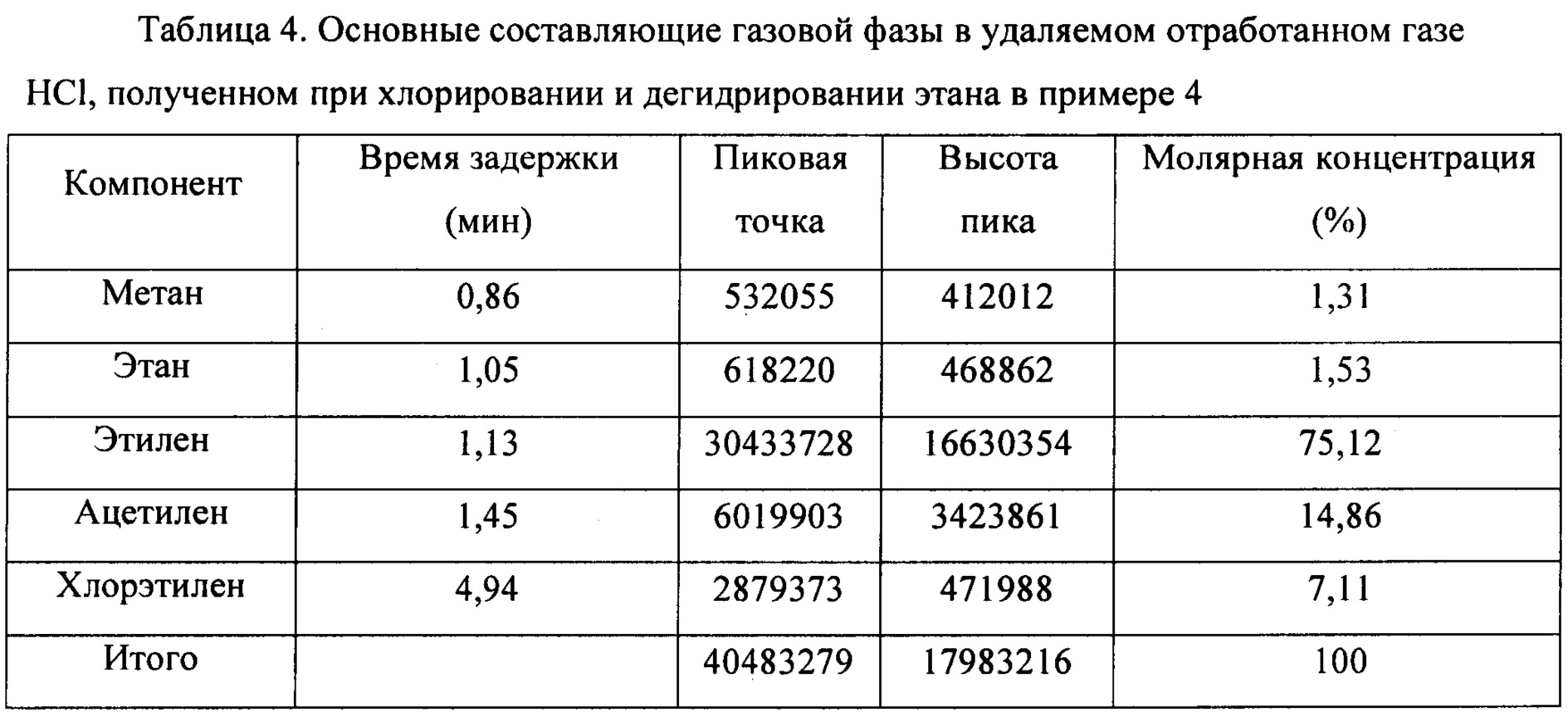
(3) HCl в смешанном газе, содержащем HCl, С2Н6, С2Н4, С2Н2 и C2H3Cl, полученном на стадии 1), абсорбировали слоем Bi2O3, получая смешанный газ, содержащий С2Н6, С2Н4, С2Н2 и C2H3Cl и т.д. Основные составляющие в удаляемом отработанном газе HCl, полученном при хлорировании и дегидрировании этана, показаны в таблице 4.
Пример 5
(1) Пары SnCl2 смешивали с С2Н6, и время реакции контролировали таким образом, чтобы скорость превращения С2Н6 составляла 77%. Молярное соотношение элемента хлора в SnCl2 к С2Н6 составляло 2:1, а температура реакции составляла 800°С. С2Н6 хлорировали и дегидрогенировали для получения смешанного газа, содержащего HCl, С2Н6, С2Н4, С2Н2 и C2H3Cl, a SnCl2 восстановливали до жидкого состояния Sn.
(2) Металл Sn, полученный на стадии 1), подвергали взаимодействию с соляной кислотой, полученной после стадии 1) для получения SnCl2 для непрерывной реакции с этаном.
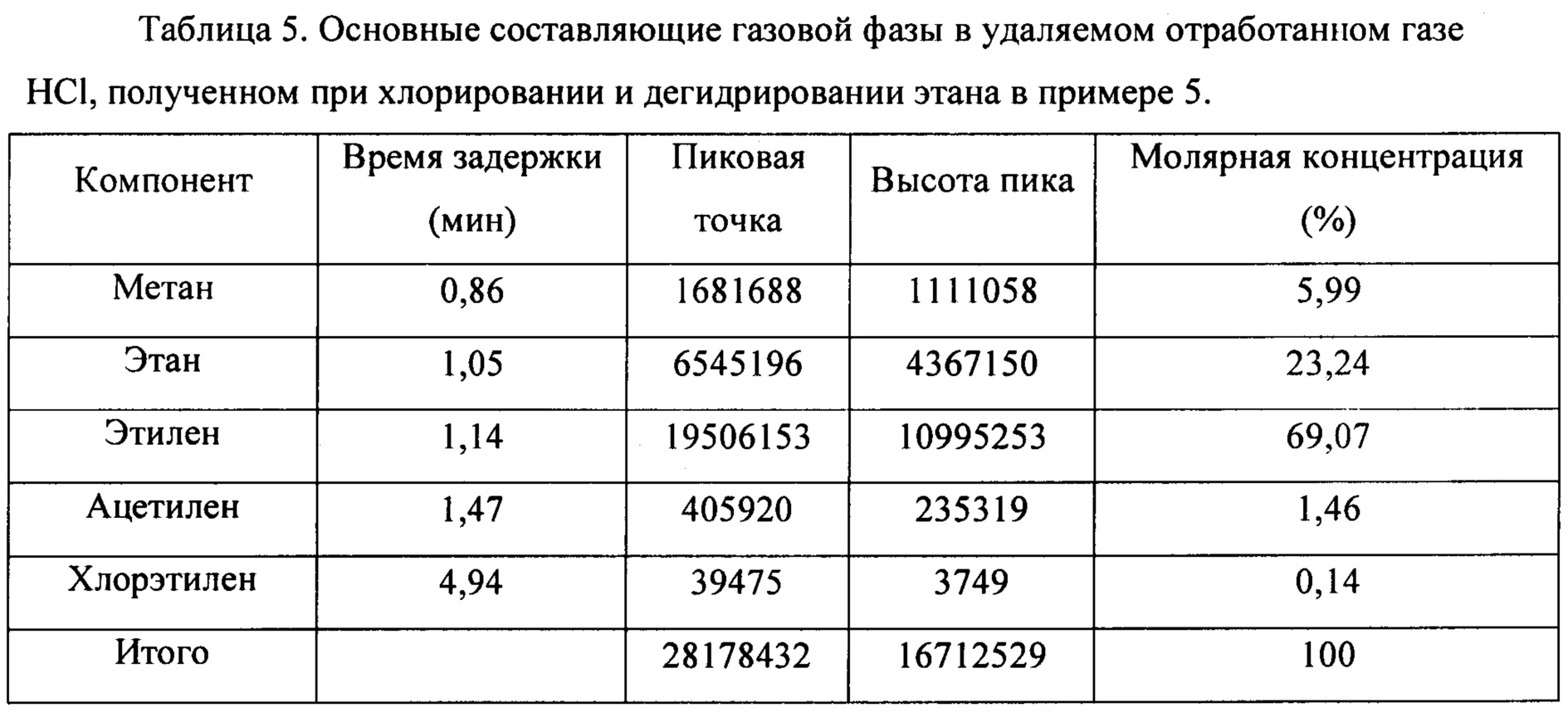
(3) HCl в смешанном газе, содержащем HCl, С2Н6, С2Н4, С2Н2 и C2H3Cl, полученном на стадии 1), абсорбировали водой, чтобы получить смешанный газ, содержащий С2Н6, С2Н4, С2Н2 и C2H3Cl и т.д., и соляную кислоту как побочный продукт. Основные составляющие удаляемого отработанного газа HCl, полученного при хлорировании и дегидрировании этана, показаны в таблице 5.
Вышеуказанные описания представляют собой только предпочтительные воплощения настоящего изобретения и никак не ограничивают настоящее изобретение. Следует отметить, что специалисты в данной области могут модифицировать и дополнять изобретение, не отклоняясь при этом от существа настоящего изобретения, которое рассматривается в объеме настоящего изобретения. Различные изменения, модификации и далее разработанные эквивалентные вариации могут быть произведены специалистами в данной области при раскрытии настоящего изобретения без отклонения при этом от существа и объема настоящего изобретения, которые представляют собой эквивалентные воплощения настоящего изобретения. Любые эквивалентные изменения, модификации и дальнейшие разработки, сделанные в воплощениях в соответствии с существенными техническими аспектами настоящего изобретения, подпадают под объем настоящего изобретения.
Реферат
Настоящее изобретение относится к способу хлорирования и дегидрирования этана, включающему смешивание и взаимодействие хлорида металла с низкой температурой плавления с СНтак, что хлорид металла с низкой температурой плавления восстанавливают до металла с низкой температурой плавления в жидком состоянии, а СНхлорируют и дегидрируют для получения смешанного газа, содержащего HCl, СН, СН, СНи CHCl, где хлорид металла с низкой температурой плавления находится в газообразном состоянии при температуре реакции. Технический результат – высокая скорость и высокая эффективность реакции. 9 з.п. ф-лы, 5 табл., 5 пр.

Комментарии