Катализатор для получения синтез-газа и способ получения синтез-газа - RU2058813C1
Код документа: RU2058813C1
Чертежи




Описание
Изобретение относится к каталитической системе и ее использованию в процессе риформинга с целью одностадийного получения газообразной смеси из Н2 и СО.
Используемые в процессе основные реагенты представляют собой СO2 и легкие
углеводороды, предпочтительно, метан. Уравнение реакции,
описывающее процесс изобретения имеет вид
CO2+CH4

Реакции риформинга углеводородов с использованием СО2 обладают некоторыми значительными преимуществами по сравнению с широкораспространенными процессами с использованием пара, которые описываются следующим химическим уравнением:
H2O+CH4

Процессы, в которых главным образом используется реакция (I), представляют собой лучший способ получения смесей Н2 и СО, если в качестве сырья используют природный газ, содержащий большие количества СО2.
Кроме этого, смесь Н2/CO с соотношением компонентов, близким к 1,
которая может быть легко получена в соответствии с изобретением, может с
успехом применяться в синтезе спиpтов и в оксосинтезе. В настоящее время при использовании сингаза, полученного по реакции
парового риформинга (II), полученные смеси Н2/CO имеют соотношение
компонентов ≥3. Для получения более низких соотношений приходится использовать вторую стадию, в которой
применяется реакция
CO2+H2
Регулирование соотношения СО/H2 с помощью такой химической реакции отрицательно влияет на общие экономические показатели процесса.
Потенциальными потребителями процесса риформинга с использованием в качестве основного реагента СО2 вместо пара являются установки (заводы) для синтеза по Фишеру-Тропшу, в которых полученные СО2 и метан могут снова рециркулироваться в сингаз с низким соотношением Н2/СО.
Процесс рифоpминга, протекающий по реакции (I), в котором в одну стадию получают смеси Н2/CO с примерно эквимолярным содержанием компонентов может также с успехом использоваться на высоко интегрированных установках, предназначенных для восстановления железосодержащих минералов.
Процессы риформинга метана с использованием СО2 могут в отличии от реакций парового риформинга с успехом использоваться в тепловых циклах для хранения и транспорта энергии по термохимическому трубопроводу (ТСР). Однако, в отличие от парового риформинга, системы, включающие синтез Н2 и СО из СО2 и легких углеводородов не обеспечены разработанной технологией. Основанные на Ni катализаторы, обычно используемые в процессе парового риформинга, не обладают достаточной селективностью и они быстро дезактивируются при соотношении Н2О/С менее 2.
Дезактивация происходит в результате образования углерода, который покрывает активные металлические центры в ходе катализа и накапливается в порах катализатора, возможно вызывая тем самым фрагментацию.
До настоящего времени не найдено каталитической системы, которая позволяла бы получать синтез-газ
(Н2 и СО) по реакции риформинга легких углеводородов без
какой-либо видимой дезактивации за счет образования кокса по реакциям
2CO __→ CO2+C
CH4__→ 2H2+C даже если
соотношение Н2О/С явно благоприятствует такому образованию.
Каталитическая система согласно изобретению характеризуется тем, что она образована из одного или более соединений металлов платиновой группы, предпочтительно выбранных из родия, рутения и иридия, подложки, состоящей из неорганических соединений, выбранных из оксидов и/или шпинелей алюминия, магния, циркония, кремния, церия и/или лантана, либо по отдельности, либо в комбинации друг с другом и возможно в присутствии щелочных металлов, в которой содержание металла или металлов платиновой группы в каталитической системе составляет 0,01-20 мас. предпочтительно 0,1-5 мас.
Используемые подложки могут также состоять из силикатизированных оксидов алюминия, магния, церия и лантана.
Площадь поверхности используемых катализаторов предпочтительно составляет 1-400 м2/г, более предпочтительно 10-200 м2/г, тогда как объем пор составляет 0,1-3 см3/г, более предпочтительно 0,5-2 см3/г.
Каталитическая система может быть получена импрегнированием (пропиткой) неорганических соединений раствором соли металлов платиновой группы с последующей термической сушкой и обжигом, или диспергированием неорганических соединений в органическом растворителе с последующей реакцией полученного продукта в среде монооксида углерода или в инертной атмосфере с раствором соединений металлов платиновой группы. На такой второй стадии протекающая экзотермическая реакция, которая в результате приводит к окрашенным продуктам реакции, сопровождается фильтрацией, сушкой и обжигом.
Более конкретно, рассматриваемая каталитическая система может быть получена гетерогенной твердожидкостной реакцией при 0-150оС, предпочтительно 20-50оС, между соединениями металлов платиновой группы в среде органического растворителя и указанными неорганическими соединениями, диспергированными в том же растворителе.
В ходе такой процедуры количество металла, фиксирующееся на субстрате определяется главным образом химическими свойствами неорганического оксида, а не его пористостью и площадью поверхности. Однако, эти последние характеристики важны в отношении целостности и стабильности катализатора в ходе реакции риформинга. В этом отношении накопление углерода в слишком малых порах приводит к фрагментации материала. Пониженная площадь поверхности подложки также приводит в результате к меньшему диспергированию металла и благоприятствует явлению спекания с последующей дезактивацией катализатора.
Способ получения подложек из силикатизированных оксидов алюминия, магния, церия или лантана заключается главным образом, в реакции конденсации между неорганическим оксидом (алюминия, магния, церия или лантана) и соединением кремния, содержащим гидролизуемые органические группы, с последующим удалением негидролизованных органических остатков путем сгорания или реакции в присутствии пара.
С использованием таких способов силикатизации могут быть получены материалы, содержащие кремний в количестве 0,5-15 мас. предпочтительно, 1-5 мас.
Изобретение предусматривает процесс каталитического риформинга легких углеводородов, предпочтительно, метана, который позволяет получать смеси Н2 и СО с мольными соотношениями компонентов 0,6-6, предпочтительно 0,8-3.
Такой каталитический способ характеризуется тем, что риформинг проводят предпочтительно в одну стадию с использованием указанной выше каталитической системы и температурного интервала 350-850оС, предпочтительно 550-750оС, при давлениях в интервале 0,5-50 атм, предпочтительно 1-40 атм. При использовании метана требуемое объемное соотношение СО2/CH4 составляет 0,5-15, предпочтительно 0,8-10.
При всех таких термодинамических условиях процесс можно также проводить в присутствии пара, если конкретное применение полученного синтез-газа требует этого.
В этом случае необходимо лишь регулировать количества подаваемых СО2 и Н2О с получением синтез-газа с любым желаемым соотношением Н2/СО в интервале 1-6.
Хотя такой способ особенно применим для процесса риформинга метана, могут также использоваться любые другие легкие углеводороды или их смеси.
Так, например, могут использоваться С1-4 парафины и олефины при подходящем подборе оптимальной температуры и условий проведения процесса, а также соответствующих количеств СО2.
Могут использоваться любые углеводородные смеси, содержащие природный газ, в которых содержание метана предпочтительно превышает 80 об.
П р и м е р 1. Получение катализатора.
Неорганический оксид, используемый в качестве подложки, получают по следующей методике.
Промышленный оксид магния, выпускаемый Карло Эрба, с площадью поверхности 210 м2/г суспендируют при перемешивании в тетраэтилсиликатном (ТЭС) растворе. Температуру поддерживают в интервале 80-90оС с целью облегчения выпаривания этанола, образовавшегося в ходе реакций конденсации. В реакционную систему вводят поток сухого газообразного азота. Газохроматографический анализ выходящего потока показывает образование этанола.
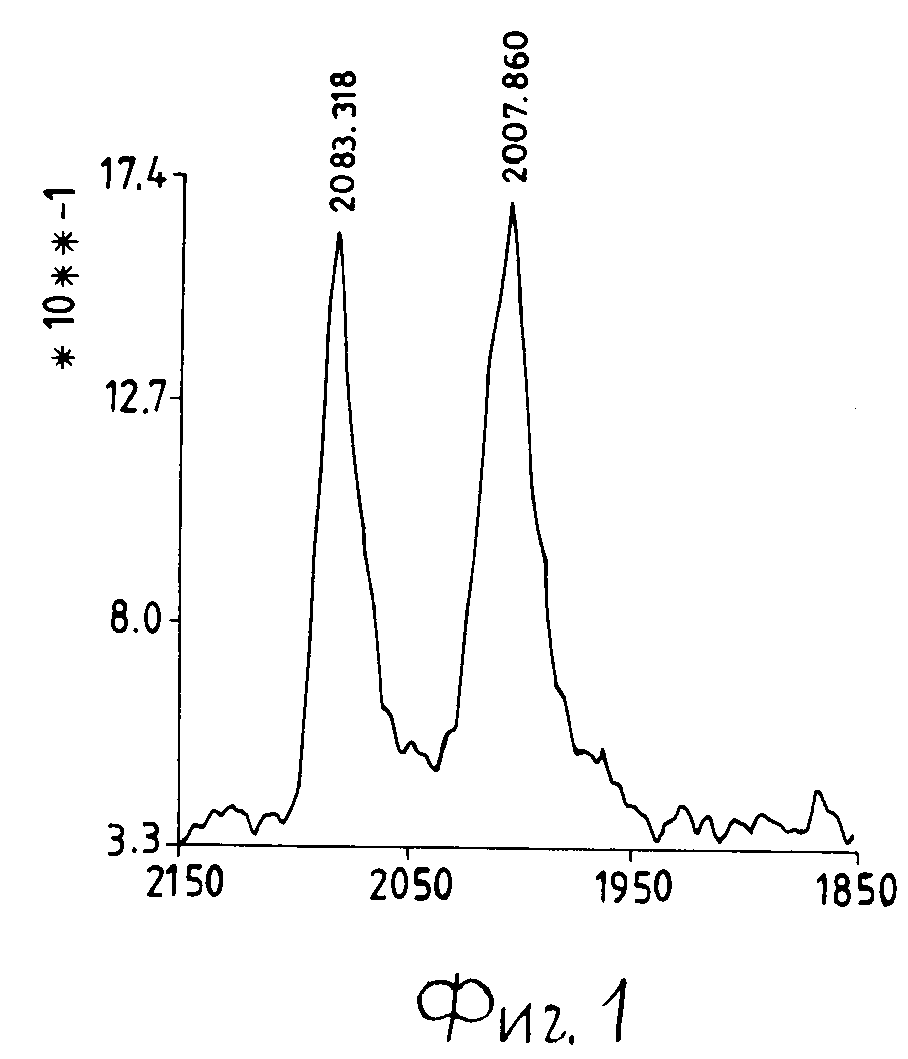
Окончанием реакции конденсации считают прекращение детекции этанола в выходящем газовом потоке. В этот момент температуру повышают до 180оС с целью отгонки непрореагировавшего ТЭС. Затем непрореагировавшие этокси группы, связанные с атомами кремния, закрепленными на твердой неорганической подложке, подвергают гидролизу путем подачи потока азота с паром при 200оС. На этой стадии в газовом потоке также определяют этанол. В ИК-спектре материала, полученного к этому моменту, обнаруживают наличие многочисленных гидроксильных полос, которые отсутствуют в исходном материале. Затем твердое вещество нагревают до 850оС (5оС/мин) и выдерживают при этой температуре в течение 10 ч. После такой обработки площадь поверхности уменьшается до 32 м2/г, содержание кремния составляет 1,5% Дифференциальный термический, термогравиметрический и ИК-спектроскопический анализы, проведенные в ходе трех циклов при 25-750оС, не обнаруживают значительного изменения физико-химических свойств полученных силикатизированных материалов. Затем 50 г силикатизированного оксида магния суспендируют в 100 мл 2-метилпентана в атмосфере азота. Второй раствор 50 мл этого же растворителя, содержащий 0,91 г Rh4 (CO)12 в атмосфере СО, при перемешивании быстро прикапывают в суспензию силикатизированного оксида. Органический раствор быстро обесцвечивается с переходом окраски от интенсивно красной до бесцветной при одновременной окраске белого твердого вещества. Это вещество отфильтровывают в инертной атмосфере с получением материала, содержащего 1 мас. Рh в высоко диспергированном состоянии, о чем можно судить по анализу вращательных карбонильных полос поверхностных комплексов (фиг. 1).
На фиг. 1 показан спектр диффузионного отражения пылевидного твердого вещества, в котором по горизонтальной оси отложено волновое число в см-1, а по горизонтальной оси единицы интенсивности Кубелка-Мунка).
Методом ИК-спектроскопии также изучены трансформации поверхностных комплексов в ходе термического восстановления водородом в атмосферах газообразного СН4 и СО2. Эти исследования внесли удовлетворительное понимание в явление образования центров поверхностной кристаллизации, обеспечивающее высокую воспроизводимость получения материала.
Реакция риформинга.
Реакцию риформинга осуществляют в кварцевом реакторе с неподвижным слоем катализатора, содержанием 3 см3 катализатора путем подачи газообразного эквимолярного потока СН4 и СО2 при давлении 1 атм. Газохроматографический анализ и линии потока выходящего газа проводят, начиная с 300оС, и продолжают до 750оС. Часовую объемную скорость газа поддерживают равной 1000 л/кг·ч.
На фиг. 2 показаны значения
различных экспериментальных конверсий СН4 и СО2 при различных изученных
температурах (черные квадраты и точки соответственно), а также теоретически рассчитанные значения
конверсий равновесной системы для реакций:
CO2+CH4
CO2+H2
Теоретическая конверсия СО2 в состоянии равновесия показана треугольниками, а СН4 белыми квадратами.
Из полученных результатов можно сделать вывод о том, что катализатор проявляет чрезвычайную активность и позволяет получать конверсии близкие к значениям конверсий в термодинамическом равновесии, в изученном температурном интервале. Процентное содержание Н2О в смеси продуктов реакции также близко к значениям, рассчитанным для системы (А) в состоянии равновесия.
На фиг. 3 показаны теоретические рассчитанные изменения концентраций газообразных продуктов от температуры для изученной системы при общем давлении 1 атм. Экспериментально полученные концентрации газообразных продуктов в полной мере отвечают расчетным значениям. Соотношение Н2/CO в интервале 650-750оС имеет значение несколько меньше 1.
В табл. 1 представлены результаты, полученные в каталитических испытаниях длительностью 100 ч при 700оС, которые проводят в присутствии катализаторов, описанных в примерах 1-4 и 6 в сравнении с результатами, полученными с использованием промышленного катализатора парового риформинга (пример 7), содержащего примерно 15,5% Ni на α-оксиде алюминия.
В ходе таких испытаний катализаторы, содержащие Rh, нанесенный на силикатизированный оксид магния, оказались чрезвычайно активными в катализе реакций, протекающих в системе (А), но неожиданно не катализировали реакции образования углерода даже в тех случаях, когда выбранные условия благоприятствовали их протеканию.
В табл. 1 приведены результаты количественного анализа выгруженных катализаторов на содержание углерода. В течение 100 ч активность и селективность каталитических систем оставалась постоянной.
П р и м е р 2. Повторяют методику синтеза катализатора, описанную в примере 1, но с использованием раствора, содержащего 1,05 г Rh(CO)12 с получением твердого вещества, содержащего 1 мас. Rh.
Реакцию риформинга проводят согласно методике примера 1, вводя те же реагенты при том же давлении и объемной скорости при 300-750оС. И в этом случае конверсии СН4 и СО2 близки к равновесным значениям даже в том случае, когда они несколько ниже значений полученных в примере 1 (см. табл. 1).
П р и м е р 3-4. В этих примерах используемые катализаторы содержат благородные металлы Rh (0,1 мас.) (пример 3) или Ru (0,5 мас.) (пример 4) и силикатизированный оксид алюминия. Последнее вещество получают конденсацией тетраэтилсиликата с гамма-оксидом алюминия, выпускаемого АК ZO, в соответствии с методикой, описанной в примере 1. Полученные таким образом каталитические системы обладают теми же характеристиками, что и описанные в примерах 1 и 2, т.е. проявляют активность в катализе реакций в системе (А) во всем изученном температурном интервале и не активны в катализе реакций, приводящих к образованию углерода на катализаторе. В табл. 1 также приведены результаты, полученные в ходе 100-часовых каталитических испытаний в двух указанных случаях.
П р и м е р 5. В этом
примере реагенты представляют собой газообразный поток С2Н6 и Со2 в соотношение 1/2. Каталитические
испытания проводят при 400 и 700оС с использованием
катализатора примера 2. Установлено, что конверсия этана при 700оС в каталитическом испытании длительностью 100 ч составляет
100% а конверсия СO2 98% Соотношение Н2
/CO составляет 0,7. Содержание метана в отходящем газе составляет величину менее 3%
П р и м е р 6. В этом примере методику синтеза
катализатора, описанную в примере 1, модифицируют таким
образом, что благородный металл наносят на силикатизированный оксид с помощью реакции импрегнирования пропитывания, осуществляемой прикапыванием
водного раствора нитрата Ph на силикатизированный
оксид до его пропитывания. Полученный таким образом катализатор содержит 1 мас. Ph. В этом примере каталитические испытания, проводимые согласно
методикам, описанным в примерах 1-5, показывают что
характеристики материала модифицируются в течение первых 10 ч реакции при 700оС. В ходе этого периода времени значения конверсий повышают
до тех пор, пока они не устанавливаются на
значениях, указанных в табл. 1.
Однако, после индукционного периода опять достигаются характеристики каталитических систем, описанных в примерах 1-4.
П р и м е р 7. Повторяют методику синтеза катализатора, описанную в примере 1, с использованием раствора Ir3(CO)12 для того, чтобы получить твердое вещество с содержанием иридия 2 мас.
Реакцию риформинга проводят согласно методике примеров 1 и 2, подачей смеси тем же самых реагентов при том же давлении и температурных условиях. В табл. 1 указаны показательные значения реакционной способности, полученные при 750оС.
П р и м е р 8. Используют катализатор, содержащий Ru (5 мас.) и Pd (1 мас. ) на подложке из силикатизированного оксида алюминия. Способ получения подложки раскрыт в примерах 3 и 4.
Катализатор получают подачей раствора Ru3(CO)12 по каплям в н-гексан, в суспензию силикатизированного оксида алюминия в том же самом растворителе.
После высушивания наносят покрытие палладия на твердое вещество путем пропитки при начинающейся смачиваемости из водного раствора Pd(CH3COO)2.
После дальнейшего высушивания, катализатор восстановлен смесью Н2 и N2(H2/N2=1/1) при 500оС.
Испытания катализаторов выполнены в соответствии с процедурами, указанными в примере 1.
В табл. 1 указаны характеристики реакционной способности.
П р и м е р 9. Получен катализатор, содержащий как Rh (0,1 мас.), так и Рt (1 мас.) на силикатизированном оксиде алюминия.
Способ получения силикатизированного оксида алюминия раскрыт в примерах 3 и 4. Катализатор получают подачей по каплям раствора кластера Rh4(CO)12 в н-гексане в суспензию силикатизированного оксида алюминия в соответствии со способом, указанным в примерах 1 и 4.
На полученную таким образом подложку после высушивания наносят покрытие платины путем пропитки при начинающейся смачиваемости из водного раствора Pt(СН3СОО)2.
Таким образом полученный продукт сушат при 160оС в течение 2 ч, и затем проводят восстановительную обработку смесью Н2 и N2 (Н2/N2=1/1) при 500оС в течение 10 ч.
Испытания катализаторов выполнены в соответствии со способом, указанным в примере 1.
П р и м е р 10. Катализатор получают осаждением катализатора, который содержит 5 мас. рутения, на подложке из силикатизированного оксида алюминия по методике примера 6. Рутений осаждают пропитыванием под действием начинающейся смачиваемости подложки из силикатизированного оксида алюминия. После высыхания, катализатор восстанавливают в потоке водорода азота (H2:N2=1) при температуре до 500оС. Испытания на катализатор проводят по методике примера 1. Данные испытаний приведены в табл. 1.
П р и м е р 11. Катализатор получают осаждением катализатора, содержащего 0,5 мас. Rh и 0,5 мас. Ru на подложку смешанных оксидов алюминия и магния.
Подложка, содержащая 16,7 мас. магния и 42,1 мас.
алюминия,
приготовлена исходя из следующих двух водных растворов:
в 20 мл воды растворяют 7,5 г Mg(NO3)2·6H2O;
1,5 г Al(NO3)3
·9H2O растворено в 10 мл водного раствора 27 мас. NaOH.
Растворы смешивают, получая осадок, который затем промывают и высушивают. Осадок затем прокаливают до 1000оС.
Процедура получения химической абсорбции Rh и Ru из двух органических растворов Rh4(CO)12 и Ru3(CO)12 та же, как в примерах 1 и 2.
Затем катализатор исследуют в условиях, аналогичных описанным в примере 1. Результаты каталитических исследований приведены в табл. 1.
В табл. 2 приведены характеристики носителя с указанием удельной поверхности и объема пор.
П р и м е р 12 (сравнительный). В целях сравнения с данными примерами 1 используют промышленный катализатор парового риформинга, состоящий из 15,5 мас. Ni, нанесенного на оксид алюминия.
Полученные результаты представлены в табл. 1.
Реферат
Использование: каталитическая химия, в частности получение синтез-газа реформингом легких углеводородов с CO2 и производство катализаторов для этого процесса. Сущность изобретения: катализатор содержит металл платиновой группы - платину, палладий, родий, рутений, иридий или их смесь 0,01 - 20 мас. %, предпочтительно, 0,1 - 5,0 мас.% на неорганическом носителе - оксиде алюминия и/или магния или силикатизированном оксиде алюминия или магния. Катализатор имеет площадь поверхности предпочтительно 1 - 400 м2/г и объем пор 0,1 - 3,0 см3/г. Способ включает реформинг легких углеводородов с CO2 при 350 - 850oС в присутствии катализатора вышеуказанного состава. 2 с. и 8 з. п. ф-лы, 3 ил., 2 табл.
Формула
Неорганический носитель Остальное
2. Катализатор по п.1, отличающийся тем, что он содержит металл платиновой группы в количестве 0,1 5,0 мас.
Неорганический носитель Остальное
6. Способ по п.5, отличающийся тем, что процесс проводят при давлении 0,5 50 атм.

Комментарии