Флуоресцентная микроскопия высокого разрешения со структурированным пучком возбуждения - RU2660301C2
Код документа: RU2660301C2
Чертежи





Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к способу определения местоположения единичных молекул вещества в образце и к устройству для осуществления этого способа. Указанные способ и устройство предназначены, в частности, для отображения с высоким пространственным разрешением распределения молекул вещества в образце или в меченой веществом структуре образца.
Изобретение в целом относится к области флуоресцентной микроскопии. Это означает определение местоположения молекулы вещества в образце с использованием ее флуоресцентных свойств.
Когда в настоящем документе речь идет о флуоресцентном состоянии молекулы, это означает, что она может быть возбуждена светом возбуждения для испускания света флуоресценции, а не то, что она уже находится в возбужденном, флуоресцирующем состоянии.
Когда речь здесь идет о нефлуоресцентном состоянии молекулы, это соответственно означает, что она не может быть возбуждена светом возбуждения для испускания света флуоресценции, и в остальных случаях тоже не флуоресцирует, то есть не испускает свет флуоресценции. При этом значение имеет только то, что молекула в нефлуоресцентном состоянии не испускает свет флуоресценции, который регистрируется, когда регистрируют свет флуоресценции, для испускания которого молекулу можно перевести во флуоресцентное состояние. Так, например, молекулу в нефлуоресцентном состоянии можно возбудить для испускания света флуоресценции другого цвета, т.е. другой длины волны, отличное от света флуоресценции, для испускания которого ее можно перевести во флуоресцентное состояние. В частности, молекулу во флуоресцентном состоянии можно возбудить для испускания зеленого света флуоресценции, а в нефлуоресцентном состоянии можно возбудить для испускания красного света флуоресценции. Нефлуоресцентное состояние молекулы, в котором ее вообще невозможно возбудить для испускания света флуоресценции, называется здесь также темным состоянием.
УРОВЕНЬ ТЕХНИКИ
Существуют два основных подхода для определения местоположения молекул, испускающих свет флуоресценции, в образце. Согласно первому подходу, местоположение определяют из пространственного распределения света флуоресценции, регистрируемого матрицей датчиков света. Согласно второму методу, местоположения молекулы приравнивают позиции пространственно ограниченного возбуждения для испускания света флуоресценции, в которых регистрируют свет флуоресценции молекул.
Согласно первому подходу, когда свет флуоресценции, испускаемый веществом, регистрируют матрицей датчиков света, на которую объективом отображается образец, достижимая пространственная точность отображения распределения молекул вещества в образце или меченой им структуры образца обычно ограничена так называемым дифракционным пределом Аббе. Так, исходя из отдельных фотонов, которые регистрируют в определенном положении матрицы фотодетекторов, судить об определенном местоположении испускающей молекулы в образце можно только с пространственной неопределенностью, составляющей по порядку величины λ/2nsinα, где λ означает длину волны света флуоресценции, n показатель преломления оптического материала между образцом и объективом, и α есть половинный угол раствора объектива.
Однако когда регистрируемый матрицей датчиков света свет флуоресценции можно поставить в соответствие единичной флуоресцирующей молекуле в образце, местоположение молекулы, если она испускает большое число фотонов, можно определить с точностью выше дифракционного предела. Для этого матрицей датчиков света определяется центр тяжести распределения позиций, в которых регистрируют отдельные фотоны, и из него выводят местоположение излучающей молекулы. Точность, достигаемая при этом методе, называемом локализацией, возрастает как , где n есть число фотонов, испускаемых молекулой и регистрируемых матрицей.
Когда молекула испускает свет флуоресценции с направленным пространственным распределением, это приводит к ошибке определения местоположения при определении ее местоположения матрицей датчиков света из распределения интенсивности света флуоресценции методом локализации. Эта ошибка определения местоположения зависит от ориентации молекулы в образце. Направленное распределение испущенного света флуоресценции выявлено, например, у молекул, время вращательной диффузии которых больше, чем их время пребывания в возбужденном состоянии, в котором они испускают свет флуоресценции (см. Engelhardt, J. et al., Molecular orientation affects localization accuracy in superresolution far-field fluorescence microscopy, Nano Lett. 2011 Jan 12; 11(1):209-13).
Из документа WO 2006/127692 A2 известно о необходимости метки интересующей структуры в образце молекулами вещества, которое находится в нефлуоресцентном исходном состоянии, но которое светом настройки можно переключить во флуоресцентное состояние. Так, с помощью света настройки можно перевести небольшую часть молекул во флуоресцентное состояние, при котором ближайшие молекулы, находящиеся во флуоресцентном состоянии, отстоят друг от друга на большее расстояние, чем дифракционный предел. При последующем нагружении светом возбуждения свет флуоресценции испускают только молекулы, находящиеся во флуоресцентном состоянии. Таким образом, свет флуоресценции единичных молекул во флуоресцентном состоянии можно регистрировать по отдельности, и местоположение единичных молекул можно, несмотря на высокую абсолютную концентрацию молекул вещества, определить методом локализации с точностью выше дифракционного предела. Отображение распределения молекул вещества постепенно достигают тем, что повторяют этапы перевода небольшой части молекул во флуоресцентное состояние, возбуждения этих молекул для испускания света флуоресценции и регистрации света флуоресценции матрицей датчиков света, что, таким образом, проводят, в соответствии с законами статистики, все время с разными молекулами вещества.
В документе WO 2006/127692 A2 описывается также, что активацию части молекул вещества во флуоресцентном состоянии можно распространить на другие методы оптической отображения. При этом можно посредством распределения интенсивности света возбуждения с максимумами, ограниченными минимумами, возбуждать молекулы вещества специально в определенных плоскостях или других пространственных субъединицах образца, чтобы они испускали свет флуоресценции.
Способ, известный из WO 2006/127692 A2, требует для определения позиции каждой молекулы вещества с точностью выше дифракционного предела числа фотонов, испускаемой молекулой, возрастающего с повышением желаемой пространственной точности. Кроме того, этот способ предъявляет высокие требования к молекулам, чтобы только малую их часть можно было переключать во флуоресцентное состояние, причем расстояние между молекулами, находящимися во флуоресцентном состоянии, больше дифракционного предела. Типично речь идет о молекулах, переключающихся между двумя конформационными состояниями белков, из которых только один является флуоресцентным, или о фотохромном люминофоре.
Способ, известный из WO 2006/127692 A2, называется также фотоактивируемой локализационной микроскопией (PALM). Очень близкий способ, называемый STORM-микроскопией (микроскопия стохастической оптической реконструкции), имеет в принципе те же достоинства и недостатки.
Из документа US8174692B2 известно, что обычные красители, которые не являются переключаемыми, но имеют флуоресцентное исходное состояние и не могут также быть переключенными между двумя конформационными состояниями, из которых только одно является флуоресцентным, также можно использовать в качестве вещества для определения местоположений единичных молекул вещества методом локализации. При этом образец нагружают светом возбуждения, который с определенной вероятностью перехода одновременно переводит молекулы вещества в относительно долгоживущее электронное темное состояние, с такой высокой интенсивностью, чтобы установить между молекулами, находящимися в текущий момент в их флуоресцентном состоянии, расстояние выше дифракционного предела.
Молекулы, находящиеся во флуоресцентном состоянии, возбуждают светом возбуждения для испускания света флуоресценции, который регистрируют матрицей датчиков света с пространственным разрешением. Этим способом постепенно локализируются различные молекулы вещества, так как молекулы, от которых фотоны уже зарегистрированы, попадают в темное состояние, из которого другие молекулы возвращаются с определенной вероятностью перехода во флуоресцентное состояние. Этот известный способ можно осуществлять в непрерывном режиме, т.е. можно непрерывно считывать кадры из матрицы датчиков света, в то время как образец нагружают светом возбуждения высокой интенсивности, которая в основном удерживает вещество в его темном состоянии и возбуждает лишь единичные молекулы для испускания света флуоресценции.
Метод, известный из патента US 8,174,692B2, называется также GSDIM (микроскопия с истощением основного состояния с последующим испусканием единичного фотона, от Ground State Depletion Individual Molecule Return Microscopy).
Высокая точность при определении местоположения единичных флуоресцентных молекул путем локализации достигается только в направлении x и y поперек оптической оси, но не в направлении z оптической оси объектива, которым соответствующий образец отображается на матрицу датчиков света. Однако известно (D.Aquino et al., Two-color nanoscopy of three-dimensional volumes by 4Pi detection of stochastically switched fluorophores, Nature Meth. 8, 353-359 (2011)), что местоположения единичных флуоресцентных молекул при применении микроскопии типа PALM, STORM или GSDIM можно определить методом 4Pi с объективами, направленными друг против друга в направлении z оптической оси, путем сканирования в плоскости измерений x-y.
Когда за местоположения молекул, испускающих свет флуоресценции, принимаются позиции их пространственно ограниченного возбуждения для испускания света флуоресценции, причем образец зондируют или сканируют в местоположении его пространственно ограниченного возбуждения, говорят о сканирующей флуоресцентной микроскопии. Пространственная точность, достигаемая при сканирующей флуоресцентной микроскопии, обычно также ограничена дифракционным пределом Аббе, в данном случае на длине волны света возбуждения. Однако известны различные способы, с помощью которых можно достичь точности сканирующей флуоресцентной микроскопии выше дифракционного предела за счет уменьшения эффективной пространственной зоны возбуждения молекул вещества для испускания света флуоресценции.
В сканирующей флуоресцентной микроскопии достаточно регистрации любых фотонов, чтобы понять, что молекулы, испускающие свет флуоресценции, находятся в текущей зоне возбуждения. Число зарегистрированных фотонов используют исключительно для определения локальной концентрации молекул вещества в текущей зоне возбуждения.
В случае флуоресцентной микроскопии типа STED (Stimulated Emission Depletion - микроскопия на основе подавления спонтанного испускания) вызванное светом возбуждения возбуждение молекул вещества, которым мечена структура образца, снова устраняется вокруг интересующей точки измерения посредством направленного излучения. Направленное испускание стимулируется STED-излучением и предотвращает испускание света флуоресценции молекулами, так что свет флуоресценции может испускаться только из области, в которой возбуждение не устранено. Область, в которой возбуждение не устранено, можно поддержать очень маленькой, задавая ее через нулевую точку распределения интенсивности STED-излучения и выбирая абсолютную интенсивность STED-излучения настолько высокой, чтобы возбуждение молекул полностью устранялось уже очень близко к нулевой точке.
Вместо того, чтобы снова устранять вызванное ранее возбуждение молекул в частях образца, можно свет с распределением интенсивности, имеющим нулевую точку, использовать также для того, чтобы переводить молекулы вещества вне нулевой точки в нефлуоресцентное состояние путем изменения конформации, как это происходит при флуоресцентной микроскопии типа RESOLFT, или переводить в электронное темное состояние, как это имеет место во флуоресцентной микроскопии типа GSD (Ground State Depletion, микроскопия снижения основного состояния).
Из заявки DE10/2005 034443 A1 известен GSD-способ, при котором работают со светом всего одной длины волны. До определенной интенсивности этот свет возбуждает молекулы вещества в образце сначала для испускания света флуоресценции. Выше этой интенсивности свет по существу полностью переводит молекулы вещества в темное состояние. Из-за того, что распределение интенсивности света, действующего на образец, имеет локальный минимум, лежащий ниже описанной интенсивности, область, в которой молекулы вещества эффективно возбуждают для испускания света флуоресценции, является пространственно ограниченной.
Из WO 2012/171999 A1 известен способ, согласно которому благодаря быстрому сканированию образца лучом света возбуждения, который окружен STED-светом с распределением интенсивности, имеющим минимум в фокусе луча света возбуждения, причем при каждом из многочисленных последовательных шагов сканирования регистрируется свет флуоресценции только от единичных молекул. За местоположения молекул, от которых регистрируют свет флуоресценции, принимают соответствующие позиции фокуса луча света возбуждения.
Из документа DE10/2011 055367A1 известен способ отслеживания единичных флуоресцентных молекул. Молекулу нагружают светом возбуждения, чтобы она испускала свет флуоресценции, и этот свет флуоресценции регистрируют. При этом свет возбуждения с распределением интенсивности, имеющим локальный минимум, направляют на образец, и минимум смещают с движущейся в образце молекулой. Для этого распределение интенсивности света возбуждения таким образом сдвигают относительно образца, чтобы интенсивность испущенного частицей света флуоресценции оставалась минимальной. Говоря об интенсивности испускаемого частицей света флуоресценции, фактически имеется в виду скорость, с которой единичные фотоны испускаются соответствующей молекулой из минимума распределения интенсивности света возбуждения. Под минимумом может иметься в виду нулевая точка распределения интенсивности света возбуждения.
Из DE10/2010 028138 A1 известен способ определения распределения вещества в области измерения путем сканирования с измерительным фронтом. Через глубину измерительного фронта, которая меньше, чем дифракционный предел на длине волны оптического сигнала, интенсивность оптического сигнала повышают таким образом, чтобы часть вещества, находящаяся в состоянии измерения, сначала возрастала с нуля, а затем опять падала до нуля. Измерительный фронт смещают в направлении, противоположном направлению повышения интенсивности оптического сигнала в области измерения. Измерительный сигнал регистрируют по меньшей мере из области измерительного фронта и ставят в соответствие соответствующей позиции измерительного фронта в области измерения.
В так называемой микроскопии типа SSIM (Saturated Structured Illumination Microscopy=микроскопия насыщенного структурированного освещения, смотри Gustafsson, M.G.L., Proc. Natl. Acad. Sei. USA 102, 13081-13086 (2005)) образец сканируют в различных направлениях светом возбуждения с распределением интенсивности, имеющим линейную нулевую точку, а вне нулевой точки имеющим такую высокую интенсивность, чтобы достигалось насыщение интенсивности света флуоресценции возбужденных молекул флуоресцентного вещества в образце. Свет флуоресценции образца, регистрируемый во время сканирования, колеблется из-за находящихся в области нулевой точки молекул флуоресцентного вещества, которые не вносят вклад в свет флуоресценции. Этот свет флуоресценции оценивают по пространственным частотам, которые встречаются при сканировании в разных направлениях и из которых затем реконструируют картину распределения флуоресцентных молекул в образце.
Для SSIM не нужно знать распределение флуоресцентных молекул в образце, у которых среднее расстояние между молекулами больше, чем дифракционный предел на длине волны света возбуждения или света флуоресценции. Метод SSIM осуществим только с флуоресцентными молекулами, которые способны возбуждаться вплоть до насыщения интенсивности создаваемого ими света флуоресценции, не переходя в результате этого в темное состояние. Получают лишь непрямое отображение распределения молекул флуоресцентного вещества в образце. Позиции единичных флуоресцентных молекулы в образце не определяются.
ЗАДАЧА, СТОЯЩАЯ ПЕРЕД ИЗОБРЕТЕНИЕМ
В основе изобретения стоит задача разработать способ и устройство для определения местоположения единичных молекул вещества в образце, посредством которых можно получить с высоким пространственным разрешением картину распределения молекул вещества в образце при оценке света флуоресценции единичных молекул, причем свет флуоресценции дополнительно может применяться для определения местоположения единичных молекул посредством локализации.
РЕШЕНИЕ
Стоящая перед изобретением задача решена посредством способа по независимому пункту 1 формулы изобретения и устройства по дополнительному независимому п. 23. Предпочтительные варианты осуществления способа и устройства определены в зависимых пунктах.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение указывает способ определения местоположения единичных молекул вещества в образце, причем единичные молекулы вещества находятся во флуоресцентном состоянии, в котором они могут возбуждаться светом возбуждения, чтобы испускать свет флуоресценции, и причем расстояния между единичными молекулами вещества в интересующей области образца поддерживают на минимальном значении.
Способ включает уже известные из WO 2006/127692 A1 этап возбуждения единичных молекул вещества светом возбуждения, чтобы они испускали свет флуоресценции, причем распределение интенсивности света возбуждения имеет по меньшей мере один локальный минимум, и этап регистрации света флуоресценции возбужденных единичных молекул вещества в различных позициях по меньшей мере одного минимума в интересующей области образца.
Согласно изобретению минимальное значение расстояния d между единичными молекулами вещества в интересующей области образца равно , где λ есть длина волны света возбуждения, n показатель преломления оптического материала, в котором образован по меньшей мере один минимум, α половинный угол раствора оптической системы, которая направляет свет возбуждения на образец, I означает максимальную интенсивность света возбуждения в образце, и Is зависящую от вещества интенсивность возбуждения светом возбуждения при насыщении флуоресценции. При интенсивности Is возбуждения светом возбуждения при насыщении флуоресценции достигается определенная процентная доля теоретически возможной интенсивности света флуоресценции молекул вещества, начиная с которой говорят также о насыщении интенсивности света флуоресценции. Типично эта процентная доля составляет 50% от теоретически возможной интенсивности света флуоресценции. Минимальное значение d соответствует точности пространственного отображения, которая достигается при сканирующей флуоресцентной микроскопии высокого разрешения типа STED, GSD и RESOLFT.
Не всегда важно, каким образом достигается соблюдение минимального значения d расстояния между единичными молекулами вещества, находящимися во флуоресцентном состоянии, в интересующей области образца. Не требуется также, чтобы расстояния между всеми молекулами вещества во флуоресцентном состоянии поддерживались на минимальном значении. Однако при меньшем расстоянии местоположение флуоресцентных молекул вышеописанным способом установить нельзя.
Согласно изобретению, максимальная интенсивность света флуоресценции единичных молекул в месте локального минимума распределения интенсивности света возбуждения составляет не больше половины значения в месте максимальной интенсивности света возбуждения в образце. Понятно, что благоприятна более высокая контрастность интенсивности, то есть еще более выраженный локальный минимум, в котором интенсивность света флуоресценции единичной молекулы снижается до малой доли от максимальной интенсивности света флуоресценции единичной молекулы. Так, интенсивность света флуоресценции единичной молекулы может снижаться, например, по меньшей мере на 80% до максимум 20% или по меньшей мере на 90% до максимум 10% от максимальной интенсивности. В идеале интенсивность света флуоресценции единичной молекулы в локальном минимуме падает до нуля, т.е. речь идет о нулевой точке распределения интенсивности света возбуждения.
Согласно изобретению, расстояние между ближайшими соседними позициями по меньшей мере одного минимума, в которых регистрируют свет флуоресценции возбужденных единичных молекул образца, составляет не больше половины минимального значения d. Тогда местоположения единичных молекул вещества выводят, согласно изобретению, из кривой зависимости интенсивности света флуоресценции соответствующей молекулы от позиций по меньшей мере одного минимума в интересующей области образца.
Когда флуоресцентная молекула попадает в область минимума, возбуждение молекулы для испускания света флуоресценции и, соответственно, интенсивность испущенного ею и позднее регистрируемого света флуоресценции падает. Так как в способе по изобретению рассматриваются единичные флуоресцентные молекулы, свет флуоресценции которых может регистрироваться и соответственно может быть оценено индивидуально, можно из кривой зависимости интенсивности зарегистрированного света флуоресценции от позиций минимума определить с повышенной пространственной точностью местоположение соответствующей флуоресцентной молекулы в образце.
Это справедливо и тогда, когда определенное выше минимальное расстояние между единичными молекулами в образце заметно меньше дифракционного предела на длине волны λ света возбуждения, а также на длине волны света флуоресценции, тогда как максимальная интенсивность I света возбуждения в образце заметно больше интенсивности Is возбуждения при насыщении флуоресценции. И в этом случае можно свет флуоресценции, регистрируемый от образца, поставить в соответствие по меньшей мере одной малой группе единичных молекул, и интенсивность света флуоресценции снижается в существенной степени, когда одна из молекул в области локального минимума достигает интенсивности света возбуждения. Это снижение при поддержании минимального расстояния d между единичными молекулами в образце также можно поставить в соответствие точно одной единичной молекуле.
Для регистрации этого снижения и вывода его пространственного профиля служат малые расстояния между позициями минимума, в которых регистрируется свет флуоресценции, максимум d/2. Таким образом, в способе согласно изобретению интересующая область образца сканируется светом возбуждения с локальным минимумом распределения интенсивности величиной шага максимум d/2.
Оптическая система, с помощью которой свет возбуждения направляют на образец, может представлять собой объектив, но это может быть и другая оптическая система, с помощью которой два частичных луча света возбуждения накладываются под углом друг к другу, чтобы в результате интерференции образовать по меньшей мере один минимум. В таком случае угол α является половинным углом между этими двумя частичными лучами или углом между каждым из лучей и оптической осью. Параметр n может быть показателем преломления образца, когда минимум образуется непосредственно в образце, или показателем преломления граничащего с образцом материала, когда минимум образован в нем. Это имеет место, например, когда применяют оптическую систему, аналогичную применяемой во флуоресцентной микроскопии типа TIRFM (Total Internal Reflection Fluorescence Microscopy) для образования минимума.
Так как определение местоположений единичных молекул основано исключительно на интенсивности света флуоресценции соответствующей молекулы, определенной в каждой позиции минимума без учета точного направления, в котором молекула испускает свет флуоресценции, способ согласно изобретению относится к сканирующей флуоресцентной микроскопии, и определение местоположений единичных молекул не зависит от ориентации молекул.
В частности, для вывода местоположений единичных молекул вещества из кривой зависимости интенсивности света флуоресценции молекулы от позиций по меньшей мере одного минимума можно аппроксимировать функцией с локальным минимумом. В таком случае местоположению соответствующей молекулы приравнивают позицию локального минимума аппроксимированной функции. Функция может быть квадратичной функцией. Однако основной вид аппроксимированной функции можно подбирать также индивидуально к кривой интенсивности света флуоресценции молекулы соответствующего вещества как отклик на профиль интенсивности света возбуждения вокруг по меньшей мере одного минимума.
Объемом настоящего изобретения охватывается также случай, когда за местоположение молекулы принимается позиция, по меньшей мере одного, минимума, которая характеризуется тем, что от соответствующей молекулы регистрируют меньший свет флуоресценции, чем в ближайших, в различных направлениях, соседних позициях минимума. Если минимум или область слабого возбуждения вокруг минимума, где молекулу возбуждают для испускания света флуоресценции лишь с минимальной интенсивностью, попадает на соответствующую молекулу, для этой позиции минимума регистрируют только минимальную интенсивность света флуоресценции молекулы. Так как в принципе для этого могут иметься и другие причины, позицию минимума, в которой регистрируют лишь минимальную интенсивность света флуоресценции соответствующей молекулы, можно принять за местоположение молекулы только тогда, когда в ближайших в различных направлениях соседних позициях минимума регистрируют больше света флуоресценции, чем минимальная интенсивность. Если эти условия выполняются, местоположение соответствующей молекулы в образце можно определить с пространственной точностью из размеров слабовозбужденной зоны в окрестности минимума.
Когда минимальная интенсивность равна нулю или близка к нулю, для этого типа определения местоположения требуется лишь очень мало фотонов свете флуоресценции, испускаемых единичной молекулой, а именно очень мало фотонов в позиции минимума, в которой регистрируют минимальную интенсивность света флуоресценции, и, соответственно, лишь на несколько фотонов больше ближайших в разных направлениях соседних позициях минимума, пока не станет ясно, что интенсивность света флуоресценции там превышает минимальную интенсивность. Как результат, минимум можно очень быстро перемещать между его отдельными позициями. При нулевой минимальной интенсивности достаточно установить наличие или отсутствие света флуоресценции соответствующей молекулы. Для этого необходимо только подождать в соответствующей позиции максимум столько, сколько требуется, чтобы получить по меньшей мере несколько фотонов света флуоресценции от соответствующей молекулы. Нулевая минимальная интенсивность реализуется, как правило, в слабовозбужденной зоне вокруг локального минимума только тогда, когда локальный минимум является нулевой точкой распределения интенсивности света возбуждения.
Когда для определения местоположений единичных молекул должна использоваться слабовозбужденная зона в окрестности минимума, необходимо обеспечить, чтобы каждая единичная молекула попадала в слабовозбужденную зону. Это достигается, если расстояние между ближайшими соседними позициями по меньшей мере одного минимума, в которых регистрируют свет флуоресценции возбужденных единичных молекул вещества, т.е. шаг, с которым сканируют интересующую область образца, был не больше диаметра слабовозбужденной зоны, чтобы интересующая область образца была полностью просканирована со слабовозбужденной зоной.
Когда интенсивность света возбуждения смежно по меньшей мере одного минимума установить настолько высокой, чтобы достигалось насыщение интенсивности света флуоресценции, испускаемого единичными молекулами, возбужденными светом возбуждения, слабовозбужденная зона в окрестности минимума, в которой соответствующая молекула возбуждается так, чтобы испускать свет флуоресценции лишь с минимальной интенсивностью, а также прилегающая к ней область, в которой интенсивность света флуоресценции молекулы зависит от ее удаления от минимума, сильно пространственно сужена. Это равносильно повышению точности определения местоположения в способе согласно изобретению. Однако этим можно воспользоваться только тогда, когда расстояния между позициями минимума в образце, в котором определяется интенсивность света флуоресценции единичных молекул, малы. Это обеспечивается благодаря тому, что максимальные расстояния между ближайшими соседними позициями, по меньшей мере одного, минимума, в которых регистрируется свет флуоресценции возбужденных единичных молекул вещества, устанавливаются равными d/2.
Единичные молекулы во флуоресцентном состоянии, среднее расстояние между которыми в интересующей области образца больше дифракционного предела на длине волны света возбуждения и длине волны света флуоресценции, можно реализовать, в частности, тем, что молекулы вещества можно переводить сигналом настройки из их флуоресцентного состояния в нефлуоресцентное состояние или из нефлуоресцентного состояния в их флуоресцентного состояние, причем вероятность перехода между состояниями (до достижения насыщения) возрастает с повышением интенсивности сигнала настройки. В таком случае при настолько высокой плотности молекул в интересующей области образца, что расстояния между ближайшими соседними молекулами вещества меньше, чем минимальное значение d, можно в результате воздействия сигнала настройки оставить только часть молекул во флуоресцентном состоянии или перевести их во флуоресцентное состояние. Эту часть молекул вещества можно устанавливать через интенсивность сигнала настройки таким образом, чтобы поддерживать расстояние между единичными молекулами вещества во флуоресцентном состоянии на минимальном значении d. Так как то, какие молекулы вещества относятся к части, находящейся во флуоресцентном состоянии, зависит от вероятности перехода, в результате можно последовательно определить местоположения различных молекул вещества в образце.
С молекулами, чье местоположение уже было определено, можно поступать по-разному. В принципе их можно стойко "обесцветить". Но они могут также под действием сигнала обратной связи и/или спонтанно, то есть исключительно за счет термического возбуждения, вернуться в свое первоначальное нефлуоресцентное состояние или могут быть переведены светом настройки, как и большинство других молекул, в их нефлуоресцентное состояние. В таком случае можно сигналом настройки и при необходимости сигналом обратной связи неоднократно или непрерывно устанавливать для других единичных молекул во флуоресцентном состоянии минимальное значение d расстояния между ближайшими соседями. Если при этом определяют позиции единичных молекул во флуоресцентном состоянии, последовательно получают отображение распределения молекул вещества в образце.
При последовательном определении местоположений разных частей вещества на образец можно непрерывно или с перерывами воздействовать сигналом настройки и при необходимости сигналом обратной связи. Регистрацию света флуоресценции образца также можно осуществлять непрерывно или с перерывами. Однако в любом случае она происходит отдельно для каждой позиции минимума света возбуждения в образце. Тем не менее, это не исключает непрерывное смещение позиции минимума в образце, если минимум в течение периода, когда регистрируют свет флуоресценции, перемещается мало, во всяком случае, не больше, чем на d/4.
Сигнал настройки, которым молекулы вещества можно переключать между флуоресцентным и нефлуоресцентным состояниями, чтобы перевести часть молекул во флуоресцентное состояние, в котором расстояние между ближайшими соседями сохраняется на минимальном значении, может быть в принципе любым химическим или физическим сигналом. Предпочтительно речь идет о свете настройки.
В частности, молекулы вещества могут быть переведены светом настройки из их флуоресцентного состояния в их нефлуоресцентное состояние, причем нефлуоресцентное состояние молекул вещества может быть состоянием электронной энергии. В последнем случае свет настройки возбуждает флуоресцентные молекулы вещества типично и для испускания света флуоресценции, и они переходят в нефлуоресцентное состояние только после испускания нескольких фотонов света флуоресценции. Таким образом, свет настройки, применяющийся в способе по изобретению, может быть одновременно светом возбуждения, так что нужно использовать свет всего с одной длиной волны.
Если сопоставить только что описанный вариант осуществления способа по изобретению с уровнем техники, известным как GSDIM (микроскопия с истощением основного состояния с последующим испусканием единичного фотона), то, как и при GSDIM, речь идет о способе определения местоположений единичных молекул вещества в образце, чтобы получить с высоким пространственным разрешением отображение распределения молекул вещества в образце, причем молекулы вещества изначально находятся во флуоресцентном состоянии, причем молекулы вещества в их флуоресцентном состоянии могут быть возбуждены светом возбуждения, чтобы испускать свет флуоресценции, причем молекулы вещества могут быть переведены светом возбуждения из их флуоресцентного состояния в нефлуоресцентное темное состояние, причем молекулы вещества из их нефлуоресцентного состояния возвращаются в их флуоресцентное состояние, и причем расстояния между молекулами вещества в образце меньше минимального значения.
Также в соответствии с GSDIM, этот вариант осуществления способа по изобретению включает этап перевода такой части молекул вещества во флуоресцентное состояние светом возбуждения, чтобы расстояния между молекулами вещества, которые в текущий момент находятся во флуоресцентном состоянии в интересующей области образца, поддерживались на минимальном значении, и этап регистрации света флуоресценции молекул вещества во флуоресцентном состоянии, возбужденных светом возбуждения.
К этому добавляется, согласно изобретению, что минимальное значение расстояний между единичными молекулами вещества в интересующей области образца равно . Распределение интенсивности света возбуждения имеет по меньшей мере один локальный минимум, причем максимальная интенсивность света флуоресценции одной единичной молекулы в месте локального минимума распределения интенсивности света возбуждения составляет не больше половины от значения в месте максимальной интенсивности света возбуждения в образце. Позицию, по меньшей мере одного, локального минимума в интересующей области образца меняют. Свет флуоресценции возбужденных светом возбуждения молекул вещества во флуоресцентном состоянии для разных позиций, по меньшей мере одного локального минимума в образце может регистрироваться в области регистрации, окружающей по меньшей мере один локальный минимум, отдельно от других областей образца, испускающего свет флуоресценции. При этом расстояния между ближайшими соседними позициями, по меньшей мере одного локального минимума, в которых регистрируют свет флуоресценции возбужденных единичных молекул вещества, составляет не больше половины минимального значения d. Таким образом, интересующая область образца сканируют поэтапно с по меньшей мере одним локальным минимумом, который составляет не больше d/2.
В таком случае местоположения единичных молекул вещества выводят из кривой зависимости интенсивности света флуоресценции в области регистрации от позиций, по меньшей мере одного локального минимума в интересующей области образца. Этот вывод местоположения единичных молекул из кривой интенсивности света флуоресценции может осуществляться точно так же, как уже пояснялось выше на примерах. Аналогично регулирование интенсивности света возбуждения и расстояния между ближайшими соседними позициями, по меньшей мере одного локального минимума может быть таким, как описано выше.
По меньшей мере один локальный минимум может быть, в частности, точечным минимумом, позиция которого в интересующей области образца изменяется во всех направлениях протяженности образца, т.е. в случае двумерного образца в двух, а в случае трехмерного образца в трех направлениях. При точечном минимуме местоположения единичных молекул вещества во всех направлениях расширения образца можно вывести из кривой зависимости интенсивности света флуоресценции соответствующей молекулы от позиций, по меньшей мере одного, локального минимума в интересующей области образца. Разумеется, что при этом разумно учитывать кривую зависимости интенсивности света флуоресценции от позиций минимума во всех направлениях протяженности образца. Соответственно в случае двух- или трехмерного образца следует аппроксимировать кривую интенсивности света флуоресценции двух-, соответственно трехмерной функцией с минимумом.
В случае точечного минимума свет флуоресценции в области регистрации, окружающей, по меньшей мере один, минимум, может регистрироваться точечным детектором, расположенным конфокально соответствующему минимуму. При этом область регистрации должна иметь размеры нескольких, предпочтительно по меньшей мере трех расстояний между позициями минимума и быть расположенной концентрически с минимумом.
По меньшей мере один, минимум может также простираться вдоль линии или плоскости. Тогда позиция минимума в интересующей области образца изменяется в направлении сканирования поперек линии или плоскости. Местоположения единичных молекул вещества при этом выводятся в направлении сканирования из кривой зависимости интенсивности света флуоресценции соответствующей молекулы от позиций, по меньшей мере одного, локального минимума. Чтобы определить местоположения единичных молекул в другом направлении, можно по-разному ориентировать линию или плоскость относительно образца и соответственно смещать в разных направлениях сканирования. Однако в принципе местоположения единичных молекул в других направлениях в принципе можно определить и другими способами, например, локализацией.
Распределение интенсивности света возбуждения может иметь не один, а несколько локальных минимумов. В таком случае позиции этих нескольких минимумов в интересующей области образца изменяют вместе, причем свет флуоресценции возбужденных единичных молекул вещества регистрируется для каждого минимума отдельно. В частности, минимумы могут располагаться в форме решетки. В случае точечных минимумов решетка может быть двух- или трехмерной. Расстояния между несколькими минимумами в каждом случае должны быть больше дифракционного предела на длине волны света флуоресценции. Их следует выбирать также большими, чем возможные зоны регистрации, в которых регистрируется свет флуоресценции к каждому минимуму. Кроме того, предпочтительно, чтобы расстояния между минимумами были в несколько раз больше, чем расстояния между позициями отдельных минимумов в образце, чтобы измерить соответствующие интенсивности света флуоресценции. Предпочтительно, расстояния между минимумами по меньшей мере в три раза больше, чем расстояния между позициями минимумов в образце, в котором измеряют свет флуоресценции.
Свет флуоресценции единичных флуоресцентных молекул в образце можно зарегистрировать с помощью находящейся в состоянии покоя относительно образца матрицы датчиков света, на которую отображается образец, например, цифровой камерой, как, например, ПЗС-камера или КМОП-камера. Если, кроме того, расстояния между единичными молекулами вещества в интересующей области образца больше дифракционного предела на длине волны света флуоресценции, местоположения единичных молекул вещества можно дополнительно определить из распределения света флуоресценции соответствующей молекулы в целом, то есть независимо от позиции минимума, с помощью матрицы датчиков света путем локализации. Таким образом, можно воспользоваться теми же фотонами света флуоресценции, посредством которых определялось местоположение молекул в зависимости от позиций минимума в образце, используя их распределение в матрице датчиков света для второго определения местоположения молекул, причем минимум и его смещение в образце не имеют значения. Результаты обоих способов определения местоположения можно объединить для повышения общей точности.
Когда отдельные расстояния между единичными молекулами вещества в интересующей области образца меньше, чем дифракционный предел на длине волны света флуоресценции, так что свет флуоресценции невозможно полностью раздельно сопоставить соответствующим молекулам, определить местоположение этих молекул можно с помощью более сложных алгоритмов локализации. В этих алгоритмы местоположения, определенные способом согласно изобретению, можно вводить как начальные значения.
Когда способом согласно изобретению и путем локализации определяют различные местоположения для единичных молекул, их можно оценить в отношении фиксированной ориентации единичных молекул в образце. Это основано на том, что определение местоположения молекул вещества в образце в зависимости от распределения света флуоресценции, регистрируемого от них матрицей датчиков света, зависит от фиксированной ориентации молекул, но не от определения местоположений с помощью смещенного минимума.
Таким образом, предлагаемый изобретением способ можно осуществлять как дополнение к таким известным способам микроскопии как PALM, STORM, GSDIM или подобные, не мешая известным способам, но позволяя получить дополнительную информацию о местоположении единичных молекул другим путем, даже когда оцениваются те же самые зарегистрированные фотоны.
Когда свет флуоресценции регистрируется матрицей датчиков света, можно непрерывно считывать кадры из матрицы датчиков света и сопоставлять соответствующим позициям, по меньшей мере одного, минимума в образце. При этом можно сопоставить несколько кадров одной, а не нескольким позициям минимума. Однако это не исключает, что по меньшей мере один минимум непрерывно смещается в образце, если введенное этим "нарушение резкости" остается малым.
Устройство согласно изобретению, которое особенно хорошо подходит для осуществления предпочтительных вариантов осуществления способа по изобретению, содержит источник света возбуждения, которое выдает свет возбуждения, с помощью которого можно возбудить молекулы вещества, находящиеся во флуоресцентном состоянии, для испускания света флуоресценции и с помощью которого молекулы вещества можно перевести из их флуоресцентного состояния в нефлуоресцентное состояние. Кроме того, имеется оптическая система, которая направляет свет возбуждения на образец. Детекторное устройство регистрирует свет флуоресценции, испускаемое возбужденными светом возбуждения молекулами вещества во флуоресцентном состоянии. Согласно изобретению, светоформирующая оптика формирует распределение интенсивности света возбуждения в образце, имеющее по меньшей мере один локальный минимум, причем интенсивность света флуоресценции единичной молекулы в месте локального минимума распределения интенсивности света возбуждения составляет не больше половины от значения в месте максимальной интенсивности света возбуждения в образце. Кроме того, предусмотрено сканирующее устройство, с помощью которого можно установить позицию по меньшей мере одного минимума света возбуждения в разных местах в образце. Детекторное устройство регистрирует свет флуоресценции, испускаемое из дифракционной области регистрации, окружающей по меньшей мере один минимум, отдельно от света флуоресценции, испускаемого в других областях образца. При этом расстояния между ближайшими соседними позициями, по меньшей мере одного, минимума, в которых детекторное устройство регистрирует свет флуоресценции из области регистрации, составляет не больше значения . Таким образом, сканирующее устройство поэтапно сканирует интересующую область образца с шагом, составляющим не больше половины минимального значения d.
Предпочтительно, светоформирующая оптика направляет свет возбуждения с решеткой локальных минимумов на образец, а сканирующее устройство таким образом смещает распределение интенсивности относительно образца, чтобы интересующая область образца сканировалась полностью со слабовозбужденной зоной вокруг минимумов, в пределах которой вещество не возбуждено для испускания света флуоресценции. Каким образом можно реализовать сетку нулевых точек, описано в Chmyrov, A. et al: Nanoscopy with more than 100,000 'doughnuts', Nature methods, 10 737-740 (2013).
Чтобы установить границы по меньшей мере одного локального минимума или локальных минимумов в случае трехмерного образца в z-направлении оптической оси, можно использовать метод 4Pi. При этом можно привлечь те же меры для формирования минимума в z-направлении, какие указаны в Schmidt, R. et al.: Spherical nanosized focal spot unravels the interior of cells, Nature Meth. 5, 539-544 (2008) для формирования распределения интенсивности STED-света в том же направлении. Когда когерентные частичные лучи света возбуждения двумя наведенными друг против друга объективами направляют в образец и используют там для интерференции, можно также образовать трехмерную сетку локальных минимумов в образце.
Детекторное устройство предпочтительно содержит матрицу датчиков изображений, находящуюся в состоянии покоя относительно образца, на которую отображается образец. Это может быть реализовано с помощью ПЗС-камеры или КМОП-камеры.
Предпочтительные усовершенствования изобретения выявляются из формулы изобретения, описания и чертежей. Указанные в описании преимущества отличительных признаков и комбинаций нескольких отличительных признаков приводятся только для примера и могут дать результат альтернативно или совокупно, без необходимости обязательного достижения преимуществ вариантов осуществления изобретения. Не приводя этим к изменению предмета приложенной формулы, можно указать, что в отношении объема раскрытия первоначальных материалов заявки и патентов справедливо следующее: другие отличительные признаки выявляются из рисунков, в частности, представленной геометрии и относительных размеров некоторых деталей между собой, а также их относительного расположения и связи. Возможна и тем самым поощряется также комбинация отличительных признаков разных вариантов осуществления изобретения или отличительных признаков разных пунктов формулы изобретения, вне зависимости от выбранных взаимосвязей пунктов формулы. Это относится также к таким признакам, которые представлены на отдельных рисунках или указываются при их описании. Эти отличительные признаки могут также комбинироваться с отличительными признаками других пунктов формулы. Аналогично, приводимые в пунктах отличительные признаки могут не иметься в других вариантах осуществления изобретения.
Отличительные признаки, указанные в формуле изобретения и описании, следует понимать в отношении их количества так, что имеется точно указанное число или число, больше указанного, без обязательного явного использования выражения "по меньшей мере". Таким образом, когда, например, речь идет об одном элементе, это следует понимать так, что имеется точно один элемент, два элемента или больше элементов. Эти признаки могут быть дополнены другим признаками или быть единственными признаками, из которых получается соответствующий продукт.
Использующиеся в формуле изобретения позиции для ссылок никоим образом не ограничивают объем защищаемых формулой объектов изобретения. Эти позиции предназначены только для облегчения понимания притязаний.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Далее изобретение подробнее описывается и поясняется посредством представленных на фигурах предпочтительных примерах осуществления.
Фиг. 1 показывает интересующую область образца с множеством находящихся в ней молекул вещества, которым мечена интересующая структура в образце, причем во флуоресцентном состоянии находятся только единичные молекулы вещества,
фиг. 2 показывает для интересующей области образца сканирование с локальным минимумом распределения интенсивности света возбуждения, причем показана единственная флуоресцентная молекула в образце,
фиг. 3 показывает график интенсивности света флуоресценции единичной флуоресцентной молекулы согласно фиг. 2, зарегистрированного в различных позициях минимума,
фиг. 4 показывает график интенсивности света флуоресценции единичной флуоресцентной молекулы при сканировании образца с минимумом согласно фиг. 2 при заметно более высокой интенсивности света возбуждения,
фиг. 5 представляет график интенсивности света флуоресценции двух единичных флуоресцентных молекул при сканировании образца с минимумом согласно фиг. 2 при высокой интенсивности света возбуждения согласно фиг. 4,
фиг. 6 показывает в сечении суммарное распределение света флуоресценции флуоресцентной молекулы, зарегистрированное матрицей датчиков света,
фиг. 7 показывает сканирование интересующей области образца с линейной нулевой точкой из двух разных направлений,
фиг. 8 показывает сканирование интересующей области образца с решеткой точечных нулевых точек,
фиг. 9 представляет собой блок-схему одного варианта осуществления способа по изобретению,
фиг. 10 является блок-схемой другого варианта осуществления способа по изобретению, и
фиг. 11 показывает устройство согласно изобретению.
ОПИСАНИЕ ФИГУР
На фиг. 1 показана интересующая область 1 образца 2, в которой структура 3 помечена молекулами 4 вещества, имеющего флуоресцентное и нефлуоресцентное состояние. Если рассматривать все молекулы 4, т.е. независимо от их состояния, они находятся на очень маленьком расстоянии от их ближайших соседей, которое заметно меньше, чем дифракционный предел на длине волны света флуоресценции, которое можно получить от молекулы 4, если возбудить в ее флуоресцентном состоянии светом возбуждения. Эти расстояния также меньше, чем минимальное значение , где λ означает длину волны света возбуждения, n показатель преломления оптического материала, в котором образован по меньшей мере один минимум, α половинный угол раствора оптической системы, которая направляет свет возбуждения на образец, I означает максимальную интенсивность света возбуждения в образце 2, и зависящую от вещества интенсивность Is насыщения флуоресценции светом возбуждения. Это минимальное значение d соответствует точности пространственного отображения, которую можно достичь методом сканирующей флуоресцентной микроскопии высокого разрешения типа STED, GSD и RESOLFT.
Однако лишь единичные молекулы 5, которые отмечены также знаком "x", находятся во флуоресцентном состоянии, тогда как другие молекулы, которые здесь показаны точками, находятся в нефлуоресцентном состоянии и поэтому не возбуждаются светом возбуждения для испускания света флуоресценции. Единичные флуоресцентные молекулы 5 находятся в интересующей области 1 на таком расстоянии друг от друга, что соблюдается минимальное значение d, а предпочтительно также дифракционный предел на длине волны света флуоресценции. Последнее позволяет регистрировать свет флуоресценции, испускаемый единичными молекулами 5, раздельно, т.е. ставя его в соответствие определенной единичной молекуле 5. Перевод соответствующей малой части молекул 4 во флуоресцентное состояние 5 можно осуществить различными путями, какие употребляются в способах, известных под обозначениями PALM, STORM и GSDIM.
Фиг. 2 показывает, каким образом интересующую область 1 образца 2 нагружают светом 23 возбуждения и при этом сканируют с локальным минимумом 6 распределения интенсивности света 23 возбуждения с шагами, указанными стрелками. При этом эти шаги и результирующее расстояние 7 между ближайшими позициями минимума 6 в образце 2 составляют не больше половины дифракционного предела на длине волны света возбуждения и, тем самым, света флуоресценции возбужденных единичных молекул 5. На фиг. 2 знаком "x" показана всего одна единичная молекула. В области 8 в окрестности минимума 6 интенсивность света флуоресценции соответствующей единичной молекулы 5 зависит от ее расстояния до минимума 6. Вне области 8 интенсивность в данном случае могла бы быть насыщенной. Это означает, что интенсивность света 23 возбуждения вне области 8 настолько высока, что достигается максимальная интенсивность света флуоресценции единичных молекул 5.
Фиг. 3 показывает интенсивность IF света флуоресценции единичной молекулы 5, на которую находит точечный минимум 6 согласно фиг. 2, причем, хотя молекула 5 точно попадает в область сканирования с фиг. 2, при этом не точно совпадает с позициями xN минимума 6, в которых измеряют интенсивность IF света флуоресценции. При этом на фиг. 3 символами "x" на графике отложена зарегистрированная интенсивность IF света флуоресценции как функция различных позиций xN минимума 6 в образце 2. В данном случае под минимумом 6 речь идет о нулевой точке интенсивности света 23 возбуждения и, соответственно, также интенсивности IF света флуоресценции. Интенсивность IF света флуоресценции в минимуме падает по меньшей мере до 50% от интенсивности IF света флуоресценции вне области 8. Если аппроксимировать кривую интенсивности IF, зарегистрированной в позициях xN, функцией 9 с локальным минимумом, из позиции минимума можно вывести местоположение xM молекулы в образце, причем с более высокой пространственной точностью, чем расстояние между позициями xN. Расстояние между позициями xN составляет не больше, а в данном случае даже меньше половины минимального значения d. Минимальное значение d соответствует полуширине кривой интенсивности IF с учетом влияния минимума 6.
Функцию 9 с локальным минимумом можно адаптировать к ожидаемой кривой интенсивности IF при наезде на молекулу 5 минимума 6 с фиг. 2. Пунктирной линией 10 на фиг. 3 показана соответствующая кривая интенсивности IF света флуоресценции, когда минимум 6 с фиг. 2 не доходит до молекулы 5 на одну строку. Штрихпунктирная линия 11 показывает интенсивность IF для случая, когда минимум не доходит до молекулы на две строки. Из соответствующих фактических измеренных значений интенсивности IF света флуоресценции можно установить местоположение молекулы также в x-направлении, перпендикулярном y-направлению.
Фиг. 4 показывает кривую 12 зависимости интенсивности IF света флуоресценции от различных позиций xN минимума 6 с фиг. 2 в форме нулевой точки для значительно более высокой абсолютной интенсивности света 23 возбуждения вне минимума 6. Здесь вне слабовозбужденной зоны 32 непосредственно вокруг минимума 6 очень быстро достигается насыщение интенсивности IF света флуоресценции, испускаемого соответствующей флуоресцентной молекулой 5. В этих краевых условиях позицию xN минимума 6, в которой регистрируют нулевую интенсивность IF света флуоресценции, можно принять за местоположение молекулы xM, поскольку с этой отмеченной позицией xN граничат другие позиции xN минимума 6, в которых регистрируют свет флуоресценции соответствующей флуоресцентной молекулы 5.
Фиг. 5 показывает кривую зависимости интенсивности IF света флуоресценции от позиции xN минимума в образце в случае двух молекул 5 во флуоресцентном состоянии, которые находятся на очень близком расстоянии друг от друга в образце 2. Это близкое расстояние заметно меньше дифракционного предела на длине волны света флуоресценции. Поэтому здесь матрицей датчиков света, на которую отображается образец 2, невозможно по отдельности поставить в соответствие интенсивность IF единичным молекулам 5. Однако резкое падение интенсивности IF света флуоресценции как функции позиции xN минимума возникает раздельно для обеих молекул при интенсивности света 23 возбуждения, согласованной с минимальным расстоянием между молекулами, так как с повышением интенсивности света возбуждения размеры области 8, а также минимальное значение d, которое соответствует полуширине интенсивности IF в области минимума, уменьшаются. Когда расстояние между молекулами 5 становится больше или равным определенного выше минимального значения d, интенсивность IF света флуоресценции снова увеличивается в позиции минимума 6 между молекулами 5, так что отдельные падения интенсивности IF можно ставить в соответствие единичным молекулам.
На фиг. 5 показан случай, когда интенсивность IF света флуоресценции флуоресцентной молекулы 5, которая попадает прямо в минимум 6, не падает до нуля, так как здесь минимум 6 не является нулевой точкой. Напротив, интенсивность IF, когда одна из молекул 5 попадает в область минимума 6, снижается всего до около 90% от максимального значения. Тем не менее, по крайней мере, пока падение интенсивности IF остается меньше или равным 50%, это не влияет на определение местоположений xM1 и xM2 единичных молекул 5 из кривой интенсивности IF.
Фиг. 6 показывает суммированную по отдельным позициям xN интенсивность ΣΙ света флуоресценции единичной молекулы 5 в сечении распределения суммарной интенсивности ∑Ι, определенной матрицей датчиков света, на которую отображают образец и с помощью которой регистрируют свет флуоресценции. Тогда как до сих пор оценка, показанная на фиг. 3 и 4, зависела только от того, какую интенсивность I света флуоресценции единичной флуоресцентной молекулы 5 регистрируют в какой позиции xN минимума 6, но не от того, где регистрируют этот свет флуоресценции, пока его можно поставить в соответствие единичной флуоресцентной молекуле 5, то согласно фиг. 6 оценивают распределение 13 света флуоресценции единичной флуоресцентной молекулы 5, регистрируемого как целое матрицей датчиков света. Из центра тяжести распределения также можно определить местоположение молекулы в образце, причем независимо от позиции минимума 6, способом, известным как локализация. Однако при этом кажущееся местоположение x'M молекулы 5 в образце 2 зависит от возможной фиксированной ориентации и, соответственно, от всегда аналогичным образом упорядоченного электрического дипольного момента молекулы в образце 2, что ведет к пространственно направленному распределению испущенного света флуоресценции (смотри Engelhardt, J. et al., Molecular orientation affects localization accuracy in superresolution far-field fluorescence microscopy, Nano Lett. 2011 Jan 12; 11(1):209-13). Это не так для способа определения местоположения, проиллюстрированного на фиг. 3 и 4.
На фиг. 2 был показан точечный минимум 6. С этим минимумом определить позицию каждой единичной флуоресцентной молекулы можно при однократном сканировании образца (двухмерного образца в двух направлениях, трехмерного образца в трех направлениях). Если, согласно фиг. 7, используют линейный минимум или минимум в форме плоскости (перпендикулярной плоскости рисунка), образец сканируют с минимумом поперек профиля минимума, чтобы определить его позицию в соответствующем направлении сканирования 14, 15. Соответственно двухмерный образец, какой показан на фиг. 7 (a) и (b), сканируют в по меньшей мере двух, предпочтительно ортогональных, направлениях сканирования 14, 15, чтобы полностью определить местоположения единичных молекул. При этом в области минимума в форме линии или плоскости одновременно может находиться несколько флуоресцентных молекул 5, пока испускаемый ими свет флуоресценции можно разделить.
Свет 23 возбуждения также не должен нагружать весь образец 2 и всю интересующую область 1 образца 2 вне минимума 6 с такой интенсивностью, чтобы всегда можно было регистрировать свет флуоресценции единичных молекул 5, если они не находятся точно в слабовозбужденной зоне 32 в окрестности минимума 6. Напротив, можно сконцентрировать интенсивность света 23 возбуждения на область вблизи минимума 6. При этом указанная область может заканчиваться следующим минимумом, после которого интенсивность света 23 возбуждения снова возрастает, или выходить из него. Если в первом случае для определения местоположения единичных молекул 5 можно также использовать следующий минимум, во втором случае изменение интенсивности IF света флуоресценции флуоресцентной молекулы 5 идентифицируется в большем числе позиций xN минимума 6 в образце 2 и, таким образом, может не учитываться при определении местоположения xM соответствующей флуоресцентной молекулы 5.
Фиг. 8 показывает, как можно с решеткой точечных локальных минимумов 6 сканировать интересующую область 1 образца 2, используя намного меньше шагов, чем в случае всего одного минимума 6 согласно фиг. 2. При этом для сканирования почти всей показанной интересующей области 1 достаточно всего четырех минимумов, с которыми можно захватить 20 позиций в плоскости. Такой рисунок минимумов, как показанный на фиг. 8, можно в принципе реализовать путем наложения ортогонально ориентированных линейных сеток, создаваемых путем наложения когерентных частичных лучей (смотри Chmyrov, A. et al: Nanoscopy with more than 100,000 'doughnuts', Nature methods 10, 737-740 (2013)).
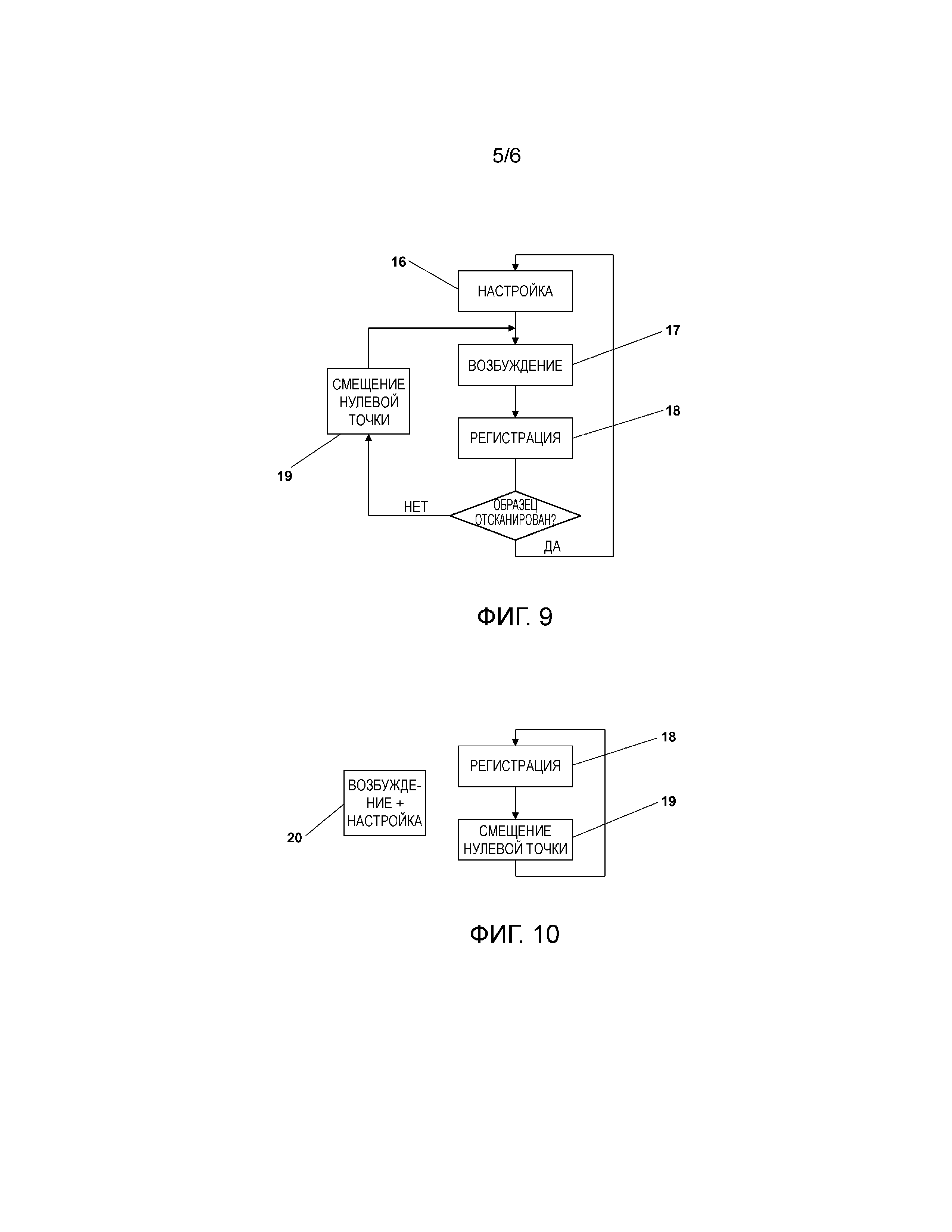
Фиг. 9 показывает базовый алгоритм способа согласно изобретению. На этапе 16 устанавливают часть от всех имеющихся молекул 4 вещества, которые находятся как единичные молекулы 5 во флуоресцентном состоянии. На этапе 17 молекулы 5, находящиеся во флуоресцентном состоянии, возбуждают для испускания света флуоресценции, светом 23 возбуждения с распределением интенсивности, которое имеет по меньшей мере один локальный минимум 6. Этот свет флуоресценции регистрируют на этапе 18 с идентификацией текущей позиции минимума 6 в образце 2. Затем минимум 6 на этапе 19 смещают на малое расстояние от последней позиции, не более чем на d/2. Затем снова происходит возбуждение 17 и регистрация 18, пока не будет отсканирован весь образец. После этого новую часть молекул 4 вещества переключают во флуоресцентное состояние, то есть при повторении этапа 16 случайным образом выбирают другие единичные молекулы 5, после чего следует повторение цикла из этапов 17-19. Показанные на фиг. 9 этапы 16-19 реализуют до тех пор, пока с их помощью не будет определено местоположение стольких единичных молекул 5 в образце 2, что распределение совокупности молекул 4 в образце 2 будет воспроизводиться с желаемой точностью. Для этого не требуется определять позиции всех молекул 4 в образце 2. Напротив, достаточно определить местоположение достаточного числа представителей молекул 4 в форме единичных молекул 5.
Когда свет флуоресценции при способе, показанном на фиг. 9, регистрируют на этапе 18 матрицей датчиков света, на которую отображается образец 2, распределение 13 всего света флуоресценции, регистрируемое для каждой единичной флуоресцентной молекулы 5 матрицей датчиков света, можно использовать также для того, чтобы определить ее позицию путем локализации (смотри фиг. 6).
Согласно способу по изобретению, этапы 16-19, показанные на фиг. 9 как отдельные, можно также прочно объединить. Это показано на фиг. 10. Здесь на этапе 20 свет возбуждения, служащий одновременно светом настройки, предназначен для того, чтобы единичные молекулы 5, остающиеся во флуоресцентном состоянии, отстояли друг от друга на достаточно большое расстояние, чтобы регистрировать их свет флуоресценции по отдельности, и чтобы эти единичные молекулы 5 возбуждались для испускания света флуоресценции по меньшей мере снаружи по меньшей мере одного минимума 6 распределения интенсивности света 23 возбуждения.
Параллельно этому протекает цикл этапов регистрации 18 света флуоресценции от единичных флуоресцентных молекул 5 в образце 2 и смещения 19 минимума 6. При этом смещение можно даже осуществлять непрерывно, если результирующее перемещение минимума 6 в образце 2 в пределах каждого временного интервала, в котором регистрируется интенсивность IF света флуоресценции, остается малым сравнительно с требуемой точностью при определении местоположений молекул 5.
То, что этот способ осуществим, было неожиданным, учитывая то, что было известно о GSD-микроскопия с единственной длиной волны (смотри DE10 2005 034443 A1) и о GSDIM-микроскопии. Способ согласно изобретению исходит, собственно, из того, что молекулы 4, попавшие в зону минимума 6 света 23 возбуждения, из-за падающей там интенсивности света 23 возбуждения не сразу возвращаются в свое флуоресцентное состояние, но что устанавливаемое интенсивностью света 23 возбуждения распределение единичных молекул 5, остающихся в их флуоресцентном состоянии, сохраняется в течение довольно большого времени, чтобы отсканировать интересующую область 1 образца 2 с минимумом 6. Однако по меньшей мере для локальных минимумов 6 с малой зоной 8 и, соответственно, еще меньшей полушириной d и при сравнимом с временем пребывания единичной молекулы 5 в ее флуоресцентном состоянии быстрым перемещении минимумов 6 в образце 2 сниженная интенсивность света 23 возбуждения в минимумах 6 не имеет существенного влияния на распределение молекул 4 вещества по их флуоресцентному и нефлуоресцентному состояниям. Таким образом, местоположения единичных молекул 5 можно определить во время их пребывания во флуоресцентном состоянии, и этому определению не препятствуют молекулы 4, снова возвращаемые в области минимумов во флуоресцентное состояние. При необходимости вероятности перехода между флуоресцентным и нефлуоресцентным состоянием молекул 4, которые определяются, в частности, интенсивностью света 23 возбуждения, для способа по изобретению устанавливаются подходящим образом. Для этого в образец 2 можно, например, добавить подходящие реактивы и/или скорректировать подходящим образом концентрацию кислорода в образце 2. Полезными могу быть также минимумы 6 только со слабовозбужденными зонами 32 малого размера, которые сравнительно быстро перемещаются между их отдельными позициями в образце 2.
На фиг. 11 изображено устройство 21 для осуществления способа по изобретению. Устройство содержит источник 22 света возбуждения, которое выдает свет 23 возбуждения. Посредством светоформирующей оптики 24 свет 23 возбуждения формируется так, чтобы он после фокусирования объективом 25 имел в образце 2 желаемое распределение интенсивности с по меньшей мере одним минимумом 6. Чтобы сместить минимум 6 на шаг максимум d/2 в пределах образца 2, предусмотрено сканирующее устройство 26. Исходящий от образца 2 свет 27 флуоресценции отбирается светоделителем 28 к матрице 29 датчиков света, на которую образец 2 отображается объективом 25. Матрица 29датчиков света позволяет оценить регистрируемую интенсивность света 27 флуоресценции от образца 2 также в отношении локализации единичных молекул 5 в образце 2. Однако в соответствии с настоящим изобретением, для определения местоположения единичных молекул 5 в образце 2 достаточно также иметь точечный детектор 30, показанный на фигуре пунктирной линией, на который другим светоделителем 31 отбирается свет 27 флуоресценции (после сканирующего устройства 26, если смотреть от образца) и который регистрирует свет флуоресценции из зоны регистрации, окружающей минимум 6. Сканирующее устройство 26 выполнено так, чтобы оно устанавливало позиции минимума 6 света 23 возбуждения, в которых регистрируется флуоресцентное сечение 27 образца 2, по меньшей мере настолько плотно, чтобы расстояния 7 между ними составляли не больше дифракционного предела на длине волны света 23 возбуждения и света 27 флуоресценции.
СПИСОК ПОЗИЦИЙ ДЛЯ ССЫЛОК
Реферат
Изобретение относится к способам определения местоположения единичных молекул вещества в образце. Единичные молекулы вещества находятся во флуоресцентном состоянии, в котором их можно возбуждать светом возбуждения для испускания света флуоресценции. Расстояние между единичными молекулами вещества в интересующей области образца поддерживается на минимальном значении d=, где λ - длина волны света возбуждения, n - показатель преломления оптического материала, α - половинный угол раствора оптической системы, которая направляет свет возбуждения на образец, I - максимальная интенсивность света возбуждения в образце, I- зависящая от вещества интенсивность света возбуждения при насыщении флуоресценции. Единичные молекулы вещества возбуждают светом возбуждения для испускания света флуоресценции. Распределение интенсивности света возбуждения содержит по меньшей мере одну нулевую точку. Свет флуоресценции возбужденных единичных молекул вещества регистрируют в различных позициях (x) по меньшей мере одной нулевой точки распределения интенсивности света возбуждения в интересующей области образца. Расстояния между ближайшими соседними позициями (x) по меньшей мере одной нулевой точки распределения интенсивности света возбуждения, в которых регистрируют свет флуоресценции возбужденных единичных молекул вещества, составляет не более половины минимального значения d. Местоположения (x) единичных молекул вещества выводят из кривой зависимости интенсивности (I) света флуоресценции соответствующей молекулы от позиций (x) по меньшей мере одной нулевой точки распределения интенсивности света возбуждения в интересующей области образца. 2 н. и 23 з.п. ф-лы, 11 ил.

Комментарии