Средство для профилактики и/или лечения нежелательной воспалительной активности и профилактики рака - RU2279282C2
Код документа: RU2279282C2
Чертежи












Описание
Данное изобретение относится к применению штаммов Lactobacillus salivarius.
Защитные механизмы, предохраняющие желудочно-кишечный тракт человека от колонизации кишечными бактериями, весьма сложны и включают в себя как иммунологические, так и неиммунологические аспекты (V.J.McCracken and H.R.Gaskins, "Probiotics a critical review", Horizon Scientific Press, UK, 1999, p.278). Природные защитные механизмы включают в себя низкое значение рН среды желудка, соли желчных кислот, перистальтику, муциновые слои и антимикробные соединения, такие как лизоцим (D.C.Savage, "Microbial Ecology of the Gut", Academic Press, London, 1997, p.278). Иммунологические механизмы включают в себя специализированные лимфоидные узелки, расположенные под М-клетками, называемые пейеровыми бляшками, которые распространены на всем протяжении тонкой и ободочной кишки (M.F.Kagnoff, Gastroenterol. 1993, 105, 1275). Люминальные антигены, представленные в этих местах, приводят к стимуляции соответствующих субпопуляций Т- и В-клеток с образованием цитокиновых сетей и секрецией антител в желудочно-кишечный тракт (M.R.Neutra and J-P Kraehenbuhl, "Essentials of mucosal immunology", Academic Press, San Diego, 1996, p.29; M.E. Lamm, Ann. Rev. Microbiol. 1997, 51, 311). Кроме этого, представление антигенов может происходить через эпителиальные клетки интраэпителиальным лимфоцитам и лежащим ниже иммунным клеткам собственной пластинки (S.Raychaudhuri et al. Nat Biotechnol, 1998, 16, 1025). Следовательно, хозяин вносит значительный вклад в иммунологическую защиту желудочно-кишечного тракта. Однако, поскольку слизистая оболочка желудочно-кишечного тракта является самой большой поверхностью, посредством которой хозяин взаимодействует с внешней средой, должны присутствовать определенные контрольные механизмы для регулирования иммунной реактивности на 100 тонн пищи, которые обрабатываются желудочно-кишечным трактом в течение среднего времени жизни (F. Shanahan. "Physiology of the gastrointestinal tract", Raven Press, 1994, p.643). Кроме этого, кишечник населен более чем 500 видами бактерий, насчитывающих 1011-1012/г в ободочной кишке. Таким образом, эти контрольные механизмы должны быть способны отличать непатогенные прикрепленные бактерии от инвазивных патогенов, которые могли бы вызвать значительное нарушение у хозяина. Фактически кишечная флора способствует защите хозяина, конкурируя с новыми проглоченными потенциально патогенными микроорганизмами.
Поглощение непатогенных, или пробиотических, бактерий приводит к улучшению иммунных параметров у здоровых добровольцев. Примеры таких иммуномодуляторных эффектов приведены в Таблице 1.
Бактерии, присутствующие в желудочно-кишечном тракте человека, могут стимулировать воспаление. Аберрантные иммунные ответы на свойственную микрофлору вовлечены в некоторые болезненные состояния, такие как воспалительное заболевание кишечника (Brandzeag P. et al., Springer Semin. Immunopathol, 1997, 18, 555). Антигены, ассоциированные с нормальной флорой, обычно имеют результатом иммунологическую толерантность, и неосуществление достижения этой толерантности является главным механизмом воспаления слизистой оболочки (Stallmach A. et al., Immunol. Today, 1998, 19, 438). Доказательством такого ухудшения толерантности является увеличение уровней антител, направленных против кишечной флоры у пациентов с IBD (воспалительное заболевание кишечника).
В WO-A-98/35014 описаны штаммы Lactobacillus salivarius, выделенные из иссеченного и промытого желудочно-кишечного тракта человека, которые ингибируют широкий ряд грамположительных и грамотрицательных микроорганизмов и которые секретируют в бесклеточный супернатант продукт, имеющий антимикробную активность.
Изложение сущности изобретения
Иммунная система предназначена для защиты ткани хозяина и уничтожения поступающих патогенов. После распознавания присутствия бактериальной клетки клетки иммунной системы становятся активными и устраняют бактериальную угрозу. Продуцирование медиаторов воспаления стимулирует клеточную активацию и уничтожение патогена.
Неожиданно авторы изобретения обнаружили, что штаммы Lactobacillus salivarius индуцируют противовоспалительное действие in vitro и in vivo. Обнаружено, что иммунное восприятие Lactobacillus salivarius приводит к подавлению воспалительной активности. Преднамеренное поглощение больших количеств Lactobacillus salivarius приводит к подавлению воспалительной активности. Вследствие этого данное изобретение имеет значительную потенциальную терапевтическую ценность для профилактики или лечения нежелательных воспалительных ответов, таких как воспалительное заболевание кишечника.
Lactobacillus salivarius представляет собой микроорганизм-комменсал, первоначально выделенный из микробной флоры желудочно-кишечного тракта человека. Иммунная система в желудочно-кишечном тракте не может иметь ясно выраженной реакции на представителей этой флоры, поскольку вытекающая из этого воспалительная активность разрушила бы также клетки хозяина и нарушила бы функцию тканей. Следовательно, существует некоторый(ые) механизм(ы), посредством которого(ых) иммунная система может распознавать непатогенных представителей-комменсалов желудочно-кишечной флоры в отличие от патогенных микроорганизмов. Это обеспечивает ограничение поражения тканей хозяина, при этом защитный барьер по-прежнему сохраняется
Согласно данному изобретению предложено применение штамма Lactobacillus salivarius в профилактике и/или лечении нежелательной воспалительной активности.
Согласно изобретению нежелательная воспалительная активность может представлять собой нежелательную желудочно-кишечную воспалительную активность, как, например, воспалительное заболевание кишечника, например болезнь Крона, неспецифический язвенный колит, синдром раздраженной толстой кишки, воспаление брюшного кармана (pouchitis) или постинфекционный колит.
Желудочно-кишечная воспалительная активность также может представлять собой диарейное заболевание. Диарейное заболевание может быть обусловлено Clostridium difficile или быть обусловлено ротавирусом (Rotovirus). Диарейное заболевание также может представлять собой постинфекционное диарейное заболевание.
Воспалительная активность может быть обусловлена раком желудочно-кишечного тракта или системным воспалительным заболеванием, таким как ревматоидный артрит.
В другом случае нежелательная воспалительная активность может быть обусловлена аутоиммунным расстройством.
Еще в одном случае нежелательная воспалительная активность может быть обусловлена раком.
В качестве одного воплощения данного изобретения предложено применение штамма Lactobacillus salivarius в профилактике рака.
В качестве другого воплощения данного изобретения предложено применение штамма Lactobacillus salivarius, причем Lactobacillus salivarius содержится в препарате.
Данный препарат предпочтительно включает в себя другой пробиотический материал. Альтернативно или дополнительно данный препарат включает в себя пребиотический материал.
В идеальном случае препарат включает в себя носитель для приема внутрь. Носитель для приема внутрь может представлять собой фармацевтически приемлемый носитель, такой как таблетка, капсула или порошок.
Предпочтительно носитель для приема внутрь представляет собой белок и/или пептид, в частности белки и/или пептиды, богатые глутамином/глутаматом; липид; углевод; витамин; минеральный и/или микроэлемент.
Носитель для приема внутрь наиболее предпочтительно представляет собой пищевой продукт, такой как сквашенное молоко, йогурт, замороженный йогурт, сухое молоко, концентрат молока, плавленые сыры, заправки или напитки.
В одном из воплощений Lactobacillus salivarius представлена в препарате в количестве более чем 106 колониеобразующих единиц (КОЕ) на грамм системы доставки.
В другом воплощении данный препарат включает в себя адъювант. Данный препарат может включать в себя бактериальный компонент. Альтернативно или дополнительно данный препарат может включать в себя лекарственное начало. Данный препарат также может включать в себя биологическое соединение.
В качестве одного из воплощений данного изобретения предложено применение штамма Lactobacillus salivarius, причем этот штамм или препарат предназначен для введения животным. Предпочтительно животное представляет собой млекопитающее, наиболее предпочтительно - человека.
В качестве другого воплощения данного изобретения предложено применение штамма Lactobacillus salivarius, причем Lactobacillus salivarius вызывает изменения в иммунологическом маркере после введения в систему, содержащую клетки, которые взаимодействуют с иммунной системой, и клетки иммунной системы.
Клетки, которые взаимодействуют с иммунной системой, предпочтительно представляют собой эпителиальные клетки. Наиболее предпочтительным иммунологическим маркером является цитокин, особенно фактор некроза опухоли α (TNFα).
Предпочтительно клетки, которые взаимодействуют с иммунной системой, и клетки иммунной системы предпочтительно имеют соответствующее происхождение.
В одном из воплощений клетки, которые взаимодействуют с иммунной системой, имеют желудочно-кишечное, респираторное или мочеполовое происхождение.
. В другом воплощении клетки иммунной системы имеют желудочно-кишечное, респираторное или мочеполовое происхождение.
В качестве следующего воплощения данного изобретения предложено применение штамма Lactobacillus salivarius, где штамм Lactobacillus salivarius представляет собой Lactobacillus salivarius подвид salivarius. Предпочтительно Lactobacillus salivarius имеет человеческое происхождение, наиболее предпочтительно из иссеченного и промытого желудочно-кишечного тракта человека.
Предпочтительно Lactobacillus salivarius ингибирует широкий ряд грамположительных и грамотрицательных микроорганизмов. Наиболее предпочтительно, она секретирует обладающий антимикробной активностью продукт в бесклеточный супернатант, причем упомянутая активность продуцируется только растущими клетками и разрушается протеиназой К и проназой Е.
Особенно предпочтительным штаммом Lactobacillus salivarius является штамм Lactobacillus salivarius UCC 118 или его мутант либо вариант.
Штамм Lactobacillus salivarius UCC 118 был депонирован в NCIMB 27 ноября 1996 г. и получил регистрационный номер NCIMB 40829. Данный штамм Lactobacillus salivarius описан в WO-A-98/35014.
Lactobacillus salivarius может представлять собой генетически модифицированный мутант или это может быть встречающийся в природе вариант Lactobacillus salivarius.
Предпочтительно Lactobacillus salivarius представлен в виде жизнеспособных клеток. Или же Lactobacillus salivarius может быть в виде нежизнеспособных клеток.
Краткое описание графических материалов
На Фиг.1 представлен график с уровнями С. perfringens у мышей, поглощающих UCC118, в сравнении с группой, поглощающей плацебо (р<0,05). Результаты отражены в форме графика в виде средних значений логарифмов ± среднеквадратическая ошибка для каждой из групп.
На Фиг.2 представлена гистограмма показателей воспаления для мышей, поглощающих UCC118, в сравнении с контрольными мышами. Результаты представлены в виде среднего значения ± среднеквадратическая ошибка для каждой из групп.
На Фиг.3 представлен график уровней TNFα (фактор некроза опухоли α) в продолжение шести недель, в течение которых пациенты поглощают UCC118. Результаты представлены в виде графика среднего значения уровня TNFα (пг/мл) для каждого момента времени (n=22).
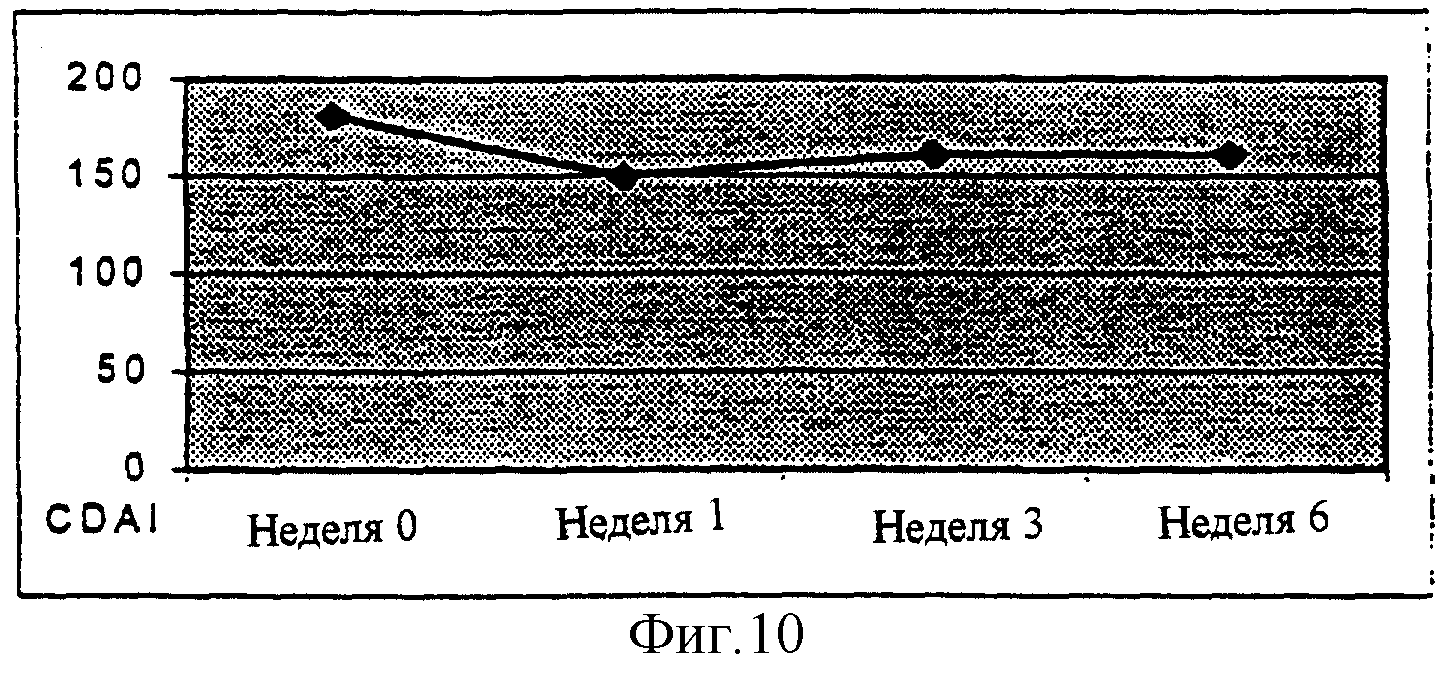
На Фиг.4 представлен график показателей CDAI (индекс активности болезни Крона) для пациентов, поглощающих UCC118 в продолжение курса пробиотического питания. Показатели CDAI уменьшились в среднем от 180 до 160.
На Фиг.5 представлен график продуцирования цитокинов in vitro после подвергания воздействию UCC118. Результаты выражены в пг/мл.
На Фиг.6 представлена гистограмма уровней внеклеточных TNFα, IL-1RA, IL-6, sIL-6R и IFNα после подвергания воздействию Lactobacillus salivarius UCC118.
На Фиг.7 представлен генный ряд со специфическими последовательностями генов 268 цитокинов и родственных молекул для исследования иммунного ответа на UCC118. Нижняя панель иллюстрирует контрольную культуру, в то время как верхняя панель иллюстрирует экспрессию генов цитокинов мононуклеарными клетками периферической крови (РВМС) после подвергания воздействию UCC118; и
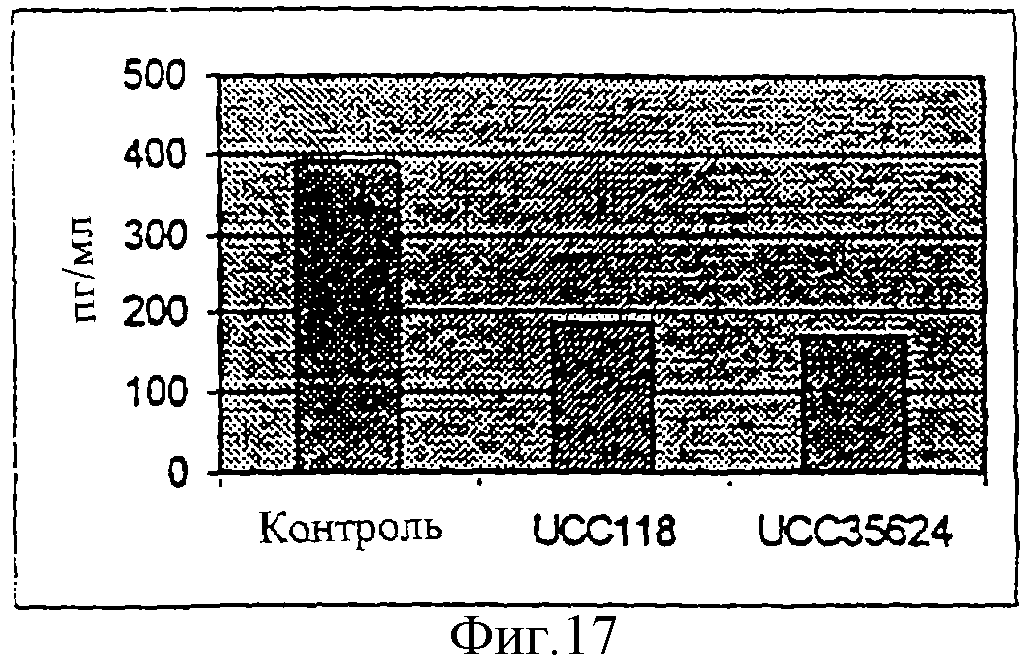
на Фиг.8 представлена гистограмма уровней TNFα в присутствии различных бактериальных штаммов.
Подробное описание
Авторы изобретения разработали критерии селекции in vitro пробиотических бактерий, которые показывают определенное действие in vivo на своего хозяина, такое как модуляция микрофлоры ЖКТ (желудочно-кишечный тракт) и модуляция относящегося к слизистой оболочке иммунного ответа, приводящая к продуцированию секреторных антител, специфичных к поглощенному штамму. Авторами изобретения обнаружено, что Lactobacillus salivarius подвид salivarius UCC118 не только выживает при прохождении по всему желудочно-кишечному тракту и прилипает к линиям клеток кишечника человека, но также, к удивлению, оказывает противовоспалительное действие.
В общем случае применение пробиотических бактерий осуществляют в форме жизнеспособных клеток. Однако оно также может быть распространено и на нежизнеспособные клетки, такие как убитые культуры или композиции, содержащие полезные факторы, экспрессируемые пробиотическими бактериями. Это может охватывать термически убитые микроорганизмы или микроорганизмы, убитые воздействием измененного рН или под действием давления. Приготовление продукта с нежизнеспособными клетками является более простым, клетки можно легко включить в фармацевтические препараты, а требования к их хранению менее жесткие, чем для жизнеспособных клеток. Lactobacillus casei YIT 9018 представляет собой пример эффективного применения термически убитых клеток в качестве способа лечения и/или предупреждения роста опухоли, как описано в патенте США №4347240.
Не известно, требуются ли неповрежденные бактерии для проявления противовоспалительного действия или могут ли быть использованы только отдельные активные компоненты по данному изобретению. Идентифицированы провоспалительные компоненты некоторых бактериальных штаммов. Провоспалительные действия грамотрицательных бактерий опосредованы липополисахаридом (LPS). Сам по себе LPS стимулирует провоспалительную сеть, частично вследствие связывания LPS с рецептором CD14 на моноцитах. Считается, что компоненты пробиотических бактерий обладают противовоспалительной активностью благодаря действиям целой клетки. По мере выделения этих компонентов прогнозируется воздействие фармацевтического качества.
Данное изобретение станет более понятным из следующих примеров.
Пример 1: подробное описание выявления in vivo противовоспалительных действий Lactobacillus salivarius, в частности подвида salivarius UCC118.
Мышиная модель воспаления желудочно-кишечного тракта
Аберрантные иммунные ответы на собственную микрофлору вовлечены в некоторые болезненные состояния, такие как воспалительное заболевание кишечника (Brandzeag P. et al. Springer Semin. Immunopathol, 1997, 18, 555). Антигены, ассоциированные с нормальной флорой, обычно приводят к иммунологической толерантности, и неспособность достичь этой толерантности является главным механизмом воспаления слизистой оболочки (Stallmach A. et al., Immunol. Today, 1998, 19, 438). Доказательством такого ухудшения толерантности является увеличение уровней антител, направленных против кишечной флоры, у пациентов с IBD. Кроме этого, некоторые мышиные модели, предрасположенные к патологическим воспалительным нарушениям в желудочно-кишечном тракте, остаются здоровыми в том случае, когда они размещены в стерильных условиях или когда подвергаются лечению антибиотиками (Kuhn R. et al. Cell, 1993, 75, 263; Panwala С. M. et al. J. Immunol., 1998, 161,5733).
Мыши C57BL/6 с нокаутом интерлейкина-10 (IL-10) предрасположены к развитию энтероколита в присутствии бактериальной флоры тонкого кишечника. При содержании в стерильных условиях у мышей с нокаутом IL-10 заболевание не развивается (Kuhn R., et al. Cell, 1993, 75, 263). Поскольку патогенез этой болезни связан с флорой тонкого кишечника, устранение специфических компонентов этой флоры может оказывать благотворное действие на тяжесть этого заболевания.
Lactobacillus salivarius подвид salivarius UCC118 представляет собой пробиотическую бактерию, выделенную из подвздошной кишки здорового человека. Она пригодна для желудочно-кишечной колонизации, поскольку удовлетворяет многим критериям, установленным для отбора пробиотических штаммов. Они включают в себя такие признаки, как толерантность к желчи, устойчивость к кислоте и адгезию in vitro к линиям клеток ободочной кишки человека. Проводили исследования приема пищи здоровыми людьми и отметили значительную модификацию желудочно-кишечной флоры. Кроме того, UCC118 воспринимался иммунной системой слизистой оболочки, что приводило к продуцированию и секреции IgA, специфичного к UCC118.
Таким образом, UCC118 выживает при прохождении по желудочно-кишечному тракту, модулирует флору кишечника и воспринимается иммунной системой слизистой оболочки. С помощью мышиной модели энтероколита было проведено исследование влияния этих пробиотических бактерий на модуляцию воспалительных реакций в желудочно-кишечном тракте. Кроме того, авторы изобретения исследовали роль Lactobacillus salivarius подвид salivarius UCC118 в уменьшении скорости неопластического преобразования в желудочно-кишечном тракте.
В течение 16 недель изучали двадцать IL-10 KO-мышей (мыши, нокаутированные по IL-10) (десять поглощали пробиотические микроорганизмы в молоке и 10 поглощали немодифицированное молоко). С целью определения количества экскретируемых молочнокислых бактерий, Clostridium perfringens, бактероидов, колиформ, бифидобактерий и энтерококков еженедельно проводили микробный анализ фекалий. После умерщвления сделали микробиологическую и гистологическую оценку содержимого тонкого и толстого кишечника.
У тестируемых животных по сравнению с контрольными были значительно снижены уровни колиформ и энтерококков в фекалиях. После умерщвления наблюдали существенное сокращение числа С. perfringens у тестируемых мышей (Фиг.1). В тестируемой группе не было летальных исходов по сравнению с двумя смертями от внезапного и быстро развившегося колита в контрольной группе. Только у одной тестируемой мыши развилась аденокарцинома ободочной кишки по сравнению с пятью в контрольной группе. Сообразно оцененное воспаление слизистой оболочки у тестируемых животных ниже, чем у контрольных мышей (Фиг.2). Уменьшение частоты образования опухолей после поглощения UCC118 может быть связано с пониженным уровнем воспаления в желудочно-кишечном тракте или может быть результатом удаления проканцерогенных элементов желудочно-кишечной флоры (Rumney C.J., et al. Carcinogenesis, 1993, 14, 79; Rowland I.R. (1995). In: Gibson G.R. (ed). Human colonic bacteria: role in nutrition, physiology and pathology, pp 155-174. Boca Raton CRC Press; Darveau D. Nat. Biotech., 1999, 17, 19).
В заключение, поглощение Lactobacillus salivarius UCC118 приводит к существенной модуляции флоры кишечника и уменьшению скорости смертности, частоты заболеваемости раком и показателей заболевания.
Пример 2: Исследование на людях с использованием UCC118, проведенное на пациентах с болезнью Крона в активной стадии.
Воспалительное заболевание кишечника (IBD) охватывает ряд воспалительных расстройств желудочно-кишечного тракта, включая как болезнь Крона, так и неспецифический язвенный колит.
Пациентов, страдающих от болезни Крона в активной стадии, лечили с помощью UCC118. Кратко: 22 пациента поглощали UCC118 в кисломолочном продукте в течение 6 недель. Микробиологические и иммунологические измерения проводили в моменты времени 0 недель, 1 неделя, 3 недели и 6 недель. Исследования с плацебо-контролем не проводили.
В продолжение курса кормления производили измерение системных уровней цитокинов; в частности фактора некроза опухоли α (TNFα), провоспалительного цитокина, который вовлечен в патогенез многих воспалительных болезненных состояний, включая воспалительное заболевание кишечника. Современные способы лечения воспалительного заболевания кишечника направлены особенно на снижение уровней TNFα (Present D.H., et al. New Eng. J. Med., 1999, 340, 1398). В этом испытании после поглощения UCC118 уровни системного TNFα были снижены (Фиг.3).
Кроме этого, пациентов оценивали в отношении их индекса активности болезни Крона (CDAI) в продолжение шестинедельного срока исследования. Этот индекс дает оценку здоровья в целом и благополучия каждого пациента (Фиг.4). В целом индекс активности болезни слегка улучшился для большинства индивидуумов в исследовании. Они представляют собой пациентов с болезнью в умеренно активной стадии, и следовало бы ожидать, что их оценки CDAI увеличатся. Однако после лечения UCC118 оценки CDAI не увеличились, и фактически они улучшились в среднем от 180 до 160.
Пример 3: подробное описание выявления in vitro механизмов, лежащих в основе противовоспалительных действий Lactobacillus salivarius, в частности подвида salivarius UCC118.
Для этих исследований использовали ряд методик, включая ELISA (иммуноферментный твердофазный анализ) (определение внеклеточных белков), проточную цитометрию (определение внутриклеточных белков) и ряды экспрессии кДНК (экспрессия мРНК). В частности, запланировали исследование экспрессии фактора некроза опухоли α вследствие его клинической значимости, и при использовании всех трех методик отметили подавление продуцирования этого цитокина после подвергания воздействию UCC118.
Используя транслуночную (transwell) систему анализа с эпителиальными клетками и мононуклеарными клетками периферической крови, с помощью ELISA измерили уровни внеклеточных цитокинов. После совместной инкубации с UCC118 количество продуцированного TNFα было значительно снижено по сравнению с контрольными культурами. Более того, уровни IL-1RA (рецепторный антагонист IL-1) и IFNγ (интерферон γ) понизились, в то время как уровни IL-6 и растворимого рецептора IL-6 (SIL-6R) повысились (Фиг.5). Внутриклеточное окрашивание в отношении TNFα подтвердило результат анализа ELISA, поскольку уровни TNFα оказались более низкими для UCC118-стимулированного образца по сравнению с контрольными образцами.
Фиг.6 демонстрирует имеющую место трехклеточную передачу сигнала. Совместное инкубирование РВМС и штамма Lactobacillus salivarius UCC118 приводит к стимулированию продуцирования TNFα. Однако совместное инкубирование РВМС, штамма Lactobacillus salivarius UCC118 и эпителиальных клеток (СаСо-2 клеток) приводит к существенному ингибированию продуцирования TNFα. Таким образом, в трехклеточной модели имеет место существенно отличная схема передачи сигнала по сравнению лишь с бактериями и РВМС.
Генные ряды определяют количество мРНК в популяции клеток. Авторы изобретения стимулировали мононуклеарные клетки периферической крови с помощью UCC118 в течение 24 часов и исследовали действие на экспрессию генов цитокинов (Фиг.7). Отмечена значительная модификация экспрессии генов цитокинов. Например, гены, кодирующие провоспалительные цитокины IL-1β и TNFα выключены, в то время как гены, кодирующие цитокины Тh2-типа, такие как IL-6, усилены.
Модели in vitro демонстрировали, что UCC118 способен к индуцированию цитокинов Тh2-типа (то есть IL-6 и растворимого рецептора IL-6), при этом подавляя продуцирование воспалительных цитокинов, таких как TNFα и IL-1β. Таким образом, эти результаты подтверждают, что поглощение UCC118 было бы полезным для пациентов, страдающих от воспалительных заболеваний, таких как IBD.
Пример 4: Тест на противовоспалительные бактериальные штаммы.
Ряд молочнокислых бактерий, выделенных из желудочно-кишечного тракта человека, исследовали с помощью этой новой системы анализа на противовоспалительное действие. Все бактериальные штаммы брали из культур, хранящихся под глицерином при -20°С, и инкубировали анаэробно в течение ночи в MRS-бульоне и отмывали в среде, содержащей антибиотик. Монослои эпителиальных клеток выращивали в течение 6 недель до добавления РВМС и бактериальных клеток.
Результаты этих стимуляций можно наблюдать на Фиг.8. По сравнению с контрольными культурами два бактериальных штамма подавляли продуцирование TNFα. Два штамма Lactobacillus salivarius, штамм UCC118, которые подавляли продуцирование TNFα, являются объектом WO-A-9835014. Bifidobacterium longum infantis, штамм UCC35624, является объектом заявки РСТ, поданной одновременно с настоящей заявкой.
Воспаление
Воспаление представляет собой термин, используемый для описания локального скопления жидкости, белков плазмы и белых кровяных телец в месте, которое подверглось физическому повреждению, инфекции, или там, где происходит иммунная реакция. Контроль воспалительной реакции применяется к ряду уровней (в качестве обзора см. Henderson В. and Wilson M. 1998, В "Bacteria-Cytokine interactions in health and disease". Portland Press, 79-130). Факторы контроля включают в себя цитокины, гормоны (например, гидрокортизон), простагландины, реакционноспособные промежуточные соединения и лейкотриены. Цитокины представляют собой низкомолекулярные биологически активные белки, которые вовлечены в генерацию и контроль иммунологических и воспалительных реакций, при этом также регулируя развитие, заживление тканей и гемопоэз. Они обеспечивают средство связи лейкоцитов между собой а также с другими типами клеток. Большинство цитокинов являются плейотропными и проявляют множественные биологически перекрывающиеся активности. Цитокиновые каскады и сети контролируют воспалительную реакцию, а не действие отдельного цитокина на отдельный тип клеток (Arai Kl, et al., Annu. Rev. Biochem. 1990, 59:783-836). Затухание воспалительной реакции приводит к более низким концентрациям соответствующих активирующих сигналов и других медиаторов воспаления, приводя к прекращению воспалительной реакции. TNFα является стержневым провоспалительным цитокином, поскольку он инициирует каскад цитокинов и биологические действия, приводящие к воспалительному состоянию. Ввиду этого, в настоящее время для лечения воспалительных заболеваний используются агенты, ингибирующие TNFα, например инфликсимаб.
Полагают, что провоспалительные цитокины играют главную роль в патогенезе многих воспалительных заболеваний, включая воспалительное заболевание кишечника (IBD). Применяемые в настоящее время способы лечения IBD направлены на уменьшение уровней этих провоспалительных цитокинов, включая IL-8 и TNFα. Такие способы лечения могут также играть существенную роль при лечении системных воспалительных заболеваний, таких как ревматоидный артрит.
Ввиду обнаруженных авторами изобретения противовоспалительных свойств Lactobacillus salivarius эти штаммы могут найти потенциальное применение при лечении ряда воспалительных заболеваний, особенно при использовании в комбинации с другими противовоспалительными способами лечения, как, например, нестероидными противовоспалительными лекарственными средствами (NSAID) или Инфликсимабом.
Диарейное заболевание
Барьерная функция кишечного эпителия может быть уменьшена во время секреции, опосредованной нервной (ацетилхолин) и иммунной (гистамин) системами. Некоторые бактериальные токсины могут также индуцировать Са2+- и РКС-зависимую секрецию и таким образом могут нарушать эпителиальный барьер (Ganguly NK and Kaur T. Indian J. Med. Res. 1996, 104:28-37; Groot JA. Vet. Q. 1998, 20(S3):45-9). В ряде работ исследованы предупреждение и лечение диареи с применением пробиотических бактерий. Последующие работы продемонстрировали эффективность введения молочнокислых бактерий как для профилактического, так и для терапевтического использования против диареи у недоношенных детей, новорожденных, детей (Isolauri E, et al., Dig. Dis. Sci. 1994 Dec; 39(12):2595-600) и при лечении диареи, связанной с антибиотиками (Siitonen S, et al., Ann. Med. 1990 Feb; 22(1):57-9), и диареи путешественников (Oksanen PJ, et al., Ann. Med. 1990 Feb; 22(1 ):53-6).
Принимая во внимание противовоспалительное действие, авторы изобретения обнаружили, что Lactobacillus salivarius также может оказывать противодиарейное действие, возможно достигаемое через лекарственную модуляцию цАМФ (циклический аденозинмонофосфат). Cl-секреция, зависимая от циклического АМФ, представляет собой главный секреторный путь в кишечнике человека (Brzuszczak IM, et al., J. Gastroenterol. Hepatol. 1996; 11(9):804-10). Противодиарейное действие не может быть ограничено только диареей, причиной которой является желудочно-кишечное воспаление, и может относиться к общему лечению диарейного заболевания.
Аутоиммунное заболевание
Иммунная система имеет большой набор специфичностей, экспрессируемых В- и Т-клетками. Некоторые из этих специфичностей направлены на "свои" компоненты. Распознавание "своего" обычно контролируется путем делеции клона и инактивации лимфоцитов, активных в отношении "своих". Однако имеется постоянный фон аутоиммунитета с антителами ко многим белкам, обнаруживаемым в сыворотке. Нарушение в системе распознавания "свое - не свое" приводит к аутоиммунитету. При аутоиммунном заболевании происходящий в результате иммунный ответ вызывает повреждение ткани, несущей "виновный" антиген. Отложение иммунных комплексов, гиперчувствительность II типа и клеточно-опосредованные реакции представляют собой наиболее важные механизмы, посредством которых осуществляется аутоиммунное повреждение. Примеры аутоимунных заболеваний включают в себя системную красную волчанку, ревматоидный артрит, инсулинзависимый сахарный диабет, тяжелую псевдопаралитическую миастению и пернициозную анемию, но не ограничены ими. Авторы изобретения обнаружили, что Lactobacillus salivarius представляет собой иммуномодулирующую бактерию. Таким образом, поглощение либо в виде единственного компонента, либо в комбинации с другими бактериями пациентами, страдающими от аутоимунного заболевания, может ограничить повреждение органов и помогать восстанавливать нормальный гомеостаз организма.
Воспаление и рак
Продуцирование многофункциональных цитокинов широким спектром типов опухолей предполагает, что у пациентов с раком постоянно происходят значительные воспалительные ответы. В настоящее время не ясно, какое защитное действие имеет этот ответ против роста и развития опухолевых клеток in vivo. Однако эти воспалительные ответы могут оказывать вредное воздействие на несущего опухоль "хозяина". Комплексные взаимодействия цитокинов вовлечены в регуляцию продуцирования цитокинов и пролиферации клеток в опухолевых и нормальных тканях (McGee DW, et at., Immunology 1995 Sep, 86(1):6-11; Wu S, et al., Gynecol. Oncol. 1994 Apr, 53(1):59-63). Давно считается, что снижение массы (кахексия) является единственной наиболее общей причиной смерти пациентов с раком (Inagaki J, et al., Cancer 1974 Feb, 33(2):568-73), и начальное нарушение питания служит признаком неблагоприятного прогноза (Van Eys. J. Nutr. Rev. 1982 Dec, 40(12):353-9). Опухоль для своего роста и распространения должна индуцировать образование новых кровеносных сосудов и разрушать внеклеточный матрикс. Воспалительный ответ может играть существенную роль в вышеупомянутых механизмах, способствуя таким образом ухудшению здоровья хозяина и прогрессированию опухоли. Благодаря противовоспалительным свойствам Lactobacillus salivarius эти бактериальные штаммы могут снижать скорость злокачественной трансформации клеток. Более того, кишечные бактерии могут производить из поступающих с пищей соединений вещества с генотоксическим, канцерогенным и активирующим развитие опухоли действием, а также кишечные бактерии могут активировать проканцерогены в ДНК-реактивные агенты (Rowland I.R. (1995). Toxicology of the colon: role of the intestinal microflora. In: Gibson G.R. (ed). Human colonic bacteria: role in nutrition, physiology and pathology, pp.155-174. Boca Raton CRC Press). Как правило, виды Lactobacillus имеют низкие активности ферментов метаболизма ксенобиотиков по сравнению с другими популяциями в кишечнике, такими как бактероиды, эубактерии и клостридии (Saito Y., et al., Microb. Ecol. Health Dis. 1992, 5, 105-110).
Следовательно, увеличение числа бактерий Lactobacillus в кишечнике может благоприятно модифицировать уровни этих ферментов.
Пребиотики
Введение пробиотических микроорганизмов осуществляется проглатыванием микроорганизма в подходящем носителе. Было бы полезно обеспечить среду, которая будет способствовать росту этих пробиотических штаммов в толстой кишке. Добавление одного или более чем одного олигосахарида, полисахарида или другого пребиотика усиливает рост молочнокислых бактерий в желудочно-кишечном тракте (Gibson, GR. Br. J. Nutr. 1998; 80(4):S209-12). Пребиотиками называют любой нежизнеспособный компонент пищи, который специфическим образом подвергается ферментации в ободочной кишке присущими бактериями, которые считаются полезными, например бифидобактериями, лактобациллами. Типы пребиотиков могут включать в себя пребиотики, содержащие фруктозу, ксилозу, сою, галактозу, глюкозу и маннозу. Совместное введение пробиотического штамма с одним или более чем одним пребиотическим соединением может усиливать рост введенного пробиотика in vivo, принося более явную пользу для здоровья, и называется симбиотическим.
Другие активные ингредиенты
Очевидно, что Lactobacillus salivarius может вводиться профилактически или в качестве способа лечения, либо сам по себе, либо с другими пробиотическими и/или пребиотическими материалами, описанными выше. Кроме того, эти бактерии можно применять как часть профилактической схемы или схемы лечения с использованием других активных материалов, как, например, материалов, используемых для лечения воспаления или других расстройств, в частности желудочно-кишечного тракта. Такие комбинации можно вводить в одном препарате или в виде отдельных препаратов, вводимых в одно и то же или в разное время, и с использованием одного и того же либо различных путей введения.
Изобретение не ограничивается вышеописанными воплощениями, которые могут отличаться в деталях.
Подкожное введение пробиотических бактерий связано с ослаблением колита и артрита у мышей
Целью данного исследования являлось: 1) определение воздействия системного введения L. salivarius 118 на колит у мышей с нокаутом интерлейкина-10, и 2) определение воздействия подкожного введения L. salivarius 118 на мышиную модель артрита - коллаген-индуцированный артрит.
Методы
Животные
Мыши с нокаутом интерлейкина-10 (IL-10 KO мыши)
В этом исследовании использовали двадцать самок мышей 129 Ola × C57BL/6-IL 10 КО в возрасте 7-9 недель (В&К Universal Ltd, East Yorkshire, UK; The Jackson Laboratory, Bar Harbor, Maine, USA). Этих мышей поддерживали на гомозиготном фенотипе и содержали в специальных условиях отсутствия патогенов, причем поддерживали температуру 20±2°С и 12-часовой цикл свет/темнота. После начала этого исследования все мыши потребляли стандартный нестерильный корм. Мыши имели свободный доступ к корму и воде.
Мыши DBA/1
Использовали двадцать шесть самцов мышей DBA/1 в возрасте 6-8 недель (Harlan UK Ltd, Oxon OХ23 ITP, UK). Этих мышей поддерживали на гомозиготном фенотипе и содержали в специальных условиях отсутствия патогенов, причем поддерживали температуру 20±2°С и 12-часовой цикл свет/темнота. После начала этого исследования мыши имели свободный доступ к корму и воде.
Пробиотические штаммы
L. salivarius 118 ssp. salivarius UCC118 первоначально выделили из илеоцекальной области взрослого человека, подвергнувшегося реконструктивной операции. Этот пробиотический штамм выделили исходя из того, что он обладает подходящими пробиотическими свойствами. Кратко, эти свойства включают: происхождение из человека, отсутствие патогенности, устойчивость к кишечной кислоте и желчи, способность прилипать к эпителиальным клеткам человека и способность временно колонизировать желудочно-кишечный тракт человека и быть метаболически активным в нем. L. salivarius 118 соответствующим образом культивировали на бульоне Man, Rogosa, Sharpe (MRS) (Oxoid, UK) при 37°С в анаэробных условиях в течение 24 часов. До начала исследования выделяли спонтанный рифампицин - устойчивый вариант штамма для того, чтобы способствовать несложной идентификации этой бактерии от других молочнокислых бактерий.
Модель II-10 КО колита
Двадцать II-10 КО мышей распределяли случайным образом в одну из двух групп, по десять мышей на группу. L. salivarius 118 подкожно вводили группе исследования, а контрольной группе подкожно вводили стерильный фосфатно-солевой буферный раствор (PBS). L. salivarius 118 сначала выращивали в 10 мл бульона MRS путем инкубирования в течение ночи при 37°С в анаэробных условиях. Бактерии дважды промывали и повторно суспендировали в стерильном PBS до конечной концентрации 1×109 в мл. Подкожно вводили дозу 1х108 бактерий/мышь. Эти инокуляции осуществляли в недели 2, 4, 6, 10, 14 и 18 и мышей умерщвляли через 19 недель.
Образцы фекалий мышей собирали каждую неделю на протяжении периода исследования. Исследование завершали через 19 недель кормления, и в это время всех выживших мышей умерщвляли посредством смещения позвонков. Образцы крови получали посредством пункции сердца для серологического анализа. Слепую кишку и ободочную кишку фиксировали в формальдегиде для гистопатологического анализа. Селезенку удаляли из каждой мыши при умерщвлении и спленоциты выделяли для культивирования in vitro.
Гистопатология
При умерщвлении слепую кишку, проксимальную кишку (восходящую и поперечную ободочную кишку) и дистальную кишку (нисходящую ободочную кишку, прямую кишку и анальный канал) всех мышей фиксировали в 10%-ном формалине и оценивали два гистопатолога. Два независимых эксперта, используя гистологический индекс от 0 до 4, оценивали тяжесть воспаления в каждом участке желудочно-кишечного тракта мышей. Этот индекс основан на степени эрозии эпителиального слоя, уменьшении бокаловидных клеток и воспалительном клеточном инфильтрате (0 - норма; 1 - минимальное доказательство воспалительного инфильтрата; 2 - значительное доказательство воспалительного инфильтрата (криптит, крипт-абсцессы); 3 - значительное доказательство воспалительного инфильтрата с уменьшением бокаловидных клеток; 4 - значительное доказательство воспалительного инфильтрата с эрозией слизистой оболочки).
Культуры спленоцитов
Селезенки от всех мышей удаляли во время умерщвления. Каждую селезенку немедленно помещали бессывороточную среду Игла, модифицированную по способу Дульбекко (DMEM). Селезенку просеивали через стерильный металлический фильтр в 5 мл 0,87%-ного хлорида аммония для лизиса эритроцитов. Суспензию клеток дважды центрифугировали при 100 g в течение 10 минут. Клетки повторно суспендировали в DMEM (10% фетальной телячьей сыворотке) в концентрации 1×106 клеток/мл для культивирования in vitro. Выделенные лимфоциты культивировали совместно с провоспалительной бактерией Salmonella typhimurium (1×106 клеток/мл) в течение 72 часов при 37°С. Клеточные супернатанты выделяли и хранили при -80°С. Анализ цитокинов осуществляли на супернатантах с использованием твердофазного иммуноферментного анализа (ELISA) (BD Pharmingen, Oxford, UK). Анализируемые цитокины представляли собой фактор некроза опухоли α (TNF-α), интерлейкин-12 (IL-12) и трансформирующий фактор роста β (TGF-β).
Микробный анализ
Образцы фекалий собирали каждую неделю, взвешивали и диспергировали в 10 мл PBS. Микробный анализ образцов фекалий включал подсчет L. salivarius 118 ssp. salivarius UCC118, общее количество молочнокислых бактерий, общее количество бифидобактерий, колиформ и Clostridia perfringens. Этот анализ осуществляли посредством засева путем выливания и распространения на MRS-агаре (рН 5,5) плюс рифампицин; MRS-агаре с добавлением 0,05% гидрохлорида цистеина (Sigma, St. Louis, Missouri, USA) плюс рифампицин; MRS-агаре; MRS-агаре с добавлением 5% овечьей крови, 0,2% хлорида лития (BDH Laboratory Supplies, Poole, UK), 0,3% пропионата натрия (Sigma) и 0,05% гидрохлорида цистеина (Sigma), на агаре с желчью и фиолетовым красным, на среде OPSP, селективной для Clostridia perfringens, с добавками A SR 76 и В SR 77, соответственно (все от Oxoid, UK, если не указано иначе). Чашки с агаром с желчью и фиолетовым красным инкубировали в аэробных условиях в течение 24 часов, а все остальные чашки инкубировали в анаэробных условиях в течение 48 часов при 37°С. Анаэробные условия создавали с использованием наборов, генерирующих CO2, (Anaerocult A; Merck Darmstadt, Germany) в герметичных газовых сосудах (BBL BD, Dublin, Ireland).
Коллаген-индуцированный артрит
Двадцать шесть мышей DBA/I распределяли случайным образом на три группы. Мышам в первой группе подкожно вводили L. salivarius UCC118 в дозе 1×108 бактерий/мышь (приготовление такое же, как и для IL-10 КО исследования). Второй группе подкожно вводили равный объем стерильного PBS. Инокуляции осуществляли в недели 1, 4 и 8. Последняя группа (n=6) не получала ни одной из указанных обработок.
На неделе 6 артрит индуцировали следующим образом: бычий коллаген типа II (Chondrex) растворяли в 0,05 М уксусной кислоте до концентрации 2 мг/мл путем перемешивания при 4°С в течение ночи. Затем эту смесь эмульгировали в равных объемах полного адъюванта Фрейнда (2 мг/мл штамм М. tuberculosis H37Ra (Difco BD, Dublin, Ireland). Группы 1 и 2 подкожно иммунизировали, в хвост, 100 мкл на неделе 6. На неделе 9 во всех трех группах осуществляли бустер-иммунизацию 50 мкл коллагена, эмульгированного в неполном адъюванте Фрейнда (Difco). С недели 10 и далее мышей каждый день оценивали на предмет визуального появления артрита в периферических суставах. Визуальные признаки оценивали с использованием следующего индекса: 0 - норма; 1 - слабое, но определенное покраснение и припухлость лодыжки или запястья или видимое покраснение или припухлость, ограниченные отдельными пальцами, независимо от количества пораженных пальцев; 2 - умеренное покраснение или припухлость лодыжки или запястья; 3 - сильное покраснение и припухлость всей лапы, включая пальцы; 4 - максимально воспаленная лапа с вовлечением множества суставов. Исследование завершали через 12 недель, и всех мышей умерщвляли путем смещения позвонков. При умерщвлении измеряли толщину каждой лапы, используя штангенциркуль.
Гистопатология
При умерщвлении конечности удаляли и фиксировали в формальдегиде для гистопатологического анализа независимый эксперт. После заключения в парафин, конечности поверхностно декальцинировали с использованием Calbonex (KB Scientific, Togher, Cork, Ireland). Срезы тканей (7 мкм) окрашивали гемолизином и эозином. Гистологический анализ разрушения хрящей и костей путем образования паннуса и инфильтрации мононуклеарными клетками в синовиальных тканях проводили с использованием следующей системы количественных показателей: разрушение хрящей и костей посредством образования паннуса: 0 - нет изменений; 1 - незначительное изменение (образование паннуса в хряще); 2 - умеренное изменение (инвазия паннуса в хрящ/субхондральную костную пластину); 3 - сильное изменение (инвазия паннуса в субхондральную костную пластину); инфильтрация мононуклеарными клетками: 0 - нет инфильтрации; 1 - незначительная инфильтрация: 2 -умеренная инфильтрация; 3 - сильная инфильтрация.
Статистический анализ
Дисперсионный анализ для различения групп по воспалительной активности осуществляли с использованием анализа ANOVA, а отличие групп по микробному количеству оценивали с использованием площади под кривой.
Результаты
Модель II-10 KO колита
Гистопатология
После умерщвления оценку 0-4 присуждали каждому исследуемому участку кишечника: слепой кишке, проксимальной кишке (восходящей и поперечной ободочной кишке) и дистальной кишке (нисходящей ободочной кишке, прямой кишке и анальному каналу), причем общая возможная оценка 12 должна быть присуждена каждому отделу. После исследования всех срезов рассчитывали среднюю оценку для каждой группы. Средняя оценка воспаления для контрольной группы составила 8,25 (0,94), а средняя оценка воспаления для группы, получавшей L. salivarius UCC118, составила 4,35 (0,9). Таким образом, "пробиотическая" группа продемонстрировала значительное снижение оценки воспаления по сравнению с контрольной группой (р<0, 05) (Фиг.1'). В дополнение, было обнаружено, что четыре мыши в PBS-контрольной группе имеют тяжелый панколит с одинаковой степенью поражения проксимальной и дистальной ободочной кишки. В "пробиотической" группе не было выявлено случая панколита.
Микробный анализ
Образцы фекалий от всех мышей анализировали для оценки изменений микрофлоры и определения транзита пробиотического штамма. Не было значительных различий культивируемых бактерий при подсчете в образцах фекалий общего количества молочнокислых бактерий, общего количества бифидобактерий, колиформ и Clostridia perfringens (данные не показаны). Штамм L. salivarius 118 не выделили из какой-либо мыши в контрольной или "пробиотической" группе (данные не показаны).
Иммунологическая оценка
Анализ цитокинов осуществляли на супернатантах спленоцитов путем ELISA после стимуляции in vitro провоспалительной бактерией Salmonella typhimurium. Анализируемые цитокины представляли собой TNF-α, IL-12 и TGF-β.
Уровни TNF-α были значительно снижены в группе, которой вводили L. salivarius 118, после стимуляции провоспалительным стимулом (уровни TNF-α в контрольной группе составили 1522,4 (112,2), уровни TNF-α в группе, которой вводили L. salivarius 118, составили 872,8 (143,8); (р<0,05) (Фиг.2'А). Уровни TNF-α не выявляли в нестимулированных культурах.
Уровни IL-12 после стимуляции Salmonella typhimurium показали значительное снижение в "пробиотической" группе (р<0,05). Уровни IL-12 в контрольной группе составили 2471,2 (256) по сравнению с 1386,4 (347,2) в группе, которой вводили L. salivarius 118 (р<0,05) (Фиг.2'Б). Уровни IL-12, обнаруженные в супернатантах нестимулированных спленоцитов, были ниже в "пробиотической" группе по сравнению с контрольной группой.
В отсутствии стимуляции уровни TGF-β были повышены в "пробиотической" группе по сравнению с контрольной группой (уровни TGF-β в контрольной группе составили 114,4 (71,6); уровни TGF-β в группе, которой вводили L. salivarius 118, составили 362,3 (79,6); р<0,05) (Фиг.2'В). Не было статистического значимого различия между уровнями TGF-β в двух группах после стимуляции сальмонеллой.
Уровни цитокинов в образцах сывороток были ниже обнаружимых пределов во всех группах в анализе посредством ELISA.
Коллаген-индуцированный артрит
Ежедневная клиническая оценка мышей на предмет визуальных признаков артрита
Ежедневную макроскопическую количественную оценку визуальных признаков артрита проводили с недели 10 до момента умерщвления (неделя 12) с использованием принятой системы оценки.
L. salivarius 118 оказывала подавляющее действие на развитие заболевания. С недели 10, день 3, по неделю 11, день 12, наблюдали значительное снижение оценки артрита в группе, которой вводили L. salivarius 118 (р<0,05). Уменьшение явлений артрита также было значительным на неделе 12, день 15 (р=0,05) (Фиг.3').
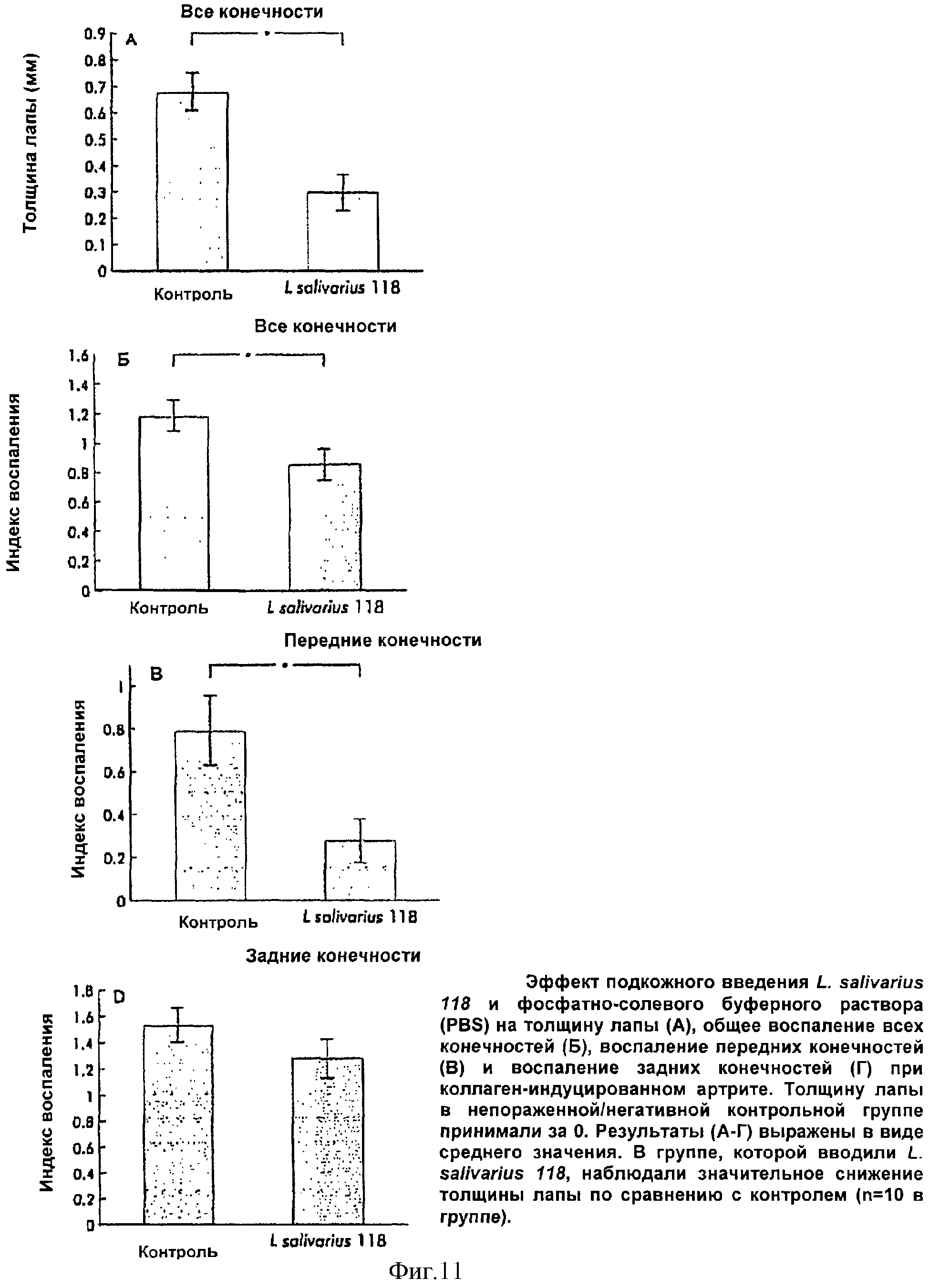
Толщина лапы
Толщину каждой лапы измеряли с использованием штангенциркуля в момент умерщвления. Результаты описывали как толщину лапы больше нормы (средняя толщина для непораженной/негативной контрольной группы составила 1,62 (0,051) мм). В группе, которой вводили L. salivarius 118, наблюдали значительное уменьшение толщины по сравнению с контрольной группой (р=0,0002) (в группе, которой вводили L. salivarius 118, толщина лапы составила 0,292 (0,071); в контрольной группе толщина лапы составила 0,677 (0,071 )(Фиг.4'А).
Гистопатология
После умерщвления гистопатологические изменения оценивали с использованием шкалы 0-3, исходя из разрушения хрящей и костей посредством образования паннуса (Фиг.5'). Инфильтрацию воспалительными клетками также оценивали по шкале 0-3, варьирующей от отсутствия инфильтрации клетками до сильной инфильтрации. После исследования всех срезов рассчитывали среднюю оценку для каждой группы, причем максимально возможная оценка равнялась 6. В группе, вакцинированной L. salivarius 118, наблюдали значительное уменьшение инфильтрации воспалительными клетками по сравнению с контрольной группой (средняя оценка воспалительных клеток в контрольной группе составила 1,18 (0,11), а группе, вакцинированной L. salivahus 118, эта оценка составила 0,85 (0,11); р=0,04) (Фиг.4'Б). Обнаружили значительное уменьшение разрушения хрящей и костей, а также инфильтрации воспалительными клетками в передних конечностях мышей, которым вводили пробиотические бактерии (средняя гистологическая оценка для контрольной группы составила 1,30 (0, 46), а в группе, которой вводили L. salivarius 118, эта оценка составила 0,46 (0,19); р=0,03) (Фиг.4'В).
Обсуждение
Результаты данного исследования подтверждают, что системное введение L. salivarius 118 оказывает противовоспалительное действие. Дозы и частота введения были произвольными. Системная природа пробиотической активности отражена в уменьшении провоспалительных цитокинов и увеличении регуляторного цитокина TGF-β.
В целом, механизм действия пробиотиков не вполне изучен. Было показано, что кишечная флора оказывает влияние на развитие и функционирование иммунной системы, и полагают, что микрофлора оказывает влияние, среди других кишечных функций, на иммунный ответ слизистой оболочки посредством передачи сигнала эпителию кишечника. Полагают, что взаимодействия между Toll-подобными рецепторами и дендритными клетками в кишечнике вовлечены в эту связь. Дендритные клетки, обитающие на слизистой оболочке кишечника, являются главным образом незрелыми и потенциально подвержены модуляции окружающей средой, содержащей микроорганизмы.
Модели II-10 КО колит и коллаген-индуцированный артрит связаны с аномальной регуляцией провоспалительных Тh1 цитокинов. В II-10 КО модели IL-12 представляет собой ключевой медиатор, ответственный за индукцию колита, и является необходимым для поддержания пролиферации хронически активированных Тh1 клеток. Было показано, что анти-IL2- и анти-TNF-лечение уменьшает повреждение суставов при коллаген-индуцированном артрите. Это подтверждает роль IL-12 и TNF-α в артрите, и модуляция этих цитокинов обеспечивает терапевтическую мишень в заболевании. Ассоциированная негативная регуляция уровней IL-12 и THF-α, обнаруженная в данном исследовании, означает, что пробиотический эффект может быть опосредован изменением этих цитокинов.
Воздействие пробиотиков на микробную флору, воспаление и развитие рака у il-10 ko мышей
Целью данного исследования являлась оценка способности Lactobacillus salivarius ssp. salivarius UCC118 модулировать тяжесть энтероколита у IL-10 КО мышей в контролируемом пилотном исследовании.
Методы
Мыши с нокаутом интерлейкина-10 (IL-10 KO мыши)
В этом исследовании использовали десять самцов мышей C57BL/6 J-IL 10 и десять самцов мышей C57BL/10 J-IL 10 в возрасте 4-8 недель (Jackson Laboratories, Maine, USA). Этих мышей поддерживали на гомозиготном фенотипе и содержали в специальных условиях отсутствия патогенов. У мышей поддерживали 24-часовой цикл свет/темнота. После начала этого исследования все мыши потребляли стандартный нестерильный корм.
Пробиотический штамм
L. salivarius ssp. salivarius UCC118 (NCIMB 40829) первоначально выделили из илеоцекальной области взрослого человека, подвергнувшегося реконструктивной операции. Этот пробиотический штамм выделили исходя из того, что он обладает подходящими пробиотическими свойствами. Кратко, эти свойства включают: происхождение из человека, отсутствие патогенности, устойчивость к кишечной кислоте и желчи, способность прилипать к эпителиальным клеткам человека и способность временно колонизировать желудочно-кишечный тракт человека и быть метаболически активным в нем. L. salivarius 118 соответствующим образом культивировали на бульоне Man, Rogosa, Sharpe (MRS) при 37°С в анаэробных условиях в течение 24 часов. До начала исследования выделяли спонтанный рифампицин - устойчивый вариант штамма UCC118 для того, чтобы способствовать несложной идентификации этой бактерии от других молочнокислых бактерий.
Исследование кормления
Двадцать IL-10 КО мышей распределяли случайным образом в одну из двух групп. "Пробиотической" группе каждый день давали 1×109 Lactobacillus salivarius ssp. UCC118 в пастеризованном молоке, а контрольной группе давали только немодифицированное пастеризованное молоко. L. salivarius 118 сначала выращивали в 10 мл бульона MRS (Oxoid, UK) путем инкубирования в течение ночи при 37°С в анаэробных условиях. 1% инокулята (об./об.) переносили в 400 мл свежего бульона MRS и инкубировали, как указано выше. UCC118 осаждали путем центрифугирования и повторно суспендировали в концентрации 1×109 клеток/мл в 10% пастеризованном снятом молоке. UCC118 давали IL-10 КО мышам в сосудах для воды, и мыши имели свободный доступ к этой смеси.
Образцы фекалий мышей собирали до кормления (неделя 0) и каждую неделю на протяжении периода исследования. Исследование завершали через 16 недель кормления, и в это время всех выживших мышей умерщвляли посредством смещения позвонков. Образцы крови получали посредством пункции сердца для серологического анализа. Образцы внутрипросветного содержимого извлекали в стерильных условиях из подвздошной кишки, слепой кишки и ободочной кишки для микробиологического анализа, причем кусочки подвздошной кишки, слепой кишки и ободочной кишки фиксировали в формальдегиде для гистопатологического анализа.
Серология
Уровни специфичных к UCC118 антител в сыворотке измеряли с использованием стандартного анализа агглютинации. Кратко, сыворотку от IL-10 КО мышей разводили 1/10, 1/20, 1/40, 1/80 и 1/160 стерильным фосфатно-солевым буферным раствором (PBS). Сыворотку инкубировали в течение ночи с пробиотической UCC118 и анализировали на наличие агглютинации. Обратную величину наименьшего разведения к результату агглютинации использовали как показатель уровней антител, специфичных к UCC118.
Микробный анализ
Образцы фекалий собирали каждую неделю, взвешивали и диспергировали в 10 мл PBS. Микробный анализ образцов фекалий включал подсчет L. salivarius ssp. salivarius UCC118, общее количество молочнокислых бактерий, общее количество бифидобактерий, энтерококков, бактероидов и колиформ. Этот анализ осуществляли посредством засева путем выливания и распространения на MRS-агаре плюс рифампицин; MRS-arape; MRS-arape с добавлением 5% овечьей крови, 0,2% LiCl2, 0,3% пропионата натрия и 0,05% цистеина, на агаре Slanetz и Bartley, на агаре Wilkins Chalgren с добавлением добавки SR108 и 5% лошадиной крови и на агаре с кровью и фиолетовым красным (Oxoid, UK), соответсвенно. В дополнение образцы фекалий и образцы содержимого из подвздошной кишки, слепой кишки и ободочной кишки оценивали на присутствие тех же самых бактерий, как описано выше, плюс Clostridium perfringens, как измерено с помощью агара OPSP с добавками A SR 76 и В SR 77 (Oxoid, UK). Чашки с агаром с кровью и фиолетовым красным и агаром Slanetz и Bartley инкубировали в аэробных условиях в течение 24 часов и 48 часов, а все остальные чашки инкубировали в анаэробных условиях в течение 48 часов при 37°С. Анаэробные условия создавали с использованием наборов, генерирующих CO2, (Anaerocult A, Merck) в герметичных газовых сосудах (BBL).
Гистопатология
При умерщвлении кусочки тонкой кишки, слепой кишки и ободочной кишки фиксировали в 10%-ном формалине и оценивали гистологически. Два независимых эксперта, используя гистологический индекс от 0 до 5, оценивали тяжесть повреждения вследствие воспалительной активности в желудочно-кишечном тракте мышей. Этот индекс основан на степени эрозии эпителиального слоя, уменьшении бокаловидных клеток и воспалительном клеточном инфильтрате. Кроме того, эти ткани исследовали на присутствие неопластических клеток.
Статистический анализ
Дисперсионный анализ для различения групп по воспалительной активности осуществляли с использованием анализа ANOVA, а различия между группами по микробному количеству оценивали с использованием площади под кривой. Точный критерий Фишера использовали для определения статистических различий развития опухолей и смертности у мышей между группой, которой давали пробиотический штамм, и контрольной группой.
Результаты
Серология
После потребления пробиотических бактерий UCC118 в течение 16 недель в периферической крови определяли уровни антител, специфичных к этим бактериям. Не было различий в уровнях антител для мышей, потребляющих UCC118, по сравнению с мышами, потребляющими только плацебо (10,1+4,1 против 9,7+2,5 соответственно). Это предполагает, что UCC118 системно не воспринимается иммунной системой IL-10 КО мышей.
Микробиология
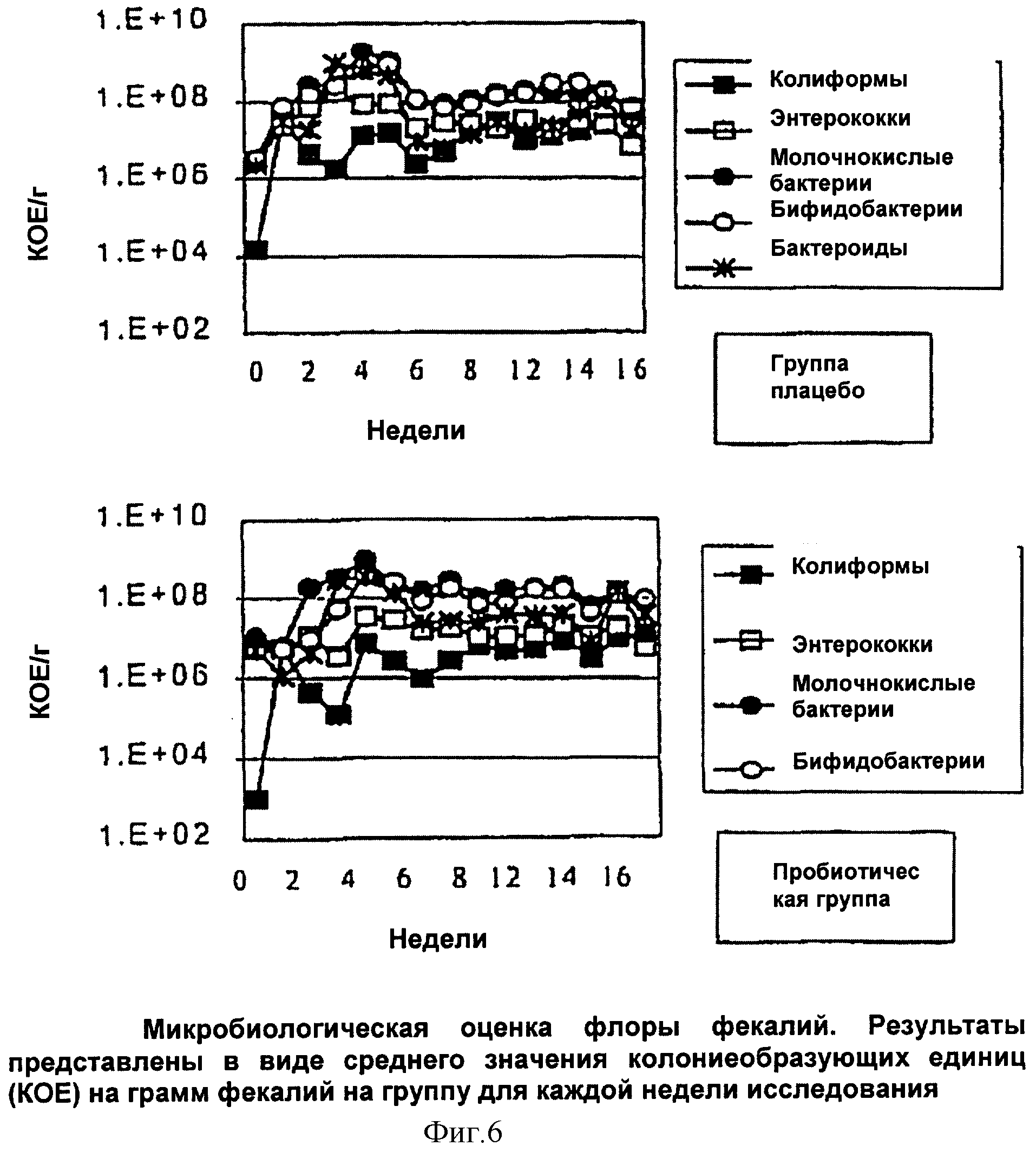
В течение недели 1 кормления в фекалиях от всех мышей в "пробиотической" группе выявляли пробиотическую UCC118. В течение 16 недель кормления UCC118 выделяли в количестве приблизительно 1×106 на грамм фекалий (Фиг.1"). От мышей в группе плацебо UCC118 не культивировали. Уровни колиформ и энтерококков в фекалиях были снижены у мышей, потребляющих UCC118, по сравнению с мышами, потребляющими только пастеризованное молоко (Фиг.2"). Суммарные уровни молочнокислых бактерий, бифидобактерий и бактероидов не изменились в обеих группах (Фиг.2").
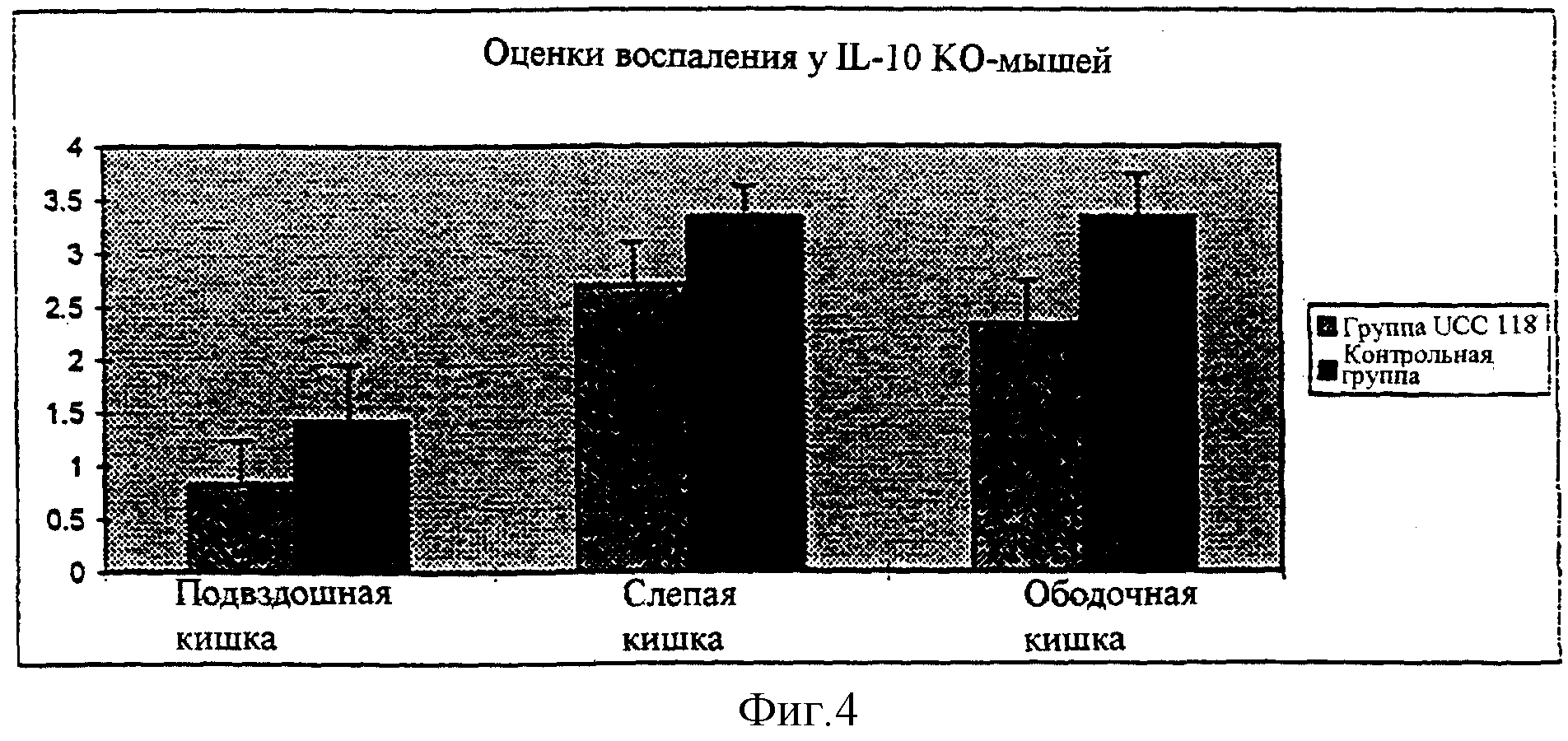
В дополнение к еженедельному микробиологическому анализу после умерщвления извлекали образцы из подвздошной кишки, слепой кишки и ободочной кишки. Количество С. perfringens было значительно снижено у мышей, потребляющих UCC118, особенно в ободочной кишке (Р<0,05) по сравнению с мышами, потребляющими только продукт плацебо (Фиг.3"). Не было выявлено значительного различия суммарного количества молочнокислых бактерий, бифидобактерий, колиформ, энтерококков или бактероидов.
Гистопатология
После умерщвления в обеих группах мышей оценивали воспалительную активность слепой кишки, подвздошной кишки и ободочной кишки (Фиг.4"). Наблюдали сильную тенденцию к сниженной воспалительной активности во всех участках (Таблица 2). Наиболее значительное различие воспалительной активности между двумя группами наблюдали в ободочной кишке (Р=0,09). Наблюдали значительное снижение развития рака между двумя группами. Желудочно-кишечная неопластическая трансформация у мышей из группы плацебо составила 50%, в то время как только у 10% мышей из группы, потребляющей UCC118, наблюдали неопластическое изменение (Р=0,07). Более того, 20% мышей из группы плацебо умерли до окончания исследования, а в группе, потребляющей UCC118, все мыши выжили.
Обсуждение
Результаты данного исследования демонстрируют выживание пробиотической Lactobacillus salivarius ssp.salivarius UCC118 после транзита по желудочно-кишечному тракту и значительное изменение желудочно-кишечной флоры, ассоциированное с пробиотиком. Потребление пробиотиков было ассоциировано с тенденцией к снижению развития опухолей и ослаблением воспаления желудочно-кишечного тракта. Эти результаты оправдывают крупномасштабное исследование с использованием пробиотиков для надежной оценки статистической значимости этих исследований.
Для модуляции желудочно-кишечной флоры этой пробиотической молочнокислой бактерией предложен ряд механизмов. UCC118 продуцирует in vitro антимикробный фактор, который является антагонистическим по отношению к широкому ряду грамположительных и грамотрицательных микроорганизмов. Продуцирование этого антимикробного фактора in vivo может элиминировать конкурирующие микроорганизмы, предоставляя преимущество выживания нововведенной бактерии. Кроме того, UCC118 сильно прилипает к эпителиальным клеткам желудочно-кишечного тракта in vitro. Таким образом, конкурентное удаление других микроорганизмов из этой ниши будет оказывать влияние на состав флоры фекалий.
Потребление UCC118 снижает воспаление желудочно-кишечного тракта в мышиной модели. Колонизация желудочно-кишечного тракта этой пробиотической бактерией также приводит к модификации флоры кишечника с возможной элиминацией провоспалительных видов. Таким образом, удаление воспалительного поражения представляет собой возможный механизм, с помощью которого пробиотические бактерии могут модулировать тяжесть заболевания. В дополнение, пробиотические бактерии могут оказывать более непосредственное влияние на воспалительные ответы в желудочно-кишечном тракте посредством взаимодействия с иммунной системой слизистой оболочки. Правильный баланс Th1/Th2 ответов в кишечнике является критическим для поддержания целостности кишечника. Потребление в большом количестве некоторых видов бактерий может способствовать восстановлению правильного Th1/Th2 баланса у мышей с нокаутом интерлейкина-10. Непосредственное взаимодействие UCC118 и иммунной системы слизистой оболочки может индуцировать ответы Th2 типа, приводя к восстановлению Th1/Th2 баланса и снижению воспаления в модели.
Кроме того, авторы исследовали роль пробиотической UCC118 в снижении скорости неопластического изменения в желудочно-кишечном тракте. Воспаление желудочно-кишечного тракта оказывает сильное влияние на целостность слизистой оболочки и ее способность противостоять повреждению, индуцируемому просветными факторами, увеличивая таким образом риск развития неопластического заболевания. В дополнение некоторые воспалительные медиаторы могут стимулировать рост опухолевых клеток в желудочно-кишечном тракте. Кишечная бактериальная флора вовлечена в патогенез злокачественных заболеваний желудочно-кишечного тракта. Стерильные крысы, обработанные канцерогеном 1,2-диметилгидразином, имеют более низкую частоту опухолей ободочной кишки, чем обработанные аналогичным образом крысы с нормальной микрофлорой. Кишечные бактерии могут продуцировать из пищевых продуктов вещества с генотоксичной, канцерогенной и опухоль-стимулирующей активностью, и кишечные бактерии могут активировать проканцерогены. В общем, молочнокислые бактерии не вовлечены в качестве причинных факторов в эти болезненные состояния и действительно могут антагонизировать вредные компоненты желудочно-кишечной флоры. Таким образом, пробиотическая UCC118 может замедлять развитие злокачественных заболеваний желудочно-кишечного тракта путем снижения воспалительной активности в нем или путем модификации бактериальной флоры.
Некоторые пробиотические бактерии являются очень привлекательными биотерапевтическими агентами для лечения воспаления желудочно-кишечного тракта благодаря их воздействию на состав кишечной флоры и активности иммунной системы. Потребление пробиотической UCC118 успешно изменило желудочно-кишечную флору, снизило воспаление и уменьшило неопластические повреждения в этой мышиной модели. Интригующее и клинически значимое открытие авторов состояло в сниженной распространенности рака ободочной кишки у животных, потребляющих пробиотические бактерии. В этом отношении сообщаемые благоприятные эффекты пробиотиков у людей с неспецифическим язвенным колитом могут иметь специальное применение для длительного снижения дисплазии/неоплазии у таких пациентов.
Реферат
Изобретение относится к биотехнологии, в частности к применению штамма Lactobacillus salivarius UCC 118 для профилактики и/или лечения нежелательной воспалительной активности и профилактики рака. Штамм Lactobacillus salivarius UCC 118[NCIMB 40829] имеет человеческое происхождение, выделен из иссеченного и промытого желудочно-кишечного тракта человека. Применение штамма позволяет замедлить развитие злокачественных заболеваний и снизить нежелательную воспалительную активность, такую как воспалительное заболевание кишечника или синдром раздраженной толстой кишки. 2 н. и 40 з.п. ф-лы, 29 ил., 1 табл.

Комментарии