Штамм bifidobacterium longum, пригодный для применения в иммуномодуляции, индукции продукции цитокинов, лечении аутоиммунного заболевания, контроле отношения il - 10:il - 12, и его использование - RU2557310C2
Код документа: RU2557310C2
Чертежи










Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к штамму бифидобактерий {Bifidobacterium) и его использованию в качестве пробиотических бактерий, в частности, в качестве иммуномодулирующего биотерапевтического вещества.
Уровень техники
Механизмы защиты желудочно-кишечного тракта человека от его колонизации кишечными бактериями исключительно сложны и включают иммунные и неиммунные взаимодействия (1). Врожденные защитные механизмы включают низкий pH желудка, желчные соли, перистальтику, муциновые слои и антимикробные вещества и составы, такие, как лизоцим (2). Иммунные механизмы включают специализированные лимфоидные образования, подстилающие М-клетки (называемые также комплексами Пейера), распределенные по всей тонкой и прямой кишке (3). Люминальные антигены, присутствующие в данных местах, стимулируют развитие субпопуляций Т- и В-клеток с образованием цитокиновых сетей и секрецию антител в желудочно-кишечный тракт (4). Кроме того, антигены могут попадать через эпителиальные клетки к интраэпителиальным лимфоцитам и к иммуноцитам находящейся под ними собственной пластины слизистой оболочки (5). Таким образом, человек тратит значительные силы на иммунную защиту желудочно-кишечного тракта. Поскольку слизистая оболочка кишечника является самой большой поверхностью, посредством которой человек контактирует с окружающей средой, ему необходимы специальные механизмы, посредством которых регулируется иммунный ответ на 100 тонн пищи, которая проходит через желудочно-кишечный тракт в течение среднего времени жизни человека. Кроме того, кишечник населяют более 500 видов бактерий, концентрация которых в прямой кишке составляет 1011-1012/г. В связи с этим регулирующие механизмы должны быть способны различать не патогенные бактерии, нормально живущие в кишечнике, от нашествий патогенов, которые могут вызвать серьезные проблемы у хозяина. Кишечная флора активно участвует в защите хозяина, борясь с попадающими через пищеварительную систему потенциально патогенными микроорганизмами.
Считается, что некоторые виды пробиотических бактерий более эффективны, когда они получены из видов, для лечения которых предназначены, или из близко родственных видов. Поэтому существует потребность в пробиотических штаммах, полученных из животных-компаньонов, и отличных от штаммов, полученных от людей, которые можно было бы использовать для лечения животных-компаньонов.
В публикации WO 01/90311 описаны пробиотические микроорганизмы, выделенные из образцов фекалий кошек и обладающие пробиотическим действием. Однако данные бактерии были получены из фекальных образцов, и поэтому они могут не представлять собой часть естественной флоры, присутствующей в верхних отделах желудочно-кишечного тракта.
Соответственно, существует потребность в штаммах бактерий, получаемых путем выделения из естественной флоры, присутствующей в верхних отделах желудочно-кишечного тракта, особенно подходящих для кошек и обладающих пробиотическими свойствами и способностью выживать в процессе их обработке. Существует также потребность в составах, содержащих такие штаммы и удобных в использовании.
Сущность изобретения
В настоящем изобретении предлагается выделенный штамм бифидобактерий №41675 по NCIMB.
Штамм бифидобактерий может быть в форме живых клеток. Штамм бифидобактерий может быть в форме не живых клеток.
Бифидобактерии могут быть выделены из образцов ткани толстой кишки здоровых кошек, взятых путем биопсии.
Штамм бифидобактерий может обладать значительным иммуномодулирущим действием при его оральном потреблении.
В настоящем изобретении предлагается также состав, содержащий упомянутый штамм бифидобактерий.
Состав может дополнительно содержать пробиотический материал. Состав может дополнительно содержать пребиотический материал. Состав может дополнительно содержать носитель для орального приема. Носитель для орального приема может быть одним из фармацевтически приемлемых носителей, таким, как, например, капсула, таблетка, порошок. Носителем для орального приема может быть также пищевой продукт, такой, как, например, масляная суспензия, суспензия на основе молока, сыр, состав на основе какао-масла, соус и/или состав на основе йогурта.
В настоящем изобретении предлагается также продукт питания, содержащий штамм бифидобактерий или состав в соответствии с настоящим изобретением.
Продукт питания может быть может быть сухим продуктом питания. Продукт питания может быть влажным продуктом питания. Продукт питания может быть кормом для животных-компаньонов.
В настоящем изобретении предлагаются также штамм бифидобактерий, или состав, или продукт питания в соответствии с настоящим изобретением, которые могут использоваться в качестве лекарственного средства.
В настоящем изобретении предлагаются также штамм бифидобактерий, или состав, или продукт питания в соответствии с настоящим изобретением, которые могут использоваться для профилактики и/или лечения нежелательных воспалительных процессов.
В настоящем изобретении предлагаются также штамм бифидобактерий, или состав, или продукт питания в соответствии с настоящим изобретением, которые могут использоваться для профилактики и/или лечения нежелательных воспалительных процессов в желудочно-кишечном тракте.
В настоящем изобретении предлагаются также штамм бифидобактерий, или состав, или продукт питания в соответствии с настоящим изобретением, которые могут использоваться для профилактики и/или лечения аутоиммунных нарушений, вызванных нежелательными воспалительными процессами.
В настоящем изобретении предлагаются также штамм бифидобактерий, или состав, или продукт питания в соответствии с настоящим изобретением, которые могут использоваться для профилактики и/или лечения диарейных состояний, вызванных нежелательными воспалительными процессами.
В настоящем изобретении предлагаются также штамм бифидобактерий, или состав, или продукт питания в соответствии с настоящим изобретением, для коррекции или улучшения работы иммунной системы животных-компаньонов.
В настоящем изобретении предлагаются также штамм бифидобактерий, или состав, или продукт питания в соответствии с настоящим изобретением, которые могут использоваться для профилактики и/или лечения аутоиммунных заболеваний у животных-компаньонов.
В настоящем изобретении предлагаются также штамм бифидобактерий, или состав, или продукт питания в соответствии с настоящим изобретением, которые могут использоваться для профилактики и/или лечения воспалений у животных-компаньонов.
В настоящем изобретении предлагается штамм бифидобактерий AH121A (номер по NCIMB 41675), а также его мутанты и варианты.
Мутант может быть генетически модифицированным мутантом. Вариант может быть естественно встречающимся вариантом бифидобактерий.
Штамм может получен путем выделения из разрезанного и промытого кошачьего желудочно-кишечного тракта.
Штамм может быть пробиотиком. Штамм может быть в форме биологически чистой культуры.
В настоящем изобретении предлагается также выделенный штамм бифидобактерий, номер по NCIMB 41675.
Штаммы бифидобактерий могут быть в форме живых клеток. В качестве альтернативы, штаммы бифидобактерий могут быть в форме не живых клеток.
Как правило, пробиотические бактерии используются в форме живых клеток. Однако возможно их использование и в форме не живых клеток, например, в виде умерщвленных культуры или составов, содержащих полезные факторы, экспрессируемые пробиотическими бактериями. Умерщвленные культуры могут включать микроорганизмы, убитые под воздействием высокой температуры, экстремальных значений pH или давления. При использовании не живых клеток изготовление конечного продукта из них упрощается, они могут быть включены в широкое разнообразие фармацевтических форм, и условия хранения препаратов из них значительно менее жесткие, чем для препаратов, содержащих живые клетки. Так, например, в патенте США 4347240 описано успешное использование убитых высокой температурой клеток штамма Lactobacillus casei YIT 9018 для лечения и/или профилактики роста опухолей.
В настоящем изобретении предлагается также использование бактерий, получаемых выделением из разрезанного и промытого кошачьего желудочно-кишечного тракта, для сохранения и улучшения здоровья животного-компаньона, а также использование составов, содержащих молочнокислые бактерии.
В настоящем изобретении предлагается также состав, содержащий предлагаемый штамм бифидобактерий. Состав может включать еще один пробиотический материал. Состав может включать пребиотический материал.
Бифидобактерии являются симбиотическими микроорганизмами. Они были выделены из микрофлоры желудочно-кишечного тракта человека. Иммунная система желудочно-кишечного тракта не дает выраженной реакции на представителей данной микрофлоры, так как иначе возникшая воспалительная реакция разрушила бы также клетки-хозяева и нарушила бы функционирование тканей. Поэтому существуют определенные механизмы, благодаря которым иммунная система может распознавать не патогенных членов семейства желудочно-кишечной микрофлоры и отличать их от патогенных организмов. Это обеспечивает сохранность клеток-хозяев с одной стороны, и поддержание требуемого защитного барьера от патогенной флоры, с другой стороны.
В контексте настоящего описания термины «мутант», «вариант» и «генетически модифицированный мутант» включают штамм бифидобактерий, генетические и фенотипические свойства которого отличаются от соответствующих свойств родительского штамма. Термин «встречающийся в природе вариант штамма Bifidobacterium longum» подразумевает организмы, отобранные в результате селекции из организмов, в которых произошли спонтанные изменения целевых свойств. Намеренные изменения свойств родительского штамма осуществляются обычными генно-инженерными методами (in vitro), такими, как разрыв генов, коньюгационный перенос и прочие. Термин «генетическое модифицирование» включает введение экзогенных и/или эндогенных последовательностей ДНК в геном штамма бифидобактерий, например, путем их вставки в геном бактериального штамма посредством векторов на основе плазмидной ДНК или бактериофагов.
Термины «естественные мутации» и «индуцированные мутации» включают изменения по меньшей мере одного основания путем делеции, вставки, обращения или иных изменений ДНК, которые могут приводить к изменению аминокислотной последовательности, кодируемой последовательностью ДНК.
Термины «мутант», «вариант» и «генетически модифицированный мутант» включают также штамм бифидобактерий, который был подвергнут генетическим изменениям, которые накапливаются в геноме в степени, в сущности и по своей природе одинаковой для всех микроорганизмов, и/или генетическим изменениям, которые происходят в результате спонтанных мутаций, приобретений и/или потерь, которые не могут быть получены путем намеренных (in vitro) преобразований генома, но которые могут быть получены путем естественного отбора вариантов и/или мутантов, и которые обеспечивают требуемые преимущества, повышающие жизнеспособность бактерий при воздействии на них агрессивных факторов среды, таких, как, например, антибиотики. Мутант может быть создан путем намеренной (in vitro) вставки тех или иных генов в геном, которые принципиально не меняют биохимической функциональности организма, но продукты экспрессии которых могут быть использованы для идентификации или селекции бактерий, например, которые придают устойчивость к антибиотикам.
Сведущим в данной области техники будет понятно, что мутантные или вариантные штаммы бифидобактерий могут быть идентифицированы посредством анализа последовательности их ДНК на гомологию с родительским штаммом. Штаммы бифидобактерий, имеющие высокую степень идентичности последовательности ДНК с родительским штаммом, могут считаться мутантными или вариантными штаммами. Штамм бифидобактерий, имеющий степень идентичности (гомологии) последовательности ДНК соответствующей последовательности родительского штамма, составляющую 96% или более, 97% или более, 98% или более, или 99% или более, может считаться мутантным или вариантным штаммом. Гомологичность последовательностей может быть определена с помощью программы BLAST, общедоступной на сайте http://www.ncbi.nlm.nih,gov/BLAST/.
Мутанты родительского штамма включают также производные штаммы бифидобактерий, имеющие гомологию межгенной спейсерной полинуклеотидной последовательности 16s-23s, составляющую по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по отношению к соответствующей последовательности родительского штамма. Такие мутанты могут дополнительно содержать мутации ДНК в других последовательностях ДНК бактериального генома.
Краткое описание чертежей
Настоящее изобретение будет более понятным из нижеследующего подробного описания его воплощений, приводимых только в качестве примеров, сопровождаемого прилагаемыми чертежами.
Фиг.1. Фотография В. longum AH121A, выращенных на агаре с красителем конго красный.
Фиг.2. Столбчатая диаграмма, отображающая отношение экспрессии IL-10:IL-12р70 в мононуклеарах периферической крови, не стимулируемых и стимулируемых штаммом Bifidobacterium longum AH121A;
Фиг.3. Столбчатая диаграмма, отображающая выживаемость бактерий штамма AH121A в условиях низких значений pH (бактерии находились в среде с pH 2,5 в течение 6 часов; выживание определяли способом чашечного подсчета).
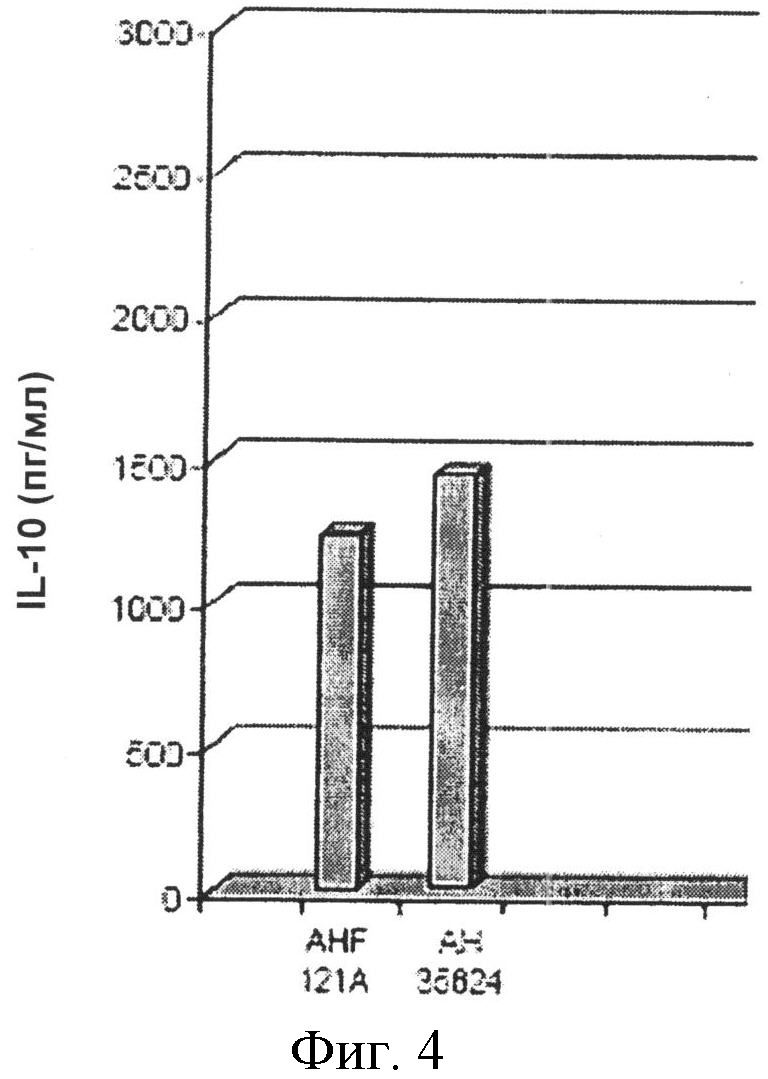
Фиг.4-6. Столбчатые диаграммы, отображающие выработку цитокинов в культурах in vitro мононуклеаров периферической крови.
Фиг.7А-7Е. Графики индукции IL-10 (в пг/мл) в мононуклеарах периферической крови после стимуляции in vitro в зависимости от количества бактерий в лунке, для штаммов AH121A и Bifidobacterium 35624;
Фиг.8A-8D. Графики индукции IL-1β (в пг/мл) в мононуклеарах периферической крови после стимуляции in vitro в зависимости от количества бактерий в лунке, для штаммов AH121A и Bifidobacterium 35624;
Фиг.9A-9D. Графики индукции IL-6 (в пг/мл) в мононуклеарах периферической крови после стимуляции in vitro в зависимости от количества бактерий в лунке, для штаммов AH121A и Bifidobacterium 35624;
Фиг.10A-10D. Графики индукции IL-8 (в пг/мл) в мононуклеарах периферической крови после стимуляции in vitro в зависимости от количества бактерий в лунке, для штаммов AH121A и Bifidobacterium 35624;
Фиг.11A-11D. Графики индукции IL-12p70 (в пг/мл) в мононуклеарах периферической крови после стимуляции in vitro в зависимости от количества бактерий в лунке, для штаммов AH121A и Bifidobacterium 35624;
Фиг.12А-12Е. Графики индукции TNF-α (в пг/мл) в мононуклеарах периферической крови после стимуляции in vitro в зависимости от количества бактерий в лунке, для штаммов AH121A и Bifidobacterium 35624;
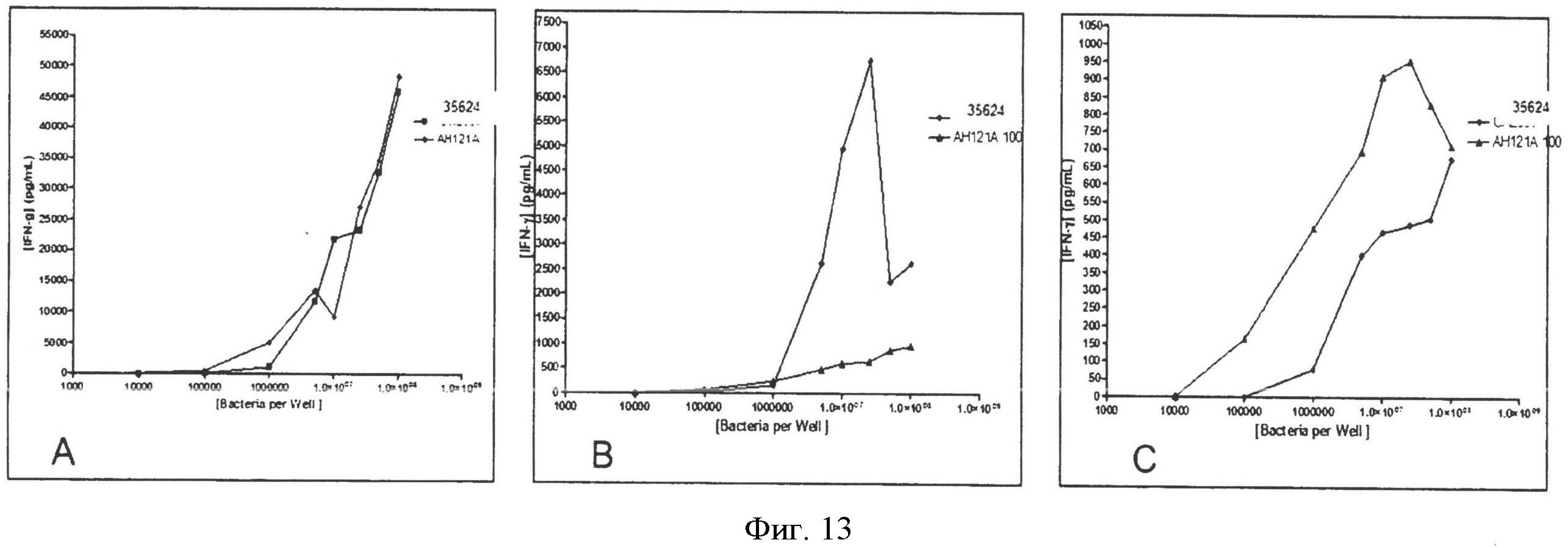
Фиг.13А-13С. Графики индукции IFN-γ (в пг/мл) в мононуклеарах периферической крови после стимуляции in vitro в зависимости от количества бактерий в лунке, для штаммов AH121A и Bifidobacterium 35624;
Фиг.14A-14D. Графики индукции G-CSF (в пг/мл) в мононуклеарах периферической крови после стимуляции in vitro в зависимости от количества бактерий в лунке, для штаммов AH121A и Bifidobacterium 35624;
Фиг.15. Столбчатые диаграммы, отображающие влияние AH121A на выработку IL-10 и IL-12p70 в человеческих дендритных клетках миелоидного типа.
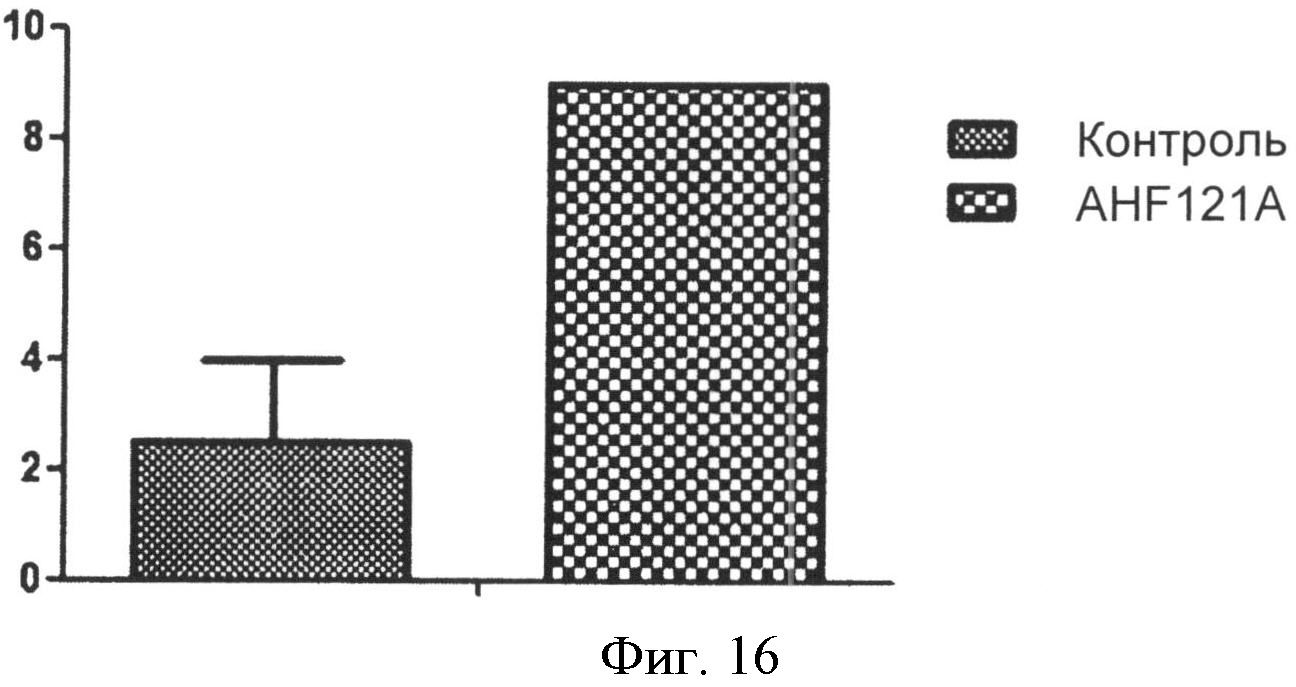
Фиг.16. Столбчатые диаграммы, отображающие влияние AH121A на человеческие Т-клетки, не подвергавшиеся воздействию CD4.
Подробное описание изобретения
Штамм Bifidobacterium longum AH121A был внесен в Национальную коллекцию промышленных и морских бактерий (NCIMB - Абердин, Великобритания) 5 ноября 2009 года с присвоением ему номера NCIMB 41675.
Штамм Bifidobacterium longum UCC35624 был внесен в Национальную коллекцию промышленных и морских бактерий (NCIMB - Абердин, Великобритания) 13 января 1999 года с присвоением ему номера NCIMB 41003.
Штамм Bifidobacterium longum может быть генетически модифицированным мутантом или встречающимся в природе вариантом.
Штамм Bifidobacterium longum предпочтительно имеет форму живых клеток.
В качестве альтернативы, штамм Bifidobacterium longum может быть в форме неживых клеток.
В контексте настоящего описания термин «животное-компаньон» означает домашнее животное. Предпочтительно термин «животное-компаньон» означает домашнее животное из семейства кошачьих (кошку), семейства псовых (собаку), кролика, хорька, лошадь, корову и им подобных животных. Наиболее предпочтительно «животное-компаньон» означает домашнее животное из семейства кошачьих.
Штаммы молочнокислых бифидобактерий
В первом типе воплощений настоящего изобретения, допускающем множество вариаций без отхода от идеи и масштабов настоящего изобретения, предлагается штамм молочнокислых бактерий рода Bifidobacteria, который может быть получен путем выделения из разрезанного и промытого кошачьего желудочно-кишечного тракта, и который обладает пробиотическим действием по отношению к животным. Пробиотиками называются микроорганизмы, живые или мертвые, их компоненты, такие, как белки, углеводороды или очищенные фракции бактериальных ферментов, которые благоприятно воздействуют на животное-хозяина. Кроме того, данный термин может быть также распространен на неживые клетки, например, на умерщвленные культуры или составы, или составы, содержащие благоприятные факторы, вырабатываемые пробиотическими бактериями. Они могут включать микроорганизмы, убитые под воздействием высокой температуры, экстремальных значений pH или давления. Для целей настоящего описания подразумевается, что термин «пробиотики» дополнительно включает метаболиты, вырабатываемые микроорганизмами в соответствии с настоящим изобретением во время брожения, если отдельно не указано иное. Такие метаболиты могут выделяться ими в сбраживаемую среду, или храниться в самих микроорганизмах. В контексте настоящего описания термин «пробиотик» включает также бактерии, гомогенизированные бактерии, экстракты из бактерий, супернатанты бактериальных ферментов и их смеси, которые оказывают благоприятное воздействие на животное-хозяина при их скармливании животному в терапевтических дозах.
Было определено, что молочнокислые бактерии рода Bifidobacteria, выделенные непосредственно из рассеченного и промытого желудочно-кишечного тракта млекопитающих, имеют сродство к желудочно-кишечному тракту при скармливании их соответствующим млекопитающим в виде живых бактериальных клеток, и также они оказывают значительное иммуномодулирующее действие на данное млекопитающее при скармливании в виде живых клеток, не живых клеток или в фракционированом виде. И хотя теоретически это не обязательно, считается, что пробиотические бифидобактерии в соответствии с настоящим изобретением вызывают благоприятные реакции в организме хозяина, в чем и заключается их пробиотическое действие. Было определено, что пробиотические бифидобактерии, выделенные из рассеченного и промытого желудочно-кишечного тракта, могут модулировать иммунную систему хозяина за счет непосредственного взаимодействия со слизистой оболочкой эпителия и клетками иммунной системы хозяина. Такое иммуномодулирующее действие, в сочетании с прочими видами воздействий, традиционно ассоциируемыми с пробиотическими бактериями, в частности, предотвращением сродства к кишечнику патогенов за счет прямого на них воздействия или за счет конкуренции за питательные вещества, обеспечивает исключительно высокую эффективность бифидобактерии в соответствии с настоящим изобретением в качестве пробиотического организма.
Бифидобактерии в соответствии с настоящим изобретением, получаемые выделением из рассеченного и промытого кошачьего желудочно-кишечного тракта, обладают антимикробным действием in vitro против ряда патогенных штаммов/видов бактерий. И хотя теоретически это не обязательно, такое антимикробное действие in vitro указывает на потенциально возможную их пробиотическую активность в животных in vivo, предпочтительно по отношению к животным-компаньонам, таким, как животные семейства кошачьих. Молочнокислые бактерии в соответствии с настоящим изобретением предпочтительно облают антимикробным действием против Salmonella typhimurium, Listeria monocytogenes, Listeria innocua или Eschericia coli, предпочтительно против смеси данных штаммов, и еще более предпочтительно против всех данных штаммов.
И хотя теоретически это не обязательно, считается, что антимикробное действие молочнокислых бактерий в соответствии с настоящим изобретением может быть результатом различных взаимодействий, в которых участвуют молочнокислые бактерии в соответствии с настоящим изобретением. Сведущими в данной области техники ранее высказывалось предположение, что некоторые штаммы бифидобактерий, выделенные из образцов фекалий, обладают пробиотическим действием в желудочно-кишечном тракте после их орального потребления за счет того, что они образуют барьерный слой на слизистой оболочке кишечника и тем самым препятствуют креплению к слизистой оболочке патогенных организмов. Это требует потребления «живых», а точнее, жизнеспособных клеток бактерий, так, чтобы в кишечнике прижилась колония таких бактерий. Мы, однако, считаем, что бифидобактерий в соответствии с настоящим изобретением, полученные выделением из рассеченного и промытого кошачьего желудочно-кишечного тракта, могут обладать значительным пробиотическим действием как при их потреблении в жизнеспособной форме, так и в не жизнеспособной форме, благодаря выработке, при брожении in vitro, вещества или веществ, которые ингибируют рост патогенных микроорганизм, или убивают патогенные микроорганизмы, и/или усиливают иммунные способности животного-хозяина. Такая форма пробиотического действия очень желательна, так как при ней бактерии в соответствии с настоящим изобретением могут быть даны животному в виде живых культур, неживых культур или очищенных продуктов брожения, и тем не менее оказывать на животное-хозяина благоприятный лечебный эффект.
Предпочтительно, чтобы молочнокислые бактерии в соответствии с настоящим изобретением могли сохранять жизнеспособность после прохождения через желудок. Это желательно для того, чтобы живые культуры бактерий можно было принимать орально, и после прохождения ими через пищевод и желудок они могли колонизовать желудочно-кишечный тракт. Колонизация желудочно-кишечного тракта молочнокислыми бактериями в соответствии с настоящим изобретением желательна для того, чтобы они могли оказывать на животное-хозяина долговременное благоприятное пробиотическое воздействие. Оральный прием не жизнеспособных клеток или выделенных из них компонентов также дает временные преимущества, но так как бактерии в данном случае являются не жизнеспособными, они не могут расти и постоянно оказывать пробиотическое действие in situ. В результате этого может потребоваться постоянный прием доз бифидобактерий хозяином, чтобы поддерживать обеспечиваемые ими преимущества для здоровья хозяина. В противоположность этому, жизнеспособные клетки, которые способны пройти через желудочно-кишечный тракт и остаться жизнеспособными, колонизуют слизистые оболочки кишечника за счет прилипания к ним и последующего разрастания, тем самым обеспечивают постоянный пробиотический эффект in situ. Поэтому предпочтительно, чтобы молочнокислые бактерии в соответствии с настоящим изобретением сохраняли жизнеспособность после нахождения в среде-суспензии, имеющей pH 2.5, в течение 1 часа. В контексте настоящего описания термин «сохранять жизнеспособность» означает, что по меньшей мере 25% бактерий, изначально помещенных в суспендированную питательную среду, остаются жизнеспособными по результатам метода чашечного подсчета, известного сведущим в данной области техники. Термин сохранять жизнеспособность» предпочтительно означает, что по меньшей мере 50% бактерий, изначально помещенных в суспендированную питательную среду, остаются жизнеспособными. При этом предпочтительно также, чтобы молочнокислые бактерии в соответствии с настоящим изобретением сохраняли жизнеспособность при воздействии на них среды с низкими значениями pH, так как это отражает воздействие на них желудочного сока в желудке и верхнем отделе кишечника in vivo при оральном их потреблении животными.
Штамм молочнокислых бактерий вида Bifidobacteria, получаемых выделением из рассеченного и промытого кошачьего желудочно-кишечного тракта, может использоваться для обеспечения пробиотического воздействия при его оральном потреблении животными, предпочтительно животными-компаньонами, или человеком. Не ограничивающие примеры благоприятного воздействия орального потребления предлагаемых бифидобактерий на составляющие здоровья и физиологии животного включают терапевтическое снятие симптомов или профилактику болезненных состояний, таких, как воспалительные расстройства, иммунодефицит, болезнь воспаленного кишечника, синдром раздраженного кишечника, рак (в особенности новообразования желудочно-кишечного тракта и иммунной системы), диарейные состояния, диарея, связанная с приемом антибиотиков, аппендицит, аутоиммунные расстройства, рассеяный склероз, болезнь Альцгеймера, амилоидоз, ревматоидный артрит, артрит, патологическая подвижность суставов, сахарный диабет, резистентность к инсулину, бактериальные инфекции, вирусные инфекции, грибковые инфекции, пародонтоз, болезни мочеполовой системы, травмы, вызванные хирургическими вмешательствами, метастатическая болезнь, вызванная хирургическим вмешательством, сепсис, потеря веса, избыточный вес, чрезмерное накопление жировой ткани, анорексия, приступы лихорадки, кахексия, заживление ран, язвы, инфекции желудочно-кишечного тракта, аллергия, астма, респираторные заболевания, нарушения системы кровообращения, ишемическая болезнь сердца, анемия, расстройства аппарата свертываемости крови, болезни почек, болезни центральной нервной системы, болезни печени, нарушения питания, остеопороз, эндокринные заболевания, болезни кожных покровов. Наиболее предпочтительным является применение предлагаемого штамма для лечения болезней желудочно-кишечного тракта, включая лечение и профилактику диареи, коррекцию иммунной системы, предпочтительно лечение или профилактику аутоиммунных заболеваний и воспалений; сохранение или улучшение состояния здоровью кожных покровов и шерсти, предпочтительно лечение или профилактику атопических заболеваний кожи, устранение или уменьшение эффектов старения, включая уровень сознания и умственной активности; предотвращение расстройств, связанных с осью гипоталамус-гипофиз-надпочечник, улучшения состояния суставов, в том числе их подвижности.
Результаты лечения перечисленных выше заболеваний могут быть оценены с помощью способов, известных сведущим в данной области техники. Так, например, воспалительные расстройства, включая аутоиммунные болезни, могут быть обнаружены и наблюдаться с использованием таких тестов на работу иммунной системы in vivo, как бластогенез лимфоцитов, активность естественных клеток-киллеров, выработка антител в ответ на вакцины, задержанная гиперчувствительность и их сочетания. Ниже приводится краткое описание данных методов, хотя они хорошо знакомы сведущим в данной области техники.
1. Бластогенез лимфоцитов. В ходе данного теста измеряется пролиферативная реакция in vitro лимфоцитов, выделенных из свежей цельной крови испытуемых и контрольных животных на различные митогены, и представляет собой общую оценку функционирования Т- и В-клеток. Для проведения данного теста из цельной крови выделяли мононуклеары периферической крови с помощью методов центрифугирования и разделения по плотности по Ficoll-Hypaque. Выделенные мононуклеары периферической крови дважды промывали в среде RPMI 1640 с добавлением HEPES, L-глютамин и пенициллина/стрептомицина. Промытые клетки ресуспендировали в среде RPMI 1640, определяли их количество и доводили до требуемого значения концентрацию клеток. 2×105 клеток подвергали воздействию диапазона концентраций (от 0,1 мкг/мл до 100 мкг/мл) различных митогенов, некоторые примеры которых включали митоген фитолакки (производства Gibco), фитогемагглютинин (Gibco) и конконавалин А (производства Sigma), троекратно в течение 72 часов при температуре 37°C и в атмосфере, содержавшей 5% CO2, с добавлением 10% эмбриональной бычьей сыворотки (производства Sigma). Спустя 54 часа клетки облучали Н-тимидином активностью 10 мкКи, после чего клетки собирали и проводили подсчет сцинтилляций с помощью прибора TopCount NXT в 72 часу.
2. Активность естественных клеток-киллеров. Как описано в патенте США 6310 090, данный тест позволяет измерить активность in vitro естественных клеток-киллеров, выделенных из свежей крови подопытных и контрольных животных. Естественные клетки-киллеры являются компонентами врожденных иммунных функций млекопитающего. Для оценки цитотоксической активности NK-клеток использовались клетки аденокарциномы щитовидной железы кошек. Предварительно было показано, что используемая клеточная линия была чувствительна, то есть убивалась NK-клетками кошек. Клетки-мишени выращивали в колбе Т75, содержавшей 20 мл минимальной среды (MEM производства Sigma Chem. Co., Сент-Луис, штат Миссури, США) с добавлением 10% эмбриональной бычьей сыворотки, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина. После достижения конфлюэнтности клетки-мишени обрабатывали трипсином, троекратно промывали и ресуспендировали в полной среде (RPMI-1640+10% эмбриональной бычьей сыворотки +100 ед./мл пенициллина +100 мкг/мл стрептомицина) до концентрации 5×105клеток/мл. По три аликвоты клеток-мишеней объемом 100 мкл наносили пипеткой на планшет с 96 лунками с U-образным дном (производства Costar, Кэмбридж, штат Массачусетс) и инкубировали в течение 8 часов в качестве подготовки клеток для лучшей адгезии друг к другу. После этого к клеткам-мишеням добавляли лимфоциты (клетки-эффекторы, 100 мкл), выделенные центрифугированием по Ficoll-Hypaque (как описано выше), так что отношение количества клеток-эффекторов к количеству клеток-мишеней (отношение Е:Т) составляло 10:1. После 10 часов инкубации при температуре 37°C добавляли 20 мкл субстрата, содержащего 5 мкг 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразол-бромида (МТТ). Смесь инкубировали в течение 4 часов при 37°C, после чего не метаболизированный МТТ отсасывали. Кристаллы формазана растворяли путем добавления 200 мкл 95%-ного этанола. Оптическую плотность измеряли на длине волны 570 нм с помощью считывающего устройства для микропланшетов. Процент специфичного лизиса NK-клеток рассчитывали следующим образом:
Специфичная цитотоксичность (%)=
100×{1-[(ODклеток-мишеней и клеток-эффекторов-ODклеток-эффекторов)/(ODклеток-мишеней)]}
3. Выработка антител при реакции на вакцины. Подопытным субъектам давали набор (до 5 вакцин) спустя по меньшей мере 12 недель после кормления пробиотиком или контрольного кормления. Вакцины могут быть смесью вакцин для первичной и повторной вакцинации. Не ограничивающие примеры наборов вакцин, которые могут использоваться для данного теста, могут включать смеси вакцин производства Fort Dodge Animal Health. He ограничивающие примеры вакцин, которые могут использоваться для данного теста, могут включать вакцины от кошачьей чумы, аденовирусной инфекции, корона-вирусной инфекции, парагриппа и парвовируса. Конкретный тип используемых вакцин определяет также история вакцинации подопытного субъекта. Уровень антител, специфичных к введенной вакцине, в крови измеряли в течение 3 недель, и таким образом определяли длительность и силу иммунного ответа у контрольной группы и группы, получавшей пробиотический корм.
4. Гиперчувствительность замедленного типа. Данный тест представляет собой метод неинвазивной оценки состояния иммунной системы in vivo. В ходе теста производится подкожная инъекция поликлонального митогена «фитогеммаглютинин» (РНА) в сочетании с овечьими эритроцитами, в качестве мультивалентной вакцины, гистамина (100 мкл гистамин-фосфата 0,0275 г/л производства Greer, Ленуар, штат Северная Каролина, США) или солевого раствора с фосфатным буфером (PBS 8,5 г/л производства Sigma). Иммунный ответ измеряли и записывали в виде толщины кожной складки с помощью штангенциркуля через 0, 24, 48 и 72 часа после инъекции. Увеличенная толщина кожной складки свидетельствует о большей гиперчувствительности иммунного ответа, которая может быть уменьшена за счет лечения бактериями в соответствии с настоящим изобретением.
Дополнительные методы для оценки эффекта от употребления бифидобактерий в соответствии с настоящим изобретением описаны в патентах США 6133323 и 6310090.
Кроме того, эффективность устранения эффектов старения может быть определена методами двойной рентгеновской абсорбциометрии или сканирующей компьютерной томографии, позволяющих определить массу жира в организме и содержание минералов в костях. Подобным образом, данный метод может также использоваться для определения анатомических изменений, таких, как потеря веса или изменение плотности костных тканей в подопытных субъектах после перенесенной инфекции.
Бифидобактерии в соответствии с настоящим изобретением могут также использоваться для снижения уровня стресса у животных-компаньонов. Для определения уровня стресса, а также при его последующей коррекции и снижении могут быть измерены уровни гормонов стресса в крови, таких, как эпинефрин, норэпинефрин, допамин, кортизол, С-реактивный белок и прочие белки острой фазы. Данные гормоны узнаются биомаркерами стресса, и их содержание может быть легко измерено способами, хорошо известными сведущим в данной области техники. Кроме того, с помощью компьютерной томографии может быть непосредственно измерен размерен размер надпочечника, как показатель активности оси гипоталамус-гипофиз-надпочечник in vivo.
Кроме того, путем оценки состояния кожно-шерстяного покрова животного-компаньона, проводимого опытным специалистом, могут быть выявлены проблемы с кожным и шерстяным покровом, и наблюдаться прогресс в улучшении состоянии кожно-шерстяного покрова. Примеры критерий оценки кожно-шерстяного покрова могут включать: а) показатель линьки - определяется по стандартной процедуре, при которой расчесывают шерсть, собирают и взвешивают вычесанные волосы, и по их весу сравнивают испытываемое животное с контрольным; b) субъективную оценку кожи и шерсти - проводится опытным специалистом по таким факторам, как линька, перхоть, блеск, однородность, мягкость и плотность шерсти; с) функциональную оценку барьерной функции кожи - проводится путем протирки участка кожи марлей, смоченной в ацетоне. При данном методе с кожи удаляется одноклеточный слой, в результате чего на данном участке кожи нарушается ее барьерная функция, обеспечиваемая липидными фракциями рогового слоя. Нарушение барьерной функции характеризуется количественно путем измерения увеличения трансэпидермальной потери воды (TEWL) и степени покраснения поврежденного участка кожи способами, хорошо известными сведущим в данной области техники. Покраснение измеряется в баллах с помощью специальной камеры и системы освещения. Показатели потери воды (TEWL) и покраснения в баллах измеряются до обработки кожи, сразу после обработки, в конце 5-го и 24-го часа после обработки, и на основании этих данных оценивается состояние защитных и ранозаживляющих функций кожи.
Кроме того, лечение инфекций желудочно-кишечного тракта у животных-компаньонов может включать улучшение состояния их бактериальной микрофлоры. Улучшение состояния микрофлоры у животных-компаньонов предпочтительно включает уменьшение содержания количества патогенных бактерий в фекалиях животных-компаньонов. Содержание патогенных бактерий в фекалиях животных-компаньонов может быть определено количественно стандартным методом чашечного подсчета, известным сведущим в данной области техники. К патогенным бактериям предпочтительно относятся бактерии, выбираемые из группы, состоящей из бактерий видов Clostridia, Escherichia, Salmonella, им подобных и их смесей. Не ограничивающие примеры подходящих штаммов патогенных бактерий включают С.perfringens, С.difficile, Eschericia coli, Salmonella typhimurium и их смеси.
Способ использования бактерий в соответствии с настоящим изобретением может также включать профилактику или лечение болезней мочевого тракта домашних животных, предпочтительно животных-компаньонов. Не ограничивающие примеры лечения или профилактики болезней мочевого тракта могут включать лечение или профилактику инфекций мочевого тракта, лечение или профилактику болезней почек, включая каменную болезнь, лечение или профилактику инфекций мочевого пузыря и им подобных болезней. И хотя теоретически это не обязательно, авторы считают, что бифидобактерии в соответствии с настоящим изобретением могут быть полезными для предотвращения описанных выше болезненных состояний благодаря своей способности разлагать щавелевую кислоту, что было показано в опытах in vitro. Щавелевая кислота является побочным продуктом процессов метаболизма, происходящих в мочевом тракте, и ее соли могут давать нерастворимые остатки, которые могут приводить к инфекциям почек, мочевого пузыря и прочих отделов мочевых путей. За счет разложения солей щавелевой кислоты и предотвращения их накопления и выпадения в осадок в мочевых путях, бактерии в соответствии с настоящим изобретением могут использоваться для лечения и профилактики инфекций и прочих болезненных состояний мочевых путей. Разложение щавелевой кислоты может быть измерено in vitro с помощью набора №755699, предлагаемого Boehringer Mannheim/R-Biopharm.
Бифидобактерии в соответствии с настоящим изобретением могут быть использованы для сохранения и улучшения здоровья животного-компаньона за счет улучшения переваривания волокон. Улучшение переваривания волокон является очень желательным, так как оно способствует росту упомянутых бифидобактерий и развитию благоприятной эндогенной микрофлоры, которая в свою очередь способствует подавлению некоторых потенциально патогенных бактерий. Кроме того, сообщалось об уменьшении количества токсичных метаболитов и вредных ферментов, образующихся в процессах брожения, вызванных патогенными микроорганизмами у людей (6). Степень переваривания волокон может быть определена по методу, описанному Vickers с соавторами (7), с тем отличием, что вместо инокуляции разбавленных образцов фекалий должны использоваться чистые культуры исследуемых бактериальных штаммов.
Штаммы пробиотических бактерий, выделенные из животных семейства кошачьих, могут быть использованы для уменьшения зловонных запахов фекалий и мочи из лотков для туалета животных-компаньонов, за счет уменьшения образования соединений в фекалиях и моче, которые вызывают неприятные запахи. Не ограничивающие примеры соединений, вызывающих неприятные запахи, включают аммиак, индолы, фенол, амины, жирные кислоты с разветвленными цепями и летучие соединения, содержащие серу. И хотя теоретически это не обязательно, можно ожидать, что уменьшение содержания данных соединений в фекалиях или моче животного-компаньона приведет к ослаблению неприятных запахов, исходящих от фекалий и мочи.
Способ использования молочнокислых бактерий в соответствии с настоящим изобретением в целом предусматривает их оральное потребление животным. Оральное потребление может представлять собой часть обычного режима питания, или может проводиться в дополнение к нему. Оральное потребление проводится по меньшей мере раз в месяц, предпочтительнее - по меньшей мере раз в неделю, и еще более предпочтительно - по меньшей мере раз в день. Молочнокислые бактерии в соответствии с настоящим изобретением могут выдаваться домашнему животному, предпочтительно животному-компаньону, в терапевтически эффективном количестве, достаточном для поддержания или улучшения состояния его здоровья. В контексте настоящего описания термин «терапевтически эффективное количество» по отношению к молочнокислым бактериям означает, что количество бактерий является достаточным для обеспечения требуемого воздействия на животное, требующее такого лечения, и в то же время достаточно малым, что позволяет избежать таких побочных эффектов, как токсичность, раздражение или аллергическая реакция, то есть обеспечивается разумное отношение польза/риск при приеме бактерий в соответствии с настоящим изобретением. Конкретное «терапевтически эффективное количество» в каждом случае будет зависеть от таких факторов, как конкретный диагноз животного, физическое состояние животного, длительность лечения, назначенные дозы, возможное наличие одновременно проводимого лечения, используемый носитель, растворимость формы препарата и конкретный режим дозировки.
Молочнокислые бактерии предпочтительно назначаются животному-компаньону в дозе от 1,0×104 КОЕ в день до 1,0×1014 КОЕ в день, более предпочтительно - от 1,0×106 КОЕ в день до 1,0×1012 КОЕ в день. Состав в соответствии с настоящим изобретением предпочтительно содержит по меньшей мере 0,001% молочнокислых бактерий, то есть от 1,0×104 КОЕ/г до 1,0×1011 КОЕ/г молочнокислых бактерий рода Bifidobacteria, выделенных из рассеченного и промытого кошачьего желудочно-кишечного тракта. Молочнокислые бактерии могут скармливаться животному в форме живых клеток, умерщвленных клеток, дистиллятов, изолятов или иных фракций продуктов ферментации молочнокислых бактерий в соответствии с настоящим изобретением, или любых их смесей.
Предпочтительно, чтобы молочнокислые бактерии, или выделенные или очищенные их фракции использовались для приготовления составов, предназначенных для сохранения или улучшения состояния здоровья животного. Как было сказано выше, состав может представлять собой часть обычного рациона питания, или даваться животному дополнительно. В случаях, когда состав является частью обычного рациона питания, он может быть в форме сухого корма для животных, например, печенья или гранул, или корма из обработанного зерна, влажного корма для животных, йогуртов, соусов, продуктов для жевания, угощений и прочего.
Такие составы могут содержать дополнительные компоненты. Такие дополнительные компоненты могут быть полезными для включения в предлагаемые составы, но в контексте настоящего изобретения они являются лишь дополнительно возможными. Так, например, пищевые составы предпочтительно должны быть сбалансированы по питательной ценности. В одном из воплощений пищевые составы могут содержать (в пересчете на сухое вещество) от примерно 20% до примерно 50% сырого белка, предпочтительно от примерно 22% до примерно 40% сырого белка, от суммарного веса пищевого состава. Сырой белковый материал может содержать любой материал, содержание белка в котором составляет по меньшей мере 15% по весу, и не ограничивающие примеры таких материалов включают материалы растительного происхождения, содержащие белок, такие, как соевые бобы, семена хлопка и арахис, материалы животного происхождения, содержащие белок, такие, как казеин, альбумин и продукты на основе мышечных тканей. Не ограничивающие примеры продуктов на основе мышечных тканей, которые могут использоваться в соответствии с настоящим изобретением, включают свежее мясо, а также высушенные и топленые мясные продукты, такие, как рыбный корм, корм из птиц, мясной корм, корм из костей и им подобные. Прочие типы подходящих источников сырого белка включают клейковину пшеницы или кукурузы, а также белки, экстрагированные из источников на основе микроорганизмов, таких, как дрожжи.
Кроме того, пищевые составы могут содержать, в пересчете на сухое вещество, от примерно 5% до примерно 35% жира, предпочтительно от примерно 10% до примерно 30% жира по весу от суммарного веса пищевого состава. Кроме того, пищевые составы, содержащие молочнокислые бактерии в соответствии с настоящим изобретением, могут также содержать от примерно 4% до примерно 25% суммарного пищевого волокна. Составы могут также содержать источник крахмалов, как описано в WO 99/51 108.
Составы в соответствии с настоящим изобретением могут дополнительно содержать источник углеводородов. Примерами таких источников являются зерновые или злаковые, такие, как рис, кукуруза, ячмень, люцерна, пшеница и им подобные продукты. Кроме того, составы могут также содержать прочие материалы, такие, как сухая молочная сыворотка или прочие молочные продукты.
Составы, содержащие бактерии в соответствии с настоящим изобретением, могут также содержать пребиотик. Термин «пребиотик» включает вещества или составы, которые сбраживаются кишечной флорой животного-компаньона и тем самым способствуют росту или развитию молочнокислых бактерий в желудочно-кишечном тракте животного-компаньона в ущерб патогенным бактериям. В результате такого брожения вырабатываются жирные кислоты, в особенности вырабатываются короткоцепочечные жирные кислоты в толстой кишке. Результатом этого является снижение значения pH в толстой кишке. Не ограничивающие примеры подходящих пребиотиков включают олигосахариды, такие, как инулин и продукты его гидролиза, известные как фруктоолигосахариды, галакто-олигосахариды, ксило-олигосахариды и олиго-производные крахмала. Пребиотик может входить в состав в любой подходящей форме. Так, например, пребиотик может входить в состав в форме растительного материала, содержащего волокно. Подходящие растительные материалы включают спаржу, артишоки, лук, пшеницу или цикорий, или продукты, остающиеся при переработке данных растительных материалов. В качестве альтернативы, пребиотическое волокно может входить в состав в виде инулинового экстракта, например, подходящими являются экстракты цикория. Подходящие инулиновые экстракты предлагаются Orafti SA (Бельгия) под торговым наименованием "Raftiline". Так, например, в качестве источника инулина подходит препарат Raftiline (g) ST, представляющий собой мелкий белый порошок, содержащий от примерно 90% до 94% по весу инулина, примерно до 4% по весу глюкозы и фруктозы и примерно от 4% до примерно 9% сахарозы.
В качестве альтернативы, волокно может присутствовать в виде фруктоолигосахарида, такого, как "Raftilose", предлагаемого Orafti SA (Бельгия). Подходит, например, продукт Raftilose (g) P95. В качестве альтернативы, фруктоолигосахариды могут быть получены гидролизом инулина, ферментативными методами или с использованием микроорганизмов.
Подходящим процессом получения сухого корма для животных-компаньонов является варка с экструдированием, хотя могут использоваться и спекание, и прочие подходящие процессы. При использовании варки с экструдированием обычно получается сухой корм для животных-компаньонов в виде гранул. При использовании пребиотика он может быть смешан с прочими компонентами корма для животных перед их последующей обработкой. Подходящий процесс описан, например, в Европейской патентной заявке No 0850569. При использовании пробиотического микроорганизма предпочтительно, чтобы такой организм был нанесен в виде слоя покрытия на сухой корм для животных-компаньонов, или изнутри заполнял сухой корм для животных-компаньонов. Походящий процесс описан, например, в Европейской патентной публикации ЕР 0862863.
Если состав имеет вид влажного корма, то для изготовления мясных продуктов, содержащих мясо и стимулированных бифидобактериями, могут использоваться процессы, описанные в патентах США 4781939 и 5132137. Могут также использоваться и прочие процессы для изготовления продуктов типа цельного мяса, например, варка в паровой печке. В качестве альтернативы, могут быть изготовлены продукты типа колбасного фарша путем эмульсификации подходящего мясного материала, добавлением подходящего желирующего агента, нагревания мясной эмульсии с желирующим агентом и последующего наполнения жестяных банок или прочих подходящих контейнеров. Как правило, влажные составы для кормления животных могут содержать от примерно 7% до примерно 15% белка, от примерно 1% до примерно 10% жира, и от примерно 1% до примерно 7% волокна. Не ограничивающие примеры ингредиентов, которые могут использоваться во влажных пищевых составах, включают курятину, индюшатину, говядину, белую рыбу, куриный бульон, индюшиный бульон, говяжий бульон, печень цыплят, пивоваренный рис, кукурузные отруби, рыбный корм, яйца, свекольную массу, хлориды, льняную массу, баранину, отходы производства говядины или курятины и их смеси. В другом воплощении составы, используемые с качестве пищевых добавок, таких, как печенья, жевательные продукты или прочие «угощения», могут содержать, в пересчете на сухое вещество, от примерно 20% до примерно 60% белка, или от примерно 22% до примерно 40% белка по весу от веса состава. Еще в одном примере составы, используемые в качестве пищевых добавок, могут содержать, в пересчете на сухое вещество, от примерно 5% до примерно 35% жира, или от примерно 10% до примерно 30% жира по весу, от суммарного веса состава, используемого как добавка. В целом пищевые составы и составы, используемые как добавки, предназначенные для животных семейства кошачьих, хорошо известны сведущим в данной области техники.
Корм для животных-компаньонов может содержать прочие активные вещества, такие, как жирные кислоты с длинными цепями и цинк. Подходящие жирные кислоты с длинными цепями включают α-линолевую кислоту, γ-линоленовую кислоту, эйкозапентаеновую кислоту и докозагексаеновую кислоту. Подходящим источником эйкозапентаеновой кислоты и докозагексаеновой кислоты является рыбий жир.
Подходящими источниками γ-линоленовой кислоты являются масло бораго, масло семян черной смородины и масло энотеры. Сафлоровое масло, подсолнечное масло, кукурузное масло и соевое масло являются подходящими источниками линолевой кислоты. Перечисленные масла могут также использоваться для покрытия субстратов, как было описано выше. Цинк может входить в состав в любой подходящей форме, например, в виде сульфата цинка или оксида цинка. Кроме того, большинство ингредиентов, традиционно используемых в кормах для животных, являются источниками жирных кислот и цинка. Было замечено, что сочетание цикория, как источника пребиотика, с маслом, богатым линолевой кислотой, таким, как, например, соевое масло, дает неожиданные преимущества, предположительно объясняемые синергическим эффектом.
Если состав имеет форму соуса, то он предпочтительно содержит по меньшей мере 10% бульона, не ограничивающие примеры которых включают бульон из овощей, говядины, цыплят или ветчины. Типичный состав в виде соуса может содержать от примерно 0,5% до примерно 5% сырого белка, от примерно 2% до примерно 5% сырого жира и от примерно 1% до примерно 5% волокна.
Прочие не ограничивающие примеры добавок, которые могут использоваться в соответствии с настоящим изобретением, включают порошки, масляные суспензии, суспензии на основе молока, сыры, составы на основе какао-масла, таблетки и капсулы. Если состав имеет форму таблетки, то для сохранения ее цельной и спрессованной формы требуются подходящие связующие. Не ограничивающие примеры подходящих связующих включают натуральные смолы, такие, как ксантановая камедь, пектины, лецитины, альгинаты и прочие соединения, известные сведущим в данной области техники. Если состав имеет вид капсулы, он должен быть заключен в оболочку, как известно сведущим в данной области техники. Не ограничивающие примеры подходящих материалов для оболочки включают поливиниловый спирта (ПВА), поливинилпирролидон, альгинаты и желатин. Составы на основе йогурта могут содержать от примерно 1% до примерно 5% белка, от примерно 10% до примерно 20% углеводородов, от примерно 1% до примерно 5% волокна, от примерно 1% до примерно 5% жира и от примерно 50% до примерно 90% жидкого носителя, такого, как молоко.
Примеры
Приведенные ниже примеры даются только для иллюстрации настоящего изобретения, и не подразумевается каким-либо образом ограничить ими масштаб настоящего изобретения.
Пример 1. Выделение Bifidobacterium longum АН1714
Штамм Bifidobacterium longum AH121A был выделен из образцов ткани кошачьего кишечника.
Образцы тканей кошачьего кишечника были получены от здоровых кошек, приведенных к местным ветеринарам для эвтаназии по инициативе и с одобрения хозяев. Все животные были здоровыми и не имели каких-либо заболеваний. У каждой кошки вырезали толстую, слепую и подвздошную кишку и рассекали их для обнажения слизистой оболочки.
Образцы тканей механически гомогенизировали, энергично встряхивали в течение 1 минуты, и собирали супернатанты. Каждый супернатант наносили на агар de Mann Rogosa Sharpe (MRS), после чего инкубировали в течение 48 часов при температуре 37°C в приборе Anerocult GasPak. Полученные после инкубации колонии из чашек пересевали штрихом на туже среду MRS и вновь выращивали при тех же самых анаэробных условиях. Полученные после этого колони пересевали штрихом еще 4 раза, до тех пор, пока, не получали чистую колонию одного штамма. Под микроскопом изучали морфологические свойства колонии. Подходящие изоляты испытывали на реакцию по Граму и каталазную активность. Испытание на активные фармацевтические ингредиенты (набор API 5 OCHL производства BioMerieux) показало, что бактерии являются грамположительными и каталаза-отрицательными. Собранные клетки дважды промывали 0,05 М фосфатным буфером (pH 6,5) и цистеином-HCl (500 мг/л), после чего разрушали ультразвуком. С помощью центрифугирования удаляли остатки клеток. Супернатанты инкубировали с NaF (6 мг/мл) и иодоацетатом натрия (10 мг/мл) в течение 30 мин при 37°C. Реакцию останавливали инкубацией с гидроксиламином-HCl (pH 6,5) в течение 10 минут при комнатной температуре. Добавляли HCl (4М), FeCl3·6H2O (5% вес/объем в 0,1М HCl) и фруктоза-6-фосфат натрия, и наблюдали за изменением цвета. Покраснение свидетельствовало об образовании ацетил-фосфата из хелата железа посредством гидроксилирования.
Идентификация вида бактерий
Для дополнительной идентификации выделенных бифидобактерий проводили секвенирование межгенной спейсерной области 16s (далее обозначается также как IGS) по следующей методике. Из бактерий штамма AH121A выделяли ДНК с помощью 100 мкл экстракционного раствора и 25 мкл препарационного раствора для ткани (набор реактивов XNAT2 производства Sigma). Образцы инкубировали в течение 5 мин при комнатной температуре, затем 2 часа при температуре 95°C, после чего добавляли 100 мкл нейтрализующего раствора из того же набора Sigma XNAT2. Определяли количество геномной ДНК в растворе с помощью спектрофотометра Nanodrop. Полученные образцы хранили при 4°C. Проводили полимеразную цепную реакцию с IGS-специфичными праймерами: IGS L: 5'-GCTGGATCACCTCCTTTCT-3' (идентификационный №3, в результате чего получали последовательность с идентификационным номером 1) и IGS R: 5'-CTGGTGCCAAGGCATCCA-3' (идентификационный №4, в результате чего получали последовательность с идентификационным номером 2). Реакцию проводили при следующих параметрах циклов: 94°C в течение 3 минут (1 цикл), 94°C в течение 30 секунд, 53°C в течение 30 секунд, 72°C в течение 30 секунд (28 циклов). Реакционная смесь для ПЦР содержала 4 мкл (50 нг) ДНК, набор для ПЦР XNAT2 производства Sigma, 0.4 мкМ праймеров IGS L и IGS R (MWG Biotech, Германия). Реакции проводили на амплификаторе Eppendorf. Для анализа экспрессии IGS продукты ПЦР (в количестве 10 мкл) разделяли в 2% агарозном геле с буфером ТАЕ, окрашенном бромидом этидия, с маркером молекулярного веса (с шагом 100 пар нуклеотидов, производства Roche). Отдельные продукты амплификации, соответствующие отдельным полосам после разделения в геле, очищали с помощью набора реактивов Wizard PCR производства Promeg. Очищенные продукты ПЦР секвенировали с использованием IGS-специфичных праймеров, последовательности которых приведены выше. Расшифрованные последовательности проверяли по базе данных нуклеотидных последовательностей NCBI на гомологию с известными последовательностями с использованием стандартной программы поиска BLAST (http://www.ncbi.nlm.nih.gov/BLAST/). После нахождения наиболее близких последовательностей производили их выравнивание с исследуемыми с помощью программы DNASTAR MegAlign. Полученные последовательности (прямая последовательность IGS, идентификационный номер 1 и обратная последовательность IGS, идентификационный номер 2, - приводятся в списке последовательностей). Поиск по базе данных NCIMB показал, что штамм AH121A характеризуется уникальными последовательностями IGS (прямая и обратная), имеющими достаточно высокую степень гомологии с соответствующими последовательностями бактерий Bifidobacterium longum.
Пример 2. Скрининг на агаре с красителем конго красный
Для фенотипического скрининга бактериальных штаммов, экспрессирующих EPS (внеклеточные полисахариды), использовали тест на агаре с красителем конго красный. Процедура состояла в следующем. В 10 мл модифицированной (добавлением 0,05% цистеина) бульонной среды Rogosa асептически инокулировали свежевыращенную колонию бактериального штамма, после чего проводили инкубацию в анаэробных условиях при 37°C до появления мутности (примерно от 16 до 24 часов). Бульонные культуры асептически штриховали на чашки с агаром, содержащим краситель конго красный и инкубировали при 37°C в течение 48 часов. Считается, что EPS, вырабатываемые в качестве побочного продукта роста и/или метаболизма определенных штаммов бактерий, препятствует поглощению ими красителя конго красный, в результате чего колония имеет молочно-белый цвет. Штаммы, вырабатывающие меньше EPS, сильнее окрашиваются красителем конго красный, в результате чего колония имеет цвет между розовым и красным. Штаммы, которые вообще не вырабатывают EPS, приобретают красную окраску и выглядят практически прозрачными на фоне красного агара.
Как показано на фиг.1, колонии В. longum AH121A имеют выпуклую мукоидную морфологию и ярко-белый цвет.
Пример 3. Устойчивость В. longum AH121A против желчных солей и низких значений pH
Данный эксперимент проводили с целью определения устойчивости изолятов кошачьих бактерий В. longum AH121A против различных концентраций желчи, а также для оценки выживаемости бактерий при pH 2,5 в течение 6 часов.
Схема эксперимента
Устойчивость бактерий штамма В. longum AH121A против желчи определяли высеванием лиофилизированных бактерий на чашки с агаром MRS/RCA, в который была добавлена кошачья желчь (в концентрации 0,5; 1,0; 2,0%). Оценивали также выживаемость штамма при pH 2,5 в течении 6 часов, метом чашечного подсчета, за 5 минут до начала инкубации и через 5, 30, 60, 120, 180 и 360 мин после начала инкубации.
Подробное описание метода
Процедура определения устойчивости бактерий против кошачьей желчи состояла в следующем.
Чашки с различной концентрацией желчи готовили из концентрированного 45%-ного раствора синтетической желчи, который подвергали тепловой обработке при 80°C в течение 10 мин, чтобы убить посторонние живые организмы.
Среду с различной концентрацией желчи готовили следующим образом:
Среда с 2% желчи: 6,67 мл концентрата желчи +143,33 мл агара
Среда с 1% желчи: 3,33 мл концентрата желчи +146.67 мл агара
Среда с 0,5% желчи: 1,67 мл концентрата желчи +148.33 мл агара
Для каждого разбавления удаляли лишнее количество агара после его автоклавирования, и добавляли вместо него соответствующее количество концентрата желчи.
Свежие чашки с желчью готовили ежедневно (хотя их можно хранить в течение недели). Предварительно определяли количество КОЕ/г для каждого образца лиофилизированных бактерий методом размазывания по стеклу.
Бактерии наносили на чашки с содержащим желчь агаром путем ресуспендирования лиофилизированных бактерий в 10 мл стерильного буфера PBS (в концентрации 109 КОЕ/мл), разделения чашки на 4 равных сектора и нанесения на чашку 4 образцов штамма (по 10 мкл суспензии).
Чашки сушили в течение 30 мин (или до высыхания пятна суспензии на агаре), после чего проводили инкубацию бактерий в соответствующих условиях.
Процедура оценки выживаемости бактерий штамма AH121A в условиях с низким значением pH (pH 2.5) состояла в следующем.
Подкисление среды проводили за счет добавления 6 М HCl. Сначала кислоту добавляли в 100 мл бульона и определяли, сколько нужно кислоты для доведения pH такого количества бульона до 2,5. Соответствующее количество кислоты добавляли в остальную часть бульона MRS (4×100 мл). Предварительно определяли количество КОЕ/г для каждого образца лиофилизированных бактерий методом размазывания по стеклу.
Сухие лиофилизированные бактерии ресуспендировали в подкисленной среде до получения их концентрации 109 КОЕ/мл и инкубировали в анаэробных условиях. Через 5, 30, 60, 120, 180, 240 и 360 после начала инкубации брали аликвоты, наносили на стекло и определяли количество КОЕ в миллилитре образца.
Результаты
Заключения
Воздействие кошачьей желчи на рост бактерий штамма AH121A представлено в Таблице 1. Как видно из таблицы, бактерии данного штамма способны выдержать концентрации кошачьей желчи, меньшие 2%.
На фиг.3 показана устойчивость штамма к среде с pH 2,5.
Пример 4. Влияние В. lonsum AH121A на отношение экспрессии IL-10:IL-12
Из периферической крови здоровых людей выделяли мононуклеары с помощью препарационных пробирок Vacutainer производства BD (номер по каталогу 362761), в соответствии с инструкцией производителя. Мононуклеары периферической крови промывали и ресуспендировали в модифицированной среде Glutamax™ производства Dulbecco, содержавшей глутамакс (заменитель глютамина) + пируват +4,5 г/л глюкозы (Gibco, номер по каталогу 10569-010)+10% эмбриональную бычью сыворотку (Sigma, номер по каталогу F4135), с добавлением 1% пенициллина/стрептомицина (Sigma, номер по каталогу Р0781). Мононуклеары периферической крови инкубировали в плоскодонных плашках с 96 лунками (2×105 клеток в лунке) с добавлением 20 мкл бактериальной суспензии (с концентрацией бактерий 1×107 КОЕ/мл) в течение 48 часов при температуре 37°C в атмосфере, содержавшей 5% CO2. После инкубации в течение 2 дней чашки центрифугировали при 300 g, супернатант удаляли, и полученные образцы хранили при температуре -80°C до последующих опытов. Уровни интерлейкина 10 (IL-10) и интерлейкина-12р70 (IL-12p70) в супернатанте культуры определяли с помощью набора с 96 лунками производства Meso Scale Discovery (Гейтерсбург, штат Мэриленд, США; номер по каталогу К15008В-1).
Бактерии для экспериментов совместного выращивания готовили двумя способами: (а) свежевыращенные бактерии выращивали в среде Difco MRS и собирали сразу после входа в стационарную фазу. Все клетки выращивали при анаэробных условиях при температуре 37°C. (b) Лиофилизированные бактерии выращивали при анаэробных условиях при температуре 37°C в среде Difco MRS и собирали сразу после входа в стационарную фазу. Из каждого препарата бактерий готовили лиофилизированный порошок и хранили при -80°C в отдельной емкости в виде аликвот по 100 мг. Непосредственно перед использованием по одной аликвоте каждого штамма извлекали из холодильника и давали ей прогреться до комнатной температуры. Для каждого опыта использовали новую аликвоту. Каждый штамм промывали 3 раза в пробирке емкостью 10 мл и затем центрифугировали. Для каждого из условий роста строили калибровочные кривые (зависимость оптической плотности от количества живых клеток), и препарат с промытыми клетками нормализовали, чтобы получить нужное число клеток, перед его добавлением к мононуклеарам периферийной крови. Во всех экспериментах использовался контроль, не содержавший бактерий. Все анализы проводили троекратно.
Результаты экспериментов, отображающие влияние штамма AH121A на отношение уровней экспрессии IL-10:IL-12, представлены на фиг.2. Результаты практически одинаковы для свежевыращенных и лиофилизированных культур.
Пример 5. Влияние штамма AH121A на выработку IL-10
Наличие адекватного иммунного ответа на микробы является важным показателем общего состояния здоровья организма-хозяина. Чрезмерная реакция может вызвать воспалительные состояния (например, колит), в то время как недостаточный иммунный ответ приводит к выживанию и распространению патогенов в организме. Описанные ниже методы анализа хорошо представлены в литературе и являются полезными методами для определения иммунологической активности организма-хозяина при реакции на различные микробы.
Для экспериментов отбирали мононуклеары периферической крови (моноциты, дендритные клетки, В-клетки и Т-клетки) у здоровых добровольцев и стимулировали их in vitro бактериальными штаммами. Супернатанты культур отбирали и определяли в них уровни цитокинов.
IL-10 - важный цитокин, предотвращающий аберрантные провоспалительные иммунные реакции. У животных с выключенной экспрессией IL-10 развивались колит и опухоли желудочно-кишечного тракта. Для предотвращения подобных потенциально опасных иммунных реакций регуляторные клетки иммунной системы вырабатывают и используют IL-10. Повышенная экспрессия данного цитокина является защитой от повышенной воспалительной активности и чрезмерной иммунной реакции на патогены.
Выработку IL-10 в мононуклеарах периферической крови in vitro определяли спустя 48 часов после их совместной инкубации с бактериальными штаммами. Штаммы AH121A и 35624 индуцировали выработку IL-10 примерно в одинаковой степени (Фиг.4-6).
Пример 6. Bifidobacterium longum АН 1714 обладает иммуномодулирующим действием при совместной инкубации с клетками иммунной системы человека, отличным от действия Bifidobacterium longum AH35624.
Материалы и методы
Штамм Bifidobacterium longum infantis UCC35624 (В624) и штамм Bifidobacterium longum AH121A подвергали анализу на индукцию цитокинов в мононуклеарах периферийной крови. Бактерии для совместного выращивания готовили следующим образом. Бактерии выращивали при анаэробных условиях при температуре 37°C в среде Difco MRS и собирали сразу после входа в стационарную фазу. Из каждого типа бактерий готовили лиофилизированный порошок и хранили при -80°C в отдельном сосуде в виде аликвот по 100 мг. Непосредственно перед использованием по одной аликвоте каждого штамма извлекали из холодильника и давали ей прогреться до комнатной температуры. Для каждого опыта использовали новую аликвоту. Каждый штамм промывали 3 раза в пробирке емкостью 10 мл и затем центрифугировали.
Проводили прямой подсчет количества клеток под микроскопом в счетной камере Петрова-Хауссера в соответствии с инструкциями производителя. Перед использованием клеток для анализа уровня цитокинов в мононуклеарах периферийной крови раствор промытых клеток нормализовали до получения одного и того же числа клеток в единице объема. В каждую ячейку для анализа добавляли 20 мкл раствора бактерий в солевом растворе с фосфатным буфером (PBS), для получения общего числа бактерий, указанного в каждом эксперименте.
Анализ индукции цитокинов в мононуклеарах периферической крови
Мононуклеары периферической крови выделяли из периферической крови здоровых людей с помощью препарационных пробирок Vacutainer производства BD (номер по каталогу 362761), в соответствии с инструкцией производителя. Мононуклеары периферической крови промывали и ресуспендировали в модифицированной среде Modified Eagle Medium-Glutamax™ производства Dulbecco, содержавшей глутамакс (заменитель глютамина) + пируват +4,5 г/л глюкозы (Gibco, номер по каталогу 10569-010)+10% эмбриональной бычьей сыворотки (Sigma, номер по каталогу F4135), с добавлением 1% пенициллина/стрептомицина (Sigma, номер по каталогу Р0781). Мононуклеары периферической крови инкубировали в плашках с 96 плоскодонными лунками (2×105 клеток в лунке) с добавлением 20 мкл бактериальной суспензии с различной концентрацией бактерий: 2,5×108, 1,0×108, 5,0×107, 2,5×107, 1,0×107 и 1,0×106 (всего до 6 концентраций) в течение 48 часов при температуре 37°C в атмосфере, содержавшей 5% CO2. Уровни интерлейкина 10 (IL-10) и интерлейкина-12р70 (IL-12p70) в супернатанте культуры определяли с помощью набора с 96 ячейками производства Meso Scale Discovery (Гейтерсбург, штат Мэриленд, США; номер по каталогу К15008В-1). Уровни человеческого интерлейкина 1β (II-1b), человеческого интерлейкина 6 (11-6), человеческого интерлейкина 8 (11-8) человеческого интерлейкина 10 (11-10), человеческого интерлейкина 12р70 (И12р70), человеческого интерферона-гамма (IFN-γ), человеческого фактора некроза опухолей альфа (TNF-α) и человеческого G-CSF (гранулоцитарный колониестимулирующий фактор) определяли количественно и выражали в пикограммах на миллилитр (пг/мл). Для каждого образца проводили по 3-5 опытов (соответствуют графикам А-Е на чертежах).
Результаты
Две независимые культуры (1 и 2) штамма Bifidobacterium longum infantis UCC35624 (В624) и штамм Bifidobacterium longum AH1714 исследовали на иммуномодулирующие свойства методом анализа индукции цитокинов в мононуклеарах периферической крови при добавлении бактерий в различной концентрации: 2,5×108, 1,0×108, 5,0×107, 2,5×107, 1,0×107 и 1,0×106 (всего до 6 концентраций). Супернатанты исследовали на уровни выработки различных цитокинов, включая IL-1β, -6, -8, -10 и -12, IFN-α, IFN-γ и G-CSF. Результаты измерений представлены в виде средних значений (в пг/мл) ± среднеквадратичное отклонение для различных образцов (от А до Е, то есть до 5 штук).
По сравнению со штаммом 35624, штамм AH121A также давал сильную индукцию выработки большинства цитокинов, включая IL-10, но несколько отличные, а именно, повышенные, уровни цитокинов IL-6 и IL-8.
IL-10: инкубация с AH121A индуцирует растущую с дозой бактерий выработку противовоспалительного цитокина IL-10 в мононуклеарах периферической крови после стимуляции in vitro (фиг.7). Характер индукции IL-10 качественно и количественно схож с индукцией при инкубации со штаммом 35624. Максимума индукции IL-10 не наблюдается вплоть до количества бактерий, составляющего 1,0×109 в лунке.
IL-1β: инкубация с AH121A индуцирует растущую с дозой бактерий выработку провоспалительного цитокина IL-1β в мононуклеарах периферической крови после стимуляции in vitro (фиг.8). Характер индукции IL-1β качественно и количественно схож с индукцией при инкубации со штаммом 35624. Максимума индукции IL-1β не наблюдается вплоть до количества бактерий, составляющего 1,0×109 в лунке.
IL-6: инкубация с AH121A индуцирует растущую с дозой бактерий выработку цитокина IL-6 в мононуклеарах периферической крови после стимуляции in vitro (фиг.9). Характер индукции IL-6 количественно отличается от индукции при инкубации со штаммом 35624: инкубация со штаммом AH121A дает более высокие уровни IL-6, особенно при малых количествах бактерий в лунке.
IL-8: инкубация с AH121A индуцирует растущую с дозой бактерий выработку цитокина IL-8 в мононуклеарах периферической крови после стимуляции in vitro (фиг.10). Характер индукции IL-8 количественно отличается от индукции при инкубации со штаммом 35624: инкубация со штаммом AH121A дает более высокие уровни IL-8 при всех дозах бактерий в лунке.
IL-12: инкубация с AH121A индуцирует растущую с дозой бактерий выработку провоспалительного цитокина IL-12 в мононуклеарах периферической крови после стимуляции in vitro (фиг.11). Характер модуляции выработки IL-12 имеет колоколообразную форму при инкубации с обоими штаммами: AH121A и 35624: постепенно достигает пика, а затем начинает падать при более высоких концентрациях бактерий. Количественно экспрессия IL-12 сильно варьирует для разных образцов, но в среднем экспрессия с бактериями AH121A аналогична экспрессии с бактериями 35624.
TNF-α: инкубация с AH121A индуцирует растущую с дозой бактерий выработку провоспалительного цитокина TNF-α в мононуклеарах периферической крови после стимуляции in vitro (фиг.12). Характер индукции TNF-α качественно и количественно схож с индукцией при инкубации со штаммом 35624 в трех из 5 образцов, и в 2 из 5 образцов индукция несколько сильнее (фиг.12С и 12Е). Максимальная индукция имеет место при концентрациях бактерий до 1,0×108 в лунке.
INF-γ: инкубация с AH121A индуцирует растущую с дозой бактерий выработку провоспалительного цитокина INF-γ в мононуклеарах периферической крови после стимуляции in vitro (фиг.13). Количественно экспрессия INF-γ сильно варьирует для разных образцов, но в среднем экспрессия с бактериями AH121A аналогична экспрессии с бактериями 35624.
G-CSF: инкубация с AH121A индуцирует растущую с дозой бактерий выработку цитокина G-CSF в мононуклеарах периферической крови после стимуляции in vitro (фиг.14). Характер индукции G-CSF качественно и количественно схож с индукцией при инкубации со штаммом 35624.
Пример 7. Влияние AH121A на выработку цитокинов в дендритных клетках
Резюме
Иммунный ответ является тщательно регулируемым процессом, который при нормальной его работе обеспечивает защиту от инфекций и толерантность к безвредным антигенам среды. Однако при воспалениях чрезмерно активированный иммунный ответ приводит к хроническому провоспалительному состоянию, характеризующемуся активацией врожденного иммунитета и росту субпопуляции поляризованных Т-клеток. В настоящее время лечение воспалительных заболеваний сконцентрировано на подавлении ключевых медиаторов воспаления, то есть популяций воспалительных клеток. Однако использование такого подхода обеспечивает лишь временное подавление симптомов воспаления. Успешное лечение или профилактика, обеспечивающие долговременное снятие симптомов воспаления, могут быть достигнуты только активизацией регуляторных процессов в клетках, которые защищают организм от разрушающих его провоспалительных реакций. Bifidobacterium AH121A являются пробиотическими микроорганизмами, селективно стимулирующими выработку IL-10 в системе врожденного иммунитета (то есть в дендритных клетках) и индуцирующими поляризацию Foxp-3+ регуляторных Т-клеток in vitro. В условиях in vivo выработка IL-10, а также регуляторных Т-клеток являются мощными суппрессорами аберрантной воспалительной реакции.
Регуляторные Т-клетки (Treg-клетки)
Основная роль регуляторных Т-клеток (Treg-клеток), заключающаяся в поддержании иммунной толерантности, была продемонстрирована в ряде моделей на животных, в которых адоптивное введение Treg-клеток, или намеренное увеличение популяции Treg-клеток способствовало предотвращению или излечению ряда заболеваний, провоцируемых Т-клетками, включая аллергию, астматическое воспалительное заболевание легких, автоиммунные болезни и отторжение аллотрансплантата, за счет восстановления толерантности к аллергенам, ауто-антигенам и алло-антигенам [8]. Описано множество механизмов подавления иммунитета, медиатором которых являются Treg-клетки, и в которых особую роль играет выработка IL-10 [9]. Отсутствие или неправильное функционирование Treg-клеток коррелирует также с синдромом повышения уровня IgE, гиперэозинофилией и аутоиммунными состояниями человека, в то время как присутствие Treg-клеток коррелирует с иммунной толерантностью [10]. Исследования механизмов, посредством которых иммунный ответ на не патологические антигены в одних случаях ведет к аллергии, а в других - к безвредному иммунному ответу, показали, что Treg-клетки, вырабатывающие аллерген-специфичные IL-10 (TR1-клетки) являются доминантной субпопуляцией Т-клеток у здоровых людей [11, 12]. Повторяющееся воздействие антигенов пчелиного яда на здоровых, не страдающих аллергией пчеловодов во время сезона медосбора представляет собой ценную модель in vivo, позволяющую подтвердить механизмы иммунной толерантности к антигенам пчелиного яда [13]. После множественных укусов пчел специфичные к антигенам пчелиного яда TH1- и TH2-клетки превращаются в TR1-клетки, вырабатывающие IL-10. Это происходит параллельно с подавлением кожной реакции на аллергены поздней фазы и ингибированием аллерген-специфичных TH1- и TH2-клеток. Эти процессы происходят, пока сохраняется воздействие на пчеловода пчелиного яда, а через 2-3 месяца после окончания сезона медосбора уровни экспрессии соответствующих клеток возвращаются на исходный уровень.
В настоящее время исследуются различные стратегии стимулирования работы Treg-клеток in vivo. Такие стратегии включают адоптивный перенос индуцируемых или конститутивных Treg-клеток и их стимулирование специфичными адъювантами или иммуномодуляторами. Данные подходы выглядят более привлекательными по сравнению с традиционными методами лечения, так как подавление активности антиген-специфичных Treg-клеток не ведет к общему подавлению иммунитета и в то же время обеспечивает долговременное антиген-специфичное регулирование иммунитета in vivo. Более того, возможно индивидуальное (специфичное) лечение пациентов при минимуме побочных эффектов. Многие иммуномодуляторы, разработанные недавно или разрабатываемые в настоящее время, такие как рапамицин, абатацепт (блокатор со-стимуляции CD80/CD86:CD28, предлагаемый Orencia), не-митогенные анти-CD3 моноклональные антитела, моноклональные антитела, расщепляющие Т-клетки и направленные против фактора некроза опухолей TNF-α - оказывают прямое или непрямое воздействие на Treg-клетки в виде стимулирования или подавления их функций [14-18]. Исследования на мышах показали селективную целесообразность увеличения популяции Treg-клеток, которые нацелены на орган (или лимфоузлы, удаляющие лимфу из данного органа) за счет узнавания аллергена или ауто-антигена, экспрессируемого в воспаленном органе [19]. Таким образом, перенос орган-специфичных Treg-клеток может быть эффективен при подавлении текущего заболевания, и при этом переносимые Treg-клетки не обязательно должны распознавать в точности тот же антиген, что и ауто-агрессивные эффекторные Т-клетки [20]. Это имеет прямые последствия на стратегии лечения, нацеленные на механизм иммунной толерантности к аллергенам, ауто-антигенам и антигенам при трансплантации, в который вовлечены Treg-клетки. Возможности адоптивного переноса Treg-клеток или низкомолекулярных соединений, стимулирующих Treg-клетки в тканях, в настоящее время исследуются [19], однако о двойных слепых испытаниях с плацебо-контролем пока не сообщалось. На данный момент единственно применяемым антиген-специфичным подходом, обеспечивающим активацию выработки Treg-клеток у человека, является метод подавления инициации транскрипции (аллерген-SIT). Аллерген-SIT активирует Treg-клетки и TR1-клетки, и похоже, что лечение адренергическими антагонистами β2 повышает количество и активность данного типа клеток [21-23]. Недавно сообщалось о существенных элементах транскрипции, регулирующих экспрессию промотора Foxp3, и они наверняка станут новыми целями при разработке новых методов лечения [24, 25]
Микробы как новые методы лечения
Интерес к намеренному назначению микроорганизмов или продуктов их метаболизма для лечения аберрантной воспалительной активности набирает обороты. Типичные микроорганизмы, исследуемые в настоящее время, включают бифидобактерии, лактобациллы, не патогенные штаммы Е. coli и бактероидов [26-31]. Защитный эффект, ассоциируемый с данными микроорганизмами, вероятно, обеспечивается множеством механизмов, в которых участвуют эпителиальные клетки, дендритные клетки и Т-клетки. Однако, что еще более важно, и о чем все чаще сообщается в последнее время, - это их общая способность активировать Treg-клетки. Так, например, исследования на мышах показали, что симбиотические микроорганизмы (пробиотический коктейль VSL №3), попадающие в желудочно-кишечный тракт, способствуют развитию Treg-клеток в слизистой оболочке, что приводит к уменьшению воспаления при колите [32]. Кроме того, потребление штамма Bifidobacterium infantis приводит к превращениям Treg-клеток и защищает от индуцируемой липополисахаридами активации NF-κВ in vivo, а Lactobacillus reuteri индуцируют Treg-клетки, защищающие от аллергических реакций в дыхательных путях у мышей [33, 34]. Treg-клетки производятся в тимусе, но их выработка может также индуцироваться в периферийных органах, включая слизистую оболочку кишечника [35, 36]. CD103-положительные дендритные клетки в целом отвечают за превращения Treg-клеток посредством процессов, зависимых от трансформирующего фактора роста TGF-β и ретиноевой кислоты [37, 38]. Похоже, что движущей силой таких превращений являются специфичные факторы среды желудочно-кишечного тракта, ассоциируемые с присутствием большого количества симбиотических микроорганизмов. Маловероятно, однако, что все симбиотические микроорганизмов одинаково эффективны в индукции Treg-клеток in vivo. Недавнее модельное исследование на мышах, в котором сравнивались различные симбиотические микроорганизмы (Bifidobacterium longum АН 1206, Bifidobacterium breve АН1205 и Lactobacillus salivarius АН102), показало, что бактерии Bifidobacterium longum АН 1206 индуцировали Treg-клетки и защищали от притока эозинофилов в легкие и блокировали индукцию сывороточного IgE [39]. Прочие виды бактерий в таких же моделях не обеспечивали эффективной индукции Treg-клеток и не могли защитить от аллергической реакции. Поэтому индукция Treg-клеток может рассматриваться как критическая характеристика здоровой микробиоты, защищающей организм от возможного развития аберрантной иммунологической реакции на потенциальные аллергены. В дополнение к использованию живых микроорганизмов для лечения от аллергии еще одним интересным подходом является определение микробных факторов, ответственных за благоприятный эффект, обеспечиваемый данными микроорганизмами, и использование лишь таких выделенных факторов. Так, например, полисахарид А, выделенный из Bacteroides fragilis, способствует достижению должного баланса TH1/TH2 в дендритных клетках слизистой оболочки кишечника у мышей, не содержащих микробов, а также, как показано в исследованиях на животных, способствует защите от колита за счет выработки IL-10 в CD4-положительных Т-клетках [29, 40]. Продолжающиеся поиски новых микроорганизмов, индуцирующих толерогенные дендритные клетки и активизирующие Treg-клетки, несомненно позволят также найти новые молекулы, обладающие лечебными свойствами.
Дифференциация и созревание дендритных клеток
Человеческие моноциты выделяли из крови с помощью метода, представлявшего собой сочетание разделение по плотности центрифугированием (по Ficoll) и разделение клеток с помощью магнитных микробусин, покрытых CD14-специфичными антителами (MiltentyiBiotec). Чистота выделенной фракции CD14+клеток была выше 90% во всех экспериментах. Для получения незрелых дендритных клеток (iDC), очищенные CD14+клетки выращивали в течение 5 дней в присутствии IL-4 (R&D systems) и GM-CFS (R&D systems), так чтобы они дифференцировались в миелоидные дендритные клетки (MDDC). На шестой день часть клеток не подвергалась стимуляции, часть стимулировали липополисахаридами (в количестве 1 мг/мл), и 5×105 клеток MDDC стимулировали бактериальными клетками (в различном количестве) в течение 24 часов. В частности, проводили стимуляцию клетками штамма В longum AH121A в пропорции 10:1 (бактерии/клетки, то есть 5×106 бактерий), и в пропорции 1:1 (бактерии/клетки, то есть 5×105 бактерий) в течение 24 часов. Как и ожидалось, из-за добавления антибиотика роста бактерий в течение данного периода не наблюдалось. Выделяли супернатанты и анализировали их на содержание IL-10 и IL-12p70 с помощью мультиплексной платформы Luminex.
Выделение человеческих CD4+Т-клеток и их совместное выращивание с дендритными клетками
Мононуклеары периферической крови выделяли центрифугированием лейкоцитарных пленок в градиентах Lymphoprep. CD4-положительные Т-клетки отделяли путем негативного отбора на колонке для аффинной хроматографии производства R&D Systems, в соответствии с инструкциями производителя. После разделения Т-клетки промывали и ресуспендировали в среде RPMI 1640 для культур с добавлением 10% эмбриональной бычьей сыворотки, инактивированной нагреванием, 100 МЕ/мл пенициллина, 100 мкг/мл стрептомицина и 3 ммоль/л L-глютамина. Очищенные CD4+Т-клетки (1×106/мл) стимулировали сочетанием моноклональных антител: иммобилизированных анти-CDS (1 мкг/мл) и растворимых aHTH-CD28 (5 мкг/мл) (производства Pharmingen). После этого очищенные CD4+Т-клетки инкубировали с дендритным клетками, полученными, как описано выше. Спустя 48 часов CD4+T-клетки пермибилизировали и окрашивали на CD25 и Foxp-3. После этого проводили анализ клеток методом проточной цитометрии.
Результаты показывают, что дендритные клетки, будучи стимулированы бактериями AH121A, запускают поляризацию и/или экспансию популяции Treg-клеток, которая экспрессирует CD25 и Foxp-3.
Пробиотики обладают различной способностью индуцировать выработку цитокинов дендритными клетками
Тип вырабатываемых цитокинов может влиять на поляризацию Т-клеток. Для изучения такого влияния мы проанализировали выработку IL-12p70 и IL-10 в миелоидных дендритных клетках через 24 часа после их обработки бактериями, как описано выше. Липополисахариды были сильными индукторами всех типов исследуемых цитокинов, в то время как AH121A индуцировали выработку различных цитокинов в различной степени (фиг.15). Так, например, бактерии AH121A индуцировали меньшие уровни IL-10 по сравнению с липополисахаридами, и не индуцировали выработку IL-12p70 на обнаружимом уровне. То есть, бактерии AH121A обладают потенциальной способностью к уменьшению воспаления.
Разность в выработке цитокинов отражает различную способность к поляризации Т-клеток
Выработка определенных типов цитокинов дендритными клетками важна для запуска поляризации Т-клеток в сторону Th1, Th2, Thl7 или Treg-клеток. Учитывая разницу в уровнях вырабатываемых цитокинов, мы дополнительно исследовали, обладают ли миелоидные дендритные клетки, стимулированные AH121A, способностью индуцировать Foxp3+Treg-клетки. Дендритные клетки инкубировали с AH121A в течение 5 дней, и после этого совместно выращивали с неподверженными аллогенам CD4+Т-клетками. После этого анализировали популяцию CD4+Foxp3+Treg-клеток методом сортировки клеток с возбуждением флуоресценции. Результаты показывают, что дендритные клетки, стимулированные бактериями AH121A, могут запускать поляризацию субпопуляции Treg-клеток, экспрессирующих CD25 и Foxp-3 (фиг.16).
Мы пришли к заключению, что бактерии AH121A вырабатывали толерогенные дендритные клетки, которые, в свою очередь, индуцировали выработку CD4+Foxp3+Treg-клеток. Действительно, мы показали, что миелоидные дендритные клетки, выращиваемые с AH121A, преобразовывали CD4+CD25- Т-клетки в CD4+CD25'Foxp3+Т-клетки. То есть, бактерии AH121A обладают сильным иммуномодулирующим действием, так как они регулируют в сторону повышения выработку Treg-клеток миелоидными дендритными клетками in vivo. Полученные результаты свидетельствуют о выработке CD4+CD25"Foxp3+Treg-клеток при реакции на AH121A in vitro, и данный эффект может быть терапевтически полезен, так как он обеспечивает модуляцию воспалительных иммунных нарушений in vivo (фиг.16).
Ранее было показано, что некоторые пробиотики (например, L. casei и L. reuteri) могут индуцировать развитие Treg-клеток (32, 41, 42). Было показано, что Bifidobacterium АН1206 являлись медиатором мощной активации Treg-клеток в трех модельных исследованиях на животных. Кроме того, потребление Bifidobacterium АН1206 защищало от притока эозинофилов в легкие и блокировало индукцию сывороточного IgE. Можно утверждать, что Treg-клетки играют важную роль в регулировании аллерген-специфичных иммунных реакций (39). Многочисленные исследования на животных показывают, что CD4 CD25 Рохр3-клетки набираются в легкие и сточные лимфоузлы, и могут подавлять вызванную аллергенами эозинофилию дыхательных путей, гиперсекретивность слизистых оболочек и гиперчувствительность дыхательных путей (43-48).
Многочисленные исследования на людях и животных показывают, что болезнь воспаленного кишечника возникает от потери толерантности к симбиотическим бактериям. Исследование Round и Mazmanian (49) показывает, что PSA руководит развитием Treg-клеток при лечении и профилактике колита. Эти выводы соответствуют результатам исследований, в которых было показано, что выработка IL-10 Foxp3+Т-клетками важна для толерантности на поверхностях слизистых оболочек и для предотвращения воспалений кишечника (49, 50).
Пример 8. Примеры составов
Ниже приводятся примеры составов в виде сухих гранул, содержащих пробиотические бифидобактерии в соответствии с настоящим изобретением.
Ниже приводятся примеры составов для приготовления влажного корма для животных, содержащего пробиотические бактерии Bifidobacteria longum в соответствии с настоящим изобретением.
Ниже приводятся примеры составов для приготовления пищевых добавок в виде йогурта, содержащего пробиотические бактерии Bifidobacteria longum в соответствии с настоящим изобретением.
Несмотря на то, что в данном документе иллюстрируются и описываются конкретные воплощения настоящего изобретения, сведущим в данной области техники будет очевидно, что возможно внесение прочих изменений и модификаций, не нарушающих идею и назначение изобретения. С этой целью имелось в виду в прилагаемой формуле изобретения представить все возможные подобные изменения и модификации в объеме настоящего изобретения.
Ссылки
1. McCracken V.J. and Gaskins H.R. Probiotics and the immune system. In: Probiotics a critical review, Tannock, GW (ed). Horizon Scientific Press, UK. 1999, p.85-1 13.
2. Savage D.C. Interaction between the host and its microbes. In: Microbial Ecology of the Gut, dark and Bauchop (eds), Academic Press, London. 1977, p.277-310.
3. Kagnoff M.F. Immunology of the intestinal tract. Gastroenterol. 1993; 105 (5): 1275-80.
4. Lamm M.E. Interaction of antigens and antibodies at mucosal surfaces. Ann. Rev. Microbiol. 1997; 51: 31 1-40.
5. Raychaudhuri S., Rock KL. Fully mobilizing host defense: building better vaccines. Nat biotechnol, 1998; 16: 1025-31.
6. Tomomatsu, H. Health effects of oligosaccharides (1994) Food Technol. 48: 61-65.
7. Vickers et al., Comparison of fermentation of selected fructooligosacchandes and other fibre substrates by feline colonic microflora (2001) Am. J. Vet. Res. 61(4): 609-615.
8. Sakaguchi S, Yamaguchi T, Nomura T, Ono M. Regulatory Т cells and immune tolerance. Cell 2008; 133: 775-87.
9. Taylor A, Akdis M, Joss A, Akkoc T, Wenig R, Colonna M, Daigle I, Flory E, Blaser K, Akdis CA. IL-10 inhibits CD28 and ICOS costimulations of T cells via src homology 2 domain-containing protein tyrosine phosphatase 1. J Allergy din Immunol 2007; 120: 76-83.
10. Chatila ТА. Role of regulatory T cells in human diseases. J Allergy din Immunol 2005; 1 16: 949-59.
11. Akdis M. Healthy immune response to allergens: T regulatory cells and more. Curr Opin Immunol 2006; 18: 738-44.
12. Akdis M, Verhagen J, Taylor A, Karamloo F, Karagiannidis C, Crameri R, Thunberg S, Deniz G, Valenta R, Fiebig H, Kegel C, Disch R, Schmidt-Weber CB, Blaser K, Akdis CA. Immune responses in healthy and allergic Individuals are characterized by a fine balance between allergen-specific T regulatory 1 and T helper 2 cells. J Exp Med 2004; 199: 1567-75.
13. Meiler F, Zumkehr J, Klunker S, Ruckert B, Akdis CA, Akdis M. In vivo switch to IL-10-secreting T regulatory cells in high dose allergen exposure. J Exp Med 2008; 205; 2887-98.
14. Hendrikx TK, Velthuis JH, Klepper M, van Gurp E, Geel A, Schoordijk W, Baan CC, Weimar W. Monotherapy rapamycin allows an increase of CD4(+) CD25(bright+)FoxP3(+) T cells in renal recipients. Transpl Int 2009; 22: 884-91.
15. Kremer JM, Dougados M, Emery P, Durez P, Sibilia J, Shergy W, Steinfeld S, Tindall E, Becker JC, Li T, Nuamah IF, Aranda R, Moreland LW. Treatment of rheumatoid arthritis with the selective costimulation modulator abatacept: twelven month results of a phase iib, double-blind, randomized, placebo-controlled trial. Arthritis Rheum 2005; 52: 2263-71.
16. Utset TO, Auger JA, Peace D, Zivin RA, Xu D, Jolliffe L, Alegre ML, Bluestone JA, dark MR. Modified anti-CD3 therapy in psoriatic arthritis: a phase 1/П clinical trial. J Rheumatol 2002; 29: 1907-13.
17. Isaacs JD, Greer S, Sharma S, Symmons D, Smith M, Johnston J, Waldmann H, Hale G, Hazleman BL. Morbidity and mortality in rheumatoid arthritis patients with prolonged and profound therapy - induced lymphopenia. Arthritis Rheum 2001; 44: 1998-2008.
18. Ehrenstein MR, Evans JG, Singh A, Moore S, Wames G, Isenberg DA, Mauri C. Compromised function of regulatory Т cells in rheumatoid arthritis and reversal by anti-TNF-a therapy. JExp Med 2004; 200: 277-85.
19. O'Connor RA, Anderton SM. Multi-faceted control of autoaggression: Foxp3+regulatory Т cells in murine models of organ-specific autoimmune disease. Cell Immunol 2008; 251: 8-18.
20. Roncarolo MG, Battaglia M. Regulatory T-cell immunotherapy for tolerance to self antigens and alloantigens in humans. Nature Rev Immunol 2007; 7: 585-98.
21. Peek EJ, Richards DF, Faith A, Lavender P, Lee TH, Corrigan CJ, Hawrylowicz CM. Interleukin-10-secreting "regulatory" Т cells induced by glucocorticoids and beta2D agonists. Am J Respir Cell Mol Biol 2005; 33: 105-11.
22. Karagiannidis С, Akdis M, Holopainen P, Woolley NJ, Hense G, Riickert B, Mantel PY, Menz G, Akdis CA, Blaser K, Schmidt- Weber CB. Glucocorticoids upregulate FOXP3 expression and regulatory Т cells in asthma. J Allergy Clin Immunol 2004; 1 14: 1425-33.
23. Akdis M, Akdis CA. Mechanisms of allergenspecific immunotherapy. J Allergy Clin Immunol 2007; 1 19: 780-91.
24. Klunker S, Chong MM, Mantel PY, Palomares 0, Bassin C, Ziegler M, Riickert B, Meiler F, Akdis M, Liftman DR, Akdis CA. Transcription factors RUNX1 and RUNX3 in the induction and suppressive function of Foxp3+ inducible regulatory Т cells. J Exp Med 2009; 206: 2701-15.
25. Mantel PY, Kuipers H, Boyman 0, Rhyner C, Ouaked N, Riickert B, Karagiannidis C, Lambrecht BN, Hendriks RW, Crameri R, Akdis CA, Blaser K, Schmidt-Weber CB. GAT A3 -driven Th2 responses inhibit TGF-β 1-induced FOXP3 expression and the formation of regulatory Т cells. PLoS Biol 2007; 5: e329.
26. van der Kleij H, O'Mahony C, Shanahan F, O'Mahony L, Bienenstock J. Protective effects of Lactobacillus reuteri and Bifidobacterium infantis in murine models for colitis do not involve the vagus nerve. Am J Physiol Regul Integr Comp Physiol 2008; 295: 1131-7.
27. Sheil B, McCarthy J, O'Mahony L, Bennett MW, Ryan P, Fitzgibbon JJ, Kiely B, Collins JK, Shanahan F. Is the mucosal route of administration essential for probiotic function? Subcutaneous administration is associated with attenuation of murine colitis and arthritis. Gut 2004; 53: 694-700.
28. McCarthy J, O'Mahony L, O'Callaghan L, Sheil B, Vaughan ЕЕ, Fitzsimons N, Fitzgibbon J, O'Sullivan GC, Kiely B, Collins JK, Shanahan 'F. Double blind, placebo controlled trial of two probiotic strains in interleukin 10 knockout mice and mechanistic link with cytokine balance. Gut 2003; 52: 975-80.
29. O'Mahony L, Feeney M, O'Halloran S, Murphy L, Kiely B, Fitzgibbon J, Lee G, O'Sullivan G, Shanahan F, Collins JK. Probiotic impact on microbial flora, inflammation and tumour development in IL-10 knockout mice. Aliment Pharmacol Ther 2001; 15: 1219-25.
30. Mazmanian SK, Round JL, Kasper DL. A microbial symbiosis factor prevents intestinal inflammatory disease. Nature 2008; 453: 620-5.
31. Grabig A, Paclik D, Guzy C, Dankof A, Baumgart DC, Erckenbrecht J, Raupach B, Sonnenbom U, Eckert J, Schumann RR, Wiedenmann B, Dignass AU, Sturm A. Escherichia coli strain Nissle 1917 ameliorates experimental colitis via toll-like receptor 2-and toll-like receptor 4-dependent pathways. Infect Immun 2006; 74: 4075-82.
32. Di Giacinto C, Marinaro M, Sanchez M, Strober W, Boirivant M. Probiotics Ameliorate Recurrent Th1 -Mediated Murine Colitis by Inducing IL-10 and IL-10-Dependent TGF-P Bearing Regulatory Cells. JImmunol 2005; 174: 3237-46.
33. O'Mahony C, Scully P, O'Mahony D, Murphy S, O'Brien F, Lyons A, Sherlock G, MacSharry J, Kiely B, Shanahan F, O'Mahony L. Commensal-Induced Regulatory Т Cells Mediate Protection against Pathogen-Stimulated NF-κВ Activation. PLOS Pathogens 2008; 4: е1000112.
34. Karimi K, Inman MD, Bienenstock J, Forsythe P. Lactobacillus reuteri-induced regulatory Т cells protect against an allergic airway response in mice. Am J Respir Crit Care Med 2009; 179: 186-93.
35. Karim M, Kingsley CI, Bushell AR, Sawitzki BS, Wood KJ. Alloantigen-induced CD25+CD4+ regulatory Т cells can develop in vivo from CD25-CD4+ precursors in a thymus-independent process. J Immunol 2004; 172: 923-8.
36. Chen W, Jin W, Hardegen N, Lei KJ, Li L, Marines N, McGrady G, Wahl SM. Conversion of peripheral CD4+CD25+ naive Т cells to CD4+CD25+regulatory Т cells by TGF-P induction of transcription factor Foxp3. JExp Med 2003; 198: 1875-86.
37. Coombes JL, Siddiqui KR, Arancibia-Carcamo CV, Hall J, Sun CM, Belkaid Y, Powrie F. A functionally specialized population ofmucosal CD 103+DCs induces Foxp3+ regulatory T cells via a TGF-p and retinoic acid-dependent mechanism. J Exp Med 2007; 204: 1757-64.
38. Sun CM, Hall JA, Blank RB, Bouladoux N, Oukka M, Mora JR, Belkaid Y. Small intestine lamina propria dendritic cells promote de novo generation of Foxp3 T reg cells via retinoic acid. J Exp Med 2007: 204: 1775-85.
39. Lyons A, O'Mahony D, O'Brien F, MacSharry J, Sheil B, Ceddia M, Russell WM, Forsythe P, Bienenstock J, Kiely B, Shanahan F, O'Mahony L. Bacterial strain-specific induction of Foxp3+T regulatory cells is protective in murine allergy models, din Exp Allergy 2009; in press.
40. Mazmanian SK, Liu CH, Tzianabos АО, Kasper DL. An immunomodulatory molecule of symbiotic bacteria directs maturation of the host immune system. Cell 2005; 122: 107-18.
41. Foligne B, Zoumpopoulou G, DewulfJ, Ben Younes A, Chareyre F, et al. (2007) A key role of dendritic cells in probiotic functionality. PLoS ONE 2: e313.
42. Smits HH, Engering A, van der Kleij D, de Jong EC', Schipper K, et al. (2005) Selective probiotic bacteria induce IL-10-producing regulatory T cells in vitro by modulating dendritic cell function through dendritic cell-specific intercellular adhesion molecule 3-grabbing nonintegrin. J Allergy din Immunol 115: 1260-1267.
43. Zuany-Amorim С, Sawicka E, Manlius С et al. Suppression of airway eosinophilia by killed mycobacterium vaccae induced allergen-specific regulatory T-cells. Nat Med 2002; 8: 625-9.
44. Leech MD, Benson RA, De Vries A, Fitch PM, Howie SE. Resolution of Der pi-induced allergic airway inflammation is dependent on CD4+CD25+Foxp3+ regulatory cells. JImmunol 2007; 179: 7050-8.
45. McGlade JP, German S, Zosky GR et al. Suppression of the asthmatic phenotype by ultraviolet b-induced, antigen-specific regulatory cells, din Exp Allergy 2007; 37: 1267-76.
46. Strickland DH, Stumbles PA, Zosky GR et al. Reversal of airway hyperresponsiveness by induction of airway mucosal CD4+CD25+regulatory Tcells. J Exp Med 2006; 203: 2649-60.
47. Wu К, Bi Y, Sun К, Xia J, Wang Y, Wang C. Suppression of allergic inflammation by allergen-DNA-modified dendritic cells depends on the induction of Foxp3+ regulatory T cells. Scand J Immunol 2008; 67: 140-51.
48. Boudousquie С, Pellaton С, Barbier N, Spertini F. CD4+CD25+ Т cell depletion impairs tolerance induction in a murine model of asthma. Clin Exp Allergy 2009; 39: 1415-26.
49. Round JL, Mazmanian SK. Inducible Foxp3+ regulatory T-cell development by a commensal bacterium of the intestinal microbiota. Proc Nati Acad Sci USA. 2010 Jul 6; 107(27): 12204-9.
50. Rubtsov YP, et al. Regulatory Т cell-derived interleukin-10 limits inflammation at environmental interfaces. Immunity. 2008; 28: 546-558.
Реферат
Группа изобретений относится к штамму Bifidobacterium longum NCIMB 41675, составу, его содержащему, и продукту питанию, содержащему указанные штамм или состав. Предложенный штамм обладает способностью к индукции продукции цитокинов и контролю отношения IL-10:IL-12 и пригоден для применения в иммуномодуляции, лечении аутоиммунного заболевания. Предложенные штамм, состав и продукт питания обладают пробиотическими свойствами. 3 н. и 22 з.п. ф-лы, 16 ил., 4 табл., 8 пр.

Комментарии