Замороженные кондитерские изделия, содержащие пробиотические микроорганизмы - RU2593716C2
Код документа: RU2593716C2
Чертежи















Описание
Настоящее изобретение относится к области замороженных йогуртов. В частности, настоящее изобретение обеспечивает замороженные композиции йогурта, содержащие нереплицирующиеся пробиотические микроорганизмы. Эти нереплицирующиеся пробиотические микроорганизмы могут быть, например, биологически активными пробиотическими микроорганизмами, подвергнутыми тепловой обработке, или все еще биологически активными пробиотическими микроорганизмами, экструдированными при низких температурах. Настоящее изобретение также относится к обеспечиваемой этими нереплицирующимися пробиотическими микроорганизмами пользе для здоровья.
При этом полезные для здоровья эффекты пробиотиков широко используются в данной области и в обобщенном виде представлены, например, Blum и др. в Curr Issues Intest Microbiol. 2003 сентябрь; 4(2):53-60. Часто пробиотики применяются в симбиотических рецептурах совместно с пребиотиками, которые могут даже увеличивать пользу для здоровья.
Обычно пробиотики в настоящее время предлагаются в продаже в составе, например, йогурта и йогуртных напитков.
Однако пробиотики могут обеспечивать свои полезные для здоровья эффекты, только когда они действительно употребляются потребителями. Другими словами, предоставление пробиотиков в продуктах, которые обычно любимы всеми, сделает пользу для здоровья пробиотиков доступной для широкого круга потребителей. Замороженный йогурт является таким продуктом, который любим почти всеми, в частности, детьми и подростками. Помимо этого, замороженный йогурт в целом видится в качестве низкокалорийной альтернативы мороженому.
Что касается мороженого, то M.W. Modler и др. сообщают, что мороженое, содержащее бифидобактерии и фруктоолигосахариды, представляет значительный интерес для здоровья человека (Cult. Dairy Prod. J., 25, стр.4-9, 1990; Canadian Dairy, 75, стр.10, 1996). Аналогичным образом в ЕР307523 (японский био-йогурт Honsha КК) сообщается, что кисломолочный продукт, содержащий волокна пребиотика, может фасоваться в форме мороженого, и таким образом использоваться для терапии некоторых желудочно-кишечных нарушений.
Применение этой концепции к замороженному йогурту дало бы возможность расширить данный подход на замороженные йогурты.
Однако приведение пищевых волокон в контакт с молочнокислыми бактериями имеет значительные недостатки. Эти недостатки имеют различные типы и относятся, в частности, к преждевременной деструкции волокон в ходе приготовления и хранения десерта и к неблагоприятным условиям in vivo, при которых, например, развивается биологическая активность этих волокон.
В патенте US 6399124 ставится цель преодоления этих недостатков посредством разъединения пищевых волокон и пробиотиков в замороженном десерте, обеспечивая съедобный барьер между содержащей волокно основой и содержащим пробиотик мороженым.
Пробиотические бактерии, как известно, способны прилипать к клеткам кишечника человека и вытеснять патогенные бактерии с клеток кишечника человека. Для того чтобы обладать такой активностью, Пробиотические бактерии должны оставаться жизнеспособными в продукте до момента его употребления. Это является задачей для промышленности, и способ ее решения предлагает, например, US 4308287.
Было бы желательно располагать композицией замороженного йогурта, способной обеспечивать полезное пробиотическое действие даже после длительных сроков хранения в критических для пробиотиков условиях и являющейся при этом простой в приготовлении. Было бы предпочтительным достичь этого посредством применения натуральных ингредиентов, которые являются безопасными для употребления, не обладая при этом побочными эффектами, и которые легко вводятся в композиции замороженных йогуртов с использованием промышленных технологий существующего уровня техники.
Также для таких препаратов было бы желательным дальнейшее улучшение укрепляющего иммунную систему действия пробиотиков.
Помимо этого, было бы желательным дальнейшее улучшение противовоспалительного эффекта пробиотиков в таких препаратах.
Настоящее изобретение обращается именно к этой потребности. То есть цель настоящего изобретения состоит в улучшении существующего уровня техники и предоставлении композиций замороженного йогурта, которые отвечали бы обозначенной выше потребности.
Авторы настоящего изобретения неожиданно обнаружили, что они могут достигнуть этого с помощью объектов независимых пунктов формулы изобретения. Основную идею настоящего изобретения развивают дополнительные пункты формулы изобретения.
Соответственно, настоящее изобретение предлагает обеспечить композиции замороженного йогурта, содержащие нереплицирующиеся пробиотические микроорганизмы.
Замороженные йогурты являются замороженными молочными продуктами, изготавливаемыми или содержащими йогурт. Замороженные йогурты могут подаваться, например, как десерт или закуска.
Авторы настоящего изобретения смогли показать, что нереплицирующиеся пробиотики также могут приносить здоровью ту пользу, которую обеспечивают пробиотики, и, возможно, даже в еще большей степени.
Следовательно, представляются излишними усложненные меры по сохранению пробиотиков в живом состоянии в конечном продукте и обеспечении их поступления в живом состоянии в кишечник. Кроме того, использование в замороженном йогуртном продукте нереплицирующихся пробиотиков позволяет иметь вместе в одном препарате и пробиотики, и пребиотики без риска протекания в ходе приготовления и хранения продукта нежелательной преждевременной деструкции волокон.
Количество нереплицирующихся микроорганизмов в композиции мороженого настоящего изобретения может соответствовать от около 106 до 1012 КОЕ на одну порцию.
Очевидно, что нереплицирующиеся микроорганизмы не образуют колоний, поэтому этот термин следует понимать как количество нереплицирующихся микроорганизмов, которое получается из от 104 до 1012 КОЕ/г реплицирующихся бактерий. Они включают микроорганизмы, которые являются инактивированными, мертвыми, нежизнеспособными и/или присутствуют в виде фрагментов, таких как ДНК или цитоплазматические соединения. Другими словами, количество микроорганизмов, которое содержит данная композиция, вне зависимости от того, являются ли они на самом деле живыми, инактивированными, мертвыми или фрагментированными, или же представляют собой смесь любых из этих состояний, выражается в терминах способности данного количества микроорганизмов образовывать колонии (КОЕ), как если бы все эти микроорганизмы являлись бы живыми.
Для целей настоящего изобретения может применяться любая композиция замороженного йогурта. Примеры представлены обычными замороженными йогуртами, обезжиренными замороженными йогуртами, замороженными йогуртами без добавления сахара или обезжиренными замороженными йогуртами без добавления сахара.
Например, такая замороженная композиция йогурта может содержать около 0-12 мас.% жира, около 5-15 мас.% обезжиренного сухого молока, около 5-32 мас.% углеводов, около 1-5 мас.% белка и имеет общее содержание сухого остатка около 30-45 мас.%.
Разумеется, могут добавляться фрукты, шоколад, ваниль, карамель, кофе, орехи, злаки, мед и/или другие вкусоароматические компоненты.
Композиция замороженного йогурта может, кроме того, содержать около 1-25 мас.% добавленного сахара.
Замороженный йогурт может также содержать пребиотики.
Под «пребиотиком» подразумеваются пищевые продукты, которые поддерживают рост пробиотиков в кишечнике. Они не подвергаются расщеплению в желудке и/или верхних отделах кишечника и не всасываются желудочно-кишечным трактом принимающего их человека, но они ферментируются желудочно-кишечной микрофлорой и/или пробиотиками. Пребиотики, например, определяются публикацией Glenn R. Gibson and Marcel B. Roberfroid Dietary Modulation of the Human Colonic Microbiota: Introducing the Concept of Prebiotics (Диетическое модифицирование толстокишечной микробиоты человека: представление концепции пребиотиков), J. Nutr. 1995 125: 1401-1412.
Пребиотики, которые могут использоваться в соответствии с настоящим изобретением, специальным образом не ограничиваются и включают все пищевые продукты, которые способствуют росту пробиотиков в кишечнике. Предпочтительно они могут выбираться из группы, состоящей из олигосахаридов, необязательно содержащих фруктозу, галактозу, маннозу; пищевых волокон, в частности, растворимых волокон, волокон сои; инулина или их смесей. Предпочтительные пребиотики являются фруктоолигосахаридами (FOS), галактоолигосахаридами (IOS), изомальтоолигосахаридами, ксилоолигосахаридами, олигосахаридами сои, гликозилсахарозой (GS), лактосахарозой (LS), лактулозой (LA), палатинозоолигосахаридами (РАО), мальтоолигосахаридами (MOS), камедями и/или их гидролизатами, пектинами и/или их гидролизатами.
Типичные примеры пребиотиков представляют олигофруктоза и инулин.
Композиция замороженного йогурта в соответствии с настоящим изобретением может, кроме того, содержать пищевую основу, связанную с замороженным йогуртом, основу, являющуюся съедобной для людей и содержащей пребиотики.
Эти пребиотики могут иметь белковую или сахаридную природу, выбираясь, например, из растительных пектинов, хито-, фрукто-, гентио-, галакто-, изомальто-, манно- или ксилоолигосахаридов, или олигосахаридов сои, Polymnia sonchifolia (якон), артишока, лука или спаржи, или резистентных крахмалов, или продуктов с высоким содержанием [бета]-глюканов, таких как, например, концентрат овса (Playne и др.; Fukai и др., Soil Sci. Plant Nutr., 39, 567-571, 1993).
Предпочтительные пектины являются полимерами [альфа]-1,4-D-галактуроновой кислоты, имеющей молекулярную массу порядка 10-400 кДа, которые могут быть выделены, например, из моркови или томатов (JP 60164432). Предпочтительные галактоолигосахариды содержат сахаридную часть, состоящую из 2-5 повторяющихся структурных звеньев {-[альфа]-D-Glu-(1->4)-[бета]-D-Gal-(1->6)-} (Yakult Honsa Co., Япония). Предпочтительными фруктоолигосахаридами являются извлекаемые из цикория инулин-олигофруктозы, которые могут содержать, например, 1-9 повторяющихся структурных звеньев {-[бета]-D-Fru-(1->2)-[бета]-D-Fru-(1->2)-} (WO 94/12541; Raffinerie Tirlemontoise S.A., Бельгия), или олигосахариды, синтезируемые из звеньев сахарозы, которые могут содержать, например, сахарозную часть, состоящую из 2-9 повторяющихся структурных звеньев {-[альфа]-D-Glu-(1->2)-[бета]-D-Fru-(1->2)-} (Meiji Seika Kasiha Co., Япония). Предпочтительные мальтоолигосахариды содержат сахаридную часть, состоящую из 2-7 повторяющихся структурных звеньев {-[альфа]-D-Gal-(1->4)-} (Yakult Honsa Co., Япония). Предпочтительные изомальтозы содержат сахаридную часть, состоящую из 2-6 повторяющихся структурных звеньев {-[альфа]-D-Glu-(1->6)-} (Showa Sangyo Co., Япония). Предпочтительные гентиоолигосахариды содержат сахаридную часть, состоящую из 2-5 повторяющихся структурных звеньев {-бета]-D-Glu-(1->6)-} (Nihon Shokuhin Kako Co., Япония). Наконец, предпочтительные ксилоолигосахариды содержат сахаридную часть, состоящую из 2-9 повторяющихся структурных звеньев, например, {-[бета]-ху1-(1->4)-} (Suntory Co., Япония).
Количество пребиотиков в композиции замороженного йогурта согласно изобретению зависит от их способности поддерживать развитие молочнокислых бактерий. Как общее правило, основа может содержать от 0,1 до 20% таких пребиотиков (мас.% по отношению к содержанию сухого вещества).
Композиция замороженного йогурта может содержать нереплицирующиеся пробиотики в количестве, соответствующем количеству по меньшей мере 103 КОЕ на 1 г пребиотика, предпочтительно от 104 до 107 КОЕ/г пребиотика, например.
Авторы данного изобретения неожиданно обнаружили, что, например, в отношении укрепления иммунной системы и/или с точки зрения противовоспалительного действия нереплицирующиеся пробиотические микроорганизмы могут быть даже более эффективными, чем реплицирующиеся пробиотические микроорганизмы.
Это является удивительным, так как пробиотики часто определяются как «живые микроорганизмы, которые при введении в надлежащих количествах приносят пользу здоровью организма» (Руководящие принципы FAO/WHO). Огромное большинство литературных публикаций касается живых пробиотиков. При этом в нескольких исследованиях изучалась полезность для здоровья снабжения нереплицирующимися бактериями, и большинство из них показало, что инактивация пробиотиков, например, тепловой обработкой приводит к потере их подразумеваемой пользы для здоровья (Rachmilewitz, D. и др., 2004, Gastroenterology 126:520-528; Castagliuolo и др., 2005, FEMS Immunol. Med. Microbiol. 43:197-204; Gill, H.S. и K.J. Rutherfurd, 2001, Br. J. Nutr. 86:285-289; Kaila, M. и др., 1995, Arch. Dis. Child 72:51-53.). Некоторые исследования показали, что мертвые пробиотики могут сохранять некоторую способность влиять на состояние здоровья (Rachmilewitz, D., и др., 2004, Gastroenterology 126:520-528; Gill, H.S. и K.J. Rutherfurd, 2001, Br. J. Nutr. 86:285-289), но очевидно, живые пробиотики с этой точки зрения были оценены как намного более эффективные.
«Нереплицирующиеся» пробиотические микроорганизмы включают пробиотические бактерии, подвергнутые тепловой обработке, и пробиотические бактерии, подвергнутые экструдированию. Они включают микроорганизмы, которые являются инактивированными, мертвыми, нежизнеспособными и/или присутствующими в виде фрагментов, таких как ДНК, метаболиты, цитоплазматические соединения или материалы клеточной оболочки.
«Нереплицирующиеся» означает, что никаких жизнеспособных клеток и/или колониеобразующих единиц классическими методами культивирования обнаружено быть не может. Такие классические методы культивирования сведены воедино в книге по микробиологии James Monroe Jay, Martin J. Loessner, David A. Golden. 2005. Modem food microbiology («Современная микробиология пищевых продуктов»). 7 издание, Springer Science, Нью-Йорк, N.Y. 790 стр. Как правило, отсутствие жизнеспособных клеток может быть показано следующим образом: отсутствие каких-либо видимых колоний на чашках с агаровой средой или отсутствие увеличивающегося помутнения в жидкой среде для выращивания после засева бактериальными препаратами в различных концентрациях («Нереплицирующиеся» образцы) и выдерживания в подходящих условиях (аэробная и/или анаэробная атмосфера на протяжении по меньшей мере 24 час).
Пробиотики для целей настоящего изобретения определяются как «препараты микробиологических клеток или компоненты микробиологических клеток, обладающие благотворным воздействием на состояние здоровья или самочувствие организма». (C Salminen, Ouwehand A. Benno Y. и др. “Probiotics: how should they be defined” («Пробиотики: как их следует определять») Trends Food Sci. Technol. 1999:10 107-10).
Композиции настоящего изобретения содержат пробиотические микроорганизмы и/или нереплицирующиеся пробиотические микроорганизмы в количестве, достаточном для по меньшей мере частичного обеспечения благотворного воздействия на здоровье. Подходящее для обеспечения такого действия количество определяется как «терапевтически эффективная доза». Эффективные для этих целей количества зависят от многих известных специалистам в данной области факторов, таких как масса тела и общее состояние здоровья потребителя, а также от эффекта, оказываемого матрицей пищевого продукта.
При профилактических применениях композиции согласно изобретению назначаются восприимчивым или иным образом подверженным риску развития определенного заболевания потребителям в количестве, которое является достаточным для по меньшей мере частичного снижения риска развития такого заболевания. Такое количество определяется как представляющее собой «профилактически эффективную дозу». Аналогично, точные количества зависят от ряда таких факторов, как состояние здоровья и масса потребителя, а также от эффекта, оказываемого матрицей пищевого продукта.
Специалисты в данной области смогут отрегулировать терапевтически эффективную дозу и/или, соответственно, профилактически эффективную дозу.
В целом композиция настоящего изобретения содержит нереплицирующиеся пробиотические микроорганизмы в терапевтически эффективной дозе и/или в профилактически эффективной дозе.
Как правило, терапевтически эффективная доза и/или профилактически эффективная доза находится в диапазоне около 0,005 мг - 1000 мг нереплицирующихся пробиотических микроорганизмов в сутки.
Предпочтительно нереплицирующиеся микроорганизмы присутствуют в количестве, эквивалентном величине между 104 и 109 КОЕ/г сухой композиции, еще более предпочтительно в количестве, эквивалентном величине между 105 и 109 КОЕ/г сухой композиции.
Пробиотики могут быть приведены в нереплицирующееся состояние любым известным в данной области способом.
Имеющиеся в настоящее время технологии, пригодные для приведения пробиотика в нереплицирующееся состояние, обычно представлены тепловой обработкой, γ-облучением, ультрафиолетовым светом или применением химических реагентов (формалин, параформальдегид).
Также обнаружено, что пробиотик может стать нереплицирующимся биологически активным посредством применения некоторой сдвиговой обработки, такой как используется при низкотемпературной экструзии. Поэтому согласно другому воплощению пробиотики приводятся в нереплицирующееся состояние с помощью низкотемпературной экструзии. Низкотемпературная экструзия широко используется в области замороженных кондитерских изделий и определяется как экструзия при отрицательных температурах, обычно при температуре ниже -11°C.
В численном выражении, например, подвергнутые «кратковременной высокотемпературной» обработке нереплицирующиеся микроорганизмы могут присутствовать в композиции в количествах, эквивалентно соответствующих между 104 и 1012 КОЕ/г сухой композиции.
Предпочтительной для приведения пробиотика в нереплицирующееся состояние была бы технология, которая является относительно простой в применении в производственных условиях пищевой промышленности.
Большинство представленных в настоящее время на рынке продуктов содержат пробиотики, подвергнутые в процессе их изготовления тепловой обработке. Поэтому было бы удобным иметь возможность обрабатывать пробиотики нагреванием либо вместе с вырабатываемым продуктом, либо по меньшей мере подобным способом, при том, чтобы пробиотики сохраняли или улучшали свои полезные качества, или даже приобретали бы новые полезные для потребителя свойства.
Однако инактивация пробиотических микроорганизмов тепловой обработкой или высокосдвиговой обработкой, такой, как применяется при низкотемпературной экструзии, по литературным данным, как правило, связана с по меньшей мере частичной потерей активности пробиотика.
Авторы настоящего изобретения в настоящее время неожиданно обнаружили, что приведение пробиотических микроорганизмов в нереплицирующееся состояние, например, тепловой обработкой или низкотемпературной экструзией не приводит к потере полезных для здоровья качеств пробиотика, но, наоборот, может усиливать имеющийся благотворный эффект и даже приводить к созданию новых благоприятствующих здоровью свойств.
Соответственно, одно воплощение настоящего изобретения является композицией замороженного йогурта, в которой нереплицирующиеся пробиотические микроорганизмы приводятся в нереплицирующееся состояние тепловой обработкой, и второе воплощение изобретения является замороженной композицией йогурта, в которой нереплицирующиеся пробиотические микроорганизмы приводятся в нереплицирующееся состояние низкотемпературной экструзией.
Что касается тепловой обработки, то предпочтительно тепловая обработка микроорганизмов выполняется независимо, а затем полученные нереплицирующиеся пробиотические микроорганизмы могут добавляться к замороженной йогуртной смеси.
Такая тепловая обработка может выполняться при по меньшей мере 71,5°C в течение по меньшей мере 1 секунды.
Может применяться как длительная тепловая обработка, так и кратковременная тепловая обработка.
В промышленных масштабах в настоящее время предпочтительными обычно являются способы кратковременной тепловой обработки, такие как пастеризация. Этот вид тепловой обработки снижает бактериальную нагрузку и сокращает продолжительность обработки, тем самым ослабляя ухудшение качества питательных веществ.
Авторы данного изобретения впервые продемонстрировали, что пробиотические микроорганизмы, подвергнутые тепловой обработке при высоких температурах в течение непродолжительного времени, демонстрируют противовоспалительные иммунные профили независимо от своих исходных свойств. В частности, либо вырабатывается новой противовоспалительный профиль, либо существующий противовоспалительный профиль в результате такой тепловой обработки усиливается.
Поэтому теперь оказывается возможным вырабатывать нереплицирующиеся пробиотические микроорганизмы с противовоспалительными иммунными профилями, применяя специальные параметры тепловой обработки, которые соответствуют типичным применяемым при тепловой обработке в промышленности, даже если их живые аналоги не являются штаммами, обладающими противовоспалительной активностью.
Поэтому тепловая обработка может представлять собой, например, высокотемпературную обработку при около 71,5-150°C в течение около 1-120 секунд. Высокотемпературная обработка может являться высокотемпературной/кратковременной (HTST) обработкой, обработкой с повышенной температурой и сокращенным временем пастеризации (HHST) или ультравысокотемпературной (UHT) обработкой.
Пробиотические микроорганизмы могут быть подвергнуты высокотемпературной обработке при около 71,5-150°C в течение короткого времени около 1-120 секунд.
Более предпочтительно микроорганизмы могут быть подвергнуты высокотемпературной обработке при около 90-140°C, например при 90-120°C, в течение короткого времени около 1-30 секунд.
Эта высокотемпературная обработка переводит микроорганизмы, по меньшей мере частично, в нереплицирующееся состояние.
Высокотемпературная обработка может проводиться при нормальном атмосферном давлении, но также может быть выполнена под повышенным давлением. Типичные диапазоны давлений составляют от 1 до 50 бар, предпочтительно от 1 до 10 бар, еще более предпочтительно от 2 до 5 бар. Очевидно, что предпочтительным будет, если пробиотики подвергаются тепловой обработке в питательной среде, которая при приложении теплоты является жидкостью или твердым веществом. Поэтому идеальная величина прикладываемого давления будет зависеть от природы композиции, которая обеспечивается микроорганизмами, и от используемой температуры.
Высокотемпературная обработка может выполняться в интервале температур около 71,5-150°C, предпочтительно около 90-120°C, еще более предпочтительно около 120-140°C.
Высокотемпературная обработка может выполняться в течение короткого времени около 1-120 секунд, предпочтительно около 1-30 секунд, еще более предпочтительно около 5-15 секунд.
Данный временной интервал относится ко времени, в течение которого пробиотические микроорганизмы подвергаются воздействию данной температуры. Следует заметить, что в зависимости от природы и количества обеспечиваемой микроорганизмами композиции, а также в зависимости от конструкции применяемого нагревательного устройства, продолжительность применяемого нагревания может изменяться.
Однако, как правило, композиция настоящего изобретения и/или микроорганизмы подвергаются высокотемпературной кратковременной (HTST) обработке, мгновенной пастеризации или ультравысокотемпературной (UHT) обработке.
Обработка является ультравысокотемпературной обработкой или ультратепловой обработкой (обе сокращаются аббревиатурой UHT), включающей по меньшей мере частичную стерилизацию композиции при нагревании ее в течение короткого времени, приблизительно 1-10 секунд, при температуре, превышающей 135°C (275°F), которая является температурой, необходимой для уничтожения в молоке спор бактерий. Например, такая обработка молока с помощью температур, превышающих 135°C, делает возможным снижение величины бактериальной нагрузки при таком обязательным времени пребывания (до 2-5 с), которое позволяет использовать режим непрерывного потока.
Есть два основных типа UHT-систем: прямые и непрямые системы. В прямой системе продукты обрабатываются впрыскиванием пара или нагнетанием пара, тогда как в непрямой системе продукты подвергаются тепловой обработке с помощью пластинчатого теплообменника, трубчатого теплообменника или скребкового теплообменника. В процессе обработки продукта комбинации UHT-систем могут применяться на любом этапе или на ряде этапов.
Обработка HTST определяется следующим образом (высокая температура / короткое время): способ пастеризации, предназначенный для пятикратного по логарифмической шкале снижения количества жизнеспособных микроорганизмов в молоке с уничтожением 99,9999% их общего содержания. Это считается подходящим для истребления почти всех дрожжей, плесневых грибков и обычных вызывающих порчу бактерий, а также для обеспечения надлежащего уничтожения обычных патогенных теплоустойчивых организмов. При способе HTST молоко на 15-20 секунд нагревается до 71,7°C (161°F).
Мгновенная пастеризация является способом тепловой пастеризации скоропортящихся напитков, таких как фруктовые и овощные соки, пиво и молочные продукты. Это выполняется перед расфасовкой в контейнеры для уничтожения вызывающих порчу микроорганизмов, придания продуктам большей безопасности и увеличения продолжительности их хранения. Жидкость двигается в контролируемом непрерывном потоке и при этом в течение около 15-30 секунд подвергается воздействию температур от 71,5°C (160°F) до 74°C (165°F).
Для целей настоящего изобретения термин «кратковременная высокотемпературная обработка» включает, например, кратковременную обработку при высокой температуре (HTST), UHT-обработку и мгновенную пастеризацию.
Так как такая тепловая обработка придает нереплицирующимся пробиотикам улучшенный противовоспалительный профиль, композиция настоящего изобретения может быть применена в профилактике или терапии воспалительных нарушений.
Воспалительные нарушения, которые могут быть излечены или предупреждены с помощью композиции настоящего изобретения, специальным образом не ограничивается. Например, они могут быть выбраны из группы, состоящей из острых воспалений, таких как сепсис; ожогов; хронических воспалений, таких как воспалительные заболевания кишечника, например, болезнь Крона, неспецифический язвенный колит, паучит; некротизирующего энтероколита; кожных воспалений, таких как УФ- или химически индуцированное воспаление кожи, экзема, реактивная кожа; синдрома раздраженного кишечника; воспалений глаз; аллергии, астмы и их комбинаций.
Если для приведения пробиотических микроорганизмов в нереплицирующееся состояние применяется длительная тепловая обработка, такая тепловая обработка может осуществляться в интервале температур около 70-150°C в течение около 3 минут - 2 часов, предпочтительно в диапазоне 80-140°C от 5 минут до 40 минут.
В то время как существующий уровень техники в основном указывает, что бактерии, приведенные в нереплицирующееся состояние с помощью длительной тепловой обработки, обычно менее эффективны, чем живые клетки, в отношении проявления их пробиотических качеств, авторы настоящего изобретения смогли продемонстрировать, что подвергнутые тепловой обработке пробиотики превосходят свои живые аналоги в способности стимулировать иммунную систему.
Настоящее изобретение также относится к композиции, содержащей пробиотические микроорганизмы, приведенные в нереплицирующееся состояние тепловой обработкой в течение по меньшей мере около 3 минут при по меньшей мере около 70°C.
Усиливающее иммунную систему действие нереплицирующихся пробиотиков было подтверждено in vitro иммунным профилем. В применяемой in vitro модели используется цитокиновый профиль человеческих мононуклеаров периферической крови (РВМС) и хорошо принимается в данной области в качестве стандартной модели для исследования иммуномодулирующих соединений (Schultz и др., 2003, Journal of Dairy Research 70, 165-173; Taylor и др., 2006, Clinical and Experimental Allergy, 36, 1227-1235; Kekkonen и др., 2008, World Journal of Gastroenterology, 14, 1192-1203).
Испытания РВМС in vitro применялись несколькими авторами / исследовательскими группами, например, для классифицирования пробиотиков согласно их иммунным профилям, то есть по их анти- или провоспалительным показателям (Kekkonen и др., 2008, World Journal of Gastroenterology, 14, 1192-1203). Было показано, например, что такие испытания позволяют прогнозировать противовоспалительное действие исследуемых пробиотиков в отношении кишечного колита в моделях на мышах (Foligne В. и др., 2007, World J. Gastroenterol. 13:236-243). Более того, это испытание регулярно применяется в качестве показательного в клинических исследованиях и была продемонстрирована его способность представлять результаты, согласующиеся с клиническими данными (Schultz и др., 2003, Journal of Dairy Research 70, 165-173; Taylor и др., 2006, Clinical and Experimental Allergy, 36, 1227-1235).
За последние десятилетия непрерывно увеличивается распространенность аллергических заболеваний и в настоящее время они рассматриваются ВОЗ в качестве эпидемических. В общих чертах, аллергия, как полагают, является следствием дисбаланса между иммунными ответами Th1 и Th2, приводящего к сильному сдвигу в сторону продуцирования медиаторов Th2. Поэтому аллергия может быть смягчена, подавлена или предотвращена посредством восстановления надлежащего соответствия между Th1 и Th2 компонентами иммунной системы. Это подразумевает необходимость в снижении ТП2-ответов или усилении, по меньшей мере временном, ответа Th1. Последнее было бы показателем укрепления иммунной системы, часто сопровождаемого высокими уровнями, например, IFN-γ, TNF-α и IL-12 (World Journal of Gastroenterology, 14, 1192-1203; Viljanen M. и др., 2005, Allergy, 60, 494-500).
Композиция замороженного йогурта настоящего изобретения позволяет поэтому излечивать или предупреждать нарушения, связанные с повреждениями иммунной защиты.
Соответственно, нарушения, связанные с повреждениями иммунной защиты, которые могут быть излечены или предупреждены с помощью композиции настоящего изобретения, специальным образом не ограничивается.
Например, они могут выбираться из группы, состоящей из инфекций, в частности, бактериальных, вирусных, грибковых и/или паразитарных инфекций; фагоцитарного дефицита; угнетения иммунитета слабой или тяжелой степени, вызванного стрессом или действием иммунодепрессивных лекарственных препаратов, химиотерапии или лучевой терапии; натуральных состояний сниженной иммунокомпетентности иммунной системы, например, у новорожденных; аллергий и их комбинаций.
Описанная в настоящем изобретении композиция замороженного йогурта позволяет также усиливать реакцию ребенка на вакцины, в частности, на пероральные вакцины.
Согласно второму воплощению нереплицирующиеся микроорганизмы приводятся в нереплицирующееся состояние посредством приложения высокосдвиговой обработки, такой как низкотемпературная экструзия. Низкотемпературная экструзия, также именуемая в области замороженных кондитерских изделий замораживанием при низких температурах, описывается, например, в патенте US 7261913, содержание которого включено здесь посредством ссылки. Эта обработка состоит в применении, например, сдвиговой обработки со скоростями сдвига в диапазоне от 1 до 50 л/с или в развитии сдвигового напряжения в диапазоне от 2500 до 75000 Па при поддержании критической температуры в шнековом экструдере. Шнековый экструдер может быть таким, как описывается в заявке WO 2005/070225. Экструзия может выполняться в одно- или двухшнековом экструдере.
В частности, нереплицирующиеся микроорганизмы, приведенные в нереплицирующееся состояние низкотемпературной экструзией, показывают такое же благоприятное противовоспалительное действие, как и подвергнутые тепловой обработке. Эффективными могут быть любые количества нереплицирующихся микроорганизмов. Однако предпочтительно, чтобы в целом по меньшей мере 90%, предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 98%, наиболее предпочтительно по меньшей мере 99%, идеально по меньшей мере 99,9%, наиболее идеально все пробиотики являлись бы нереплицирующимися.
В одном воплощении настоящего изобретения все микроорганизмы являются нереплицирующимися.
Соответственно, в композиции настоящего изобретения по меньшей мере 90%, предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 98%, наиболее предпочтительно по меньшей мере 99%, идеально по меньшей мере 99,9%, наиболее идеально все пробиотики могут быть нереплицирующимися.
Для целей настоящего изобретения могут применяться любые пробиотические микроорганизмы.
Например, пробиотические микроорганизмы могут выбираться из группы, состоящей из бифидобактерий, молочнокислых бактерий, пропионовокислых бактерий или их комбинаций, например, Bifidobacterium longum, Bifidobacterium lactis, Bifidobacterium animalis, Bifidobacterium breve, Bifidobacterium infantis, Bifidobacterium adolescentis, Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus paracasei, Lactobacillus salivarius, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus johnsonii, Lactobacillus plantarum, Lactobacillus fermentum, Lactococcus lactis. Streptococcus thermophilus, Lactococcus lactis, Lactococcus diacetylactis, Lactococcus cremoris, Lactobacillus bulgaricus, Lactobacillus helveticus, Lactobacillus delbrueckii, Escherichia coli и/или их смесей.
Композиция в соответствии с настоящим изобретением может, например, содержать пробиотические микроорганизмы, выбранные из группы, состоящей из Bifidobacterium longum NCC 3001, Bifidobacterium longum NCC 2705, Bifidobacterium breve NCC 2950, Bifidobacterium lactis NCC 2818, Lactobacillus johnsonii La1, Lactobacillus paracasei NCC 2461, Lactobacillus rhamnosus NCC 4007, Lactobacillus reuteri DSM 17983, Lactobacillus reuteri ATCC 55730, Streptococcus thermophilus NCC 2019, Streptococcus thermophilus NCC 2059, Lactobacillus casei NCC 4006, Lactobacillus acidophilus NCC 3009, Lactobacillus casei ACA-DC 6002 (NCC 1825), Escherichia coli Nissle, Lactobacillus bulgaricus NCC 15, Lactococcus lactis NCC 2287 или их комбинаций.
Все эти штаммы были или депонированы согласно Будапештскому договору, и/или являются предлагаемыми в продаже.
Депонированными согласно Будапештскому договору являются следующие штаммы:
Штаммы, именуемые ATCC, были депонированы в Американской коллекции типовых культур (ATCC Patent Depository), 10801 University Blvd., Manassas, VA 20110, США.
Штаммы, именуемые CNCM, были депонированы в COLLECTION NATIONALE DE CULTURES DE MICROORGANISMES (CNCM), 25 rue du Docteur Roux, F-75724 PARIS Cedex 15, Франция.
Штаммы, именуемые CGMCC, были депонированы в Китайском главном коллекционном центре микробиологических культур, Институт микробиологии Академии наук Китая, Zhongguancun, P.O. Box 2714, Пекин 100080, Китай.
Штаммы, именуемые ACA-DC, были депонированы в Греческом координационном центре коллекций микроорганизмов. Лаборатория молочных продуктов, Отдел теоретических основ и технологии пищевых продуктов, Сельскохозяйственный университет Афин, 75, Iera odos, Botanikos, Афины, 118 55, Греции.
Штаммы, именуемые DSM, были депонированы в DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Inhoffenstr., 7 B, 38124 Braunschweig, Германия.
Специалистам в данной области ясно, что они могут свободно объединять все описанные здесь признаки настоящего изобретения без отступления от его раскрываемого здесь объема.
Дальнейшие признаки и преимущества настоящего изобретения будут очевидны из следующих далее Фигур и Примеров.
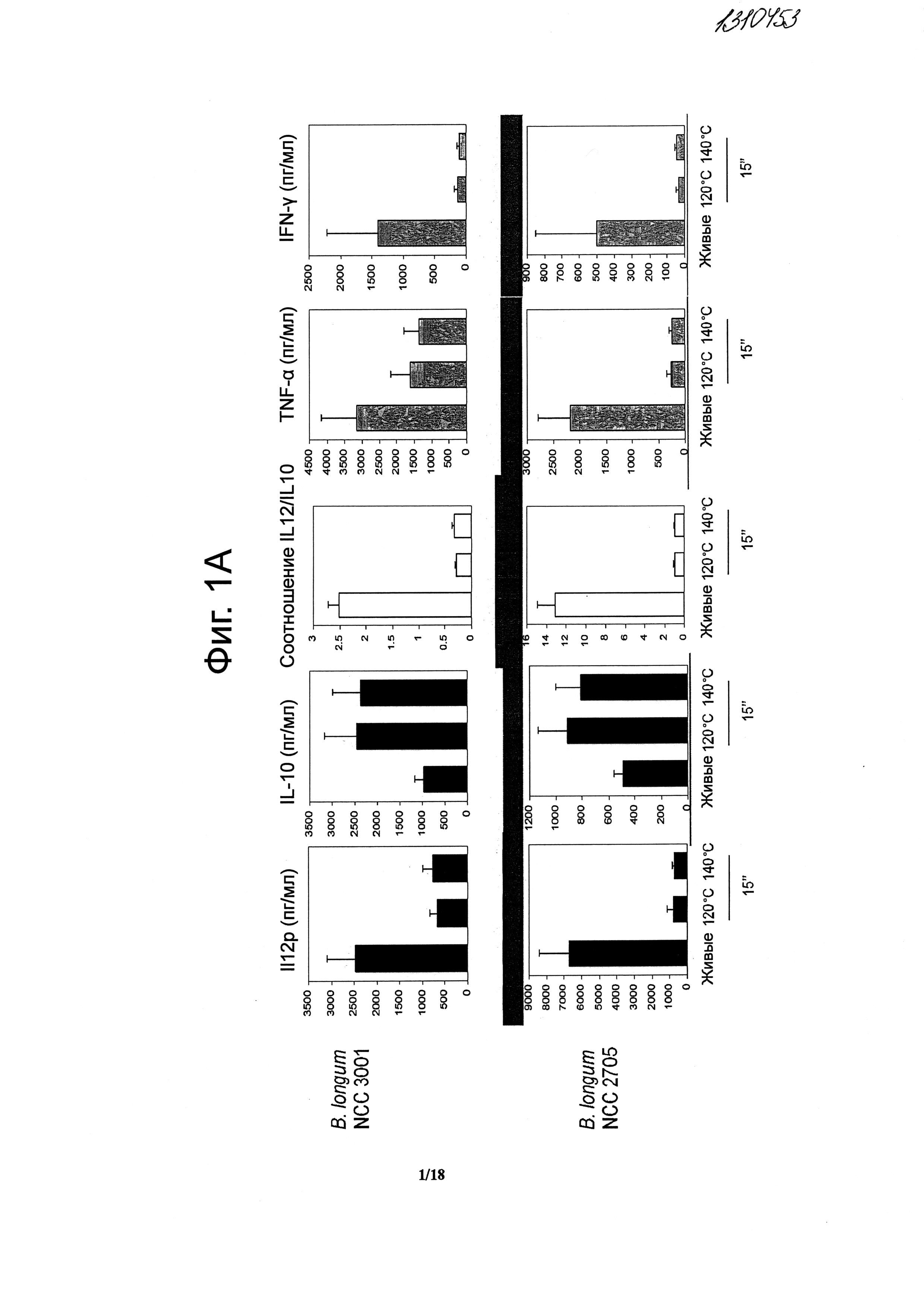
Фигуры 1A и B показывают усиление противовоспалительных иммунных профилей пробиотиков, подвергнутых «кратковременной высокотемпературной» обработке.
Фигура 2 показывает штаммы пробиотиков, не обладающие противовоспалительными качествами, которые становились противовоспалительными, то есть демонстрирующими выраженный противовоспалительный профиль in vitro после «кратковременной высокотемпературной» обработки.
Фигуры 3A и B показывают штаммы пробиотиков, применяемые в коммерчески доступных продуктах, которые демонстрируют усиленные или новоприобретенные противовоспалительные иммунные профили in vitro после «кратковременной высокотемпературной» обработки.
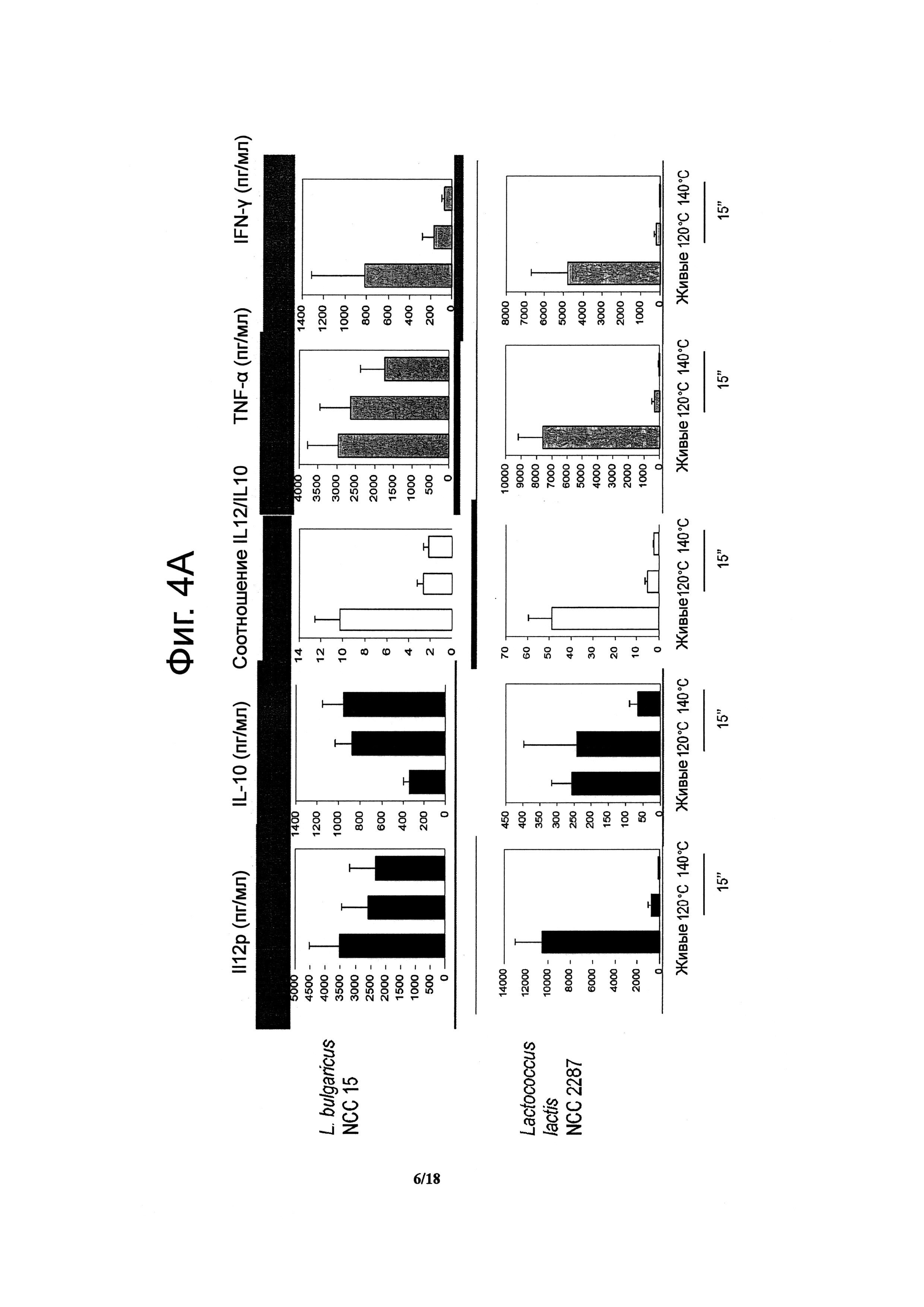
Фигуры 4A и B показывают штаммы молочной закваски (то есть заквасочные штаммы Lc1), которые демонстрируют усиленные или новоприобретенные противовоспалительные иммунные профили in vitro после кратковременной обработки при высоких температурах.
Фигура 5 показывает штамм пробиотика, не обладающий противовоспалительными качествами, который демонстрирует противовоспалительный иммунный профиль in vitro после HTST-обработки.
Фигура 6 представляет приложение метода главных компонент к данным по РВМС (IL-12p40, IFN-γ, TNF-α, IL-10), демонстрируемым пробиотическими и молочными заквасочными штаммами в их живом и подвергнутом тепловой обработке (140°C в течение 15 секунд) состоянии. Каждая точка представляет один штамм, живой либо подвергнутый тепловой обработке, и идентифицируемый его NCC-номером или названием.
Фигура 7 показывает отношения IL-12p40/IL-10 живых и подвергнутых тепловой обработке (85°C, 20 мин) штаммов. В целом тепловая обработка в течение 20 минут при 85°C приводит к возрастанию величин отношения IL-12p40/IL-10 по сравнению с кратковременной высокотемпературной обработкой настоящего изобретения (Фигуры 1, 2, 3, 4 и 5).
Фигура 8 показывает повышение in vitro секреции цитокина из человеческих РВМС, стимулируемой подвергнутыми тепловой обработке бактериями.
Фигура 9 показывает процентную интенсивность диареи, наблюдаемой у OVA-сенсибилизированных мышей, подвергнутых провокации солевым раствором (отрицательный контроль), OVA-сенсибилизированных мышей, подвергнутых провокации OVA (положительный контроль) и OVA-сенсибилизированных мышей, подвергнутых провокации OVA и терапии подвергнутыми тепловой обработке или живыми Bifidobacterium breve NCC2950. Результаты отображены в виде процента от интенсивности диареи (среднее ±SEM, рассчитанное по 4 независимым экспериментам) со 100% интенсивностью диареи, соответствующей симптомам, развившимся в группе с положительным контролем (сенсибилизация и провокация аллергеном).
Фигура 10 представляет блок-схему процесса, применяемого для получения экструдированной матрицы, содержащей нереплицирующиеся пробиотические микроорганизмы (пробиотические микроорганизмы, введенные в экструдер в виде влажной смеси).
Фигура 11 представляет блок-схему процесса, применяемого для получения экструдированной матрицы, содержащей нереплицирующиеся пробиотические микроорганизмы (пробиотические микроорганизмы, введенные в экструдер в виде влажной смеси), с помощью холодной экструзии.
Фигура 12 представляет блок-схему альтернативного способа, который может применяться для получения экструдированной матрицы, содержащей нереплицирующиеся пробиотические микроорганизмы (пробиотические микроорганизмы представляют часть сухой смеси).
Фигура 13 демонстрирует результаты анализа РСА цитокиновых профилей нескольких экструдированных образцов. Легенда: A: BL818 800 об/мин, B: BL818 1000 об/мин, C: BL818 1200 об/мин, D: BL818 85°C, E: BL818 100°C, F: BL818 120°C, G: BL818 140°C, H: BL818 120°C /15 с, I: BL818 140°C / 15 с, J: LPR 800 об/мин, K: LPR 1000 об/мин, L: LPR 1200 об/мин, M: LPR 85°C, N: LPR 100°C, O: LPR 120°C, P: LPR 140°C, Q: LPR 120°C / 15 с, R: LPR 140°C / 15 с, S: ST11 800 об/мин, T: ST11 1000 об/мин, U: ST11 1200 об/мин, V: ST11 85°C, W: ST11 100°C, X: ST11 120°C, Y: ST11 140°C, Z: ST11 120°C / 15 с, AZ: ST11 140°C/15 c.
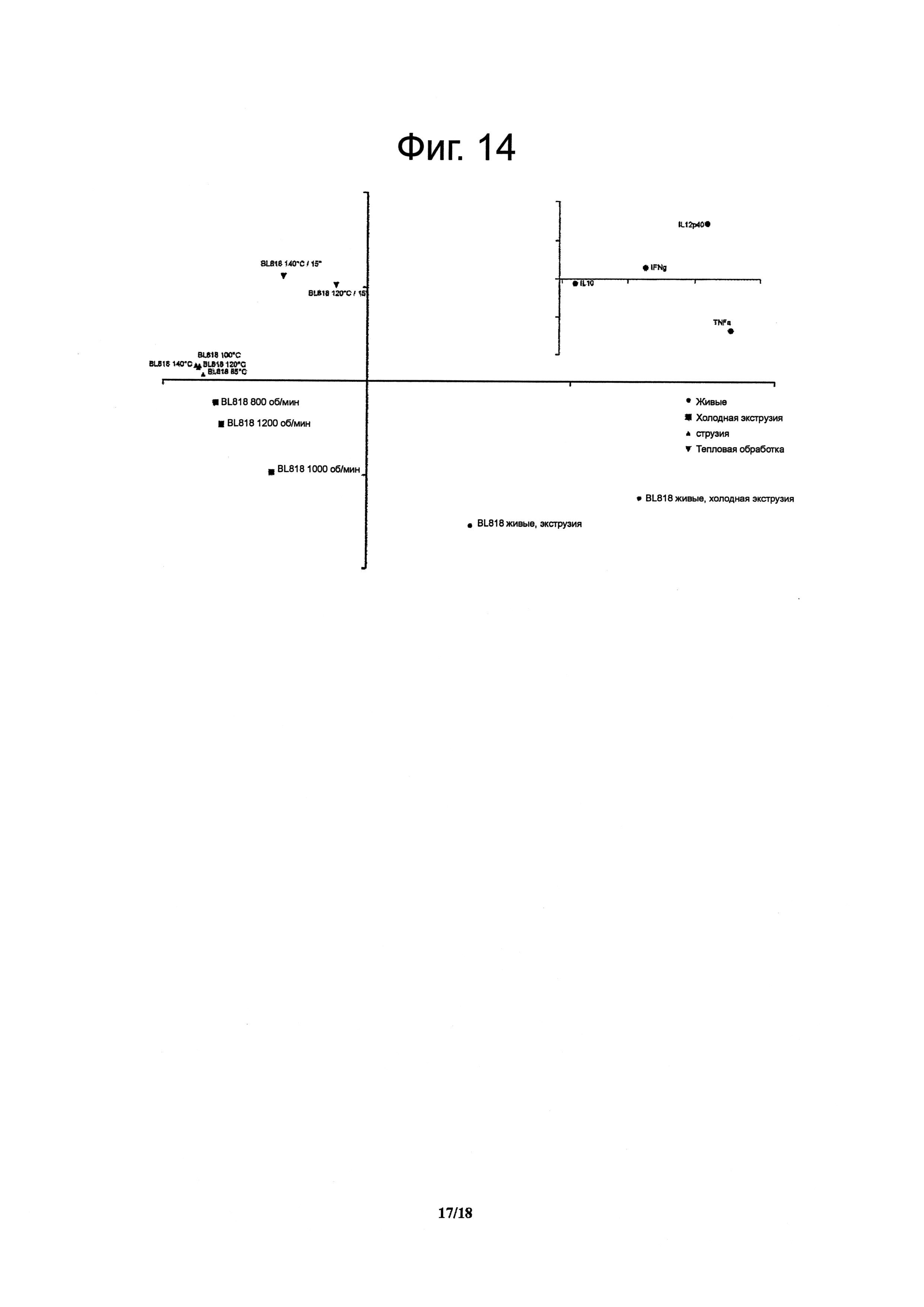
Фигура 14 демонстрирует результаты анализа РСА цитокиновых профилей различных экструдированных препаратов В. longum BL818.
Фигура 15 демонстрирует результаты анализа РСА цитокиновых профилей различных экструдированных препаратов L. paracasei ST11.
Пример 1
Методика.
Бактериальные препараты.
Польза, предоставляемая живыми пробиотиками иммунной системе организма, как правило, рассматривается как штаммоспецифическая. Было показано, что пробиотики, приводящие к высоким уровням IL-10 и/или вызывающие снижение уровней провоспалительным цитокинов in vitro (испытание РВМС), являются действенными противовоспалительными штаммами in vivo (Foligne В. и др., 2007, World J. Gastroenterol. 13: 236-243).
При исследованиях противовоспалительных свойств подвергнутых тепловой обработке пробиотиков было использовано несколько пробиотических штаммов. Это были Bifidobacterium longum NCC 3001, Bifidobacterium longum NCC 2705, Bifidobacterium breve NCC 2950, Bifidobacterium lactis NCC 2818, Lactobacillus paracasei NCC 2461, Lactobacillus rhamnosus NCC 4007, Lactobacillus casei NCC 4006, Lactobacillus acidophilus NCC 3009, Lactobacillus casei ACA-DC 6002 (NCC 1825) и Escherichia coli Nissle. Были также исследованы несколько штаммов заквасочных культур, включая некоторые штаммы, применяемые промышленно для получения ферментированных Lc1 продуктов Nestle: Streptococcus thermophilus NCC 2019, Streptococcus thermophilus NCC 2059, Lactobacillus bulgaricus NCC 15 и Lactococcus lactis NCC 2287.
Бактериальные клетки культивировались в условиях, оптимизированных для каждого штамма, в 5-15 л биореакторах. Пригодными являются любые стандартные среды для выращивания бактериальных культур. Такие среды известны специалистам в данной области. После доведения pH до 5,5 в непрерывном режиме добавлялся 30% основной раствор (либо NaOH, либо Ca(OH)2). Когда это было необходимо, создавались анаэробные условия заполнением свободного пространства газообразным CO2. Е. coli выращивалась при стандартных аэробных условиях.
Бактериальные клетки собирались центрифугированием (5000 g, 4°C) и ресуспендировались в фосфатно-солевом буфере (PBS) в объемах, подходящих для достижения конечной концентрации около 109-1010 КОЕ/мл. Часть препарата была заморожена при -80°C с 15% глицерином. Другая часть клеток была подвергнутой тепловой обработке с помощью:
- ультравысокой температуры: 140°C в течение 15 с; впрыскиванием глухого пара;
- высокой температуры в течение короткого времени (HTST): 74°C, 90°C и 120°C в течение 15 с впрыскиванием глухого пара;
- низкой температуры в течение длительного времени (85°C, 20 минут) на водяной бане.
При тепловой обработке образцы перед применением сохранялись в замороженном при -80°C состоянии.
Оценка in vitro иммунного профиля бактериальных препаратов.
Были выполнены оценки иммунных профилей живых и подвергнутых тепловой обработке бактериальных препаратов (то есть способности индуцировать секрецию специфических цитокинов клетками крови человека in vitro). Мононуклеары периферической крови (РВМС) человека были выделены из фильтров для крови. После разделения по градиенту плотности клеток были отобраны мононуклеарные клетки и дважды промыты сбалансированным солевым раствором Хэнкса. Клетки затем были ресуспендированы в среде Дульбекко, модифицированной по способу Исков, (IMDM, Sigma), дополненной 10% эмбриональной телячьей сыворотки (Bioconcept, Париж, Франция), 1% L-глютамина (Sigma), 1% пенициллина/стрептомицина (Sigma) и 0,1% гентамицина (Sigma). РВМС (7×105 клеток на лунку) затем инкубировались с живыми и подвергнутыми тепловой обработке бактериями (эквивалент 7×106 КОЕ на лунку) в 48-луночных планшетах в течение 36 час. Влияние живых и подвергнутых тепловой обработке бактерий было проверено на РВМС, полученных от 8 различных доноров, разделенных на два отдельных эксперимента. После 36 час инкубации культуральные планшеты были заморожены и до измерений цитокинов сохранялись при -20°C. Определение цитокиновых профилей выполнялось параллельно (то есть в одном эксперименте на одной и тоже серии РВМС) для живых бактерий и для их экземпляров, подвергнутых тепловой обработке.
После 36 час инкубации в супернатантах клеточной культуры были определены уровни цитокинов (IFN-γ, IL-12p40, TNF-α и IL-10) методом ELISA (иммуноферментный анализ) (R&D DuoSet Human IL-10, BD OptEIA Human IL12p40, BD OptEIA Human TNFα, BD OptEIA Human IFN-γ) согласно инструкциям производителя. IFN-γ, IL-12p40 и TNF-α являются провоспалительными цитокинами, тогда как IL-10 является мощным противовоспалительным медиатором. Результаты выражены в виде среднего (пг/мл) +/-SEM по 4 индивидуальным донорам и являются репрезентативными для двух отдельных экспериментов, выполненных с 4 донорами в каждом. Для каждого штамма было вычислено отношение IL-12p40/IL-10 в качестве прогностического показателя in vivo противовоспалительного эффекта (Foligne В. и др., 2007, World J. Gastroenterol. 13: 236-243).
Численные характеристики цитокинов (пг/мл), определенные по данным ELISA (см. выше) для каждого штамма, были введены в программу BioNumerics v5.10 ((Applied Maths, Sint-Martens-Latem, Бельгия). К этому набору данных был применен метод главных компонент (РСА, методика задания размерности). В этот анализ было включено определение разницы средних величин по признакам и деление полученного показателя на величину дисперсии по этим признакам.
Результаты.
Противовоспалительные профили, обеспечиваемые видами обработки, сходными с ультравысокотемпературной (UHT)/кратковременной высокотемпературной (HTST) обработкой.
Штаммы пробиотиков при исследовании были подвергнуты серии тепловых обработок (ультравысокотемпературная (UHT), кратковременная высокотемпературная (HTST) и 20 мин при 85°C), и их иммунные профили были сравнены с аналогичными профилями живых клеток in vitro. Живые микроорганизмы (пробиотики и/или молочные заквасочные культуры) при инкубации с человеческими РВМС индуцировали различные уровни продуцирования цитокинов (Фигуры 1, 2, 3, 4 и 5). Тепловая обработка этих микроорганизмов модифицировала уровни продуцируемых РВМС цитокинов температурно зависимым образом. «Кратковременная высокотемпературная» обработка (120°C или 140°C в течение 15 с) приводила к получению нереплицирующихся бактерий с противовоспалительными иммунными профилями (Фигуры 1, 2, 3 и 4). Фактически, штаммы, подвергнутые обработке, подобной ультравысокотемпературной (140°C, 15 с), индуцировали меньше провоспалительных цитокинов (TNF-α, IFN-γ, IL-12p40) при сохранении или стимулировании продуцирования дополнительного IL-10а (в сравнении с живыми аналогами). Полученные величины отношения IL-12p40/IL-10a для всех штаммов, подвергнутых UHT-подобной обработке, по сравнению с живыми клетками были сниженными (Фигуры 1, 2, 3 и 4). Это наблюдение было также действительно и для бактерий, подвергнутых HTST-подобной обработке, то есть 15 с при 120°C (Фигуры 1, 2, 3 и 4), или 15 с при 74°C и 90°C (Фигура 5). Тепловые обработки (UHT-подобные или HTST-подобные) имели сходное воздействие на in vitro иммунные профили штаммов пробиотиков (Фигуры 1, 2, 3 и 5) и молочных заквасочных культур (Фигура 4). Метод главных компонент на данных РВМС, полученных с живыми и подвергнутыми тепловой обработке (140°C, 15 с) штаммами пробиотиков и молочных заквасок, выявил, что живые штаммы распределяются по всей оси X, что показывает, что эти штаммы демонстрируют сильно различающиеся иммунные профили in vitro, от слабой (левая сторона) до сильной (правая сторона) индукции провоспалительных цитокинов. Группа подвергнутых тепловой обработке штаммов с левой стороны графика показывает, что подвергнутыми тепловой обработке штаммами провоспалительные цитокины индуцируются в значительно меньшей степени (Фигура 6). В отличие от этого, бактерии, подвергнутые тепловой обработке в течение 20 мин при 85°C, индуцировали больше провоспалительных цитокинов и меньше IL-10a, чем живые клетки, приводя к более высоким показателям отношения IL-12p40/IL-10a (Фигура 7).
Противовоспалительные профили, усиленные или полученные в результате UHT-подобной и HTST-подобной обработки.
Подвергнутые UHT- и HTST-обработке штаммы демонстрируют противовоспалительные профили независимо от их соответствующих исходных иммунных профилей (живые клетки). Было показано, что штаммы пробиотиков, известные в качестве противовоспалительных in vivo, и демонстрирующие противовоспалительные профили in vitro (В. longum NCC 3001, В. longum NCC 2705, В. breve NCC 2950, В. lactis NCC 2818), демонстрируют усиленные противовоспалительные профили in vitro после «кратковременной высокотемпературной» обработки. Как показано на Фигуре 1, отношения IL-12p40/IL-10a подвергнутых UHT-подобной обработке штаммов Bifidobacterium были ниже, чем у живых аналогов, тем самым показывая улучшенные противовоспалительные профили образцов, подвергнутых UHT-подобной обработке. Еще более удивительно образование противовоспалительных профилей под действием UHT-подобной и HTST-подобной обработки, подтвержденное также и у не обладавших противовоспалительной активностью живых штаммов. Оба штамма живых L. rhamnosus NCC 4007 и L. paracasei NCC 2461 показывают высокие величины отношения IL-12p40/IL-10a in vitro (Фигуры 2 и 5). Было показано, что эти два живых штамма не обладают протективным действием против TNBS-индуцированного колита у мышей. Величины индуцированного L. rhamnosus NCC 4007 и L. paracasei NCC 2461 отношения IL-12p40/IL-10a резко снижались после «кратковременной высокотемпературной» обработки (UHT или HTST), достигая столь же низких уровней, как и полученные со штаммами Bifidobacterium. Такие низкие показатели отношения IL-12p40/IL-10a являются результатом низких уровней продупирования IL-12p40 в сочетании с отсутствием изменений (L. rhamnosus NCC 4007) или сильным индуцированием секреции IL-10a (L. paracasei NCC 2461) (Фигура 2).
Как следствие:
- противовоспалительные профили живых микроорганизмов могут быть усилены UHT-подобной и HTST-подобной тепловой обработкой (например, В. longum NCC 2705, В. longum NCC 3001, В. breve NCC 2950, В. lactis NCC 2818);
- противовоспалительные профили могут быть получены у не обладающих противовоспалительной активностью живых микроорганизмов (например, L. rhamnosus NCC 4007, L. paracasei NCC 2461, молочные закваски S. thermophilus NCC 2019) посредством применения UHT-подобной и HTST-подобной тепловой обработки;
- продемонстрировано также наличие противовоспалительных профилей у штаммов, выделенных из представленных в продаже продуктов (Фигуры 3A и B), включая штамм пробиотической Е. coli.
Действие UHT/HTST-подобной обработки было сходным для всех проверенных пробиотиков и молочных заквасок, например, молочнокислых бактерий, бифидобактерий и стрептококков.
UHT/HTST-подобная обработка применялась к нескольким видам молочнокислых бактерий, бифидобактерий и стрептококков, демонстрирующим различные in vitro иммунные профили. Все штаммы после UHT/HTST-подобной обработки индуцировали меньше провоспалительных цитокинов, чем их живые экземпляры (Фигуры 1, 2, 3, 4, 5 и 6), демонстрируя, что действие UHT/HTST-подобной обработки на иммунные свойства конечных нереплицирующихся бактерий может быть обобщено на все пробиотики, в частности, на молочнокислые бактерии, бифидобактерий и определенные штаммы Е. coli, а также на все молочные заквасочные культуры, в частности, стрептококки, лактококки и молочнокислые бактерии.
Пример 2
Методика.
Бактериальные препараты.
При исследовании усиления иммунных свойства нереплицирующихся пробиотиков было использовано пять пробиотических штаммов: 3 вида бифидобактерий (В. longum NCC3001, В. lactis NCC 2818, В. breve NCC 2950) и 2 молочнокислых бактерий (L. paracasei NCC2461, L. rhamnosus NCC4007).
Бактериальные клетки выращивались на среде MRS в режиме периодического культивирования в течение 16-18 час при 37C без контроля pH. Бактериальные клетки центрифугировались (5000 g, 4°C) и ресуспендировались в фосфатно-солевом буфере перед разведением в водно-солевом растворе до достижения конечной концентрации около 1010 КОЕ/мл. В. longum NCC3001, В. lactis NCC2818, L. paracasei NCC 2461, L. rhamnosus NCC 4007 подвергались тепловой обработке в течение 20 мин при 85C на водяной бане. В. breve NCC2950 нагревались 30 минут на водяной бане при 90°C. Подвергнутые тепловой обработке бактериальные суспензии аликвотировались и до применения сохранялись в замороженном при -80°C состоянии. Живые бактерии до применения сохранялись при -80°C в смеси PBS-глицерин (15%).
Оценка in vitro иммунного профиля бактериальных препаратов.
Были выполнены оценки иммунных профилей живых и подвергнутых тепловой обработке бактериальных препаратов (то есть способности индуцировать секрецию специфических цитокинов клетками крови человека in vitro). Мононуклеары периферической крови (РВМС) человека были выделены из фильтров для крови. После разделения по градиенту плотности клеток были отобраны мононуклеарные клетки и дважды промыты сбалансированным солевым раствором Хэнкса. Клетки затем были ресуспендированы в среде Дульбекко, модифицированной по способу Исков, (IMDM, Sigma), дополненной 10% эмбриональной телячьей сыворотки (Bioconcept, Париж, Франция), 1% L-глютамина (Sigma), 1% пенициллина/стрептомицина (Sigma) и 0,1% гентамицина (Sigma). РВМС (7×105 клеток на лунку) затем инкубировались с живыми и подвергнутыми тепловой обработке бактериями (эквивалент 7×106 КОЕ на лунку) в 48-луночных планшетах в течение 36 час. Влияние живых и подвергнутых тепловой обработке бактерий было проверено на РВМС, полученных от 8 различных доноров, разделенных на два отдельных эксперимента. После 36 час инкубации культуральные планшеты были заморожены и до измерений цитокинов сохранялись при -20°C. Определение цитокиновых профилей выполнялось параллельно (то есть в одном эксперименте на одной и тоже серии РВМС) для живых бактерий и для их экземпляров, подвергнутых тепловой обработке.
После 36 час инкубации в супернатантах клеточной культуры были определены уровни цитокинов (IFN-γ, IL-12p40, TNF-γ и IL-10) методом ELISA (иммуноферментный анализ) (R&D DuoSet Human IL-10, BD OptEIA Human IL12p40, BD OptEIA Human TNFα, BD OptEIA Human IFN-γ) согласно инструкциям производителя. IFN-γ, IL-12p40 и TNF-γ являются провоспалительными цитокинами, тогда как IL-10 является мощным противовоспалительным медиатором. Результаты выражены в виде среднего (пг/мл) +/- SEM по 4 индивидуальным донорам и являются репрезентативными для двух отдельных экспериментов, выполненных с 4 донорами в каждом.
Эффект in vivo живых и подвергнутых тепловой обработке Bifidobacterium breve NCC2950 в профилактике аллергической диареи.
Для проверки Th1-промотирующего действия В. breve NCC 2950 использовалась модель аллергической диареи на мышах (Brandt Е.В и др. JCI 2003; 112 (11): 1666-1667). После сенсибилизации (2 интраперитонеальные инъекции яичного альбумина (OVA) и алюминиевокалиевых квасцов с интервалом в 14 дней; дни 0 и 14), самцы мышей линии Balb/c были подвергнуты 6-кратной пероральной провокации OVA (дни 27, 29, 32, 34, 36, 39), приводящий к кратковременным клиническим симптомам (диарея) и изменению иммунных параметров (плазменная концентрация общего IgE, OVA-специфического IgE, протеазы-1 тучных клеток мышей, то есть ММСР-1). Bifidobacterium breve NCC 2950, живые или подвергнутые 30 мин тепловой обработке при 90°C, вводились чреззондовым питанием за 4 дня до OVA-сенсибилизации (дни -3, -2, -1, 0 и дни 11, 12, 13 и 14) и во время провокационного периода (дни 23-39). Использовалась суточная доза бактерий около 109 колониеобразующих единиц (КОЕ) или эквивалентные количества в выражении КОЕ/мышь.
Результаты.
Индукция секреции «провоспалительных» цитокинов после тепловой обработки.
Была оценена in vitro способность подвергнутых тепловой обработке бактериальных штаммов стимулировать секрецию цитокинов мононуклеарами периферической крови (РВМС) человека. Иммунные профили, основанные на четырех цитокинах, продуцируемых при стимулировании РВМС подвергнутыми тепловой обработке бактериями, сравнивались с индуцируемыми живыми бактериальными клетками в одинаковых условиях испытаний in vitro.
Подвергнутые тепловой обработке препараты высевались на чашки и оценивались на отсутствие какого-либо количества жизнеспособных микроорганизмов. Подвергнутые тепловой обработке бактериальные препараты не образовывали колоний после высевания на чашки.
Живые пробиотики при инкубации с человеческими РВМС индуцировали различные и зависящие от вида штамма уровни цитокинов (Фигура 8). Тепловая обработка пробиотиков модифицировала уровни продуцируемых РВМС цитокинов по сравнению с их живыми аналогами. Подвергнутые тепловой обработке бактерии индуцировали больше провоспалительных цитокинов (TNF-α, IFN-γ, IL-12p40), чем их живые аналоги. Напротив, подвергнутые тепловой обработке бактерии в сравнении с живыми клетками индуцировали подобные или более низкие количества IL-10а (Фигура 8). Эти данные показывают, что подвергнутые тепловой обработке бактерии способны в большей степени стимулировать иммунную систему, чем их живые аналоги, и поэтому могут эффективнее укреплять ослабленную иммунную защиту. Другими словами, in vitro данные иллюстрируют улучшение эффекта укрепления иммунитета бактериальными штаммами после тепловой обработки.
Для того, чтобы показать повышенную эффективность подвергнутых тепловой обработке В. breve NCC 2950 (по сравнению с живыми клетками) в отношении действия на иммунную систему, и живые, и подвергнутые тепловой обработке В. breve NCC 2950 (штамм А) были проверены в модели аллергической диареи на животных.
По сравнению с группой позитивного контроля интенсивность диареи после терапии с подвергнутыми тепловой обработке В. breve NCC2950 была значительно и устойчиво снижена (41,1±4,8%), тогда как интенсивность диареи после терапии с живыми В. breve NCC 2950 была снижена только на 20±28,3%. Эти результаты показывают, что подвергнутые тепловой обработке В. breve NCC 2950 демонстрируют более выраженное протективное действие против аллергической диареи, чем их живые эквиваленты (Фигура 9).
В результате показано улучшение способности пробиотиков усиливать иммунную защиту после их подвергания тепловой обработке.
Пример 3
С помощью известных в данной области методов стандартного замораживания или низкотемпературной экструзии может быть приготовлена следующая композиция замороженного йогурта:
Примеры 4 и 5
Методы и материалы.
Бактериальные препараты.
Порошки L. rhamnosus NCC 4007 (CGMCC 1.3724, LPR), L. paracasei NCC 2461 (CNCM I-2116, ST11), В. lactis NCC 2818 (CNCM I-3446, BL818), L. johnsonii NCC 533 (CNCM I-1225, La1) и В. longum NCC 3001 (ATCC BA-999, BL999) были ресуспендированы в фосфатно-солевом буфере (PBS, Sigma) с достижением конечной величины TS в 35% или обеспечением итогового жидкого раствора, содержащего около 5×109 КОЕ/мл.
Рецептуры для экструдирования.
Была приготовлена сухая смесь рисового крахмала, кукурузной крупы, двузамещенного фосфата кальция, карбоната кальция, мальтодекстрина и сухого молока согласно рецептурам, представленным в Таблицах 1 и 2. Все ингредиенты смешивались в течение 30 минут с помощью смесителя периодического действия (смеситель Prodima, AC-MS (Prodima, St-Sulpice, Швейцария)).
Эксперименты проводились с использованием двухшнекового экструдера с вращением в одном направлении (Evolum BC25, Clextral, Firminy, FR) согласно блок-схеме, представленной на Фигуре 10. Температуры экструзии задавались шестью зонами нагревания так, чтобы достичь температур продукта в 85, 100, 110, 120, 130, 140 и 160°C. Для экспериментов использовались шесть цилиндров, от №1 (первая питающая зона) до №6 (перед каналом мундштука). В осевом профиле использовались два различных вида шнековых элементов: C2F и C1F. Использовалась кольцевая экструзионная головка 3 мм для образования экстрударованных труб. Сухая смесь вводилась в подающий цилиндр экструдера при скорости потока 10-12,0 кг/час с помощью питателя K-Tron (K-Tron, Lenzburg, CH). Бактериальный препарат (описанный выше) вводился в цилиндр экструдера №2 с помощью насоса при скорости потока 0,69-0,87 г/час. В соответствии с температурой нагревания в цилиндр экструдера №2 впрыскивалась вода со скоростью потока 20-60 мл/мин. Скорость вращения шнеков устанавливалась равной 500 об/мин. Развивающееся в канале мундштука давление составляло между 55 и 125 бар. Содержащие бактерии экструдированные продукты отрезались вручную и извлекались на поддон из нержавеющей стали, а затем кондиционировались в алюминиевых мешках. Для аналитических нужд при 85°C, 100°C, 110°C, 120°C, 130°C, 140 или 160°C и в тех же самых условиях были экструдированы контрольные эталонные образцы без бактерий (далее «экструдированный контроль»).
Альтернативный способ показан на Фигуре 12, при котором пробиотики добавляются к сухой рецептуре смеси (Пример 1, Таблица 1).
Холодная экструзия.
Эксперименты проводились с использованием двухшнекового экструдера с вращением в одном направлении (Evolum BC25, Clextral, Firminy, FR) согласно блок-схеме, представленной на Фигуре 11. Температура экструзии регулировалась шестью охлаждаемыми зонами для обеспечения температуры продукта между 25 и 40°C. Для экспериментов использовались шесть цилиндров, от №1 (первая питающая зона) до №6 (перед каналом мундштука). В осевом профиле использовались два различных вида шнековых элементов: C2F и C1F. Использовалась кольцевая экструзионная головка 3 мм для образования экструдированных труб. Сухая смесь вводилась в подающий цилиндр экструдера при скорости потока 8,0 кг/час с помощью питателя K-Tron (K-Tron, Lenzburg, CH). Бактериальный препарат (описанный выше) вводился в цилиндр экструдера №3 с помощью насоса при скорости потока 2 кг/час. Скорость вращения шнеков устанавливалась в 200, 500, 800, 1000 и 1200 об/мин. Развивающееся в канале мундштука давление составляло между 1 и 70 бар. Содержащие бактерии экструдированные продукты отрезались вручную и извлекались на поддон из нержавеющей стали, а затем кондиционировались в алюминиевых мешках. Для аналитических нужд при 200, 500, 800, 1000 и 1200 об/мин и в тех же самых условиях были экструдированы контрольные эталонные образцы без бактерий (далее «экструдированный контроль»).
Экстракция бактерий из экструдированного продукта.
Для микроскопических исследований.
Бактерии извлекались из экструдированных образцов следующим образом. Взвешивалось 25 г экструдированных образцов и смешивалось с 225 мл триптоновой соли и антивспенивающего агента (Sigma). Далее смесь подвергалась в течение 90 секунд механическому разрушению в гомогенизаторе Stomacher и инкубации в течение 15 минут при 68°C. После чего были проведены два последовательных этапа фильтрации через, соответственно, 40 мкм и 5 мкм фильтры. Экструдированные продукты, не содержащие пробиотиков, то есть «экструдированные контрольные образцы» или «контроль», были подвергнуты обработке согласно такому же регламенту. Отфильтрованные образцы, далее именуемые «экструдированными пробиотиками», до применения сохранялись при 4°С.
Определение цитокинового профиля мононуклеарных клеток периферической крови человека.
Бактерии извлекались из экструдированных образцов следующим образом. Взвешивалось 10 г экструдированных образцов и смешивалось с 90 мл фосфатно-солевого буфера (Sigma). После этого смесь в течение 90 секунд подвергалась механическому разрушению в гомогенизаторе Stomacher. Далее был выполнен один этап фильтрации через 40 мкм фильтр. Экструдированные продукты, не содержащие пробиотиков, то есть «экструдированные контрольные образцы» или «контроль», были подвергнуты обработке согласно такому же регламенту и использовались в качестве контрольных при анализах in vitro. Отфильтрованные образцы, далее именуемые «экструдированными пробиотиками», до применения сохранялись при -20°C.
Экстракция бактерий из образцов, полученных холодной экструзией.
Бактерии извлекались из экструдированных образцов следующим образом. Взвешивалось 2 г экструдированных образцов и смешивалось с 18 мл фосфатно-солевого буфера (Sigma). Затем смесь гомогенизировалась в течение нескольких секунд. Экструдированные продукты, не содержащие пробиотиков, то есть «экструдированные контрольные образцы» или «контроль», были подвергнуты обработке согласно такому же регламенту и использовались в качестве контрольных при анализах in vitro. Отфильтрованные образцы, далее именуемые «экструдированными пробиотиками», сохранялись при -20°C до применения (определение иммунного профиля цитокинов РВМС человека).
Выделение человеческих РВМС.
Мононуклеары периферической крови (РВМС) человека были выделены из лейкоцитарных пленок, полученных в трансфузионном центре CHUV (Lausanne). Клетки были разбавлены 1:2 сбалансированным солевым раствором Хенкса (HBSS) (Sigma, Lachen, Швейцария). После центрифугирования на градиенте плотности с применением среды Histopaque (Сигма) одноядерные клетки собирались с границы раздела фаз и дважды промывались HBSS. Клетки затем были ресуспендированы в среде Дульбекко, модифицированной по способу Исков, (IMDM, Sigma), дополненной 10% эмбриональной телячьей сыворотки (Bioconcept, Париж, Франция), 1% L-глютамина (Sigma), 1% пенициллина/стрептомицина (Sigma) и 0,1% гентамицина (Sigma). PBMC (7×105 клеток на лунку) затем инкубировались в течение 36 час с различными дозами экструдированных пробиотиков (дозировки представлены на фигурах) в 48-луночных планшетах. Эффективность экструдированных пробиотиков и экструдированных контрольных образцов была проверена на PBMC, полученных от 8 различных доноров, разделенных на два отдельных эксперимента. После 36 час инкубации культуральные планшеты были заморожены и до измерений цитокинов сохранялись при -20°C.
Измерения цитокинов.
Уровни цитокинов (IL-12p40, TNF-α и IL-10) в супернатанте клеточной культуры определялись после инкубирования в течение 36 часов мультиплексным анализом на основе электрохемилюминесценции (MesoScale Discovery, Gaithersburg, MD), следуя инструкциям изготовителя. IL-12p40 и TNF-α являются провоспалительными цитокинами, тогда как IL-10 является мощным противовоспалительным и регуляторным медиатором. Результаты выражены в виде среднего (пг/мл) +/- SEM по 4 индивидуальным донорам и являются репрезентативными для двух отдельных экспериментов, выполненных с 4 донорами в каждом.
Анализ РСА.
Численные показатели цитокинов (пг/мл), определенные по данным мультиплексного анализа (см. выше) для каждого штамма, были введены в программу BioNumerics v5.10 ((Applied Maths, Sint-Martens-Latem, Бельгия). К этому набору данных был применен метод главных компонент (РСА, методика задания размерности). В этот анализ было включено определение разницы средних величин по признакам и деление полученного показателя на величину дисперсии по этим признакам. Штаммы, индуцирующие высокие уровни провоспалительных цитокинов, сгруппированы с правой стороны диаграммы в противоположность штаммам, индуцирующим низкие количества провоспалительных цитокинов, собранным в левой части поля.
Оптическая микроскопия.
Бактерии были экстрагированы из экструдированных образцов, как описано выше в разделе «Экстракция бактерий из экструдированного продукта» с некоторыми изменениями. Образцы были подвергнуты ферментативному перевариванию альфа-амилазой в течение 1 часа при 68°C перед этапом фильтрации, сопровождаемым изучением методом оптической микроскопии (увеличение ×40 и ×100).
Для исследований PCR.
Экстракция ДНК из экструдированных бактерий для PCR.
ДНК извлекалась из экструдированных образцов с помощью набора QIAquick and QIAamp (Qiagen) согласно указаниям поставщика со следующим модифицированием. Было взвешено 2 г экструдированных образцов и смешано с 10 мл СТАВ (гексадецилтриметиламмоний бромид) (AppliChem) и 225 мкл протеазы (Qiagen) для достижения конечной концентрации 450 мкг/мл. Затем смесь инкубировалась на водяной бане в течение 1 часа при 65°C. Препарат центрифугировался, водная фаза отбиралась и смешивалась с равным объемом хлороформа (Merck). После центрифугирования супернатант был перенесен с 5 объемами РВ буфера (Qiagen) на колонку Maxi QIAamp, подсоединенную к вакуумному насосу с максимальным разрежением -600 мбар. Колонка дважды промывалась буфером РЕ (Qiagen) и осушалась центрифугированием. Очищенная ДНК в течение 5 минут элюировалась с 1 мл буфера ЕВ (Qiagen) и выделялась после центрифугирования. Вторая очистка выполнялась так же, как и предыдущая, с помощью элюирования ДНК на колонке QIAquick (Qiagen).
Полимеразная цепная реакция (PCR).
PCR выполнялись в амплификаторе Thermocycler (GeneAmp PCR System 9700, Applied Biosystem). 1 мкл очищенной ДНК добавлялся к 24 мкл амплифицируемой смеси. Амплификация выполнялась в 0,2 мл пробирках Thermo-Strip, содержащих рабочий буферный раствор: по 2,5 ммоль нуклеотидов dATP, dCTP, dGTP, dTTP (Roche Applied Science), 10 пмол/мкл каждого специфичного праймера, 2,5 мкл 10х буфера PCR, содержащего 15 ммоль MgCl2 (Applied Biosystem), 1,25 единиц AmpliTaq Gold (Applied Biosystem), и не содержащая нуклеазу вода. Было выполнено 30 циклов амплификации, при этом каждый цикл состоял из этапа денатурации (30 с при 94°C), сопровождаемого 30-секундным этапом отжига при 60°C и этапом элонгации (30 с при 72°C). Этап элонгации в ходе последнего цикла был продолжен до 7 минут при 72°C. После этого продукты PCR были подвергнуты анализу методом электрофореза на агарозном геле или автоматизированным электрофоретическим разделением (LabChip GXII, Caliper).
Электрофорез.
Продукты PCR визуализировались на агарозном геле.
10 мл продукта PCR было смешано с 2 мл синего загрузочного буфера и помещено на 1,2% агарозный гель, содержащий 1×SYBR. Электрофорез образцов и лесенки маркеров молекулярной массы проводился в течение 1 часа при 80 В. Были сделаны снимки геля под УФ освещением.
Автоматизированное электрофоретическое разделение ДНК.
Был приготовлен ДНК-чип добавлением красителя геля и маркера ДНК (Caliper). Продукты PCR помещались в 96-луночный планшет и загружались в LabChip GXII. Образцы детектировались по лазерно-индуцированной флуоресценции и полученные данные в автоматическом режиме анализировались системным программным обеспечением, представляющим сведения о размере (pb) и количестве (нг/мкл) продукта. Результаты представлены в виде смоделированного гель-электрофоретического изображения.
Результаты.
С помощью исследования РВМС были определены in vitro иммунные профили экструдированных образцов В. longum NCC 3001. Измерялись уровни провоспалительных (TNF-α и IL-12p40) и противовоспалительных цитокинов (IL-10) в супернатантах клеточной культуры после инкубирования в течение 36 час. Контрольные экструдированные продукты без бактериальных добавок индуцировали низкие уровни про- и противовоспалительных цитокинов. Включение в экструзионный процесс (температура 130°C) живых В. longum NCC 3001 резко стимулировало продуцирование цитокинов дозозависимым образом. Наибольшая индукция цитокинов была обнаружена при дозировке, эквивалентной около 108 КОЕ/мл.
После этого авторы изобретения обратились к выяснению вопроса, ведет ли экструзия при различных температурах (110°C и 120°C) к сходной in vitro иммуноактивации. Для этих целей было выполнено сравнение образцов, полученных в результате экструзии при трех различных температурах в дозировке, эквивалентной 109КОЕ/г. Все экструдированные образцы, содержащие В. longum NCC3001, эффективно по сравнению с контролем активировали иммунные клетки крови. По-видимому, применявшиеся в ходе экструзии температуры не оказывали воздействия на иммунные профили экструдированных образцов В. longum, поскольку при каждой проверенной температуре индуцировались относительно высокие уровни цитокинов. Как показано на Фигуре 1, B. longum NCC 3001 добавлялись в экструдер в виде живых бактерий (1010КОЕ/мл). Были проверены остаточные количества жизнеспособных микроорганизмов в конце процесса посевом образцов на агаре MRS + цистеин. Все добавленные бактерии в результате этого процесса были приведены в нереплицирующееся состояние, поскольку никаких колоний ни в одном из образцов, экструдированных при 110°C, 120°C и 130°C, не наблюдалось (данные не показаны). Наличие, в противоположность контрольному образцу, палочковидных бактерий в экструдированных продуктах, содержащих В. longum NCC 3001 (увеличение ×100), дало авторам возможность заключить, что in vitro иммуноактивация, описанная выше для экструдированных образцов В. longum NCC 3001, происходит вследствие наличия в конечных продуктах нежизнеспособных бактерий.
Тогда авторы изобретения обратились к вопросу о возможности достижения сходной in vitro иммуноактивации при экструзии различных штаммов, при различных температурах (от 85°C до 140°C) и при различных скоростях вращения шнеков (от 200 об/мин до 1200 об/мин. Для этих целей было выполнено сравнение образцов, полученных в результате экструзии четырех дополнительных штаммов, при пяти различных температурах и при пяти различных скоростях вращения шнеков, в дозировке, эквивалентной 109 КОЕ/г. Как показано на Фигуре 13, экструдированные образцы, содержащие нереплицирующиеся L. paracasei NCC 2461 (ST11), В. lactis NCC 2818 (BL818) и L. johnsonii NCC 533, эффективно по сравнению с контролем активировали иммунные клетки крови. Эти данные находятся в согласии с данными, ранее полученными для В. longum NCC 3001. По-видимому, применявшиеся в ходе экструзии температуры (то есть горячая или холодная экструзия) не оказывали воздействия на иммунные профили экструдированных образцов В. longum, поскольку при каждой проверенной температуре индуцировались относительно высокие уровни цитокинов. Аналогичным образом скорости вращения шнеков, превышающие 600 об/мин, обеспечивали образование нереплицирующихся штаммов (отсутствие при посеве обнаруживаемых КОЕ), которые, тем не менее, служили триггерным фактором для иммунных клеток (Фигуры 14 и 15). Таким образом, вне зависимости от температуры, механический сдвиг может применяться для приведения пробиотиков в нереплицирующееся состояние при сохранении их способности стимулировать иммунные клетки.
Анализы РСА показали, что экструдированные бактерии вызывали in vitro активацию иммунных клеток (Фигуры 14 и 15). Однако экструдированные и живые бактерии оказались в различных группах, что указывает на то, что в сравнении с живыми микроорганизмами контроля экструдированные бактерии способны демонстрировать улучшенные или вновь приобретенные иммунные свойства.
Палочковидные формы были обнаружены микроскопией во всех образцах, экструдированных с различными штаммами пробиотиков, но не в их соответствующих контрольных группах. Наличие пробиотических штаммов в экструдированных образцах было подтверждено анализом PCR, использующим штаммоспецифические антитела. Например, была обнаружена хромосомная ДНК L. paracasei NCC 2461, В. longum NCC 3001, В. lactis NCC 2818 и L. johnsonii NCC 533, что подтверждено определенными полосами на смоделированном гель-электрофоретическом изображении или на агарозном геле.
Как показано на Фигурах 10 и 12, пробиотические бактерии добавлялись в экструдер в виде живых бактерий (1010 КОЕ/мл). Были проверены остаточные количества жизнеспособных микроорганизмов в конце процесса посевом образцов на агаре MRS +/- цистеин. Все добавленные бактерии в результате этого процесса были приведены в нереплицирующееся состояние, поскольку никаких колоний ни в одном из образцов, экструдированных при температурах от 85°C до 160°C и при 140°C, а также при холодной экструзии со скоростями вращения шнека от 800 об/мин до 1200 об/мин, не наблюдалось (данные не показаны). Наличие, в противоположность контрольным образцам, палочковидных бактерий в экструдированных продуктах (увеличение ×100) дало авторам возможность заключить, что in vitro иммуноактивация, наблюдавшаяся в ответ на экструдированные продукты, происходит вследствие присутствия в конечных продуктах нежизнеспособных бактерий.
В результате авторами изобретения было показано, что экструзия исходных материалов с живыми пробиотическими бактериями при различных температурах и условиях сдвига приводила к экструдированным продуктам, содержащим нереплицирующиеся пробиотические микроорганизмы, обладающие иммуностимулирующим действием. Согласно сведениям авторов, о способе применения экструзии для образования нежизнеспособных нереплицирующиеся пробиотиков, которые, тем не менее, являются способными активировать иммунную систему, никогда ранее не сообщалось. Данный принцип может быть распространен на любые пробиотические бактерии или молочные закваски и любые температуры или условия экструзии. Таким образом, данное изобретение описывает новый способ получения нереплицирующихся пробиотиков, которые обладают полезными для здоровья свойствами, и приводит к новым концепциям экструдированных продуктов. В частности, настоящее изобретение также описывает новый способ образования нереплицирующихся пробиотиков, которые демонстрируют улучшенные или вновь приобретенные иммуностимулирующие качества.
Реферат
Изобретение относится к композиции замороженного йогурта для укрепления иммунной системы и/или с противовоспалительным действием. Композиция содержит нереплицирующиеся пробиотические микроорганизмы в количестве от около 10до 10КОЕ на одну порцию, в которой нереплицирующиеся пробиотические микроорганизмы приведены в нереплицирующееся состояние тепловой обработкой при 71,5-150ºС в течение 1-120 с. Изобретение обеспечивает получение композиций, обладающих новыми и улучшенными противовоспалительными и иммуногенными свойствами по сравнению с исходными живыми штаммами. 12 з.п. ф-лы, 18 ил., 2 табл., 5 пр.

Комментарии