Лактозонегативные штаммы lactobacillus helveticus, способные образовывать гипотензивные трипептиды ipp и vpp, и способ их получения, применение штаммов для получения кисломолочного продукта, кисломолочный продукт и способ его получения - RU2422509C2
Код документа: RU2422509C2
Чертежи
Описание
Настоящее изобретение относится к новым штаммам Lactobacillus helveticus, а также к их применению в сельском хозяйстве и пищевой промышленности. Более конкретно, настоящее изобретение относится к штаммам Lactobacillus helveticus, обладающим лактозонегативным фенотипом. Настоящее изобретение также относится к способу получения штаммов Lactobacillus helveticus.
Гипертонией страдает значительная часть населения. Применение пептида ВПП (Вал Про Про) и пептидов, содержащих последовательность ВПП, в качестве средств, способных снижать артериальное давление путем ингибирования ангиотензин-превращающего фермента (АСЕ), было описано в ЕР 0583074. В литературе описан также аналогичный эффект трипептида ИПП (Иле Про Про). Эти пептиды ингибируют АСЕ, блокируя его активный центр, тем самым не позволяют ему активизировать ангиотензин.
Известно, что эти две последовательности ВПП и ИПП присутствуют в бычьем бета-казеине и что надлежащий гидролиз этого казеина (или в более общем случае содержащего казеин молока) позволяет получить вышеназванные трипептиды. Многочисленные исследования на животных и на человеке показали, что ежедневное потребление нескольких миллиграммов этих трипептидов позволяет существенно снизить артериальное давление, в частности, у индивидуумов, страдающих гипертензией, уменьшая также риск инсультов и инфарктов.
Пептиды, полученные из молока, ферментированного Lactobacillus helveticus, показали свое ингибирующее действие на АСЕ (ACEI) in vivo; эти пептиды были обнаружены в крови, отобранной на уровне аорты, у крыс, участвовавших в исследовании (Masuda О. et al., 1996. J. Nutr. 126, 3063-8). Другие исследования также более конкретно показали снижение артериального давления у страдающих гипертензией крыс после приема внутрь пептидов, полученных из молока, которое было ферментировано L. helveticus (Yamamoto N. et al., 1994. Biosci. Biotech. Biochem. 58, 776-8).
У человека это же ферментированное молоко также позволило снизить систолическое артериальное давление (Hata et al.; 1996. Am. J. Clin. Nutr., 64, 767-71). Проведенное позднее исследование подтверждает, что пептиды, присутствующие в продукте AMEAL S ®, который выпускается компанией CALPIS, значительно снижают артериальное давление у лиц, артериальное давление которых выше нормы (Mizuno et al. 2005. British Journal of Nutrition; vol 94, issue 1, 84-91). Однако в другом недавно проведенном исследовании (Jauhiainen et al.; 2005. Am. J. of Hypertension, 18: 1600-1605) высказана гипотеза, согласно которой механизм действия (ингибирование АСЕ), упоминаемый выше для объяснения гипотензивного эффекта молока, ферментированного L. helveticus, у человека может не являться основным механизмом действия.
Подавляющее большинство Lactobacillus helveticus способно производить трипептиды ИПП и ВПП при ферментировании молока, но количество полученных пептидов может различаться. ЕР 1 016 709 описывает способ производства трипептидов ВПП и ИРР путем ферментирования молока с помощью штаммов специфических молочнокислых бактерий, принадлежащих к роду Lactobacillus helveticus. Но полученный таким образом продукт (ферментированное молоко) содержит очень большое количество молочной кислоты и в этой связи является неприемлемо кислым с органолептической и вкусовой точки зрения. Кроме того, встает проблема последующего закисления: даже если ферментирование было остановлено (классическим способом - охлаждением) на органолептически приемлемом уровне рН (рН>4), закисление продолжается на холоде вследствие свойств, присущих Lactobacillus helveticus. Это приводит к снижению рН продукта, который также становится неприемлемым для потребления.
Во избежание последующего закисления можно остановить ферментирование на приемлемом уровне рН, мгновенно убив штамм термической обработкой (пастеризация, термическая обработка): при этом последующее закисление отсутствует (кислотность продукта не изменяется при хранении). К сожалению, в результате преждевременного прекращения ферментирования количество трипептидов оказывается сниженным. Поэтому в полученных таким образом продуктах содержится небольшое количество ИПП и ВПП. Можно также ферментировать молоко тем же штаммом до того момента, когда будет достигнута максимальная концентрация трипептидов. В этом случае большое количество образующейся одновременно молочной кислоты должно быть удалено сложным и дорогостоящим многоступенчатым способом. Кроме того, этот способ не является «естественным», поскольку он предусматривает стадии разделения. Поэтому такой способ не адаптирован к производству в промышленном масштабе.
Настоящее изобретение предлагает решения технологических проблем. В частности, настоящее изобретение предлагает штаммы Lactobacillus helveticus, позволяющие готовить пищевые продукты, а именно кисломолочные продукты, обладающие многочисленными предпочтительными свойствами:
- кислотность молочных продуктов по изобретению прекрасно регулируется не только в конце ферментирования, но и при хранении. В частности, они не подвержены последующему закислению. Таким образом, молочные продукты по изобретению обладают очень хорошими органолептическими качествами;
- молочные продукты по изобретению готовы к непосредственному употреблению как пробиотики, то есть содержат значительное количество живых бактерий, что никоим образом не влияет на их вкусовые качества, в частности, не влияет на их кислотность;
- получение продуктов по изобретению не требует ни стадии термической обработки, ни комплексной стадии очистки. Способы по изобретению также несложно внедрить на установках классического молокозавода без значительной переделки оборудования. Наряду с этим, способы по изобретению являются полностью естественными;
- пищевые продукты, более конкретно, молочные продукты по изобретению могут содержать большие количества трипептидов ВПП и ИПП при повышенном соотношении (ИПП+ВПП)/(молочная кислота). Эти результаты можно получить без стадии предварительной очистки или концентрации;
- пищевые продукты, более конкретно, молочные продукты по изобретению предпочтительно содержат большую биомассу (т.е. имеют значительную концентрацию живых микроорганизмов).
В контексте настоящего изобретения под штаммом понимают всякую культуру микроорганизма, обычно чистую, полученную из одной клетки или изолированной колонии.
Под вариантом или мутантом штамма Х в контексте настоящего изобретения понимают любой штамм, полученный из референтного штамма X. В частности, в настоящем контексте будут использоваться термины «вариант» для обозначения штамма, полученного главным образом путем мутации и селекции из референтного штамма X, и «мутант» для обозначения более конкретно штамма, полученного методами неспецифического или направленного мутагенеза (например, генетической трансформации с помощью векторов) применительно к штамму X.
Разумеется, что на мутанты или варианты штаммов по настоящему изобретению будет распространяться защита, предусматриваемая этим патентом, с того момента, когда они будут сохранять основные аспекты изобретения, в частности фенотип лактозонегативный.
Под штаммом с лактозонегативным фенотипом понимают любой штамм, неспособный метаболизировать лактозу в молочную кислоту.
Под штаммом с фруктозонегативным фенотипом понимают любой штамм, неспособный метаболизировать фруктозу.
Под молочной средой понимают любую среду, содержащую молочные белки, например, коровье молоко с содержанием белков 4%, нормализованное сухим коровьим молоком (обезжиренным или нет) или концентрированным молоком.
В контексте настоящего изобретения под молочным продуктом понимают помимо молока любой продукт, получаемый из молока, например, сливки, сливочное мороженое, сливочное масло, сыр, йогурт, ферментированное молоко; вторичные продуты, такие как молочная сыворотка, казеин, а также различные полученные пищевые продукты, включающие молоко или компоненты молока в качестве основного ингредиента. В числе молочных продуктов, кисломолочные продукты включают помимо прочих йогурт, ферментированные молочные продукты, творог, кефир, сыры, пробиотические молочные продукты и, в общем, любой молочный продукт, который был подвергнут, по меньшей мере, одной стадии ферментирования. Вышеупомянутое молоко обычно является коровьим молоком, но также может быть молоком других млекопитающих, таких как коза, овца, кобыла, верблюдица, буйволица.
В контексте настоящего изобретения под пищевым продуктом понимают любой продукт, предназначенный для питания человека или животных. В частности, пищевые продукты включают продукты, предназначенные для кормления грудных детей, детей, подростков и взрослых. Пищевые продукты по изобретению могут состоять полностью или частично, по меньшей мере, из одного кисломолочного продукта по изобретению. Пищевые продукты по изобретению могут также содержать другие ингредиенты, обычно используемые в сельском хозяйстве и пищевой промышленности, такие как добавки, консерванты, фрукты или плодово-ягодные экстракты, ароматизаторы, красители, улучшители консистенции, злаки, кусочки шоколада и тому подобное.
В контексте настоящего изобретения под закваской понимают любую композицию, содержащую, по меньшей мере, один живой штамм микроорганизма, способного ферментировать данную среду. В числе заквасок, молочными заквасками являются композиции, содержащие, по меньшей мере, один живой штамм микроорганизма, способного ферментировать молочную среду.
По способу осуществления настоящее изобретение относится к штамму Lactobacillus helveticus, не обладающему способностью превращать лактозу в молочную кислоту. Настоящее изобретение также относится к штамму Lactobacillus helveticus, не обладающему способностью превращать лактозу в молочную кислоту и имеющему, по меньшей мере, одну мутацию в лактозном опероне.
По способу осуществления вышеназванная мутация в лактозном опероне является точечной мутацией, вводящей терминирующий кодон. По более предпочтительному способу осуществления вышеназванная точечная мутация, вводящая терминирующий кодон, располагается в гене lacL лактозного оперона. Под точечной мутацией понимают любое замещение нуклеотида, произошедшее в последовательности нуклеотидов по сравнению с последовательностью, называемой «диким типом». Специалист умеет идентифицировать терминирующий кодон (который также называют бессмысленным кодоном), который применительно к мРНК обычно соответствует одному из триплетов: УАА, УАГ, УГА.
Таким образом, штаммы Lactobacillus helveticus по изобретению не обладают способностью разлагать лактозу (отсутствует превращение лактозы в молочную кислоту). Действительно, штаммы по изобретению обладают фенотипом «лактозонегативный». Зато они способны расти в присутствии глюкозы как источника углерода (ферментирование глюкозы с образованием молочной кислоты) и метаболизировать некоторые компоненты молока, в частности, белки.
Таким образом, штаммы по изобретению позволяют проводить ферментирование предпочтительно при полностью контролируемом уровне рН: конечный уровень рН после ферментирования можно успешно контролировать в зависимости от количества глюкозы, которое первоначально содержалось в ферментационной среде. Это следует из того факта, что из определенного количества глюкозы, почти по принципу стехиометрии, получается такое же количество молочной кислоты. Кроме того, применение штаммов по изобретению позволяет избежать явления последующего закисления. Так, благодаря штаммам по изобретению, имеется возможность получать пищевые продукты, которые, в частности, обладают удовлетворительными органолептическими качествами.
Предпочтительно, по способу осуществления штаммы Lactobacillus helveticus по изобретению являются такими, что молочная среда с общим содержанием белка 4,0%, содержащая 1,0% глюкозы (по массе), ферментируемая вышеназванными штаммами Lactobacillus helveticus в течение максимального периода ферментирования продолжительностью 30 часов, при температуре от 30 до 45°C, имеет уровень рН, выше или равный 4,0; предпочтительно выше или равный 4,1; предпочтительно выше или равный 4,2; предпочтительно выше или равный 4,3; предпочтительно выше или равный 4,5.
Следовательно, это преимущество особенно ярко выражено у штаммов Lactobacillus helveticus, продуцирующих повышенное количество трипептидов ИПП и/или ВПП, и нет никакой необходимости искать компромисс между:
образованием большого количества трипептидов во время ферментирования (что требует максимально возможного удлинения периода ферментирования) и
приемлемыми органолептическими качествами (что требует ограничения закисления, и, следовательно, не только максимально возможного укорочения периода ферментирования для ограничения образования молочной кислоты при ферментировании, но и проведения термической обработки/пастеризации с целью предотвращения явления последующего закисления).
Действительно, предпочтительно по настоящему изобретению то, что образование трипептидов ВПП и/или ИПП и образование молочной кислоты частично разделены: образование молочной кислоты является лишь функцией количества глюкозы, первоначально присутствующего в ферментационной среде, и больше не является функцией времени ферментирования.
Простой способ выражения концентрации трипептидов состоит в ее выражении в виде концентрации, эквивалентной ВПП [ВППэкв].
Ее выражают в мг/кг: [ВППэкв]=[ВПП]+(9/5×[ИПП])
Следовательно, согласно одному аспекту, штаммы Lactobacillus helveticus по изобретению обладают предпочтительной способностью при ферментировании производить трипептиды с последовательностью ИПП и/или ВПП в количестве, по меньшей мере, 25 мг, предпочтительно, по меньшей мере, 30 мг, предпочтительно, по меньшей мере, 35 мг, предпочтительно, по меньшей мере, 40 мг, предпочтительно, по меньшей мере, 45 мг, предпочтительно, по меньшей мере, 50 мг, предпочтительно по меньшей мере, 55 мг, предпочтительно, по меньшей мере, 60 мг, предпочтительно, по меньшей мере, 65 мг, предпочтительно, по меньшей мере, 70 мг, предпочтительно, по меньшей мере, 75 мг, более предпочтительно, по меньшей мере, 80 мг ВППэкв на кг ферментируемого продукта. Такие количества ВПП и/или ИПП обычно получаются при ферментировании штаммом по изобретению при температуре от 30 до 45°C, предпочтительно от 31 до 44°C, предпочтительно от 32 до 43°C, предпочтительно от 33 до 42°C, предпочтительно от 34 до 41°C, предпочтительно от 35 до 40°C, и более предпочтительно при 37°C, молочной среды, содержащей глюкозу в количестве более 3% (по массе), с общим содержанием белка, выше или равным 2% (по массе), предпочтительно от 2 до 10% (по массе), более предпочтительно от 2,5 до 6% (по массе) и наиболее предпочтительно равным 4% (по массе).
Согласно другому аспекту, штаммы Lactobacillus helveticus по изобретению обладают также фенотипом фруктозонегативный. В частности, наиболее предпочтительным является сочетание фенотипов «лактозонегативный» и «фруктозонегативный». Действительно, фруктоза обладает выраженным сладким вкусом и является полезным ингредиентом в пищевых продуктах. Таким образом, если фруктоза не разлагается штаммом Lactobacillus helveticus, пищевой продукт сохраняет превосходные органолептические качества. Кроме того, штамм, одновременно «лактозонегативный» и «фруктозонегативный», может расти только в среде, содержащей глюкозу. Следовательно, конечный уровень рН предпочтительно будет лучше контролироваться в том случае, если пищевой продукт содержит заготовку из фруктов, в частности, кусочки фруктов и/или фруктовый сок. По способу осуществления штамм по изобретению выбирается из:
I-3504 депонированного в CNCM (Национальная коллекция культур микроорганизмов) 14.10.05;
I-3505 депонированного в CNCM 14.10.05;
I-3508 депонированного в CNCM 14.10.05;
и варианты или мутанты штаммов, полученные от штаммов, перечисленных выше.
Согласно другому аспекту, настоящее изобретение относится к применению штамма Lactobacillus helveticus по изобретению для получения пищевого продукта или фармацевтического продукта, в частности кисломолочного продукта.
Предпочтительно, согласно другому аспекту изобретения, вышеупомянутый пищевой продукт или фармацевтический продукт обладает антигипертензивными свойствами.
Настоящее изобретение также относится к продукту питания, в частности, к кисломолочному продукту, содержащему, по меньшей мере, один штамм Lactobacillus helveticus по изобретению.
Предпочтительно, согласно другому аспекту, вышеназванный пищевой продукт содержит, по меньшей мере, 106, предпочтительно, по меньшей мере, 107, предпочтительно, по меньшей мере, 108 КОЕ/мл живых бактерий Lactobacillus helveticus. Следовательно, пищевой продукт по изообретению содержит значительную биомассу.
Согласно другому аспекту, вышеназванный пищевой продукт содержит, по меньшей мере, 25 мг, предпочтительно, по меньшей мере, 30 мг, предпочтительно, по меньшей мере, 35 мг, предпочтительно, по меньшей мере, 40 мг, предпочтительно, по меньшей мере, 45 мг, предпочтительно, по меньшей мере, 50 мг, предпочтительно, по меньшей мере, 55 мг, предпочтительно, по меньшей мере, 60 мг, предпочтительно, по меньшей мере, 65 мг, предпочтительно, по меньшей мере, 70 мг, предпочтительно, по меньшей мере, 75 мг, более предпочтительно, по меньшей мере, 80 мг ВППэкв на кг пищевого продукта.
Согласно другому аспекту, пищевой продукт по изообретению содержит также включения из фруктов, в частности, кусочки фруктов и/или фруктовый сок.
Согласно другому аспекту, уровень рН пищевого продукта по изообретению выше или равен 3,85; предпочтительно выше или равен 3,90; предпочтительно выше или равен 3,95; предпочтительно выше или равен 4,00; предпочтительно выше или равен 4,05; предпочтительно выше или равен 4,10; предпочтительно выше или равен 4,15; более предпочтительно выше или равен 4,20.
Предпочтительно, согласно другому аспекту, пищевой продукт по изобретению обладает антигипертензивными свойствами.
Согласно другому аспекту, настоящее изобретение относится к способу получения пищевого продукта.
Согласно другому аспекту, вышеназванный способ включает следующие стадии:
- выбрать сырье, содержащее молочные белки, более конкретно, белки, содержащие пептидные последовательности ИПП и/или ВПП. Это может быть, например, молоко, содержащее 2-10% общего белка (по массе);
- выбрать, по меньшей мере, один штамм Lactobacillus helveticus по изообретению,
- засеять вышеназванное сырье вышепоименованным штаммом;
- ферментировать вышеназванное сырье в присутствии 1-3% глюкозы (по массе) в течение 12-30 часов при 30-45°C и в присутствии вышепоименованного штамма.
Согласно другому аспекту, способ по изообретению предпочтительно исключает любую стадию термической обработки после ферментирования. Это позволяет сохранить живые бактерии в пищевом продукте (пробиотике).
Согласно другому аспекту, настоящее изобретение относится к применению стрептозотоцина для получения штаммов Lactobacillus helveticus, обладающих фенотипом «лактозонегативный».
Настоящее изобретение предоставляет также способ получения таких штаммов Lactobacillus helveticus.
Согласно другому аспекту, вышеназванный способ получения штаммов Lactobacillus helveticus, обладающих фенотипом «лактозонегативный», включает следующие стадии:
- взять, по меньшей мере, один штамм Lactobacillus helveticus;
- привести в соприкосновение по меньшей один штамм вышеназванной бактерии с действенным количеством стрептозотоцина в присутствии лактозы;
- изолировать колонию или колонии фенотипа «лактозонегативный».
Действительно, популяция клеток Lactobacillus helveticus, способных выжить в присутствии стрептозотоцина, предпочтительно очень сильно обогащена клетками «лактозонегативный».
Согласно другому аспекту, к вышеназванному способу получения штаммов по изобретению добавлена стадия колориметрического анализа на среде, содержащей Xgal, и/или Sgal, и/или любое другое соединение, связанное с галактозой β-галактозной связью, которое можно обнаружить после разрыва этой связи под действием микроорганизма. Для проведения этого анализа можно также добавить ИПТГ (изопропил-бета-D-тиогалактопиранозид), поскольку это соединение будет действовать как индуктор переносчика лактозы или как индуктор применения лактозы микроорганизмом.
В качестве примера вышеупомянутый способ можно осуществлять следующим образом:
- 1-й пересев исходных штаммов Lactobacillus helveticus (материнские штаммы) в нейтральный бульон MRS (Ман Рогоза Шарп), на ночь при 35-40°C;
- 2-й пересев в нейтральный бульон MRS;
- инкубация до получения достаточной биомассы, например, в течение 10-30 часов при 35-40°C;
- посев в MRS, который содержит лактозу в концентрации, позволяющей получить достаточную биомассу, например 2-7% (по массе); инкубация с отслеживанием изменений оптической плотности при 580 нм;
- свежеполученный стрептозотоцин добавляют во время ферментирования в таком количестве, чтобы получить конечную концентрацию, обладающую бактерицидным действием на конкретный штамм. Эта концентрация зависти от штамма;
- после инкубации при 35-40°C культуры дважды промывают триптоновой солью;
- остаток растворяют в триптоновой соли, затем помещают в нейтральный бульон MRS и возобновляют культуру;
- инкубация при 35-40°C до роста штамма;
- изоляты получают на нейтральном MRS+Xgal+ИПТГ, затем инкубируют при 35-40°C в атмосфере СO2. Этот стадия представляет собой колориметрический тест, позволяющий определить, является ли бактериальный штамм штаммом «лактозопозитивный» или «лактозонегативный»: если штамм способен использовать лактозу как источник углерода, будет образовываться вещество голубого цвета, и колония будет окрашена в голубой цвет, в противном случае (штамм «лактозонегативный») она будет белой;
- белые колонии пересевают в нейтральный MRS и инкубируют при 35-40°C;
- более подробно изобретение будет описано на следующих примерах, не являющихся ограничивающими.
Пример 1: Получение штаммов, обладающих фенотипом «лактозонегативный»
Материалы и методы
Исходные штаммы (так называемые «материнские» штаммы)
I-3431 депонированный в CNCM 25.05.05
I-3434 депонированный в CNCM 25.05.05
I-3435 депонированный в CNCM 25.05.05
Тест на чувствительность к стрептозотоцину
Сначала проверяют, чувствительны ли материнские штаммы к используемому антибиотику, стрептозотоцину. Культуры выращивают при 42°C в нейтральном бульоне MRS (Ман Рогоза Шарп) до 0,1 оптической плотности при 580 нм, после чего в пробирку добавляют стрептозотоцин до конечной концентрации 50 мкг/мл (например, 100 мкл раствора с концентрацией 5 мг/мл на 10 мл среды).
Селекция штаммов «лактозонегативный»
Для получения лактозонегативных штаммов Lactobacillus helveticus выполняют следующие стадии:
- 1-й пересев исходных штаммов Lactobacillus helveticus (материнские штаммы) из ампул с рабочим бактериальным штаммом в нейтральный бульон MRS, на ночь при 37°C;
- 2-й пересев из расчета 1% в нейтральный бульон MRS;
- инкубация в течение 16 часов при 37°C;
- посев в 10 мл бульона MRS, содержащего 5% лактозы (по массе), из расчета 1% и инкубация при 40°C с отслеживанием изменений оптической плотности при 580 нм;
- свежеполученный стрептозотоцин добавляют после 2 ч 15 мин или 4 часов ферментирования так, чтобы получить конечную концентрацию 50 мкг/мл;
- после 7 ч 30 мин инкубации при 40°C культуры дважды промывают триптоновой солью;
- остаток растворяют в 2 мл триптоновой соли, затем засевают нейтральный бульон MRS из расчета 10%;
- инкубация при 37°C до роста штамма;
- изоляты получают на нейтральном MRS+Xgal+IPTG, затем инкубируют при 37°C в атмосфере СО2. Эта стадия представляет собой колориметрический тест, позволяющий определить, является ли бактериальный штамм штаммом лактозопозитивным или лактозонегативным: если штамм способен использовать лактозу как источник углерода, будет образовываться вещество голубого цвета, и колония будет окрашена в голубой цвет, в противном случае (лактозонегативный штамм) она будет белой;
- белые колонии пересевают на нейтральный MRS и инкубируют при 37°C.
Результаты
Описанный выше способ позволил получить следующие штаммы, обладающие лактозонегативным фенотипом, которые были депонированы в CNCM (Национальная коллекция культур микроорганизмов), Франция, 75724, Париж, ул. Доктора Ру, 28, в соответствии с положениями Будапештского договора:
I-3504 депонированный в CNCM 14.10.05; полученный из материнского штамма I-3431
I-3505 депонированный в CNCM 14.10.05; полученный из материнского штамма I-3434
I-3508 депонированный в CNCM 14.10.05; полученный из материнского штамма I-3435
Лактозонегативный фенотип полученных штаммов снова подтверждается на агаровой среде: нейтральный MRS + Xgal + ИПТГ (цветовой тест, называемый «бело-голубой тест»).
Пример 2: Штаммы, обладающие лактозонегативным фенотипом
Штамм I-3504, депонированный в CNCM (Национальная коллекция культур микроорганизмов), Франция, 75724, Париж, ул. Доктора Ру, 28, 14.10.05, в соответствии с положениями Будапештского договора, является штаммом Lactobacillus helveticus, обладающим следующими свойствами:
- лактозонегативный, фруктозонегативный,
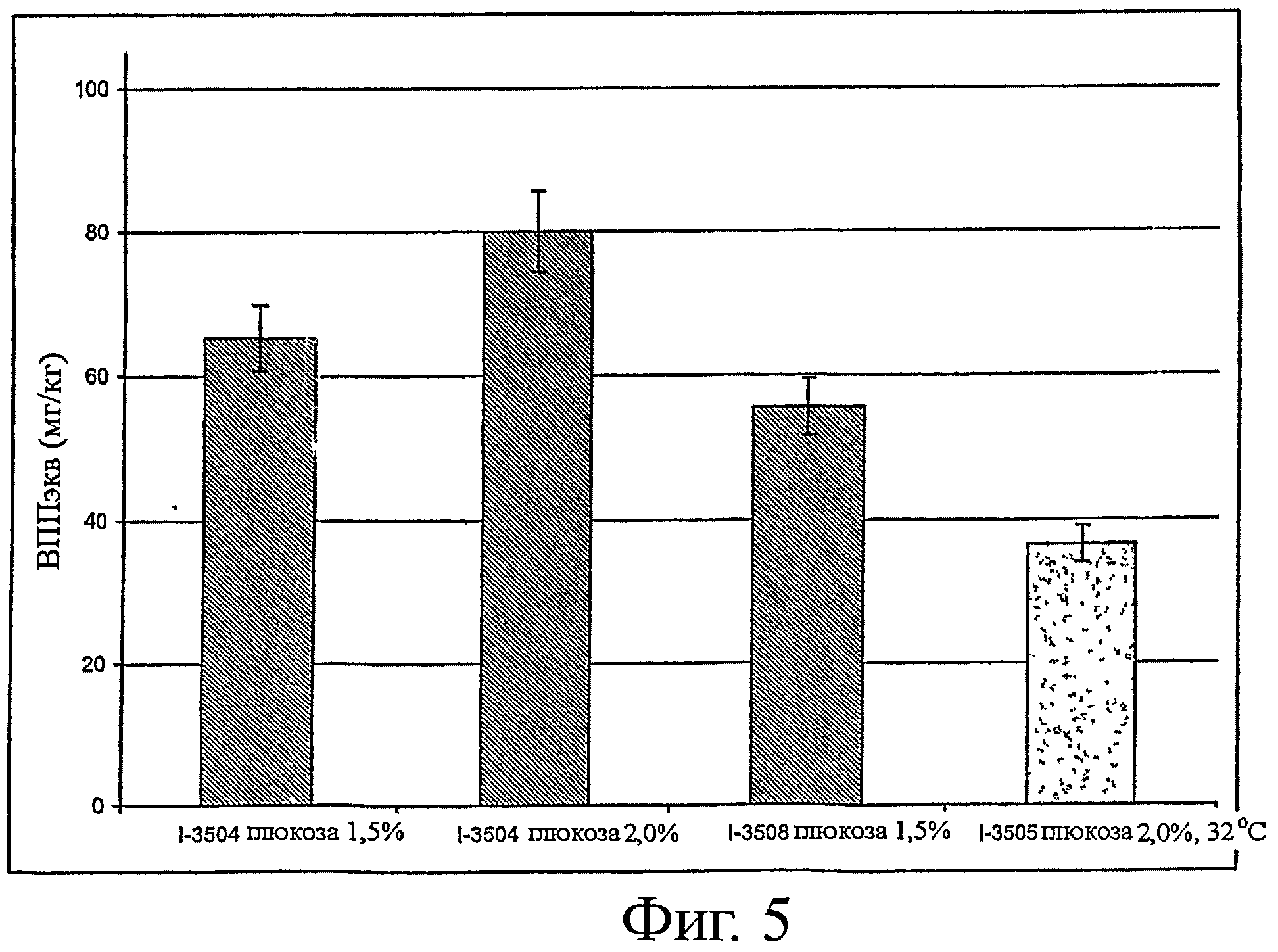
- выработка ИПП и ВПП: см. фигуры 4 и 5,
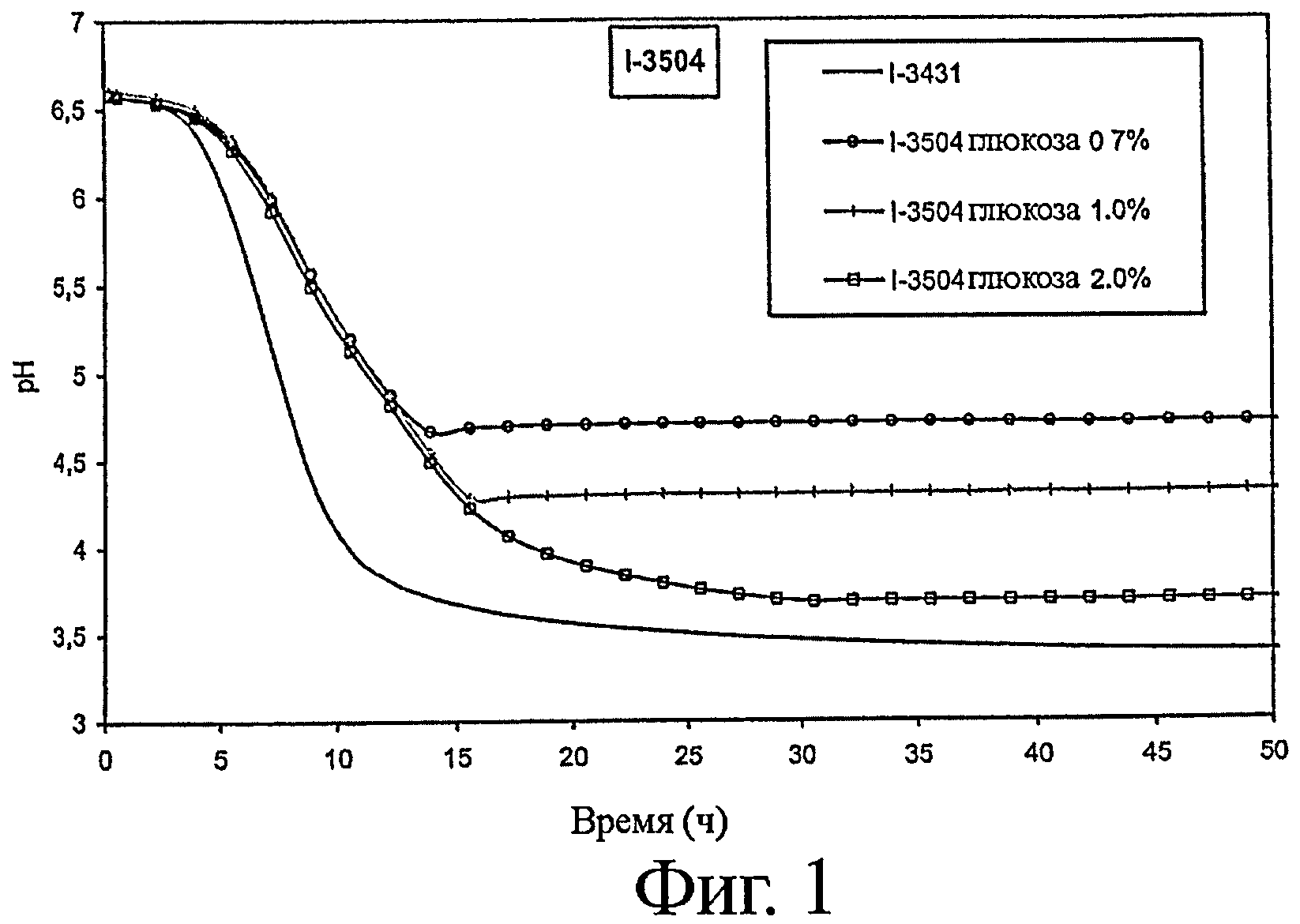
- закисление среды: см. фигуру 1,
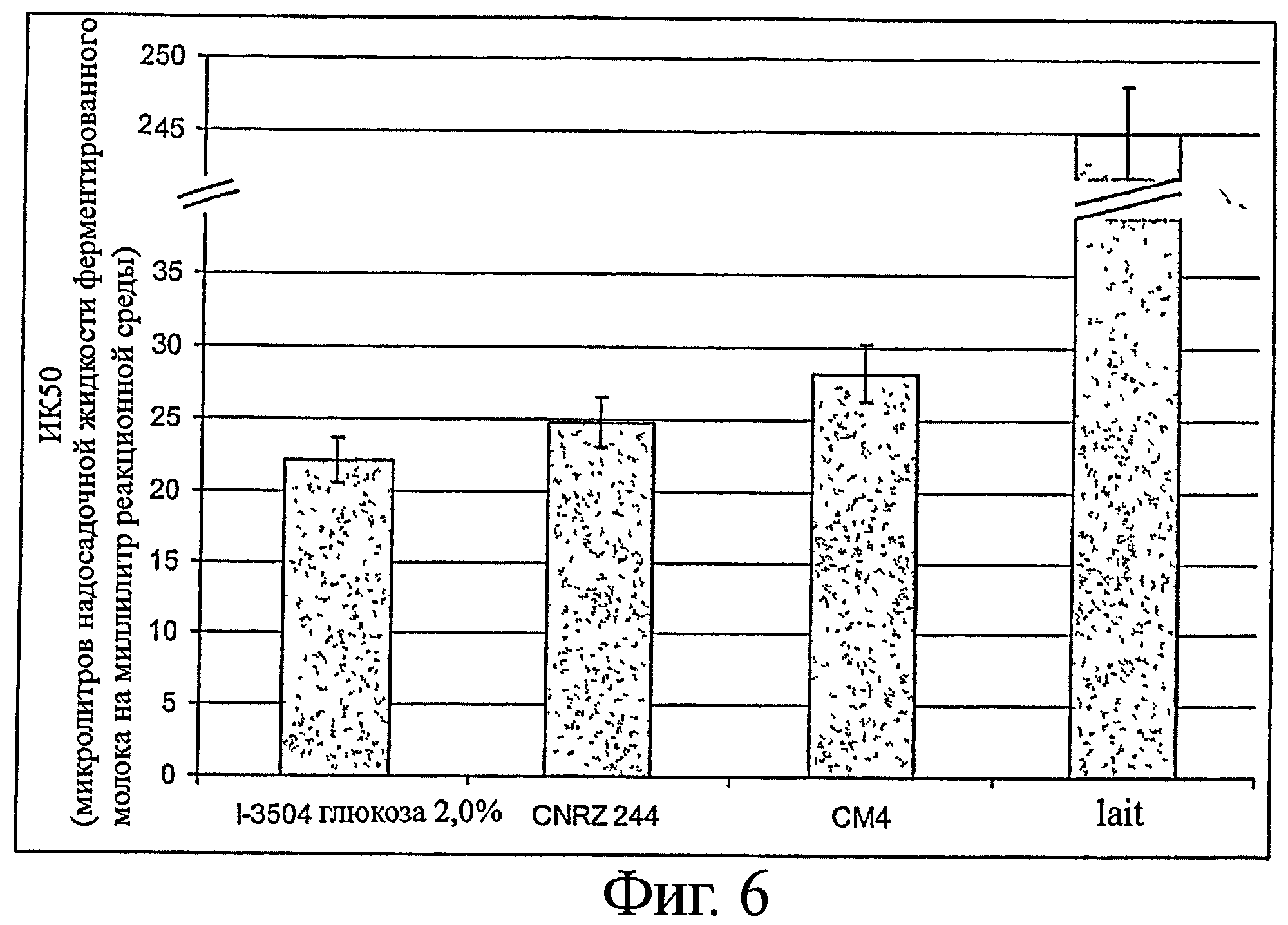
- ингибирование АСЕ: см. фигуру 6.
Штамм I-3505, депонированный в CNCM (Национальная коллекция культур микроорганизмов), Франция, 75724, Париж, ул. Доктора Ру, 28, 14.10.05, в соответствии с положениями Будапештского договора, является штаммом Lactobacillus helveticus, обладающим следующими свойствами:
- лактозонегативный, фруктозонегативный,
- выработка ИПП и ВПП: см. фигуру 5,
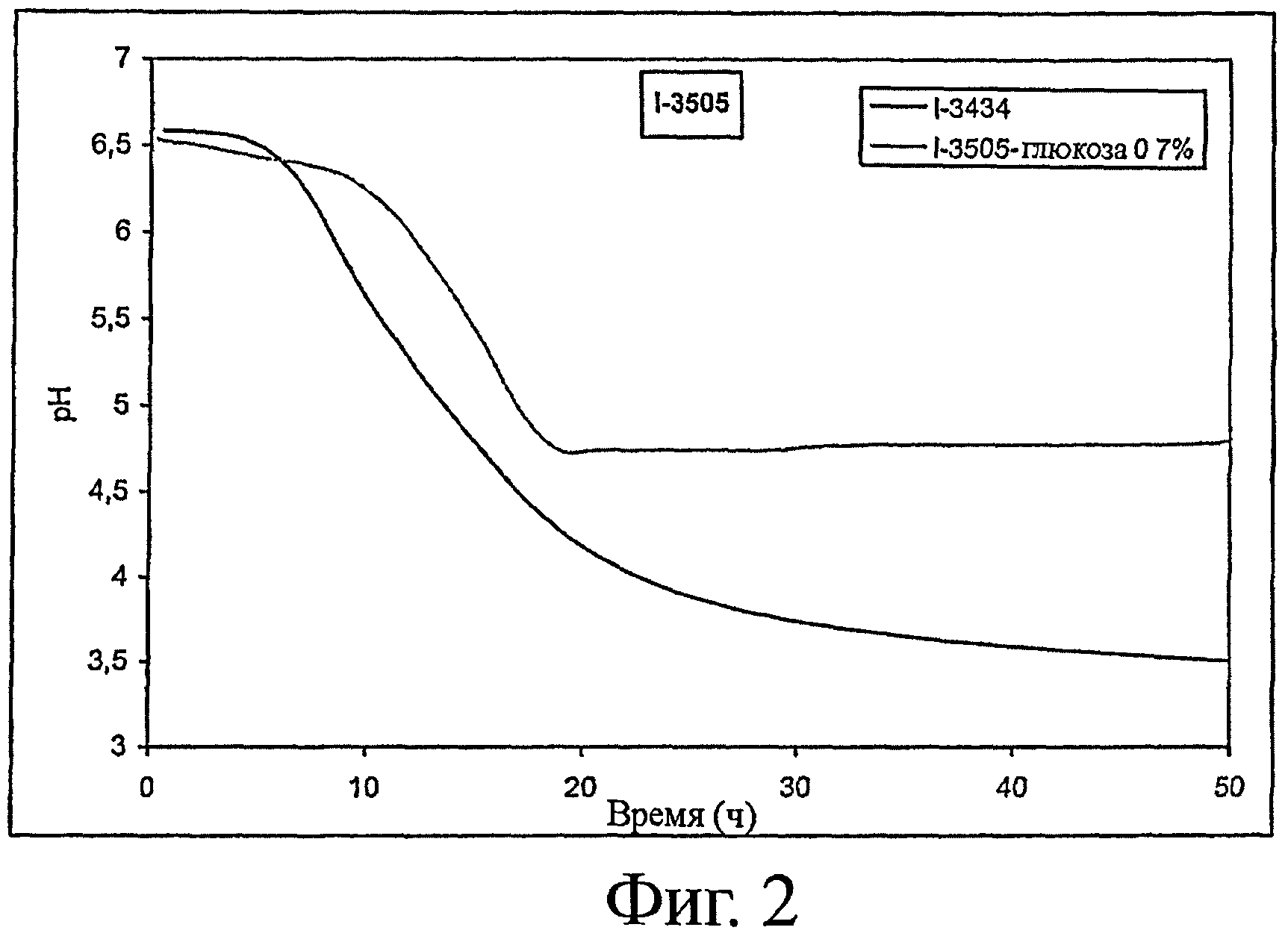
- закисление среды: см. фигуру 2.
Штамм I-3508, депонированный в CNCM (Национальная коллекция культур микроорганизмов), Франция, 75724, Париж, ул. Доктора Ру, 28, 14.10.05, в соответствии с положениями Будапештского договора, является штаммом Lactobacillus helveticus, обладающим следующими свойствами:
- лактозонегативный, фруктозонегативный,
- выработка ИПП и ВПП: см. фигуру 5,
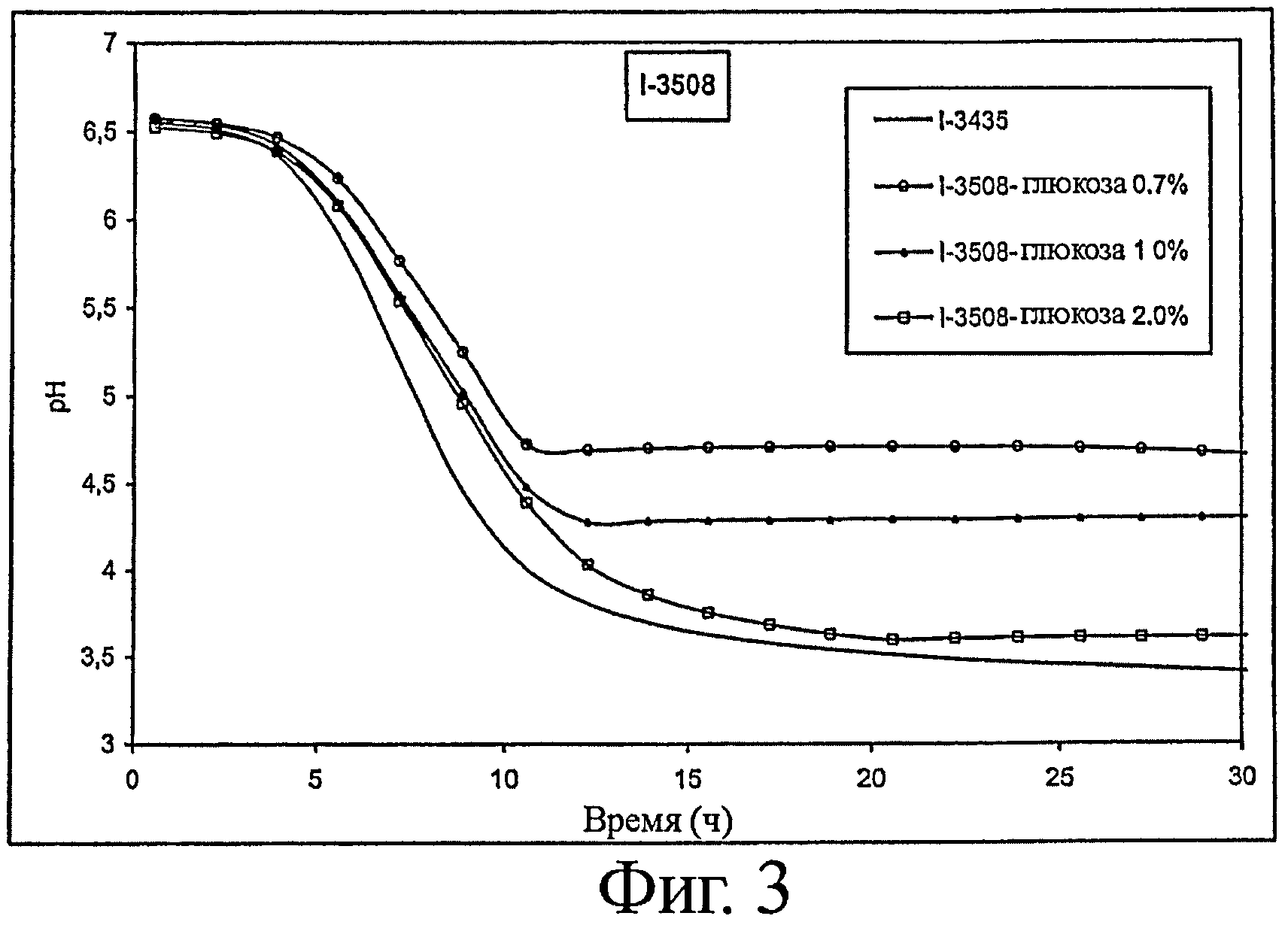
- закисление среды: см. фигуру 3.
1. Определение способности к закислению различных вариантов штаммов
Способность к закислению оценивается следующим образом.
Среду, содержащую 120 г обезжиренного сухого молока, растворенного в 930 мл воды, пастеризуют в течение 10 мин при 95°C. Эту среду засевают из расчета 0,5% и инкубируют при 37°C в присутствии различных концентраций глюкозы. (Сокращение Gx указывает на концентрацию глюкозы х% (по массе) в среде до ферментирования). Для различных штаммов определяют рН как функцию времени. Образец ферментируемой среды, отобранный после 30 часов ферментирования, будет использоваться для оценки выработки трипептидов ИПП и ВПП, а также для оценки активности ACEI, результаты которых будут приведены ниже.
Для штамма I-3504 также представлены результаты по материнскому штамму (I-3431, штамм лактозопозитивный) (см. фигуру 1).
Для штамма I-3505 также представлены результаты по материнскому штамму (I-3434. лактозопозитивный штамм) (см. фигуру 2).
Для штамма I-3508 также представлены результаты по материнскому штамму (I-3435. лактозопозитивный штамм) (см. фигуру 3).
Результаты, представленные на фигурах 1-3, показывают, что штаммы по изообретению предпочтительно позволяют тонко регулировать рН в конце ферментирования в зависимости от количества глюкозы, первоначально присутствовавшего в среде. К тому же, ферментирование с помощью лактозонегативных штаммов предпочтительно приводит к более высокому уровню рН, который позволит получать продукты с приемлемыми органолептическими свойствами.
2. Измерение выработки трипептидов ИПП и ВПП
Материалы и методы
Для выполнения этих измерений используется образец молочной среды, отобранный через 30 часов ферментирования, так, как описано выше в пункте 1.
Анализ количества содержащихся пептидов, в частности, трипептидов ИПП и ВПП, проводился с помощью метода жидкостной хроматографии (ВЭЖХ) с применением детектора типа МС/МС как описано ниже:
- учитывая интерференцию, свойственную для анализа сложных образцов, настоятельно рекомендуется применение дейтерированных внутренних стандартов, которые добавляются в известном количестве, которое фиксируется в момент получения образца;
- получение образца выполняется путем разведения ферментированной среды в смеси воды, метанола и трифторуксусной кислоты (50/50/0,1%), содержащей 25 ppm внутреннего стандарта дейтерированного ВПП (обозначаемого в дальнейшем ВППд, имеющего формулу H-Val [D8]-Pro-Pro-OH, с молярной массой = 319,45 г/моль, производства Bachem Chemicals, Франция) и 10 ppm внутреннего стандарта дейтерированного ИПП (обозначаемого в дальнейшем ИППд, имеющего формулу H-Ile [D10 N15]-Pro-Pro-OH, с молярной массой = 336,2 г/моль, имеющегося в наличии в компании NEOMPS производства SNPE, Франция, 67100, Страсбург, ул. де Булонь, 7) в соотношении от 1 до 3 (например, точную навеску образца 600 мг в микропробирке типа «эппендорф» разводят в 1200 мг смеси вода-метанол-ТФУК, содержащей внутренние стандарты);
- затем этот разведенный образец центрифугируют при 14000 g в течение 15 минут. Полученную прозрачную надосадочную жидкость, содержащую пептиды, которые образовались при ферментировании, затем разводят смесью воды и метанола (50/50, по объему), содержащей 0,1% трифторуксусной кислоты, точно в соотношении 1/50;
- после этого, раствор, полученный посредством такого разведения, анализируют в хроматографической системе ВЭЖХ типа Agilent 1100 (компания Agilent Technologies, Франция, 91745, Масси, ул. Гальвани, 1), оснащенной колонкой, адаптированной для анализа пептидов, типа Waters Biosuite® (3 мм 2,1 × 150 мм, С18 РА-А, WAT186002427, Waters France, Франция, 78280, Гийанкур, ул. Жака Моно, 5) при температуре 50°C, со скоростью 0,25 мл/мин. Пептиды элюируют классическим способом с увеличением градиента концентрации растворителя В (ацетонитрил + 0,100% муравьиной кислоты) в растворителе А (вода + 0,106% муравьиной кислоты), в течение от 35 мин до 2 часов в зависимости от желаемого хроматографического разрешения. В методе, адаптированном для количественного определения пептидов ИПП и ВПП, используется следующий градиент:
- определение проводится с помощью детектора типа МС/МС, например, с помощью прибора с ионным уловителем, таким как Esquire3000+ (Broker Daltonique, 67166, Виссембург, ул. де Индустри), параметризованным ионизацией электрораспылением в режиме определения положительных ионов, либо для анализа общего количества пептидов (режим МС-МС), либо для точного и специфичного количественного определения одного пептида на основании характерных фрагментов (режим МРМ). При определении содержания пептидов ИПП и ВПП, а также внутренних стандартов ИППд и ВППд, эти пептиды различают по удельной массе (однозарядные ионы 312,2 Да для ВПП; 326,2 Да для ИПП; 320,2 Да для ВППд; 337,3 Да для ИППд) и проводят количественный анализ на базе интенсивности излучения их специфических ионов после фрагментации (фрагменты>=85 Да).
Суммирование площадей хроматографических пиков каждого из пептидов ИПП, ВПП и сравнение с площадями пиков внутренних стандартов с известной концентрацией ИППд и ВППд позволяет рассчитать с помощью простой линейной регрессии, исходное содержание ВПП и ИПП в образце (как правило, выражаемое в мг/кг или в ppm).
Результаты
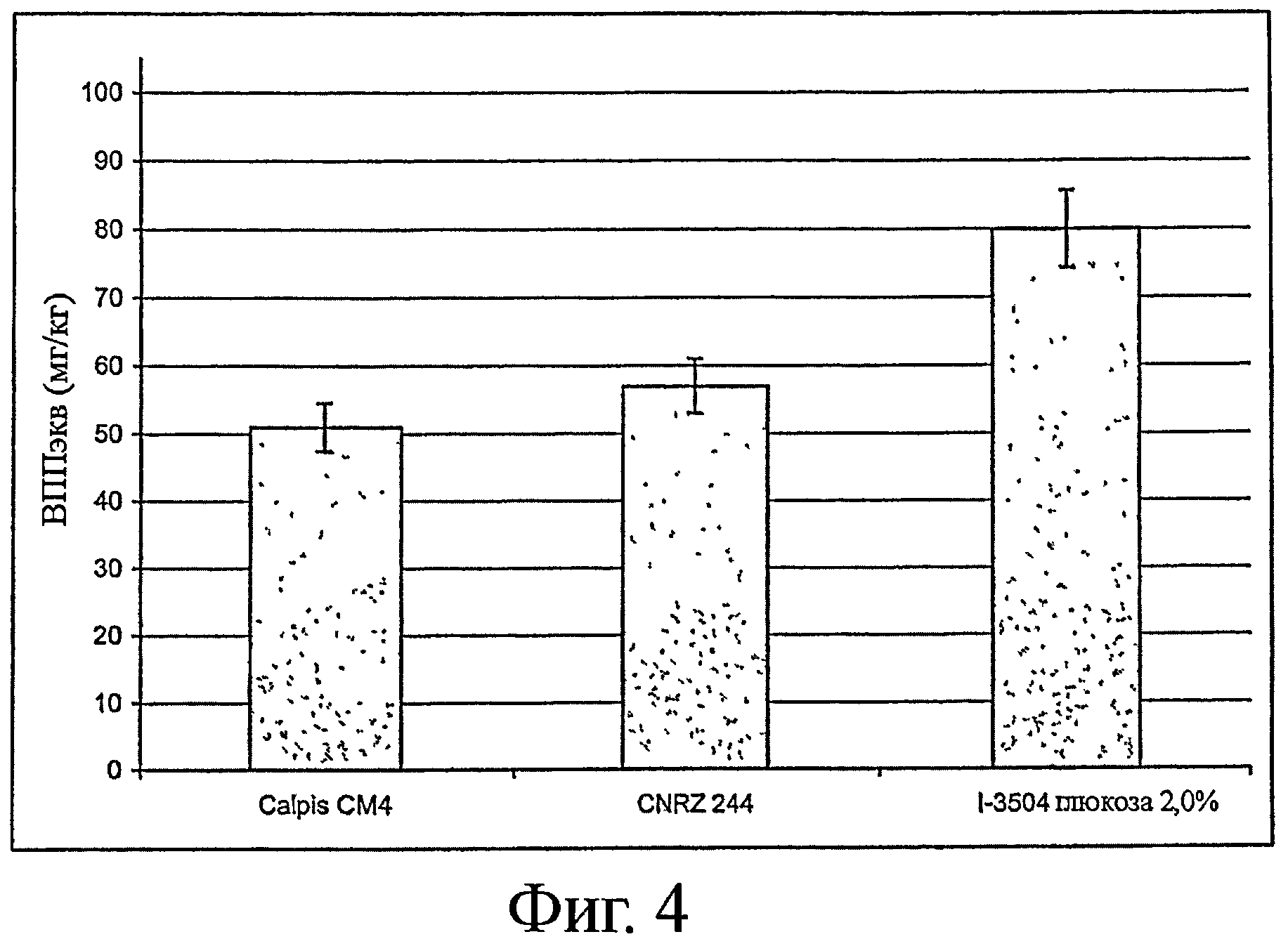
На фигуре 4 показана выработка трипептидов ИПП и ВПП штаммом I-3504 (к среде добавлено 2% глюкозы (по массе)) в сравнении с ранее полученными штаммами.
Штамм CM4 компании CALPIS описан в патенте ЕР 1 016 709, а штамм CRNZ 244 описан в заявке на патент WO 2004/060073.
На фигуре видно, что штамм I-3504 (штамм по изобретению) в тех же условиях образует гораздо больше трипептидов ИПП и ВПП, чем эти два ранее созданных штамма.
На фигуре 5 приведено сравнение штаммов по изобретению по выработке трипептидов ИПП и ВПП.
3. Определение активности ACEI (ингибирования ангиотензин-превращающего фермента)
Материалы и методы
Для определения активности ACEI используется образец молочной среды, отобранный через 30 часов ферментирования, так, как описано выше в пункте 1. В основу настоящего метода был положен метод Кушмана и Шенга (Cushman et Cheng) (Cushman et al. Biochem. Pharmacol. 1971. 20: 1637), который был адаптирован так, чтобы его можно было использовать для анализа образцов типа кисломолочных продуктов.
1. Получение реактивов и растворов
1.1 0,1М натрий-боратный буфер, рН 8,3, с добавлением 0,3М NaCl
Взвесить 6,1843 г H3BO3 (Carlo Erba №: 402766). Растворить примерно в 800 мл деминерализованной воды, довести раствором NaOH до рН 8,3, затем добавить 12,0 г NaCl (конечная концентрация 0,3 М) и долить деминерализованной водой до 1 литра.
1.2 Получение субстрата ГГЛ: 5 мМ раствора Гип-Гис-Лей в 0,1М натрий-боратном буфере, рН 8,3, с добавлением 0,3М NaCl
Взвесить точно 42,95 мг безводного пептида ГГЛ (N-гиппурил-гистидил-лейцин тетрагидрат РМ: 501,5 г, Sigma-Aldrich №: 53285-250 мг) и растворить приблизительно в 15 мл 0,1 М натрий-боратного буфера, рН 8,3, с добавлением 0,3М NaCl, затем долить тем же буфером до 20 мл.
1.3 Получение раствора АСЕ, 0,1 ед./мл
Ангиотензин-превращающий фермент в форме лиофилизированного порошка (источник: легкие кролика, Sigma-Aldrich №: А6778, 0,25 единиц) растворяют в 2,5 мл 0,1 М натрий-боратного буфера, рН 8,3, для получения раствора 0,1 ед./мл. Полученный таким образом раствор должен быть применен максимум в течение 2 недель при условии хранения при 4°C, чтобы сохранить достаточную активность фермента.
2. Получение образцов ферментированного молока
Необходимо довести образец до уровня рН в интервале от 8,0 до 8,5 с тем, чтобы приблизить его к оптимальному уровню рН для АСЕ. Ферментированное молоко сначала центрифугируют, затем рН надосадочной жидкости доводят до величины от 8,0 до 8,5 (в идеале рН 8,3), затем жидкость ультрафильтруют с помощью фильтрующего устройства Vivaspin с порогом удерживания 10000 Да (Vivascience, Франция), чтобы удалить мешающие элементы (целые белки, соли кальция).
Полная процедура получения следующая:
- поместить около 6 мл ферментированного молока в пробирку Фалькон 15 мл, предварительно взвесив пустую пробирку. Взвесить количество ферментированного молока, помещенного в пробирку;
- отцентрифугировать при 14000 g в течение 10 мин при 10°C;
- собрать надосадочную жидкость;
- определить количественное соотношение осадка/надосадочной жидкости, что позволит в случае необходимости установить ИК50, эквивалентную концентрации в исходном продукте, а не только в его надосадочной жидкости;
- отобрать 2,0 мл надосадочной жидкости в пробирку и определить рН;
- добавить 2М раствор NaOH в количестве, необходимом для получения рН в диапазоне от 8,0 до 8,5 (цель: 8,3) после добавления боратного буфера, затем перемешать;
- добавить необходимый объем боратного буфера для разведения исходной надосадочной жидкости в два раза с учетом точного объема добавленного раствора NaOH (например, проба надосадочной жидкости для анализа = 2 мл + 250 мкл NaOH + 1,75 мл боратного буфера);
- убедиться, что конечное значение рН находится в диапазоне от 8,0 до 8,5. Далее возобновить процедуру, добавив большее или меньшее количество NaOH. Образуется осадок: он появился из-за присутствия солей кальция;
- провести ультрацентрифугирование образца при 12000 g в течение 15 мин при 10°C с помощью фильтрующего устройства Vivaspin с порогом удерживания 10000 Да (объем 4-6 мл), чтобы получить прозрачный образец.
3. Измерение ингибирования АСЕ образцами ферментированного молока
При каждой серии анализов необходимо готовить контрольные образцы (0 и 100% активность АСЕ). По каждому образцу для каждого разведения выполняют два независимых теста и один контрольный опыт. При этом необходимо более точно скорректировать (путем разведения) объем образца, необходимый для уменьшения активности АСЕ на 50%. Для этого:
- поместить 80 мкл образца, доведенного до рН 8,3, в пробирку для холостого опыта и в пробирки для тестов;
- добавить 80 мкл деминерализованной воды в пробирки с контролем 0 и 100%;
- добавить 200 мкл 5 мМ раствора субстрата ГГЛ во все пробирки. Перемешать;
- поместить пробирки в термостатированную водяную баню при 37°C, оставить до выравнивания температуры;
- запустить ферментативную реакцию путем добавления в каждую пробирку 20 мкл раствора АСЕ с концентрацией 0,1 ед./мл, кроме пробирок для холостого опыта и контроля 0%, в которые надо добавить 20 мкл боратного буфера с рН 8,3;
- оставить гидролизоваться на 1 час при температуре точно 37°C;
- остановить реакцию путем добавления в каждую пробирку 250 мкл 1М раствора HCl.
Сводная таблица композиций различных реакционных сред:

Определение проводится путем экстрагирования гидролизованного субстрата (гиппуровой кислоты) и его количественного анализа с помощью спектрофотометра в соответствии со следующей процедурой:
- добавить в каждую пробирку 1,7 мл этилацетата, перемешать;
- отцентрифугировать при 2000 g в течение 5 мин при 10°C;
- отобрать точно 1 мл надосадочной жидкости в микропробирку типа «эппендорф»;
- выпарить этилацетат при 120°C в течение 10 мин в нагревателе;
- добавить точно 1 мл деминерализованной воды, затем перемешать в течение 10 с, чтобы растворить гиппуровую кислоту;
- снять показания прибора при 228 нм в кюветах, адаптированных для исследования в УФ.
Представление результатов
Степень ингибирования АСЕ рассчитывают следующим образом:
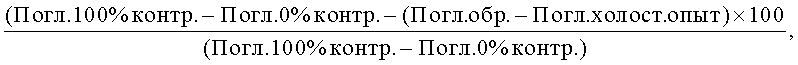
где Погл. = поглощение при 228 нм после экстрагирования гиппуровой кислоты;
контр. = контроль;
обр. = образец.
Для ферментированного молока мы определяем ИК50 как количество надосадочной жидкости этого ферментированного молока, которое ингибирует 50% ферментной активности АСЕ в реакционной среде, и выражаем в микролитрах надосадочной жидкости ферментированного молока на миллилитр реакционной среды.
Результаты
На фигуре 6 показана ингибирующая активность ангиотензин-превращающего фермента разных штаммов по настоящему изобретению в сравнении с другими ранее созданными штаммами.
По оси ординат отложена эквивалентная концентрация ферментированного молока на мл реакционной среды, необходимая для ингибирования 50% активности ангиотензин-превращающего фермента (ИК50). Чем выше эта концентрация, тем ниже способность штамма ингибировать ангиотензин-превращающий фермент.
ПРИМЕР 3: Получение молочного продукта по изообретению (пробиотика)
Кисломолочный продукт получают в соответствии с описанием ниже.
Молоко сбалансированного состава, предварительно обезжиренное, пастеризованное и охлажденное до 4°C, нормализуют по белку (4,0%) сухим обезжиренным молоком, в молоко добавляют глюкозу из расчета 1,8% (по массе). Полученную таким образом молочную среду подвергают пастеризации (95°C - 8 мин). После охлаждения до 37°C молочную среду засеивают штаммом по настоящему изобретению из расчета 107 КОЕ/мл и выдерживают при 37°C в течение всего периода ферментирования. После достижения рН 3,8 сгусток извлекают из ферментера для придания однородности (путем пропускания через фильтр) и охлаждают до 10°C в пластинчатом теплообменнике. Затем к гомогенизированному и охлажденному сгустку добавляют заготовку из фруктов (с рН от 4 до 4,1) из расчета 15% конечного продукта, продукт упаковывают в бутылочки на 110 мл и закладывают на хранение при 4°C на 28 дней.
Полученный таким образом продукт содержит трипептиды с последовательностью ИПП/ВПП из расчета 65 мг/кг эквивалента ВПП. Содержание пептидов в продукте предпочтительно является стабильным в течение всего срока годности продукта. Снижение рН при хранении на холоде предпочтительно незначительно (менее 0,1), и численность штаммов по настоящему изобретению предпочтительно остается на уровне от 107 до 108 КОЕ/мл.
ПРИМЕР 4: Выявление бессмысленных точечных мутаций в лактозном опероне штаммов по изобретению
На базе последовательностей лактозных оперонов штаммов DPC4571 и АТСС15009, имеющихся в банке генов, были выбраны олигонуклеотиды (затравки) в генах, которые, казалось, максимально сохранились. Эти олигонуклеотиды позволили провести ПЦР длинных фрагментов, затем начать определение последовательности лактозного оперона штаммов по изобретению. Затем определение последовательности было выполнено постадийно, то есть в зависимости от полученной последовательности, для запуска новых реакций определения последовательности использовались другие затравки.
У штамма I-3504 по сравнению с материнским штаммом I-3431 была обнаружена бессмысленная мутация: в направлении 5'-3', цитозиновое основание заменено на тимин, что вызывает появление терминирующего кодона у 1320 пар оснований инициирующего кодона гена lacL (что составляет около 1900 пар оснований), кодирующего β-галактозидазу.
За исключением этой мутации лактозные опероны двух штаммов I-3431 и I-3504 идентичны.
Последовательность лактозного оперона штамма I-3431 (мутация заключена в рамку)



Так, анализ результатов определения последовательностей выявил следующие мутации в лактозном опероне штаммов по изообретению:
- штамм I-3505 в сравнении со штаммом I-3434:
В штамме I-3505, аденозиновое основание заменяет гуаниновое основание, что приводит к появлению терминирующего кодона у 1713 пар оснований от начала гена lacL кодирующего β-галактозидазу.
- штамм I-3508 в сравнении со штаммом I-3435:
В штамме I-3508, аденозиновое основание заменяет гуаниновое основание, что приводит к появлению терминирующего кодона у 183 пар оснований от начала гена lacL кодирующего β-галактозидазу.
Реферат
Изобретение относится к биотехнологии и может быть использовано в сельском хозяйстве и пищевой промышленности. Лактозонегативные штаммы Lactobacillus helveticus CNCM I-3504, Lactobacillus helveticus CNCM I-3505 и Lactobacillus helveticus CNCM I-3508 не обладают способностью превращать лактозу в молочную кислоту и способны образовывать гипотензивные трипептиды IPP и VPP, используют в способе получения кисломолочного продукта, обладающего антигипертензивными свойствами. Получают штаммы контактированием, по меньшей мере, одного штамма с эффективным количеством стрептозоцина в присутствии лактозы. Это обеспечивает стабильное содержание пептидов в продукте в течение всего срока хранения при высокой численности штаммов на уровне от 107 до 108 КОЕ/мл. 7 н. и 7 з.п. ф-лы, 6 ил., 3 табл.
Формула
выбор сырья, содержащего белки молока, в частности белки, содержащие аминокислотную последовательность IPP и VPP,
посев штамма Lactobacillus helveticus CNCM I-3504, и/или штамма Lactobacillus helveticus CNCM I-3505, и/или штамма Lactobacillus helveticus CNCM I-3508 в указанное сырье,
ферментирование указанного сырья в присутствии 1-3 мас.% глюкозы в течение 12-30 ч.
выбор по меньшей мере одного штамма Lactobacillus helveticus,
обеспечение контактирования указанного по меньшей мере одного штамма с эффективным количеством стрептозотоцина в присутствии лактозы,
выделение колонии (колоний), имеющих лактозонегативный фенотип.

Комментарии