Lactobacillus johnsonii - продуцент l(+)-лактата (варианты) и способ получения бактериального штамма - RU2202610C2
Код документа: RU2202610C2
Чертежи





Описание
Изобретение относится к генетически рекомбинированным бактериальным штаммам и к способу получения этих штаммов.
Предшествующий уровень техники
Ферментация является разложением источника углерода, во время которого конечный
акцептор водорода является органическим соединением. В ходе ферментации молочной кислоты некоторые бактериальные штаммы продуцируют рацемическую смесь двух изомерных форм лактата, D(-)-лактата и
L(+)-лактата, во время регенерации НАД+ при восстановлении пирувата с помощью двух специфических, НАД-зависимых лактатдегидрогеназ.
Известно, что у некоторых лиц проявляется непереносимость (неспособность) к восстановлению лактозы. Это плохое расщепление лактозы часто связано с отсутствием достаточного количества β-галактозидазы в тонком кишечнике. В разных исследованиях (Коlars et al., N.Engl. J. Med., 310, 1-3, 1984; Marteau et al., Br. J. Nutr., 64, 71-79, 1990 и Arrigoni et al., Am. J.Clin. Nutr., 60, 926-929, 1994) показан тот факт, что у этих людей расщепляется и ими лучше переносится лактоза, содержащаяся в йогуртах, чем содержащаяся в молоке. Это лучшее расщепление и лучшая переносимость лактозы во время прохождения через кишечник связаны, в частности, с активностью β-галактозидазы бактерий, содержащихся в йогуртах.
Кроме того, известно, что D(-)-лактат может создавать проблемы ацидоза у детей. По этим причинам Всемирная Организация Здравоохранения (FAO/WHO, 1967; 1974) рекомендует, чтобы лактат не добавляли в пищу для детей как сам по себе, так и в виде рацемической смеси с L(+)-лактатом. К тому же ежедневный лимит потребления D(-)-лактата для взрослых предпочтительно не должен превышать 100 мг/кг веса тела.
В настоящее время известны бактериальные штаммы, которые были генетически перестроены так, чтобы они продуцировали только L(+)-лактат.
Так, T.Bhowmilk et al. (Appl. Microbiol. Biotechnol., 432-439, 1994) описывают методику выделения и инактивации путем направленного мутагенеза, гена, кодирующего фермент D-лактатдегидрогеназу штамма Lactobacillus helveticus CNRZ32, в частности штамма Lactobacillus helveticus CNRZ32 (pSUW104), который продуцирует только L(+)-лактат.Этот штамм получен путем электропорации интегрирующего вектора pSUW104, который включает вектор рSА3 и внутренний фрагмент SalI-SphI из 0,6 т.п.о. гена, кодирующего фермент D-лактатдегидрогеназу Lactobacillus helveticus.
Однако в настоящее время не известны бактериальные штаммы со способностью выживать в кишечнике, прикрепляться к клеткам кишечника и осуществлять иммуномодуляцию, которые были генетически рекомбинированы таким образом, что они продуцируют только L(+)-лактат. Сейчас было бы очень ценно иметь для получения пищевых продуктов такие бактериальные штаммы со способностью выживать в кишечном тракте, которые обладают этими благоприятными для здоровья человека свойствами и продуцируют только L(+)-лактат, так что исключаются побочные эффекты, связанные с D(-)-лактатом.
Объект данного изобретения удовлетворяет эти потребности.
Краткое изложение изобретения
В соответствии с этой задачей данное
изобретение относится к бактериальному штамму со способностью выживать в кишечнике, прикрепляться к клеткам человеческого кишечника и осуществлять иммуномодуляцию, который был генетически перестроен
так, что он продуцирует только L(+)-лактат.
Данное изобретение, в частности, относится к бактериальному штамму, в котором ген, кодирующий фермент D-лактатдегидрогеназу, инактивирован.
Данное изобретение, в частности, относится к штаммам Lactobacillus acidophilus, Lactobacillus johnsonii, Lactobacillus gasseri, Lactobacillus crispatus, Lactobacillus amylovorus или Lactobacillus gallinarum.
Данное изобретение, кроме того, относится к штамму CNCM 1-1851 и штамму CNCM 1-1852.
Дополнительным объектом данного изобретения является способ получения бактериального штамма, который был генетически изменен так, что он продуцирует только L(+)-лактат.
И, наконец, данное изобретение относится к использованию бактериального штамма, полученного путем осуществления способа данного изобретения, в производстве пищевых продуктов.
Детальное описание изобретения
В оставшейся
части описания выражение "конъюгативный вектор" будет использоваться для обозначения вектора ДНК, переносимого путем конъюгации между двумя штаммами разных видов молочнокислых бактерий.
А также в оставшейся части описания выражение "штамм со способностью выживать в кишечнике" будет использоваться для обозначения штамма молочнокислых бактерий, который после приема с пищей обнаруживается в испражнениях.
И, наконец, в оставшейся части описания выражение "бактериальный штамм со способностью осуществлять иммуномодуляцию" будет использоваться для обозначения штамма молочнокислых бактерий, который обладает благоприятным эффектом на иммунную систему, особенно свойством повышения фагоцитоза у макрофагов.
Данное изобретение, следовательно, относится к бактериальному штамму со способностью выживать в кишечнике, прикрепляться к клеткам человеческого кишечника и осуществлять иммуномодуляцию, который был генетически перестроен так, что он продуцирует только L(+)-лактат.
Данное изобретение, в частности, относится к бактериальному штамму со способностью выживать в кишечнике, прикрепляться к клеткам человеческого кишечника и осуществлять иммуномодуляцию, у которого ген, кодирующий фермент D-лактатдегидрогеназу, инактивирован.
Штамм по данному изобретению может быть, например, штаммом Lactobacillus acidophilus, Lactobacillus johnsonii, Lactobacillus gasseri, Lactobacilius crispatus, Lactobacillus amylovorus или Lactobacillus gallinarum.
В частности, было выделено два штамма Lactobacillus johnsonii, которые были генетически перестроены так, что они продуцируют только L(+)-лактат. Эти штаммы были помещены на хранение 20/02/97 по условиям Бухарестского договора в Национальную коллекцию культур микроорганизмов Института Пастера (Collection Nationale de Cultures de Microorganismes, INSTITUT PASTEUR, 25, rue du Docteur Roux, F-75724 PARIS CEDEX 15, где им был дан депозитарный номер CNCM I-1851 и депозитарный номер CNCM I-1852 соответственно.
Данное изобретение, кроме того, относится к способу получения такого штамма, причем последовательность гена, кодирующего фермент D-лактатдегидрогеназу, выделяется из бактериального штамма-хозяина со способностью выживать в кишечнике, прикрепляться к клеткам кишечника человека и осуществлять иммуномодуляцию, направленный мутагенез проводится у этой последовательности с получением модифицированной последовательности, эту модифицированную последовательность интегрируют в конъюгативный вектор, конъюгативный вектор переносится с помощью конъюгации в бактериальный штамм-хозяин и затем производится селекция бактерии-хозяина, у которой последовательность, кодирующая фермент D-лактатдегидрогеназу, была заменена путем гомологичной рекомбинации модифицированной последовательностью.
При способе по данному изобретению последовательность гена, кодирующего фермент D-лактатдегидрогеназу, может быть выделена из бактериального штамма-хозяина с помощью ПЦР, клонирования или, например, комплементации.
Направленный мутагенез может проводиться у этой последовательности с получением модифицированной последовательности с помощью метода сплайсинга гена и перекрывающей вставки (Gene Splicing Overlap Extension method; Molecular Biotechnology, R. M.Horton, 1995, 3, 93-99), который состоит в получении последовательности гена, в которой, например, вводят или удаляют один или более нуклеотидов.
Для интеграции модифицированной последовательности в конъюгативный вектор донорского бактериального штамма из бактериального штамма-хозяина может быть выбран донорский бактериальный штамм, содержащий конъюгативный вектор, который не обладает способностью к репликации в бактериальном штамме-хозяине, конструкция может быть получена путем лигирования модифицированной последовательности в первый вектор, который не способен к размножению в донорском бактериальном штамме бактерии-хозяина, эта конструкция может быть введена в донорский бактериальный штамм и затем, например, может быть проведена селекция бактерии-донора, в которой первый вектор и конъюгативный вектор были рекомбинированы.
Конъюгативный вектор, содержащий модифицированную последовательность, вследствие этого переносится с помощью конъюгации в бактериальный штамм-хозяин.
Затем производят отбор бактерии-хозяина, в которой последовательность, кодирующая фермент D-лактатдегидрогеназу, была заменена с помощью гомологичной рекомбинации модифицированной последовательностью.
Селекция бактерии-хозяина, в геном которой был интегрирован конъюгативный вектор, может быть проведена, например, на среде, содержащей некоторые антибиотики. Фактически в результате интеграции конъюгативного вектора в их геном эти бактерии могут экспрессировать гены резистентности к антибиотикам, заключенные в последовательности указанного вектора.
И, наконец, отбирают бактерию-хозяин, у которой последовательности ДНК конъюгативного вектора были удалены из генома за исключением модифицированной последовательности.
Это может быть осуществлено путем проведения первого отбора на среде, содержащей антибиотики, так, чтобы отобрать бактерии, чувствительные к этим антибиотикам, т.е. бактерии дикого типа и генетически трансформированные бактерии, например, содержащие теперь только фрагмент модифицированной последовательности гена.
Затем может быть выполнен цветной ферментативный тест в присутствии D-лактатдегидрогеназы, соли тетразолия и диафоразы так, чтобы дифференцировать бактерии дикого типа от, например, генетически трансформированных бактерий по данному изобретению. Этот ферментативный тест дает возможность продемонстрировать тот факт, что бактерии, которые не продуцируют D(-)-лактат, не могут окислять D(-)-лактат, когда в среду добавляют фермент D(-)-лактатдегидрогеназу; в результате соль тетразолия в среде не восстанавливается ферментом диафоразой в отсутствии окисленного D(-)-лактата, и эти бактерии остаются бесцветными.
Затем на геномных последовательностях генетически рекомбинированной бактерии-хозяина по данному изобретению может быть проведена ПЦР с использованием праймеров, специфичных для бактериального штамма-хозяина, продукт ПЦР может быть затем расщеплен в присутствии специфических ферментов рестрикции, и размер полученных таким путем фрагментов можно сравнить с теми, которые получены, например, после расщепления теми же самыми ферментами рестрикции из генома бактерии-хозяина дикого типа.
И, наконец, данное изобретение относится к использованию бактериального штамма, полученного путем осуществления способа данного изобретения при производстве пищевых продуктов.
Способ получения бактериальных штаммов по данному изобретению и
эти генетически рекомбинированные бактериальные штаммы охарактеризованы более детально ниже с помощью биохимического и молекулярного анализов со ссылками на прилагаемые чертежи, в которых:
фигура 1 представляет вектор pLL83, который является продуктом лигирования вектора pGEMT, поставляемым на рынок Promega, MADISON WI-USA, и модифицированной последовательности гена, кодирующего фермент
D(-)-лактатдегидрогенаау,
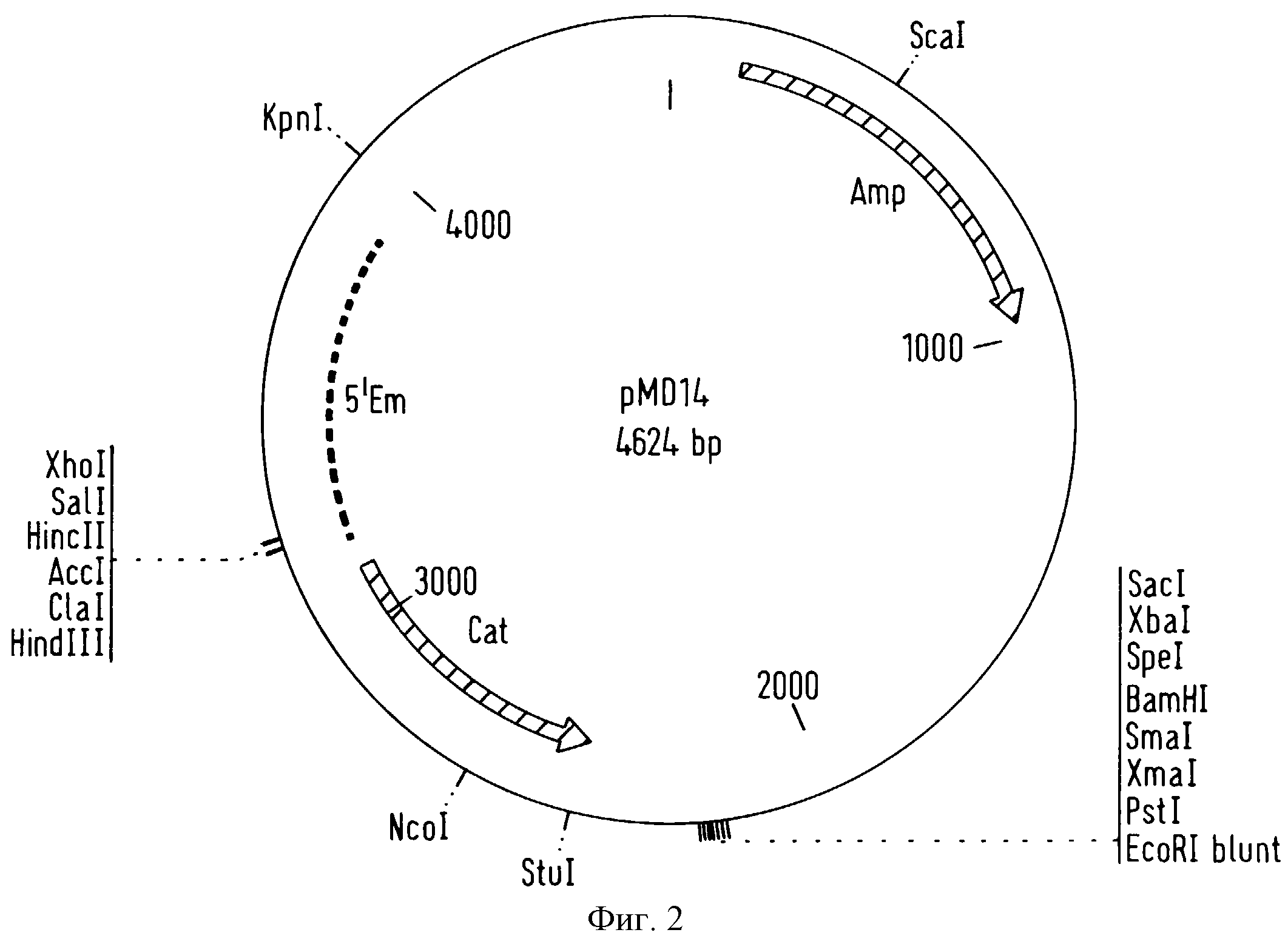
фигура 2 представляет вектор pMD14, который сконструирован из вектора pBlueScript SK+ Escherichia coli (Stratagene, LA, YOLLA, CA-USA) и который содержит ген
резистентности к хлорамфениколу (cat) вектора pNZ12 (Gasson et al. , J. Bacteriol. , 154, 1-9, 1983) и 5'-область в обратном направлении последовательности гена устойчивости к эритромицину вектора
pAMβ1 (Clewell et al. , J. Bacteriol. , 33, 426-428, 1974), который получен из плазмиды pUC-838 (Mollet et al., J. Bacteriol., 175, 4315-4324, 1993),
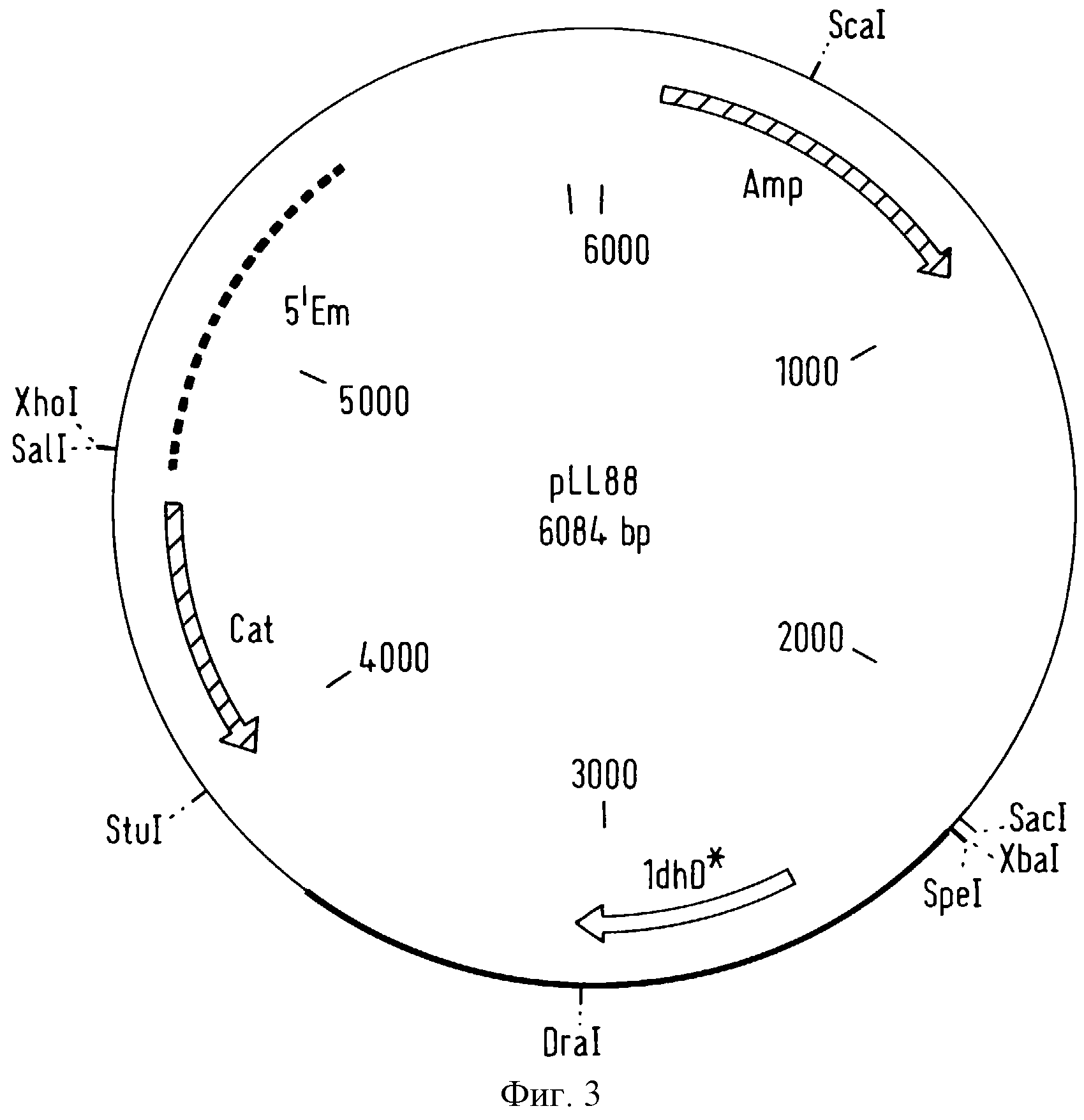
фигура 3 представляет вектор pLL88,
который является продуктом лигирования фрагмента вектора pLL83, содержащего модифицированную последовательность гена, кодирующего фермент D(-)-лактатдегидрогеназу в вектор pMD14,
фигура 4
представляет вектор pLL91, который включает последовательность вектора pLL88 и последовательность вектора pAMβ1 (Clewell et al., J. Bacteriol., 33, 426-428, 1974).
I. Выделение
последовательности гена, кодирующего фермент D(-)-лактатдегидрогеназу Lactobacillus johnsonii, Lal
Lactobacillus johnsonii Lal подращивали на среде MRS в течение ночи при 37oС.
Затем культуру переносили в пробирку, содержащую среду MRS, и позволяли расти до ОП600, равной примерно 1.
Геном Lactobacillus johnsonii Lal выделяли по методу, описанному в статье "DNA probe for Lactobacillus delbrueckii" (В. Mollet et al., Applied and Environmental Microbiology, June 1990, vol. 56(6), p. 1967-1970).
Последовательность гена, кодирующего фермент D(-)-лактатдегидрогеназу Lactobacillus johnsonii Lal затем выделяли с помощью ПЦР, используя в качестве специфических праймеров последовательности SEQ ID NO: 1 и SEQ ID NO: 2 (см. в конце описания), которые являются последовательностями консервативных областей гена, кодирующего фермент D(-)-лактатдегидрогеназу Lactobacillus helveticus (Eur. J. Biochem., Cloning and Overexpression of Lactobacillus helveticus D-lactatedehydrogenase gene in Escherichia coli, Kochhar et al., 208, 799-805, 1992).
Это дает фрагмент в 890 п.о., который клонировали в вектор pGEMT, продаваемый Promega, MADISON, WI - USA, и затем секвенировали. Чтобы выделить полную последовательность гена, кодирующего фермент D-лактатдегидрогеназу Lactobacillus johnsonii Lal, затем осуществляли блоттинг по Саузерну с различными рестрикционными ферментами, причем используемая проба является последовательностью, предварительно полученной с помощью ПЦР.
Таким образом была выделена нуклеотидная последовательность в 3 т.о., содержащая открытые рамки считывания противоположной ориентации.
Высокая степень гомологии обнаружена между одной из открытых рамок считывания и последовательностью гена, кодирующего фермент D-лактатдегидрогеназу Lactobacillus helveticus. Последовательность этой открытой рамки считывания имеет длину в 1014 нуклеотидов и обладает гомологией 85% с последовательностью гена, кодирующего фермент D-лактатдегидрогеназу Lactobacillus helveticus и гомологией 81% с такой последовательностью Lactobacillus bulgaricus (FEBS lett., Bernard et al., 1991, 290, 61-64). Эта последовательность кодирует полипептид из 338 аминокислот.
II. Направленный мутагенез последовательности, кодирующей фермент D-лактатдегидрогеназу
Lactobacillus johnsonii Lal
Направленный мутагенез осуществляли на последовательности, выделенной методом сплайсинга гена и перекрывающей вставки (Molecular Biotechnology, R. M. Horton, 1995,
3, 93-99). Эту последовательность подвергали ПЦР до делеции из 11 нуклеотидов и вставки из 3 нуклеотидов в центре. Эти модификации последовательности дают эффект создания сайта рестрикции DraI и
элиминации сайта рестрикции EcoRV. Эти две модификации сайтов рестрикции использовали в качестве маркера для демонстрации наличия модифицированной последовательности гена, кодирующего
D-лактатдегидрогеназу Lactobacillus johnsonii Lal в разных векторах, используемых в последующем конструировании и в селекции мутантов, в которые интегрирована только модифицированная
последовательность гена, кодирующего фермент D-лактатдегидрогеназу.
Последовательность гена, модифицированного таким образом, кодирует полипептид из 181 аминокислоты вместо полипептида из 338 аминокислот.
III. Клонирование модифицированной последовательности гена, кодирующего фермент D-лактатдегидрогеназу Lactobacillus johnsonii Lal в вектор pGEMT Escherichia coli
Модифицированную последовательность гена, кодирующего фермент D-лактатдегидрогеназу, клонировали в вектор pGEMT Escherichia coli.
Это производили путем лигирования модифицированной последовательности гена в этот вектор pGEMT, содержащий ген резистентности к ампициллину.
Эту смесь лигирования затем вводили в Escherichia coli XLl-Blue путем электропорации, и положительные клоны отбирали в присутствии Х-gаl и IPTG (Sambrook et al. , Molecular cloning: a laboratory manual, 2nd ed., 1989). Полученный вектор, который показан на фигуре 1, назван pLL83.
Вектор pLL83 затем очищали методом щелочного лизиса (Sambrook et al., Molecular cloning: a laboratory manual, 2nd ed., 1989).
Фрагмент, включающий модифицированную последовательность гена, кодирующего фермент D-лактатдегидрогиназу, затем выделяли из вектора pLL83, очищенного таким образом. Это выполняли путем проведения расщепления с помощью фермента рестрикции SphI в сайте рестрикции SphI вектора pLL83. Полимераза Т4 затем реагировала при этом расщеплении таким образом, что добавлялись нуклеотиды и получался разрез с тупым концом. И, наконец, производили расщепление с помощью фермента рестрикции SpeI.
В параллельной операции расщепление производили у вектора, который не способен к репликации в донорском бактериальном штамме, Lactobacillus lactis, и в бактериальном штамме-хозяине, Lactobacillus johnsonii. Это расщепление производили в сайте рестрикции, после чего Т4 полимераза реагировала у этого расщепления так, что добавлялись нуклеотиды и получался разрез с тупыми концами. И, наконец, производили расщепление рестрикционным ферментом SpeI. Вектор pMD14, описанный на фигуре 2, может, в частности, использоваться для получения этой конструкции. Расщепление этого вектора pMD14 можно проводить с помощью рестрикционного фермента EcoRI, затем осуществляли реакцию с Т4 полимеразой и, наконец, производили расщепление с помощью рестрикционного фермента SpeI.
Фрагмент вектора pLL83, содержащего модифицированную последовательность гена, кодирующего фермент D-лактатдегидрогеназу, затем вводили в вектор pMD14.
Смесь лигирования затем вводили в Escherichia coli XL1-Blue с помощью электропорации.
Примерно сто колоний Escherichia coli XLl-Blue, созданных таким образом, были помещены затем на платы для микрофильтрации, затем их переносили на нитроцеллюлозную мембрану, лизировали in situ и производили гибридизацию с внутренним фрагментом гена, кодирующего фермент D-лактатдегидрогеназу Lactobacillus johnsonii Lal.
Таким образом было отобрано 3 положительных клона, содержащих вектор pLL88, описанный на фигуре 3. Секвенирование вектора pLL88 демонстрирует тот факт, что он содержит модифицированную последовательность гена, кодирующего фермент D-лактатдегидрогеназу Lactobacillus johnsonii Lal, области pGEMT, ограничивающие эту последовательность, и вектор pMD14.
IV. Введение вектора pLL88 в штамм Lactococcus lactis MG1363(pAMβ1)
Вектор pLL88 вводят в штамм
Lactococcus lactis MG1363 (рАМβ1) с помощью электропорации.
Трансформанты, полученные таким образом, помещали затем на агаризованную среду GM17, содержащую 12 мкг/мл хлорамфеникола, и инкубировали при 30oС в течение ночи. Вектор pLL88 не может реплицироваться в грамположительных бактериях. Таким образом, все бактерии Lactococcus lactis MG1363(pAMβ 1), в которые был интегрирован по гомологичной области, вектор pLL88, содержащий ген устойчивости к хлорамфениколу, в конъюгативный вектор рАМβ1, описанный на фигуре 2, отбирали на среде, содержащей хлорамфеникол. Эта конструкция, содержащая последовательность вектора pLL88 и последовательность вектора pAMβ1, будет затем названа вектором pLL91, описанным на фигуре 4.
V. Условия конъюгации
Lactococcus lactis MG1363, содержащие вектор pLL91, культивируют на среде GM17, содержащей 12 мкг/мл хлорамфеникола, a Lactobacillus johnsonii Lal
культивировали на среде MRS.
0,2%-ную Культуру Lactobacillus johnsonii Lal, полученную таким путем, засевали в пробирку, содержащую свежую среду MRS, и смесь инкубировали в течение 5 часов 00 мин при 37oС.
Культуры Lactococcus lactis MG1363 и Lactobacillus johnsonii Lal затем центрифугировали при 3000 об/мин в течение 5 мин, и каждый осадок переносили в 10 мл среды LCMG (Efthymiou et al., An antigenic analysis Lactobacillus acidophilus, J. Infect. Dis., 1962, 110, 258-267), содержащей 10 г триптиказы, 5 г дрожжевого экстракта, 3 г триптозы, 3 г K2HPO4, 3 г KH2PO4, 2 г цитрата аммония, 5 мл раствора, обогащенного минеральными солями, 1 г Твин 80, 1 г ацетата натрия, 20 г глюкозы и 0,2 г цистеина.
1 мл культуры донорского штамма Lactococcus lactis MG1363, полученного таким же образом, затем смешивали с 10 мл культуры реципиентного штамма Lactobacillus johnsonii Lal, полученного таким же путем, и смесь центрифугировали.
Супернатант отбрасывали и концентрированный остаток помещали в чашки с агаризованной средой PEG (Takemoto et al., Agric. Biol. Chem., 1989, 53, 3333-3334), содержащей 5 г PEG6000, 15 г агара, 1000 мл раствора LCMG без сахаров, 100 мл содержащего сахара раствора и 10 мл раствора минеральных солей. Эти чашки оставляли при комнатной температуре до тех пор, пока остаток не высохнет, и затем его покрывали 10 мл среды LCMG, содержащей 7% агара.
Эти чашки затем инкубировали в течение ночи при 37oС, затем агар, содержащий бактериальные клетки, которые дали рост, вырезали, и этот агар помещали в пробирки, содержащие 10 мл среды LCMG.
Эти пробирки затем энергично встряхивали, и культуры, полученные таким образом, разводили в среде TS, содержащей 1 г/л триптона и 8,5 г/л NaCl.
Разведенные культуры затем помещали на чашки агаризованной среды MRS, содержащей 100 мкг/мл фосфомицина и 14 мкг/мл хлорамфеникола, и инкубировали при 37oС в течение 48 часов 00 мин в анаэробных условиях.
VI. Конъюгация и интеграция вектора pLL91 в Lactobacillus
johnsonii Lal
Lactococcus lactis MG1363, содержащие вектор pLL91, подвергали конъюгации с Lactobacillus johnsonii Lal. Эта конъюгация происходит с частотой в интервале от 1•10-5 и 3•10-7 трансформантов/реципиентных клеток.
Затем отбирали 6 колоний Lactobacillus johnsonii Lal, устойчивых к хлорамфениколу и фосфомицину, и культивировали при 37oС на среде MRS перед тем, как их перенести на несколько часов в условия с температурой 45o так, чтобы отобрать бактерии Lactobacillus johnsonii Lal, в геном которых был интегрирован вектор pLL91 по гомологичной области в последовательности, кодирующей фермент D-лактатдегидрогеназу. Фактически вектор pAMβ1, содержащийся в векторе pLL91, способен к репликации при температуре выше 42oС. Таким образом, все бактерии Lactobacillus johnsonii Lal, которые устойчивы к хлорамфениколу и могут расти при 45oС, имеют в своем геноме интегрированный вектор pLL91, по гомологичной области в последовательности, кодирующей фермент D-лактатдегидрогеназу.
Следовательно, интеграцию вектора pLL91 в геном Lactobacillus johnsonii Lal получают путем единичного кроссинговера или в концевой 5' области последовательности гена, кодирующего D-лактатдегидрогеназу, или в концевой области 3' последовательности этого гена.
VII. Подтверждение интеграции модифицированной последовательности гена, кодирующего фермент D-лактатдегидрогеназу, в хромосомную ДНК Lactobacillus johnsonii Lal
Интеграцию
вектора pLL91 в геном Lactobacillus johnsonii Lal подтверждали с помощью ПЦР. Это выполняется с использованием специфических для генома Lactobacillus johnsonii Lal праймеров, последовательности
которых являются последовательностями SEQ ID NO: 3 и SEQ ID NO: 4 (см. в конце описания), и праймеров, специфичных для вектора pLL91, последовательности которых являются последовательностями SEQ ID
NO: 5 и SEQ ID NO: 6 (см. в конце описания). Фрагменты, амплифицированные таким образом с помощью ПЦР, затем расщепляли рестрикционным ферментом EcoRV, чей сайт рестрикции расположен в первоначальной
последовательности гена, кодирующего фермент D-лактатдегидрогеназу, и рестрикционным ферментом DraI, чей сайт рестрикции расположен в модифицированной последовательности гена, кодирующего фермент
D-лактатдегидрогеназу, с тем, чтобы продемонстрировать тот факт, что интеграция путем единственного кроссинговера произошла в концевой 5' области или в концевой 3' области первоначальной
последовательности гена. Затем отбирали бактерии Lactobacillus johnsonii Lal, генетически модифицированные с помощью интеграции модифицированной последовательности гена в концевую 5' область
первоначальной последовательности гена, и бактерии Lactobacillus johnsonii Lal, генетически модифицированные с помощью интеграции модифицированной последовательности гена в концевую 3' область
первоначальной последовательности гена.
Интеграцию вектора pLL91 в геном Lactobacilius johnsonii Lal затем подтверждали путем осуществления Саузерн-блоттинга генома этих двух генетически модифицированных бактерий Lactobacillus johnsonii Lal, отобранных, как описано выше. Это производили путем расщепления геномной ДНК этих двух бактерий с помощью разных рестрикционных ферментов, сайты которых находятся в геноме на векторе pLL91 и на модифицированной последовательности гена, кодирующего D-лактатдегидрогеназу. Используемой для гибридизации пробой является фрагмент первоначальной последовательности гена, кодирующего фермент D-лактатдегидрогеназу. Это демонстрирует тот факт, что фрагменты генома двух генетически модифицированных бактерий Lactobacillus johnsonii Lal, полученные после расщепления разными рестрикционными ферментами, имеют другой размер по сравнению с фрагментами, полученными после расщепления генома бактерии Lactobacillus johnsonii Lal дикого типа теми же самыми ферментами.
VIII. Устранение интеграции
Интеграцию устраняли с помощью выделения вектора pLL91 из генома. Потерю вектора pLL91 получали или путем
единственного кроссинговера между концевой 5' областью первоначальной последовательности гена, кодирующего фермент D-лактатдегидрогеназу, и такой же областью модифицированной последовательности
указанного гена, или путем единственного кроссинговера между концевой 3' областью первоначальной последовательности гена, кодирующего фермент D-лактатдегидрогеназу, и той же областью модифицированной
последовательности указанного гена.
Интеграцию устраняли при 37oС, которая является допустимой температурой для вектора, так что благоприятствует выделению вектора pLL91 из генома.
Цветную ферментативную пробу выполняли в присутствии D-лактатдегидрогеназы, соли тетразолия и диафоразы для того, чтобы дифференцировать бактерии дикого типа от генетически трансформированных бактерий по данному изобретению. Этот ферментативный тест дает возможность продемонстрировать тот факт, что бактерии, которые не продуцируют D(-)-лактат, не могут окислять D(-)-лактат, когда фермент D(-)-лактат-дегидрогеназа добавлена в среду; в результате соль тетразолия в среде не восстанавливается ферментом диафоразой в отсутствии окисленного D(-)-лактата, и эти бактерии остаются бесцветными.
Примеры, представленные ниже, даны для того, чтобы проиллюстрировать использование бактериального штамма по данному изобретению в производстве пищевых продуктов. Проценты даны по весу, если не указано иначе.
Пример 1
Йогурты были приготовлены со штаммом Lactobacillus johnsonii CNCM 1-1851 путем осуществления способа по
данному изобретению.
Это было сделано путем получения 500 мл 9% растворенного снятого порошкового молока, добавления 0,1% дрожжевого экстракта и стерилизации смеси в автоклаве в течение 15 минут при 121oС. Эту смесь затем оставляли охлаждаться до 40oС перед добавлением 10% по объему активной культуры штамма Lactobacillus johnsonii CNCM I-1851, содержащей 5•108 микроорганизмов/см2.
Этот препарат инкубировали в течение 4 часов 00 мин при 40oС, чтобы получить закваску, содержащую примерно 2, 5•108 микроорганизмов/см3.
В параллельной операции закваску, содержащую примерно 5•108 сгущенных бактерий Streptococcus thermophilus на см3, получали по способу, описанному выше.
Смесь, содержащую 1,5% жира и 3% порошка снятого молока пастеризовали при 90oС в течение 30 мин. К этой смеси добавляли 1% закваски из Lactobacillus johnsonii CNCM 1-1851 и 3% закваски из Streptococcus thermophilus.
Этот препарат перемешивали и инкубировали в течение 4 часов 20 минут при 40oС с получением препарата с рН 4,6.
Это дает йогурты приятной текстуры, в которых концентрация Lactobacillus johnsonii CNCM I-1851 составляет 1•108 клеток/см3, а концентрация Streptococcus thermophilus coставляет 1•108 клеток/см3.
Пример 2
Процедура является такой же, какая описана в примере 1, за
исключением того, что получаемые йогурты разбавляли до 50% стерильной дистиллированной водой так, чтобы этот препарат мог использоваться для парентерального питания в клинических условиях.
Пример 3
Ферментированное молоко готовили со штаммом Lactobacillus johnsonii CNCM I-1852, полученным согласно способу по данному изобретению.
Для этого нагревали 1 л молока при 120oС в течение 15 мин, чтобы денатурировать его.
Молоко затем охлаждали до 37oС и засевали 5% (по объему) Lactobacillus johnsonii CNCM 1-1852, полученными согласно способу по данному изобретению.
Препарат, произведенный таким путем, инкубировали при комнатной температуре в течение 18-24 часов до тех пор, пока уровень кислотности достигает значения, равного 1%.
И, наконец, полученное ферментированное молоко разливали в бутылки и хранили охлажденным.
Пример 4
Молодой сыр
готовили со штаммом Lactobacillus johnsonii CNCM 1-1852, полученным путем осуществления способа по данному изобретению.
Для этого нагревали 1 л молока при 72oС в течение 15 мин и оставляли его охлаждаться до 19oС.
Затем молоко засевали 0,5% по объему смеси бактерий, содержащей Lactococcus lactis cremoris, Lactococcus diacetylactis и штамм Lactobacillus johnsonii CNCM I-1852.
Полученную смесь инкубировали при примерно 20oС до тех пор, пока рН молока не станет равным 4,6.
Молоко, коагулированное таким образом, затем выливали в нейлоновые сумки для того, чтобы дать стечь избытку воды, содержащейся в полученном свежем сыре.
Затем свежий сыр смешивали с противогрибковым средством, таким как сорбат калия, чтобы предотвратить образование плесени.
И, наконец, его гомогенизировали путем медленного перемешивания с получением свежего сыра однородной гладкой текстуры.
Свежий сыр, полученный этим способом, упаковывали в небольшие сосуды, которые могут храниться при 4-5oС в течение 4-5 недель.
Реферат
Изобретение относится к генетически рекомбинированным бактериальным штаммам. Из бактериального хозяина выделяют последовательность гена, кодирующего D-лактатдегидрогеназу. Получают модифицированную последовательность. Выбирают донорский бактериальный штамм, содержащий конъюгативный вектор, который не обладает способностью реплицироваться в бактериальном штамме хозяина. Модифицированную последовательность лигируют в этот вектор. Полученную конструкцию вводят в донорский бактериальный штамм. Отбирают донорские бактерии, в которых исходный вектор и конъюгативный вектор прошли рекомбинацию. Конъюгативный вектор переносят с помощью конъюгации в бактериальный штамм-хозйин. Отбирают штаммы, у которых последовательность, кодирующая фермент D-лактатдегидрогеназу, заменена модифицированной последовательностью, а последовательность ДНК конъюгативного вектора удалена из генома. Штаммы Lactobacillus johnsonii CNCM 1-1851 и 1-1852 являются продуцентами L(+)-лактата и используются для приготовления молочных продуктов. Изобретение позволяет получить бактериальные штаммы со способностью выживать в кишечнике, прикрепляться к клеткам кишечника и осуществлять иммуномодуляцию, продуцирующие только L(+)-лактат. 5 с. и 1 з.п.ф-лы, 4 ил.


Комментарии