Фармацевтическая композиция для лечения и предотвращения дегенеративных неврологических нарушений, которая содержит, в качестве активного ингредиента, смешанный экстракт коры корня пиона полукустарникового, корня дудника даурского и корня володушки или ег - RU2668135C1
Код документа: RU2668135C1
Чертежи



Описание
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
1. Область изобретения
Настоящее изобретение относится к фармацевтической композиции для лечения и предотвращения дегенеративных неврологических нарушений, которая содержит смешанный экстракт двух или больше типов, выбранных из группы, состоящей из коры корня пиона полукустарникового (Moutan Radicis Cortex), корня дудника даурского (Angelicae Dahuricae Radix) и корня володушки (Bupleuri Radix), или его фракцию в качестве активного ингредиента.
2. Описание связанной области
За последние два десятилетия в мире быстро растет число пациентов с дегенеративными неврологическими нарушениями. При лечении дегенеративного неврологического нарушения наиболее важной стадией является предотвращение. Однако причина заболевания до сих пор не полностью понятна, и, таким образом, способ лечения все еще требует изучения. Общий патологический феномен дегенеративного неврологического нарушения представляет собой гибель клеток центральной нервной системы. В отличие от клеток других органов, регенерация клеток центральной нервной системы почти невозможна после гибели клеток, что ведет к постоянной утрате функции. Способы лечения таких заболеваний головного мозга, разработанные до сегодняшнего времени, преимущественно сосредоточены на анализе механизма гибели самих нервных клеток и предотвращении гибели на основании анализа. В соответствии с результатами последних фундаментальных и клинических исследований болезни Альцгеймера и болезни Паркинсона, воспалительная реакция в головном мозге является основной причиной гибели нейронов. В действительности, увеличение медиаторов воспаления и реакционно-способного кислорода подтверждено в цереброспинальной жидкости у пациентов с заболеваниями головного мозга. Также множество активных микроглиальных клеток наблюдают в области повреждения головного мозга, которые указывают, что воспаление головного мозга является основной причиной болезни Паркинсона. Следовательно, ингибирование воспаления головного мозга посредством нейроглиальных клеток стало мишенью при лечении дегенеративного неврологического нарушения. Однако терапевтические средства, разработанные до настоящего момента, эффективны только при регулировании симптомов заболевания, но не эффективны при лечении самого дегенеративного неврологического нарушения. Многие загрязнители окружающей среды, воздействию которых постоянно подвержено современное общество, и мутации в генах, являющиеся результатом загрязнителей, вызывают дегенеративное неврологическое нарушение. Следовательно, необходимо разрабатывать профилактическое и терапевтическое средство для дегенеративного неврологического нарушения на основании идеи, полностью отличающейся от стандартных.
Дегенеративное неврологическое нарушение включает болезнь Альцгеймера, болезнь Паркинсона, инсульт, хорею Гентингтона и повреждение спинного мозга и т. д. Среди этих заболеваний болезнь Паркинсона представляет собой второе наиболее распространенное дегенеративное неврологическое нарушение, которое поражает 1-2% корейцев в возрасте старше 60 и 4-5% корейцев в возрасте старше 85. В последнее время болезнь Паркинсона быстро распространяется в Корее среди людей среднего возраста в их 40-50. В предшествующем сообщении предполагалось, что болезнь Паркинсона вызвана недостатком дофамина, который является результатом гибели дофаминергических нейронов в черном веществе и полосатом теле в среднем мозге. Причина избирательной гибели дофаминергических нейронов до сих пор не объяснена. Соответственно, эффективное лечебное средство и диагностический реактив до сих пор не разработаны. Болезнь Паркинсона демонстрирует такие симптомы, как безэмоциональное лицо, ригидность, тремор, согнутая поза и брадикинезия.
В последнее время сделано предположение о том, что нарушение функции митохондрий может быть причиной различных нейродегенеративных заболеваний, включая болезнь Паркинсона. В качестве генов, вызывающих наследственную болезнь Паркинсона (наследственная БП), идентифицировали гены, участвующие в образовании реакционно-способных частиц кислорода (ROS) и протеолизе, такие как PARKl/4 (α-синуклеин), PARK2 (паркин), PARK6 (PTEN-индуцируемая предполагаемая киназа 1, PINK1), PARK7 (DJ-1) и PARK8 (киназа 2 с богатыми лейцином повторами, LRRK2), существующие во внешней мембране митохондрий, и PARK13 (HTRA2/0MI), существующая во внутренней мембране митохондрий (Nat. Clin. Pract. Neurol 2, 136-146, 2006). PINKI, паркин и DJ-1 вовлечены в такие действия в митохондриальной динамике, как разделение и слияние для поддержания сетевой структуры митохондрий (PLoS BioI. 6, e1000298, 2010).
Спорадическая болезнь Паркинсона (спорадическая БП), составляющая 95% всей болезни Паркинсона, также отличается нарушением митохондриальной активности. Известно, что инсектициды/гербициды, такие как паракват и ротенон, являются материалами, вызывающими нарушение активности митохондрий посредством супрессии системы электронного транспорта митохондрий. MPTP (1-метил-4-фенил-1,2,3,6-тетрагидропиридин), используемый для создания модели болезни Паркинсона на животных, и его метаболит MPP+ известны в качестве избирательных ингибиторов комплекса 1 системы электронного транспорта митохондрий. Этот пример подсказывает, что избирательная гибель дофаминергических нейронов из-за нарушения митохондриальной функции может являться причиной болезни Паркинсона и одновременно восстановление митохондриальной активности может представлять собой важную мишень для лечения болезни Паркинсона
Внутриклеточную органеллу эндоплазматический ретикулум делят на шероховатый эндоплазматический ретикулум (шероховатый ER, RER) с прикрепленными рибосомами и гладкий эндоплазматический ретикулум (гладкий ER, SER). Основная функция шероховатого эндоплазматического ретикулума состоит в синтезе белка. Синтез приблизительно 1/3 внутриклеточных белков происходит в шероховатом эндоплазматическом ретикулуме. В то же время, синтез различных липидов и стероидных гормонов происходит в гладком эндоплазматическом ретикулуме. Гладкий ER также играет важную роль в регуляции внутриклеточной концентрации кальция. Однако анормальная укладка белков в силу различных причин вызывает функциональное повреждение эндоплазматического ретикулума, которое называют стрессом эндоплазматического ретикулума. При длительном стрессе эндоплазматического ретикулума, через различные механизмы сигнальной трансдукции, возрастает апоптоз и массивное образование реакционно-способных частиц кислорода (ROS), что ведет к повреждению клеток. Также сообщалось о том, что стресс эндоплазматического ретикулума также является причиной дегенеративных неврологических нарушений, таких как болезнь Альцгеймера, болезнь Паркинсона, инсульт, хорея Гентингтона и повреждение спинного мозга, наряду с метаболическим синдромом, сахарным диабетом, ожирением и дислипидемией, которые опосредованы повреждением митохондрий (Lindholm et al., 2006; Penas et al., 2007; Yoshida, 2007; Zhang et al., 2006).
Кора корня пиона полукустарникового (Moutan Radicis Cortex) представляет собой кору корня Paeonia suffruticosa Andrews, который является лекарственным растением, содержащим пеонол, пеонифлорин, оксипеонифлорин и чесночную кислоту или пеонифлоригенон. В восточной медицине известно, что кора корня пиона полукустарникового эффективна для расслабления, снятия боли, снятия воспаления и, тем самым, лечения воспалительного заболевания. В последнее время стало известно, что кора корня пиона полукустарникового обладает противомикробной, противовоспалительной, антиоксидантной и омолаживающей активностями, а также сообщалось о эффективности лечения ей заболевания головного мозга в качестве компонента различных смесей.
Корень дудника даурского (Angelicae dahuricae Radix) представляет собой сушеный корень Angelica dahurica Bentham et Hooker f. или Angelica dahurica Bentham et Hooker f. var. formosana Shan et Yuan, который представляет собой растение возрастом 2-3 года, которое является эндемиком в Корее, Китае и Японии. Основными биологически активными соединениями корня дудника даурского являются императорин, изоимператорин, оксипеуцеданин, феллоптерин и биакангеликол. В восточной медицине известны различные эффекты корня дудника даурского. В частности, известно, что он эффективен для облегчения потоотделения, успокоения, боли, простуды, головной боли или зубной боли. Однако нет сообщений об участии корня дудника даурского в улучшении митохондриальной функции и снятии стресса эндоплазматического ретикулума с тем, чтобы улучшать эффект лечения нейронального заболевания.
Корень володушки (Bupleuri Radix) представляет собой лекарственное растение, которое относится к корню Bupleurum falcatum Linne или его вариантам (Umbelliferae).
Основные фармакологические активности корня володушки включают различные фармакологические активности, такие как антипиретическая, болеутоляющая, аналгетическая, антибактериальная, противовирусная и противовоспалительная активности. Главными фармакологическими активностями корня володушки являются антипиретическая, болеутоляющая, аналгетическая, антибактериальная, противовирусная и противовоспалительная активности.
Авторы настоящего изобретения пытались разработать терапевтическое средство для дегенеративного неврологического нарушения из съедобных растений. Как результат, авторы изобретения обнаружили, что экстракт смеси из двух или больше типов, выбранных из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, обладает активностью для восстановления функционального повреждения митохондрий, чтобы ослаблять стресс эндоплазматического ретикулума и одновременно ингибировать воспалительную реакцию, что значительно выше, чем то, что продемонстрировано у каждого отдельного экстракта. Экстракт приведенной выше смеси значительно повышает двигательную координацию и демонстрирует защитный эффект, оказываемый на дофаминергические нейроны in vivo в модели болезни Паркинсона, так что авторы настоящего изобретения подтвердили, что экстракт смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки или их фракция может быть эффективнее в качестве активного ингредиента фармацевтической композиции для лечения и предотвращения дегенеративных неврологических нарушений, что ведет к созданию изобретения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Цель настоящего изобретения состоит в том, чтобы предоставить фармацевтическую композицию для лечения или предотвращения дегенеративных неврологических нарушений, которая содержит экстракт смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового (Moutan Radicis Cortex), корня дудника даурского (Angelicae Dahuricae Radix) и корня володушки (Bupleuri Radix), или его фракцию в качестве активного ингредиента, и здоровой функциональной пище для улучшения или предотвращения дегенеративных неврологических нарушений, которая содержит его же.
Для достижения приведенной выше цели настоящее изобретение предусматривает фармацевтическую композицию для лечения или предотвращения дегенеративных неврологических нарушений, которая содержит экстракт смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового (Moutan Radicis Cortex), корня дудника даурского (Angelicae Dahuricae Radix) и корня володушки (Bupleuri Radix), в качестве активного ингредиента.
Настоящее изобретение также относится к фармацевтической композиции для лечения или предотвращения дегенеративных неврологических нарушений, которая содержит фракцию органического растворителя из экстракта приведенной выше смеси в качестве активного ингредиента.
Настоящее изобретение также относится к здоровой функциональной пище для улучшения или предотвращения дегенеративных неврологических нарушений, которая содержит экстракт смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, в качестве активного ингредиента.
Настоящее изобретение также относится к здоровой функциональной пище для улучшения или предотвращения дегенеративных неврологических нарушений, которая содержит фракцию органического растворителя из экстракта приведенной выше смеси в качестве активного ингредиента.
Настоящее изобретение также относится к способу лечения или предотвращения дегенеративных неврологических нарушений, который включает стадию введения фармацевтически эффективной дозы экстракта смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового (Moutan Radicis Cortex), корня дудника даурского (Angelicae Dahuricae Radix) и корня володушки (Bupleuri Radix), субъекту.
Настоящее изобретение также относится к фармацевтической композиции, которая содержит экстракт смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового (Moutan Radicis Cortex), корня дудника даурского (Angelicae Dahuricae Radix) и корня володушки (Bupleuri Radix), для применения при лечении или предотвращении дегенеративных неврологических нарушений.
Настоящее изобретение также относится к способу лечения или предотвращения дегенеративных неврологических нарушений, который включает стадию введения фармацевтически эффективной дозы фракции органического растворителя из экстракта смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, субъекту.
Кроме того, настоящее изобретение предусматривает фармацевтическую композицию, которая содержит фракцию органического растворителя из экстракта смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, для применения при лечении или предотвращении дегенеративных неврологических нарушений.
ПОЛЕЗНЫЙ ЭФФЕКТ
Экстракт смеси из двух или больше типов, выбранных из группы, состоящей из коры корня пиона полукустарникового (Moutan Radicis Cortex), корня дудника даурского (Angelicae Dahuricae Radix) и корня володушки (Bupleuri Radix), может повышать внутриклеточный уровень АТФ, восстанавливать потенциал поврежденных митохондриальных мембран; и подавлять образование ROS в 1,5 раза сильнее, чем отдельный экстракт, когда функциональное повреждение митохондрий, стресс эндоплазматического ретикулума и воспалительный ответ индуцируют одновременно в модели болезни Паркинсона. Также подтверждали, что экстракт смеси по настоящему изобретению значимо эффективен для улучшения двигательной координации и защиты дофаминергических нейронов в модели болезни Паркинсона на животных, с тем, чтобы экстракт смеси по изобретению или его фракцию можно было эффективно использовать в качестве активного ингредиента фармацевтической композиции для предотвращения и лечения дегенеративного неврологического нарушения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
В заявке предпочтительные варианты осуществления настоящего изобретения легче всего понять со ссылкой на сопроводительные рисунки, на которых:
На фиг. 1 представлено схематическое изображение, которое иллюстрирует процесс создания модели болезни Паркинсона на животном через введение 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (MPTP). В частности, лиофилизированный экстракт в 90% этаноле из смеси, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки в соотношении 1:1:1, растворяли в 3% HPMC и вводили (перорально, p.o.) тестовой мыши (1, 3 или 10 мг/кг), раз в сутки в течение 14 суток. С 8-х суток эксперимента 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (MPTP) вводили (интраперитонеально, i.p.) мыши в дозе 30 мг/кг через три часа после перорального введения в течение 5 суток, что вело к созданию модели болезни Паркинсона на животном. Полученную мышиную модель использовали для поведенческого теста. Животное умерщвляли и осуществляли анализ клеток и вестерн-блоттинг.
На фиг. 2 представлено схематическое изображение, которое иллюстрирует процесс создания модели болезни Паркинсона на животном через введение 6-OHDA (6-гидроксидофамин). В частности, 16 мкг 6-OHDA (6-гидроксидофамин) разводили в 2 мл 0,1% аскорбиновой кислоты и инъецировали посредством стереотактического хирургического вмешательства тестовому животному один раз, что вело к созданию модели болезни Паркинсона на животном. Через одну неделю после хирургического вмешательства лиофилизированный экстракт в 90% этаноле из смеси, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки в соотношении 1:1:1, растворяли в воде и вводили (перорально, p.o.) мыши в дозе 3 мг/кг раз в сутки в течение 7 суток. Полученную мышиную модель использовали для поведенческого теста. Животное умерщвляли и осуществляли анализ клеток и вестерн-блоттинг.
На фиг. 3 представлено схематическое изображение, которое иллюстрирует процесс создания модели болезни Паркинсона на животном через введение ротенона. В частности, лиофилизированный экстракт в 90% этаноле из смеси, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки в соотношении 1:1:1, растворяли в воде и вводили (перорально, p.o.) крысе в дозе 10 мг/кг раз в сутки в течение 6 недель. Через одну неделю после перорального введения, ротенон инъецировали (интраперитонеально, i.p.) крысе в дозе 2,5 мг/кг раз в сутки в течение 5 недель, что вело к созданию модели болезни Паркинсона на животном. Полученную крысиную модель использовали для поведенческого теста. Животное умерщвляли и осуществляли анализ клеток и вестерн-блоттинг.
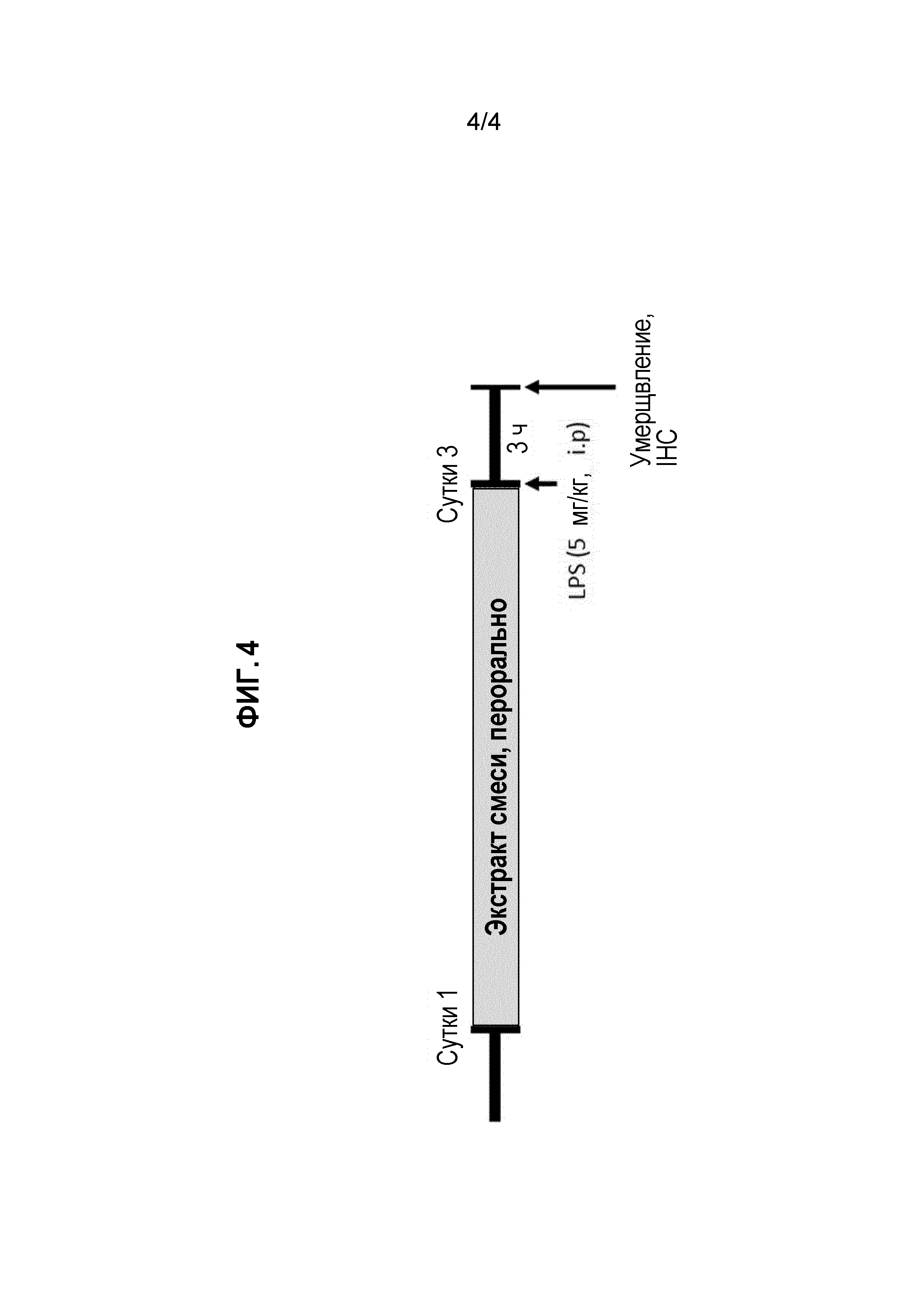
На фиг. 4 представлено схематическое изображение, которое иллюстрирует процесс создания модели болезни Паркинсона на животном через введение LPS (липополисахарид). В частности, лиофилизированный экстракт в 90% этаноле из смеси, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки в соотношении 1:1:1, растворяли в воде и вводили (перорально, p.o.) мыши в дозе 10 или 30 мг/кг раз в сутки в течение 3 суток. После последнего введения LPS (липополисахарид) вводили один раз (интраперитонеально, i.p.) мыши в дозе 5 мг/кг, что вело к созданию модели болезни Паркинсона на животном. Полученную мышиную модель использовали для теста на эффективность снятия воспаления головного мозга.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Далее в настоящем документе настоящее изобретение описано подробно.
Настоящее изобретение предусматривает фармацевтическую композицию для лечения или предотвращения дегенеративных неврологических нарушений, которая содержит экстракт смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового (Moutan Radicis Cortex), корня дудника даурского (Angelicae Dahuricae Radix) и корня володушки (Bupleuri Radix), в качестве активного ингредиента.
Настоящее изобретение также относится к фармацевтической композиции для лечения или предотвращения дегенеративных неврологических нарушений, которая содержит фракцию органического растворителя из экстракта смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, в качестве активного ингредиента.
Предпочтительно смешивать кору корня пиона полукустарникового, корень дудника даурского и корень володушки в массовом соотношении 1:0,2-5:0,2-5 (масс.:масс.:масс.). Более предпочтительно, кору корня пиона полукустарникового, корень дудника даурского и корень володушки смешивают в соотношении 1:0,5-2:0,5-2 (масс.:масс.:масс.), и наиболее предпочтительно в соотношении 1:1:1 (масс.:масс.:масс.), но не всегда с таким ограничением.
Два материала, выбранные из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, предпочтительно смешивают в массовом соотношении 1:0,2-5 (масс.:масс.), более предпочтительно в соотношении 1:0,5-2 (масс.:масс.) и наиболее предпочтительно в соотношении 1:1 (масс.:масс.), но не всегда с таким ограничением.
Экстракт приведенной выше смеси предпочтительно экстрагируют с использованием воды, C1-C4 низшего спирта или их смеси в качестве растворителя, и в этот момент низший спирт предпочтительно представляет собой этанол, метанол или бутанол.
Экстракт смеси предпочтительно экстрагируют из смеси, состоящей по меньшей мере из двух материалов, выбранных из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, но его можно экстрагировать из смеси, состоящей из по меньшей мере двух экстрактов, помимо каждого экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки.
Экстракт приведенной выше смеси предпочтительно получают способом, который включает следующие стадии, но не всегда с таким ограничением:
1) добавление экстракционного растворителя в смесь, состоящую по меньшей мере из двух из тех материалов, которые выбирают из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, после чего следует экстрагирование;
2) фильтрование экстракта со стадии 1); и
3) концентрирование фильтрата, получаемого на стадии 2), при пониженном давлении, после чего следует его сушка.
В приведенном выше способе кору корня пиона полукустарникового, корень дудника даурского и корень володушки со стадии 1) приобретают или культивируют.
В приведенном выше способе, способ экстрагирования экстракта представляет собой любой из таких стандартных способов, как фильтрование, экстрагирование горячей водой, анфлераж, экстрагирование с обратным холодильником и ультразвуковое экстрагирование.
В этом способе концентрирование при пониженном давлении на стадии 3) предпочтительно осуществляют с использованием вакуумного концентратора или вакуумного роторного испарителя, но не всегда с таким ограничением. Сушку в настоящем документе предпочтительно осуществляют посредством сушки при пониженном давлении, вакуумной сушки, сушки кипячением, распылительной сушки или лиофилизационной сушки, но не всегда с таким ограничением.
Указанную фракцию предпочтительно получают из экстракта посредством добавления органического растворителя. Органический растворитель в настоящем документе предпочтительно представляет собой один или несколько растворителей, выбранных из группы, состоящей из гексана, хлороформа, этилацетата и бутанола, и более предпочтительно бутанол, но не всегда с таким ограничением.
Указанный экстракт предпочтительно содержит одно или несколько соединений, выбранных из группы, состоящей из пеонола (2ʹ-гидрокси-4ʹ-метоксиацетофенон), представленного формулой 1, пеонифлорина, представленного формулой 2, пеонифлоригенона ([(2s,3as,5s,7ar,8s)-3a-гидрокси-7a-метил-6-оксогексагидро-2,5-метано-1,3-бензодиоксол-8-ил]метилбензоат), представленного формулой 3, императорина (9-[(3-метил-2-бутен-1-ил)окси]-7h-фуро[3,2-g][1]бензопиран-7-он), представленного формулой 4, сайкосапонина A ((3бета,4альфа,16бета)-13,28-эпокси-16,23-дигидроксиолеан-11-ен-3-ил-6-дезокси-3-O-бета-D-глюкопиранозил-бета-D-галактопиранозид), представленного формулой 5, сайкосапонина B2 ((3b,4a,16a)-16,23,28-тригидроксиолеана-11,13(18)-диен-3-ил-6-дезокси-3-O-бета-D-глюкопиранозил-бета-D-галактопиранозид), представленного формулой 6, сайкосапонина B4 ((3β,11α,16α)-16,23,28-тригидрокси-11-метоксиолеан-12-ен-3-ил-6-дезокси-3-O-β-D-глюкопиранозил-β-D-галактопиранозид), представленного формулой 7, и сайкосапонина D ((3b,4a,16a)-13,28-эпокси-16,23-дигидроксиолеан-11-ен-3-ил 6-дезокси-3-O-бета-D-глюкопиранозил бета-D-галактопиранозид), представленного формулой 8, но не всегда с таким ограничением:
[Формула 1]

[Формула 2]

[Формула 3]

[Формула 4]

[Формула 5]

[Формула 6]

[Формула 7]

[Формула 8]

Приведенный выше экстракт предпочтительно ингибирует функциональное повреждение митохондрий, стресс эндоплазматического ретикулума или воспалительную реакцию, но не всегда с таким ограничением.
Дегенеративное неврологическое нарушение в настоящем документе предпочтительно выбирают из группы, состоящей из деменции, хореи Гентингтона, болезни Паркинсона, болезни Альцгеймера, инсульта, болезни Лу Герига (амиотрофического бокового склероза) и повреждения спинного мозга, но не всегда с таким ограничением.
В предпочтительном варианте осуществления настоящего изобретения авторы настоящего изобретения исследовали восстановление нервных клеток, в которых индуцировали функциональное повреждение для того, чтобы подтверждать эффект отдельного экстракта коры корня пиона полукустарникового, корня дудника даурского или корня володушки.
Как результат, подтверждено, что отдельный экстракт коры корня пиона полукустарникового оказывал восстанавливающий эффект на функциональное повреждение митохондрий (см. таблицы 2-7), тогда как отдельный экстракт корня дудника даурского оказывал восстанавливающий эффект на стресс эндоплазматического ретикулума (см. таблицы 8-13). Также подтверждали, что отдельный экстракт корня володушки оказывал восстанавливающий эффект на воспаление (см. таблицы 14-20).
Экстракт смеси, состоявшей по меньшей мере из двух тех материалов, которые выбирали из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, в соответствии с настоящим изобретением демонстрировал эффект восстановления уровня АТФ и подавлял образование реакционно-способных частиц кислорода в клеточной модели болезни Паркинсона. В частности, экстракт смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки демонстрировал значимый восстанавливающий эффект, оказываемый на функциональное повреждение митохондрий (см. таблицы 21-24).
Авторы настоящего изобретения также исследовали восстанавливающий эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на функцию клеток в клеточной модели болезни Паркинсона в соответствии с соотношением смешивания. Как результат, когда эти растительные материалы смешивали в соотношении 1:1:1 (масс.:масс.:масс.), эффект восстановления функции клеток наиболее выражен (см. таблицы 24-26). Авторы изобретения также исследовали восстанавливающий эффект смешанного этанолового экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на функцию клеток в клеточной модели болезни Паркинсона в соответствии с концентрацией этанола. Как результат, когда обрабатывали экстракт смеси, которую экстрагировали с использованием 90% этанола, комбинированный эффект восстановления функции клеток возрастал наиболее значительно (см. таблицы 28-30). Этаноловый экстракт может увеличивать восстанавливающий эффект наиболее значительно, по сравнению с водным экстрактом, метаноловым экстрактом и бутаноловым экстрактом (см. таблицы 31-33).
Для того чтобы подтверждать эффект смешанного экстракта в 90% этаноле, полученного из смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки в соотношении 1:1:1 (масс.:масс.:масс.), восстанавливающий эффект изучали в нейрональной клеточной линии, в которой индуцировали повреждение функции клеток. Как результат, подтверждено, что экстракт смеси оказывал восстанавливающий эффект на функциональное повреждение митохондрий, стресс эндоплазматического ретикулума и воспаление (см. таблицы 34-38).
Кроме того, модели болезни Паркинсона на животных, которые создавали с использованием 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (MPTP), 6-гидроксидофамина (6-OHDA), ротенона и липополисахарида (LPS), использовали для того, чтобы подтверждать терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый болезнь Паркинсона in vivo. Экстракт смеси вводили в модель болезни Паркинсона на мышах, созданную посредством обработки MPTP, после чего следовал поведенческий тест. Как результат, происходило улучшение двигательной координации в модели болезни Паркинсона по сравнению с животной моделью, которую не лечили экстрактом смеси по изобретению. Также подтверждали, что экстракт смеси по изобретению имеет защитный эффект, оказываемый на дофаминергические нейроны, и восстанавливающий эффект, оказываемый на повреждение системы сигнальной трансдукции в полосатом теле (ST), черном веществе (SN) и мозжечке (см. таблицы 39-47). Поведенческий тест также осуществляли для модели болезни Паркинсона на мышах, которую создавали посредством обработки 6-OHDA. Как результат, подтверждали, что экстракт смеси по изобретению оказывает эффект улучшения на двигательную координацию и защитный эффект на дофаминергические нейроны в полосатом теле и черном веществе (см. таблицы 48-52). Поведенческий тест также осуществляли для модели болезни Паркинсона на мышах, которую создавали посредством обработки ротеноном. Как результат, происходило улучшение двигательной функции, подавляемой ротеноном, и снижение накопления олигомера α-синуклеина, основного патогенного фактора болезни Паркинсона, в черном веществе (см. таблицы 53-54). В то же время, в модели нейровоспаления на мышах, которую создавали посредством введения LPS, активацию микроглии и астроцитов, индуцируемую в черном веществе и гиппокампе, ингибировали с помощью экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки, что указывает на то, что там продемонстрировали эффект снятия воспаления (см. таблицы 55-58).
Экстракт смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению оказывает восстанавливающий эффект на повреждение митохондриальной функции, облегчающий эффект на стресс эндоплазматического ретикулума и также одновременно оказывает ингибирующий эффект на воспалительную реакцию, которые удивительно улучшены по сравнению с тем, что оказывает отдельный экстракт in vitro, и экстракт смеси значимо оказывает эффект улучшения на двигательную координацию и защитный эффект на дофаминергические нейроны в модели болезни Паркинсона на животных, и, таким образом, экстракт смеси по настоящему изобретению или его фракцию можно использовать в качестве активного ингредиента фармацевтической композиции для лечения и предотвращения дегенеративных неврологических нарушений.
Композицию по настоящему изобретению можно вводить перорально или парентерально и использовать в фармацевтическом составе в основных формах. То есть, композицию по настоящему изобретению можно получать для орального или парентерального введения посредством смешивания с обычно используемыми разбавителями или эксципиентами, такими как наполнители, разбавители, связывающие средства, увлажняющие средства, средства для улучшения распадаемости и поверхностно-активные средства.
Твердые составы для перорального введения представляют собой таблетки, пилюли, порошки, гранулы и капсулы. Эти твердые составы получают посредством смешивания указанного бетаина с одним или несколькими подходящими эксципиентами, такими как крахмал, карбонат кальция, сахароза или лактоза, желатин и т. д. Помимо простых эксципиентов, можно использовать смазывающие средства, например, стеарат магния, тальк и т. п. Жидкие составы для перорального введения представляют собой суспензии, растворы, эмульсии и сиропы, и указанные выше составы могут содержать различные эксципиенты, такие как увлажняющие средства, подсластители, ароматические средства и консерванты, в дополнение к обычно используемым простым разбавителям, таким как вода и жидкий парафин.
Составы для парентерального введения представляют собой стерилизованные водные растворы, водонерастворимые эксципиенты, суспензии, эмульсии, лиофилизированные препараты и суппозитории. Водонерастворимые эксципиенты и суспензии могут содержать, в дополнение к активному соединению или соединениям, пропиленгликоль, полиэтиленгликоль, растительное масло, такое как оливковое масло, инъецируемый сложный эфир, такой как этилолеат, и т. д. Суппозитории могут содержать, в дополнение к активному соединению или соединениям, витепсол, макрогол, Tween 61, масло какао, лауриновое масло, глицерин, желатин и т. д.
Композицию по настоящему изобретению можно вводить перорально или парентерально, и парентеральное введение предпочтительно приведено в качестве примера посредством внешнего нанесения на кожу, интраперитонеальной инъекции, интраректальной инъекции, внутривенной инъекции, внутримышечной инъекции, подкожной инъекции, внутриматочной инъекции и интрацеребровентрикулярной инъекции. Среди них, внешнее нанесение на кожу является более предпочтительным.
Композицию по настоящему изобретению предпочтительно вводят в фармацевтически эффективной дозе. Термин «фармацевтически эффективная доза» в настоящем документе обозначает количество, достаточное для того, чтобы лечить заболевание применимой, обоснованной или рискованной концентрацией. Дозу можно определять, учитывая многие факторы, такие как тип заболевания, тяжесть заболевания, активность лекарственного средства, чувствительность к лекарственному средству, частота и путь введения, экскреция, условия лечения, лекарственное средство для совместного лечения и другие факторы, рассматриваемые как релевантные в области медицины. Композицию по настоящему изобретению можно вводить отдельно или вместе с другими лекарственными средствами. Если необходимо совместное лечение, введение можно осуществлять поэтапно или одновременно. Композицию можно вводить однократно или многократно. Важно учитывать все приведенные выше факторы и вводить количество, при котором можно получать максимальный эффект в минимальном количестве без побочных эффектов, которые может легко определять специалист в данной области.
Эффективную дозу соединения по настоящему изобретению можно определять в соответствии с массой, возрастом, полом, состоянием здоровья, диетой, частотой введения, способом введения, экскрецией и тяжестью заболевания. Доза составляет 0,01-1000 мг/кг в сутки, предпочтительно 30-500 мг/кг в сутки и более предпочтительно 50-300 мг/кг в сутки, а частота введения предпочтительно составляет 1-6 раз в сутки. Однако эффективную дозу можно увеличивать или уменьшать в соответствии с путем введения, тяжестью ожирения, полом, массой тела и возрастом пациента и т. п. с тем, чтобы приведенная выше эффективная доза не могла ограничивать настоящее изобретение в каких-либо аспектах.
Композицию по настоящему изобретению можно вводить отдельно или лечение можно осуществлять вместе с хирургической операцией, гормональной терапией, химиотерапией и биологическими регуляторами.
Настоящее изобретение также относится к здоровой функциональной пище для улучшения или предотвращения дегенеративных неврологических нарушений, которая содержит экстракт смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, в качестве активного ингредиента.
Настоящее изобретение также относится к здоровой функциональной пище для улучшения или предотвращения дегенеративных неврологических нарушений, которая содержит фракцию органического растворителя из экстракта смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, в качестве активного ингредиента.
Предпочтительно смешивать кору корня пиона полукустарникового, корень дудника даурского и корень володушки в массовом соотношении 1:0,2-5:0,2-5 (масс.:масс.:масс.). Более предпочтительно кору корня пиона полукустарникового, корень дудника даурского и корень володушки смешивают в соотношении 1:0,5-2:0,5-2 (масс.:масс.:масс.) и наиболее предпочтительно в соотношении 1:1:1 (масс.:масс.:масс.), но не всегда с таким ограничением.
Два материала, выбранные из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, предпочтительно смешивают в массовом соотношении 1:0,2-5 (масс.:масс.), более предпочтительно в соотношении 1:0,5-2 (масс.:масс.) и наиболее предпочтительно в соотношении 1:1 (масс.:масс.), но не всегда с таким ограничением.
Экстракт приведенной выше смеси предпочтительно экстрагируют с использованием воды, C1-C4 низшего спирта или их смеси в качестве растворителя, и в этот момент низший спирт предпочтительно представляет собой этанол, метанол или бутанол.
Экстракт смеси предпочтительно экстрагируют из смеси, состоящей по меньшей мере из двух материалов, выбранных из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, но его можно экстрагировать из смеси, состоящей по меньшей мере из двух экстрактов, помимо каждого экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки.
Указанный смешанный экстракт предпочтительно содержит одно или несколько соединений, выбранных из группы, состоящей из пеонола, представленного формулой 1, пеонифлорина, представленного формулой 2, пеонифлоригенона, представленного формулой 3, императорина, представленного формулой 4, сайкосапонина A, представленного формулой 5, сайкосапонина B2, представленного формулой 6, сайкосапонина B4, представленного формулой 7, и сайкосапонина D, представленного формулой 8, но не всегда с таким ограничением
Экстракт приведенной выше смеси предпочтительно ингибирует функциональное повреждение митохондрий, стресс эндоплазматического ретикулума и воспалительную реакцию, но не всегда с таким ограничением.
Дегенеративное неврологическое нарушение в настоящем документе предпочтительно выбирают из группы, состоящей из деменции, хореи Гентингтона, болезни Паркинсона, болезни Альцгеймера, инсульта, болезни Лу Герига (амиотрофического бокового склероза) и повреждения спинного мозга, и болезнь Паркинсона является более предпочтительной, но не всегда с таким ограничением.
Экстракт смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению оказывает восстанавливающий эффект на повреждение митохондриальной функции, облегчающий эффект на стресс эндоплазматического ретикулума и также одновременно оказывает ингибирующий эффект на воспалительную реакцию, которые удивительно улучшены по сравнению с тем, что оказывает отдельный экстракт in vitro, и экстракт смеси значимо оказывает эффект улучшения на двигательную координацию и защитный эффект на дофаминергические нейроны в модели болезни Паркинсона на животных, и, таким образом, экстракт смеси по настоящему изобретению или его фракцию можно использовать в качестве активного ингредиента здоровой функциональной пищи для улучшения или предотвращения дегенеративных неврологических нарушений.
Настоящее изобретение также относится к способу лечения или предотвращения дегенеративных неврологических нарушений, который включает стадию введения фармацевтически эффективной дозы экстракта смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового (Moutan Radicis Cortex), корня дудника даурского (Angelicae Dahuricae Radix) и корня володушки (Bupleuri Radix), субъекту.
Настоящее изобретение также относится к фармацевтической композиции, которая содержит экстракт смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового (Moutan Radicis Cortex), корня дудника даурского (Angelicae Dahuricae Radix) и корня володушки (Bupleuri Radix), для использования при лечении или предотвращении дегенеративных неврологических нарушений.
Настоящее изобретение также относится к способу лечения или предотвращения дегенеративных неврологических нарушений, который включает стадию введения фармацевтически эффективной дозы фракции органического растворителя из экстракта смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, субъекту.
Кроме того, настоящее изобретение предусматривает фармацевтическую композицию, которая содержит фракцию органического растворителя из экстракта смеси из двух или больше, выбранных из группы, состоящей из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, для использования при лечении или предотвращении дегенеративных неврологических нарушений.
Экстракт смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению оказывает восстанавливающий эффект на повреждение митохондриальной функции, облегчающий эффект на стресс эндоплазматического ретикулума и также одновременно оказывает ингибирующий эффект на воспалительную реакцию, которые удивительно улучшены по сравнению с тем, что оказывает отдельный экстракт in vitro, и экстракт смеси значимо оказывает эффект улучшения на двигательную координацию, защитный эффект на дофаминергические нейроны и противовоспалительный эффект в модели болезни Паркинсона на животных, и, таким образом, экстракт смеси по настоящему изобретению или его фракцию можно использовать в качестве активного ингредиента фармацевтической композиции для лечения и предотвращения дегенеративных неврологических нарушений.
Практические и в настоящее время предпочтительные варианты осуществления настоящего изобретения являются иллюстративными, как показано в дальнейших примерах.
Однако следует принимать во внимание, что специалисты в данной области, по соображениям этого раскрытия, могут выполнять модификации и усовершенствования в пределах сущности и объема настоящего изобретения.
Пример 1: получение отдельного экстракта каждого из коры корня пиона полукустарникового, корня дудника даурского и корня володушки
<1-1> Получение этанолового экстракта коры корня пиона полукустарникового
90% этанол добавляли к коре корня пиона полукустарникового (Moutan Radicis Cortex; Jeungdo Herb Medicine Co., Korea), после чего следовало экстрагирование при комнатной температуре в течение 110 минут. Этаноловый экстракт получали посредством фильтрования экстракта. Получаемый экстракт лиофилизировали и хранили. Во время использования экстракт растворяли в буфере. В качестве маркерного компонента экстракта использовали пеонол для подтверждения чистоты.
<1-2> Получение этанолового экстракта корня дудника даурского
90% этанол добавляли к корню дудника даурского (Angelicae Dahuricae Radix; Jeungdo Herb Medicine Co., Korea). Этаноловый экстракт корня дудника даурского получали таким же образом, как описано в примере <1-1>. В качестве маркерного компонента экстракта корня дудника даурского использовали императорин для подтверждения чистоты.
<1-3> Получение этанолового экстракта корня володушки
90% этанол добавляли к корню володушки (Bupleuri Radix; Jeungdo Herb Medicine Co., Korea). Этаноловый экстракт корня володушки получали таким же образом, как описано в примере <1-1>. В качестве маркерного компонента экстракта корня володушки использовали сайкосапонин A для подтверждения чистоты.
Пример 2: получение смешанного экстракта коры корня пиона полукустарникового и корня дудника даурского
Кору корня пиона полукустарникового и корень дудника даурского смешивали в соотношении 1:5, 1:1 или 1:0,2 (масс.:масс.) и добавляли 90% этанол, после чего следовало экстрагирование при комнатной температуре в течение 110 минут. Смешанный этаноловый экстракт коры корня пиона полукустарникового и корня дудника даурского получали посредством фильтрования экстракта. Полученный смешанный этаноловый экстракт лиофилизировали и хранили. Во время использования экстракт растворяли в воде или буфере. В качестве маркерных компонентов смешанного экстракта для подтверждения чистоты использовали пеонол и императорин.
Пример 3: получение смешанного экстракта коры корня пиона полукустарникового и корня володушки
Кору корня пиона полукустарникового и корень володушки смешивали в соотношении 1:5, 1:1 или 1:0,2 (масс.:масс.) и добавляли 90% этанол, после чего следовало экстрагирование при комнатной температуре в течение 110 минут. Смешанный этаноловый экстракт коры корня пиона полукустарникового и корня володушки получали посредством фильтрования экстракта. Полученный смешанный этаноловый экстракт лиофилизировали и хранили. Во время использования экстракт растворяли в буфере. В качестве маркерных компонентов смешанного экстракта для подтверждения чистоты использовали пеонол и сайкосапонин A.
Пример 4: получение смешанного экстракта корня дудника даурского и корня володушки
Корень дудника даурского и корень володушки смешивали в соотношении 1:5, 1:1 или 1:0,2 (масс.:масс.) и добавляли 90% этанол, после чего следовало экстрагирование при комнатной температуре в течение 110 минут. Смешанный этаноловый экстракт корня дудника даурского и корня володушки получали посредством фильтрования экстракта. Полученный смешанный этаноловый экстракт лиофилизировали и хранили. Во время использования экстракт растворяли в буфере. В качестве маркерных компонентов смешанного экстракта для подтверждения чистоты использовали императорин и сайкосапонин A.
Пример 5: получение смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
<5-1> Получение смешанного этанолового экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Кору корня пиона полукустарникового, корень дудника даурского и корень володушки смешивали в соотношении, представленном далее в таблице 1, и добавляли 10, 30, 50, 70 или 90% этанол, после чего следовало экстрагирование при комнатной температуре в течение 110 минут. Смешанный этаноловый экстракт коры корня пиона полукустарникового, корня дудника даурского и корня володушки получали посредством фильтрования экстракта. Полученный смешанный этаноловый экстракт лиофилизировали и хранили. Во время использования экстракт растворяли в буфере. В качестве маркерных компонентов смешанного экстракта для подтверждения чистоты использовали пеонол, сайкосапонин A и императорин.
Таблица 1
Соотношение смешивания коры корня пиона полукустарникового, корня дудника даурского и корня володушки
<5-2> Получение смешанного водного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Кору корня пиона полукустарникового, корень дудника даурского и корень володушки смешивали в соотношении 1:1:1 (масс.:масс.:масс.) и добавляли воду. Смешанный водный экстракт коры корня пиона полукустарникового, корня дудника даурского и корня володушки получали таким же образом, как описано в примере <5-1>.
<5-3> Получение смешанного метанолового экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Кору корня пиона полукустарникового, корень дудника даурского и корень володушки смешивали в соотношении 1:1:1 (масс.:масс.:масс.) и добавляли 90% метанол. Смешанный метаноловый экстракт коры корня пиона полукустарникового, корня дудника даурского и корня володушки получали таким же образом, как описано в примере <5-1>.
<5-4> Получение смешанного бутанолового экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Кору корня пиона полукустарникового, корень дудника даурского и корень володушки смешивали в соотношении 1:1:1 (масс.:масс.:масс.) и добавляли 90% бутанол. Смешаный бутаноловый экстракт коры корня пиона полукустарникового, корня дудника даурского и корня володушки получали таким же образом, как описано в примере <5-1>.
Экспериментальный пример 1: оценка внутриклеточной эффективностивности экстракта коры корня пиона полукустарникового и его активного компонента
<1-1> Эффект экстракта коры корня пиона полукустарникового и его активного компонента, оказываемый на коэффициент выживаемости клеток
Для того чтобы оценивать внутриклеточную эффективностость экстракта коры корня пиона полукустарникового по настоящему изобретению и его активного компонента, изучали цитотоксичность в клетках нейробластомы человека.
В частности, SH-SY5Y, клеточную линию нейробластомы человека, инокулировали в DMEM/F12 (модифицированная Дульбекко среда Игла и среда Хэма F12; Gibco, USA) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 2,5×104 клеток/лунка. Клетки обрабатывали экстрактом коры корня пиона полукустарникового, полученным в примере <1-1>, или его активным компонентом, пеонолом, пеонифлорином или пеонифлоригеноном в концентрации 1,0 мкг/мл в течение 4 часов. Клетки собирали и коэффициент выживаемости клеток измеряли с использованием кальцеина. Коэффициент выживаемости клеток, который повышался или снижался по сравнению с таковым у нормальных контрольных клеток, которые не обрабатывали экстрактом или его активным компонентом, приведенным выше, и вместо этого обрабатывали DMSO, вычисляли и представляли в виде процентной доли (%).
Как результат, как показано далее в таблице 2, экстракт коры корня пиона полукустарникового и его активный компонент не демонстрируют цитотоксичность в нормальных клетках (таблица 2).
Таблица 2
Эффект экстракта коры корня пиона полукустарникового и его активного компонента, оказываемый на коэффициент выживаемости клеток
<1-2> Ингибирующий эффект экстракта коры корня пиона полукустарникового и его активного компонента, оказываемый на гибель клеток, индуцированную митохондриальным повреждением
Для того чтобы исследовать эффект экстракта коры корня пиона полукустарникового и его активного ингредиента, оказываемый на восстановление митохондриального функционального повреждения, MTT анализ осуществляли для того, чтобы подтверждать восстанавливающий эффект, оказываемый на повреждение митохондриального комплекса 1 в клетках.
В частности, SH-SY5Y, клеточную линию нейробластомы человека, инокулировали в DMEM/F12 (1:1, модифицированная Дульбекко среда Игла и среда Хэма F12; Gibco, USA) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали экстрактом коры корня пиона полукустарникового в 90% этаноле, полученным в примере <1-1>, или его активным компонентом, пеонолом, пеонифлорином или пеонифлоригеноном в концентрации 1,0 мкг/мл, после чего следовало культивирование в течение 4 часов. Затем клетки обрабатывали с использованием 50 мкг/мл атразина (2-хлор-4-(этиламин)-6-(изопропиламин)-s-триазин, ATZ), после чего следовало культивирование в течение 24 часов для того, чтобы индуцировать нарушение функции митохондрий. Клетки с митохондриями с нарушением функции обрабатывали с использованием 0,2 мг/мл MTT (3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2H-тетразолия бромид, MTT; Sigma, USA), после чего следовало культивирование в течение 4 часов. Затем MTT формазановый преципитат, образованный выжившими клетками, растворяли в 100 мл 0,04 Н HCl/изопропаноле. OD540 измеряли на считывателе микропланшетов ELISA (Molecular Devices, USA). Повреждение митохондриального комплекса 1 подтверждали для того, чтобы видеть, как увеличивался или снижался уровень повреждения, по сравнению с нормальной контрольной группой, которую обрабатывали DMSO без экстракта или его активного компонента. В то же время, группу отрицательного контроля обрабатывали только атразином 50 мкг/мл для того, чтобы индуцировать митохондриальное повреждение, и не обрабатывали экстрактом или его активным компонентом. Затем MTT анализ осуществляли таким же образом, как описано выше.
Как результат, как показано далее в таблице 3, митохондриальное повреждение, индуцированное атразином, восстанавливали до нормального уровня посредством обработки экстрактом коры корня пиона полукустарникового в 90% этаноле, пеонолом, пеонифлорином или пеонифлоригеноном (таблица 3).
Таблица 3
Восстанавливающий эффект экстракта коры корня пиона полукустарникового и его активного компонента, оказываемый на повреждение митохондриального комплекса 1
<1-3> Восстанавливающий эффект экстракта коры корня пиона полукустарникового и его активного компонента, оказываемый на утрату АТФ в результате повреждения митохондрий
Для того чтобы исследовать эффект экстракта коры корня пиона полукустарникового и его активного ингредиента, оказываемый на восстановление митохондриального функционального повреждения, осуществляли анализ АТФ для того, чтобы подтверждать восстанавливающий эффект, оказываемый на утрату АТФ в клетках.
В частности, клетки SH-SY5Y культивировали таким же образом, как описано в экспериментальном примере <1-2>, которые обрабатывали 50 мкг/мл атразина для того, чтобы индуцировать нарушение функции митохондрий. Затем 100 мл клеточного лизата, полученного из клеток с митохондриями с нарушением функции, смешивали с 100 мл люциферин-люциферазы, используя набор для биолюминесцентного анализа АТФ в соматических клетках (Sigma, USA), после чего следовало культивирование при 20°C в течение 10 минут. Получали супернатант. Сигнал флуоресценции измеряли с использованием люминометра LB 9501 Lumat (Berthold, Germany). Флуоресценцию контрольной лунки, содержащей среду без клеток, использовали в качестве фона. Измеряемые значения вычисляли посредством вычитания фона и нормализовали количество АТФ по концентрации белка. Нормальный контроль не обрабатывали экстрактом по изобретению или его активным компонентом, но вместо этого обрабатывали только DMSO. Все результаты представлены в виде % от нормального контроля, чтобы представлять внутриклеточный уровень АТФ. Отрицательный контроль обрабатывали только 50 мкг/мл атразина для того, чтобы индуцировать митохондриальное повреждение, и не обрабатывали экстрактом или его активным компонентом. Внутриклеточный уровень АТФ измеряли таким же образом, как описано выше.
Как результат, как показано далее в таблице 4, митохондриальное повреждение, индуцированное атразином, восстанавливали до нормального уровня посредством обработки экстрактом коры корня пиона полукустарникового в 90% этаноле, пеонолом, пеонифлорином или пеонифлоригеноном (таблица 4).
Таблица 4
Восстанавливающий эффект экстракта коры корня пиона полукустарникового и его активного компонента, оказываемый на утрату внутриклеточного АТФ
<1-4> Экспрессия гена, вовлеченного в болезнь Паркинсона или митохондрии, соответствующая экстракту коры корня пиона полукустарникового и его активному компоненту
Для того чтобы исследовать эффект экстракта коры корня пиона полукустарникового по настоящему изобретению и его активного компонента, оказываемый на восстановление функции поврежденных митохондрий, уровни экспрессии гена субъединицы III цитохром c-оксидазы (COX III), кодируемого митохондриальным геном, и Park7 (DJ-1), одного из генов, вызывающих наследственную болезнь Паркинсона, измеряли с помощью ПЦР в реальном времени (RT-ПЦР).
В частности, клетки SH-SY5Y культивировали таким же образом, как описано в экспериментальном примере <1-2>, и индуцировали нарушение функции митохондрий. После этого клетки с митохондриями с нарушением функции суспендировали в TRIzol (Invitrogen, USA) и из них экстрагировали общую РНК в соответствии с протоколом прозводителя. Общую кДНК синтезировали с использованием 1 мкг экстрагированной РНК. ПЦР осуществляли в GeneAmp PCR system 9700 (Applied Biosystem, USA) при требуемых оптимальных условиях, используя синтезированную кДНК в качестве матрицы в присутствии прямого и обратного праймеров, перечисленных далее в таблице 5, что вело к амплификации генов COX III и Park7 (DJ-1). Электрофорез амплифицированных продуктов ПЦР проводили на 1,5% агарозном геле. Относительную концентрацию измеряли с использованием прибора для измерения оптической плотности изображений (программное обеспечение Alpha Ease FC; Alpha Innotech, USA) под УФ. Уровень мРНК стандартизовали посредством сравнения с уровнем 18S рРНК. Нормальный контроль не обрабатывали экстрактом по изобретению или его активным компонентом, но вместо этого обрабатывали только DMSO. Отрицательный контроль обрабатывали только 50 мкг/мл атразина для того, чтобы индуцировать митохондриальное повреждение, и не обрабатывали экстрактом или его активным компонентом. Уровень экспрессии генов изучали таким же образом, как описано выше.
Таблица 5
Последовательности праймеров, используемых в этом изобретении
Как результат, как показано в таблице 6 и таблице 7, сниженные экспрессии COX III, кодируемой митохондриальным геном, и Park7 (DJ-1), одного из генов, вызывающих наследственную болезнь Паркинсона, восстанавливали до нормального уровня (таблицы 6 и 7).
Таблица 6
Экспрессия COX III, соответствующая экстракту коры корня пиона полукустарникового и его активному компоненту
Таблица 7
Экспрессия Park7 (DJ-1), соответствующая экстракту коры корня пиона полукустарникового и его активному компоненту
Экспериментальный пример 2: оценка внутриклеточной эффективностивности экстракта корня дудника даурского и его активного компонента
<2-1> Эффект экстракта корня дудника даурского и его активного компонента, оказываемый на коэффициент выживаемости клеток
Для того чтобы оценивать внутриклеточную эффективностость экстракта корня дудника даурского по настоящему изобретению и его активного компонента, изучали цитотоксичность в клетках нейробластомы человека.
В частности, клетки SH-SY5Y культивировали таким же образом, как описано в экспериментальном примере <1-1>. Культивируемые клетки переносили в бессывороточную среду с плотностью 2,5×104 клеток/лунка. Клетки обрабатывали с использованием 1,0 мкг/мл экстракта корня дудника даурского, полученного в примере <1-2>, или 0,5 мкг/мл или 1,0 мкг/мл его активного компонента, императорина, в течение 4 часов. Собирали клетки и измеряли коэффициент выживаемости клеток с использованием кальцеина. Коэффициент выживаемости клеток, который увеличивался или уменьшался по сравнению с таковым у нормальной контрольной группы, которую не обрабатывали приведенным выше экстрактом или его активным компонентом и вместо этого обрабатывали DMSO, вычисляли и представляли в виде процентной доли (%).
Как результат, как показано в таблице 8, экстракт корня дудника даурского и императорин не вызывают цитотоксичность в нормальных клетках в концентрации 0,5 мкг/мл. Однако императорин вызывает токсичность на низком уровне в концентрации 1 мкг/мл (таблица 8).
Таблица 8
Коэффициент выживаемости клеток, соответствующий экстракту корня дудника даурского и его активному компоненту
<2-2> Ингибирующий эффект экстракта корня дудника даурского и его активного компонента, оказываемый на гибель клеток, индуцированную стрессом эндоплазматического ретикулума
Для того чтобы исследовать, может ли экстракт корня дудника даурского по изобретению и его активный компонент индуцировать восстановление от стресса эндоплазматического ретикулума или нет, осуществляли MTT анализ с клетками, которые имеют стресс эндоплазматического ретикулума, индуцированный обработкой туникамицином (Tuni), который, как известно, индуцирует стресс эндоплазматического ретикулума посредством ингибирования N-гликозилирования, или посредством обработки тапсигаргином (Thap), который, как известно, индуцирует стресс эндоплазматического ретикулума посредством нарушения гомеостаза кальция, чтобы подтверждать восстановление повреждения митохондриального комплекса 1 в живых клетках.
В частности, клетки SH-SY5Y культивировали таким же образом, как описано в экспериментальном примере <1-2>. Клетки обрабатывали с использованием 1,0 мкг/мл экстракта корня дудника даурского, полученного в примере <1-2>, или 0,5 мкг/мл или 1,0 мкг/мл императорина, его активного компонента, после чего следовало культивирование в течение 4 часов. Клетки обрабатывали с использованием 0,5 мкг/мл тапсигаргина (Thap) или 1 мкг/мл туникамицина (Tuni), после чего следовало культивирование в течение 24 часов для того, чтобы индуцировать стресс эндоплазматического ретикулума. После этого осуществляли MTT анализ таким же образом, как описано в экспериментальном примере <1-2>. По сравнению с нормальными контрольными клетками, которые не обрабатывали экстрактом или его активным компонентом, но обрабатывали DMSO, изучали повреждение митохондриального комплекса 1 в клетках, будь то увеличение или уменьшение. Отрицательный контроль обрабатывали с использованием 0,5 мкг/мл тапсигаргина или 1 мкг/мл туникамицина для того, чтобы вызывать стресс эндоплазматического ретикулума, но не обрабатывали экстрактом или его активным компонентом, после чего следовал MTT анализ таким же образом, как описано выше.
Как результат, как показано в таблице 9 и таблице 10, функциональное повреждение митохондрий и гибель клеток, индуцированные стрессом эндоплазматического ретикулума, обусловленным тапсигаргином или туникамициномом, восстанавливали до нормального уровня посредством обработки экстрактом корня дудника даурского в 90% этаноле и императорином (таблицы 9 и 10).
Таблица 9
Восстанавливающий эффект экстракта корня дудника даурского и его активного компонента, оказываемый на стресс эндоплазматического ретикулума, опосредованный повреждением митохондриального комплекса 1, индуцированным тапсигаргином
Таблица 10
Восстанавливающий эффект экстракта корня дудника даурского и его активного компонента, оказываемый на стресс эндоплазматического ретикулума, опосредованный повреждением митохондриального комплекса 1, индуцированным туникамицином
<2-3> Восстанавливающий эффект экстракта корня дудника даурского и его активного компонента, оказываемый на утрату АТФ в результате стресса эндоплазматического ретикулума
Для того чтобы исследовать эффект экстракта корня дудника даурского и его активного компонента, оказываемый на восстановление стресса эндоплазматического ретикулума, осуществляли анализ АТФ для того, чтобы подтверждать восстанавливающий эффект, оказываемый на утрату АТФ в клетках.
В частности, клетки SH-SY5Y культивировали таким же образом, как описано в экспериментальном примере <2-2>, и индуцировали стресс эндоплазматического ретикулума. После этого внутриклеточный уровень АТФ измеряли таким же образом, как описано в экспериментальном примере <1-3>. Нормальный контроль не обрабатывали экстрактом по изобретению или его активным компонентом, но обрабатывали только DMSO. Все результаты представлены в виде % от нормального контроля, чтобы представлять внутриклеточный уровень АТФ. Отрицательный контроль не обрабатывали экстрактом или активным компонентом, но обрабатывали только 0,5 мкг/мл тапсигаргина или 1,0 мкг/мл туникамицина для того, чтобы индуцировать стресс эндоплазматического ретикулума. После этого внутриклеточный уровень АТФ измеряли таким же образом, как описано выше.
Как результат, как показано в таблице 11, функциональное повреждение митохондрий и гибель клеток у клеток нейробластомы человека, индуцированные стрессом эндоплазматического ретикулума, обусловленным тапсигаргином или туникамицином, восстанавливали до нормального уровня посредством обработки экстрактом корня дудника даурского в 90% этаноле и императорином (таблица 11).
Таблица 11
Восстанавливающий эффект экстракта корня дудника даурского и его активного компонента, оказываемый на утрату внутриклеточного АТФ
<2-4> Экспрессия маркерного гена стресса эндоплазматического ретикулума, соответствующая экстракту корня дудника даурского и его активному компоненту
Для того чтобы исследовать эффект экстракта корня дудника даурского по настоящему изобретению и его активного компонента, оказываемый на восстановление стресса эндоплазматического ретикулума, измеряли уровни экспрессии маркерных генов стресса эндоплазматического ретикулума GRP78 и XBP1p.
В частности, клетки SH-SY5Y культивировали таким же образом, как описано в экспериментальном примере <2-2>, и индуцировали стресс эндоплазматического ретикулума. После этого осуществляли RT-ПЦР с клетками, имеющими стресс эндоплазматического ретикулума, таким же образом, как описано в экспериментальном примере <1-4>, после чего следовал электрофорез для того, чтобы исследовать уровни экспрессии генов GRP78 и XBP1p, на 1,5% агарозном геле под УФ. Нормальный контроль не обрабатывали экстрактом по изобретению или его активным компонентом, но обрабатывали только DMSO. Отрицательный контроль не обрабатывали экстрактом или активным компонентом, но обрабатывали только 0,5 мкг/мл тапсигаргина для того, чтобы индуцировать стресс эндоплазматического ретикулума. После этого экспрессию маркерного гена стресса эндоплазматического ретикулума подтверждали таким же образом, как описано выше.
Как результат, как показано в таблице 12 и таблице 13, уровни экспрессии маркерных генов стресса эндоплазматического ретикулума GRP78 и XBP1p восстанавливали до нормального уровня в клетках, имеющих стресс эндоплазматического ретикулума, индуцированный в них, посредством обработки экстрактом корня дудника даурского в 90% этаноле и императорином (таблицы 12 и 13).
Таблица 12
Экспрессия мРНК GRP78 в соответствии с экстрактом корня дудника даурского и его активным компонентом в клетках, имеющих стресс эндоплазматического ретикулума, индуцированный тапсигаргином
Таблица 13
Экспрессия мРНК XBP1p, соответствующая экстракту корня дудника даурского и его активному компоненту, в клетках, имеющих стресс эндоплазматического ретикулума, индуцированный тапсигаргином
Экспериментальный пример 3: оценка внутриклеточной эффективности экстракта корня володушки и его активного компонента
<3-1> Эффект экстракта корня володушки и его активного компонента, оказываемый на коэффициент выживаемости клеток
Для того чтобы оценивать внутриклеточную эффективность экстракта корня володушки по настоящему изобретению и его активного компонента, изучали цитотоксичность в микроглиальных клетках мыши.
В частности, BV2, микроглиальную клеточную линию мыши, инокулировали в 1:1 DMEM (модифицированная Дульбекко среда Игла; Gibco, USA) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 2,5×104 клеток/лунка. Клетки обрабатывали экстрактом корня володушки в 90% этаноле, полученным в примере <1-3>, сайкосапонином A, сайкосапонином B2, сайкосапонином B4 или сайкосапонином D в концентрации 1,0 мкг/мл в течение 4 часов. Клетки собирали и коэффициент выживаемости клеток измеряли с использованием кальцеина. Коэффициент выживаемости клеток, который увеличивался или уменьшался по сравнению с таковым у нормальных контрольных клеток, которые не обрабатывали приведенным выше экстрактом или его активным компонентом и вместо этого обрабатывали DMSO, вычисляли и представляли в виде процентной доли (%).
Как результат, как показано далее в таблице 14, экстракт корня володушки и его активный компонент не демонстрируют цитотоксичность в нормальных клетках (таблица 14).
Таблица 14
Эффект экстракта корня володушки и его активного компонента, оказываемый на коэффициент выживаемости клеток
<3-2> Ингибирующий эффект экстракта корня володушки и его активного компонента, оказываемый на гибель клеток, индуцируемую воспалительной реакцией
Для того чтобы исследовать ингибирующий эффект экстракта корня володушки по настоящему изобретению и его активного ингредиента, оказываемый на воспалительную реакцию, осуществляли MTT анализ с клетками, которые имеют воспалительную реакцию, индуцированную липополисахаридом (LPS), для того, чтобы подтверждать восстанавливающий эффект, оказываемый на повреждение митохондриального комплекса 1 в живых клетках.
В частности, клетки BV2 культивировали таким же образом, как описано в экспериментальном примере <3-1>. Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали экстрактом корня володушки в 90% этаноле, полученным в примере <1-3>, сайкосапонином A, сайкосапонином B2, сайкосапонином B4 или сайкосапонином D в концентрации 1,0 мкг/мл, после чего следовало культивирование в течение 4 часов. Затем клетки обрабатывали с использованием 100 нг/мл липополисахарида (LPS), после чего следовало культивирование в течение 20 часов для того, чтобы индуцировать воспалительную реакцию. Осуществляли MTT анализ с клетками, у которых индуцировали воспалительную реакцию таким же образом, как описано в экспериментальном примере <1-2>. Повреждение митохондриального комплекса 1 подтверждали, чтобы видеть как повышается или снижается уровень повреждения по сравнению с нормальной контрольной группой, которую обрабатывали DMSO без экстракта или его активного компонента. В то же время, группу отрицательного контроля обрабатывали только 100 нг/мл LPS для того, чтобы индуцировать воспалительную реакцию и не обрабатывали экстрактом или его активным компонентом. После этого MTT анализ осуществляли таким же образом, как описано выше.
Как результат, как показано далее в таблице 15, воспалительную реакцию, которую индуцировали посредством LPS, восстанавливали до нормального уровня посредством обработки экстрактом корня володушки в 90% этаноле, сайкосапонином A, сайкосапонином B2, сайкосапонином B4 или сайкосапонином D (таблица 15).
Таблица 15
Восстанавливающий эффект экстракта корня володушки и его активного компонента, оказываемый на повреждение митохондриального комплекса 1
<3-3> Снижение воспалительной реакции, зависящей от оксида азота (II) (NO), экстрактом корня володушки и его активным компонентом
Для того чтобы исследовать восстанавливающий эффект экстракта корня володушки по настоящему изобретению и его активного компонента, оказываемый на воспалительную реакцию, способ Грисса осуществляли для того, чтобы измерять концентрацию нитрита/нитрата(NOx) в клеточной культуральной среде.
В частности, клетки BV2 культивировали таким же образом, как описано в экспериментальном примере <3-1>, и индуцировали воспалительную реакцию. После этого получали 100 мл клеточной культуральной среды, в которую добавляли 100 мл реактива Грисса, содержащего соляную кислоту, 5% сульфаниламид и 2% нафтилэтилендиамин, после чего следовала реакция в темном помещении в течение 30 минут. По завершении реакции, OD540 измеряли с использованием считывателя микропланшетов EISA (Versamax, USA). Концентрацию оксида азота (II) в среде вычисляли с использованием стандартной калибровочной кривой для нитрита натрия. Нормальный контроль не обрабатывали экстрактом или его активным компонентом, но обрабатывали DMSO. Отрицательный контроль обрабатывали только 100 нг/мл LPS для того, чтобы индуцировать воспалительную реакцию, но не обрабатывали экстрактом или активным компонентом. После этого изучали эффект снижения концентрации оксида азота (II) таким же образом, как описано выше.
Как результат, как показано в таблице 16, подтверждали, что экстракт корня володушки в 90% этаноле, сайкосапонин A, сайкосапонин B2, сайкосапонин B4, и сайкосапонин D обладают эффектом подавления LPS-опосредованного образования NO (таблица 16).
Таблица 16
Эффект экстракта корня володушки и его активного компонента, оказываемый на снижение концентрации оксида азота (II) (NO)
<3-4> Экспрессия маркерного гена воспалительной реакции, соответствующая экстракту корня володушки и его активному компоненту
Для того чтобы исследовать эффект экстракта корня володушки по настоящему изобретению и его активного компонента, оказываемый на восстановление воспалительной реакции, уровни экспрессии маркерных генов воспалительной реакции индуцибельной синтазы оксида азота (II) (iNOS), интерлейкина-6 (IL-6) и NF-kB p65/ReIA.
В частности, клетки BV2 культивировали таким же образом, как описано в экспериментальном примере <3-1>, и индуцировали воспалительную реакцию. После этого осуществляли RT-ПЦР с клетками таким же образом, как описано в экспериментальном примере <1-4>, после чего следовал количественный анализ уровней экспрессии генов iNOS, IL-6 и NF-kB p65/ReIA. Нормальный контроль не обрабатывали экстрактом по изобретению или его активным компонентом, но обрабатывали только DMSO. Отрицательный контроль не обрабатывали экстрактом или активным компонентом, но обрабатывали только 100 нг/мл LPS для того, чтобы индуцировать воспалительную реакцию. После этого экспрессию маркерного гена воспалительной реакции подтверждали таким же образом, как описано выше.
Как результат, как показано в таблицах 17-19, уровни экспрессии маркерных генов воспалительной реакции iNOS, IL-6 и NF-kB p65/ReIA восстанавливали до нормального уровня в клетках, имеющих воспалительную реакцию, индуцированную в них, посредством обработки экстрактом корня володушки в 90% этаноле, сайкосапонином A, сайкосапонином B2, сайкосапонином B4 и сайкосапонином D (таблицы 17-19).
Таблица 17
Экспрессия мРНК iNOS, соответствующая экстракту корня володушки и его активному компоненту
Таблица 18
Экспрессия мРНК IL-6, соответствующая экстракту корня володушки и его активному компоненту
Таблица 19
Экспрессия мРНК p65/ReIA, соответствующая экстракту корня володушки и его активному компоненту
<3-5> Снижение образования реакционно-способных частиц кислорода (ROS) экстрактом корня володушки и его активным компонентом
Для того чтобы исследовать восстанавливающий эффект экстракта корня володушки по настоящему изобретению и его активного компонента, оказываемый на воспалительную реакцию, концентрацию внутриклеточных ROS измеряли с использованием 2ʹ,7ʹ-дихлорфлуоресцеина диацетата (DCF-DA).
В частности, клетки BV2 культивировали таким же образом, как описано в экспериментальном примере <3-1>, и индуцировали воспалительную реакцию. После этого клетки, в которых индуцировали воспалительную реакцию, обрабатывали 1 мкМ DCF-DA и 0,05 мкМ бисбензимида (Hoechst 33342), после чего следовало окрашивание при 37°C в течение 1 часа. После окрашивания интенсивность флуоресценции DCF-DA измеряли на 485 нм/535 нм и интенсивность флуоресценции бисбензимида измеряли на 335 нм/460 нм. На основании соотношения DCF-DA/бисбензимид определяли количество ROS. Количество ROS, повышенное или пониженное, сравнивали с таковым у нормального контроля, который не обрабатывали экстрактом или его активным компонентом, но обрабатывали DMSO, и результаты представляли в виде %. Отрицательный контроль обрабатывали только 100 нг/мл LPS для того, чтобы индуцировать воспалительную реакцию, но не обрабатывали экстрактом или его активным компонентом. После этого образование ROS изучали таким же образом, как описано выше.
Как результат, как показано в таблице 20, подтверждали, что экстракт корня володушки в 90% этаноле по настоящему изобретению, сайкосапонин A, сайкосапонин B2, сайкосапонин B4 и сайкосапонин D обладают эффектом снижения образования ROS, опосредованного DCF-DA, которое обусловлено воспалительной реакцией и стрессом (таблица 20).
Таблица 20
Эффект экстракта корня володушки и его активного компонента, оказываемый на снижение образования реакционно-способных частиц кислорода (ROS)
Экспериментальный пример 4: оценка внутриклеточной эффективности смешанного экстракта, содержащего по меньшей мере два из коры корня пиона полукустарникового, корня дудника даурского и корня володушки
<4-1> Восстанавливающий эффект смешанного экстракта, содержащего по меньшей мере два из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на митохондриальную активность в клеточной модели болезни Паркинсона
Для того чтобы исследовать восстанавливающий эффект экстракта смеси, содержащей по меньшей мере два из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на митохондриальную активность в клеточной модели болезни Паркинсона, исследовали показатель митохондриальной активности в клеточной модели болезни Паркинсона.
В частности, SH-SY5Y, клеточную линию нейробластомы человека, инокулировали в DMEM/F12 (1:1) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали смешанным экстрактом коры корня пиона полукустарникового и корня дудника даурского в 90% этаноле, полученным в примере 2, смешанным экстрактом коры корня пиона полукустарникового и корня володушки в 90% этаноле, полученным в примере 3, смешанным экстрактом корня дудника даурского и корня володушки в 90% этаноле, полученным в примере 4, или смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле, полученным в примере <5-1>, в концентрации 1 мкг/мл, после чего следовало культивирование в течение 4 часов. По завершении культивирования клетки обрабатывали 1-метил-4-фенилпиридинием (MPP+) в концентрации 1 мМ, после чего следовало культивирование в течение 24 часов. Как результат, создавали клеточную модель болезни Паркинсона. После этого коэффициент выживаемости клеток измеряли таким же образом, как описано в экспериментальном примере <1-1>, с использованием кальцеина. Коэффициент выживаемости клеток, который повышался или снижался по сравнению с таковым у нормальных контрольных клеток, которые не обрабатывали приведенным выше экстрактом или его активным компонентом и вместо этого обрабатывали DMSO, вычисляли и представляли в виде процентной доли (%). Отрицательный контроль обрабатывали только 1 мМ MPP+, что вело к созданию клеточной модели болезни Паркинсона, которую не обрабатывали экстрактом или его активным компонентом. После этого коэффициент выживаемости клеток также измеряли, повышенный или пониженный, по сравнению с таковым у нормального контроля, таким же образом, как описано выше.
Как результат, как показано в таблице 21, коэффициент выживаемости клеток клеточной модели болезни Паркинсона, соответствующий снижению митохондриальной активности, обусловленной MPP+, восстанавливали до 65-70% посредством обработки смешанным экстрактом, а именно этаноловым экстрактом смеси, содержащей кору корня пиона полукустарникового, корень дудника даурского и корень володушки, при различных соотношениях смешивания. В то же время, восстанавливающий эффект был повышен и достигал 77-81% посредством обработки экстрактом смеси коры корня пиона полукустарникового и корня володушки, экстрактом смеси коры корня пиона полукустарникового и корня дудника даурского и экстрактом смеси корня дудника даурского и корня володушки. В частности, восстанавливающий эффект был наивысшим и составлял 92,84% при обработке экстрактом смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки (таблица 21).
Таблица 21
Эффект смешанного экстракта, содержащего по меньшей мере два из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на коэффициент выживаемости клеток
<4-2> Восстанавливающий эффект смешанного экстракта, содержащего по меньшей мере два из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на утрату АТФ в клеточной модели болезни Паркинсона
Для того чтобы исследовать эффект экстракта смеси, содержащей по меньшей мере два из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на восстановление митохондриального функционального повреждения в клеточной модели болезни Паркинсона, осуществляли анализ АТФ для того, чтобы подтверждать восстанавливающий эффект, оказываемый на утрату АТФ в клетках.
В частности, SH-SY5Y, клеточную линию нейробластомы человека, инокулировали в DMEM/F12 (1:1) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали смешанным экстрактом коры корня пиона полукустарникового и корня дудника даурского в 90% этаноле, полученным в примере 2, смешанным экстрактом коры корня пиона полукустарникового и корня володушки в 90% этаноле, полученным в примере 3, смешанным экстрактом корня дудника даурского и корня володушки в 90% этаноле, полученным в примере 4, или смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле, полученным в примере <5-1>, в концентрации 1 мкг/мл, после чего следовало культивирование в течение 4 часов. По завершении культивирования, создавали клеточную модель болезни Паркинсона таким же образом, как описано в экспериментальном примере <4-1>. После этого внутриклеточный уровень АТФ измеряли таким же образом, как описано в экспериментальном примере <1-3>. Увеличение или снижение внутриклеточного уровня АТФ вычисляли посредством сравнения такового у нормального контроля, который не обрабатывали экстрактом или активным компонентом, но обрабатывали только DMSO. Отрицательный контроль обрабатывали только 1 мМ MPP+, но не обрабатывали экстрактом или его активным компонентом, после чего следовало исследование восстановления уровня АТФ таким же образом, как описано выше. Отрицательный контроль обрабатывали только 1 мМ MPP+, что вело к созданию клеточной модели болезни Паркинсона, которую не обрабатывали экстрактом или его активным компонентом. После этого восстанавливающий эффект, оказываемый на внутриклеточный уровень АТФ, изучали таким же образом, как описано выше.
Как результат, как показано в таблице 22, утрату внутриклеточного АТФ, соответствующую снижению митохондриальной активности, обусловленному 1-метил-4-фенилпиридинием (MPP+), восстанавливали посредством обработки отдельным экстрактом коры корня пиона полукустарникового, корня дудника даурского или корня володушки в 90% этаноле вплоть до 68-69% от уровня нормальной группы. В то же время, степень восстановления возрастала вплоть до 78-83% посредством обработки экстрактом смеси коры корня пиона полукустарникового и володушки, экстрактом смеси коры корня пиона полукустарникового и дудника даурского и экстрактом смеси корня дудника даурского и корня володушки. В частности, наивысшая степень восстановления составляла вплоть до 95,82% при обработке экстрактом смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки (таблица 22).
Таблица 22
Восстанавливающий эффект экстракта смеси, содержащей по меньшей мере два из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на утрату внутриклеточного АТФ
<4-3> Снижение образования реакционно-способных частиц кислорода (ROS) в клеточной модели болезни Паркинсона экстрактом смеси, содержащей по меньшей мере два из коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Для того чтобы исследовать эффект снижения, оказываемый на образование ROS, обусловленное митохондриальным функциональным повреждением в клеточной модели болезни Паркинсона, который соответствует обработке экстрактом смеси коры корня пиона полукустарникового и володушки, экстрактом смеси коры корня пиона полукустарникового и дудника даурского, экстрактом смеси корня дудника даурского и корня володушки и экстрактом смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки, измеряли концентрацию внутриклеточных ROS с использованием 2ʹ,7ʹ-дихлорфлуоресцеина диацетата (DCF-DA).
В частности, SH-SY5Y, клеточную линию нейробластомы человека, инокулировали в DMEM/F12 (1:1) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали смешанным экстрактом коры корня пиона полукустарникового и корня дудника даурского в 90% этаноле, полученным в примере 2, смешанным экстрактом коры корня пиона полукустарникового и корня володушки в 90% этаноле, полученным в примере 3, смешанным экстрактом корня дудника даурского и корня володушки в 90% этаноле, полученным в примере 4, или смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле, полученным в примере <5-1>, в концентрации 1 мкг/мл, после чего следовало культивирование в течение 4 часов. По завершении культивирования, создавали клеточную модель болезни Паркинсона таким же образом, как описано в экспериментальном примере <4-1>. После этого ROS количественно определяли на основании соотношения DCF-DA/бисбензимида таким же образом, как описано в экспериментальном примере <3-5>. Уровень ROS, повышенный или пониженный, сравнивали с таковым у нормального контроля, который не обрабатывали экстрактом или его активным компонентом, но обрабатывали DMSO, и результаты представлены в виде % от нормального контроля. Создавали отрицательный контроль для клеточной модели болезни Паркинсона посредством обработки только 1 мМ MPP+, но без обработки экстрактом или его активным компонентом. После этого изучали эффект снижения образования ROS таким же образом, как описано выше.
Как результат, как показано в таблице 23, образование ROS в результате сниженной митохондриальной активности, обусловленной 1-метил-4-фенилпиридинием (MPP+), восстанавливали даже до 144-146% от нормального уровня после обработки отдельным экстрактом коры корня пиона полукустарникового, корня дудника даурского или корня володушки в 90% этаноле, тогда как образование ROS восстанавливали даже до 120-132% от нормального уровня после обработки экстрактом смеси коры корня пиона полукустарникового и володушки, экстрактом смеси коры корня пиона полукустарникового и дудника даурского и экстрактом смеси корня дудника даурского и корня володушки. В частности, образование ROS восстанавливали почти до нормального уровня, что составляло 108,20%, посредством обработки экстрактом смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки, что подсказывает, что экстракт приведенной выше смеси имел наибольший восстанавливающий эффект (таблица 23).
Таблица 23
Эффект экстракта смеси, содержащей по меньшей мере два из коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на снижение образования реакционно-способных частиц кислорода (ROS)
Экспериментальный пример 5: оценка внутриклеточной эффективности смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в соответствии с различными соотношениями смешивания
<5-1> Восстанавливающий эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, соответствующий различным соотношениям смешивания, оказываемый на митохондриальную активность в клеточной модели болезни Паркинсона
Для того чтобы исследовать восстанавливающий эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки, соответствующий различным соотношениям смешивания, оказываемый на митохондриальную активность в клеточной модели болезни Паркинсона, показатель митохондриальной активности сначала подтверждали для того, чтобы сравнивать восстанавливающий эффект.
В частности, SH-SY5Y, клеточную линию нейробластомы человека, инокулировали в DMEM/F12 (1:1) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали различными смешанными экстрактами коры корня пиона полукустарникового и корня дудника даурского в 90% этаноле, имеющими различные соотношения смешивания и полученными в примере 5, в концентрации 1 мкг/мл, после чего следовало культивирование в течение 4 часов. По завершении культивирования, создавали клеточную модель болезни Паркинсона таким же образом, как описано в экспериментальном примере <4-1>. После этого коэффициент выживаемости клеток измеряли с использованием кальцеина таким же образом, как описано в экспериментальном примере <1-1>. Коэффициент выживаемости клеток, который повышался или снижался по сравнению с таковым у нормальной контрольной группы, которую не обрабатывали приведенным выше экстрактом или его активным компонентом, но обрабатывали DMSO, вычисляли и представляли в виде процентной доли (%). Создавали отрицательный контроль для клеточной модели болезни Паркинсона посредством обработки только 1 мМ MPP+, но без обработки экстрактом или его активным компонентом. После этого коэффициент выживаемости клеток, который повышался или снижался по сравнению с таковым у нормальной контрольной группы, вычисляли и представляли в виде процентной доли (%) таким же образом, как описано выше.
Как результат, как показано в таблице 24, сниженную митохондриальную активность, обусловленную 1-метил-4-фенилпиридинием, восстанавливали до 93,22% от нормального контроля после обработки экстрактом смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1), что было выше всего (таблица 24).
Таблица 24
Эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, соответствующий различным соотношениям смешивания, оказываемый на коэффициент выживаемости клеток
* Соотношение смешивания экстракта смеси представляет собой массовое соотношение коры корня пиона полукустарникового:корня дудника даурского:корня володушки (масс.:масс.:масс.).
<5-2> Восстанавливающий эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, соответствующий различным соотношениям смешивания, оказываемый на утрату внутриклеточного АТФ в клеточной модели болезни Паркинсона
Для того чтобы исследовать эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки, соответствующий различным соотношениям смешивания, оказываемый на восстановление митохондриального функционального повреждения в клеточной модели болезни Паркинсона, осуществляли анализ АТФ для того, чтобы подтверждать восстанавливающий эффект, оказываемый на утрату внутриклеточного АТФ.
В частности, SH-SY5Y, клеточную линию нейробластомы человека, инокулировали в DMEM/F12 (1:1) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали различными смешанными экстрактами коры корня пиона полукустарникового и корня дудника даурского в 90% этаноле, имеющими различные соотношения смешивания и полученными в примере 5, в концентрации 1 мкг/мл, после чего следовало культивирование в течение 4 часов. По завершении культивирования, создавали клеточную модель болезни Паркинсона таким же образом, как описано в экспериментальном примере <4-1>. После этого внутриклеточный уровень АТФ измеряли таким же образом, как описано в экспериментальном примере <1-3>. Внутриклеточный уровень АТФ, который повышался или снижался по сравнению с таковым у нормальной контрольной группы, которую не обрабатывали приведенным выше экстрактом или его активным компонентом, но обрабатывали DMSO, вычисляли и представляли в виде процентной доли (%). Создавали отрицательный контроль для клеточной модели болезни Паркинсона посредством обработки только 1 мМ MPP+, но без обработки экстрактом или его активным компонентом. Затем восстанавливающий эффект, оказываемый на утрату внутриклеточного АТФ, подтверждали таким же образом, как описано выше.
Как результат, как показано в таблице 25, утрату внутриклеточного АТФ, обусловленную 1-метил-4-фенилпиридинием, восстанавливали до 94,10% от нормального контроля после обработки экстрактом смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1), что было выше всего (таблица 25).
Таблица 25
Восстанавливающий эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, соответствующий различным соотношениям смешивания, оказываемый на утрату внутриклеточного АТФ
* Соотношение смешивания экстракта смеси представляет собой массовое соотношение коры корня пиона полукустарникового:корня дудника даурского:корня володушки (масс.:масс.:масс.).
<5-3> Эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, соответствующий различным соотношениям смешивания, оказываемый на снижение образования реакционно-способных частиц кислорода (ROS) в клеточной модели болезни Паркинсона
Для того чтобы исследовать восстанавливающий эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки, соответствующий различным соотношениям смешивания, в клеточной модели болезни Паркинсона, концентрацию внутриклеточных ROS измеряли с использованием 2ʹ,7ʹ-дихлорфлуоресцеина диацетата (DCF-DA).
В частности, BV2, микроглиальную клеточную линию мыши, инокулировали в DMEM/F12 (1:1) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали различными смешанными экстрактами коры корня пиона полукустарникового и корня дудника даурского в 90% этаноле, имеющими различные соотношения смешивания, полученными в примере 5, в концентрации 1 мкг/мл, после чего следовало культивирование в течение 4 часов. По завершении культивирования, создавали клеточную модель болезни Паркинсона таким же образом, как описано в экспериментальном примере <4-1>. После этого ROS количественно определяли на основании соотношения DCF-DA/бисбензимида таким же образом, как описано в экспериментальном примере <3-5>. Уровень ROS, повышенный или пониженный, сравнивали с таковым у нормального контроля, который не обрабатывали экстрактом или его активным компонентом, но обрабатывали DMSO, и результаты представлены в виде % от нормального контроля. Создавали отрицательный контроль для клеточной модели болезни Паркинсона посредством обработки только 1 мМ MPP+, но без обработки экстрактом или его активным компонентом. После этого эффект снижения образования ROS изучали таким же образом, как описано выше.
Как результат, как показано в таблице 26, образование ROS в результате сниженной митохондриальной активности, обусловленной 1-метил-4-фенилпиридинием, восстанавливали до 106,23% от нормального контроля после обработки экстрактом смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1), что было выше всего (таблица 26).
Таблица 26
Эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки, соответствующий различным соотношениям смешивания, оказываемый на снижение образования реакционноспособных частиц кислорода (ROS)
* Соотношение смешивания экстракта смеси представляет собой массовое соотношение коры корня пиона полукустарникового:корня дудника даурского:корня володушки (масс.:масс.:масс.).
Экспериментальный пример 6: оценка внутриклеточной эффективности смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1, масс.:масс.:масс.) в соответствии с концентрацией этанола
<6-1> Изменения активных компонентов в смешанном экстракте коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1, масс.:масс.:масс.), соответствующие концентрации этанола
Исследовали изменения активных компонентов в экстракте смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки, соответствующие концентрации этанола.
В частности, экстракционный растворитель этанол добавляли в смесь коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1, масс.:масс.:масс.) в различных концентрациях 10%, 30%, 50%, 70% и 90%, после чего следовало экстрагирование таким же образом, как описано в примере <5-1>. Полученные смешанные экстракты поступали на количественный анализ с использованием ВЭЖХ.
Как результат, как показано в таблице 27, смешанный экстракт коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле (1:1:1) демонстрировал наибольшие содержание пеонола, пеонифлорина, сайкосапонина A и императорина (таблица 27).
Таблица 27
Изменения активных компонентов в смешанном экстракте коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1, масс.:масс.:масс.), соответствующие концентрации этанола
<6-2> Восстанавливающий эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1, масс.:масс.:масс.), соответствующий концентрации этанола, оказываемый на митохондриальную активность в клеточной модели болезни Паркинсона
Для того чтобы исследовать восстанавливающий эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1), соответствующий концентрации этанола, оказываемый на митохондриальную активность в клеточной модели болезни Паркинсона, исследовали показатель митохондриальной активности в клеточной модели болезни Паркинсона.
В частности, SH-SY5Y, клеточную линию нейробластомы человека, инокулировали в DMEM/F12 (1:1) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали смешанными этаноловыми экстрактами коры корня пиона полукустарникового и корня дудника даурского (1:1:1), полученными в примере <5-1>, с использованием различных концентраций этанола в концентрации 1 мкг/мл, после чего следовало культивирование в течение 4 часов. По завершении культивирования, создавали клеточную модель болезни Паркинсона таким же образом, как описано в экспериментальном примере <4-1>. После этого коэффициент выживаемости клеток измеряли таким же образом, как описано в экспериментальном примере <1-1>, используя кальцеин. Коэффициент выживаемости клеток, который повышался или снижался по сравнению с таковым у нормальных контрольных клеток, которые не обрабатывали приведенным выше экстрактом или его активным компонентом и вместо этого обрабатывали DMSO, вычисляли и представляли в виде процентной доли (%). Отрицательный контроль обрабатывали только 1 мМ MPP+, что вело к созданию клеточной модели болезни Паркинсона, которую не обрабатывали экстрактом или его активным компонентом. После этого коэффициент выживаемости клеток также измеряли, повышенный или пониженный, по сравнению с таковым у нормального контроля, таким же образом, как описано выше.
Как результат, как показано в таблице 28, митохондриальную активность, сниженную 1-метил-4-фенилпиридинием, восстанавливали до 95,02% от нормального контроля после обработки смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле (1:1:1), что было выше всего (таблица 28).
Таблица 28
Эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1, масс.:масс.:масс.), оказываемый на коэффициент выживаемости клеток, соответствующий концентрации этанола
<6-3> Восстанавливающий эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1, масс.:масс.:масс.), соответствующий концентрации этанола, оказываемый на утрату АТФ в клеточной модели болезни Паркинсона
Для того чтобы исследовать восстанавливающий эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1, масс.:масс.:масс.), соответствующий концентрации этанола, оказываемый на митохондриальное функциональное повреждение в клеточной модели болезни Паркинсона, осуществляли анализ АТФ для того, чтобы подтверждать восстанавливающий эффект, оказываемый на утрату внутриклеточного АТФ.
В частности, SH-SY5Y, клеточную линию нейробластомы человека, инокулировали в DMEM/F12 (1:1) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали смешанными этаноловыми экстрактами коры корня пиона полукустарникового и корня дудника даурского (1:1:1), полученными в примере <5-1>, с использованием различных концентраций этанола в концентрации 1 мкг/мл, после чего следовало культивирование в течение 4 часов. По завершении культивирования, создавали клеточную модель болезни Паркинсона таким же образом, как описано в экспериментальном примере <4-1>. После этого внутриклеточный уровень АТФ измеряли таким же образом, как описано в экспериментальном примере <1-3>. Увеличение или снижение внутриклеточного уровня АТФ вычисляли посредством сравнения с таковым у нормального контроля, который не обрабатывали экстрактом или активным компонентом, но обрабатывали только DMSO. Внутриклеточный уровень АТФ, который повышался или снижался по сравнению с таковым у нормальных контрольных клеток, которые не обрабатывали приведенным выше экстрактом или его активным компонентом и вместо этого обрабатывали DMSO, вычисляли и представляли в виде процентной доли (%). Отрицательный контроль обрабатывали только 1 мМ MPP+, что вело к созданию клеточной модели болезни Паркинсона, которую не обрабатывали экстрактом или его активным компонентом. После этого восстанавливающий эффект, оказываемый на внутриклеточный уровень АТФ, изучали таким же образом, как описано выше.
Как результат, как показано в таблице 29, митохондриальную активность, сниженную 1-метил-4-фенилпиридинием, восстанавливали до 96,45% от нормального контроля после обработки смешанным экстрактом в 90% этаноле, что было выше всего (таблица 29).
Таблица 29
Восстанавливающий эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1, масс.:масс.:масс.), соответствующий концентрации этанола, оказываемый на утрату внутриклеточного АТФ
<6-4> Снижение образования реакционно-способных частиц кислорода (ROS) в клеточной модели болезни Паркинсона смешанным этаноловым экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1) в соответствии с концентрацией этанола
Для того чтобы исследовать снижающий эффект смешанного этанолового экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1), оказываемый на образование ROS, обусловленное митохондриальным функциональным повреждением, в клеточной модели болезни Паркинсона в соответствии с концентрацией этанола, концентрацию внутриклеточных ROS измеряли с использованием 2ʹ,7ʹ-дихлорфлуоресцеина диацетата (DCF-DA).
В частности, BV2, микроглиальную клеточную линию мыши, инокулировали в DMEM/F12 (1:1) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали различными смешанными этаноловыми экстрактами коры корня пиона полукустарникового и корня дудника даурского, имеющими различные соотношения смешивания, которые получали в примере 5, с использованием различных концентраций этанола, в концентрации 1 мкг/мл, после чего следовало культивирование в течение 4 часов. По завершении культивирования, создавали клеточную модель болезни Паркинсона таким же образом, как описано в экспериментальном примере <4-1>. После этого ROS количественно определяли на основании соотношения DCF-DA/бисбензимида таким же образом, как описано в экспериментальном примере <3-5>. Уровень ROS, повышенный или пониженный, сравнивали с таковым у нормального контроля, который не обрабатывали экстрактом или его активным компонентом, но обрабатывали DMSO, и результаты представлены в виде % от нормального контроля. Создавали отрицательный контроль для клеточной модели болезни Паркинсона посредством обработки только 1 мМ MPP+, но без обработки экстрактом или его активным компонентом. После этого эффект снижения образования ROS изучали таким же образом, как описано выше.
Как результат, как показано в таблице 30, митохондриальную активность, сниженную 1-метил-4-фенилпиридинием, восстанавливали до 106,06% от нормального контроля после обработки смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле (1:1:1), что было выше всего (таблица 30).
Таблица 30
Эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки (1:1:1, масс.:масс.:масс.), соответствующий концентрации этанола, оказываемый на снижение образования реакционно-способных частиц кислорода (ROS)
Экспериментальный пример 7: оценка внутриклеточной эффективности смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в соответствии с типом экстракционного растворителя
<7-1> Восстанавливающий эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на митохондриальную активность в клеточной модели болезни Паркинсона, в соответствии с типом экстракционного растворителя
Для того чтобы исследовать восстанавливающий эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на митохондриальную активность в клеточной модели болезни Паркинсона, в соответствии с типом экстракционного растворителя, исследовали показатель митохондриальной активности в клеточной модели болезни Паркинсона.
В частности, SH-SY5Y, клеточную линию нейробластомы человека, инокулировали в DMEM/F12 (1:1) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали смешанными этаноловыми экстрактами коры корня пиона полукустарникового и корня дудника даурского (1:1:1), полученными в примере <5-1>, с использованием различных концентраций этанола, в концентрации 1 мкг/мл, после чего следовало культивирование в течение 4 часов. По завершении культивирования, создавали клеточную модель болезни Паркинсона таким же образом, как описано в экспериментальном примере <4-1>. После этого коэффициент выживаемости клеток измеряли таким же образом, как описано в экспериментальном примере <1-1>, с использованием кальцеина. Коэффициент выживаемости клеток, который повышался или снижался по сравнению с таковым у нормальных контрольных клеток, которые не обрабатывали приведенным выше экстрактом или его активным компонентом и вместо этого обрабатывали DMSO, вычисляли и представляли в виде процентной доли (%). Отрицательный контроль обрабатывали только 1 мМ MPP+, что вело к созданию клеточной модели болезни Паркинсона, которую не обрабатывали экстрактом или его активным компонентом. После этого коэффициент выживаемости клеток также измеряли, повышенный или пониженный, по сравнению с таковым у нормального контроля, таким же образом, как описано выше.
Как результат, как показано в таблице 31, митохондриальную активность, сниженную 1-метил-4-фенилпиридинием, восстанавливали до 93,09% от нормального контроля после обработки смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле, что было выше всего (таблица 31).
Таблица 31
Эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на коэффициент выживаемости клеток, в соответствии с типом экстракционного растворителя
<7-2> Восстанавливающий эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на утрату внутриклеточного АТФ в клеточной модели болезни Паркинсона, в соответствии с типом экстракционного растворителя
Для того чтобы исследовать восстанавливающий эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на митохондриальное функциональное повреждение в клеточной модели болезни Паркинсона, в соответствии с типом экстракционного растворителя, осуществляли анализ АТФ для того, чтобы подтверждать восстанавливающий эффект, оказываемый на утрату внутриклеточного АТФ.
В частности, SH-SY5Y, клеточную линию нейробластомы человека, инокулировали в DMEM/F12 (1:1) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали смешанными экстрактами коры корня пиона полукустарникового и корня дудника даурского (1:1:1), полученными в примере 5, с использованием различных экстракционных растворителей, в концентрации 1 мкг/мл, после чего следовало культивирование в течение 4 часов. По завершении культивирования, создавали клеточную модель болезни Паркинсона таким же образом, как описано в экспериментальном примере <4-1>. После этого внутриклеточный уровень АТФ измеряли таким же образом, как описано в экспериментальном примере <1-3>. Внутриклеточный уровень АТФ, повышенный или пониженный по сравнению с таковым у нормальных контрольных клеток, которые не обрабатывали приведенным выше экстрактом или его активным компонентом и вместо этого обрабатывали DMSO, вычисляли и представляли в виде процентной доли (%). Отрицательный контроль обрабатывали только 1 мМ MPP+, что вело к созданию клеточной модели болезни Паркинсона, которую не обрабатывали экстрактом или его активным компонентом. После этого восстанавливающий эффект, оказываемый на внутриклеточный уровень АТФ, изучали таким же образом, как описано выше.
Как результат, как показано в таблице 32, митохондриальную активность, сниженную 1-метил-4-фенилпиридинием, восстанавливали до 95,90% от нормального контроля после обработки смешанным экстрактом в 90% этаноле, что было выше всего (таблица 32).
Таблица 32
Восстанавливающий эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на утрату внутриклеточного АТФ в соответствии с типом экстракционного растворителя
<7-3> Снижение образования реакционно-способных частиц кислорода (ROS) в клеточной модели болезни Паркинсона смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в соответствии с типом экстракционного растворителя
Для того чтобы исследовать снижающий эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на образование ROS, обусловленное митохондриальным функциональным повреждением, в клеточной модели болезни Паркинсона в соответствии с типом экстракционного растворителя, концентрацию внутриклеточных ROS измеряли с использованием 2ʹ,7ʹ-дихлорфлуоресцеина диацетата (DCF-DA).
В частности, BV2, микроглиальную клеточную линию мыши, инокулировали в DMEM/F12 (1:1) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали смешанными экстрактами коры корня пиона полукустарникового и корня дудника даурского, полученными в примере 5, с использованием различных экстракционных растворителей, в концентрации 1 мкг/мл, после чего следовало культивирование в течение 4 часов. По завершении культивирования, создавали клеточную модель болезни Паркинсона таким же образом, как описано в экспериментальном примере <4-1>. После этого ROS количественно определяли на основании соотношения DCF-DA/бисбензимида таким же образом, как описано в экспериментальном примере <3-5>. Уровень ROS, повышенный или пониженный, сравнивали с таковым у нормального контроля, который не обрабатывали экстрактом или его активным компонентом, но обрабатывали DMSO, и результаты представлены в виде % от нормального контроля. Создавали отрицательный контроль для клеточной модели болезни Паркинсона посредством обработки только 1 мМ MPP+, но без обработки экстрактом или его активным компонентом. После этого эффект снижения образования ROS изучали таким же образом, как описано выше.
Как результат, как показано в таблице 33, митохондриальную активность, сниженную 1-метил-4-фенилпиридинием, восстанавливали до 106,82% от нормального контроля после обработки смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле, что было выше всего (таблица 33).
Таблица 33
Эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в соответствии с типом экстракционного растворителя, оказываемый на снижение образования реакционно-способных частиц кислорода (ROS)
Экспериментальный пример 8: оценка внутриклеточной эффективности смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
<8-1> Улучшение митохондриальной активности смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Для того чтобы оценивать внутриклеточную эффективность экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, уровни экспрессии TFAM и H2AX, репрезентативных маркеров биогенеза митохондрий, в клетках нейробластомы человека измеряли с помощью вестерн-блоттинга.
В частности, SH-SY5Y, клеточную линию нейробластомы человека, инокулировали в DMEM/F12 (1:1) с добавлением 10% FBS, после чего следовало культивирование в инкубаторе при 37°C, 5% CO2/95% воздуха (O2). Затем культивируемые клетки переносили в бессывороточную среду с плотностью 1×105 клеток/лунка. Клетки обрабатывали лиофилизатом смешанного экстракта коры корня пиона полукустарникового и корня дудника даурского в 90% этаноле (1:1:1), полученным в примере <5-1>, в концентрации 1,0 мкг/мл, после чего следовало культивирование в течение 4 часов. По завершении культивирования, создавали клеточную модель болезни Паркинсона таким же образом, как описано в экспериментальном примере <4-1>. После этого предварительно обработанные клетки обрабатывали 0,5 мМ MPP+, после чего следовало культивирование в течение 24 часов для того, чтобы индуцировать нарушение функции митохондрий. Из клеток получали внутриклеточный белок, после чего следовал вестерн-блоттинг для того, чтобы исследовать фосфорилирование белка STAT (S727 и Y705), фосфорилирование белка AKT (T308 и S473) и уровни экспрессии белков TH, TFAM, и H2AX. β-актин использовали в качестве контрольного белка для сравнения экспрессии. Нормальный контроль не обрабатывали экстрактом по изобретению, но обрабатывали DMSO. Отрицательный контроль обрабатывали только 0,5 мМ MPP+, чтобы вызывать митохондриальное повреждение, и в этот момент отрицательный контроль не обрабатывали экстрактом по изобретению.
Как результат, как показано в таблице 34, когда смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле обрабатывали клетки в концентрации 1,0 мкг/мл, восстанавливали фосфорилирование белка STAT (Y705), фосфорилирование белка AKT (T308 и S473) и уровни экспрессии TH, TFAM, и H2AX почти до нормального уровня (таблица 34).
Таблица 34
Уровни экспрессии белков с генов, связанных с митохондриальной активностью, соответствующие смешанному экстракту коры корня пиона полукустарникового, корня дудника даурского и корня володушки
<8-2> Экспрессия маркерного гена стресса эндоплазматического ретикулума, соответствующая смешанному экстракту коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Для того чтобы исследовать эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый на восстановление стресса эндоплазматического ретикулума, измеряли уровни экспрессии маркерных генов стресса эндоплазматического ретикулума GRP78 и XBP1p.
В частности, клетки SH-SY5Y культивировали таким же образом, как описано в экспериментальном примере <2-2>, и индуцировали стресс эндоплазматического ретикулума. После этого осуществляли RT-ПЦР с использованием клеток, имеющих стресс эндоплазматического ретикулума, таким же образом, как описано в экспериментальном примере <1-4>, после чего следовал электрофорез для того, чтобы исследовать уровни экспрессии генов GRP78 и XBP1p, на 1,5% агарозном геле под УФ. Нормальный контроль не обрабатывали экстрактом по изобретению, но обрабатывали только DMSO. Отрицательный контроль не обрабатывали экстрактом или активным компонентом, но обрабатывали только 0,5 мкг/мл тапсигаргина для того, чтобы индуцировать стресс эндоплазматического ретикулума. После этого экспрессию маркерного гена стресса эндоплазматического ретикулума подтверждали таким же образом, как описано выше.
Как результат, как показано в таблице 35 и таблице 36, уровни экспрессии маркерных генов стресса эндоплазматического ретикулума GRP78 и XBP1p восстанавливали до нормального уровня в клетках, имеющих стресс эндоплазматического ретикулума, индуцированный в них, посредством обработки смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле в концентрации 1,0 мкг/мл (таблицы 35 и 36).
Таблица 35
Экспрессия мРНК GRP78, соответствующая смешанному экстракту коры корня пиона полукустарникового, корня дудника даурского и корня володушки, в клетках, имеющих стресс эндоплазматического ретикулума, индуцированный тапсигаргином
Таблица 36
Экспрессия мРНК XBP1p, соответствующая смешанному экстракту коры корня пиона полукустарникового, корня дудника даурского и корня володушки, в клетках, имеющих стресс эндоплазматического ретикулума, индуцированный тапсигаргином
<8-3> Противовоспалительный эффект и антиоксидантный эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Для того чтобы исследовать восстанавливающий эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый на воспалительную реакцию, способ Грисса осуществляли для того, чтобы измерять концентрацию нитрита/нитрата(NOx) в клеточной культуральной среде и концентрацию внутриклеточных ROS с использованием 2ʹ,7ʹ-дихлорфлуоресцеина диацетата (DCF-DA).
В частности, клетки BV2 культивировали таким же образом, как описано в экспериментальном примере <3-1>, и индуцировали воспалительную реакцию. После этого получали 100 мл клеточной культуральной среды, в которые добавляли 100 мл реактива Грисса, содержащего соляную кислоту, содержащую 5% сульфаниламид и 2% нафтилэтилендиамин, после чего следовала реакция в темном помещении в течение 30 минут. По завершении реакции, OD540 измеряли с использованием считывателя микропланшетов EISA (Versamax, USA). Концентрацию оксида азота (II) в среде вычисляли с использованием стандартной калибровочной кривой для нитрита натрия. Для того чтобы измерять концентрацию ROS, клетки обрабатывали 1 мкМ DCF-DA и 0,05 мкМ бисбензимида (Hoechst 33342), после чего следовало окрашивание при 37°C в течение 1 часа. После окрашивания интенсивность флуоресценции DCF-DA измеряли на 485 нм/535 нм, а интенсивность флуоресценции бисбензимида измеряли на 335 нм/460 нм. На основании соотношения DCF-DA/бисбензимида, количественно определяли ROS. Количество ROS, повышенное или пониженное, сравнивали с таковым у нормального контроля, который не обрабатывали экстрактом, но обрабатывали DMSO, и результаты представлены в виде %. Отрицательный контроль обрабатывали с использованием только 100 нг/мл LPS для того, чтобы индуцировать воспалительную реакцию, но без обработки экстрактом или его активным компонентом. После этого эффект снижения концентрации оксида азота (II) и эффект снижения концентрации ROS исследовали таким же образом, как описано выше.
Как результат, как показано в таблице 37, подтверждали, что экстракт смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению оказывает эффект снижения LPS-опосредованного образования NO (таблица 37) и эффект снижения опосредованного DCF-DA образования ROS, обусловленных воспалительной реакцией и стрессом (таблица 38).
Таблица 37
Эффект снижения концентрации оксида азота (II) (NO) у смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Таблица 38
Эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на снижение образования реакционно-способных частиц кислорода (ROS)
Экспериментальный пример 9: терапевтический эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на болезнь Паркинсона in vivo
<9-1> Создание модели болезни Паркинсона на животном: MPTP-индуцированная модель болезни Паркинсона на мышах
Как показано на фиг. 1, модель болезни Паркинсона на животных создавали для того, чтобы исследовать in vivo терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый на болезнь Паркинсона (фиг. 1).
В частности, распределяли самцов мышей C57BL/6 в возрасте 5 недель (масса: приблизительно 19-22 г), после чего следовала адаптация в лаборатории для животных Dong-A ST Research Division в течение по меньшей мере 1 недели. В этот момент, регулировали температуру в помещении 22±2°C и контролировали влажность 53±3%. Задавали цикл света-темноты 12 ч/12 ч. Воду и корм предоставляли свободно. После адаптации мышей группировали по 5 группам, и в каждую группу распределяли 6 мышей. Лиофилизат смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле (1:1:1), полученного в примере <5-1>, растворяли в 3% HPMC и вводили перорально (p.o.) мышам в дозе 1, 3 и 10 мг/кг раз в сутки в течение 14 суток. После этого мышам вводили (интраперитонеально, i.p.) 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (MPTP) в дозе 30 мг/кг через 3 часа после перорального введения в течение 5 суток с 8-х суток эксперимента, что вело к созданию модели болезни Паркинсона на животном. Нормальный контроль вводили в 3% HPMC в дозе 5 мл/кг без смешанного экстракта, и после этого интраперитонеально вводили PBS без MPTP.
<9-2> Улучшение двигательной координации в MPTP-индуцированной модели болезни Паркинсона на мышах с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Для того чтобы исследовать in vivo терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый на болезнь Паркинсона, поведенческий тест (тест с шестом, тест с вращающимся стержнем) осуществляли для MPTP-индуцированной модели болезни Паркинсона на мышах после введения экстракта приведенной выше смеси.
В частности, модель болезни Паркинсона на мышах создавали в экспериментальном примере <8-1>. Животную модель через 14 суток после создания помещали на верхнюю часть шеста, имеющего шероховатую поверхность (диаметр: 8 мм, высота: 55 см). Время, необходимое мыши для перемещения полностью вниз, измеряли каждые 30 секунд, и определяли его как время для поворота (T-turn), а также измеряли время, необходимое мыши для того, чтобы попасть на пол, которое определяли как время локомоторной активности (T-LA). Животное помещали на колесо, у которого можно регулировать об./мин. Измеряли время для падения животного вниз (задержку падения). Нормальный контроль обрабатывали наполнителем 3% HPMC. Отрицательному контролю интраперитонеально вводили (i.p.) MPTP в дозе 30 мг/кг в течение 5 суток, но без обработки экстрактом смеси после этого. Затем тест с шестом осуществляли с использованием контролей для того, чтобы измерять T-turn и T-LA, а тест с вращающимся стержнем осуществляли для того, чтобы измерять задержку падения таким же образом, как описано выше.
Как результат, как показано в таблице 39 и таблице 40, по сравнению с нормальной контрольной группой, которую обрабатывали наполнителем, T-turn и T-LA были значительно увеличены в отрицательном контроле, который обрабатывали только MPTP. В то же время, в модели болезни Паркинсона на мышах, которых обрабатывали смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле, T-turn и T-LA были снижены (таблица 39 и таблица 40). Как показано в таблице 41, в тесте с вращающимся стержнем подтверждали, что задержка падения значительно снижена в отрицательном контроле, который обрабатывали только MPTP, тогда как задержка падения увеличена в модели болезни Паркинсона на мышах, которую обрабатывали смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле. Следовательно, подтверждено, что двигательную координацию восстанавливали в модели болезни Паркинсона на мышах посредством обработки смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле (таблицы 39-41).
Таблица 39
Снижение T-turn с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в MPTP-индуцированной модели болезни Паркинсона на мышах
* Доза представляет массу (мг) экстракта смеси, которой обрабатывают кг массы тела мыши животной модели
Таблица 40
Снижение T-LA с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в MPTP-индуцированной модели болезни Паркинсона на мышах
* Доза представляет массу (мг) экстракта смеси, которой обрабатывают кг массы тела мыши животной модели
Таблица 41
Снижение задержки падения с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в MPTP-индуцированной модели болезни Паркинсона на мышах
* Доза представляет массу (мг) экстракта смеси, которым обрабатывают кг массы тела мыши животной модели
<9-3> Защитный эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на дофаминергические нейроны in vivo
Для того чтобы исследовать in vivo терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый болезнь Паркинсона, получали ткань головного мозга MPTP-индуцированной модели болезни Паркинсона на мышах, которую обрабатывали экстрактом смеси по изобретению, с использованием которой подтверждали защитный эффект, оказываемый на дофаминергические нейроны в полосатом теле (ST) и черном веществе (SN).
В частности, мышиной модели, которая закончила поведенческий тест в экспериментальном примере <8-2>, вводили золетил (50 мг/кг) через внутримышечную инъекцию для анестезии. PBS, содержащий 4% параформальдегид, перфузировали через сердце и после этого извлекали головной мозг. Извлеченный головной мозг фиксировали в 4% параформальдегиде еще раз и затем погружали в 30% раствор сахарозы при 4°C до тех пор, пока головной мозг не утопал, затем его замораживали. Замороженную ткань головного мозга резали на 30 мкм коронарные срезы с использованием микротома-криостата (название продукта: CM3000, Leica, Germany), и срезы хранили в стоковом растворе, содержащем глицерин, этиленгликоль и PBS при 4°C. Срезы помещали на покровное стекло и промывали в PBS, после чего следовала обработка PBS, содержащим 1% H2O2 в течение 15 минут для того, чтобы устранять пероксидазную активность в ткани. После этого его обрабатывали антителом против тирозингидроксилазы (anti-TH; 1:2000, кроличьего происхождения; Millipore, USA) в качестве первичного антитела, после чего следовала реакция в течение ночи. Его обрабатывали биотинилированным антителом против IgG кролика в качестве вторичного антитела, после чего следовала реакция при комнатной температуре в течение 90 минут. По завершении реакции, ткань обрабатывали раствором авидин-биотинового комплекса, содержащимся в наборе Vectastain ABC (Vector Laboratories, USA), после чего следовала реакция в течение 1 часа. Развитие окраски индуцировали с использованием диаминобензидина. Для того чтобы исследовать эффект защиты дофаминовых клеток, измеряли оптическую плотность полосатого тела (ST) и затем в черном веществе (SN) подсчитывали положительные по тирозингидроксилазе (TH) клетки. Нормальную контрольную группу обрабатывали растворителем и отрицательному контролю интраперитонеально вводили (i.p.) MPTP в дозе 30 мг/кг в течение 5 суток, но без обработки экстрактом смеси после этого.
Как результат, как показано в таблице 42, оптическая плотность окрашенной TH в полосатом теле (ST) модели болезни Паркинсона на животном, которому вводили смешанный этаноловый экстракт коры корня пиона полукустарникового, корня дудника даурского и корня володушки, возрастала в зависимости от дозы, что подсказывает, что экстракт имеет защитный эффект, оказываемый на дофаминергические нейроны. Как показано в таблице 43, положительные по TH клетки в черном веществе (SN) также возрастали в соответствии со введением смешанного этанолового экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, в зависимости от дозы (таблицы 42 и 43).
Таблица 42
Увеличение TH оптической плотности в полосатом теле (ST) с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в MPTP-индуцированной модели болезни Паркинсона на мышах
* Доза представляет массу (мг) экстракта смеси, которым обрабатывают кг массы тела мыши животной модели
Таблица 43
Увеличение TH-положительных клеток в черном веществе (SN) с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в MPTP-индуцированной модели болезни Паркинсона на мышах
* Доза представляет массу (мг) экстракта смеси, которым обрабатывают кг массы тела мыши животной модели
<9-4> Эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на количество дофамина in vivo
Для того чтобы исследовать in vivo терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый на болезнь Паркинсона, получали ткань головного мозга MPTP-индуцированной модели болезни Паркинсона на мышах, которую обрабатывали экстрактом смеси по изобретению, и измеряли в ней уровень дофамина.
В частности, головный мозг извлекали у мыши, закончившей поведенческий тест в экспериментальном примере <8-2>. ST отделяли от извлеченного головноо мозга, после чего следовала гомогенизация. В него добавляли перхлорную кислоту (Sigma), после чего следовало культивирование. Культивированное ST фильтровали и к нему прикладывали давление/концентрировали. Концентрированный экстракт поступал на хроматографию для того, чтобы измерять уровень дофамина. Нормальную контрольную группу обрабатывали растворителем и отрицательному контролю интраперитонеально вводили (i.p.) MPTP в дозе 30 мг/кг в течение 5 суток, но без обработки экстрактом смеси после этого.
Как результат, как показано в таблице 44, уровень дофамина значительно снижен в модели болезни Паркинсона на животных, которую не обрабатывали смешанным этаноловым экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки, но уровень дофамина значительно повышен, когда животному вводили смешанный этаноловый экстракт коры корня пиона полукустарникового, корня дудника даурского и корня володушки (таблица 44).
Таблица 44
Эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на количество дофамина в MPTP-индуцированной модели болезни Паркинсона на мышах
* Доза представляет массу (мг) экстракта смеси, которым обрабатывают кг массы тела мыши животной модели
<9-5> Восстанавливающий эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на TH, митохондрий и систему передачи инсулиновых сигналов in vivo
Для того чтобы исследовать in vivo терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый на болезнь Паркинсона, получали ткань головного мозга MPTP-индуцированной модели болезни Паркинсона на мышах, которую обрабатывали экстрактом смеси по изобретению, и измеряли уровни экспрессии TH и ND9, митохондриального маркера и уровень фосфорилирования Akt1, маркера системы передачи инсулиновых сигналов.
В частности, получали срезы черного вещества (SN), полосатого тела (ST) и мозжечка таким же образом, как описано в экспериментальном примере <8-3>, из которых получали белок ткани головного мозга. Осуществляли вестерн-блоттинг белка для того, чтобы измерять уровни экспрессии TH и ND9 и уровень фосфорилирования Akt1 (S473 и T308). В этот момент, β-актин использовали в качестве контрольного белка для сравнения экспрессии. Нормальную контрольную группу обрабатывали растворителем и отрицательному контролю интраперитонеально вводили (i.p.) MPTP в дозе 30 мг/кг в течение 5 суток, но без обработки экстрактом смеси после этого.
Как результат, как показано в таблицах 45-47, уровни экспрессии TH и ND9 в SN, ST и мозжечке животной модели, которой вводили смешанный экстракт коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле в дозе 10 мг/кг, восстанавливали почти до нормального уровня как у нормального контроля, и уровень фосфорилирования белка Akt1 также восстанавливали до нормального уровня (таблицы 45-47).
Таблица 45
Восстанавливающий эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на повреждение TH, митохондрий и системы передачи инсулиновых сигналов в SN из MPTP-индуцированой модели болезни Паркинсона на мышах
Таблица 46
Восстанавливающий эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на повреждение TH, митохондрий и системы передачи инсулиновых сигналов в ST из MPTP-индуцированной модели болезни Паркинсона на мышах
Таблица 47
Восстанавливающий эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на повреждение TH, митохондрий и системы передачи инсулиновых сигналов в мозжечке у MPTP-индуцированной модели болезни Паркинсона на мышах
Экспериментальный пример 10: терапевтический эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на болезнь Паркинсона in vivo
<10-1> Создание модели болезни Паркинсона на животном: 6-OHDA-индуцированной (6-гидроксидофамином) модели болезни Паркинсона на мышах
Для того чтобы исследовать in vivo терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый на болезнь Паркинсона, модель болезни Паркинсона на животных конструировали, как показано на фиг. 2 (фиг. 2).
В частности, распределяли самцов мышей ICR в возрасте 8 недель (масса: приблизительно 19-22 г), после чего следовала адаптация в лаборатории для животных Kyung Hee University College of Pharmacy в течение по меньшей мере 1 недели. В этот момент регулировали температуру в помещении 22±2°C и контролировали влажность 53±3%. Задавали цикл света-темноты 12 ч/12 ч. Воду и корм предоставляли свободно. После адаптации мышей разделяли на 3 группы, и в каждую группу распределяли 6 мышей. 16 мкг 6-OHDA (6-гидроксидофамин) разводили в 2 мл 0,1% аскорбиновой кислоты и инъецировали каждой мыши посредством стереотактического хирургического вмешательства, что вело к созданию модели болезни Паркинсона на животном. Лиофилизат смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле (1:1:1), полученного в примере <5-1>, растворяли в воде и вводили перорально (p.o.) мышам в дозе 3 мг/кг раз в сутки в течение 7 суток. Нормальную контрольную группу обрабатывали растворителем и отрицательному контролю инъецировали 0,1% аскорбиновую кислоту, содержащую 6-OHDA, посредством стереотактического хирургического вмешательства.
<10-2> Улучшение двигательной координации с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 6-OHDA-индуцированной модели болезни Паркинсона на мышах
Для того чтобы исследовать in vivo терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый на болезнь Паркинсона, поведенческий тест (тест с шестом, тест с вращающимся стержнем) осуществляли с использованием 6-OHDA-индуцированной модели болезни Паркинсона на мышах после введения экстракта приведенной выше смеси.
В частности, модель болезни Паркинсона на мышах создавали в экспериментальном примере <9-1>. Животную модель через 7 суток после создания помещали на верхнюю часть шеста, имеющего шероховатую поверхность (диаметр: 8 мм, высота: 55 см). Время, необходимое мыши для перемещения полностью вниз, измеряли каждые 30 секунд, и определяли его как время для поворота (T-turn), а также измеряли время, необходимое мыши для того, чтобы попасть на пол, которое определяли как время локомоторной активности (T-LA). Животное помещали на колесо, у которого можно регулировать об./мин. Измеряли время для падения животного вниз (задержку падения). Нормальную контрольную группу обрабатывали растворителем и отрицательному контролю инъецировали 0,1% аскорбиновую кислоту, содержащую 6-OHDA, посредством стереотактического хирургического вмешательства. Затем тест с шестом осуществляли с использованием контролей для того, чтобы измерять T-turn и T-LA, а тест с вращающимся стержнем осуществляли для того, чтобы измерять задержку падения таким же образом, как описано выше.
Как результат, как показано в таблице 48 и таблице 49, по сравнению с нормальной контрольной группой, которую обрабатывали растворителем, T-turn и T-LA значительно увеличены в группе отрицательного контроля, которую обрабатывали только 6-OHDA. В то же время, в модели болезни Паркинсона на мышах, которую обрабатывали смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле, T-turn и T-LA были снижены (таблица 48 и таблица 49). Как показано в таблице 50, в тесте с вращающимся стержнем подтверждали, что задержка падения значительно снижена в отрицательном контроле, который обрабатывали только 6-OHDA, тогда как задержка падения увеличена в модели болезни Паркинсона на мышах, которую обрабатывали смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле. Следовательно, подтверждено, что двигательную координацию восстанавливали в модели болезни Паркинсона на мышах посредством обработки смешанным экстрактом коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле (таблицы 48-50).
Таблица 48
Снижение T-turn с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 6-OHDA-индуцированной модели болезни Паркинсона на мышах
Таблица 49
Снижение T-LA с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 6-OHDA-индуцированной модели болезни Паркинсона на мышах
Таблица 50
Снижение задержки падения с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 6-OHDA-индуцированной модели болезни Паркинсона на мышах
<10-3> Защитный эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на дофаминергические нейроны in vivo
Для того чтобы исследовать in vivo терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый на болезнь Паркинсона, получали ткань головного мозга 6-OHDA-индуцированной модели болезни Паркинсона на мышах, которую обрабатывали экстрактом смеси по изобретению, с использованием которого подтверждали защитный эффект, оказываемый на дофаминергические нейроны в полосатом теле (ST) и черном веществе (SN).
В частности, мышиной модели, закончившей поведенческий тест в экспериментальном примере <9-2>, вводили золетил (50 мг/кг) через внутримышечную инъекцию для анестезии. PBS, содержащий 4% параформальдегид, перфузировали через сердце и после этого извлекали головной мозг. Извлеченный головной мозг фиксировали в 4% параформальдегиде еще раз и затем погружали в 30% раствор сахарозы при 4°C до тех пор, пока головной мозг не утопал, затем его замораживали. Замороженную ткань головного мозга нарезали на 30 мкм коронарные срезы с использованием микротома-криостата (название продукта: CM3000, Leica, Germany), и срезы хранили в стоковом растворе, содержащем глицерин, этиленгликоль и PBS, при 4°C. Срезы помещали на покровное стекло и промывали в PBS, после чего следовала обработка PBS, содержащим 1% H2O2, в течение 15 минут для того, чтобы устранять пероксидазную активность в ткани. После этого их обрабатывали антителом против тирозингидроксилазы (anti-TH; 1:2000, кроличьего происхождения; Millipore, USA) в качестве первичного антитела, после чего следовала реакция в течение ночи. Их обрабатывали биотинилированным антителом против IgG кролика в качестве вторичного антитела, после чего следовала реакция при комнатной температуре в течение 90 минут. По завершении реакции, ткань обрабатывали раствором авидин-биотинового комплекса, входящим в набор Vectastain ABC (Vector Laboratories, USA), после чего следовала реакция в течение 1 часа. Развитие окраски индуцировали с использованием диаминобензидина. Для того чтобы исследовать эффект защиты дофаминовых клеток, измеряли оптическую плотность полосатого тела (ST) и затем в черном веществе (SN) подсчитывали положительные по тирозингидроксилазе (TH) клетки. Нормальную контрольную группу обрабатывали растворителем и отрицательному контролю инъецировали 0,1% аскорбиновую кислоту, содержащую 6-OHDA, посредством стереотактического хирургического вмешательства.
Как результат, как показано в таблице 51 и таблице 52, возрастала оптическая плотность окрашенной TH в полосатом теле (ST) модели болезни Паркинсона на животном, которой вводили смешанный этаноловый экстракт коры корня пиона полукустарникового, корня дудника даурского и корня володушки, в зависимости от дозы, что подсказывает, что экстракт имел защитный эффект, оказываемый на дофаминергические нейроны. Положительные по TH клетки в черном веществе (SN) также возрастали в соответствии со введением смешанного этанолового экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, в зависимости от дозы (таблицы 51 и 52).
Таблица 51
Увеличение TH оптической плотности в полосатом теле (ST) с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 6-OHDA-индуцированной модели болезни Паркинсона на мышах
Таблица 52
Увеличение TH-положительных клеток в черном веществе (SN) с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 6-OHDA-индуцированной модели болезни Паркинсона на мышах
Экспериментальный пример 11: терапевтический эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на болезнь Паркинсона in vivo
<11-1> Создание модели болезни Паркинсона на животном: индуцированная ротеноном модель болезни Паркинсона на крысах
Для того чтобы исследовать in vivo терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый болезнь Паркинсона, модель болезни Паркинсона на животных создавали как показано на фиг. 3 (фиг. 3).
В частности, распределяли самцов крыс SD в возрасте 7 недель (масса: 200-220 г), после чего следовала адаптация в лаборатории для животных Dong-A ST Research Division в течение по меньшей мере 1 недели. В этот момент регулировали температуру в помещении 22±2°C и контролировали влажность 53±3%. Задавали цикл света-темноты 12 ч/12 ч. Воду и корм предоставляли свободно. После адаптации крыс разделяли на 3 группы, и в каждую группу распределяли 6 крыс. Лиофилизат смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле (1:1:1), полученного в примере <5-1>, растворяли в воде и вводили перорально (p.o.) крысам в дозе 10 мг/кг раз в сутки в течение 6 недель. После этого крысам вводили (интраперитонеально, i.p.) ротенон в дозе 2,5 мг/кг через 1 неделю после перорального введения раз в сутки в течение 5 недель, что вело к созданию модели болезни Паркинсона на животном. Нормальную контрольную группу обрабатывали растворителем и отрицательному контролю вводили (интраперитонеально, i.p.) ротенон в дозе 2,5 мг/кг раз в сутки в течение 5 недель.
<11-2> Улучшение двигательной координации в индуцированной ротеноном модели болезни Паркинсона на крысах с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Для того чтобы исследовать in vivo терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый на болезнь Паркинсона, осуществляли поведенческий тест (тест с цилиндром) с использованием индуцированной ротеноном модели болезни Паркинсона на крысах после введения экстракта приведенной выше смеси.
В частности, тест с цилиндром осуществляли с использованием модели болезни Паркинсона на крысах, созданной в экспериментальном примере <11-1>. Крыс помещали в цилиндр (высота: 30 см, диаметр: 20 см). Считали, сколько раз крыса поднимала туловище и помещала лапы на стенку в течение 5 минут. Нормальную контрольную группу обрабатывали растворителем и отрицательному контролю интраперитонеально вводили ротенон в дозе 2,5 мг/кг раз в сутки в течение 5 недель. Аналогичным образом, с использованием контролей подсчитывали, сколько раз крыса поднимала туловище и помещала лапы на стенку в течение 5 минут.
Как результат, как показано в таблице 53, число подъемов в группе отрицательного контроля, которой вводили только ротенон, было значительно снижено, по сравнению с таковым в нормальной контрольной группе, которую обрабатывали только растворителем, которое повышалось при введении смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле (таблица 53).
Таблица 53
Эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на число раз, когда лапы помещали на стенку в течение 5 минут в индуцированной ротеноном модели болезни Паркинсона на крысах
<11-3> Снижение накопления α-синуклеина с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Для того чтобы исследовать in vivo терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый на болезнь Паркинсона, ткани головного мозга получали из индуцированной ротеноном модели болезни Паркинсона на крысах, которую обрабатывали смешанным экстрактом. Изучали паттерн накопления олигомеров α-синуклеина в черном веществе (SN) ткани головного мозга.
В частности, крысиной модели, которая заканчивала поведенческий тест в экспериментальном примере <11-2>, вводили золетил (50 мг/кг) через внутримышечную инъекцию для анестезии. PBS, содержщий 4% параформальдегид, перфузировали через сердце и после этого извлекали головной мозг. Извлеченный головной мозг фиксировали в 4% параформальдегиде еще раз и затем погружали в 30% раствор сахарозы при 4°C до тех пор, пока головной мозг не утопал, затем его замораживали. Замороженную ткань головного мозга нарезали на 30 мкм коронарные срезы с использованием микротома-криостата (название продукта: CM3000, Leica, Germany), и срезы хранили в глицерине, этиленгликоле и PBS при 4°C. Срезы помещали на покровное стекло и промывали в PBS, после чего следовала обработка PBS, содержащим 1% H2O2, в течение 15 минут для того, чтобы устранять пероксидазную активность в ткани. После этого их обрабатывали антителом против α-синуклеина (1:2000; мышиного происхождения, abcam, England) в качестве первичного антитела, после чего следовала реакция в течение ночи. Их обрабатывали биотинилированным антителом против IgG мыши в качестве вторичного антитела, после чего следовала реакция при комнатной температуре в течение 90 минут. По завершении реакции, ткань обрабатывали раствором авидин-биотинового комплекса, содержащимся в наборе Vectastain ABC (Vector Laboratories, USA), после чего следовала реакция в течение 1 часа. Развитие окраски индуцировали с использованием диаминобензидина. Накопление олигомера α-синуклеина измеряли посредством подсчета положительных по α-синуклеину клеток. Нормальную контрольную группу обрабатывали растворителем и отрицательному контролю интраперитонеально вводили ротенон в дозе 2,5 мг/кг раз в сутки в течение 5 недель.
Как результат, как показано в таблице 54, число положительных по α-синуклеину клеток снижено в черном веществе (SN) модели болезни Паркинсона на животном, которой вводили смешанный этаноловый экстракт коры корня пиона полукустарникового, корня дудника даурского и корня володушки (таблица 54).
Таблица 54
Снижение положительных по α-синуклеину клеток в черном веществе (SN) модели болезни Паркинсона на животном с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Экспериментальный пример 12: терапевтический эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки, оказываемый на болезнь Паркинсона (воспаление головного мозга) in vivo
<12-1> Создание животной модели нейровоспаления: LPS-индуцированная модель болезни Паркинсона на мышах
Для того чтобы исследовать in vivo терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый на болезнь Паркинсона, модель болезни Паркинсона на животных создавали как показано на фиг. 4 (фиг. 4).
В частности, распределяли самцов мышей C57BL/6 в возрасте 8 недель (масса: приблизительно 19-22 г), после чего следовала адаптация в лаборатории для животных Kyung Hee University College of Pharmacy в течение по меньшей мере 1 недели. В этот момент регулировали температуру в помещении 22±2°C и контролировали влажность 53±3%. Задавали цикл света-темноты 12 ч/12 ч. Воду и корм предоставляли свободно. После адаптации мышей разделяли на 4 группы, и в каждую группу распределяли 6 мышей. Лиофилизат смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в 90% этаноле (1:1:1), полученного в примере <5-1>, растворяли в воде и перорально вводили (p.o.) мышам в дозе 10 или 30 мг/кг раз в сутки в течение 3 суток. После этого мышам вводили (интраперитонеально, i.p.) LPS (липополисахарид) в дозе 5 мг/кг после перорального введения, что вело к созданию модели болезни Паркинсона на животном. Нормальную контрольную группу обрабатывали растворителем и отрицательному контролю вводили LPS в дозе 5 мг/кг, но без обработки экстрактом смеси после этого.
<12-2> Снятие воспаления головного мозга эффект смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Для того чтобы исследовать in vivo терапевтический эффект экстракта смеси коры корня пиона полукустарникового, корня дудника даурского и корня володушки по настоящему изобретению, оказываемый на болезнь Паркинсона, ткани головного мозга получали из модели болезни Паркинсона на крысах, которую обрабатывали смешанным экстрактом. Эффект снятия воспаления головного мозга у экстракта смеси подтверждали посредством исследования активации астроцитов и микроглии в черном веществе (SN) и гиппокампе тканей головного мозга, полученных выше.
В частности, животной модели нейровоспаления, созданной в экспериментальном примере <12-1>, вводили золетил (50 мг/кг) через внутримышечную инъекцию для анестезии. PBS, содержащий 4% параформальдегид, перфузировали через сердце и после этого извлекали головной мозг. Извлеченный головной мозг фиксировали в 4% параформальдегиде еще раз и затем погружали в 30% раствор сахарозы при 4°C до тех пор, пока головной мозг не утопал, затем его замораживали. Замороженную ткань головного мозга нарезали на 30 мкм коронарные срезы с использованием микротома-криостата (название продукта: CM3000, Leica, Germany) и хранили срезы в глицерине, этиленгликоле и PBS при 4°C. Срезы помещали на покровное стекло и промывали в PBS, после чего следовала обработка PBS, содержащим 1% H2O2, в течение 15 минут для того, чтобы устранять пероксидазную активность в ткани. После этого их обрабатывали антителом против GFAP (1:5000; кроличьего происхождения, Neuromics, USA) или антителом против Iba-1 (1:1000; кроличьего происхождения, Dako, Japan) в качестве первичного антитела, после чего следовала реакция в течение ночи. Их обрабатывали биотинилированным антителом против IgG кролика в качестве вторичного антитела, после чего следовала реакция при комнатной температуре в течение 90 минут. По завершении реакции, ткань обрабатывали раствором авидин-биотинового комплекса, содержащимся в наборе Vectastain ABC (Vector Laboratories, USA), после чего следовала реакция в течение 1 часа. Развитие окраски индуцировали с использованием диаминобензидина. Уровни астроцитов и микроглии, активированных в SN и гиппокампе измеряли посредством подсчета числа положительных по GFAP и Iba-1 клеток. Нормальную контрольную группу обрабатывали растворителем и отрицательному контролю вводили LPS в дозе 5 мг/кг и после этого не обрабатывали его экстрактом смеси по изобретению.
Как результат, как показано в таблице 55 и таблице 56, положительные по GFAP и lba-1 клетки, повышенные с помощью LPS в черном веществе (SN) модели болезни Паркинсона на мышах, снижали посредством введения смешанного этанолового экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в зависимости от дозы. Приведенные выше результаты показывают, что активация астроцитов и микроглии снижена, то есть воспаление головного мозга снижено (таблица 55 и таблица 56). Как показано в таблице 57 и таблице 58, положительные по GFAP и lba-1 клетки, повышенные с помощью LPS в гиппокампе модели болезни Паркинсона на мышах, снижали посредством введения смешанного этанолового экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки в зависимости от дозы. Аналогичным образом, снижали активацию астроцитов и микроглии, что подсказывает, что воспаление головного мозга было снижено (таблица 57 и таблица 58).
Таблица 55
Снижение GFAP-положительных клеток (астроцитов) в черном веществе (SN) LPS-индуцированной модели болезни Паркинсона на мышах с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Таблица 56
Снижение положительных по Iba-1 клеток в черном веществе (SN) LPS-индуцированной модели болезни Паркинсона на мышах с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Таблица 57
Снижение GFAP-положительных клеток в гиппокампе LPS-индуцированной модели болезни Паркинсона на мышах с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Таблица 58
Снижение положительных по Iba-1 клеток в гиппокампе LPS-индуцированной модели болезни Паркинсона на мышах с помощью смешанного экстракта коры корня пиона полукустарникового, корня дудника даурского и корня володушки
Производственный пример 1: получение фармацевтических составов
<1-1> Получение порошков
Смешанный экстракт по изобретению или его фракция: 0,1 г
Лактоза: 1,5 г
Тальк: 0,5 г
Порошки получали смешиванием всех приведенных выше компонентов, которыми заполняли воздухонепроницаемые упаковки в соответствии со стандартным способом получения порошков.
<1-2> Получение таблеток
Смешанный экстракт по изобретению или его фракция: 0,1 г
Лактоза: 7,9 г
Кристаллическая целлюлоза: 1,5 г
Стеарат магния: 0,5 г
Таблетки получали смешиванием всех приведенных выше компонентов стандартным способом прямого таблетирования.
<1-3> Получение капсул
Смешанный экстракт по изобретению или его фракция: 0,1 г
Кукурузный крахмал: 5 г
Карбоксицеллюлоза: 4,9 г
Капсулы получали смешиванием всех приведенных выше компонентов, которыми заполняли твердые капсулы в соответствии со стандартным способом получения капсул.
<1-4> Получение инъецируемых растворов
Смешанный экстракт по изобретению или его фракция: 0,1 г
Стерилизованная дистиллированная вода: надлежащее количество
Регулятор pH: надлежащее количество
Инъецируемые растворы получали смешиванием всех приведенных выше компонентов, помещали смесь в 2 мл ампулы и стерилизовали их с помощью стандартного способа получения инъецируемых растворов.
<1-5> Получение жидких составов
Смешанный экстракт по изобретению или его фракция: 0,1 г
Изомеризованный сахар: 10 г
Маннит: 5 г
Очищенная вода: надлежащее количество
Все приведенные выше компоненты растворяли в очищенной воде. После добавления лимонного аромататизатора общий объем корректировали до 100 мл посредством добавления очищенной воды. Жидкие составы получали, помещая смесь в коричневые бутылки и стерилизуя ее с помощью стандартного способа получения жидких составов.
Производственный пример 2: получение здоровой функциональной пищи
<2-1> Получение мучной пищи
В муку добавляли 0,5-5,0 массовой части экстракта смеси по настоящему изобретению или его фракции. Пищу, улучшающую здоровье, такую как хлеб, пирог, печенье, крекеры и лапша, получали с использованием мучной смеси в соответствии со стандартным способом.
<2-2> Получение супов и подливок
В супы и подливки добавляли 0,1-5,0 массовой части экстракта смеси по настоящему изобретению или его фракции. Мясные продукты, супы и подливки, улучшающие здоровье, получали с использованием этой смеси стандартным способом.
<2-3> Получение говяжьего фарша
Говяжий фарш, улучшающий здоровье, получали посредством смешивания 10 массовых частей экстракта смеси по настоящему изобретению или его фракции с говяжьим фаршем в соответствии со стандартным способом.
<2-4> Получение говяжьего фарша
5-10 массовых частей экстракта смеси по настоящему изобретению или его фракции добавляли в молоко. Молочные продукты, улучшающие здоровье, такие как сливочное масло и мороженое, получали с использованием молочной смеси в соответствии со стандартным способом.
<2-5> Получение Sun-Sik
Коричневый рис, ячмень, клейкий рис и юлму (слезы Иова) желатинизировали в соответствии со стандартным способом, сушили и пульверизовали для получения порошков 60 меш.
Черсные соевые бобы, черный кунжут и дикий кунжут обрабатывали паром и сушили в соответствии со стандартным способом и пульверизовали для получения порошков 60 меш.
Экстракт смеси по настоящему изобретению или его фракцию концентрировали при пониженном давлении, сушили распылением и пульверизовали для получения сухих порошков 60 меш.
Sun-Sik получали посредством смешивания сухих порошков злаков, семян и экстракта смеси по настоящему изобретению или его фракции в соответствии со следующим соотношением.
Злаки (коричневый рис: 30 массовых частей, юлму: 15 массовых частей, ячмень: 20 массовых частей),
Семена (дикий кунжут: 7 массовых частей, черные соевые бобы: 8 массовых частей, черный кунжут: 7 массовых частей),
Экстракт смеси по настоящему изобретению или его фракция (3 массовые части),
Ganoderma lucidum (0,5 массовой части),
Rehmannia glutinosa (0,5 массовой части)
<2-6> Получение здоровых пищевых добавок
Экстракт смеси по настоящему изобретению или его фракция: 100 мг
Витаминный комплекс: надлежащее количество
Ацетат витамина A: 70 мкг
Витамин E: 1,0 мг
Витамин B1: 0,13 мг
Витамин B2: 0,15 мг
Витамин B6: 0,5 мг
Витамин B12: 0,2 мкг
Витамин C: 10 мг
Биотин: 10 мкг
Амид никотиновой кислоты: 1,7 мг
Фолиевая кислота: 50 мкг
Пантотенат кальция: 0,5 мг
Минералы: надлежащее количество
Сульфат железа (II): 1,75 мг
Оксид цинка: 0,82 мг
Карбонат магния: 25,3 мг
Фосфат калия одноосновный: 15 мг
Фосфат калия двухосновный: 55 мг
Цитрат калия: 90 мг
Карбонат кальция: 100 мг
Хлорид магния: 24,8 мг
Витамины и минералы смешивали в соответствии с предпочтительным соотношением для композиции здоровой пищи. Однако соотношение для композиции можно корректировать. Составляющие смешивали в соответствии со стандартным способом получения здоровой пищи и затем композицию для здоровой пищи получали в соответствии со стандартным способом.
Производственный пример 3: получение здоровых напитков
Экстракт смеси по настоящему изобретению или его фракция: 100 мг
Лимонная кислота: 100 мг
Олигосахарид: 100 мг
Экстракт сливы китайской (Prunus mume): 2 мг
Таурин: 100 мг
Очищенная вода: вплоть до 500 мл
Приведенные выше составляющие смешивали в соответствии со стандартным способом получения здоровых напитков. Смесь нагревали при 85°C в течение 1 часа при перемешивании и затем фильтровали. Фильтрат загружали в 1 л стерилизованные контейнеры, которые герметизировали и стерилизовали снова, хранили в холодильнике до их использования для получения композиции для здоровых напитков.
Составляющие, подходящие для выбранных напитков, смешивали в соответствии с предпочтительным соотношением смешивания, но соотношение для композиции можно корректировать в соответствии с региональными и национальными предпочтениями и т. д.
Специалисты в данной области примут во внимание, что идеи и конкретные варианты осуществления, раскрытые в приведенном выше описании легко можно использовать в качестве основы для модификации или разработки других вариантов осуществления для достижения тех же целей по настоящему изобретению. Специалисты в данной области также примут во внимание, что такие эквивалентные варианты осуществления не отступают от сущности и объема изобретения, как изложено в приложенной формуле изобретения.
Реферат
Изобретение относится к фармацевтической промышленности, а именно к композиции для лечения или предотвращения дегенеративных неврологических нарушений. Фармацевтическая композиция для лечения или предотвращения дегенеративных неврологических нарушений содержит экстракт смеси коры корня пиона полукустарникового (Moutan Radicis Cortex), корня дудника даурского (Angelicae Dahuricae Radix) и корня володушки (Bupleuri Radix) в качестве активного ингредиента в массовом соотношении 1:0,2-5:0,2-5 (масс.:масс.:масс.), где экстракт экстрагирован с использованием воды, C-Cнизшего спирта или их смеси в качестве растворителя. Способ лечения или предотвращения дегенеративных неврологических нарушений включает стадию введения фармацевтически эффективной дозы экстракта смеси коры корня пиона полукустарникового (Moutan Radicis Cortex), корня дудника даурского (Angelicae Dahuricae Radix) и корня володушки (Bupleuri Radix) в массовом соотношении 1:0,2-5:0,2-5 (масс.:масс.:масс.) субъекту. Вышеописанная композиция обладает выраженной активностью для лечения или предотвращения дегенеративных неврологических нарушений. 2 н. и 4 з.п. ф-лы, 58 табл., 3 пр., 4 ил.
Формула

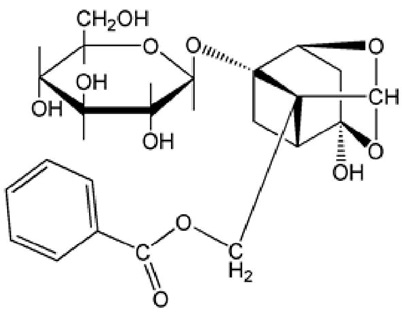







Комментарии