Способ полуяения бицикло/2,2,2/ октана - SU587856A3
Код документа: SU587856A3
Описание
(5).СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БИЦИКЛО- (2,2,2)-ОКТАНА где R,, RI-RI имеют вьаиеуказанные значения , подвергают взаимодействию с апкеном общей формулы R - СН СН-Рщ или алкином общей формулы R - С в R и R-J - как .указано выше, при температуре 15О-ЗОО°С и давлении 1О,5-28Окгс/с в среде инертного органического растворителя , например ароматического углеводорода , полученный кетон общей формулы где R( имеют указанные выше эна чения, обрабатывают металлоорганическим соединением, таким, как магнийгалоиддлкил или алкил щелочного металла, или гидридом щелочного металла, преимущественно литийалюминийгидридом , при 1О-125 С, лучше 4О-1ОО С, в среде инертного органического растворителя, предпочтительно линейного или циклического простого эфира, с последу ющим гидролизом образующегося соединения и выделением иелевого продукта или гидрированием его в присутствии катализатора гидрирования при температуре SO-210С и давлении 10,5-42,0 кгс/см в среде инерт Hotx органического растворителя. Гидрирование целесообразно проводить пр температуре о, 1ОО-16О с и давлении 1428 кгс/см Б среде низшего алифатического спирта в присутствии катализатора гидрирования - 5 о-иого палладия на углеродном но сителе Pd/C, На первой стадии реакции, т. е. реакции Лильса-Альдера, используют либо стехиомет рические количества исходных peareHTOBj ли бо небольшой избыток (до 25%) диенофила, а в качестве ароматического углеводорода применяют бензол, толуол, ксилол и т.д. Вторая стадия реакции - взаимодействие полиалкилбицикло-(2,2,2)-октадиенона или полиалкипбииикло-(2,2,2)-октенона с мет пнеорганическим соединением или гидридом щелочного металла. Для получения спирта, в котором один из Rg или RJ - водород, а другг й - гицроксил, используют гидрид щелочного металла, ареимуществен; 14 лити адюмнннй1чш)пд. Для синтеза соединений, в которых один из R, или R - алкил, а другой - гидроксип, применяют металлоорганическое соединение, например магнийгалоидалкил (галоид - хпор, бром или йод). Лучше всего использовать низшие магнийхлоралкилы, преимущественно «лормбтил-, хлорэтил-, хлорпропил- или хлорбутилмагний . Если же надо получить вещества, где один из R, или R, - алкил, берут низшие алкилы щелочных металлов, например метилили этилпитий. : Целесообразно использовать стехиометрическое количество металлоорганического соединения или его избыток (15О%). Как правило , его количество составляет 125-2ОО% от стехиометрии. Продолжительность реакции зависит от температуры применяемых реагентов, давления и т.д. Обычно продолжительность реакции составляет 2-24 час. В качестве растворителей на этой стадии реакции применяют полярнь е органические растворители, например простые циклические эфиры, такие, как тетрагидрофуран (ТГФ), циклические полиэфиры, такие,как диоксан, линейные простые эфиры, такие, как диэтиловый эфир, и линейные полиэфиры, такие, как диметиловый эфир диэтиленгликоля (диглим). В качестве растворителя могут быть также использованы фосфорсодержащие соединения, такие, как гексаметилфосфорамид. Среди ароматических растворителей преимущественно используют моноциклические соединения, такие, как бензол, толуол. После взаимодействия с металлоорганическим соединением продукт реакции гидролизуют путем подкисления или подшелачивания и получают соответствующий спирт. Основание или кислоту можно вводить в воду и затем этот раствор использовать для промывки и гидролиза соли (продукта реакции). Гидролиз обычно осуществляют при (-5)1ОО С, преимущественно при 15-ЗО С, лучше в кислой среде, например в «присутствии насыщенного раствора хлорида аммония. В результате гидрирования производных бицикло-{2,2,2)-октана или бицикло-( 2,2,2)-октена газообразшям водородом получают насыщенные циклические производные этих соединений. Температуру гипрпрования в,|бирают таким образом, чтобы процопжительность реакutiH составляла 1-8, преимущэственно 2-6 . Температура гидрирования составляет СГ|1,1ччо 1ОО-1вО°С. (еакцню прож.шят в присутч:твии кагалихЧатора гидрирования, такого , как 1шкель, ,;и )роаные металлы, такие, как платина и -палладий, которые могут быть использованы на носителе. Наиболее предпочтительными соединениям являются: 1,3,3,4,5,6-гексаметилбицикло-(2,2,2)-окт-5-ен-2-он 5 1,2,3,3,4,5,6-гептаметилбицикло-( 2,2,2 )-ойт-5-ен-2-ол карбометоксипированные 1,3,3,5-тетраметкл бицикло-(2,2,2)-октены, в частности производное . 7-карбометоксила -d-o-CHj
И производное 8-карбометоксила L
О
11
C-O-CHj
карбоме токси-113,3,5-тетр аме тилбицик ло- (2,2,2)октаны, в частности производные 7-карбометоксила
О
II О-о-бНз в производное 8-карбометоксила Инанопроиэводные 1,3,3,5-тетраметилбицикпог- (2,2,2)-октен6в, в частности 7-цианопроизводные jd и в-цианопронаводные Л 25
о
II
C-Ctts
„ изопропильные производные 1,3,3-триметил- бицшсло-(2,2,2)-окта-5,7-дкен-2-она, в частности 5-изопропил-1,3,3-триметилбицикло- ( 2,2,2 )-окта-5,7-диен-2-он
35
К бi-иaoпpoпил-l,3,3-триметилбицикло-{2, 2.)-окта-5,7-диен-2-он
«) 45 JJ цианопроиэводпые 1,3,3,o-тeтpaмeтилбицикпo {2 ,2,2)-oктaчoв, в частности 7-цианопроиэводные и 8-цианопроизводные L 4:1. ацетильные производные 1,3,3,5-тeтpaмeтиnбицикпp- (2,2,2)-oктeнoв, в частности произ- . водное 7-ацетила О -(ЗНз И производное 8-ацетила I изопропильные производные 1,3,3-триметилбицикло- ( 2,2,2)-октан-2-она, в частности 5-изопропил-1,3,3-триметилбнцикло-( 2,2,2 )-октан-2-он н 6-изопропип-1,3,3-триметилбииикло-{2,2, ,2)-октан-2-он Гг -:кА изопропильные производные 3,3-димети/rfi цикло- ( 2,2,2)-окта-5,7-пиен-2-она, в част ности 5-ваопропил-3,3-диметнпбицикпо-(2, , 2,2)-окта-5,7-аиен-2-он р 6-иэопропип-3,3-диметилби1шкпо-( 2,2,2}-ок1 5 № -он
Й1 и 6-нзопропип-3,3 димвтилбицикло-( 2,2,2)-окта-5 ,7-дивн-2-он .CS зопропильные производные 3,3-диметвлб цикло- (,2)-октаи-2-01Ш, в частности 5-изощэопил-3 ,3-димвТилбицикло-( 2,2,2)-ок- 5 тан-2-он
Qi . и 6-изопропи7Г-3,3-диметилбицикло-(2,2,2)-окта -2-он KZ изопропильные производные 1,2,3,3-тетраметилбицикло- ( 2,2,2)-октан-2-ола, в частности 5-изопропил-1,2,3,3-тетраметилбицикло (2,2,2)-октан-2-ол30 ji и в-изопропил-1,2,3,3.тетраметилбицикло- 3. -Ы,-г,Ьоктан- -ол н, изопропильные производные 2,3,3-триметил бицккло-(2,2,2)-октан-2-ола, в частности 5-изо пропкл-2,3,3-триметилбицикло-( 2,2,2)-октан-2-ол СЕ 6-изопропил-2,3,3-триметипбицикло-( 2,2, 2)-октан-2-ол ,50 ts зопропильные производные 3,3-диметил6и- 55 цикло-(2,2-,2)-ок1 5-ен-2-она, в частности 5ч-язопро1шл-3,3-диметилбицикло-{ 2,2,2 )i-OKT-5-ен-2-он
-f
™Х1 „
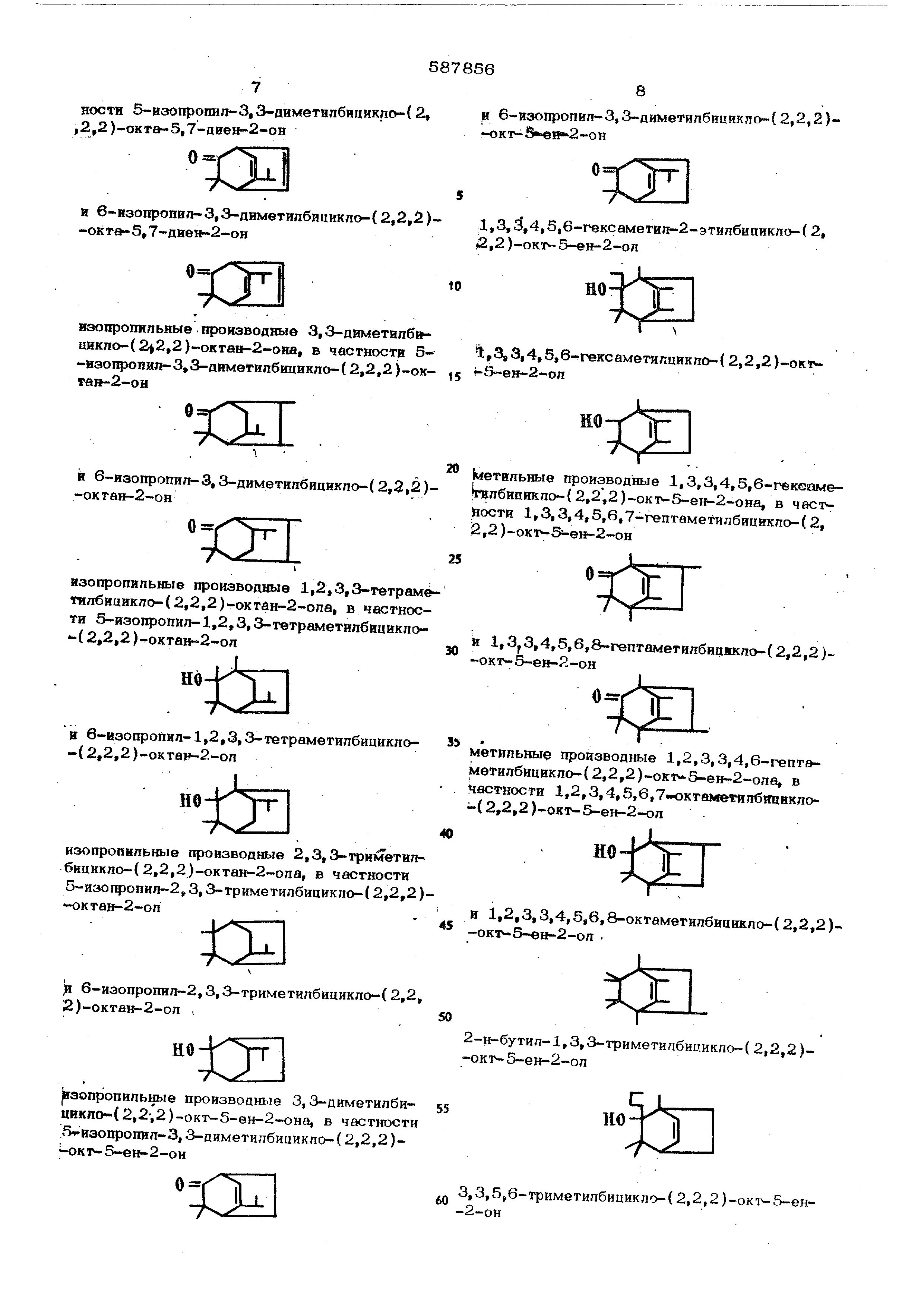
3,3,5,6-триметилбицикло-( 2,2,2 )-окг 5-ен-2-он 1,3,,4,5,6-гексамвтилЕ-2-этилбицикпо-(2, 2,2)-окт-5-ен-2-ол 1,3,3,4,5,в- гексамвтилцикло-( 2,2,2)-окг-5 ед-2-ол Ь етильныв производные 1,3,3,4,5,6-гекеаме1гвлбицикло- (2,2;2)-ок1 -5-ен-2-она, в часгjjoc g 1,3,3,4,5,6,7-гептамеТилбшикло-(2, 12,2 )-окт-5 -е -2-он т п п ,3,4,5,6,8-гептаметилбиаякло-(2,2,2)-окт-5-е -2-он i . производные 1.2,3,3,4.6-гепт метнлбицикло-(2,2,2)-ок1 -5-ен-2-ола, в настностн 1,2,3,4,5,6,7-окта №тепбт1икло- (2,2,2 )-окт-5-ен-2-ол В 1,2,3,3,4,5,в,8-октаметилбнцикло-( 2,2,2)-окГ-5-ен-2-ол Xi 2-н-бутил-1,3,3-триметипби1.шкло-( 2,2,2 )-окт-5-ен-2-ол
9 2,3, Э, 5,6-пентамвтипбицикпое( 2,2,2 )-окт-5-е -2-оп HoV . k Цвпевые соединения могут находиться в виде различных днастереоизомеров, и указа« нЬге формулы включают изомерньсе формы этих соедишний.; Так, соединение формулы Щ может иметь следующие изомерные формы Предпочтительными соединениями явллпот ся такие, в котчэрых алкил или алкоксил содержат низший С -Сф - алкил, в частности такие, в которых R и R - метил. Пример 1. Получение 2,3,4,5,6,6-гексаметилциклогекса-2 ,4-диен-1-она. В колбу на 3 л помещают 36О мп уксусного ангидрида, охлажденного до -5 С, медленно вводят 9О мл концентрированной серной кислоты, поддерживая температуру раст4 вора ниже О С, в течение 25 мин добавляют 84 мл: 30%-ной перекиси водорода, охлажденной до - 5 С, и полученный белый шлам растворяют в 25О мл хлористого метилена . Получен12 1й раствор при О С добавляют по каплям в течение 3 мин к раствору 8О г гексаметилбензола, ЗОО мл хлористого метилена , 36О мл уксусной кислоты и 27О мл ( Концентрированной серной кислоты, перемешив .аат. 90 мин при 0-5 С и полученный желтый раствор выливают в смесь льда и воды (1500 мл). Водный спой отделяют, экстрагируют 3; 5ОО мл хлористого метилена, органически слой и экстракты промывают последовательно л воды, 1 л 5%-ного едкого натура , 1 л насыщенного раствора сульфата двух валентного железа и аммония и два раза во дой, сушат над сульфатом магния, отгоняют хлористый метилен и получают 85 г светло10 желтой маслянистой жидкости, которую фракционируют на колонке Vigreaих (30, 48 ew). Выход 76,0 г, т, кип. 75-9О с/О.5 мм. ИК-спектр, см : 2880, 2980, 162О1660 .,166О-1540 (верхтше) 145О, 137(3, 1335, 1285, 1262, 1215, 11ОО, 107О, 106О, 985, 945, 900, 790, 630 и 6ОО, Спектр ЯМР (CDCeij ), 8 : 1,14 (синглет 6Н), 2,О2 (синг;;1ет ЗН). Масс-спектр, «п/е:178 (молекулярлвл ион). Пример 2. Получение 1,3,3,4,5,6-гексаметилбииикпо- (2,2,2 )-окт-5-ен-2-она. Раствор 70 г 2,3,4,5,б1б-гексаметилциклогекса-2 ,4-диен-1-она в 300 мл бензола вводят в автоклав Парра на 2 п, снабжен ный мешалкой, пропускают через него этилен для удаления воздуха, повышают давление цо 12,6 кгс/см при комнатной температуре и нагревают до 20О С в течение 2,5 час. Давление при этом повышается до максимального (28 кгс/см) и снижается до 23,8 кгс/см :. После охлаждения до комнатной температуры отгоняют бензол в вакууме и получают 85 г светло-желтой маслянистой жидкости. имеющей тонкий аромат леса, сосковой шишки. ИК-спектр, 2860-297О, 171О, 1470, 1455, 1440, 1380, 1375, 1370, 1355, 1260, 123OV 1205, 114О, 1100, 1062, 1055, 103О и 101О. Спектр ЯМР, & : 0,88, 0,93, 1,О7 и 1,12 (синглеты, метил), 1,7 (С-5 метил) и 1,62 (С-6 метил). Масс-спектр, п/е:.206 (молекулярный ион). .П р л м е рЗ. Получение 1,2,3,3,4,5,6-гептаметилбицикло- ( 2,2,2 )-окт-5-ен-2-ола. 170 мл ЗМ раствора хлорметилмагния в ТГФ нагревают с обратным холодильником в атмосфере азота, добавляют по каплям в течение 2О мин раствор 85 г 1,3,3,4,5,6-гексаметилбициклр- ( 2,2,2 )-окт-5-ен-2-она н 2О мл ТГФ, нагревают 2 час с обратным холодильником. Затем добавляют 50 мл раствора хлорметилмагния в ТГФ, нагревают 12 час с обрат ным холодильником, избыток реактива Гриньяра и солей гидролизуют насыщенным раствором хлорида аммония, медленно вводят в баню со льдом и декантируют раствор. ТГФ отгоняют в вакууме, получают,75 г желтой маслянистой жидкости, перегоняют ее в к логске с насадкой GoodEoe (ЗО, 48 см) при коэффициенте дефлегмации ,4:1 и отбирают продукт, кипящий при 80-87°С/0,5 мм. После перекристаллизации из гексана получают твердое кристаллическое вегцество бе11
лого цвета, т. п. 72-73 С, имеющее очень приятный запах лесноп дерева, камфоры и абсо/потно походящий на спирт из масла пачули .
Методом газожидкостной хроматографии показано наличие двух эпимерных спиртов (ffi а и Q а ) и (5J б и ij G ). в соотношении .
ИК-спектр спирта (|В а и gj а ), см : 3630, 3520, 286О-3000, 1470, 1440, 139О, 1383,1379, 1368, 13ОО,...1190, 118О, 1150, 1118, 1099, 1О78, 1О59, 1О5О, 1ООО, 986, 907 и 798.
Спектр ЯМР, & : 0,95, 1,27, 1,38, 1,46 и 1,68 (санглет метила, ЗН), 2,82 (синглет метила, 6Н).
Масс-спектр, т/е 2.22 (молекулярный ион).
ИК-спектр спирта ( ff б н б ); j 358О, 3510, 286О-ЗоЪо, 1470, 144О 1390, 1378, 13.62, 1316, 1297, 1242, 1210, 1184, 1145, 1119, 1098, 1078, lOeO, 1050, 104О, 1030, 100О, 910, 8вО, 8ОО, 74О, 708, 68О, 615 н 58О.
Спектр ЯМР, е : 0,86, 1,23, 1,46, 1,55, 1,6О, 2,88 и 2,93 (сингпеты метила , ЗН). Масс-спектр , га/в|222 (молекулярный Hojr),
П р и м е р 4. Получение 1,3,3,5-тетраметил-7- и 1,3,3 5-;тетраметип-8-карботиетоксибицикпо- ( 2,2,2 y-oKT-S-OHa.t
В автоклав на 2 л вводят .68 г 1,3,5,5-гетраметилциклогекса-1 ,3-дяена, 45 г метилакрилата и 10О мп бензола, нагревают 9 час при 2ОО С, удаляют растворитель путем быстрого KCTiapejffirsEjв вакууме и получают 1О2 г сырого продукта, который фракционируют на колонке Vl reaux (7,-6 см), выделяя 34 г маслянистой жидкости, т. кип. 76-145 С/ 1,2 мм.
Методом газожицкостной хроматографии показано наличие четырех компонентов: основного компонента - производного 7-карбо мётоксила и трех не основных компонентов п ( нзводного 8-карбометоксипа.
Эта смесь имеет запах листвы, мяты, валерьяновых капель.
ИК-спектр основного компонента, см : ЗО25,292О,287О, 1870, 1700,1460,1450 1440,1430,1375,1360,1340,1320,1285, 127О, 125О, 1215, 1197, 1160, ИЗО, 1105, 1О20, 990, 980, 92О, 8ОО и 740
Спектр ЯМР, S : О,78, 0,98, 1,02, 2,00, и 3,56 (сингпеты, ЗН), 5,38 (синглет , 1Н). .
Масс-спектр, т/е: 222 : (молекулярный .ион).
ИК-спектр второго из не оснопюлх компонентов , cv-i : , 2860, 1735, 144
12.13GO , 125О, 12ОО, 117О, 1155, 106О, 1020, ЮОО, 880 и 83О. .
Спектр ЯМР, в : О,93, 1,74 и 3,64 синглеты, ЗН), 5,02 и 5,48 (сИнглет, 1Н). Масс-спектр,-т/е: 236 и 238 (зона).
аким образом, этот компонент представляет Ьобой, вероятно, смесь соединений с непосредственными молекулярными весами.
ИК-спектр третьего из не основных компонентов , см : 3070, .295О, 1735, 1650. 1б6зД43р,1360,1310,1275,1240,1215, 11 ВО, ll4O, ИЗбГЮбО, 104О, lOloi 99О, 94О, 880, 850, 81О, 640 и 57О.
Спектр ЯМР, 8 : 0,82, 0,92, 0,98,. 1,69 и 3,62 (синглеты, ЗН), 4,67 (дублет, 2Н) и 5,76 (синглет, 1Н).
Мжс-спектр, (молекулярный ион).
Пример 5. Получение 1,3,3,5-тетраметил-7- и 1,3,3,5-Т8Траметил-8-карбометоксибицикло-f 2,2,2 )-октана.
В автоклав на 2 л вводят 3,0 г смеси 1,3,3,5-тетраметил-7- и 1,3,3,5-тетраметил-8-карб6метоксибицикло-{2 ,2,2)-окр-5 ена, 2ОО мл изопропилового спирта и О,05 г 5%-ного палладия не углеродном носителе, продувают водородом, доводят давление до 14 кг/см , нагревают до 100 С (давление 14 кгс/см) в течение 6,5 час, охлаждают до комнатной температуры.
Катализатор отфильтровывают, растворитель удаляют путем быстрого испарения в вакууме и получают 3,О г сырого продукта. При газожидкостной хроматографии получают два довольно больших пика. Данные спектрального анализа (тоже два пика) показывают ,что эти два компонента, вероятно, представляют собой структурные изомеры. Эти компонентыимеют запах (прИ анализе аапаха два пика) фруктов, листвы, мяты, фиников и лесного дерева.
ИК-спектр производного 7-карбометоксила , см : 298О-2860, 1725, 1460, 1430, 1360, 1340, 1320, 1280, 1260, 1240, 121О, 119О, 116О, ИЗО, 1115, 1085, 1060, 1035, 1020, 995, 978, 930, 912, 890, 820, 812, 780 и 740.
Спектр ЯМР, 8 : 0,70, 1,О5 и 3,59 (синглеты, ЗН), О,96 (синглет, 6Н) и 1,О1 (дублет, ЗН).
Масс-спектр, т/е: 224 .(молекулярный ион).
ИК-спектр не основного компонента производного 8-карбометоксила, см : 2 9бО2860 , 1730, 1455, 1430, 1380, 136О, J 318, 1262, 1255, 1235, 1210, 1200, Ii90, 1160, 1070., 105О, 102О, 1ОО5, 915, 9ОО, ,330/800, 780 и 74О. Спектр ЯМР показывает, что не основной компонент Состоит из цвух изомеров. 13 Спектр ЯМ1, S : 0,73, 0,77,/Э,02, 1,03, 1,05 и .1,13 (синглет, метил), 3,59 (ситгглет, ЗИ, метильная группа эфира). Масс-спектр близок к масс-спектру основногр компонента. Масс-спектр производных 8- и 7-карбометоксила , «я/е: 224 : (мопекупярный нон). Пример б. Получение 1,3,3,5-гетраметип-7- и 1,3,3,5-тетраметил-8-цианобицикпо- ( 2,2,2 )70кт-5-ена. В атоклав на 2 л вводят 136 г 1,3,3,5-тетраметилциклогекса-1 ,3-диена, 53 г акрипонитрила и 500 мл бензола, нагревают 6 час при 200 С, охлаждают до комнатной температуры, быстро испаряют растворитель в вакууме и получают 176,4 г сырого процукта . При гаэожидкостной хроматографии получают два основных пика и пик соответствующий небольшому количеству исхоцногс вещества. Сьфую маслянистую жидкость пропускают через разбрызгивающую колонку 5,08 ем) и получают 139 г продукта, т, кил., 7175°С/0 ,3 мм, имеющего запах лесного дерева , камфоры, мяты, цветов. ИК-спектр 7-цианопроизводного, см : ЗОЮ, 296О, 2920, 2860 2230, 1650, 1450, 1380, 1365, 1335, 1315. 1282,, 1210, 1190, 1150, ИЗО, 1040, 1022, йООЗ, 965, 91О, 802, 715 и 6вО. Спектр ЯМР, 8- : 0,80, 1,12, 1,18 и 1,76 (синглеты, ЗН), 5,42 (синглет, 1Н, винил). Масс-спектр, Ш /в: (молекулярный ион). ИК-спектр 8-цианолроизводного, см ЗОЮ, 296О, 2910, 2235, 1455, .1450, 1380, 1360, 1340, 1210, 1190, П60, 1020, 980, 975, 800 и 795.. Спектр ЯМР содержит большое число сиг налов метильных групп. Четыре сигнала метильных групп составляют в сумм© девять протонов или 3 метильных группы при 0,79 О,97, 1,10 к 1,23 б , тогда как пятый сигнал метильных групп при 1,8 ff. определяется , как три протона, и сигнал винильного протона при 5,48 6 определяется, как один протон. Масс-спектр близок к масс-спектру 7-ци анопроизводного (молекулярный ион при «п/ 189). По данным ЯМР-спектроскопии npoflyKt вероятно, содержит смесь изомеров. Пример 7. Получение 1,3,3,5-тетраметил-7- и 1,3,3,5-тетраметил-8-цианобицикло- (2,2,2)-октана. В автоклав на 2 л вводят 15,0 г 1,3,3, |5-тетраметил-7- и 1,3,3,5-тетраметил-8-цианобш1Нкло- (2,2,2)-окг-3-ена, 0,2 г 5%-ного палладия на углеродном носителе и 20О мл изопропилового спирта, продувают азС11ч.)м и повышают давление до 21 кгс/см 5 6 Автоклав нягревпи т до 10О С при перемешивании в течение 2О -(fu:, охлаждают до комнатной температуры, вмтружают рвпкиионную смесь и фильтруют. Растворитель быстро испаряют и получают 13 г сырогч) гтродук-: та, показывающего пва основных пика при газожидкостной хроматографии, который имеет очень приятный запах фруктов лесного пе рева с нежным ароматом мяты. ИК-спектр 7-цианопроизвоаного, см ; 2960, 2920, 2870, 2230, 145О, 1375. 137О. 1350, 1300, 1275, 1205. 1195. 1170, 1140, 1020 и 960. Спектр ЯМР, 6 : 0,90, р,95 ио,98 ( синглеты, ЗН), 1,07 (дублет, ЗН).. Масс-спектр, т/е: 191 (молекулярный ион). ИК-спектр 8-цианопроизволного, см : , 2960,2920,2880,2235,1460,1390,1378, 1360,1340,1300,1260,1210,1105,1175, 1145, 1120; 100О и 960. Спектр ЯМР, S : 0,96, 1,02, 1,07 {cинr леты , ЗН), 1,1О (дублет, ЗНЧ Macc-cneKTpj ш/е: -191 олекулярныЯ ион). Пример 8. Получение 1,3,3,5-твтраметил-7- и 1,3,3,5-тeтpaмeтил-8-aцвтипбициклo- (2,2,2)-oкI 5-eнa. ... В атоклав на 2 л-вводят 136 г 1,3,5,5 -тетраметилциклогекс а-1,3-диена, 7О г метилвинилкетона и 300 мл бензола, пр.омы0йют азотом и нагревают ао 200 С в течение 5 час. Затем автоклав о слаждают до KOMHat ной температуры, быстро испаряют растворигель в вакууме и получают 174 г маслянистой жидкости, которую пропускают через разбрызгивающую колонну. Выделяют 100 г продукта ,-т. кип. 68-125 С/0,5 мм, повтсрмо перегоняют его в колонке с насадкой OoodEoe (ЗО, 48 см) я получают продукт, т. кип. 83-94°С/О,7 мм, показывающий при гяяожидкостной хроматографии два основных пи ка. Этот продукт имеет запах фруктов, ;шсного дерева спримесью аромата камг|(оры. ИК-спект производного 8-адетилв, см ; ЗО05, 296О,292О, 2865, 1705, 1445, 1375, 136О,127О, 120О, 1185, lieS, ИЗО, 1060,1ОЗО, 98О, 940, 000,840 и 80О, Спектр ЯМР, & : 0,73, 1,ОЗ, 1,О7, 1,72 и 2,06 (синглеты, ЗН) , 5,43 (синглет , 1Н). Масс-спектр, т/е: 206 {молекулярный ион). ИК-снектр произвоаного 7-ацетила, см ; 296О-2900, 2860, 281О, 17О7, 166О, 160О, 1440, 1420, 136О, 128О, 122О, 1180,1155,1055,lO4O,l6O5, 98О, 94О, 91ё, 87О, 835, 818,73О, 645, 638, 590 и 57,О.
15
Спектр ЯМР, 8Г : 0,75, 1,79, 1,92 (синглеты, ЗН), 0,98 (сннгпет, 6Н), 5,4О (синглет, 1Н, винип).
Масс-спектр, 2О6 {молекулярный ион).
Пример 9. Получение 5- и 6-изопросга л-1,3,3-тримвтилбицикло-( 2,2,2 )-5,7-октадиен-2-она .
В атоклав Парра на 2 п вводят 2,9 г 2,6,6-триметил-2,4 циклогексадиенового аимера , 4,35 г З-метял-1-бутина и 250 мл бензола, нагревают 17 час при 19О-2ОО°С (давление 14,7-16,8 кг/см), охлаждают, отгоняют в вакууме растворитель (55 мм) при 5О С и получают 4,7 г сырого продукта , имеющего запах мяты, камфоры, лесного дерева с. примесью аромата пряностей (перечно-лаятного аромата).
Масс-спектр, 70, 119, 41, 42, 91 (молекулярный пик 204),
Спектр ЯМР, е : 1,О2 (m , 12Н), (d , ЗН), 2,42 (т, 1Н), 3,36 (ЦП , IH), 6,00 (ш, 2Н), В,50 {т, 1Н).
Данные газожидкостной хроматографии, ЯМР-спектроскспии и масс-спектрометрии подтверждают получение целевого продукта.
Пример Ю. Получение 1,3,3-триметил-5- и 1,3,3-трнметнл-С-изопропиобицикпо- ( 2,2,2)-окта -2-она. г
В атвоклав Парра на 2. л снабженный устройством для подачи водорода, вводят 8,6г 5- и 6-изопропил-1,3,3-триметилбицикло- (2,2,2 )-5,7--ктадие -2-она, 0,5 г 5%-ного палпадия на углеродном носителе и ЗОО мл этанола, выдерживают 30 час при темпеатуре 90-12О°С и давлении 7,7-16,8 кгс/см, тфильтровывают катализатор и отгоня- т этанол в вакууме (50 мл) при 60°С, ногучая 25,7 г продукта, имеющего запах мяты, камфоры.
По данным газожндкостной хроматографии, масс-спектрометрии и ЯМР-спектроскопии полученный продукт представляет собой смесь 1,3,3-триметил-5- и 1,3,3-триметил-6-изопропилбицикло- ( ,2 )-октан-2-онов.
Масс-спектр, т/е: 82, 137, 208, 41, 138, 81.
Спектр ЯМР, 8- : О,7 (т, 6Н), О,91 (S, ЗН), 1,09 (S ,6Н ) и 1,7О (т, 9Н).
Пример 11. Получение 3,3-диметил-6- и 3,3-димeтил-5-иэoпpoпипбициклo- (2,2,2)-oктa-5,7-диeн-2-oнa.
В автоклав Парра на 2 л вводят 25 г (0,2 моль) 6,6-диметилциклогекса-2,4-динбна , 28 г З-метил-1-бутина и ЗОО мл бенола , нагревают до в течение 11 час, тгоняют растворитель в вакууме и получат 34,0 г продукта, который перегоняют в вакууме (3 мм). Полученный продукт имеет
16
неприятный фенольный запах, напоминающий запах валерианового Корня.
Спектр ЯМР, 5 : 0,9 (5, 3Fi), 0,98 (5, 9Н), 2,35 (т, 1Н), 3, (т, 1Н), 3,85 (м, 1Н, 5,93 (ж, 1Н) и 6,34 ,(т, 2Н).
ИК-спектр, 17Ю (карбонил).
Масс-спектр, т/е: 70,43, 105, 42 и 91.
Пример 12, Получение 5- и 6-изопропил-3 ,3-димeтилбициклo-(2,2,2)-oктaн-2-oнa ,
В автоклав Парра на 2 л вводят 15 г 5- и 6-изопропип-3,3-аиметипбицикло-(2, ,2,2)-5,7-октадиен-2-она, 0,5 г 5%-ного палладия на. уг 1еродноМ носителе и 300 мл этанола и гфопускаюТ водород при температуре 12О-130 С и давлении 14 кгс/см. Автоклав нагревают 3,5 час, повышая давление до 23,8 кгс/см .
Катализатор отфильтровывают, отгоняют растворитель и получают 15,0 г продукта.
Данные масс-спектрометрии и ЯМР-спектроскопии подтверждают получение целевого продукта, имеющего июпрнятный запах валерианы .
Масс-спектр, т/е: 123, 41,69, 65, 82, 194 (молекулярный пик).
Спектр ЯМР, е- : 0,79 (d , 6F). 1,06 (d ,6Н), 1,69 (m, 9Н)-и 2,34 (т, 1Н).
Пример 13. Получение 5- и 6-изопропил-1 ,2,3,3-тетраметилбицикло-( 2,2,2)-октан-2-ола .
В емкость на 10 мл вводят 1 об.ч. 5и 6-изопропил-1,3,3-триметилбицикло-(2,2, )2)-рктан-2-она, 4 об.ч. 5%-ного раствора метиллития в эфире и 6 об.ч. бензола, нагревают 2 час с обратным холодильником и получают смесь С-2 эпнмеров целевых со.еди-i нений (по данным газожидкостной хроматографии ) , имеющих аромат масла, лесного дерева .
Масс-спекгр, т/е: 86, 71, 43, 41, 95 и 2О6 (молекулярный пик).
Пример 14. Получение 2- и 6-из1упропил-3 ,3-диметилбицркло-( 2,2,2 )-окта-5 ,7-д11ен-2-она.
В автоклав Парра на 2 л вводят 25 г (0,2 моль) 6,6-диметилгО са-2,4-диенона, 28 г З-метил-1-бутина и ЗОО мл бензола, нагревают до 195 С (давление 14 кг/см), нагревают 11 час при данной температуре, охлаждают до комнатной температ}фы, извлекают из автоклава, отгоняют бензол в вакууме и получают 34,0 г сырого продукта, который перегоняют, и выделяют 24,9 г смеси целевых соединений, т. кип. 92 С/3 мм. 0 Анализ методом газожидкостной хроматографии показывает наличие двух пиков. : 17 1О (карбонип). ИК-спектр, см .(5, ЗН), 0,9fe (5, 9Н Спектр ЯМР, 6 2,35 (то, 1Н), 3,34 (т., 1Н), 3,85 (т, 1Н), 5,93 {т, 1Н) и 6,34 (т, 2Н). Масс-спектр, m/е: 7О,43, 1Q5, 42 и 91. Пример 15. Получение 5- и 6-изопропип-2 ,3,3-триметнпбииикпо-(2,2,2)-ок тан-2-опа. В емкость на 50 мп вводят 7 г 5- и 6-изопропил-3 ,3-диметипбицикпо-( 2,2,2 )-октан-2-она , 16 г 5%-ного раствора метиппития в эфире и 2О мл бензола, нагревают 2 час с обратным холодильником, добавляют еще 16 г раствора метиппития, нагревают 1 час с обратным холодильником, гидролизуют 5О мл воды, промывают 5О мп насыщенного раствора хлорида натрия, сушат над безводным сульфатом натрия « отго1Шют растворитель, получая 6.8 г смеси целевых соединений, т. кип. 112 С/2-3 мм, имеющей запах камфо|эы. «Мжю-спектр; . 01/в: 43, 71, 86, 41, 210 (молекулярнь1.й пик).; Спектр ЯМР, S : 0,9О (т, 12Н), 1,15 (И, ЗН) и 1,50 (tn, ЮН).. Пример 16. Получение 1,3,3,4,5, }6-гекеамегил-2-этилбицикло-( 2,2,2 )-окт-5 -ен-2-ола, В трехгорпую круглодонную колбу вводят 44 млраствора 1,3,3,4,5,б-гаксамети бииикпо-(2,2,2)-окт-5-ен-2-она s бензоле (концентрация 1,73 моль в 6ОО мл раствора ), добавляют 1ОО мп бензола и перемеши вают, охлаждая до -10 С, и вводят по каппям 10О мл 5,1%-ного раствора этиппития в бензоле, поддерживая температуру 10 ,15С (ледяная баня). Систему продувают азотом. При газожидкостной хроматографии обна ружено три основных пика (непро реагирова& шее исходное вещество, два изомерных про- дукта при 45 и 39%). К Смеси добавляют по каплям 10О мл этиллития и перемещибают 35 мин при Ю По данным газожидкостной хроматографи реакционна смесь содержит 90% целевогю продукта и 1,3% исходного вещества. После перемешивания еще в течение 30 мин к реакционной массе добавляют 100 мл воды, перемешивают в делительной воронке, отделяют органический слой, промывают 1ОО мп воды и упаривают в роторном испарителе, получая 22 г сырого-продукта, который экстрагируют бензолом и промывают едким натром. Органический слой анализируют методом газожидкостной хроматографии, который показывает наличие С-2 эпимеров целевого J8 лесного дерево, ifMCKniiHx звпах соединения, камфоры. Попученный продукт перегоняют в микроколонке Yigfeaux , получая пять фракгшй. Четвертую фракцию анализируют методами газожицкостной хроматогра4|ии и масс-спект ,ром«тпчя. Масс-спектр, w /е;136, 119, 41, 219 (молекулярный пик) и 2ОЗ. 1,3,3,4,5,6-гексаметилбицикло-( 2,2,2 )-окт-5-ен-2-ол получают атгапогичным образом при взаЕмодействни 1,3,3-триметилби Шкло- (2,2,2)-ок -5-ен-2-она с н-бутиллктием . Этот продукт имеет запах листвы, лесного дерева, кам(|юры. Пример 17. Получение 1,3,3,4,5, 5-гексаметилбицикло-( 2,2,2 )-окт-5-ен-2ола . В сухую трехгорловую колбу емкостью 500 мл вводят 15О мл безводного эфира и 4;2 г (0,11 моль) литийалюминийгидрида, в течение 1,2 час при нагревании с обратным холодильником добавляют смесь 50 мп безводного эфира и 41 г 1,3,4, 5,6-гексаметилбицякло- (2,2,2)-окг-5-е11-2-она, перемащивают при нагревании с обратным холодильником в течение 0,5 час и обрабатьшают образец для газожидкостной хроматографии. По данным анализа образец содержит 17,9% исходного вещества и 40,9% одного р 41,2% другого продуктов реакции. Перемещивают 1 час с обратным холодильником , добавляют еще 2,0 г литийалюминийгидрида , перемащивают 0,5 час с обратным холодильником и выдерживают 14 час. Реакционная масса содержит менее 0,1% исходного вещества. В реакционную массу добавляют по каплям 20 мл воды, фильтруют, сушат фильграт над безводным сульфатом магния, отгоняют растворитель и получают 37,7 г остатка , дающего пики 48,5% и 49,3% при газожидкостной хроматографии. Масс-спектр, т/е: 136,121, 41, 1О5, 91 и 2О8 (молекулярный пик). Спектр ЯМР смеси изомеров, б : 0,94, 1,02, 1,25, 1,42, 1,46, 1,6О, 1,80,2,80 и 2,86 (синглеты, 18Н), 2,6О (мультиплет 4Н). Масс-спектр и спектр ЯМР псдверждаюг получение целевого продукта, имеющего за пах шоколада, лесного дерева, камфоры. Пример 18. Получение 1,3,3,4,5, 6,7- и ,1,3,3,4,5,6,8-гептаметилбицикпо(2, 2,2,)-OKr-5-ен-2-она. В автоклав на 2 л вводят ,ЗОО г чистск го 93,7%-ного 2,3,4,5,6,6-гексаметилциклогекса-2 ,4-диенона, вводят пропилен до давления 5,25 кгс/см и нагревают. Давление постепенно повышают до 37,1 кгс/см при 587 Гемпературе 200-220 С, затем давпение начинают снижать, а температуру повышать. Температура изменяется от 210 до 215 С. Выдерживают 1 час при указанной температуре охпаж| ают и оставляют на ночь. Реакаионную массу выгружают из автоклава, веретх няют в колонке с насадкой SoodEoe {22,8 см) при 103-105°С/1,3-1,8 мм к получают 360,5 г смеси целевых соединений имеющей аромат начупв. Масс-спектр, , т/е: 15О, 135, 220 (мо пекулярнБ1й пик), 41, 119 и 178, Пример 19. Получение 1,2,3,3,4, ,5,6,7- и 1,2,3,3,4,5,6,8-октамегилбицикло- (2,2,2)-окт-5-ен-2-ола. В сухую трехгорлевую колбу емкостью 250 мл, продутую азотом и снабженную мешалкой с обратным холодильником, вводят 26 мл 2М раствора хпорметнлмагння в ТГФ. В течение 5 мин подают смесь 25 мп ТГФ и 8,0 г 1,2,3,3,4,5,6,7- и 1,2,3,3,4,5,6, 8-октаметил-( 2,2,2 )-окт-5-ен-2-она, перемешивают с обратным холодильником и анализируют методом газожидкостной хроматографии . Через 17 час обнаруживают лишь следы исходного вещества. Смесь охлаждают до 10°С и гидролизуют насыщенным раствором хлорида аммония, фильтруют и перегоняют в небольшом вакууме. . Получают 7,8 г продукта, который по дац масс-спектрометрии содержит смесь целевых соединений. Масс-спектр, т/е: 15О, 135, 41, 43, 119 и 236 (молекулярный пик). Продукт имеет запах камфоры. Пример 2О. Получение 1,3,3,4,5, .6s7 и 1,3,3,4,5,6,8-гептаметилбицикло-(2 j2,2)-oK -5-eH-2-ona. В сухую трёхгорлую колбу емкостью 25О мл, снабженную мешалкой, термометром, обратным холодильником, капельной воронкой и устройством длябарботировяния азота, вво дят 35 мл безводного, эфира и 1,5 г литийалюминийгидрида , нагревают с обратным холодильником при перемешивании. После однократного стекания флегмы нагрев приостанавливают, в течение 14 мин по каплям вводят смесь 1О г 1,3,3,4,5,6, 7- и 1,3,3,4,5,6,8-гептаметилбицикло-(2, 2,2)-окт-5-ен-2-она и 2О мл безводного эфира и перемешивают 75 мин с обратным холодильником. При газожидкостнойхроматографии обнаружены три новых пика и Небольшое количе во исходного вещества. Смесь выдерживают в течение ночи, npvt капывают к ней 15 мл воды при охлаждении фильтруют, сушат фильтрат над безводным сульфатом магния, отгоняют растворитель н получают 10,1 г продукта, содержащего 5-6% исходго вещества. Обнаружено три новых пика (24:29:40). После перегонки 8,1 г полученного проду та выделяют 6,7 г смеси целевых соединений . Масс-спектр, п/е: 1ай, 150, 41, 119, 91 и 222 (молекулярный пик). Полученный продукт имеет приятный запах лесного дерева. Пример21. Получение 1,2,3,3,4,5, 3-гептаметилбицикло-( 2,2,2)-окт-5-ен-2ола . В колбу на 12 л,-Снабженную мешалкой, термометром, холодильником и ловушкой Бидвелпа , вводят 792 г 1,3,3,4,5,6-гексаметилбицикло- (2,2,2)-окт-.5-ен- 2-она, 2OOOMrL ЗМ раствора хлорметилмагния , в ТГФ и 21ОО мл толуола в атмосфере сухого азота, нагревают с обратным холодильником (65-7О°С). ТГФ удаляют в течение 50 мин по мере постепенного повышения температуры до 95°С. После этого температуру повышают до 1ОО°С и выдерживают 1,5 час при . Смесь охлаждают до ЗО С, добавляют в нее 4ОО мл насыщенного водного раствора хлорида аммония, поддерживая температуру ниже 35 С, фильтруют, промывают фильтрат 2xl л эфира, из соединенных органических слоев отгоняют растворитель и получают 893 г сырого продукта, который быстро перегоняют в керамической колонке (30,48см) с насадкой. Полученный продукт, т. кип. 143-192 С/ /0,3-0,4 мм, повторно перегоняют в колонке с насадкойSooolEoe (30, 48 см) и выделяют 669 г целевого соединения (смесь изомерных формЩ а иЩ б). Пример 22. Получение 2,2,4,5-тет раметилциклогекса-3,5-диен-1-она. В трёхгорлую колбу на 2 л вводят смесь 256 мл уксусного ангидрида и 33 мл ангидрида , трифторуксусной кислоты, добавляют 75 мл концентрированной серной кислоты при охлаждении, очень медленно в течение 15 мин прибавляют бЬ мл 5О%-ной перекиси водорода , поддерживая температуру 0-5 С, перемешивают 10 мин при О С, в течение 2 мин добавляют 288 мл трифторуксусной кислоты И затем в течение еще 2 мин 216 мл серной кислоты, поддерживая температуру О 5 С, добавляют 332 мл дихлорметана и медленно при (-1О) - (-5) С вводят 75 г. , 4,5-тетраметилбензола. Через 2 мин после этого реакцвоннай масса значительно темнеет, а температура повышается до 11°С. Реакционную массу охлаждают до 25°С и перемешивают. Реакция протекает в течение 7О мин. По данным газожидкостной хроматографии4кол 21 ка циаметром 0,32 см и длиной 3,04 м) сырой продукт реакции содержит 46,8% 2,2, j,4,5-тетраметипцикпогекса- 3,5-диен- 1-она. Эту смесь вводят в 8ОО мл ледяной воаы , э|сстрагируют водный слой 20О мл хлористого метилена, экстракт и органический слой промы-веаот 2x1 л воды, 5%-ным едким явтром, хлористым метиленом, насыщенным раствором хлорица натрия и два раза водой, сушат над сульфатом магния, быстро отгоняют растворитель в роторном испарителе, фильтруют и перегоняют в микроколонке VigСБСШХ при 82 С/3-4 мм, получая более 8О% чистого целевого соединения. Пример 23. Получение 3,3,б,6-тет;раметилбицикпо- (2,2,2)-ок1 5-ен-2-она В автоклав на 2 л вводят 3,1 г тетраме- тилциклогексадиенона и 30 мл бензола, подают этилен до давления 13,3 кгс/см и нагревают , до 200 С, Перемешивают 1 час при 20О С, охлаждают, выгружают реакционную массу и выдерживают в течение ночи (при этом большая часть растворителя испаряется Остаток анализируют методом газожидкос ной хроматографии, по данным которгой продукт не содержит тетраметилциклогексадиенона и содержит 68% основного компонента (от смеси). Масс-спектр, m/е: 108, 93, 41, 39, 27 и 107. 8- : 1,02 (S, ЗН), 1,06 Спектр ЯМР, (S , ЗН), 1,74 (т , ЗН), 1,80 (т, ЗН), 4Н), 2,24 (-t , 1Н) и ,08 (т, 2,84 (t , 1Н). Масс-спектр и спектр ЯМР подтверждают образование целевого продукта, имеющего аромат пачули, камфоры и вкус сафранала пачули, целлулоида, камфоры. Пример 24. Получение 2,3,3,5,6-пентаметилби1шкло- ( 2,2,2 )-окт-5-ен-2-ола. В трехгорлую колбу емкостью 50 мл при перемешивании вводят смесь 15 мл хпор метилмагния в ТГФ (2,88 моль) и 1О мл толуола, отгоняют растворитель до тех пор, пока температура верхней фракции не достйг нет 1ОО С, а температура головной фракции - 78 С (отгоняется 9 мл растворителя) вводят в смесь 4 г тетраметилбициклооктенона ( в течение 5 мин при 1ОО С) и следы тетраметилбициклооктенона, оставшиеся на воронке, смывают 7 мл толуола, спивая его в реакционную колбу. Перемешивак т 3,5 час при нагревании с обратным холодиль ником, выцержйВг-и :)т в течение ночи, фильтру ют, при перемешивании добавляют к фильтрату 10 мл насыщенного раствора хлорида аммония , фильтруют и сущат фильтрат над безводным сульфатом магния. Из фильтрата отгоняют растворитель в роторном испарителе, и по/гучают 2,7 г 1ц эдукта, по aaHiibJM газо
22 вой хромятогра }ти имеющего основной иик 67%. Масс-спектр, m-е: 133, 148, 41, 27 и 39. Спектр ЯМР, е : 0,83(S, ЗН), О,99 IS, ЗН), 1,07 (&, ЗН), 1,71 (S, 6Н) и 1, (1П,6Н). Масс-спектр и спектр ЯМР подтверждают получение целевого продукта ; имеюшего запах лесного дерева, камфоры и вкус целлулоида , пачули, лесного дерева, камфоры. Формул изобретения 1. Способ получения производных бицикпо- (2,2,2)-октана обшей формулы где пунктирные линии представляют собой одинарную или двойную связь углерод-углерод; RJ - водород или низший алкил; R. или RJ - водород или один из них низший алкил, а - водород или гидроксил; R и Rj - низший алкил; R., f и Rj - водород или низший алкил; Rq вопорол или один из них низший алкил, ниапогруппа, низший карбглкоксил , ацил,а другой-водород, кроме TOIX, не менее пяти из R - f не должны быть водородом , отличающийся тем,что гексадиенон общей фс)рмулы О пае R. , R. - h имеют вышеуказанные значения , подвергают взаимодействию с алкеном бшей формулы тг,-сн сн-тг,о или алкином оби1ей формулы R -CSC-RjQ , где R- и Ryj - как указано выще, при температуре 15О-300 С и д шлении Ю, 5 8 ,О кгс/см в среде инертного органического растворителя, полученный кетон общей формулы
23
где R
PID
I имеют указанные выше
значения, обрабатывают метаплоорганическим соединеннем нли гидридом щелочного металла при 10-125 С в среде инертного органического растворителя с последующим гндролиаом образующегося соединения и выделением целевого продукта или гидрированием его в присутствии катализатора гидрирования при температуре 8О-21О°С и давлении 1О,542 ,0 г.гс/см2 в среде инертного opraimnecкого растворителя.
2.Способ по П.1, от л и ч а юШ и йо я тем, что в качестве растворителя в реакции вэлнмоаействйя гексадяенона общей формулы J с алкеном или алкином используют ароматический углеводород.
3.Способ по п. 1, о т л и ч а и йс я тем, что в качестве металлоорганического соединения используют магнийгалоидалкил или алкил щелочного металла.
4.Способ по-п. 1, о т л и ч а ю ш и йс я тем, что в качестве гидрида щелочног-о металла применяют литийалюминийгидрид.
5.Способ по пп. 1 и 4, о т л и ч а ющ и и с я тем, что Б качестве растворите24
ля при обработке кетона общей формулы J металлоорганическим соединением или гидриддом щелочного металла используют линейи. илв циклический простой эфир и процесс ocyvществляют при 4О-1ОО°С.
6.Способ по п. 1, о т л и ч а ю щ и Й4с я тем, что гидрирование проводят при температуре 10О-160°С и давлении 14 28 кгс/см в среде низшего алифатического спирта.
7.Способ по п. 1, о т л и ч а ю ш и ft-i с я тем, что гидролиз осуществляют, в кислой водной среде.
8.Способ по пп, 1 и 6, о т л я м а юШ и и с я -тем, что в качестве каталиаатс ра при гидрировании используют 5%-ный пал ладий на Ялеродном носителе Pd/C .
Источники информации, принятые во внимание при экспертизе:
1 еррвй А, Справочник по opraiDiiecким реакциям, М., Госхнмиздат, 1962. с 119-121.
2. Бюлер К, Пирсон Д. Органические, синтезы, М., -Мир, ч. 1,с. 258-262, 1973.











Реферат

Формула


Комментарии