Дрожжевой штамм для получения биомассы на субстрате, содержащем с5-сахара, и его применение - RU2656138C2
Код документа: RU2656138C2
Чертежи



Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к области получения биомассы, в частности к дрожжевому производству. В частности, изобретение касается получения дрожжей на субстрате, содержащем, по меньшей мере, один C5-сахар, а более, в частности, получения дрожжей на субстрате, полученном гидролизом лигноцеллюлозных материалов. Изобретение также касается применения дрожжей, полученных в приложениях дрожжевой промышленности, таких как хлебопечение, получение биомассы, получение вкусовых веществ, получение вторичных метаболитов, получение бежа, получение РНК, получение этанола, пивоварение или получение дрожжевого экстракта.
Предшествующий уровень техники и решаемая задача
Для размножения дрожжей при аэробном дыхании, дрожжам необходимы:
- соединения углерода в качестве источника углерода и источника энергии,
- восстановленные соединения азота в виде аммония; однако, некоторые дрожжи способны использовать окисленные соединения (такие как нитраты) или органические соединения для синтеза бежов и нуклеиновых кислот,
- различные минеральные элементы и витамины и факторы роста, которые варьируются в зависимости от дрожжей.
Если дрожжи получены на среде с определенной композицией, основанной, например, на глюкозном или фруктозном сиропе в качестве источника углерода, и солях аммония и фосфора в качестве источников азота и фосфата, то культуральную среду следует дополнить минеральными солями, витаминами и микроэлементами, которые делают производство сложным и дорогим.
Патоки, полученные при очистке свекловичного и тростникового сахара, состоят из Сахаров (глюкозы и фруктозы), органических соединений и минеральных соединений. По этой причине эти патоки представляют собой предпочтительные субстраты с экономической и технической точки зрения, и поэтому к настоящему времени они представляют собой главный исходный материал, используемый для промышленного производства дрожжей.
Однако снижающаяся доступность тростниковой и свекловичной патоки, связанная с массовым применением патоки при производстве биоэтанола, ставит под удар данный тип производства. Следовательно, необходимо найти новые субстраты углерода в качестве замены сахарозы, получаемой из патоки.
В настоящее время в промышленном производстве биоэтанола, в частности биоэтанола второго поколения, выявили доступность других источников субстратов для ферментации. Фактически, в промышленном производстве биоэтанола второго поколения используются лигноцеллюлозные материалы, полученные из растений. Эти материалы, которые предоставляет огромное большинство растений, состоят из целлюлозы, гемицеллюлозы и лигнина. После гидролиза лигноцеллюлозные материалы дают смеси C6-сахаров (6 атомов углерода) и C5-сахаров (5 атомов углерода).
Все дрожжи способны метаболизировать C6-сахара; с другой стороны, C5-сахара, как правило, плохо подходят для ферментации или не могут ферментироваться дрожжами рода Saccharomyces, в частности, Saccharomyces cerevisiae (Sc).
Недавние публикации, касающиеся производства биоэтанола второго поколения, описывают дрожжи Sc, которые были модифицированы для получения у них способности к ферментации C5-сахаров. Среди этих документов можно процитировать, например, WO 2011/128552 и WO 2012/72793 за авторством заявителя.
WO 2011/128552 описывает дрожжевой штамм, полученный способом генетической модификации, который включает введение в геном штамма гена, кодирующего ксилозоредуктазу (XR), и гена, кодирующего ксилозодегидрогеназу (XDH).
WO 2012/72793 описывает дрожжевой штамм, полученный способом введения в геном штамма копии экзогенного гена, кодирующего ксилозоизомеразу, причем указанный ген предпочтительно происходит из Clostridium phytofermentans, и, по меньшей мере, одной копии гена, кодирующего ксилитдегидрогеназу, причем указанный ген происходит из Pichia stipitis.
Хотя штаммы, описанные в данных документах, способны размножаться на субстрате, содержащем C5-сахар, авторы настоящего изобретения наблюдали, что скорость размножения на субстрате, состоящем из или содержащем C5-сахар, остается низкой и, в любом случае, несовместима с промышленным производством дрожжей.
Кроме того, авторы изобретения наблюдали, что во время их конечного промышленного применения, например, в качестве дрожжей в хлебопечении, или в качестве дрожжей, предназначенных для производства дрожжевых экстрактов и т.д., дрожжи, полученные таким образом, демонстрировали пониженную эффективность по сравнению с эффективностью дрожжей, полученных из немодифицированных исходных штаммов.
Таким образом, существует реальный запрос на получение новых штаммов для производства дрожжей, которые позволяют полностью или частично заменить C6-сахара в качестве углеродного субстрата, причем выход дрожжей при таком производстве сопоставим с экономической и промышленной эксплуатацией. Кроме того, культивирование таких дрожжей должно приводить к получению дрожжей, обладающих эффективностью в их конечном промышленном применении, что представляет собой большой интерес и в целом является удовлетворительным результатом.
Сущность изобретения
Объект настоящего изобретения относится к новым штамма дрожжей Sc, способным к размножению на субстрате, содержащем, по меньшей мере, один C5-сахар со скоростью и коэффициентом размножения, сопоставимыми с промышленным производством дрожжей.
Объект изобретения также относится к новым штаммам, которые при культивировании делают возможным получение дрожжей, обладающих эффективностью применения, т.е. эффективностью, которая удовлетворительна в их конечном промышленном применении, т.е, равной, по меньшей мере, 80%, предпочтительно, 95% и еще более предпочтительно, 105% эталонной эффективности применения.
Другой объект изобретения представляет собой способ получения дрожжевого штамма согласно изобретению с помощью генетической модификации или гибридизации.
Другой объект изобретения представляет собой применение дрожжей, полученных способом по изобретению, и/или новых дрожжей в промышленном применении, выбранном из хлебопечения, получения биомассы, получения вкусовых веществ, получения вторичных метаболитов, получения белка, получения РНК, получения этанола, пивоварения, виноделия или получения дрожжевого экстракта.
Краткое описание чертежей
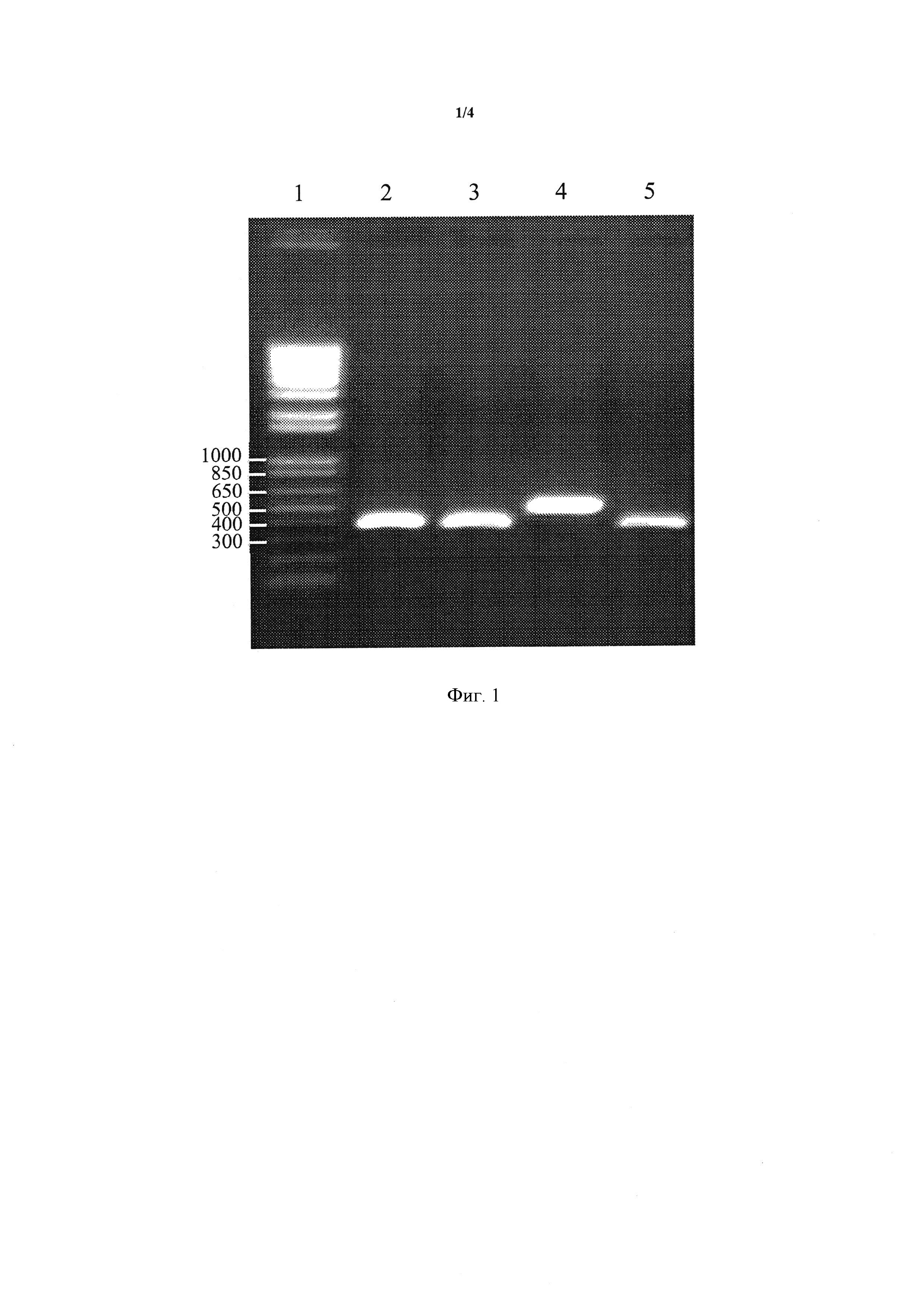
Фигура 1 представляет собой результат ПЦР-анализа Примера 1. Значения, указанные в левой части геля, соответствуют размеру ДНК-фрагментов маркера размеров, и выражены в парах оснований (дорожка 1). Дорожки 2-5 соответствуют X10S1, X10S2, МАТ а Контролю и МАТ альфа Контролю, соответственно.
Фигура 2 представляет собой график, представляющий изменение мутности среды, выраженное в Log 10(ODlambda-600 нм) в виде функции времени культивирования (выражено в часах) при 30°С и при 150 об/мин в среде СР.
Фигура 3 представляет собой график, представляющий мутность среды, выраженную в OD при длине волны 600 нм, в виде функции времени культивирования, выраженном в часах, при 30°С и при 150 об/мин в среде YFX.
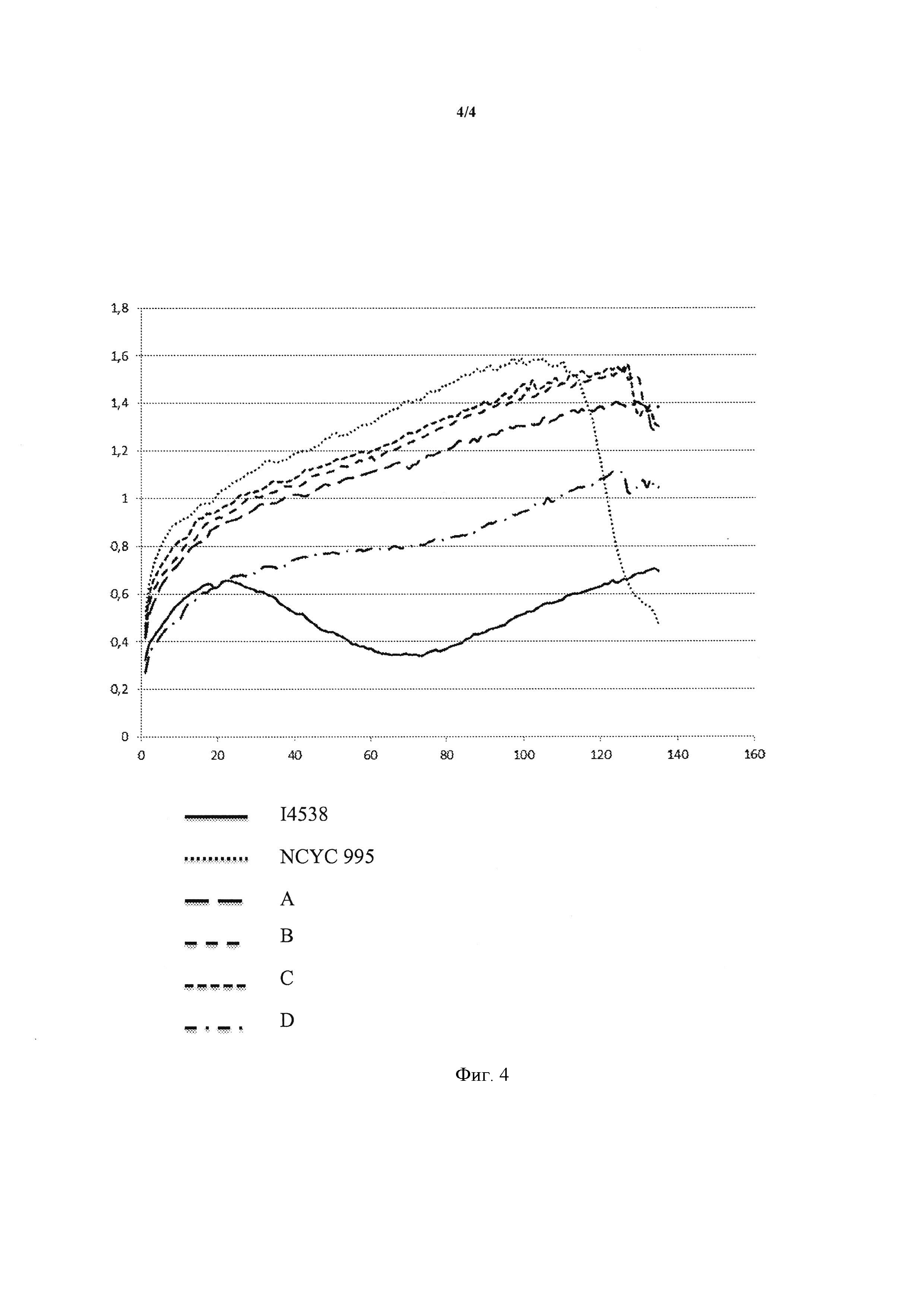
Фигура 4 представляет собой график, демонстрирующий высвобождение газа, выраженное в мл в минуту из обычного теста относительно времени, выраженном в минутах.
Подробное описание изобретения
Настоящее изобретение относится к дрожжевому штамму, способному размножаться в анаэробных условиях на субстрате, содержащем, по меньшей мере, один C5-сахар, отличающийся тем, что штамм удовлетворяет тесту роста на ксилозе или тем, что штамм имеет максимальную скорость размножения, такую что удовлетворяет тесту роста на среде СР.
Тест роста на ксилозе:
Данный тест состоит из мониторинга в течение времени с помощью спектрометрии при длине волны 600 нм изменения мутности раствора, содержащего 50 мл культуральной среды YFX, инокулированной клетками штамма в количестве 108, которые тестируют при 30°С при постоянном перемешивании при 150 об/мин. Тест удовлетворителен, когда оптическая плотность (OD) в момент времени 24 ч выше 2, и, по меньшей мере, равна 3, предпочтительно, по меньшей мере, равна 10 через 48 ч.
Среда YFX определена ниже:

Тест роста на среде CP:
Данный тест состоит из мониторинга в течение времени с помощью спектрофотометрии при длине волны 600 нм изменения мутности раствора, содержащего 50 мл культуральной среды CP, которая содержит 10 г/кг EXL типа J100 (Biospringer) и 10 г/кг бактоферона, а также 100 г/кг сахарозы, где указанная среда инокулирована клетками штамма в количестве 108, тестируемыми при 30°С при постоянном перемешивании со скоростью 150 об/мин. Тести удовлетворителен, если вариация в OD экспоненциальна в интервале между 3,5 и 7,5 часов. Уравнение, которое таким образом характеризует изменение OD, имеет вид ODtf=ODti en(tf-ti), где n находится в интервале 0,35-0,9, предпочтительно, в интервале 0,45-0,8, и наиболее предпочтительно, 0,65-0,75.
Согласно предпочтительному воплощению, штаммы согласно изобретению удовлетворяют как тесту роста на ксилозе, так и тесту роста на среде СР.
Согласно изобретению дрожжевой штамм выбирают из рода Saccharomyces, и предпочтительно, он представляет собой Saccharomyces cerevisiae.
Согласно изобретению, C5-сахар относится к моносахариду, содержащему 5 атомов углерода, или к пентозе. C5-сахар выбирают из группы, состоящей из арабинозы, ксилозы и их смесей. Предпочтительно, C5-сахар представляет собой ксилозу.
Согласно изобретению, субстрат, содержащий, по меньшей мере, один C5-сахар, также содержит, по меньшей мере, один C6-сахар, т.е. моносахарид, содержащий 6 атомов углерода или гексозу. C6-сахар выбирают из группы, содержащей глюкозу, фруктозу, галактозу, маннозу, или C6-сахар получен при деградации дисахарида, такого как сахароза, мальтоза, трегалоза, изомальтоза или их смеси.
Предпочтительно, если субстрат по изобретению включает, по меньшей мере, один C5-сахар и, по меньшей мере, один C6-сахар в соотношении C5/C6 от 0,1 до 2.
Дрожжи, полученные с помощью размножения штаммов согласно изобретению, обладают полезными характеристиками для промышленных применений, таких как хлебопечения, производство биомассы, производство вкусовых веществ, производство вторичных метаболитов, производство белка, производство РНК, производство этанола, пивоварение, виноделие или производство дрожжевого экстракта. Другими словами, дрожжи, полученные культивированием штаммов по изобретению, эффективны в конечном промышленном применении, для которого они предназначены. Эта эффективность относится к «эффективности применения» в настоящей патентной заявке.
Для предполагаемых промышленных применений необходимо, чтобы дрожжи, полученные путем культивирования штаммов по изобретению, не разрушались в процессе сушки, т.е. что менее чем 20% дрожжей инактивируются после сушки.
Согласно конкретному воплощению штаммы по изобретению удовлетворяют следующему тесту сушки:
Биомассу, полученную культивированием, отделяют от среды центрифугированием необязательно с использованием стадий промывки для получения дрожжевой суспензии 18-22% сухого экстракта («дрожжевое молоко»).
Данная суспензия подвергается стадии дегидратации фильтрацией с целью получения пастообразной массы («прессованные дрожжи») 28-34% сухого экстракта.
Данная композиция затем подвергается процессу формирования кусочков типа сосисек (экструзия) для получения кусочков типа сосисек (вермишелеобразных кусочков), имеющих диаметр 0,2-2 мм, которые сушат с помощью потока горячего воздуха в сушилке с псевдоожиженным слоем.
Условия сушки (температурный режим) контролируются неукоснительно так, чтобы температура продуктов всегда составляла менее чем 50°С. Конечные сухие дрожжи, которые представлены в виде вермишелеобразных кусочков, имеют содержание сухого экстракта, по меньшей мере, 95%.
С целью улучшения жизнеспособности клеток сухих дрожжей к дрожжам (суспензионным или прессованным дрожжам) можно добавить добавки с защитным эффектом, такие как эмульгаторы в количестве 0,2-2%/на массу сухого вещества дрожжей, среди которых стандартно используемую добавку представляет собой сорбитан моностеарат (MSS).
Штаммы удовлетворяют тесту, если количество живых дрожжей после сушки равно, по меньшей мере, 80% от количества живых дрожжей до сушки.
Согласно другому воплощению, штамм по изобретению обладает эффективностью применения AE, по меньшей мере, равную 80%, предпочтительно, по меньшей мере, равную 95%, а еще более предпочтительно, по меньшей мере, равную 105% от эталонной эффективности применения. В смысле настоящего изобретения, термин эффективность применения штаммов относится к эффективности дрожжей, полученных культивированием, которая удовлетворяет конечному промышленному применению указанных дрожжей, т.е. эффективности применения AE, по меньшей мере, равное 90% эффективности применения дрожжей, полученных культивированием эталонного штамма для этого применения. Эталонный штамм для данного применения является штаммом, обычно используемым для данного применения. Таким образом, эффективностью применения для штамма, культивируемого для хлебопекарного производства, будет ферментативная сила, и эталонная эффективность применения будет эффективностью штамма, депонированного 12 февраля 2003 года в Collection Nationale des Cultures de Microorganismes [National Collection of Cultures of Microorganisms] (CNCM, Pasteur Institute, 28 rue du Docteur Roux, 75724 Paris cedex 15) как No. I-2970, и будет высвобождать 120 мл CO2 в течение 2 часов из 20 г муки. Способ определения является так называемым ризографическим способом, осуществляемым посредством ферментометра «Burrows and Harris» (Journal of Institute of Brewing, Vol. LXV, No. 1, January-February 25, 1959).
Выработка биомассы проводится с использованием так называемого «аэробного способа с подпиткой» также называемого «культивирование в полунепрерывном режиме» или «полунепрерывное культивирование» или «полунепрерывный режим», который в данном документе относится к культивированию в ферментере (или реакторе), который прогрессивно подпитывается культуральной средой, но из которого объем среды не отводится. В таком способе, культуральный объем в ферментере изменяется (и, как правило, увеличивается), а скорость подпитки может быть постоянной или варьирующей.
Способ «с подпиткой», как правило, проводится в условиях, описанных в справочнике «Дрожжевая Технология», глава 6, 2 издание, 1991 г, G. Reed и Т.W. Nagodawithana, опубликованном VanNostrand Reinhold, ISBN 0-442-31892-8.
Для штамма, культивируемого для получения биомассы, эффективность применения будет выходом производства, а эталонная эффективность применения будет эффективностью штамма, депонированного 26 февраля 1981 года в NCYC (National Collection of Yeast Cultures, Institute of Food Research, Norwich Research Park, Colney, Norwich, United Kingdom, NR4 7UA) как No. 995, и будет составлять 80% выхода относительно использования C6-сахара, или 80 г дрожжей на грамм налитой патоки. Тест будет проводиться измерением количества выработанного сухого вещества.
Для штамма, культивируемого для получения спирта, эффективностью применения будет выход при выработке этанола, и эталонная эффективность применения будет эффективностью штамма, депонированного 4 сентября 2008 года в Collection Nationale des Cultures de Microorganismes (CNCM, Pasteur Institute, 28 rue du Docteur Roux, 75724 Paris cedex 15) как No. I-4071 и будет составлять 0,40 г продуцируемого этанола на г использованного C6-сахара. Количества этанола и C6-сахара измеряются с помощью ВЭЖХ или ферментативных тестов.
Для штамма, культивируемого для получения дрожжевого экстракта, эффективность применения будет определением содержания азота полученного дрожжевого экстракта, а эталонная эффективность применения будет эффективностью дрожжевого экстракта, продаваемого компанией «Bio Springer» под указателем Springer 0203/0-MG-L и будет составлять 10% азота относительно сухого вещества. Анализ азота осуществляется методом анализа сжиганием.
Согласно конкретному воплощению, штамм имеет эффективность применения AE, по меньшей мере, равную 80%, предпочтительно, по меньшей мере, равную 95%, а еще более предпочтительно, по меньшей мере, равную 105% от эталонной эффективности применения, где эффективность применения выбрана из группы, включающей ферментативную силу, выход биомассы, аромат, вторичный метаболит, белок, выработка этанола.
Преимущественно, штамм по изобретению удовлетворяет тесту сушки и имеет эффективность применения AE, по меньшей мере, равную 80% от эталонной эффективности применения.
Изобретение относится к следующим новым штаммам:
- дрожжевой штамм, депонированный 23 августа 2012 года в Collection Nationale des Cultures de Microorganismes (CNCM, Pasteur Institute, 28 rue du Docteur Roux, 75724 Paris cedex 15) как No. I-4670
- дрожжевой штамм, депонированный 23 августа 2012 года в Collection Nationale des Cultures de Microorganismes (CNCM, Pasteur Institute, 28 rue du Docteur Roux, 75724 Paris cedex 15) как No. I-4671.
Эти штаммы представляют собой дрожжевые штаммы для хлебопечения, которые удовлетворяют тесту роста на ксилозе и тесту роста на среде CP, каждый из которых обладает ферментативной силой, по меньшей мере, 100 мл CO2, высвобождаемых в течение 2 часов из 20 г муки, соответственно. Эти штаммы также удовлетворяют тесту сушки.
Другой объект изобретения представляет собой способ получения дрожжевого штамма, как определено выше.
Согласно первому воплощению, способ включает стадию генетической модификации штамма B, имеющего эталонную эффективность применения с тем чтобы, сделать его способным метаболизировать C5-сахар.
Согласно второму воплощению, способ включает скрещивание штамма A, способного метаболизировать C5-сахар, со штаммом B, обладающим эталонной эффективностью применения.
Вне зависимости от воплощения способа по изобретению, указанный способ может включать, по меньшей мере, одну стадию скрининга, позволяющую отобрать штамм, удовлетворяющий, по меньшей мере, одному из тестов, выбранных из числа теста роста на ксилозе, теста роста на среде CP и теста на высушивание, или имеющий эффективность применения AE, по меньшей мере, равную 80%, предпочтительно, по меньшей мере, равную 95% и еще более предпочтительно, по меньшей мере, равную 105% эталонной эффективности применения штамма A.
Стадия скрининга может быть проведена в виде последней стадии способа изобретения.
Согласно изобретению, способность метаболизировать C5-сахар отражена в способности продуцировать в анаэробных условиях этанол из среды, содержащей C6-сахар. Штаммы, способные метаболизировать C5-сахар, представляют собой, как правило, генетически модифицированные штаммы, в которых каждый ген пентозофосфатного пути был дерегулирован, копии гена GRE3, кодирующего альдозоредуктазу, удалены, нативный ген XKS1, кодирующий ксилулокиназу был сверхэкспрессирован, и которые подверглись направленной эволюции.
Согласно форме изобретения, штамм, способный метаболизировать C5-сахар, представляет собой штамм, включающий, по меньшей мере, одну копию гена XR из Pichia stipitis, кодирующий фермент ксилозоредуктазу, и, по меньшей мере, одну копию гена XDH из Pichia stipitis, кодирующего фермент ксилозодегидрогеназу.
Согласно другой форме изобретения, дрожжи, способные метаболизировать C6-сахар, представляют собой штамм дрожжей, содержащий, по меньшей мере, одну копию экзогенного гена, кодирующего ксилозоизомеразу, и, по меньшей мере, одну копию экзогенного гена, кодирующего ксилитдегидрогеназу, предпочтительно происходящую из Pichia stipitis.
Ксилозоизомераза является геном, происходящим из Clostridium, Piromyces, Bacteroides, Streptomyces, Haemophilus, Burkholderia, Enterococcus, Thermotoga, Fusobacterium, Geobacillus, Arthrobacter, Ciona, Physcomitrella, Cellvibrio, Chitinophaga, Saccharopolyspora или Salinibacter, а предпочтительно геном, происходящим из Clostridium phytofermentans или из Piromyces sp.
Кроме того, штаммы, способные метаболизировать C5-сахар, включают следующие модификации:
- по меньшей мере, одну копию, предпочтительно, по меньшей мере, две копии, гена, кодирующего альдозоредуктазу, предпочтительно ген GRE3 удален, и
- эндогенный ген, кодирующий ксилулокиназу, предпочтительно ген XKS1, помещен под контролем промотора гена, нерепрессируемого анаэробиозом или катаболической репрессией, индуцируемой любым источником углерода, и сильно экспрессирующегося в ходе спиртовой ферментации,
- по меньшей мере, один эндогенный ген неокислительной части пентозофосфатного пути, выбранный предпочтительно из RPE1, RKI1, TKL1 и TAL1, а особенно предпочтительно все эти гены, помещенный под контроль промотора гена, нерепрессируемого анаэробиозом или катаболической репрессией, индуцируемой любым источником углерода, и сильно экспрессирующегося в ходе спиртовой ферментации.
Способы для генетических модификаций могут быть одними из тех, что описаны в WO 2011/128552 или в WO 2012/72793.
Согласно первому воплощению, способ для генетической модификации включает введение в геном штамма А, по меньшей мере, одной копии гена Pichia Stipitis, кодирующего ксилозоредуктазу, и, по меньшей мере, одной копии гена Pichia Stipitis, кодирующего ксилозодегидрогеназу.
Способ для генетической модификации может, кроме того, включать введение в геном штамма копии экзогенного гена, кодирующего ксилозоизомеразу, причем указанный ген предпочтительно имеет происхождение из Clostridium phytofermentans, и, по меньшей мере, одной копии гена, кодирующего ксилитдегидрогеназу, причем указанный ген имеет происхождение из Pichia stipitis.
Согласно воплощению способа гибридизации по изобретению, указанный способ включает следующие стадии:
- отбор штамма (А), способного метаболизировать C5-сахар;
- отбор штамма (В), обладающего характеристиками, совместимыми с промышленным применением;
- гибридизация сегрегантов штамма (А) с сегрегантами штамма (В).
Согласно варианту, указанный способ гибридизации по изобретению включает следующие дополнительные стадии:
- отбор штамма (А), способного метаболизировать C5-сахар;
- споруляция штамма (А) с целью получения сегрегата X;
- отбор штамма (В), обладающего характеристиками, совместимыми с промышленным применением;
- споруляция штамма (В) с целью получения сегрегата Y;
- гибридизация X и Y.
Штамм А выбирают из генетически модифицированных штаммов, в которых каждый ген пентозофосфатного пути был дерегулирован, копии гена, кодирующего альдозоредуктазы, удалены, и которые подверглись направленной эволюции.
Согласно форме изобретения, штамм А, способный метаболизировать C5-сахар, представляет собой штамм, включающий, по меньшей мере, одну копию гена XR из Pichia stipitis, кодирующего фермент ксилозоредуктазу, и, по меньшей мере, одну копию гена XDH из Pichia stipitis, кодирующего фермент ксилозодегидрогеназу.
Согласно другой форме изобретения, штамм А, способный метаболизировать C6-сахар, представляет собой штамм дрожжей, содержащий, по меньшей мере, одну копию экзогенного гена, кодирующего ксилозоизомеразу, и, по меньшей мере, одну копию экзогенного гена, кодирующего ксилитдегидрогеназу, предпочтительно происходяющую из Pichia stipitis.
Ксилозоизомераза является геном, происходящим из Clostridium, Piromyces, Bacteroides, Streptomyces, Haemophilus, Burkholderia, Enterococcus, Thermotoga, Fusobacterium, Geobacillus, Arthrobacter, Ciona, Physcomitrella, Cellvibrio, Chitinophaga, Saccharopolyspora или Salinibacter, а предпочтительно геном, происходящим из Clostridium phytofermentans или из Piromyces sp.
Кроме того, штаммы А, способные метаболизировать C5-сахар, содержат следующие модификации:
- по меньшей мере, одна копия, предпочтительно, по меньшей мере, две копии, гена, кодирующего альдозоредуктазу, предпочтительно удален ген GRE3, и
- эндогенный ген, кодирующий ксилулокиназу, предпочтительно ген XKS1, помещен под контролем промотора гена, нерепрессируемого анаэробиозом или катаболической репрессией, индуцируемой любым источником углерода, и сильно экспрессирующегося в ходе спиртовой ферментации,
- по меньшей мере, один эндогенный ген неокислительной части пентозофосфатного пути, выбранный предпочтительно из RPE1, RKI1, TKL1 и TAL1, а особенно предпочтительно все эти гены, помещен под контроль промотора гена, нерепрессируемого анаэробиозом или катаболической репрессией, индуцируемой любым источником углерода, и сильно экспрессирующийся в ходе спиртовой ферментации.
Способы для генетических модификаций могут быть одними из тех, что описаны в WO 2011/128552 или в WO 2012/72793.
Штамм А также может быть выбран способом нацеленного воздействия на штамм. Отбираются только штаммы, удовлетворяющие тесту роста на ксилозе и/или тесту роста на среде CP, как определено выше.
Штамм В также может быть выбран с помощью способа нацеленного воздействия на штамм. Будут отобраны только штаммы, имеющие эффективность применения AE, по меньшей мере, равную 80%, предпочтительно, по меньшей мере, равную 95%, а еще более предпочтительно, по меньшей мере, равную 105% от эталонной эффективности применения.
Когда штамм является штаммом для хлебопечения, отбираемый штамм (В) будет иметь ферментативную силу больше, чем 5 мл⋅2 ч-1⋅г муки-1, предпочтительно, больше, чем 6 мл⋅2 ч-1⋅г муки-1, а еще более предпочтительно, больше чем 8 мл⋅2 ч-1⋅г муки-1.
Способ, в котором используются стадии получения сегрегантов, также может включать стадию скрининга сегреганта X и/или стадию скрининга сегреганта Y. Отбираются только сегреганты X, которые удовлетворяют тесту роста на ксилозе и/или тесту роста на среде CP, как определено выше. Будут отобраны только сегреганты Y, имеющие эффективность применения AE, по меньшей мере, 80%, предпочтительно, по меньшей мере, равную 95%, а еще более предпочтительно, по меньшей мере, равную 105% эталонной эффективности применения.
Предпочтительно, сегрегант X выбирают из штаммов, депонированных в Collection Nationale des Cultures de Microorganismes (CNCM, Institut Pasteur, 28 rue du Docteur Roux, 75724 Paris cedex 15) 23 августа 2013 года как No. I-4672 и I-4673, а сегрегант Y является штаммом, депонированным в Collection Nationale des Cultures de Microorganismes (CNCM, Institut Pasteur, 28 rue du Docteur Roux, 75724 Paris cedex 15) 23 августа 2012 года как No. I-4669.
Другой объект изобретения представляет собой аэробный способ «с подпиткой» для получения дрожжей на субстрате, содержащем, по меньшей мере, один C5-сахар, из штамма, как описано выше. Под аэробным способом «с подпиткой» подразумевается «культивирование в полунепрерывном режиме» или «полунепрерывное культивирование» или «полунепрерывный режим», который в данном документе относится к культивированию в ферментере (или реакторе), который прогрессивно подпитывается культуральной средой, но из которого объем среды не отводится. В таком способе, культуральный объем варьирует (и, как правило, увеличивается) в ферментере, а скорость подпитки может быть постоянной или варьирующей.
Способ «с подпиткой», как правило, проводится в условиях, описанных в справочнике «Дрожжевая Технология», глава 6, 2 издание, 1991 г, G. Reed и Т.W. Nagodawithana, опубликованном VanNostrand Reinhold, ISBN 0-442-31892-8.
Согласно изобретению, скорость размножения, как правило, составляет 1,16. Обычно скорость использования сахаров C5 штаммами изобретения зависит от природы этих штаммов и может достигать в определенных условиях вплоть до 100%. Таким образом, штамм, предназначенный для конечного применения в хлебопечении, может при размножении использовать вплоть до 50% C5-сахаров, включенных в ферментативный субстрат, а штамм, предназначенный для применения при выработке этанола может использовать вплоть до 100% C5-сахаров.
Другой объект изобретения заключается в применении дрожжей, полученных, по меньшей мере, в одном промышленном применении, выбранном из хлебопечения, получения биомассы, получения вкусовых веществ, получения вторичных метаболитов, получения белка, получения РНК, получения этанола, пивоварения, виноделия или получения дрожжевого экстракта.
Следующие примеры иллюстрируют изобретение без ограничения его объема.
ПРИМЕРЫ
Пример 1: Получение сегрегантов X
Для получения сегрегантов штамма CNCM I-4538, этот штамм культивировали в течение 24 часов в среде YPG, содержащей 10 г/кг дрожжевого экстракта (EXL) типа J100, 10 г/кг пептона и 20 г/кг глюкозы. Полученную суспензию клеток затем переносили в чашку Петри, содержащую среду SAA, состоящую из 20 г/кг агарозы и 7,5 г/кг ацетата натрия. После 5 дней инкубации при 30°С, тетрады разделяли с помощью микроманипулятора. Полученные таким образом чашки инкубировали в течение 48 часов при 30°С.
Одно из ограничений применения полученных сегрегантов относится к их половому сигналу. Действительно, во время создания методами молекулярной биологии штаммов, способных ферментировать ксилозу, некоторые гены, существенные для данного пути, были введены в локус, который был генетически связан с МАТ альфа. Этот момент, следовательно, подразумевает, что все сегреганты происходят из штамма, депонированного в Collection Nationale des Cultures de Microorganismes (CNCM, Institut Pasteur, 28 rue du Docteur Roux, 75724 Paris cedex 15) 5 октября 2011 года как CNCM I-4538, и что все сегреганты, способные метаболизировать ксилозу, имеют сигнал МАТ альфа. Для устранения этого ограничения, половой сигнал этих сегрегантов был изменен. Для этой цели мы использовали способ, который существует в природе. Действительно, некоторые дикие дрожжи, когда они находятся в гаплоидном состоянии, способны изменять половой сигнал. Этот процесс происходит под действием HO-рекомбиназы. Последняя не функциональна в штамме, депонированном в CNCM как CNCM 1-4538, и, следовательно, она не работает в данном штамме. Мы ввели реплицирующуюся плазмиду, содержащую ген, кодирующий функциональную HO-рекомбиназу, в представляющие интерес сегреганты. Этот способ основан на исследованиях Herskowitz and Jensen, опубликованных в 1991 году. HO-ген, который несет рассматриваемая плазмида, был помещен под зависимость от промотора, индуцируемого галактозой. Сегреганты трансформированные таким образом, инкубировали в течение 16 часов в среде, содержащей 10 г/кг EXL type J100, 10 г/кг пептона и 20 г/кг галактозы. Клетки затем распределяли по твердой среде, содержащей 10 г/кг EXL type J100, 20 г/кг агарозы и 20 г/кг глюкозы. После получения клонов, изменение в половом сигнале верифицировали путем проведения ПЦР на локусе экспрессии полового сигнала. Реакцию проводили с использованием матрицы геномной ДНК каждого потенциального сегреганта. Олигонуклеотиды представляют собой, с одной стороны, праймер, специфичный к МАТ-локусу, экспрессируемому на хромосоме III дрожжей (праймер МАТ1: AGTCACATCAAGATCGTTTATGG), и два других праймера, один, специфичный к МАТ альфа (праймер Mat2: GCACGGAATATGGGACTACTTCG), а другой специфичный к МАТ а (праймер Mat3: ACTCCACTTCAAGTAAGAGTTTG).
Генотип МАТ дрожжей характеризует наличие ампликона длиной 544 пары оснований, который детектируется на 0,8% агарозном геле.
Полученные результаты представлены на Фигуре 1.
Пример 2: Получение сегрегантов Y и верификация способности сегрегантов передавать высокую ферментативную силу после гибридизации.
Получение сегреганта: сегрегант, депонированный в CNCM как No. I-4669, получали из штамма для хлебопечения, депонированного в CNCM как No. I-2970. Использованный способ получения идентичен способу, описанному в Примере 1.
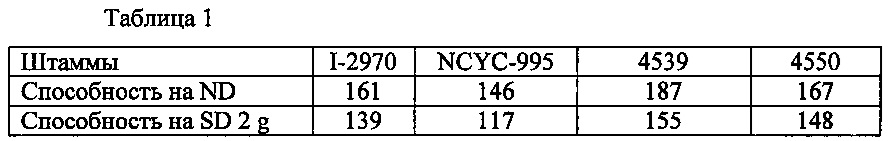
Верификация передачи: гибриды 4539 и 4550 были получены путем гибридизации сегрегантов, происходящих из штаммов для хлебопечения, депонированных в NCYC как No. 955 и в CNCM как No. I-2970.
Ферментативные силы для Нормального Теста (ND) и для Сладкого теста 2 г (SD 2 g) указаны в таблице ниже, в которой показано, что сегрегант I-4669 может передавать высокую ферментативную силу после гибридизации.
Пример 3: Гибридизация
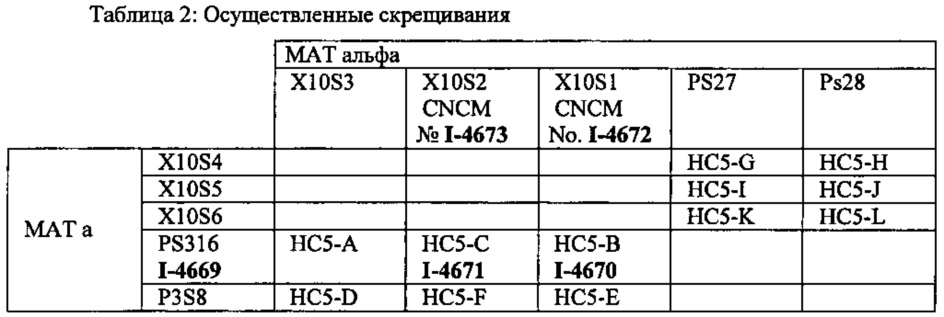
Различные полученные сегреганты скрещивали, как указано в таблице ниже:
Пример 4: Скрининг
Гибридные штаммы, полученные в Примере 3 выше, были подвергнуты следующим различным скринингам:
1/Тест роста на ксилозе
Это первый тест касается способности размножаться с использованием ксилозы в качестве источника углерода.
Для определения способности штаммов размножаться с помощью ксилозы в качестве источника углерода, мы инокулировали их в концентрации 2×106 клеток/мл в 50 мл среды YFX, композиция которой представлена ниже, и поддерживали их при 30°С при перемешивании 150 об/мин.
Изменение биомассы определяли отслеживанием мутности, измеренной с помощью спектрофотометра при длине волны 600 нм. Результаты данного мониторинга представлены на Фигуре 2.
Изменение биомассы на среде YFX позволила нам выбрать 4 штамма. Они представляют собой штаммы HC5-А, HC5-В, HC5-С и HC5-D, которые обладают хорошей способностью использовать ксилозу в качестве источника углерода. Кроме того, эти штаммы способны процессировать ксилозу быстро, так как гибриды HC5-К и HC5-L не были выбраны из-за их задержки в инициации роста на ксилозе.
2/Тест роста на среде CP
Другим важным критерием является максимальная скорость размножения клеток. Для определения этого, дрожжи инокулировали в 50 мл среды CP в концентрации 2×106 клеток на мл. Эта среда является очень богатой, поскольку она содержит 10 г/кг EXL и 10 г/кг бактопептона а также 100 г/кг сахарозы. Изменение в мутности измеряли с помощью спектрофотометрии при 600 нм. Затем анализировали максимальную скорость размножения путем идентификации периода, в ходе которого биомасса растет экспоненциально. На Фигуре 3 показано изменение мутности на логарифмической шкале в виде функции от времени культивирования.
В интервале между 3,5 и 7,5 часами изменение мутности является экспоненциальным, что подтверждено линейным видом нашего графика, в котором используется логарифмическая шкала. Скорость размножения определяется как производное изменения мутности при 600 нм как функция от времени. Так как различные линии оказались параллельными, то это говорит о том, что скорости размножения на этой среде сравнимы со скоростями штамма, депонированного в NCYC с указателем NCYC 995 и штамма, депонированного в CNCM с указателем CNCM I-4538.
3/Тест ферментативной силы после псевдоподпитки
Гибриды HC5-В и HC5-С (штаммы I-4670 и I-4671) размножали с использованием рафинозы в качестве источника углерода. Применение данного трисахарида позволяет постепенно доставлять сахар дрожжам. Действительно, рафиноза медленно гибридизуется инвертазой дрожжей. После стандартизации количеств биомассы различных выработок путем измерения количества сухого дрожжевого материала на единицу объема с помощью устройства SMART System5™ (СЕМ corporation, США), мы анализировали выделение газа с помощью ризографического ферментометра. Измерение изменения выделений газа при тестировании на нормальном тесте, представленное на Фигуре 4, проведено следующим образом:
- Суспензию дрожжей получали следующим образом: количество, эквивалентное 1 г сухого вещества тестируемых дрожжей, суспендировали и доводили вплоть до 100 мл раствором, содержащим 27 г/л NaCl и 4 г/л (NH4)2SO4.
- 15 мл вышеуказанной суспензии (то есть 150 мг сухого вещества дрожжей) уравновешивали при температуре 30°С в течение 15 минут.
- К этой суспензии добавляли 20 г муки, уравновешенной заблаговременно в течение ночи при 30°С. Полученное гомогенизировали в течение 35 секунд.
- Формованное тесто инкубировали в герметично закрытом контейнере, помещенном при температуре 30°С. Выброс газа (выраженный в мл при 760 мм рт.ст.) записывали в течение общего периода 120 минут.
Протокол измерения выброса газа при тестировании в подслащенном тесте (SD) идентичен полученному для ND, за исключением того, что с другими сухими ингредиентами добавлен сахар (здесь 2 г).
Полученные профили демонстрируют, что катаболическая репрессия является высокой в штамме, депонированном в CNCM под указателем CNCM I-4538, который индуцирует важный феномен диауксии, который называется «мальтозным запаздыванием», который дисквалифицирует штамм для применений в хлебопечении. С другой стороны, следует отметить, что гибриды HC5-А, В, С и D, хотя и являются более медленными, чем штамм, депонированный в NCYC под No. NCYC 995, но, по всей видимости, обладают представляющими интерес профилями. Гибриды HC5-В и HC5-С (штаммы I-4670 и 4671) дают наилучшие результаты.
Пример 5
Каждый из штаммов, депонированных под номером No. I-4670 и No. I-4671 подвергали тесту роста на ксилозе, тесту роста на среде CP, и измеряли ферментативную силу штамма.
Полученные результаты представлены в таблице ниже.

Пример 6
Каждый из штаммов, депонированных под номерами No. I-4670 и No. I-4671 размножали в соответствии с аэробным способом с подкормкой в течение 18 часов. Ферментативные силы дрожжей, полученные после сушки, измеряли согласно тестированию с Нормальным Тестом (ND) и согласно тестированию с Подслащенным Тестом 2 г (SD 2g). Полученные результаты воспроизведены ниже:

Реферат
Группа изобретений относится к вариантам дрожжевой клетки рода сахаромицетов, способной к размножению в аэробных условиях на субстрате, содержащем по меньшей мере один C5-сахар, и применению такой клетки. Дрожжевая клетка характеризуется тем, что удовлетворяет тесту роста на ксилозе или тесту роста на среде CP, а также тем, что в ее геноме экспрессия генов RPE1, RKI1, TKL1 и TAL1 пентозного пути помещена под контроль промотора гена, нерепрессируемого анаэробиозом или катаболической репрессией, индуцируемой любым источником углерода, и экспрессирующегося в ходе спиртовой ферментации, копии гена GRE 3, кодирующего альдозоредуктазу, удалены, нативный ген XKS1 сверхэкспрессирован, введена по меньшей мере одна копия гена Pichia stipitis, кодирующего ксилозодегидрогеназу, и введена по меньшей мере одна копия гена, кодирующего ксилозоизомеразу. Предложено также применение указанной дрожжевой клетки для изготовления хлеба. Группа изобретений обеспечивает получение дрожжей, обладающих высокой эффективностью в их конечном промышленном применении. 3 н. и 8 з.п. ф-лы, 4 ил., 5 табл., 6 пр.

Комментарии