Создание уменьшающих уровень аспарагина дрожжей путем адаптивной эволюции и их применение для уменьшения образования акриламида - RU2764014C2
Код документа: RU2764014C2
Чертежи











Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет на основании предварительной патентной заявки США № 62/189547, поданной 7 июля 2015 г., полное содержание которой включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к продуктам и способам для снижения концентрации акриламида в пищевых продуктах, а также к пищевым продуктам, имеющим сниженное содержание акриламида. В частности, изобретение относится к эволюционировавшим штаммам дрожжей, обладающим повышенной способностью к уменьшению уровня аспарагина и, следовательно, акриламида.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Акриламид (AA) является промышленным химическим веществом, используемым для получения полиакриламидных полимеров, которые используют в очистке сточных вод, производстве бумаги, переработке руды, добыче нефти, научных исследованиях и обработке красителями тканей. Хотя он имеет широкую сферу применения, AA является высокотоксичным для биологических систем, о чем свидетельствует множество исследований in vitro, in vivo и на животных моделях (крысах и мышах) (1-6). В совокупности, полученные данные бесспорно указывают на то, что AA - и его активный метаболит глицидамид - являются токсичными химическими веществами с сильным мутагенным, цитотоксическим и нейротоксическим потенциалом.
Вследствие его токсичности, продемонстрированной в биологических системах, кроме человека, AA был классифицирован Международным агентством по изучению рака Всемирной организации здравоохранения (ВОЗ-МАИР) в 1994 как канцерогенное соединение группы 2A - к этой группе относят соединения, которые «вероятно являются канцерогенными для человека» на основании «достаточного доказательства канцерогенности у экспериментальных животных и убедительного доказательства того, что канцерогенез опосредован механизмом, также действующим в организме человека».
В 2002 г. было показано, что AA присутствует во многих обычных пищевых продуктах, употребляемых людьми, в результате реакций потемнения Майяра, которые имеют место при тепловой обработке продуктов (7-9). Более конкретно, AA быстро образуется, когда аминокислота аспарагин реагирует с восстанавливающими сахарами в крахмалосодержащих пищевых продуктах или пищевых продуктах, которые были подвергнуты воздействию температур, равных или превышающих 120°C (например, при глубокой обжарке, запекании, жарении и так далее). Таким образом, AA присутствует в значительных количествах в самых разных пищевых продуктах, включая хлеб (муку из разных видов зерна), картофель, продукты из картофеля (картофель фри, картофельные чипсы, картофельные хлопья и муку), кофе, крупы, овощи и так далее (10-19).
Вследствие его широкой распространенности в пищевых продуктах AA в диете людей присутствует повсеместно. Однако в настоящее время в научных кругах нет общего мнения относительно прямой роли пищевого АА в возникновении раковых заболеваний человека. Хотя до настоящего времени было проведено более 30 эпидемиологических исследований (20), во многих из этих исследований были сделаны противоречивые или неясные выводы, свидетельствующие лишь в пользу корреляционной связи между высоким содержанием в пищевых продуктах АА и различными видами рака, в частности, раком почки, эндометрия и яичников (20).
Несмотря на отсутствие в научных кругах консенсуса о роли пищевого AA в развитии рака, правительства и регулирующие органы многих стран мира сделали важным приоритетом оценку риска и меры по уменьшению воздействия пищевого AA. Действительно, Европейское ведомство по безопасности пищевых продуктов (EFSA), ВОЗ, Управление по контролю за качеством пищевых продуктов и лекарств США (FDA), Калифорнийский Отдел по оценке влияния вредных факторов окружающей среды на здоровье (OEHHA) и Министерство здравоохранения Канады считают присутствие AA в пищевых продуктах серьезной проблемой и рекомендуют снижение уровней AA в пищевых продуктах и напитках до разумно достижимого низкого уровня (ALARA). Кроме того, и EFSA (Acrylamide Toolbox-http://www.fooddrinkeurope.eu/publications/category/toolkits/), и FDA США (http://www.fda.gov/Food/FoodborneIllnessContaminants/ChemicalContaminants/ucm2006782.htm) опубликовали отраслевые руководящие документы по сокращению содержания АА в пищевых продуктах и напитках.
Известные в настоящее время способы уменьшения содержания AA основаны на двух основных принципах: 1) уменьшение образования AA за счет условий обработки пищевых продуктов (ограничение продолжительности и температуры тепловой обработки) и 2) удаление аспарагина, являющегося предшественником AA. Важно отметить, что лишь вторая стратегия потенциально обеспечивает уменьшение уровня AA в пищевых продуктах, поскольку AA может образовываться в процессе приготовления пищи конечными пользователями. Как в коммерчески произведенных продуктах, так и пище, приготовленной в домашних условиях, содержание АА значительно возрастает при увеличении времени и температуры приготовления пищи (21). Таким образом, способы уменьшения содержания AA, основанные на удалении аспарагина, считаются более эффективными, поскольку они устраняют потенциал для последующего образования AA.
В настоящее время доступно множество способов уменьшения содержания AA в пищевых продуктах. К ним относится использование препаратов фермента аспарагиназы (Acrylaway®, Novozymes, Denmark и PreventASe, DSM, Netherlands) (http://www.acrylaway.com/en/Pages/default.aspx; http://www.dsm.com/markets/foodandbeverages/en_US/products/enzymes/baking/preventase.html), экстенсивная дрожжевая ферментация (22), добавление глицина в тесто перед ферментацией (23, 24), замачивание картофеля в растворе хлорида кальция перед обжариванием (25), замена восстанавливающих сахаров сахарозой (26), общая оптимизация условий обработки, таких как температура, pH и содержание воды (25, 27, 28), исследования, относящиеся к выбору разных сырых материалов (27), и ферментация молочнокислыми бактериями (Zerabac и Zeracid, Zeracryl, Norway; http://www.zeracryl.com/). Кроме того, недавно был описан сорт картофеля с низким содержанием аспарагина (29-31), однако он был создан при помощи технологии рекомбинантной ДНК и, следовательно, считается генетически модифицированным организмом) (ГМО) (http://www.simplotplantsciences.com/). Все эти описанные подходы являются в какой-то степени неадекватными или имеют существенные недостатки, которые делают их непрактичными при производстве пищевых продуктов с точки зрения стоимости, влияния на органолептические свойства пищи и/или неэффективного уменьшения содержания акриламида в условиях промышленной обработки пищевых продуктов.
Пекарские дрожжи (Saccharomyces cerevisiae) естественным образом способны поглощать/разрушать предшественники AA, аспарагин и восстанавливающие сахара. Однако в большинстве условий, обычных для пищевой промышленности, клеточный аппарат, необходимый для разрушения аспарагина, отключается. Таким образом, если не использовать их в конкретных условиях и временных рамках, обычные штаммы дрожжей неэффективны для уменьшения уровней AA. Чтобы обойти эту проблему, авторы настоящего изобретения ранее разработали новую технологию на основе генетически модифицированных (ГМО) пекарских дрожжей для уменьшения уровней акриламида в пищевых продуктах (US 2012/0321744 A1). Данная технология основана на определенном штамме S. cerevisiae, сконструированном методами рекомбинантной ДНК, который способен к разрушению аспарагина и, следовательно, акриламида. Хотя дрожжевой штамм, описанный в публикации патента США № 2012/0321744 A1, эффективен для уменьшения уровней акриламида в самых разных пищевых продуктах, из-за использования технологии рекомбинантной ДНК при его разработке этот штамм классифицируют как самоклонированный генетически модифицированный организм (ГМО). Отнесение его к данной категории по сути ограничивает его применение в отраслях промышленности и странах, где ГМО продукты воспринимаются негативно и/или законодательно запрещены.
В S. cerevisiae генами, ответственными за разрушение аспарагина, являются ASP1 и ASP3, которые кодируют внутриклеточную аспарагиназу I и внеклеточную связанную с клеточной стенкой аспарагиназу II, соответственно (32-34). ASP1 существует в виде однокопийного гена (35), в то время как ASP3 существует в виде локуса из четырех тандемных повторов (36). Интересно, что локус ASP3 не является изначально присущим S. cerevisiae, а был приобретен в процессе эволюции путем горизонтального переноса гена из вида дрожжей, иного чем Saccharomyces (Wickerhamomyces) (34).
Хорошо известно, что ASP1 экспрессируется конститутивно, но отвечает, главным образом, за внутриклеточную утилизацию аспарагина, а не внеклеточную утилизацию аспарагина ради азота (32, 33). Следовательно, активности только ASP1 недостаточно для разрушения дрожжами достаточного количества аспарагина для уменьшения уровней AA в пищевых продуктах. Для разрушения внеклеточного аспарагина дрожжи должны экспрессировать аспарагиназу II, однако ASP3 подвержен действию механизмов, избирательно контролирующих утилизацию азота у дрожжей, более известных как азотная катаболитная репрессия (АКР) (37-41). В общих чертах, АКР означает молекулярные механизмы, состоящие из воспринимающих систем и транскрипционных регуляторных цепей, которые обеспечивают дифференциальную экспрессию генов пермеаз и катаболических ферментов, необходимых для разрушения источников азота. Более конкретно, если культуры растут на среде с несколькими источниками азота, АКР позволяет дрожжам последовательно катаболизировать разные источники азота на основании их относительной биохимической иерархии утилизации (32, 42). В контексте ASP3 известно, что, как и в случае с другими АКР-регулируемыми генами, экспрессия фермента может быть индуцирована во время роста на среде, бедной азотом или с дефицитом азота, независимо от типа источника азота при условии, что внутриклеточные пулы аминокислот истощены до субпорогового уровня (36, 37, 39, 40).
Случайный мутагенез и адаптивная эволюция означают последовательную или итерационную адаптацию организма к новым условиям роста и/или окружающей среды. Для осуществления этого в организм вносят случайные мутации, с последующей характеризацией большого набора вариантов и выбором вариантов с желательными свойствами. Таким образом используют искусственную селекцию для идентификации желательной генетической вариабельности, ускоренной за счет мутагенеза (43). Данную методику обычно используют в микробиологии для придания или усиления желательных свойств у промышленно значимых микроорганизмов и она, в частности, имеет долгую историю использования в пищевой промышленности (43-56). Важно отметить, что адаптивная эволюция не включает использование технологии рекомбинантной ДНК; таким образом, организмы, созданные путем адаптивной эволюции, не являются ГМО (http://ec.europa.eu/food/plant/gmo/new/index_en.htm) и, следовательно, не подлежат законодательному ограничению использования ГМО в пищевых продуктах и не имеют проблем с их употреблением пользователями.
В силу своей природы адаптивная эволюция всегда приводит к оптимальному способу выполнения задачи (52). В больших популяциях и на протяжении многих поколений случайные мутации позволяют эволюции «испробовать» каждое возможное решение проблемы. Лишь те решения, которые приводят к лучшей приспособляемости, или как минимум не являются явно губительными, будут передаваться следующему поколению (52). Эта концепция приобретает особую важность, если учесть, что адаптация к нишевым условиям, как правило, сопровождается худшей приспособляемостью за пределами этих условий (52). Следовательно, адаптивная эволюция позволяет организмам достигать равновесия в их приспособляемости к условиям окружения. Это равновесие достигается за счет причинных мутаций, необходимых для соответствующей адаптации, а также компенсаторных мутаций, которые максимально противодействуют генерализованной потере приспособляемости. В этом отношении адаптивно эволюционировавшие механизмы часто могут превосходить результаты направленных и специфических способов воздействия, таких как генная инженерия с использованием рекомбинантной ДНК.
Подобно другим микроорганизмам, пекарские дрожжи в высокой степени подвержены случайному мутагенезу и адаптивной эволюции. Действительно, этот метод широко использовался для модификации признаков, важных для промышленных процессов, таких как производство вин и биоэтанола (56). Адаптивную эволюцию также использовали для изучения адаптивного ответа на ограничение источников азота в среде (57, 58) и, более конкретно, для изменения способности дрожжей к использованию азота (нарушения регуляции АКР) для очистки сточных вод (59). Кроме того, случайный мутагенез и однократную селекцию использовали для выделения мутантов лабораторных дрожжей с дерепрессированным геном ASP3 для изучения механизмов АКР-опосредованной регуляции ASP3 (60).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения показали, что с использованием конкретного способа итерационной адаптивной эволюции может быть выделен новый дрожжевой штамм, обладающий уменьшающей уровень аспарагина активностью в не индуцирующих условиях.
Соответственно, изобретение относится к способу выделения дрожжевого штамма, разрушающего L-аспарагин в не индуцирующих условиях, включающему:
a) субкультивирование дрожжевого штамма дикого типа, который экспрессирует, или способен экспрессировать, связанную с клеточной стенкой аспарагиназу в присутствии среды, содержащей D-аспарагин в виде единственного источника азота;
b) постоянное субкультивирование, отслеживание скорости роста и еженедельное осуществление мутагенеза;
c) отбор культур по пункту b), когда скорость роста достигает исходного уровня;
d) постоянное субкультивирование выбранных клеток в селективной среде, содержащей метиламин, отслеживание скорости роста и еженедельное осуществление мутагенеза до того момента, когда скорость роста в присутствии метиламина достигнет скорости роста в селективной среде без метиламина;
e) выделение отдельных колоний по пункту d) путем высевания на селективную среду, содержащую метиламин, выращивание указанных колоний и отбор крупных и быстро растущих колоний;
f) анализ выбранных колоний по пункту e) на способность разрушать L-аспарагин в не индуцирующих условиях и отбор по меньшей мере одной колонии с высокой разрушающей L-аспарагин активностью по сравнению с клетками в начале этапа d);
g) повторение этапов d) - f) с выбранными клетками на этапе f), с увеличением каждый раз концентрации метиламина, до того момента, когда разрушающая L-аспарагин активность достигнет плато;
h) выделение штамма из этапа g), в котором разрушающая L-аспарагин активность достигла плато.
В одном варианте осуществления связанная с клеточной стенкой аспарагиназа закодирована локусом ASP3.
В одном варианте осуществления дрожжевой штамм дикого типа представляет собой производственный дрожжевой штамм. В одном из вариантов осуществления дрожжевой штамм представляет собой производственный штамм пекарских дрожжей.
Дрожжевые штаммы могут относиться, без ограничения, к родам и видам царства грибов. В одном варианте осуществления роды и виды можно выбирать из тех, которые используют в пищевой промышленности. В другом варианте осуществления виды включают, без ограничения, Aspergillus acidus, Aspergillus niger, Aspergillus oryzae, Aspergillus sojae, Candida etchellsii, Candida milleri, Candida oleophila, Candida rugosa, Candida tropicalis, Candida versatilis, Candida zemplinina, Candida zeylanoides, Cyberlindnera jadinii, Cyberlindnera mrakii, Cystofilobasidium infirmominiatum, Debaryomyces hansenii, Dekkera bruxellensis, Fusarium domesticum, Fusarium venenatum, Galactomyces candidum, Geotrichum candidum, Guehomyces pullulans, Hanseniaspora guilliermondii, Hanseniaspora osmophila, Hanseniaspora uvarum, Kazachstania exigua, Kazachstania unispora, Kluyveromyces lactis, Kluyveromyces marxianus, Lachancea fermentati, Lachancea thermotolerans, Lecanicillium lecanii, Metschnikowia pulcherrima, Mucor hiemalis, Mucor mucedo, Mucor plumbeus, Mucor racemosus, Neurospora sitophila, Penicillium camemberti, Penicillium caseifulvum, Penicillium chrysogenum, Penicillium commune, Penicillium nalgiovense, Penicillium roqueforti, Penicillium solitum, Pichia fermentans, Pichia kluyveri, Pichia kudriavzevii, Pichia membranifaciens, Pichia occidentalis, Pichia pijperi, Rhizopus microspores, Rhizopus oligosporus, Rhizopus oryzae, Rhizopus stolonifer, Saccharomyces bayanus, Saccharomyces cerevisiae, Schizosaccharomyces pombe, Schwanniomyces vanrijiae, Scopulariopsis flava, Starmerella bombicola, Torulaspora delbrueckii, Torulopsis candida, Torulopsis holmii, Trigonopsis cantarellii, Wickerhamomyces anomalus, Yarrowia lipolytica, Zygosaccharomyces rouxii, Zygotorulaspora florentina. Существуют различные коммерческие источники дрожжевых штаммов, такие как Lallemand Inc. (Канада), AB Mauri (Австралия) и Lesaffre (Франция).
В одном варианте осуществления мутагенез представляет собой физический мутагенез, такой как УФ-мутагенез. В другом варианте осуществления мутагенез представляет собой химический мутагенез.
В одном из вариантов осуществления этапы a) - c) происходят в течение 2-4 недель. В одном из вариантов осуществления этапы d) - g) происходят в течение 6-48 недель.
В одном варианте осуществления число повторений на этапе g) составляет 5-20.
В другом варианте осуществления колонии выращивают в течение 2-10 дней на этапе e) перед отбором крупных и быстро растущих колоний.
В одном варианте осуществления на этапе g) количество метиламина повышают постепенно, например, на 25-50% при каждом повторении. В одном из вариантов осуществления количество метиламина на этапе e) представляет собой количество, достаточное для снижения скорости роста на 25-75% по сравнению со скоростью роста в селективной среде без метиламина. В другом варианте осуществления концентрацию метиламина можно увеличивать от 0,05 г/л до 12 г/л прежде, чем разрушающая L-аспарагин активность достигнет плато.
По настоящему изобретению также предложены дрожжи, полученные способом, раскрытым в настоящем документе. Кроме того, предложены выделенные не генетически модифицированные дрожжи, экспрессирующие аспарагиназу клеточной стенки и обладающие уменьшающей содержание аспарагина активностью в не индуцирующих условиях. В одном варианте осуществления выделенные не генетически модифицированные дрожжи уменьшают содержание аспарагина на по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, или более, при выращивании в не индуцирующих условиях. В одном из вариантов осуществления аспарагиназа клеточной стенки экспрессируется конститутивно. В одном из вариантов осуществления аспарагиназа клеточной стенки закодирована локусом ASP3. В одном варианте осуществления дрожжевой штамм представляет собой производственный дрожжевой штамм. В одном из вариантов осуществления дрожжевой штамм представляет собой производственный штамм пекарских дрожжей.
Также предложен выделенный дрожжевой штамм, депонированный в международном депозитарии Канады (IDAC) под регистрационными номерами 140515-01 («RBAR-01»), 140515-02 («RBAR-02») и/или 140515-03 («RBAR-03»).
Авторы настоящего изобретения также показали, что дрожжевые штаммы, раскрытые в настоящем документе, особенно полезны для уменьшения содержания аспарагина и, следовательно, уменьшения образования акриламида в процессе приготовления и обработки пищевых продуктов. Соответственно, по настоящему изобретению также предложен способ уменьшения содержания аспарагина и, следовательно, образования акриламида в процессе приготовления и обработки пищевых продуктов, включающий добавление дрожжевого штамма, раскрытого в настоящем документе, к пищевому продукту при приготовлении и обработке пищевого продукта; при этом дрожжи уменьшают содержание аспарагина и, следовательно, образование акриламида в процессе приготовления и обработки пищевого продукта.
В одном из вариантов осуществления дрожжевой штамм является неактивным. В другом варианте осуществления дрожжи являются свежими. В другом варианте осуществления дрожжи представляют собой активные сухие дрожжи.
Пищевой продукт может быть любым пищевым продуктом, который обычно содержит аспарагин, и включает, без ограничения, овощные пищевые продукты, напитки, хлебобулочные продукты, зерновые продукты, фрукты, бобы, молочные продукты или мясные продукты. В одном из вариантов осуществления пищевой продукт представляет собой хлебобулочный продукт, такой как хлеб, печенье или крендель. В одном варианте осуществления пищевой продукт представляет собой картофель или продукт из картофеля. В другом варианте осуществления пищевой продукт представляет собой кофе.
В одном варианте осуществления пищевой продукт представляет собой картофель или продукт из картофеля, и добавление дрожжей к пищевому продукту при приготовлении или обработке пищевого продукта включает предварительное замачивание картофеля или продукта из картофеля в смеси воды и дрожжевого штамма перед тепловой обработкой.
В другом варианте осуществления пищевой продукт представляет собой легкую закуску из картофеля, и добавление дрожжей к пищевому продукту при приготовлении или обработке пищевого продукта включает добавление дрожжей в картофельную тестообразную смесь перед формованием, экструдированием или иным процессом создания прессованного продукта, который будет подвергнут тепловой обработке посредством запекания, глубокой обжарки или жарения.
В другом варианте осуществления пищевой продукт представляет собой кофе, и добавление дрожжевого штамма к пищевому продукту при приготовлении или обработке пищевого продукта включает замачивание свежих зеленых кофейных бобов в экстракте зеленых кофейных бобов, который был предварительно обработан дрожжевым штаммом для уменьшения содержания аспарагина, при этом предварительно обработанный экстракт удаляет аспарагин из кофейных бобов перед обжариванием.
В другом варианте осуществления пищевой продукт представляет собой кофе, и добавление дрожжевого штамма к пищевому продукту при приготовлении или обработке пищевого продукта включает ферментацию измельченных зеленых кофейных бобов дрожжевым штаммом перед обжариванием.
По настоящему изобретению также предложен пищевой продукт с пониженным содержанием аспарагина, полученный с использованием дрожжевого штамма, раскрытого в настоящем документе, или способа, раскрытого в настоящем документе.
Другие особенности и преимущества настоящего изобретения станут очевидными из следующего далее подробного описания. Следует понимать, однако, что подробное описание и конкретные примеры, хотя и представляют варианты осуществления изобретения, приведены лишь в качестве иллюстрации, поскольку различные изменения и модификации в пределах сущности и объема настоящего изобретения будут очевидны для специалистов в данной области из данного подробного описания.
Краткое описание ЧЕРТЕЖЕЙ
Далее изобретение описано с помощью чертежей, в которых:
Фигура 1 представляет собой схематическое изображение стратегии адаптивной эволюции, использованной для создания AR (уменьшающих содержание акриламида) дрожжевых штаммов, раскрытых в настоящем документе.
Фигура 2 показывает, что AR дрожжевые штаммы разрушают L-аспарагин даже при выращивании в богатой среде. Штамм дикого типа, AR штаммы (RBAR-01, RBAR-02 и RBAR-03), а также контрольный ГМО штамм, сконструированный для избыточной экспрессии ASP3, выращивали в среде YEG в течение ночи (18 часов при 30°C), с последующей инокуляцией 2×107 клеток в 5 мл свежей среды YEG с добавлением 0,6 г/л L-аспарагина. Клетки инкубировали в среде YEG+L-аспарагин в течение разных периодов времени, с последующей тепловой инактивацией при 80°C. Остаточную концентрацию L-аспарагина в каждом образце измеряли при помощи набора для колориметрического ферментативного анализа. Данные являются репрезентативными для дважды повторенных экспериментов.
Фигура 3 показывает, что итерационная адаптивная эволюция необходима для создания AR дрожжевых штаммов. Штамм дикого типа, а также AR штаммы (RBAR-01, RBAR-02 и RBAR-03) высевали на неселективную среду (YEG+D-аспарагин), умеренно селективную среду, используемую Kamerud и Roon (YEG+D-аспарагин+3,1 г/л метиламина) и высокоселективную среду, используемую в данном исследовании (YEG+D-аспарагин+12 г/л метиламина). Одинаковые количества клеток каждого штамма высевали в 10-кратных серийных разведениях. Чашки инкубировали при 30°C в течение четырех дней. Данные являются репрезентативными для трижды повторенных экспериментов.
Фигура 4 показывает, что AR дрожжевые штаммы эволюционировали из их родительского штамма дикого типа. Использовали ПЦР-фингерпринтинг областей интер-дельта для сравнения наследуемых черт AR дрожжевых штаммов с их родительским штаммом дикого типа. Геномную ДНК экстрагировали из ночных культур каждого из штаммов и использовали в качестве матрицы для ПЦР областей интер-дельта, как описано ранее (61). Ампликоны визуализировали методом электрофореза в агарозном геле. Данные являются репрезентативными для дважды повторенных экспериментов.
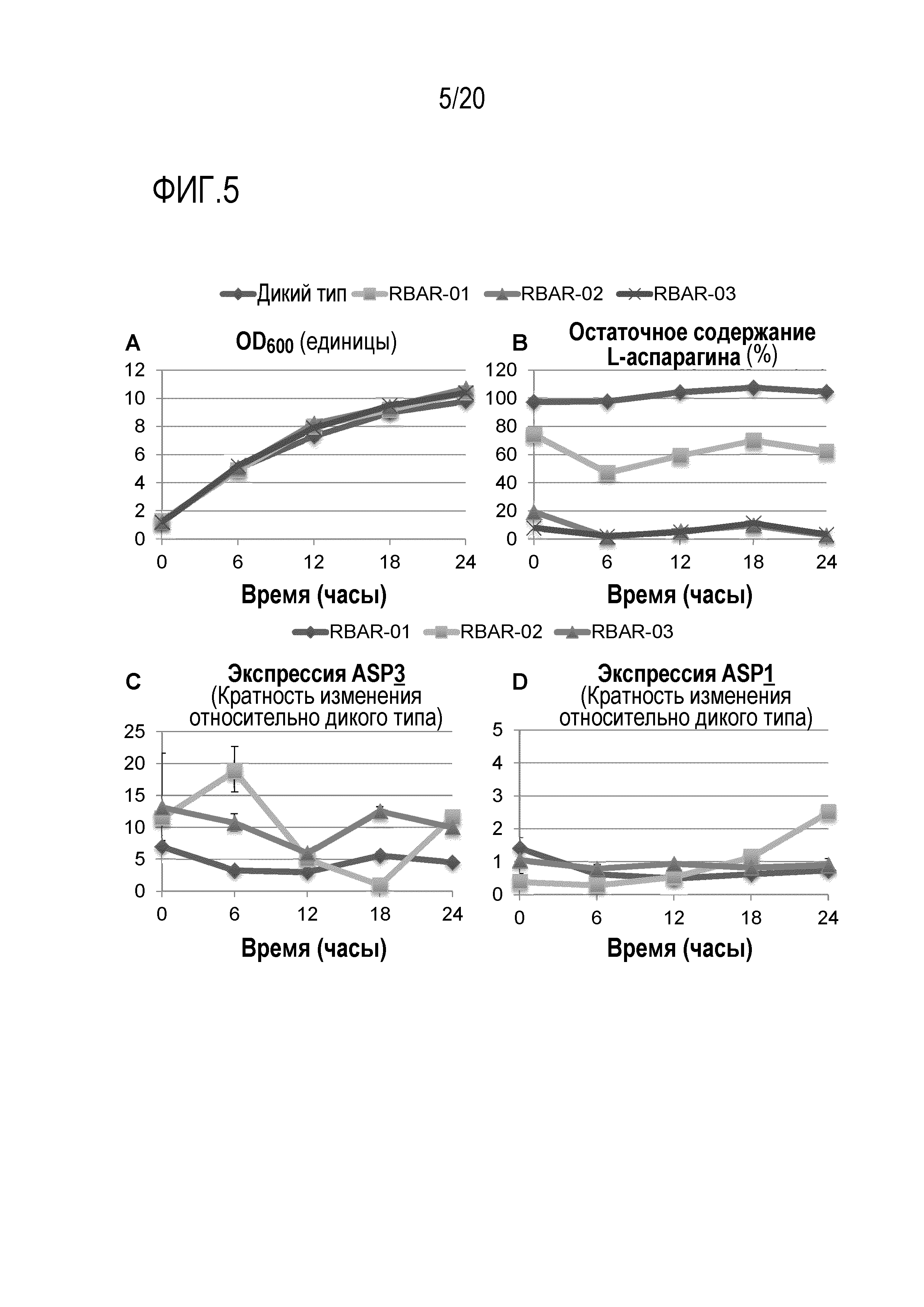
Фигура 5 показывает, что AR дрожжевые штаммы конститутивно разрушают L-аспарагин и конститутивно экспрессируют связанную с клеточной стенкой аспарагиназу II (ASP3). Из AR дрожжевых штаммов (RBAR-01, RBAR-02 и RBAR-03), а также их родительского штамма дикого типа отбирали образцы каждые шесть часов в процессе их роста в среде YEG. Данные являются репрезентативными для дважды повторенных экспериментов. A) Скорость роста каждого штамма отслеживали путем измерения OD600. B) Разрушающую L-аспарагин активность каждого штамма количественно определяли с использованием стандартизированного анализа разрушения L-аспарагина (время инкубации в анализе 1 час). C) Относительную экспрессию ASP3 для каждого штамма измеряли в техническом тройном повторе методом кПЦР кДНК, обратно транскрибированной с выделенной суммарной РНК. Значения кратности изменения ASP3 рассчитывали с использованием метода ΔΔCt и нормировали к ACT1 и ASP3 дикого типа. D) Относительную экспрессию ASP1 для каждого штамма измеряли в техническом тройном повторе методом кПЦР кДНК, обратно транскрибированной с выделенной суммарной РНК. Значения кратности изменения ASP1 рассчитывали с использованием метода ΔΔCt и нормировали к ACT1 и ASP1 дикого типа.
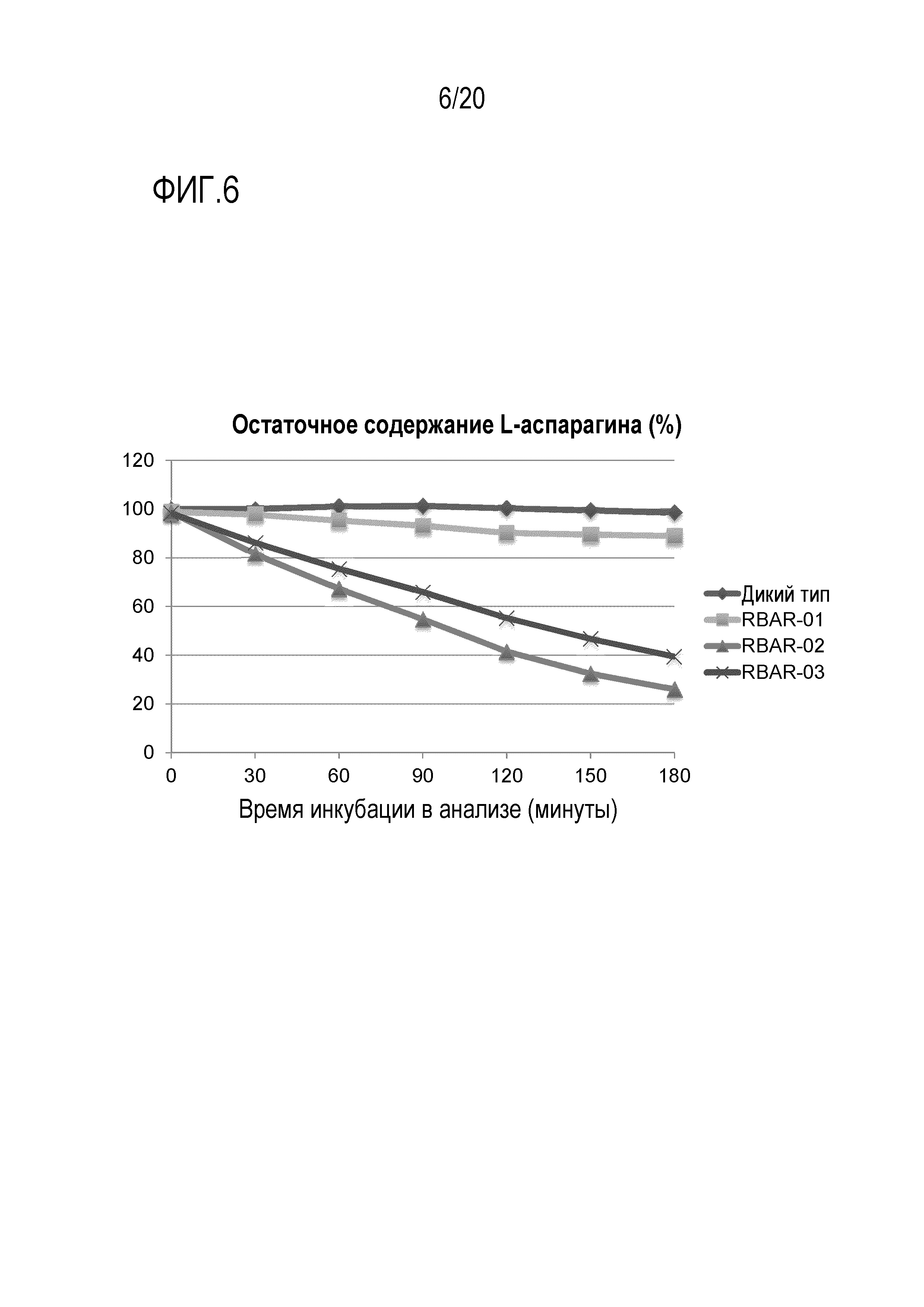
Фигура 6 показывает, что кинетика разрушения L-аспарагина отличается у разных AR дрожжевых штаммов. Штамм дикого типа, а также AR штаммы (RBAR-01, RBAR-02 и RBAR-03) выращивали в среде YEG в течение ночи (18 часов при 30°C), с последующей инокуляцией 2×107 клеток в 5 мл свежей среды YEG с добавлением 0,6 г/л L-аспарагина. Клетки инкубировали в среде YEG+L-аспарагин в течение разных периодов времени, с последующей тепловой инактивацией при 80°C. Остаточную концентрацию L-аспарагина в каждом образце измеряли при помощи набора для колориметрического ферментативного анализа. Данные являются репрезентативными для дважды повторенных экспериментов.
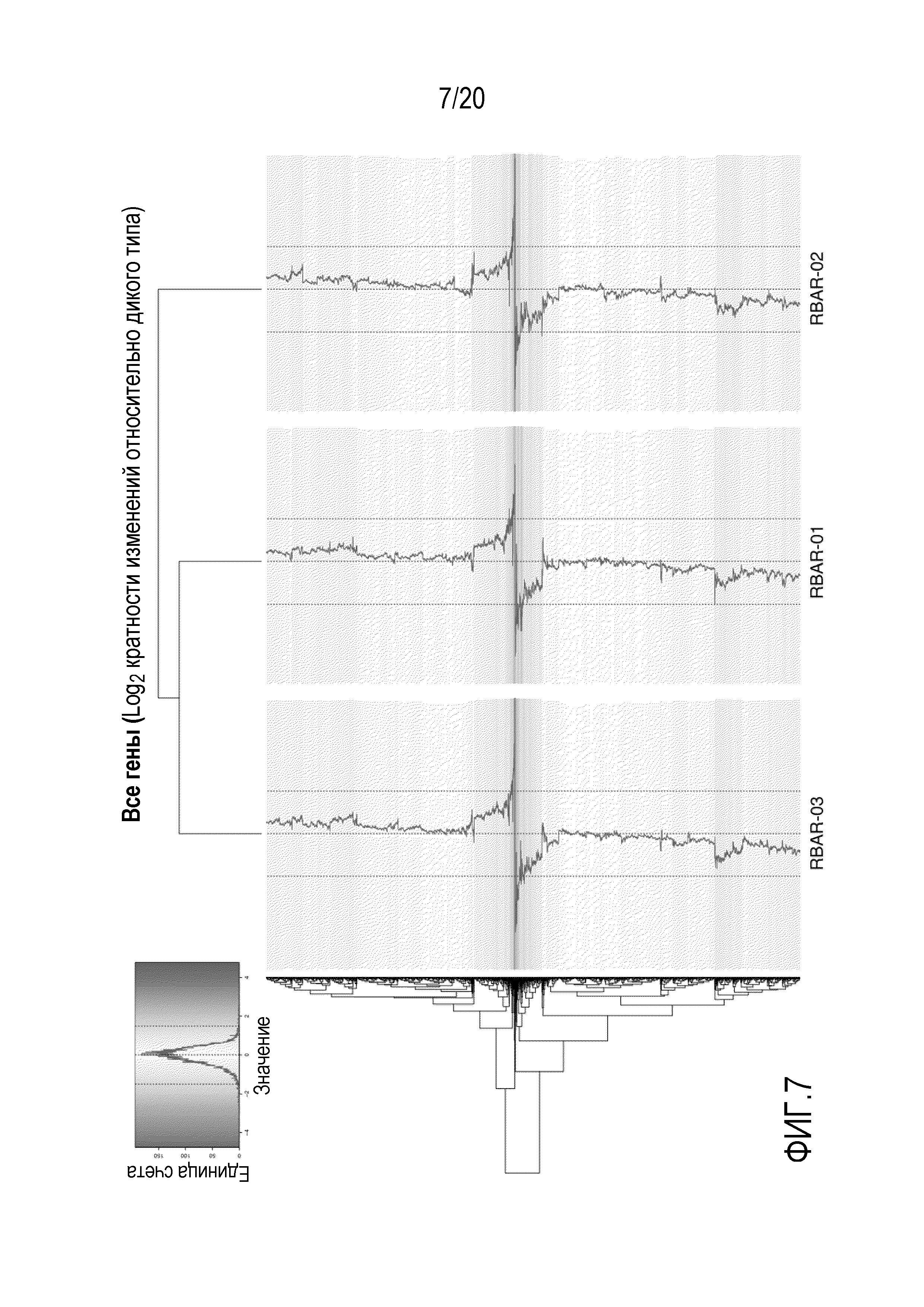
Фигура 7 показывает, что минимальное число генов дифференцированно экспрессируются во всех AR дрожжевых штаммах. Суммарную РНК получали из штамма дикого типа и AR дрожжевых штаммов (RBAR-01, RBAR-02 и RBAR-03) во время экспоненциального роста в среде YEG. Библиотеки РНК для секвенирования (TruSeq v3), полученные из суммарной РНК, были секвенированы на платформе Illumina HiSeq2500 с высокой пропускной способностью в конфигурации парных прочтений с длиной прочтения 2×100 п.н. Первичные прочтения фильтровали в отношении качества и картировали на эталонный геном S288C. Значения log2 кратности изменений (относительно дикого типа) приведены для каждой из 6604 дрожжевых ОРС (проверенных, не охарактеризованных и сомнительных). Пунктирные линии проведены на уровнях +1,5, 0 и -1,5 для справки. Вычерченная линия в каждом ряду соответствует фактическому значению кратности изменения для каждого гена. Иерархическую кластеризацию использовали для группировки как кластеров генов, так и штаммов.
Фигура 8 показывает, что множество дифференциально экспрессированных генов являются общими для всех AR дрожжевых штаммов. Суммарную РНК получали из штамма дикого типа и AR дрожжевых штаммов (RBAR-01, RBAR-02 и RBAR-03) во время экспоненциального роста в среде YEG. Библиотеки РНК для секвенирования (TruSeq v3), полученные из суммарной РНК, были секвенированы на платформе Illumina HiSeq2500 с высокой пропускной способностью в конфигурации парных прочтений с длиной прочтения 2×100 п.н. Первичные прочтения фильтровали в отношении качества и картировали на эталонный геном S288C. A) Значения log2 кратности изменений (относительно дикого типа) приведены для каждого из дифференциально экспрессированных генов (≥ | 1,5 | log2 кратности изменений и ≥ 100 единиц счета в дрожжах дикого типа). Пунктирные линии проведены на уровнях +1,5, 0 и -1,5 для справки. Вычерченная линия в каждом ряду соответствует фактическому значению кратности изменения для каждого гена. Иерархическую кластеризацию использовали для группировки как кластеров генов, так и штаммов. B) Диаграмма Венна перекрывания между дифференцированно экспрессированными генами в каждом из AR дрожжевых штаммов.
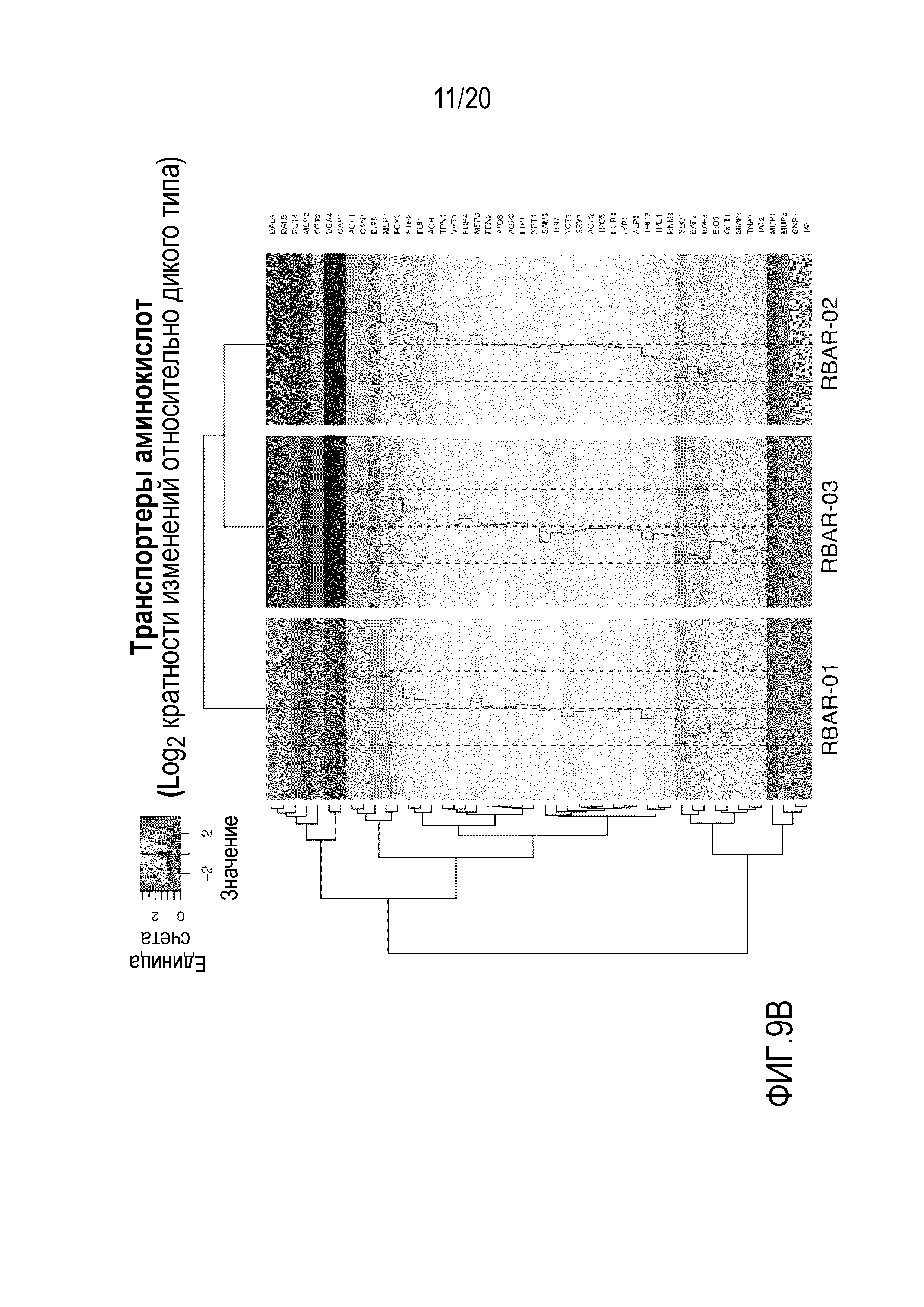
Фигура 9 показывает, что многие гены АКР и транспортеров аминокислот дифференцированно экспрессированы в каждом из AR дрожжевых штаммов. Суммарную РНК получали из штамма дикого типа и AR дрожжевых штаммов (RBAR-01, RBAR-02 и RBAR-03) во время экспоненциального роста в среде YEG. Библиотеки РНК для секвенирования (TruSeq v3), полученные из суммарной РНК, были секвенированы на платформе Illumina HiSeq2500 с высокой пропускной способностью в конфигурации парных прочтений с длиной прочтения 2×100 п.н. Первичные прочтения фильтровали в отношении качества и картировали на эталонный геном S288C. A) Значения log2 кратности изменений (относительно дикого типа) приведены для каждого из аннотированных генов АКР (71). B) Значения log2 кратности изменений (относительно дикого типа) приведены для каждого из аннотированных генов транспортеров аминокислот (71). A и B) Пунктирные линии проведены на уровнях +1,5, 0 и -1,5 для справки. Вычерченная линия в каждом ряду соответствует фактическому значению кратности изменения для каждого гена. Иерархическую кластеризацию использовали для группировки как кластеров генов, так и штаммов.
Фигура 10 показывает, что большинство мутаций, идентифицированных в AR дрожжевых штаммах, являются общими для всех. Геномную ДНК получали из штамма дикого типа и AR дрожжевых штаммов (RBAR-01, RBAR-02 и RBAR-03). Библиотеки ДНК для секвенирования (Nextera XT), полученные из геномной ДНК, были секвенированы на платформе Illumina MiSeq в конфигурации парных прочтений с длиной прочтения 2×300 п.н. Первичные прочтения фильтровали в отношении качества и картировали на эталонный геном S288C. Наборы прочтений использовали для определения вариантов каждого нуклеотида относительно консенсусной последовательности S288C. Варианты в AR дрожжевых штаммах фильтровали относительно вариантов в штамме дикого типа для удаления излишних мутаций. Диаграмма Венна перекрывания между отфильтрованными мутациями в каждом из AR дрожжевых штаммов.
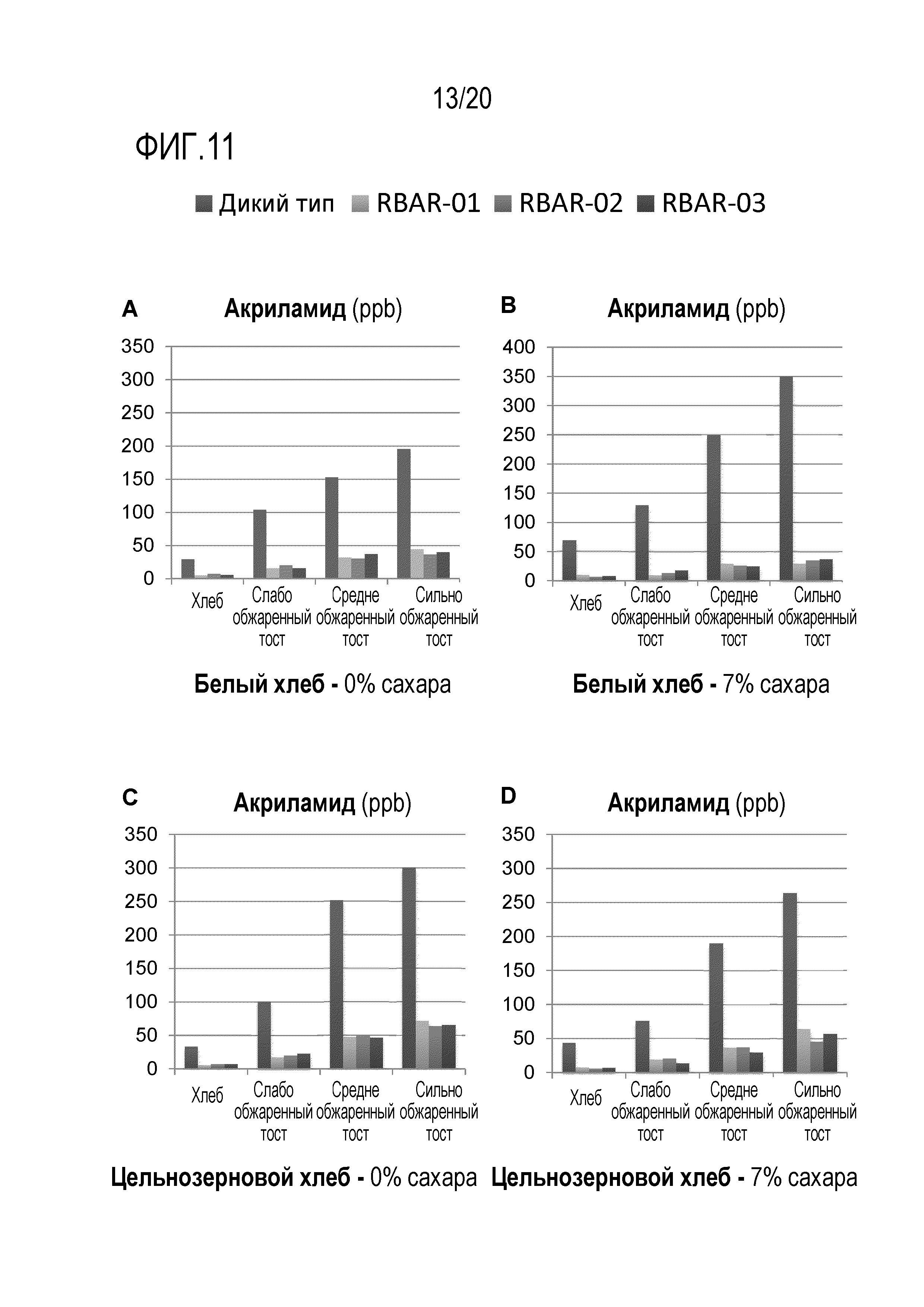
Фигура 11 показывает, что AR дрожжевые штаммы уменьшают содержание акриламида в хлебе и тостах. Белый и цельнозерновой хлеб (с добавлением или 0, или 7% сахарозы) производили с использованием либо дрожжей дикого типа, либо AR штаммов RBAR-01, RBAR-02 и RBAR-03. Уровни AA анализировали в не обжаренном хлебе, а также при низкой, средней и высокой степени обжарки, как указано в разделе «Материалы и методы». A) Белый хлеб с 0% сахарозы. B) Белый хлеб с 7% сахарозы. C) Цельнозерновой хлеб с 0% сахарозы. D) Цельнозерновой хлеб с 7% сахарозы. Данные являются репрезентативными для дважды повторенных экспериментов.
Фигура 12 показывает, что AR дрожжевые штаммы уменьшают содержание акриламида в картофеле фри. Картофель фри из свежего картофеля сорта Russet готовили путем замачивания нарезанного, не подвергнутого тепловой обработке картофеля в воде либо без дрожжей, либо с дрожжами дикого типа или AR штаммами RBAR-01, RBAR-02 и RBAR-03. Уровни AA анализировали в конечном обжаренном продукте. Данные являются репрезентативными для дважды повторенных экспериментов.
Фигура 13 показывает, что AR дрожжевой штамм RBAR-03 уменьшает содержание акриламида в картофеле фри зависимым от дозы образом в условиях коротких периодов инкубации и высокой температуры. Нарезанный картофель предварительно обрабатывали, как описано в разделе «Методы», а затем выдерживали в течение 50 секунд только в воде или в воде с добавлением 100, 200, 250 или 300 г/л дрожжевого молока AR штамма (23% сухого вещества) при 68°C. После обжаривания уровни акриламида в картофеле фри измеряли методом СЭЖХ/МС. Данные являются репрезентативными для трижды повторенных экспериментов.
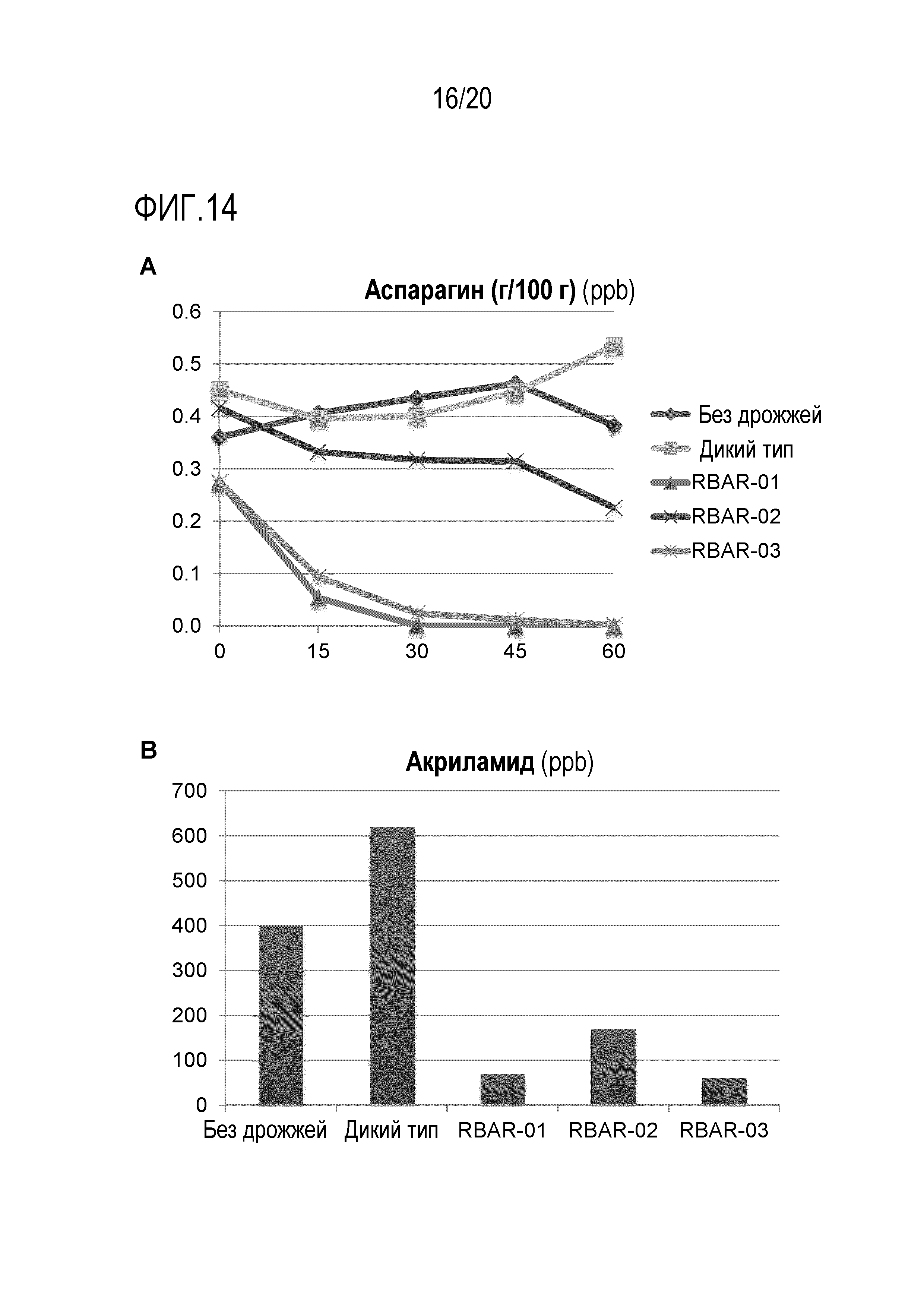
Фигура 14 показывает, что AR дрожжевые штаммы уменьшают содержание акриламида в обжаренных легких закусках из картофеля. Экструдированную и обжаренную легкую закуску из картофеля готовили либо без дрожжей, либо с дрожжами дикого типа или AR штаммами RBAR-01, RBAR-02 и RBAR-03. Уровни аспарагина анализировали в разные временные точки во время производственного процесса (A) и уровни AA анализировали в конечном обжаренном продукте (B). Данные являются репрезентативными для дважды повторенных экспериментов.
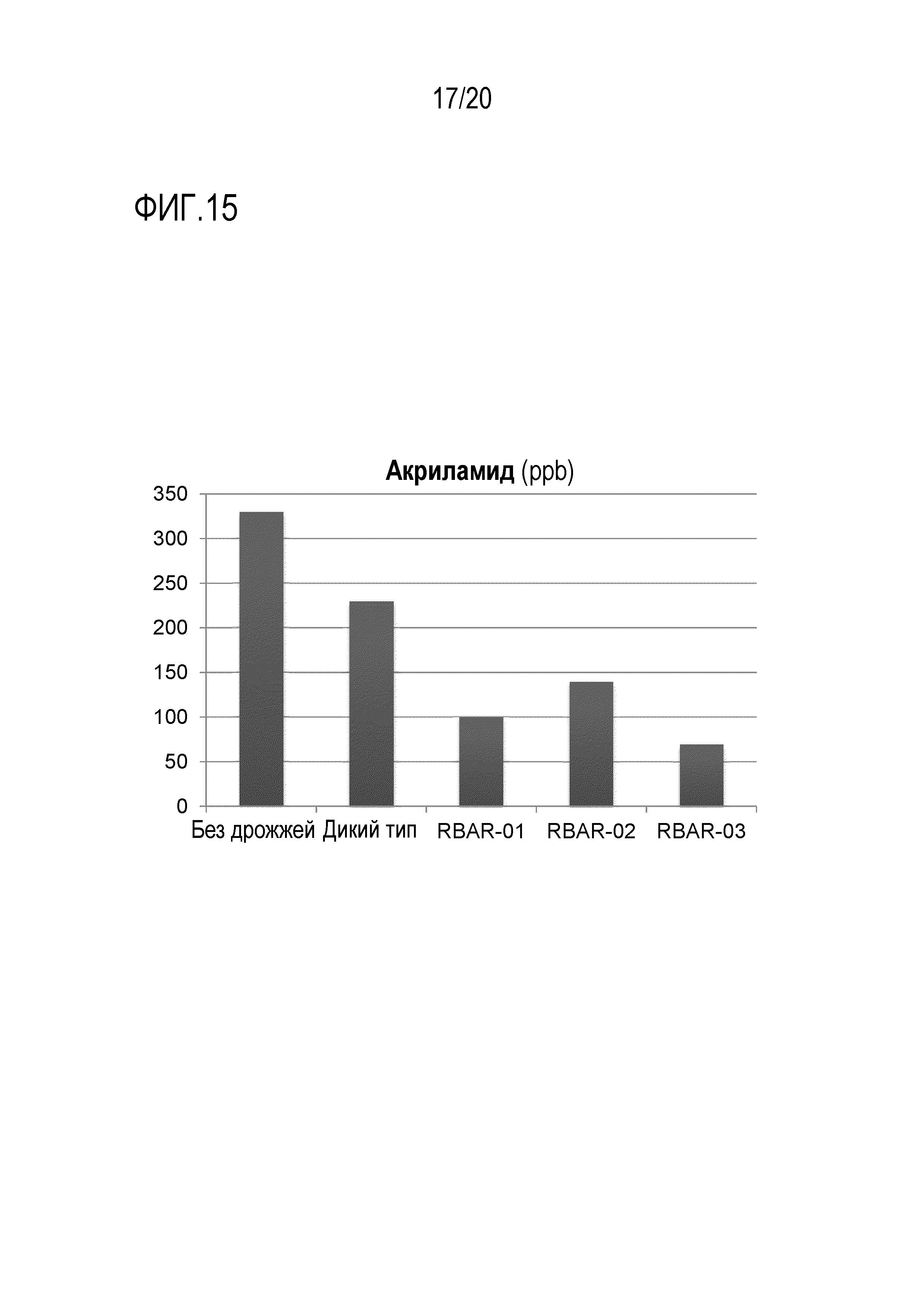
Фигура 15 показывает, что AR дрожжевые штаммы уменьшают содержание акриламида в сладком печенье. Сладкое печенье готовили либо без дрожжей, либо с дрожжами дикого типа или AR штаммами RBAR-01, RBAR-02 и RBAR-03. Уровни AA анализировали в конечном продукте. Данные являются репрезентативными для дважды повторенных экспериментов.
Фигура 16 показывает, что AR дрожжевые штаммы уменьшают содержание акриламида в кренделях. Крендели готовили или с дрожжами дикого типа, или с AR штаммами RBAR-01, RBAR-02 и RBAR-03. Уровни AA анализировали в конечном продукте. Данные являются репрезентативными для дважды повторенных экспериментов.
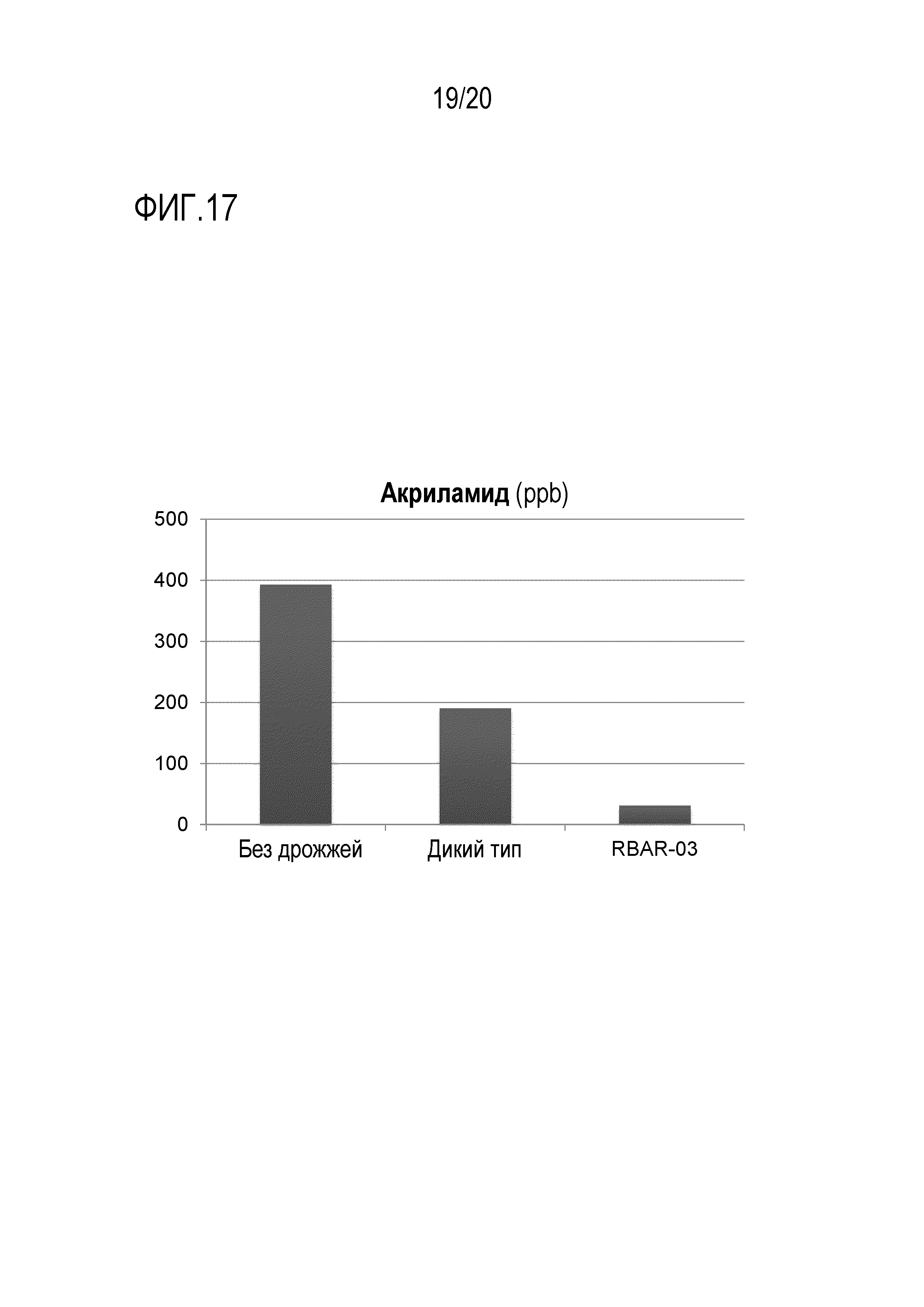
Фигура 17 показывает, что AR дрожжевые штаммы уменьшают содержание акриламида в кофе в результате прямой ферментации зеленых кофейных бобов. Измельченные зеленые кофейные бобы инкубировали либо только в воде, либо в воде с дрожжами дикого типа или AR штаммом RBAR-03. После инкубации измельченные бобы сушили и обжаривали, после чего анализировали уровни AA.
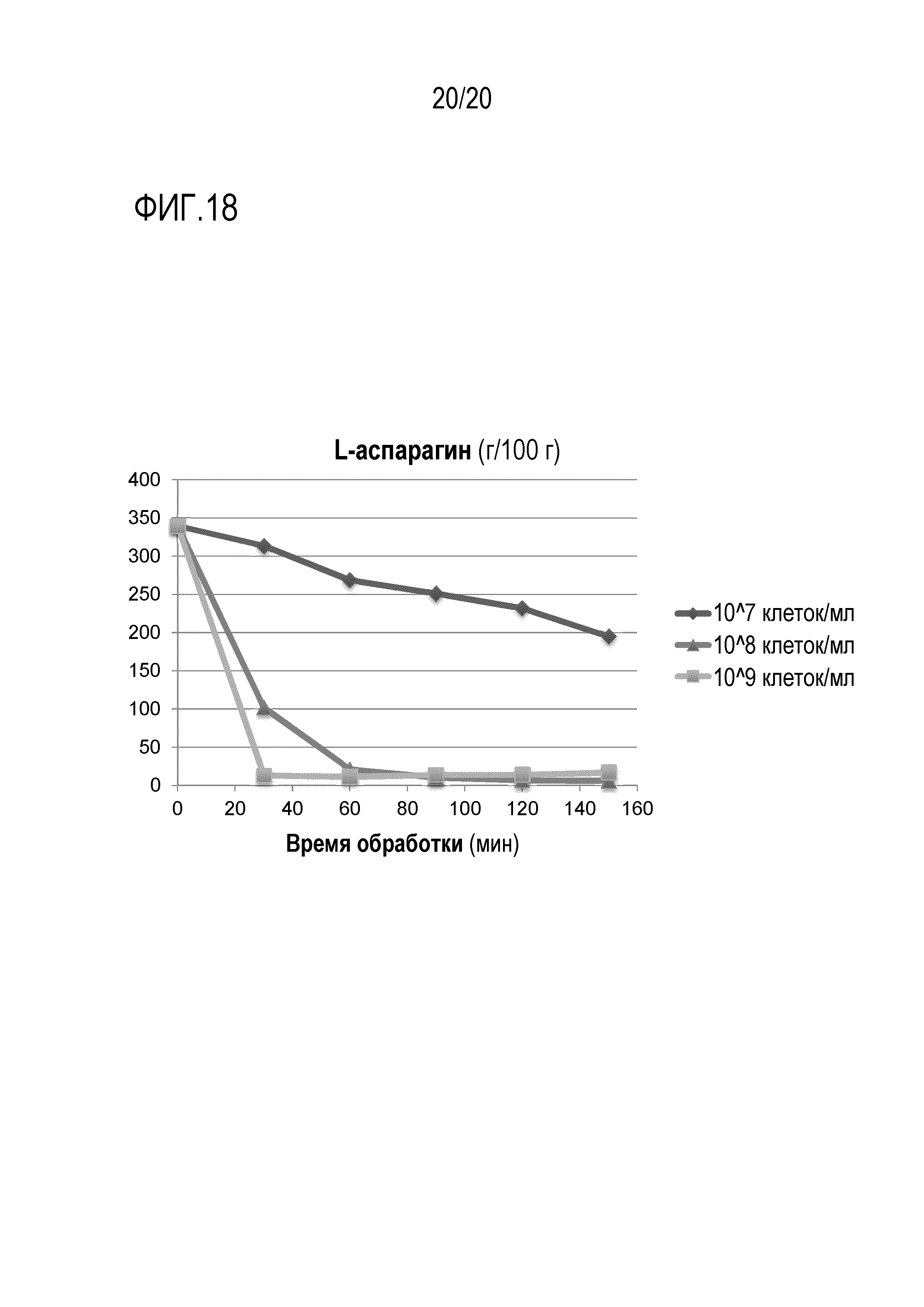
Фигура 18 показывает, что AR дрожжевые штаммы уменьшают содержание аспарагина в экстракте зеленого кофе. Экстракт зеленого кофе (18% растворимых сухих веществ) инкубировали с AR дрожжами в разных концентрациях. После инкубации экстракты осветляли центрифугированием и анализировали уровни L-аспарагина. Данные являются репрезентативными для дважды повторенных экспериментов.
Подробное описание ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения продемонстрировали, что итерационный процесс случайного мутагенеза в сочетании с давлением отбора позволил создать производственный дрожжевой штамм, обладающий уменьшающей содержание аспарагина активностью в не индуцирующих условиях.
Соответственно, изобретение относится к способу выделения дрожжевого штамма, разрушающего L-аспарагин в не индуцирующих условиях, включающему:
a) субкультивирование дрожжевого штамма дикого типа, который экспрессирует, или способен экспрессировать, связанную с клеточной стенкой аспарагиназу в присутствии среды, содержащей D-аспарагин в виде единственного источника азота;
b) постоянное субкультивирование, отслеживание скорости роста и еженедельное осуществление мутагенеза;
c) отбор культур по пункту b), когда скорость роста достигает исходного уровня;
d) постоянное субкультивирование выбранных клеток в селективной среде, содержащей метиламин, отслеживание скорости роста и еженедельное осуществление мутагенеза до того момента, когда скорость роста в присутствии метиламина достигнет скорости роста в селективной среде без метиламина;
e) выделение отдельных колоний по пункту d) путем высевания на селективную среду, содержащую метиламин, выращивание указанных колоний и отбор крупных и быстро растущих колоний;
f) анализ выбранных колоний по пункту e) на способность разрушать L-аспарагин в не индуцирующих условиях и отбор по меньшей мере одной колонии с высокой разрушающей L-аспарагин активностью по сравнению с клетками в начале этапа d);
g) повторение этапов d) - f) с выбранными клетками на этапе f), с увеличением каждый раз концентрации метиламина, до того момента, когда разрушающая L-аспарагин активность достигнет плато;
h) выделение штамма из этапа g), в котором разрушающая L-аспарагин активность достигла плато.
В одном варианте осуществления связанная с клеточной стенкой аспарагиназа закодирована локусом ASP3 (регистрационный номер в GenBank NM_001182042.1).
В одном варианте осуществления дрожжевой штамм дикого типа представляет собой производственный дрожжевой штамм. В одном из вариантов осуществления дрожжевой штамм представляет собой пекарские дрожжи (S. cerevisiae).
Используемый в настоящем документе термин «производственный штамм» означает штамм, используемый в производственных процессах, в отличие от лабораторных штаммов дрожжей, которые, как правило, используют для лабораторных исследований. Как правило, производственные штаммы дрожжей бывают преимущественно диплоидными, некоторые бывают триплоидными, тетраплоидными или анеуплоидными. При этом лабораторные штаммы дрожжей, как правило, бывают гаплоидными.
Дрожжевые штаммы могут относиться, без ограничения, к родам и видам царства грибов. В одном варианте осуществления роды и виды выбирают из тех, которые используют в пищевой промышленности. В другом варианте осуществления виды включают, без ограничения, Aspergillus acidus, Aspergillus niger, Aspergillus oryzae, Aspergillus sojae, Candida etchellsii, Candida milleri, Candida oleophila, Candida rugosa, Candida tropicalis, Candida versatilis, Candida zemplinina, Candida zeylanoides, Cyberlindnera jadinii, Cyberlindnera mrakii, Cystofilobasidium infirmominiatum, Debaryomyces hansenii, Dekkera bruxellensis, Fusarium domesticum, Fusarium venenatum, Galactomyces candidum, Geotrichum candidum, Guehomyces pullulans, Hanseniaspora guilliermondii, Hanseniaspora osmophila, Hanseniaspora uvarum, Kazachstania exigua, Kazachstania unispora, Kluyveromyces lactis, Kluyveromyces marxianus, Lachancea fermentati, Lachancea thermotolerans, Lecanicillium lecanii, Metschnikowia pulcherrima, Mucor hiemalis, Mucor mucedo, Mucor plumbeus, Mucor racemosus, Neurospora sitophila, Penicillium camemberti, Penicillium caseifulvum, Penicillium chrysogenum, Penicillium commune, Penicillium nalgiovense, Penicillium roqueforti, Penicillium solitum, Pichia fermentans, Pichia kluyveri, Pichia kudriavzevii, Pichia membranifaciens, Pichia occidentalis, Pichia pijperi, Rhizopus microspores, Rhizopus oligosporus, Rhizopus oryzae, Rhizopus stolonifer, Saccharomyces bayanus, Saccharomyces cerevisiae, Schizosaccharomyces pombe, Schwanniomyces vanrijiae, Scopulariopsis flava, Starmerella bombicola, Torulaspora delbrueckii, Torulopsis candida, Torulopsis holmii, Trigonopsis cantarellii, Wickerhamomyces anomalus, Yarrowia lipolytica, Zygosaccharomyces rouxii, Zygotorulaspora florentina. Существуют различные коммерческие источники дрожжевых штаммов, такие как Lallemand Inc. (Канада), AB Mauri (Австралия) и Lesaffre (Франция).
В одном варианте осуществления мутагенез представляет собой физический мутагенез, включая, без ограничения, мутагенез за счет УФ-излучения и формы мутагенеза за счет радиационного облучения, например, вызываемый рентгеновскими лучами и гамма-лучами мутагенез. В одном из вариантов осуществления физический мутагенез представляет собой УФ-мутагенез. Специалисту в данной области известны условия для осуществления УФ-мутагенеза. Для УФ-мутагенеза на клетки можно воздействовать источником УФ-излучения (стандартной постоянной интенсивности) в течение различных периодов времени. Дозировки могут быть основаны на показателях гибели клеток - в среднем во время каждой обработки культуры могут подвергаться воздействию достаточного количества УФ-излучения для гибели 25-90% клеток.
В другом варианте осуществления мутагенез представляет собой химический мутагенез (например, при помощи EMS - этилметансульфоната).
Специалистам в данной области известно, что мутагенез используют для увеличения частоты мутаций и, следовательно, вероятности обнаружения интересующих мутаций в надлежащих селективных условиях.
Используемый в настоящем документе термин «не индуцирующие условия» означает любые условия культивирования, при которых способность к внеклеточному разрушению L-аспарагина обычно подавлена в дрожжах дикого типа. Напротив, термин «селективные условия» означает условия культивирования, при которых D-аспарагин является единственным источником азота, и для увеличения давления отбора в среде может присутствовать ингибитор роста, такой как метиламин.
Специалисту в данной области известны условия культивирования дрожжевых клеток. Например, для этапа (a) дрожжевые клетки можно выращивать при 30°C в жидкой селективной среде, такой как среда, состоящая из основы азотного агара для дрожжей без аминокислот или сульфата аммония (YNB-AA/AS) с добавлением источника углерода, такого как 2% (масс/об) сахароза, и D-аспарагина, например, в концентрации 10 г/л, однако концентрация может варьироваться от 0,5 до 15 г/л в зависимости от штаммов. Ночные культуры можно субкультивировать ежедневно в свежую среду при постоянной концентрации, например, до оптической плотности (OD600) 0,01.
Для этапа (d) селекции при помощи метиламина клетки можно выращивать при 30°C в жидкой селективной среде, такой как среда, состоящая из основы азотного агара для дрожжей без аминокислот или сульфата аммония (YNB-AA/AS) с добавлением источника углерода, такого как 2% (масс/об) сахароза, и D-аспарагина, например, в концентрации 10 г/л, однако концентрация может варьироваться от 0,5 до 15 г/л в зависимости от штаммов, и кроме того, с добавлением различных количеств метиламина.
Для этапа (e) выделения отдельных колоний, отобранных при помощи метиламина, клетки можно высевать и выращивать при 30°C на твердой селективной среде, такой как среда, состоящая из основы азотного агара для дрожжей без аминокислот или сульфата аммония (YNB-AA/AS) с добавлением источника углерода, такого как 2% (масс/об) сахароза, D-аспарагина, например, в концентрации 10 г/л, однако концентрация может варьироваться от 0,5 до 15 г/л в зависимости от штаммов, достаточного количества агара для затвердевания среды и, кроме того, с добавлением различных количеств метиламина.
Для обычного поддержания дрожжей клетки можно выращивать при 30°C на твердой неселективной среде, такой как YEG-агар (2% дрожжевого экстракта+1% глюкозы+2% агара).
Методы определения скорости роста известны в данной области, и примеры такого определения описаны в настоящем документе в разделе «Примеры». В одном варианте осуществления скорость роста определяют путем измерения оптической плотности. Измерение оптической плотности является самым быстрым и наиболее широко используемым методом, он основан на том факте, что дрожжи в водной суспензии рассеивают свет. Величина светорассеяния пропорциональна количеству клеток на единицу объема, то есть, концентрации клеток. В альтернативном варианте осуществления скорость роста определяют путем подсчета количества клеток. Количество клеток в объеме культуры можно точно подсчитывать с использованием микроскопа и гемоцитометра. В следующем варианте осуществления скорость роста на твердой среде можно определять путем визуального сравнения размера колоний клеток, растущих в эквивалентных условиях (то есть в течение одного и того же периода времени, при той же температуре и в той же среде). Например, колонии большего размера росли быстрее, чем колонии меньшего размера.
Используемое в настоящем документе выражение «крупные и быстро растущие колонии» относится к колониям, которые визуально растут наиболее быстро и имеют самый крупный размер колоний в сравнении с примерным средним размером колоний на чашке. Такая идентификация может быть качественной по характеру, и специалист в данной области сможет с легкостью определять колонии, отвечающие этому критерию.
Используемый в настоящем документе термин «исходный уровень» применительно к скорости роста означает скорость роста штамма на не индуцирующей и не селективной среде (среде, содержащей достаточное количество азота, то есть, среде, богатой питательными веществами, то есть содержащей не только D-аспарагин и/или не содержащей метиламин).
В одном варианте осуществления на этапе g) количество метиламина увеличивают постепенно, например, на 25-50% при каждом повторении, так что начальные увеличения являются небольшими, а затем возрастают. В одном из вариантов осуществления количество метиламина на этапе e) представляет собой количество, достаточное для уменьшения скорости роста на 25-75% относительно скорости роста в селективной среде без метиламина. В другом варианте осуществления содержание метиламина можно увеличивать от 0,05 г/л до 12 г/л прежде, чем разрушающая L-аспарагин активность достигнет плато.
Временные рамки для субкультивирования и общее число эволюционных итераций варьируются и зависят от ряда переменных, включая генетическую сложность штамма дикого типа, вид используемого мутагенеза (то есть химический, УФ-, рентгеновское излучение), дозу мутагена и силу отбора. В одном из вариантов осуществления период времени для этапов a)-c) занимает 2-4 недели. В одном из вариантов осуществления период времени для этапов d)-g) занимает 6-48 недель. В одном из вариантов осуществления число повторений на этапе g) составляет 5-20.
Колонии можно анализировать на способность к разрушению L-аспарагина в не индуцирующих условиях, как описано, например, в разделе «Примеры».
По настоящему изобретению также предложены дрожжи, полученные способом, раскрытым в настоящем документе. Кроме того, предложены выделенные не генетически модифицированные дрожжи, экспрессирующие аспарагиназу клеточной стенки и обладающие уменьшающей содержание аспарагина активностью в не индуцирующих условиях. В одном варианте осуществления выделенные не генетически модифицированные дрожжи уменьшают содержание аспарагина на по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, или более, при росте в не индуцирующих условиях. Специалист в данной области может с легкостью тестировать способность дрожжевого штамма уменьшать содержание аспарагина с использованием способов, раскрытых в разделе «Примеры». В одном из вариантов осуществления аспарагиназа клеточной стенки закодирована локусом ASP3.
В одном из вариантов осуществления выделенные не генетически модифицированные дрожжи конститутивно экспрессируют аспарагиназу клеточной стенки. Используемый в настоящем документе термин «конститутивная экспрессия» означает постоянную экспрессию гена на протяжении роста микроорганизма, в отличие от избирательной экспрессии в зависимости от условий роста. В одном варианте осуществления дрожжевой штамм представляет собой производственный дрожжевой штамм. В одном из вариантов осуществления дрожжевой штамм представляет собой производственный штамм пекарских дрожжей.
Также предложен выделенный дрожжевой штамм, депонированный 14 мая 2015 г. в международном депозитарии Канады (IDAC), Национальной микробиологической лаборатории Министерства здравоохранения Канады, 1015 Arlington Street, Winnipeg, Manitoba, Canada R3E 3R2, под регистрационными номерами: 140515-01 (в настоящем документе называемый «RBAR-01»), 140515-02 (в настоящем документе называемый «RBAR-02») и/или 140515-03 (в настоящем документе называемый «RBAR-03»). Документы, относящиеся к депонированию и жизнеспособности данных штаммов, приведены в Приложении A.
Авторы настоящего изобретения также показали, что эти эволюционировавшие дрожжевые штаммы особенно полезны для уменьшения содержания аспарагина и, в свою очередь, акриламида в процессе приготовления и обработки пищевых продуктов, и, вследствие этого, дрожжевые штаммы, раскрытые в настоящем документе, называют уменьшающими содержание акриламида дрожжами, или AR дрожжами. В настоящем документе термины «уменьшающие содержание акриламида дрожжи» и «уменьшающие содержание аспарагина дрожжи» используют взаимозаменяемо. Соответственно, по настоящему изобретению также предложен способ уменьшения содержания аспарагина и, в свою очередь, акриламида в процессе приготовления и обработки пищевых продуктов, включающий добавление дрожжевого штамма, раскрытого в настоящем документе, к пищевому продукту при приготовлении или обработке пищевого продукта; при этом дрожжи уменьшают содержание аспарагина и, следовательно, образование акриламида в процессе приготовления и обработки пищевого продукта.
В одном из вариантов осуществления дрожжевой штамм является неактивным. Используемый в настоящем документе термин «неактивный» относится к композиции из неактивных, нежизнеспособных и/или мертвых дрожжевых микроорганизмов, которые все-еще сохраняют свою питательную ценность и другие свойства. Например, дрожжи можно выращивать в условиях, допускающих избыточную экспрессию желаемого белка или белков. Затем дрожжи можно использовать для получения неактивных дрожжей, например, с помощью различных методов пастеризации, включая, без ограничения, пастеризацию при высокой температуре в течение короткого времени, различных методов стерилизации, включая, без ограничения, влажную термообработку и облучение, различных методов инактивации, включая, без ограничения, высокое давление, фотокатализ и импульсный свет, фотосенсибилизацию, электрические поля, в том числе РЧ и импульсные, разрушение клеток, обработку ультразвуком, гомогенизацию, автолиз и инактивацию химическими реагентами, в том числе, без ограничения, формальдегидом, тимеросалом, хлораминами, диоксидом хлора, йодом, серебром, медью, антибиотиками и озоном.
В другом варианте осуществления дрожжевой штамм является свежим. В другом варианте осуществления дрожжевой штамм представляет собой активные сухие дрожжи. Термин «свежие дрожжи» означает дрожжи, которые были выращены в не селективной дрожжевой среде (например, описанной выше) и центрифугированы для удаления большинства жидкости. Свежие дрожжи являются живыми и метаболически активными. Свежие дрожжи нестабильны при хранении и, как правило, могут храниться лишь в течение 1-5 недель при охлаждении. Типичные свежие дрожжи содержат примерно 25% сухого вещества. Активные сухие дрожжи (ADY) представляют собой обработанный продукт, в котором дрожжи высушены до конечного содержания влаги 3% (97% сухого вещества). Дрожжевые клетки в данном продукте являются живыми, но метаболически инертными до регидратации. В герметичной вакуумной упаковке ADY, как правило, могут храниться в течение 2-4 лет. Стандартизированные методы изготовления ADY хорошо известны в отраслях промышленности, в которых используют дрожжи, таких как виноделие, пивоварение и хлебопекарное производство.
Используемое в настоящем документе выражение «уменьшение содержания аспарагина» означает уменьшение уровня аспарагина или разрушение аспарагина, например, в пищевом продукте, по меньшей мере на 20%, 30%, 40%, 50%, 60%, 70%, 80%, или более, по сравнению с контрольным дрожжевым штаммом, таким как родительский штамм, из которого дрожжевой штамм эволюционировал.
Аспарагин является лимитирующим предшественником в реакции образования акриламида в процессе приготовления или обработки пищевых продуктов. Соответственно, в другом варианте осуществления предложен способ уменьшения содержания акриламида в пищевом продукте, включающий добавление дрожжевого штамма, описанного в настоящем документе, к пищевому продукту при приготовлении или обработке пищевого продукта; при этом дрожжи уменьшают содержание аспарагина, тем самым уменьшая содержание акриламида, в пищевом продукте. По настоящему изобретению также предложено применение дрожжевых штаммов, раскрытых в настоящем документе, для уменьшения концентрации акриламида при приготовлении или обработке пищевого продукта.
Используемое в настоящем документе выражение «уменьшение содержания акриламида» означает уменьшение уровня акриламида в пищевом продукте на по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, или более, по сравнению с условиями, когда дрожжевой штамм отсутствует.
В одном варианте осуществления приготовление или обработка пищевого продукта включает ферментацию. Например, способы и варианты применения по настоящему изобретению полезны для ферментации пищевого продукта, в том числе, без ограничения, углеводов при выпечке хлеба, при обработке картофеля, производстве печенья, производстве кофе или производстве легких закусок. Используемый в настоящем документе термин «ферментация» означает потребление дрожжами сахара и других питательных веществ.
Соответственно, пищевой продукт может представлять собой любой пищевой продукт, который, как правило, содержит аспарагин, и включает, без ограничения, овощной пищевой продукт, напиток, хлебобулочный продукт, зерновой продукт, плод, бобы, молочный или мясной продукт. В одном варианте осуществления пищевой продукт представляет собой картофель или продукт из картофеля. В другом варианте осуществления пищевой продукт представляет собой кофе.
В одном варианте осуществления пищевой продукт представляет собой картофель или продукт из картофеля, и добавление дрожжей к пищевому продукту при приготовлении или обработке пищевого продукта включает предварительное замачивание картофеля или продукта из картофеля в смеси воды и дрожжевого штамма перед тепловой обработкой. В одном из вариантов осуществления картофель предварительно замачивают при комнатной температуре и сушат на воздухе перед тепловой обработкой. Термин «тепловая обработка» включает, без ограничения, глубокую обжарку, жарение и запекание. В одном из вариантов осуществления концентрация дрожжевого штамма, раскрытого в настоящем документе, в смеси вода/дрожжевой штамм составляет по меньшей мере 1, по меньшей мере 10, по меньшей мере 50, по меньшей мере 100 г/л (сухой клеточной массы/объем) или более. В одном из вариантов осуществления время предварительного замачивания составляет по меньшей мере 0,25 мин, по меньшей мере 0,5 мин, по меньшей мере 1 мин, по меньшей мере 5 мин, по меньшей мере 10 мин, по меньшей мере 20 мин или более.
В другом варианте осуществления пищевой продукт представляет собой легкую закуску из картофеля, и добавление дрожжей к пищевому продукту при приготовлении или обработке пищевого продукта включает добавление дрожжей в картофельную тестообразную смесь перед формованием, экструдированием или иным процессом создания прессованного продукта, который будет подвергнут тепловой обработке посредством запекания, глубокой обжарки или жарения.
В другом варианте осуществления пищевой продукт представляет собой кофе, и добавление дрожжевого штамма к пищевому продукту при приготовлении или обработке пищевого продукта включает замачивание свежих зеленых кофейных бобов в экстракте зеленых кофейных бобов, который был предварительно обработан дрожжевым штаммом, раскрытым в настоящем документе, для уменьшения содержания аспарагина, при этом предварительно обработанный экстракт удаляет аспарагин из кофейных бобов перед обжариванием. В одном из вариантов осуществления экстракт предварительно обрабатывают при температуре от 60°C до 80°C, необязательно, при 70°C. В одном из вариантов осуществления время предварительной обработки экстракта составляет по меньшей мере 1 час, по меньшей мере 5 часов, по меньшей мере 10 часов, по меньшей мере 15 часов или более.
В другом варианте осуществления пищевой продукт представляет собой кофе, и добавление дрожжевого штамма к пищевому продукту при приготовлении или обработке пищевого продукта включает ферментацию измельченных зеленых кофейных бобов дрожжевым штаммом перед обжариванием.
По настоящему изобретению также предложен пищевой продукт, имеющий уменьшенное содержание аспарагина и, в свою очередь, уменьшенное содержание акриламида, полученный с использованием дрожжевого штамма, раскрытого в настоящем документе, или способа, раскрытого в настоящем документе.
Пищевой продукт может представлять собой любой пищевой продукт, который получают в условиях приготовления или обработки, приводящих к превращению аспарагина в акриламид. Типичные условия приготовления и обработки, приводящие к образованию акриламида, включают приготовление при высокой температуре (превышающей 120°C), которое включает, без ограничения, глубокую обжарку и запекание, обжаривание, жарение, приготовление на гриле, тушение и обжаривание на открытом огне. Акриламид, как правило, присутствует в высокой концентрации в продуктах из картофеля, хлебобулочных продуктах, а также любых продуктах из злаков и зерна. Соответственно, в одном из вариантов осуществления пищевой продукт представляет собой овощ, такой как картофель, таро или оливки, хлебобулочный продукт или продукт из злаков и зерна. Продукты из картофеля включают, без ограничения, картофель фри, картофельные чипсы, жареные/запеченные легкие закуски из картофеля и формованные продукты из картофеля. Хлебобулочные продукты включают, без ограничения, бисквиты, печенья, крекеры, хлеб, хлеб из безопарного теста, продукты из сдобного теста, кукурузные и мучные лепешки, мучные кондитерские изделия, пироги, торты и кексы, а также сдобное тесто. Например, хлеб может включать, без ограничения, свежий и замороженный хлеб и тесто, закваску, тесто для пиццы, булочки, рулеты и разнообразные хлебцы, а также родственные хлебобулочные изделия, такие как обжаренные или запеченные легкие закуски или панировочные сухари; и мучные кондитерские изделия могут включать, без ограничения, сладкие булочки, пончики и торты. Продукты из злаков и зерна включают, без ограничения, типичные сухие завтраки, пивной солод и продукты из молочной сыворотки, кукурузные чипсы и крендели. Другие пищевые продукты, которые обрабатывают при высокой температуре, включают, без ограничения, кофе, жареные орехи, жареную спаржу, пиво, солод и напитки из молочной сыворотки, какао-порошок, рыбные продукты, продукты из мяса и домашней птицы, луковый суп и смесь для макания, ореховое масло, глазированный арахис, обжаренные соевые бобы, жареные семена подсолнечника, жареные или запеченные пищевые продукты, такие как фалафель и кеббе, а также шоколадные батончики.
Вышеприведенная спецификация в целом описывает настоящее изобретение. Более полное понимание может быть достигнуто при изучении следующих далее примеров. Данные примеры описаны исключительно с целью иллюстрации, и не должны ограничивать объем изобретения. Подразумевается, что в зависимости от обстоятельств и по мере необходимости могут быть внесены изменения по форме или произведена замена эквивалентами. Хотя в настоящем документе использованы конкретные термины, такие термины носят исключительно описательный характер и не предназначены для ограничения изобретения.
Следующие далее неограничивающие примеры иллюстрируют настоящее изобретение:
примеры
Материалы и методы
Дрожжевые штаммы и среды
Дрожжевые штаммы поддерживали на чашках с YEG-агаром (2% масс/об глюкозы, 1% масс/об дрожжевого экстракта, 2% масс/об агара). Ночные культуры выращивали из отдельных колоний, которые инокулировали в жидкую среду YEG и инкубировали в течение 18 часов при 30°C (250 об/мин).
Анализ разрушения аспарагина
Плотность клеток в ночных культурах измеряли при помощи гемоцитометра. Затем 1×107 клеток инокулировали в 5 мл среды YEG с добавлением 0,6 г/л L-аспарагина и инкубировали при 30°C. В моменты времени, указанные для каждого эксперимента, 500 мкл среды удаляли, центрифугировали при 13000 x g в течение 1 мин (комнатная температура) и супернатант переносили в новую пробирку. Аспарагиназу инактивировали путем инкубации супернатанта при 80°C в течение 30 минут. Остаточное содержание L-аспарагина в супернатанте измеряли в ферментативном анализе в соответствии с инструкциями производителя (Megazyme, K-ASNAM).
Фингерпринтинг областей интер-дельта
Фингерпринтинг областей интер-дельта выполняли, как описано (61). Вкратце, геномную ДНК экстрагировали из ночных культур методом с использованием фенол-хлороформа, как описано ранее (62). Реакционная смесь для ПЦР с Taq полимеразой имела следующий состав: 100 нг геномной ДНК, 1 мкМ праймера 1 (дельта12: 5′-TCAACAATGGAATCCCAAC-3′) (SEQ ID NO: 1), 1 мкМ праймера 2 (дельта21: 5′-CATCTTAACACCGTATATGA) (SEQ ID NO: 2), смесь 200 нМ дНТФ, 2,5 мМ MgCl2, 1x Taq буфер+KCl и 1 Ед Taq полимеразы (Thermo Fisher, EP0402). Реакции амплификации проводили в термоциклере BioRad C1000 в соответствии со следующим протоколом: 4:00 при 95°C (начальная денатурация), 0:30 при 95°C, 0:30 при 46°C, 1:30 при 72°C (35 циклов), 10:00 при 72°C (окончательное удлинение). Продукты ПЦР подвергали электрофорезу в 2% масс/об агарозном геле HRB (Amresco, E776) со стандартным TBE буфером при 8 В/см и визуализировали с помощью красителя для нуклеиновых кислот GelGreen (Biotium).
Экстракция РНК
Клетки в количестве, соответствующем 5 единиц OD600, выделяли центрифугированием (13000 x g, 1 мин, RT), а затем быстро замораживали в смеси сухой лед/метанол. Суммарную РНК экстрагировали с использованием горячего подкисленного фенола, как описано ранее (63). Вкратце, клетки промывали один раз DEPC водой и затем лизировали в TES буфере и смеси подкисленный фенол-хлороформ в течение 1 часа при 65°C. Жидкую фазу очищали с использованием пробирок Phase Lock Gel™ (5Prime) и смеси подкисленный фенол-хлороформ, а затем другой пробирки Phase Lock Gel™ и смеси хлороформ:изоамиловый спирт. РНК осаждали этанолом в течение ночи при -80°C, промывали 70% этанолом и ресуспендировали в DEPC воде.
Количественная ПЦР (кПЦР)
100 мкг исходной суммарной РНК очищали с использованием спин-колонки для суммарной РНК EZNA (Omega Biotek) в соответствии с инструкциями производителя. Затем очищенную РНК определяли количественно и проверяли на качество анализом ScreenTape для РНК (Agilent Technologies).
800 нг чистой суммарной РНК переводили в кДНК методом обратной транскрипции в соответствии с инструкциями производителя (BioRad, набор iScript Reverse Transcription kit). Относительное количественное определение экспрессии ASP1 и ASP3 выполняли в тройном повторе. Реакционная смесь iTaq™ Universal SYBR® Green для кПЦР содержала: 8 нг кДНК, 500 нМ прямого праймера, 500 нМ обратного праймера и 1x iTaq™ Universal SYBR® Green Supermix (BioRad). Амплификацию проводили в термоциклере StepOnePlus для количественной ПЦР (Applied Biosystems) в соответствии со следующим протоколом: 0:30 при 95°C (начальная денатурация), 0:15 при 95°C, 1:00 при 60°C (40 циклов), 65-95°C с приращением по 0,5°C (кривая плавления). Анализ относительных количественных данных выполняли методом ΔΔCt, нормируя на ген «домашнего хозяйства» ACT1.
Праймеры для кПЦР были следующими:
Секвенирование ДНК
Геномную ДНК экстрагировали из ночных культур методом с использованием смеси фенол-хлороформ, как описано ранее (62). Библиотеку Nextera XT создавали в соответствии с инструкциями производителя (Illumina). Секвенирование выполняли на платформе Illumina MiSeq в конфигурации парных прочтений с длиной прочтения 2×300 п.н. (GeneWiz).
Секвенирование РНК
Суммарную РНК экстрагировали, очищали и проверяли на качество, как описано выше. Библиотеку TruSeq v3 создавали в соответствии с инструкциями производителя (Illumina). Секвенирование выполняли на платформе Illumina HiSeq2500 с высокой пропускной способностью в конфигурации парных прочтений с длиной прочтения 2×100 п.н. (GeneWiz).
Производство хлеба
Дрожжи для производства хлеба готовили, инокулируя петлю культуры с чашки с YEG-агаром в 75 мл жидкой среды YEG. Культуры выращивали в течение 18 часов (30°C), затем распределяли в 3×450 мл среды YEG и выращивали в течение 24 часов, как ранее. Дрожжевую культуру собирали центрифугированием (10 мин, 4000 x g, RT). Дрожжевое молоко промывали дважды путем ресуспендирования в стерилизованной воде и центрифугирования (10 мин, 4000 x g, RT).
Дрожжи активировали путем предварительной ферментации в течение 45 минут при 29°C (Таблица 1), после чего остальные ингредиенты добавляли к предварительно ферментированным дрожжам и смешивали в течение 21 мин с использованием стационарного миксера (Kitchen Aid), оборудованного крючком для замеса теста (Таблица 2). Тесто выдерживали в течение 15 минут при 22°C («время брожения теста между замесом и разделкой») и разделяли на две равные буханки, а затем выдерживали в течение 1,5 часов при 35°C (или до того момента, когда буханки вдвое увеличивались в размерах). Затем обработанные буханки выпекали в течение 15 минут при 204°C.
Таблица 1. Смесь для предварительной ферментации при изготовлении хлеба
Таблица 2. Окончательная смесь ингредиентов для изготовления хлеба
* Количества приведены в % от количества муки (по массе)
После выпекания буханки хлеба охлаждали до RT и нарезали на ломти толщиной 1,4 см. Образцы хлеба обжаривали в стандартном кухонном тостере с цифровым термометром (VWR Traceable). Степень обжаривания определяли на основании температуры тостера следующим образом: легкая - 167°C; средняя - 217°C; сильная - 235°C. Затем образцы хлеба и тостов измельчали (аналитическая мельница IKA модель A11BS1) и гомогенизировали.
Приготовление картофеля фри
Дрожжи для приготовления картофеля фри готовили, как описано ранее для хлеба.
Картофель сорта Russet очищали, промывали, нарезали и бланшировали в воде с температурой 90°C в течение 10 мин для дезактивации ферментов, вызывающих потемнение картофеля. Бланшированный картофель сушили, охлаждали до RT и добавляли либо просто в воду, либо в смесь AR дрожжей и воды (Таблица 3). Картофель выдерживали в смеси вода/дрожжи при RT, и образцы отбирали через 10, 20, 40 и 60 мин, после чего образцы немедленно высушивали на воздухе при 80°C в течение 10 мин. Затем высушенные образцы картофеля обжаривали в кукурузном масле при 175°C (Таблица 3).
Для тестирования эффективности AR дрожжей в условиях короткого времени обработки и высоких температур 50 г картофеля выдерживали в течение 50 секунд либо в 100 мл воды, либо в 100 мл воды с добавлением 100, 200, 250 или 300 г/л дрожжевого молока из AR дрожжей (23% сухого вещества) при 68°C. Перед добавлением картофеля смесь дрожжи/вода выдерживали при 68°C в течение 10 минут. После обработки образцы немедленно высушивали на воздухе при 80°C в течение 10 минут. Затем высушенные образцы картофеля обжаривали в кукурузном масле в порционной фритюрнице при 175°C в течение 5 минут. Приготовление картофеля фри и обработку AR дрожжами выполняли в тройном повторе. Статистическую значимость определяли при помощи критерия Стьюдента в сравнении с контролем, содержащим 0 г/л AR дрожжей.
Таблица 3. Дрожжевые смеси и параметры обжаривания при обработке картофеля
Изготовление гранулированной легкой закуски
Дрожжи для изготовления гранулированной легкой закуски готовили, как описано ранее для хлеба.
Ингредиенты крошки для легкой закуски (Таблица 4) добавляли в стационарный миксер (Kitchen Aid) с плоской лопастной насадкой и перемешивали в течение 5 мин. Крошку экструдировали в гранулы (длиной примерно 2 см), используя мундштук диаметром 4 мм. Полученные гранулы сушили одним слоем при 60°C в течение 3-3,5 часов до достижения содержания влаги 11%. Гранулы хранили в течение 1 недели в воздухонепроницаемом пластиковом пакете, затем обжаривали во фритюре в течение 10 сек при 185°C.
Таблица 4. Конечная смесь ингредиентов для изготовления гранулированной легкой закуски
Изготовление сладкого печенья
Дрожжи для изготовления печенья готовили, как описано ранее для хлеба.
Ингредиенты для сладкого печенья (Таблица 5) обрабатывали путем смешивания масла, сиропа и сахара в течение 1 мин при высокой скорости с использованием плоской лопастной насадки (классический стационарный миксер Kitchen Aid). Разрыхлитель и/или дрожжи растворяли в ингредиентной воде и добавляли в емкость для смешивания. Добавляли сухие ингредиенты и смешивали еще в течение 6 мин. Полученному тесту давали отстояться в течение 20 мин. 13 г бисквитного теста прессовали в круглую форму диаметром 65 мм и запекали при 180°C в течение 6 мин (целевое содержание влаги: 2,5-3,5%).
Таблица 5. Конечная смесь ингредиентов для изготовления сладкого печенья
Изготовление кренделей
Дрожжи для испытания кренделей готовили, как описано ранее для хлеба.
Крендели готовили, сначала смешивая сухие ингредиенты (Таблица 6), воду и дрожжи в течение 1 мин на стационарном миксере (классический стационарный миксер Kitchen Aid) с плоской лопастной насадкой. Добавляли кулинарный жир, и тесто перемешивали еще в течение 5 мин, а затем оставляли для ферментации на 30 мин при 35°C. Ферментированное тесто экструдировали через 9-мм мундштук кусками примерно 40 мм в длину и затем выдерживали в течение 10 мин. Гранулы подвергали тепловой обработке в течение 20 сек при 94°C в щелочной бане (1% NaOH). Затем крендели выпекали в течение 25 мин при 204°C (целевое содержание влаги 15%). Испеченный продукт сушили при 119°C в течение 25 мин (целевое содержание влаги 3,5%).
Таблица 6. Конечная смесь ингредиентов для изготовления кренделей
Приготовление кофе
Дрожжи для испытания кофе готовили, как описано ранее для хлеба.
Прямая ферментация кофейных бобов
Зеленые кофейные бобы (GCB) (Brazil Serra Negra) измельчали в порошок (аналитическая мельница IKA модель A11BS1). С использованием механизма обратного осмоса (RO) добавляли воду в пропорции 75 мл на 40 г порошка GCB. 4 г дрожжевого молока (25% сухого вещества) или 3 г RO-воды в качестве контроля без дрожжей добавляли к пасте GCB и проводили ферментацию в течение 20 час в инкубаторе со встряхиванием (250 об/мин, 30°C). 10 г ферментированной пасты обжаривали в ИК измерителе влажности (Ohaus MB45-2A0) в течение 13 минут при 200°C.
Приготовление экстракта зеленых кофейных бобов и обработка AR дрожжами
Экстракты зеленых кофейных бобов (GCE) готовили, по нескольку раз вымачивая партии GCB в воде. Более конкретно, 500 г GCB вымачивали в воде в течение 16 часов при 70°C, а затем отбрасывали. Затем свежую партию GCB предварительно вымачивали в воде в течение 1 часа при 70°C, с последующим выдерживанием в GCE в течение 16 часов при 70°C. Этот процесс вымачивания свежих GCB в GCE повторяли до того момента, когда содержание растворимых сухих веществ достигало 18%.
GCE обрабатывали AR дрожжами путем инкубации AR дрожжей в разных концентрациях с GCE при комнатной температуре в течение разного времени. Затем обработанный AR дрожжами GCE осветляли центрифугированием и использовали для измерения содержания аспарагина.
Количественное определение акриламида методом СЭЖХ/МС
Отдельные порции твердых пищевых продуктов тонко измельчали в кухонном комбайне перед отбором образцов. В случае жидких и порошкообразных пищевых продуктов образцы отбирали непосредственно. Образцы массой 1,00 г взвешивали и переносили в 50-мл центрифужные пробирки, добавляли 1 мл 200 мкг/кг13C3-меченого внутреннего стандарта акриламида и 9 мл воды. Затем каждую пробирку закрывали и быстро встряхивали вручную или на вихревой мешалке для перемешивания содержимого пробирок. Пробирки зажимали в ротационном шейкере на 20 мин для перемешивания содержимого пробирок. Пробирки центрифугировали при 9000 об/мин в течение 15 мин в центрифуге Eppendorf 5810R. 5-мл аликвоту осветленного водного слоя быстро отбирали пипеткой для спин-фильтрации. При отборе части водной фазы пипетку пропускали через верхний масляный слой, не задевая кончиком пипетки нижний слой твердых веществ. 5-мл аликвоту помещали в пробирку для спин-фильтрации и центрифугировали при 9000 об/мин в течение 2-4 мин. Если фильтр засорялся, вставляли новую фильтровальную пробирку, не профильтрованную жидкость наносили на новый фильтр, и центрифугирование продолжали до тех пор, пока большая часть жидкости не проходила через фильтр. Картриджи Oasis HLB SPE обрабатывали 3,5 мл метанола, с последующей обработкой 3,5 мл воды; эти порции метанола и воды отбрасывали. На каждый картридж наносили 1,5 мл фильтрованного экстракта. Экстракт пропускали через материал сорбента, а затем пропускали 0,5 мл воды. Затем колонку элюировали 1,5 мл воды, и элюэнт собирали для очистки при помощи Accucat SPE. Картриджи Accucat SPE с внешней стороны маркировали на высоте 1 мл жидкости над слоем сорбента, после чего картриджи обрабатывали 2,5 мл метанола, а затем 2,5 мл воды. Эти порции метанола и воды отбрасывали. Весь элюэнт, собранный с Oasis SPE, наносили и элюировали до отметки 1 мл прежде, чем собрать остатки элюированных порций. Эти порции переносили в 2-мл флаконы автодозатора из янтарного стекла и проводили анализ методом жидкостной хроматографии/масс-спектрометрии (ЖХ-МС) на приборе Waters ACQUITY UPLC H-Class, соединенном с масс-спектрометрическим детектором Waters ACQUITY QDa, используя следующие параметры:
Состав подвижной фазы: 0,1% водный раствор муравьиной кислоты, 2% метанол
Колонка: Waters ACQUITY UPLC HSS T3 2,1×50 мм 1,8 мкм
Скорость потока через колонку: 500 мкл/мин
Температура колонки: 20°C
Объем впрыска: 5 мкл
Время элюции: 1 минута
Режим ионизации: Электрораспыление положительно заряженных ионов
Капиллярное напряжение: 600 В
Напряжение на конусе: 5 В
Режим МС: мониторинг SIR m/z 72,04
Количественное определение L-аспарагина в экстракте кофейных бобов методом СЭЖХ-ФДМ
Экстракт кофейных бобов центрифугировали при 13000 об/мин в течение 5 минут при комнатной температуре. Полученный супернатант разбавляли Milli-Q водой и проводили измерение количества L-аспарагина методом сверхэффективной жидкостной хроматографии (СЭЖХ) в системе Waters с детектором на фотодиодной матрице (ФДМ) (Acquity UPLC H-Class, Waters, Milford, MA, USA) и колонкой Acquity UPLC BEH C18 (1,7 мкм, 2,1 мм X 100 мм, Waters, Milford, MA, USA). L-аспарагин 99,6% чистоты (Sigma-Aldrich, St. Louis, MO, USA) использовали для приготовления стандартных растворов с диапазоном концентраций от 15 до 500 пмоль/мкл для построения калибровочной кривой и расчетов. L-аспарагин в образцах и стандартных растворах дериватизировали при помощи набора AccQ·Tag Ultra™ Derivatization Kit (WATERS, Milford, MA, USA) для добавления хромофорной группы, которая может быть обнаружена по ее поглощению при 260 нм. Выполняли анализ с объемом впрыска 1 мкл и температурой колонки 43°C. Концентрированные растворы элюента A и элюента B AccQ·Tag Ultra™ приобретали у компании Waters (Milford, MA, USA) и использовали для градиентной элюции производного L-аспарагина. Подробная программа элюции приведена далее в Таблице 7:
Таблица 7. Программа элюции
Растворитель A: Концентрат элюента A
Растворитель B: 10% элюента B в воде
Растворитель C: Вода
Растворитель D: Концентрат элюента B
Результаты
Оценка существующего метода однократного скрининга для мутантов с дерепрессией ASP3
Чтобы обойти АКР, за счет которой ген ASP3 обычно остается репрессированным, использовали метод случайного мутагенеза и скрининга для отбора дрожжевых клеток, способных расти на среде с D-аспарагином, как единственным источником азота (60). Подобно всем другим известным формам жизни, Saccharomyces cerevisiae не используют D-аминокислоты. Однако связанный с клеточной стенкой фермент аспарагиназа II (ASP3) является уникальным в том, что он способен разрушать D-аспарагин, хотя и не эффективно (64). Важно отметить, что цитозольная аспарагиназа I (ASP1) не способна разрушать D-аспарагин.
Хотя рост на среде с D-аспарагином указывает на то, что ASP3 продуцируется, ген также должен экспрессироваться в условиях сильной АКР для того, чтобы быть полностью дерепрессированным. Таким образом, метод селекции также включал использование метиламина в среде. S. cerevisiae не способны утилизировать метиламин в качестве источника азота. Однако метиламин конкурирует с ионами аммония за транспортеры аммиака. Находясь в клетке, метиламин не участвует в метаболических реакциях, но вызывает сильную АКР - как в случае роста на предпочтительном для дрожжей источнике азота: аммиаке (сульфате аммония). Таким образом, метиламин является ингибитором роста (65, 66).
Культивирование клеток в среде, содержащей D-аспарагин в качестве единственного источника азота и метиламин, создает условия, в которых единственная возможность роста для клеток заключается в экспрессии ASP3, разрушении внешнего D-аспарагина и последующем поглощении высвобожденных ионов аммония. В то же время, высвобожденные ионы аммония должны конкурировать с метиламином за возможность быть использованными клеткой для роста. Таким образом, клетки с наиболее высокими уровнями экспрессии ASP3 получают селективное преимущество вследствие репрессирующих условий в ростовой среде. Важно отметить, что дрожжи не могут использовать высвобожденную D-аспарагиновую кислоту для роста.
Такой метод селекции (D-аспарагин и метиламин) ранее был использован для идентификации мутантов с дерепрессированным геном ASP3 в лабораторном штамме дрожжей (DJ2-23C) (60). Авторы отбирали мутанты ASP3, непосредственно высевая мутировавшие за счет EMS клетки на чашки с селективной средой (с 100 мМ (3,1 г/л) метиламина и 5 мМ (0,66 г/л) D-аспарагина). В результате авторам удалось обнаружить различные варианты с дерепрессированным геном ASP3. Однако при повторных попытках не удалось воспроизвести эти результаты в соответствующем производственном штамме пекарских дрожжей.
Важно отметить, что авторам оригинального исследования (Kamerud and Roon, 1986) удалось с легкостью обнаружить мутанты с дерепрессированным геном ASP3, поскольку они использовали гаплоидные лабораторные дрожжевые штаммы. В случае производственного штамма с гораздо более сложным геномом (триплоидным, тетраплоидным, анеуплоидным) обнаруживать дерепрессированные мутанты гораздо более сложно. Это происходит потому, что любые мутации с рецессивным фенотипом не будут проявляться, как они проявлялись бы в случае гаплоидного штамма. Кроме того, существует гораздо больше возможностей для возникновения эпистаза или плейотропных мутаций. По существу, любая одна полезная мутация будет амортизироваться за счет генетической избыточности. Это редко происходит с лабораторным штаммом, особенно таким, который имеет гаплоидный генетический фон.
Разработка стратегии случайного мутагенеза и адаптивной эволюции для получения уменьшающих содержание акриламида дрожжей
Поскольку к производственным пекарским дрожжам не применима стратегия однократной селекции Kamerud и Roon, метод скрининга был доработан для применения стратегии итерационной адаптивной эволюции в сочетании с несколькими раундами мутагенеза (Фигура 1). Цель этой новой стратегии заключалась в медленном постепенном увеличении давления отбора в сочетании с повторяющимся мутагенезом для того, чтобы добиться полной экспрессии ASP3 и, следовательно, разрушения аспарагина в условиях, которые в ином случае являются репрессивными. Важно отметить, что давление селективных условий, необходимых для обеспечения полной дерепрессии ASP3, должно увеличиваться медленно, поскольку конечные концентрации D-аспарагина и метиламина, используемые для селекции, полностью предотвращают рост неадаптированных дрожжей. Таким образом, только конкретное использованное сочетание случайного мутагенеза и адаптивной эволюции смогло привести к получению фенотипа AR.
Коллекцию культур коммерчески доступных производственных дрожжевых штаммов подвергали скринингу на признак роста в среде с D-аспарагином в качестве единственного источника азота. Только один производственный штамм - японский штамм пекарских дрожжей - отличался заметным ростом на среде с D-аспарагином, это указывало на наличие у него природных генов ASP3. Лабораторный штамм S288C использовали в качестве положительного контроля, поскольку известно, что он содержит ASP3.
В момент времени «ноль» штамм дикого типа начинали субкультивировать в минимальной среде, содержащей D-аспарагин (10 г/л) в качестве единственного источника азота (сахарозу в качестве источника углерода). В этой среде штамм дикого типа демонстрировал очень низкую скорость роста, и в этих условиях клетки с природными мутациями, способствующими слегка повышенной экспрессии ASP3, имели селективное преимущество. Для привнесения генетической вариабельности клетки еженедельно подвергали УФ-мутагенезу при разных дозах УФ-излучения (10-99% летальной дозы). Штамм постоянно субкультивировали (ежедневно) и снимали показания поглощения при OD600 для отслеживания относительного роста. При каждом субкультивировании клетки инокулировали в свежую среду в одном и том же исходном количестве, соответствующем OD600=0,01. Через четыре недели было отмечено, что скорость роста мутировавших дрожжей на селективной среде увеличилась до такой степени, что стала сопоставима со скоростью роста на не селективной среде. Это свидетельствовало о том, что авторы изобретения отобрали клетки с повышенной экспрессией ASP3 в не индуцирующих условиях, таким образом, получив хороший генетический фон для начала отбора дерепрессированных мутантов (в условиях сильной АКР, или не индуцирующих условиях) с максимальным потенциалом экспрессии.
Через один месяц в культуральную среду вносили метиламин для создания сильной АКР, то есть, полностью репрессивных условий для ASP3. Используя в качестве стартового материала мутантную линию, к ростовой среде добавляли минимальное количество метиламина (0,05 г/л). Это приводило к значительному снижению скорости роста клеток до уровня, который имел место, когда впервые было начато субкультивирование на селективной среде.
В течение следующих четырех месяцев наиболее быстро растущие линии подвергали постоянному субкультивированию в присутствии метиламина и еженедельному УФ-мутагенезу (как описано выше). Когда скорость роста в присутствии метиламина стала сопоставимой со скоростью роста в отсутствие метиламина, получали отдельные колонии, высевая дрожжи на твердую селективную среду, содержащую метиламин. Колонии, демонстрирующие быстрый рост (то есть, визуально растущие более быстро и имеющие наиболее крупный размер колоний в сравнении с примерным средним размером колоний на чашке), отбирали и анализировали на разрушающую L-аспарагин активность. Колонии, проявляющие высокую активность, были дополнительно субкультивированы и подвергнуты мутагенезу с постепенно возрастающими количествами метиламина (от 0,05 г/л до 12 г/л метиламина) для увеличения давления отбора и, следовательно, повышения разрушающей L-аспарагин активности. Следует отметить, что мутагенез на разных стадиях в период субкультивирования постоянно приводил к возникновению новых линий. Только те линии, которые демонстрировали улучшенную разрушающую L-аспарагин активность в сравнении с культурой непосредственного предшественника, использовали в дальнейшей работе.
В качестве контроля сохраняли линию дрожжей дикого типа, которую никогда не подвергали мутагенезу. Эта линия позволяла определить, может ли одна лишь адаптивная эволюция (без мутагенеза) быть достаточной для создания нужного фенотипа (полностью дерепрессированного гена ASP3), или приобретенный фенотип является следствием подхода эволюционной инженерии (то есть, обеспечение генетической вариабельности за счет УФ-мутагенеза для дальнейшего отбора).
AR дрожжи разрушают аспарагин в условиях АКР
Экспрессия ASP3 и, следовательно, способность пекарских дрожжей разрушать аспарагин, репрессирована в большинстве условий роста. Для максимального увеличения функциональности AR штаммов было чрезвычайно важно нарушить нормальные механизмы АКР, контролирующие экспрессию ASP3. Следовательно, AR штаммы должны разрушать аспарагин даже при выращивании в среде, богатой питательными веществами. Для тестирования функциональности адаптированных дрожжей сравнивали их способность разрушать аспарагин со способностью не адаптированного родительского штамма дикого типа.
На основании протокола адаптивной эволюции были идентифицированы три основные варианта с желательным фенотипом (рост на среде с D-аспарагином в присутствии метиламина): RBAR-01, RBAR-02 и RBAR-03. При тестировании этих штаммов на разрушающую аспарагин активность каждый из штаммов демонстрировал высокую степень разрушения аспарагина даже при выращивании в среде, богатой питательными веществами (репрессивных условиях) (Фигура 2). В сравнении со штаммом дикого типа, у которого отсутствовала какая-либо заметная активность вплоть до трех часов, и имела место лишь минимальная активность в дальнейшем (более 60% остаточного L-аспарагина), высокие уровни разрушающей L-аспарагин активности наблюдали у каждого из AR штаммов даже при анализе в течение одного часа (RBAR-01: 82% остаточного L-аспарагина через 1 час; RBAR-02: 59% остаточного L-аспарагина через 1 час; RBAR-03: 54% остаточного L-аспарагина через 1 час). Важно отметить, что RBAR-02 и RBAR-03 проявляли существенно более высокую активность на одно- и двухчасовой отметке в сравнении с контрольным ГМО штаммом, сконструированном для конститутивной экспрессии ASP3. Это свидетельствует в пользу идеи о том, что адаптивная эволюция может часто приводить к функциональным решениям, которые превосходят результаты обратной инженерии, производимой руками человека. Более того, эти данные свидетельствуют о том, что адаптивно эволюционировавшие AR дрожжи найдут более широкое применение в промышленности, где часто желательны более короткие периоды инкубации, которые имеют преимущества как с точки зрения экономики, так и продовольственной безопасности. В совокупности, Фигуры 1 и 2 показывают, что использованный протокол адаптивной эволюции привел к успешному изменению условий нормальной АКР, в результате чего AR дрожжи разрушают аспарагин даже при выращивании в богатой среде (YEG). Важно отметить, что все три AR варианта были получены из отдельных мутантных линий, таким образом, существует вероятность, что и фенотипы, и связанные механизмы действия, эволюционировали независимо.
Итерационная адаптивная эволюция является чрезвычайно важной для создания AR штаммов
Как описано ранее, стратегия однократной селекции Kamerud и Roon не применима к производственным штаммам пекарских дрожжей. Таким образом, была разработана новая стратегия итерационной адаптивной эволюции для получения AR штаммов со способностью к разрушению L-аспарагина. Целью этой новой стратегии являлось медленное постепенное увеличение давления отбора в сочетании с повторяющимся мутагенезом с целью достижения достаточного генетического разнообразия для обеспечения полной экспрессии гена ASP3 и, следовательно, разрушения аспарагина в условиях, которые в ином случае являются репрессивными.
Для подтверждения необходимости этого итерационного процесса для получения AR штаммов рост конечных AR штаммов, а также их родительского штамма, тестировали при разной степени давления отбора. Штаммы высевали на минимально селективную среду (YEG+D-аспарагин), умеренно селективную среду, используемую Kamerud и Roon (YEG+D-аспарагин+3,1 г/л метиламина), и высокоселективную среду, используемую в данном исследовании (YEG+D-аспарагин+12 г/л метиламина). Как и ожидалось, все штаммы росли одинаково хорошо в не селективных условиях (Фигура 3, левая чашка), но только AR штаммы были способны расти в самых сильных селективных условиях (Фигура 3, правая чашка). В соответствии с предыдущими результатами, родительский штамм был способен расти в умеренно селективных условиях, хотя и более медленно, чем адаптивно эволюционировавшие AR штаммы (Фигура 3, средняя чашка). Эти отличия роста являются показателем эволюционных изменений AR штаммов, позволяющих им успешно расти в более высокоселективной среде. В совокупности, эти данные подчеркивают необходимость итерационного увеличения давления отбора для отбора успешного генетического разнообразия (эволюции) с течением времени. Действительно, только этот итерационный подход позволил получить производственные штаммы пекарских дрожжей, которые способны к росту в высокоселективных условиях и, как следствие, приобретают уникальный AR фенотип.
AR дрожжевые штаммы представляют собой функционально отличающееся, эволюционно адаптированное потомство штамма дикого типа
Направленная адаптивная эволюция позволяет высоко специфически создавать новые фенотипы (например, конститутивное разрушение аспарагина). После демонстрации эволюционировавшего фенотипа AR штаммов (Фигуры 2 и 3) было важно убедиться, что эти штаммы действительно являются потомками штамма дикого типа, а не каким-либо примесным штаммом, который был привнесен в процессе культивирования. Для подтверждения линейного происхождения AR штаммов (RBAR-01, RBAR-02 и RBAR-03) использовали ПЦР-фингерпринтинг областей интер-дельта для типирования каждого AR штамма относительно родителя дикого типа. Дельта-последовательности, которые фланкируют ретротранспозоны TY1 и TY2, распределены по всему геному дрожжей. Вследствие высокой частоты мутаций в этих ретротранспозонах амплификация интер-дельта последовательностей приводит к получению смеси полос разного количества и размера, которые можно использовать для идентификации конкретных дрожжевых штаммов (61). Фингерпринтинг областей интер-дельта RBAR-01, RBAR-02 и RBAR-03 при амплификации показал наличие идентичного количества, распределения по размерам и относительной интенсивности полос в сравнении со штаммом дикого типа (Фигура 4, сравните дорожки 3, 4, 5 и 6). Это свидетельствует о том, что все адаптированные AR штаммы происходят из одного и того же родительского штамма, вследствие чего, вполне вероятно, что они будут иметь аналогичные свойства, например, кинетику роста, жизнеспособность и пригодность для использования в хлебопекарной промышленности. Важно отметить, что штамм дикого типа и AR штаммы при типировании отличались от не родственного штамма S288C и разрушающих аспарагин контрольных ГМО дрожжевых штаммов (Фигура 4, дорожки 1 и 7).
AR штаммы конститутивно экспрессируют аспарагиназу II, а также разрушают L-аспарагин
Система АКР дрожжей позволяет клеткам утилизировать сложные источники азота максимально возможным эффективным образом. То есть, если доступно несколько источников разного качества, АКР регулирует экспрессию необходимых для катаболизма генов таким образом, что клетки предпочтительно утилизируют наиболее качественный доступный источник, прежде чем перейти к следующему источнику. Действительно, богатая ростовая среда, такая как YEG, содержит комплексную смесь различных источников азота, включая аммоний, свободные аминокислоты, пептиды и белки. Как следствие, при росте дрожжей в среде YEG количество и качество доступных источников азота, а также активность АКР, постоянно изменяется. Следовательно, хотя AR штаммы проявляют повышенную способность к разрушению L-аспарагина при выращивании в течение ночи в среде YEG (Фигура 2), сохраняется вероятность того, что разрушение аспарагина будет ограничено конкретным азотным окружением в данный момент времени.
Для тестирования того, являлась ли экспрессия гена ASP3, и последующая разрушающая L-аспарагин активность, специфичной для конкретного момента времени или конститутивной, был поставлен длительный эксперимент, в котором образцы дрожжей отбирали на протяжении 24-часового периода времени. После начального культивирования в течение ночи одинаковое количество клеток каждого штамма инокулировали в свежую культуральную среду YEG и выращивали в течение 24 часов. Образцы из каждого штамма отбирали с шестичасовыми интервалами для измерения разрушения L-аспарагина (стандартный 1-часовой анализ), а также экспрессии гена ASP3 методом кПЦР.
Как показано на Фигуре 5A, все штаммы росли со сравнимыми скоростями, что позволяло собирать равные количества клеток в каждой временной точке.
Что касается разрушения L-аспарагина, и RBAR-02, и RBAR-03, были способны полностью разрушать L-аспарагин за указанный период времени (менее 10% остаточного L-аспарагина), в то время как RBAR-01 продемонстрировал умеренную способность катаболизировать L-аспарагин в течение того же периода времени (в среднем 60% остаточного L-аспарагина). Важно отметить, что штамм дикого типа не демонстрировал какого-либо заметного разрушения L-аспарагина ни в один из моментов времени на протяжении эксперимента (Фигура 5B). Примечательно, что эти данные согласуются с данными по разрушению L-аспарагина, представленными ранее на Фигуре 2.
При анализе экспрессии ASP3 все AR штаммы демонстрировали конститутивную экспрессию ASP3 (Фигура 5C). В среднем, для всех временных точек RBAR-01, RBAR-02 и RBAR-03 экспрессировали в 4,7, 9,6 и 10,5 раз больше ASP3, чем штамм дикого типа, соответственно (Фигура 5C). Интересно, что относительная величина конститутивной экспрессии отражала способность каждого штамма к разрушению L-аспарагина на протяжении всего периода времени (сравните Фигуры 5B и 5C). И наконец, экспрессия ASP1 во всех штаммах AR не изменялась в сравнении со штаммом дикого типа (Фигура 5D), свидетельствуя о том, что наблюдаемое разрушение L-аспарагина является результатом действия связанной с клеточной стенкой аспарагиназы II (ASP3), а не цитозольной аспарагиназы I (ASP1). В совокупности, эти данные также указывают на то, что AR штаммы конститутивно экспрессируют ASP3 и конститутивно разрушают L-аспарагин вследствие их адаптивной эволюции.
AR штаммы демонстрируют повышенную и уникальную кинетику аспарагиназы II
Катаболизм аспарагина приводит к образованию аспарагиновой кислоты и аммиака, оба из которых могут превращаться в придающие посторонний привкус продуктам соединения, такие как пиразины, в процессе обработки пищевых продуктов при высокой температуре. Таким образом, в некоторых вариантах применения, относящихся к приготовлению пищевых продуктов, может быть полезно использовать AR дрожжи с субмаксимальными уровнями активности аспарагиназы II для того, чтобы избежать образования придающих посторонний привкус продуктам соединений. Для тестирования кинетики аспарагиназы II в каждом AR дрожжевом штамме ночные культуры инокулировали в среду YEG, содержащую L-аспарагин, до фиксированного количества клеток. Затем отбирали образцы с 30-минутными интервалами и анализировали остаточное содержание L-аспарагина. Хотя все три AR штамма разрушали L-аспарагин в сравнении с контролем дикого типа, кинетика разрушения L-аспарагина отличалась у AR штаммов (Фигура 6). Более конкретно, RBAR-01 имел более низкую скорость разрушения L-аспарагина в сравнении с RBAR-02 и RBAR-03 (RBAR-01: 82% остаточного L-аспарагина через 90 мин), в то время как RBAR-02 и RBAR-03 действовали примерно одинаково (RBAR-02: 54% остаточного L-аспарагина через 90 мин; RBAR-03: 66% остаточного L-аспарагина через 90 мин). Эти данные согласуются с данными по разрушению L-аспарагина, представленными на Фигуре 2, и в совокупности с остальными данными свидетельствуют в пользу особого фенотипа адаптивно эволюционировавших AR дрожжей.
AR штаммы отличаются дифференциальной генной экспрессией АКР-регулируемых генов
В силу своего неотъемлемого неспецифического характера, случайный мутагенез и адаптивная эволюция обладают способностью изменять экспрессию многих разных генов, помимо интересующего гена. Определив, что AR дрожжевые штаммы действительно конститутивно экспрессируют ASP3 и разрушают L-аспарагин в присутствии качественных источников азота, в условиях, в которых в иной ситуации АКР была бы активна (Фигуры 2, 5, и 6), авторы изобретения решили провести глобальный анализ профиля экспрессии генов AR дрожжей.
Для этого, фиксированное количество клеток из ночных культур инокулировали в свежую среду YEG, и культуры инкубировали в течение шести часов. Затем из образцов экстрагировали суммарную РНК и конструировали библиотеки для секвенирования РНК из обратно транскрибированных кДНК (поли dT примирование). Секвенирование выполняли на платформе Illumina HiSeq2500 с высокой пропускной способностью в конфигурации парных прочтений с длиной прочтения 2×100 п.н.
В среднем, было получено 67,5 миллионов прочтений для каждого штамма, что равняется 6818 мегабаз и примерно 560-кратному покрытию (предполагая гаплоидный геном размером 12 Мб). Данные секвенирования, как правило, были очень высокого качества, с 94% показателей Q, превышающих или равных 30, и средним показателем Q, равным 37.
Первичные прочтения для каждого штамма были обработаны и отфильтрованы по качеству (показатель Q выше или равен 30) перед картированием на эталонный геном S288C. В среднем, 97,6% прочтений были успешно выровнены. Выровненные прочтения использовали для составления для каждого гена количества прочтений, которые затем создавали основу для анализа дифференциальной экспрессии генов (ДЭГ). Для каждого AR штамма рассчитывали log2 кратности изменения экспрессии каждого гена относительно контроля дикого типа (Фигура 7). Гены с величиной показателей кратности изменения, превышающей 1,5, и по меньшей мере 100 единицами счета для дикого типа, считали дифференциально экспрессированными (ДЭ). На Фигуре 8A и в Таблице 8 приведено сравнение уровней экспрессии ДЭГ в каждом AR штамме. Согласно этому критерию для ДЭГ, 81 (1,6%), 73 (1,4%) и 84 (1,6%) ДЭГ (из 5121 проверенных ОРС в S288C) наблюдали в каждом из RBAR-01, RBAR-02 и RBAR-03, соответственно. Более того, 50 из 113 (44,2%) ДЭГ были общими для всех трех штаммов, при этом 75 (66,4%) ДЭГ были общими для по меньшей мере двух из AR штаммов (Фигура 8B). При анализе секвенирования РНК ASP3 был в числе генов с максимальной повышающей регуляцией в каждом из AR штаммов (Таблица 8). Действительно, регуляция ASP3 была повышена в 4,9, 7,8 и 8,9 раз в RBAR-01, RBAR-02 и RBAR-03, соответственно, что согласовалось с данными по разрушению L-аспарагина и данными кПЦР, представленными на Фигурах 5B и 5C.
Помимо ASP3, анализ ДЭГ выявил существенную дифференциальную регуляцию многих генов, связанных с АКР (Фигура 9A). В общей сложности 15 (19,0%), 15 (19,0%) и 17 (21,2%) из 79 известных АКР-контролируемых генов были дифференциально экспрессированы в RBAR-01, RBAR-02 и RBAR-03, соответственно. Все эти изменения имели высокую статистическую значимость согласно точному критерию Фишера (p ≤0,0001).
И наконец, для анализа затронутых генетических путей и сетей в AR дрожжах с глобальной точки зрения также проводили онтологический анализ генов ДЭГ в каждом из AR штаммов (Таблица 9). Хотя многие биологические процессы, клеточные компартменты и молекулярные функции были в значительной степени затронуты, наиболее очевидным было массовое нарушение регуляции транспорта питательных веществ в AR штаммах, особенно аминокислотного транспорта (Фигура 9A, Таблицы 8 и 9). Действительно, многие из особо выдающихся ДЭГ (как с повышающей, так и с понижающей регуляцией) представляли собой ферменты пермеазы, включая UGA4, GAP1, MEP2, DAL4, DAL5, PUT4, OPT2, HXT5, HXT4, HXT10, HXT11, HXT14, HXT9, MUP1, TAT1, MUP3 и GNP1 (Фигура 9A и Таблица 8).
В совокупности, эти данные указывают на то, что адаптивно эволюционировавшие AR дрожжи демонстрируют профили генной экспрессии с существенной дифференциальной экспрессией генов в сравнении с их не эволюционировавшим родительским штаммом. Кроме того, основные затронутые пути в AR дрожжах включают контроль АКР и аминокислотный транспорт.
Суммарную РНК выделяли из штамма дикого типа и AR дрожжевых штаммов (RBAR-01, RBAR-02 и RBAR-03) во время экспоненциального роста в среде YEG. Библиотеки для секвенирования РНК (TruSeq v3), полученные из суммарной РНК, были секвенированы на платформе Illumina HiSeq2500 с высокой пропускной способностью в конфигурации парных прочтений с длиной прочтения 2×100 п.н. Первичные прочтения фильтровали в отношении качества и картировали на эталонный геном S288C. Значения log2 кратности изменений (относительно дикого типа) рассчитывали для каждой из 6604 дрожжевых ОРС (проверенных, не охарактеризованных и сомнительных). Дифференциально экспрессированные гены определяли на основании следующих критериев: ≥ | 1,5 | log2 кратности изменения и ≥ 100 единиц счета в дрожжах дикого типа. Смотри Таблицу 8.
Таблица 8. Дифференциально экспрессированные гены в AR дрожжевых штаммах
a Кратность изменения
Дифференциально экспрессированные гены, приведенные в Таблице 8, анализировали путем ГО анализа представленности групп генов (Таблица 9). p-значения для представленности групп генов скорректированы методом Холма-Бонферрони для множественных проверок гипотез.
Таблица 9. Генно-онтологический (ГО) анализ представленности групп генов в AR дрожжевых штаммах
aДиффренциально экспрессированные гены
AR штаммы генетически отличаются от своего адаптивно не эволюционировавшего родительского штамма
Фундаментальный принцип, регулирующий адаптивную эволюцию, заключается в накоплении мутаций, которые коллективно обеспечивают организму преимущества в приспособлении к конкретному окружению. После отбора AR штаммов на основании способности к конститутивному разрушению L-аспарагина (Фигуры 1, 2, 5 и 6) и идентификации подгрупп соответствующих ДЭГ в AR штаммах (Фигуры 7, 8 и 9) авторы изобретения решили исследовать AR штаммы на дифферецировочные мутации по всему геному. Для этого выделяли геномную ДНК из каждого AR штамма, а также родительского штамма, и создавали библиотеки для секвенирования ДНК. Секвенирование выполняли на платформе Illumina MiSeq в конфигурации парных прочтений с длиной прочтения 2×300 п.н.
В среднем, было получено 4,05 миллионов прочтений для каждого штамма, что равняется 2430 мегабаз и примерно 203-кратному покрытию (предполагая гаплоидный геном размером 12 Мб). Данные секвенирования, как правило, были очень высокого качества, с 84% показателей Q, превышающих или равных 30, и средним показателем Q, равным 35.
Первичные прочтения для каждого штамма были обработаны и отфильтрованы по качеству (показатель Q выше или равен 30) перед картированием на эталонный геном S288C. В среднем, 96,12% прочтений были успешно выровнены. Картированные прочтения были использованы для создания совокупности статистических данных и консенсусных последовательностей для каждого основания в геноме. Затем эту информацию сравнивали с эталонным геномом и аннотировали мутации на основании эталонной последовательности S288C. В завершение, идентифицированные мутации в AR штаммах фильтровали относительно тех, которые были идентифицированы также и в штамме дикого типа, для удаления излишних мутаций. Чтобы увеличить статистическую мощность для идентификации мутаций, данные секвенирования РНК, исходно полученные для ДЭГ, также использовали для определения мутаций. Поскольку геном дрожжей является примерно на 72% кодирующим, набор данных секвенирования РНК обеспечивает хорошее покрытие основной части дрожжевого генома.
Суммарные статистические данные для анализа мутаций приведены в Таблицах 10 и 11. Сравнение перекрывающихся мутаций между AR штаммами приведены на Фигуре 10. Интересно, что 15918 из 21047 (75,6%) мутаций были общими для всех трех штаммов, при этом 17571 (83,5%) были общими для по меньшей мере двух AR штаммов (Фигура 10).
Геномную ДНК выделяли из штамма дикого типа и AR дрожжевых штаммов (RBAR-01, RBAR-02 и RBAR-03). Библиотеки для секвенирования ДНК (Nextera XT), полученные из геномной ДНК, были секвенированы на платформе Illumina MiSeq в конфигурации парных прочтений с длиной прочтения 2×300 п.н. Первичные прочтения фильтровали в отношении качества и картировали на эталонный геном S288C. Совокупности прочтений использовали для определения вариантов по каждому нуклеотиду относительно консенсусной последовательности S288C. Варианты в AR дрожжевых штаммах фильтровали относительно вариантов в штамме дикого типа для удаления излишних мутаций. Смотри Таблицу 10.
Таблица 10. Совокупные данные по всем мутациям, идентифицированным в базах данных секвенирования ДНК и секвенирования РНК
Таблица 11. Разбивка по типам мутаций в AR штаммах. Мутации, приведенные в Таблице 10, классифицированы по их типу.
a Промоторы, определенные по положению от -1000 до -1 относительно сайта начала транскрипции
bСайт связывания фактора транскрипции
cОднонуклеотидный вариант
Поскольку случайный мутагенез и адаптивная эволюция не отличаются конкретной направленностью, возможно, что подавляющее большинство мутаций, идентифицированных в AR штаммах, являются лишними для AR фенотипа, то есть, конститутивной экспрессии ASP3 и разрушения L-аспарагина. Таким образом, наиболее логичным местом для возникновения важных мутаций являются положения внутри кодирующих областей соответствующих генов или промоторов указанных генов. Важно отметить, что для того, чтобы мутации в кодирующей области влияли на функцию белка, они должны затрагивать структуру белка, то есть, последовательность. Аналогично, чтобы мутации в области промотора влияли на экспрессию гена, очевидно, что они должны иметь место в сайтах связывания фактора транскрипции (ССФТ). Следовательно, как синонимичные экзонные однонуклеотидные варианты (ОНВ), так и межгенные мутации и мутации промотора не в ССФТ, могут быть отфильтрованы. В совокупности, эти критерии фильтрования оставляют 8469 (4894 ССФТ и 3575 экзонных), 8324 (4792 ССФТ и 3532 экзонных), а также 8350 (4862 ССФТ и 3488 экзонных) мутаций-кандидатов в RBAR-01, RBAR-02 и RBAR-03, соответственно. Таким образом, очевидно, что адаптивная эволюция AR штаммов привела к изменениям последовательности ДНК штаммов, тем самым позволив им преодолеть АКР репрессию гена ASP3 и конститутивно разрушать L-аспарагин.
AR штаммы уменьшают образование акриламида в хлебе и тостах
Акриламид образуется в хлебе, когда свободный аспарагин реагирует с восстанавливающими сахарами при температурах выше 120°C. Важно отметить, что восстанавливающие сахара в хлебе находятся в избытке относительно аспарагина; таким образом, уровни AA в хлебе сильно коррелируют с содержанием аспарагина (26, 67-69). Более того, хорошо известно, что уровни AA в хлебе сильно увеличиваются при изготовлении тостов, когда непрореагировавший аспарагин внутри буханок подвергается воздействию высоких температур (21). Таким образом, удаление аспарагина из всей буханки перед обжариванием чрезвычайно важно для общего уменьшения потенциального образования AA в хлебе.
После установления того, что AR дрожжевые штаммы конститутивно экспрессируют ASP3 и разрушают L-аспарагин (Фигуры 2, 5 и 6), следующей задачей было определение того, можно ли использовать эти штаммы для уменьшения содержания AA в хлебе. Для этого, белый и цельнозерновой хлеб был изготовлен либо с дрожжами дикого типа, либо с AR штаммами RBAR-01, RBAR-02 и RBAR-03, и уровни AA были проанализированы как в выпеченном хлебе, так и в тостах (Фигура 11). Во всех образцах хлеба, изготовленного с дрожжами дикого типа, уровни AA находились в диапазоне 30-67 частей на миллиард (ppb). Напротив, все образцы хлеба, изготовленного с AR дрожжевыми штаммами, имели почти не поддающиеся обнаружению уровни AA (<10 ppb), что соответствует примерному среднему уменьшению содержания AA на 80%. В соответствии с известным влиянием нагревания на уровни AA четкую положительную корреляцию наблюдали между степенью обжаривания хлеба и уровнями AA во всех образцах хлеба, изготовленного со всеми дрожжевыми штаммами. В среднем, слабое, среднее и сильное обжаривание приводило к увеличению содержания AA в 3, 5 и 7 раз, соответственно (Фигура 11). Однако в тостах, полученных с использованием AR штаммов, уровни AA были существенно ниже, со средним уменьшением содержания AA на 75-85%. В большинстве случаев уровни AA в обжаренном хлебе, изготовленном с использованием AR штаммов, были ниже, чем в не обжаренном хлебе, изготовленном с использованием штамма дикого типа (Фигура 10). Следует отметить, что эти результаты и условия являются репрезентативными для более чем 10 независимых экспериментов. В совокупности, эти результаты свидетельствуют в пользу использования AR дрожжевых штаммов, как надежного и органичного способа снижения уровней AA в хлебе и тостах.
AR штаммы уменьшают образование акриламида в картофеле фри
Поскольку пищевые продукты из картофеля богаты как аспарагином, так и восстанавливающими сахарами, они, как правило, имеют одни из самых высоких уровней содержания AA (12). Таким образом, после установления того, что AR дрожжевые штаммы конститутивно экспрессируют ASP3 и разрушают L-аспарагин (Фигуры 2, 5 и 6), а также их способности к существенному уменьшению уровней AA в хлебе и тостах (Фигура 11), следующей задачей было определение того, можно ли использовать эти штаммы для уменьшения содержания AA в картофеле фри. Хотя дрожжи не являются ингредиентом в картофеле фри, при его приготовлении обычно используют этапы замачивания в воде. Таким образом, идея заключалась в том, что замачивание картофеля в смеси воды и дрожжей перед обжариванием может привести к уменьшению содержания AA в картофеле фри - за это время дрожжи разрушили бы аспарагин на поверхности картофеля, что привело бы к уменьшению количества AA.
Для проверки этой идеи анализировали уровни AA в картофеле фри, изготовленном из картофеля сорта Russet, замоченного только в воде или в растворах, содержащих воду и дрожжи, либо дрожжи дикого типа, либо AR штаммы RBAR-01, RBAR-02 и RBAR-03 (Фигура 12). В соответствии с высоким содержанием в картофеле сахара и аспарагина, не обработанный дрожжами контрольный картофель фри имел высокие уровни AA - 440 ppb. Напротив, все AR дрожжевые штаммы были способны существенно уменьшать содержание AA в картофеле фри (в среднем, 71% уменьшения - 127 ppb), при этом штамм RBAR-03 приводил к уменьшению на 77% (100 ppb). Интересно, что дрожжевой штамм дикого типа был способен уменьшать содержание AA в картофеле фри на 55% (200 ppb) в сравнении с контролем без использования дрожжей. Вероятно, причиной этого была природная способность дрожжей ферментировать сахар. Действительно, в большинстве пищевых продуктов, в которых образуется AA, то есть, продуктах не из картофеля, аспарагин является лимитирующим реагентом при образовании AA. Однако в картофеле аспарагин и восстанавливающие сахара присутствуют примерно в эквимолярных количествах (70), таким образом, ограничение по восстанавливающим сахарам является эффективной мерой для ограничения содержания AA в картофеле. Однако известно, что уровни восстанавливающих сахаров и аспарагина варьируются в зависимости от сорта картофеля, сезона и условий хранения (70). Вследствие этого, эффективность дрожжей дикого типа, которые способны лишь потреблять сахар и лишь при благоприятных условиях обработки, например, достаточном периоде времени для контакта, для уменьшения содержания акриламида в картофельных продуктах будет варьироваться. Следовательно, AR дрожжевые штаммы, благодаря их способности разрушать аспарагин, способны существенно и воспроизводимо уменьшать уровни AA не только за счет простой ферментации сахаров.
Для дополнительного тестирования AR дрожжей в условиях относительно короткого времени контакта и высокой температуры авторы изобретения приготовили нарезанный картофель, как описано выше, и вымачивали его только в воде или в смеси воды и AR дрожжей (только RBAR-03) в течение 50 секунд при 68°C. Как показано на Фигуре 13, авторы изобретения наблюдали зависимую от дозы связь между используемым количеством AR дрожжей и наблюдаемым уменьшением содержания акриламида. В протестированных условиях AR дрожжи в наименьшей концентрации (100 г/л) были способны уменьшать содержание акриламида на 19% (1002 ppb в сравнении с 1240 ppb). Однако при использовании AR дрожжей в концентрации 250 г/л наблюдалось значительное уменьшение содержания акриламида, составляющее 49% (632 ppb в сравнении с 1240 ppb). Интересно, что авторы изобретения не наблюдали никакого существенного преимущества при использовании AR дрожжей в концентрации 300 г/л, это свидетельствовало о том, что 50% может быть максимальной степенью уменьшения содержания акриламида в протестированных условиях. Однако в других, более оптимизированных условиях уменьшение содержания акриламида за счет AR дрожжей может быть значительно выше. Следует отметить, что эти результаты и условия являются репрезентативными для нескольких независимых экспериментов. В совокупности, эти данные указывают на то, что AR дрожжи эффективны для уменьшения содержания AA в картофеле фри и, в более широком смысле, в жареных продуктах, приготовленных из сырого картофеля.
AR штаммы уменьшают образование акриламида в гранулированной легкой закуске
После установления полезности AR штаммов для уменьшения содержания AA в продуктах из свежего картофеля (Фигура 14), их эффективность была протестирована при изготовлении легкой закуски из картофельной муки. Для этого готовили экструдированную и обжаренную легкую закуску на основе картофеля, либо с дрожжами дикого типа, либо с AR штаммами RBAR-01, RBAR-02 и RBAR-03, и в процессе обработки анализировали уровни аспарагина, кроме того измеряли уровни AA в конечном обжаренном продукте (Фигура 14). Что касается аспарагина, в сравнении как с контролем без дрожжей, так и с дрожжами дикого типа, все AR штаммы были способны разрушать аспарагин (Фигура 14A). Более конкретно, RBAR-01 и RBAR-03 потребляли весь аспарагин в грануле закуски при обработке в течение всего лишь 30 минут. Напротив, разрушающая аспарагин активность у штамма RBAR-02 была менее надежной в этой пищевой модели - имело место уменьшение на 45% через 60 минут. Однако эта активность была заметна в сравнении с контролем без использования дрожжей или с использованием дрожжей дикого типа.
В отношении уменьшения содержания AA, все AR штаммы были эффективными. В среднем, AR штаммы уменьшали содержание AA на 75% (в среднем, 100 ppb против 400 ppb - Фигура 14B). В соответствии с их продемонстрированной превосходной способностью разрушать аспарагин в этой пищевой модели, RBAR-01 и RBAR-03 позволяли достигать самых низких уровней содержания AA, с уменьшением содержания на 82 и 85% (70 и 60 ppb), соответственно (Фигура 14B). Интересно, что, в отличие от ситуации с картофелем фри, дрожжи дикого типа были неспособны уменьшать уровни AA в грануле легкой закуски. Вероятно, это было результатом присутствия в смеси для легкой закуски не содержащих аспарагин ингредиентов (картофельного крахмала и мальтодекстрина). Эти ингредиенты значительно увеличивают содержание в смеси восстанавливающих сахаров, тем самым делая аспарагин лимитирующим реагентом для образования AA в грануле легкой закуски. Как следствие, ферментирующая сахара активность дрожжей не эффективна для уменьшения содержания AA. Следует отметить, что эти результаты и условия являются репрезентативными для нескольких независимых экспериментов. В совокупности, эти данные подтверждают, что AR дрожжи могут быть с успехом использованы для уменьшения содержания AA в экструдированных обжаренных пищевых продуктах из картофельной муки.
AR штаммы уменьшают образование акриламида в сладком печенье
После установления полезности AR штаммов для уменьшения содержания AA в хлебе и тостах, продуктах из свежего картофеля и продуктах из переработанного картофеля (Фигуры 11, 12, 13 и 14), их эффективность была протестирована при изготовлении сладкого печенья.
Для этого было изготовлено сладкое печенье с использованием либо дрожжей дикого типа, либо AR штаммов RBAR-01, RBAR-02 и RBAR-03, и проанализированы уровни AA в конечном обжаренном продукте (Фигура 15). В сравнении с контролем без использования дрожжей все AR штаммы были способны уменьшать уровни AA в конечном продукте (среднее уменьшение 69% - в среднем, 103 ppb против 330 ppb), при этом штамм RBAR-03 был наиболее эффективным (уменьшение 79% - 70 ppb против 330 ppb). Как и в ситуации с картофелем фри (Фигура 12), было отмечено, что дрожжи дикого типа были способны уменьшать содержание AA в некоторой степени (уменьшение 30% - 230 ppb против 330 ppb), что, скорее всего, являлось следствием ферментативной активности. Однако AR штаммы обладали гораздо более высокой способностью к уменьшению содержания AA вследствие их способности к разрушению аспарагина. Следует отметить, что эти результаты и условия являются репрезентативными для нескольких независимых экспериментов. В совокупности, эти данные свидетельствуют о том, что AR дрожжи эффективны для уменьшения содержания AA в сладком печенье.
AR штаммы уменьшают образование акриламида в кренделях
После установления полезности AR штаммов для уменьшения содержания AA в хлебе и тостах, продуктах из свежего картофеля, продуктах из переработанного картофеля и сладком печенье (Фигуры 11, 12, 13, 14 и 15) их эффективность была протестирована при изготовлении кренделей. Крендели, как правило, содержат высокие уровни AA из-за процесса промывания гидроксидом натрия, используемого для увеличения потемнения в процессе приготовления - действительно, образование AA ускоряется при высоких значениях pH.
Крендели готовили либо с дрожжами дикого типа, либо с AR штаммами RBAR-01, RBAR-02 и RBAR-03, и уровни AA анализировали в конечном продукте (Фигура 16). В сравнении с дрожжами дикого типа все AR штаммы обладали превосходной способностью к уменьшению уровней AA в конечном продукте (среднее уменьшение 98% - в среднем, <5 ppb против 200 ppb). Следует отметить, что эти результаты и условия являются репрезентативными для нескольких независимых экспериментов. В совокупности, эти данные свидетельствуют о том, что AR дрожжи высокоэффективны для уменьшения содержания AA в кренделях.
AR дрожжи уменьшают содержание аспарагина и образование акриламида в кофе
После установления полезности AR штаммов для уменьшения содержания AA в хлебе и тостах, продуктах из свежего картофеля, продуктах из переработанного картофеля, сладком печенье и кренделях (Фигуры 11, 12, 13, 14, 15 и 16) их эффективность была протестирована для кофе. В качестве первого доказательства правильности гипотезы тестировали штамм дикого типа и AR дрожжевой штамм RBAR-03 при ферментации измельченных зеленых кофейных бобов (Фигура 17). В сравнении с контролем без использования дрожжей штамм дикого типа уменьшал содержание AA на 52% (191 ppb против 394 ppb), предположительно, вследствие ферментации восстанавливающих сахаров в бобах. Однако AR штамм RBAR-03 с его способностью к потреблению как сахара, так и аспарагина, уменьшал содержание AA на 92% (32 ppb против 394 ppb).
Поскольку AR дрожжи были способны уменьшать содержание AA при нанесении непосредственно на измельченные зеленые кофейные бобы (Фигура 17), далее способность AR дрожжей уменьшать содержание аспарагина тестировали в водном экстракте зеленых кофейных бобов. Такие экстракты, после истощения по интересующим соединениям, например, аспарагину или кофеину, могут быть использованы для избирательного удаления данного соединения из зеленых кофейных бобов перед обжариванием. Если удалять аспарагин таким образом, в полученном обжаренном кофе содержание AA будет снижено.
Как показано на Фигуре 18, AR дрожжи (RBAR-03) способны уменьшать содержание L-аспарагина в GCE (18% сухого вещества) зависимым от времени и концентрации образом. При максимальной концентрации AR дрожжей (109 клеток/мл) более 95% L-аспарагина было потреблено в течение 30 минут (340 г/100 г L-аспарагина, время=0, против 13,1 г/100 г L-аспарагина, время=30 мин), в то время как при использовании промежуточной концентрации (108 клеток/мл) такой результат был достигнут через 90 минут (340 г/100 г L-аспарагина, время=0, против 10,5 г/100 г L-аспарагина, время=30 мин). При самой низкой концентрации AR дрожжей (107 клеток/мл) потребление L-аспарагина было неполным, с уменьшением содержания лишь на 43% за 150 минут (340 г/100 г L-аспарагина, время=0, против 195 г/100 г L-аспарагина, время=150 мин). Следует отметить, что эти результаты и условия являются репрезентативными для нескольких независимых экспериментов. В совокупности, эти данные подтверждают, что AR штаммы, обладающие способностью разрушать L-аспарагин, способны эффективно уменьшать содержание L-аспарагина и AA в кофе.
Выводы
Несмотря на насущную потребность в более эффективных способах уменьшения содержания AA, современные способы либо недостаточно эффективны, либо являются сложными для применения с технической, логистической и финансовой точек зрения. Для решения этой проблемы была разработана новая технология уменьшения содержания AA, основанная на использовании пекарских дрожжей. Использование дрожжей для уменьшения содержания AA в пищевых продуктах является идеальным решением, поскольку 1) дрожжи уже являются природным пищевым ингредиентом, имеющим долгую историю использования людьми; 2) дрожжи имеют статус «в целом, считающихся безопасными» (GRAS) согласно FDA США или международным эквивалентам в большинстве юрисдикций по всему миру; 3) дрожжи уже являются основным ингредиентом во многих пищевых продуктах, содержание AA в которых представляет серьезную проблему, например, в хлебе; 4) AR дрожжи могут быть использованы для промежуточной обработки тех пищевых продуктов, содержание AA в которых является проблемой, например, картофельных продуктов, изделий из дробленого зерна, легких закусок и кофе; 5) наращивание дрожжей обходится дешево, и они просты в обращении и 6) большинство коммерческих производителей пищевых продуктов уже имеют опыт работы с дрожжами. Кроме того, будучи адаптивно эволюционировавшими из штамма пекарских дрожжей, AR дрожжевые штаммы могут просто и легко заменить пекарские дрожжи во всех существующих процессах выпечки, поскольку для использования AR дрожжей не требуется внесения никаких изменений в существующие технологии хлебобулочного производства, будь то производство хлеба или любого ферментированного дрожжами выпеченного продукта.
Как описано в данном документе, использование не генетически модифицированных, адаптивно эволюционировавших AR штаммов пекарских дрожжей, которые конститутивно экспрессируют связанную с клеточной стенкой аспарагиназу II ASP3 (Фигуры 2, 5 и 6), является надежным и высокоэффективным решением проблемы содержания AA в пищевых продуктах. AR дрожжевые штаммы способны существенно уменьшать уровни аспарагина в различных пищевых продуктах на величину вплоть до 95% с минимальными затратами времени и изменениями технологии обработки (Фигуры 11, 12, 13, 14, 15, 16, 17 и 18); для пищевых продуктов, где дрожжи уже являются ингредиентом, не требуется никакого изменения технологии.
За счет существенного разрушения аспарагина в пищевых продуктах перед тепловой обработкой данная технология позволяет предотвращать образование AA независимо от последующих процессов обработки продуктов, то есть, AR штаммы уменьшают потенциал для образования AA в пищевых продуктах. Это устраняет необходимость в многоэтапной стратегии контроля и уменьшения содержания AA, включающей измерение широкого спектра параметров и широкомасштабное вмешательство, осуществление которой является сложным с логистической и технической точек зрения, чрезвычайно затратным и трудным для регулирования (например, при приготовлении пищи дома и в ресторане).
Подводя итоги, была использована адаптивная эволюция для разработки новых, не-ГМО штаммов пекарских дрожжей, которые конститутивно экспрессируют связанную с клеточной стенкой аспарагиназу II (ASP3) и разрушают L-аспарагин, приводя к уменьшению уровней AA в самых разных общеупотребительных пищевых продуктах. AR штаммы способны уменьшать уровни AA в хлебе и других ферментируемых дрожжами продуктах, продуктах из картофеля, экструдированных легких закусках, сладком печенье, кренделях и кофе на величину вплоть до 95%.
Хотя настоящее изобретение описано со ссылкой на то, что в настоящее время считается примерами, следует понимать, что изобретение не ограничено описанными примерами. Напротив, изобретение должно охватывать различные модификации и эквивалентные схемы, находящиеся в пределах сущности и объема прилагаемой формулы изобретения.
Все публикации, патенты и патентные заявки включены в настоящий документ посредством ссылки в полном объеме в той же степени, как если было бы специально и индивидуально указано, что каждая отдельная публикация, патент или патентная заявка включена посредством ссылки в полном объеме.
Источники информации
1. Besaratinia A, Pfeifer GP. 2007. A review of mechanisms of acrylamide carcinogenicity. Carcinogenesis 28:519-528.
2. Exon JH. 2006. A Review of the Toxicology of Acrylamide. Journal of Toxicology and Environmental Health, Part B 9:397-412.
3. Capuano E, Fogliano V. 2011. Acrylamide and 5-hydroxymethylfurfural (HMF): A review on metabolism, toxicity, occurrence in food and mitigation strategies. LWT - Food Science and Technology 44:793-810.
4. Shipp A, Lawrence G, Gentry R, McDonald T, Bartow H, Bounds J, Macdonald N, Clewell H, Allen B, Van Landingham C. 2006. Acrylamide: review of toxicity data and dose-response analyses for cancer and noncancer effects. Crit. Rev. Toxicol. 36:481-608.
5. Besaratinia A, Pfeifer GP. 2004. Genotoxicity of acrylamide and glycidamide. J. Natl. Cancer Inst 96:1023-1029.
6. Rice JM. 2005. The carcinogenicity of acrylamide. Mutation Research/Genetic Toxicology and Environmental Mutagenesis 580:3-20.
7. Mottram DS, Wedzicha BL, Dodson AT. 2002. Acrylamide is formed in the Maillard reaction. Nature 419:448-449.
8. Stadler RH, Blank I, Varga N, Robert F, Hau J, Guy PA. 2002. Food chemistry: acrylamide from Maillard reaction products. Nature 419:449-450.
9. Tareke E, Rydberg P, Karlsson P, Eriksson S, Törnqvist M. 2002. Analysis of Acrylamide, a Carcinogen Formed in Heated Foodstuffs. Journal of Agricultural and Food Chemistry 50:4998-5006.
10. Normandin L, Bouchard M, Ayotte P, Blanchet C, Becalski A, Bonvalot Y, Phaneuf D, Lapointe C, Gagné M, Courteau M. 2013. Dietary exposure to acrylamide in adolescents from a Canadian urban center. Food and Chemical Toxicology 57:75-83.
11. Chen Y-H, Xia E-Q, Xu X-R, Ling W-H, Li S, Wu S, Deng G-F, Zou Z-F, Zhou J, Li H-B. 2012. Evaluation of Acrylamide in Food from China by a LC/MS/MS Method. IJERPH 9:4150-4158.
12. Wenzl T, Anklam E. 2007. European Union database of acrylamide levels in food: Update and critical review of data collection. Food Additives and Contaminants 24:5-12.
13. Mojska H, Gielecińska I, Szponar L, Ołtarzewski M. 2010. Estimation of the dietary acrylamide exposure of the Polish population. Food and Chemical Toxicology 48:2090-2096.
14. Tran NL, Barraj LM, Murphy MM, Bi X. 2010. Dietary Acrylamide Exposure and Hemoglobin Adducts â€ʺ National Health and Nutrition Examination Survey (2003â€ʺ04). Food and Chemical Toxicology 48:3098-3108.
15. Sirot VR, Hommet F, Tard A, Leblanc J-C. 2012. Dietary acrylamide exposure of the French population: Results of the second French Total Diet Study. Food and Chemical Toxicology 50:889-894.
16. Zhou PP, Zhao YF, Liu HL, Ma YJ, Li XW, Yang X, Wu YN. 2013. Dietary exposure of the Chinese population to acrylamide. Biomed. Environ. Sci. 26:421-429.
17. Mojska H, Gielecińska I, Stoś K. 2012. Determination of acrylamide level in commercial baby foods and an assessment of infant dietary exposure. Food and Chemical Toxicology 50:2722-2728.
18. Cengiz MF, Gündüz CPB. 2013. Acrylamide exposure among Turkish toddlers from selected cereal-based baby food samples. Food and Chemical Toxicology 60:514-519.
19. Bent G-A, Maragh P, Dasgupta T. 2012. Acrylamide in Caribbean foods â€ʺ Residual levels and their relation to reducing sugar and asparagine content. Food Chemistry 133:451-457.
20. Pelucchi C, Bosetti C, Galeone C, La Vecchia C. 2014. Dietary acrylamide and cancer risk: An updated meta-analysis. Int. J. Cancer 136:2912-2922.
21. Jackson LS, Al-Taher F. 2005. Effects of consumer food preparation on acrylamide formation. Advances in Experimental Medicine and Biology 561:447-465.
22. Fredriksson H, Tallving J, Rosén J, Åman P. 2004. Fermentation reduces free asparagine in dough and acrylamide content in bread. Cereal Chemistry 81:650-653.
23. Bråthen E, Kita A, Knutsen SH, Wicklund T. 2005. Addition of Glycine Reduces the Content of Acrylamide in Cereal and Potato Products. Journal of Agricultural and Food Chemistry 53:3259-3264.
24. Fink M, Andersson R, Rosén J, Åman P. 2006. Effect of Added Asparagine and Glycine on Acrylamide Content in Yeast-Leavened Bread. Cereal Chemistry 83:218-222.
25. Gökmen V, Palazoğlu TK. 2007. Acrylamide Formation in Foods during Thermal Processing with a Focus on Frying. Food Bioprocess Technol 1:35-42.
26. Amrein TM, Schönbächler B, Escher F, Amadò R. 2004. Acrylamide in Gingerbread: Critical Factors for Formation and Possible Ways for Reduction. Journal of Agricultural and Food Chemistry 52:4282-4288.
27. Claus A, Schreiter P, Weber A, Graeff S, Herrmann W, Claupein W, Schieber A, Carle R. 2006. Influence of Agronomic Factors and Extraction Rate on the Acrylamide Contents in Yeast-Leavened Breads. Journal of Agricultural and Food Chemistry 54:8968-8976.
28. Claus A, Mongili M, Weisz G, Schieber A, Carle R. 2008. Impact of formulation and technological factors on the acrylamide content of wheat bread and bread rolls. Journal of Cereal Science 47:546-554.
29. Chawla R, Shakya R, Rommens CM. 2012. Tuber-specific silencing of asparagine synthetase-1 reduces the acrylamide-forming potential of potatoes grown in the field without affecting tuber shape and yield. Plant Biotechnology Journal 10:913-924.
30. Ye J, Shakya R, Shrestha P, Rommens CM. 2010. Tuber-Specific Silencing of the Acid Invertase Gene Substantially Lowers the Acrylamide-Forming Potential of Potato. Journal of Agricultural and Food Chemistry 58:12162-12167.
31. Rommens CM, Yan H, Swords K, Richael C, Ye J. 2008. Low-acrylamide French fries and potato chips. Plant Biotechnology Journal 6:843-853.
32. Cooper TG. 1982. Nitrogen metabolism in S. cerevisiae, pp. 39-99. In J.N. Strathern, EWJ (ed.), The molecular biology of the yeast: metabolism and gene expression. Cold Spring Harbor Press, New York.
33. Jones GE. 1977. Genetic and physiological relationships between L-asparaginase I and asparaginase II in Saccharomyces cerevisiae. Journal of Bacteriology 130:128-130.
34. League GP, Slot JC, Rokas A. 2012. The ASP3 locus in Saccharomyces cerevisiae originated by horizontal gene transfer from Wickerhamomyces. FEMS Yeast Research 12:859-863.
35. Sinclair K, Warner JP, Bonthron DT. 1994. The ASP1 gene of Saccharomyces cerevisiae, encoding the intracellular isozyme of L-asparaginase. Gene 144:37-43.
36. Kim KW, Kamerud JQ, Livingston DM, Roon RJ. 1988. Asparaginase II of Saccharomyces cerevisiae. Characterization of the ASP3 gene. Journal of Biological Chemistry 263:11948-11953.
37. Dunlop PC, Meyer GM, Roon RJ. 1980. Nitrogen catabolite repression of asparaginase II in Saccharomyces cerevisiae. Journal of Bacteriology 143:422-426.
38. Huang Y-C, Chen H-T, Teng S-C. 2010. Intragenic transcription of a noncoding RNA modulates expression of ASP3 in budding yeast. RNA (New York, N.Y.) 16:2085-2093.
39. Pauling KD, Jones GE. 1980. Asparaginase II of Saccharomyces cerevisiae: Dynamics of Accumulation and Loss in Rapidly Growing Cells. J. Gen. Microbiol. 117:423-430.
40. Roon RJ, Murdoch M, Kunze B, Dunlop PC. 1982. Derepression of asparaginase II during exponential growth of Saccharomyces cerevisiae on ammonium ion. Arch. Biochem. Biophys. 219:101-109.
41. Ferrara MA, Mattoso JMV, Bon EPS, Pereira N. 2004. Kinetics of asparaginase II fermentation in Saccharomyces cerevisiae ure2dal80 mutant: effect of nitrogen nutrition and pH. Applied Biochemistry and Biotechnology 113-116:299-305.
42. Hofman-Bang J. 1999. Nitrogen catabolite repression in Saccharomyces cerevisiae. Molecular biotechnology 12:35-73.
43. Derkx PM, Janzen T, Sørensen KI, Christensen JE, Stuer-Lauridsen B, Johansen E. 2014. The art of strain improvement of industrial lactic acid bacteria without the use of recombinant DNA technology. Microb. Cell Fact. 13:S5.
44. Pedersen MB, Iversen SL, Sørensen KI, Johansen E. 2005. The long and winding road from the research laboratory to industrial applications of lactic acid bacteria. FEMS microbiology reviews 29:611-624.
45. Margolles A, Sanchez B. 2012. Selection of a Bifidobacterium animalis subsp. lactis Strain with a Decreased Ability To Produce Acetic Acid. Applied and Environmental Microbiology 78:3338-3342.
46. Saarela M, Alakomi HL, Mättö J, Ahonen AM, Puhakka A, Tynkkynen S. 2011. Improving the storage stability of Bifidobacterium breve in low pH fruit juice. International Journal of Food Microbiology 149:106-110.
47. Smith J, van Rensburg E, Görgens JF. 2014. Simultaneously improving xylose fermentation and tolerance to lignocellulosic inhibitors through evolutionary engineering of recombinant Saccharomyces cerevisiae harbouring xylose isomerase. BMC Biotechnol. 14:41.
48. Bachmann H, Starrenburg MJC, Molenaar D, Kleerebezem M, van Hylckama Vlieg JET. 2012. Microbial domestication signatures of Lactococcus lactis can be reproduced by experimental evolution. Genome research 22:115-124.
49. guez JOV-R, Shi S, Siewers V, Nielsen J. 2014. Metabolic engineering of Saccharomyces cerevisiae for production of fatty acid ethyl esters, an advanced biofuel, by eliminating non-essential fatty acid utilization pathways. APPLIED ENERGY 115:226-232.
50. Callanan MJ, Beresford TP, Ross RP. 2005. Genetic Diversity in the Lactose Operons of Lactobacillus helveticus Strains and Its Relationship to the Role of These Strains as Commercial Starter Cultures. Applied and Environmental Microbiology 71:1655-1658.
51. Çakar ZP, Turanlı-Yıldız B, Alkım C, Yılmaz Ü. 2011. Evolutionary engineering of Saccharomyces cerevisiae for improved industrially important properties. FEMS Yeast Res 12:171-182.
52. Winkler JD, Kao KC. 2014. Recent advances in the evolutionary engineering of industrial biocatalysts. Genomics 104:406-411.
53. Stanley D, Fraser S, Chambers PJ, Rogers P, Stanley GA. 2009. Generation and characterisation of stable ethanol-tolerant mutants of Saccharomyces cerevisiae. Journal of Industrial Microbiology and Biotechnology 37:139-149.
54. Liu E, Hu Y. 2010. Construction of a xylose-fermenting Saccharomyces cerevisiae strain by combined approaches of genetic engineering, chemical mutagenesis and evolutionary adaptation. Biochemical Engineering Journal 48:204-210.
55. Stroman P, Muller CC, Sorensen KI. 2003. Heat Shock Treatment Increases the Frequency of Loss of an Erythromycin Resistance-Encoding Transposable Element from the Chromosome of Lactobacillus crispatus CHCC3692. Applied and Environmental Microbiology 69:7173-7180.
56. Dragosits M, Mattanovich D. 2013. Adaptive laboratory evolution: principles and applications for biotechnology. Microb. Cell Fact. 12:1-1.
57. Gresham D, Usaite R, Germann SM, Lisby M, Botstein D, Regenberg B. 2010. Adaptation to diverse nitrogen-limited environments by deletion or extrachromosomal element formation of the GAP1 locus. Proceedings of the National Academy of Sciences of the United States of America 107:18551-18556.
58. Hong J, Gresham D. 2014. Molecular Specificity, Convergence and Constraint Shape Adaptive Evolution in Nutrient-Poor Environments. PLoS genetics 10:e1004041-16.
59. WATANABE T, IEFUJI H, KITAMOTO HK. 2013. Genome-wide screening to study breeding methods to improve the nitrogen accumulation ability of yeast without gene recombinant techniques. Bioscience, biotechnology, and biochemistry 77:917-922.
60. Kamerud JQ, Roon RJ. 1986. Asparaginase II of Saccharomyces cerevisiae: selection of four mutations that cause derepressed enzyme synthesis. Journal of Bacteriology 165:293-296.
61. Tristezza M, Gerardi C, Logrieco A, Grieco F. 2009. An optimized protocol for the production of interdelta markers in Saccharomyces cerevisiae by using capillary electrophoresis. Journal of Microbiological Methods 78:286-291.
62. Hoffman CS, Winston F. 1987. A ten-minute DNA preparation from yeast efficiently releases autonomous plasmids for transformation of Escherichia coli. Gene 57:267-272.
63. Köhrer K, Domdey H. 1991. Preparation of high molecular weight RNA. Methods in enzymology 194:398-405.
64. Dunlop PC, Roon RJ, Even HL. 1976. Utilization of D-asparagine by Saccharomyces cerevisiae. Journal of Bacteriology 125:999-1004.
65. Roon RJ, Even HL, Dunlop P, Larimore FL. 1975. Methylamine and ammonia transport in Saccharomyces cerevisiae. Journal of Bacteriology 122:502-509.
66. Roon RJ, Levy JS, Larimore F. 1977. Negative interactions between amino acid and methylamine/ammonia transport systems of Saccharomyces cerevisiae. Journal of Biological Chemistry 252:3599-3604.
67. Keramat J, LeBail A, Prost C, Jafari M. 2010. Acrylamide in Baking Products: A Review Article. Food Bioprocess Technol 4:530-543.
68. Capuano E, Ferrigno A, Acampa I, Serpen A, Açar ÖÇ, Gökmen V, Fogliano V. 2009. Effect of flour type on Maillard reaction and acrylamide formation during toasting of bread crisp model systems and mitigation strategies. FRIN 42:1295-1302.
69. Surdyk N, Rosén J, Andersson R, Åman P. 2004. Effects of Asparagine, Fructose, and Baking Conditions on Acrylamide Content in Yeast-Leavened Wheat Bread. Journal of Agricultural and Food Chemistry 52:2047-2051.
70. Halford NG, Curtis TY, Muttucumaru N, Postles J, Elmore JS, Mottram DS. 2012. The acrylamide problem: a plant and agronomic science issue. Journal of Experimental Botany 63:2841-2851.
71. Ljungdahl PO, Daignan-Fornier B. 2012. Regulation of amino acid, nucleotide, and phosphate metabolism in Saccharomyces cerevisiae. Genetics 190:885-929.
Реферат
Предложен способ выделения производственного дрожжевого штамма, экспрессирующего аспарагиназу клеточной стенки и обладающего уменьшающей содержание аспарагина активностью в не индуцирующих условиях, включающий повторные циклы адаптивной эволюции и мутагенеза, с последующей селекцией штамма. Также предложены производственные дрожжевые штаммы Saccharomyces cerevisiae, полученные указанным способом и экспрессирующие аспарагиназу клеточной стенки, обладающие уменьшающей содержание аспарагина активностью в не индуцирующих условиях. Вышеуказанные дрожжи используют для уменьшения содержания аспарагина в процессе приготовления или обработки пищевых продуктов. 6 н. и 25 з.п. ф-лы, 18 ил., 11 табл.

Комментарии