Лекарственное средство и способ лечения нарушений врожденного иммунного ответа - RU2671832C1
Код документа: RU2671832C1
Чертежи




Описание
Область техники и сущность изобретения
Настоящее изобретение относится к лекарственному средству или диетической добавке, включающей аспергиллоглутамил-пептидазу из Aspergillus niger, которая способна к гидролизу растительных пищевых аллергенов, а более конкретно, ингибиторов альфа-амилазы/трипсина, тем самым позволяя лечить заболевания, обусловленные врожденным иммунным ответом у человека, и/или позволяя отсрочить проявления указанных заболеваний. Настоящее изобретение относится к открытию того, что аспергиллоглутамил-пептидаза из Aspergillus niger способна гидролизовать ингибиторы альфа-амилазы/трипсина, которые присутствуют в пшенице и родственных злаках, где указанные ингибиторы являются сильными индукторами врожденного иммунного ответа. Кроме того, настоящее изобретение относится к способу гидролиза ингибиторов альфа-амилазы/трипсина, включающему инкубацию композиции для употребления в качестве продукта питания, содержащей ингибиторы альфа-амилазы/трипсина, с аспергиллоглутамил-пептидазой из Aspergillus niger, где ингибиторы подвергаются гидролизу. Оно также относится к ферментной композиции, включающей аспергиллоглутамил-пептидазу из Aspergillus niger и дополнительный фермент, и к продукту питания, включающему аспергиллоглутамил-пептидазу из Aspergillus niger.
Предшествующий уровень техники
Растительные диетические аллергены являются широко распространенной группой растительных белков, включающих надсемейства купинов и проламинов, а также белковые молекулы защитной системы растений. Надсемейство проламинов включает несколько важных типов аллергенов бобовых, орехов, зерновых, фруктов и овощей, а также ингибиторы альфа-амилазы и протеазы зерновых. Проламины зерновыхых являются основными запасными белками в эндосперме семян зерновых и носят название глютенины и глиадииы в пшенице, секалины во ржи и гордеины в ячмене. Белковые ингибиторы альфа-амилазы являются не-глютеновыми белками. На основании структурного сходства, среди белковых ингибиторов альфа-амилазы растительного происхождения, как правило, выделяют шесть семейств, включающих лектин-иодобные, кноттин-подобные, СМ-белки, Кунитц-подобные, с-пуротиоиин-подобные, и тауматин-подобные (Richardson, 1990). СМ (хлороформ-метанол)-белки - большое семейство белков из семян зерновых культур, содержащих от 120 до 160 аминокислотных остатков, и пять дисульфидных связей. В них присутствует типичный двунаправленный домен альфа-амилазы/трипсина. Этот признак дает им возможность ингибировать активность альфа-амилазы и трипсиноподобных ферментов. Ингибитор альфа-амилазы 0.19 является одним из наиболее изученных ингибиторов этого семейства; он имеет широкую специфичность, и ингибирует альфа-амилазы насекомых, птиц и млекопитающих.
Кроме того, растительные защитные белки также включают ингибиторы иротеаз. Большинство органов хранения растений, таких как семена и клубни, содержат 1-10% от общего количества белков в качестве ингибиторов протеаз с различными биохимическими и структурными свойствами ингибирования различных типов протеаз. Белковые ингибиторы классифицируют на основе типа фермента, который они ингибируют: ингибиторы сериновых иротеаз, ингибиторы цистеиновых протеаз, ингибиторы аспарагиновых протеаз или ингибиторы металлокарбокси-протеаз.
В документе WO 2011/137322 недавно показано, что члены семейства неглютеновых ингибиторов альфа-амилазы/трипсина, содержащиеся в пшенице и родственных злаках, являются сильными индукторами врожденного иммунного ответа в тонкой кишке человека, таким образом, способствуя развитию таких заболеваний, как целиакия. Кроме того, ингибиторы альфа амилазы/трипсина также являются ключевыми факторами, способствующими развитию таких заболеваний или патологических состояний, как гиперчувствителыюсть к глютену, синдром раздраженного кишечника, воспалительное заболевание кишечника, а также внекишечное воспаление.
Целиакия, также известная как целиакия-спру, глютеновая энтеропатия или непереносимость глютена, является одной из наиболее частых пищевых непереносимостей во всем мире, с самым высоким уровнем распространенности в Европе, Северной и Южной Америке, и в Австралии. Целиакия представляет собой воспалительное заболевание верхних отделов тонкой кишки у генетически предрасположенных лиц, вызванное употреблением в пищу пшеницы, ячменя, ржи и их перекрестно связанных разновидностей, приводящее к синдрому мальабсорбции.
Глютен является основным пищевым белком, присутствующим в пшенице, ячмене, ржи, и их перекрестно связанных сортах. Глютен представляет собой сложную смесь из богатых глутамином и пролином глютениновых и проламиновых молекул, которые, как полагают, являются фактором, ответственным за индукцию целиакии у чувствительных человеческих индивидуумов. Из-за их необычной структуры с высоким содержанием пролина и глутамина, белки глютена частично устойчивы к кишечным ферментам, что приводит к наличию некоторых не подвергшихся деградации иммуногенных пептидов, которые могут восприниматься иммунной системой кишечника. Употребление таких белков чувствительными людьми производит к уплощению эпителиальной выстилки тонкой кишки, в нормальном состоянии пышной и подобной ковру, которая, как известно, отвечает за эффективное и экстенсивное терминальное расщепление пептидов и других питательных веществ. Клинические симптомы целиакии-спру включают утомляемость, хроническую диарею, нарушение усвоения питательных веществ, потерю веса, вздутие живота, анемию, а также существенно повышенный риск развития остеопороза и злокачественных опухолей кишечника (лимфомы и карциномы). Заболевание имеет частоту около 1 на 200 среди населения Европы и Северной Америки.
В настоящее время основным лечением непереносимости глютена является постоянное строгое исключение глютена из диеты, что трудновыполнимо. Однако важно выделить две категории непереносимость глютена для понимания того, как на болезнь влияет действие фермента в кишечнике. Целиакия-спру является аутоиммунным состоянием, генетическим воспалительным заболеванием тонкого кишечника. Когда белки глютена разрушаются в процессе пищеварения, они фрагментируются. Эти белковые фрагменты называются пептидами. У больных целиакией неадекватный иммунный ответ в тонком кишечнике инициируется одним типом пептидов, что приводит к повреждению клеток тонкой кишки.
Второй тип непереносимости глютена возникает, когда кишечник поврежден чем-либо иным, чем целиакия; например отрицательный эффект бактериальной или дрожжевой инфекции приводит к потере кишечных ферментов, что в свою очередь ведет к ухудшению переваривания глютена. Хотя ферментативная поддержка может быть полезна для больных целиакией, они должны оставаться на строго безглютеновой диете из-за возможной силы аутоиммунной реакции, когда следовые количества глютена остаются непереваренными.
Использование специфических ферментов в качестве добавки может быть эффективным для минимизации потребности в безглютеновой диете у тех лиц, которые подвержены риску развития непереносимости глютена, у чувствительных к глютену индивидуумов, или при непереносимости глютена из-за повреждения кишечника.
Использование экзогенных протеолитических ферментов для детоксикации глютена является одной из наиболее перспективных стратегий лечения целиакии. Такие ферменты могут быть использованы как для предварительной обработки муки, содержащей глютен, так и в качестве добавок. Пролил-эндопептидазы известны как ферменты, расщепляющие глютен, которые, как было показано, расщепляют глиадиновые пептиды (WO 2002/45524 и WO 2002/46381).
В WO 2011/137322 описано применение антител против альфа-амилазы СМ3 для лечения пациентов с целиакией, или для обработки пищевых композиций, а также рассматривается использование протеазы в качестве альтернативы. Тем не менее, в документе ничего не говорится о специфической ферментативной обработке для эффективного гидролиза ингибиторов альфа-амилазы/трипсина в желудочно-кишечном тракте или для предварительной обработки пищевых продуктов, полученных из пшеницы, ячменя, ржи и их перекрестно связанных сортов.
Индолины и пуротионины составляют группу богатых серой и основных низкомолекулярных белков, которые присутствуют в эндосперме некоторых зерновыхых. Например, идентичность последовательности альфа-пуртионинов из пшеницы, ржи и ячменя составляет более 80%. Пуртионин является членом семейства аллергенов, обозначенным Всемирной организацией здравоохранения - Международным Союзом иммунологических обществ, как «Tri а 37», и может представлять собой диагностический маркер для повышенного риска анафилаксии, индуцированной пшеницей (Pahr et al, J Allergy Cin Immunol., 132 (4), pp 1000-1003).
Необходимо обеспечить безопасный, эффективный и экономически конкурентоспособный способ деградации ингибиторов альфа-амилазы/триисина в желудочно-кишечном тракте, а также в пищевых композициях, содержащих такие ингибиторы; для лечения целиакии, повышения желудочно-кишечного комфорта у лиц с целиакией или чувствительностью к глютену, не связанной с целиакией, или для задержки появления желудочно-кишечного дискомфорта у здоровых людей, не чувствительных к глютену, путем снижения воздействия на кишечник растительных аллергенов, и более конкретно, ингибиторов альфа-амилазы/трипсина, таких как СМ3 и 0.19. Применение в соответствии с настоящим изобретением, не только решает проблему чувствительности к глютену/аллергии, но также позволяет стабилизировать пену при использовании с целью деградации ингибиторов амилазы и трипсина в пиве.
Раскрытие изобретения
Неожиданно авторы настоящего изобретения обнаружили, что фермент аспергиллоглутамил-пептидаза из Aspergillus niger имеет большой потенциал к гидролизу растительных аллергенов, таких как ингибиторы альфа-амилазы/трипсина в желудочно-кишечном тракте индивидуума, а также в пищевом матриксе, содержащем указанные ингибиторы, и следовательно, может быть использована в качестве лекарственного средства, диетической добавки, в предварительной обработке продуктов питания или в процессе приготовления выпекаемого продукта.
Таким образом, настоящее изобретение относится к диетической добавке или фармацевтической композиции, включающей аспергиллоглутамил-пептидазу из Aspergillus niger, пролил-эндопептидазу, и фармацевтически или диетически пригодные вспомогательные вещества. Аспергиллоглутамил-пептидаза из Aspergillus niger (AGP), которая раньше называлась аспергиллопепсином II, выделенная из Aspergillus niger var. macrosporus (EC 3.4.23.19), представляет собой уникальную протеазу, принадлежащую к семейству пептидаз А4. Этот фермент не гомологичен аспарагинововым протсазам, принадлежащим к пептидазам семейства А1, которые являются типичными пепсиноподобными кислыми протеазами, что делает их нечувствительными к специфическим ингибиторам, таким как пепстатин А. Поэтому этот фермент был также классифицирован как «пепстатин-нечувствительная» кислая протеиназа. Среди известных к настоящему времени глутаминовых пептидаз, AGP характерна тем, что она является единственным двухцепочечным ферментом. Аминокислотная последовательность фермента не имеет гомологии с типичными аспарагиновыми протеиназами.
Термин «аспергиллоглутамил-пептидаза из Aspergillus niger» в соответствии с настоящим изобретением включает ферменты, имеющие по меньшей мере 70% идентичности аминокислотной последовательности с аспергиллоглутамил-пептидазой из Aspergillus niger (UniProtKB/Swiss-Prot, идентификатор Р24665), например фермент, имеющий, по меньшей мере 80, 85, 90, 95, 98, 99% идентичности с Р24665. Наиболее предпочтительными гомологичными ферментами по настоящему изобретению являются сциталоглутамилпептидаза из Scytalidium lignicolum, кислые пептидазы В и С из Crypphoneclria parasitica, и кислая протеаза из Sclerotina sclerotiorum.
Аспергиллоглутамил-пептидаза из Aspergillus niger в диетической добавке или фармацевтической композиции, как описано в настоящей заявке, может присутствовать в чистом виде, либо в виде препарата, содержащего аспергиллоглутамил-пептидазу из Aspergillus niger, где по меньшей мере 40%, 50%, 60%, 70%, 80%, 90%, 95% или более от активности протеазы получено из аспергиллоглутамил-пептидазы из Aspergillus niger, где активность выражают в HPU (гистидиновых протеазных единицах); одна HPU является количеством фермента, гидролизующим количество гемоглобина в минуту, которое дает раствор с оптической плотностью при 275 нм, равной оптической плотности раствора, содержащего 1 мкг L-тирозина на мл в 0,1 М растворе НСl. Условия испытания: рН 1,75, температура 40°С, концентрация гемоглобина во время инкубации 16,7 г/л.
Активность (HPU/мл)=(ОПобр. - ОПконтр./S)×11/30; где
ОПобр.: оптическая плотность образца фильтрата (275 нм)
ОПконтр.: оптическая плотность образца чистого фильтрата (275 нм)
S: ОП стандартного раствора L-тирозина 1,1 мкг/мл (мл/мкг)
30: Время инкубации (мин)
11: общий объем реакционной смеси (мл).
Аспергиллоглутамил-пептидаза из Aspergillus niger в соответствии с настоящим изобретением может быть получена, как описано в «HIandbook of Proteolytic Enzymes», A.J. Barret, N.D. Rawlings, and J.F. Woessner eds.; Academic Press («Руководство по протеолитическим ферментам»); или в РСТ/ЕР 2013/066899.
Термин «фармацевтическая композиция» относится к лекарственному средству или лекарству, в то время как термин «диетическая добавка» относится к небольшому количеству активного вещества для добавления в рацион человека, упакованному в виде одной дозы или множества доз. Диетические добавки, как правило, не обеспечивают значительного количества калорий, но могут содержать другие питательные микронутриенты, такие как минералы и витамины.
Диетическая добавка или фармацевтическая композиция согласно настоящему изобретению дополнительно содержит фармацевтически пригодные вспомогательные вещества. «Вспомогательные вещества» являются наполнителями, носителями или разбавителями, включая воду, желатин любого происхождения, растительные камеди, лигнинсульфонат, тальк, сахара, крахмал, целлюлозу, микрокристаллическую целлюлозу, аравийскую камедь, растительные масла, полиалкиленгликоли, вкусоароматические агенты, консерванты, стабилизаторы, эмульгаторы, буферы, лубриканты, красители, смачивающие агенты, наполнители и тому подобное, но не ограничиваясь ими. Материал-носитель может быть органическим или неорганическим инертным материалом-носителем, пригодным для перорального/парентерального/инъекционного введения.
В настоящем изобретении диетическая добавка или фармацевтическая композиция аспергиллоглутамил-пептидазы из Aspergillus niger содержит от 1 до 100 HPU единиц аспергиллоглутамил-пептидазы из Aspergillus niger, предпочтительно от 10 до 50 HPU на порцию.
Кроме того, диетическая добавка или фармацевтическая композиция согласно настоящему изобретению дополнительно содержит пролил-эндопептидазу. Пролил-эндопептидаза млекопитающих является большим цитозольным ферментом, принадлежащим к отдельному классу сериновых пептидаз. Впервые она была описан в цитозоле мозга кролика как олигопептидаза, которая расщепляет нонапептидный брадикинин по связи пролин-фенилаланин. Фермент участвует в созревании и дирадации пептидных гормонов и нейропептидов, таких как альфа-меланоцит-стимулирующий гормон, рилизинг-фактор лютеинизирующего гормона (LH-RH), тиреотропин-рилизинг-гормон, ангиотензин, нейротензин, окситоцин, вещество Р и вазопрессип.Пролил-олигопептидаза расщепляет пептидные связи на С-концевой стороне остатков пролина. Ее активность сводится к действию на олигопептиды менее 10 кД и имеет абсолютное требование к гране-конфигурации пептидной связи предыдущего пролина.
Наиболее предпочтительной пролил-эндопептидазой в соответствии с настоящим изобретением является грибковый фермент пролил-эндопептидаза из Aspergillus niger (AN-PEP). AN-PEP может быть получена из DSM Food Specialties (Делфт, Нидерланды). Сочетание AN-PEP и AGP позволяет использовать одну диетическую добавку или фармацевтическую композицию в обоих аспектах глютеновой непереносимости/гиперчувствительности путем предоставления ферментов для гидролиза ингибиторов и альфа-амилазы, и трипсина, а также эпитопов глютена в желудочно-кишечном тракте. В таком случае, диетическая добавка или фармацевтическая композиция содержит от 10'000 до 100'000 PPI единиц (Protease Picomole International) фермента пролил-эндопептидазы. Пролин-протеазная единица (PPU) определяется как количество фермента, которое высвобождает 1 мкмоль п-нитроанилида в минуту при 37°С в цитратном/динатрий фосфатном буфере (рН 4,6) с использованием 0,37 мМ Z-Гли-Про-пара-нитроанилида (Bachem, Будендорф, Швейцария) в качестве субстрата.
Диетическая добавка или фармацевтическая композиция согласно настоящему изобретению может также дополнительно содержать аспергиллопеисин I. Аспергиллопепсин I (ЕС 3.4.23.18), также называемый кислотной протеазой Aspergillus, катализирует гидролиз белков с широкой специфичностью. Она, как правило, предпочитает гидрофобные остатки в Р1 и Р1', но также использует Лиз в Р1, что приводит к активации трипсиногена. Подходящий аспергиллопепсин I для всех вариантов осуществления настоящего изобретения может быть выделен из Aspergillus niger, Aspergillus saitoi и Trichoderma reesei. Предпочтительно, аспергиллопепсин I в соответствии с настоящим изобретением выделяют из Aspergillus niger. В таком случае, диетическая добавка или фармацевтическая композиция содержит от 1 до 1000 единиц HPU фермента аспергиллопепсин I, более предпочтительно, от 1 до 100 единиц HPU на порцию.
Диетическая добавка или фармацевтическая композиция согласно настоящему изобретению может быть в любой галеновой форме, которая подходит для введения человеку, но предпочтительны твердые или жидкие пероральные формы, например, в твердой форме, такие как диетические добавки, таблетки, пилюли, гранулы, драже, капсулы, жевательные составы и шипучие составы, такие как порошки и таблетки.
Диетические добавки и фармацевтические композиции могут быть изготовлены в форме составов для контролируемого (замедленного) высвобождения.
Во всех вариантах осуществления настоящего изобретения диетическая добавка или фармацевтическая композиция в соответствии с настоящим изобретением предпочтительно находится в форме таблетки, капсулы, саше, или любой другой лекарственной формы, в том числе жидкой лекарственной формы. Более предпочтительно, она находится в форме таблетки или капсулы. Капсулы, таблетки или саше или другие лекарственные формы могут находиться в контейнере, который может иметь любую обычную форму. Например, лекарственные формы могут быть помещены в банку, бутылку, жестяную коробку, чашку, дозатор, саше или тому подобное, где содержатся лекарственные формы в заданном количестве, например, с 30-дневным запасом, 60-дневным запасом, 90-дневным запасом, или в любом необходимом количестве. В дополнение и факультативно, капсулы могут быть в блистерной упаковке, в которой каждый блистер содержит заранее определенное количество капсул, обычно разовую дозу (обычно 1-4 капсулы). Компоновка количества капсул в блистере, количество блистеров на одной полосе блистерной упаковки, и количество полос блистерной упаковки, которые продаются в группе, могут быть представлены любыми подходящими количествами или конфигурациями.
Диетические или фармацевтические композиции в соответствии с настоящим изобретением могут дополнительно содержать защитные гидроколлоиды (такие как камеди, белки, модифицированные крахмалы), связующие агенты, пленкообразующие агенты, инкапсулирующие агенты/материалы, материалы стенки/оболочки, матриксные соединения, покрытия, эмульгаторы, поверхностно-активные агенты, солюбилизирующие агенты (масла, жиры, воски, лецитины и т.п.), адсорбенты, носители, наполнители, сопутствующие соединения, диспергирующие агенты, смачивающие агенты, технологические средства (растворители), текучие агенты, маскирующие вкус агенты, утяжелители, желирующие агенты, гелеобразующие агенты, антиоксиданты и противомикробные средства.
В контексте настоящего изобретения фармацевтическая композиция продается по рецепту или без рецепта врача, в то время как диетическая добавка должна продаваться без рецепта врача, и должна рассматриваться в качестве пищи.
В другом варианте осуществления настоящее изобретение также относится к диетической добавке или фармацевтической композиции, включающей аспергиллоглутамил-пептидазу из Aspergillus niger для применения в качестве лекарственного средства. Таким образом, настоящее изобретение относится к применению диетической добавки или фармацевтической композиции, включающей аспергиллоглутамил-пептидазу из Aspergillus niger, в качестве лекарственного средства для лечения заболеваний. Предпочтительно, лекарственное средство предназначено для лечения пациента, страдающего от врожденного иммунного ответа в тонкой кишке. Еще более предпочтительно, лекарственное средство предназначено для лечения целиакии, непереносимости глютена без целиакии, чувствительности к глютену, синдрома раздраженного кишечника или воспалительного заболевания кишечника. Наиболее предпочтительно, лекарственное средство является диетической добавкой для поддержания или повышения желудочно-кишечного комфорта у индивидуумов, чувствительных к глютену, или для задержки появления желудочно-кишечного дискомфорта у лиц с целиакией или не связанной с целиакией чувствительностью к глютену, а также для уменьшения воздействия ингибиторов альфа-амилазы/трипсина у здоровых людей, тем самым поддерживая пищеварение. Ингибиторы альфа-амилазы/трипсина, которые разрушаются под действием данной композиции, являются растительными аллергенами: СМ 2, СМ 3, СМ 16 и 0.19, более предпочтительно, СМ 3 и 0.19, на основе их быстрой деградации с помощью аспергиллоглутамил-пептидазы Aspergillus niger. Идентификатором аминокислотной последовательности СМ 3 является SwissProt Р01083, в то время как идентификатором аминокислотной последовательности 0.19 является SwissProt Р01085.
Лекарственное средство или диетическая добавка в соответствии с настоящим изобретением предназначена для использования индивидуумами, которым необходимо снизить риск развития диетической аллергии на растительный белок, и которые испытывают желудочно-кишечный дискомфорт, связанный с целиакией-спру, а также непереносимостью глютена, не связанной с целиакией.
В предпочтительном варианте осуществления лекарственное средство применяют перорально в пределах 1 часа до или после приема пищи.
«Желудочно-кишечный комфорт» - занимает центральное место в качестве жизни. Развитие комфорта желудочно-кишечного пищеварения включает в себя регуляцию времени прохождения через желудочно-кишечный тракт и облегчение боли, связанной с пищеварением, и связанных с ним заболеваний.
«Не связанная с целиакией чувствительность к глютену» - Не связанная с целиакией чувствительность к глютену была введена для описания тех людей, которые не переносят глютен и испытывают симптомы, похожие на целиакию, но все же не имеют антитела и повреждения кишечника, характерные для целиакии. Не связанная с целиакией чувствительность к глютену является еще одной формой непереносимости глютена, где иммунный ответ менее охарактеризован. Не связанная с целиакией чувствительность к глютену разделяет многие симптомы с целиакией. Однако, в соответствии с Sapone et al. (2012), у индивидуумов с не связанной с целиакией чувствительностью к глютену преобладают внекишечные или не желудочно-кишечные симптомы, такие как головная боль, «помутнение сознания», боли в суставах и онемение в ногах, руках или пальцах. Симптомы обычно появляются через несколько часов или дней после употребления глютена; реакция характерна для врожденных нарушений иммунитета, таких как не связанная с целиакией чувствительность к глютену.
«Здоровый индивидуум» - при использовании в контексте настоящего изобретения здоровым индивидуумом является тот, у кого не была диагностирована целиакия.
«Задержка появления» означает облегчение состояния, ослабление тяжести симптомов, раннее вмешательство, и увеличение продолжительность времени до проявления заболевания, и не предназначается для ограничения ситуацией, когда пациент не испытывает каких-либо симптомов желудочно-кишечного дискомфорта.
Для использования в соответствии с настоящим изобретением, лекарственное средство или диетическую добавку вводят перорально в пределах 1 часа до или после еды.
В другом варианте осуществления настоящее изобретение относится к способу разрушения растительных аллергенов в диетической композиции, включающему инкубацию диетической композиции, содержащей растительные аллергены, с асиергиллоглутамил-пептидазой из Aspergillus niger, в течение времени, достаточного для гидролиза растительных аллергенов. Специалист в данной области техники сможет оценить количество фермента, которое нужно добавить к пищевому продукту, и время, необходимое для разрушения пищевых аллергенов, в зависимости от состава пищи, подвергаемой обработке. Обнаружение пищевых аллергенов может быть эффективно достигнуто с использованием специфических антител или с помощью масс-спектрометрии, в соответствии со способами, известными в данной области техники. Для пивных матриксов аспергиллоглутамил-пептидазу из Aspergillus niger добавляют в дозе от 50 до 2000 HPU на гектолитр пива, предпочтительно от 100 до 1000 HPU/гл нива. Для матриксов выпекаемой продукции аспергиллоглутамил-пептидазу из Aspergillus niger можно добавить в дозе от 10 до 5000 HPU/ кг композиции. Подходящие матриксы для выпекаемой продукции включают выпекаемую композицию, но не ограничиваются ей.
Неожиданно, при использовании аспергиллоглутамил-пептидазы при обработке пива при низкой концентрации от 0,5 до 500 мг/гл, предпочтительно от 1 до 50 мг/гл, более предпочтительно от 10 до 20 мг/гл, отмечалась стабилизация пивной пены.
Растительные аллергены, деградируемые с помощью аспергиллоглутамил-пептидазы из Aspergillus niger, предпочтительно являются аллергенами, содержащимися в пшенице, ячмене, ржи, овсе и их перекрестно связанных разновидностях; такими как ингибиторы альфа-амилазы/трипсина, более предпочтительно, растительными аллергенами СМ 2, СМ 3, СМ 16, и 0.19, и еще более предпочтительно, СМ 3 и 0.19, на основе их быстрой деградации с помощью аспергиллоглутамил-пептидазы из Aspergillus niger. Идентификатором аминокислотной последовательности СМ 3 является SwissProt Р01083, а идентификатором аминокислотной последовательности 0.19 является SwissProt Р01085.
В настоящем варианте осуществления пищевая композиция представляет собой диетической продукт, содержащий пшеницу, ячмень, рожь, овес и/или их перекрестно связанные разновидности. Предпочтительными пищевыми композициями являются пиво на различных стадиях процесса пивоварения, выпекаемая композиция, тесто, кислое тесто или выпекаемый продукт, такой как хлеб.
В данном способе аспергиллоглутамил-пептидаза из Aspergillus niger предпочтительно может быть дополнена пролил-эндопептидазой, предпочтительно, пролил-эндопептидазой из Aspergillus niger, для того, чтобы также разрушить эпитопы глютена, и, факультативно, также с ферментом аспергиллопепсином I.
Предпочтительное количество фермента, которое необходимо добавить в диетическую композицию в указанном выше способе, зависит от пищевого матрикса и установленного количества глютена и ингибитора трипсина/альфа-амилазы.
В еще одном варианте осуществления настоящее изобретение относится к продукту питания, полученному вышеуказанным способом разрушения растительных аллергенов в пищевом продукте, включающим инкубацию диетической композиции, содержащей растительные аллергены, с аспергиллоглутамил-пептидазой из Aspergillus niger, в течение времени, достаточного для гидролиза растительных аллергенов, где указанная композиция содержит деградированные ингибиторы альфа-амилазы/трипсина. Предпочтительным продуктом питания является выпекаемый продукт, такой как хлеб, тесто, пиво.
В другом варианте осуществления настоящее изобретение также относится к выпекаемой композиции и ферментной композиции или к тесту, включающим аспергиллоглутамил-пептидазу из Aspergillus niger. Оно также относится к способу приготовления теста, включающему стадию добавления аспергиллоглутамил-пептидазы из Aspergillus niger по меньшей мере в один ингредиент теста.
Выпекаемые продукты часто делают с использованием муки, содержащей глютен. Поэтому выпекаемые продукты представляют собой диетической продукт, который может быть не пригоден для людей глютеновой чувствительностью. Выпекаемая композиция в соответствии с настоящим изобретением включает пшеницу, ячмень, рожь, овес и/или их перекрестно связанные разновидности, предпочтительно в виде муки и аспергиллоглутамил-пептидазы из Aspergillus niger. Выпекаемая композиция может содержать от 10 до 5000 HPU аспергиллоглутамил-пептидазы из Aspergillus niger на кг муки.
В одном аспекте выпекаемая композиция включает аспергиллоглутамил-пептидазу из Aspergillus niger в количестве от 20 до 3000 HPU/кг муки, в другом аспекте в количестве от 30 до 1000 HPU/кг муки, в количестве от 40 до 500 HPU/кг муки, в количестве от 50 до 250 HPU/кг муки. В одном аспекте выпекаемая композиция включает от 1 ч./млн. до 2000 ч./млн. аспергиллоглутамил-пептидазы из Aspergillus niger, обладающей активностью в диапазоне примерно от 1000 до 50000 HPU/г.
В одном аспекте выпекаемая композиция включает 10-200 ч./млн. аспергиллоглутамил-пептидазы из Aspergillus niger, обладающей активностью в диапазоне примерно от 1000 до 50000 HPU/г.
Выпекаемая композиция в соответствии с изобретением может содержать по меньшей мере один дополнительный фермент, как описано в настоящей заявке.
«Дополнительный фермент» - термин «дополнительный фермент» здесь и далее в настоящей заявке включает амилазу, такую как альфа-амилаза, бета-амилаза, мальтогенная амилаза; циклодекситрин-глюканотрансферазу; протеазу, пептидазу, такую как пролил-эндопептидаза, предпочтительно, пролил-эндопептидаза из Aspergillus niger, для того, чтобы также деградировать эпитопы глютена, и факультативно, также с ферментом аспергиллопепсином I; трансглутаминазу; липазу, такую как триацилглицерин-липаза, галактолипаза, фосфолипаза; целлюлазу; гемицеллюлазу, в частности пентозаназу, такую как ксиланаза; белковую дисульфид-изомеразу, например, белковую дисульфид-изомеразу, как описано в WO 95/00636; гликозилтраисферазу, пероксидазу; лакказу; или оксидазу, такую как гексозооксидаза, глюкозооксидаза, альдозооксидаза, пиранозооксидаза, липоксигеназа или оксидаза L-аминокислот; или G4-образующую амилазу; но не ограничивается ими.
В одном варианте осуществления ферментной композиции согласно изобретению дополнительный фермент представляет собой липолитический фермент, предпочтительно фосфолипазу, галактолипазу или фермент, обладающий как фосфолипазной, так и галактолипазной активностью.
В одном варианте осуществления ферментной композиции согласно изобретению дополнительным ферментом является Panamore® от DSM, как описано в WO2009/106575. Подходящий липолитический фермент может включать Lipopan®F, Lipopan®50 и Lipopan® от Novozymes.
В одном из вариантов осуществления ферментной композиции согласно изобретению дополнительный фермент представляет собой фермент, как описано в WO 9826057, или как описано в US RE38,507, или как описано в WO 9943794, в частности, в ЕР 1058724 В1.
В одном аспекте ферментной композиции согласно изобретению дополнительный фермент представляет собой амилазу, как описано в US 8426182.
Дополнительный фермент может включать G4-образующую амилазу. G4-образующая амилаза представляет собой фермент, который, среди прочего, способен катализировать расщепление крахмала. В частности, он способен к расщеплению α-D-(1→4) О-гликозидных связей в крахмале. Он может упоминаться как глюкан-1,4-альфа-мальтотетрагидролаза (ЕС 3.2.1.60). Он может также обозначаться как мальтотетрагидролаза. Подходящие G4-образующие амилазы могут быть G4-образующими амилазами, описанными в любом из WO 9950399, WO 2005007818, WO 2004111217, WO 2005003339, WO 2005007818, WO 2005007867, WO2006003461, WO 2007007053, WO 2007148224, WO 2009083592, WO 2009088465.
Примером пищевого продукта является выпекаемый продукт.
«Выпекаемый продукт» - термин относится к хлебопекарным пищевым продуктам/хлебобулочным изделиям, приготовленным из теста. Примеры выпекаемых продуктов типа белого, черного хлеба или хлеба из цельной муки грубого помола, которые могут быть предпочтительно произведены в соответствии с настоящим изобретением, включают хлеб (в частности, белый, из цельной муки или ржаной хлеб), как правило, в виде буханок или рулетов, хлеб типа французского багета, пирожные, круассаны, булочки, панеттоне, макароны, лапшу (вареную или стир-фрай), питу и другие виды плоского хлеба, тортилыо, тако, пироги, блины; выпекаемье, в частности, бисквиты; пончики, в том числе дрожжевые пончики; баранки, коржи, вареный хлеб, хрустящий хлеб, шоколадные пирожные, слойки, закусочные продукты (например, претцели, чипсы тортилья, искусственные закусочные продукты, искусственные картофельные чипсы). Термин «выпекаемый продукт» включает хлеб, содержащий от 2 до 30 масс. % сахара; хлеб, содержащий фрукты; завтраки из зерновых, зерновые батончики; пирожные, не содержащие яиц; мягкие рулеты и хлеб, не содержащий глютена. Хлеб, не содержащий глютена, здесь и далее в настоящей заявке означает хлеб, который содержит не более 20 ч./млн. глютена. Для безглютеновой диеты считаются приемлемыми некоторые злаки и источники крахмала. Часто используемыми источниками являются картофель, рис и тапиока (полученная из маниоки). Выпекаемый продукт включает формовой хлеб, буханки, бублики; булочки, такие как булочки для гамбургера или приготовленные на пару булочки; чапати, сухари, сушеные ломтики паровых булочек, панировочные сухари, мацу, фокаччо, тосты Мельба, галеты, крутоны, мягкие претцели, мягкий и твердый хлеб, хлебные палочки, дрожжевой хлеб и хлеб на основе химических разрыхлителей; продукты из слоеного теста, такие как датская сдоба, круассаны или продукты из пресного слоеного теста, маффины, пирожные из слоеного теста; бублики, кондитерские оболочки, крекеры, вафли, пиццу, тортилью, макаронные продукты, блины, вафли, частично запеченные продукты и охлажденные и замороженные продукты из теста; но не ограничивается ими. Пирожные включают песочное пирожное, такое как, например, фунтовый кекс и масляный кекс, и в том числе кексы из взбитого теста, например, такие как безе, бисквит, бисквитное пирожное, рулет, генуэзский бисквит и шифоновый бисквит, по не ограничиваются ими.
Примером частично выпеченного продукта является, без ограничения, частично выпекаемый хлеб, который доводят до готовности в момент продажи или потребления с коротким вторым процессом выпечки. Хлеб может быть белым или черным формовым хлебом; такой хлеб может, например, быть изготовлен с использованием так называемого Американского способа для бисквита и теста или Американского прямого способа.
«Тесто» - термин «тесто» означает в настоящей заявке смесь муки и других ингредиентов, в частности, ингредиентов теста. В одном из аспектов тесто является достаточно плотным для замешивания и раскатки. Тесто может быть свежим, замороженным, приготовленным или частично запеченным. Получение замороженного теста описывается Kulp and Lorenz в «Frozen and Refrigerated Doughs and Batters» («Замороженное и охлажденное тесто»). Термин «тесто» в настоящем изобретении включает жидкое тесто. Жидкое тесто представляет собой полужидкую смесь, достаточно жидкую, чтобы стекать каплями или выливаться из ложки, из одного или нескольких видов муки в сочетании с жидкостями, такими как вода, молоко или яйца, используемую для приготовления различных пищевых продуктов, включая пирожные.
«Ингредиент теста» - Ингредиент теста включает в себя любой компонент, выбранный из муки, яйца, воды, соли, сахара, ароматизаторов, жира (в том числе сливочного масла, маргарина, растительного масла и шортенинга), пекарских дрожжей, химического разрыхлителя, молока, подкислителей (включая аскорбиновую кислоту, бромат и азодикарбонамид (АДА)), восстанавливающих агентов (включая L-цистеин), эмульгаторов (включая моно/диглицериды, моноглицериды, такие как глицерин моностеарат (ГМС), натрия стеароиллактилат (НСЛ), кальция стеароил лактилат (КСЛ), сложные эфиры полиглицерина и жирных кислот (ПГЭ) и сложные эфиры диацетилвинной кислоты и моно- и диглицеридов (DATEM)), камедей (включая гуаровую и ксантановая камедь), кислот (включая лимонную кислоту, пропионовую кислоту), крахмала, модифицированного крахмала, глютена, увлажнителей (включая глицерин) и консервантов.
В предпочтительном варианте осуществления настоящее изобретение относится к ферментной композиции, содержащей аспергиллоглутамил-пептидазу из Aspergillus niger и по меньшей мере один дополнительный фермент.Ферментная композиция может содержать от 10 до 5000 HPU аспергиллоглутамил-пептидазы из Aspergillus niger на кг композиции.
В одном аспекте ферментная композиция содержит от 1 до 2000 ч./млн. аспергиллоглутамил-пептидазы из Aspergillus niger, обладающей активностью в диапазоне примерно от 1000 до 50000 HPU/г. В одном аспекте ферментная композиция содержит от 10 до 200 ч./млн. аспергиллоглутамил-пептидазы из Aspergillus niger, обладающей активностью в диапазоне примерно от 1000 до 50000 HPU/г
В одном варианте осуществления ферментная композиция в соответствии с изобретением обеспечивается в сухом виде, что позволяет легко добавлять ее к тесту, или по меньшей мере к одному ингредиенту теста, но также возможны и жидкие формы.
Способ в соответствии с настоящим изобретением для приготовления теста включает стадию добавления аспергиллоглутамил-пептидазы из Aspergillus niger по меньшей мере к одному ингредиенту теста. Аспергиллоглутамил-пептидаза из Aspergillus niger может быть добавлена на любой стадии приготовления теста, и может быть добавлена в одну, две или более стадий.
Если имеется один или несколько дополнительных ферментов, то эти ферменты могут быть добавлены отдельно или вместе с аспергиллоглутамил-иептидазой из Aspergillus niger в соответствии с изобретением, например, в качестве ферментной композиции согласно настоящему изобретению,
Кроме того, изобретение относится к способу получения выпекаемого продукта, причем этот способ включает выпекание теста в соответствии с изобретением. В одном из вариантов осуществления способа производства выпеченного продукта выпекаемый продукт является хлебом или пирожным.
Специалисту в данной области техники известно, как приготовить тесто или выпекаемый продукт, начиная с ингредиентов теста. Кроме того, изобретение относится к выпеченному продукту, полученному способом производства выпекаемого продукта в соответствии с настоящим изобретением.
Кроме того, изобретение относится к применению аспергиллоглутамил-пептидазы из Aspergillus niger в производстве выпекаемого продукта. Краткое описание фигур
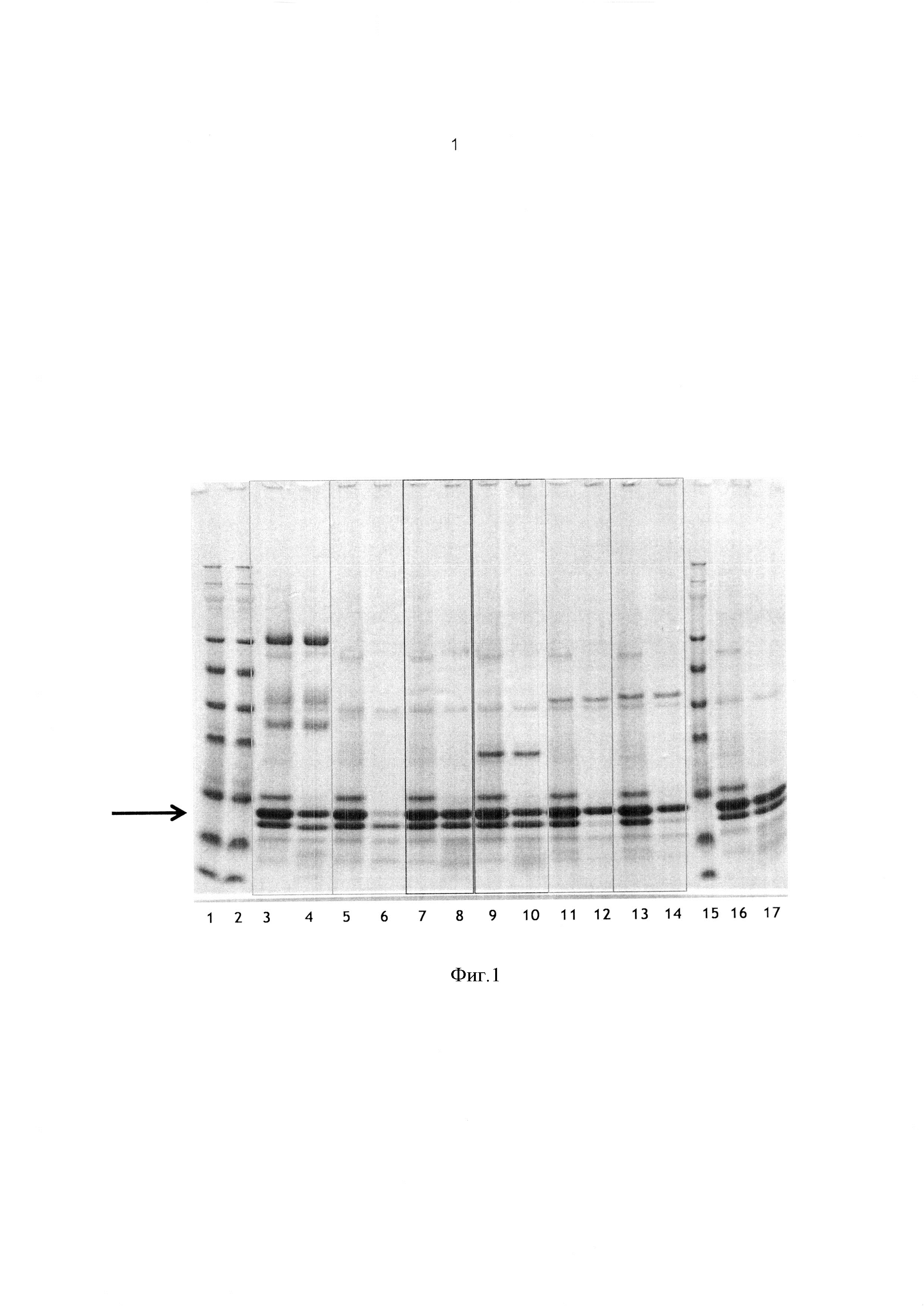
Фигура 1: 4-12% ДСН-ПАГЭ (от 4 до 12% Бис-Трис гель) анализ различных образцов с инкубацией ингибиторов альфа-амилазы пшеницы с различными протеазами и пепсином при имитации условий желудка. Включены два контрольных образца с обработкой пепсином без дополнительного фермента. Стрелка указывает на положение трех основных белковых продуктов, присутствующих в препарате альфа-амилазы.
- Маркеры молекулярной массы: дорожки 1, 2 и 15
- Обработка пролин-специфической эндопротеазой из A. niger при Т=0, дорожка 3; Т=90 минут, дорожка 4.
- Обработка аспергиллоглутамил-пептидазой из A. niger при Т=0, дорожка 5; Т=90 минут, дорожка 6.
- Пепсин при Т=0, дорожка 7; Т=90 мин, дорожка 8
- Папайи при Т=0, дорожка 9; Т=90 минут, дорожка 10
- Multifect PR® 15L при Т=0, дорожка 11; Т=90 минут, дорожка 12
- Аспергиллопепсин I при Т=0, дорожка 13; Т=90 минут, дорожка 14
- Пепсин при Т=0, дорожка 16; Т=90 минут, дорожка 17.
Фигура 2: Препаративный ДСН-ПАГЭ ингибиторов альфа-амилазы пшеницы, для определения характера наиболее распространенных белков, присутствующих в полосах B1-G1.
Фигура 3: 4-12% ДСН-ПАГЭ (от 4 до 12% Бис-Трис гель) анализ различных образцов, при инкубации стандартизированного количества глютена пшеницы с увеличением концентрации аспергиллоглутамил-пептидазы из Aspergillus niger (AGP) при имитации условий желудка. Стрелка указывает на положение ингибиторов альфа-амилазы пшеницы 0.19, СМ2 и СМ16 (см. Пример 1).
- Маркеры молекулярной массы (Mark 12™ Unstaned Standard, Life Technologies): дорожка 13.
- Очищенные ингибиторы альфа-амилазы/протеазы: дорожка 14.
- Без добавления аспергиллоглутамил-пептидазы из A. niger: дорожка 1=0, дорожка 2=60 минут.
- Добавление аспергиллоглутамил-пептидазы из A. niger 0,09 мг/мл: дорожка 3=0, дорожка 4=60 минут
- Добавление аспергиллоглутамил-пептидазы из A. niger 0,19 мг/мл: дорожка 5=0, дорожка 6=60 минут.
- Добавление аспергиллоглутамил-пептидазы из A. niger 0,28 мг/мл: дорожка 7=0, дорожка 8=60 минут.
- Добавление аспергиллоглутамил-пептидазы из A. niger 0,37 мг/мл: дорожка 9=0, дорожка, 10=60 минут.
- Добавление аспергиллоглутамил-пептидазы из A. niger 0,47 мг/мл: дорожка 11=0, дорожка 12=60 минут.
Фигура 4: 4-12% ДСН-ПАГЭ (от 4 до 12% Бис-Трис гель) анализ различных образцов при инкубации полученных из пшеницы пуротионинов с различными протеазами с пепсином в условиях имитации желудка. Стрелка указывает положение очищенных пуротионинов.
- Маркеры молекулярной массы: дорожки 1, 2, 9 и 10
- Аспергиллоглутамил-пептидаза из A. niger при Т=0, дорожка 3; Т=90 минут, дорожка 4.
- Пролин-специфичная эндопротеаза из A. niger при Т=0, дорожка 5; Т=90 минут, дорожка 6.
- Multifect® PR 15L (аспергиллопепсин I-подобная протеаза из Trichoderma reesei) при Т=0, дорожка 7; и Т=90 минут, дорожка 8.
Фигура 5: 4-12% ДСН-ПАГЭ (от 4 до 12% Бис-Трис гель) анализ различных образцов при инкубации пуротионинов, полученных из пшеницы, с различными протеазами и пепсином в условиях, имитирующих желудок. Стрелка указывает положение очищенных пуротионинов.
- Маркеры молекулярной массы: дорожка 1.
- Очищенные пуротионины пшеницы: дорожка 2.
- Multifect® PR 15 L (аспергиллопепсин I-подобная протеаза из Trichoderma reesei, http//biosciences.dupont.com) при: Т=0, дорожка 3; Т=90 минут, дорожка 4.
- Смесь 90 масс. % (фермента к присутствующему белку) Multifect® PR 15L и 10% аспергиллоглутамил-пептидазы из A. niger при Т=0, дорожка 5; Т=90 минут, дорожка 6.
- Proctase (не-ГМО смесь протеаз, секретируемых A.niger, включающая примерно 85% аспергиллоиепсина I) при Т=0, дорожка 7; Т=90 минут, дорожка 8.
Изобретение далее иллюстрируется следующими примерами.
Примеры
Пример 1: Аспергиллоглутамил-пептидаза из Aspergillus niger эффективно расщепляет ингибиторы альфа амилаз/трипсина из пшеницы при имитации условий желудка, в то время как другие кислые эндопротеазы не являются эффективными.
Материалы и методы
Получение аспергиллопепсина I из Aspergillus niger
Ген аспергиллопепсина I из Aspergillus niger (рерА; Anl4g04710) был подвергнут гиперэкспрессии в A. niger, с использованием методов, описанных в публикации WO 98/46772. В WO 98/46772 описано, как выбрать трансформантов на чашках с агаром, содержащих ацетамид, а также как выбрать целевые мультикопийные интеграты. Трансформанты A.niger, содержащие множество копий кассеты экспрессии, были отобраны для дальнейшего производства материала образца. Трансформированный штамм A.niger подвергали ферментации в модифицированной среде КСМ-ферментации, рН 6,2 (40 г/л мальтозы, 30 г/л Bacto-soytone, 70 г/л натрия цитрата трехзамещешюго дигидрата, 15 г/л (NH4)2SO4, 1 г/л NaH2PO4*2H2O, 1 г/л MgSO4*7H2O, 1 г/л L-Аргипипа, 0,25 мл/л пеногасителя Clerol). Полученный культуральный бульон фильтровали, подвергали стерилизующей фильтрации, и затем концентрировали с помощью ультрафильтрации. Хроматографию проводили путем внесения фермента на колонку с Q-сефарозой ХК 26/10 в 50 ммоль/л натрий-ацетатном буфере, рН 5,6, с последующим элюированием в солевом градиенте. Присутствие белка аспергиллопепсина I в различных фракциях определяли количественно по интенсивности цветных полос белка после 4-12% ДСН-ПАГЭ (NuPAGE Bis-Tris гель, Invitrogen).
Ферментативный анализ
Инкубацию проводили в 50 ммоль/л цитрата натрия при рН 4,0 в течение 90 минут при 37°С. Во всех соответствующих инкубациях пепсин присутствовал в концентрации белка фермента 0,2 мг/мл. Пролин-специфическую эндопротеиназу тестировали в концентрации 0,5 мг белка фермента на мл, другие кислотные эндопротеиназы в концентрации 0,05 мг белка фермента на мл. Ингибитор амилазы был добавлен последним и присутствовал в концентрации 2 мг/мл.
При Т=0, 100 мкл реакционной смеси переносили в 400 мкл 25% ТХУК. После 90 минут инкубации при температуре 37°С, еще 100 мкл переносили в 400 мкл свежего раствора ТХУК. Спустя 2 ч при температуре 4°С, образцы центрифугировали в течение 10 мин при 14'000 оборотов в минуту. После центрифугирования добавляли 65 мкл фосфатного буфера, рН 7, 25 мкл лития додецилсульфата (ЛДС) и 10 мкл образца редуцирующего агента. Образцы хранили при 4°С в течение ночи и затем готовили для ДСН-ПАГЭ, в соответствии с протоколом Invitrogen (Invitrogen, www.lifetechnologies.com).
Определение активности аспергиллоглутамил-пептидазы из Aspergillus niser (HPU)
20,0 г гемоглобина из бычьей крови (Sigma, продукт Н2625) суспендировали примерно в 700 мл воды и перемешивали в течение 10 мин при комнатной температуре. После добавления 3,73 г хлорида калия (KCl), рН доводили до 1,75 с 0,5 моль/л соляной кислоты. Объем суспензии гемоглобина доводили до 1 л водой. Значение рН проверяли снова и доводили до рН 1,75.
Ферментные растворы готовили путем растворения очищенной аспергиллоглутамил-пептидазы, полученной, как описано выше, в буфере KСl/НСl, содержащем 3,73 г/л КСl, с рН, доведенным до 1,75 с 2,0 моль/л НСl. Чтобы проверить активность аспергиллоглутамил-пептидазы, 5 мл раствора гемоглобина нагревали при 40°С, а затем 1 мл раствора фермента с активностью от 5 до 25 Гистидиновых Протеазных Единиц (HPU/мл) добавляли, чтобы начать реакцию. Через 30 минут реакцию останавливали добавлением 5 мл раствора трихлоруксусной кислоты (140 г/л) для осаждения более крупных пептидных фрагментов. Контрольное измерение проводили путем добавления 1,0 мл образца фермента к смеси 5 мл раствора гемоглобина и 5 мл раствора трихлоруксусной кислоты. Пробирки инкубировали при 40°С в течение 30 минут, чтобы завершить осаждение. После центрифугирования оптическую плотность прозрачной надосадочной жидкости, содержащей небольшие пептиды, измеряли при 275 нм. Результат сравнивали с результатом, полученным для раствора L-тирозина 1 мкг/мл.
Одна единица HPU является количеством фермента, которое гидролизует такое количество гемоглобина в минуту, которое дает раствор с оптической плотностью при 275 нм, равной оптической плотности раствора, содержащего 1 мкг L-тирозина на мл в 0,1 М растворе НСl. Условия испытания: рН 1,75, температура 40°С, концентрация гемоглобина во время инкубации 16,7 г/л.
Активность (HPU/мл)=(ОПобр. - ОПконтр./S)×11/30; где
ОПобр.: оптическая плотность образца фильтрата (275 нм)
ОПконтр.: оптическая плотность образца чистого фильтрата (275 нм)
S: ОП стандартного раствора L-тирозина 1,1 мкг/мл (мл/мкг)
30: Время инкубации (мин)
11: общий объем реакционной смеси (мл).
ЖХ-МС/МС анализ
Расщепление in-vitro
Образец растворяли до концентрации 1 мг/мл в воде MilliQ. Раствор разбавляли в 10 раз в 100 мМ NH4HCO3 (рН 7,8). Образец восстанавливали путем добавления ДТТ, 5 мМ, при 30-минутной инкубации при комнатной температуре, и алкилировали добавлением иодацетамида (ИАА), 5,5 мМ, при 30-минутной инкубации при комнатной температуре в темноте. Расщепление с помощью трипсина проводили при 37°С в течение ночи.
Расщепление в геле
Гелевые полосы вырезали из геля, используя резак ExQuest (BioRad, Hercules, Калифорния, США) и переносили на планшеты для связывания белка (Eppendorf, Гамбург, Германия). Кусочки геля промывали путем добавления 75 мкл 50 мМ NH4HCO3 для набухания, и 75 мкл ацетонитрила для сушки, всего 3 промывания. Промытые кусочки геля расщепляли трипсином, путем инкубации при 37°С в течение ночи. Образцы обрабатывали ультразвуком в течение 1 минуты, и надосадочную жидкость собирали в во флакон для инъекций.
LC-MS/MS анализ
Образцы подкисляли 1% муравьиной кислотой и анализировали на Accela-LTQ-Velos (Thermo Scientific, Сан-Диего, Калифорния, США). Хроматографическое разделение осуществляли на колонке С-18 Eclipse XDB Zorbax (Agilent, Санта-Клара, Калифорния, США) размером 2,1×100 мм с размером частиц 1,8 мкм, с диаметром пор 80 Ангстрем, с применением градиента с (А) водой класса ЖХ-МС, содержащей 0,1% муравьиной кислоты; (Б) ацетонитрила класса ЖХ-МС, содержащего 0,1% раствор муравьиной кислоты (Biosolve BV, Нидерланды) в качестве подвижной фазы. Градиент поддерживали от 5 до 40% В в течение 83 минут. Скорость потока поддерживали на уровне 0,4 мл/мин, используя вводимый объем 25 мкл, и устанавливая температуру колонки 50°С. Сбор данных MS осуществляли с использованием 10 верхних зависимых от данных результатов с диапазоном массы 400-2000 m/z, с помощью динамического исключения и включения заряда только в положениях 2 и 3. МС/МС эксперименты проводили с шириной изоляции, установленной на 3,0, а нормализованную энергию коллизии устанавливали на 35. Поиск в базе данных осуществляли с использованием Sorcerer 2 (Sorcerer™-SEQUEST®) поисковой системы и Trans Proteome Pipeline (ТРР), с использованием трипсина в качестве предпочтительного фермента. Были рассмотрены только белки, идентифицированные со степенью достоверности >90%. Проводили поиск в базе данных SwissProt.
Результаты
В настоящем примере мы показали (см. Фигуру 1), что в смоделированных условиях желудка, только аспергиллоглутамил-пептидаза из Aspergillus niger среди ряда кислых эндопротеиназ способна эффективно разлагать очищенный препарат, включающий различные ингибиторы альфа-амилазы пшеницы (ингибитор альфа-амилазы из семян пшеницы, тип 1, Sigma). В эксперименте сравнивали эффективность следующих ферментов в присутствии пепсина (контроль):
- Пепсин (из слизистой оболочки желудка свиньи, Sigma),
- Пролин-специфическая эндопротеиназа из Aspergillus niger (MaxiPro PSP, DSM Food Specialities, Делфт, Нидерланды)
- Папаин (Collupuline, DSM Food Specialities, Делфт, Нидерланды),
- Аспергиллоглутамил-пептидаза из Aspergillus niger, также называемая аспергиллопепсином II (MaxiPro HSP, DSM Food Specialities, Делфт, Нидерланды),
- Аспергиллопепсин I (см. Материалы и методы),
- Multifect PR 15 L (аспергиллопепсин I-подобная протеаза из Trichoderma reesei; http//biosciences.dupont.com).
Результаты (см. Фигуру 1) показывают, что очищенный препарат ингибитора альфа-амилазы пшеничного глютена включает три основные белковые полосы массой приблизительно 12 кДа (см. стрелку). Эти данные также показывают, что в имитированных условиях желудка и в присутствии пепсина и равных количеств различных протеиназ, аспергиллоглутамил-пептидаза из Aspergillus niger является наиболее эффективной в расщеплении этих трех основных полос, присутствующих в очищенном препарате ингибиторов альфа-амилазы.
Для подтверждения природы различных белков, присутствующих в каждой из этих полос, образцы полос геля вырезали, экстрагировали и идентифицировали присутствующие белки с использованием ЖХ-МС/МС анализа, как описано в Материалах и методах выше.
В этом случае раствора ингибитора альфа-амилазы Sigma 10 мг/мл разбавляли в 10 раз водой. Затем 65 мкл этого раствора смешивали с 25 мкл образца LiДС и 10 мкл образца восстанавливающего агента, нагревали в течение 10 мин при 70°С, после чего белки разделяли с помощью ДСН-ПАГЭ в соответствии с протоколом Invitrogen. Затем гель фиксировали в течение 1 часа со смесью 50% метанола/7%-ной уксусной кислоты, дважды промывали деминерализованной водой и окрашивали с Sypro Rubin в течение ночи. Образцы геля были получены из трех полос, предположительно, ингибитора альфа-амилазы, как показано на Фигуре 2. В соответствии с данным ЖХ-МС/МС, полученными для экстрагированных белков, белки, присутствующие в наибольшем количестве в виде полос С1 и В1, были ингибиторами альфа-амилазы пшеницы с SwissProt номерами доступа SwissProt P17314 (CM 3) и Р16159 (CM 16), в полосах E1 и D1 - ингибиторами альфа-амилазы пшеницы Р01085 (0.19), Р16851 (СМ 2) и Р16159 (СМ 16), а в полосах G1 и F1 - Р01083 (СМ 3).
Эти данные показывают, что аспергиллоглутамил-пептидаза из Aspergillus Niger на удивление наиболее эффективна в расщеплении ингибиторов альфа-амилазы пшеницы в условиях желудка и, прежде всего, ингибиторов альфа амилазы пшеницы СМ 2, 3 СМ, СМ 16, и 0.19.
Пример 2: Аспергиллоглутамил-пептидаза из Aspergillus niger расщепляет ингибиторы альфа-амилазы/трипсина в пиве и стабилизирует пену.
В соответствии с аминокислотными последовательностями, ячмень содержит ингибиторы альфа-амилазы, которые очень похожи на ингибиторы альфа-амилазы, присутствующие в пшенице. Таким образом, пиво представляет собой диетической продукт, который может иметь значение для людей, чувствительных к глютену. В пиве, как и в других пищевых продуктах, ингибиторы альфа-амилазы присутствуют либо в качестве интактной молекулы, либо в виде пептидов, достаточно больших, чтобы вызвать иммунный ответ. Например, при ЖХ-МС/МС анализе 16 различных сортов пива мы идентифицировали около 3300 различных пептидов длиной более 9 аминокислот с последовательностями, приписываемым ингибиторам альфа-амилазы. Этот результат иллюстрирует потенциальную значимость ингибиторов альфа-амилазы для людей чувствительных к глютену, и тем самым актуальность аспергиллоглутамил-пептидазы для производства пива.
Использование протеаз во время фазы ферментации пива или за ее пределами довольно распространено для предотвращения так называемого холодного помутнения. Исторически кислые протеазы с широкой специфичностью, такие как Proctase или папаин, были использованы для этой цели, но в настоящее время пролин-специфичпая эндопротеаза, называемая Brewers Clarex, представляет предпочтительный вариант. Основная причина перехода от ферментов с такой широкой специфичностью к высоко специфичному продукту Brewers Clarex является то, что применение ферментов широкой специфичности, как правило, приводит к получению пива с плохой пенообразующей способностью. Таким образом, любое негативное воздействие на пивную пену является необходимым условием применения протеолитической обработки при производстве пива. Для того, чтобы проверить влияние аспергиллоглутамил-пептидазы из Aspergillus niger на формирование пивной пены, был проведен следующий эксперимент.
Бутылочное пиво большого международного бренда было получено из местного супермаркета. Бутылки осторожно открывали, добавляли соответствующий фермент(ы) и сразу же снова закрывали бутылки нова с использованием новой кронен-пробки. После тщательного перемешивания, бутылки хранили при 20°С. Данные, представленные в вышеприведенном примере 1, показывают, что концентрация аспергиллоглутамил-пептидазы, необходимой для разрушения ингибиторов альфа-амилазы, по меньшей мере в десять раз ниже, чем концентрация пролин-специфичной эндопротеазы. Типичный промышленный уровень использования коммерческого пролин-специфичного продукта Brewers Clarex составляет 3 г/гл пива, что соответствует 150 мг чистого белка фермента на гл пива. В настоящем эксперименте пролин-специфичную эндопротеазу также добавляли в этой концентрации, но две других протеазы были добавлены в концентрациях только 15 мг чистого белка фермента на гл пива. После инкубации в течение одной недели, стабильность пены всех сортов пива измеряли в соответствии с Analytica-EBC методом 9,42 с использованием оборудования Haffmans (устройство для отбора образцов Inpack 2000 в сочетании с тестером стабильности пены NIBEM ТРН, Haffmans BV, Венло, Нидерланды). Средние значения пены от двух образцов на инкубацию приведены в Таблице 1.
Как и следовало ожидать, стабильность пены пива, инкубированного с пролин-специфичной эндопротеазой, добавленной в концентрациях, пригодных для предотвращения помутнения (т.е. 150 мг/гл), сопоставима с данными, полученными для эталонного продукта (коммерческого пива без добавления протеазы). Неожиданное наблюдение состоит в том, что при добавлении низкой концентрации аспергиллоглутамил-пептидазы или аспергиллопепсин-1-подобного фермента стабильность пены пива значительно увеличивалась, даже если ее применяли в сочетании с промышленно используемыми уровнями пролин-специфичной эндопротеазы. Этот результат наводит на мысль, что добавление аспергиллоглутамил-пептидазы, например, с целью уничтожения крупных пептидов ингибиторов альфа-амилазы, обеспечивает стабилизацию пивной пены в качестве желательного побочного эффекта.

Пример 3: Аспергиллоглутамил-пептидаза из Aspergillus niger расщепляет ингибиторы альфа-амилазы/трипсина дозозависимым образом.
В настоящем примере мы определяли количество белка фермента аспергиллоглутамил-пептидазы из Aspergillus niger, необходимого для гидролиза в имитированных условиях желудка ингибиторов альфа-амилазы/протеазы, присутствующих в 1 г пшеничного глютена. Для этого глютен пшеницы (Sigma) растворяли в 50 ммоль/л лимонной кислоты, рН 4,0 в концентрации 9,35 мг/мл. К раствору при тщательном перемешивании добавляли фермент пепсин для достижения конечной концентрации 0,2 мг/мл, а затем отбирали шесть образцов по 1 мл. К этим шести образцам добавляли возрастающие количества чистого фермента аспергиллоглутамил-пептидазы из Aspergillus niger. Для образца 1: AGP не добавляли, для образца 2: 0,09 мг, для образца 3: 0,19 мг, для образца 4: 0,28 мг, для образца 5: 0,37 мг, а для последнего образца: 0,47 мг. Затем различные образцы инкубировали в течение 60 минут при температуре 37°С, и из каждого образца отбирали аликвоты для анализа ДСН-ПАГЭ при Т=0 мин и Т=60 мин. Анализ ДСН-ПАГЭ проводили в соответствии с протоколом Invitrogen.
Результаты (см. Фигуру 3) показывают, что при добавлении 0,28 мг чистой аспергиллоглутамил-пептидазы из Aspergillus niger ингибиторы альфа-амилазы/протеазы, присутствующие в 9,35 мг глютена пшеницы, могут быть гидролизованы в течение одного часа. Это означает, что 30 мг чистой аспергиллоглутамил-пептидазы из Aspergillus niger (что соответствует 15000 HPU) может справиться с 1 грамм пшеничного глютена при таких имитированных условиях желудка. Таким образом, после частичной фрагментации ингибиторов альфа-амилазы/протеазы посредством перорального препарата аспергиллоглутамил-пептидазы из Aspergillus niger, вновь сформированные пептидные ингибиторы будут дополнительно разрушаться до неиммуногенных олигопептидов пепсином при прохождении через желудок, и после поступления в двенадцатиперстную кишку - панкреатическими протеазами, такими как трипсин и химотрипсин.
Пример 4: Гомолог аспергиллопепсина I из Т. reesei может расщеплять пуритионины, полученные из пшеницы, в условиях желудка.
Материалы и методы
Пуритионины выделяли, как описано Ohtani et al. (J. Biochem. 82, 753-767 (1977)), с некоторыми изменениями. Надосадочную жидкость из пшеницы подвергали хроматографии на SP-Сефарозе-6 FF (Amersham), уравновешенной 20 мМ натрия фосфата, рН 7,2, и элюировали с линейным градиентом от 0 до 1,0 моль/л NaCl в том же буфере. Наличие чистого пуритионина с молекулярной массой приблизительно 5 кДа в различных фракциях определяли посредством ДСН-ПАГЭ. Фракции, показывающие одну полосу белка, собирали, концентрировали с помощью мембраны Amicon 3 кДа, а затем лиофилизировали. Идентичность и чистоту выделенного белка подтверждали посредством ЖХ-МС/МС анализа, по существу, как описано в Примере 1, с использованием базы данных UniProt/SwissProt.
Ферментативный анализ
Инкубацию очищенных пуритионинов с различными протеазами проводили в 50 мМ цитрате натрия при pH 4,0 в течение 90 минут при 37°С, аналогично условиям, указанным в Примере 1 настоящей заявки. Во всех соответствующих инкубациях пепсин присутствовал в концентрации белка 0,2 мг/мл. Аспергиллоглутамил-пептидазу, пролин-специфичную эндопротеиназу и Multifect PR 15L тестировали в концентрации 0,11 мг ферментного белка/мл. Пуротионин пшеницы был добавлен последним, и присутствовал в концентрации 0,44 мг/мл.
Результаты
В эксперименте сравнивали эффективность следующих ферментов в присутствии пепсина:
Аспергиллоглутамил-пептидаза из Aspergillus niger, также называемая аспергиллопепсином II (MaxiPro HSP, DSM Food Specialities, Делфт, Нидерланды),
- Пролин-специфичная эндопротеиназа из Aspergillus niger (MaxiPro PSP, DSM Food Specialities, Делфт, Нидерланды),
- Multifect PR 15L (аспергиллопепсин I-подобная протеаза из Trichoderma reesei; http//biosciences.dupont.com).
Полученные результаты (см. Фигуру 4) показывают, что в имитированных условиях желудка и при равных количествах различных протеиназ, аспергиллопепсин I-подобные протеазы из Trichoderma reesei эффективно деградирует пуритионин, полученный из пшеницы.
Пример 5: Расщепление полученных из пшеницы пуритионинов в условиях желудка.
Материалы и методы
Пуритионины были выделены из пшеницы, как описано в примере 4. Proctase получали из Meiji (Токио, Япония).
Результаты
Как показано с помощью продуктов расщепления пуритионинов пшеницы на Фигуре 5, ферментные продукты, содержащие либо аспергиллопепсин I из Aspergillus niger, либо его гомолог из Trichoderma reesei, могут гидролизовать пуритионины пшеницы в имитированных условиях желудка.
Пример 6: При эффективных дозах аспергиллоглутамил-пептидаза и аспергиллопепсин I-подобные ферменты не оказывают негативного влияния на пивную пену.
Пиво содержит ингибиторы альфа-амилазы/трипсина ячменного происхождения, которые, как известно, высоко гомологичны аллергенным ингибиторам альфа-амилазы/трипсина, присутствующим в пшенице (Okada et al., J. Agric. Food Chem. 2008, 56, 1458-1464). Результаты, приведенные в Примере 1 настоящей заявки, показывают, что аспергиллоглутамил-пептидаза может эффективно гидролизовать различные ингибиторы альфа-амилазы/трипсина. Таким образом, при добавлении аспергиллоглутамил-пептидазы к пиву можно ожидать, что ингибиторы альфа-амилазы/трипсина из ячменя также будут гидролизоваться. В Примере 2 мы показали, что добавление соответствующих кислых протеаз не оказывает негативного влияния на качество пивной пены. В настоящем примере мы показали, что дозы ферментов аспергиллоглумил-пептидазы, аспергиллопепсина I или гомолога аспергиллопепсина I из Trichoderma reesei, необходимые для гидролиза известных аллергенов пива, таких как ингибиторы альфа-амилазы/трипсина и белка Z (Garcia-Casado et al., J Allergy Clin Immunol, 108 (4), p.p.647-649), не оказывают негативного влияния на стабильность пивной пены, даже в сочетании с количествами пролин-специфичных эндопротеаз (MaxiPro PSP, DSM Food Specialities, Делфт, Нидерланды), которые необходимы для предотвращения холодного помутнения.
Бутылочное пиво большого международного бренда было получено из местного супермаркета. Бутылки осторожно открывали, добавляли соответствующие ферменты и сразу же снова закрывали бутылки с использованием новой кронен-пробки. После тщательного перемешивания бутылки хранили при 20°С в течение одной недели. Стабильность пены измеряли, как описано в Примере 2, и средние значения пены для двух повторностей на инкубацию приведены в Таблице 2. Полученные данные четко показывают, что высокие дозы различных добавленных кислых протеаз не оказывают негативного влияния на образование пены.


Реферат
Изобретение относится к фармацевтической промышленности и представляет собой диетическую добавку, содержащую аспергиллоглутамил-пептидазу из Aspergillus niger, пролил-эндопептидазу и диетически пригодные вспомогательные вещества, а также фармацевтическую композицию для лечения непереносимости глютена у человека, содержащую аспергиллоглутамил-пептидазу из Aspergillus niger, пролил-эндопептидазу и фармацевтически пригодные вспомогательные вещества. Изобретение обеспечивает гидролиз ингибиторов альфа-амилазы/трипсина с целью лечения заболеваний, связанных с врожденным иммунным ответом у человека, или для обеспечения замедления проявления указанных заболеваний. 8 н. и 12 з.п. ф-лы, 6 пр., 2 табл., 5 ил.

Комментарии