Полипептид - RU2415939C2
Код документа: RU2415939C2
Чертежи










Описание
Ссылка относится к предварительным заявкам США на патент с регистрационными номерами 60/485413, 60/485539 и 60/485616, поданным 7 июля 2003. Ссылка также относится к международным заявкам РСТ/US2004/021723 и РСТ/US2004/021739, поданным 7 июля 2004 и указывающим США (заявитель: Genencor International, Inc). Ссылка также относится к заявкам США на патент на изобретение под регистрационными номерами 10/886905 и 10/866903, которые также все были поданы 7 июля 2004.
Ссылка также относится к предварительной заявке США на патент под регистрационным номером 60/608919 (поданной как заявка США на патент на изобретение под регистрационным номером 10/887056 7 июля 2004, но преобразованной в предварительную заявку от 15 сентября 2004). Ссылка также относится к предварительной заявке США под регистрационным номером 60/612407, которая была подана 22 сентября 2004.
Ссылка дополнительно относится к заявке США на патент под регистрационным номером 60/485539, поданной 7 июля 2003. Ссылка также относится к международной заявке РСТ/IB2004/002487, поданной 7 июля 2004 и указывающей США (заявитель: Danisco A/S). Ссылка также относится к предварительной заявке США на патент на изобретение под регистрационным номером 10/886023, поданной 7 июля 2004.
Ссылка также относится к заявкам США на патент на изобретение под регистрационными номерами 10/886505, 10/886527 и 10/886504, которые все были поданы 7 июля 2004. Ссылка также относится к заявке США на патент на изобретение под регистрационным номером 10/947612, поданной 22 сентября 2004.
Вышеприведенные заявки и каждый документ, цитированный или внесенный ссылкой в каждую из данной и вышеприведенных заявок, в том числе в течение рассмотрения каждой из вышеприведенных заявок (“цитированные документы заявок и статей”), и любые инструкции разработчиков или каталоги по любым продуктам, цитированным или упомянутым в каждой из вышеприведенных заявок и статей и в любой заявке и цитированных документах статей, таким образом, являются включенными в данную работу посредством ссылки. Кроме того, все документы, цитированные в данном тексте, и все документы, цитированные или внесенные ссылкой в документы, цитированные в данном тексте, и любые инструкции разработчиков или каталоги по любым продуктам, цитированным или упомянутым в данном тексте или в любом документе, таким образом включенном в данный текст, являются включенными в данную работу посредством ссылки. Документы, включенные посредством ссылки в данный текст, или любые их прописи могут быть использованы при практической реализации данного изобретения. Документы, включенные посредством ссылки в данный текст, не признаются являющимися предшествующим уровнем техники.
Область техники, к которой относится изобретение
Данное изобретение относится к полипептидам, особенно к полипептидам амилазы и нуклеиновым кислотам, кодирующим их, и их применениям в качестве немальтогенных экзоамилаз в производстве пищевых продуктов. Амилазы данного изобретения сконструированы таким образом, что они имеют больше полезных качеств. В частности, амилазы настоящего изобретения проявляют измененную экзоспецифичность и/или измененную термостабильность. В частности полипептиды получены из полипептидов, имеющих немальтогенную экзомилазную активность, в частности активность глюкан-1,4-альфа-мальтотетрагидролазы (ЕС 3.2.1.60).
Уровень техники
Улучшенные амилазы могут способствовать решению проблем, присущих некоторым процессам, таким как выпекание. Кристаллизация амилопектина происходит в крахмальных гранулах в день после выпекания, что приводит к повышенному черствению хлеба и вызывает потерю свежести хлеба. Когда хлеб черствеет, хлеб теряет эластичность мякиша и влагу мякиша. В результате мякиши становятся менее эластичными, и на хлебе образуется кожистая корка.
Ферментативный гидролиз (например, амилазами) боковых цепей амилопектина может снижать кристаллизацию и повышать противодействие черствению. Кристаллизация зависит от длины боковых цепей амилопектина: чем длиннее боковые цепи, тем больше кристаллизация. Большинство крахмальных гранул состоит из смеси двух полимеров: амилопектина и амилозы, из которых примерно 75% приходится на амилопектин. Амилопектин представляет собой очень большую, разветвленную молекулу, состоящую из цепей α-D-глюкопиранозильных единиц, соединенных (1-4)-связями, где цепи прикреплены α-D-(1-6)-связями для образования ответвлений. Амилоза представляет собой линейную цепь из (1-4)-связанных α-D-глюкопиранозильных единиц, имеющих незначительное количество α-D-(1-6)ответвлений.
Выпекание мучных хлебобулочных продуктов, таких как белый хлеб, хлеб, сделанный из просеянной рисовой муки и пшеничной муки, и булочки, выполняется выпеканием хлебного теста при температурах печи в интервале от 180 до 250°С в течение примерно от 15 до 60 минут. В течение процесса выпекания крутой градиент температуры (200→120°С) преобладает выше в поверхностных слоях теста, где образуется корка выпекаемого продукта. Однако из-за пара температура в мякише составляет только около 100°С в конце процесса выпекания. При температурах выше, примерно 85°С, может происходить инактивация фермента и фермент не будет обладать свойствами, противодействующими черствению. Таким образом, только термостабильные амилазы способны эффективно модифицировать крахмал в процессе выпекания.
Активность эндоамилазы может отрицательно влиять на качество конечного хлебного продукта образованием липкого, клейкого мякиша из-за аккумулирования разветвленных декстринов. Предпочтительной является активность экзоамилазы, потому что она осуществляет желаемую модификацию крахмала, которая приводит к замедлению черствения, с меньшими отрицательными эффектами, связанными с активностью эндоамилазы. Уменьшение активности эндоамилазы может привести к большей экзоспецифичности, что может уменьшить разветвленные декстрины и произвести хлеб более высокого качества.
Сущность изобретения
Авторы данного изобретения предлагают PS4-вариантный полипептид, представленный в формуле изобретения. Авторы также предлагают применение такого PS4-вариантного полипептида в качестве пищевых добавок и включением его в продовольственные продукты, хлебобулочные изделия, композиции улучшителя, кормовые продукты, в том числе корма для животных, и т.д., как представлено в формуле изобретения. Авторы предлагают нуклеиновые кислоты, которые кодируют и которые имеют отношение к PS4-вариантным полипептидам, представленным в формуле изобретения. Способы получения таких PS4-вариантных полипептидов, а также другие аспекты изобретения представлены в формуле изобретения.
Списки последовательностей
SEQ ID NO:1 представляет PS4-эталонную последовательность, полученную из аминокислотной последовательности мальтотетрагидролазы Pseudomonas saccharophila. SEQ ID NO:2 представляет PSac-D34 последовательность; аминокислотную последовательность мальтотетрагидролазы Рseudomonas saccharophila с 11 замещениями и делецией крахмал-связывающего домена. SEQ ID NO:3 представляет PSac-D20 последовательность; аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila с 13 замещениями и делецией крахмал-связывающего домена. SEQ ID NO:4 представляет PSac-D14 последовательность; аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila с 14 замещениями и делецией крахмал-связывающего домена. SEQ ID NO:5 представляет предшественник глюкан-1,4-альфа-мальтотетрагидролазы Pseudomonas saccharophila (ЕС 3.2.1.60) (G4-амилаза)(мальтотетраозо-образующая амилаза)(экзомальтотетраогидролаза)(мальтотетраозо-образующая экзоамилаза). Номер доступа в SWISS-PROT - Р22963. SEQ ID NO:6 представляет ген mta P.saccharophila, кодирующий мальтотетраогидролазу (ЕС номер = 3.2.1.60). Номер доступа в GenBank - Х16732. SEQ ID NO:7 представляет PS4-эталонную последовательность, полученную из аминокислотной последовательности мальтотетрагидролазы Pseudomonas stutzeri. SEQ ID NO:8 представляет PStu-D34 последовательность; аминокислотную последовательность мальтотетрагидролазы Pseudomonas stutzeri с 9 замещениями. SEQ ID NO:9 представляет PStu-D20 последовательность; аминокислотную последовательность мальтотетрагидролазы Pseudomonas stutzeri с 11 замещениями. SEQ ID NO:10 представляет PStu-D14 последовательность; аминокислотную последовательность мальтотетрагидролазы Pseudomonas stutzeri с 12 замещениями. SEQ ID NO:11 представляет предшественник глюкан-1,4-альфа-мальтотетрагидролазы Pseudomonas stutzeri (Pseudomonas perfectomarina) (ЕС 3.2.1.60) (G4-амилаза) (мальтотетраозо-образующая амилаза) (экзомальтотетраогидролаза) (мальтотетраозо-образующая экзоамилаза). Номер доступа в SWISS-PROT - Р13507. SEQ ID NO:12 представляет ген мальтотетраозо-образующей амилазы (amyP) P. stutzeri, полный cds. Номер доступа в GenBank - M24516. SEQ ID NO:13 представляет pMD55 последовательность; аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila с 11 замещениями (G134R, A141P, I157L, G223A, H307L, S334P, N33Y, D34N, L178F, A179T и G121F). SEQ ID NO:13 представляет pMD55 последовательность; аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila с 11 замещениями (G134R, A141P, I157L, G223A, H307L, S334P, N33Y, D34N, L178F, A179T и G121F) и делецией крахмал-связывающего домена. SEQ ID NO:14 представляет РMD96 последовательность: аминокислотную последовательность мальтотетрагидролазы Pseudomonassaccharophila, имеющую мутации N33Y, D34N, G121F, G134R, A141P, I157L, S161A, L178F, A179T, G223E, H307L и S334P. SEQ ID NO:15 представляет SSM 381 последовательность: аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 307L и 334P. SEQ ID NO:16 представляет SSM279 B1 последовательность: аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157М, 161A, 178F, 179T, 223E, 307L и 334P. SEQ ID NO:17 представляет SSM237 Р2 последовательность: аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 158T, 161A, 178F, 179T, 223E, 307L и 334P. SEQ ID NO:18 представляет аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 198W, 223E, 307L и 334P. SEQ ID NO:19 представляет SSM325 F3 последовательность: аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 229Р, 307L и 334P. SEQ ID NO:20 представляет рMD129 последовательность: аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 198W, 223E, 303E, 307L и 334P. SEQ ID NO:21 представляет SSM341 A9 последовательность: аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 303E, 307L и 334P. SEQ ID NO:22 представляет SSM341 G11 последовательность: аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 303D, 307L и 334P. SEQ ID NO:23 представляет SSM350 B11 последовательность: аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 306T, 307L и 334P. SEQ ID NO:24 представляет SSM350 C12 последовательность: аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 306G, 307L и 334P. SEQ ID NO:25 представляет SSM332 Q4 последовательность: аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 309Р, 307L и 334P. SEQ ID NO:26 представляет SSM365 В4 последовательность: аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 307L, 316S и 334P. SEQ ID NO:27 представляет SSM365 F4: аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 307L, 316P и 334P. SEQ ID NO:28 представляет SSM360 C7: аминокислотную последовательность мальтотетрагидролазы Pseudomonas saccharophila, имеющую мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 307L, 334P и 353T.
Подробное описание
В нижеследующих описании и примерах, если в тексте не оговорено иначе, дозы PS4-вариантных полипептидов даны в частях на миллион (микрограммы на грамм) муки. Например, обозначение “1 D34”, использованное в таблице 2, указывает на 1 часть на миллион pSac-D34 на основе массы к массе. Предпочтительно количества фермента или количества определяют на основе анализов активности в виде эквивалентов чистого ферментного белка, измеренного с помощью альбумина бычьей сыворотки (BSA) в качестве стандарта, используя анализ, описанный в Bradford (1976, A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72:248-254).
В описании различных вариантов PS4-вариантного полипептида, созданных или подразумеваемых в качестве охватываемых данным документом, будут приняты следующие обозначения для облегчения ссылки:
(i) в тех случаях, когда замещение включает число и букву, например, 141Р, то это относится к [положение в соответствии с системой нумерации/замещающая аминокислота]. Таким образом, например, замещение аминокислоты на пролин в положении 141 обозначается как 141Р;
(ii) в тех случаях, когда замещение включает букву, число и букву, например, А141Р, то это относится к [первоначальная аминокислота/положение в соответствии с системой нумерации/замещающая аминокислота]. Таким образом, например, замещение аланина на пролин в положении 141 обозначается как А141Р.
В тех случаях, когда возможно присутствие двух или более вероятных заместителей в конкретном положении, это будет обозначаться прилежащими буквами, которые необязательно могут быть разделены косой черточкой “/”, например, G303ED или G303E/D. Там, где в положении соответствующей аминокислоты может быть замещение на любую аминокислоту, это обозначается следующим образом [положение, в соответствии с системой нумерации/Х], например, 121Х.
Множественные мутации могут обозначаться наличием разделительных косых черточек “/”, например, А141Р/G223A, что означает мутации в положении 141 и 223 при замещении аланина пролином и глицина аланином, соответственно.
Если не указано иначе, то все технические и научные термины, использованные в данной работе, имеют то же самое значение, что и обычно подразумеваемое средним специалистом в данной области, к которой настоящее изобретение относится. Singleton, et al., Dictionary of Microbiology and Molecular Biology, 2d Ed., John Wiley and Sons, New York (1994), и Hale and Marham, The Happer Collins Dictionary of Biology, Harper Perennial, NY (1991) обеспечивают специалистов общим словарем по многим терминам, использованным в данном изобретении. Хотя любые методы и материалы, подобные или эквивалентные тем, которые описаны здесь, могут быть применены на практике или при тестировании данного изобретения, в нем описаны предпочтительные методы и материалы. Области числовых значений включают числовые значения, определяющие границы области. Если не указано иначе, нуклеиновые кислоты представлены слева направо в направлении от 5' к 3'; аминокислотные последовательности представлены слева направо в направлении от амино до карбокси, соответственно.
В практике данного изобретения будут использованы, если не указано иначе, обычные методики химии, молекулярной биологии, микробиологии, рекомбинантной ДНК и иммунологии, которые находятся на уровне способностей среднего специалиста в данной области. Такие методики изложены в литературе. См., например, J. Sambrооk, E. F. Fritsch, and T. Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Second Edition, Books 1-3, Cold Spring Harbor Laboratory Press; Ausubel, F. M. et al. (1995 and periodic supplements; Current Protocols in Molecular Biology, ch. 9,13, and 16, John Wiley & Sons, New York, N.Y.); B. Roe, J. Crabtree, and A. Kahn, 1996, DNA Isolation and Sequencing: Essential Techniques, John Wiley & Sons; J. M. Polak and James O'D. McGee, 1990, In Situ Hybridization: Principles and Practice, Oxford University Press; M. J. Gait (Editor), 1984, Oligonucleotide Synthesis: A Practical Approach, Irl Press; D. M. J. Lilley and J. E. Dahlberg, 1992, Methods of Enzymology: DNA Structure Part A: Synthesis and Physical Analysis of DNA Methods in Enzymology, Academic Press; Using Antibodies: A Laboratory Manual: Portable Protocol № 1 by Edward Harlow, David Lane, Ed Harlow (1999, Cold Spring Harbor Laboratory Press, ISBN 0-87969-544-7); Antibodies: A Laboratory Manual by Ed Harlow (Editor), David Lane (Editor) (1988, Cold Spring Harbor Laboratory Press, ISBN 0-87969-314-2), 1855, Lars-Inge Larsson "Immunocytochemistry: Theory and Practice", CRC Press inc., Baca Raton, Florida, 1988, ISBN 0-8493-6078-1, John D. Pound (ed); "Immunochemical Protocols, vol.80", in the series: "Methods in Molecular Biology", Humana Press, Totowa, New Jersey, 1998, ISBN 0-89603-493-3, Handbook of Drug Screening, edited by Ramakrishna Seethala, Prabhavathi B. Fernandes (2001, New York, NY, Marcel Dekker, ISBN 0-8247-0562-9); and Lab Ref: A Handbook of Recipes, Reagents, and Other Reference Tools for Use at the Bench, Edited Jane Roskams and Linda Rodgers, 2002, Cold Spring Harbor Laboratory, ISBN 0-87969-630-3. Каждый из перечисленных источников включен в данную работу посредством ссылки.
Все патенты и публикации, включающие все последовательности, раскрытые в таких патентах и публикациях, отнесенных к данной работе, в явной форме включены посредством ссылки.
PS4-вариантные полипептиды
Авторы предлагают немальтогенную экзоамилазу, имеющую замещение в одном или нескольких положениях, которое приводит к измененному свойству, предпочтительно, к измененной экзоспецифичности или измененной термостабильности, или к обоим свойствам относительно исходного фермента.
Кроме того, авторы предлагают композиции, включающие пищевые добавки, пищевые продукты, хлебобулочные изделия, композиции улучшителей, кормовые продукты, включающие животные корма, и т.д., содержащие полипептиды, которые обладают немальтогенной экзоамилазной активностью, а также способы получения и применения таких полипептидов и композиций. Авторы предлагают другие применения таких композиций, а именно в приготовлении детергентов, подсластителей, сиропов, и т.д. Композиции включают полипептид вместе, с по меньшей мере, одним другим компонентом. В частности авторы предлагают пищевые или кормовые добавки, содержащие полипептиды.
Такие полипептиды и нуклеиновые кислоты отличаются от их исходных последовательностей включением ряда мутаций и обозначены для удобства как “PS4-вариантные полипептиды”. Иными словами, последовательность PS4-вариантного полипептида или нуклеиновой кислоты отличается от исходной последовательности по ряду положений или остатков. В предпочтительных вариантах осуществления мутации включают аминокислотные замещения, т.е. замену одного аминокислотного остатка на другой. Таким образом, PS4-вариантные полипептиды содержат ряд замен в природе аминокислотного остатка в одном или нескольких положениях исходной последовательности.
Использованный в данной работе термин “вариант” следует понимать, как обозначающий молекулу, происходящую от исходной молекулы. Варианты включают полипептиды, а также нуклеиновые кислоты. Варианты включают замещения, инсерции, трансверсии и инверсии, наряду с другими превращениями, на одном или нескольких положениях. Варианты включают также усечения. Варианты включают гомологи и функциональные производные исходных молекул. Варианты включают последовательности, которые являются комплементарными последовательностям, которые способны к гибридизации с нуклеотидными последовательностями, представленными в данной работе.
Замещения для PS4-вариантных полипептидов
Авторы предлагают PS4-вариантные полипептиды с изменениями последовательностей, включающими аминокислотные замещения в немальтогенной экзоамилазной последовательности. Аминокислотное замещение может быть представлено в любом одном или нескольких положениях 26, 70, 121, 145, 146, 157, 158, 161, 188, 198, 223, 229, 272, 303, 306, 309, 316, 339 и 353 относительно нумерации положений последовательности экзоамилазы Pseudomonas saccharophila, представленной как SEQ ID NO:1.
Аминокислотная мутация может присутствовать в одном или нескольких положениях, выбранных из групп, состоящих из: (а) положений 121, 161, 223; (b) положений 146, 157, 158, 198, 229, 303, 306, 309, 316, 353; и (с) положений 26, 70, 145, 188, 272, 339; и любых комбинаций (а), (b) и (с).
Аминокислотное замещение может включать замену на 121F, 121Y, 121W, 161A, 223E, 223K. В альтернативном случае или в дополнение, аминокислотное замещение может включать замену на 146G, 146M, 157M, 158T, 158A, 158S, 198W, 198F, 229P, 303E, 303D, 306T, 306G, 309P, 316S, 316P, 316K, 316Q, 353T. Кроме того, в альтернативном случае или в дополнение аминокислотное замещение может включать замену на 26E, 70D, 1145D, 188S, 188T, 188H, 272Q, 339A, 339E.
Такие вариантные полипептиды обозначены в данном документе как “PS4-вариантные полипептиды”. Нуклеиновые кислоты, кодирующие такие вариантные полипептиды, также раскрыты и будут обозначаться для удобства как «PS4-вариантные нуклеиновые кислоты». PS4-вариантные полипептиды и нуклеиновые кислоты будут более подробно описаны ниже.
«Исходные» последовательности, т.е. последовательности, на которых основаны PS4-вариантные полипептиды и нуклеиновые кислоты, предпочтительно представляют собой полипептиды, имеющие немальтогенную экзоамилазную активность. Термины “исходные ферменты” и “исходные полипептиды” следует интерпретировать соответственно и использовать для обозначения ферментов и полипептидов, на которых основаны PS4-вариантные полипептиды. Они более подробно описаны ниже.
В особенно предпочтительных вариантах осуществления исходные последовательности представляют собой немальтогенные экзоамилазные ферменты, предпочтительно бактериальные немальтогенные экзоамилазные ферменты. В наиболее предпочтительных вариантах осуществления исходные последовательности содержат глюкан-1,4-альфа-мальтотетрагидролазу (ЕС 3.2.1.60). Предпочтительно исходная последовательность представляет собой последовательность, получаемую из видов Pseudomonas, например Pseudomonas saccharophilia или Pseudomonas stutzeri.
В некоторых вариантах осуществления исходный полипептид содержит или является гомологом последовательности немальтогенной экзоамилазы дикого типа, например, из Pseudomonas spp.
Таким образом, исходный полипептид может включать немальтогенную экзоамилазу из Pseudomonas saccharophilia, имеющую последовательность, представленную как SEQ ID NO:1. В других предпочтительных вариантах осуществления исходный полипептид включает немальтогенную экзоамилазу из Pseudomonas stutzeri, имеющую последовательность, представленную как SEQ ID NO:11, или немальтогенную экзоамилазу из Pseudomonas stutzeri, имеющую номер доступа в SWISS-PROT-Р13507.
С другой стороны, исходный полипептид может представлять собой вариант из любых последовательностей дикого типа, что означает, что исходный полипептид может быть сам по себе сконструирован или содержать PS4-вариантный полипептид.
Однако, как будет ясно специалисту в данной области, хотя PS4-вариантные полипептиды могут быть получены мутациями уже мутированных последовательностей, можно создать такие вариантные полипептиды, начиная от последовательности дикого типа (или фактически любой подходящей последовательности), идентификацией различий между начальной последовательностью и желаемым вариантом и введением требуемых мутаций в исходную последовательность для достижения желаемого варианта.
Родственные белки и нуклеиновые кислоты, предпочтительно имеющие последовательность или функциональную гомологию с последовательностью немальтогенной экзоамилазы Pseudomonas saccharophilia, представленной как SEQ ID NO:1, или с последовательностью немальтогенной экзоамилазы Pseudomonas stutzeri, представленной как SEQ ID NO:11, названы в данном документе членами “PS4-семейства”. Примеры немальтогенных экзоамилазных ферментов из “PS4-семейства”, подходящих для применения при получении PS4-вариантных полипептидов и нуклеиновых кислот, более подробно раскрыты ниже.
PS4-вариантные полипептиды, описанные в данном документе, предпочтительно сохраняют свойства исходных полипептидов и, кроме того, предпочтительно обладают дополнительными полезными свойствами, например повышенной активностью, или термостабильностью, или рН устойчивостью или любой их комбинацией (предпочтительно всеми). Это более подробно описано ниже.
Описанные здесь мутанты, полученные замещением в РS4, могут быть использованы для любой подходящей цели. Предпочтительно они могут быть использованы для целей, для которых подходит исходный фермент. В частности они могут быть использованы в любом применении, для которого используется экзомальтотетраогидролаза. В наиболее предпочтительных вариантах осуществления они обладают дополнительным преимуществом более высокой термостабильности, или более высокой экзоамилазной активности, или более высокой рН стабильности, или любой их комбинации. Примеры подходящих применений PS4-вариантных полипептидов и нуклеиновых кислот включают производство продовольствия, в частности выпекание хлеба, а также производство кормовых продуктов; дополнительные примеры подробно представлены ниже.
PS4-вариантные полипептиды могут включать одну или несколько мутаций в дополнение к представленным выше положениям. Это могут быть одна, две, три, четыре, пять, шесть, семь или более мутаций, предпочтительно замещений в дополнение к уже представленным мутациям. Также могут быть другие мутации, такие как делеции, инсерции, замещения, трансверсии, транзиции и инверсии, в одном или нескольких других положениях. Кроме того, для PS4-вариантов нет необходимости содержать все замещения в перечисленных положениях. В действительности у них могут отсутствовать одно, два, три, четыре или пять замещений, т.е. аминокислотный остаток дикого типа присутствует в таких положениях.
PS4-вариантные полипептиды на основе последовательностей дикого типа
В вариантах осуществления, где исходный полипептид включает последовательность дикого типа, PS4-вариантные полипептиды могут содержать последовательность дикого типа, но с мутацией в одном или нескольких положениях 121, 161 и 223, предпочтительно 121F, 121Y, 121W, 161A, 223E или 223K, предпочтительнее G121F, G121Y, G121W, S161A, G223E или G223K.
PS4-вариантные полипептиды могут содержать последовательность дикого типа или последовательности, представленные в предыдущем абзаце, но с мутацией в любом одном или нескольких положениях 146, 157, 158, 198, 229, 303, 306, 309, 316 или 353, предпочтительно 146G, 146M, 157M, 158T, 158A, 158S, 198W, 198F, 229P, 303E, 303D, 306T, 306G, 309P, 316S, 316P, 316K, 316Q или 353T, предпочтительнее 146G, 157M, 158T, 198W, 229P, 303E, 303D, 306T, 306G, 309P, 316S, 316P или 353T.
PS4-вариантные полипептиды могут содержать последовательность дикого типа или последовательность, представленную в двух предыдущих параграфах, но с мутацией в любом одном или нескольких положениях 26, 70, 145, 188, 272 или 339, предпочтительно 26Е, 26D, 70D, 145D, 188S, 188T, 188H, 272Q, 339A или 339Е, предпочтительнее N26E, N26D, G70D, N145D, G188S, G188T, G188H, H272Q, W339A или W339E.
В целом любая комбинация положений, замещений и специфических мутаций может быть скомбинирована любым способом и в любом количестве для получения PS4-вариантных полипептидов, раскрытых в данной работе.
Таким образом, авторы раскрывают PS4-вариантные полипептиды, основанные на исходной последовательности PS4 дикого типа, предпочтительно на немальтогенной экзоамилазе Pseudomonas saccharophilia, имеющей последовательность, представленную как SEQ ID NO:1. Таким образом, PS4-вариантные полипептиды могут содержать последовательность, представленную как SEQ ID NO:1, но с любой одной или несколькими мутациями в положениях, представленных выше. PS4-вариантные полипептиды также могут быть основаны на последовательности немальтогенного фермента Pseudomonas stutzeri дикого типа, представленной как SEQ ID NO:7 ниже, но с любой одной или несколькими мутациями в положениях, представленных выше.
Хотя PS4-вариантные полипептиды могут быть основаны на исходных последовательностях PS4-дикого типа, в предпочитаемых вариантах осуществления PS4-вариантные полипептиды основаны на сконструированных генной инженерией (или мутированных) версиях исходных последовательностей PS4-дикого типа. Следовательно, такие варианты осуществления, исходные последовательности включают уже мутированные PS4-последовательности. Такие последовательности могут быть сделаны заново (de novo) или мутированием базовой последовательности, один или несколько раз, как описано более детально ниже.
Положения 121, 161 и/или 223
PS4-вариантный полипептид может содержать последовательность дикого типа или мутантную последовательность, являющуюся вариантом последовательности дикого типа, такую, как уже мутированная последовательность, с замещениями в еще одном из положений, таких как 121, 161 и 223.
Таким образом, в основном объект мутации или мутаций в соответствующем положении или положениях может быть выгодно скомбинирован с одиночной дополнительной мутацией в одном, двух или всех положениях 121, 161 или 223.
Замещение в положении 121 в случае, когда присутствует, предпочтительно выбрано из группы, состоящей из 121F, 121Y, 121W, 121H, 121A, 121M, 121G, 121S, 121T, 121D, 121E, 121L, 121K и 121V. Предпочтительно, замещение в положении 121 представляет собой 121F, 121Y или 121W. Замещение в положении 161 в случае, когда присутствует, предпочтительно представляет собой 161А, более предпочтительно S161A. В случае, когда положение 161 мутируют, дополнительная мутация в положении 160 также может присутствовать, предпочтительно 160D, более предпочтительно Е160D.
Замещение в положении 223 в случае, когда присутствует, предпочтительно выбрано из группы, состоящей из 223K, 223Е, 223V, 223R, 223A, 223P и 223D. Предпочтительно, замещение в положении 223 представляет собой 223E или 223K. В особенно предпочтительных вариантах осуществления дополнительное замещение или замещения выбраны из группы, состоящей из G121F, G121Y, G121W, 161A, 223E и 223K.
В особенно предпочтительных вариантах осуществления PS4-вариантный полипептид содержит, по меньшей мере, три следующих замещения: 121F/Y/W, 161A, 223E/K. Могут быть включены другие мутации, представленные ниже.
Положения 146, 157, 158, 198, 229, 303, 306, 309, 316 и 353
PS4-вариантный полипептид может содержать последовательность дикого типа или мутантную последовательность, являющуюся вариантом последовательности дикого типа, такую, как уже мутированная последовательность - включающая PS4-вариантный полипептид, имеющий мутацию в одном или нескольких положениях 121, 161 и 223 - с замещениями еще в одном из положений, таких как положения 146, 157, 158, 198, 229, 303, 306, 309, 316 и 353.
Положения 26, 70, 145, 188, 272 и 339
PS4-вариантный полипептид может содержать последовательность дикого типа или мутантную последовательность, являющуюся вариантом последовательности дикого типа, такую, как уже мутированная последовательность - включающая PS4-вариантный полипептид, имеющий мутацию в одном или нескольких положениях 121, 161, 223, 146, 157, 158, 198, 229, 303, 306, 309, 316 и 353 - с замещениями еще в одном из положений, таких как положения 26, 70, 145, 188, 272 и 339.
Таким образом, обычно объект мутации или мутаций в соответствующем положении или положениях можно выгодно комбинировать с одиночной дополнительной мутацией в одном, двух или всех положениях 26, 70, 145, 188, 272 и 339.
PS4-вариантный полипептид может содержать замещение в положении 26, предпочтительно 26Е или 26D. Более предпочтительно замещение в положении 26 включает N26E или N26D. Наиболее предпочтительно замещение в положении 26 включает N26E.
PS4-вариантный полипептид может содержать замещение в положении 70, предпочтительно 70D. Предпочтительнее замещение в положении 70 включает G70D.
PS4-вариантный полипептид может содержать замещение в положении 145, предпочтительно 145D. Предпочтительнее замещение в положении 145 включает N145D.
PS4-вариантный полипептид может содержать замещение в положении 188, предпочтительно 188S, 188T или 188H. Предпочтительнее замещение в положении 188 включает G188S, G188T или G188H. Наиболее предпочтительно замещение в положении 188 включает G188S или G188H.
PS4-вариантный полипептид может содержать замещение в положении 272, предпочтительно 272Q. Предпочтительнее замещение в положении 272 включает H272Q.
PS4-вариантный полипептид может содержать замещение в положении W339A, предпочтительно 339A или 339E. Предпочтительнее замещение в положении 339 включает W339A или W339E.
PS4-вариантные полипептиды на основе вариантных последовательностей
Комбинации с положениями 33, 34, 121, 134, 141, 157, 178, 179, 223, 307 и/или 334
В некоторых вариантах осуществления исходные последовательности содержат мутации в одном или нескольких, предпочтительно во всех, положениях 33, 34, 121, 134, 141, 157, 178, 179, 223, 307 и 334 (и соответственно PS4-вариантные полипептиды будут также содержать относящиеся к делу соответствующие мутации).
В таких вариантах осуществления мутации предпочтительно представляют одну или несколько мутаций, предпочтительно все из следующих: N33Y, D34N, G121D, G134R, A141P, I157L, L178F, A179T, G223A, H307L и S334P.
В таких вариантах осуществления PS4-вариантный полипептид можно удобно получить из последовательности немальтогенного фермента Pseudomonas saccharophilia, содержащей последовательность Psac-D34(SEQ ID NO:2).
Комбинации с положениями 33, 34, 121, 134, 141, 157, 178, 179, 223, 307 и 334, 121, 161 и/или 223
PS4-вариантные полипептиды могут дополнительно содержать мутации в любом из положений 33, 34, 121, 134, 141, 157, 178, 179, 223, 307 и 334 в комбинации с мутациями в любом из положений 121, 161 и/или 223. Таким образом, авторы раскрывают PS4-вариантный полипептид, включающий любую комбинацию из: (а) любая одна или несколько мутаций в остатках 33, 34, 121, 134, 141, 157, 178, 179, 223, 307 и 334, предпочтительно N33Y, D34N, G121D, G134R, A141P, I157L, L178F, A179T, G223A, H307L и S334P; (b) любая одна или несколько мутаций в положениях 121, 161 или 223, предпочтительно 121F, 121Y, 121W, 161A, 223E или 223K, предпочтительнее 121F, 161A или 223E, и (с) любая одна или несколько мутаций в положениях 146, 157, 158, 198, 229, 303, 306, 309, 316 или 353, предпочтительно 146G, 146M, 157M, 158T, 158A, 158S, 198W, 198F, 229P, 303E, 303D, 306T, 306G, 309P, 316S, 316P, 316K, 316Q или 353T, предпочтительнее 146G, 157M, 158T, 198W, 229P, 303E, 303D, 306T, 306G, 309P, 316S, 316P или 353T.
В некоторых вариантах осуществления авторы предлагают PS4-вариантный полипептид, содержащий все из следующих мутаций, представленных в (а) выше, в комбинации с одной или несколькими мутациями, представленными в (с) выше. В других вариантах осуществления авторы предлагают PS4-вариантный полипептид, содержащий все из дополнительных мутаций, представленных в (а) выше, в комбинации со всеми мутациями, представленными в (b) выше, в комбинации с любой одной или несколькими мутациями, представленными в (с) выше.
PS4-вариантные полипептиды на основе рМD96
В вариантах осуществления, где включены мутации из всех (а) и (b), PS4-вариантный полипептид может быть удобно получен из последовательности немальтогенного фермента Pseudomonas saccharophilia, содержащей последовательность рМD96 (SEQ ID NO:14).
Таким образом, авторы, в частности, предлагают PS4-вариантные полипептиды, представленные в примерах 12-20, имеющие последовательности SEQ ID NO:15-28. Как показано в примерах, каждый из данных полипептидов обладает одним или несколькими улучшенными свойствами по сравнению с исходным полипептидом.
Другие комбинации
Кроме того, также могут быть использованы исходные последовательности, содержащие мутации в других положениях, например, в любом одном или нескольких положениях из 134, 141, 157, 223, 307 и 334. Необязательно, они могут включать мутации либо в одном, либо в обоих положениях 33 и 34.
Таким образом, исходная последовательность может содержать одну или несколько мутаций в положениях, выбранных из группы, состоящей из 134, 141, 157, 223, 307, 334 и необязательно 33 и 34 (и соответственно, конечно, PS4-вариантные полипептиды будут также содержать относящиеся к делу соответствующие мутации).
В некоторых вариантах осуществления исходные полипептиды содержат замещения на аргинин в положении 134, пролин в положении 141 и пролин в положении 334, например G134R, A141P и S334P.
В следующих вариантах осуществления исходный полипептид дополнительно содержит мутацию в положении 121. Исходный полипептид может дополнительно содержать мутацию в положении 178. Он может дополнительно содержать мутацию в положении 179. Он может дополнительно содержать мутацию в положении 87. Соответствующие особенно предпочтительные замещения представляют собой предпочтительно 121D, предпочтительнее G121D, предпочтительно 178F, предпочтительнее L128F, предпочтительно 179T, предпочтительнее A179T, предпочтительно 87S, предпочтительнее G87S.
Остатки в данных положениях могут быть замещены рядом остатков, например, I157V, или I157N, или G223L, или G223I, или G223S, или G223T, или H307I, или H307V, или D34G, или D34A, или D34S, или D34T, или A179V. Однако исходные полипептиды предпочтительно содержат замещения I157L, G223A, H307L, L178F и A179T (необязательно N33Y, D34N).
В особенно предпочтительном варианте осуществления PS4-вариантные полипептиды содержат замещение в любом одном или нескольких положениях 146, 157, 158, 198, 229, 303, 306, 309, 316 и 353, предпочтительно 146G, 157M, 158T, 198W, 229P, 303E, 303D, 306T, 306G, 309P, 316S, 316P или 353T, а также одно или несколько следующих замещений: G134R, A141P, I157L, G223A, H307L, S334P, N33Y и D34N вместе с одним или обоими замещениями L178F и A179T.
PS4-вариантные полипептиды на основе Psac-D20
PS4-варианты могут быть основаны на последовательности немальтогенного исходного фермента Pseudomonas saccharophilia - Psac-D20 (SEQ ID NO:3).
В таком варианте осуществления PS4-вариантные полипептиды содержат замещение в любом одном или нескольких положениях 146, 157, 158, 198, 229, 303, 306, 309, 316 и 353, предпочтительно 146G, 157M, 158T, 198W, 229P, 303E, 303D, 306T, 306G, 309P, 316S, 316P или 353T, а также одно или несколько следующих замещений: G134R, A141P, I157L, G223A, H307L, S334P, N33Y, D34N и G121D вместе с одним или обоими замещениями L178F и A179T.
PS4-вариантные полипептиды на основе Psac-D14
PS4-варианты могут быть основаны на последовательности немальтогенного исходного фермента Pseudomonas saccharophilia - Psac-D14 (SEQ ID NO:4).
В таком варианте осуществления PS4-вариантные полипептиды содержат замещение в любом одном или нескольких положениях 146, 157, 158, 198, 229, 303, 306, 309, 316 и 353, предпочтительно 146G, 157M, 158T, 198W, 229P, 303E, 303D, 306T, 306G, 309P, 316S, 316P или 353T, а также одно или несколько следующих замещений: G134R, A141P, I157L, G223A, H307L, S334P, N33Y, D34N, G121D и G87S вместе с одним или обоими замещениями L178F и A179T.
PS4-вариантные полипептиды на основе pMD55
PS4-варианты могут быть основаны на последовательности немальтогенного исходного фермента Pseudomonas saccharophilia - pMD55 (SEQ ID NO:13).
В таком варианте осуществления PS4-вариантные полипептиды содержат замещение в любом одном или нескольких положениях 146, 157, 158, 198, 229, 303, 306, 309, 316 и 353, предпочтительно 146G, 157M, 158T, 198W, 229P, 303E, 303D, 306T, 306G, 309P, 316S, 316P или 353T, а также одно или несколько следующих замещений: G134R, A141P, I157L, G223A, H307L, S334P, N33Y, D34N, G121F и G87S вместе с одним или обоими замещениями L178F и A179T. PS4-вариантный полипептид может быть получен из исходного полипептида, имеющего такие замещения.
PS4-вариантные полипептиды на основе исходных полипептидов Pseudomonas stutzeri
В некоторых вариантах осуществления PS4-варианты получены из последовательности немальтогенного фермента Pseudomonas stutzeri, предпочтительно представленной как SEQ ID NO:7 ниже.
Соответственно, PS4-вариантный полипептид может быть получен из последовательности PStu-D34 (SEQ ID NO:8). Авторы далее раскрывают PS4-вариантные полипептиды, основанные на последовательности немальтогенного фермента Pseudomonas stutzeri и включении G121 и/или G87 замещений. Они могут содержать следующие замещения: G134R, A141P, I157L, G223A, H307L, S334P, N33Y, D34N и G121D вместе с одним или обоими замещениями L178F и A179T, а также PS4-вариантные полипептиды, включающие следующие замещения: G134R, A141P, I157L, G223A, H307L, S334P, N33Y, D34N, G121D и G87S вместе с одним или обоими замещениями L178F и A179T.
Поэтому PS4-вариантный полипептид может быть получен из исходной последовательности немальтогенного фермента Pseudomonas stutzeri, и эта исходная последовательность может иметь последовательность PStu-D20 (SEQ ID NO:9), содержащую G121D, или последовательность PStu-D14 (SEQ ID NO:10), дополнительно содержащую G87S.
PS4-вариантные нуклеиновые кислоты
Авторы также раскрывают PS4-нуклеиновые кислоты, имеющие последовательности, которые соответствуют или кодируют изменения в последовательностях PS4-вариантных полипептидов, для применения при получении таких полипептидов для целей, описанных в данной работе. Таким образом, авторы предлагают нуклеиновые кислоты, способные кодировать любую полипептидную последовательность, представленную в данном документе.
Специалист будет представлять взаимосвязь между последовательностью нуклеиновых кислот и последовательностью полипептидов, в частности, между генетическим кодом и вырожденностью данного кода, и он способен сконструировать такие PS4-нуклеиновые кислоты без трудностей. Например, он будет представлять, что для каждого аминокислотного замещения в последовательности PS4-вариантного полипептида может быть один или несколько кодонов, которые кодируют замещающую аминокислоту. Соответственно будет очевидно, что в зависимости от вырожденности генетического кода по отношению к коду определенного аминокислотного остатка могут быть получены одна или несколько последовательностей PS4-нуклеиновых кислот, соответствующие этой PS4-вариантной полипептидной последовательности. Кроме того, в случае, когда PS4-вариантный полипептид включает более одного замещения, например А141Р/G223A, соответствующие PS4-нуклеиновые кислоты могут включать парные комбинации кодонов, которые соответственно кодируют две аминокислотных замены.
Последовательности PS4-вариантных нуклеиновых кислот могут быть получены из исходных нуклеиновых кислот, которые кодируют любой из исходных полипептидов, описанных выше. В частности, исходные нуклеиновые кислоты могут содержать последовательности дикого типа, например, SEQ ID NO:6 или SEQ ID NO:12. PS4-вариантные нуклеиновые кислоты могут поэтому содержать как нуклеиновые кислоты, кодирующие немальтогенные экзоамилазы дикого типа, так и те, которые кодируют другую аминокислоту в соответствующем положении вместо аминокислотного остатка, содержащегося в диком типе. Последовательности PS4-вариантных нуклеиновых кислот могут также содержать последовательности дикого типа с одной или несколькими мутациями, например, которые кодируют исходные полипептиды, описанные выше как “комбинации”.
Следует понимать, что последовательности нуклеиновых кислот, которые не идентичны конкретным последовательностям PS4-вариантных нуклеиновых кислот, но являютcя родственными им, также будут применимы для способов и композиций, описанных в данной работе, таких как вариант, гомолог, производное или фрагмент последовательности PS4-вариантной нуклеиновой кислоты или их комплементарная последовательность или последовательность, способная к гибридизации с ней. Если в тексте не указано иначе, то термин “PS4-вариантная нуклеиновая кислота” предназначен для включения каждого из данных понятий, перечисленных выше.
Мутации в аминокислотной последовательности и последовательности нуклеиновых кислот могут быть осуществлены по любой из ряда методик, известных в данной области. Вариантные последовательности могут быть легко сделаны по любой из известных методик мутагенеза, например сайт-направленного мутагенеза с применением PCR c соответствующими олигонуклеотидными праймерами, 5' add-on мутагенеза, мутагенеза ошибочно спаренных праймеров и т.д. В альтернативном случае или в дополнение последовательности PS4-вариантных нуклеиновых кислот могут быть созданы de novo/заново.
В особенно предпочтительных вариантах осуществления мутации вводят в исходные последовательности способами PCR (полимеразная цепная реакция) с использованием соответствующих праймеров, проиллюстрированных в примерах. Поэтому можно изменять последовательность полипептида введением любых желаемых аминокислотных замещений в исходный полипептид, предпочтительно имеющий немальтогенную экзоамилазную активность, такую как у последовательности экзоамилазы Pseudomonas saccharophilia или Pseudomonas stutzeri, на уровне аминокислот или нуклеиновых кислот, как описано. Авторы описывают способ, по которому последовательность немальтогенной экзоамилазы меняется в результате изменения последовательности нуклеиновой кислоты, которая кодирует немальтогенную экзоамилазу.
Однако следует, конечно, отметить, что фактически нет необходимости в том, чтобы PS4-вариантный полипептид получать действительно из полипептида дикого типа или последовательности нуклеиновых кислот, например, поступенчатой мутацией. Скорее, как только последовательность PS4-вариантного полипептида установлена, специалист может легко сделать такую последовательность из дикого типа со всеми мутациями, с помощью способов, известных в данной области, например, использованием соответствующих олигонуклеотидных праймеров и PCR. Фактически PS4-вариантный полипептид может быть сделан de novo/заново cо всеми мутациями посредством, например, методологии пептидного синтеза.
В основном, однако, PS4-вариантные полипептиды и/или нуклеиновые кислоты получены или могут быть получены из последовательности “предшественника”. Термин “предшественник”, применяемый в данной работе, означает фермент, который предшествует ферменту, который модифицируют способами и композициями, описанными в данной работе. Следовательно, предшественник включает фермент, используемый для получения модифицированного фермента. Таким образом, предшественник может представлять собой фермент, который модифицируют мутагенезом, описанным в другом месте в данном документе. Также предшественник может представлять собой фермент дикого типа, вариантный фермент дикого типа или уже мутированный фермент.
PS4-вариантные полипептиды и нуклеиновые кислоты могут быть получены любыми способами, известными в данной области. Конкретно, они могут быть экспрессированы из систем экспрессии, что может быть осуществлено in vitro или in vivo в природе. Конкретно авторы описывают плазмиды и векторы экспрессии, содержащие последовательности PS4-нуклеиновых кислот, предпочтительно способные экспрессировать PS4-вариантные полипептиды. Также раскрываются клетки и клетки-хозяева, которые включают и предпочтительно трансформированы с помощью таких PS4-нуклеиновых кислот, плазмиды и векторы, и следует ясно представлять, что все они также охватываются данным документом.
В предпочтительных вариантах осуществления PS4-вариантная полипептидная последовательность используется как пищевая добавка в выделенной форме. Термин “выделенная” означает, что последовательность является, по меньшей мере, в основном свободной от, по меньшей мере, одного другого компонента, с которым данная последовательность естественно связана в природе и находится в природе. В одном аспекте последовательность предпочтительно находится в очищенной форме. Термин “очищенная” означает, что последовательность находится в относительно чистом состоянии - например, по меньшей мере, примерно 90% чистоты, или, по меньшей мере, примерно 95% чистоты или, по меньшей мере, примерно 98% чистоты.
Нумерация положений
Все положения, касающиеся нумерации в настоящем документе, относятся к нумерации эталонной последовательности экзоамилазы Pseudomonas saccharophilia, показанной ниже (SEQ ID NO:1):

Эталонная последовательность получена из последовательности Pseudomonas saccharophilia, имеющей номер доступа в SWISS-PROT -Р22963, но без сигнальной последовательности MSHILRAAVLAAVLLPFPALA.
C-концевой крахмалосвязывающий домен EGGLVNVNFR CDNGVTQMGD SVYAVGNVSQ LGNWSPASAV RLTDTSSYPT WKGSIALPDG QNVEWKCLIR NEADATLVRQ WQSGGNNQVQ AAAGASTSGS F необязательно может быть проигнорирован. В альтернативном случае он может быть включен.
В контексте данного описания использована специфическая нумерация положений аминокислотных остатков в PS4-экзоамилазных ферментах. В этом отношении выравниванием аминокислотных последовательностей различных известных экзоамилаз можно точно приписать номер положения аминокислоты в экзоамилазе для любого положения аминокислотного остатка в любом экзоамилазном ферменте, аминокислотная последовательность которого известна. Применением данной системы нумерации, происходящей, например, от аминокислотной последовательности экзоамилазы, полученной из Pseudomonas saccharophilia, совмещенной с аминокислотными последовательностями ряда других известных экзоамилаз, можно точно указать положение аминокислотного остатка в экзоамилазе.
Следовательно, система нумерации, даже если она может использовать определенную последовательность в качестве основной эталонной точки, является применимой ко всем релевантным гомологичным последовательностям. Например, нумерация положений может быть применена к гомологичным последовательностям от других видов Pseudomonas или гомологичным последовательностям от других бактерий. Предпочтительно, такие гомологи имеют 60% гомологии или выше, например 70% или более, 80% или более, 90% или более либо 95% или более гомологии, с эталонной последовательностью SEQ ID NO:1, указанной выше, или последовательностями с номерами доступа в SWISS-PROT - Р22963 или Р13507, предпочтительно со всеми данными последовательностями. Гомология последовательностей между белками может быть установлена применением хорошо известных программ по выравниванию и методик гибридизации, описанных в данной работе. Такие гомологичные последовательности, а также функциональные эквиваленты, описанные ниже, будут называться в данном документе как “PS4-семейство”.
Кроме того, и как указано выше, система нумерации, использованная в данном документе, делает ссылку на эталонную последовательность SEQ ID NO:1, которая получена из последовательности Pseudomonas saccharophilia, имеющей номер доступа в SWISS-PROT-Р22963, но без сигнальной последовательности MSHILRAAVLAAVLLPFPALA. Данная сигнальная последовательность локализована на N-конце эталонной последовательности и состоит из 21 аминокислотного остатка. Следовательно, будет легко идентифицировать конкретные остатки, предназначенные для мутации, или замещенные в соответствующих последовательностях, содержащих сигнальную последовательность, или фактически, соответствующие последовательности, содержащие любые другие N- или C-концевые удлинения или делеции. Что касается N-концевых добавлений или делеций, то все, что требуется, заключается в обозначении нумерации положения с помощью номера остатков, вставленных или утраченных. Например, положение 1 в SEQ ID NO:1 соответствует положению 22 в последовательности с сигнальной последовательностью.
Исходный фермент/Полипептид
PS4-вариантные полипептиды получены из или представляют собой варианты другой последовательности, известной как “исходный фермент”, “исходный полипептид” или “исходная последовательность”.
Используемый в данном документе термин “исходный фермент” означает фермент, который обладает близкой, предпочтительно самой близкой химической структурой с получающимся в результате вариантом, т.е. с PS4-вариантным полипептидом или нуклеиновой кислотой. Исходный фермент может представлять собой предшественник фермента (т.е. фермент, который фактически изменен) или он может быть приготовлен de novo/заново. Исходный фермент может быть ферментом дикого типа или он может быть ферментом дикого типа, включающим одну или несколько мутаций.
Примененный в данном документе термин “предшественник” означает фермент, который предшествует ферменту, который модифицируется для получения фермента. Следовательно, предшественник может быть ферментом, который модифицируют мутагенезом. Также предшественник может быть ферментом дикого типа, вариантным ферментом дикого типа или уже мутированным ферментом.
Термин “дикий тип” является термином из области, понятной специалистам, и означает фенотип, который характерен для большинства представителей из видов, находящихся в природе, и отличается от мутантного фенотипа. Таким образом, в данном контексте фермент дикого типа представляет собой форму фермента, найденного в природе в большинстве представителей релевантных видов. Большей частью релевантный фермент дикого типа в связи с вариантными полипептидами, описанными в данной работе, представляет собой самый близко родственный соответствующий фермент дикого типа в терминах гомологии последовательностей. Однако в случае, когда использована определенная последовательность дикого типа в качестве основы для получения вариантного PS4-полипептида, описанного в данной работе, это будет последовательность соответствующего дикого типа независимо от наличия другой последовательности дикого типа, которая является более близко родственной в терминах гомологии аминокислотной последовательности.
Исходный фермент предпочтительно представляет собой полипептид, который предпочтительно ингибирует немальтогенную экзоамилазную активность. Предпочтительно исходный фермент как таковой представляет собой немальтогенную экзоамилазу. Например, исходный фермент может представлять собой немальтогенную экзоамилазу Pseudomonas saccharophilia, такую как полипептид, имеющий номер доступа в SWISS-PROT - Р22963, или Pseudomonas stutzeri немальтогенную экзоамилазу, такую как полипептид, имеющий номер доступа в SWISS-PROT - Р13507.
Другие представители PS4-семейства могут быть использованы как исходные ферменты; такие “представители PS4-семейства” обычно будут подобными, гомологами или функциональными эквивалентами любого из данных двух ферментов и могут быть идентифицированы стандартными способами, такими как гибридизационный скрининг с использованием подходящих библиотек с использованием зондов или анализ генома методом секвенирования.
В частности, функциональные эквиваленты любого из данных двух ферментов, а также другие представители “PS4-семейства” могут быть также использованы в качестве отправных точек или исходных полипептидов для получения PS4-вариантных полипептидов, описанных в данной работе.
“Функциональный эквивалент” белка означает то, что имеет одну или несколько, предпочтительно, по существу, все функции такого белка. Предпочтительно, такие функции представляют собой биологические функции, предпочтительно ферментативные функции, такие как амилазная активность, предпочтительно немальтогенная экзоамилазная активность. В связи с исходным ферментом термин “функциональный эквивалент” предпочтительно означает молекулу, обладающую подобной или идентичной функцией исходной молекулы. Исходная молекула может представлять собой немальтогенную экзоамилазу из Pseudomonas saccharophilia, или немальтогенную экзоамилазу из Pseudomonas stutzeri, или полипептид, полученный из других источников.
Термин “функциональный эквивалент” в связи с исходным ферментом, являющимся немальтогенной экзоамилазой из Pseudomonas saccharophilia, такой как полипептид, имеющий номер доступа в SWISS-PROT - Р22963, или немальтогенной экзоамилазой из Pseudomonas stutzeri, такой как полипептид, имеющий номер доступа в SWISS-PROT - Р13507, означает, что функциональный эквивалент мог быть получен из других источников. Функционально эквивалентный фермент может иметь отличающуюся последовательность, но будет обладать немальтогенной экзоамилазной активностью. Примеры анализов по определению функциональности описаны в данной работе и известны для специалиста в данной области.
В наиболее предпочтительных вариантах осуществления функциональный эквивалент будет иметь гомологию последовательности с любой из Pseudomonas saccharophilia и Pseudomonas stutzeri немальтогенных экзоамилаз, приведенных выше, предпочтительно с обеими. Функциональный эквивалент может также иметь гомологию последовательности с любой из последовательностей, представленных как SEQ ID NO:1-14, предпочтительно SEQ ID NO:1, или SEQ ID NO:7, или с обеими. Гомология последовательностей между такими последовательностями равна предпочтительно, по меньшей мере, 60%, предпочтительно 65% или более, предпочтительно 75% или более, предпочтительно 80% или более, предпочтительно 85% или более, предпочтительно 90% или более, предпочтительно 95% или более. Такие гомологии последовательности могут быть генерированы любым набором компьютерных программ, известных в данной области, например BLAST и FASTA, и т.д. Подходящая компьютерная программа для осуществления такого выравнивания представляет собой пакет GCG Wisconsin Bestfit (University of Wisconsin, U.S.A.; Devereux et al.1984, Nucleic Acids Research 12:387). Примеры других программных обеспечений, которые могут проводить сравнения последовательностей, включают, но без ограничения, BLAST пакет (см., Ausubel et al., 1999 ibid - Chapter 18), FASTA (Atschul et al., 1990, J. Mol. Biol., 403-410) и GENEWORKS набор средств сравнения. Как BLAST, так и FASTA являются доступными для режимов offline и online (см. Ausubel et al., 1999 ibid, pages 7-58 to 7-60). Однако предпочитают использовать программу GCG Bestfit.
В других вариантах осуществления функциональные эквиваленты будут способны к специфической гибридизации с любой из последовательностей, приведенных выше. Способы определения, способна ли одна последовательность к гибридизации с другой, известны в данной области и описаны, например, в Sambrook, et al. (см. выше) и Ausubel, F.M. et al. (см. выше). В наиболее предпочтительных вариантах осуществления функциональный эквивалент будет способен к гибридизации в строгих условиях, например, 65°С и 0,1×SSC {1×SSC = 0,15 M NaCl, 0,015 M Na3цитрат рН 7,0}.
Например, функциональные эквиваленты, которые имеют гомологию последовательностей с немальтогенными экзоамилазами из Pseudomonas saccharophilia и Pseudomonas stutzeri, являются подходящими для применения в качестве исходных ферментов. Такие последовательности могут отличаться от последовательности Pseudomonas saccharophilia в одном или нескольких положениях. Кроме того, немальтогенные экзоамилазы из других штаммов Pseudomonas spp, таких как АТСС17686, могут быть также использованы в качестве исходного полипептида. Остатки PS4-вариантного полипептида могут быть вставлены в любую из данных исходных последовательностей для получения последовательностей вариантного PS4-полипептида.
Следует понимать, что в случаях, где желательно, чтобы PS4-вариантные полипептиды дополнительно включали одну или несколько мутаций, представленных выше, соответствующие мутации могут быть сделаны в последовательностях нуклеиновых кислот функциональных эквивалентов немальтогенной экзоамилазы из Pseudomonas spp, а также других представителей “PS4-семейства” для того, чтобы их можно было использовать в качестве отправных точек или исходных полипептидов для получения PS4-вариантных полипептидов, описанных в данной работе.
Специально включенными в рамки термина “PS4-вариантные полипептиды” являются полипептиды, раскрытые в: US 60/485413, 60/485539 и 60/485616; PCT/US2004/021723 и PCT/US2004/021739; US 10/886905 и US 10/886903; US 60/608919; US 60/612407; US 60/485539; PCT/IB2004/002487; US 10/886023; US 10/886505, US 10/886527 и US 10/886504; US 10/947612.
Такие полипептиды подходят для использования в применениях, описанных в данной работе, в частности, как пищевые добавки, для обработки крахмала, как описано, для приготовления пищевого продукта, для приготовления хлебобулочного продукта, для приготовления композиций улучшителя, для приготовления комбинаций и т.д.
Модификация исходных последовательностей
Исходные ферменты можно модифицировать на уровне аминокислот или на уровне нуклеиновых кислот для получения PS4-вариантных последовательностей, описанных в данной работе. Поэтому авторы предлагают получение PS4-вариантных полипептидов путем введения одного или нескольких изменений в соответствующем кодоне нуклеотидной последовательности, кодирующей полипептид немальтогенной экзоамилазы.
Нумерация нуклеиновых кислот должна предпочтительно соответствовать нумерации положений нуклеотидной последовательности экзоамилазы из Pseudomonas saccharophilia, представленной как SEQ ID NO:6. В альтернативном случае или в дополнение ссылка может быть сделана на последовательность с номером доступа в GenBank - Х16732. В предпочтительных вариантах осуществления нумерация нуклеиновых кислот должна соответствовать нуклеотидной последовательности, представленной как SEQ ID NO:6. Однако так же, как с нумерацией аминокислотных остатков, нумерация остатков данной последовательности должна быть применена только для целей ссылки. В частности, следует отметить, что вышеуказанные изменения в кодоне могут быть сделаны в любой последовательности нуклеиновых кислот PS4-семейства. Например, изменения последовательности могут быть сделаны в последовательности нуклеиновых кислот немальтогенных экзоамилаз из Pseudomonas saccharophilia и Pseudomonas stutzeri (например, Х16732, SEQ ID NO:6 или M24516, SEQ ID NO:12).
Исходный фермент может включать “полный” фермент, т.е. в его полной протяженности, как он находится в природе (или в качестве мутированного), или он может включать его укороченную форму. PS4-вариант, полученный из такого фермента, может быть соответственно также укороченным или быть “полной длины”. Укорачивание может быть на N-терминальном конце или С-терминальном конце, предпочтительно на С-терминальном конце. Исходный фермент или PS-вариант может не содержать одного или нескольких участков, таких как субпоследовательности, сигнальные последовательности, домены или фрагменты, независимо от того, активные ли они и т.д. Например, исходный фермент или PS4-вариантный полипептид может не содержать сигнальной последовательности, как описано выше. В альтернативном случае или в дополнение исходный фермент или PS4-вариант может не содержать один или несколько каталитических или связывающих доменов.
В наиболее предпочтительных вариантах осуществления исходный фермент или PS4-вариант может не содержать один или несколько доменов, присутствующих в немальтогенных экзоамилазах, такой как крахмалосвязывающий домен. Например, PS4-полипептиды могут иметь только последовательность вплоть до положения 429, относящегося к нумерации немальтогенной экзоамилазы Pseudomonas saccharophilia, представленной как SEQ ID NO:1. Следует отметить, что это характерно для случая PS4-вариантов рSac-D34, рSac-D20 и рSac-D14.
В других вариантах осуществления исходный фермент или PS4-вариант может включать “полный” фермент, т.е. в его полной протяженности, как он находится в природе (или в качестве мутированного), вместе с одной или несколькими дополнительными последовательностями на N-конце или С-конце. Например, исходный фермент или PS4-вариантный полипептид может включать единственный экстрааминокислотный остаток на С-конце или N-конце, например, M, A, G и т.д. Предпочтительно дополнительный аминокислотный остаток присутствует на N-конце. В случаях, где включены один или несколько дополнительных остатков, нумерация положений будет продолжена в длину добавлением.
Амилаза
PS4-вариантные полипептиды обычно обладают активностью амилазы.
Термин “амилаза” использован в его обычном значении - например фермент, который, между прочим, способен катализировать разложение крахмала. В частности они являются гидролазами, которые способны расщеплять α-D-(1→4) O-гликозидные связи в крахмале.
Амилазы представляют собой ферменты, разлагающие крахмал, классифицируемые как гидролазы, которые расщепляют α-D-(1→4) O-гликозидные связи в крахмале. Обычно, α-амилазы (Е.С. 3.2.1.1, α-D-(1 →4)глюканглюканогидролаза) определяются как эндодействующие ферменты, расщепляющие α-D-(1→4) O-гликозидные связи в молекуле крахмала произвольным образом. В противоположность этому, экзодействующие амилолитические ферменты, такие как β-амилазы (Е.С. 3.2.1.2, α-D-(1→4)глюканмальтогидролаза), и некоторые продукт-специфические амилазы, подобные мальтогенной альфа-амилазе (Е.С. 3.2.1.133), расщепляют молекулу крахмала с невосстанавливающего конца субстрата. β-Амилазы, α-глюкозидазы (Е.С. 3.2.1.20, α-D-глюкозидглюкогидролаза), глюкоамилаза (Е.С. 3.2.1.3, α-D-(1→4)глюканглюкогидролаза) и продукт-специфические амилазы могут производить мальто-олигосахариды определенной длины из крахмала.
Немальтогенная экзоамилаза
PS4-вариантные полипептиды, описанные в данном документе, получены из (или из вариантов) полипептидов, которые предпочтительно проявляют немальтогенную экзоамилазную активность. Предпочтительно данные исходные ферменты сами по себе представляют собой немальтогенные экзоамилазы. PS4-вариантные полипептиды сами по себе в наиболее предпочтительных вариантах осуществления также проявляют немальтогенную экзоамилазную активность.
В наиболее предпочтительных вариантах осуществления термин “немальтогенный экзоамилазный фермент”, используемый в данном документе, следует воспринимать в том смысле, что фермент первоначально не разлагает крахмал до значительных количеств мальтозы, анализируемой в соответствии с процедурой определения продукта, описанной в данном документе.
В наиболее предпочтительных вариантах осуществления немальтогенная экзоамилаза содержит экзомальтотетраогидролазу. Экзомальтотетраогидролаза (Е.С.3.2.1.60) более формально известна как глюкан-1,4-альфа-мальтотетрагидролаза. Этот фермент гидролизует 1,4-альфа-D-глюкозидные связи в амилазных полисахаридах таким образом, что удаляются последующие остатки мальтотетраозы из невосстанавливающих концов цепи.
Немальтогенные экзоамилазы описаны детально в патенте США № 6667065, включенном в качестве ссылки.
Анализ немальтогенной экзоамилазной активности
Следующая система использована для того, чтобы охарактеризовать полипептиды, обладающие немальтогенной экзоамилазной активностью, которые являются подходящими для применения согласно способам и композициям, описанным в данной работе. Данная система может быть применена, например, для характеристики PS4-исходных или вариантных полипептидов, описанных здесь.
По данным исходной предпосылочной информации воскообразный кукурузный амилопектин (получаемый как WAXILYS 200 от Roquette, Франция) представляет собой крахмал с очень высоким содержанием амилопектина (выше 90%). 20 мг/мл воскообразного кукурузного крахмала кипятят в течение 3 мин в буфере из 50 мМ MES (2-(N-морфолино)этансульфоновая кислота), 2 мМ хлорида кальция, рН 6,0 и затем инкубируют при 50°С и используют в течение получаса.
Одну единицу немальтогенной экзоамилазы определяют как количество фермента, которое высвобождает эквивалент продуктов гидролиза на 1 мкмоль восстанавливающего сахара в мин, когда инкубируют при 50°С в тестируемой пробирке с 4 мл 10 мг/мл воскообразного кукурузного крахмала в 50 мМ MES, 2 мМ хлорида кальция, рН 6,0, приготовленных как описано выше. Восстанавливающие сахара измеряют, используя мальтозу в качестве стандарта и применяя способ с динитросалициловой кислотой из публикации Bernfeld, Methods Enzymol., (1954), 1, 149-158 или другой способ, известный в области количественной оценки восстанавливающих сахаров.
Образцы продуктов гидролиза немальтогенной экзоамилазы определяют инкубированием 0,7 единиц немальтогенной экзоамилазы в течение 15 или 300 мин при 50°С в тестируемой пробирке с 4 мл 10 мг/мл воскообразного кукурузного крахмала в буфере, приготовленном, как описано выше. Реакцию останавливают погружением тестируемой пробирки на 3 мин в кипящую водяную баню.
Продукты гидролиза анализируют и количественно определяют анионообменной ВЭЖХ (HPLC) с использованием колонки Dionex PA 100 с ацетатом натрия, гидроксидом натрия и водой в качестве элюентов, с импульсной амперометрической детекцией и с известными линейными мальтоолигосахаридами от глюкозы до мальтогептаозы в качестве стандартов. Фактор ответа, примененный от мальтооктаозы до мальтодекаозы, представляет собой фактор ответа, найденный для мальтогептаозы.
Предпочтительно PS4-вариантные полипептиды обладают немальтогенной экзоамилазной активностью, такой что, если взяты 0,7 единиц указанной немальтогенной экзоамилазы для инкубирования в течение 15 минут при температуре 50°С при рН 6,0 в 4 мл водного раствора 10 мг предварительно нагретого воскообразного кукурузного крахмала на мл буферного раствора, содержащего 50 мМ 2-(N-морфолино)этансульфоновой кислоты и 2 мМ хлорида кальция, то в таком случае фермент должен приводить к продукту(ам) гидролиза, который должен состоять из одного или нескольких линейных мальтоолигосахаридов, содержащих от двух до десяти D-глюкопиранозильных единиц и необязательно глюкозу; такой что, по меньшей мере, 60%, предпочтительно, по меньшей мере, 70%, предпочтительнее, по меньшей мере, 80% и наиболее предпочтительно, по меньшей мере, 85% масс. от указанных продуктов гидролиза должны состоять из линейных мальтоолигосахаридов, содержащих от трех до десяти D-глюкопиранозильных единиц, предпочтительно из линейных мальтоолигосахаридов, содержащих от четырех до восьми D-глюкопиранозильных единиц.
Для облегчения ссылки и для данных целей характеристика инкубирования количества в 0,7 единиц немальтогенной экзоамилазы в течение 15 минут при температуре 50°С при рН 6,0 в 4 мл водного раствора 10 мг предварительно нагретого воскообразного кукурузного крахмала на мл буферного раствора, содержащего 50 мМ 2-(N-морфолино)этансульфоновой кислоты и 2 мМ хлорида кальция, может быть названа как “Опыт по инкубированию воскообразного кукурузного крахмала”.
Таким образом, выражаясь альтернативно, предпочтительные PS4-вариантные полипептиды, которые представляют собой немальтогенные экзоамилазы, характеризуются наличием способности в опыте по инкубированию воскообразного кукурузного крахмала образовывать продукт(ы) гидролиза, который должен состоять из одного или нескольких линейных мальтоолигосахаридов, содержащих от двух до десяти D-глюкопиранозильных единиц и необязательно глюкозу; такой способности, что, по меньшей мере, 60%, предпочтительно, по меньшей мере, 70%, предпочтительнее, по меньшей мере, 80% и наиболее предпочтительно, по меньшей мере, 85% масс. от указанных продуктов гидролиза должны состоять из линейных мальтоолигосахаридов, содержащих от трех до десяти D-глюкопиранозильных единиц, предпочтительно из линейных мальтоолигосахаридов, содержащих от четырех до восьми D-глюкопиранозильных единиц.
Продукты гидролиза в опыте по инкубированию воскообразного кукурузного крахмала могут включать один или несколько мальтоолигосахаридов, содержащих от двух до десяти D-глюкопиранозильных единиц и необязательно глюкозу. Продукты гидролиза в опыте по инкубированию воскообразного кукурузного крахмала также могут включать другие гидролитические продукты. Однако % массовые количества линейных мальтоолигосахаридов, содержащих от трех до десяти D-глюкопиранозильных единиц, основаны на количестве продукта гидролиза, который состоит из одного или нескольких мальтоолигосахаридов, содержащих от двух до десяти D-глюкопиранозильных единиц и необязательно глюкозу. Другими словами, % массовые количества линейных мальтоолигосахаридов, содержащих от трех до десяти D-глюкопиранозильных единиц, не основаны на количестве других продуктов гидролиза, отличных от одного или нескольких мальтоолигосахаридов, содержащих от двух до десяти D-глюкопиранозильных единиц и глюкозу.
Продукты гидролиза могут быть проанализированы любыми подходящими способами. Например, продукты гидролиза могут быть проанализированы анионообменной ВЭЖХ (HPLC) с использованием колонки Dionex PA 100, с импульсной амперометрической детекцией и с, например, известными линейными мальтоолигосахаридами от глюкозы до мальтогептаозы в качестве стандартов.
Для облегчения ссылки и для данных целей описание анализа продукта(ов) гидролиза анионообменной ВЭЖХ (HPLC) с использованием колонки Dionex PA 100, с импульсной амперометрической детекцией и с известными линейными мальтоолигосахаридами от глюкозы до мальтогептаозы в качестве стандартов может быть названо как “Метод анионного обмена”. Конечно, и как только что указано, другие аналитические методики могут быть доступными, а также другие специфические методики анионного обмена.
Таким образом, выражаясь альтернативно, предпочтительный PS4-вариантный полипептид представляет собой полипептид, который содержит немальтогенную экзоамилазу, такой, что он обладает способностью в опыте по инкубированию воскообразного кукурузного крахмала к образованию продукта(ов) гидролиза, который должен состоять из одного или нескольких линейных мальтоолигосахаридов, содержащих от двух до десяти D-глюкопиранозильных единиц и необязательно глюкозу, при этом указанные продукты гидролиза способны к тому, чтобы быть проанализированными анионным обменом; такой что, по меньшей мере, 60%, предпочтительно, по меньшей мере, 70%, более предпочтительно, по меньшей мере, 80% и наиболее предпочтительно, по меньшей мере, 85% масс. от указанных продуктов гидролиза должны состоять из линейных мальтоолигосахаридов, содержащих от трех до десяти D-глюкопиранозильных единиц, предпочтительно из линейных мальтоолигосахаридов, содержащих от четырех до восьми D-глюкопиранозильных единиц.
Используемый в данной работе термин “линейный мальтоолигосахарид” используется в обычном смысле в качестве обозначения 2-10 единиц α-D-глюкопиранозы, связанных α-(1→4) связью.
В наиболее предпочтительных вариантах осуществления PS4-полипептиды, описанные здесь, обладают повышенной экзоамилазной активностью, предпочтительно немальтогенной экзоамилазной активностью, при сравнении с исходным полипептидом, предпочтительно при оценке в тех же самых условиях. В частности, в наиболее предпочтительных вариантах осуществления PS4-вариантные полипептиды имеют 10% или более, предпочтительно 20% или более, предпочтительно 50% или более экзоамилазной активности при сравнении с их исходными полипептидами, предпочтительно при измерении в опыте с воскообразным кукурузным крахмалом.
Продукты гидролиза могут быть проанализированы любыми подходящими способами. Например, продукты гидролиза могут быть проанализированы анионообменной ВЭЖХ (HPLC) с использованием колонки Dionex PA 100, с импульсной амперометрической детекцией и с, например, известными линейными мальтоолигосахаридами от глюкозы до мальтогептаозы в качестве стандартов.
Используемый в данной работе термин “линейный мальтоолигосахарид” используется в обычном смысле в качестве обозначения 2-20 единиц α-D-глюкопиранозы, связанных α-(1→4)связью.
Улучшенные свойства
PS4-варианты, описанные здесь, предпочтительно обладают улучшенными свойствами при сравнении с их исходными ферментами, такими как одним или несколькими свойствами из повышенной термостабильности, повышенной рН стабильности или повышенной экзоспецифичности.
В частности PS4-вариантные полипептиды, имеющие мутации в положениях 303, например 303Е, 303D, 306T и 306G, имеют увеличенную экзоспецифичность. Полипептиды, имеющие мутации в любом из положений 146, 157, 158, 198, 229 (предпочтительно как 198, так и 229), 309, 316 и 353, например 146G, 157M, 158T, 198W, 229P (198W, 220P), 309P, 316S, 316P и 353T, показывают повышенную термостабильность.
Не прибегая к какой-либо определенной теории, авторы предполагают, что мутации в определенных положениях приводят к индивидуальным или кумулятивным влияниям на свойства полипептида, содержащего такие мутации.
Термостабильность и рН стабильность
Предпочтительно PS4-вариантный полипептид является термостабильным; предпочтительно он обладает более высокой термостабильностью, чем его исходный фермент.
Поэтому авторы предлагают PS4-вариантные полипептиды, которые обладает более высокой термостабильностью при сравнении с исходным полипептидом или полипептидом дикого типа при оценке в тех же самых условиях. В частности авторы предлагают PS4-вариантные полипептиды, содержащие мутации в одном или нескольких положениях 121, 145, 146, 157, 158, 188, 198, 223, 229, 316, 353, более предпочтительно любую одну или несколько мутаций 121А, 121D, 121F, 121H, 121M, 121W, 121Y, 145D, 146G, 157M, 158T, 188H, 188S, 198W, 223A, 223E, 223K, 223R, 223V, 229P, 316P, 316S, 353T.
В пшенице и других злаках внешние боковые цепи в амилопектине находятся в интервале DP 12-19. Таким образом, ферментативный гидролиз боковых цепей амилопектина, например описанными PS4-вариантными полипептидами, обладающими немальтогенной экзоамилазной активностью, может значительно снизить их тенденции к кристаллизации.
Крахмал в пшенице и других злаках, применяемых для хлебопекарных целей, присутствует в форме крахмальных гранул, которые обычно устойчивы к ферментативному действию амилаз. Поэтому модификация крахмала в основном мало восприимчива к повреждению крахмала и изменяется очень медленно в процессе обработки теста и начального выпекания, пока не начинается клейстеризация при примерно 60°С. Из этого следует, что только амилазы с высокой степенью термостабильности способны модифицировать крахмал эффективно в процессе выпекания. И обычно эффективность амилаз увеличивается с увеличением термостабильности. Поэтому, чем более термостабилен фермент, тем продолжительнее время, когда он может быть активен в процессе выпекания, и, таким образом, тем больший эффект он будет проявлять как ингибитор черствения.
Следовательно, применение PS4-вариантных полипептидов, описанных в данной работе, при добавлении к крахмалу на любой стадии его переработки в пищевой продукт, например перед, в процессе или после выпекания хлеба, может тормозить, препятствовать или снижать ретроградацию. Такое применение подробно описано ниже.
Используемый в данной работе термин “термостабильный” относится к способности фермента сохранять активность после воздействия повышенных температур. Предпочтительно PS4-вариантный полипептид способен разлагать крахмал при температурах от примерно 55°С до примерно 80°С или более. Соответственно фермент сохраняет свою активность после воздействия температур вплоть до примерно 95°С.
Термостабильность фермента, такого как немальтогенная экзоамилаза, измеряют его временем полужизни. Так, PS4-вариантные полипептиды, описанные в данной работе, имеют время полужизни, увеличенные в сравнении с исходным ферментом, предпочтительно на 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200% или более, предпочтительно при повышенных температурах от 55°С до примерно 95°С или более, предпочтительно при примерно 80°С.
Используемое в данной работе время полужизни (t1/2) представляет собой время (в минутах), в течение которого половина активности фермента исчезает при определенных условиях нагревания. В предпочтительных вариантах осуществления время полужизни определяют при 80°С. Предпочтительно образец нагревают в течение 1-10 минут при 80°С или выше. Значение времени полужизни затем вычисляют измерением остаточной активности амилазы с помощью любого способа, описанного в данной работе. Предпочтительно оценку времени полужизни проводят, как описано более подробно в примерах.
Предпочтительно PS4-варианты, описанные здесь, являются активными в процессе выпекания и гидролизуют крахмал в течение и после клейстеризации крахмальных гранул, которая начинается при температурах примерно 55°С. Чем более термостабильна немальтогенная экзоамилаза, тем продолжительнее время, в течение которого она может быть активна и, таким образом, тем больший эффект она будет проявлять против черствения. Однако в процессе выпекания выше температур примерно 85°С может происходить инактивация фермента. Если это происходит, то немальтогенная экзоамилаза может постепенно инактивироваться так, что в основном не остается активности в полученном хлебе после процесса выпекания. Поэтому предпочтительны немальтогенные экзоамилазы, подходящие для описанного применения, имеющие оптимум температуры выше 50°С и ниже 98°С.
Термостабильность PS4-вариантов, описанных в данной работе, может быть повышена с использованием белковой инженерии для достижения большей термостабильности и, таким образом, лучшей пригодности для применений, описанных здесь; поэтому авторы охватывают применение PS4-вариантов, модифицированных для достижения большей термостабильности с помощью белковой инженерии.
Предпочтительно PS4-вариантный полипептид является рН стабильным; более предпочтительно он обладает более высокой рН стабильностью, чем его родственный исходный полипептид. Используемый в данной работе термин “рН стабильный” относится к способности фермента оставаться активным в широком диапазоне рН. Предпочтительно PS4-вариантный полипептид способен разлагать крахмал при рН от примерно 5 до примерно 10,5. В одном из вариантов осуществления степень рН стабильности может быть определена измерением времени полужизни фермента в определенных условиях рН. В другом варианте осуществления степень рН стабильности может быть определена измерением активности или удельной активности фермента в определенных условиях рН. Определенные рН условия могут представлять собой любой рН от 5 до 10,5.
Таким образом, PS4-вариантный полипептид может обладать более продолжительным временем полужизни или более высокой активностью (в зависимости от анализа) по сравнению с исходным полипептидом при идентичных условиях. PS4-вариантные полипептиды могут иметь 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200% или более продолжительное время полужизни по сравнению с их исходными полипептидами при идентичных рН условиях. В альтернативном случае или в дополнение они могут обладать более высокой активностью по сравнению с исходными полипептидами при идентичных рН условиях.
Экзоспецифичность
Известно, что некоторые немальтогенные экзоамилазы могут проявлять некоторую эндоамилазную активность. В некоторых случаях данный тип активности требуется уменьшить или устранить, так как эндоамилазная активность отрицательно влияет на качество конечного хлебного продукта образованием липкого иди клейкого мякиша из-за аккумулирования разветвленных декстринов.
Авторы предлагают PS4-вариантные полипептиды, которые обладают повышенной экзоспецифичностью по сравнению с исходным полипептидом или полипептидом дикого типа при оценке в тех же самых условиях. В частности, авторы предлагают PS4-вариантные полипептиды, включающие мутации в любом одном или нескольких положениях 26, 70, 121, 145, 161, 223, 223, 303, 306, 309, 339, 339, более предпочтительно любую одну или несколько мутаций 26E, 70D, 121A, 121D, 121H, 121M, 121W, 121Y, 145D, 161A, 223A, 223E, 223K, 223R, 223V, 303D, 303E, 306G, 306T, 309P, 339A, 339E.
Экзоспецифичность успешно может быть измерена определением отношения общей амилазной активности к общей эндоамилазной активности. Данное отношение названо в данном документе как “индекс экзоспецифичности”. В предпочтительных вариантах осуществления фермент рассматривают как экзоамилазу, если он имеет индекс экзоспецифичности, равный 20 или более, т.е. его общая амилазная активность (включая экзоамилазную активность) в 20 раз или более выше его эндоамилазной активности. В наиболее предпочтительных вариантах осуществления индекс экзоспецифичности равен 30 или более, 40 или более, 50 или более, 60 или более, 70 или более, 80 или более, 90 или более, или 100 или более. В наиболее предпочтительных вариантах осуществления индекс экзоспецифичности равен 150 или более, 200 или более, 300 или более, 400 или более, 500 или более, или 600 или более.
Общая амилазная активность и эндоамилазная активность может быть измерена любыми способами, известными в данной области. Например, общая амилазная активность может быть измерена определением общего числа восстанавливающих концов, высвобождаемых из крахмального субстрата. Альтернативно применение Betamyl анализа подробно описано далее в примерах, и для удобства активность амилазы, определенная в примерах, описана в виде “Betamyl единиц” в таблицах.
Эндоамилазная активность может быть определена применением набора Phadebas (Pharmacia and Upjohn). Он использует голубой меченый сшитый крахмал (меченный азокрасителем); только внутренние разрывы в молекуле крахмала высвобождают метку, в то время как внешние разрывы ее не высвобождают. Высвобождение красителя можно измерить спектрофотометрией. В соответствии с этим, набор Phadebas измеряет активность эндоамилазы, и для удобства результаты такого анализа (описанного в примерах) названы в данном документе как “Phadebas единицы”.
В очень предпочтительном варианте осуществления, поэтому, индекс экзоспецифичности выражен в виде отношения Betamyl единицы/Phadebas единицы, также названного как “В/Phad”.
Экзоспецифичность также может быть определена способами, описанными в данной области ранее, например, в международной патентной публикации авторов данного изобретения под № WO 99/50399. В этой публикации экзоспецифичность измеряют путем определения отношения эндоамилазной активности к экзоамилазной активности. Таким образом, в предпочтительном аспекте, PS4-варианты, описанные в данной работе, будут иметь меньше чем 0,5 эндоамилазных единиц (EAU) на единицу экзоамилазной активности. Предпочтительно немальтогенные экзоамилазы, которые являются подходящими для применения по данному изобретению, имеют меньше чем 0,05 EAU на единицу экзоамилазной активности и более предпочтительно меньше чем 0,01 ЕAU на единицу экзоамилазной активности.
PS4-варианты, описанные в данной работе, будут предпочтительно иметь экзоспецифичность, например, выраженную индексами экзоспецифичности, как описано выше, согласующуюся с их экзоамилазами. Кроме того, они предпочтительно имеют более высокую или увеличенную экзоспецифичность по сравнению с исходными ферментами или полипептидами, из которых они получены. Так, например, PS4-вариантные полипептиды могут иметь 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200% или более высокий индекс экзоспецифичности по сравнению с их исходными полипептидами, предпочтительно при идентичных условиях. Они могут иметь значения, кратные 1,5 или более, 2 или более, 5 или более, 10 или более, 50 или более, 100 или более по сравнению с их исходными полипептидами, предпочтительно при идентичных условиях.
Применения PS4-вариантных полипептидов и нуклеиновых кислот
PS4-вариантные полипептиды, нуклеиновые кислоты, клетки-хозяева, векторы экспрессии и т.д. можно использовать в любых применениях, для которых может быть использована амилаза. В частности, они могут быть использованы для замещения для любой немальтогенной экзоамилазы. Они могут быть использованы для дополнения амилазной или немальтогенной экзоамилазной активности сами по себе или в комбинации с другими известными амилазами или немальтогенными экзоамилазами.
PS4-вариантные полипептиды, описанные здесь, можно использовать в различных применениях в пищевой промышленности, таких как хлебобулочные изделия, напитки, их можно также использовать в других применениях, таких как фармацевтическая композиция, или даже в химической промышленности. В частности, PS4-вариантные полипептиды и нуклеиновые кислоты применимы для различных промышленных употреблений, включающих хлебопекарное производство (раскрытое в WO 99/50399) и стандартизацию муки (интенсификация объема или улучшение). Они могут быть использованы для производства мальтотетраозы из крахмала и других субстратов.
Поэтому авторы описывают способ приготовления продукта питания, причем данный способ включает: (а) получение немальтогенной экзоамилазы; (b) введение мутации в любое одно или несколько положений немальтогенной экзоамилазы, представленных в данном документе; (с) смешивание полученного полипептида с компонентом пищевого продукта.
PS4-вариантные полипептиды можно использовать для увеличения объема хлебобулочных продуктов, таких как хлеб. Не прибегая к какой-либо определенной теории, авторы предполагают, что это обусловлено уменьшением вязкости теста в процессе нагревания (таком, как выпекание) в результате экзоамилазного укорачивания молекул амилозы. Это дает возможность диоксиду углерода, генерированному ферментацией, увеличить размер хлеба с меньшей помехой.
Таким образом, пищевые продукты, содержащие или обработанные PS4-вариантными полипептидами, имеют больший объем по сравнению с продуктами, которые не были так обработаны или обработаны исходными полипептидами. Другими словами, пищевые продукты имеют больший объем воздуха на единицу пищевого продукта. В альтернативном случае или в дополнение пищевые продукты, обработанные PS4-вариантными полипептидами, имеют более низкую плотность или вес (или массу) в объемном отношении. В особенно предпочтительных вариантах осуществления PS4-вариантные полипептиды используют для увеличения объема хлеба. Увеличение в объеме или разбухание полезно, потому что оно уменьшает клейкость или крахмалистость пищевых продуктов. Легкие пищевые продукты предпочтительны для потребителей и покупательская способность повышается. В предпочтительных вариантах осуществления применение PS4-вариантных полипептидов увеличивает объем на 10, 20, 30, 40, 50% или больше.
Применение PS4-вариантных полипептидов для увеличения объема пищевых продуктов описано детально в примерах.
Применения в пищевых продуктах
PS4-вариантные полипептиды и нуклеиновые кислоты, описанные в данной работе, могут быть использованы в пищу или в приготовлении пищевого продукта. В частности, они могут быть добавлены в пищевой продукт, т.е. в качестве пищевой добавки. Термин “пищевой продукт” предназначен для включения как приготовленного пищевого продукта, так и ингредиента для пищевого продукта, такого как мука. В предпочтительном аспекте пищевой продукт представляет собой продукт, предназначенный для потребления человеком. Пищевой продукт может быть в виде раствора или твердого вещества - в зависимости от применения и/или способа применения, и/или способа введения.
PS4-вариантные полипептиды и нуклеиновые кислоты могут быть применены в качестве компонента пищевого продукта. Используемый в данной работе термин “компонент пищевого продукта” включает состав, который представляет собой или может быть добавлен к функциональным продуктам питания или кормам и включает составы, которые могут применяться в малых количествах в продуктах широкого разнообразия, которые требуют, например, подкисления или эмульгирования.
Компонент пищевого продукта может быть в виде раствора или твердого вещества - в зависимости от применения и/или способа применения, и/или способа введения.
PS4-вариантные полипептиды и нуклеиновые кислоты, раскрытые здесь, могут представлять собой пищевые добавки или могут быть добавлены к пищевым добавкам. PS4-вариантные полипептиды и нуклеиновые кислоты, раскрытые здесь, могут представлять собой функциональные продукты питания или могут быть добавлены к функциональным продуктам питания. Используемый в данной работе термин “функциональный продукт питания” означает продукт питания, который способен обеспечивать не только эффект питания и/или вкусовое удовлетворение, но также способен оказать дополнительное полезное воздействие на потребителя. Хотя нет официального определения функциональных продуктов питания, большинство единомышленников в данной области соглашается с тем, что они представляют собой продукты, реализуемые как продукты с определенными влияниями на здоровье.
PS4-вариантные полипептиды могут быть также использованы в производстве пищевого продукта или продукта питания. Типичные продукты питания включают молочные продукты, мясные продукты, птицепродукты, рыбопродукты и заготовки для теста. Заготовка может представлять собой любую обработанную заготовку для теста, включающую жареные, прожаренные, поджаренные, испеченные, паровые и нагретые виды теста, такие как паровой хлеб и рисовые лепешки. В наиболее предпочтительных вариантах осуществления пищевой продукт представляет собой хлебобулочное изделие.
Предпочтительно продукт питания представляет собой хлебобулочное изделие. Типичные хлебобулочные (испеченные) продукты включают хлеб - такой как батоны, булочки, сдобные булочки, основы для пиццы и т.д., мучные кондитерские изделия, крендели, торты, пирожные, печенья, бисквиты, крекеры и т.д.
Следовательно, авторы описывают способ модификации пищевой добавки, содержащей мальтогенную экзоамилазу, при этом способ включает введение мутации в любое одно или несколько положений немальтогенной экзоамилазы, представленных в данном документе. Тот же способ может быть использован для модификации компонента пищевого продукта, или пищевой добавки, или пищевого продукта, или кормового продукта.
Ретроградация/черствение
Авторы описывают применение PS4-вариантных полипептидов, которые способны тормозить потерю свежести крахмальных сред, таких как крахмальные клейстеры. PS4-вариантные полипептиды особенно способны тормозить вредную ретроградацию крахмала.
Большинство крахмальных гранул составлено из смеси двух полимеров: в основном линейной амилозы и высоко разветвленного амилопектина. Амилопектин представляет собой очень большую, разветвленную молекулу, состоящую из цепей α-D-глюкопиранозильных единиц, связанных (1-4)связями, где указанные цепи прикреплены α-D-(1-6)связями для образования ветвей. Амилопектин присутствует во всех природных крахмалах, причем составляет примерно 75% от массы большинства обычных крахмалов. Амилоза представляет собой в основном линейную цепь (1-4)связанных α-D-глюкопиранозильных единиц, имеющих очень мало α-D-(1-6)ветвей. Большинство крахмалов содержит примерно 25% амилозы.
Гранулы крахмала, нагретые в присутствии воды, претерпевают упорядоченный-разупорядоченный фазовый переход, называемый клейстеризацией, где жидкость поглощается разбухающими гранулами. Температуры клейстеризации отличаются для различных крахмалов. При охлаждении свежевыпеченного хлеба часть амилозы за часы ретроградирует с образованием каркаса. Данный процесс является полезным в том, что он создает желательную структуру мякиша с низкой степенью плотности и с улучшенными свойствами для нарезания. Более постепенно происходит кристаллизация амилопектина внутри клейстеризованных крахмальных гранул в течение дней после выпекания. Полагают, что в данном процессе амилопектин усиливает каркас амилозы, в который вставлены гранулы крахмала. Данное усиление приводит к увеличению твердости хлебного мякиша. Данное усиление является одной из главных причин черствения хлеба.
Известно, что качество хлебобулочных изделий постепенно ухудшается в процессе хранения. Вследствие перекристаллизации крахмала (также называемой ретроградацией) влагоудерживающая способность мякиша меняется с важными влияниями на органолептические и диетические свойства. Мякиш теряет мягкость и эластичность и становится твердым и крошковатым. Увеличение твердости мякиша часто используют как меру процесса черствения хлеба.
Скорость вредной ретроградации амилопектина зависит от длины боковых цепей амилопектина. Следовательно, ферментативный гидролиз боковых цепей амилопектина, например PS4-вариантными полипептидами, обладающими немальтогенной экзоамилазной активностью, может значительно снизить их тенденции к кристаллизации.
Соответственно применение PS4-вариантных полипептидов, описанных здесь, при добавлении к крахмалу на любой стадии его переработки в пищевой продукт, например, перед, во время или после выпекания хлеба, может затормозить, воспрепятствовать или снизить ретроградацию. Такое применение описано в дальнейшем подробно ниже.
Поэтому авторы описывают способ улучшения способности немальтогенной экзоамилазы ингибировать черствение, предпочтительно вредную ретроградацию тестовой заготовки, причем способ включает введение мутации в любое одно или несколько положений немальтогенной экзоамилазы, представленных в данном документе.
Анализы для измерения ретроградации (черствения)
Для оценки эффекта ингибирования черствения, вызываемого PS4-вариантными полипептидами, обладающими немальтогенной экзоамилазной активностью и описанными здесь, твердость мякиша может быть измерена через 1, 3 и 7 дней после выпекания посредством Instron 4301 Universal Food Texture Analyzer или подобного оборудования, известного в данной области.
Другой метод, применяемый традиционно в данной области и который использован для оценки влияния PS4-вариантных полипептидов, обладающих немальтогенной экзоамилазной активностью, на ретроградацию крахмала, основан на DSC (дифференциальная сканирующая калориметрия). В данной работе измеряли энтальпию плавления ретроградированного амилопектина в хлебном мякише или мякише из модельной системы теста, выпеченного с или без ферментов (контроль). DSC-оборудование, использованное в описанных примерах, представляет собой Mettler-Toledo DSC 820 run с температурным градиентом 10°С в мин от 20 до 95°С. Для приготовления образцов 1-20 мг мякиша взвешивали и переносили в алюминиевые формочки Mettler-Toledo, которые затем герметично закупоривали.
Модельные системы видов теста, используемые в описанных примерах, содержат стандартную пшеничную муку и оптимальное количество воды или буфера с или без немальтогенной PS4-вариантной экзоамилазы. Их перемешивают в 10 или 50 г Brabender Farinograph в течение 6 или 7 мин, соответственно. Образцы теста помещают в стеклянные тестируемые пробирки (15×0,8 см) с крышкой. Данные тестируемые пробирки подвергали процессу выпекания в водяной бане, начиная с 30 мин инкубирования при 33°С с последующим нагреванием от 33 до 95°С с градиентом 1,1°С в мин и конечным 5-мин инкубированием при 95°С. Затем сосуды хранят в термостате при 20°С перед DSC-анализом.
В предпочтительных вариантах осуществления PS4-варианты, описанные здесь, имеют пониженную энтальпию плавления по сравнению с контролем. В наиболее предпочтительных вариантах осуществления PS4-варианты имеют 10% или более пониженную энтальпию плавления. Предпочтительно, они имеют 20% или более, 30, 40, 50, 60, 70, 80, 90% или более пониженную энтальпию плавления по сравнению с контролем.
Нижеприведенная таблица 2 представляет DSC для модельных систем теста, приготовленных с различными дозами Psac-D34 после 7 дней хранения. Тестированы 0,5, 1 и 2 части на миллион (или микрограмм на грамм) муки.
Приготовление крахмалопродуктов
Авторы предлагают применение PS4-вариантных полипептидов для приготовления пищевых продуктов, в частности крахмалопродуктов. Способ включает образование крахмалопродукта добавлением немальтогенного экзоамилазного фермента, такого как PS4-вариантный полипептид, к крахмальной среде. Если крахмальная среда представляет собой тесто, тогда тесто готовят смешиванием вместе муки, воды, немальтогенной экзоамилазы, которая является PS4-вариантным полипептидом, и необязательно других возможных ингредиентов и добавок.
Термин “крахмал” следует принимать для обозначения крахмала per se в чистом виде или его компонента, особенно амилопектина. Термин “крахмальная среда” означает любую подходящую среду, содержащую крахмал. Термин “крахмалопродукт” означает любой продукт, который содержит, или основан на крахмале, или произведен из крахмала. Предпочтительно крахмалопродукт содержит, или основан на крахмале, или произведен из крахмала, полученного из пшеничной муки. Термин “мука”, используемый в данной работе, представляет собой синоним для мелкоосадочной муки грубого помола пшеницы или другого злака. Предпочтительно, однако, данный термин означает муку, полученную из пшеницы per se в чистом виде, а не из другого злака. Таким образом, если не указано иначе, ссылки на “пшеничную муку”, используемую в данной работе, предпочтительно означают ссылки на пшеничную муку per se в чистом виде, а также на пшеничную муку, присутствующую в среде, такой как тесто.
Предпочтительная мука представляет собой пшеничную муку, или рисовую муку, или смеси из пшеничной и рисовой муки. Однако также предполагаются виды теста, содержащие муку, полученную из других видов злаков, такую как, например, из риса, кукурузы, ячменя и сорго хлебного. Предпочтительно крахмалопродукт представляет собой хлебобулочное изделие. Предпочтительнее крахмалопродукт представляет собой хлебное изделие. Еще предпочтительнее крахмалопродукт представляет собой выпеченное мучное хлебное изделие. Термин “выпеченное мучное хлебное изделие” относится к любому выпеченному продукту на основе теста, полученного смешиванием муки, воды и разрыхлителя при условиях образования теста. Дополнительные компоненты, конечно, можно добавить в тестовую смесь.
Таким образом, если крахмалопродукт представляет собой выпеченное мучное хлебное изделие, тогда способ включает смешивание - в любом подходящем порядке - муки, воды и разрыхлителя при условиях образования теста и затем добавление PS4-вариантного полипептида, необязательно в форме премикса. Разрыхлитель может быть химическим разрыхлителем, таким как бикарбонат натрия, или любым штаммом Saccharomyces cerevisiae (хлебопекарные дрожжи).
PS4-вариантная немальтогенная экзоамилаза может быть добавлена вместе с любым ингредиентом теста, включая воду, или со смесью тестовых ингредиентов, или с любой добавкой, или добавочной смесью. Тесто может быть приготовлено любым традиционным способом приготовления теста, обычным в хлебопекарной отрасли или в любой другой отрасли, производящей продукты на основе теста из муки.
Выпекание мучных хлебных изделий, таких как, например, белый хлеб, хлеб, сделанный из просеянной ржаной муки и пшеничной муки, булочки и тому подобное, проводится обычно выпеканием хлебного теста при температурах печи в интервале от 180 до 250°С в течение примерно от 15 до 60 минут. В течение процесса выпекания очень высокий температурный градиент (200→120°С) преобладает на внешних слоях теста, где образуется корка, характерная для выпеченного продукта. Однако из-за потребления тепла, обусловленного парообразованием, температура в мякише составляет исключительно около 100°С в конце процесса выпекания.
Поэтому авторы описывают способ изготовления хлебного изделия, включающий: (а) получение крахмальной среды; (b) добавление к крахмальной среде PS4-вариантного полипептида, описанного в данном документе; и (с) применение подогрева крахмальной среды в течение или после стадии (b) для того, чтобы произвести хлебное изделие. Авторы также описывают способ изготовления хлебного изделия, включающий добавление к крахмальной среде описанного PS4-вариантного полипептида.
Немальтогенный экзоамилазный PS4-вариантный полипептид может быть добавлен как жидкий препарат или как сухая порошкообразная композиция, содержащая фермент либо как одиночный активный компонент, либо в смеси с одним или несколькими дополнительными ингредиентами или добавкой для теста.
Улучшающая композиция
Авторы описывают композиции улучшителей, которые включают композиции, улучшающие хлеб, и композиции, улучшающие тесто. Они содержат PS4-вариантный полипептид, необязательно вместе с дополнительным ингредиентом, или дополнительным ферментом, или с обоими компонентами.
Авторы предлагают также применение таких композиций, улучшающих хлеб и тесто, при выпекании. В следующем аспекте авторы предлагают испеченный продукт или тесто, полученные из композиции, улучшающей хлеб, или композиции, улучшающей тесто. В другом аспекте авторы предлагают испеченный продукт или тесто, полученные с применением композиции, улучшающей хлеб, или композиции, улучшающей тесто.
Приготовление теста
Тесто может быть приготовлено смешиванием муки, воды, тестоулучшающей композиции, содержащей PS4-вариантный полипептид (описанный выше) и необязательно другие ингредиенты и добавки.
Тестоулучшающую композицию можно добавлять вместе с любым ингредиентом для теста, включающим муку, воду или необязательно другие ингредиенты и добавки. Тестоулучшающую композицию можно добавлять перед мукой или водой или необязательно другими ингредиентами и добавками. Тестоулучшающую композицию можно добавлять после муки или воды или необязательно других ингредиентов и добавок. Тесто может быть приготовлено любым традиционным способом приготовления теста, обычным в хлебопекарной отрасли или в любой другой отрасли, производящей продукты на основе теста из муки.
Тестоулучшающая композиция может быть добавлена как жидкий препарат или как сухая порошкообразная композиция, включающая состав либо на основе одиночного активного компонента, либо как смесь с одним или несколькими дополнительными ингредиентами для теста или добавкой для теста.
Количество немальтогенной экзоамилазы PS4-вариантного полипептида, которое добавляют, равно обычно количеству, которое дает присутствие в полученном тесте от 50 до 100000 единиц на кг муки, предпочтительно от 100 до 50000 единиц на кг муки. Предпочтительно, данное количество находится в интервале от 200 до 20000 единиц на кг муки. В альтернативном случае немальтогенную экзоамилазу PS4-вариантного полипептида добавляют в количестве, которое дает присутствие в конечном тесте 0,02-50 ч/млн фермента в расчете на муку (0,02-50 мг фермента на кг муки), предпочтительно 0,2-10 ч/млн.
В данном контексте 1 единица немальтогенной экзоамилазы определена как количество фермента, которое высвобождает продукты гидролиза, эквивалентные 1 мкмоль восстанавливающего сахара в минуту при инкубировании при 50°С в тестируемой пробирке с 4 мл 10 мг/мл воскообразного кукурузного крахмала в 50 мМ MES, 2 мМ хлорида кальция, рН 6,0, как описано далее.
Описанное здесь тесто обычно содержит муку из цельного зерна пшеницы, пшеничную муку и/или другие типы муки грубого помола, муку или крахмал, такие как кукурузная мука, кукурузный крахмал, муку маиса, рисовую муку, ржаную кормовую муку, ржаную муку, овсяную муку, овсяную муку грубого помола, соевую муку, кормовую муку из сорго, картофельную муку грубого помола, картофельную муку и картофельный крахмал. Тесто может быть свежим, замороженным или частично запеченным.
Тесто может быть тестом с разрыхлителем или тестом, которое может подвергаться разрыхлению. Тесто можно разрыхлять различными способами, такими как добавление химических разрыхлителей, например бикарбоната натрия, или добавлением дрожжевой закваски (ферментирующее тесто), но предпочитают разрыхлять тесто добавлением подходящей дрожжевой культуры, такой как культура Saccharomyces cerevisiae (хлебопекарные дрожжи), например, коммерчески доступный штамм S. cerevisiae.
Тесто может содержать жир, такой как гранулированный жир или шортенинг. Кроме того, тесто может содержать дополнительно эмульгатор, такой как моно- или диглицериды, эфиры сахарозы и жирных кислот, полиглицериновые эфиры жирных кислот, эфиры молочной кислоты и моноглицеридов, эфиры уксусной кислоты и моноглицеридов, полиоксиэтиленстеараты или лизолецитин.
Авторы также описывают предварительно приготовленную смесь, содержащую муку вместе с комбинацией, описанной в данной работе. Предварительно приготовленная смесь содержит другие тестоулучшающие и/или хлебулучшающие добавки, например, любые из добавок, включающие ферменты, упомянутые в данной работе.
Дополнительные добавки в тесто или ингредиенты
Для того чтобы улучшить дополнительно свойства испеченного продукта и придать своеобразные качества испеченному продукту, в тесто могут быть включены дополнительные ингредиенты для теста и/или добавки для теста. Обычно такие дополнительно добавленные компоненты могут включать ингредиенты для теста, такие как соль, зерна, жиры и масла, сахар или подслащивающее вещество, диетические волокна, источники белка, такие как сухое молоко, соевая клейковина или яйца, и тестовые добавки, такие как эмульгаторы, другие ферменты, гидроколлоиды, ароматизаторы, окислители, минералы и витамины.
Эмульгаторы применимы как улучшители теста и размягчители мякиша. Как улучшители теста эмульгаторы могут обеспечивать устойчивость во время промежуточной расстойки теста и устойчивость к удару в течение расстойки. Кроме того, улучшители теста будут повышать устойчивость данного теста к изменениям времени ферментации. Большинство улучшителей теста также усиливает подъем теста в печи, что означает увеличение в объеме свежих изделий, от расстоенных до испеченных. Наконец, улучшители теста будут эмульгировать любые жиры, присутствующие в рецептуре смеси.
Подходящие эмульгаторы включают лецитин, полиоксиэтиленстеарат, моно- и диглицериды съедобных жирных кислот, эфиры уксусной кислоты и моно- и диглицеридов съедобных жирных кислот, эфиры молочной кислоты и моно- и диглицеридов съедобных жирных кислот, эфиры лимонной кислоты и моно- и диглицеридов съедобных жирных кислот, эфиры диацетилвинной кислоты и моно- и диглицеридов съедобных жирных кислот, эфиры сахарозы и съедобных жирных кислот, стеароил-2-лактат натрия и стеароил-2-лактат кальция.
Дополнительную добавку в тесто или ингредиент можно добавлять вместе с любым тестовым ингредиентом, включающим муку, воду или необязательно другие ингредиенты и добавки или композицию, улучшающую тесто. Дополнительную добавку в тесто или ингредиент можно добавлять перед мукой, водой, необязательно другими ингредиентами и добавками или композицией, улучшающей тесто. Дополнительную добавку в тесто или ингредиент можно добавлять после муки, воды, необязательно других ингредиентов и добавок или композиции, улучшающей тесто.
Дополнительная добавка в тесто или ингредиент может представлять собой для удобства жидкий препарат. Однако дополнительная добавка в тесто или ингредиент может быть для удобства в форме сухой композиции.
Предпочтительно дополнительная добавка в тесто или ингредиент составляет, по меньшей мере, 1% от массы мучного компонента теста. Предпочтительнее, дополнительная добавка в тесто или ингредиент составляет, по меньшей мере, 2%, предпочтительно, по меньшей мере, 3%, предпочтительно, по меньшей мере, 4%, предпочтительно, по меньшей мере, 5%, предпочтительно, по меньшей мере, 6%. Если добавка является жиром, тогда обычно жир может присутствовать в количестве от 1 до 5%, обычно от 1 до 3%, более обычно примерно 2%.
Дополнительный фермент
В дополнение к PS4-вариантным полипептидам могут быть использованы один или несколько дополнительных ферментов, например добавляемые к пищевому продукту, заготовке теста, корму или композиции крахмала.
Дополнительные ферменты, которые могут быть добавлены к тесту, включают оксидоредуктазы, гидролазы, такие как липазы и эстеразы, а также гликозидазы, подобные α-амилазе, пуллуланазе и ксиланазе. Оксидоредуктазы, такие как, например, глюкозооксидаза и гексозооксидаза, могут быть использованы для улучшения теста и контроля объема выпекаемых продуктов и ксиланазы и другие гемицеллюлазы могут быть добавлены для улучшения свойств, связанных с переработкой теста, эластичности мякиша и объема хлебного изделия. Липазы применимы как улучшители теста и размягчители мякиша и α-амилазы и другие амилолитические ферменты могут быть включены в тесто для контроля объема и дополнительного снижения плотности мякиша.
Дополнительные ферменты, которые могут быть использованы, можно выбрать из группы, состоящей из целлюлазы, гемицеллюлазы, фермента, разлагающего крахмал, протеазы, липоксигеназы.
Примеры применимых оксидоредуктаз включают оксидазы, такие как мальтозо-окисляющий фермент, глюкозооксидаза (ЕС 1.1.3.4.), карбогидратоксидаза, глицеролоксидаза, пиранозооксидаза, галактозооксидаза (ЕС 1.1.3.10) и гексозооксидаза (ЕС 1.1.3.5).
Среди ферментов, разлагающих крахмал, амилазы особенно применимы как добавки, улучшающие тесто. α-Амилаза разрушает крахмал до декстринов, которые затем разрушаются β-амилазой до мальтозы. Другие применимые ферменты, разлагающие крахмал, которые могут быть добавлены к композиции теста, включают глюкоамилазы и пуллуланазы.
Предпочтительно дополнительный фермент представляет собой, по меньшей мере, ксиланазу и/или, по меньшей мере, амилазу. Термин “ксиланаза”, используемый в данной работе, относится к ксиланазам (ЕС 3.2.1.32), которые гидролизуют ксилозидные связи.
Термин “амилаза”, используемый в данной работе, относится к амилазам, таким как α-амилазы (ЕС 3.2.1.1), β-амилазы (ЕС 3.2.1.2) и γ-амилазы (ЕС 3.2.1.3).
Дополнительный фермент можно добавлять вместе с любым ингредиентом для теста, включающим муку, воду или необязательно другие ингредиенты или добавки, или композицию, улучшающую тесто. Дополнительный фермент можно добавлять перед мукой, водой, необязательно другими ингредиентами и добавками или композицией, улучшающей тесто. Дополнительный фермент можно добавлять после муки, воды, необязательно других ингредиентов и добавок или композиции, улучшающей тесто. Дополнительный фермент может представлять собой для удобства жидкий препарат. Однако дополнительный фермент может быть для удобства в форме сухой композиции.
Некоторые ферменты тестоулучшающей композиции способны взаимодействовать друг с другом при тестовых режимах до такой степени, что эффект улучшения реологических свойств и/или свойств, характеризующих способность к механической обработке мучного теста, и/или улучшения качества продукта, сделанного из теста с помощью ферментов, является не только аддитивным, но и данный эффект является синергическим.
Что касается улучшения продукта, сделанного из теста (конечный продукт), то может оказаться, что комбинация приводит к существенному синергическому эффекту в отношении структуры мякиша. Также в отношении удельного объема испеченного продукта может проявиться синергический эффект.
Дополнительный фермент может представлять собой липазу (ЕС 3.1.1), способную гидролизовать карбоксильные сложноэфирные связи для высвобождения карбоксилата. Примеры липаз включают, но без ограничения только ими, триацилглицероллипазу (ЕС 3.1.1.3), галактолипазу (ЕС 3.1.1.26), фосфолипазу А1 (ЕС 3.1.1.32), фосфолипазу А2 (ЕС 3.1.1.4) и липопротеинлипазу А2 (ЕС 3.1.1.34).
Другие применения
PS4-варианты являются подходящими для производства мальтозы и сиропов с высоким содержанием мальтозы. Такие продукты представляют значительный интерес в производстве некоторых кондитерских изделий благодаря низкой гигроскопичности, малой вязкости, хорошей устойчивости к нагреванию и среднему, не слишком сладкому вкусу мальтозы. Промышленный способ производства сиропов мальтозы включает разжижение крахмала, затем осахаривание с ферментом, производящим мальтозу, и необязательно с ферментом, отщепляющим ветви в положениях 1,6 в амилопектине, например альфа-1,6-амилоглюкозидазой.
PS4-варианты, описанные здесь, могут быть добавлены к композиции детергента и, таким образом, могут становиться компонентом данной композиции. Композиция детергента может быть приготовлена как композиция детергента для ручного или машинопрачечного использования, включающая бельевую дополнительную композицию, подходящую для предварительной обработки загрязненных тканей, и композицию умягчителя для дополнительной промывки тканей, или может быть приготовлена как композиция детергента для применения в операциях чистки в основном твердых хозяйственных поверхностей, или может быть приготовлена для ручных и машинных посудомоечных операций. В определенном аспекте авторы описывают детергентную добавку, содержащую PS4-вариант. Детергентная добавка, а также детергентная композиция может содержать один или несколько ферментов, таких как протеаза, липаза, кутиназа, амилаза, карбогидраза, целлюлаза, пектиназа, маннаназа, арабиназа, галактаназа, ксиланаза, оксидаза, например лактаза и/или пероксидаза. В общем свойства выбранного фермента(ов) должны быть совместимы со свойствами выбранного детергента (т.е. рН-оптимум, совместимость с другими ферментативными и неферментативными ингредиентами, и т.д.), и фермент(ы) должен присутствовать в эффективных количествах.
PS4-вариант может быть также применен в производстве лигноцеллюлозных материалов, таких как техническая целлюлоза, бумага и картон от обогащенных крахмалом отходов бумаги и картона, особенно, где распускание бумажного брака происходит при рН 7 и где амилазы могут облегчать дезинтеграцию утильсырья через разложение повышенного количества крахмала. PS4-варианты могут быть особенно применимы в производстве бумажной массы для изготовления бумаги из макулатуры с крахмальным покрытием. Данный процесс может быть осуществлен, как описано в WO 95/14807, причем он включает следующие стадии: а) дезинтеграцию бумаги для производства бумажной массы; b) обработку ферментом, разлагающим крахмал, перед, в течение или после стадии а); с) отделение частиц типографской краски от бумажной массы после стадий а) и b). PS4-вариант может быть также очень полезным в модификации крахмала, где используют ферментативно модифицированный крахмал в производстве бумаги вместе со щелочными наполнителями, такими как карбонат кальция, каолин и глины. С PS4-вариантами, описанными здесь, становится возможным модифицировать крахмал в присутствии наполнителя, таким образом, допускающим более простой интегрированный процесс. PS4-вариант может быть также очень полезным в текстильной расшлихтовке. В текстильной обрабатывающей промышленности амилазы традиционно применяются как подсобные средства в процессе расшлихтовки для облегчения удаления крахмалсодержащего шлихтовочного вещества, которое служило как защитное покрытие уточных нитей в процессе ткацкого переплетения/ткачества. Полное удаление шлихтовочного покрытия после переплетения является важным для обеспечения оптимальных результатов в последующих процессах, в которых ткань промывают, обесцвечивают и окрашивают. Ферментативное разложение крахмала преобладает, так как оно не оказывает никакого вредного воздействия на тканевый материал. PS4-вариант может быть использован один или в комбинации с целлюлазой при расшлихтовке целлюлозосодержащей ткани или текстиля.
PS4-вариант может также представлять собой альтернативную амилазу для производства подсластителей из крахмала. “Традиционный” способ превращения крахмала во фруктозные сиропы обычно состоит из трех последовательных ферментативных процессов, а именно процесса разжижения, за которым следуют процесс осахаривания и процесс изомеризации. В течение процесса разжижения крахмал разлагается до декстринов под действием амилазы при значениях рН от 5,5 до 6,2 и при температурах 95-160°С в течение приблизительно 2-часового периода. Для обеспечения оптимальной стабильности фермента при данных условиях добавляют 1 мМ кальция (40 ч/млн свободных ионов кальция). После процесса разжижения декстрины превращают в декстрозу добавлением глюкоамилазы и фермента, устраняющего разветвления, такого как изоамилаза или пуллуланаза. Перед данной стадией рН снижают до величины ниже 4,5, поддерживая высокую температуру (примерно 95°С), и разжижающая амилазная активность теряется. Температуру снижают до 60°С и добавляют глюкоамилазу и фермент, устраняющий разветвления. Процесс осахаривания происходит в течение 24-72 часов.
Применения в кормах
В одном из вариантов осуществления PS4-вариантный полипептид способен разлагать устойчивый крахмал.
Используемый в данной работе термин “разложение” относится к частичному или полному гидролизу или разложению устойчивого крахмала до глюкозы и/или олигосахаридов - таких как мальтоза и/или декстрины.
PS4-вариантный полипептид может разлагать остаточный крахмал, который полностью не разлагается амилазой животного. В качестве примера PS4-вариантный полипептид можно применять для того, чтобы стимулировать амилазу животного (например, панкреатическую амилазу) в повышении разложения устойчивого крахмала. Панкреатическая α-амилаза выделяется в пищеварительной системе животных. Панкреатическая α-амилаза разлагает крахмал в корме. Однако часть крахмала, устойчивого крахмала, не разлагается полностью панкреатической α-амилазой и поэтому не абсорбируется в тонком кишечнике (см. определение устойчивого крахмала). PS4-вариантный полипептид в некоторых вариантах осуществления способен содействовать панкреатической α-амилазе в разложении крахмала в пищеварительной системе и тем самым увеличивать использование крахмала животным.
Способность фермента к разложению устойчивого крахмала может быть проанализирована, например, способом, разработанным и раскрытым Megazyme International Ireland Ltd. для определения устойчивого крахмала, растворенного крахмала и общего содержания крахмала в образце (Resistant Starch Assay Procedure, AOAC Method 2002.02, AACC Method 32-40).
Таким образом, животные могут потреблять PS4-вариантные полипептиды для полезных целей, и поэтому полипептиды могут быть включены в корма для животных.
Авторы раскрывают применение PS4-вариантного полипептида в качестве компонента для использования в корме, содержащем крахмал, или в композиции, улучшающий корм, в котором PS4-вариантный полипептид способен разлагать устойчивый крахмал. Авторы также раскрывают корм, содержащий крахмал и PS4-вариантный полипептид. Авторы дополнительно раскрывают способ разложения устойчивого крахмала в корме, содержащем указанный устойчивый крахмал, контактирующий с PS4-вариантным полипептидом.
Авторы дополнительно описывают применение PS4-вариантного полипептида в приготовлении корма, содержащего крахмал, для разложения устойчивого крахмала. Кроме того, авторы раскрывают применение PS4-вариантного полипептида в приготовлении корма для повышения теплотворности указанного корма. Авторы раскрывают применение фермента в приготовлении корма для повышения продуктивности животных. В следующем варианте осуществления авторы описывают способ для приготовления корма, содержащего смесь крахмала и PS4-вариантного полипептидного фермента.
Как пример, применение компонента, содержащего PS4-вариантные полипептиды и способного разлагать устойчивый крахмал, имеет преимущество, так как происходит заметное повышение разложения крахмала и/или образования продуктов разложения крахмала в животном. Кроме того, такое применение имеет преимущество, так как происходит заметное повышение усвояемости крахмала и/или образования продуктов разложения крахмала животным. Кроме того, такое применение имеет преимущество, так как оно обеспечивает средства для повышения эффективности получения животным энергии от корма. Кроме того, такое применение имеет преимущество, так как оно обеспечивает средства для повышения биодоступности устойчивого крахмала.
Корма для животных
Корма для животных, где PS4-вариантные полипептиды являются подходящими для применения, могут быть приготовлены для удовлетворения определенных потребностей конкретных групп животных и для обеспечения необходимыми углеводами, жирами, белками и другими питательными веществами в форме, которая может быть метаболизирована животным.
Предпочтительно данный корм для животных представляет собой корм для свиньи или домашней птицы.
Используемый в данной работе термин “свинья” относится к нежвачным всеядным, таким как свиньи любого пола, американские боровы или хряки. Обычно корм для свиней включает примерно 50% углеводов, примерно 20% белка и примерно 5% жира. Примером высококалорийного корма для свиней является кукуруза, которую часто комбинируют с кормовыми добавками, например белком, минералами, витаминами и аминокислотами, такими как лизин и триптофан. Примеры кормов для свиней включают животные белковые продукты, морепродукты, молочные продукты, продукты из зерновых культур и белковые продукты растительного происхождения, все из которых могут дополнительно содержать природные ароматизаторы, искусственные ароматизаторы, микро- и макроминералы, животные жиры, растительные жиры, витамины, консерванты или медикаменты, такие как антибиотики.
Следует понимать, что там, где сделана ссылка в данном описании, включая сопровождающую формулу изобретения, на “корм для свиней”, такая ссылка предназначена для включения “переходных” или “стартовых” кормов (употребляемых во время отнятия молодой свиньи от матки) и “завершающих” либо “ростовых или гроуэр” кормов (употребляемых после переходной стадии для роста свиньи до возраста и/или размера, подходящего для сбыта).
Используемый в данной работе термин “домашняя птица” относится к домашней птице, такой как молодые куры, бройлеры, куры, петухи, каплуны, индейки, утки, бойцовые куры, молодки или цыплята. Корма для домашней птицы могут быть названы как “полные” корма, потому что они содержат все витамины, минералы, белки, богатые энергией, и другие питательные вещества, необходимые для надлежащего роста, производства яиц и здоровья птиц. Однако корма для домашней птицы могут дополнительно содержать витамины, минералы или медикаменты, такие как кокцидиостатики (например, монензин натрий, лазалоцид, ампролиум, залиномицин и сульфахиноксалин) и/или антибиотики (пенициллин, вацитрасин, хлортетрациклин и окситетрациклин).
Молодых кур или бройлеров, индеек и уток, содержащихся для производства мяса, кормят отлично от молодок, служащих для производства яиц. Бройлеры, утки и индейки характеризуются тушками большего размера и более быстрым приростом массы, чем типы кур, производящих яйца. Поэтому данным птицам дают корма с более высокими уровнями белка и энергии.
Следует понимать, что там, где сделана ссылка в данном описании, включая сопровождающую формулу изобретения, на “корм для домашней птицы”, такая ссылка предназначена для включения “стартовых” кормов (после вылупления цыплят), “завершающих”, “гроуэр” или “девелопер” кормов (для особей от 6-8-недельного возраста до достижения размера для забоя) и “лейер” кормов (корм для несушек).
Корма для животных могут быть составлены для удовлетворения потребностей животных в питательных веществах в отношении, например, производства мяса, молока, яиц, восстановления и реакции на стресс. Кроме того, корма для животных составляют для улучшения качества навоза.
В предпочтительном аспекте корм для животных содержит необработанный продукт, такой как бобовые, например горох или сою, или злаковые, например пшеницу, кукурузу (маис), рис или ячмень. Соответственно необработанный продукт может представлять собой картофель.
Кормовые продукты
PS4-вариантные полипептиды могут быть использованы в кормах для потребления животными косвенным или прямым внесением PS4-вариантных полипептидов в корм, либо индивидуально, либо в комбинации с другими ингредиентами, такими как кормовые компоненты.
Типичные кормовые компоненты могут включать одну или несколько добавок, таких как животный или растительный жир, природное или синтетическое кондиционирующее средство, антиоксидант, модификатор вязкости, эфирное масло, и/или ароматизатор, краситель и/или пигмент, витамин, природную или неприродную аминокислоту, питательное вещество, дополнительный фермент (включая генетически модифицированные ферменты), связующее вещество, такое как гуаровая камедь или ксантановая смола, буфер, эмульгатор, замасливатель, адъювант, суспендирующее средство, консервант, покровное средство, растворяющее средство и тому подобное).
Примеры способов применения включают, но без ограничения, покрытие кормом продукта, содержащего PS4-вариантный полипептид, прямое внесение смешиванием PS4-вариантного полипептида с кормом, разбрызгивание PS4-вариантного полипептида на поверхности корма или погружение корма в препарат PS4-вариантного полипептида.
PS4-вариантный полипептид предпочтительно вносят смешиванием его с кормом или разбрызгиванием на частицы корма для потребления животным. В альтернативном случае PS4-вариантный полипептид может быть включен в эмульсию корма или во внутрь твердых продуктов инъекцией или забрасыванием.
PS4-вариантный полипептид может быть внесен рассыпанием, покрытием и/или пропитыванием корма. Могут быть также применены смеси с другими ингредиентами раздельно, одновременно или последовательно. Хелатообразователи, связующие вещества, эмульгаторы и другие добавки, такие как микро- и макроминералы, аминокислоты, витамины, животные жиры, растительные жиры, консерванты, красители, могут быть аналогично внесены в корм одновременно (либо в смеси, либо раздельно) или внесены последовательно.
Количество PS4-вариантного полипептида
Оптимальное количество PS4-вариантного полипептида, предназначенного для применения, будет зависеть от корма, предназначенного для обработки, и/или способа контактирования корма с PS4-вариантным полипептидом и/или предполагаемого применения корма и пептида. Количество PS4-вариантного полипептида должно быть достаточным, чтобы быть эффективным для значительного разложения устойчивого крахмала после проглатывания и в процессе переваривания корма.
Преимущественно PS4-вариантный полипептид должен оставаться эффективным после съедания корма по норме для животного и в процессе переваривания корма до тех пор, пока не получено полное переваривание, т.е. пока не высвобождена повышенная калорийность корма.
Комбинации амилаз
Авторы раскрывают, в частности, комбинации PS4-вариантных полипептидов с амилазами, в особенности, с мальтогенными амилазами. Мальтогенная альфа-амилаза (глюкан-1,4-а-мальтогидролаза, Е.С. 3.2.1.133) способна гидролизовать амилозу и амилопектин до мальтозы в альфа-конфигурации.
Мальтогенная альфа-амилаза из Bacillus (ЕР 120693) коммерчески доступна под торговым названием новамил(novamyl)(Novo Nordisk A/S, Denmark) и широко применяется в хлебопекарной промышленности как средство против черствения из-за его способности снижать ретроградацию крахмала. Новамил подробно описан в публикации международного патента WO 91/04669. Мальтогенная альфа-амилаза новамил обладает частью некоторых свойств циклодекстринглюканотрансфераз (СGT-азы), включающих гомологию последовательностей (Henrissat B, Bairoch A; Biochem. J., 316, 695-696 (1996)) и образование продуктов трансгликозилирования (Christophersen, C., et al., 1997, Starch, vol.50, № 1, 39-45).
В наиболее предпочтительных вариантах осуществления авторы раскрывают комбинации, содержащие PS4-вариантные полипептиды вместе с новамилом или другими его разновидностями. Такие комбинации применимы для производства продуктов питания, такого как хлебопекарное производство. Новамил может включать, в частности, новамил 1500 МG.
Другие документы, описывающие новамил и его применения, включают публикации Christophersen, C., Pedersen, S., and Christensen, T., (1993) Method for production of maltose an a limit dextrin, the limit dextrin, and use of the limit dextrin. Denmark, и WO 95/10627. Новамил еще описан в патентах США № 4598048 и № 4604355. Каждый из данных документов, таким образом, включен ссылкой, и любые из новамил-полипептидов, описанных в данной работе, могут быть применены в комбинациях с любыми PS4-вариантными полипептидами, описанными здесь.
Варианты, гомологи и мутанты новамила могут быть применены для комбинаций, при условии, если только они сохраняют альфа-амилазную активность. Например, любой из вариантов новамила, раскрытых в патенте США № 6162628, полное раскрытие которого, таким образом, включено ссылкой, может быть применен в комбинации с PS4-вариантными полипептидами, описанными в данной работе. В частности может быть применен любой из полипептидов, описанных в данном документе, особенно варианты SEQ ID NO:1 из US 6162628 в любом одном или нескольких положениях, соответствующиx Q13, I16, D17, N26, N28, P29, A30, S32, Y33, G34, L35, K40, M45, P73, V74, D76, N77, D79, N86, R95, N99, I100, H103, Q119, N120, N131, S141, T142, A148, N152, A163, H169, N171, G172, I174, N176, N187, F188, A192, Q201, N203, H220, N234, G236, Q247, K249, D261, N266, L268, R272, N275, N276, V279, N280, V281, D285, N287, F297, Q299, N305, K316, N320, L321, N327, A341, N342, A348, Q365, N371, N375, M378, G397, A381, F389, N401, A403, K425, N436, S442, N454, N468, N474, S479, A483, A486, V487, S493, T494, S495, A496, S497, A498, Q500, N507, I510, N513, K520, Q526, A555, A564, S573, N575, Q581, S583, F586, K589, N595, G618, N621, Q624, A629, F636, K645, N664 и/или Т681.
Аминокислотные последовательности
Данное изобретение предлагает применение PS4-вариантных нуклеиновых кислот и аминокислотные последовательности таких PS4-вариантных нуклеиновых кислот, охваченных способами и композициями, описанными здесь.
Используемый в данной работе термин “аминокислотная последовательность” представляет собой синоним термина “полипептид” и/или термина “белок”. В некоторых примерах термин “аминокислотная последовательность” является синонимом термина “пептид”. В некоторых примерах термин “аминокислотная последовательность” является синонимом термина “фермент”.
Аминокислотная последовательность может быть получена/выделена из подходящего источника или может быть получена синтезом, или может быть получена применением методик рекомбинантных ДНК (DNA).
PS4-вариантный фермент, описанный здесь, может быть использован в сочетании с другими ферментами. Таким образом, авторы дополнительно раскрывают комбинацию ферментов, где комбинация содержит PS4-вариантный полипептидный фермент, описанный здесь, и другой фермент, который сам по себе может представлять собой другой PS4-вариантный полипептидный фермент.
PS4-вариантная нуклеотидная последовательность
Как отмечено выше, авторы раскрывают нуклеотидные последовательности, кодирующие PS4-вариантные ферменты, обладающие определенными описанными свойствами.
Термин “нуклеотидная последовательность” или “последовательность нуклеиновых кислот”, используемый в данной работе, относится к олигонуклеотидной последовательности или полинуклеотидной последовательности или их варианту, гомологам, фрагментам и производным (таким, как их части). Нуклеотидная последовательность может быть геномного, синтетического или рекомбинантного происхождения, при этом может быть двухцепочечной или одноцепочечной, представляющей смысловую или антисмысловую нить.
Термин “нуклеотидная последовательность”, используемый в данном документе, включает геномную ДНК, кДНК, синтетическую ДНК и РНК. Предпочтительно, он означает ДНК, предпочтительнее кДНК последовательность, кодирующую PS4-вариантный полипептид.
Обычно PS4-вариантную нуклеотидную последовательность получают с применением методик рекомбинантных ДНК (т.е. рекомбинантной ДНК). Однако в альтернативном варианте осуществления нуклеотидная последовательность могла быть синтезирована, полностью или частично, применением химических способов, известных в данной области (см. Caruthers M.H. et al., (1980) Nuc. Acids Res. Symp. Ser. 215-23 и Horn T. et al., (1980) Nuc. Acids Res. Symp. Ser. 225-232).
Получение последовательностей нуклеиновых кислот
Нуклеотидная последовательность, кодирующая либо фермент, который имеет особые свойства, описанные здесь (например, PS4-вариантный полипептид), либо фермент, который является подходящим для модификации, такой как исходный фермент, может быть идентифицирована и/или выделена, и/или очищена из любой клетки или организма, производящего указанный фермент. Различные способы для идентификации и/или выделения, и/или очистки нуклеотидных последовательностей хорошо известны в данной области. Как пример, могут быть использованы методики PCR амплификации для получения большей последовательности, в том случае, если подходящая последовательность идентифицирована и/или выделена, и/или очищена.
Как следующий пример, геномная ДНК и/или кДНК библиотеки могут быть созданы использованием хромосомной ДНК или информационной РНК от организма, производящего фермент. Если аминокислотная последовательность фермента или часть аминокислотной последовательности фермента известна, то могут быть синтезированы меченые олигонуклеотидные зонды и применены для идентификации фермент-кодирующих клонов из геномной библиотеки, выделенных из организма. В альтернативном случае меченый олигонуклеотидный зонд, содержащий последовательности, гомологичные с другим известным ферментным геном, может быть использован для идентификации фермент-кодирующих клонов. В последнем случае применяют гибридизацию и условия промывания меньшей строгости.
В альтернативном случае фермент-кодирующие клоны могут быть идентифицированы путем вставки фрагментов геномной ДНК в вектор экспрессии, такой как плазмида, трансформацией фермент-негативной бактерии с помощью образовавшейся геномной ДНК-библиотеки, и затем посевом трансформированной бактерии в чашки с агаровой средой, содержащей субстрат для фермента (т.е. мальтозу), что таким образом дает клоны, экспрессирующие фермент, предназначенный для идентификации.
В еще дополнительном альтернативном случае нуклеотидная последовательность, кодирующая фермент, может быть получена синтетически по установленным стандартным способам, например фосфороамидитным способом, описанным Beucage S.L. et al., (1981) Tetrahedron Letters 22, pр.1859-1869, или способом, описанным Matthes et al., (1984) EMBO J. 3, pр.801-805. По фосфороамидитному способу синтезируют олигонуклеотиды, например, в автоматическом синтезаторе ДНК, очищают, отжигают, лигируют и клонируют в соответствующие векторы.
Нуклеотидная последовательность может быть смешанного геномного и синтетического происхождения, смешанного синтетического и кДНК-происхождения или смешанного геномного и кДНК-происхождения, полученная лигированием фрагментов синтетического, геномного или кДНК-происхождения (как целесообразно) в соответствии со стандартными методиками. Каждый лигированный фрагмент соответствует различным частям полной нуклеотидной последовательности. ДНК-последовательность может быть также получена реакцией полимеразной цепи (PCR) с применением специальных праймеров, например, как описано в US 4683202 или в публикации Saiki R.K. et al., (Science (1988) 239, pp.487-491).
Варианты/Гомологи/Производные
Авторы далее описывают применение вариантов, гомологов и производных любой аминокислотной последовательности фермента или любой нуклеотидной последовательности, кодирующей такой фермент, таких как PS4-вариантный полипептид или PS4-вариантная нуклеиновая кислота. Если контекст не указывает иначе, следует полагать, что термин “PS4-вариантная нуклеиновая кислота” включает каждую из структурных единиц нуклеиновых кислот, описанных ниже, и следует также полагать, что термин “PS4-вариантный полипептид” включает каждую из структурных единиц полипептида или аминокислоты, описанных ниже.
Здесь термин “гомолог” означает структурную единицу, обладающую определенной гомологией с исследуемыми аминокислотными последовательностями и исследуемыми нуклеотидными последовательностями. Здесь термин “гомология” может быть приравнен к термину “идентичность”.
В данном контексте полагают, что гомологичная последовательность включает аминокислотную последовательность, которая может быть, по меньшей мере, на 75, 80, 85 или 90% идентичной, предпочтительно, по меньшей мере, на 95, 96, 97, 98 или 99% идентичной исследуемой последовательности. Обычно гомологи будут содержать те же самые активные сайты и т.д., как исследуемая аминокислотная последовательность. Хотя гомологию можно рассматривать также в терминах подобия (т.е. аминокислотных остатков, имеющих подобные химические свойства/функции), в контексте данного документа предпочитают выражать гомологию в терминах идентичности последовательностей.
В данном контексте полагают, что гомологическая последовательность включает нуклеотидную последовательность, которая может быть, по меньшей мере, на 75, 80, 85 или 90% идентичной, предпочтительно, по меньшей мере, на 95, 96, 97, 98 или 99% идентичной нуклеотидной последовательности, кодирующей PS4-вариантный полипептидный фермент (такой как PS4-вариантная нуклеиновая кислота). Обычно гомологи будут содержать те же самые последовательности, которые кодируют активные сайты и т.д., как исследуемая последовательность. Хотя гомологию можно рассматривать также в терминах подобия (т.е. аминокислотных остатков, имеющих подобные химические свойства/функции), в контексте данного документа предпочитают выражать гомологию в терминах идентичности последовательностей.
Гомологичные сравнения могут проводиться визуально или, как принято, с помощью легкодоступных программ сравнения последовательностей. Эти коммерчески доступные компьютерные программы могут рассчитать процент гомологии между двумя или более последовательностями.
Процент гомологии может быть вычислен на всем протяжении смежных последовательностей, т.е. одну последовательность выравнивают с другой последовательностью и каждую аминокислоту в одной последовательности сравнивают непосредственно с соответствующей аминокислотой в другой последовательности, один остаток одновременно. Это называется “плотным” выравниванием. Обычно такое выравнивание проводят только на относительно небольшом числе остатков.
Хотя данный способ представляет собой простой и согласующийся способ, он недостаточен, чтобы принять в рассмотрение, например, то, что в другой идентичной паре последовательностей одна вставка или делеция вызовут выключение последующего аминокислотного остатка из выровненного, таким образом, потенциально получается большое снижение процента гомологии, когда проводят общее выравнивание. В результате большинство способов сравнения последовательностей создано для проведения оптимальных выравниваний, которые учитывают возможные вставки и делеции без чрезмерных потерь для счета общей гомологии. Это достигается вставкой “гэпов/пробелов” в выровненную последовательность, чтобы довести до максимума локальную гомологию.
Однако данные более сложные способы определяют “гэповые пенальти/gap penalties” к каждому гэпу, что имеет место выравнивание, таким образом, что для одинакового числа идентичных аминокислот выравнивание последовательности с минимально возможными гэпами - отражающими более высокое родство между двумя сравниваемыми последовательностями - достигнет более высокого счета, чем выравнивание со многими гэпами. Обычно используют “расходование родственных гэпов/affine gap costs”, что обуславливает относительно высокую цену для существования гэпа и меньший пенальти для каждого последующего остатка в гэпе. Данная система представляет собой самую обычно используемую систему подсчета гэпов. Сильные геповые пенальти будут производить, конечно, оптимальные выравнивания с меньшим числом гэпов. Большинство выравнивающих программ допускает, чтобы геповые пенальти могли быть модифицированы. Однако предпочитают использовать отсутствующие величины при применении такого программного обеспечения для сравнения последовательностей. Например, при применении GCG Wisconsin Bestfit пакета отсутствующий гэповый пенальти для аминокислотной последовательности составляет -12 для гэпа и -4 для каждого расширения.
Вычисление максимального процента гомологии поэтому сначала требует создания оптимального выравнивания, принимающего во внимание гэповые пенальти. Подходящая компьютерная программа для выполнения такого выравнивания представляет собой GCG Wisconsin Bestfit пакет (Devereux et al., 1984 Nuc. Acids Research 12, p.387). Примеры другого программного обеспечения, с помощью которого можно провести сравнения последовательностей, включают, но без ограничения, BLAST пакет (см. Ausubel et al., 1999 Short Protocols in Molecular Biology, 4th Ed-Chapter 18), FASRA (Altschul et al., 1990 J. Mol. Biol. 403-410) и GENEWORKS пакет средств сравнения. Как BLAST, так и FASTA являются пригодными для режима офлайн (offline) и онлайн (online) (см. Ausubel et al., 1999 Short Protocols in Molecular Biology, pp.7-57 - 7-60).
Однако для некоторых применений предпочитают использование GCG Bestfit программы. Новое средство, называемое как BLAST 2 Sequences, является также пригодным для сравнения белковой и нуклеотидной последовательности (см. FEMS Microbiol. Lett. 1999 174(2):247-50; FEMS Microbiol. Lett. 1999 177(1):187-8 и Tatiana@ncbi.nlm.nih.gov).
Хотя конечная процентная гомология может быть измерена в терминах идентичности, процесс выравнивания сам по себе обычно не основан на сравнении всех присутствующих или отсутствующих пар. Вместо этого обычно используют изображенную в масштабе счетную матрицу подобия, которая назначает метки для каждого парного сравнения на основании химического сходства или развившегося расстояния. Пример такой обычно применяемой матрицы представляет собой BLOSUM62 матрицу - недостающую матрицу для BLAST пакета программ. GCG Wisconsin программы обычно используют либо опубликованные недостающие величины, либо таблицу символов сравнения пользователя, если она дана (см. руководство пользователя по дополнительным деталям). Для некоторых применений предпочитают использовать недостающие величины для GCG пакета или в случае другого программного обеспечения - недостающую матрицу, такую как BLOSUM62.
В альтернативном случае процентная гомология может быть вычислена использованием составных характеристик выравнивания по программе DNASIS (Hitachi Software), основанной на алгоритме, аналогичном CLUSTAL (Higgins DG and Sharp PM (1988), Gene 73(1), 237-244).
После того как программное обеспечение провело оптимальное выравнивание, можно рассчитать процент гомологии предпочтительно проценту идентичности последовательностей. Программное обеспечение обычно выдает это как часть сравнения последовательностей или генерирует результат нумерации.
Последовательности могут также иметь делеции, вставки или замещения аминокислотных остатков, которые производят молчащие изменения и приводят к функционально эквивалентному веществу. Заранее планируемое замещение может быть сделано на основе подобия свойств аминокислот (таких как полярность, заряд, гидрофобность, гидрофильность, амфипатическая природа остатков) и оно поэтому применимо для группирования аминокислот вместе в функциональные группы. Аминокислоты могут быть сгруппированы вместе на основе свойств их боковой цепи самой по себе. Однако более применимо включение также данных по мутации. Наборы аминокислот, полученных таким образом, вероятно следует сохранять для структурных основ. Данные наборы могут быть описаны в форме Venn-диаграмм (Livingstone C.D. and Barton G.J. (1993) “Protein sequence alignments: a strategy for the hierarchical analysis of residue conservation” Comput. Appl. Biosci. 9:745-756) (Taylor W.R. (1986) “The classification of amino acid conservation” J. Theor. Biol. 119; 205-218). Консервативные замещения могут быть сделаны согласно таблице, данной ниже, которая представляет общепринятую Venn-диаграмму, группирующую аминокислоты.
Авторы далее раскрывают последовательности, включающие гомологичное замещение (замещение, substitution и replacement, оба английских варианта применены в данном документе для обозначения замещения имеющегося аминокислотного остатка альтернативным остатком), которое может происходить, т.е. подобное на подобное замещение, такое как основное на основное, кислотное на кислотное, полярное на полярное и так далее. Негомологичное замещение также может происходить, т.е. остатка из одного класса на другой остаток, или, в альтернативном случае, содержащее включение неприродных аминокислот, таких как орнитин (далее обозначенный как Z), орнитиндиаминомасляная кислота (далее обозначенная как В), норлейцинорнитин (далее обозначенный как О), пиридилаланин, тиенилаланин, нафтилаланин и фенилглицин.
Вариантные аминокислотные последовательности могут включать подходящие спейсерные группы, которые могут быть вставлены между двумя аминокислотными остатками последовательности, включающие алкильные группы, такие как метильные, этильные или пропильные группы в дополнение к аминокислотным спейсерам, таким как глицин или остатки β-аланина. Следующий вариант разновидности включает присутствие одного или нескольких аминокислотных остатков в пептоидной форме, которая будет понятна специалистам в данной области. Для снятия сомнения “пептоидная форма” использована для обозначения вариантных аминокислотных остатков, в которых α-углерод-заместительная группа находится на атоме азота остатка, а не на атоме α-углерода. Способы получения пептидов в пептоидной форме известны в данной области, например, из публикаций Simon R.J. et al., PNAS (1992) 89(20), 9367-9371 и Horwell D.C., Trends Biotechnol. (1995) 13(14), 132-134.
Нуклеотидные последовательности, описанные в данном документе и подходящие для применения по способам и в композициях, описанных здесь (такие как PS4-вариантные нуклеиновые кислоты), могут включать внутри себя синтетические или модифицированные нуклеотиды. Ряд различных типов модификаций для олигонуклеотидов известен в данной области. Они включают метилфосфонатные и фосфоротиоатные основы и/или добавление акридиновых или полилизиновых цепей в 3' и/или 5'-концах молекулы. Для целей данного документа следует подразумевать, что нуклеотидная последовательность, описанная здесь, может быть модифицирована любым способом, доступным в данной области. Такие модификации могут быть осуществлены для повышения активности in vivo или времени жизни нуклеотидных последовательностей.
Авторы далее описывают применение нуклеотидных последовательностей, которые комплементарны последовательностям, представленным в данной работе, или любому производному, фрагменту или их производному. Если последовательность комплементарна их фрагменту, тогда эта последовательность может быть использована как зонд для идентификации подобных кодирующих последовательностей в других организмах и т.д.
Полинуклеотиды, которые не обладают 100% гомологией с PS4-вариантными последовательностями, могут быть получены рядом способов. Другие варианты последовательностей, описанных здесь, могут быть получены, например, зондированием ДНК-библиотек, сделанных из ряда индивидуумов, например индивидуумов от различных популяций. Дополнительно могут быть получены другие гомологи, и такие гомологи и их фрагменты в основном будут способны к селективной гибридизации с последовательностями, показанными здесь в списке последовательностей. Такие последовательности могут быть получены зондированием из сделанных кДНК-библиотек, или геномных ДНК-библиотек от других видов, при этом такие библиотеки зондируются с помощью зондов, содержащих всю или часть любой одной из последовательностей в прилагаемых списках последовательностей, в условиях среды высокой жесткости. Подобные рассмотрения применяются для получения видовых гомологов и аллельных вариантов полипептидных или нуклеотидных последовательностей, описанных здесь.
Варианты и штаммы/виды гомологов могут быть также получены применением вырожденной PCR, которая будет использовать праймеры, созданные к целевым последовательностям внутри вариантов и гомологов, кодирующих консервативные аминокислотные последовательности. Консервативные последовательности можно прогнозировать, например, выравниванием аминокислотных последовательностей из нескольких вариантов/гомологов. Выравнивание последовательностей может быть осуществлено с использованием компьютерного программного обеспечения, известного в данной области. Например, широко используется GCG Wisconsin PileUp программа.
Праймеры, применяемые в вырожденной PCR, будут содержать одно или несколько вырожденных положений и будут использованы в условиях контроля, более слабых, чем условия, применяемые для клонирующих последовательностей с отдельной последовательностью праймеров, по сравнению с известными последовательностями.
В альтернативном случае такие полинуклеотиды могут быть получены сайт-направленным мутагенезом характеризуемых последовательностей. Это может применяться в случаях, где требуются, например, изменения последовательностей молчащих кодонов для оптимизации кодоновых предпочтений для конкретной клетки-хозяина, в которой полинуклеотидные последовательности экспрессируются. Другие изменения последовательностей могут потребоваться для введения сайтов узнавания рестрикционных ферментов или для изменения свойства или функции полипептидов, кодируемых полинуклеотидами.
Полинуклеотиды (нуклеотидные последовательности), такие как PS4-вариантные нуклеиновые кислоты, описанные в данном документе, могут быть использованы для получения праймера, например PCR праймера, праймера для альтернативной реакции амплификации, зонда, например меченого проявляющейся меткой традиционными способами с использованием радиоактивных или нерадиоактивных меток, или полинуклеотиды могут быть клонированы в векторы. Такие праймеры, зонды и другие фрагменты будут представлять собой, по меньшей мере, 15, предпочтительно, по меньшей мере, 20, например, по меньшей мере, 25, 30 или 40 нуклеотидов в длину, и также охватываются термином полинуклеотиды.
Полинуклеотиды, такие как ДНК-полинуклеотиды и зонды, могут быть произведены рекомбинантным путем, синтетически или любыми способами, доступными для специалистов данной области. Они также могут быть клонированы по стандартным методикам. В основном праймеры будут произведены синтетическими способами, включающими ступенчатое получение требуемой последовательности нуклеиновых кислот путем присоединения одного нуклеотида за один цикл. Методики для осуществления данного способа с применением автоматических процедур легко доступны в данной области.
Более длинные полинуклеотиды в основном будут получены применением рекомбинантных способов, например применением PCR (полимеразная цепная реакция) клонирующих методик. Праймеры могут быть созданы с включением соответствующих сайтов узнавания рестрикционных ферментов, так что амплифицированная ДНК может быть клонирована в подходящий клонирующий вектор. Предпочтительно вариантные последовательности и т.д. являются биологически активными, такими как последовательности, представленные здесь.
Используемый в данной работе термин “биологически активный” относится к последовательности, имеющей подобную структурную функцию (но необязательно в такой же степени), и/или подобную регуляторную функцию (но необязательно в такой же степени), и/или подобную биохимическую функцию (но необязательно в такой же степени) при сравнении с функцией последовательности природного происхождения.
Гибридизация
Авторы далее описывают последовательности, которые являются комплементарными последовательностям нуклеиновых кислот PS4-вариантов или последовательностям, которые способны к гибридизации с PS4-вариантными последовательностями или с последовательностями, которые вдобавок к этому являются комплементарными.
Термин “гибридизация”, используемый в данной работе, будет включать “cпособ, по которому нить нуклеиновой кислоты связывается с комплементарной нитью через спаривание оснований”, а также способ амплификации, осуществляемый по методикам полимеразной цепной реакции (PCR). Поэтому авторы раскрывают применение нуклеотидных последовательностей, которые способны к гибридизации с последовательностями, которые являются комплементарными последовательностям, представленным в данной работе, или любому производному, фрагменту или их производным.
Термин “вариант” также охватывает последовательности, которые являются комплементарными последовательностям, которые способны к гибридизации с нуклеотидными последовательностями, представленными в данном документе.
Предпочтительно термин “вариант” охватывает последовательности, которые являются комплементарными последовательностям, которые способны к гибридизации при жестких условиях (например, 50°С и 0,2×SSC {1×SSC = 0,15 M NaCl, 0,015 M Na3цитрат рН 7,0}) с нуклеотидными последовательностями, представленными здесь. Предпочтительнее термин “вариант” охватывает последовательности, которые являются комплементарными последовательностям, которые способны к гибридизации при более жестких условиях (например, 65°С и 0,1×SSC {1×SSC = 0,15 M NaCl, 0,015 M Na3цитрат рН 7,0}) с нуклеотидными последовательностями, представленными здесь.
Авторы далее раскрывают нуклеотидные последовательности, которые могут гибридизироваться с нуклеотидными последовательностями PS4-вариантов (включая комплементарные последовательности последних, представленные здесь), а также нуклеотидные последовательности, которые являются комплементарными последовательностям, которые могут гибридизироваться с нуклеотидными последовательностями PS4-вариантов (включая комплементарные последовательности последних, представленные здесь). Авторы далее описывают полинуклеотидные последовательности, которые способны гибридизироваться с нуклеотидными последовательностями, представленными здесь, в условиях от промежуточной до максимальной жесткости.
В предпочтительном аспекте авторы раскрывают нуклеотидные последовательности, которые могут гибридизироваться с нуклеотидной последовательностью PS4-вариантной нуклеиновой кислоты или ее комплементом в жестких условиях (например, 50°С и 0,2×SSC). Предпочтительнее нуклеотидные последовательности могут гибридизироваться с нуклеотидной последовательностью PS4-варианта или ее комплементом в более жестких условиях (например, 65°С и 0,1×SSC).
Сайт-направленный мутагенез
После того как фермент-кодирующая нуклеотидная последовательность выделена или предполагаемая фермент-кодирующая нуклеотидная последовательность идентифицирована, может быть целесообразно мутировать последовательность для того, чтобы приготовить фермент. Таким образом, PS4-вариантная последовательность может быть получена из исходной последовательности. Мутации могут быть введены применением синтетических олигонуклеотидов. Данные олигонуклеотиды содержат нуклеотидные последовательности, фланкирующие целевые сайты мутации.
Подходящий способ описан в публикации Morinaga et al., (Biotechnology (1984) 2, pр.646-649). Другой способ введения мутаций в фермент-кодирующие нуклеотидные последовательности описан в публикации Nelson и Long (Analytical Biochemistry (1989), 180, pр.147-151). Другой способ описан в публикации Sarkar и Sommer (Biotechniques (1990), 8, pр.404-407 - “The megaprimer method of site directed mutagenesis”).
В одном из аспектов последовательность для применения по способам и в композициях, описанных здесь, представляет собой рекомбинантную последовательность, т.е. последовательность, которая получена применением методик рекомбинантных ДНК. Эти методики рекомбинантных ДНК находятся в рамках компетенций обычного специалиста в данной области. Такие методики обсуждены в литературе, например, в J. Sambrook, E. F. Fritisch and T. Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Second Edition, Books 1-3, Cold Spring Harbor Laboratory Press.
В одном из аспектов последовательность для применения по способам и в композициях, описанных здесь, представляет собой синтетическую последовательность, т.е. последовательность, которая была получена in vitro химическим или ферментативным синтезом. Она включает, но без ограничения только ими, последовательности с использованием оптимального кодона для организмов-хозяев, таких как метилотрофические дрожжи Pichia и Hansenula.
Нуклеотидная последовательность для применения по способам и в композициях, описанных здесь, может быть включена в рекомбинантный реплицируемый вектор. Данный вектор может быть применен для репликации и экспрессии нуклеотидной последовательности, в форме фермента, в и/или из совместимой клетки-хозяина. Экспрессию можно контролировать использованием контрольных последовательностей, например регуляторных последовательностей. Фермент, произведенный рекомбинантной клеткой-хозяином путем экспрессии нуклеотидной последовательности, может быть выделен или может содержаться внутриклеточно в зависимости от примененных последовательностей и/или вектора. Кодирующие последовательности могут быть созданы с сигнальными последовательностями, которые направляют секрецию последовательностей, кодирующих вещество, через конкретную прокариотическую или эукариотическую клеточную мембрану.
Экспрессия PS4-нуклеиновых кислот и полипептидов
PS4-полинуклеотиды и нуклеиновые кислоты могут включать ДНК и РНК как синтетического, так и природного происхождения, и эта ДНК или РНК может содержать модифицированные или немодифицированные деокси- или дидеоксинуклеотиды, или рибонуклеотиды, или их аналоги. PS4-нуклеиновая кислота может существовать как одно- или двухцепочечная ДНК или РНК, РНК/ДНК-гетеродуплекс или РНК/ДНК-сополимер, где термин “сополимер” относится к одноцепочечной нуклеиновой кислоте, которая содержит и рибонуклеотиды, и деоксирибонуклеотиды. PS4-нуклеиновая кислота может даже быть кодоноптимизированной для последующего увеличения экспрессии.
Термином “синтетический”, используемым здесь, определено то, что произведено in vitro химическим или ферментативным синтезом. Он включает, но без ограничения только ими, PS4-нуклеиновые кислоты, сделанные с помощью оптимального использования кодона для организмов-хозяев, таких как метилотрофические дрожжи Pichia и Hansenula.
Полинуклеотиды, например, вариантные PS4-полинуклеотиды, описанные здесь, могут быть включены в рекомбинантный реплицируемый вектор. Данный вектор может быть применен для репликации нуклеиновой кислоты в совместимой клетке-хозяине. Вектор, содержащий полинуклеотидную последовательность, может быть трансформирован в подходящей клетке-хозяине. Подходящие хозяева включают бактериальные, дрожжевые клетки, клетки насекомых и грибные клетки.
Термин “трансформированная клетка” включает клетки, которые были трансформированы применением методик рекомбинантных ДНК. Трансформация обычно происходит включением одной или нескольких нуклеотидных последовательностей в клетку, которая предназначена для трансформирования. Вставленная нуклеотидная последовательность может быть разнородной нуклеотидной последовательностью (т.е. представляет собой последовательность, которая не является природной по отношению к клетке, которая предназначена для трансформирования). В дополнение или в альтернативном случае вставленная нуклеотидная последовательность может быть гомологичной нуклеотидной последовательностью (т.е. представляет собой последовательность, которая является природной по отношению к клетке, которая предназначена для трансформирования) - таким образом, клетка получает одну или несколько экстракопий нуклеотидной последовательности, уже присутствующей в ней.
Таким образом, в следующем варианте осуществления авторы предлагают способ создания PS4-вариантных полипептидов или полинуклеотидов введением полинуклеотида в реплицируемый вектор, введением вектора в совместимую клетку хозяина и выращиванием клетки хозяина при условиях, которые приносят репликацию вектора. Вектор может быть выделен из клетки-хозяина.
Экспрессионные конструкции
PS4-нуклеиновая кислота может быть функционально связана с транскриптационными и трансляционными элементами, активными в клетке-хозяине, представляющей интерес. PS4-нуклеиновая кислота может также кодировать гибридный белок, содержащий сигнальные последовательности, такие как, например, полученные из гена глюкоамилазы от Schwanniomyces occidentalis, гена α-фактора спаривания от Saccharomyces cerevisiae и ТАКА-амилазы от Aspergillus oryzae. В альтернативном случае PS4-нуклеиновая кислота может кодировать гибридный белок, содержащий мембранный связывающий домен.
Вектор экспрессии
PS4-нуклеиновая кислота может быть экспрессирована в требуемых количествах в организме-хозяине применением вектора экспрессии.
Вектор экспрессии, включающий PS4-нуклеиновую кислоту, может представлять собой любой вектор, который способен экспрессировать ген, кодирующий PS4-нуклеиновую кислоту, в выбранном организме-хозяине, и выбор вектора будет зависеть от клетки-хозяина, в которую он должен вводиться. Таким образом, вектор может представлять собой автономно реплицируемый вектор, т.е. вектор, который существует как эписомная структурная единица, репликация которой происходит независимо от хромосомной репликации, например такая как плазмида, бактериофаг или эписомный элемент, минихромосома или искусственная хромосома. В альтернативном случае вектор может быть одиночным, который при введении в клетку-хозяина интегрируется в геном клетки-хозяина и воспроизводится вместе с хромосомой.
Компоненты вектора экспрессии
Вектор экспрессии обычно включает компоненты клонирующего вектора, такие как, например, элемент, который запускает автономную репликацию вектора в выбранном организме-хозяине и один или несколько фенотипически определяемых маркеров для целей отбора. Вектор экспрессии обычно включает контрольные нуклеотидные последовательности, кодирующие промотор, оператор, рибосомный связывающий сайт, сигнал начальной трансляции и необязательно ген-репрессор и один или несколько генов-активаторов. Дополнительно вектор экспрессии может содержать последовательность, кодирующую аминокислотную последовательность, способную направить PS4-вариантный полипептид к клеточной органелле хозяина, такой как пероксисома, или к определенному компартменту клетки-хозяина. Такая целевая последовательнеость включает, но без ограничения только ею, последовательность SKL. В данном контексте термин “сигнал экспрессии” включает любую из выше данных контрольных последовательностей, репрессорных или активаторных последовательностей. Для экспрессии в направлении контрольных последовательностей последовательность нуклеиновых кислот PS4-вариантного полипептида функционально присоединяется к контрольным последовательностям соответствующим образом по отношению к экспрессии.
Предпочтительно полинуклеотид в векторе функционально связан с контрольной последовательностью, которая способна обеспечить экспрессию кодирующей последовательности клеткой хозяином, т.е. вектор представляет собой вектор экспрессии. Термин “функционально связан” означает, что описанные компоненты находятся в состоянии допуска их к функции целевым образом. Регуляторная последовательность, “функционально связанная” с кодирующей последовательностью, лигирована таким образом, что экспрессия кодирующей последовательности достигается при условиях, совместимых с контрольной последовательностью.
Контрольные последовательности могут быть модифицированы, например, добавлением дополнительных регуляторных элементов транскрипции для получения уровня транскрипции, управляемой контрольными последовательностями, более чувствительными по отношению к модуляторам транскрипции. Контрольные последовательности могут, в частности, содержать промоторы.
Промотор
В векторе последовательность нуклеиновых кислот, кодирующая вариантный PS4-полипептид, функционально соединена с последовательностью подходящего промотора. Данный промотор может представлять собой любую ДНК-последовательность с транскрипционной активностью в выбранном организме-хозяине, и может быть получена из генов, которые являются гомологичными или гетерологичными для организма-хозяина.
Бактериальные промоторы
Примеры подходящих промоторов для направления транскрипции модифицированной нуклеотидной последовательности, такой как PS4-нуклеиновые кислоты, в бактериальном хозяине включают промотор lac оперона E. coli, dagA промоторы гена агаразы Streptomyces coelicolor, промоторы гена α-aмилазы (amyL) Bacillus licheniformis, промоторы гена мальтогенной амилазы (amyM) Bacillus stearothermophilus, промоторы гена α-aмилазы (amyQ) Bacillus amyloliquefaciens, промоторы xylA and xylB генов Bacillus subtilis и промотор, полученный из Lactococcus sp. промотора, включающего Р170 промотор. Когда ген, кодирующий PS4-вариантный полипептид, экспрессирован в бактериальных видах, таких как E. coli, подходящий промотор может быть выбран, например, из промотора бактериофага, включающего Т7 промотор и фаг лямбда промотор.
Грибные промоторы
Для транскрипции в грибных видах примеры применимых промоторов представляют собой промоторы, происходящие из генов, кодирующих TAKA амилазу Aspergillus oryzae, аспартикпротеиназу Rhizomucor miehei, нейтральную α-амилазу Aspergillus niger, кислотоустойчивую α-амилазу А. niger, глюкоамилазу А. niger, липазу Rhizomucor miehei, щелочную протеазу Aspergillus oryzae, триозофосфатизомеразу Aspergillus oryzae или ацетамидазу Aspergillus nidulans.
Дрожжевые промоторы
Примеры подходящих промоторов для экспрессии в дрожжевых видах включают, но без ограничения только ими, Gal 1 и Gal 10 промоторы Saccharomyces cerevisiae и AOX1 или AOX2 промоторы Pichia pastoris.
Организмы-хозяева
(I) Бактериальные организмы-хозяева
Примеры подходящих бактериальных организмов-хозяев представляют собой грамположительные бактериальные виды, такие как виды Bacillaceae, включающие Bacillus subtilis, Bacillus licheniformis, Bacillus lentus, Bacillus brevis, Bacillus stearothermophilus, Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus coagulans, Bacillus lautus, Bacillus megaterium и Bacillus truringiensis, виды Streptomyces, такие как Streptomyces murinus, молочнокислые бактериальные виды, включающие Lactococcus spp., такие как Lactococcus lactis, Lactobacillus spp., включающие Lactobacillus reuteri, Leuconostoc spp., Pediococcus spp. и Streptococcus spp. В альтернативном случае штаммы грамотрицательных бактериальных видов, принадлежащих к Enterobacteriaceae, включающему Е. coli, или к Pseudomonadaceae, могут быть выбраны в качестве организма-хозяина.
(II) Дрожжевые организмы-хозяева
Подходящий дрожжевой организм-хозяин может быть выбран из биотехнологически релевантных дрожжевых видов, таких как, но не ограниченных только ими, виды дрожжей, такие как Pichia sp., Hanseluna sp. или Kluyveromyces, виды Yarrowinia или виды Saccharomyces, включающие Saccharomyces cerevisiae, или виды, принадлежащие к Schizosaccharomyce, такие как, например, виды S. Pombe.
Предпочтительно штамм метилотрофических дрожжевых видов Pichia pastoris применяется как организм-хозяин. Предпочтительно организм-хозяин относится к видам Hansenula.
(III) Грибные организмы-хозяева
Подходящие организмы-хозяева среди мицелиальных грибов включают виды Aspergillus, например Aspergillus niger, Aspergillus oryzae, Aspergillus tubigensis, Aspergillus awamori или Aspergillus nidulans. В альтернативном случае штаммы Fusarium видов, например Fusarium oxysporum, или Rhizomucor видов, таких как Rhizomucor miehei, могут быть использованы в качестве организма-хозяина. Другие подходящие штаммы включают виды Thermomyces и Mucor.
Экспрессия и очистка белка
Клетки-хозяева, содержащие полинуклеотиды, могут быть использованы для экспрессии полипептидов, таких как вариантные PS4-полипептиды, фрагменты, гомологи, варианты или их производные. Клетки-хозяева могут быть культивированы в подходящих условиях, которые допускают экспрессию белков. Экспрессия полипептидов может быть составлена так, что они образуются непрерывно или индуцируемым образом, требующим стимулирования для начала экспрессии. В случае индуцируемой экспрессии образование белка может быть инициировано, когда требуется, например, добавлением индуктора в культуральную среду, например, дексаметазона или IPTG.
Полипептиды могут быть проэкстрагированы из клеток-хозяев с помощью множества методик, известных в данной области, включающих ферментативный, химический и/или осмотический лизис и физическое разложение. Полипептиды могут быть также получены рекомбинантным путем в in vitro бесклеточной системе, такой как TnT™ (Promega) система ретикулоцитов кролика.
ПРИМЕРЫ
Пример 1
Клонирование PS4
Pseudomonas sacharophila выращивают в продолжение ночи на LB среде и хромосомную ДНК выделяют стандартными способами (Sambrook J.,1989). Фрагмент из 2190 пар оснований, содержащий открытую рамку считывания PS4 (Zhou et al., 1989), амплифицируют хромосомной ДНК P. sacharophila с помощью PCR, используя праймеры Р1 и Р2 (см. таблицу 3). Образовавшийся фрагмент используют как матрицу в гнездовой PCR с праймерами Р3 и Р4, амплифицируя открытую рамку считывания PS4 без его сигнальной последовательности и вводя NcoI сайт в 5'-конец гена и BamHI сайт в 3'-конец. Вместе с NcoI сайтом вводят кодон для N-терминального метионина, позволяющий проводить внутриклеточную экспрессию PS4. Фрагмент из 1605 пар оснований клонируют в pCRBLUNT TORO (Invitrogen) и целостность конструкции анализируют секвенированием. E. coli Bacillus шаттл-вектор pDP66K (Penninga et al., 1996) модифицируют для осуществления экспрессии PS4 под контролем Р32 промотора и ctgase сигнальной последовательности. Полученную плазмиду рCSmta трансформируют в В. subtilis.
Cоздают вторую экспрессионную конструкцию, в которой удаляют крахмал-связывающий домен PS4. В PCR с праймерами Р3 и Р6 (см. таблицу 3) на рCSmta генерируют укороченную версию гена mta. Полно-длинный ген mta в рCSmta изменяют с помощью укороченной версии, что дает плазмидный рCSmta-SBD.
Пример 2
Сайт-направленный мутагенез PS4
Мутации вводят в ген mta двумя способами. Либо способом, основанным на 2-ступенчатой PCR, либо способом быстрого обмена (QE). Для удобства ген mta расщепляют на три части; PvuI-FspI фрагмент, FspI-PstI фрагмент и PstI-AspI фрагмент, далее обозначенные как 1, 2 и 3, соответственно.
В способе, основанном на 2-ступенчатой PCR, мутации вводят, используя Pfu ДНК-полимеразу (Stratagene). Первую PCR проводят с праймером мутагенеза (таблица 4) для кодирования нити плюс праймер справа, ниже (от избранного участка цепи ДНК) на более короткой нити (либо 2R, либо 3R, таблица 3). Продукт реакции используют как праймер во второй PCR вместе с праймером слева, выше (от избранного участка цепи ДНК) на кодирующей нити. Продукт последней реакции клонируют в pСRBLUNT topo (Invitrogen) и после секвенирования фрагмент обменивают с соответствующим фрагментом в pСSmta.
При применении способа быстрого обмена (Stratagene) мутации вводят, используя два комплементарных праймера в PCR на плазмиде, содержащей ген mta или часть гена mta.
С этой целью конструируют подходящий набор плазмид, содержащий 3 SDM плазмиды и 3 рCSΔ плазмиды. Каждая SDM плазмида производит 1 из фрагментов гена mta, упомянутых выше, в который желаемую мутацию вводят посредством QE. После проверки секвенированием фрагменты клонируют в соответствующую реципиентную рCSΔ плазмиду. рCSΔ плазмиды представляют собой неактивные производные из рСSmta. Активность теряется клонированием соответствующего фрагмента из SDM плазмиды, при этом возможность скрининга облегчается.
Таблица 3
Праймеры, примененные в клонировании гена mta, и стандартные праймеры, примененные в создании сайт-направленных мутантов с помощью способа 2 ступенчатой PCR

Таблица 4
Праймеры, примененные для введения сайт-направленных мутаций в mta

Таблица 5
Характерные особенности SDM и рCSΔ плазмид

Пример 3
Поли-SDM
PS4-варианты получали, используя набор для полисайт-направленного мутагенеза по способу быстрого обмена (QuickChange® Multi Site Directed Mutagenesis Kit (Stratagene)), согласно протоколу производителя с некоторыми описанными модификациями.
Стадия 1: Реакция синтеза мутантной цепи (PCR)
Инокулировать 3 мл LB (22 г/л Lennox L Broth Base, Sigma) + антибиотики (0,05 мкг/мл канамицин, Sigma) в 10 мл Falkon пробирке
- Инкубировать при 37°С, около 200 об/мин
- Вращать клетки центрифугированием (5000 об/мин/5 мин)
- Убрать среду
- Приготовить ds-ДНК-матрицу, используя мини-протокол по очистке плазмид (QIAGEN Plasmid Mini Purification Protocol)
1. Реакцию синтеза мутантной цепи для термального цикла подготавливали, как указано ниже:
PCR смесь:
Cмешать все компоненты пипетированием и недолго повращать реакционные смеси.
2. Провести цикл реакций с применением следующих параметров:
35 циклов денатурации (96°С/1 мин)
отжиг праймера (62,8°С/1 мин)
элонгация (65°С/15 мин)
затем выдерживание при 4°С
Предварительно нагреть крышку PCR прибора/термоциклера до 105°С и планшет до 95°С, прежде чем PCR пробирки помещают в прибор (термоциклер Эппендорфа).
Стадия 2: Dpn I расщепление
1. Добавить 2 мкл Dpn I рестрикционного фермента (10 ед./мкл) в каждую реакцию амплификации, смешать пипетированием и вращать смесь.
2. Инкубировать при 37°С в течение ~3 ч.
Стадия 3: Трансформация XL10-Gold® ультракомпетентных клеток
1. Растопить XL10-Gold клетки на льду. Разделить без остатка 45 мкл клеток на реакцию мутагенеза в предварительно прокаленных Falkon пробирках.
2. Включить водяную баню (42°С) и поместить пробирку с NZY+ бульоном в баню для предварительного подогрева.
3. Добавить 2 мкл β-меркаптоэтанольной смеси в каждую пробирку. Повращать, осторожно закрыть и инкубировать 10 мин на льду, вращая каждые 2 мин.
4. Добавить 1,5 мкл Dpn I-обработанной ДНК в каждую порцию клеток, вращать для смешивания и инкубировать на льду в течение 30 мин.
5. Нагревать со встряхиванием пробирки в водяной бане при 42°С в течение 30 с и поместить на лед на 2 мин.
6. Добавить 0,5 мл предварительно нагретого NZY+ бульона в каждую пробирку и инкубировать при 37°С в течение 1 ч с вибрацией при 225-250 об/мин.
7. Посеять 200 мкл из каждой реакции трансформации на LB пластинки (33,6 г/л Lennox L Agar, Sigma), cодержащие 1% крахмала и 0,05 мкг/мл канамицина.
8. Инкубировать трансформационные пластинки при 37°С в продолжение ночи.
Таблица 6
Таблица праймеров для рPD77d14
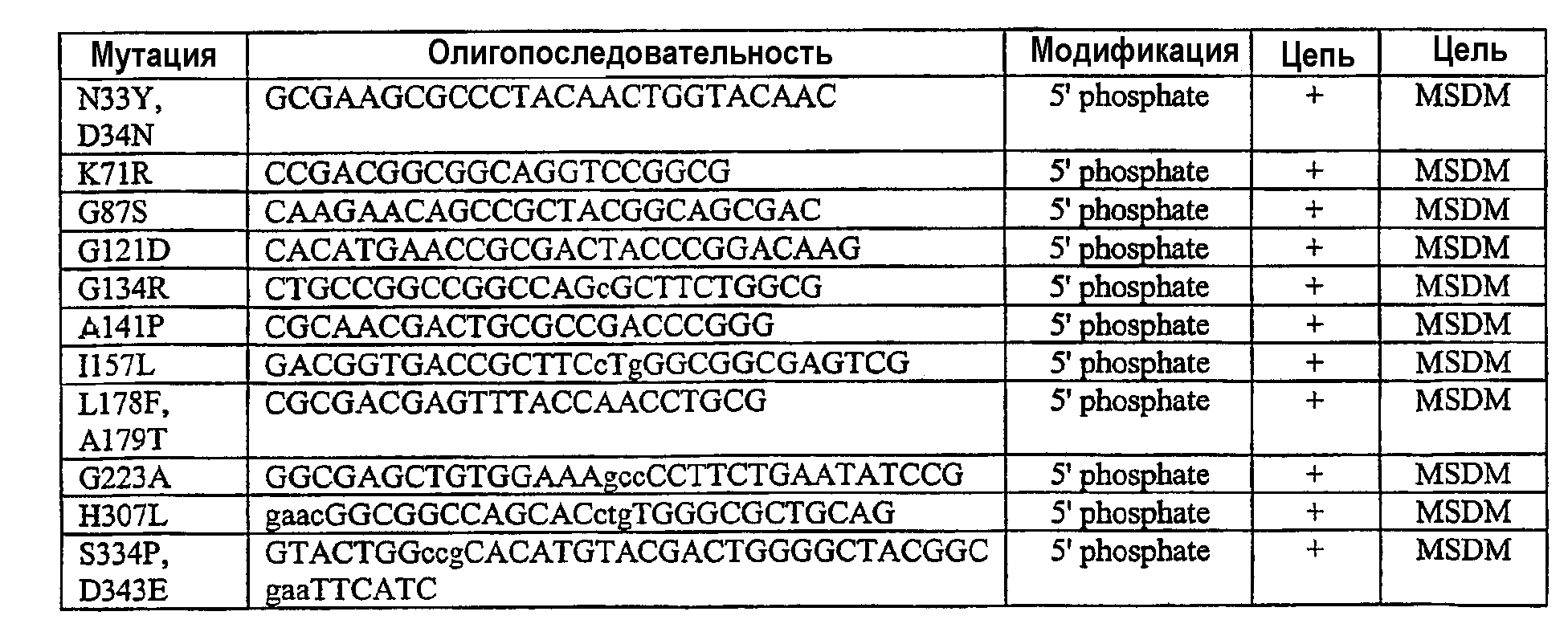
Таблица 7
Таблица праймеров для рPD77d20

Таблица 8
Таблица праймеров для рPD77d34

Векторная система на основе рPD7
Векторная система, примененная для рPD77, основана на рCRbluntTOPOII (invitrogen). Зеоцин-устойчивую кассету удаляли с помощью pm1I, удаленного фрагмента из 393 пар оснований. Экспрессионную кассету из рСС вектора (Р32-ssCGTase-PS4-tt) затем вставляли в вектор.
Лигирование PS4-варианта в рССMini
Плазмиду, которая содержит релевантные мутации (созданные с помощью MSDM), разрезают c помощью рестрикционного фермента Nco 1 и Hind III (Biolabs): 3 мкг ДНК плазмиды, Х мкл 10х буфера 2, 10 единиц Nco 1, 20 единиц Hind III.
Инкубирование 2 ч при 37°C.
Проведение расщепления на 1% геле агарозы. Фрагменты размером в 1293 пар оснований (PS4-ген) вынимают из геля и очищают, используя гелевый набор для очистки Qiagen.
Вектор pCCMini затем разрезают c помощью рестрикционных ферментов, Nco 1 и Hind III, и затем проводят расщепление на 1% геле агарозы. Фрагменты, доведенные до размера 3569 пар оснований, вынимают из геля и очищают, используя гелевый набор для очистки Qiagen.
Лигирование: применять набор для быстрого лигирования ДНК (Roche).
Применять двойное количество вставки по отношению к вектору, например,
2 мкл вставка (PS4-ген)
1 мкл вектор
5 мкл T4 ДНК-буфер 2хconc для лигирования
1 мкл dH2O
1 мкл T4 ДНК-лигаза
Лигировать 5 мин/к.т.(RT).
Трансформировать лигирование в One Shot TOPO компетентные клетки согласно протоколу разработчика (Invitrogen). Применять 5 мкл лигирование на трансформацию.
Посеять 50 мкл трансформированной смеси на LB пластинки (33,6 г/л Lennox L Agar, Sigma), cодержащие 1% крахмала и 0,05 мкг/мл канамицина. Векторы, содержащие вставку (PS4-варианты), могут быть узнаны по образованию галогена на пластинках с крахмалом.
Пример 4
Трансформация в Bacillus subtilis (трансформация протопласта)
Bacillus subtilis (штамм DB104A; Smith et al., 1988; Gene 70, 351-361) трансформируют с помощью мутированных рCS-плазмид согласно следующему протоколу.
А. Среда для приготовления протопластов и трансформации
Добавить соответствующие антибиотики: хлорамфеникол и тетрациклин, 5 мкг/мл; эритромицин, 1 мкг/мл. Выбор канамицина является проблематичным в DM3 среде: может потребоваться концентрация в 250 мкг/мл.
С. Приготовление протопластов
1. Использовать свободную от детергента пластмассовую или стеклянную посуду.
2. Инокулировать 10 мл 2 × YT среды в 100-мл колбе от моноколонии. Выращивать в продолжение ночи культуру при 25-30°С в вибраторе (200 об/мин).
3. Разбавить ночную культуру в 20 раз в 100 мл свежей 2 × YT смеси (250-мл колба) и выращивать до значения величины OD600=0,4-0,5 (приблизительно 2 ч) при 37°С в вибраторе (200-250 об/мин).
4. Собрать клетки центрифугированием (9000×g, 20 мин, 4°С).
5. Удалить супернатант пипеткой и ресуспендировать клетки в 5 мл SMMP + 5 мг лизоцима, стерильно отфильтрованного.
6. Инкубировать при 37°С в вибраторе с водяной баней (100 об/мин).
Через 30 мин и после этого в 15-минутные интервалы исследовать 25 мкл образцы под микроскопом. Продолжать инкубирование до тех пор, пока 99% клеток не превратятся в протопласты (появление глобул). Собрать протопласты центрифугированием (4000×g, 20 мин, к.т./RT) и отобрать супернатант пипетками. Ресуспендировать гранулы осторожно в 1-2 мл SMMP.
В данный момент протопласты готовы для применения. (Порции (например, 0,15 мл) могут быть заморожены при -80°С для последующего использования (добавления глицерина не требуется). Хотя это может привести к некоторому снижению способности к трансформации, 106 трансформантов на мкг ДНК можно получить с замороженными протопластами).
D. Трансформация
1. Внести 450 мкл PEG в микропробирку.
2. Смешать 1-10 мкл ДНК (0,2 мкг) с 150 мкл протопластов и добавить смесь в микропробирку с PEG. Перемешать смесь сразу, но осторожно.
3. Выдержать в течение 2 мин при к.т., затем добавить 1,5 мл SMMP и перемешать.
4. Собрать протопласты микрофугированием (10 мин, 13000 об/мин (10-12000 г)) и слить супернатант. Удалить остающиеся капли тканью.
Добавить 300 мкл SMMP (не встряхивать) и инкубировать в течение 60-90 мин при 37°С в вибраторе с водяной баней (100 об/мин) для осуществления экспрессии маркеров антибиотикоустойчивости. (Протопласты становятся достаточно ресуспендированными в процессе вибрации бани). Сделать соответствующие разбавления в 1 × SSM и поместить 0,1 мл на DM3 пластинки.
Пример 5
Ферментация PS4-вариантов во встряхиваемых колбах
Субстрат для встряхиваемой колбы приготавливают как указано ниже:
В субстрате устанавливают рН 6,8 с помощью 4 н. серной кислоты или гидроксида натрия перед автоклавированием. 130 мл субстрата помещают в 500 мл колбу с одной отражательной перегородкой и автоклавируют в течение 30 минут. Затем добавляют 6 мл стерильного сиропа декстрозы. Декстрозный сироп приготавливают смешиванием одного объема 50% мас./об. декстрозы с одним объемом воды с последующим автоклавированием в течение 20 минут.
Встряхиваемые колбы инокулируют вариантами и инкубируют в течение 24 часов при 35°С/180 об/мин в инкубаторе. После инкубирования клетки отделяют от бульона центрифугированием (10000×g в 10 минут) и супернатант освобождают от клеток микрофильтрованием при 0,2 мкм. Бесклеточный супернатант используют для анализов и рабочих тестов.
Пример 6
Анализы амилазы
Betamyl анализ
Одну Betamyl единицу определяют как активность, разлагающую 0,0351 ммоль в мин PNP-связанной мальтопентаозы, так что 0,0351 ммоль PNP в мин может высвобождаться избытком α-глюкозидазы в анализируемой смеси. Смесь для анализа содержит 50 мкл 50 мМ Na-цитрата, 5 мМ CaCl2, pH 6,5 с 25 мкл пробой фермента и 25 мкл Betamyl субстрата (Glc5-PNP и α-глюкозидаза) от Megazyme, Ireland (1 ампула, растворенная в 10 мл воды). Смесь для анализа инкубируют в течение 30 мин при 40°С и затем останавливают добавлением 150 мкл 4% Tris. Измеряют поглощение при 420 нм, используя ELISA-ридер, и вычисляют Betamyl активность на основе равенства активность=А420∗d в Betamyl единицы/мл анализируемого образца фермента.
Эндоамилазная активность
Эндоамилазный анализ является идентичным Phadebas анализу, проведенному согласно разработчику (Pharmacia and Upjohn Diagnostics AB).
Экзоспецифичность
Отношение экзоамилазной активности к Phadebas активности использовали для оценки экзоспецифичности.
Удельная активность
Для Psac-D14, Psac-D20 и Psac-D34 вариантов авторы данного изобретения установили, что средняя удельная активность, измеренная согласно Bradford (1976; Anal. Biochem. 72, 248), равна 10 Betamyl единицам на микрограмм очищенного белка. Данную удельную активность используют как основную активность для расчета доз, употребляемых в тестах на применение.
Пример 7
Определение времени полужизни
t1/2 определяют как время (в минутах), в течение которого половина активности фермента исчезает при определенных условиях нагревания. Для того чтобы определить время полужизни фермента, образец нагревают в течение 1-10 минут при постоянных температурах от 60 до 90°С. Время полужизни вычисляют на основе Betamyl анализа остаточной активности.
Методика: В сосуде Эппендорфа предварительно нагревают 1000 мкл буфера в течение, по меньшей мере, 10 минут при 60°С или выше. Тепловую обработку образца начинают добавлением 100 мкл образца к предварительно нагретому буферу при непрерывном перемешивании (800 об/мин) сосуда Эппендорфа в термоинкубаторе (термомиксер комфорт от Eppendorf). После 0, 1, 2, 4, 6, 8 и 9 минут инкубирования обработку останавливают перенесением 45 мкл образца в 1000 мкл буфера, уравновешенного при 20°С, и инкубированием в течение 1 минуты при 1500 об/мин и при 20°С. Остаточную активность измеряют Betamyl анализом.
Вычисление: вычисление t1/2 проводят по наклону прямой log10 (основа-10 логарифм) остаточной Betamyl активности в зависимости от времени инкубирования. t1/2 рассчитывают как тангенс угла наклона/0,301=t1/2.
Пример 8
Модельные системные тесты для выпекания
Виды теста делают в фаринографе при 30,0°С. Взвешивают 10,00 г реформированной муки и добавляют в фаринограф; после 1 мин смешивания эталон/образец (эталон = масло или вода, образец = фермент + масло или вода) добавляют стерильной пипеткой через отверстия в баке для замеса. Через 30 сек муку счищают с краев - также через отверстия в баке для замеса. Образец перемешивают в течение 7 мин.
Тест с буфером или водой выполняют на фаринографе прежде, чем работают с конечным эталоном. FU должен составлять 400 на эталоне, если это не так, то следует установить данное значение, например, количеством воды. Эталон/образец удаляют шпателем и берут в руку (со свободной перчаткой на ней) перед тем, как смесью наполняют маленькие стеклянные пробирки (приблизительно 4,4 см длины), которые помещают в NMR пробирки и закупоривают пробками. Делают 7 пробирок на тесто.
После того, как все образцы приготовлены, пробирки помещают в (программно-управляемую) водяную баню при 33°С (без пробок) на 25 мин и затем устанавливают водяную баню на 33°С на 5 мин, затем нагревают до 98°С на протяжении 56 мин (1,1°С в мин) и, наконец, выдерживают в течение 5 мин при 96°С.
Пробирки хранят при 20,0°С в термостате шкафного типа. Содержание сухого вещества мякиша измеряют протонным ЯМР, используя Bruker NMS 120 Minispec ЯМР анализатор, на 1, 3 и 7 день, как показано для образцов мякиша, приготовленных с 0, 0,5, 1 и 2 ч/млн PsacD34, на фиг.2. Меньшее увеличение в содержании сухого вещества во времени отражает уменьшение ретроградации амилопектина. Через 7 дней хранения при 20,0°С в термостате шкафного типа взвешивают 10-20 мг образцов мякиша, помещают в 40 мкл алюминиевые стандартные DSC капсулы и выдерживают при 20°С.
Капсулы используют для дифференциальной сканирующей калориметрии на приборе Mettler Toledo DSC 820. В качестве параметров применяют цикл нагревания 20-95°С со скоростью нагрева 10°С в мин и газ/поток: N2/80 мл в мин. Результаты анализируют и вычисляют энтальпию плавления ретроградированного амилопектина в Дж/г.
Пример 9
Эффекты против черствения
Модельные хлебные мякиши приготавливают и измеряют, следуя методике примера 8. Как показано в таблице 2, PS4-варианты показывают сильное снижение ретроградации амилопектина после выпекания, измеренное дифференциальной сканирующей калориметрией, по сравнению с контролем. PS4-варианты показали четкое влияние дозировки.
Пример 10
Влияния на твердость в пробных выпеканиях
Пробные выпекания выполняли со стандартной опарой белого хлеба и тестом по рецепту для тостов/гренок. Опарное тесто готовят из 1600 г муки “универсальная классическая” (“All Purpose Classic” от Sisco Mills, USA”), 950 г воды, 40 г соевого масла и 32 г сухих дрожжей. Опару перемешивают в течение 1 мин при малой скорости и затем 3 мин при скорости 2 Hobart спирального миксера. Опару затем подвергают ферментации в течение 2 часов при 35°С, 85% RH c последующим контролем при 5°С в течение 0,5 часа.
Затем к опаре добавляют 400 г муки, 4 г сухих дрожжей, 40 г соли, 2,4 г пропионата кальция, 240 г высококонцентрированного фруктозного кукурузного сиропа (Isosweet), 5 г эмульгатора PANODAN, 205,5 г ферментативно-активной соевой муки, 30 г неактивной соевой муки, 220 г воды и 30 г раствора аскорбиновой кислоты (приготовленного из 4 г аскорбиновой кислоты, растворенной в 500 г воды). Полученное тесто перемешивают в течение 1 мин при малой скорости и затем 6 мин при скорости 2 Diosna миксера. После этого тесто выдерживают в течение 5 мин при температуре окружающей среды, разделяют на 550 г куски теста, выдерживают в течение 5 мин, затем раскатывают на полосы на тестовальцовочной машине Glimek с регулировками 1:4, 2:4, 3:15, 4:12 и 10 на каждой стороне и переносят в форму для выпекания. После 60-минутной расстойки при 43°С при 90% RH тестовые заготовки выпекают в течение 29 мин при 218°С.
Твердость и эластичность измерены ТА-ХТ анализатором консистенции. Твердость, слипаемость и эластичность оценивают по хлебным срезам с помощью анализа профиля консистенции (Texture Profile Analysis) c использованием анализатора консистенции от стабильных микросистем (Texture Analyser From Stable Micro Systems UK). Использовали следующие установочные показатели:
Скорость до опыта: 2 мм/с
Скорость во время опыта: 2 мм/с
Скорость после опыта: 10 мм/с
Тестируемое расстояние разрыва: 1%
Дистанция: 40%
Сила: 0,098 N
Время: 5,00 сек
Счет/определение: 5
Загрузочная камера: 5 кг
Тип запуска: авто - 0,01N
Измерения твердости показывают, что PS4-вариантные полипептиды значительно снижают развитие твердости в период от 1 до 7 дней и проявляют более высокое действие с повышением дозы фермента.
Пример 11
Контроль объема датских булочек
Датские булочки готовят из теста на основе 2000 г реформированной муки (из злаковых), 120 г прессованных дрожжей, 32 г соли и 32 г сахарозы. К тесту добавляют воду в соответствии с ранее данной водной оптимизацией.
Тесто перемешивают в Diosna миксере (2 мин при малой скорости и 5 мин при высокой скорости). Температуру теста после перемешивания поддерживают при 26°С. 1350 г теста отделяют и выдерживают в течение 10 мин в нагревательном шкафу при 30°С. Булочкам придают форму на формовочной машине Fortuna и оставляют на расстойку в течение 45 мин при 34°С и при 85% относительной влажности. Затем булочки выпекают в Bago 2 печи в течение 18 мин при 250°С с паром в первые 13 секунд. После выпекания булочки охлаждают в течение 25 мин перед взвешиванием и измерением объема.
Булочки оценивают по наличию корки, гомогенности мякиша, характеру покрытия корки, бугристости?/ausbund? и удельному объему (измерение объема по способу замещения семенами рапса).
На основании данных критериев установлено, что PS4-варианты увеличивают удельный объем и улучшают параметры качества датских булочек. Таким образом, PS4-варианты способны контролировать объем хлебобулочных изделий.
Пример 12
Результаты
Таблица 9
Биохимические свойства Psac-вариантов по сравнению с PSac-cc1 дикого типа


Последовательности pPD77d40, pMD55, pMD85, pMD96, pMD86 и pMD109 имеют в колонке 5 мутированные остатки и крахмал-связывающий домен, утраченный в основе (SEQ ID NO:1) P. saccharophila дикого типа. Эти последовательности могут быть созданы прямым образом с использованием данной информации.
Подробные эффекты индивидуальных мутаций в различных положениях описаны в следующих подразделах.
Повышенная термостабильность PS4-вариантного полипептида с мутацией 121F
PS4-вариантный полипептид, обозначенный как рMD55, имеющий аминокислотные мутации N33Y, D34N, G121F, G134R, A141P, I157L, G223A, H307L, S334P, L178F, A179T, испытан на термостабильность. Данный полипептид представляет повышенную термостабильность, приведенную в таблице ниже. См. также пример 12 и таблицу 9 выше.

Повышенная экзоспецифичность PS4-вариантного полипептида с мутацией 161А
PS4-вариантный полипептид, обозначенный как рMD96, имеющий аминокислотные мутации N33Y, D34N, G121F, G134R, A141P, I157L, S161A, L178F, A179T, G223E, H307L, S334P, испытан на экзоспецифичность. Данный полипептид представляет повышенную экзоспецифичность, приведенную в таблице ниже. См. также пример 12 и таблицу 9 выше.
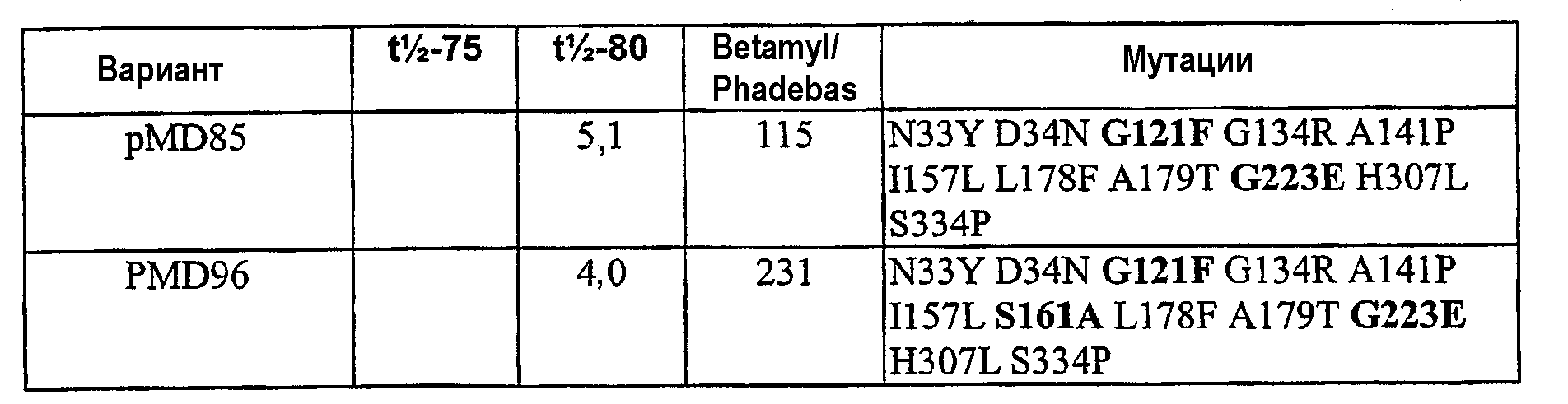
Повышенная экзоспецифичность PS4-вариантного полипептида с мутацией 223Е
PS4-вариантный полипептид, обозначенный как рMD85, имеющий аминокислотные мутации в N33Y, D34N, G121F, G134R, A141P, I157L, L178F, A179T, G223Е, H307L, S334P, испытан на экзоспецифичность. Данный полипептид представляет повышенную экзоспецифичность, приведенную в таблице ниже. См. также пример 12 и таблицу 9 выше.

Пример 13
Повышенная термостабильность и экзоспецифичность PS4-вариантного полипептида с мутацией 121D
PS4-вариантный полипептид, обозначенный как рMD3, имеющий аминокислотные мутации N33Y, D34N, G134R, A141P, I157L, L178F, A179T, G121D, H307L, S334P, испытан на термoстабильность и экзоспецифичность. Данный полипептид представляет повышенную термостабильность и повышенную экзоспецифичность, приведенную в таблице ниже.

Пример 14
Повышенная термостабильность и экзоспецифичность PS4-вариантного полипептида с мутацией 121W
PS4-вариантный полипептид, обозначенный как рмD44, имеющий аминокислотные мутации N33Y, D34N, G134R, A141P, I157L, L178F, A179T, G121W, H307L, S334P, испытан на термoстабильность и экзоспецифичность. Данный полипептид представляет повышенную термостабильность и повышенную экзоспецифичность, приведенную в таблице ниже.
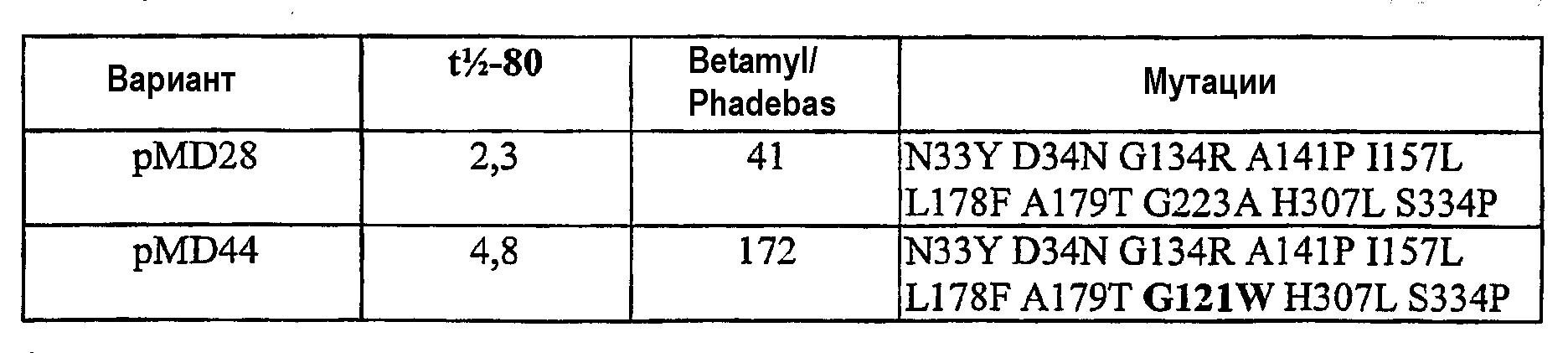
Пример 15
Повышенная термостабильность и экзоспецифичность PS4-вариантного полипептида с мутацией 121H
PS4-вариантный полипептид, обозначенный как рMD43, имеющий аминокислотные мутации N33Y, D34N, G134R, A141P, I157L, L178F, A179T, G121H, H307L, S334P, испытан на термoстабильность и экзоспецифичность. Данный полипептид представляет повышенную термостабильность и повышенную экзоспецифичность, приведенную в таблице ниже.

Пример 16
Повышенная термостабильность и экзоспецифичность PS4-вариантного полипептида с мутацией 121М
PS4-вариантный полипептид, обозначенный как рМD41, имеющий аминокислотные мутации N33Y, D34N, G134R, A141P, I157L, L178F, A179T, G121М, H307L, S334P, испытан на термoстабильность и экзоспецифичность. Данный полипептид представляет повышенную термостабильность и повышенную экзоспецифичность, приведенную в таблице ниже.

Пример 17
Повышенная термостабильность и экзоспецифичность PS4-вариантного полипептида с мутацией 121А
PS4-вариантный полипептид, обозначенный как рМD74, имеющий аминокислотные мутации N33Y, D34N, G134R, A141P, I157L, L178F, A179T, G121А, H307L, S334P, испытан на термoстабильность и экзоспецифичность. Данный полипептид представляет повышенную термостабильность и повышенную экзоспецифичность, приведенную в таблице ниже.

Пример 18
Повышенная термостабильность и экзоспецифичность PS4-вариантного полипептида с мутацией 121Y
PS4-вариантный полипептид, обозначенный как рMD73a, имеющий аминокислотные мутации N33Y, D34N, G134R, A141P, I157L, L178F, A179T, G121Y, H307L, S334P, испытан на термoстабильность и экзоспецифичность. Данный полипептид представляет повышенную термостабильность и повышенную экзоспецифичность, приведенную в таблице ниже.

Пример 19
Повышенная термостабильность и экзоспецифичность PS4-вариантного полипептида с мутацией 223A
PS4-вариантный полипептид, обозначенный как рMD3, имеющий аминокислотные мутации N33Y, D34N, G134R, A141P, I157L, L178F, A179T, G223A, H307L, S334P, испытан на термoстабильность и экзоспецифичность. Данный полипептид представляет повышенную термостабильность и повышенную экзоспецифичность, приведенную в таблице ниже.
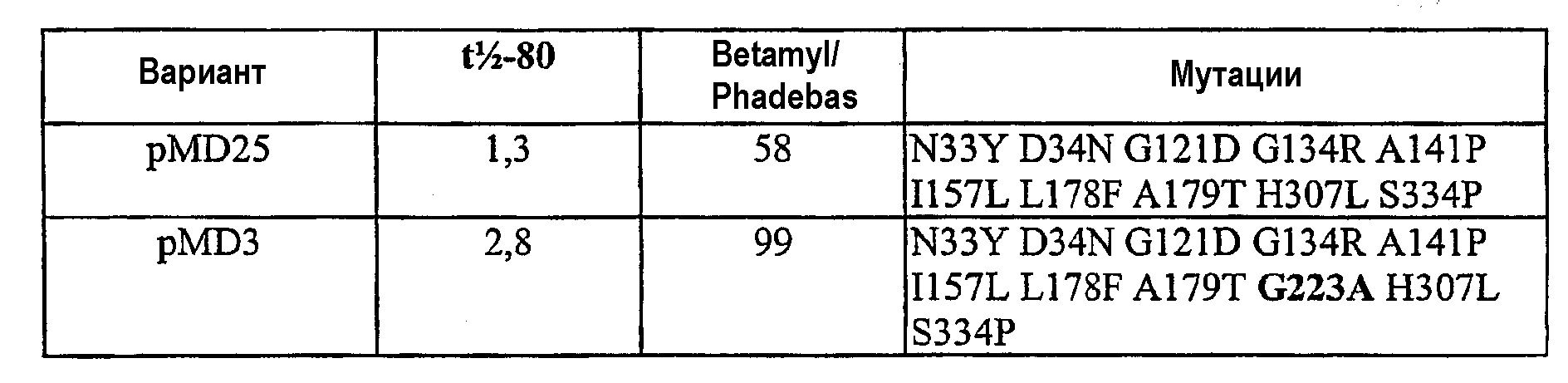
Пример 20
Повышенная термостабильность и экзоспецифичность PS4-вариантного полипептида с мутацией 223K
PS4-вариантный полипептид, обозначенный как SSM173 F6, имеющий аминокислотные мутации N33Y, D34N, G121D, G134R, A141P, I157L, L178F, A179T, G223K, H307L, S334P, испытан на термостабильность и экзоспецифичность. Данный полипептид представляет повышенную термостабильность и повышенную экзоспецифичность, приведенную в таблице ниже.

Пример 21
Повышенная термостабильность и экзоспецифичность PS4-вариантного полипептида с мутацией 223V
PS4-вариантный полипептид, обозначенный как рMD49, имеющий аминокислотные мутации N33Y, D34N, G121D, G134R, A141P, I157L, L178F, A179T, G223V, H307L, S334P, испытан на термoстабильность и экзоспецифичность. Данный полипептид представляет повышенную термостабильность и повышенную экзоспецифичность, приведенную в таблице ниже.

Пример 22
Повышенная термостабильность и экзоспецифичность PS4-вариантного полипептида с мутацией 223Е
PS4-вариантный полипептид, обозначенный как SSM171 G11, имеющий аминокислотные мутации N33Y, D34N, G121D, G134R, A141P, I157L, L178F, A179T, G223E, H307L, S334P, испытан на термoстабильность и экзоспецифичность. Данный полипептид представляет повышенную термостабильность и повышенную экзоспецифичность, приведенную в таблице ниже.

Пример 23
Повышенная термостабильность и экзоспецифичность PS4-вариантного полипептида с мутацией G223R
PS4-вариантный полипептид, обозначенный как SSM173 B6, имеющий аминокислотные мутации N33Y, D34N, G121D, G134R, A141P, I157L, L178F, A179T, G223R, H307L, S334P, испытан на термoстабильность и экзоспецифичность. Данный полипептид представляет повышенную термостабильность и повышенную экзоспецифичность, приведенную в таблице ниже.

Пример 24
Повышенная термостабильность PS4-вариантного полипептида с мутацией Y146G
PS4-вариантный полипептид, обозначенный как SSM 381, имеющий аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 307L и 334P, испытан на термостабильность. Данный полипептид представляет повышенную термостабильность, приведенную в таблице ниже.

Пример 25
Повышенная термостабильность PS4-вариантного полипептида с мутацией 157М
PS4-вариантный полипептид, обозначенный как SSM279 В1, имеющий аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157М, 161A, 178F, 179T, 223E, 307L и 334P, испытан на термостабильность. Данный полипептид представляет повышенную термостабильность, приведенную в таблице ниже.

Пример 26
Повышенная термостабильность PS4-вариантного полипептида с мутацией 158Т
PS4-вариантный полипептид, обозначенный как SSM237 Р2, имеющий аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 158Т, 161A, 178F, 179T, 223E, 307L и 334P, испытан на термостабильность. Данный полипептид представляет повышенную термостабильность, приведенную в таблице ниже.
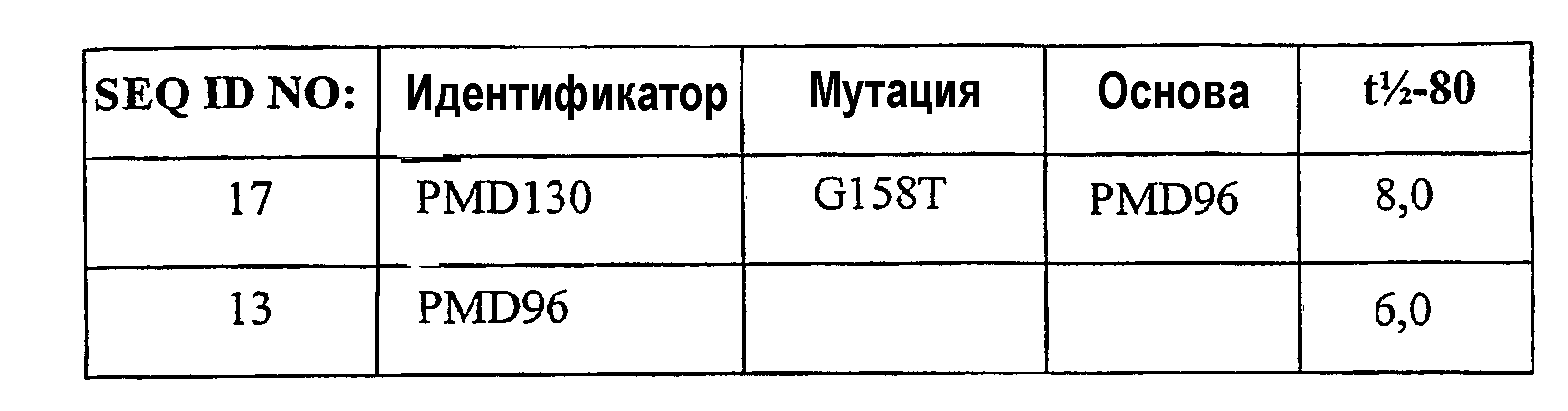
Пример 27
Повышенная термостабильность PS4-вариантного полипептида с мутацией 198W и/или 229Р
PS4-вариантный полипептид, обозначенный как SSM325 F3, имеющий аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 229P, 307L и 334P, испытан на термостабильность. Данный полипептид представляет повышенную термостабильность, приведенную в таблице ниже.
PS4-вариантный полипептид, обозначенный как pMD129, имеющий аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 198W, 223E, 229P, 307L и 334P, испытан на термостабильность. Данный полипептид представляет повышенную термостабильность, приведенную в таблице ниже.

Пример 28
Повышенная экзоспецифичность PS4-вариантного полипептида с мутацией G303E или G303D
PS4-вариантный полипептид, обозначенный как SSM341 A9, имеющий аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 303E, 307L и 334P, испытан на экзоспецифичность. Данный полипептид представляет повышенную экзоспецифичность, приведенную в таблице ниже.
PS4-вариантный полипептид, обозначенный как SSM341 G11, имеющий аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 303D, 307L и 334P, испытан на экзоспецифичность. Данный полипептид представляет повышенную экзоспецифичность, приведенную в таблице ниже.

Пример 29
Повышенная экзоспецифичность PS4-вариантного полипептида с мутацией H306T или H306G
PS4-вариантный полипептид, обозначенный как SSM350 B11, имеющий аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 306T, 307L и 334P, испытан на экзоспецифичность. Данный полипептид представляет повышенную экзоспецифичность, приведенную в таблице ниже.
PS4-вариантный полипептид, обозначенный как SSM350 C12, имеющий аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 306G, 307L и 334P, испытан на экзоспецифичность. Данный полипептид представляет повышенную экзоспецифичность, приведенную в таблице ниже.

Пример 30
Повышенная экзоспецифичность PS4-вариантного полипептида с мутацией A309P
PS4-вариантный полипептид, обозначенный как SSM332 Q4, имеющий аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 309P, 307L и 334P, испытан на экзоспецифичность. Данный полипептид представляет повышенную экзоспецифичность, приведенную в таблице ниже.

Пример 31
Повышенная термостабильность PS4-вариантного полипептида с мутацией R316S или R316P
PS4-вариантный полипептид, обозначенный как SSM365 B4, имеющий аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 307L, 316S и 334P, испытан на термостабильность. Данный полипептид представляет повышенную стабильность, приведенную в таблице ниже.
PS4-вариантный полипептид, обозначенный как SSM365 F4, имеющий аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 307L, 316P и 334P, испытан на термостабильность. Данный полипептид представляет повышенную термостабильность, приведенную в таблице ниже.

Пример 32
Повышенная термостабильность PS4-вариантного полипептида с мутацией R353Т
PS4-вариантный полипептид, обозначенный как SSM360 С7, имеющий аминокислотные мутации 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 307L, 334Р и 353Т, испытан на термостабильность. Данный полипептид представляет повышенную стабильность, приведенную в таблице ниже.

Пример 33
Повышенная экзоспецифичность PS4-вариантного полипептида с мутацией 26Е
PS4-вариантный полипептид, обозначенный как SSM219 B3, имеющий аминокислотные мутации N26E, N33Y, D34N, G121F, G134R, A141P, I157L, L178F, A179T, G223E, H307L, S334P, испытан на экзоспецифичность. Данный полипептид представляет повышенную экзоспецифичность, приведенную в таблице ниже.

Время полужизни t1/2-85 определяют, следуя примеру 8, после гель-фильтрации образцов с PD-10 колонок (от Amersham Biosciences) c использованием 50 мМ цитрата натрия, 5 мМ CaCl2, pH 6,5 буфер.
Пример 34
Повышенная экзоспецифичность PS4-вариантного полипептида с мутацией 70D
PS4-вариантный полипептид, обозначенный как SAS1401 L10, имеющий аминокислотные мутации N33Y, D34N, G70D, G121F, G134R, A141P, Y146G, I157L, G158, S161A, L178F, A179T, G223E, S229P, H307L, A309P, S334P, испытан на экзоспецифичность. Данный полипептид представляет повышенную экзоспецифичность, приведенную в таблице ниже.

Время полужизни t1/2-85 определяют, следуя примеру 8, после гель-фильтрации образцов с PD-10 колонок (от Amersham Biosciences) c использованием 50 мМ цитрата натрия, 5 мМ CaCl2, pH 6,5 буфер.
Пример 35
Повышенная термостабильность и экзоспецифичность PS4-вариантного полипептида с мутацией 145D
PS4-вариантный полипептид, обозначенный как SAS1387 D16 bf, имеющий аминокислотные мутации N33Y, D34N, G121F, G134R, A141P, N145D, Y146G, I157L, G158T, S161A, L178F, A179T, G223E, S229P, H307L, A309P, S334P, испытан на термoстабильность и экзоспецифичность. Данный полипептид представляет повышенную термостабильность и повышенную экзоспецифичность, приведенную в таблице ниже.

Время полужизни t1/2-85 определяют, следуя примеру 8, после гель-фильтрации образцов с PD-10 колонок (от Amersham Biosciences) c использованием 50 мМ цитрата натрия, 5 мМ CaCl2, pH 6,5 буфер.
Пример 36
Повышенная термостабильность PS4-вариантного полипептида с мутацией 188H
PS4-вариантный полипептид, обозначенный как pMD236, имеющий аминокислотные мутации N33Y, D34N, G70D, G121F, G134R, A141P, N145D, Y146G, I157L, G158T, S161A, L178F, A179T, G188H, G223E, S229P, H307L, A309P, S334P, W339E, испытан на термoстабильность. Данный полипептид представляет повышенную термостабильность, приведенную в таблице ниже.

Время полужизни t1/2-85 определяют, следуя примеру 8, после гель-фильтрации образцов с PD-10 колонок (от Amersham Biosciences) c использованием 50 мМ цитрата натрия, 5 мМ CaCl2, pH 6,5 буфер.
Пример 37
Повышенная термостабильность PS4-вариантного полипептида с мутацией 188S
PS4-вариантный полипептид, обозначенный как pMD237, имеющий аминокислотные мутации N33Y, D34N, G70D, G121F, G134R, A141P, N145D, Y146G, I157L, G158T, S161A, L178F, A179T, G188S, G223E, S229P, H307L, A309P, S334P, W339E, испытан на термoстабильность. Данный полипептид показывает повышенную термостабильность, представленную в таблице ниже.

Время полужизни t1/2-85 определяют, следуя примеру 8, после гель-фильтрации образцов с PD-10 колонок (от Amersham Biosciences) c использованием 50 мМ цитрата натрия, 5 мМ CaCl2, pH 6,5 буфер.
Пример 38
Повышенная экзоспецифичнность PS4-вариантного полипептида с мутацией 339A
PS4-вариантный полипептид, обозначенный как SAS1379 O13, имеющий аминокислотные мутации N33Y, D34N, G121F, G134R, A141P, Y146G, I157L, G158T, S161A, L178F, A179T, G223E, S229P, H307L, A309P, S334P, W339A, испытан на экзоспецифичность. Данный полипептид показывает повышенную экзоспецифичность, представленную в таблице ниже.

Время полужизни t1/2-85 определяют, следуя примеру 8, после гель-фильтрации образцов с PD-10 колонок (от Amersham Biosciences) c использованием 50 мМ цитрата натрия, 5 мМ CaCl2, pH 6,5 буфер.
Пример 39
Повышенная экзоспецифичность PS4-вариантного полипептида с мутацией 339Е
PS4-вариантный полипептид, обозначенный как SAS1379 O9, имеющий аминокислотные мутации N33Y, D34N, G121F, G134R, A141P, Y146G, I157L, G158T, S161A, L178F, A179T, G223E, S229P, H307L, A309P, S334P, W339Е, испытан на экзоспецифичность. Данный полипептид показывает повышенную экзоспецифичность, представленную в таблице ниже.
Время полужизни t1/2-85 определяют, следуя примеру 8, после гель-фильтрации образцов с PD-10 колонок (от Amersham Biosciences) c использованием 50 мМ цитрата натрия, 5 мМ CaCl2, pH 6,5 буфер.
Дополнительные аспекты
Дополнительные аспекты и варианты осуществления изобретения представлены здесь в следующих пронумерованных пунктах; следует подразумевать, что изобретение охватывает данные аспекты:
Пункт А1. PS4-вариантный полипептид, получаемый из исходного полипептида, имеющего немальтогенную экзоамилазную активность, где PS4-вариантный полипептид содержит аминокислотную мутацию в положении 121 относительно нумерации положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной как SEQ ID NO:1.
Пункт А2. PS4-вариантный полипептид по пункту А1, где мутация в положении 121 содержит замещение 121F, 121Y и/или 121W, предпочтительно G121F, G121Y и/или G121W.
Пункт А3. PS4-вариантный полипептид по пункту А1 или А2, где PS4-вариантный полипептид дополнительно содержит одну или несколько дополнительных мутаций в положении, выбранном из группы, состоящей из: 161 и 223.
Пункт А4. PS4-вариантный полипептид по пункту А3, где одна или несколько дополнительных мутаций выбраны из группы, состоящей из: 161А и 223Е и 223К, предпочтительнее S161A, G223E и/или G223K.
Пункт А5. PS4-вариантный полипептид по любому предыдущему пункту А, где PS4-вариантный полипептид содержит мутации в положениях, выбранных из группы, состоящей из: 121, 161; 121, 223.
Пункт А6. PS4-вариантный полипептид по пункту А5, где PS4-вариантный полипептид содержит мутации в положениях, выбранных из группы, состоящей из: 121F/Y/W, 161A; 121F/Y/W, 223E/K.
Пункт А7. PS4-вариантный полипептид по любому предыдущему пункту А, где PS4-вариантный полипептид содержит мутации в положениях, выбранных из группы, состоящей из: 121, 161 и 223.
Пункт А8. PS4-вариантный полипептид по любому предыдущему пункту А, где PS4-вариантный полипептид содержит мутации 121F/Y/W, 161A, 223E/K.
Пункт А9. PS4-вариантный полипептид по любому предыдущему пункту А, где PS4-вариантный полипептид дополнительно содержит одну или предпочтительно все мутации, выбранные из группы, состоящей из: 134, 141, 157, 223, 307, 334.
Пункт А10. PS4-вариантный полипептид по любому предыдущему пункту А, где PS4-вариантный полипептид дополнительно содержит мутации либо в одном, либо в двух положениях 33 и 34.
Пункт А11. PS4-вариантный полипептид по пункту А10, где PS4-вариантный полипептид дополнительно содержит одно или замещения, предпочтительно все, выбранные из группы, состоящей из: G134R, A141P, I157L, G223A, H307L, S334P, и необязательно одно или оба из N33Y и D34N.
Пункт А12. PS4-вариантный полипептид по любому предыдущему пункту А, где PS4-вариантный полипептид дополнительно содержит:
(а) мутацию в положении 121, предпочтительно 121D, предпочтительнее G121D;
(b) мутацию в положении 178, предпочтительно 178F, предпочтительнее L178F;
(c) мутацию в положении 179, предпочтительно 179T, предпочтительнее A179T; и/или
(d) мутацию в положении 87, предпочтительно 87S, предпочтительнее G87S.
Пункт B1. PS4-вариантный полипептид, получаемый из исходного полипептида, имеющего немальтогенную экзоамилазную активность, где PS4-вариантный полипептид содержит аминокислотную мутацию в положении 161 относительно нумерации положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной как SEQ ID NO:1.
Пункт B2. PS4-вариантный полипептид по пункту B1, где мутация в положении 161 содержит замещение 161A, предпочтительно S161A.
Пункт B3. PS4-вариантный полипептид по пункту B1 или B2, где PS4-вариантный полипептид дополнительно содержит одну или несколько дополнительных мутаций в положении, выбранном из группы, состоящей из: 121 и 223.
Пункт В4. PS4-вариантный полипептид по пункту В3, где одна или несколько дополнительных мутаций выбраны из группы, состоящей из: 121F, 121Y, 121W, 223Е и 223K, предпочтительнее G121F, G121Y, G121W, G223E и/или G223K.
Пункт B5. PS4-вариантный полипептид по любому предыдущему пункту B, где PS4-вариантный полипептид содержит мутации в положениях, выбранных из группы, состоящей из: 121, 161; 161, 223.
Пункт B6. PS4-вариантный полипептид по пункту B5, где PS4-вариантный полипептид содержит мутации в положениях, выбранных из группы, состоящей из: 121F/Y/W, 161A; 161A, 223E/K.
Пункт B7. PS4-вариантный полипептид по любому предыдущему пункту B, где PS4-вариантный полипептид содержит мутации в положениях, выбранных из группы, состоящей из: 121, 161 и 223.
Пункт В8. PS4-вариантный полипептид по любому предыдущему пункту В, где PS4-вариантный полипептид содержит мутации 121F/Y/W, 161A, 223E/K.
Пункт В9. PS4-вариантный полипептид по любому предыдущему пункту В, где PS4-вариантный полипептид дополнительно содержит одну или предпочтительно все мутации, выбранные из группы, состоящей из: 134, 141, 157, 223, 307, 334.
Пункт В10. PS4-вариантный полипептид по любому предыдущему пункту В, где PS4-вариантный полипептид дополнительно содержит мутации либо в одном, либо в двух положениях 33 и 34.
Пункт В11. PS4-вариантный полипептид по пункту В10, где PS4-вариантный полипептид дополнительно содержит одно или предпочтительно все замещения, выбранные из группы, состоящей из: G134R, A141P, I157L, G223A, H307L, S334P, и необязательно одно или оба из N33Y и D34N.
Пункт В12. PS4-вариантный полипептид по любому предыдущему пункту В, где PS4-вариантный полипептид дополнительно содержит:
(а) мутацию в положении 121, предпочтительно 121D, предпочтительнее G121D;
(b) мутацию в положении 178, предпочтительно 178F, предпочтительнее L178F;
(c) мутацию в положении 179, предпочтительно 179T, предпочтительнее A179T; и/или
(d) мутацию в положении 87, предпочтительно 87S, предпочтительнее G87S.
Пункт C1. PS4-вариантный полипептид, получаемый из исходного полипептида, имеющего немальтогенную экзоамилазную активность, где PS4-вариантный полипептид содержит аминокислотную мутацию в положении 223 относительно нумерации положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной как SEQ ID NO:1.
Пункт C2. PS4-вариантный полипептид по пункту C1, где мутация в положении 223 содержит замещение 223E и/или 223К, предпочтительно G223E и/или G223K.
Пункт C3. PS4-вариантный полипептид по пункту C1 или C2, где PS4-вариантный полипептид дополнительно содержит одну или несколько дополнительных мутаций в положении, выбранном из группы, состоящей из: 121 и 161.
Пункт C4. PS4-вариантный полипептид по пункту C3, где одна или несколько дополнительных мутаций выбраны из группы, состоящей из: 121F, 121Y, 121W и 161А, предпочтительнее G121F, G121Y, G121W и/или S161A.
Пункт С5. PS4-вариантный полипептид по любому предыдущему пункту С, где PS4-вариантный полипептид содержит мутации в положениях, выбранных из группы, состоящей из: 121, 223; 161, 223.
Пункт С6. PS4-вариантный полипептид по пункту С5, где PS4-вариантный полипептид содержит мутации в положениях, выбранных из группы, состоящей из: 121F/Y/W, 223E/K; 161A, 223E/K.
Пункт C7. PS4-вариантный полипептид по любому предыдущему пункту C, где PS4-вариантный полипептид содержит мутации в положениях, выбранных из группы, состоящей из: 121, 161 и 223.
Пункт C8. PS4-вариантный полипептид по любому предыдущему пункту C, где PS4-вариантный полипептид содержит мутации 121F/Y/W, 161A, 223E/K.
Пункт C9. PS4-вариантный полипептид по любому предыдущему пункту C, где PS4-вариантный полипептид дополнительно содержит одну или предпочтительно все мутации, выбранные из группы, состоящей из: 134, 141, 157, 223, 307, 334.
Пункт C10. PS4-вариантный полипептид по любому предыдущему пункту C, где PS4-вариантный полипептид дополнительно содержит мутации либо в одном, либо в двух положениях 33 и 34.
Пункт C11. PS4-вариантный полипептид по пункту C10, где PS4-вариантный полипептид дополнительно содержит одно или предпочтительно все замещения, выбранные из группы, состоящей из: G134R, A141P, I157L, G223A, H307L, S334P, и необязательно одно или оба из N33Y и D34N.
Пункт C12. PS4-вариантный полипептид по любому предыдущему пункту C, где PS4-вариантный полипептид дополнительно содержит:
(а) мутацию в положении 121, предпочтительно 121D, предпочтительнее G121D;
(b) мутацию в положении 178, предпочтительно 178F, предпочтительнее L178F;
(c) мутацию в положении 179, предпочтительно 179T, предпочтительнее A179T; и/или
(d) мутацию в положении 87, предпочтительно 87S, предпочтительнее G87S.
Пункт D1. PS4-вариантный полипептид, получаемый из исходного полипептида, имеющего немальтогенную экзоамилазную активность, где PS4-вариантный полипептид содержит аминокислотную мутацию в одном или нескольких положениях, выбранных из группы, состоящей из: 146, 157, 158, 198, 229, 303, 306, 309, 316 и 353, относительно нумерации положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной как SEQ ID NO:1.
Пункт D2. PS4-вариантный полипептид по пункту D1, где PS4-вариантный полипептид содержит аминокислотную мутацию, выбранную из группы, состоящей из: 146G, 146M, 157M, 158T, 158A, 158S, 198W, 198F, 229P, 303E, 303D, 306T, 306G, 309P, 316S, 316P, 316K, 316Q, и 353Т.
Пункт D3. PS4-вариантный полипептид по пункту D1, где PS4-вариантный полипептид содержит аминокислотную мутацию 146G, 157M, 158T, 198W, 229P, 303E, 303D, 306T, 306G, 309P, 316S, 316P и 353Т.
Пункт D4. PS4-вариантный полипептид по пункту D1, где PS4-вариантный полипептид дополнительно содержит одну или несколько мутаций, выбранных из группы, состоящей из положений: 33, 34, 121, 134, 141, 157, 161, 178, 179, 223, 307 и 334, предпочтительно выбранных из группы, состоящей из: 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 307L и 334P.
Пункт D5. PS4-вариантный полипептид по пункту D1, где PS4-вариантный полипептид содержит каждую из следующих мутаций:
(а) 33Y, 34N, 121F, 134R, 141P, 146G, 157L, 161A, 178F, 179T, 223E, 307L и 334P, предпочтительно имеющий последовательность SEQ ID NO:15;
(b) 33Y, 34N, 121F, 134R, 141P, 157M, 161A, 178F, 179T, 223E, 307L и 334P, предпочтительно имеющий последовательность SEQ ID NO:16;
(c) 33Y, 34N, 121F, 134R, 141P, 157L, 158T, 161A, 178F, 179T, 223E, 307L и 334P, предпочтительно имеющий последовательность SEQ ID NO:17;
(d) 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 198W, 223E, 307L и 334P, предпочтительно имеющий последовательность SEQ ID NO:18;
(e) 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 229P, 307L и 334P, предпочтительно имеющий последовательность SEQ ID NO:19;
(f) 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 198W, 223E, 229P, 307L и 334P, предпочтительно имеющий последовательность SEQ ID NO:20;
(g) 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 303E, 307L и 334P, предпочтительно имеющий последовательность SEQ ID NO:21;
(h) 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 303D, 307L и 334P, предпочтительно имеющий последовательность SEQ ID NO:22;
(i) 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 306L, 307L и 334P, предпочтительно имеющий последовательность SEQ ID NO:23;
(j) 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 306G, 307L и 334P, предпочтительно имеющий последовательность SEQ ID NO:24;
(k) 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 309P, 307L и 334P, предпочтительно имеющий последовательность SEQ ID NO:25;
(l) 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 307L, 316S и 334P, предпочтительно имеющий последовательность SEQ ID NO:26;
(m) 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 307L, 316P и 334P, предпочтительно имеющий последовательность SEQ ID NO:27;
(n) 33Y, 34N, 121F, 134R, 141P, 157L, 161A, 178F, 179T, 223E, 307L, 334P и 353T, предпочтительно имеющий последовательность SEQ ID NO:28.
Пункт 13. PS4-вариантный полипептид по любому предыдущему пункту, где исходный полипептид содержит немальтогенную экзоамилазу, предпочтительно глюкан 1,4-альфа-мальтотетрагидролазу (EC 3.2.1.60).
Пункт 14. PS4-вариантный полипептид по любому предыдущему пункту, где исходный полипептид представляет собой или получен из видов Pseudomonas, предпочтительно Pseudomonas saccharophilia или Pseudomonas stutzeri.
Пункт 15. PS4-вариантный полипептид по любому предыдущему пункту, где исходный полипептид представляет собой немальтогенную экзоамилазу из экзоамилазы Pseudomonas saccharophilia, имеющей последовательность, представленную как SEQ ID NO:1 или SEQ ID NO:5.
Пункт 16. PS4-вариантный полипептид по любому из пунктов от А1 до А12, от В1 до В12, от С1 до С12, от D1 до D5, 13 и 14, где исходный полипептид представляет собой немальтогенную экзоамилазу из экзоамилазы Pseudomonas stutzeri, имеющей последовательность, представленную как SEQ ID NO:7 или SEQ ID NO:11.
Пункт 17. PS4-вариантный полипептид по любому предыдущему пункту, который содержит последовательность, представленную в описании, пунктах или фигурах.
Пункт 18. PS4-вариантный полипептид по любому предыдущему пункту, где PS4-вариантный полипептид обладает более высокой термостабильностью по сравнению с исходным полипептидом или полипептидом дикого типа при оценке в одинаковых условиях.
Пункт 19. PS4-вариантный полипептид по любому предыдущему пункту, время полужизни (t1/2) которого, предпочтительно при 60°С, больше на 15% или более, предпочтительно на 50% или более, наиболее предпочтительно на 100% или более по сравнению с исходным полипептидом или полипептидом дикого типа.
Пункт 20. PS4-вариантный полипептид по любому предыдущему пункту, где PS4-вариантный полипептид обладает более высокой экзоспецифичностью по сравнению с исходным полипептидом или полипептидом дикого типа при оценке в одинаковых условиях.
Пункт 21. PS4-вариантный полипептид по любому предыдущему пункту, где PS4-вариантный полипептид имеет 10% или более, предпочтительно 20% или более, предпочтительно 50% или более экзоспецифичности по сравнению с исходным полипептидом или полипептидом дикого типа.
Пункт 22. Применение PS4-вариантного полипептида, представленного в любом предыдущем пункте, в качестве пищевой добавки.
Пункт 23. Способ обработки крахмала, включающий контактирование крахмала с PS4-вариантным полипептидом, представленным в любом из пунктов от А1 до А12, от В1 до В12, от С1 до С12, от D1 до D5 и от 13 до 21, и предоставление полипептиду возможности генерирования из крахмала одного или нескольких линейных продуктов.
Пункт 24. Применение PS4-вариантного полипептида, представленного в любом из пунктов от А1 до А12, от В1 до В12, от С1 до С12, от D1 до D5 и с 13 до 21, в приготовлении пищевого продукта.
Пункт 25. Способ приготовления пищевого продукта, включающий смешивание полипептида, представленного в любом из пунктов от А1 до А12, от В1 до В12, от С1 до С12, от D1 до D5 и от 13 до 21, с компонентом пищевого продукта.
Пункт 26. Применение по пункту 24 или способ по пункту 25, где пищевой продукт включает тесто или продукт из теста, предпочтительно продукт из обработанного теста.
Пункт 27. Применение или способ по любому из пунктов от 24 до 26, где пищевой продукт представляет собой хлебобулочное изделие.
Пункт 28. Способ изготовления хлебобулочного изделия, включающий: (а) получение крахмальной среды; (b) добавление к крахмальной среде PS4-вариантного полипептида, представленного в любом из пунктов от А1 до А12, от В1 до В12, от С1 до С12, от D1 до D5 и от 13 до 21; и (с) применение нагревания к крахмальной среде в течение и после стадии (b) для производста хлебобулочного изделия.
Пункт 29. Пищевой продукт, продукт из теста или хлебобулочное изделие, полученные способом по любому из пунктов с 24 до 28.
Пункт 30. Композиция улучшителя для теста, где композиция улучшителя содержит PS4-вариантный полипептид, представленный в любом из пунктов от А1 до А12, от В1 до В12, от С1 до С12, от D1 до D5 и от 13 до 21, и, по меньшей мере, один дополнительный ингредиент для теста или добавку для теста.
Пункт 31. Композиция, содержащая муку и PS4-вариантный полипептид, представленный в любом из пунктов от 1 до 21.
Пункт 32. Применение PS4-вариантного полипептида, представленного в любом из пунктов от А1 до А12, от В1 до В12, от С1 до С12, от D1 до D5 и от 13 до 21, в продукте из теста для ингибирования или снижения черствения, предпочтительно вредной ретроградации, продукта из теста.
Пункт 33. Комбинация PS4-вариантного полипептида, представленного в любом предыдущем пункте, вместе с новамилом, или вариантом, гомологом или его мутантами, которая обладает мальтогенной альфа-амилазной активностью.
Пункт 34. Применение комбинации по пункту 33 для использования по любому предыдущему пункту.
Пункт 35. Пищевой продукт, полученный обработкой комбинацией по пункту 34.
Пункт 36. Пищевая добавка, содержащая PS4-вариантный полипептид по любому из пунктов от А1 до А12, от В1 до В12, от С1 до С12, от D1 до D5 и от 13 до 21.
Ссылки
Penninga, D., van der Veen, B.A., Knegtel, R.M., van Hium, S.A., Rozeboom, H.J., Kalk, K.H., Dijkstra, B.W., Dijkhuizen, L. (1996). The raw starch binding domain of cyclodextrin glycosyltransferase from Bacillus circulans strain 251. J. Biol. Chem. 271, 32777-32784.
Sambrook J, F.E.M.T. (1989). Molecular Cloning: A Laboratory Manual, 2nd Edn. Cold Spring Harbor Laboratory, Cold Spring Harbor NY.
Zhou, J.H., Baba, Т., Takano, T., Kobayashi, S., Arai, Y. (1989). Nucleotide sequence of the maltotetraohydrolase gene from Pseudomonas saccharophila. FEBS Lett. 255, 37-41.
Каждая из заявок и каждый из патентов, приведенных в данном документе, и каждый документ, цитированный или внесенный в каждую из вышеупомянутых заявок и патентов, в том числе в течение рассмотрения каждой из заявок и патентов (“заявочные цитированные документы”), и любые инструкции разработчиков или каталоги по любым продуктам, цитированным или упомянутым в каждой из заявок и патентов и в любых заявочных цитированных документах, таким образом являются включенными в данную работу ссылкой. Кроме того, все документы, цитированные в данном тексте, и все документы, цитированные или внесенные в документы, цитированные в данном тексте, и любые инструкции разработчиков или каталоги по любым продуктам, цитированным или упомянутым в данном тексте, таким образом являются включенными в данную работу ссылкой.
Различные модификации и изменения описанных способов и систем изобретения будут очевидными для специалистов в данной области без отступления от охвата и сущности изобретения. Несмотря на то, что изобретение описано в связи с конкретными предпочтительными вариантами осуществления, следует подразумевать, что данное заявленное изобретение не должно быть несправедливо ограниченным такими конкретными вариантами осуществления. Фактически различные модификации описанных способов выполнения изобретения, которые являются очевидными для специалистов молекулярной биологии или родственных областей, предназначены для того, чтобы быть охваченными формулой изобретения.
Реферат
Изобретение относится к биотехнологии и представляет собой PS4-вариантный полипептид, получаемый из исходного полипептида, имеющий немальтогенную экзоамилазную активность, который по меньшей мере на 60% идентичен любой из SEQ ID NO:1-14, причем PS4-вариантный полипептид содержит аминокислотную мутацию в одном или нескольких положениях, выбранных из группы, состоящей из 146, 229, 303, 306, 309, 316, 353, 26, 145, 339, относительно нумерации положений последовательности экзоамилазы Pseudomonas saccharophilia, представленной как SEQ ID NO:1. Изобретение относится также к применению данного полипептида в пищевой промышленности. Изобретение позволяет расширить арсенал используемых в пищевой промышленности немальтогенных экзоамилаз. 22 н. и 20 з.п. ф-лы, 39 табл.
Формула
(a) 33Y, 34N, 121F, 134R, 141Р, 146G, 157L, 161А, 178F, 179Т, 223Е, 307L и 334Р;
(b) 33Y, 34N, 121F, 134R, 141Р, 157М, 161А, 178F, 179Т, 223Е, 307L и 334Р;
(c) 33Y, 34N, 121F, 134R, 141Р, 157L, 158Т, 161А, 178F, 179Т, 223Е, 307L и 334Р;
(d) 33Y, 34N, 121F, 134R, 141Р, 157L, 161А, 178F, 179Т, 198W, 223Е, 307L и 334Р;
(e) 33Y, 34N, 121F, 134R, 141Р, 157L, 161А, 178F, 179Т, 223Е, 229Р, 307L и 334Р;
(f) 33Y, 34N, 121F, 134R, 141Р, 157L, 161А, 178F, 179Т, 198W, 223Е, 229Р, 307L и 334Р;
(g) 33Y, 34N, 121F, 134R, 141Р, 157L, 161А, 178F, 179Т, 223Е, 303Е, 307L и 334Р;
(h) 33Y, 34N, 121F, 134R, 141Р, 157L, 161А, 178F, 179Т, 223Е, 303D, 307L и 334Р;
(i) 33Y, 34N, 121F, 134R, 141Р, 157L, 161А, 178F, 179Т, 223Е, 306Т, 307L и 334Р;
(j) 33Y, 34N, 121F, 134R, 141Р, 157L, 161А, 178F, 179Т, 223Е, 306G, 307L и 334Р;
(k) 33Y, 34N, 121F, 134R, 141Р, 157L, 161А, 178F, 179Т, 223Е, 309Р, 307L и 334Р;
(l) 33Y, 34N, 121F, 134R, 141Р, 157L, 161А, 178F, 179Т, 223Е, 307L, 316S и 334Р;
(m) 33Y, 34N, 121F, 134R, 141Р, 157L, 161А, 178F, 179Т, 223Е, 307L, 316Р и 334Р;
(n) 33Y, 34N, 121F, 134R, 141Р, 157L, 161А, 178F, 179Т, 223Е, 307L, 334Р и 353Т.
(a) N26E, N33Y, D34N, G121F, G134R, А141Р, I157L, L178F, А179Т, G223A, H307L, S334P;
(b) N33Y, D34N, G70D, G121F, G134R, А141Р, Y146G, I157L, G158T, S161A, L178F, А179Т, G223E, S229P, H307L, А309Р, S334P;
(c) N33Y, D34N, G121F, G134R, А141Р, N145D, Y146G, I157L, G158T, S161A, L178F, А179Т, G223E, S229P, H307L, А309Р, S334P;
(d) N33Y, D34N, G70D, G121F, G134R, А141Р, N145D, Y146G, I157L, G158T, S161A, L178F, А179Т, G188H, G223E, S229P, H307L, А309Р, S334P, W339E;
(e) N33Y, D34N, G70D, G121F, G134R, А141Р, N145D, Y146G, I157L, G158T, S161A, L178F, А179Т, G188S, G223E, S229P, H307L, А309Р, S334P, W339E;
(f) N33Y, D34N, G121F, G134R, А141Р, Y146G, I157L, G158T, S161A, L178F, А179Т, G223E, S229P, H307L, А309Р, S334P, W339A;
(g) N33Y, D34N, G121F, G134R, А141Р, Y146G, I157L, G158T, S161A, L178F, А179Т, G223E, S229P, H307L, А309Р, S334P, W339E.

Комментарии