Новая протеаза грибов и ее применение - RU2566549C2
Код документа: RU2566549C2
Чертежи






















































Описание
Область изобретения
Данное изобретение относится к ферменту сериновой протеазе грибов, применяемому в различных ситуациях, в частности, в стиральных и посудомоечных средствах. Изобретение относится к нуклеиновокислотной молекуле, кодирующей указанный фермент, рекомбинантному вектору, клетке-хозяину для продукции указанного фермента, композиции, содержащей указанный фермент, а также к способу изготовления такой композиции. Это изобретение также относится к различным применениям указанного фермента или композиций, содержащих указанный фермент.
Уровень техники
Микробные протеазы являются одними из наиболее важных гидролитических ферментов и находят применение в различных промышленных областях, таких как моющие средства, продукты питания, кожа, фармацевтические средства, диагностические средства, управление отходами и восстановление серебра. Микробные внеклеточные протеазы составляют основную часть, более одной трети, общего объема продаж промышленных ферментов по всему миру (Cherry and Fidantsef, 2003). Приблизительно 90% коммерческих протеаз являются ферментами моющих средств (Gupta et al., 2002). Большинство коммерческих протеаз, в основном нейтральные и щелочные, производятся организмами, принадлежащими роду Bacillus.
Сериновые протеазы семейства субтилизинов, или субтилизины, продуцируемые видами Bacillus, образуют крупнейшую подгруппу промышленных протеаз. Эти ферменты являются коммерчески важными в качестве компонента, разрушающего белки, или добавки моющих средств. Коммерческие моющие препараты, используемые в настоящее время, содержат природные щелочные сериновые протеазы, полученные из видов Bacillus, или являются рекомбинантными протеазными препаратами (Maurer, 2004). Варианты природных ферментов с улучшенной каталитической эффективностью и/или лучшей устойчивостью к температуре, окислителям и изменениям условий мытья были разработаны путем сайт-направленного и/или случайного мутагенеза. Примерами коммерческих протеаз являются такие, как субтилизин Carlsberg (Alcalase®, Novozymes, Дания), субтилизин 309 (Savinase®, Novozymes, Дания), субтилизин 147 (Esperase®, Novozymes, Дания), Kannase® (Novozymes, Дания), Purafect® (Genencor Inc., США), Purafect® Ox, Properase® (Genencor Inc., США) и BLAP серий S и X (Henkel, Германия).
Несколько щелочных сериновых протеаз (ЕС 3.4.21) и генов, кодирующих эти ферменты, также были выделены из эукариотических организмов, в том числе дрожжей и мицелиальных грибов. Патенты US №3652399 и ЕР 519229 (Takeda Chemical Industries, Ltd, JP) раскрывают щелочную протеазу из рода Fusarium (бесполое состояние, телеоморфа) или Gibberella (половое состояние, анаморфа), в частности из Fusarium sp.S-19-5 (ATCC 20192, IFO 8884), F. oxysporum f. sp.lini (IFO 5880) или G. saubinetti (ATCC 20193, IF06608), используемую для составления моющих средств и других очищающих композиций. WO 88/03946 и WO 89/04361 (Novo Industri A/S, Дания) раскрывают ферментативную моющую добавку и моющую композицию, включающую протеазу и липазу, где протеаза грибов получена из Fusarium, в частности, F. oxysporum или F. so/an/. Моющая добавка, включающая протеазу со специфичностью к пептидным связям, граничащим только с одной или двумя конкретными аминокислотами, раскрыта в WO 89/06270. WO 1994025583 (NovoNordisk A/S, Дания) раскрывает активный трипсиноподобный протеазный фермент, получаемый из видов Fusarium, в частности из штамма F. oxysporum (DSM 2672), а также последовательность ДНК, кодирующую его. Аминокислотная последовательность новой протеазы, получаемой из Fusarium sp.BLB (FERM ВР-10493), раскрыта в WO 2006101140 (SODX Co. Ltd, Накамура). Кроме того, сообщалось о щелочных протеазах из видов грибов, таких как Tritirachium и Conidiobolus (см. обзор Anwar and Saleemuddin, 1998).
Применение сериновых протеаз грибов в различных случаях также известно из нескольких патентных заявок. Например, комбинация целлюлазы и протеазы, в частности трипсиноподобной протеазы из Fusarium sp. DSM 2672, в качестве моющей добавки или композиции раскрыта в WO 1992018599 (NovoNordisk A/S). Такие моющие композиции также могут содержать обратимые ингибиторы протеаз для стабилизации фермента(ов), как описано в WO 1992003529 и WO 1992005239 (NovoNordisk A/S). Процесс удаления или отбеливания загрязнения и пятен с целлюлозных тканей с помощью ферментного гибрида, включающего каталитически активную аминокислотную последовательность такой протеазы, связанную с аминокислотной последовательностью, содержащей целлюлозо-связывающий домен, раскрыт в WO 1997028243 (NovoNordisk A/S). WO 1997002753 (NovoNordisk A/S) раскрывает способ мягкой очистки загрязненного технологического оборудования с помощью липазы и протеазы, которая предпочтительно является сериновой протеазой, получаемой из Fusarium. Применение F. equiseti и других грибов в восстановлении органических веществ в сточных водах раскрыто в патентной заявке ЕР 1464626 (Biovitis S.A., Франция).
Социально-экономические задачи и правительственные постановления вынуждают индустрию моющих средств принимать во внимание многие экологические аспекты, включая не только применение более мягких химических веществ, которые могут быть использованы в небольших количествах и, следовательно, оставляют меньше следов, загрязняющих окружающую среду, но также необходимость энергосбережения. Ферменты моющих средств, в частности протеазы, являются важным компонентом в композициях моющих средств. Необходимость экономии энергии за счет уменьшения температур стирки и более широкое применение синтетических волокон, которые не переносят высокие температуры и современный образ жизни, изменили привычки клиентов в сторону низких температур стирки и создали спрос на новые ферменты, которые эффективны при низких температурах.
Несмотря на то, что были опубликованы многочисленные патентные публикации, обзоры и статьи, например ЕР 0290567 и ЕР 0290569 (Novo Nordisk A/S, Дания), в которых раскрыты сериновые протеазы из различных микроорганизмов, например низкотемпературные щелочные протеазы из актиномицетов (Nocardiopsis dassonvillei) и грибов (Paecilomyces marquandii), до сих пор существует большая потребность в альтернативных сериновых протеазах, которые являются подходящими и эффективными в изменении, разрушении и удалении белковых материалов, в частности в диапазоне низких или умеренных температур, и которые стабильны в присутствии моющих средств с сильно изменяющимися свойствами.
Промышленность моющих средств делает большие успехи в адаптации своих новых продуктов к привычкам и потребностям клиентов, свойствам новых текстильных изделий и новых стиральных машин. Очевидно, что при разработке новых моющих средств, в частности композиций для стирки и мытья посуды, должен быть удовлетворен широкий спектр различных и быстро меняющихся потребностей. Для того чтобы выполнить все изменяющиеся требования промышленности моющих средств и правительственные постановления, новые ингредиенты сериновые протеазы для моющих композиций не только должны быть способны выполнять свои задачи в широких диапазонах рН и температур и оставаться стабильными в различных условиях, в том числе при механическом и химическом вмешательствах в сочетании с различными моющими средствами, но также желательно, чтобы сериновая протеаза могла быть получена в больших количествах, которые затем могут быть доходно обработаны путем простого отделения от ферментативного бульона и мицелия.
Сущность изобретения
Целью данного изобретения является создание сериновой протеазы грибного происхождения, которая демонстрирует широкую субстратную специфичность, является активной в широком диапазоне рН и имеет широкий температурный оптимум, т.е. функционирует как при низких, так и при умеренных температурах. Сериновые протеазы для стиральных и посудомоечных средств должны быть стабильны также в присутствии моющих средств или должны быть совместимыми с моющими средствами. В частности, объектом изобретения является создание сериновой протеазы, которая способна удалять белковый материал, в том числе загрязнители, при стирке белья и мытье посуды при более низких температурах, чем имеющиеся в настоящее время коммерческие ферментные препараты, тем самым экономя энергию. Сериновая протеаза грибов может быть произведена в грибах-хозяевах с высокой продуктивностью, и затем легко может быть выполнена последующая обработка, например путем отделения ферментативного бульона и мицелия.
Данное изобретение относится к ферменту сериновой протеазе грибов, который обладает активностью сериновой протеазы и включает аминокислотную последовательность зрелого фермента Fe_RF6318, определенного в SEQ ID №15, или аминокислотную последовательность, имеющую по меньшей мере 86% идентичность с аминокислотной последовательностью зрелого фермента Fe_RF6318, определенного в SEQ ID №15.
Фермент изобретения можно получить из Fusarium equiseti, более предпочтительно из сданного на хранение штамма CBS 119568.
Фермент имеет молекулярную массу от 25 до 35 кДа. Фермент имеет оптимальную температуру в диапазоне от 30°С до 70°С при рН 9. Указанный фермент имеет оптимум рН в диапазоне рН от 6 до 11 при 50°С. Оптимумы температуры и рН определяли в 15-минутной реакции с помощью казеина в качестве субстрата. Сериновая протеаза изобретения способна разрушать или удалять белковые загрязнители в присутствии моющего средства в пределах от 10 до 60°C.
Фермент сериновая протеаза грибов изобретения кодируется выделенной полинуклеотидной последовательностью, которая гибридизуется в жестких условиях с полинуклеотидной последовательностью, включенной в плазмиду pALK2521, содержащую нуклеотидную последовательность SEQ ID №9, сохраненную в E. coli RF7664 под регистрационным номером DSM 22171.
Указанный фермент кодируется выделенной полинуклеотидной последовательностью, которая кодирует полипептид, включающий аминокислотную последовательность зрелого фермента Fe_RF6318, определенную в SEQ ID №15, или аминокислотную последовательность, по меньшей мере на 86% идентичную аминокислотной последовательности зрелого Fe_RF6318, определенной в SEQ ID №15. Предпочтительно указанный фермент кодируется выделенной нуклеиновокислотной молекулой, содержащей нуклеотидную последовательность SEQ ID №14.
Фермент сериновая протеаза грибов изобретения полной длины кодируется полинуклеотидной последовательностью, включенной в pALK2529, сохраненный в E. coli RF7800 под регистрационным номером DSM 22172.
Фермент сериновая протеаза грибов производится из рекомбинантного экспрессионного вектора, содержащего нуклеиновокислотную молекулу, кодирующую сериновую протеазу грибов изобретения, функционально связанную с регуляторными последовательностями, способными направлять экспрессию гена, кодирующего сериновую протеазу, в подходящем хозяине. Подходящие хозяева включают гетерологичных хозяев, предпочтительно микробных хозяев рода Trichoderma, Aspergillus, Fusarium, Humicola, Chrysosporium, Neurospora, Rhizopus, Penicillium и Mortiriella.
Предпочтительно указанный фермент вырабатывается в Trichoderma или Aspergillus, наиболее предпочтительно в Т. reesei.
Данное изобретение также относится к выделенной нуклеиновокислотной молекуле, кодирующей фермент сериновую протеазу грибов, выбранной из группы, включающей:
(а) нуклеиновокислотную молекулу, кодирующую полипептид, имеющий активность сериновой протеазы и включающий аминокислотную последовательность, показанную в SEQ ID №15;
(б) нуклеиновокислотную молекулу, кодирующую полипептид, имеющий активность сериновой протеазы и по меньшей мере на 86% идентичный аминокислотной последовательности SEQ ID №15;
(в) нуклеиновокислотную молекулу, содержащую кодирующую последовательность нуклеотидной последовательности, показанной в SEQ ID №10;
(г) нуклеиновокислотную молекулу, содержащую кодирующую последовательность полинуклеотидной последовательности, содержащейся в DSM 22171 или DSM 22172;
(д) нуклеиновокислотную молекулу, кодирующая последовательность которой отличается от кодирующей последовательности нуклеиновокислотной молекулы любого из пп. от (в) до (г) из-за вырожденности генетического кода; а также
(е) нуклеиновокислотную молекулу, гибридизующуюся в жестких условиях с нуклеиновокислотной молекулой, содержащейся в DSM 22171, и кодирующую полипептид, имеющий активность сериновой протеазы и аминокислотную последовательность, по меньшей мере на 86% идентичную аминокислотной последовательности, показанной в SEQ ID №15.
Изобретение также относится к рекомбинантному экспрессионному вектору, включающему нуклеотидную последовательность изобретения, функционально связанную с регуляторными последовательностями, способными направлять экспрессию указанного гена, кодирующего сериновую протеазу, в подходящем хозяине. Подходящие хозяева включают гетерологичных хозяев, предпочтительно микробных хозяев рода Trichoderma, Aspergillus, Fusarium, Humicola, Chrysosporium, Neurospora, Rhizopus, Penicillium и Mortiriella. Предпочтительно указанный фермент вырабатывается в Trichoderma или Aspergillus, наиболее предпочтительно в Т. reesei.
Изобретение также относится к клетке-хозяину, содержащей рекомбинантный экспрессионный вектор, описанный выше. Предпочтительно клеткой-хозяином является микробный хозяин, такой как нитчатый гриб. Предпочтительные хозяева относятся к роду Trichoderma, Aspergillus, Fusarium, Humicola, Chrysosporium, Neurospora, Rhizopus, Penicillium и Mortiriella. Более предпочтительно хозяином является Trichoderma или Aspergillus, наиболее предпочтительно нитчатый гриб Т. reesei.
Данное изобретение относится к способу получения полипептида, имеющего активность сериновой протеазы, при этом указанный способ включает этап культивирования клетки-хозяина изобретения и этап восстановления полипептида. Также в рамки изобретения включен полипептид, имеющий активность сериновой протеазы, кодируемый нуклеиновой кислотой изобретения и получаемый способом, описанным выше.
Изобретение относится к способу получения ферментного препарата, включающему этапы культивирования клетки-хозяина изобретения и либо восстановления полипептида из клетки, либо выделения клеток из культуральной среды и получения супернатанта. В рамки изобретения также включен ферментный препарат, получаемый способом, описанным выше.
Изобретение относится к ферментному препарату, в состав которого входит фермент сериновая протеаза изобретения.
Ферментный препарат изобретения также может содержать другие ферменты, выбранные из группы протеазы, амилазы, целлюлазы, липазы, ксиланазы, маннаназы, кутиназы, пектиназы или оксидазы с посредником или без него, а также подходящие добавки, выбранные из группы стабилизаторов, буферов, поверхностно-активных веществ, отбеливающих агентов, посредников, антикоррозионных агентов, структурообразователей, средств, препятствующих распространению грязи по ткани после стирки, оптических отбеливателей, красителей, пигментов, каустика, абразивов, консервантов и др.
Использованная культуральная среда от продуцирующего хозяина может быть использована как таковая, либо клетки-хозяева могут быть удалены и/или она может быть сконцентрирована, профильтрована или фракционирована. Она может также быть высушена. Ферментный препарат изобретения может быть в виде жидкости, порошка или гранул.
Также в рамки изобретения входит применение фермента сериновой протеазы или ферментного препарата изобретения для моющих средств, для обработки волокон, для обработки шерсти, для обработки волос, для обработки кожи, для обработки пищи или корма или для любых применений, включающих модификацию, разрушение или удаление белкового материала. В частности, фермент или ферментный препарат используется в качестве моющей добавки в производстве жидких моющих средств и стиральных порошков.
Краткое описание графических материалов
На фиг.1 показана нуклеотидная последовательность гена Fe prtS8A от Fusarium equiseti RF6318 и выведенная аминокислотная последовательность. Предполагаемый сигнальный пептид, проанализированный с помощью программы SignalP V3.0, отмечен строчными буквами и подчеркнут. Пропоследовательность и выведенные аминокислоты пропоследовательности отмечены строчными буквами. Зрелая нуклеотидная и пептидная последовательности отмечены заглавными буквами (N-концевая последовательность, определенная из очищенного белка Fe_RF6318 дикого типа). Расположение предполагаемой последовательности интрона отмечено нижним регистром, курсивом и пунктирной линией под нуклеотидной последовательностью. Стоп-кодон показан звездочкой под последовательностью. N-концевая последовательность и пептидные последовательности, полученные из белка Fe_RF6318 дикого типа, выделены серым фоном.
На фиг.1А показана нуклеотидная последовательность гена Fe prt8A от старт-кодона ATG до кодона ССТ (нуклеотиды с 898 по 900), область последовательности, кодирующая аминокислотную последовательность с Met1 по Val278 белка Fe_RF6318.
На фиг.1В показана нуклеотидная последовательность гена Fe prt8A от кодона СТС (нуклеотиды с 901 по 903) до стоп-кодона ТАА, область последовательности, кодирующая аминокислотную последовательность от Leu279 до А1а412 белка Fe_RF6318.
На фиг.2 схематически показана кассета, используемая для экспрессии гена Fe prtSSA в Trichoderma reesei.
На фиг.3 показан частично очищенный рекомбинантный белок Fe_RF6318, проанализированный в 12% геле SDS PAGE. Линия 1. Образец частично очищенного Fe_RF6318, Линия 2. Маркер молекулярного веса (Bench Mark Protein Ladder, Invitrogen).
На фиг.4А описана температурная характеристика рекомбинантного белка Fe_RF6318, анализированного при рН 9 в 15-минутной реакции с помощью казеина в качестве субстрата. Данные точки являются средними значениями трех отдельных измерений.
На фиг.4В описано влияние рН на активность рекомбинантного белка Fe_RF6318. Используемым буфером был 40 мМ буфер Бриттон-Робинсона, казеин был использован в качестве субстрата, время реакции составляло 15 минут, а температура реакции составляла 50°С. Данные точки являются средними значениями трех отдельных измерений.
На фиг.5 описана эффективность рекомбинантного белка Fe_RF6318 на загрязнителе кровь/молоко/чернила (арт.116, ЕМРА) при 30°С, рН 9, 60 мин. Для сравнения использовали коммерческие препараты Savinase Ultra® 16L (Novozymes A/S, Дания) и Purafect® 4000L (Genencor Inc., США). ΔL* (дельта L*)=насыщенность белого L* обработанной ферментом ткани - насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
На фиг.6 описана эффективность рекомбинантного белка Fe_RF6318 на загрязнителе кровь/молоко/чернила (арт.116, ЕМРА) при 50°С, рН 9, 60 мин. Для сравнения использовали коммерческие препараты Savinase Ultra® 16L и Purafect® 4000L. ΔL* (дельта L*)=насыщенность белого L* обработанной ферментом ткани - насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
На фиг.7А описана эффективность рекомбинантного белка Fe_RF6318 на загрязнителе кровь/молоко/чернила (арт.117, ЕМРА) при 40°С, рН примерно 10, 60 мин, в присутствии стирального порошка (арт.601, ЕМРА). Для сравнения использовали коммерческий препарат Purafect® 4000L. ΔL* (дельта L*)=насыщенность белого L* обработанной ферментом ткани - насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
На фиг.7В описана эффективность рекомбинантного белка Fe_RF6318 на загрязнителе кровь/молоко/чернила (арт.117, ЕМРА) при 40°С, рН примерно 10, 60 мин, в присутствии стирального порошка и отбеливающих агентов (арт.604 и 606, ЕМРА). Для сравнения использовали коммерческий препарат Purafect® 4000L. ΔL* (дельта L*) = насыщенность белого L* обработанной ферментом ткани - насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
На фиг.8А описана эффективность рекомбинантного белка Fe_RF6318 на загрязнителе кровь/молоко/чернила (арт.117, ЕМРА) при 50°С, рН примерно 10, 60 мин, в присутствии стирального порошка (арт.601, ЕМРА). Для сравнения использовали коммерческий препарат Purafect® 4000L. ΔL* (дельта L*) = насыщенность белого L* обработанной ферментом ткани - насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
На фиг.8 В описана эффективность рекомбинантного белка Fe_RF6318 на загрязнителе кровь/молоко/чернила (арт.117, ЕМРА) при 50°С, рН примерно 10, 60 мин, в присутствии стирального порошка и отбеливающих агентов (арт.604 и 606, ЕМРА). Для сравнения использовали коммерческий препарат Purafect® 4000L. ΔL* (ltkmnf L*)=насыщенность белого L* обработанной ферментом ткани -насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
На фиг.9 показана эффективность рекомбинантного белка Fe_RF6318 на загрязнителе кровь/молоко/чернила (арт.117, ЕМРА) и жидкого моющего средства Ariel Sensitive при 40°С, рН примерно рН 7,9, 60 мин. Для сравнения использовали коммерческие препараты Savinase® Ultra 16L и Purafect® 4000L. На оси абсцисс показана дозировка фермента (единицы активности/мл), на оси ординат ΔL* (дельта L*)=насыщенность белого L* обработанной ферментом ткани - насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
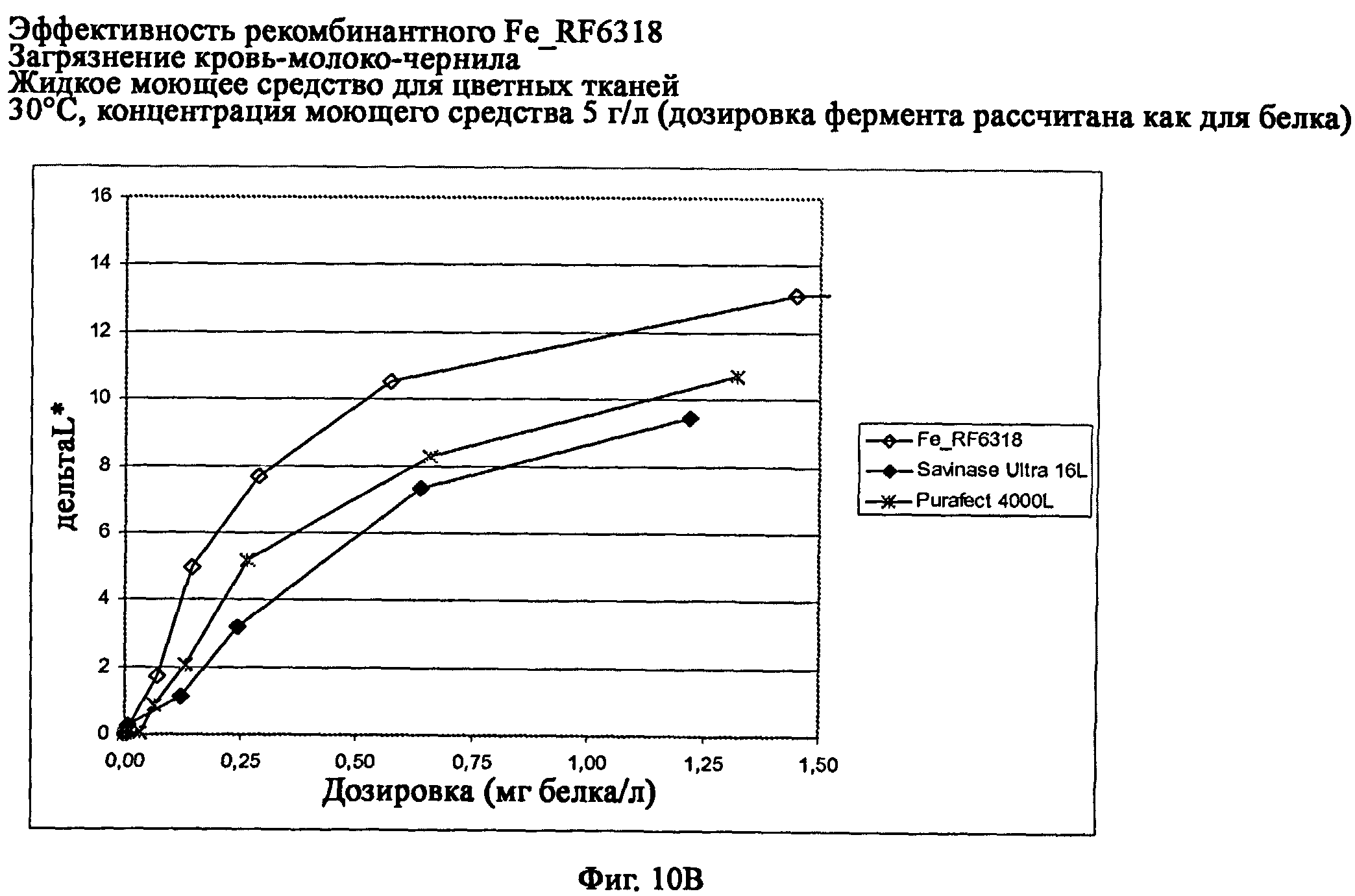
На фиг.10 показана эффективность рекомбинантного белка Fe_RF6318 на загрязнителе кровь/молоко/чернила (арт.117, ЕМРА) с различными концентрациями жидкого моющего средства для цветных тканей при 30°С. Для сравнения использовали коммерческие препараты Purafect® 4000L и Savinase® Ultra 16L. ΔL* (дельта L*) = насыщенность белого L* обработанной ферментом ткани - насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
На фиг.10А показана эффективность с концентрацией моющего средства 5 г/л и рН 7,5.
На фиг.10 В показана эффективность с концентрацией моющего средства 5 г/л (доза фермента рассчитывается как для белка).
На фиг.10С показана эффективность с концентрацией моющего средства 3,3 г/л и рН 7,4.
На фиг.10D показана эффективность с концентрацией моющего средства 1 г/л и рН 7,3.
На фиг.11 показана эффективность рекомбинантного белка Fe_RF6318 на загрязнителе кровь/молоко/чернила (арт.117, ЕМРА) с различными концентрациями Ariel Sensitive (ферментный контроль) на тканях при 30°С. Для сравнения использовали коммерческие препараты Purafect® 4000L и Savinase® Ultra 16L. ΔL* (дельта L*) = насыщенность белого L* обработанной ферментом ткани - насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
На фиг.11А показана эффективность с концентрацией моющего средства 5 г/л и рН 8.
На фиг.11В показана эффективность с концентрацией моющего средства 5 г/л (доза фермента рассчитывается как для белка).
На фиг.11С показана эффективность с концентрацией моющего средства 3,3 г/л и рН 7,9.
На фиг.11D показана эффективность с концентрацией моющего средства 1 г/л и рН 7,6.
На фиг.12 показана эффективность рекомбинантного белка Fe_RF6318 на различных загрязнителях в анализах Launder Ometer с жидким моющим средством Ariel Sensitive (без ферментов) при 30°С. Для сравнения использовали коммерческий препарат Savinase® Ultra 16L. ΔL* (дельта L*) = насыщенность белого L* обработанной ферментом ткани - насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
На фиг.12А показана эффективность на крови/молоке/чернилах/ПЭ-хлопке (арт.117, ЕМРА).
На фиг.12В показана эффективность на крови/молоке/чернилах/хлопке (арт.116, ЕМРА).
На фиг.12С показана эффективность на траве (арт.164, ЕМРА).
На фиг.13 показана эффективность рекомбинантного белка Fe_RF6318 на различных загрязнителях в анализах Launder Ometer с жидким моющим средством для цветных тканей при 30°С. Для сравнения использовали коммерческие препараты Savinase® Ultra 16L и Purafect® 4000L. ΔL* (дельта L*) = насыщенность белого L* обработанной ферментом ткани - насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
На фиг.13А показана эффективность на крови/молоке/чернилах/ПЭ-хлопке (арт.117, ЕМРА).
На фиг.13В показана эффективность на крови/молоке/чернилах/хлопке (арт.116, ЕМРА).
На фиг.13С показана эффективность на траве (арт.164, ЕМРА).
На фиг.13D показана эффективность на какао (арт.112, ЕМРА).
На фиг.14 описана общая эффективность по удалению загрязнителя (дельта % SR) ферментного препарата Fe_RF6318 на восьми различных чувствительных к протеазам загрязнителях (таб.5) в полномасштабных испытаниях моющих средств. Для сравнения использовали коммерческие препараты Savinase® Ultra 16L и Purafect® 4000L.
На фиг.14А описана общая эффективность по удалению загрязнителя с дозировкой протеазных препаратов в зависимости от активности.
На фиг.14В описана общая эффективность по удалению загрязнителя с дозировкой протеазных препаратов в зависимости от количества белка.
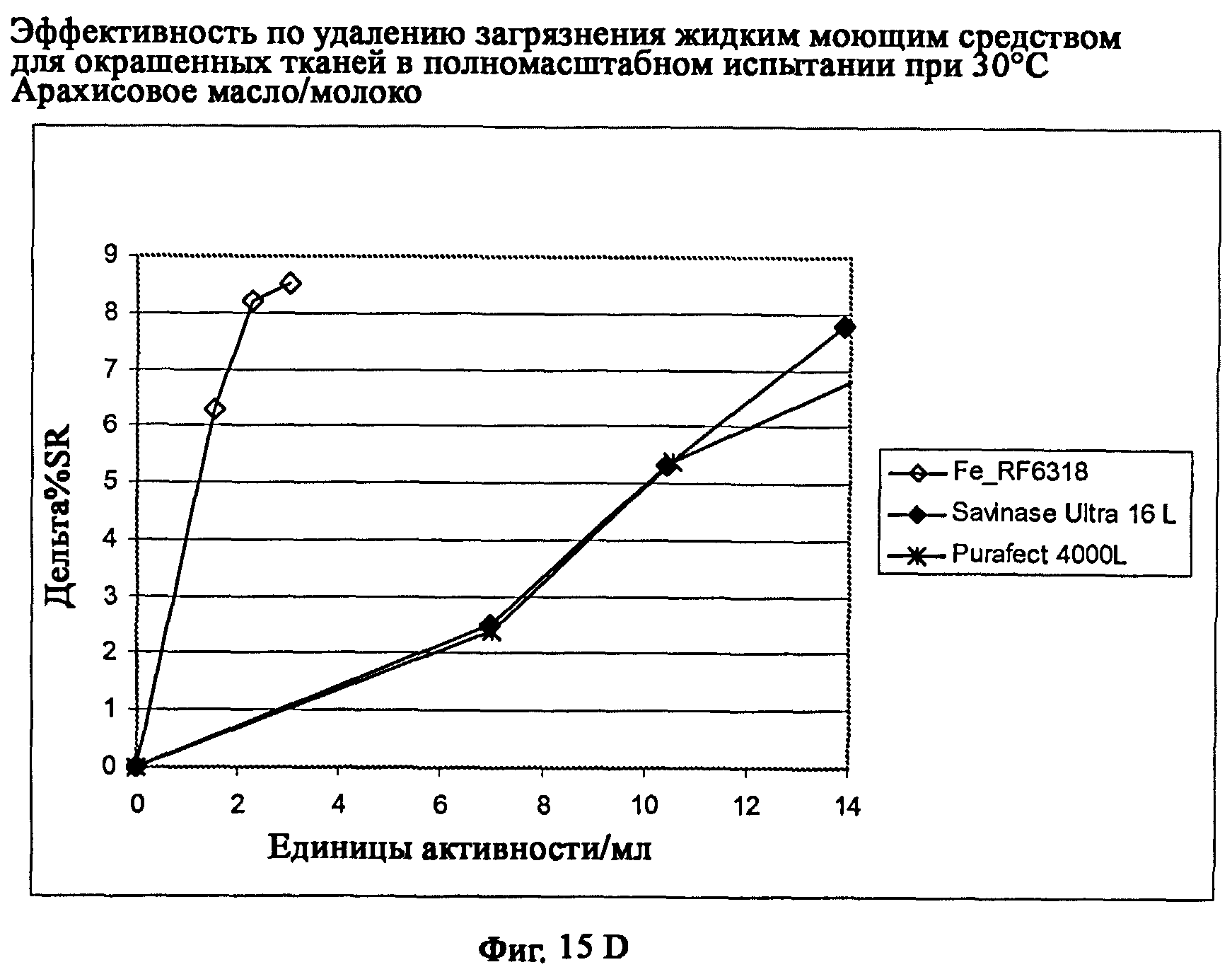
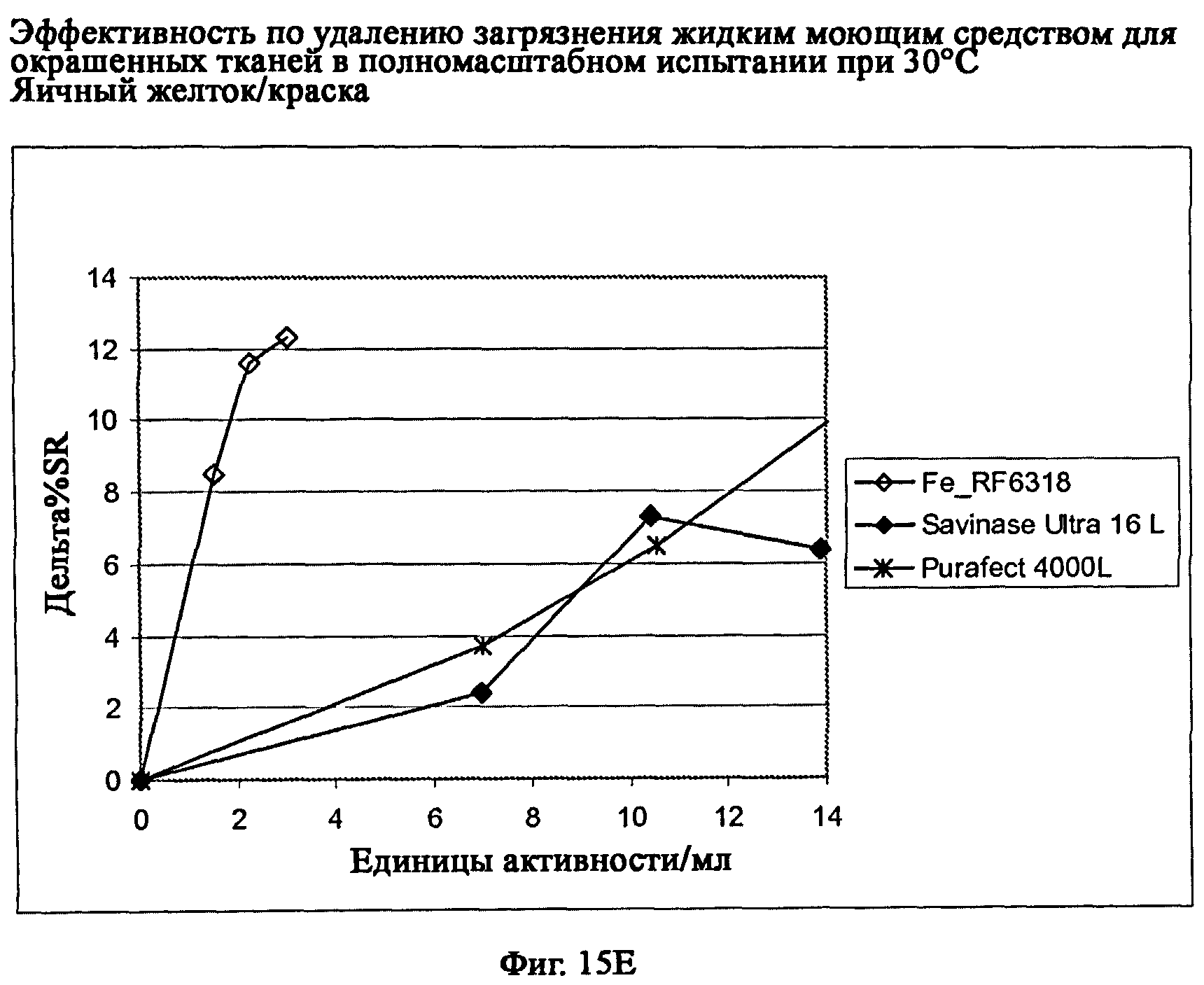
На фиг.15 описан эффект удаления загрязнителя жидким моющим средством для цветных тканей в полномасштабном испытании при 30°С.
На фиг.15А описано удаление загрязнителя кровь/молоко/чернила/хлопок (C-05-014/CFT).
На фиг.15В описано удаление загрязнителя кровь/молоко/чернила/ПЭ-хлопок (C-05-014/CFT).
На фиг.15С описано удаление загрязнителя шоколадное молоко/краска/хлопок (C-03-030/CFT).
На фиг.15D описано удаление загрязнителя арахисовое масло/молоко/хлопок (С-05-014/CFT).
На фиг.15Е описано удаление загрязнителя яичный желток/краска/хлопок (CS-38-010/CFT).
На фиг.16 описана эффективность рекомбинантного белка Fe_RF6318 на загрязнителе кровь/молоко/чернила (арт.117, ЕМРА) при температурах от 10°С до 60°С, рН 9, 60 мин. Для сравнения использовали коммерческие препараты Savinase Ultra® 16L (Novozymes A/S, Дания), Purafect® 4000L (Genencor Inc., США) и Properase® 4000E (Genencor, США). ΔL* (дельта L*) = насыщенность белого L* обработанной ферментом ткани - насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
На фиг.16А показана эффективность рекомбинантного белка Fe_RF6318 и коммерческих протеазных препаратов при 10°С.
На фиг.16В показана эффективность рекомбинантного белка Fe_RF6318 и коммерческих протеазных препаратов при 20°С.
На фиг.16С показана эффективность рекомбинантного белка Fe_RF6318 и коммерческих протеазных препаратов при 30°С.
На фиг.16D показана эффективность рекомбинантного белка Fe_RF6318 и коммерческих протеазных препаратов при 40°С.
На фиг.16Е показана эффективность рекомбинантного белка Fe_RF6318 и коммерческих протеазных препаратов при 50°С.
На фиг.16F показана эффективность рекомбинантного белка Fe_RF6318 и коммерческих протеазных препаратов при 60°С.
На фиг.17 показана эффективность рекомбинантного белка Fe_RF6318 на загрязнителе кровь/молоко/чернила (арт.117, ЕМРА) и с жидким моющим средством в концентрации 3,3 г/л при 10°С и 20°С. Для сравнения использовали коммерческие препараты Savinase® Ultra 16L, Purafect® 4000L и Properase® 4000 E. ΔL* (дельта L*) = насыщенность белого L* обработанной ферментом ткани - насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
На фиг.17А показана эффективность при 10°С.
На фиг.17В показана эффективность при 20°С.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID №1 Последовательность амино-концевого пептида №3792 из протеазы RF6318 Fusarium equiseti.
SEQ ID №2 Последовательность триптического пептида 1246.673 из протеазы RF6318 Fusarium equiseti.
SEQ ID №3 Последовательность триптического пептида 3341.633 из протеазы RF6318 Fusarium equiseti.
SEQ ID №4 Последовательность триптического пептида 1503.799 из протеазы RF6318 Fusarium equiseti.
SEQ ID №5 Последовательность олигонуклеотидного праймера PR087, полученного из амино-концевого пептида SEQ ID №1.
SEQ ID №6 Последовательность олигонуклеотидного праймера PR088, полученного из амино-концевого пептида SEQ ID №1.
SEQ ID №7 Последовательность олигонуклеотидного праймера PR089, полученного из пептида SEQ ID №4.
SEQ ID №8 Последовательность олигонуклеотидного праймера PR090, полученного из пептида SEQ ID №4.
SEQ ID №9 Последовательность ПЦР-фрагмента, полученного с помощью праймеров PR088 (SEQ ID №6) и PR089 (SEQ ID №7) и геномной ДНК RF6318 Fusarium equiseti в качестве субстрата.
SEQ ID №10 Нуклеотидная последовательность гена протеазы RF6318 Fusarium equiseti (Fe prtS8A).
SEQ ID №11 Выведенная аминокислотная последовательность протеазы RF6318 Fusarium equiseti (Fe_RF6318) полной длины, включающая аминокислоты с Met1 до Ala412.
SEQ ID №12 Нуклеотидная последовательность, кодирующая аминокислотную последовательность проферментной формы протеазы RF6318 Fusarium equiseti.
SEQ ID №13 Аминокислотная последовательность проферментной формы протеазы RF6318 Fusarium equiseti, включающая аминокислоты сА1а21 до Ala412 протеазы полной длины.
SEQ ID №14 Нуклеотидная последовательность, кодирующая аминокислотную последовательность зрелой формы протеазы RF6318 Fusarium equiseti.
SEQ ID №15 Аминокислотная последовательность зрелой формы протеазы RF6318 Fusarium equiseti, включающая аминокислоты сА1а124 до Ala412 фермента полной длины.
ДЕПОЗИТЫ
Fusarium equiseti RF6318 сдали на хранение в Centraalbureau Voor Schimmelcultures на Uppsalalaan 8, 3508 AD, Утрехт, Нидерланды, 7 апреля 2006 года и присвоили регистрационный номер CBS 119568.
Штамм E. coli RF7664, содержащий плазмиду pALK2521, сдали на хранение в Deutsche Sammlung von Mikroorganismen und Zeilkulturen GmbH (DSMZ), Inhoffenstrasse 7b, D-38124 Брауншвейг, Германия, 14 января 2009 года и присвоили регистрационный номер DSM 22171.
Штамм Е. coli RF7800, содержащий плазмиду pALK2529, сдали на хранение в Deutsche Sammlung von Mikroorganismen und Zeilkulturen GmbH (DSMZ), Inhoffenstrasse 7b, D-38124 Брауншвейг, Германия, 14 января 2009 года и присвоили регистрационный номер DSM 22172.
Подробное описание изобретения
Данное изобретение предлагает сериновую протеазу грибного происхождения, которая демонстрирует широкую субстратную специфичность, стабильность при широких диапазонах рН и имеет широкий температурный оптимум, т.е. хорошую эффективность как при низких, так и при умеренных температурах. Фермент идеально подходит для применения в моющих средствах, выдерживая окисление и хелатообразование и будучи эффективным при низких уровнях фермента в моющих растворах. В частности, сериновая протеаза активна при температурах до 10°С, предпочтительный диапазон составляет от 10°С до 60°С. Таким образом, данное изобретение предлагает альтернативную сериновую протеазу для применения в производстве моющих средств и в других применениях. Сериновая протеаза грибов может быть получена в высокопродуктивных грибах-хозяевах, и последующая обработка, например, путем отделения ферментативного бульона и мицелия, может быть легко выполнена.
Под «сериновой протеазой» или «сериновой эндопептидазой» или «сериновой эндопротеиназой» в связи с этим изобретением понимается фермент, классифицируемый как ЕС 3.4.21 по Номенклатуре Международного союза биохимии и молекулярной биологии. Сериновые протеазы имеются как в одноклеточных, так и в сложных организмах. На основании их структурного сходства сериновые протеазы были сгруппированы по меньшей мере в шесть родов (SA, SB, SC, SE, SF и SG; S обозначает сериновую протеазу), которые затем были подразделены на семейства с аналогичными аминокислотными последовательностями и трехмерными структурами (см., например, Интернет-страницу сериновых протеаз http://www.biochem.wustl.edu/~protease/, Отделение биохимии и молекулярной биофизики Вашингтонского Университета Медицины в Сент-Луисе, штат Миссури, США). Эти ферменты, гидролизующие или разрушающие белки, характеризуются наличием нуклеофильной сериновой группы в активном центре, а протеазы рода SA и рода SB также отличаются наличием важных остатков аспартата и гистидина, которые наряду с серином формируют каталитическую триаду.
Основные рода включают «химотрипсин-подобные» сериновые протеазы, в том числе химотрипсин, трипсин и эластазу (род SA), и «субтилизин-подобные» сериновые протеазы (род SB). Ферменты нацелены на различные области полипептидной цепи на основании боковых цепей аминокислотных остатков, примыкающих к участку расщепления. Сериновая протеаза данного изобретения относится к роду SB.
Охарактеризованные «субтилизин-подобные сериновые протеазы», или «субтилазы», как правило, имеют бактериальную природу. Этот класс протеаз, представленный различными Bacillus, такими как В. amyloliquifaciens, В. licheniformis и Б. subtilis (Rao et al., 1998), является специфическим для ароматических или гидрофобных остатков, таких как тирозин, фенилаланин и лейцин.
Термин «сериновая протеазная активность», используемый в изобретении, предназначен для обозначения гидролитической активности по отношению к белок-содержащим субстратам, например, казеину, гемоглобину, кератину и БСА. Способы анализа протеолитической активности хорошо известны в литературе и приведены, например, в Gupta et al. (2002).
Протеазы можно классифицировать с помощью группоспецифических ингибиторов. Разнородная группа «ингибиторов сериновых протеаз» включает синтетические химические ингибиторы и природные белковые ингибиторы. Одна группа природных ингибиторов представляет собой серпины (сокращенно от ингибиторов сериновых протеаз), такие как антитромбин и альфа-1-антитрипсин. Искусственные синтетические ингибиторы включают 3,4-дихлороизокумарин (3,4-DCI), диизопропилфторфосфат (DFP), фенилметилсульфонилфторид (PMSF) и тозил-L-лизин-хлорметилкетон (TLCK). Некоторые из сериновых протеаз ингибируются тиоловыми реагентами, такими как п-хлормеркурибензоат (РСМВ), из-за присутствия цистеинового остатка вблизи активного центра. Таким образом, активность сериновой протеазы может быть определена в анализе, основанном на расщеплении специфического субстрата, или в анализе с использованием какого-либо белок-содержащего субстрата с или без специфического ингибитора сериновых протеаз в соответствующих условиях.
Сериновые протеазы, как правило, активны в нейтральной или щелочной рН с оптимумом рН между 7 и 11 и имеют широкую субстратную специфичность. Под «щелочными сериновыми протеазами» понимаются ферменты, активные и стабильные при рН от 9 до 11 или даже при рН от 10 до 12,5 (Shimogaki et al., 1991) и с изоэлектрической точкой примерно рН 9. Они представляют наибольшую подгруппу коммерческих сериновых протеаз. Молекулярные массы щелочных сериновых протеаз находятся в диапазоне между 15 и 35 кДа. Температурные оптимумы природных сериновых протеаз составляют примерно 60°С (Rao et al., 1998).
Штаммы микроорганизмов, способные проявлять протеазную активность, могут быть проверены, и активность может быть определена на различных субстратах. Выбранные штаммы можно культивировать на подходящей среде. После того, как было получено достаточное количество интересующей сериновой протеазы, фермент может быть выделен или очищен, и его свойства могут быть более тщательно охарактеризованы. Альтернативно, гены, кодирующие сериновые протеазы в различных организмах, могут быть выделены, и аминокислотную последовательность, кодируемую генами, можно сравнить с аминокислотными последовательностями выделенной сериновой протеазы и охарактеризовать в Примерах данного документа.
Полученные протеазные ферменты, в частности, сериновые протеазы, могут быть очищены с помощью традиционных способов химии ферментов, таких как приготовление солей, ультрафильтрация, ионообменная хроматография, аффинная хроматография, гель-фильтрация и хроматография гидрофобных взаимодействий. Очистку можно контролировать с помощью определения белка, анализов активности ферментов и электрофореза в SDS-полиакриламидном геле. Может быть определена ферментативная активность и стабильность очищенного фермента при различных значениях температуры и рН, а также молекулярная масса и изоэлектрическая точка.
Очистка предпочтительной сериновой протеазы данного изобретения была продемонстрирована в примере 16. Профильтрованный культуральный супернатант проводили через колонку Q Sepharose FF. Фракцию, прошедшую через колонку, проводили через фенильную колонку Sepharose HP, и белки элюировали с линейным уменьшением градиента соли. Фракции, демонстрирующие протеазную активность, объединяли, концентрировали и проводили через колонку Superdex 75 10/300 GL. После анализа активности проводили очистку на казеине, меченном резоруфином, как описано в примере 16. Естественно, можно выделить фермент данного изобретения с помощью других известных способов очистки вместо или в дополнение к способам, описанным в данном документе. Рекомбинантную сериновую протеазу очищали, как описано в примере 5, и использовали для характеризации рН и температурного профилей.
Молекулярную массу очищенной сериновой протеазы можно определить с помощью масс-спектрометрии или SDS-PAGE в соответствии с Laemmli (1970). Молекулярную массу также можно предсказать по аминокислотной последовательности фермента. Зрелая сериновая протеаза или зрелый фермент сериновая протеаза, как правило, имеет молекулярную массу от 20 до 35 кДа, как правило, примерно от 25 до 30 кДа (Rao et al., 1998).
Сериновые протеазы синтезируются в виде неактивных «зимогенных предшественников», или «зимогенов», в форме препроферментов, которые активируются путем удаления сигнальной последовательности (секреторного сигнального пептида, или препептида) и пропоследовательности (пропептида) для получения активной зрелой формы фермента (Chen и Inouye, 2008). Этот процесс активации включает действие протеаз и может возникнуть в результате ограниченного саморасщепления или аутокаталитического процессинга сериновой протеазы. Пропоследовательность может быть отщеплена, например, во время посттрансляционной фазы продукции или в отработанной культуральной среде или во время хранения культуральной среды или ферментного препарата. Активация профермента также может быть достигнута путем добавления протеолитического фермента, способного превращать неактивный профермент в активный зрелый фермент, в культуральную среду, где культивируется организм-хозяин, или путем добавления протеолитического фермента в культуральный супернатант после процесса культивирования. Сокращение фермента также может быть достигнуто, например, путем усечения гена, кодирующего полипептид, до трансформации им продуцирующего хозяина.
Термин «зрелая» означает форму фермента, которая после удаления сигнальной последовательности и пропептида включает аминокислоты, необходимые для ферментативной или каталитической активности. В мицелиальных грибах - это нативная форма, которая секретируется в культуральную среду.
Температурный оптимум сериновой протеазы может быть определен в соответствующем буфере при различных температурах с помощью казеина в качестве субстрата, как описано в примерах 1b, 5 или 14, или с помощью других субстратов и буферных систем, описанных в литературе (например, Gupta et al., 2002). Определение рН-оптимума может быть проведено в подходящем буфере при различных значениях рН по активности на белковом субстрате.
Активность протеазы, как правило, основана на разрушении растворимых субстратов. В моющих средствах протеазы должны работать на веществах, которые по меньшей мере частично нерастворимы. Таким образом, важным параметром для протеазы моющего средства является способность адсорбировать и гидролизовать эти нерастворимые фрагменты.
Другим важным параметром для выбора протеаз моющих средств является их изоэлектрическая точка, или значение pI. Протеазы моющих средств действуют наилучшим образом при рН моющего раствора, в котором она работает, примерно равном значению pI фермента, pI может быть определена с помощью изоэлектрофокусировки в геле с иммобилизованным градиентом рН, состоящим из полиакриламида, крахмала или агарозы, или путем оценки pI на основе аминокислотной последовательности, например, с помощью инструмента pI/MW на сервере ExPASy (http://expasy.org/tools/pi_tool.html: Gasteiger et al., 2003).
N-конец очищенной протеазы, а также внутренние пептиды, можно секвенировать в соответствии с химией деградации Эдмана (Edman and Begg, 1967), как описано в примере 2, или с помощью других способов, описанных в литературе.
Фермент сериновую протеазу изобретения можно получить из любого организма, включая бактерии, археи, грибы, дрожжи и даже высшие эукариоты, такие как растения. Предпочтительно указанный фермент получен из грибов, в том числе мицелиальных грибов и дрожжей, например из рода, выбранного из группы, включающей Fusarium. Щелочные протеазы грибов выгодны по сравнению с бактериальными протеазами из-за легкости последующей обработки для получения безмикробного фермента или ферментной композиции. Мицелий может быть легко удален с помощью фильтрационных методик перед очисткой фермента.
Данное изобретение относится к сериновой протеазе грибов, которая обладает хорошей эффективностью в присутствии моющих средств с широко варьирующими свойствами, в широком температурном диапазоне, т.е. от низкой до умеренной температуры, например от 10°С до 60°С.
В данном изобретении хорошая эффективность в присутствии моющих средств означает, что фермент, в данном случае сериновая протеаза грибов изобретения, функционирует в более низких температурных диапазонах, чем многие коммерческие субтилизины, доступные в настоящее время в продаже. Другими словами, хорошая эффективность означает, что фермент способен разрушать или удалять белковые загрязнители или материалы в низких и умеренных температурных диапазонах, но особенно в более низких температурных диапазонах, чем нынешние коммерческие продукты, например, коммерческий ферментный продукт Purafect® 4000L (Genencor Inc., США).
Сериновая протеаза грибов изобретения функционирует в низких температурных режимах. Например, при изменении рН, выборе моющих средств с подходящими свойствами, включении защищающих ферменты агентов и управлении условиями стирки активность сериновой протеазы изобретения может быть сохранена при температуре до 10°С. Таким образом, сериновая протеаза изобретения в зависимости от условий стирки и вспомогательных ингредиентов и добавок в моющих средствах используется, в частности, при температуре не выше 50°С. Фермент функционирует также при температуре не выше 45°С, при температуре не выше 40°С, при температуре не выше 35°С или при температуре не выше 30°С.
В присутствии моющего средства сериновая протеаза грибов изобретения функционирует, как определено выше, при температуре от 10°С до 60°С. В примерах с 6 по 13 описаны сравнительные эксперименты, а фиг.7-17 доказывают, что эффективность сериновой протеазы грибов Fe_RF6318 в изменяющихся условиях и при той или иной обработке, на множестве различных загрязнителей на различных текстильных материалах, измеряемая как дельта L* или дельта % SR, на сегодняшний день выше, чем эффективность коммерческих продуктов Savinase® Ultra 16L (Novozymes A/S, Дания), Purafect® 4000L (Genencor Inc., США) и Properase® 4000E (Genencor Inc., США). В частности, эффект удаления загрязнителя указанной сериновой протеазы грибов Fe_RF6318 в диапазонах низкой и умеренной температуры, например от 10°С до 60°С, заметно выше, чем у Savinase® Ultra 16L и Purafect® 4000L. Она также имеет более высокую способность удаления загрязнителя в диапазоне от 30°С до 60°С по сравнению с Properase® 4000E.
Из указанных экспериментальных результатов можно сделать вывод, что сериновая протеаза грибов изобретения способна удовлетворить широко варьирущие требования пользователей моющих средств, промышленности моющих средств и промышленности стиральных машин, и что она хорошо подходит к требованиям будущих нормативных документов и привычкам клиентов.
В соответствии с предпочтительным воплощением изобретения фермент сериновая протеаза грибов является полипептидом, проявляющим активность сериновой протеазы и содержащим зрелый фермент Fe_RF6318 с аминокислотной последовательностью SEQ ID №15 или с аминокислотной последовательностью, по меньшей мере на 86% идентичной аминокислотной последовательности SEQ ID №15, или меньшей мере на 86% идентичной аминокислотной последовательности SEQ ID №11. Предпочтительные ферменты имеют по меньшей мере 86%, предпочтительно по меньшей мере 87%, более предпочтительно по меньшей мере 88%, еще более предпочтительно по меньшей мере 90% идентичность. Еще более предпочтительно аминокислотные последовательности имеют по меньшей мере 92% или по меньшей мере 94% или 96%, более предпочтительно по меньшей мере 98%, наиболее предпочтительно 99% идентичность с аминокислотной последовательностью SEQ ID №15. Идентичность этих двух ферментов сравнивают в пределах последовательностей соответствующих областей, например, в зрелой области или области полной длины сериновой протеазы.
Сериновая протеаза данного изобретения отмечена как Fe_RF6318, выделенная сериновая протеаза, полученная из Fusarium equiseti, и является членом рода SB, семейства 8 сериновых эндопротеиназ.
Под термином «идентичность» в данном документе понимается идентичность двух аминокислотных последовательностей, сравненных друг с другом в пределах соответствующих областей последовательностей, имеющих приблизительно одинаковое количество аминокислот. Например, можно сравнивать идентичность зрелой последовательности или последовательности полной длины двух аминокислотных последовательностей. Аминокислотные последовательности двух сравниваемых молекул могут отличаться в одной или более позициях, которые, тем не менее, не изменяют биологическую функцию или структуру молекул. Такие изменения могут произойти естественно из-за разных организмов-хозяев или мутаций в аминокислотной последовательности, либо они могут быть получены путем специфического мутагенеза. Изменения могут возникнуть в результате удаления, замены, вставки, добавления или комбинации одной или более позиций в аминокислотной последовательности. Идентичность последовательностей измеряли с помощью выравнивания ClustalW (например, в www.ebi.ac.uk/Tools/Clustalw). Используемая матрица была следующей: BLOSUM, штраф на открытие делеции: 10, штраф на удлинение делеции: 0,5.
Предпочтительно сериновую протеазу грибов получают из Fusarium, более предпочтительно из Fusarium equiseti. В соответствии с наиболее предпочтительным воплощением сериновую протеазу изобретения можно получить из штамма, сданного на хранение в Centraalbureau voor Schimmelcultures под регистрационным номером CBS 119568.
Одним предпочтительным воплощением изобретения является фермент сериновая протеаза грибов с активностью сериновой протеазы и аминокислотной последовательностью зрелого фермента Fe_RF6318, определенной в SEQ ID №15. Зрелый фермент теряет сигнальную последовательность, или препептид, и пропоследовательность, или пропептид. Зрелая сериновая протеаза изобретения включает аминокислоты с Ala124 до Ala412 протеазы полной длины, охарактеризованной в SEQ ID №11. Таким образом, в рамки изобретения также входит фермент Fe_RF6318 полной длины, имеющий SEQ ID №11, включающий сигнальную последовательность (препептид) и пропептид и зрелый фермент, а также проферментная форма, теряющая сигнальную последовательность (препептид), тем самым имеющая SEQ ID №13.
Данное изобретение относится к ферменту сериновой протеазе грибов, зрелая форма которого имеет молекулярную массу или молекулярный вес от 20 до 35 кДа, предпочтительно от 25 до 33 кДа, более предпочтительно от 28 до 30 кДа. Наиболее предпочтительным MW является предсказанный молекулярный вес Fe_RF6318 29 кДа для зрелого полипептида, полученный с помощью инструмента Compute pI/MW на сервере ExPASy (Gasteiger et al., 2003).
Фермент изобретения является эффективным в разрушении белкового материала в широком диапазоне температур. Оптимальная температура фермента составляет от 30°С до 70°С (примерно 20% от максимальной активности), предпочтительно от 40°С до 60°С (по меньшей мере примерно 40% от максимальной активности), и более предпочтительно от 50°С до 60°С (по меньшей мере 70% от максимальной активности), наиболее предпочтительно при 60°С (максимальная активность, Fe_RF6318) при измерении с рН 9 в 15-минутной реакции с казеином в качестве субстрата, как описано в примере 5.
В соответствии с одним из предпочтительных воплощений изобретения фермент сериновая протеаза грибов имеет оптимум рН по меньшей мере от рН 6 до рН 11, демонстрируя более 40% от максимальной активности при рН 10 при 50°С в 15-минутной реакции с казеином в качестве субстрата, как описано в примере 5. В частности, оптимум рН находится между рН 6 и рН 10 (примерно 60% от максимальной активности), и более предпочтительно от рН 9 до рН 10 (примерно 80% от максимальной активности), а наиболее предпочтительно при рН 10 при 50°С.
Сериновая протеаза грибов изобретения имеет «хорошую эффективность в присутствии моющего средства», т.е. способна разрушать или удалять белковые загрязнители или материал в присутствии моющего средства в низких температурных диапазонах, в частности в более низких температурных диапазонах, чем нынешние коммерческие продукты, например коммерческий ферментный продукт Purafect® 4000L (Genencor Inc., США). В присутствии моющего средства фермент изобретения функционирует между 10°С и 60°С, предпочтительно при температуре не выше 50°С. Фермент Fe_RF6318 также функционирует при температуре не выше 45°С, при температуре не выше 40°С, при температуре не выше 35°С или при температуре не выше 30°С.
Фермент сериновая протеаза изобретения имеет pI, которая, как рассчитано исходя из выведенной аминокислотной последовательности, находится между pI 9 и pI 9,5, предпочтительно между pI 9,1 и pI 9,4. Рассчитанная pI фермента изобретения Fe_RF6318 составляет pI 9,3.
Олигонуклеотиды, синтезированные на аминокислотной последовательности N-концевых или триптических пептидов очищенного фермента или ПЦР-продукта, полученного с помощью указанных выше олигонуклеотидов, могут быть использованы в качестве зондов в выделении кДНК или геномного гена, кодирующего сериновую протеазу изобретения. Зонд также может быть разработан на основе известных нуклеотидных или аминокислотных последовательностей гомологичных сериновых протеаз. Клоны сериновых протеаз также могут быть проверены на основе активности на чашках, содержащих специфический субстрат для фермента, или с помощью антител, специфичных для сериновой протеазы.
В соответствии с предпочтительным воплощением фермент сериновая протеаза грибов кодируется выделенной полинуклеотидной последовательностью, которая гибридизуется в жестких условиях с последовательностью полинуклеотида или зонда, включенной в плазмиду pALK2521, содержащую нуклеотидную последовательность SEQ ID №9 в E. coli RF7664, сданной на хранение в Deutsche Sammlung von Mikroorganismen und Zeilkulturen (DSMZ) под регистрационным номером DSM22171.
В данном изобретении ген Fe prt8A был выделен с зондом, полученным с помощью ПЦР с использованием жестких условий гибридизации, как описано в примере 3d. В выделении кДНК или геномной ДНК организма-хозяина могут быть использованы стандартные способы молекулярной биологии, например способы, описанные в справочниках по молекулярной биологии, таких как Sambrook and Russell, 2001.
Гибридизация с ДНК-зондом, таким как, например, SEQ ID №9, состоящим более чем из 100-200 нуклеотидов, как правило, осуществляется в условиях «высокой жесткости», т.е. гибридизация проводится при температуре, которая на 20-25°С ниже расчетной температуры плавления (Tm) идеального гибрида; Tm рассчитывается в соответствии с Bolton и McCarthy (1962). Обычно предварительная гибридизация и гибридизация проводятся по меньшей мере при 65°С в 6×SSC (или 6×SSPE), 5x реагенте Денхардта, 0,5% (вес/объем) SDS, 100 мкг/мл денатурированной фрагментированной ДНК спермы лосося. Добавление 50% формамида снижает предварительную гибридизацию и гибридизацию до температуры 42°С. Стирку проводят при низком содержании соли, например в 2×SSC-0,5% (вес/объем) SDS, в течение 15 минут при комнатной температуре (RT), а затем в 2×SSC-0,1% (вес/объем) SDS при комнатной температуре, и, наконец, в 0,1×SSC 0,1% (вес/объем) SDS по меньшей мере при 65°С.
В соответствии с одним из предпочтительных воплощений фермент сериновая протеаза грибов изобретения кодируется выделенной нуклеиновокислотной молекулой, которая кодирует полипептид, содержащий аминокислотную последовательность, охарактеризованную в SEQ ID №15, или полипептид, имеющий по меньшей мере 86% от аминокислотной последовательности SEQ ID №15 или по меньшей мере 86% от аминокислотной последовательности SEQ ID №11. Предпочтительные ферменты демонстрируют по меньшей мере 86%, предпочтительно по меньшей мере 87%, более предпочтительно по меньшей мере 88%, еще более предпочтительно по меньшей мере 90% идентичность. Еще более предпочтительно аминокислотные последовательности демонстрируют по меньшей мере 92% или по меньшей мере 94% или 96%, более предпочтительно по меньшей мере 98%, наиболее предпочтительно 99% идентичность с аминокислотной последовательностью SEQ ID №15. Идентичность этих двух ферментов сравнивают в пределах последовательностей соответствующих областей, например, в зрелой области или области полной длины сериновой протеазы.
Таким образом, в рамки изобретения входит полипептидная последовательность, которая кодируется нуклеиновокислотной молекулой, кодирующей аминокислотную последовательность сериновой протеазы изобретения полной длины, которая включает препептид (сигнальную последовательность) и пропептид в дополнение к зрелой форме фермента и которая является аминокислотной последовательностью, охарактеризованной в SEQ ID №11.
Кроме того, в рамки изобретения входит полипептидная последовательность, которая кодируется нуклеиновокислотной молекулой, кодирующей пропептид фермента сериновой протеазы изобретения, включающий пропептид в дополнение к зрелой форме фермента, где аминокислотная последовательность охарактеризована в SEQ ID №13.
Одним предпочтительным воплощением изобретения является фермент сериновая протеаза грибов, кодируемый выделенной нуклеиновокислотной молекулой, которая состоит из нуклеотидной последовательности, кодирующей зрелую форму сериновой протеазы Fe_RF6318, имеющую SEQ ID №15.
В соответствии с одним из предпочтительных воплощений фермент изобретения сериновая протеаза грибов кодируется выделенной нуклеиновокислотной молекулой, которая состоит из нуклеотидной последовательности SEQ ID №14, кодирующей фермент зрелой формы Fe_RF6318(SEQID№15).
Таким образом, в рамки изобретения входит полипептид, кодируемый нуклеиновокислотной молекулой, имеющей нуклеотидную последовательность SEQ ID №10, состоящей из «кодирующей последовательности» фермента. Выражение «кодирующая последовательность» означает нуклеотидную последовательность, которая начинается со старт-кодона трансляции (ATG) и заканчивается стоп-кодоном трансляции (ТАА, TAG или TGA). Транслированный полипептид полной длины обычно начинается с метионина и включает интронные области.
Кроме того, в рамки изобретения входит фермент сериновая протеаза грибов, кодируемый нуклеиновокислотной молекулой, содержащей нуклеотидную последовательность SEQ ID №12, которая кодирует проферментную форму Fe_RF6318.
В соответствии с другим предпочтительным воплощением изобретения сериновая протеаза грибов кодируется полинуклеотидной последовательностью, включенной в pALK2529, сохраненной в E.coli RF7800 под регистрационным номером DSM22172.
Одним из воплощений изобретения является фермент сериновая протеаза, полученный из рекомбинантного вектора экспрессии, содержащего нуклеиновокислотную молекулу, которая кодирует фермент сериновую протеазу грибов, охарактеризованную выше, функционально связанную с регуляторными последовательностями, способными направлять экспрессию указанного гена, кодирующего сериновую протеазу, в подходящем хозяине. Конструкция указанного рекомбинантного вектора экспрессии и применение указанного вектора более подробно описаны в примере 4.
Подходящими хозяевами для продукции фермента сериновой протеазы грибов являются гомологичные или гетерологичные хозяева, такие как микробные хозяева, в том числе бактерии, дрожжи и грибы. Нитчатые грибы, такие как Trichoderma, Aspergillus, Fusarium, Humicola, Chrysosporium Neurospora, Rhizopus, Penicillium и Mortiriella, являются предпочтительными продуцирующими хозяевами из-за легкости последующей обработки и восстановления ферментного продукта. Подходящие хозяева включают такие виды, как типы штаммов Т. reesei, A. niger, A oryzae, A. sojae, A. awamori или A. japonicus, F. venenatum или F. oxysporum, H. insolens или H. lanuginosa, N. crassa и С.lucknowense, некоторые из которых перечислены в качестве продуцирующих фермент организмов-хозяев, например, в списке коммерческих ферментов AMFEP 2007 (http://www.amfep.org/list.html). Более предпочтительно фермент продуцируется в нитчатых грибах-хозяевах рода Trichoderma или Aspergillus, таких как Т. reesei или A. niger, A oryzae или А. awamori. В соответствии с наиболее предпочтительным воплощением изобретения фермент сериновая протеаза грибов продуцируется в Т. reesei.
Данное изобретение также относится к выделенной нуклеиновокислотной молекуле, кодирующей фермент сериновую протеазу грибов, выбранной из группы, включающей:
(а) нуклеиновокислотную молекулу, кодирующую полипептид, имеющий активность сериновой протеазы и включающий аминокислотную последовательность, приведенную в SEQ ID №15;
(б) нуклеиновокислотную молекулу, кодирующую полипептид, имеющий активность сериновой протеазы и по меньшей мере 86% от SEQ ID №15;
(в) нуклеиновокислотную молекулу, содержащую последовательность, кодирующую нуклеотидную последовательность, приведенную в SEQ ID №10;
(г) нуклеиновокислотную молекулу, содержащую последовательность, кодирующую полинуклеотидную последовательность, содержащуюся в DSM 22171 или DSM22172;
(д) нуклеиновокислотную молекулу, кодирующую последовательность, которая отличается от кодирующей последовательности нуклеиновокислотной молекулы любого из пп. с (в) по (г) из-за вырожденности генетического кода; а также
(е) нуклеиновокислотную молекулу, которая гибридизуется в жестких условиях с нуклеиновокислотной молекулой, содержащейся в DSM 22171, и которая кодирует полипептид, имеющий активность сериновой протеазы и аминокислотную последовательность, которая демонстрирует по меньшей мере 86% идентичность с аминокислотной последовательностью, приведенной SEQ ID №15.
Нуклеиновокислотная молекула изобретения может быть РНК или ДНК, где ДНК может быть геномной ДНК или кДНК.
В выделении и ферментной обработке полинуклеотидной последовательности, кодирующей сериновую протеазу грибов изобретения, могут быть использованы стандартные способы молекулярной биологии, в том числе выделение геномной и плазмидной ДНК, расщепление ДНК для создания фрагментов ДНК, секвенирование, трансформация E. coli и др. Основные способы описаны в стандартных справочниках по молекулярной биологии, например в Sambrook and Russell, 2001.
Выделение гена Fe prtS8A, кодирующего полипептид Fe_RF6318, описано в примере 3. Вкратце, ПЦР-фрагмент длиной 866 п.о., полученный с помощью последовательностей вырожденных олигонуклеотидных праймеров (SEQ ID №6 и SEQ ID №7), использовали для выделения Fe prt8A из Fusarium equiseti RF6318 в векторе pBluescript II KS+. Ген Fe prtSSA Fusarium equiseti полной длины был включен в плазмиду pALK2529, сданную на хранение в E. coli в коллекцию культур DSMZ под регистрационным номером DSM 22172. Выведенную аминокислотную последовательность сериновой протеазы анализировали по последовательности ДНК.
Нуклеотидная последовательность сериновой протеазы Fe prtS8A Fusarium equiseti (SEQ ID №10) и выведенная последовательность (SEQ ID №11) представлены на фиг.1А-В. Длина гена составляет 1303 п.о. (включая стоп-кодон). Было обнаружено, что один предполагаемый интрон имеет длину 64 п.о. Выведенная белковая последовательность состоит из 412 аминокислот, включая предсказанную сигнальную последовательность из 20 аминокислот (SignalP V3.0; Nielsen et al., 1997 и Nielsen and Krogh, 1998) и пропептид с Ala21 до Arg123. Очищенные пептиды из Fe_RF6318 дикого типа соответствовали выведенной аминокислотной последовательности, указывая, что клонированный ген кодирует протеазу, очищенную из хозяина Fusarium equiseti RF6318, сохраненного в коллекции культур CBS под регистрационным номером CBS 119568. Предсказанная молекулярная масса составляла 29 кДа для зрелого полипептида, а предсказанная pI составляла 9,30. Эти предсказания были сделаны с помощью инструмента Compute pI/MW на сервере ExPASy (Gasteiger et al., 2003). Выведенная аминокислотная последовательность содержит два возможных сайта N-гликозилирования (Asn77 и Asn255), но в соответствии с CBS Server NetNGlyc V1.0 только один сайт, Asn77 (расположенный в пропоследовательности), является вероятным. Гомологии для опубликованных последовательностей протеаз искали с помощью программы BLAST версии 2.2.9 на NCBI (Национальный центр биотехнологической информации) (Altschul et al., 1990). Значения идентичности зрелой последовательности Fe_RF6318 с соответствующими областями гомологичных последовательностей, полученные с помощью выравнивания ClustalW (матрица: BLOSUM, штраф на открытие делеции: 10, штраф на удлинение делеции: 0,5 (например, в www.ebi.ac.uk/Tools/ClustaIw), приведены в таблице 3.
Сериновая протеаза Fe_RF6318 данного изобретения демонстрировала наиболее высокую гомологию с гипотетическим белком РН-1 Gibberella zeae, локусом FG03315.1 (регистрационный №EMBL XPJ383491, не опубликован), с сериновой эндопептидазой СЕСТ 2413 Т. harzianum (регистрационный №EMBL CAL25508, Suarez et al., 2007) и с предшественником щелочной протеиназы S08.066 Т. atroviride, ALP (регистрационный №EMBL M87516, Geremia et al., 1993), последний раскрыт как аминокислотная последовательность SEQ ID №313 в US 60/818910 (Catalyst Bioscience Inc.). Идентичность с гипотетическим белком G. zeae в ферменте полной длины составляла 85%. При выравнивании зрелого полипептида без сигнальной последовательности и пропептида идентичность составляла 85%. Идентичность с сериновой эндопептидазой СЕСТ 2413 Т. harzianum составляла 70% (фермент полной длины) и 75% (зрелый фермент). Идентичность с ALP Т. atroviride составляла 69% (фермент полной длины) и 74% (зрелый фермент).
Таким образом, в рамки данного изобретения входит выделенная полинуклеотидная последовательность или выделенная нуклеиновокислотная молекула, которая кодирует фермент сериновую протеазу грибов или полипептид, включающий аминокислотную последовательность зрелой формы фермента Fe_RF6318, охарактеризованную в SEQ ID №15, т.е. аминокислоты с Ala124 до Ala412 сериновой протеазы полной длины SEQ ID №11.
Кроме того, в рамки данного изобретения входят нуклеиновокислотные молекулы, которые кодируют фрагмент полипептида сериновой протеазы грибов, где фрагмент имеет активность сериновой протеазы и по меньшей мере 86% идентичность с аминокислотной последовательностью SEQ ID: №15 или по меньшей мере 86% идентичность с аминокислотной последовательностью SEQ ID:
№11. Предпочтительные ферменты демонстрируют по меньшей мере 86%, предпочтительно по меньшей мере 87%, более предпочтительно по меньшей мере 88%, еще более предпочтительно по меньшей мере 90% идентичность. Еще более предпочтительно аминокислотные последовательности демонстрируют по меньшей мере 92% или по меньшей мере 94% или 96%, более предпочтительно по меньшей мере 98%, наиболее предпочтительно 99% идентичность с аминокислотной последовательностью SEQ ID №15. Идентичности этих двух ферментов сравнивали в пределах соответствующих областей последовательности, например, в области полной длины или зрелой области сериновой протеазы.
Нуклеиновокислотная молекула предпочтительно является молекулой, содержащей кодирующую последовательность, показанную в SEQ ID №10, которая кодирует полную форму фермента сериновой протеазы грибов данного изобретения.
Выделенная нуклеиновокислотная молекула изобретения может быть молекулой, содержащей кодирующую последовательность полинуклеотидной последовательности, содержащейся в DSM 22171, или DSM 22172. DSM 22171 несет нуклеотидную последовательность ПЦР-фрагмента (SEQ ID №9), используемую в клонировании гена Fe prtS8A полной длины. DSM 22172 несет нуклеотидную последовательность гена Fe prtS8A полной длины (SEQ ID №10).
Нуклеиновокислотная молекула изобретения также может быть аналогом нуклеотидной последовательности, охарактеризованной выше. Под «вырожденными» понимаются аналоги нуклеотидной последовательности, которые отличаются одним или более нуклеотидом или кодоном, но которые кодируют рекомбинантную протеазу изобретения.
Нуклеиновокислотная молекула также может быть нуклеиновокислотной молекулой, которая гибридизуется в жестких условиях с ПЦР-зондом, содержащимся в плазмиде pALK2521, сохраненной в Е. coli под регистрационным номером DSM 22171, и кодирует полипептид, имеющий активность сериновой протеазы и аминокислотную последовательность, которая на протяжении соответствующей области последовательности демонстрирует по меньшей мере 86% идентичность с аминокислотной последовательностью, указанной в SEQ ID №15. Гибридизирующаяся ДНК может происходить из гриба, принадлежащего к видам Fusarium, либо она может происходить из других видов грибов.
Таким образом, в рамки данного изобретения входит выделенная Нуклеиновокислотная молекула, содержащая нуклеотидную последовательность, приведенную в SEQ ID №10, SEQ ID №12 или SEQ ID №14, и ее аналоги.
Данное изобретение также относится к рекомбинантному экспрессионному вектору или рекомбинантной экспрессионной конструкции, которая может использоваться для размножения или экспрессии нуклеиновокислотной последовательности или гена, кодирующего выбранную сериновую протеазу, в подходящем прокариотическом или эукариотическом хозяине. Рекомбинантный экспрессионный вектор включает ДНК или нуклеиновокислотные последовательности, которые способствуют или направляют экспрессию и секрецию последовательности, кодирующей сериновую протеазу, в подходящем хозяине, например промотеры, энхансеры, терминаторы (в т.ч. сигналы терминации транскрипции и трансляции), и сигнальные последовательности, функционально связанные с полинуклеотидной последовательностью, кодирующей указанную сериновую протеазу. Экспрессионный вектор также может содержать маркерные гены для селекции трансформированных штаммов, либо маркер для селекции можно ввести в хозяина в другой векторной конструкции путем котрансформации. Указанные регуляторные последовательности могут быть гомологичны или гетерологичны продуцирующему организму, либо они могут происходить из организма, из которого выделен ген, кодирующий сериновую протеазу.
Примерами промоторов для экспрессии сериновой протеазы изобретения в нитчатых грибах-хозяевах являются промотор ТАКА-амилазы, щелочной протеазы ALP и триозофосфатизомеразы A. oryzae, липазы Rhizopus miehei, глюкоамилазы (glaA) Aspergillus niger или A. awamori, трипсиноподобной протеазы Fusarium oxysporum, промотор целлобиогидролазы I Chrysosporium lucknowense, целлобиогидролазы I Trichoderma reesei (Cel7A) и т.д.
У дрожжей, например, промоторы энолазы (ENO-1), галактокиназы (GAL1), алкогольдегидрогеназы (ADH2) и 3-фосфоглицераткиназы S. cerevisiae могут быть использованы для обеспечения экспрессии.
Примерами промоторных последовательностей для направления транскрипции сериновой протеазы изобретения в бактериальном хозяине являются промотор lac-оперона Escherichia coli, промотор агаразы dagA Streptomyces coelicolor, промотор гена альфа-амилазы б. licheniformis (amyL), промотор гена мальтогенной амилазы В. stearothermophilus (amyM), промоторы генов xylA и xylB В. sublitis и т.д.
Подходящие терминаторы включают терминаторы этих вышеупомянутых генов или любые другие охарактеризованные терминаторные последовательности.
Подходящие маркеры для трансформации или селекции включают те, которые дополняют дефект хозяина, например, гены dal от В. subtilis или В. licheniformis или amdS и niaD от Aspergillus. Селекция также может быть основана на присвоении маркера устойчивости к антибиотикам, таким как ампициллин, канамицин, левомицетин, тетрациклин, плеомицин или гигромицин.
Внеклеточная секреция сериновой протеазы изобретения является предпочтительной. Таким образом, рекомбинантный вектор содержит последовательности, облегчающие секрецию в выбранном хозяине. Сигнальная последовательность сериновой протеазы изобретения или препоследовательность или препептид могут быть включены в рекомбинантный экспрессионный вектор, либо природная сигнальная последовательность может быть заменена на другую сигнальную последовательность, способную облегчать секрецию в выбранном хозяине. Таким образом, выбранная сигнальная последовательность может быть гомологичной или гетерологичной принимающему хозяину.
Примеры подходящих сигнальных последовательностей принадлежат грибам или дрожжевым организмам, например, сигнальные последовательности из хорошо экспрессированных генов. Такие сигнальные последовательности хорошо известны из литературы.
Рекомбинантный вектор также может содержать последовательности, облегчающие интеграцию вектора в хромосомную ДНК хозяина для получения стабильной экспрессии.
Протеаза изобретения Fe_RF6318 была экспрессирована со своей сигнальной последовательностью из промотора cbh1 (celTA) от Т. reesei, как описано в примере 4. Экспрессионная конструкция, используемая для трансформации хозяина Т. reesei, включает также терминатор cbh1 и маркер amdS для отбора трансформантов от нетрансформированных клеток.
Данное изобретение также относится к клеткам-хозяевам, содержащим рекомбинантный экспрессионный вектор, описанный выше. Подходящими хозяевами для продукции фермента сериновой протеазы грибов являются гомологичные или гетерологичные хозяева, такие как микробные хозяева, в том числе бактерии, дрожжи и грибы. Также возможны производственные системы в клетках растений или млекопитающих.
Нитчатые грибы, такие Trichoderma, Aspergillus, Fusarium, Humicola, Chrysosporium, Neurospora, Rhizopus, Penicillium и Mortiriella, являются предпочтительными хозяевами для продукции благодаря легкости последующей обработки и восстановления ферментного продукта. Подходящими принимающими системами для экспрессии и продукции являются, например, производственная система, разработанная для нитчатых грибов-хозяев Trichoderma reesei (EP 244234), или производственные системы для Aspergillus, таких как штаммы А. oryzae или A. niger (WO 9708325, US 5843745, US 5770418), A. awamori, A. sojae и A. japonicus, или производственная система, разработанная для Fusarium, таких как F. oxysporum (Malardier et al., 1989) или F. venenatum, и для Neurospora crassa, Rhizopus miehei, Mortiriella alpinis, H. lanuginosa или Н. insolens или для Chrysosporium lucknowense (US 6573086). Подходящими производственными системами для дрожжей являются системы, разработанные для Saccharomyces, Schizosaccharomyces или Pichia pastoris. Подходящими производственными системами для бактерий являются системы, разработанные для Bacillus, например для В. subtilis, В. licheniformis, В. amyloliquefaciens, для E. coli или для актиномицета Streptomyces. Предпочтительно сериновая протеаза изобретения производится в нитчатых грибах-хозяевах рода Trichoderma или Aspergillus, таких как штаммы Т. reesei или A. niger, A oryzae, A. sojae, A. awamori или A. japonicus. В соответствии с наиболее предпочтительным воплощением изобретения фермент сериновая протеаза грибов продуцируется в Т. reesei.
Продуцирующая клетка-хозяин может быть гомологичной или гетерологичной сериновой протеазе изобретения. Хозяин может быть свободным от однородных протеаз благодаря удалению протеаз либо путем инактивации, либо путем удаления одной или более протеаз хозяина, например, путем удаления гена(ов), кодирующего такие однородные или гомологичные протеазы.
Данное изобретение также относится к способу получения полипептида, имеющего активность сериновой протеазы, при этом указанный способ включает этапы культивирования природной или рекомбинантной клетки-хозяина, несущей рекомбинантный вектор для экспрессии сериновой протеазы изобретения в соответствующих условиях и, возможно, для выделения указанного фермента. Средой для продукции может быть среда, пригодная для выращивания организма-хозяина и содержащая индукторы для эффективной экспрессии. Подходящие среды хорошо известны из литературы.
Изобретение относится к полипептиду, имеющему активность сериновой протеазы, при этом указанный полипептид кодируется нуклеиновокислотной молекулой изобретения и производится способом, описанным выше. Предпочтительно полипептид является рекомбинантным протеазным ферментом, полученным путем культивирования клетки-хозяина, несущей рекомбинантный вектор для экспрессии сериновой протеазы изобретения.
Изобретение также относится к способу получения ферментного препарата, содержащего полипептид, который обладает активностью сериновой протеазы, при этом указанный способ включает этапы культивирования клетки-хозяина, несущей экспрессионный вектор изобретения, и либо восстановления полипептида из клеток, либо отделения клеток от питательной среды и получения супернатанта с активностью сериновой протеазы.
Данное изобретение также относится к ферментному препарату, в состав которого входит фермент сериновая протеаза, охарактеризованный выше. Ферментный препарат или композиция обладает активностью сериновой протеазы и производится способом в соответствии с изобретением.
В рамки изобретения входит ферментный препарат, который содержит сериновую протеазу грибов изобретения, предпочтительно рекомбинантную сериновую протеазу, полученную путем культивирования клетки-хозяина, которая несет рекомбинантный экспрессионный вектор изобретения.
Указанный ферментный препарат также может содержать различные типы ферментов в дополнение к сериновой протеазе данного изобретения, например другую протеазу, амилазу, липазу, целлюлазу, кутиназу, пектиназу, маннаназу, ксиланазу и/или оксидазу, например лакказу или пероксидазу, с посредником или без него. Эти ферменты, по-видимому, повышают эффективность сериновой протеазы изобретения путем удаления углеводов и масел или жиров, присутствующих в обрабатываемом материале. Указанные ферменты могут быть природными или рекомбинантными ферментами, продуцируемыми штаммами-хозяевами, или они могут быть добавлены к культуральному супернатанту после производственного процесса.
Указанный ферментный препарат также может содержать подходящую добавку, выбранную из группы сурфактантов или поверхностно-активных веществ, буферов, антикоррозионных агентов, стабилизаторов, отбеливающих агентов, посредников, структурообразователей, каустиков, абразивов и консервантов, оптических отбеливателей, средств, препятствующих распространению грязи по ткани после стирки, красителей, пигментов и т.д.
Поверхностно-активные вещества используются для эмульгации жиров и смачивания поверхностей. Поверхностно-активное вещество может быть неионным, в том числе полуполярным, и/или анионным, и/или катионными, и/или цвиттерионным.
Буферы могут быть добавлены к ферментному препарату для изменения рН или влияния на эффективность и стабильность других ингредиентов.
Подходящие стабилизаторы включают полиолы, такие как пропиленгликоль или глицерин, сахар или сахарный спирт, молочную кислоту, борную кислоту или производные борной кислоты, пептиды и т.д.
Отбеливающий агент используется для окисления и разрушения органических соединений. Примерами подходящих химических отбеливающих систем являются источники H2O2, такие как перборат и перкарбонат с или без образующих перкислоту отбеливающих активаторов, таких как тетраацетилэтилендиамин, или, альтеранативно, пероксикислоты, например амидного, имидного или сульфонового типа. Химические окислители могут быть заменены частично или полностью путем применения окислительных ферментов, таких как лакказы или пероксидазы. Многие лакказы не функционируют эффективно в отсутствие посредников.
Структурообразователи или комплексообразующие агенты включают такие вещества, как цеолит, дифосфат, трифосфат, карбонат, цитрат и т.д. Ферментный препарат также может содержать один или более полимер, такой как карбоксиметилцеллюлозу, поли(этиленгликоль), поливиниловый спирт), поли(винилпирролидон) и т.д. Кроме того, могут быть добавлены пластификаторы, каустики, консерванты для предотвращения порчи и другие ингредиенты, абразивные материалы и вещества, изменяющие пенообразующие и вяжущие свойства.
В соответствии с одним из предпочтительных воплощений изобретения указанный ферментный препарат находится в виде жидкости, порошка или гранулята.
Сериновая протеаза грибов данного изобретения может, как и другие протеазы, особенно щелочные протеазы, быть использована в промышленности моющих средств, белковой, пивоваренной, мясной, фотографической, кожевенной, молочной и фармацевтической промышленности (Kalisz, 1988; Rao et al., 1998). Например, она может быть использована в качестве альтернативы химическим веществам для преобразования волокнистых белковых отходов (например, рогов, перьев, ногтей и волос) в полезную биомассу, белковый концентрат или аминокислоты (Anwar and Saleemuddin, 1998). Применение сериновой протеазы грибов данного изобретения может, подобно другим ферментам, оказаться успешным в улучшении качества кожи и уменьшении загрязнения окружающей среды и экономии энергии, и, подобно щелочной протеазе, оно может быть полезным в синтезе пептидов и разделении смеси D,L-аминокислот. Субтилизин в сочетании с антибиотиками широкого спектра действия для лечения ожогов и ран является примером применения сериновых протеаз в фармацевтической промышленности, поэтому сериновая протеаза грибов данного изобретения также может найти подобное применение, а также подобно щелочной протеазе может применяться для удаления крови на хирургическом оборудовании и для очистки контактных линз или зубных протезов. Подобно щелочной протеазе от Conidiobolus coronatus, сериновая протеаза грибов данного изобретения может быть использована для замены трипсина в культурах клеток животных. Протеазы изобретения также могут быть использованы для очистки мембран и для разрушения биопленок. При производстве выпечки протеазы могут быть использованы, например, для разрушения глютеновой сетки и в других случаях производства пищи с гидролизом пищевых белков, например белков в молоке. Они также могут быть использованы, например, в обработке дрожжей, рендеринге (извлечении большего количества белков из костей животных), создании новых ароматизаторов, уменьшении горечи, изменении эмульгирующих свойств, образовании биологически активных пептидов и уменьшении аллергенности белков. Субстраты включают белки животных, растений и микроорганизмов.
Промышленность моющих средств, в частности промышленность средств для стирки, стала одним из основных потребителей протеаз, активных в высоком диапазоне рН (Anwar and Saleemuddin, 1998). Идеальная протеаза моющего средства должна обладать широкой субстратной специфичностью для облегчения удаления большого разнообразия загрязнений от еды, травы, крови и других выделений тела. Она должна быть активной при рН и ионной силе моющего раствора, при температуре и рН стирки и должна выдерживать механическую обработку, а также добавление в моющие средства хелатирующих и окисляющих агентов, pI протеазы должна быть близка к рН раствора моющего средства. Из-за нынешнего энергетического кризиса и информированности в области энергосбережения, в настоящее время желательно использовать протеазу при более низких температурах.
Данное изобретение также относится к применению фермента сериновой протеазы или ферментного препарата для моющих средств, обработки текстильных волокон, для обработки шерсти, для обработки волос, для обработки кожи, для обработки корма или продуктов питания или для любого применения, включающего модификацию, разрушение или удаление белкового материала.
Одним предпочтительным воплощением изобретения является применение фермента сериновой протеазы, как охарактеризовано выше, в качестве добавки к моющему средству, применяемому в качестве средства для стирки и композиций для мытья посуды, включая композиции для автоматического мытья посуды.
Выражение «моющее средство» используется для обозначения вещества или материала, предназначенного для оказания помощи в очистке или имеющего очищающие свойства. Термин «моющее» указывает на наличие или степень очищающих свойств. Степень очищающих свойств может быть проверена на различных белковых или содержащих белок субстратах, материалах или загрязнителях или загрязняющих смесях, связанных с твердым, нерастворимым в воде носителем, например, текстильными волокнами или стеклом. Типичный белковый материал включает кровь, молоко, чернила, яйцо, траву и соусы. С целью тестирования в продаже имеются смеси белковых загрязнителей. Функция фермента моющего средства заключается в разрушении и удалении белок-содержащих загрязнителей. Результаты анализа зависят от типа загрязнителя, композиции моющего средства и природы и состояния текстиля, используемого в моющем анализе (Maurer, 2004).
Как правило, протеаза или эффективность мытья измеряется как «эффективность удаления загрязнителя» или «эффект удаления загрязнителя» или «степень очищающего свойства», означающая видимое и измеримое осветление или изменение цвета испачканного материала, например искусственно испачканных образцов или тестируемых тканей. Показатели осветления или изменения цвета можно измерить, например, путем измерения цвета как показатели отражения с помощью спектрофотометра, используя координаты цветового пространства L*a*b*, как описано в примерах 6-10. Уменьшение яркости или удаление белкового загрязнителя, указывающее на эффективность протеазы (эффективность удаления загрязнителя), рассчитывается, например, как AL*, что означает значение осветления *L обработанной ферментом ткани минус значение осветления *L ткани, обработанной буфером или моющим средством без фермента (образец без фермента или контроль). Наличие моющего средства может улучшить эффективность фермента в плане удаления загрязнителя.
Сериновая протеаза данного изобретения разрушает различные виды белковых загрязнителей в условиях нейтральной и щелочной рН и даже в присутствии моющих средств с различными композициями (как показано в примерах 6-13).
Как показано в примере 6, сериновая протеаза изобретения удаляла загрязнитель кровь/молоко/чернила при 50°С и особенно при температуре 30°С в буфере с рН 9 лучше, чем коммерческие протеазные препараты Savinase® Ultra 16L и Purafect® 4000L (фиг.5 и 6). Ферментные препараты дозировали как единицы активности. Эффект удаления загрязнителя кровь/молоко/чернила проверяли также на всем температурном диапазоне от 10°С до 60°С, как описано в примере 12. Протеазный препарат Fe_RF6318 демонстрировал более высокую мощность в плане удаления загрязнителя по сравнению с коммерческими протеазными препаратами Savinase® Ultra 16L и Purafect® 4000L. Он также демонстрировал более высокую мощность в плане удаления загрязнителя в диапазоне от 30°С до 60°С по сравнению с Properase® 4000E (фиг.16).
Эффективность протеазы Fe_RF6318 также анализировали в стиральном порошке при 40°С/50°С при рН 10, как описано в примере 7. Была проверена способность фермента удалять загрязнитель кровь/молоко/чернила на полиэфирно-хлопковом материале. Каждый ферментный препарат вводили как единицы активности (мкмоль тирозина/мин). Как показано на фиг.7 и 8, протеаза изобретения также подходит для стиральных порошков в очень щелочных условиях, и ее устойчивость к отбеливающим агентам несколько выше, чем у коммерческой протеазы Purafect® 4000L.
Протеаза Fe_RF6318 удаляла стандартный загрязнитель кровь/молоко/чернила также в жидком моющем средстве и в Ariel Sensitive (Procter&Gamble, Великобритания) в присутствии жидкого моющего средства и при температуре 30°С (пример 9). Эффективность на загрязнителе кровь/молоко/чернила была значительно выше, чем у коммерческих препаратов Savinase® Ultra 14L и Purafect® 4000L (фиг.10 и 11). Ферментные препараты вводили как единицы активности. Такой же эффект наблюдали и при дозировке, рассчитанной как количество добавленного белка (фиг.10 В и 11 В). Мытье, проводимое с жидким моющим средством в концентрации 3,3. г/л при 10°С и 20°С, вновь показало превосходную эффективность по сравнению с коммерческими препаратами Savinase® Ultra 14L, Purafect® 4000L и Properase® 4000E (пример 13; фиг.17).
В дополнение к загрязнителям кровь/молоко/чернила протеаза Fe_RF6318 была эффективна в удалении таких загрязнителей, как трава и какао, при тестировании в жидких моющих средствах при температуре 30°С. Обработку проводили в ATLAS LP-2 Launder-Ometer. Результаты (фиг.12 и 13) показывают, что Fe_RF6318 была эффективна на нескольких загрязнителях при низких температурах, таких как 30°С.
Эффективность препарата с рекомбинантным ферментом Fe_RF6318, полученным в T. reesei, анализировали в присутствии жидкого моющего средства в полном объеме в стиральной машине при температуре 30°С (пример 11). Восемь различных чувствительных к протеазам индикаторов для тестирования побочных эффектов приведены в таблице 5, а условия процесса приведены в таблице 6. Дозы фермента, используемые в испытаниях, были рассчитаны как активность ферментов и как количество ферментного белка. Результаты, представленные на фиг.14А-В, показывают, что сумма результатов, полученных с различными загрязнителями, была выше у Fe_RF6318, чем у коммерческих протеазных препаратов Savinase® Ultra 16L и Purafect® 4000L, при этом фермент дозировали как значение активности или как белок. Fe_RF6318 был наиболее эффективен на загрязнителях кровь/молоко/чернила, шоколад/молоко, арахисовое масло/молоко и яичный желток (фиг.15А-Е).
В соответствии с предпочтительным воплощением изобретения сериновая протеаза грибов изобретения используется в жидких моющих средствах и в стиральных порошках, как показано в примерах 6-13. Фермент ферментного препарата изобретения может быть составлен для применения в ручной или машинной стирке или может быть составлен для применения в бытовой очистке твердых поверхностей или, предпочтительно, в ручном или машинном мытье посуды.
ПРИМЕР 1. Продукция и очистка протеазы Fusarium equ/set/RF6318
(a) Культивирование Fusarium equiseti RF6318
Штамм гриба RF6318 предварительно был выделен в виде нитчатого гриба, производящего целлюлазы. Он был определен как Fusarium cf. equiseti (Libert) Desmazieres (Arthur de Cock, Identification Services, Centralbureau Voor Schimmelcultures, P.O. Box 85167, 3508 AD Утрехт, Нидерланды). Было показано, что F. equiseti RF6318 проявляет протеазную активность на чашке с агаром, содержащим гемоглобин в качестве субстрата. Так как чашки культивировали примерно при 10°С, то этот результат позволял предположить, что RF6318 продуцирует протеазу или проявляет протеазную активность при низких температурах. F. equiseti RF6318 выращивали, поддерживали и подвергали споруляции на картофельном агаре с декстрозой (PD) (Difco) при +4°С. Для продукции фермента споры со скошенного агара с RF6318 инокулировали в культуральную среду, которая содержала: 30 г/л кукурузной муки (мелкого помола), 5 г/л кукурузного порошка, 4 г/л соевого шрота (обезжиренного), 2 г/л КН2РО4, 1 г/л NaCl и 1 г/л парафинового масла. рН среды корректировали перед стерилизацией с помощью NaOH до 8,5, и среду автоклавировали в течение 30 минут при температуре 121°С. Микроорганизмы культивировали в объеме 50 мл на шейкере (200 оборотов в минуту) при 28°С в течение 7 дней. При измерении активности (в соответствии с примерами 1с, 5 или 14) при различных значениях рН (рН 7-10) было показано, что отработанный культуральный супернатант проявлял активность щелочной протеазы. Благодаря этой щелочной активности штамм RF6318 был выбран в качестве донора предполагаемого гена протеазы.
(b) Очистка протеазы из культуральной среды F. equiseti RF6318
Клетки и твердые тела удаляли из отработанной культуральной среды центрифугированием в течение 30 мин, 50000 g при температуре +4°С (Sorvall RC6 plus). 50 мл супернатанта использовали для очистки протеазы. После центрифугирования рН супернатанта доводили до 8,0, добавляя соляную кислоту. Затем супернатант фильтровали через фильтр с диаметром пор 0,44 мкм (Millex HV Millipore) и проводили через 5 мл колонку Q Sepharose FF (GE Healthcare), уравновешенную 20 мМ Трис-HCl, рН 8. Прошедшую через колонку фракцию собирали и снижали ее рН до 7,5, добавляя HCl. Твердый сульфат аммония добавляли к прошедшей через колонку фракции для получения конечной концентрации соли 1 М. Затем прошедшую через колонку фракцию фильтровали через фильтр с диаметром пор 0,44 мкм перед проведением ее через фенильную колонку Sepharose HP (1 мл) (GE Healthcare), уравновешенную 20 мМ Трис-HCl - 1М сульфат аммония рН 7,5. Белки элюировали с линейным уменьшением градиента сульфата аммония (от 1 до 0 М). Фракции по 1 мл собирали и анализировали в плане протеазной активности на меченном резоруфином казеине (Boehringer Mannheim Biochemica) при рН 8,0 в соответствии с инструкциями производителя. Фракции с протеазной активностью объединяли и подвергали ультрафильтрации через мембрану 10 k (Amicon). Концентрированный фильтрат проводили через колонку Superdex 75 10/300 GL (GE Healthcare), уравновешенную 20 мМ Трис-HCl - 200 мМ NaCl, рН 7,5. Белки элюировали в том же буфере и собирали 0,5 мл фракции. Анализировали протеазную активность этих фракций. Фракции с протеазной активностью анализировали путем электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE). Было показано, что фракции содержали одну основную белковую полосу с молекулярной массой примерно 29 кДа. Выбранные фракции объединяли. Объединенные фракции использовали для приготовления пептидов (пример 2). В соответствии с измерениями активности очищенный белок имел рН-оптимум при рН 10. Эта очищенная протеаза F. equiseti RF 6318 была названа Fe_RF6318.
(с) Анализ протеазной активности
Протеазную активность анализировали способом Фолина-Чокальтеу с помощью казеина в качестве субстрата. Скорость разрушения казеина протеазой измеряли путем спектрофотометрического мониторинга высвобождения кислотно-растворимых фрагментов в зависимости от времени. Казеиновый субстрат, используемый в анализе, готовили следующим образом: 6 г казеина Hammerstein Grade от МР Biomedicals, LLC (101289) растворяли в 500 мл 100 мМ Трис, 20 мкМ CaCl2, 7 мкМ MgCl2, 25 мкМ NaHCO3. рН раствора субстрата доводили до 9,0 с помощью HCI. Ферментативные реакции останавливали с помощью раствора трихлоруксусной кислоты (ТСА, trichloroacetic acid), который содержит: 0,11 М ТСА, 0,22 М ацетат натрия, 0,33 М уксусную кислоту, 0,5 М Na3CO3 в 1000 мл дистиллированной воды. Реагент Фолина, используемый в анализе, готовили путем разведения 25 мл 2N фенольного реагента Фолина-Чокальтеу (Sigma, F 9252) дистиллированной водой до 100 мл. Реакцию начинали первой инкубацией 2,5 мл раствора субстрата в течение 5 мин при данной температуре, после чего добавляли 0,5 мл раствора фермента и проводили реакцию в течение 15 мин или 30 мин. Через 15 мин или 30 мин к 2,5 мл реакции добавляли стоп-раствор, содержимое перемешивали и оставляли на 30 минут при комнатной температуре. Пробирки центрифугировали при 4000 об/мин в течение 10 минут (Hettich Rotanta 460). Пипеткой отбирали один мл чистого супернатанта и смешивали с 2,5 мл 0,5 М Na2CO3 и 0,5 мл разбавленного реагента Фолина. Через 5 мин (развитие окраски) измеряли абсорбцию смеси (цвет) при 660 нм против ферментного контроля. Ферментный контроль готовили следующим образом: 0,5 мл раствора фермента смешивали с 2,5 мл стоп-раствора и 2,5 мл субстрата, и смесь оставляли на 15 мин или 30 мин при данной температуре. Одна единица активности фермента была определена как количество фермента, который высвобождает кислоторастворимый продукт гидролиза белка, соответствующего 1 мкг тирозина на 1 мл реакционной смеси в минуту.
Пример 2. N-концевая и внутренняя аминокислотные последовательности очищенной протеазы Fe_RF6318 F. equiseti
Для определения внутренних последовательностей полосу, окрашенную Кумасси бриллиантовым голубым, вырезали из полиакриламидного геля и «в геле» расщепляли преимущественно, как описано в Shevchenko et al. (1996). Белки восстанавливали с помощью дитиотреитола и алкилировали с помощью йодоацетамида перед расщеплением трипсином (Sequencing Grade Modified Trypsin, V5111, Promega).
Квадрупольную времяпролетную тандемную масс-спектрометрию с ионизацией электроспрея для секвенирования de novo проводили с помощью инструмента Q-TOF (Micromass, Манчестер, Великобритания), связанного с жидкостным хроматографом Ultimate nano (LC-Packings, Нидерланды), преимущественно как было описано ранее (Poutanen et al., 2001), но используя улавливающую колонку 150 мкм × 1,0 мм (3 мкм, 120А, №222403, SGE Ltd, Великобритания) для предварительного концентрирования пептида.
Для анализа N-концевой последовательности SDS-PAGE/разделенные белки с помощью электроблоттинга переносили на поливинилиден-дифторидную мембрану (ProBlott; Perkin Elmer Applied Biosystems Division, Foster City, Калифорния). После окраски Кумасси бриллиантовым голубым интересующие белковые полосы вырезали, и N-концевую последовательность подвергали анализу путем деградации по Эдману на белковом секвенаторе Procise 494A (Perkin Elmer Applied Biosystems Division, Фостер Сити, Калифорния).
N-концевая и внутренняя пептидные последовательности, определенные в очищенной протеазе Fe_RF6318, показаны в таблице 1. Пептидные последовательности демонстрируют гомологию с опубликованными протеазными последовательностями сериновых протеаз из Fusarium oxysporum с регистрационными номерами EMBL Q5R2N9 и 074236.
Пример 3. Клонирование гена F. equiseti RF6318, кодирующего протеазу Fe_RF6318
(а) Выделение ДНК и используемые способы молекулярной биологии
Стандартные способы молекулярной биологии использовали для выделения и ферментной обработки ДНК (например, для выделения плазмидной ДНК, расщепления ДНК для получения фрагментов ДНК), для трансформации Е. coli, секвенирования и т.д. Основными используемыми способами являются либо описанные производителем в инструкциях к ферменту, реагенту или набору, либо описанные в стандартных справочниках по молекулярной биологии, например в Sambrook and Russell (2001). Выделение геномной ДНК из F. equiseti RF6318 проводили в соответствии с описанием в Raeder and Broda (1985).
(б) Праймеры для получения зонда
Зонд для клонирования гена, кодирующего белок Fe_RF6318, синтезировали с помощью ПЦР. Вырожденные олигонуклеотиды планировали на основании аминокислотных последовательностей пептидов, полученных из очищенного Fe_RF6318 (таб. 1). Последовательности праймеров приведены в таблице 2 (SEQ ID №№:5-8).
(в) ПЦР и выбор зондов для клонирования
Геномную ДНК F. equiseti RF6318 использовали в качестве матрицы для синтеза зондов. ПЦР-смеси содержали 10 мМ Трис-HCl, рН 8,8, 50 мМ KCl, 0,1% Triton X-100, 1,5 мМ MgCl2, 0,2 мМ dNTP, 1 мкМ каждого праймера, 4 единицы ДНК-полимеразы Dynazyme II (Finnzymes, Финляндия) и приблизительно 3 мкг геномной ДНК в объеме реакционной смеси 100 мкл. Условия ПЦР были следующими: 5 мин начальная денатурация при 96°С, затем 32 цикла по 1 мин при 96°С, 30 сек отжиг при 55,5°С, 1 мин элонгация при 72°С и окончательная элонгация при 72°С в течение 5 мин. Комбинация праймеров PR088 (SEQ ID №6) и PR089 (SEQ ID №7) давала специфический ДНК-продукт с ожидаемым размером (в соответствии с расчетами на основании опубликованных последовательностей протеаз грибов). ДНК-продукт выделяли и очищали от реакционной смеси ПЦР и клонировали в вектор pCR®2.1-TOPO® в соответствии с инструкциями производителя (Invitrogen, США). ДНК-фрагмент длиной 866 п.о. секвенировали из этой плазмиды (SEQ ID №9). Плазмиду pCR®2.1-TOPO®, содержащую этот амплифицированный с помощью ПЦР ДНК-фрагмент, назвали pALK2521. Штамм E. coli RF7664, включающий плазмиду pALK2521, сдали на хранение в коллекцию DSM под регистрационным номером DSM 22171.
Выведенная аминокислотная последовательность ПЦР-фрагмента включала последовательности внутренних пептидов Fe_RF6318 1246.673 (SEQ ID №2) и 3341.633 (SEQ ID №3) (таб.1). Кроме того, С-концевая часть N-концевого пептида №3792 (SEQ ID №1), не входившая в праймер, была найдена в выведенной аминокислотной последовательности (табл. 1). Это подтверждает, что фрагмент ДНК, полученный в ПЦР, был частью гена, кодирующего белок Fe_RF6318, и, таким образом, использовался в качестве зонда для скрининга гена полной длины из геномной ДНК F. equiseti.
(г) «локирование гена F. equiseti RF6318, кодирующего протеазу Fe_RF6318
Геномную ДНК F. equiseti расщепляли ферментами рестрикции для саузерн-блот-анализа. Гибридизацию проводили с EcoRI фрагментом 884 п.о., включающим SEQ ID №9, вырезали из плазмиды pALK2521, как зонд (пример 3с). Указанный выше зонд метили с помощью дигоксигенина в соответствии с инструкциями поставщика (Roche, Германия). Гибридизацию проводили в течение ночи при 65°С. После гибридизации фильтры промывали 2 раза по 5 минут при комнатной температуре с помощью 2×SSC-0,1% SDS, и затем 2 раза по 15 мин при 65°С с помощью 0,1×SSC-0,1% SDS.
Было обнаружено несколько гибридизирующихся фрагментов в геномной ДНК F. equiseti. Геномные продукты расщепления MunI и BdlII содержали гибридизирующийся фрагмент с приблизительными размерами 4,2 т.п.о. и 3,2 т.п.о., соответственно. Размеры одного гибридизирующегося фрагмента были достаточно велики, чтобы содержать ген полной длины, кодирующий белок Fe_RF6318, в соответствии с расчетами, основанными на опубликованных последовательностях протеазы грибов. Фрагменты геномной ДНК выделяли из геномных продуктов расщепления RF6318 рестриктазами MunI и BglII из размера диапазона гибридизирующегося фрагмента (примерно 4 т.п.о. для расщепления MunI и примерно 3 т.п.о. для расщепления BglII). Геномные фрагменты выделяли из агарозного геля и клонировали в векторы pBluescript II KS+ (Stratagem, США), расщепленные EcoRI и BamHI. Лигазными смесями трансформировали клетки Escherichia coli XL10-Gold (Stratagene) и высевали их на чашки с LB (средой Лурия-Бертани), содержащей 50-100 мкг/мл ампициллина. Среди колоний E. coli искали положительные клоны с помощью гибридизации колоний с вставкой pALK2521 в качестве зонда. Гибридизацию проводили, как описано для продуктов расщепления геномной ДНК RF6318. С чашек были отобраны четыре положительных клона BamHI и восемь положительных клонов MunI. С помощью расщепления рестриктазами было показано, что они содержат вставки ожидаемых размеров. Вставку из фрагмента MunI, лигированную с обработанным BamHI вектором, разрезали путем двойной рестрикции с помощью PstI-SalI. Вставку из фрагмента BamHI, лигированную с обработанным EcoRI вектором, разрезали путем двойной рестрикции с помощью PstI-NotI. Саузерн-блоттинг выполняли на вставках отобранных клонов (саузерн-блот-гибридизация при 68°С и промывка 2 раза по 5 минут при комнатной температуре с помощью 2×SSC-0,1% SDS, а затем 2 раза по 15 мин при 68°С с помощью 0,1×SSC-0,1% SDS). Три из отобранных клонов BglII и шесть из отобранных клонов MunI содержали гибридизирующийся фрагмент в саузерн-блоте. Ген полной длины, кодирующий протеазу Fe_RF6318 (SEQ ID №10), секвенировали из BglII-вставки длиной 3,2 т.п.о., и плазмиду, содержащую эту вставку, назвали pALK2529. Штамм E. coli RF7800, содержащий плазмиду pALK2529, сдали на хранение в коллекцию DSM под регистрационным номером DSM 22172. Ген, кодирующий белок Fe_RF6318, назвали Fe prtS8A.
(д) Характеризация гена, кодирующего протеазу Fe_RF6318, и выведенной аминокислотной последовательности
Последовательность Fe prtS8A (SEQ ID №10) и выведенная аминокислотная последовательность (SEQ ID №11) показаны на фиг.1А-В. Длина гена составляет 1303 п.о. (включая стоп-кодон). Было обнаружено, что один предполагаемый интрон имеет длину 64 п.о. (5'- и 3'-концевые последовательности в соответствии с интронами у грибов no Gurren et al. (1987). Выведенная белковая последовательность (SEQ ID №11) состоит из 412 аминокислот, включая прогнозируемую сигнальную последовательность из 20 аминокислот (SignalP V3.0; Nielsen et al., 1997 and Nielsen and Krogh, 1998). Целый N-концевой пептид №3792 (также N-концевая часть, не включенная в последовательность зонда) был включен в выведенную аминокислотную последовательность. Прогнозируемая молекулярная масса составляла 29141,09 Да для зрелого полипептида, а прогнозируемая pI составляла 9,30. Эти прогнозы были сделаны с помощью инструмента Compute PI/MW на сервере ExPASy (Gasteiger et al., 2003). Выведенная аминокислотная последовательность содержала два возможных сайта N-гликозилирования в аминокислотных позициях Asn77 и Asn255 (фиг.1), но в соответствии с CBS Server NetNGIyc V1.0 вероятен только сайт в позиции Asn77 (находится в пропоследовательности).
(е) Исследования гомологии, идентичности и выравнивания
Гомологии с опубликованными последовательностями протеаз мы искали с помощью программы BLASTX версии 2.2.9 в NCBI (Национальный центр биотехнологической информации) с настройками по умолчанию (Altschul et al., 1990). Наиболее высокие гомологии наблюдались с гипотетическим белком из Gibberella zeae (Fusarium graminearum) (регистрационный номер в EMBL XPJ383491) и сериновой эндопептидазой из Trichoderma harzianum (Hypocrea lixii) (регистрационный номер в EMBL CAL25508). Также была найдена гомология с последовательностью, включенной в патентную заявку US 60/818910 (Catalyst Bioscience Inc.) как SEQ ID №313. Последовательность Fe_RF6318 была выровнена с приведенными выше гомологичными последовательностями. Значения идентичности, полученные с помощью выравнивания ClustalW (www.ebi.ac.uk/Tools/clustalw: Матрица: BLOSUM, штраф на открытие делеции: 10, штраф на удлинение делеции: 0,5), приведены в таблице 3.
Таблица 3. Значения идентичности (%), полученные при выравнивании ClustalW выведенных аминокислотных последовательностей протеазы.
Были выровнены зрелые аминокислотные последовательности, за исключением сигнальных пептидов и пропептидов. Матрица: BLOSUM, штраф на открытие делеции: 10, штраф на удлинение делеции: 0,5, EMBL_EBI. G. zeae, XP_383491, T. harzianum CAL25508; US 60/818910, SEQ ID №313 в приложении.
Пример 4. Продукция рекомбинантной протеазы Fe_RF6318 в Trichoderma reesei
(а) Получение продуцирующего вектора (хозяина)
Экспрессионная плазмида pALK2533 была построена для продукции рекомбинантной протеазы Fe_RF6318 в Trichoderma reesei. Ген Fe prtS8A с собственной сигнальной последовательностью точно сливали с промотором cbh1 от Т. reesei (cel7A) с помощью ПЦР. Фрагмент гена Fe prtS8A вырезали из его 3'-конца с помощью BamHI (сайта, созданного после стоп-кодона при ПЦР). Из-за этого оригинальный терминатор Fe prtS8A не оставался в конструкции перед последовательностью терминатора cbh1. Маркерный ген amdS добавляли к конструкции, включающей промотор cbh1 и терминатор cbh1. Конструкция была аналогична той, которая описана в Paloheimo et al. (2003), линейная экспрессионная кассета длиной 8,7 т.п.о. представлена на фиг.2. Экспрессионную кассету выделяли из остова вектора после расщепления EcoRI и использовали для трансформации протопластов Т. reesei. Используемый хозяйский штамм не продуцировал ни одну из четырех основных целлюлаз T. reesei (CBHI, CBHII, EGI, EGII). Трансформацию проводили, как описано в Penttile et al. (1987) с модификациями, описанными в Karhunen et al. (1993). Трансформанты очищали на селективных чашках путем посева одиночных конидий перед их споруляцией на PD.
(б) Продукция протеазы во встряхиваемых флаконах и лабораторном биореакторе
Трансформанты инокулировали из скошенной PD во встряхиваемые флаконы, содержащие 50 мл комплексной среды на основе лактозы, индуцирующей целлюлазу (Joutsjoki et al., 1993), буферизованной с помощью 5% KH2PO4 при рН 6,0. Продукцию трансформантами протеазы анализировали на культуральных супернатантах после их роста в течение 7 дней при температуре 30°С, 250 об/мин. В геле SDS-PAGE в отработанных культуральных супернатантах была выявлена основная белковая полоса примерно 29 кДа, соответствующая рекомбинантной протеазе Fe_RF6318. Протеазную активность проверяли с помощью казеина в качестве субстрата, как описано в примерах 1b или 14. В культуральных супернатантах были измерены явно увеличенные по сравнению с хозяином активности. Интеграцию экспрессионной кассеты в геном гриба подтверждали в выбранных трансформантах с помощью саузерн-блот-анализа, в который были включены продукты расщепления генома, а в качестве зонда использовалась экспрессионная кассета.
Трансформанты Т. reesei, демонстрирующие лучшую протеазную активность во встряхиваемых культивационных флаконах, отбирали для культивации в лабораторных биореакторах. При культивации использовали индуцирующую целлюлазу комплексную среду. Отработанную культуральную среду, полученную при культивации, использовали для анализов применения (примеры 6-11) и в качестве исходного материала для очистки и дальнейшей характеризации рекомбинантной протеазы Fe_RF6318.
Пример 5. Очистка и характеризация рекомбинантной протеазы Fe_RF6318
Клетки и твердые тела удаляли из отработанной культуральной среды, полученной при ферментации (пример 4) путем центрифугирования в течение 30 мин, 50000 g при температуре +4°С (Sorvall RC6 plus). 15 мл супернатанта использовали для очистки протеазы. Все этапы очистки проводили в холодном помещении. После центрифугирования образцы фильтровали через фильтр с диаметром пор 0,44 мкм (Millipore HV Millex) перед проведением через колонку HiPrep 26/10 Desalting (от GE Healthcare), уравновешенную 20 мМ Трис рН 8,8. Профильтрованный через гель образец проводили через 20 мл колонку Q Sepharose FF (от GE Healthcare), уравновешенную 20 мМ Трис рН 8,8. Фракцию, прошедшую через колонку, собирали и анализировали в 12% SDS-PAGE-геле (фиг.3). Этот ферментный образец использовали для характеризации рН и температурного профилей.
Температурный профиль
Профиль температур получали для протеазы Fe_RF6318 при рН 9 с помощью анализа, описанного в примерах 1в или 14, с использованием 15-минутной реакции. Результат показан на фиг.4А. Протеаза имеет оптимальную температуру примерно 60°С.
рН-профиль
рН-профиль протеазы определяли при температуре 50°С с помощью казеина в качестве субстрата, как описано в примерах 1b или 14. рН реакции подводили до рН 6-12 с помощью 40 мМ буфера Бриттон-Робинсона, а время реакции составляло 15 мин. Ферментативные реакции останавливали с помощью 0,11 М раствора ТСА, который содержал 0,22 М ацетат натрия и 0,33 М уксусную кислоту. Результаты показаны на фиг.4 В. Рекомбинантная протеаза Fe_RF6318 демонстрирует относительную активность более 60% при рН от 6 до 10 с оптимальной активностью при рН примерно 10. рН-профиль очищенной рекомбинантной протеазы Fe_RF6318 соответствовал рН-профилю протеазы Fe_RF6318 дикого типа, очищенной, как описано в примере 1а.
Пример 6. Эффективность рекомбинантной протеазы Fe_RF6318 в буфере с рН 9 при различных температурах
Препарат рекомбинантного белка Fe_RF6318, продуцированный в Trichoderma (как описано в примере 4), тестировали на его способность удалять стандартный загрязнитель кровь/молоко/чернила (арт.116, 100% хлопок, ЕМРА Testmaterialen AG, Швейцария) при температурах 30°С и 50°С. Для сравнения использовали коммерческие протеазные препараты Savinase® Ultra 16 L (Novozymes) и Purafect® 4000L (Genencor International) и обработку без фермента (контроль). Загрязненную ткань вначале разрезали на образцы размером 1,5 см х 1,5 см, и затем куски делали более круглыми, обрезая углы. Куски помещали в лунки микротитровальных плат (Nunc 150200). В каждую лунку диаметром 2 см на поверхность ткани помещали 1,5 мл фермента, разведенного в буфере Glysine-NaOH с рН 9. Каждый фермент вводили в дозе 0, 0,2, 0,4, 0,8, 1,6, 4 и 8 единиц активности (мкмоль тирозина/мин) в 1,5 мл буфера. Активность измеряли в 30-минутной реакции, как описано в примерах 1 (в) или 14, ожидая в течение 10 минут проявления цвета после добавления разбавленного реагента Фолина. Микротитровальные платы с образцами инкубировали в горизонтальном шейкере при 30°С и 50°С в течение 60 мин при 125 об/мин. После этого образцы тщательно промывали под проточной водой (примерно 45°С) и сушили в течение ночи на воздухе в помещении, на сетке, в защищенном от света месте.
Эффект удаления загрязнителя оценивали путем измерения цвета как отражение значений спектрофотометра Minolta CM 2500, используя координаты цветового пространства L*a*b* (осветитель D65/2°). После обработки измеряли цвет с обеих сторон образцов. Каждое значение было усредненным по меньшей мере от двух параллельных образцов ткани, измеренных с обеих сторон. Уменьшение яркости загрязнителя кровь/молоко/чернила, обозначающее эффективность протеазы (эффективность удаления загрязнителя), рассчитывали как ΔL*, что означает насыщенность белого L* обработанной ферментом ткани - насыщенность белого L* ткани, обработанной только буфером (ферментный контроль).
Результаты показаны на фиг.5 и 6. Препарат рекомбинантной протеазы Fe_RF6318Fe_RF6318 демонстрировал значительно более высокую эффективность по удалению загрязнителя при 50°С и особенно при 30°С в буфере с рН 9 по сравнению с коммерческими протеазными препаратами Savinase® Ultra 16L и Purafect® 4000L
Пример 7. Эффективность рекомбинантного белка Fe_RF6318 со стиральным порошком при температуре 40°С/50°С и рН 10
Препарат рекомбинантного белка Fe_RF6318, продуцированный в Trichoderma (как описано в примере 4), тестировали на его способность удалять стандартный загрязнитель кровь/молоко/чернила в присутствии фосфат-содержащего референсного моющего средства с отбеливающим агентом и без него при 40°С и 50°С (рН примерно 10). Стандартный загрязнитель арт.117 (кровь/молоко/чернила, полиэстер+хлопок, ЕМРА) использовали в качестве тестового материала. Для сравнения использовали коммерческую протеазу Purafect® 4000L (Genencor International) и обработку без фермента (контроль). Каждый фермент вводили в дозе 0, 0,2, 0,4, 0,8, 1,6, 4 и 8 единиц активности (мкмоль тирозина/мин) на 1 мл промывочной жидкости. Активность измеряли, как описано в примере 6.
Фосфат-содержащее ЕСЕ референсное моющее средство 77 без оптического отбеливателя (арт.601, ЕМРА) в количестве 3,3 г растворяли в 1 л водопроводной воды (вода, dH≤4), тщательно перемешивали с помощью магнитной мешалки и доводили до 40°С/50°С. Загрязненную ткань разрезали на куски, как описано в примере 6. Образцы помещали в лунки микротитровальных плат (Nunc 150200), и на поверхность ткани помещали 1,5 мл промывочной жидкости, содержащей моющее средство, и фермент, разведенный в воде (до 60 мкл). Платы с образцами инкубировали в горизонтальном шейкере при 40°С/50°С в течение 60 мин при 125 об/мин. После этого образцы тщательно промывали под проточной водой (примерно 45°С) и сушили в течение ночи на воздухе в помещении, на сетке, в защищенном от света месте. Другую серию испытаний проводили тем же способом, за исключением того, что в дополнение к моющему средству был добавлен 0,81 г натрия пербората тетрагидрата (арт.604, ЕМРА) и 0,16 г активатора отбеливания TAED (тетраацетилэтилендиамин) (арт.606, ЕМРА).
Цвет образцов после обработки измеряли на спектрофотометре Minolta CM 2500, используя координаты цветового пространства L*a*b*, и эффект удаления загрязнителя рассчитывали как ΔL*, как описано в примере 6.
Результаты, показанные на фиг.7А, 7Б, 8А и 8Б, демонстрируют, что протеаза Fe_RF6318 также подходит для стиральных порошков с очень щелочной средой, и ее устойчивость к отбеливающим веществам несколько выше, чем у коммерческой протеазы Purafect® 4000L.
Пример 8. Эффективность рекомбинантного белка Fe_RF6318 с жидким моющим средством при температуре 40°С
Рекомбинантный белковый препарат Fe_RF6318, продуцированный в Trichoderma (как описано в примере 4), тестировали на его способность удалять стандартный загрязнитель кровь/молоко/чернила в присутствии жидкого моющего средства Ariel Sensitive(Procter & Gamble, Англия), не содержащего фермент, при 40°С и рН примерно 7,9. Стандартную искусственно загрязненную тестируемую ткань арт.117 (кровь/молоко/чернила, полиэстер+хлопок, ЕМРА) использовали в качестве тестового материала. Для сравнения использовали коммерческие протеазные препараты Purafect® 4000L, Savinase® Ultra 16 L и обработку без фермента (контроль). Каждый фермент вводили в дозе 0, 0,2, 0,4, 0,8, 1,6, 4 и 8 единиц активности (мкмоль тирозина/мин) на 1 мл промывочной жидкости. Активность измеряли, как описано в примере 6.
Ariel Sensitive в количестве 3,3 г растворяли в 1 л водопроводной воды (dH≤4), тщательно перемешивали с помощью магнитной мешалки и доводили до 40°С. Загрязненную ткань разрезали на куски, как описано в примере 6. Образцы помещали в лунки микротитровальных плат (Nunc 150200), и на поверхность ткани помещали 1,5 мл промывочной жидкости, содержащей моющее средство, и фермент, разведенный в воде буфере (до 60 мкл). Платы с образцами инкубировали в горизонтальном шейкере при 40°С в течение 60 мин при 125 об/мин. После этого образцы тщательно промывали под проточной водой (примерно 45°С) и сушили в течение ночи на воздухе в помещении, на сетке, в защищенном от света месте.
Цвет образцов после обработки измеряли на спектрофотометре Minolta CM 2500, используя координаты цветового пространства L*a*b*, и эффект удаления загрязнителя рассчитывали как ΔL*, как описано в примере 6.
На основании результатов, показанных на фиг.9, протеаза Fe_RF6318 имеет отличную эффективность с жидким моющим средством при температуре 40°С. Эффективность Fe_RF6318 на загрязнителе кровь/молоко/чернила (полиэстер+хлопок) была значительно выше по сравнению с коммерческими препаратами Purafect® 4000L и Savinase® Ultra 14 L, когда вводили то же количество протеазной активности. Доза 4-8 единиц коммерческих ферментов на мл промывочной жидкости была равна дозе примерно 0,2-0,5% ферментного препарата на вес моющего средства, что является типичным уровнем применения ферментов моющих средств.
Пример 9. Эффективность рекомбинантного белка Fe_RF6318 с различными концентрациями жидких моющих средств при 30°С
Рекомбинантный белковый препарат Fe_RF6318, продуцированный в Trichoderma (как описано в примере 4), тестировали на его способность удалять стандартный загрязнитель кровь/молоко/чернила в присутствии жидкого моющего средства в концентрации 1-5 г/л при 30°С. Ariel Sensitive(Procter & Gamble, Англия), не содержащий ферментов, и жидкое моющее средство для цветной ткани, содержащее 25% моющих активных веществ, полиолов и полимеров (табл.4), использовали в качестве моющих средств, а стандартный загрязнитель арт.117 (кровь/молоко/чернила, полиэстер + хлопок, ЕМРА) использовали в качестве тестового материала. Для сравнения использовали коммерческие протеазные препараты Purafect® 4000L, Savinase® Ultra 16 L и обработку без фермента (контроль). Каждый фермент вводили в дозе 0, 0,2, 0,4, 0,8, 1,6, 4 и 8 единиц активности (мкмоль тирозина/мин) на 1 мл промывочной жидкости. Активность измеряли, как описано в примере 6.
Жидкое моющее средство в количестве 3,3 г и 5 г растворяли в 1 л водопроводной воды (dH≤4), тщательно перемешивали с помощью магнитной мешалки и доводили до 30°С. рН в промывочных жидкостях составлял примерно 7,3-7,5 с моющим средством Base или 7,6-8,0 с Ariel, в зависимости от концентрации моющего средства. Загрязненную ткань разрезали на куски, как описано в примере 6. Образцы помещали в лунки микротитровальных планшетов (Nunc 150200), и на поверхность ткани помещали 1,5 мл промывочной жидкости, содержащей моющее средство и фермент, разведенный в воде (до 60 мкл). Планшеты с образцами инкубировали в горизонтальном шейкере при 30°С в течение 60 мин при 125 об/мин. После этого образцы тщательно промывали под теплой проточной водой и сушили в течение ночи на воздухе в помещении, на сетке, в защищенном от света месте.
Цвет образцов после обработки измеряли на спектрофотометре Minolta CM 2500, используя координаты цветового пространства L*a*b*, и эффект удаления загрязнителя рассчитывали как ΔL*, как описано в примере 6.
Результаты, полученные с основным моющим средством для цветных тканей, показаны на фиг 10A-D, а результаты, полученные с Ariel Sensitive, показаны на фиг.11A-D. Эффективность Fe_RF6318 на загрязнителях кровь/молоко/чернила была значительно выше по сравнению с коммерческими препаратами Purafect® 4000L и Savinase® Ultra 14L, и концентрации всех моющих средств были одинаковыми при дозировании одинакового количества активности. Также, если дозировка рассчитывалась как количество добавленного белка (фиг.10В и 11В), эффективность удаления загрязнителя была самой высокой с Fe_RF6318. Количество белка из ферментных препаратов определяли с помощью белкового анализа Bio-Rad (Bio-Rad Laboratories, Геркулес, Калифорния) с использованием бычьего гаммаглобулина (Bio-Rad) в качестве стандарта. Результаты этих анализов показывают, что протеаза Fe_RF6318 имеет отличную эффективность с жидкими моющими средствами при низких температурах, например 30°С.
Пример 10. Эффективность рекомбинантного белка Fe_RF6318 на разных загрязнителях с жидкими моющими средствами при 30°С (Launder Ometer)
Рекомбинантный белковый препарат Fe_RF6318, продуцированный в Trichoderma (как описано в примере 4), тестировали на его способность удалять различные загрязнители в присутствии жидкого моющего средства при 30°С и сравнивали с коммерческими протеазными препаратами Purafect® 4000L и/или Savinase® Ultra 16 L. Использовали следующие искусственно загрязненные тестовые ткани из ЕМРА: кровь/молоко/чернила (арт.117, полиэстер + хлопок), кровь/молоко/чернила (арт.116, хлопок), трава (арт.164, хлопок) и какао (арт.112, хлопок). Ткань разрезали на образцы размером 9 см × 12 см, а края подгибали зигзагообразным швом. Были выполнены две серии анализов: первый с Ariel Sensitive без ферментов и затем второй с жидким моющим средством для цветных тканей (пример 8). В двух предыдущих экспериментах использовали различные серии загрязнителей.
Процедуры по удалению загрязнителей проводили в LP-2 Launder Ometer следующим образом. Вначале Launder Ometer предварительно нагревали до 30°С. В контейнеры, содержащие загрязнители арт.116 и арт.117 или загрязнители арт.164 и арт.112, добавляли 450 мл нагретой промывочной жидкости, содержащей 5 г моющего средства на литр водопроводной воды (dH≤4) и разведенный фермент. Каждый фермент вводили в дозе 0, 2,5, 10, а в некоторых тестах 20 или 30 единиц активности (мкмоль тирозина/мин) на 1 мл промывочной жидкости. Активность измеряли, как описано в примере 6. Launder Ometer запускали при 30°С на 60 мин, а рН составлял 7,5 (основное моющее средство) или 8 (Ariel). После этого образцы тщательно промывали под теплой проточной водой (примерно 20°С) и сушили в течение ночи на воздухе в помещении, на сетке, в защищенном от света месте.
Цвет образцов после обработки измеряли на спектрофотометре Minolta CM 2500, используя координаты цветового пространства L*a*b*, и эффект удаления загрязнителя рассчитывали как ΔL*, как описано в примере 6. После обработки измеряли цвет с обеих сторон образцов. Каждое значение было усредненным от по меньшей мере 20 измерений на образец. Измерения не проводили на участках с увеличенным количеством отметок, образующихся при обработке из-за складывания ткани (хлопок с загрязнителем арт.116 и арт.112).
Результаты, полученные с Ariel® Sensitive (фиг.12А-С), показывают, что эффективность на загрязнителях кровь/молоко/чернила и трава была значительно выше у Fe_RF6318 по сравнению с коммерческим препаратом Savinase® Ultra 16L при температуре 30°С, при введении такого же количества протеазной активности. Кроме того, результаты, полученные с загрязнителем какао, были лучше с Fe_RF6318 (данные не представлены).
Также результаты, полученные с основным моющим средством (5 г/л) для цветных тканей (фиг.13 A-D), показали, что эффективность на загрязнителе кровь/молоко/чернила, трава и какао была значительно выше у Fe_RF6318 по сравнению с коммерческими препаратами Savinase® Ultra 16L и Purafect® 4000L при температуре 30°С при введении такого же количества протеазной активности. Дозировка 10 единиц коммерческих ферментов на мл жидкости была равна дозировке примерно 0,4% ферментного препарата на вес моющего средства, который составляет обычно используемый уровень ферментов моющих средств. Результаты этих анализов показывают, что протеаза Fe_RF6318 является эффективной на нескольких загрязнителях при низких температурах, таких как 30°С.
Пример 11. Оценка эффективности рекомбинантного белка Fe_RF6318 в жидком стиральном средстве в полномасштабных испытаниях при 30°С
Эффективность рекомбинантного белкового препарата Fe_RF6318, продуцированного в Trichoderma (пример 4), тестировали в жидком моющем средстве в полномасштабном испытании в стиральной машине при 30°С и сравнивали с коммерческими протеазными препаратами Purafect® 4000L и Savinase® Ultra 16L и обработкой моющим средством без фермента. Использовали жидкое основное моющее средство для цветных тканей, как описано в примере 9, и 8 различных чувствительных к протеазам индикаторов (таб. 5). Кроме того, в сеть для промывки помещали два куска с балластным загрязнением (CFT-SBL), чтобы избежать загрязнения при контакте с другими образцами. Индикаторы были из CFT (Center For Testmaterials BV, Нидерланды). Загрязненные образцы размером 10 см × 10 см были сшиты с кухонными полотенцами. Технологические параметры и условия описаны в таблице 6. Дозы ферментов, используемые в испытаниях, рассчитывали и как активности ферментов (примерно 0-14 единиц активности на мл промывочной жидкости), и как количество белка (примерно 0-2,2 мг на литр промывочной жидкости). Активность протеаз и содержание белка в препаратах измеряли, как описано в примерах 6 и 9.
Оценка эффекта удаления загрязнителя основана на измерении отражения (R 457 нм) спектрофотометром Datacolor с УФ-фильтром и рассчитывается как процентный эффект удаления загрязнителя (%SR):
Результаты рассчитывали как Δ%SR (дельта % SR), что означает %SR обработанной ферментом ткани минус %SR обработанной без фермента (только моющим средством).
С каждой дозой фермента выполняли две стирки, содержащие два образца каждого загрязнителя, и образец каждого загрязнителя измеряли три раза, так что значения основаны на 12 измерениях на загрязнитель для каждого продукта.
Результаты общей эффективности удаления загрязнения (дельта % SR) показаны на фиг.14А-В и фиг.15 А-Е. Общий эффект удаления загрязнителя на основе суммы результатов, полученный с восемью различными чувствительными к протеазам загрязнителями (загрязнители 1-8, значения были выше с Fe_RF6318 по сравнению с коммерческими протеазными препаратами Purafect® 4000L и Savinase® Ultra 16L, когда протеазы вводили как количество активности и как белок на объем промывочной жидкости (фиг.14А-В). Fe_RF6318 была эффективной особенно на крови/молоке/чернилах, шоколаде/молоке, арахисовом масле/молоке и яичном желтке (фиг.15А-Е).
Обычный индикатор моющего средства (краска/масло) использовали в качестве контроля в повторах в разных машинах. Между различными анализами различий не наблюдалось.
Пример 12. Эффективность рекомбинантного белка Fe_RF6318 в буфере рН 9 при температурах от 10°С до 60°С
Рекомбинантный белок Fe_RF6318, продуцированный в Trichoderma (как описано в примере 4), анализировали на его способность удалять стандартный загрязнитель кровь/молоко/чернила (арт.117, полиэстер+хлопок, ЕМРА Testmaterialen AG, Швейцария) при температурах от 10°С до 60°С. Для сравнения использовали коммерческие протеазные препараты Savinase® Ultra 16L, Purafect® 4000L и Properase® 4000 Е и обработку без фермента (контроль). Анализы проводили в буфере с рН 9, как описано в примере 6, за исключением того, что диапазон температуры инкубации был более широким, загрязненный материал отличался, а температура воды для промывания образцов была такой же, как температура стирки. Цвет образцов после обработки измеряли на спектрофотометре Minolta CM 2500, используя координаты цветового пространства L*a*b*, и эффект удаления загрязнителя рассчитывали как ΔL*, как описано в примере 6.
Результаты приведены на фиг.16A-F. Протеазный препарат Fe_RF6318 демонстрировал более высокую мощность по удалению загрязнителя на всем температурном диапазоне от 10°С до 60°С в буфере с рН 9 по сравнению с коммерческими протеазными препаратами Savinase® Ultra 16L и Purafect® 4000L. Он также демонстрировал более высокую мощность по удалению загрязнителей в диапазоне от 30°С до 60°С по сравнению с Properase® 4000E.
Пример 13. Эффективность рекомбинантного белка Fe_RF6318 с жидким моющим средством при низкой температуре стирки 10°С и 20°С
Рекомбинантный белок Fe_RF6318, продуцированный в Trichoderma (как описано в примере 2), тестировали на его способность удалять стандартный загрязнитель кровь/молоко/чернила (арт.117, хлопок + полиэстер, ЕМРА) с жидким моющим средством при низких температурах. Способы тестирования были аналогичны примеру 9 за исключением того, что использовалась концентрация моющего средства 3,3 г/л и более низкая температура инкубации, 10°С и 20°С. Температура воды для промывания была такой же, как температура стирки.
Цвет образцов после обработки измеряли на спектрофотометре Minolta CM 2500, используя координаты цветового пространства L*a*b*, и эффект удаления загрязнителя рассчитывали как ΔL*, как описано в примере 6. Для обработки без фермента (ферментный контроль) в качестве жидкости для стирки использовали раствор моющего средства.
Результаты, полученные с жидким моющим средством в концентрации 3,3 г/л при 10°С и 20°С, приведены на фиг.17А и В. Эффективность Fe_RF6318 на загрязнителе кровь/молоко/чернила была значительно выше и при 10°С, и при 20°С по сравнению с коммерческими препаратам Savinase® Ultra 16L, Purafect® 4000L и Properase® 4000E при введении того же количества активности. Результаты этих тестов показывают, что протеаза Fe_RF6318 имеет отличную эффективность с жидкими моющими средствами при очень низких температурах стирки.
Пример 14. II анализ протеазной активности
Протеазную активность анализировали способом Фолина-Чокальтеу с помощью казеина в качестве субстрата. Скорость разрушения казеина протеазой измеряли путем спектрофотометрического мониторинга высвобождения кислоторастворимых фрагментов в зависимости от времени. Казеиновый субстрат, используемый в анализе, готовили следующим образом: 6 г казеина Hammerstein Grade от МР Biomedicals, LLC (101289) растворяли в 500 мл 30 мМ Трис, 2,0 мМ CaCl2, 0,7 мМ MgCl2, 2,5 мМ NaHCO3. рН раствора субстрата доводили до 8,5 с помощью HCl. Ферментативные реакции останавливали с помощью 0,11 М раствора ТСА. Реагент Фолина, используемый в анализе, готовили путем разведения 25 мл 2N фенольного реагента Фолина-Чокальтеу (Sigma, F 9252) дистиллированной водой до 100 мл. Реакцию начинали первой инкубацией 2,5 мл раствора субстрата в течение 5 мин при температуре 50°С, после чего добавляли 0,5 мл раствора фермента и проводили реакцию в течение 30 мин. Через 30 мин к 2,5 мл реакции добавляли стоп-раствор, содержимое перемешивали и оставляли на 30 минут при комнатной температуре. Пробирки центрифугировали при 4000 об/мин в течение 10 минут (Hettich Rotanta 460). Пипеткой отбирали один мл чистого супернатанта и смешивали с 2,5 мл 0,5 М Na2CO3 и 0,5 мл разбавленного реагента Фолина. Через по меньшей мере 5 мин (развитие окраски) измеряли абсорбцию смеси (цвет) при 660 нм против ферментного контроля. Ферментный контроль готовили следующим образом: 0,5 мл раствора фермента смешивали с 2,5 мл стоп-раствора и 2,5 мл субстрата, и смесь оставляли на 30 мин при температуре 50°С. Одну единицу активности фермента определяли как количество фермента, которое высвобождает кислоторастворимый продукт гидролиза белка, соответствующего 1 мкг тирозина на 1 мл реакционной смеси в минуту.
ССЫЛКИ
Altschul SF, W Gish, W Miller, EW Myers and DJ Lipman. 1990. Basic local alignment search tool. J. Mol. Biol. 215:403-410.
AMFEP, 2007. Association of Manufacturers and Formulators of Enzyme products, List of commercial enzymes at http://www.amfep.org/list.html (updated 30 November 2007).
Anwar, A and M Saleemuddin. 1998. Alkaline proteases: A review. Bioresource Technology 64:175-183.
Bolton, ET and BJ McCarthy. 1962. A general method for the isolation of RNA complementary to DNA. Proc. Nat. Acad. Sci. USA 48: 1390-1397.
Chen, Y-J, and M Inouye, 2008. The intramolecular chaperone-mediated protein folding. Curr. Opin. Struct. Biol. 18:765-770.
Cherry, J.R., and Fidantsef, A.L. 2003. Directed evolution of industrial enzymes: an update. Curr. Opin. Biotechnol. 14: 438-443.
Edman P and G Begg. 1967. A protein sequenator. Eur. J. Biochem. 1: 80-91.
Gasteiger, E, A Gattiker, С Hoogland, I Ivanyi, RD Appel and A Bairoch. 2003. ExPASy: the proteomics server for in-depth protein knowledge and analysis. Nucleic Acids Res. 31:3784-3788.
Geremia RA, Goldman GH, Ardiles W, Vila SB, Van Montagu M, Herrera-Estrella A. 1993) Molecular characterization of the proteinase-encoding gene, prb1, related to mycoparasitism by Trichoderma harzianum. Mol. Microbiol. 8(3):603-613.
Gupta, R, QK Beg, S Khan and В Chauhan. 2002. An overview on fermentation, downstream processing and properties of microbial alkaline protease. Appl. Microbiol. Biotechnol. 60: 381-395.
Gurr, SJ, Uncles, SE, and Kinghorn JR. 1987. The structure and organization of nuclear genes in filamentous fungi, pp 93-139. In (JR Kinghorn, ed.) Gene Structure in Eukaryotic Microbes. IRL Press, Oxford.
Joutsjoki, W, TK Torkkeli, and KMH Nevalainen. 1993. Transformation of Trichoderma reesei with the Hormoconis resinae glucoamylase P (gamP) gene:production of a heterologous glucoamylase by Trichoderma reesei. Curr. Genet. 24:223-228.
Kalisz, HM. 1988. Microbial proteinases. Adv. Biochem. Eng. Biotechnol. 36:1-65.
Karhunen T, A Mantyle, KMH Nevalainen, and PL Suominen. 1993. High frequency one-step gene replacement in Trichoderma reesei. I. Endoglucanase I overproduction. Mol. Gen. Genet. 241:515-522.
Laemmli, UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227:680-685.
Malardier L, MJ Daboussi, J Julien, F Roussel, С Scazzocchio and Y Brygoo. 1989. Cloning of the nitrate reductase gene (niaD) of Aspergillus nidulans and its use for transformation of Fusarium oxysporum. Gene 78:147-156.
Maurer, K-H. 2004. Detergent proteases. Curr. Opin. Biotechnol. 15:330-334.
Nielsen H, J Engelbrecht, S Brunak and G von Heijne. 1997. Identification of prokaryotic and eukaryotic signal peptides and prediction of their cleavage sites. Protein Engineering 10:1-6.
Nielsen H and A Krogh. 1998. Prediction of signal peptides and signal anchors by a hidden Markov model. In: Proceedings of the Sixth International Conference on Intelligent Systems for Molecular Biology (ISMB 6), AAAI Press, Menio Park, California, pp.122-130.
Paloheimo M, A Mäntylä, J Kallio, and P Suominen. 2003. High-yield production of a bacterial xylanase in the filamentous fungus Trichoderma reesei requires a carrier polypeptide with an intact domain structure. Appl. Env. Microbiol. 69:7073-7082.
Penttilä M, H Nevalainen, M Rättö, E Salminen, and J Knowles. 1987. A versatile transformation system for the cellulolytic filamentous fungus Trichoderma reesei. Gene 61:155-164.
Poutanen, M, L Salusjarvi, L Ruohonen, M Penttilä and N Kalkkinen. 2001. Use of matrix-assisted laser desorption/ionization time-of-flight mass mapping and nanospray liquidchromatography/electrospray ionization tandem mass spectrometry sequence tag analysis for high sensitivity identification of yeast proteins separated by two-dimensional gel electrophoresis. Rapid Commun. Mass Spectrom. 15:1685-1692.
Raeder U and P Broda. 1985. Rapid preparation of DNA from filamentous fungi. Lett. Appl. Microbiol. 1:17-20.
Rao, MB, AM Tanksale, MS Ghatge and W Deshpande. 1998. Molecular and biotechnological aspects of microbial proteases. Microbiol. Mol. Biol. Rev. 62:597-635.
Sambrook J and DW Russell. 2001. Molecular cloning, a laboratory manual. Cold Spring Harbor Laboratory, New York, US.
Shevchenko, A, M.Wilm, O.Vorm, M Mann. 1996. Mass spectrometric sequencing of proteins from silver-stained polyacrylamide gels. Anal Chem. 68:850-858.
Shimogaki, H, K Takenchi, Т.Nishino, M.Ohdera, T.Kudo, K.Ohba, MV Iwama and M Irie. 1991. Purification and properties of a novel surface active agent and alkaline-resistant protease from Bcillus sp.Y. Agric. Biol. Chem. 55:2251-2258.
Suarez MB, Vizcaino JA, Lobell A, and Monte E. 2007. Characterization of genes encoding novel peptidases in the biocontrol Trichoderma harzianum CECT 2413 using the TrichoEST functional genomics approach. Curr. Genet. 51(5):331-342.
Реферат
Изобретение относится в области биотехнологии. Описан фермент сериновая протеаза грибов, имеющая аминокислотную последовательность зрелого фермента, которая по меньшей мере на 86% идентична аминокислотной последовательности зрелого фермента Fe_RF6318, представленной в описании. Раскрыты: выделенная нуклеиновая кислота, кодирующая указанный фермент; рекомбинантный вектор экспрессии, содержащий указанную нуклеиновую кислоту, функционально связанную с регуляторными последовательностями; и клетка-хозяин для получения фермента сериновой протеазы по настоящему изобретению, содержащая указанный рекомбинантный экспрессионный вектор. Предложен способ получения фермента или ферментного препарата, содержащего указанный фермент сериновой протеазы, при этом способ включает этап культивирования клетки-хозяина по настоящему изобретению и либо этап восстановления протеазы из клетки, либо этап выделения клетки из культуральной среды и получения супернатанта, содержащего протеазу. Описан ферментный препарат, содержащий сериновую протеазу грибов, раскрытую в описании, полученный указанным способом. Изобретение позволяет расширить арсенал протеолитических ферментов. 9 н. и 29 з.п. ф-лы, 17 ил., 6 табл., 14 пр.
Формула
(а) нуклеиновокислотную молекулу, кодирующую полипептид, имеющий активность сериновой протеазы и представляющий собой аминокислотную последовательность, показанную в SEQ ID NO:15;
(б) нуклеиновокислотную молекулу, кодирующую полипептид, имеющий активность сериновой протеазы и по меньшей мере на 86% идентичный аминокислотной последовательности SEQ ID NO:15;
(в) нуклеиновокислотную молекулу, содержащую кодирующую последовательность нуклеотидной последовательности, показанной в SEQ ID NO:10;
(г) нуклеиновокислотную молекулу, соответствующую кодирующей последовательности полинуклеотидной последовательности SEQ ID NO:10, содержащейся в штамме E.coli, депонированном в DSMZ под номером DSM 22172;
(д) нуклеиновокислотную молекулу, кодирующая последовательность которой отличается от кодирующей последовательности нуклеиновокислотной молекулы любого из подпунктов от (в) до (г) из-за вырожденности генетического кода.

Комментарии