Катализатор биологического происхождения для задержки процессов развития растений - RU2482681C2
Код документа: RU2482681C2
Чертежи






Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам задержки развития растений, включающим воздействие на растение или часть растения одной или более бактерий или ферментов. Дополнительно предусмотрены устройства задержки процесса развития растений.
УРОВЕНЬ ТЕХНИКИ
Образование этилена в растениях и частях растений вызвано многообразием внешних факторов и стрессоров, включая повреждения, применение гормонов (например, ауксина), анаэробные условия, охлаждение, нагрев, засушливость и заражение патогенами. Повышенное образование этилена также наблюдается во многих процессах развития растений, включая созревание плодов или овощей, прорастание семян, опадание листьев и увядание цветков.
Биосинтез этилена в растениях традиционно изображают в виде биокаталитической схемы, включающей три фермента, обычно называемой “цикл Янга”, в которой синтаза S-аденозил-L-метионина (SAM) катализирует превращение метионина в S-аденозил-L-метионин (AdoMet); синтаза 1-аминоциклопропан-1-карбоксильной кислоты (ACC) катализирует превращение AdoMet в ACC; и ACC-оксидаза катализирует превращение ACC в этилен и побочные продукты диоксид углерода и цианистый водород. Общее описание биосинтеза этилена в растениях и процессов развития растений, регулируемых этиленом, можно найти, например, в Srivastava (2001) Plant Growth and Development: Hormones and Environment (Academic Press, New York).
Ранее проведенные исследования показали, что созревание климактерических плодов вызывается, по меньшей мере частично, внезапным и значительным усилением биосинтеза этилена. Хотя резкое увеличение образования этилена участвует в процессе созревания климактерических плодов, точный механизм этого процесса, особенно для неклимактерических плодов, до конца не понят. Хотя в неклимактерическом плоде отсутствует внезапный рост продукции этилена, неклимактерический плод также реагирует на этилен. Более того, плоды, овощи и другие продукты растительного происхождения отличаются по количеству синтезируемого этилена, а также по чувствительности определенного продукта к этилену. Например, для яблок характерен высокий уровень синтеза этилена и чувствительности к этилену, тогда как у артишоков обнаружен низкий уровень биосинтеза этилена и чувствительности к этилену. См., например, Cantwell (2001) “Properties and Recommended Conditions for Storage of Fresh Fruit and Vegetables” на сайте postharvest.ucdavis.edu/Produce/Storage/index.shtml (дата последнего обращения: 6 марта, 2007 г.), которая полностью включена в данную заявку посредством ссылки. Созревание плода обычно приводит к изменению цвета, размягчению околоплодника и изменению содержания сахара и вкуса плода. Тогда как созревание в начальной стадии делает плод более съедобным и привлекательным для употребления в пищу, этот процесс в конечном счете приводит к деградации и ухудшению качества плода, делая его неприемлемым для употребления и приводя к значительному коммерческому убытку в стоимостном выражении. Контроль процесса созревания желателен для улучшения срока хранения и увеличения времени, доступного для транспортировки, хранения и продажи плода и других сельскохозяйственных продуктов, подлежащих созреванию.
Помимо резкого увеличения биосинтеза этилена в климактерических плодах, изменения при созревании также связаны с повышением интенсивности дыхания. В результате дыхания плодов, овощей и других продуктов растительного происхождения образуется теплота и, следовательно, она оказывает влияние на срок хранения и требуемые условия хранения (например, хранение в холодильнике) этих продуктов. Продукты растительного происхождения с более интенсивным дыханием (например, артишоки, срезанные цветы, спаржа, брокколи, шпинат, и т.д.) имеют более короткие сроки хранения, чем продукты с менее интенсивным дыханием (например, орехи, финики, яблоки, цитрусовые, виноград, и т.д.). На дыхание оказывает влияние ряд факторов окружающей среды, включая температуру, состав атмосферы, физический стресс, дневной свет, химический стресс, радиацию, стресс, вызванный недостатком воды, регуляторы роста и поражение патогенами. В частности, температура играет значительную роль в интенсивности дыхания. Для общего обзора дыхательного газообмена и рекомендованных контролируемых атмосферных условий для плодов, овощей и других продуктов растительного происхождения см., например, Kader (2001) Postharvest Horticulture Series No. 22A:29-70 (Калифорнийский университет в Дейвисе); Saltveit (Калифорнийский университет в Дейвисе) “Respiratory metabolism” на usna.usda.gov/hb66/019respiration.pdf (дата последнего обращения: 6 марта, 2007 г.); и Cantwell (2001) “Properties and Recommended Conditions for Storage of Fresh Fruit and Vegetables” на postharvest.ucdavis.edu/Produce/Storage/index.shtml (дата последнего обращения: 6 марта, 2007 г.), каждая из которых полностью включена в данную заявку посредством ссылки.
Способы и композиции для задержки процесса созревания плода включают, например, применение солей серебра (например, тиосульфата серебра), 2,5-норборнадиена, перманганата калия, 1-метилциклопропена (1-MCP), циклопропена (CP) и их производных. Эти соединения имеют значительные недостатки, как, например присутствие тяжелых металлов, дурных запахов и взрывоопасных свойств при сжатии, что делает их неприемлемыми или ограничивает их применимость для использования в пищевой промышленности. Трансгенные способы контроля образования этилена для задержки процессов развития растений (например, созревания плода) путем введения последовательностей нуклеиновых кислот, которые ограничивают образование этилена, особенно путем уменьшения экспрессии ферментов ACC синтазы или ACC оксидазы, также находятся в стадии исследования. Общественная реакция на генетически модифицированные сельскохозяйственные продукты тем не менее неблагосклонна.
Соответственно, в данной отрасли сохраняется существенная необходимость в безопасных способах и устройствах для задержки процессов развития растений. Такие способы и устройства могли бы обеспечить лучший контроль за созреванием плодов, созреванием овощей, увяданием цветов, опадением листьев и прорастанием семян, и продлить срок хранения различных сельскохозяйственных продуктов (например, плодов, овощей и срезанных цветов), тем самым позволяя транспортировку этих продуктов на более дальние расстояния без необходимости охлаждения, повышая привлекательность продукта для потребителей и уменьшая денежные расходы, связанные с потерей продукта вследствие преждевременного созревания и увядания.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Предусмотрены способы задержки процесса развития растений, включающие, но не ограниченные перечисленными: созревание плодов, созревание овощей, увядание цветов и опадание листьев. Способы согласно настоящему изобретению, как правило, включают воздействие на растение или часть растения одной или более бактерий в количестве, достаточном для задержки процесса развития интересующих растений. В некоторых аспектах настоящего изобретения, бактерии выбраны из группы, состоящей из: видов Rhodococcus, Pseudomonas chloroaphis, Brevibacterium ketoglutamicum, и их смесей. Бактерии, используемые для применения на практике способов согласно настоящему изобретению, могут быть дополнительно обработаны стимулирующим агентом, включая, например, аспарагин, глутамин, кобальт, мочевину, и их смеси, чтобы индуцировать способность бактерий задерживать процесс развития интересующих растений.
Настоящее изобретение дополнительно обеспечивает устройства задержки процесса развития растений, включающие катализатор, содержащий одну или более бактерий, особенно видов Rhodococcus, Pseudomonas chloroaphis, Brevibacterium ketoglutamicum, или их смесь. Любое устройство, которое позволяет осуществлять воздействие катализатора на растение или часть растения и задерживает процесс развития интересующих растений, входит в объем настоящего изобретения. Типичные устройства включают такие, в которых катализатор иммобилизован на матрице и помещен внутри, помещен сверху или другим способом прикреплен к любой физической структуре. Различные конфигурации описанных устройств предусмотрены и подробнее описаны ниже в данной заявке. Способы и устройства согласно настоящему изобретению для задержки процесса развития растений могут найти применение, в частности, для увеличения срока хранения и облегчения транспортировки на дальние расстояния продуктов растительного происхождения, таких как, например, плоды, овощи и цветы, улучшения удовлетворенности потребителя в продукте и уменьшения потери продукта в результате преждевременного созревания или увядания.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Таким образом, после того, как изобретение описано в общих чертах, в данном разделе представлены сопроводительные фигуры, которые не обязательно выполнены в масштабе, и на которых:
На ФИГ. 1 представлено неограничивающее объем изобретения изображение трехслойного устройства для задержки созревания плодов. Наружные слои (обозначенные A и B) обеспечивают структурную целостность устройства. Каталитический слой, определенный ниже в данной заявке, включает один или более ферментов согласно настоящему изобретению, и он расположен между наружными слоями.
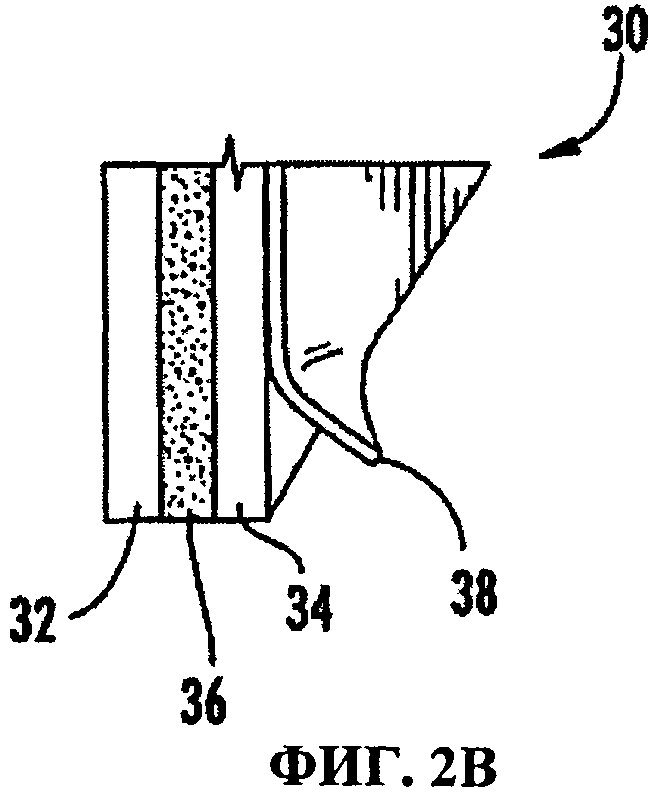
На ФИГ. 2A-C представлены неограничивающие объем изобретения изображения различных устройств для задержки созревания плодов. Эти устройства включают каталитический слой, один или более слоев, предназначенных для обеспечения структурной целостности, и один или более слоев, которые должны быть удалены перед применением устройства. Удаление одного или более из этих слоев может, например, открыть клейкое вещество для прикрепления устройства к другой физической структуре.
На ФИГУРАХ 3A-3B представлено неограничивающее объем изобретения изображение устройства для задержки созревания плодов. Устройство включает катализатор, иммобилизованный на слое пленки и закрепленный на физической структуре (например, ящике, подходящем для хранения/транспортировки плодов).
На ФИГ. 4 представлено неограничивающее объем изобретения изображение устройства для задержки созревания плодов. Устройство включает сегментированную полостную структуру, которая позволяет осуществлять вставку и замену одной или более каталитических модульных секций, как описано ниже. Наружные слои физической структуры могут состоять из материала, который позволяет воздуху проникать в катализатор.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящие изобретения будут описаны далее более подробно со ссылкой на конкретные варианты реализации настоящего изобретения и, в частности, на различные фигуры, представленные в приложении. В действительности, настоящее изобретение может быть реализовано во многих различных формах и объем изобретения не ограничивается вариантами реализации, описанными в данной заявке; скорее, эти варианты реализации представлены с тем, чтобы настоящее описание изобретения удовлетворяло соответствующим законодательным требованиям. В настоящем описании, и в прилагаемой формуле изобретения, единственное число включает ссылку на множественное, если в контексте четко не указано иное.
Везде в настоящем описании слово “включающий”, или его грамматические формы, следует понимать в значении, которое подразумевает включение указанного элемента, числа или этапа, или группы элементов, чисел или этапов, но не исключение возможности присутствия любого другого элемента, числа или этапа, или группы элементов, чисел или этапов.
Настоящее изобретение обеспечивает способы задержки интересующего процесса развития растений, включающие воздействие на растение или часть растения одной или более бактерий. В конкретных вариантах реализации описаны способы задержки процесса развития растений, включающие воздействие на растение или часть растения одной или более бактерий, выбранных из группы, состоящей из видов Rhodococcus, Pseudomonas chloroaphis, Brevibacterium ketoglutamicum, и их смесей, при этом указанные одна или более бактерий воздействуют на растение или часть растения в количестве, достаточном для задержки процесса развития растений. Дополнительно предусмотрены устройства для задержки интересующего процесса развития растений и для осуществления способов, описанных в данной заявке. Способы и устройства согласно настоящему изобретению можно применять, например, для задержки процесса созревания плодов/овощей или процесса увядания цветов и для повышения срока хранения плодов, овощей или цветов, что таким образом облегчает транспортировку, дистрибуцию и продажу таких продуктов растительного происхождения.
В данной заявке термин “растение” или “часть растения” широко определен и включает целые растения и любую часть растения, включая, но не ограничиваясь перечисленными: плоды, овощи, цветы, семена, листья, орехи, зародыши, пыльцу, семяпочки, ветки, косточки, колосья, початки, кожуру, стебли, корни, кончики корней, пыльники, и тому подобное. В конкретных вариантах реализации, часть растения представляет собой плод, овощ или цветок. В некоторых вариантах настоящего изобретения, часть растения представляет собой плод, конкретнее климактерический плод, описанный более подробно ниже.
Способы и устройства согласно настоящему изобретению направлены на задержку процесса развития растений, например, процесса развития растений, как правило, связанного с повышенным биосинтезом этилена. Термин “процесс развития растений” подразумевает любой процесс роста или развития растения или части растения, включая, но не ограничиваясь перечисленными: созревание плодов, созревание овощей, увядание цветов, опадание листьев, прорастание семян, и тому подобное. В конкретных вариантах реализации, интересующий процесс развития растений представляет собой созревание плодов или овощей, увядание цветов или опадение листьев, в частности созревание плодов или овощей. Определенный в данной заявке термин “задержка процесса развития растений”, и его грамматические формы, относится к любому замедлению, прерыванию, подавлению или ингибированию процесса развития интересующих растений или фенотипических или генотипических изменений растения или части растения, обычно связанных с конкретным процессом развития растения. Например, когда интересующий процесс развития растения представляет собой созревание плодов, задержка созревания плодов может включать ингибирование изменений, как, правило связанных с процессом созревания (например, с изменением цвета, размягчением околоплодника (т.е. стенки завязи), повышением содержания сахара, изменением вкуса, общим разрушением/ухудшением плода и потенциальным уменьшением привлекательности плода для потребителей, как описано выше). Для специалиста в данной области очевидно, что период времени, требуемый для созревания плодов, будет изменяться, например, в зависимости от типа плода и конкретных применяемых условий хранения (например, температуры, влажности, вентиляции, и т.д.). Соответственно, “задержка созревания плодов” может составлять от 1 до 90 дней, конкретнее от 1 до 30 дней, конкретнее от 5 до 30 дней. Способы оценки задержки процесса развития растений, такого как созревание плодов, созревание овощей, увядание цветов и опадание листьев, известны специалистам в данной области и могут быть основаны, например, на сравнении с процессами развития растений для необработанных растений или частей растений. В некоторых аспектах настоящего изобретения, задержки в процессе развития растений, обусловленные применением на практике способов согласно настоящему изобретению, можно оценить по сравнению с необработанными растениями или частями растений, или с растениями или частями растений, которые были обработаны одним или более агентами, задерживающими интересующий процесс развития растений. Например, задержку в созревании плодов, обусловленную осуществлением способа согласно настоящему изобретению, можно сравнить со временем созревания плодов для необработанного плода или плода, который был обработан агентом против созревания, таким как описанные выше в данной заявке.
Способы задержки процесса развития растений согласно настоящему изобретению обычно включают осуществление воздействия на растение или часть растения одной или более из следующих бактерий: виды Rhodococcus, Pseudomonas chloroaphis, Brevibacterium ketoglutamicum, или смесью, содержащей любую комбинацию этих бактерий. В некоторых вариантах реализации, одна или более бактерий включают виды Rhodococcus, в частности штамм DAP 96253 Rhodococcus rhodochrous, штамм DAP 96622 вида Rhodococcus, Rhodococcus erythropolis, или их смеси. В данной заявке, воздействие на растение или часть растения одной или более из вышеупомянутых бактерий включает, например, воздействие интактных бактериальных клеток, лизатов бактериальных клеток и бактериальных экстрактов, которые обладают ферментной активностью (т.е. “ферментных экстрактов”). Способы получения лизатов и ферментных экстрактов из клеток, включая бактериальные клетки, являются общеизвестными в данной области. Одна или более бактерий, используемых в способах и устройствах согласно настоящему изобретению, может иногда в более общем смысле упоминаться в данной заявке как “катализатор”.
В соответствии со способами согласно настоящему изобретению, осуществляют воздействие на растение или часть растения одной или более бактериями, в количестве, достаточном для задержки процесса развития растения. Осуществление “воздействия” на растение или часть растения одной или более бактериями согласно настоящему изобретению включает любой способ воздействия бактерией на растение или часть растения. Непрямые способы воздействия включают, например, помещение бактерии или смеси бактерий на произвольное расстояние от растения или части растения (т.е. непрямое воздействие). В других вариантах реализации, бактерии могут воздействовать на растение или часть растения посредством близкого или непосредственного контакта. Более того, используемый в данной заявке термин “достаточное” количество одной или более бактерий согласно настоящему изобретению зависит от множества факторов, включая, но не ограничиваясь перечисленными: конкретные используемые в способе бактерии, форму, в которой бактерии воздействуют на растение или часть растения (например, в виде интактных бактериальных клеток, клеточных лизатов или ферментных экстрактов, как описано выше), способы воздействия бактерии на растение или часть растения, и период времени воздействия. Специалист в данной области при помощи обычных экспериментов сможет определить “достаточное” количество одной или более бактерий, необходимых для задержки процесса развития интересующих растений.
Хотя в конкретных вариантах реализации настоящего изобретения одна или более бактерий выбраны из группы, состоящей из: видов Rhodococcus, Pseudomonas chloroaphis, Brevibacterium ketoglutamicum, любую бактерию, которая задерживает процесс развития растения при ее воздействии на растение или часть растения, можно применять в способах и устройствах согласно настоящему изобретению. Например, бактерии, принадлежащие к роду Nocardia [см. заявку на патент Японии номер 54-129190], Rhodococcus [см. заявку на патент Японии номер 2-470], Rhizobium [см. заявку на патент Японии номер 5-236977], Klebsiella [заявка на патент Японии номер 5-30982], Aeromonas [заявка на патент Японии номер 5-30983], Agrobacterium [заявка на патент Японии номер 8-154691], Bacillus [заявка на патент Японии номер 8-187092], Pseudonocardia [заявка на патент Японии номер 8-56684], Pseudomonas и Mycobacterium, представляют собой неограничивающие примеры микроорганизмов, которые можно применять согласно настоящему изобретению. Не все виды, принадлежащие к данному роду, могут проявлять одинаковые свойства. Таким образом, возможно, что род, о котором известно, что он включает штаммы, способные проявлять желаемую активность (например, способность задерживать определенный процесс развития растений, такой как созревание плодов), может также включать один или более видов, которые обычно не проявляют желаемой активности. В свете описания настоящего изобретения, приведенного в данной заявке, и известного уровня техники в данной области тем не менее специалисту в данной области потребуются рутинные эксперименты, чтобы провести анализ и определить, обладают ли определенные виды одной или более из желаемых активностей.
Кроме того, конкретные примеры бактерий, используемых согласно настоящему изобретению, включают, но не ограничены перечисленными: вид Nocardia, вид Rhodococcus, Rhodococcus rhodochrous, вид Klebsiella, вид Aeromonas, Citrobacter freundii, Agrobacterium rhizogenes, Agrobacterium tumefaciens, Xanthobacter flavas, Erwinia nigrifluens, вид Enterobacter, вид Streptomyces, вид Rhizobium, Rhizobium loti, Rhizobium legminosarum, Rhizobium merioti, Candida guilliermondii, Pantoea agglomerans, Klebsiella pneumoniae подвида pneumoniae, Agrobacterium radiobacter, Bacillus smithii, Pseudonocardia thermophila, Pseudomonas chloroaphis, Pseudomonas erythropolis, Brevibacterium ketoglutamicum, Rhodococcus erythropolis, Nocardia farcinica, Pseudomonas aeruginosa и Heliobacter pylori. В конкретных вариантах реализации, бактерии из рода Rhodococcus, а именно штамм DAP 96253 Rhodococcus rhodochrous (номер депонирования в ATCC 55899; депонированный в ATCC 11 декабря, 1996 г.), штамм DAP 96622 вида Rhodococcus (номер депонирования в ATCC 55898; депонированный в ATCC 11 декабря, 1996 г.), Rhodococcus erythropolis, или их смеси, применяют в способах и устройствах согласно настоящему изобретению.
В некоторых вариантах настоящего изобретения, указанная одна или более бактерий “стимулированы”, с тем чтобы придать им желаемые свойства (например, способность задерживать процесс развития растений, такой как созревание плодов), путем воздействия на них или обработкой подходящим стимулирующим агентом. Стимулирующие агенты включают, но не ограничены перечисленными: аспарагин, глутамин, кобальт, мочевину или любую их смесь. В конкретных вариантах реализации, бактерии подвергают воздействию, или обрабатывают стимулирующим агентом аспарагином, в частности, смесью стимулирующих агентов, включающей аспарагин, кобальт и мочевину. Стимулирующий агент можно добавить в любой момент культивирования заданных клеток. Например, что касается бактерий, в культуральную среду можно внести стимулирующий агент перед началом культивирования бактерий. В качестве альтернативы, бактерии можно культивировать в среде в течение заранее определенного количества времени, чтобы вырастить бактерии, и стимулирующий агент можно добавить в один или более заранее определенных моментов времени, чтобы индуцировать желаемую ферментную активность бактерий. Более того, стимулирующий агент можно добавить в питательную среду (или в отдельную смесь, включающую ранее выращенные бактерии), чтобы индуцировать желаемую активность бактерий по завершении роста бактерий.
Не ограничиваясь определенным механизмом, “стимулирование” бактерий согласно настоящему изобретению может привести к образованию (или к усиленному образованию) одного или более ферментов, таких как нитрилгидратаза, амидаза и/или аспарагиназа, и стимулирование одного или более из этих ферментов может играть роль в задержке процесса развития интересующих растений. “Нитрилгидратазы”, “амидазы” и “аспарагиназы” включают семейства ферментов, присутствующих в клетках различных организмов, включая, но не ограничиваясь перечисленными: бактерии, грибы, растения и животные. Такие ферменты хорошо известны специалистам в данной области, и каждый класс ферментов обладает хорошо известными ферментативными активностями. “Ферментная активность” в данной заявке, как правило, относится к способности фермента выполнять функцию катализатора в процессе, таком как превращение одного соединения в другое. В частности, нитрилгидратаза катализирует гидролиз нитрила (или циангидрина) в соответствующий амид (или оксикислоту). Амидаза катализирует гидролиз амида в соответствующую кислоту или гидроксикислоту. Аналогично, фермент аспарагиназы, такой как аспарагиназа I, катализирует гидролиз аспарагина в аспарагиновую кислоту.
В некоторых вариантах настоящего изобретения, ферментвная активность может быть указана в “единицах” на массу фермента или клеток (обычно на основании сухого веса клеток, например, единицы/мг свк). “Единица”, как правило, относится к способности преобразовывать определенное количество соединения в другое соединение при определенных условиях, как функция от времени. В определенных вариантах реализации, одна “единица” активности нитрилгидратазы может относиться к способности преобразовывать один мкмоль акрилонитрила в соответствующий амид в минуту, на миллиграмм клеток (сухой вес) при pH 7,0 и температуре, равной 30ºC. Аналогично, одна единица активности амидазы может относиться к способности преобразовывать один мкмоль акриламида в соответствующую кислоту в минуту, на миллиграмм клеток (сухой вес) при pH 7,0 и температуре, равной 30ºC. Дополнительно, одна единица активности аспарагиназы может относиться к способности преобразовывать один мкмоль аспарагина в соответствующую кислоту в минуту, на миллиграмм клеток (сухой вес) при pH 7,0 и температуре, равной 30ºC. Тесты для измерения активности нитрилгидратазы, амидазы, или активности аспарагиназы известны в данной области и включают, например, детектирование свободного аммиака. См. Fawcett и Scott (1960) J. Clin. Pathol. 13:156-159, которая полностью включена в данную заявку посредством ссылки.
Способы задержки процесса развития растения, включающие воздействие на растение или часть растения одним или более ферментов, выбранных из группы, состоящей из нитрилгидратазы, амидазы, аспарагиназы, или их смеси, при этом один или более ферментов воздействуют на растение или часть растения в количестве или при уровне ферментной активности, достаточном для задержки процесса развития растения, дополнительно входят в объем настоящего изобретения. Например, целые клетки, которые производят, стимулированы для производства, или генетически модифицированы для производства одного или более из вышеупомянутых ферментов (т.е. нитрилгидратазы, амидазы и/или аспарагиназы), можно применять в способах задержки процесса развития растения. В качестве альтернативы, нитрилгидратазу, амидазу и/или аспарагиназу можно выделить, очистить или частично очистить из любых из вышеупомянутых клеток и подвергнуть их действию растение или часть растения в более изолированной форме. См., например, Goda и др. (2001) J. Biol. Chem. 276:23480-23485; Nagasawa и др. (2000) Eur. J. Biochem. 267:138-144; Soong и др. (2000) Appl. Environ. Microbiol. 66:1947-1952; Kato и др. (1999) Eur. J. Biochem. 263:662-670, каждая из которых полностью включена в данную заявку посредством ссылки. Кроме того, для специалиста в данной области очевидно, что один тип клеток может быть способен производить (или его можно стимулировать, или генетически модифицировать для производства) более чем одного из ферментов согласно настоящему изобретению. Такие клетки являются подходящими для применения в описанных способах и устройствах.
Последовательности нуклеотидов и аминокислот для нескольких нитрилгидратаз, амидаз и аспарагиназ из различных организмов описаны в открытых для доступа базах данных последовательностей. Неограничивающий список типичных нитрилгидратаз и алифатических амидаз, известных в данной области, приведен в Таблицах 1 и 2 и в списке последовательностей. “Белковый показтель”, упоминаемый в Таблицах 1 и 2, обеспечивает общее представление о процентных интервалах достоверности (% инт. достовер.) идентификации выделенных белков на основании результатов масс-спектроскопии.
Как правило, любую бактериальную, грибковую, растительную или животную клетку, способную производить или которую можно стимулировать для производства нитрилгидратазы, амидазы, аспарагиназы, или любой их комбинации, можно использовать в реализации настоящего изобретения. Нитрилгидратаза, амидаза и/или аспарагиназа могут образовываться конститутивно в клетке, взятой из определенного организма (например, в клетке бактерии, грибка, растения или животного) или, в качестве альтернативы, клетка может производить желаемый фермент или ферменты только после “индукции” подходящим стимулирующим агентом. Термин “конститутивно” предназначен для обозначения того, что по меньшей мере один фермент согласно настоящему изобретению непрерывно образуется или экспрессируется в определенном типе клеток. Другие типы клеток тем не менее могут нуждаться в “стимулировании”, как описано выше, чтобы экспрессировать нитрилгидратазу, амидазу и/или аспарагиназу в достаточном количестве или с достаточным уровнем ферментной активности для задержки процесса развития интересующих растений. То есть фермент согласно настоящему изобретению может продуцироваться (или продуцироваться на достаточном уровне) только после воздействия или обработки подходящим стимулирующим агентом. Такие стимулирующие агенты известны в данной области и приведены выше. Например, в некоторых вариантах настоящего изобретения, одну или более бактерий обрабатывают стимулирующим агентом, таким как аспарагин, глутамин, кобальт, мочевина, или любой их смесью, конкретнее, смесью аспарагина, кобальта и мочевины. Более того, как описано в заявке на патент США, находящейся на рассмотрении, номер 11/669,011, под названием “Induction and Stabilization of Enzymatic Activity in Microorganisms”, поданной 30 января, 2007 г., активность аспарагиназы I можно индуцировать в DAP 96622 Rhodococcus rhodochrous (грамположительный) или в DAP 96253 вида Rhodococcus (грамположительный), в среде, дополненной амидсодержащими аминокислотами, или их производными. Другие штаммы Rhodococcus также можно предпочтительно аналогично индуцировать, чтобы они проявляли ферментную активность аспарагиназы I, применяя амидсодержащие аминокислоты, или их производные.
В других вариантах настоящего изобретения, P. chloroaphis (номер депонирования в ATCC 43051), которая производит активную аспарагиназу I в присутствии аспарагина, и B. kletoglutamicum (номер депонирования в ATCC 21533), грамположительная бактерия, для которой также известно, что она продуцирует активную аспарагиназу, применяются в описанных способах. Грибковые клетки, такие как клетки рода Fusarium, клетки растений и клетки животных, которые экспрессируют нитрилгидратазу, амидазу и/или аспарагиназу, можно также применять в способах и устройствах, описанных в данной заявке, либо в виде целых клеток, либо в виде источника, из которого можно выделить один или более из вышеупомянутых ферментов.
В дополнительных вариантах реализации, клетки-хозяева, которые были изменены методами генетической инженерии, для экспрессирования нитрилгидратазы, амидазы и/или аспарагиназы, можно применять, подвергая их действию растение или часть растения, в соответствии со способами согласно настоящему изобретению и устройствами для задержки процесса развития растений. В частности, полинуклеотид, который кодирует нитрилгидратазу, амидазу или аспарагиназу (или множество полинуклеотидов, каждый из которых кодирует нитрилгидратазу, амидазу или аспарагиназу), можно ввести с помощью стандартных методик молекулярной биологии в клетку-хозяина, чтобы получить трансгенную клетку, которая экспрессирует один или более ферментов согласно настоящему изобретению. Использование терминов “полинуклеотид”, “полинуклеотидная структура”, “нуклеотид” или “нуклеотидная структура” не подразумевается ограничивающим настоящее изобретение полинуклеотидами или нуклеотидами, включающими ДНК. Для средних специалистов в данной области будет очевидно, что полинуклеотиды и нуклеотиды могут включать рибонуклеотиды и комбинации рибонуклеотидов и дезоксирибонуклеотидов. Такие дезоксирибонуклеотиды и рибонуклеотиды включают как встречающиеся в природе молекулы, так и синтетические аналоги. В полинуклеотиды согласно настоящему изобретению также входят все формы последовательностей, включая, но не ограничиваясь, перечисленными: одноцепочечные формы, двухцепочечные формы, и тому подобное.
Варианты и фрагменты полинуклеотидов, которые кодируют полипептиды, которые сохраняют желаемую ферментную активность (т.е. нитрилгидратазную, амидазную или аспарагиназную активность), можно также использовать в реализации настоящего изобретения. Под термином “фрагмент” подразумевается часть полинуклеотида и, следовательно, он также кодирует часть соответствующего белка. Полинуклеотиды, которые представляют собой фрагменты нуклеотидной последовательности фермента, как правило, включают по меньшей мере 10, 15, 20, 50, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 800, 900, 1,000, 1,100, 1,200, 1,300, или 1,400 последовательных нуклеотидов, или вплоть до количества нуклеотидов, присутствующих в полноразмерной полинуклеотидной последовательности фермента. Фрагмент полинуклеотида кодирует полипептид с желаемой ферментной активностью и, как правило, кодирует по меньшей мере 15, 25, 30, 50, 100, 150, 200 или 250 последовательных аминокислот, или вплоть до общего количества аминокислот, присутствующих в полноразмерной последовательности аминокислот фермента согласно настоящему изобретению. Термин “вариант” предназначен для обозначения по существу сходных последовательностей. Как правило, варианты определенной последовательности фермента согласно настоящему изобретению по меньшей мере приблизительно на 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичны с эталонной последовательностью фермента, что можно определить с помощью стандартных программ выравнивания последовательностей. Варианты полинуклеотидов, входящие в объем настоящего изобретения, кодируют полипептиды с желаемой ферментной активностью.
В контексте получения трансгенных клеток, термин “введение” предназначен для обозначения обеспечения клетки-хозяина, конкретнее, микроорганизма, такого как Escherichia coli, полинуклеотидом, который кодирует нитрилгидратазу, амидазу и/или аспарагиназу. В некоторых вариантах реализации, полинуклеотид обеспечивается таким образом, что последовательность получает доступ к внутреннему пространству клетки-хозяина, включая его возможное встраивание в геном клетки-хозяина. Способы согласно настоящему изобретению не зависят от конкретного способа введения последовательности в клетку-хозяина, за исключением того, что полинуклеотид получает доступ к внутреннему пространству по меньшей мере одной клетки-хозяина. Способы введения полинуклеотидов в клетки-хозяева хорошо известны в данной области, включая, но не ограничиваясь перечисленными: способы стабильной трансфекции, способы временной трансфекции и способы, опосредованные вирусом. Термин “стабильная трансфекция” означает, что полинуклеотидная структура, введенная в клетку-хозяина, встраивается в геном хозяина и может наследоваться ее потомством. Термин “временная трансфекция” или “временная экспрессия” означает, что полинуклеотид введен в клетку-хозяина, но не встраивается в геном хозяина.
Более того, последовательность нуклеотидов нитрилгидратазы, амидазы или аспарагиназы может содержаться, например, в плазмиде для введения в клетку-хозяина. Типичные интересующие плазмиды включают векторы, имеющие определенные сайты клонирования, точки начала репликации и селектируемые маркеры. Плазмида может дополнительно включать последовательности инициации транскрипции и трансляции и терминаторы транскрипции и трансляции. Плазмиды могут также включать типичные кассеты экспрессии, содержащие по меньшей мере одну независимую последовательность терминатора, последовательности, позволяющие репликацию кассеты в эукариотах, или прокариотах, или обоих (например, челночные векторы), и селекционные маркеры как для прокариотических, так и для эукариотических систем. Векторы подходят для репликации и встраивания в прокариот, эукариот, или, оптимально, в обоих. Для общих описаний систем и способов клонирования, упаковки и экспрессии см. Giliman и Smith (1979) Gene 8:81-97; Roberts и др. (1987) Nature 328:731-734; Berger и Kimmel (1989) Guide to Molecular Cloning Techniques, Methods in Enzymology, том 152 (Academic Press, Inc., Сан-Диего, Калифорния); Sambrook и др. (1989) Molecular Cloning: A Laboratory Manual, тома 1-3 (2-е изд.; Cold Spring Harbor Laboratory Press, Плейнвью, Нью-Йорк); и Ausubel и др., ред. (1994) Current Protocols in Molecular Biology, Current Protocols (Greene Publishing Associates, Inc., и John Wiley & Sons, Inc., New York; 1994 Supplement). Трансгенные клетки-хозяева, которые экспрессируют один или более ферментов согласно настоящему изобретению, можно применять в описанных способах и устройствах как целые клетки или как биологический источник, из которого можно выделить один или более ферментов согласно настоящему изобретению.
Дополнительно предусмотрены устройства для задержки процесса развития растений и для осуществления способов согласно настоящему изобретению. В конкретных вариантах реализации, устройство для задержки процесса развития растений, конкретнее, для задержки созревания плодов, включающее катализатор, который содержит одну или более бактерий, выбранных из группы, состоящей из: видов Rhodococcus, Pseudomonas chloroaphis, Brevibacterium ketoglutamicum, и их смесей, - входит в объем настоящего изобретения. Штамм DAP 96253 Rhodococcus rhodochrous, штамм DAP 96622 вида Rhodococcus, Rhodococcus erythropolis, или их смеси, могут применяться в определенных вариантах настоящего изобретения. Одна или более бактерий устройства согласно настоящему изобретению предусмотрены в количестве, достаточном для задержки процесса развития интересующих растений, определенном в данной заявке выше. В других вариантах настоящего изобретения, катализатор включает один или более ферментов (т.е. нитрилгидратазу, амидазу и/или аспарагиназу) в количестве или при уровне ферментной активности, достаточном для задержки процесса развития растений. Источники ферментов, предпочтительных для применения в качестве катализатора в устройстве согласно настоящему изобретению также подробно описаны выше. Например, катализатор может применяться в форме целых клеток, которые производят (или индуцированы, или генетически модифицированы для производства) одного или более ферментов согласно настоящему изобретению, или может включать сам фермент(ы) в выделенной, очищенной или частично очищенной форме.
Устройства для задержки процесса развития растений, входящие в объем настоящего изобретения, могут быть предусмотрены во множестве подходящих форм и могут быть предназначены для однократного применения или многократного применения (например, “перезаряжаемые”). Более того, устройства согласно настоящему изобретению находят применение как в бытовых, так и в коммерческих условиях. Например, такие устройства могут быть встроены в бытовые или коммерческие холодильники, включены в поезда, грузовики и т.д. для транспортировки на дальние расстояния плодов, овощей или цветов, или применяться как отдельностоящие шкафы для хранения или транспортировки таких продуктов растительного происхождения. Типичные неограничивающие устройства согласно настоящему изобретению описаны ниже в данной заявке и изображены на Фигурах 1-4.
В конкретных вариантах реализации, катализатор предусмотрен в иммобилизованном виде. Любой процесс или матрицу для иммобилизации катализатора можно применять при условии, что способность одной или более бактерий (или ферментов) к задержке процесса развития растений сохраняется. Например, катализатор может быть иммобилизован на матрице, включающей альгинат (например, альгинат кальция), карраген, диэтиламиноэтилцеллюлозу (DEAE-целлюлозу) или полиакриламид. Другие подобные матрицы хорошо известны в данной области и могут быть дополнительно связаны перекрестными связями с любым подходящим связывающим перекрестными связями агентом, включая, но не ограничиваясь перечисленными: глутаральдегид или полиэтиленимин, для повышения механической прочности каталитической матрицы. В одном варианте настоящего изобретения, катализатор иммобилизован на DEAE-целлюлозной матрице, связанной перекрестными связями с помощью глутаральдегида. Катализатор, конкретнее, иммобилизованный катализатор, может также называться в данной заявке “каталитической модульной секцией”. Каталитическая модульная секция включает катализатор, такой как иммобилизованный катализатор, внутри дополнительной структуры, которая, например, уменьшает возможный контакт с катализатором, облегчает замену катализатора или позволяет воздуху проникать через катализатор.
В одном варианте реализации, матрица включает альгинат, или его соли. Альгинат представляет собой линейный сополимер с гомополимерными блоками (1-4)-сшитого ß-D-маннуроната (M) и его эпимерными по C-5 остатками α-L-гулуроната (G), соответственно, ковалентно связанными друг с другом в различных последовательностях или блоках. Мономеры могут присутствовать в гомополимерных блоках последовательных G-остатков (G-блоки), последовательных M-остатков (M-блоки), попеременных M и G-остатков (MG-блоки), или беспорядочно организованных блоках. В одном варианте реализации, альгинат кальция используется в качестве субстрата, конкретнее, альгинат кальция, который был связан перекрестными связями, как, например, с полиэтиленимином, с образованием загустевшего альгината кальция. Дополнительное описание таких методик иммобилизации можно найти у Bucke (1987) “Cell Immobilization in Calcium Alginate” в Methods in Enzymology, том. 135(B) (Academic Press, Inc., Сан-Диего, Калифорния; Mosbach, ред.), которая включена в данную заявку посредством ссылки. Типичный способ иммобилизации с использованием альгината кальция, связанного перекрестными связями с помощью полиэтиленимина, также описан ниже в Примере 5. В другом варианте реализации, матрица включает амидсодержащий полимер. Любой полимер, включающий одну или более амидных групп, можно применять согласно настоящему изобретению. В одном варианте реализации, субстрат включает полиакриламидный полимер.
Повышенной механической прочности матрицы с иммобилизованным катализатором можно достичь благодаря связыванию поперечными связям. Например, клетки можно химически связать поперечными связями с образованием агглютинировавших скоплений клеток. В одном варианте реализации, собранные из культуры клетки были связаны поперечными связями с применением глутаральдегида. Например, клетки можно суспендировать в смеси деионизированной воды и глутаральдегида, а затем добавлять полиэтиленимин до тех пор, пока не будет достигнута максимальная флокуляция. Связанные поперечными связями клетки (обычно в виде частиц, образованных несколькими клетками) можно выделить путем обычной фильтрации. Дополнительное описание таких методик приведено у Lopez-Gallego и др. (2005) J. Biotechnol. 119:70-75, которая настоящим полностью включена посредством ссылки. Традиционная методика иммобилизации клеток, в частности клеток вида Rhodococcus, в DEAE-целлюлозе, связанной перекрестными связями с помощью глутаральдегида, также описан ниже в Примере 4.
В некоторых вариантах настоящего изобретения, иммобилизованный катализатор или одна или более каталитических модульных секций помещены внутри, помещены сверху или прикреплены к “физической структуре”. Физическая структура включает, но не ограничена перечисленными: пленку, лист, покрывающий слой, коробку, мешок, пакет, или сегментированную камеру, способную держать одну или более каталитических модульных секций. В некоторых вариантах реализации, физическая структура включает контейнер, подходящий для транспортировки или хранения плодов, овощей или цветов. Физическая структура может дополнительно включать более чем одну отдельную структуру, при помощи которой все отдельные структуры соединены с центральным катализатором или каталитической модульной секцией. Физическая структура, описанная в данной заявке выше, может возможно быть охлаждаемой с помощью внешних средств или включать охлаждающий модуль в саму физическую структуру.
Элементы для контроля эффективности катализатора для задержки процесса развития интересующих растений (например, для оценки того, когда катализатор или каталитический модуль следует заменить) или для измерения или регулирования вентиляции, содержания влаги/влажности и уровней диоксида углерода могут быть возможно включены в устройство согласно настоящему изобретению. Любое устройство задержки процесса развития растений может дополнительно включать один или более элементов для обеспечения проникновения воздуха к катализатору или каталитической модульной секции или через них. Специалист в данной области сможет легко предвидеть другие возможные модификации устройств, описанных в данной заявке, для контроля и регулирования атмосферных условий (например, вентиляции, влажности и уровней диоксида углерода) для катализатора, каталитической модульной секции или физической структуры. Условия, такие как температура, состав атмосферы (например, относительная влажность, уровни O2 и CO2), физический стресс, дневной свет, химический стресс, радиация, стресс, вызванный недостатком воды, регуляторы роста и повреждение патогенами играют важную роль в интенсивности дыхания и значительно влияют на срок хранения плодов, овощей, цветов и других продуктов растительного происхождения. Хотя температура и атмосферные условия хранения изменяются в зависимости от конкретного плода, овоща или другого интересующего продукта растительного происхождения, рекомендованные температуры хранения обычно лежат в диапазоне от приблизительно 0° до приблизительно 20°C при уровнях O2 и CO2, лежащих в приблизительных диапазонах 1-10% и 0-20%, соответственно. Относительная влажность от приблизительно 50% до приблизительно 100%, конкретнее, от 85% до приблизительно 95%, конкретнее, от приблизительно 90% до приблизительно 95%, как правило, рекомендована для хранения плодов, овощей и подобных продуктов растительного происхождения. Принимая во внимание значительную корреляцию между интенсивностью дыхания и сроком хранения продуктов растительного происхождения, контроль вышеупомянутых факторов важен для задержки разрушения таких продуктов. Соответственно, в устройстве может быть предусмотрен поглотитель диоксида углерода для уменьшения содержания диоксида углерода.
В конкретных вариантах реализации настоящего изобретения предусмотрены устройства с воздухопроницаемым катализатором для задержки процесса развития растений, включающие несколько слоев. Например, на Фигуре 1 показано каталитическое устройство 10, которое может включать наружные слои 12 и 14 и промежуточный каталитический слой 16, расположенный между наружными слоями 12 и 14. Каталитический слой 16 включает одну или более бактерий (например, видов Rhodococcus, Pseudomonas chloroaphis, Brevibacterium ketoglutamicum, и их смеси) или ферментов (нитрилгидратазу, амидазу, аспарагиназу, и их смеси), при этом указанные одна или более бактерий или ферментов предусмотрены в количестве, достаточном для задержки процесса развития интересующих растений, и третий слой. В этом варианте реализации, один или более наружных слоев 12 и 14 обеспечивает структурную целостность каталитическому устройству 10. Наружные слои 12 и 14 обычно позволяют воздуху проникать к каталитическому слою 16, хотя, в некоторых вариантах реализации, может оказаться полезным иметь наружный слой, который не является воздухопроницаемым, например, если устройство образует стенки коробки и существует требование не позволять внешнему слою коробки подвергать каталитический слой воздействию окружающей среды. Каталитическое устройство 10 может быть предусмотрено в виде пакетов или мешков, допускающих или не допускающих повторное использование, в соответствии с настоящим изобретением. В одном варианте реализации, каталитический слой 16 включает клетки видов Rhodococcus, конкретнее, штамм DAP 96253 Rhodococcus rhodochrous, штамм DAP 96622 вида Rhodococcus, Rhodococcus erythropolis, или их смеси. Бактериальные клетки, применяемые в качестве катализатора в устройстве согласно настоящему изобретению, можно индуцировать одним или более стимулирующими агентами (например, аспарагином, глутамином, кобальтом, мочевиной, или их смесью), что подробно описано выше.
На Фигурах 2A-2C изображены альтернативные устройства задержки процесса развития растений, в соответствии с настоящим изобретением. Эти устройства включают несколько слоев, при этом один или более слоев являются удаляемыми. На Фигуре 2A показано устройство, которое включает воздухопроницаемый структурный слой 22 и каталитический слой 24. Удаляемые слои 26 и/или 28 могут быть расположены вдоль структурного слоя 22 и/или каталитического слоя 24, и, как правило, их следует снять перед применением или активированием катализатора. В некоторых вариантах настоящего изобретения, снятие удаляемых слоев 26 и 28 открывает клейкое вещество, которое облегчает помещение или прикрепление каталитической структуры к отдельной физической структуре. На Фигуре 2B изображен альтернативный вариант реализации, в котором устройство 30 включает два воздухопроницаемых структурных слоя 32 и 34, промежуточный каталитический слой 36 и удаляемый слой 38. На Фигуре 2C изображен еще один вариант реализации, в котором устройство 40 включает два воздухопроницаемых структурных слоя 42 и 44, промежуточный каталитический слой 46 и два удаляемых слоя 48 и 50.
На Фигурах 3A-3B изображен альтернативный вариант реализации 60, в котором катализатор прикреплен к внутренней стороне контейнера, такого как картонная коробка. На Фигуре 3A показана сторона 62 контейнера, которая включает каталитический слой 64, присоединенный к ней с помощью клейкого вещества слоя 66. Отслаиваемая пленка 68 может быть выполнена прилегающей к каталитическому слою 64, чтобы защитить каталитический слой от воздействия окружающей среды. Отслаиваемую пленку 68 можно удалить, чтобы активировать катализатор в каталитическом слое 64, подвергая действию катализатора часть растения, находящуюся в контейнере, чтобы тем самым задержать нежелательный процесс развития растения.
На Фигуре 3B изображена каталитическая структура 70 перед прикреплением каталитической структуры к внутренней стороне контейнера способом, показанным на Фигуре 3A. Кроме каталитического слоя 64, слоя клейкого вещества 66 и отслаиваемой пленки 68, каталитическая структура 70 включает дополнительную отслаиваемую пленку 72. Отслаиваемая пленка 72, подобно отслаиваемой пленке 68, защищает каталитическую структуру 70 при упаковке, перевозке или хранении. Отслаиваемую пленку 72 можно удалить, чтобы открыть слой клейкого вещества 66, чтобы обеспечить прикрепление каталитической структуры 70 к внутренней стороне контейнера способом, изображенным на Фигуре 3A.
На Фигуре 4 изображена каталитическая структура 80, которая включает два слота 82 и 84 для приема каталитической кассеты (например, кассеты 86). Каталитическая кассета 86 является воздухопроницаемой, и ее можно легко вставить или удалить из слота 84. Таким образом, каталитическую кассету 86 можно легко заменить, если необходима новая каталитическая кассета для использования в каталитической структуре 80. Каталитическая кассета 86 включает катализатор, такой как описанный в данной заявке, и который предпочтительно иммобилизован на матрице. Каталитическая структура 80 может включать находящиеся друг напротив друга воздухопроницаемые поверхности 88 и 90, такие как решетчатые перегородки, чтобы позволить воздуху проникать через каталитическую кассету 86. Каталитическая структура 80, в альтернативных вариантах реализации, может включать только одну воздухопроницаемую поверхность, две не находящиеся друг напротив друга воздухопроницаемые поверхности или более чем две воздухопроницаемые поверхности, что должно быть очевидно для специалиста в данной области. Хотя на Фигуре 4 изображена каталитическая структура, включающая два слота 82 и 84 для приема каталитической кассеты (например, кассеты 86), для специалиста в данной области должно быть очевидно, что каталитическая структура 80 может включать один или более слотов для приема кассеты. Каталитическая структура 80 может быть предусмотрена внутри контейнера, используемого для транспортировки части растения, такой как плод или цветы, или может быть прикреплена к контейнеру, например, с помощью слоя клейкого вещества, описанного в данной заявке.
Способы и устройства согласно настоящему изобретению можно применять для задержки процесса развития любого интересующего растения или части растения. В конкретных вариантах реализации, способы и устройства согласно настоящему изобретению направлены на задержку созревания, и часть растения представляет собой плод (климактерический или не климактерический), овощ или другую часть растения, которая подвергается созреванию. Для специалиста в данной области должно быть очевидно, что “климактерические плоды” характеризуются внезапным всплеском образования этилена во время созревания плодов, тогда как считается, что для “неклимактерических плодов” нехарактерно значительное усиление биосинтеза этилена во время процесса созревания. Типичные плоды, овощи и другие интересующие продукты растительного происхождения включают, но не ограничены перечисленными: яблоки, абрикосы, бирибу, плод хлебного дерева, черимойю, фейхоа, инжир, гуаву, джекфрут, киви, бананы, персики, авокадо, яблоки, канталупы, манго, мускусные дыни, нектарины, хурму, сапоту, анону игольчатую, оливки, папайю, маракуйю, груши, сливы, помидоры, болгарские перцы, чернику, какао-бобы, кешью, огурцы, грейпфрут, лимоны, лаймы, перцы, вишню, апельсины, виноград, ананасы, клубнику, арбузы, тамарилло и орехи.
В других вариантах настоящего изобретения, способы и устройства направлены на задержку увядания цветка, поникания, опадания или сворачивания лепестков. Данное изобретение применимо к любому цветку. Типичные интересующие цветы включают, но не ограничены перечисленными: розы, гвоздики, орхидеи, портулак, мальву и бегонии. Срезанные цветы, более конкретно, срезанные цветы, важные с коммерческой точки зрения, такие как розы и гвоздики, представляют особый интерес. В некоторых вариантах реализации изобретения используют цветы, чувствительные к этилену. Чувствительные к этилену цветы включают, но не ограничены перечисленными: цветы родов Alstroemeria, Aneomone, Anthurium, Antirrhinum, Aster, Astilbe, Cattleya. Cymbidium, Dahlia, Dendrobium, Dianthus, Eustoma, Freesia, Gerbera, Gypsophila, Iris, Lathyrus, Lilium, Limonium, Nerine, Rosa, Syringa, Tulipa, и Zinnia. Типичные чувствительные к этилену цветы также включают цветы из семейств Амариллисовых, Луковых, Ландышевых, Гемерокаллисовых, Гиацинтовых, Лилейных, Орхидных, Аизовых, Кактусовых, Колокольчиковых, Гвоздичных, Толстянковых, Горечавковых, Мальвовых, Плюмбаговых, Портулаковых, Пасленовых, Агавовых, Асфоделиевых, Спаржевых, Бегониевых, Жимолостных, Ворсянковых, Молочайных, Бобовых, Губоцветных, Миртовых, Кипрейных, Камнеломковых и Вербеновых. См., например, Van Doorn (2002) Annals of Botany 89:375-383; Van Doorn (2002) Annals of Botany 89:689-693; и Elgar (1998) “Cut Flowers and Foliage - Cooling Requirements and Temperature Management” на hortnet.co.nz/publications/hortfacts/hf305004.htm (дата последнего обращения: 20 марта, 2007 г.), каждая из которых полностью включена в данную заявку посредством ссылки. Способы и устройства для задержки опадания листьев также входят в объем настоящего изобретения. В промышленном растениеводстве, плодоводстве, овощеводстве и цветоводстве существует значительный коммерческий интерес к способам и устройствам для регулирования процессов развития растений, таких как созревание, увядание и опадание.
Кроме того, для специалиста в данной области очевидно, что любые из способов или устройств, описанных в данной заявке, можно комбинировать с другими известными способами и устройствами для задержки процесса развития растений, в частности таких процессов, которые обычно связаны с усиленным биосинтезом этилена (например, созревания плодов/овощей, увядания цветов и опадания листьев). Более того, как описано выше, усиленное образование этилена также наблюдали при повреждении патогенными организмами растений или частей растений. Соответственно, способы и устройства согласно настоящему изобретению можно дополнительно применять для улучшения реакции растений на патогены.
Следующие примеры предлагаются в качестве иллюстрации, но не с целью ограничения:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Настоящее изобретение описано с конкретными ссылками на различные примеры. Следующие примеры не предназначены для ограничения настоящего изобретения и, скорее, предусмотрены в качестве типичных вариантов реализации.
Пример 1: Задержанное созревание плодов после воздействия индуцированных видов Rhodococcus
Клетки видов Rhodococcus, индуцированные аспарагином, акрилонитрилом или ацетонитрилом, были иммобилизованы на матрице из DEAE-целлюлозы, соединенной перекрестными связями посредством глутаральдегида. Способы индуцирования клеток и получения вышеупомянутой матрицы описаны подробнее в данной заявке ниже.
Каталитическую матрицу из соединенной перекрестными связями DEAE-целлюлозы помещали в три отдельных бумажных пакета (приблизительно 1-2 грамма уплотненной сырой массы клеток на пакет), при этом каждый пакет содержал неспелые бананы, персики или авокадо. В качестве отрицательных контролей, те же самые плоды были помещены в отдельные бумажные пакеты в отсутствии каталитической матрицы. Бумажные пакеты держали при комнатной температуре, и продукцию осматривали ежедневно на признаки созревания и разрушения плодов.
Вся продукция, подвергнутая воздействию каталитической матрицы, проявляла значительную задержку в созревании плодов. В частности, жесткость и целостность кожуры персиков сохранялась дольше в присутствии каталитической матрицы. Аналогично, для бананов, появление коричневых пятен задерживалось, и жесткость сохранялась дольше по сравнению с отрицательным контролем.
Пример 2: Общие методики ферментации и индукции
Процесс ферментации
Следующие традиционные методики и культуральные среды были использованы для ферментации видов Rhodococcus: штаммов DAP 96622 вида Rhodococcus и DAP 96523 Rhodococcus rhodochrous для применения в других экспериментах.
Ферментационные чаны были оснащены контактными датчиками для измерения растворенного кислорода (DO) и pH, а также пробоотборниками для измерения концентрации глюкозы (автономно). Дополнительные входные отверстия использовали для корректировки (например, кислотой, основанием или пеногасителем), внесения индукторов, питательных веществ и добавок. Предварительно очищенные чаны стерилизовали на месте. Использовали подходящую основную среду (1 или 1.5X) R2A или R3A. Конкретные компоненты этих культуральных сред приведены ниже. В некоторых экспериментах в состав сред были внесены изменения. Например, Proflo® (Trader's Protein, Мемфис, Теннесси) иногда применяли вместо протеозопептона и/или казаминовых кислот. Более того, в некоторых экспериментах, Hy-Cotton 7803® (Quest International, имение Хоффмана, Иллинойс), Cottonseed Hydrolysate (гидролизат семян хлопчатника), Cottonseed Hydrolysate-Ultrafiltered (гидролизат семян хлопчатника, подвергнутый ультрафильтрации) (Marcor Devolpment Corp., Карлстад, Нью-Джерси) применяли вместо Proflo® (Trader's Protein, Мемфис, Теннесси).
Профиль подпитки для добавления питательных веществ был установлен таким образом, чтобы постепенно замещать основную среду R2A или R3A на питательную среду, а именно 2X YEMEA, компоненты которой также описаны подробнее ниже. Другие возможные добавки питательных веществ включали мальтозу 50% (вес/объем) и декстрозу 50% (вес/объем). Коммерческие продукты, содержащие эквиваленты декстрозы (глюкозу, мальтозу и высшие полисахариды), иногда применяли вместо мальтозы и декстрозы.
Инокуляты (посевные культуры) получали из культур штаммов DAP 96622 вида Rhodococcus и DAP 96523 Rhodococcus rhodochrous на подходящей твердой среде и инкубировали при подходящей температуре (например, 30°C). В конкретных вариантах реализации, клетки выращивали на чашках с агаровой средой YEMEA в течение 4-14 дней, предпочтительно 7 дней. В качестве альтернативы, инокуляты получали из замороженных концентратов клеток из предыдущих циклов ферментации. Концентраты клеток обычно получали в концентрации, превосходящей в 20 раз присутствующую в ферментере концентрацию. Вдобавок, инокулят иногда получали из подходящей двухфазной среды (т.е. комбинации жидкой среды, покрывающей твердую среду с таким же или отличным составом). Когда использовали двухфазную среду, указанная среда, как правило, содержала YEMEA как в жидком, так и в твердом слоях.
Для индукции нитрилгидратазы, при t=0 часов, стерильный CoCl2·6H2O и мочевину добавляли, чтобы достичь концентраций, равных 5-200 промилле CoCl2 и 750 мг/л - 10 г/л мочевины, предпочтительно, как правило, 10-50 промилле CoCl2 и 7500 мг/л - 7,5 г/л мочевины. В определенном варианте реализации, мочевину и/или кобальт снова добавляли во время ферментации. Например, эквивалентный объем мочевины и 150 промилле CoCl2 добавляли через 4-6 часов или через 24-30 часов. Кроме мочевины, добавляли акрилонитрил/ацетонитрил до конечной концентрации 300 - 500 промилле или 0,1 М-0,2 М аспарагина, пошагово или при постоянной скорости, начиная в различное время. Циклы ферментации останавливали, когда клеточная масса и концентрации ферментов были подходящими, обычно через 24-96 часов.
Клетки затем собирали любым подходящим способом, включая, но не ограничиваясь перечисленными: периодическое или непрерывное центрифугирование, декантирование или фильтрацию. Собранные клетки ресуспендировали до 20X концентрированного объема в подходящем буфере, таком как 50 мМ фосфатно-солевой буферный раствор (ФБР), дополненный индуктором, используемым во время процесса ферментации. Концентраты клеток затем замораживали, конкретнее, путем быстрого замораживания. Замороженные клетки хранили при -20°C -80°C или в жидком азоте для дальнейшего использования.
Описание культуральных сред
Среда R2A (см. Reasoner и Geldreich (1985) Appl. Environ. Microbiol. 49:1-7)
Дрожжевой экстракт 0,5 г
Протеозопептон #3 0,5 г
Казаминовые кислоты 0,5 г
Глюкоза 0,5 г
Растворимый крахмал 0,5 г
K2HPO4 0,3 г
MgSO4.7H2O 0,05 г
Пируват натрия 0,3 г
Деионизир. или дист. H2O 1,0 литр
Среда R3A (см. Reasoner и Geldreich, выше.)
Дрожжевой экстракт 1,0 г
Протеозопептон #3 1,0 г
Казаминовые кислоты 1,0 г
Глюкоза 1,0 г
Растворимый крахмал 1,0 г
K2HPO40,6 г
MgSO4.7H2O 0,1 г
Пируват натрия 0,5 г
Деионизир. или дист. H2O 1,0 литр
Среда YEMEA
1X 2X
Дрожжевой экстракт 4,0 г 8,0 г
Экстракт солода 10,0 г 20,0 г
Глюкоза 4,0 г 8,0 г
Индукция
Следующий традиционный метод использовали для индукции видов Rhodococcus: штаммов DAP 96622 вида Rhodococcus и DAP 96523 Rhodococcus rhodochrous.
Летучие индуцирующие жидкости (например, акрилонитрил/ацетонитрил) добавляли волюмометрически в виде стерилизованных путем фильтрации жидких индукторов, в зависимости от плотности конкретного жидкого индуктора. В случае твердых индукторов (например, аспарагина/глутамина), твердые вещества взвешивали и добавляли непосредственно в культуральную среду. Полученные среды автоклавировали. Когда использовали стерилизованные путем фильтрации жидкие индукторы, культуральную среду отдельно автоклавировали и охлаждали до 40°C перед добавлением жидкого индуктора. Типичные концентрации интересующих индукторов составляли: 500 промилле акрилонитрила/ацетонитрила; 500 промилле аспарагина/глутамина; и 50 промилле сукцинонитрила. Клетки затем выращивали на указанных средах и дополнительно анализировали на определенные ферментные активности и биомассу.
Пример 3: Анализ нитрилгидратазной, амидазной и аспарагиназной активности и биомассы в индуцированных аспарагином клетках видов Rhodococcus
Нитрилгидратазную, амидазную и аспарагиназную активность и биомассу оценивали в индуцированных аспарагином клетках видов Rhodococcus: штаммов DAP 96622 вида Rhodococcus и DAP 96523 Rhodococcus rhodochrous. Анализировали различные изменения компонентов культуральных сред, способов введения, скоростей и концентраций аспарагина, подаваемого клеткам, и источника клеток в отношении их влияния на активности вышеупомянутых ферментов и на биомассу. В разделах от A до G в данном Примере описаны особенности каждого набора условий теста и приведено краткое описание ферментных активностей и биомасс, полученных при каждом из конкретных условий.
A. По существу, как описано выше в Примере 2, в 20-литровый ферментер, инокулированный с использованием клеток DAP 96253 Rhodococcus rhodochrous, собранных из твердой среды, непрерывно подавали индуктор аспарагин (120 мкл/минуту 0,2 М раствора). Hy-Cotton 7803® применяли вместо протеозопептона #3 в среде R3A, описанной выше. К моменту окончания цикла ферментации, акрилонитрил-специфичную нитрилгидратазную активность, амидазную активность и биомассу измеряли в соответствии со стандартными методиками, известными в данной области.
Результаты для нитрилгидратазной активности, амидазной активности и биомассы представлены ниже в Таблице 3, при этом активности предусмотрены в единицах/мг свк (сухого веса клеток). Одна единица нитрилгидратазной активности означает способность преобразовывать 1 мкмоль акрилонитрила в соответствующий амид в минуту, на миллиграмм клеток (сухой вес) при pH 7,0 и температуре 30ºC. Одна единица амидазной активности означает способность преобразовывать 1 мкмоль акриламида в соответствующую кислоту в минуту, на миллиграмм клеток (сухой вес) при pH 7,0 и температуре 30ºC. Биомасса представлена в виде клеток, измеряемых в г/л смк (сырой массы клеток).
B. Оценивали ферментную активность и биомассу клеток DAP 96523 Rhodococcus rhodochrous по существу, как описано выше в Примере 3A, с изменениями, внесенными в состав среды, отмеченными ниже. В частности, YEMEA, декстрозу или мальтозу добавляли в модифицированную среду R3A, дополнительно содержащую Hy-Cotton 7803®, используемый вместо протеозопептона #3. 0,2 М раствор аспарагина добавляли при постоянной скорости потока, равной 120 мкл/минуту, начиная в момент времени t=8 часов. К моменту окончания цикла ферментации, измеряли акрилонитрил-специфичную нитрилгидратазную активность, амидазную активность и биомассу. Результаты представлены в Таблице 4. Повышенный выход биомассы наблюдали при добавлении в среду YEMEA, декстрозы или мальтозы.
C. Клетки DAP 96622 вида Rhodococcus из твердой среды применяли в качестве источника инокулята для цикла 20-литровой ферментации (см. Пример 2 для более подробного описания процесса ферментации). 0,2 М раствор аспарагина добавляли полунепрерывно каждые 6 часов, начиная в момент времени t=24 часа, в течение 50-70 минут при скорости потока, равной 2 мл/минуту. Hy-Cotton 7803® применяли вместо протеозопептона #3 в модифицированной среде R3A. К моменту окончания цикла ферментации, измеряли акрилонитрил-специфичную нитрилгидратазную активность, амидазную активность и биомассу. Результаты приведены в Таблице 5.
D. Клетки DAP 96622 вида Rhodococcus из твердой среды применяли в качестве источника инокулята для цикла 20-литровой ферментации. 0,2 М раствор аспарагина добавляли полунепрерывно каждые 6 часов, начиная в момент времени t=12 часов, в течение 12-85 минут при скорости потока, равной 2,5 мл/минуту. Cottonseed Hydrolysate применяли вместо протеозопептона #3 в модифицированной среде R3A. К моменту окончания цикла ферментации, измеряли акрилонитрил-специфичную нитрилгидратазную активность, амидазную активность и биомассу, и результаты представлены в Таблице 6.
E. Предварительно замороженные клетки DAP 96253 Rhodococcus rhodochrous применяли в качестве источника инокулята для цикла 20-литровой ферментации. YEMEA, декстрозу или мальтозу добавляли в модифицированную среду R3A, которая дополнительно содержала Hy-Cotton 7803® в качестве заменителя протеозопептона #3. 0,15 М раствор аспарагина добавляли при постоянной скорости потока, равной 120 мкл/минуту, начиная в момент времени t=8 часов. К моменту окончания цикла ферментации, измеряли акрилонитрил-специфичную нитрилгидратазную активность, амидазную активность и биомассу. Результаты представлены в Таблице 7.
F. Клетки DAP 96253 Rhodococcus rhodochrous, выращенные на двухфазной среде, применяли в качестве источника инокулята для цикла 20-литровой ферментации. Применяли модифицированную среду R3A, которая была дополнена путем добавления углевода (т.е. YEMEA, декстрозы или мальтозы) и дополнительно содержала Cottonseed Hydrolysate вместо протеозопептона #3. 0,15 М раствор аспарагина добавляли при постоянной скорости потока, равной 1000 мкл/минуту, начиная в момент времени t=10 часов. К моменту окончания цикла ферментации, измеряли акрилонитрил-специфичную нитрилгидратазную активность, амидазную активность, активность аспарагиназы I и биомассу. Результаты приведены в Таблице 8.
G. Клетки DAP 96253 Rhodococcus rhodochrous, выращенные на двухфазной среде, применяли в качестве источника инокулята для цикла 20-литровой ферментации. Применяли модифицированную среду R3A, которая содержала мальтозу (вместо декстрозы) и Hy-Cotton 7803® в качестве заменителя протеозопептона #3. 0,15 М раствор аспарагина добавляли при постоянной скорости потока, равной 476 мкл/минуту, начиная в момент времени t=8 часов. К моменту окончания цикла ферментации, измеряли акрилонитрил-специфичную нитрилгидратазную активность, амидазную активность и биомассу, и результаты приведены в Таблице 9.
Пример 4: Иммобилизация клеток видов Rhodococcus на DEAE-целлюлозе, связанной поперечными связями посредством глутаральдегида
Модифицированный процесс, полученный из способов, описанных в патенте США номер 4,229,536 и у Lopez-Gallego и др. (2005) J. Biotechnol. 119:70-75, применяли для иммобилизации клеток видов Rhodococcus на матрице, включающей DEAE-целлюлозу, связанную поперечными сшивками посредством глутаральдегида.
Получение клеток
Клетки Rhodococcus выращивали в подходящей культуральной среде (например, YEMEA-мальтоза + индукторы, двухфазные культуры, и т.д.) и отделяли центрифугированием при 8,000 об/мин в течение 10 минут. Полученный осадок клеток ресуспендировали в 100 мл 50 мМ фосфатного буфера (pH 7,2) и центрифугировали при 8,000 об/мин в течение 10 минут. Этот процесс ресуспендирования осадка клеток и центрифугирования при 8,000 об/мин в течение 10 минут повторяли дважды. Записывали уплотненную сырую массу (см) конечного образца клеток. Выполняли оценку нитрилгидратазной активности небольшого образца клеток для оценки ферментной активности целых клеток.
Иммобилизация клеток
Получали количество DEAE-целлюлозы, эквивалентное таковому для собранных клеток видов Rhodococcus, и клетки, и DEAE-целлюлозу ресуспендировали в 100 мл деионизированной H2O. Объем 25% раствора глутаральдегида, достаточный, чтобы достичь конечной концентрации, равной 0,5%, добавляли при перемешивании в смесь клеток/DEAE-целлюлозы. Смесь перемешивали в течение 1 часа, по истечении которого добавляли 400 мл деионизированной H2O при дополнительном перемешивании. При перемешивании добавляли 50% (по весу раствора) полиэтиленимина (PEI; молекулярный вес 750,000). Перемешивание продолжали до тех пор, пока не завершилась флокуляция. Флокулированную смесь фильтровали и продавливали через шприц подходящего размера. Выдавленную из шприца массу иммобилизованных клеток делили на мелкие части, сушили в течение ночи и измельчали с получением гранул размером приблизительно 2-3 мм.
Пример 5: Иммобилизация клеток видов Rhodococcus на альгинате кальция и отверждение гранул альгината кальция
Процесс, адаптированный из способа, описанного у Bucke (1987) “Cell Immobilization in Calcium Alginate” в Methods in Enzymology, том 135(B) (Academic Press, Inc., Сан-Диего, Калифорния; Mosbach, ред.), применяли для иммобилизации клеток вида Rhodococcus на альгинате кальция.
Получение клеток
Клетки видов Rhodococcus получали, как описано выше в Примере 4.
Иммобилизация клеток
25 г 4% раствора альгината натрия получали путем растворения 1 г альгината натрия в 24 мл 50 мМ Tris-HCl (pH 7,2). 25 мг метапериодата натрия добавляли к раствору альгината и перемешивали при 25°C в течение 1 часа или до тех пор, пока альгинат полностью не растворился. Клетки, полученные описанным выше способом, ресуспендировали до конечного объема, равного 50 мл в 50 мМ Tris-HCl (pH 7,2), и затем добавляли к раствору альгината натрия при перемешивании. Полученные гранулы пропускали через иглу диаметром 27G в 500 мл 0,1 М раствора CaCl2. Иглу, как правило, помещали приблизительно в двух дюймах над раствором, чтобы предотвратить проникновение воздуха в гранулы и предотвратить слипание гранул. Гранулы обрабатывали в течение 1 часа в растворе CaCl2, а затем гранулы промывали водой и хранили при 4°C в 0,1 М растворе CaCl2 до применения.
Придание твердости гранулам альгината кальция, включающим клетки видов Rhodococcus
Гранулы альгината кальция, полученные, как описано выше, можно дополнительно упрочнить образованием перекрестных связей с PEI. Гранулы инкубировали в 2 л 0,5% PEI в 0,1 М растворе CaCl2 (20 г 50% PEI в 0,1 М растворе CaCl2). pH конечного раствора подводили до 7,0 с помощью HCl или NaOH, при необходимости, и гранулы инкубировали в течение 24 часов. Гранулы затем промывали водой и хранили при 4°C в 0,1 М растворе CaCl2 до применения.
Множество модификаций и других вариантов реализации изобретений, описанных в данной заявке, придет в голову специалисту в данной области, для которого настоящие изобретения принадлежат к полезным идеям, изложенным в предшествующих описаниях. Следовательно, должно быть очевидно, что настоящие изобретения не должны быть ограничены конкретными описанными вариантами реализации и что модификации и другие варианты реализации предполагаются включенными в объем прилагаемой формулы изобретения. Несмотря на то что в данной заявке используются конкретные термины, они применяются исключительно в обобщенном и описательном смысле, но не с целью ограничения.
Реферат
Изобретение относится к области биохимии. Представлен способ задержки процесса развития растений, связанного с биосинтезом этилена, включающий воздействие на растение или часть растения одной или более бактериями, продуцирующими один или более ферментов, выбранных из группы, состоящей из нитрилгидратаз, амидаз, аспарагиназ и их смесей, и указанную одну или более бактерий выбирают из группы, состоящей из видов Rhodococcus, Brevibacterium ketoglutamicum, и их смесей, и при этом указанная одна или более бактерий воздействуют на растение или часть растения в количестве, достаточном для задержки процесса развития растений. Раскрыто устройство для задержки процесса развития растений, связанного с биосинтезом этилена, включающее несколько слоев. При этом по меньшей мере один слой содержит катализатор, который содержит одну или более бактерий, выбранных из группы, состоящей из видов Rhodococcus, Pseudomonas chloroaphis, Brevibacterium ketoglutamicum, и их смесей, причем одна или более бактерий продуцируют один или более ферментов, выбранных из группы, состоящей из нитрилгидратаз, амидаз, аспарагиназ и их смесей. Изобретение позволяет повысить эффективность задерживания процесса развития растений, связанного с биосинтезом этилена. 5 н. и 54 з.п. ф-лы, 4 ил., 9 табл., 5 пр.
Формула
первый слой; и
второй слой, который включает катализатор, содержащий одну или более бактерий, выбранных из группы, состоящей из видов Rhodococcus, Pseudomonas chloroaphis, Brevibacterium ketoglutamicum, и их смесей, причем одна или более бактерий продуцируют один или более ферментов, выбранных из группы, состоящей из нитрилгидратаз, амидаз, аспарагиназ и их смесей, и одна или более бактерий предусмотрены в количестве, достаточном для задержки процесса развития растений;
при этом первый слой обеспечивает структурную целостность устройства.

Комментарии