Композиция и способ борьбы с болезнями растений - RU2143199C1
Код документа: RU2143199C1
Чертежи











Описание
Изобретение относится к средствам защиты растений, а более конкретно - к новому штамму бактерий Pseudomonas chlororaphis и к использованию в растениеводстве средств, содержащих этот штамм или продуцированные им антибиотики, для защиты растений от поражения фитопатогенными микроорганизмами.
Некоторые микробы, способные вызывать болезни растений, приносят значительный вред культурным растениям и соответственно экономические потери. Многие из них поражают листья и/или другие наземные части растений, а затем обычно переносятся спорами по воздуху на новые неинфицированные культуры. Другие передаются от одного поколения культур к другому через семена, а некоторые вызывающие заболевания и причиняющие экономический ущерб микроорганизмы передаются через почву, оставаясь в ней более или менее пассивными до появления восприимчивой к ним культуры.
Многие методы борьбы с вызывающими заболевания микроорганизмами в растениеводстве требуют значительных финансовых затрат, но их использование для большинства растениеводческих хозяйств экономически необходимо. Один из широкоиспользуемых методов - обработка биостатическими или биоцидными химикатами. Их в большинстве случаев наносят опрыскиванием на посевы, обрабатывают ими семена или корни, или дезинфицируют почву. Другие общепринятые методы включают селекцию культур, устойчивых к патогенам, и агротехнические мероприятия.
Все эти общепринятые методы профилактики имеют некоторые недостатки. Агротехнические мероприятия эффективны или приемлемы только для решения некоторых проблем, связанных с заболеваниями растений. Селекция устойчивых к болезням культурных растений также возможна или приемлема только в определенных случаях, на нее может потребоваться много времени, а достигнутая устойчивость может быть утеряна через некоторое время с появлением новых штаммов патогена. Часто высокоэффективны химические соединения, но они могут приводить к нежелательным последствиям для окружающей среды, требуют осторожности в обращении из-за риска для здоровья человека, и, кроме того, они могут стать неэффективными при появлении устойчивых патогенных штаммов.
Использование средств биологической борьбы или биопестицидов может быть более эффективным и предпочтительным, чем использование других методов и поэтому такие средства испытывают в широких масштабах. Известно, что некоторые штаммы бактерий или грибов подавляют рост различных фитопатогенных микроорганизмов. Для эффективного использования такие штаммы должны обладать стабильностью, давать воспроизводимые результаты в полевых условиях, и пользователи должны иметь возможности применять их в полевых условиях. До настоящего времени ряд штаммов отвечал этим требованиям и поэтому их использовали как коммерческие продукты.
Известен (публикация международной заявки WO 92/18613, C 12 N 1/20, C 12 R 1:39, A 01 N 63/00, 29.10.92) штамм бактерий Pseudomonas fluorescens Biovar I NCIB 40189, который активен в отношении грибов - возбудителей увядания растений гороха и кукурузы, относящихся к родам Rhizoctonia, Pythium, Fusarium. Недостатком штамма является ограниченный спектр его антигрибной активности.
Известно (публикация международной заявки WO 92/18613, C 12 N 1/20, C 12 R 1: 39, A 01 N 63/00, 29.10.92) средство для борьбы с заболеваниями растений, вызываемыми патогенными грибами, которое включает в себя штамм бактерий Pseudomonas fluorescens Biovar I NCIB 40189. Это средство эффективно против ограниченного круга патогенов, вызывающих увядание растений гороха и кукурузы.
Известен (публикация международной заявки WO 92/18613, C 12 N 1/20, C 12 R 1:39, A 01 N 63/00, 29.10.92) способ борьбы с заболеваниями растений, вызываемыми патогенными грибами, включающий введение эффективной дозы микробиологического средства в окружающую среду, где возбудитель заболевания должен быть подавлен, при котором в качестве микробиологического средства используют штамм бактерий Pseudomonas fluorescens Biovar I NCIB 40189. К недостаткам этого метода следует отнести достаточно ограниченный круг заболеваний растений, для борьбы с которыми может быть использован данный способ.
В задачу настоящего изобретения входило получение бактериального штамма, обладающего широким спектром активности в отношении фитопатогенных грибов, а также создание на его основе микробиологического средства и способа для борьбы с заболеваниями растений, вызываемыми патогенными грибами.
Эта задача решается тем, что предложен новый штамм бактерий Pseudomonas chlororaphis NCIMB 40616 для борьбы с заболеваниями растений, вызываемыми патогенными грибами.
Задача решается также тем, что предложено средство для борьбы с заболеваниями растений, вызываемыми патогенными грибами, отличающееся тем, что оно содержит штамм бактерий Pseudomonas chlororaphis NCIMB 40616 или его культуральную жидкость, содержащую метаболиты, активные в отношении патогенных грибов.
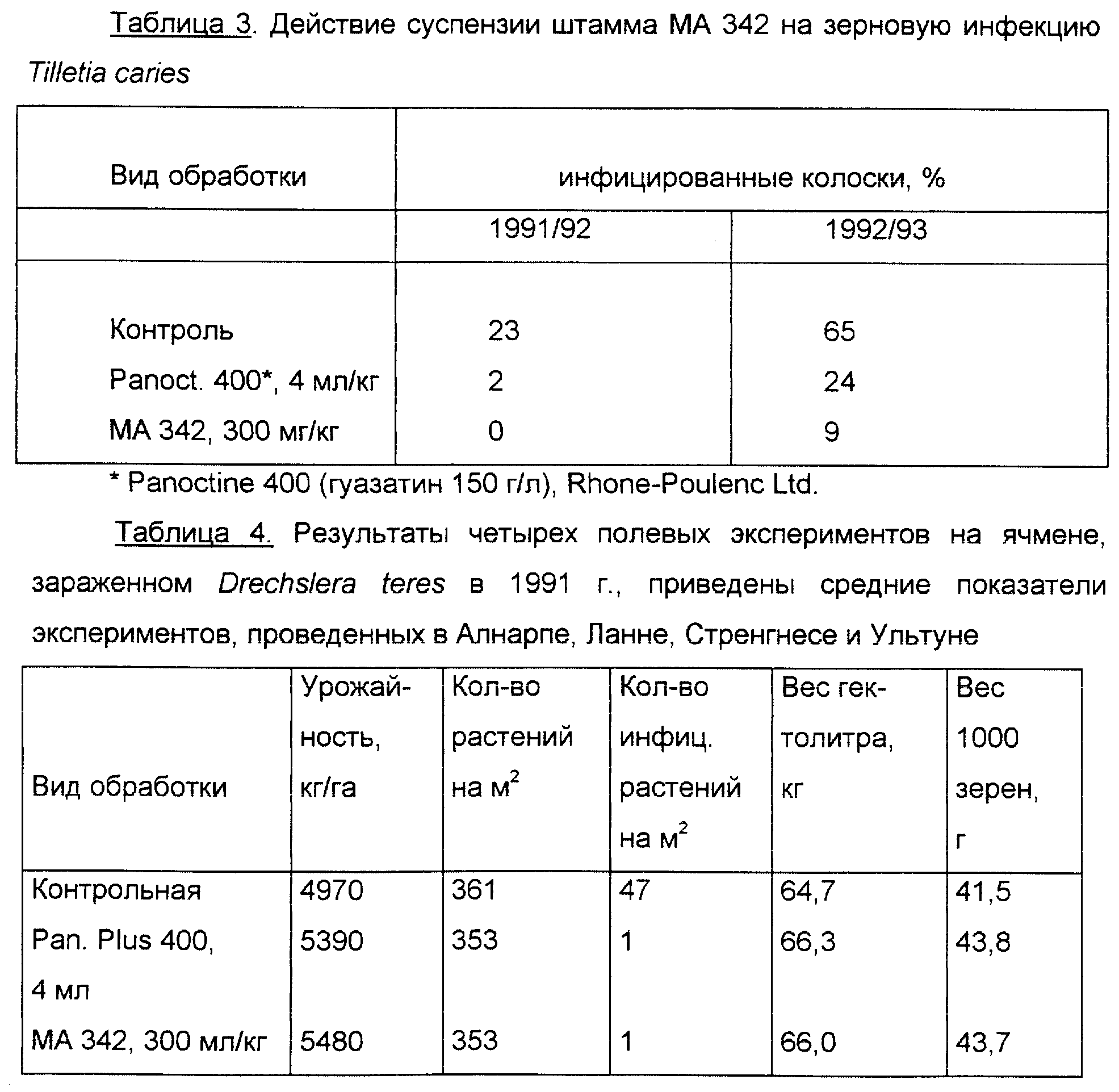
Указанное средство активно, в частности, в отношении грибов Drechslera teres, Drechslera graminea, Drechslera avenae, Microdochium nivale, Tilletia caries и Ustilago avenae.
Предпочтительно, чтобы указанное средство дополнительно содержало носитель, приемлемый для сельского хозяйства. Наиболее предпочтительно, чтобы носитель был жидким или являлся твердым пористым материалом, насыщенным указанным штаммом или его культуральной жидкостью. Средство по изобретению может дополнительно содержать клейкие добавки или питательные вещества.
Для решения указанной выше задачи предложен также способ борьбы с заболеваниями растений, вызываемыми патогенными грибами, включающий введение эффективной дозы микробиологического средства в окружающую среду, где возбудитель заболевания должен быть подавлен, отличающийся тем, что в качестве микробиологического средства используют вышеописанный штамм бактерий или его культуральную жидкость, содержащую метаболиты, активные в отношении патогенных грибов.
Предпочтительно указанное введение осуществляют путем нанесения микробиологического агента на семена, на части растений, служащие для вегетативного размножения и на растения или путем внесения в среду, на которой растет или должно быть выращено растение.
На чертеже показан жирнокислотный профиль выделенного штамма MA 342, полученный с помощью системы распознавания патогенных микроорганизмов (Microbial Identification System) (MIDI, Newark Ltd., USA).
Предложенный новый штамм (MA 342) бактерий Pseudomonas chlororaphis с желаемыми характеристиками депонирован в Национальных Коллекциях промышленных и морских бактерий (National collections of Industrial and Marine Bacteria Limited (NCIMB)), Абердин, Шотландия, 14 февраля 1994 г., согласно Будапештскому Договору, и ему присвоен регистрационный N 40616.
Характеристика нового бактериального штамма MA 342
Морфологические характеристики. Морфология колоний на TSA 10 (10 г триптон-соевого бульона
(Difco Ltd.); 12 г технического агара (Oxoid Ltd.) в 1000 мл дистиллированной воды): образует круглые белые, умеренно выпуклые колонии, в виде хорошо видимых прозрачных кристаллов в агаре при высокой
плотности клеток. Клетки представляют собой грамотрицательные палочки, флуоресцирующие ярко-желтым светом в Kings среде B (1,5 г K2HPO4; 1,5 г MgSO4•7H2O; 20 г протеолитического пептона (Difco Ltd.); 10 мл глицерина, 15 г агара Bacto (Difco Ltd.) в 1000 мл дистиллированной воды).
Жирнокислотный анализ. Жирнокислотный профиль бактерии показан на чертеже. Этот анализ был произведен с использованием системы распознавания патогенных микроорганизмов (Microbial Identification System) (MIDI, Newark Ltd. , USA), версия 3.7. Согласно этой программе испытания MA 342 больше всего похож на Pseudomonas chlororaphis с индексом подобия 0,705.
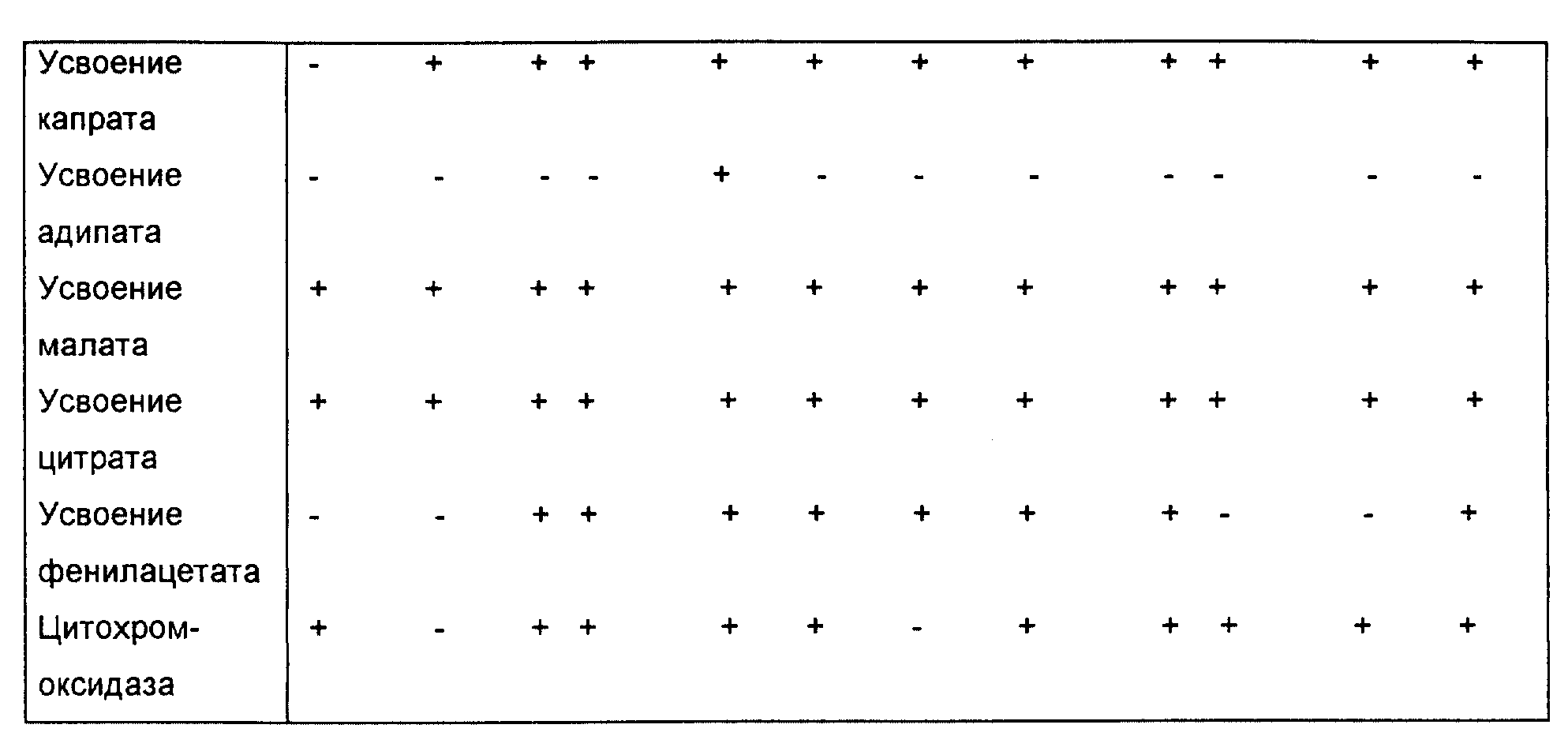
Биохимические характеристики приведены в таблице 17.
Предпочтительные способы репродукции штамма, приготовления препаратов и их применения в полевых условиях и теплицах
Биомассу активного штамма лучше всего получать путем ферментации,
включающей в себя инокуляцию образца чистой культуры штамма в жидкую культуру, выращиваемую при встряхивании, или в ферментатор, заполненный подходящей ферментационной средой. Штамм может быть также
выращен на стерильной поверхности, например на агаризованной поверхности, и когда клетки вырастут, их можно суспендировать в воде или другой известной жидкой среде. В качестве среды для выращивания в
принципе пригодны любые известные среды для выращивания бактерий. Ферментацию ведут до получения достаточной концентрации клеток, например около 5-109 КОЕ (колониеобразующих единиц)/мл для
жидких культуральных сред. Полученная таким образом культуральная жидкость или суспензия бактерий может быть использована в таком виде для защиты растений, ее также до использования можно обработать и
приготовить состав в соответствии с рецептурой.
В одном способе обработки бактериальные клетки в культуральной жидкости можно убить, например нагревом, или их можно отцентрифугировать, а оставшуюся среду или супернатант, содержащие бактериальные метаболиты, можно использовать для защиты растений как с предварительной очисткой и/или концентрированием, так и без них. Суспензии бактерий и культуральные жидкости можно также гомогенизировать в смеси с одним или несколькими известными соединениями или группами соединений при условии, что такие соединения совместимы со штаммами бактерий или их антипатогенно активными метаболитами или их производными. Подходящими соединениями могут быть: порошкообразные добавки или твердые носители, такие как тальк, каолин, бентонит или монтмориллонит, известные смачивающиеся порошки, питательные вещества-источники углерода (глюкоза, сахароза и фруктоза) или комплексные бактериальные питательные вещества (дрожжевой экстракт, бактериологический пептон или триптон), соли металлов, соли жирных кислот, эфиры жирных кислот, ионные или неионные ПАВ, растительные питательные вещества, регуляторы роста растений, фунгициды, инсектициды, бактерициды и им подобные. Суспензии бактерий и культуральные жидкости могут быть высушены или лиофилизированы до или после смешивания с подходящими соединениями, а полученный продукт - использован для защиты растений. Подходящий способ сушки - например, сушка на воздухе вермикулита с присутствующей в нем бактериальной культуральной жидкостью.
Препараты бактерий и метаболитов могут быть применены любым способом, известным для обработки семян, частей растений, служащих для вегетативного размножения, растений и почвы штаммами бактерий: разбрызгиванием, опрыскиванием, распылением, опылением, рассеиванием, осаждением, погружением или поливом в соответствии с целями и преобладающими обстоятельствами. Обычный расход препарата для обработки семян преимущественно составляет от 1011 до 1012 КОЕ/га, а при опрыскивании от 1012 до 1014 КОЕ/га, или соответствующее количество бактериальных метаболитов.
Пример 1
Выделение микроорганизма MA 342
Выкопанные корни растения Empetrum nigrum промыли в стерильной водопроводной воде для удаления налипшей почвы. От молодого корня
отрезали кусок длиной 2-3 см, соблюдая стерильность. Этот кусок отрезали выше конца корня. В этом куске корня сделали маленькие надрезы прокаленным над пламенем скальпелем. Затем кусок корня натерли
на поверхность агара TSA 10. После прорастания бактерий микроорганизм MA 342 собрали и на TSA 10 вырастили чистую культуру.
Пример 2
Хранение микроорганизма MA 342
Чистую культуру в небольшой ампуле подвергли глубокому замораживанию при -70oC. В качестве вещества-протектора замороженной культуры использовали 10%-ный раствор глицерина в водопроводной
воде с pH 7,15 после автоклавирования. После замораживания при -70oC ампулы хранили при -20oC.
Для длительного хранения образец подвергли лиофилизации. После прорастания в течение 48 часов на агаре TSA 10 бактериальный газон соскребли с агаризованной поверхности, смешали с протектором лиофилизированной культуры (50 г Dextran Т 70 (Pharmacia Fine Chemicals Ltd.), 50 г Na-L-глутамата (Kebo AB) в 1000 мл дистиллированной воды), разлили в небольшие ампулы (20 мл) и поставили в лиофильную сушку Hetosicc (Heto Ltd., Denmark) на 24 часа. После лиофилизации ампулы закрыли газонепроницаемыми резиновыми пробками и оставили на хранение при 4oC.
Пример 3
Действие MA 342 против Microdochium nivale при первичном скрининге в
теплице
Бактерии использовали для обработки семян пшеницы следующим образом: 24-часовые культуры на TSA 10, выращенные при 15oC, соскребли с агаризованной поверхности
9-сантиметровой чашки Петри и смешали с 40 мл питательного бульона (SNB: 18 г сахарозы, 5 г бактериального пептона (Oxoid Ltd.), 2 г дрожжевого экстракта (Oxoid Ltd.), 0,5 г K2HPO4 и 0,25 г MgSO4•7H2O в 1000 мл дистиллированной воды с pH 7,2-7,4) и 40 мл 2%-ного (масса/об.) раствора натриевой соли карбоксиметилцеллюлозы (CMC) в стерильной
дистиллированной воде. Этой смесью полили семена, через 20 мин излишек смеси слили, а семена высушили под вентилятором в течение ночи.
Для обработки семян в этом тепличном анализе взяли две банки и засеяли в каждую по 50 семян. Банки 18 см диаметром и 4 см высотой были заполнены на 2/3 нестерилизованной коммерческой торфяной смесью (Enhetsjord K Normal), с добавлением 20% по объему песка.
До обработки бактериями семена озимой пшеницы (культурный сорт "Kosack") искусственно заразили патогеном Microdochium nivale. Патоген культивировали в течение 7 дней в картофельно-декстрозном бульоне (24 г картофельно-декстрозного бульона (Difco Ltd.) в 1000 мл дистиллированной воды) при комнатной температуре на роторной качалке. Полученную кашицу гомогенизировали в кухонном смесителе и вылили на семена. Через 30 мин жидкость слили, а семена оставили сушиться под вентилятором на ночь. Таким образом инвазированные семена затем обработали штаммом MA 342 и высеяли в банки, как было описано выше.
После высевания банки накрыли стеклянными крышками и поставили в темное место при 6oC. Через 5 дней крышки сняли, каждую банку полили 100 мл воды и поместили в пятилитровый пластиковый мешок, который поддерживали две деревянные палки. Затем банки поместили в теплицу при 12-15oC на 8 дней.
Опыт на семенах заключался в следующем.
1. Штаммом MA 342 бактерии P.chlororaphis, смешанным с SNB/CMC, обработали семена, инвазированные патогеном M. nivale.
2. Семена, инвазированные патогеном M. nivale, составляли контрольную группу больных.
3. Необработанные семена составляли контрольную группу здоровых.
Эффект подавления заболевания зафиксировали в процентах появления всходов здоровых (то есть без мицелия) растений среди посеянных. Результаты типичного первичного анализа с патогеном M. nivale представлены в таблице 1.
Пример
4
Действие MA 342 против Drechslera teres при вторичном скрининге в теплице
При этом отборе штамм MA 342 выращивали в течение 48 часов в полуконцентрированном (15 г/л) триптон-соевом
бульоне (Difco Ltd.) на роторной качалке в темноте при 18-20oC. Затем естественно зараженные патогеном D. teres семена ячменя культурного сорта "Golp" смешали в пластиковом мешке с
полученной суспензией бактерий из расчета 300 мл на 1 кг семян и после перемешивания мешок встряхивали около 4 мин. Обработанные таким образом семена сушили под вентилятором при комнатной температуре
в течение одного дня, а затем высеяли в банки, как описано в примере 3.
Три засеянные банки на обработку поместили сначала в темное помещение при 6oC на 7 дней, а затем в теплицу при около 20oC, как описано в примере 3. Для выявления эффекта от обработки подсчитали количество появившихся ростков растений и количество растений с пораженным первым листом. Бактериальное действие сравнивали с необработанными контрольными образцами и семенами, обработанными фунгицидом Panoctine Plus 400 (гуазатин 150 г/л + имазалил 10 г/л), Rhone-Poulenc Ltd., при дозе 4 мл на килограмм семян (таблица 2).
Пример 5
Действие MA 342 на патогены растений в полевых условиях
Полевые испытания проводили в виде рандомизированных блоков с
повторением от трех до восьми раз на участках с размерами от 0,15 м2 (один эксперимент с T. caries) до примерно 15 м2 (большинство экспериментов). Эти участки находились в разных
местностях Швеции и в большинстве случаев на суглинистых почвах с содержанием гумуса примерно 3%.
Обработку семян бактериями и препаратом Panoctine Plus 400 проводили так, как описано в примере 4. После того, как обработанные семена высушили вентилятором, их оставили при комнатной температуре на различное время перед высеванием на полевые участки. Все семена, за исключением инвазированных патогеном T. caries, были естественно инвазированы или заражены различными болезнями. Семена озимой пшеницы (культурный сорт "Kosack") были искусственно инвазированы спорами N. caries путем смешивания 2 г зараженных T. caries измельченных колосков с 1 кг семян пшеницы.
Действие MA 342 на Tilletia caries
Это действие определяли по частоте появления
зараженных колосков во время созревания. Результаты, полученные во время двух испытаний в 1991/92 г и двух испытаний в 1992/93 г, представлены в таблице 3. Разница между бактериальной и фунгицидной
обработками была существенна в 1992/93 г.
Действие MA 342 на Drechslera teres, D.Graminea. D.avenae и Ustilago avenae
В полевых экспериментах с этими патогенами измеряли число
проросших и число инфицированных растений на м2, а также в большинстве экспериментов - урожайность злаков, вес тысячи зерен и вес гектолитра зерен.
Действие на Drechslera teres. Результаты полевых испытаний в 1991-1993 гг. и действие D. teres на ячмене в тех случаях, где проводили испытания, показаны в таблицах 4, 5 и 6.
Действие на Drechslera graminea. Результаты экспериментов с семенами, зараженными D.graminea, проведенных в 1991-1993 гг., приведены в таблицах 7, 8 и 9.
Действие на Drechslera avenae: Результаты экспериментов с семенами овса, зараженного D. avenae, проведенных в 1991 - 1993 гг., приведены в таблицах 10, 11 и 12.
Действие на Ustilago avenae: В полевых экспериментах с колосьями овсянки, зараженной U. avenae, было подсчитано число колосков овсянки или их процентное содержание на м2 или их %. В период созревания урожайность не определяли. Результаты трех экспериментов в 1991-1993 гг. приведены в табл. 13.
Пример 6
Применение MA 342 для обработки семян и других частей растения
Обработка семян водным составом, содержащим MA 342.
Бактериальные суспензии, полученные как описано в примерах 3 и 4, смешали с каждым из следующих веществ или соединений:
Порошок талька (Kebo Lab AB), 48 г/л бактериальной
суспензии.
Бактериологический пептон (Oxoid, Ltd.), 5 г/л бактериальной суспензии
Tween 20 (Merck Ltd.), 20 мл/л бактериальной суспензии.
Metocel (эфир целлюлозы, Sveola Kemi AB), 12 г на литр бактериальной суспензии.
Lissapol (ICI Agrochemicals Ltd.), 1 г на литр бактериальной суспензии.
Bond (Newman Agrochemicals Ltd.), 1 г на литр бактериальной суспензии.
В других экспериментах бактериальную суспензию центрифугировали при 10000 g в течение примерно 10 мин, а полученные гранулы ресуспендировали в 0,1 М MgSO4 или в пептонной воде (5 г бактериологического пептона (Oxoid Ltd.) на литр водопроводной воды).
После тщательного перемешивания полученными суспензиями обработали семена (см. пример 4 для несмешанных бактериальных суспензий).
Обработка семян лиофилизированными бактериями
Бактерии MA 342, выращенные в культуре, выращиваемой
при встряхивании (см. пример 4), центрифугировали и полученные гранулы ресуспендировали в растворе молочных сливок (200 г порошка молочных сливок фирмы Semper AB, Швейцария, на литр стерильной
дистиллированной воды), используемом в качестве протектора модифицированных бактерий. Смесь заморозили в закрытых стеклянных банках, а затем лиофилизировали в этих банках в течение примерно 48 часов в
лиофильной сушке Hetosicc (Heto Ltd., Дания). Полученный порошок оставили до применения при 4oC в пластиковых мешках или в пластиковых бутылях с завинчивающимися крышками. Для обработки
семян порошок перемешали в воде или в других водных растворах, а затем обработали семена (см. пример 4 для бактериальной суспензии), или его смешивали в пластиковом контейнере с семенами всухую,
тщательно встряхивая смесь (примерно 10 г порошка на кг семян).
Гранулирование семян, обработанных MA 342
Бактерии MA 342, выращенные в культуре, выращиваемой при встряхивании
(см. пример 4), перемешали в пропорции 1:1 по объему с клейким веществом (2 % мас. /об. водного раствора натриевой соли карбоксиметилцеллюлозы или 50 % мас. /об. водного раствора гуммиарабика). Этой
смесью обработали семена (см. пример 4). Затем в пластиковый мешок добавили избыточное количество бентонита (Dresser Minerals Inc.) или порошка талька (Kebo Lab. AB); мешок надули и сильно потрясли в
течение нескольких минут. После этого семена разложили на большие подносы под вентилятором и оставили сохнуть при комнатной температуре.
Опрыскивание побегов растений бактериальной
суспензией
Бактериями MA 342, выращенными в культуре, выращиваемой при встряхивании (см. пример 4), заполнили пластиковые ручные опрыскиватели или опрыскиватели с приводом, затем опрыскали
листву и побеги растений. В другом случае бактерии сначала центрифугировали при 10000 g в течение десяти минут, осадок ресуспендировали в водопроводной воде и полученную бактериальную суспензию
использовали для опрыскивания листвы и побегов растений.
Пример 7
Действие очищенных метаболитов из MA 342 против заболеваний, вызванных Drechslera teres, при экспериментах в
теплицах.
Штамм MA 342 вырастили за 48 часов в полуконцентрированном (15 г/л) триптон-соевом бульоне (Difco Ltd.) на роторной качалке в темноте при 18-20oC. Полученную суспензию бактерий центрифугировали при 48000 g в течение 30 мин, а затем метаболиты в надосадочной жидкости подвергли дальнейшей очистке в патронах Sep-pak C 18 (Walers Associates) следующим образом.
1. 80 мл надосадочной жидкости влили в Spe-pak, активированный 10 мл метанола.
2. Sep-pak промыли сначала 5 мл 30%-ного этанола, а затем 5 мл 40%-ного этанола.
3. Метаболиты элюировали 5 мл 70%-ного этанола.
4. Элюат в 70%-ном этаноле выпарили в роторном испарителе, оставив примерно 1,5 мл водного раствора. Затем его разбавили водопроводной водой до объема 6,5 мл.
Семена ячменя культурного сорта "Golf", естественно зараженные D.teres, погрузили в эти 6,5 мл водного раствора метаболитов на 30 мин, а затем посеяли в банки по 50 семян. Банки накрыли стеклянными крышками и поместили в темное место при 6oC. Через 9 дней крышки сняли и банки поместили в теплицу при 15-22oC на примерно 2 недели. Число проросших и число пораженных болезнью растений подсчитали (см. пример 4). Для контроля использовали необработанные семена и семена, обработанные надосадочной жидкостью, не очищенной в патроне Sep-pak и не содержащей клетки MA 342.
Пример 8
Результаты сравнительных испытаний штамма MA 342 и 11-ти других изолятов бактерий Pseudomonas chlororaphis,
полученных из разных коллекций культур.
Одиннадцать разных не шведских изолятов Pseudomonas chlororaphis (см. табл. 1) испытали вместе со штаммом MA 342 на действие против пятнистости листьев ячменя и на индукцию ответа в биохимических тестах согласно системе тестирования API 20 NE. Дополнительно, образцы сравнивали по появлению колоний и кристаллических образований на чашках с агаром. Эти одиннадцать не шведских изолятов были получены из различных стран и депонированы в четырех разных признанных коллекциях культур (табл. 1).
Тест на способность подавлять
заболевания при испытаниях в теплице
Тесты были проведены с ячменем, зараженным Drechslera teres (см. пример 4) и для обеспечения адекватного сравнения все изоляты были испытаны одновременно.
Как видно из таблицы 15, результаты показывают, что MA 342 уникален в том смысле, что ни один из других испытаний изолятов не обладает таким свойством как MA 342 при таком тестировании, а именно
- способность подавлять инфекцию, вызванную Drechslera teres.
Индукция реакций при биохимических тестах согласно системе тестирования API 20 NE
Тесты проводились, как описано
выше. Результаты приведены в табл. 16. Они показывают, что MA 342 и в этом отношении уникален и отличается от остальных 11 испытанных изолятов. Некоторые из испытанных изолятов нельзя считать согласно
этому тесту главными среди видов Pseudomonas chroloraphis.
Сравнение появления колоний и образования кристаллов на чашках с агаром
Изоляты культивировали в чашках Петри на TSA
10, как описано выше. Наблюдали небольшую разницу в появлении колоний различных изолятов, но по этому признаку все изоляты различить нельзя. Однако изолят MA 342 был единственным, который образовывал
типичные прозрачные кристаллы в агаре и по этому свойству его можно было отличить от всех других изолятов.
Реферат
Изобретение относится к средствам защиты растений от заболеваний и касается нового штамма бактерий Pseudomonas chlororaphis для получения этого средства и к использованию его. Штамм Pseudomonas chlororaphis NСIМВ 40616 активен против грибов рода Drechslera, Microdochium, Tilletia и Ustilago. Для борьбы с грибковыми заболеваниями растений штамм может быть использован совместно с жидким или твердым пористым носителем, а также с клейкими добавками. Вышеуказанное средство может быть нанесено на семена, растения и в среду, на которой растет или должно расти растение. Средство позволяет защитить растения от вышеуказанных возбудителей заболеваний. 3 с. и 15 з.п. ф-лы, 1 ил., 17 табл.


Комментарии