Жидкая среда для культивирования энтомопатогенных нематод и способ получения энтомопатогенных нематод - RU2044484C1
Код документа: RU2044484C1
Чертежи

Описание
Изобретение относится к способу получения энтомопатогенных нематод путем внесения бактериального симбионата в стерильную жидкую питательную среду, содержащую источники витаминов и минеральных солей на основе дрожжей, источник триглицеридов, источник белка и воду, с последующим заражением молодыми стадиями нематод, культивированием в условиях аэрации и перемешивания и выделением ювенильных нематод, а также к среде для культивирования энтомопатогенных нематод.
Энтомопатогенные нематоды используют в качестве биологического средства борьбы с насекомыми, в частности сельскохозяйственными, садовыми и домашними насекомыми. Нематоды представляют группу безсегментных круглых червей. Некоторые семейства нематод паразитируют на растениях или животных. Нематоды семейств, паразитирующих на насекомых, называют энтомопатогенными.
Отрядом нематод, представляющим большой промышленный интерес, является отряд Rhabditida, включающий несколько семейств, многие виды которых паразитируют на насекомых. К числу перспективных семейств относятся Steinernematids и Heterorhabditids. Общее обсуждение классификации нематод и их энтомогенных семейств можно найти в книге Poinar G.O. The natural history of nematodes. Прентис-Холл, Нью Джерси, 1983.
Нематоды проходят обычный жизненный цикл, состоящий из пяти стадий, очерченных процессом линьки, в котором формируется новая кожица, а старая сбрасывается. Вкратце, взрослые особи стадии 5 откладывают яйца, из которых появляются личинки стадии 1, переходящие в соответствующих условиях на стадию 2. Обычно личинка стадии 2 просто развивается в личинку стадии 3 и затем личинку стадии 4, которая и завершает цикл на взрослой стадии. Однако, и это представляет интерес с точки зрения использования нематод для борьбы с насекомыми в условиях, относительно неблагоприятных для продолжения роста и репродуцирования, личинка стадии 2 нематод Steinernematid и Heterorhabditid развивается в инфекционные ювенильные нематоды стадии 3 или ИЮ. В этих условиях сохраняются показатели кожицы, характерные для стадии 2, и в данном случае ее называют оболочкой. Оболочка полностью заключает нематоду. ИЮ инфекционны для насекомых, и они завершают свой жизненный цикл за счет насекомого-хозяина.
ИЮ нематоды Steinernematid и Heterorhabditid являются эффективным средством борьбы с насекомыми. Они поддаются морфологической идентификации и обычно обитают в поверхностной пленке воды, окружающей частицы почвы. Для выживания им необходимы кислород и влага, но не пища, в качестве источника энергии они используют собственные резервы пищи. Они сохраняют инфекционность при удалении оболочки.
В биологии нематод Steinernematid и Heterorhabditid важен еще один аспект, а именно: нематоды этих семейств симбиотичны с видами бактерий, которые в первую очередь, но не полностью ответственны за их энтомопатогенные свойства. Росту нематод благоприятствует присутствие соответствующего симбионта, в основном потому, что симбионт служит легко ассимилируемым источником пищи.
Для массового производства энтомогенных нематод Bedding (Ann.Appl.Biol. 104, 117-120, 1984) предложил метод моноксенной культуры. В методе Bedding применяют твердофазную матрицу из пластиковой пены, пропитанную гомогенизированной животной тканью, в которой выращивают нематоды. Методикой предусмотрен хорошо аэрируемый субстрат для роста как бактериального сомбионта, так и нематод. Способ Bedding использован для получения 109 нематод за одну загрузку, однако потенциальный рынок может потребовать производственных мощностей, в 10000 раз превышающих указанное количество. Более масштабный вариант способа Bedding потребует дорогостоящего автоматизированного оборудования, его трудно сохранять в асептическом состоянии и создает трудности в подготовке среды и сборе нематод. Жидкостной моноксенный способ позволил бы избежать указанных затруднений.
Жидкостные моноксенные культуры энтомогенных нематод обычно выращивают в небольших капельках гемолимфы насекомых. Имеются сообщения и об аксенных жидкостных культурах, но они обладают ограниченной эффективностью и требуют дорогих питательных добавок. Например, в ходе исследования питания нематод использованы жидкостные культуры объемом менее 100 мл: Stoll N. (Helminthol I. Lister, Suppl. c.169-174, 1961; Jackson G.I. Exp. Parasitol. 34, 111-114, 1973; Hansen и др. 42 nd. Ann.Meeting Am. Soc. 1967; Parasitol Lower W.M.R. и др. Nematologia 16, 563-566, 1970; Beucher E.J. и др. Nematologia 16, 403-409, 1970). Тем не менее, указанные сообщения показали, что биологические и физиологические потребности нематод могут быть удовлетворены в жидкой суспензии. Для аэрации таких культур могут потребоваться определенные средства, в частности диффузия в тонкие слои жидкости, встряхивание или пробулькивание.
Одна из самых больших трудностей в создании жидкостной моноксеновой культуры заключается в достаточной аэрации как бактерий, так и нематод без чрезмерных сдвиговых сил. Существуют методика выращивания C.elegans (свободноживущая нематода) в жидкостной моноксенной культуре. Согласно этой методике бактерии и нематоды суспендируют в не являющемся источником питания солевом растворе. В этих условиях бактерии имеют мало свободной пищи для метаболизма, вследствие чего имеют низкую потребность в кислороде. В ходе исследований, приведших к настоящему изобретению, обнаружено, что эта методика может быть использована для культуры N.carpocapsae при условии добавления стерола. Однако бактериальные потребности были найдены настолько высокими, что промышленное применение методики экономически нецелесообразно.
Заявка на патент РСТ N 86/01074, кл. A 01 K 67/00, 1986 (далее ссылка на нее дается как "Пэйс и др.") описывает способ широкомасштабного культивирования нематод, направленный на решение проблем, связанных с требованиями аэрации. В этой методике определяется скорость перемешивания в перемешиваемом реакторе, при которой происходит разрушение нематод. Затем скорость перемешивания устанавливают ниже такого определенного уровня и поддерживают в течение всего периода культивирования.
Пейс и др. также описывают применение простой жидкостной культурной среды, включающей гомогенат бычьей печени и дрожжевой экстракт. Другие среды для культивирования нематод включают: соевый пептон-дрожжевой экстракт-декстрозу (Buecher и др. J.Nematol 3, 199-200, 1971, для применения в аксенной жидкостной культуре), пептон-глюкозу и бактерии (Dutky S.R. и др. J.Nematol 13, 140, 1967 для моноксенной культуры на агаре); питательный бульон дрожжевой экстракт соевая мука кукурузное масло (Wouts W.M. и др. V.Nematol 13, 467-469, 1981 для моноксенного твердого носителя или рены). Каждая из указанных сред содержит один или более компонентов, которые либо дороги, либо трудны в изготовлении.
Моноксенный жидкостной способ культивирования Пэйс и др. дает скорость репродуцирования в первые 10 дней из 20, повышающую от 2000 до 4000 нематод на мл, и, как сообщается, приводит к возникновению инфекционных ювенильных особей через 20 дней в жидкой культуре. Другие исследователи, использующие аксенные системы, сообщают об аналогичных скоростях репродуцирования, но не сообщают о наблюдении заметных количеств инфекционных ювенильных особей.
Обнаружено, что решающим компонентом в жидкостной питательной среде, поддерживающей моноксенное культивирование нематод с регулированием потребления кислорода, является эмульгатор, такой как яичный желток, предназначенный для ускорения утилизации добавляемых масел или жиров. К настоящему времени отсутствуют какие-либо сообщения о применении эмульгатора для улучшения жидкостного культивирования энтомогенных нематод; однако яичный желток был использован в качестве замены животной сыворотки при культивировании паразитов млекопитающих как успешно, так и безрезультатно.
A.Roder (Naturwissenschaften 69, 92-93, 1982) применил яичный желток для замены плодной сыворотки в культуре клеток насекомого. В работе M.S.Schniner, B.Fried (Int.J.Parasitol 10, 391-395, 1981) используют яичный желток в IIСТС 135 в культивировании Ablosma suwaense паразитирующей трематоде (червь трематодного типа). Кроме того, яичный желток часто использовался в бактериальных клеточных культурах, особенно в случае Staphylococcus. P.F.Busch и др. (J. Parasitol 59, 319-322, 1973) обнаружили, что яичный желток не дает преимуществ при культивировании Cotylurus (трематода), а D.W.W.Kannangara (Int.J.Parasitol 4, 675-6, 1974) обнаружил, что яичный желток не дает преимуществ при культивировании Paragonimus. Ни в одном из этих случаев не указано на роль яичного желтка в качестве эмульгатора масляного компонента.
Цель изобретения улучшение эффективности продуцирования энтомогенных нематод в жидкой культуре, а также создание улучшенной жидкой культуральной среды для моноксенной нематодной культуры, но с регулированием потребления кислорода. Такая питательная среда легко готовится и сравнительно недорога при получении по сравнению с существующими в настоящее время средами.
Кроме того, целью изобретения является создание способа усиления развития бактерий и нематод, в котором скорость перемешивания изменяют в зависимости от изменения потребности в переносе кислорода, связанного с каждой стадией развития нематод.
В соответствии с поставленной задачей, настоящее изобретение предлагает жидкую среду для культивирования энтомопатогенных нематод, содержащую источник витаминов и минеральных солей на основе дрожжей, источник триглицеридов, источник белков и воду, отличающуюся от известных сред тем, что она дополнительно содержит эмульгатор яичный желток, при этом в качестве источника витаминов и минеральных солей используют дрожжевые клетки, в качестве источника триглицеридов кукурузное масло, а в качестве источника белков соевую муку в эффективном количестве.
Предпочтительный вариант состава
среды по изобретению содержит ингредиенты в следующем количественном соотношении, мас. Яичный желток 1-2
Дрожжевые клетки или дрожжевой экстракт 0,1-2 Кукурузное масло 2-5 Соевая мука 1-3 Вода
Остальное
Изобретение предлагает также способ получения энтомопатогенных нематод, отличающийся тем, что
для совместного культивирования используют нематоды Neoplectana corpocapsae и
бактериальный симбионт Xenorhabdis nematophilus, культивирование проводят в питательной среде в присутствии эмульгатора
яичного желтка, при этом аэрацию осуществляют при постоянной скорости
воздушного потока, а перемешивание проводят с минимальной скоростью в фазе развития взрослых нематод с увеличением ее в ходе
развития новой популяции. Предпочтительно, для культивирования используют
нематоды Neoplectana corpocapsae преимущественно третьей и четвертой личиночной стадии.
На стадии развития нематод третьей и четвертой личиночной стадии предпочтительно проводить обновление питательной среды.
На чертеже иллюстрируется зависимость между скоростью перемешивания и репродуцированием нематод в ходе ферментационного цикла энтомогенных нематод. Скорость перемешивания либо постоянна и равна 50 об./мин (обозначено квадратиками), 125 об./мин (обозначено значками Х), 500 об./мин (обозначено перевернутыми треугольниками), либо меняется (обозначено значками) в ходе опыта с установлением уровня переноса кислорода в 64 мм Hg.
Характер проведения
изобретения
А. Определения
Термин "энтомогенные
нематоды" относится к нематодам, паразитирующим на одном или нескольких видах насекомых. К наиболее важному отряду энтомогенных
нематод относится Rhabditida, и изобретение главным образом направлено
на культивирование и/или нагрузки двух семейств Rhabditida этой группы, а именно: Steinernematidae и Heterorhabditidaе.
Однако и другие энтомогенные свойства могут быть также применимы в качестве объектов, к которым могут быть приложены способы изобретения, в том числе Riplogasteridae, Panagrolaimidae, Rhabditi-dae и Syrophonematidae, а также не относящиеся к Rhabditid семейства, в том числе: Allantonematidae, Aphelenchoididae, Entaphelenchidae, Mermithidae, Neoty- lenehidae, Sphaerulariidae и Tetradone-matidae.
Как указано выше, в случае Rhabditidа к наиболее важным семействам для промышленного применения относятся Steinernematidae и Heterorhabditidae. Ссылки в литературе на Neoaplactana относятся к определенному роду Steinernematidae и термин Neoplactana и Steinernema для обозначения особых видов, например N.glaseri или S.glaseri, иногда взаимозаменяемы.
Хотя классификация различных групп нематод может оказаться запутанной, ясно, что изобретение направлено на виды, характерной особенностью которых является инфекционность по отношению к насекомым и которые в качестве стадии жизненного цикла имеют стадию 3 инфекционных ювенильных нематод (ИЮ), характеризующуюся особенностями, описанными выше. В зависимости от намеченного применения в сельском хозяйстве, т.е. целевого насекомого, один или несколько видов могут оказаться особенно перспективными.
Термин "инфекционная ювенильная" стадия или "ИЮ" относится к стадии, не достигшей взрослого состояния особи, способной поразить или инфицировать насекомое-хозяина. Для семейств, являющихся объектом предлагаемого изобретения, такой стадией является стадия 3 ИЮ.
Термин "перемешивание" относится к любому физическому способу создания движения потока в ферментационном сосуде в том числе, но без ограничения только ими: механическое перемешивание лопастной мешалкой и принудительное пробулькивание воздуха.
В.
Общее описание
Инфекционные ювенильные особи, являющиеся объектами приведенных методик, применимы для борьбы с
разнообразными насекомыми-вредителями, в том числе сверлильщиками,
долгоносиками, гусеницами, чревовидными личинками жуков, червей корней кукурузы, хрущиками японскими и медведками. Основные
сельскохозяйственные продукты, подверженные действию инфекционных
ювенильных нематод, включают кукурузу, землянику, миндаль, тепличные культуры, грибы, сахарный тростник и картофель. Птицеводческие
хозяйства и фермы для выращивания других животных освобождаются от
мух. В обычной практике сельского хозяйства инфекционные ювенильные нематоды наносят в больших количествах в намеченные места.
Например, для борьбы со сциаридными мушками в помещениях для выращивания
грибов в каждое помещение вносят примерно 5˙ 109 червей.
Настоящее изобретение направлено на способы широкомасштабного жидкостного культивирования энтомопатогенных нематод использованием улучшенной жидкой культурной среды. Среда включает эмульгатор, дрожжевой источник витаминов и минералов, источник триглицеридов, источник белка и может включать дополнительные необязательные добавки, такие как противопенные добавки, соли, питательные вещества и буферные системы. Найдено, что триглицерид или масляный компонент в присутствии эмульгатора, такого как яичный желток, хорошо эмульгируется и остается хорошо эмульгированным в течение нескольких дней ферментации. В этом резкое отличие от составов без яичного желтка, в которых масло разделяется и поднимается в верхнюю часть ферментационного сосуда. Яичный желток рекомендуется в качестве эмульгатора. До настоящего времени никакого верхнего предела для концентрации такого эмульгатора не установлено. Установлено, что 1-2 (об./об.) вполне приемлемы. Хотя яичный желток и является предпочтительным эмульгатором, частично он может быть замещен лецитином. Как правило, в сочетании с яичным желтком может быть использовано 0,1-0,5% лецитина. Другие эмульгаторы включают моностеарат или моноолеат глицерина, полиоксиэтиленсорбит и сложные эфиры жирных кислот с углеводами.
Среда также должна включать источник витаминов и минералов, которые могут поставляться, например, дрожжевым экстрактом и дрожжевыми клетками. Другие источники витаминов и минералов включают мясные экстракты и овощные экстракты, однако дрожжи являются гораздо более удобным и экономичным источником. Дрожжевые клетки рекомендуются в качестве менее дорогостоящей альтернативы дрожжевому экстракту. Рекомендуется использовать 0,1-1% (сухой вес) или для сравнения 0,3-3% (влажный вес) источника дрожжей в культурной среде.
Целый ряд источников триглицеридов доступен для использования в предлагаемом изобретении. Такие источники включают, но без ограничения только ими, растительные масла, такие как кукурузное, сафлоровое, соевое, подсолнечное и рапсовое масло, а также животные масла, такие как рыбий жир и лярд. В среду должен быть введен по крайней мере один источник триглицеридов, но может быть использована также и смесь масел, которая охватывается объемом изобретения. Рекомендуемым источником триглицеридов является растительное масло, особенно кукурузное масло в концентрации 2-5% (об./об.).
Источники белка также могут быть самыми разнообразными. К примеру, это могут быть белковые экстракты, включая продукты животного или растительного происхождения, широко применяемые в качестве компонентов культурных сред. Экстракты высушенных органов животных, такие как EnlivPro и мясной пептон, рыбная мука, соевый пептон и соевая мука все это может быть использовано в предлагаемом изобретении. Из указанных источников рекомендуется соевая мука. Хотя верхний предел концентрации соевой муки и не был определен, рекомендуется ее добавлять в концентрации 1-3% (мас./об.).
При желании в среду могут быть введены не являющиеся существенными дополнительные компоненты, например соли, холестерин, стерильная вода или фосфатный буферный солевой раствор использованы в настоящем изобретении без ухудшения выхода инфекционных нематод.
Предлагаемая жидкая культурная среда для массового получения энтомогенных нематод, таким образом, включает: 1-2% яичного желтка, 0,1-1% (сухой вес) дрожжевых клеток, 2-5% кукурузного масла и 1-3% соевой муки. Такую среду готовят из компонентов, представляющих собой необразованные сырые продукты, применяемые в пищевой промышленности, и легко доступных.
Среду получают первоначальным смешиванием масляного компонента с яичным желтком с последующей гомогенизацией полученного маслянистого продукта с водой. Затем добавляют остальные компоненты и сразу стерилизуют в автоклаве. Хотя проведение начальной стадии смешивания и не является обязательным, найдено, что среда, полученная именно таким путем, образует более устойчивую эмульсию и приводит к более высоким выходам нематод.
Другим аспектом настоящее изобретение направлено на способ широкомасштабного жидкостного культивирования энтомогенных нематод для получения в высоких концентрациях инфекционных нематод, в котором культурную среду предлагаемого изобретения предварительно заражают находящимися в симбиозе с нематодами бактериями. Как общепринято в данной области, рекомендуется использовать бактерии в их первичной форме. Введение симбиотичных бактеpий важно с точки зрения максимального повышения выходов способа и инфекционности нематод по отношению к насекомым.
Примерно 1˙107 бактериальных клеток на мл среды выращивают 24-48 ч при 25-30оС перед заражением культурой нематод. После бактериального заражения среды в нее подают поток воздуха в количестве 1 объем ферментатора/мин и скорость перемешивания устанавливают такой, при которой уровень растворенного кислорода достигает 50% насыщения, хотя могут применяться и другие условия для подачи достаточного количества кислорода в среду.
Ювенильные нематоды могут быть любыми инфекционными нематодами Ю1-Ю4 стадии ювенильных особей, из которых стадия Ю3 предпочтительна. Концентрация нематодного инокулята может составлять интервал 100-5000 нематод/мл среды. Во время заражения нематодами давление может быть установлено до 3 бар, если хотят повысить доступность кислорода. На стадии ферментации, соответствующей возникновению взрослых нематод, потребность бактерий в кислороде падает. В результате перемешивание может быть уменьшено.
После заражения температуру понижают до 20-28оС в зависимости от линии нематод и ту же температуру поддерживают в ходе роста культуры.
При использовании встряхиваемой колбы Эрленмейера рекомендуемый объем ферментируемой культуры составляет к объему колбы отношение (1:4)-(1:8). Культуру встряхивают на роторной качалке при скорости 150 об./мин в течение всего периода культивирования, состоящего 10-16 дн.
Перемешиваемый резервуар реактор является рекомендуемым ферментационным сосудом независимо от создаваемых в таких сосудах высоких сдвиговых деформаций. При скорости потока воздуха 1 объем ферментатора/мин скорость перемешивания может быть достаточно высокой для компенсации изменений потребности в кислороде на любой конкретной стадии роста культуры без нежелательного влияния на конечные выходы инфекционных ювенильных нематод. Как более подробно описывается ниже, чувствительность к сдвигу культуры определяют для различных стадий роста и сопутствующих потребностей в кислороде ферментируемых культур, в результате чего выявлены верхние пределы скорости перемешивания.
Концентрацию второго поколения ювенильных нематод определяют с 8-го дня и вплоть до 16-го дня периода ферментации. Как найдено, среда поддерживает на более высоком уровне репродуцирование по сравнению с другими средами, превышающем 200-кратное увеличение на генерацию, и среда приводит к инфекционным ювенильным нематодам в более короткий срок, например в пределах 10-16 ч по сравнению с известными способами. Таким образом, среда и методика предлагаемого изобретения дают способ, которым может быть легко осуществлено широкомасштабное культивирование энтомогенных нематод использованием недорогих легкодоступных компонентов.
Изобретением также предусмотрен способ периодической подпитки, в котором среда вновь подается в ходе Ю3 и Ю4 стадий развития. В таком способе дается дополнительный источник питательных веществ для ферментируемой культуры, в результате чего можно избежать каких-либо состояний с ограничением питательных веществ.
В еще одном аспекте изобретение относится к способу достижения развития бактерий и нематод в перемешиваемых сосудах, в котором скорость перемешивания меняют в зависимости от изменений потребностей в переносимом кислороде с целью дифференциального обеспечения оптимальных условий репродуцирования и роста нематод. Условия, достигаемые в перемешиваемых сосудах, даже в лучшем случае трудно предсказуемы, но эти условия играют решающую роль в успешном получении нематод. Решающие параметры включают температуру, напряжение растворенного кислорода и напряжение сдвига, а также другие источники физического напряжения. Температура способа может быть легко оптимизирована в небольших сосудах или статичных культурах. Поддержание оптимальной температуры не оказалось трудным и в больших сосудах.
Растворенный кислород должен поддерживаться на уровне примерно 32 мм Hg в течение большего периода осуществления способа, но должно быть выше 40 мм Hg, предпочтительно 80 мм Hg, в момент появления взрослых особей и откладывания ими яиц. Трудность создания таких условий в перемешиваемых резервуарах зависит от потребности кислорода в способе и скорости переноса кислорода. Скорость переноса кислорода складывается из скорости потока воздуха, распределения пузырьков по размеру и степени перемешивания. Пиковая потребность в кислороде в ходе предлагаемого способа составляет около 200 ммоль/ч, но в другие моменты ферментация может быть всего 5 ммоль/ч или ниже. Установление критического напряжения кислорода в перемешиваемых резервуарах реакторах в моменты пиковой потребности в кислороде может потребовать высокоскоростного перемешивания.
Давно установлено, что интенсивное перемешивание может ингибировать репродукцию нематод (Stoll N. J.Parasitol 39, 422-444, 1953). Пэйс и др. приводят методику определения скорости перемешивания в перемешиваемом реакторе, при которой разрушаются взрослые нематоды. В методике определяют силу сдвига, которая может привести к разрушению взрослых нематод, как минимальную скорость конца мешалки в описанном реакторе, при которой происходит разрушение. Однако хорошо известно, что напряжение сдвига является произведением скорости сдвига (пропорциональна скорости конца мешалки) и вязкости (Rowen R.L. (1986) Chem. Engineering 9 июня, стр.55-63). Определения Пэйса и др. допустимых скоростей конца мешалки проведены в воде с вязкостью 1 сП, но вязкость среды способа Пэйса и др. не определялась. Поэтому приведенная методика не позволяет предсказать сдвиговые условия в течение самого способа, в котором вязкость неизвестна и вероятно меняется.
Опубликованы многочисленные способы расчета максимального напряжения сдвига. Однако общепризнано, что ни один из таких способов не может быть надежно использован для определения допустимых состояний в ходе масштабных биологических процессов (Trilli A. Industrial Microbiology, Американское общество микробиологии, стр.277-307, 1986).
Существуют, однако, два подхода, которые с успехом могут быть использованы для оптимизации равновесия между скоростью переноса кислорода и
интенсивностью перемешивания. Один из них
заключается в применении неперемешиваемого сосуда, такого как пробулькиваемая колонна или реактор с перемешиванием струей воздуха, которые, как известно,
характеризуются низкими (но определенными)
сдвиговыми силами. Другой подход, особенно приемлемый для ферментационных сосудов, таких как встряхиваемые колбы и перемешиваемые резервуары-реакторы,
заключается в ограничении интенсивности
перемешивания только в периоды, когда сдвиговые силы и в самом деле являются ограничивающим фактором, и повышении интенсивности перемешивания только тогда,
когда это необходимо для переноса кислорода.
В отличие от многих способов ферментации продуцирование нематод характеризуется изменением распределения стадий развития в ходе процесса. Например,
взрослые нематоды преобладают в промежуток между
2-ым и 5-ым днем, а молодые ювенильные нематоды преобладают с 6-го дня и далее. Способ настоящего изобретения основан на открытии того, что наибольшая
потребность в кислороде приходится на начальный
рост бактерий, уменьшается с развитием взрослых нематод и снова повышается с увеличением сила ювенильных нематод. Кроме того обнаружено, что молодые
ювенильные нематоды гораздо менее чувствительны к
напряжению сдвига по сравнению со взрослыми нематодами. Например, действия сдвига испытывают, поместив нематоды между вращающейся бобиной и полым
цилиндром, где промежуток между двумя поверхностями
составляет 2 мм. Действие сдвига было следующим: Стадия нематод Об./мин в момент
разрушения Ю1 3000 Ю2-Ю3 2800 Взрослая 1800
В
отдельном опыте в устройстве с ламинарным сдвигом
разрушения взрослых нематод не происходит и при 630 дин/см2.
Хотя сдвиговые силы, обнаруживаемые в одном сосуде, с трудом поддаются сравнению с теми же силами в другом сосуде, ясно, что взрослые нематоды более чувствительны, чем более молодые формы. На основании грубой экстраполяции вышеприведенных результатов можно предсказать, что разрушение в ферментаторе на 20 л произойдет при 500 об./мин, а в ферментаторе на 2500 л менее чем при 100 об./мин. Таким образом, такое знание позволяет регулировать процесс ферментации так, что скорость перемешивания будет меняться дифференциально с обеспечением оптимальных условий для преобладающей инфекционной стадии развития нематод в культуре.
По окончании ферментации нематоды собирают прямо из ферментационного сосуда. Сбор нематод может быть осуществлен с помощью любого из обычных способов выделения нематод из среды, в том числе центрифугирования, отстаивания и фильтрования. В настоящем способе используют центрифугу с твердой камерой для отделения нематод от вязкой части среды. Взвесь пропускают через камерную центрифугу при максимальной скорости потока 6 л/мин и при 2500-3000 об. /мин. Взвесь еще более осветляют с отделением нематод от грязи, масла и не имеющих отношения к ИЮ элементов. Так, взвесь разбавляют мягким мылом, таким как мыло Айвори

Стадию осветления повторяют до тех пор, пока не будет достигнута достаточная очистка, что устанавливают наблюдением под микроскопом распределения нематоды-частицы.
После выделения продукта при желании может быть проведена стадия концентрирования.
Вне зависимости от других форм, которые могут охватываться объемом предлагаемого изобретения, нижеследующие примеры иллюстрируют рост различных линий нематод с применением дополнительных бактериальных симбионтов. Необходимо отметить, что изобретение применимо ко всем линиям энтомогенных нематод, хотя примеры иллюстрируют только избранные линии.
Таким образом, изобретение далее описывается нижеследующими примерами. Примеры приведены только с целью иллюстрации воплощений изобретения, и их не следует рассматривать, как ограничивающие объем изобретения.
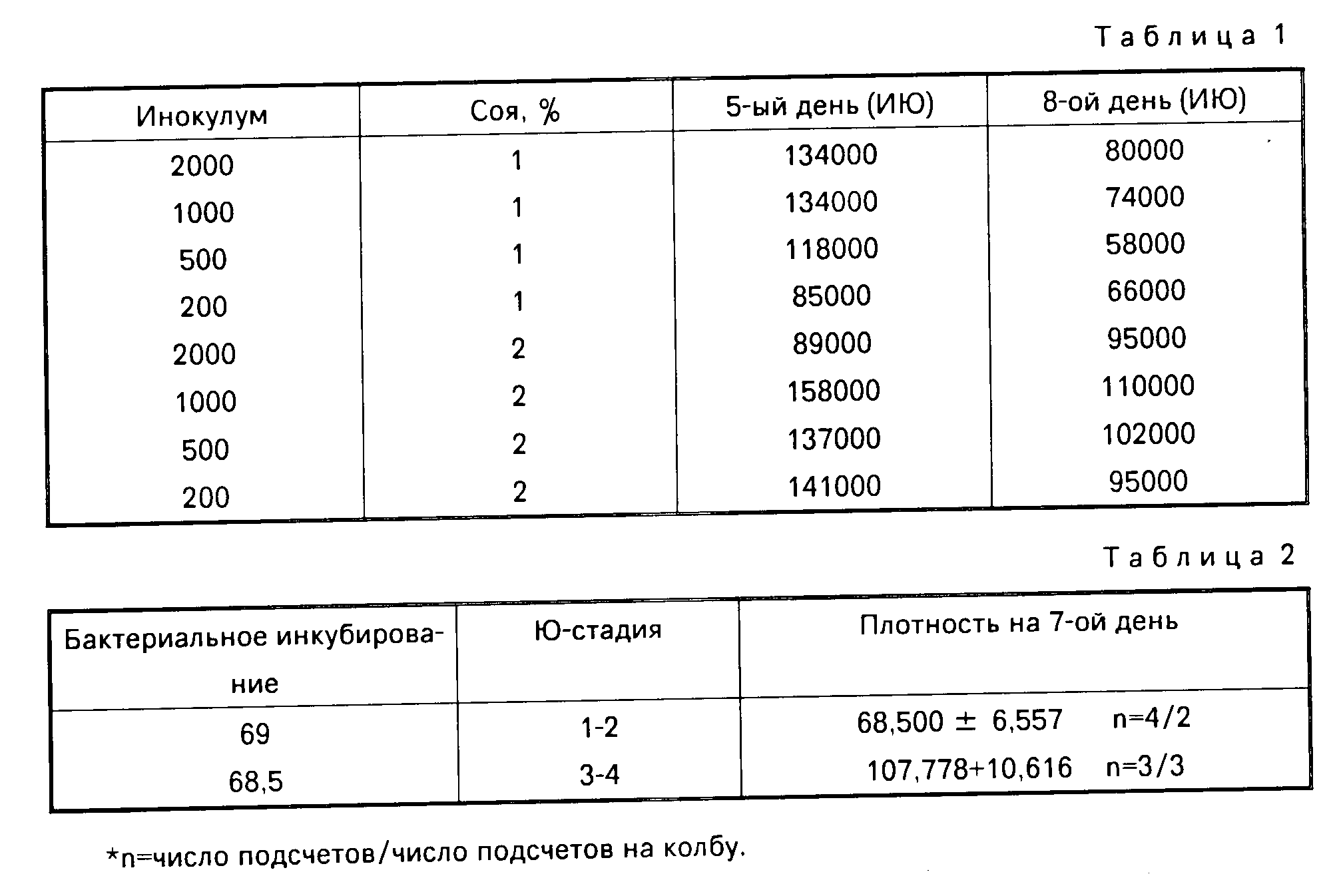
П р и м е р 1. Среду, содержащую 0,5% NaCl, 0,25% KH2PO4, 0,5% яичного желтка, 3% (сухой вес) дрожжевых клеток, 1 или 2% соевой муки, 0,5% Enliopro, 5% кукурузного масла и 20 мг/л холестерина, с рН 8 автоклавируют объемами по 30 мл в колбах на 125 мл.
Стерильную среду заражают 3 ˙ 108 бактерий Xenorbadus nemotophilus и инкубируют при 28оС в роторной качалке (150 об./мин). Спустя примерно 24 ч вносят Neoaplectana carpocapsae (все ИЮ) до плотностей 2000, 1000, 500 и 200/мл. Температуру инкубирования понижают до 25оС.
На 5-й и 8-й день после заражения нематодами отбирают образцы. В табл.1 представлена общая популяция нематод на 5-ый день и инфекционных ювенильных нематод популяции на 8-ой день.
Наилучшая степень репродукции 705. Собранные с этих культур нематоды были патогенны по отношению к насекомым.
П р и м е р 2. Пластиковые подносы с ячейками диаметром 1 см используют для культуры N. carpоcapsae (0,25 мл). Среда содержит
0,5% NaCl, 0,25% KH2PO4, 3% (сухой вес)
дрожжевых клеток, 2% соевой муки, 5% кукурузного масла, 0,625% Enliopro и яичный желток в различных концентрациях, указанных ниже. Среду
заражают X.Nematophilus (количество) и N.carpocapsae
(количество) и инкубируют при 25оС. Спустя 7 дн. подсчет дает следующие результаты: Яичный желток Нематоды/мл 1% 56500 0,25% 27000 0%
13000
П р и м е р 3. Среду, содержащую 2%
соевой муки, 1% яичного желтка, 0,625%
высушенного животного белка (Enliopro), 0,5% дрожжевых клеток (сухой вес), 5% кукурузного масла, 0,5 NaCl и
KH2PO4, с рН 8 автоклавируют
объемами по 30 мл в колбах Эрленмейера на 125 мл.
Стерильную среду в каждой колбе заражают 3˙108 бактерий Xenorhadis nemоtophilus и инкубируют при 28оС на роторной качалке (150 об/мин). Через 72 ч две колбы независимо заражают 1000 ювенильных нематод/мл либо Ю1-Ю2 N.carpocapsae инокулумом, либо Ю3-Ю4 N.caprocapsae инокулумом. После заражения нематодами колбы инкубируют при 25оС со встряхиванием при 150 об/мин.
Плотности нематод подсчитывают в конце опыта, продолжавшегося 7 дн (169 ч) после заражения нематодами (стадии ювенильного инокулума указаны в табл. 2).
Применение ювенильного инокулума, содержащего нематоды стадии Ю3-Ю4 (в данном опыте используют инокулум, в основном содержащий Ю3), на 50% более успешно по сравнению с инокулумом, содержащим нематоды стадии Ю1-Ю2.
П р и м е р 4. Используют стеклянный ферментатор диаметром 10 см и высотой 75 см, работающий в режиме реактора с перемешиванием струей воздуха с вытяжной трубкой диаметром 5 см и высотой 20 см. В нижней части вытяжной трубки расположен барботер из сплавленного металла пористостью 40 мкм.
Культуру N. carpocapsae выращивают, как в примере 3, но в объеме 6 л. В течение всего опыта воздух пропускают со скоростью 6 л/мин. Через 7 дн достигают плотности нематод 95000/мл.
П р и м е р 5. Перемешиваемый резервуар ферментатор на 20 л (Биоэнджиниринг), содержащий 161 л среды, заражают Х.nematophilus и через 48 ч N. carpоcapsae. Ферментатор работает при скорости воздушного потока, поступающего через кольцевой барботер, 16 л/мин. Ферментатор перемешивают при 205 об/мин, пока значение растворенного кислорода (РК) не падает ниже 64 мм Hg. В этот момент обороты повышают до 300 об/мин Hg, пока не будет достигнута пиковая скорость перемешивания в 500 об/мин. Если РК возрастает выше 96 мм Hg обороты уменьшают на инкременты в 50 или 100 об/мин до конечной скорости в 250 об/мин.
Напряжение кислорода в опытах с 50 до 125 об/мин (см. чертеж) в обоих случаях уменьшается до 0 мм Hg в период между 5-ым и 12-ым днем после заражения нематодами. Напряжение кислорода успешно поддерживалось выше 64 мм Hg как в опыте со скоростью перемешивания 500 об/мин, так и в опыте с переменной скоростью.
Энтомогенные нематоды, полученные предлагаемым способом могут быть использованы в качестве биологических инсектицидов широкого спектра действия.
Нематоды могут быть введены любым известным способом, таким как опрыскивание урожая, впрыскивание инъекцией в ствол дерева, опрыскивание почвы и внесение в почву в твердом виде, например в виде таблеток в разбавленной или неразбавленной форме.
Реферат
Использование: сельское хозяйство, в частности биологическая защита растений. Сущность: предложена эмульгируемая среда и способ для культивирования энтомопатогенных нематод в промышленных масштабах. Культивирование проводят в жидкой фазе в ферментаторах с регулированием скорости перемешивания в зависимости от потребности нематод в кислороде. 2 с. и 3 з. п. ф-лы, 1 ил. 2 табл.
Формула
Дрожжевые клетки или дрожжевой экстракт 0,1 1,0
Кукурузное масло 2 5
Соевая мука 1 3
Вода Остальное
3. Способ получения энтомопатогенных нематод путем внесения бактериального симбионта в стерильную жидкую питательную среду, содержащую источники витаминов и минеральных солей на основе дрожжей, источник триглицеридов, источник белка и воду, с последующим заражением молодыми стадиями нематод и культивированием в условиях аэрации и перемешивания с выделением ювенильных нематод, отличающийся тем, что для совместного культивирования используют Neoplectana carpocapsae и бактериальный симбионт Xenorhabdus nematophulus, культивирование проводят в питательной среде в присутствии эмульгатора яичного желтка, при этом аэрацию осуществляют при постоянной скорости воздушного потока, перемешивание проводят с минимальной скоростью в фазе развития взрослых нематод с увеличением ее в ходе развития новой популяции.

Комментарии