Амиды ненасыщенных кислот и промежуточные продукты для их получения - RU2072351C1
Код документа: RU2072351C1
Чертежи





































Описание
Изобретение относится к новым амидом ненасыщенных кислот, обладающих инсектицидной активностью, и промежуточным продуктам для их получения.
Ненасыщенные амиды, имеющие цепь из метиленовых звеньев с числом атомов углерода от 1 до 10, возможно, имеющие как минимум один атом кислорода или дополнительную метиленовую группу, как известно, являются пестицидами или инсектицидами, имеющими различные концевые группы, перечень которых включает в себя фенильную группу, возможно, содержащую заместители (Европейские заявки NN 228222, 194784, 225011, заявка Японии N 57-212150- Meisters and wailes: Aust. J. Chem. 1966, 19, 1215, Vig. et al: J. Ind. Chem. Soc. 1974, 51 (9), 817 или пиридильную группу, возможно, содержащую заместители (Европейская заявка N 269467), или конденсированную бициклическую систему (Европейские заявки NN 143593, 228853), дигалоидвинильную группу или возможно содержащую заместители этинильную группу (Европейская заявка N 228222).
Отсутствует информация о каких-либо промежуточных циклоалкильных группах, связывающих диеновый фрагмент с концевой группой.
Н. O.Huiswan et al. Rev. trav. Chem. 77, 97-102 (1958) сообщают о группе 5-(2,6,6-триметилциклогексил)-2,4-пентадиенамидов как об инсектицидах.
Обнаружено, что новые ненасыщенные амиды, содержащие 1,2-циклопропильное ядро, соседствующее с диеновым фрагментом и связывающее последний с концевой группой, выбранной из числа возможно замещенных моноциклических ароматических систем или возможно замещенных конденсированных бициклических систем, дигалоидвинильных групп или возможно замещенных этинильных групп, обладают интересными пестицидными свойствами.
В соответствии с изобретением предложены амиды ненасыщенных кислот общей формулы (I)
Q1QCR2 CR3CR4 CR5
C(X)NHR1
(I)
или их соли,
где Q фенил, нафтил, пиридил, дигаловинил, каждый из которых может быть замещен 1-3 заместителями, выбранными из группы: С1-C6 алкил, С1-C6 алкокси, СF3, галоген;
Q1 1,2-циклопропил, возможно замещенный С1-C4 алкилом или галогеном,
R2, R3, R4 и R5 являются одинаковыми или различными и означают водород, галоген, С1-C6 алкил, гало(С1-C4)алкил,
при этом один из
радикалов обязательно означает водород,
R1 водород, С1-C6 алкил, который может быть замещен диоксаланильной группой, цикло (С3
-C6) алкил,
2-метил-2-пропенил, Х O, S.
Одной предпочтительной группой соединений являются соединения формулы (I), где Q означает фенил, пиридил, нафтил, каждый из которых может быть замещен 1-3 заместителями, выбранными из группы С1-C6 алкил, С1-C6-алкокси, галоген.
Другой предпочтительной группой соединений являются соединения формулы (I), где R2, R3, R4 и R5 означают водород, метил или фтор.
Следующей предпочтительной группой соединений являются соединения формулы (I), где положения 2 и 3 циклопропильного ядра Q1 являются незамещенными, а положение 1 является незамещенным или замещено атомом фтора или хлора.
Еще одной предпочтительной группой соединений формулы (I) являются соединения формулы (I), где R1 означает изобутил, 1,2-диметилпропил, 1,1,2-триметилпропил, 2,2-диметилпропил, 2-метил-1,3-диоксоланил-2-метил.
Таким образом, предпочтительные соединения, отвечающие формуле (I), включают:


Обычно R2, R3, R4 и R5 выбираются из водорода, метильной группы или фтора. Обычно стереохимическая конфигурация двойных связей представляет собой

Предпочтительно R2 представляет собой водород, R3 представляет собой водород или фтор, R5 представляет собой водород или фтор, и R4 представляет собой водород или С1-4 алкильную группу, наиболее предпочтительно метильную группу.
Предпочтительно стереометрическая конфигурацию Q1 в цепи такова, что заместители, соединенные с ядром, находятся в транс-положении. Предпочтительно положение 3 циклопропильного ядра является незамещенным. Подходящие заместители в положениях 1 и 2 циклопропильного ядра включают фтор, хлор, метильную группу или трифторметильную группу. Предпочтительно положение 1 является незамещенным, а положение 2 является незамещенным или замещено фтором или хлором.
Подходящей группой R1 является алкильная группа, возможно содержащая в качестве заместителей циклоалкильную группу, диоксаланильную группу, или R1 является С2-5 алкенильной группой R1 является алькильная группа С4-6 с разветвленной цепью, например, изобутил, 1,2-диметилпропил, 1,1,2-триметилпропил, 2, 2-диметилпропил, или R1 представляет собой 2-метилпропенил-2 или (2-метил-1,3-диоксаланил-2)метил. Предпочтительно R1 представляет собой изобутил или 2-метилпропенил-2, когда R3 и R2 представляют собой водород, R4 представляет собой метильную группу и R5 представляет собой водород или метильную группу.
Одной
подходящей группой соединений, отвечающих формулу (I), является группа соединений, общей формулы (II):
QaQ1aCR2a CR3aCR4a CR5a
C(=Xa)NHR1a (II)
или соли этих соединений, где Qa обозначает возможно замещенные фенильную или пиридильную группы или конденсированную биядерную
систему, в
которой как минимум одно ядро является ароматическим, содержащим 9 10 атомов, из которых один может быть атомом азота, остальные атомы углерода, или Qa обозначает
дигалоидвинильную группу
или группу R6a-C ≡ C-, где R6a обозначает С1-4 алькильную группу, триалкилсилильную группу или водород; Q1a обозначает 1,
2-циклопропильное ядро,
возможно содержащее в качестве заместителей одну или несколько групп из числа нижеследующих: С1-3 алкильная группа, галоген или С1-3 галоидалкильная
группа; R2a, R3a, R4a и R5a обозначают одинаковые или разные группы, причем как минимум одна из них представляет собой водород, а остальные независимо друг
от друга выбираются из числа
нижеследующих групп: водород, галоген, С1-4 алкильная группа, или С1-4 галоидалкисльная группа; Хa обозначает атом кислорода или серы;
R1a выбирается из
водорода и С1-6 углеводородной группы, возможно содержащей в качестве заместителей диоксаланильную группу, галоген, цианогруппу, трифторметильную группу,
трифторметилтиогруппу или С1-6 алкоксигруппу.
Когда Qа содержит ароматическую систему, подходящие заместители включают одну или несколько групп, выбранных из числа нижеследующих: галоген, цианогруппа, нитрогруппа, С1-6 алкильная группа, С1-6 алкоксигруппа и метилендиоксигруппа, каждая из которых возможно содержит в качестве заместителей 1 5 атомов галогена, или заместителем является группа S(O)nR7a, где n 0, 1 или 2 и R7a представляет собой С1-6 алкильную группу, возможно замещенную галогеном, или R7a представляет собой аминогруппу.
Предпочтительно Qa представляет собой фенил или нафтил.
Обычно R2a, R3a, R4a и R5a выбираются из водорода, метильной группы или фтора.
Обычно R1a представляет собой С1-6 алкальную группу, возможно, замещенную диоксаланильной группой, или R1a представляет собой С2-5 алкенильную группу. Наиболее подходящей группой R1a является алкильная группа С4-6 с разветвленной цепью, такая как, например, изобутил, 1,2-диметилпропил, 1,1,2-триметилпропил, 2,2-диметилпропил, или R1a представляет собой 2-метилпропенил-2 или (2-метил-1, 3-диоксаланил-2)-метил. Предпочтительно R1a представляет собой изобутил или 2-метилпропенил-2, когда R2a и R3a представляют собой водород, а R4a представляет собой метильную группу.
Одна
предпочтительная группа соединений, отвечающих формуле (II), включает соединения общей формулы (III):
QaQ1aCH
CHCR4a CHCONHR1a (III)
где
Qa, Q1a, R4a и R1a обозначают то же, что и выше.
Одна предпочтительная группа
заявляемых соединений включает соединения общей формулы IV:
Q Q1CH CR3CR4 CR5CXNHR1 (IV)
где Q, Q1 и R1
-R5 обозначают то же, что и выше.
Предпочтительные соединения, отвечающие формулу (IV), включают соединения, в которых Q представляет собой замещенную фенильную группу, Q1 представляет собой транс-1,2-циклопропильное ядро, в котором положение 2 является незамещенным или замещено фтором или хлором, R4 представляет собой метильную группу или водород, R2 представляет собой водород, R3 и R5 представляют собой водород или фтор, и R1 представляет собой изобутильную группу, или 1,2-диметилпропильную группу, или 2-метилпропил-2-енильную группу, и Х представляет собой атом кислорода или серы.
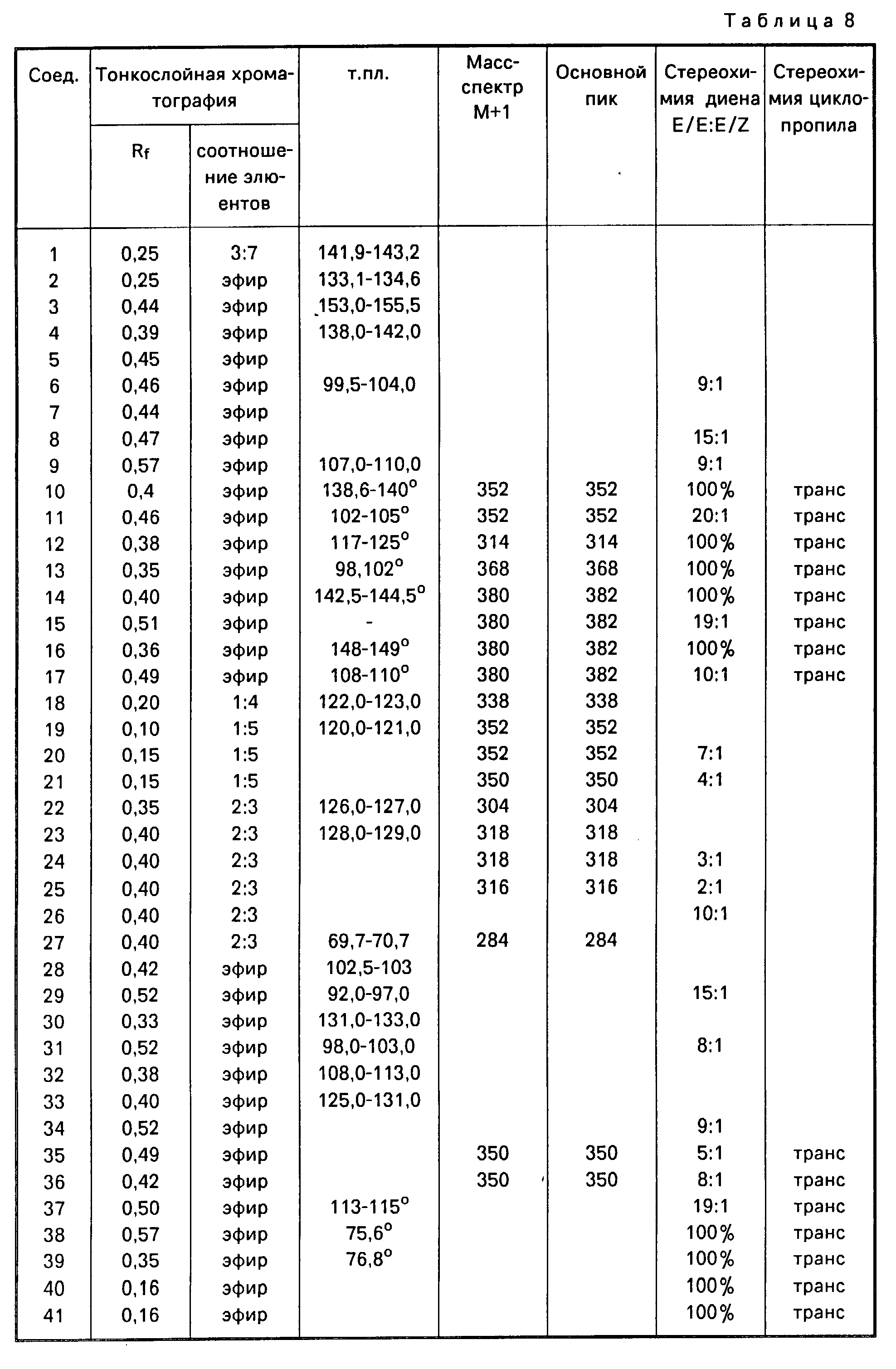
Предпочтительные соединения, отвечающие формуле (I), приведены в конце текста.
Под термином "галоген" подразумеваются фтор, хлор, бром и йод.
Под термином "углеводородная группа" подразумеваются алкильная, алкенильная, алкинильная, аралкильная группы, включая циклоалкильную или алкенильную группу, возможно содержащую в качестве заместителей алкильную, алкенильную или алкинильную группу; алкильная или алкенильная группа, содержащая в качестве заместителей циклоалкильную или алкенильную группу; фенильная группа.
Соли предлагаемых соединений, как правило, представляют собой соли, образующиеся при добавлении кислоты. Такие соли могут образовываться с участием минеральных, или органических или циклоалкильных кислот. Предпочтительные соли включают соли, образующиеся с участием соляной, серной, бромистоводородной, лимонной, азотной, тартроновой, фосфорной, молочной, бензойной, глютаминовой, аспарагиновой, пировиноградной, уксусной, янтарной, фумаровой, малеиновой, щавелевоуксусной, оксинафтойной, изэтионовой, стеариновой, метансульфоновой, этансульфоновой, бензолсульфоновой, п-толуолсульфоновой, лектобионовой, глюкуроновой, роданистоводородной, пропионовой, эмбоновой, нафтионовой и перхлорной кислот.
Соединения, отвечающие формуле (I), могут существовать в различных стереоизомерных формах. Настоящее изобретение включает в себя как индивидуальные геометрические и стереоизомеры, так и их смеси. Изобретение также включает в себя соединения, отвечающие формуле (I), которые содержат радиоактивные изотопы, особенно такие, в которых от одного до трех атомов водорода заменены на атомы трития или один или несколько атомов углерода заменены на атомы изотопов14C.
Способ получения описанного выше соединения, отвечающего формуле (I), включает в себя (см.
схему 1):
a) когда Х представляет собой кислород, реакцию
соответствующей кислоты или производного кислоты QQ1CR2=CR3CR4=CR5C(=X)1 с амином H2NR1, где Q, Q1,
R2, R3, R4, R5 и R1 обозначают то же, что и выше Х представляет собой
кислород, Z1 обозначает гидроксильную группу, галоген, С1-6 алкоксигруппу или фосфоримидный сложный эфир (-Р(O)(O-арил)NH-арил, где арил представляет собой С6-10
арильную группу;
б) образование по реакции Виттига фрагмента СR2=CR3CR4=CR5C(=X)NHR1 и затем, возможно, превращение одного соединения,
отвечающего формуле (I), в другое соединение, отвечающее формуле (I),
способами, которые хорошо известны специалистам в данной области техники.
Способ (а), как правило, осуществляют при умеренных температурах, например, при (-25) 150oC в безводном апротонном растворителе, таком как, например, простой эфир, дихлорметан, толуол или бензол. Конкретные условия зависят от природы группы Z1, например, когда Z1 представляет собой алкоксигруппу, реакция хорошо протекает при повышенных температурах, например, 50 125oC и при нагревании с обратным холодильником, предпочтительно в присутствии триалкилалюминия, например, триметилалюминия, образующего комплекс с амином H2NR1. Когда Z1 представляет собой галоген или фосфоримидат, реакция хорошо протекает при 0 30oC, обычно при комнатной температуре, предпочтительно в присутствии третичного амина, например, триэтиламина.
Если производное кислоты представляет собой галоидангидрид, например, хлорангидрид, оно может быть получено из соответствующей кислоты взаимодействием с подходящим реагентом, например, с оксалилхлоридом или с тионилхлоридом. Когда Z1 представляет собой фосфоримидную группу, последнюю обычно получают из (РhO) P(_→O)NHPhCl, где Ph фенильная группа. Кислоту или кислотную функцию в соединении QQ1CR2=CR3CR4=CR5COZ1 можно получить гидролизом соответствующего сложного эфира.
Сложные эфиры можно получить следующими альтернативными способами (см. схему 2).
(i) Стандартная реакция Виттига или Вадсдорфа-Эммонса, с использованием, например, альдегида и этоксикарбонилметилентрифенилфосфорана, или аниона из триэтилфосфонкротоната или 3-метилтриэтилфосфонкротоната. Эта последняя реакция может привести к образованию смеси изомеров, например, смеси замещенных диеноатов конфигураций


где Z2 обозначает (арил)3P, (арил)2P(O) или (С1-4 алкокси)2P(O), арил предпочтительно представляет собой фенильную группу, алкокси предпочтительно представляет собой этоксигруппу.
(1) N-бромсукцинимид,
(2)
например, (ЕtO)3P или (Рh)3P,
(3) эту реакцию, как правило, проводят в присутствии
основания, например, диизопропиламида лития, бутиллития, алкоксида натрия или гидрида
натрия.
(ii) Перегруппировка и элюминирование HS(_→O)Z3 из соединения,
общей формулы

где Q, Q1, R2, R3 и R4 обозначают то же, что и выше, Z3 обозначает любую подходящую группу, например, фенильную группу, замещенную фенильную группу, например, 4-хлорфенильную группу, или С1-4 алкильную группу, например, метильную группу, обозначает С1-4 алкильную группу, например, метильную или этильную группу.
Вышеуказанное соединение можно получить реакцией между соединением QQ1CHR2CHR3CR4O и соединением Z3S(O)CH2CO2Z4.
(iii) Элюирование из соединения QQ1 CHR2CR3(OZ5)CR4 CR5 CO2Z4, где Q, Q1, R2, R3, R4, R5 и Z4 обозначают то же, что и выше, а Z5 обозначает водород или С1-4 ацильную группу, например, ацетильную группу. Реакцию предпочтительно проводят в среде ароматического растворителя, лучше в присутствии молибденового катализатора и основания, например, бис-триметилсилилацетамида.
Вышеуказанное соединение можно получить реакцией подходящего альдегида с подходящим сульфенильным соединением с последующим ацилированием.
(iv) Реакция соединения, изображаемого формулой QQ1CR2 CR3C(=O)R4, с соединением, изображаемым формулой Ме3SiCHR5CO2Z4, где Q, R2-R5, Q1 и Z4 обозначают то же, что и выше.
Эту реакцию можно проводить в безводном растворителе, например, в тетрагидрофуране, в отсутствие кислорода, в присутствии основания, например, циклогексилизопропиламида лития, (v) реакция соединения формулы QQ1CR2 CR3C(OZ6 ) CR5CO2Z4 с соединением формулы R4M1, где Q, Q1, R2, R3, R4, R5 и Z4 обозначают то же, что и выше, Z6 обозначает подходящую группу, например, диалкилфосфатную или трифторметансульфонатную группу, а М1 обозначает металл, например, медь (I) или медь (I), связанная с литием или магнием.
Эту реакцию можно проводить при низкой температуре в среде безводного простого эфира, например, диэтилового эфира, диметилсульфида или тетрагидрофурана, в отсутствие кислорода.
(vi) Реакция соединения, изображаемого формулой QQ1CR2 CR3 M2, с соединением, изображаемым формулой YCR4 CR5CO2Z4, где Q, Q1, R2, R3, R4, R5 и Z4 обозначают то же, что и выше, обозначает галоген или олово и М2 обозначает силильную группу или группу, содержащую металл, например, триметилсилильную группу или группу, содержащую цирконий, олово, алюминий или цинк, например, бис-(циклопентадиенил)цирконийхлоридную группу. Эту реакцию, как правило, проводят при умеренных температурах, т.е. при 0 100oC, лучше при комнатной температуре, в безводном растворителе типа простого эфира, например, в тетрагидрофуране, в присутствии катализатора, содержащего палладий (0) (например, бис(трифенилфосфин)палладий), в инертной атмосфере азота или аргона.
(vii) Элюминированием Z3S (->0) из соединения, общей формулы

где Q, Q1, R2, R3, R4, R5, Z3 и Z4 обозначают то же, что и выше. Вышеуказанное соединение можно получить реакцией соединения QQ1CHR2CR3 CHR4 c Z3S(O)CH2CO2Z4.
Способ (б) можно
осуществлять при наличии
альдегидной или кетогруппы, связанной с амидным/тиоамидным концом или с фрагментом QQ1 формулы (I), проводя реакцию с соответствующим илидом фосфора
например,
QQ1(CR2=CR3)COR4 + Z2CHR5C(=X)NHR1 или
QQ1COR2 + Z2CHR3CR4 CR5C(=X)NHR1 или
QQ1(CR2=CR3)CHR5Z2 + R5COC(=C)NHR1
где Q,
Q1, R2,
R3, R4, R5, R1, X и Z2 обозначают то же, что и выше.
Способ (б) осуществляют в безводном инертном растворителе, например, в простом эфире, таком как, например, тетрагидрофуран, возможно в присутствии основания, например, изопропиламина, предпочтительно в отсутствие кислорода, например, в атмосфере азота, при низкой температуре (от -60 до 20oC). Илид фосфора можно получить из его предшественника так, как это описано выше, реакцией с основанием, например, с диизопропиламидом лития, бутиллитием, алкоксидом натрия или гидридом натрия. Соединения, отвечающие формуле (I), в которой Х представляет собой атом серы, предпочтительно получают способом (б), когда Z2 представляет собой группу (С1-4алкокси)2P=O.
Альдегидные интермедиаты QQ1CR2= O можно получить кислотным гидролизом кеталей, енольных простых эфиров или ацеталей в растворителе, таком как, например, смесь ацетон-вода, или окислением соответствующих спиртов, используя, например, пиридинхлорхромат, пиридиндихромат или оксалилхлорид-диметилсульфоксид в растворителе, например, в дихлорметане. Альдегиды можно также получить восстановлением соответствующих нитрилов таким реагентом, как, например, диизобутилалюминийгидрид, в гексане.
Спирты (схема 3) можно получить следующими способами.
а) Реакция QCH-CX2OH c (Z7)2M2 и CH2X23, где X2 обозначает водород, фтор, хлор, или метильную группу, X3 обозначает галоген, например, йод, Z7 обозначает С1-4 алькильную группу, например, этильную группу, и М2 обозначает металл, например, этильную группу, и М2 обозначает металл, например, цинк, в инертном растворителе, таком как, например, гексан или дихлорметан, при умеренной температуре (от -20 до +20oC), и СH2 и CH=CX2 соединяются, давая Q1.
(б) Реакция QCH=CX2CH2OH c CX24X5CO2M3, где X4 и X5 обозначают галогены, например, фтор и хлор, и М3 обозначает щелочной металл, например, натрий, в инертном растворителе, например, диглиме, при умеренных/повышенных температурах (150 200oC), и CX24 и CH=CX2 соединяются, давая Q1.
Промежуточные спирты можно получить восстановлением сложных эфиров QCH= CX2CO2Z4, например, диизобутилалюминийгидридом в инертном растворителе, например, в дихлорметане или в тетрагидрофуране, при смеренной температуре (от -20 до 25oC).
в) Восстановление сложного эфира QQ1CO2 Z4 или соответствующей карбоновой кислоты, например, диизобутилалюминийгидридом или дибораном в инертном растворителе, например, в дихлорметане или в тетрагидрофуране, при умеренной температуре (от -20 до 25oC). Эфиры можно получить реакцией диазоацетата N2CHCO2Z4 с соединением QCH=CH2 в присутствии медьсодержащего катализатора, например, сульфата меди; в этом случае СН и СН=СН2 соединяются, давая Q1. Эфиры можно также получить реакцией ОСН=СНСО2Z4 с анионом, полученным из МеrS(O)mC(Z7)2, где r обозначает водород или С1-6 алкильную группу, и m 1 или 2.
Прилагаемые схемы реакцией помогают проиллюстрировать получением интермедиатов и их превращение в соединения, отвечающие формуле (I). Предлагаемые интермедиаты составляют следующую отличительную особенность изобретения; они могут быть получены, если это желательно, стандартными способами, отличающимися от описанных в изобретении.
Соединения, отвечающие формуле (I), можно использовать для борьбы с вредителями, такими как членистоногие, например, насекомые-вредители и клещи-паразиты, и паразитические черви, например, нематоды.
Таким образом, изобретение предлагает способ борьбы с членистоногими и/или паразитическими червями, который включает в себя воздействие на членистоногое и/или на паразитического червя, или на их окружение, соединения, отвечающего формуле (I), в количестве, обеспечивающем эффективность воздействия.
Изобретение предлагает также способ борьбы и/или ликвидации вызванных членистоногими и/или паразитическими червями инвазий животных (включая людей) и/или растений (включая деревья) и/или хранящихся продуктов, который включает в себя воздействие на животное или очаг заражения эффективного количества соединения, отвечающего формуле (I).
Далее, изобретение предлагает соединения, отвечающие формуле (I), для использования в медицине и ветеринарии, в народном здравоохранении и в сельском хозяйстве для борьбы с членистоногими-вредителями и/или с паразитическими червями.
Соединения, отвечающие формуле (I), представляют особую ценность для защиты полевых культур, кормовых растений, плантационных культур, тепличных культур, плодовых деревьев и виноградников, декоративных растений и плантационных и лесных деревьев, например, зерновых (таких как, например, кукуруза, пшеница, рис, сорго, хлопка, табака, овощей и овощных культур салатного назначения таких как, например, бобы, капуста, салат латук, лук репчатый, помидоры и перец), полевых культур (таких как, например, картофель, сахарная свекла, арахис, соя, масличные семена рапса), сахарного тростника, пастбищ и кормовых культур (таких как, например, кукуруза, сорго, люцерна), плантационных культур (таких как, например, чай, кофе, какао, бананы, масличная пальма, кокосы, каучуконосы, пряности), плодовых деревьев и садов (например, костянки, односемянки, цитрусовых, киви, авокадо, манго, маслин и орехов), виноградников, декоративных растений, цветов и кустарников в оранжереях и в садах и парках, лесных деревьев (как лиственных, так и вечнозеленых) в лесах, на плантациях и в питомниках.
Эти соединения представляют также ценность для защиты лесоматериалов (растущих, срубленных, переработанных, хранящихся или оструктуренных) от нападения пилильщиков (например, Urourus) или жуков (например, жуков-короедов, платинодидов, ликтидов, бострицидов, жуков-дровосеков, анобиидов).
Другой областью их применения является защита хранящихся продуктов, таких как, например, зерно, фрукты, орехи, пряности и табак, в цельном и размолотом виде и в виде составных продуктов, от нападения моли, жуков и клещей. Они защищают также хранящиеся продукты животного происхождения, такие как, например, шкуры, волосы, шерсть и перья в натуральном или переработанном виде (например, ковровые или текстильные изделия) от нападения моли и жуков; а также хранящиеся мясо и рыбу от нападения жуков, клещей и мух.
Соединения, отвечающие общей формуле (I), представляют особую ценность для борьбы с членистоногими или паразитическими червями, которые являются вредными для человека и домашних животных, или размножаются в них, или действуют как переносчики заболеваний человека и домашних животных, названными выше, более конкретно, для борьбы с клещами, вшами, блохами, мелкими двукрылыми насекомыми, кусающимися насекомыми и мухами.
Соединения, отвечающие формуле (I), можно использовать для этих целей, применяя их или самих по себе, или в разбавленном виде, в форме дезинфицирующего раствора, разбрызгиваемого раствора, тумана, лака, пены, пылевого препарата, порошка, водной суспензии, пасты, геля, крема, шампуня, жира, горючего твердого вещества, парообразующего мата, горючей спирали, отравленной приманки, кормовой добавки, смачивающегося порошка, гранул, аэрозоля, эмульгируемого концентрата, масляных суспензий, масляных растворов, упаковок под давлением, пропитанных изделий выливаемого на поверхность препарата или в других стандартных формах, хорошо известных специалистам в данной области. Концентрированные дезинфицирующие растворы не применяют per se, но разбавляют водой и погружают животных в дезинфицирующую ванну, содержащую дезинфицирующий промывочный раствор. Разбрызгиваемые растворы можно применять вручную или с помощью распыления из опрыскивателя или дуговой штанги опрыскивателя. Обрабатываемые животное, почву, растение или поверхность можно насытить разбрызгиваемым раствором, применяя большие объемы, или покрыть их поверхности разбрызгиваемым раствором, применяя малые или сверхмалые объемы. Водные суспензии можно применять так же, как разбрызгиваемые растворы или дезинфицирующие растворы. Пылевидные препараты можно распространять с помощью машины для внесения порошкообразных препаратов или, в случае обработки животных, помещать в перфорированные мешки, прикрепленные к деревьям. Пасты, шампуни и жировые препараты можно применять мануально или распределять по поверхности инертного материала, такого, об который животные трутся и переносят таким образом препарат себе на шкуры. Выливаемые на поверхность препараты распределяют в виде порции жидкости небольшого таким образом, чтобы вся жидкость или большая ее часть осталась на животном.
Соединения, отвечающие формуле (I), можно приготовить или в виде, готовом для непосредственного применения для животных, растений или поверхностей, или в виде, требующем разбавления перед употреблением, но обе формы содержать соединение, отвечающее формуле (I), в смеси с одним или несколькими носителями или разбавителями. Носители могут быть жидкими, твердыми или газообразными, или содержать смеси таких веществ, а соединение формулы (I) может присутствовать в концентрации 0,025 99 мас./об. в зависимости от того, требует ли данная форма дальнейшего разбавления, или нет.
Пылевидные препараты, порошкообразные препараты и гранулированные препараты, а также другие твердые формы, содержащие соединение формулы (I) в смеси с порошкообразным твердым инертным носителем, например, с подходящими глинами, каолином, бентонитом, аттапульгитом, активированным углем, тальком, слюдой, мелом, гипсом, трикальцийфосфатом, порошкообразной пробкой, силикатом магния, носителями растительного происхождения, крахмалом и диатомитовыми почвами. Такие твердые формы, как правило, готовят пропиткой твердых разбавителей растворами соединения формулы (I) в летучих растворителях, выпариванием растворителя и, если желательно, размалыванием полученных продуктов с получением порошка, или если желательно, гранулированием, прессованием или капсулированием продуктов.
Разбрызгиваемые растворы, содержащие соединение формулы (I), могут включать в себя раствор в органическом растворителе (например, в нижеперечисленных растворителях), или эмульсию в воде (дезинфицирующий моющий раствор или разбрызгиваемый моющий раствор), приготовляемую на месте использования из эмульгируемого концентрата (известного также под названием смешивающегося с водой масла), который можно также использовать для дезинфекции. Концентрат предпочтительно содержит смесь активного ингредиента с органическим растворителем (или органический растворитель отсутствует), и один или несколько эмульгаторов. Количество растворителя, присутствующего в смеси, может меняться в широких пределах, но предпочтительно составляет 0 90 мас. объемных композиций; растворитель может быть выбран из числа нижеследующих: керомин, кетоны, спирты, ксилол, ароматические углеводороды и другие растворители, известные в данной области техники. Концентрация эмульгаторов может меняться в широких пределах, но предпочтительно составляет 5 25 мас. объемных, и эмульгаторы обычно представляют собой неионные поверхностно-активные вещества, включая полиоксиалкиленовые сложные эфиры или алкилфенолы и полиоксиэтиленовые производные гекситоловых ангидридов, и анионные поверхностно-активные вещества, включая лаурилсульфат натрия, сульфаты простые эфиров жирных спиртов, натриевые и кальциевые соли алкиларилсульфонатов и алкилсульфосукцинатов. Катионные эмульгаторы включают бензальконийхлорид и четвертичные аммонийные этосульфаты.
Амфотерные эмульгаторы включают карбоксиметилированный имидоазолинолеат и алкилдиметилбетаин.
Парообразующие маты, как правило, представляют собой смесь хлопка и целлюлозы, спрессованные в щитки размером приблизительно 35х22х3 мм, обработанные концентратом (до 0,3 мл), содержащим активный ингредиент в органическом растворителе, и возможно антиоксидант, краситель и ароматический компонент. Инсектицид испаряют, используя источник тепла, например, электрический нагреватель матов.
Горючие твердые вещества, как правило, содержат порошок древесины и связывающего вещества, смешанные с активным ингредиентом и сформированы в виде полосок (обычно спиралевидных). Могут быть также добавлены краситель и фунгицид.
Смачивающиеся порошки содержат инертный твердый носитель, один или несколько поверхностно-активных агентов, и возможно стабилизаторы и/или антиоксиданты.
Эмульгируемые концентраты содержат эмульгирующие агенты, и часто органический растворитель, такой как, например, керосин кетоны, спирты, ксилолы, ароматические углеводороды, и другие растворители, известные в данной области техники.
Смачивающиеся порошки и эмульгируемые концентраты, как правило, содержат 5 95 мас. активного ингредиента, и разбавляются, например, водой, перед использованием.
Лаки содержат раствор активного ингредиента в органическом растворителе вместе со смолой, и возможно пластификатор.
Дезинфицирующие моющие растворы можно приготовить не только из эмульгируемых концентратов, но также из смачивающихся порошков, мыльных дезинфицирующих растворов и водных суспензий, содержащих соединение формулы (I) в смеси с диспергирующим агентом и одним или несколькими поверхностно-активными агентами.
Водные суспензии соединения формулы (I) могут содержать суспензию в воде вместе с суспендирующим, стабилизирующим или каким-либо другим агентом. Суспензии или растворы можно применять per se или в разбавленном виде известным способом.
Жировые препараты (или мазы) можно приготовить из растительных масел, синтетических сложных эфиров жирных кислот или из шеpстянного жира с инертной основой, такой как, например, мягкий парафин. Соединение формулы (I) предпочтительно равномерно распределяют в растворе или суспензии. Жировые препараты можно также приготовить из эмульгируемых концентратов, разбавляя их мазевой основой.
Пасты и шампуни также представляют собой полужидкие препараты, в которых соединение формулы (I) может находиться в виде однородной дисперсии в подходящей основе, такой как, например, мягкий или жидкий парафин, или изготовлены на нежировой основе с глицерином, растительным клеем или подходящим мылом. Как и жировые препараты, шампуни и пасты обычно применяют без дальнейшего разбавления, и поэтому они должны содержать соответствующий процент соединения формулы (I), требуемый для обработки.
Аэрозольные разбрызгиваемые растворы можно приготовить в виде простого раствора активного ингредиента в аэрозольном процелланте и сорастворителе, таких как, например, галоидалкилы и вышеуказанные растворители, соответственно. Выливаемые на поверхность препараты (I) в жидкой среде. Птицу-хозяина или млекопитающее-хозяина можно также защитить от инвазии клещевыми эктопаразитами с помощью ношения ими соответствующим образом профилированных пластмассовых изделий, пропитанных соединением формулы (I). Такие изделия включают пропитанные хомуты, бирки, повязки, пластинки и ленты, закрепленные на соответствующих участках тела. Подходящим материалом для этих изделий является поливинилхлорид (ПВХ).
Концентрация соединения формулы (I), применяемая к животному, недвижимости или к участкам, находящимся на открытым воздухе, меняется в зависимости от выбранного соединения, интервала между обработки, природы препарата (его вида) и предполагаемой инвазии, но, как правило, 0,001 20,0 мас. об. и предпочтительно 0,01 10 соединения должно присутствовать в применяемом препарате. Количество соединения, наносимое на животное, меняется в зависимости от способа применения, размера животного, концентрации соединения в применяемом препарате, способа разбавления препарата и вида препарата, но, как правило, составляет 0,0001 0,5 по весу, исключая неразбавленные препараты, например, вливаемые на поверхность, которые, как правило, наносятся в концентрации 0,1 20 предпочтительно 0,1 10 Количество соединения, применяемого для хранящихся продуктов, как правило, составляет 0,1 20 рр. Разбрызгиваемые в пространстве растворы можно применять так, чтобы создать среднюю начальную концентрацию соединения формулы (I) 0,001 1 мг/м3 обрабатываемого пространства.
Соединения формулы (I) используются также для защиты и обработки растений; в этом случае применяют такое количество активного ингредиента, которое эффективно по отношению к насекомым, клещевым паразитам и нематодам. Интенсивность применения меняется в зависимости от выбранного соединения, вида препарата, способа применения, вида растения, плотности посадки растения и вероятного заражения, а также от других подобных факторов, но, как правило, обычная норма для сельскохозяйственных культур составляет 0,001 3 кг/га, предпочтительно 0,01 1 кг/га. Обычно применяемые в сельском хозяйстве препараты содержат 0, 001 50 соединения формулы (I), обычно 0,1 15 по весу соединения формулы (I).
Пылевидные, жировые, пастообразные и аэрозольные препараты обычно применяют произвольным способом, как это описано выше, и в применяемом препарате может содержаться 0,001 20 мас./об. соединения формулы (I).
Найдено, что соединения формулы (I) обладают активностью по отношению к обыкновенной мухе комнатной (Musca domestica). Кроме того, определенные соединения формулы (I) обладают активностью по отношению к другим членистоногим-вредителям, включая Myzus persicae, Tetranychus urticae, Plutella xylostella, Culex spp. Tribolium castaneum, Sitophilus granaris, Periplaneta americana и Blattella germanica.
Соединения формулы (I), таким образом, полезны при борьбе с членистоногими, например, с насекомыми и клещами, в любой области, где они являются вредителями, например, в сельском хозяйстве, в животноводстве, в народном здравоохранении и в быту.
Насекомые-вредители включают представителей отрядов Coleoptera (напр. Anobium, Centronychus, Rhynchophorus, Cosmopolites, Lissor hoptrus, Meligethes, Hypothenemus, Hylesinus, Acalymma, Lema, Psylliodes, Leptinotarsa, Gonocephalum, Agriotes, Dermolipida, Heteronychus, Phaedom, Tribolium, Sitophilus, Diabrotica, Authanonus или Authrenus spp.), Lepidoptera (напр. Ephestia, Mamestra, Earies, Pectinophora, Ostrinia, Trichoplusia, Pieris, Laphygma, Agrotis, Amathes, Wiseana, Tryporysa, Siatre, Aporganofis, Cydia, Archips, Plutella.
Chilo, Heliothis, Spodoptera или Tineala
spp.). Siptera (напр. Musca, Aedes, Anopheles, Culex, Glossina, Simulium, Stomoxys, Haemetobia, Tabanus, Lucilia, Callitroga,
dermafobia, Gasterophilus, Hypoderma, Hylemyia, Atherigona, Chlorops,
Phytomyza, Cerafifis, Ziriomyza, Melophagus spp.), Phyhiraptera (Malophaga, например, Damalina, app. и Anoplura, например,
Linognathus и Haematohinus spp.), Hemiptera (например, Aphis, Bemisia,
Phorodon, Aeneolamia, Empoasca, Parkinsiella, Pyrilla, Aonidiella, Coccus, Pseudococus, Helopeltis, Lygus, Sysdereus, Oxycarenus,
Nezaza, Aleurodes, Triatoma, Bsylla, Musus Megoura, Phylloxera,
Adelyes, Niloparvata, Nephrotetix, cimex spp.),
Orthoptera (например, Locusta, Gryllus, Schistocerca или Acgeta spp.),
Dictyoptera (например, Athalia, Cephus, Atta, Solenopsis или Monomorium
spp. ), Isoptera (например, Odontotermes и Reticulitermes spp.), Siphonatera (например, Glenocephalides или Pulex spp.),
Thysanura (например, Lepisma spp.), Dermaptera (например, Forficula spp.),
Pseoptera (например, Peripsocus spp.) и Thysanoptera (например, Thrips tabaci).
Клещевые паразиты включают клещей, например, представителей семейств Boophilus, Ornithodorus, Rhipicephalus, Albyomma, Hyalomma, Sxodex, Haemaphysalis, Dermacentor, Anocentor и клещей и возбудителей чесотки, таких как, например, Acarus, Tetranychus, Psojroptes, Nofoedus, Sacroptes, Psorergates, Chorioptes, Eutrombieula, Demodex, Panonychus, Beyobia, Eriophyes, Blaniulus, Polyphagotarsonemus, Seutigerella, oniscus spp.
Нематоды, нападающие на растения и деревья, представляющие ценность с точки зрения сельского хозяйства, лесоводства, садоводства, или непосредственно, или путем распространения бактериальных, вирусных, микроплазматических или грибковых заболеваний растений, включают яванские галловые нематоды, например, Meloidogyne spp. (например, М. incognita); свекловичные нематоды, например, Globodera spp. (например, G. rostochiensis); Heterodera spp. (например, hydrogen aveance); Radopholus spp. (например, R. similis); нематоды, например, Pratylenchus spp. (например, P. ptatensis); Belonolaimus spp. (например, В. gracilis); Tylenchulus spp. (например, I. semipenetrans); Rotylenchulus spp. (например, R. reinformis); Rotylenchus spp. (например, R. robustrus); Helicotylenchus spp. (например, hydrogen multiciuctus); Hemicycliophora spp. (например, hydrogen gracilis); Griconemoides spp. (например, С. similis); Trichoderus spp. (например, Т. рrimitivus), нематоды, например, Xiphenema spp. (например, Х. diversicaudatum), Zongidorus spp. (например, L. elongatus); Hoplolaimus spp. (например, hydrogen coronatus); Aphelenehoides spp. (например, A. ritzemabosi, A. besseyi); Ditylenchus spp. (например, D. dipsaei), стеблевые нематоды.
Предлагаемые соединения можно сочетать с одним или несколькими другими ингредиентами, обладающими пестицидной активностью (например, пиретроидами, карбаматами и органофосфатами) и/или с аттрактантами, репеллентами, бактериоцидами, фунгицидами, нематоцидами, гельминтоцидами и им подобными. Найдено, что активность предлагаемых соединений можно увеличить добавлением синергиста или потенцирующего средства, например, одного из синергистов класса ингибиторов оксидаз, такого как, например, пинеронилбутоксид или пропил-2-проинилфенилфосфонат; второго предлагаемого соединения; или перитроидного пестицидного соединения. Когда в формуле изобретения присутствует синергист ингибитор оксидазы, отношение синергиста к соединению формулы (I) лежит в интервале от 25:1 до 1:25, например около 10:1.
Стабилизаторы для предотвращения какого-либо разрушения, которому могут подвергаться предлагаемые соединения, включают, например, антиоксиданты (такие как, например, токоферолы, бутилоксианизол и бутилокситолуол) и перехватчики (например, эпихлоргидрин) и органические или неорганические основание, например, триалкиламины, например, триэтиламин, которые могут действовать как основные стабилизаторы и перехватчики.
Предлагаемые соединения проявляют пестицидную активность. Нижеследующие примеры иллюстрируют предпочтительные варианты изобретения, не ограничивая его объема.
Препараты
1. Эмульгируемый концентрат
Соединение формулы (I) 10,00
Алкилфенолэтоксилатx 7,50
Алкиларилсульфонатx 2,50
Ароматический растворитель С8-13 80,00
Итого 100,
0
2. Эмульгируемый концентрат
Соединение формулы (I) 10,00
Алкилфенолэтоксилатx 2,50
Алкиларилсульфонатx 2,50
Растворитель класса
кетонов 64,00
Ароматический растворитель С8-13 18,00
Антиоксидант 3,00
Итого 100,0
3. Смачиваемый порошок
Соединение формулы (I) 5,00
Ароматический растворитель С8-13 7,00
Ароматический
растворитель С18 28,00
Китайская глина 10,00
Алкиларилсульфонатx 1,00
Нафталинсульфоновая кислотаx 3,00
Диатомитовая почва 46,00
Итого 100,0
4. Пылевидный препарат
Соединение формулы (I) 0,50
Тальк 99,50
Итого 100,0
5. Приманка
Соединение формулы (I) 0,5
Сахар
79,5
Парафиновый воск 20,0
Итого 100,0
6. Эмульсионный концентрат
Соединение
формулы (I) 5,0
Ароматический растворитель C8-13 32,00
Цетиловый спирт 3,00
Моноолеат полиоксиэтиленглицеринаx 0,75
Полиоксиэтиленсорбитные
сложные эфирыx 0,25
Силиконовый раствор 0,1
Вода 58,9
Итого 100,0
7. Суспензионный концентрат
Соединение формулы (I) 10,00
Алкиларилэтоксилатx 3,00
Силиконовый раствор 0,1
Алкандиол 5,0
Дымчатый кварц 0,50
Ксантановая смола 0,20
Вода 80,0
Буферный агент 1,
2
Итого 100,0
8. Микроэмульсия
Соединение формулы (I) 10,0
Моноолеат полиоксиэтиленглицеринаx 10,00
Алкандиол 4,00
Вода 76,00
Итого 100,0
9. Диспергируемые в воде гранулы
Соединение формулы (I) 70,00
Поливинилпирролидин 2,50
Алкиларилэтоксилат 1,25
Алкиларилсульфонат 1,25
Китайская клина 25,00
Итого 100,0
10. Гранулы
Соединение формулы
(I) 2,00
Алкилфенолэтоксилатx 5,00
Алкиларилсульфонатx 3,00
Ароматический растворитель С8-13 20,00
Гранулы из кизельгура 70,00
Итого 100,00
11. Аэрозоль (упаковка под давлением)
Соединение формулы (I) 0,3
Пиперонилбутоксид 1,5
Насыщенный углеводородный растворитель С8-13 58,
2
Бутан 40,0
Итого 100,0
12. Аэрозоль (упаковка под давлением)
Соединение формулы (I) 0,3
Насыщенный углеводородный растворитель С8-13 10,0
Моноолеат сорбитаx 1,0
Вода 40,0
Бутан 48,7
Итого 100,
00
13. Аэрозоль (упаковка под давлением)
Соединение формулы (I) 1,00
CO2 3,00
Моноолеат полиоксиэтиленглицеринаx 1,40
Пропанон 38,
00
Вода 56,60
Итого 100,00
14. Лак
Соединение формулы (I) 2,50
Смола 5,00
Антиоксидант 0,50
Высокоароматический уайт-спирит 92,00
Итого 100,00
15. Разбрызгиваемый раствор (готовый к употреблению)
Соединение формулы
(I) 0,10
Антиоксидант 0,10
Керосин без запаха 99,8
Итого 100,
00
16. Разбрызгиваемый раствор, содержащий потенцирующее средство (готовый к употреблению)
Соединение формулы (I) 0,10
Пиперонилбутоксид 0,50
Антиоксидант 0,10
Керосин без запаха 99,30
Итого 100,00
17. Микрокапсулированный
Соединение
формулы (I) 10,0
Ароматический растворитель С8-13 10,0
Ароматический диизоцианат 4,5
Алкилфенолэтоксилатx 6,0
Алкилдиамин 1,0
Диэтилентриамин 1,0
Концентрированная соляная кислота 2,2
Ксантамовая
смола 0,2
Дымчатый кварц 0,5
Вода 64,6
Итого 100,00
x поверхностно-активное
вещество
реагирует с образованием полимочевинных стенок микрокапсулы.
Антиоксидант может представлять собой любое из нижеперечисленных соединений или их сочетание:
бутилированный окситолуол,
бутилированный оксианизол,
витамин С
(аскорбиновая кислота).
Общие синтетические способы и методики
Разнообразные соединения были
синтезированы и охарактеризованы в соответствии с нижеследующими
экспериментальными методиками.
1Н ЯМР-спектры были получены на спектрометре Bruker АМ-250 для растворов в дейтерохлороформе с использованием тетраметилсилана в качестве внутреннего стандарта; результаты приведены в виде ppm от количества ТМС, числа протонов, числа пиков, константы спин-спинового взаимодействия J, Гц.
За протеканием реакции удобно также следить с помощью алюминиевых пластинок, предварительно покрытых слоями силикагеля толщиной 0,25 мм, содержащими флюоресцентный индикатор, проявляемых в подходящем растворителе или в смеси растворителей. Температура всюду дана в градусах Цельсия.
Обычно обработку реакционной смеси проводили следующим образом.
Реакционную смесь разделяли между органическим растворителем и водой. Фазы отделяли друг от друга, и органическую фазу промывали как минимум эквивалентным объемом разбавленного водного раствора основания, а затем насыщенным рассолом. Затем органическую фазу сушили над осушителями, обычно над сульфатом магния, и фильтровали. Удаляли летучие растворители, и полученный продукт подвергали соответствующей очистке, после чего использовали в следующей стадии синтеза или анализировали как конечный продукт.
Исходный альдегид, коричную кислоту и амин получали от Aldrich, BDH, Fluorochem, Fluka Lancaster Synthesis исключая следующие исходные соединения, получение которых описано ниже.
a) 4-трифторметоксибензойную кислоту (5 г)
(ех Fluorochem) в этаноле (100 мл) обрабатывали
концентрированной серной кислотой (1 мл). После нескольких часов кипячения с обратным холодильником смесь концентрировали в вакууме, и остаток
обрабатывали обычным путем с получением
этил-4-трифторметоксибензоата (5 г). ЯМР1H: 8,90 2Н [дублет (д)] 7,22 (2Н, д), 4,37 [2Н, квартет, (к)] 1,40 3Н, [триплет (т)]
Вышеуказанный
сложный эфир (5 г) в дихлорметане (40
мл) в атмосфере азота при -20oC обрабатывали диизобутилалюминий гидридом (43 мл). После 18 ч при 25oC добавляли разбавленную соляную кислоту,
и смесь обрабатывали обычным путем,
получая 4-трифторметоксибензиловый спирт. ЯМР1H: 7,24 (2Н, д), 7,15 (2Н, д), 4,52 [2Н, синглет (с)] 3,37 (3Н, с).
Вышеуказанный спирт окисляли, используя условия Swerh'a (оксалилхлорид, 2,05 мл; диметилсульфоксид, 3,33 мл, триэтиламин, 14,8 мл), в дихлорметане, получая 4-трифторметоксибензальдегид (4 г). ЯМР1: 10,04 (2Н, с), 7,98 (2Н, д), 7,35 (2Н, д).
б) 4-бром-2-фтортолуол (ех Fluorochem) в ледяной уксусной кислоте (88 мл) и уксусном ангидриде (89,7 г) охлаждали до -10oC. По каплям добавляли серную кислоту (11,7 г), поддерживая температуру реакции ниже -5oC. Триоксид хрома (14,7 г) добавляли порциями при 0oC, смесь выливали в лед (300 г) и обрабатывали обычным путем, получая диацетоксиметил-2-фтор-4-бромбензол.
Вышеуказанный диацетат в этаноле (30 мл) и воде (30 мл) обрабатывали концентрированной серной кислотой (3 мл). После
нескольких часов кипячения с
обратным холодильником раствор концентрировали, и остаток обрабатывали обычным путем, получая 2-фтор-4-бромбензальдегид (4,89 г). ЯМР1H: 10,3 (1Н, с), 7,5 [3Н,
мультиплет (м)]
в)
4-бром-3-фторбензальдегид получали аналогичным путем.
г) К суспензии 4-хлор-3-трифторметиланилина (ех Fluorochem) (15,9 г) в воде (16 мл) добавляли концентрированную соляную кислоту (18 мл). Добавляли лед (30 г) и смесь охлаждали до 0oC и обрабатывали раствором нитрита натрия (5,6 г) в воде (8 мл). Через 15 мин смесь делали нейтральной по конго-рот добавлением раствора ацетата натрия (8 г) в воде (10 мл). Раствор формальдоксима, приготовленный из гидрохлорида формальдоксима (ех Lancaster) (9,9 г) и ацетата натрия (ех BDH), в воде (57 мл), при 10o C обрабатывали сульфатом меди (2 г) (ех BDH) и сульфитом натрия (0,34 г), и затем раствором ацетата натрия (55 г) в воде (60 мл). Ранее приготовленную смесь (содержащую производное анилина) добавляли по каплям при 10 15oC. После 1 ч при 15oC добавляли соляную кислоту (77 мл) и смесь обрабатывали обычным путем. Очистка дистилляцией (80o C, 0,5 мм рт.ст.) давала 4-хлор-3-трифторметилбензальдегид (1,5 г).
д) К нафтойной кислоте (50 г) (ух Aldrich) в ледяной уксусной кислоте при нагревании с обратным холодильником добавляли несколько капель брома (ех BDH), а затем йод (0,5 г) (ех BDH). В течение 1 ч по каплям добавляли бром (15 мл). Смесь охлаждали до 25oC и перемешивали при этой температуре в течение 18 ч. Образовавшийся белый осадок отфильтровывали, растворяли в горячей воде и обрабатывали концентрированной соляной кислотой. Осадок отфильтровывали и сушили над пятиокисью фосфора (ех BDH), получая 5-бром-2-нафтойную кислоту (перекристаллизация из этанола) (28 г). Температура плавления 261 262oC. ЯМР1H: (ДМСО, СDCl3), 8,60 (1Н, с), 8,00 (5Н, м), 7,40 (1Н, м).
Вышеуказанную кислоту (34 г) в этаноле (240 мл) обрабатывали концентрированной серной кислотой (0,5 мл) при нагревании с обратным холодильником в течение 6 ч. Дальнейшая обработка реакционной смеси, осуществленная обычным путем, давала этил-5-бром-2-нафтоат (23 г). Температура плавления: 52 54oC. ЯМР1H: 8,68 (1Н, с), 7,80-8,35 (4Н, м), 7,43 [1Н, двойной дублет (дд)] 4,50 (2Н, к), 1,48 (3Н, т).
Пример 1.
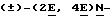
(i) 4-бромбензальдегид (9,25 г) растворяли в сухом дихлорметане (250 мл) при 25oC в атмосфере азота. Карбометоксиметилентрифенилфосфоран (17,4 г) (ех Lancaster) добавляли к раствору и полученный раствор перемешивали при 25oC в течение 18 ч. Растворитель удаляли в вакууме. Остаток промывали гексаном и отфильтровывали. После удаления гексана в вакууме получали этиловый эфир 4-бромкоричной кислоты (12,12 г). ЯМР1H: 7,35 (5Н, м), 6,38 (1Н, д), 4,1 (2Н, к), 1,35 (3Н, т).
(ii). Этиловый эфир 4-бромкоричной кислоты (12,12 г) растворяли в сухом дихлорметане (50 мл) в атмосфере азота и охлаждали до -20oC. По каплям добавляли диизобутилалюминийгидрид (100 мл 1М раствора и дихлорметане) (ех Aldrich). Раствору давали нагреться до 25oC, затем перемешивали в течение 18 ч, затем разделяли раствор между простым эфиром и разбавленной соляной кислотой. Органическую фазу промывали насыщенным раствором бикарбоната натрия, рассолом, сушили над сульфатом магния и концентрировали в вакууме, получая 3-(4-бромфенил)пропен-2-1-ол (8,9 г). ЯМР1H: 7,28 (2Н, д), 7,05 (2Н, д), 6.45 (1Н, д), 6,25 (1Н, т), 4,25 (2Н, д), 2,0 (1Н, с).
(iii) Вышеуказанный спирт (1,07 г) суспендировали в гексане (50 мл) при комнатной температуре и охлаждали до -20oC в атмосфере азота. Диэтилцинк (ех Aldrich) (22,7 мл 1,1М раствора в гексане) добавляли по каплям, затем добавляли дийодметан (ех Aldrich) (4,1 мл). Давали смеси медленно нагреться до 25oC, затем перемешивали в течение 18 ч. Добавляли насыщенный раствор хлорида аммония и экстрагировали смесь простым эфиром. Совмещенные эфирные экстракты промывали насыщенным раствором тиосульфата натрия сушили над сульфатом магния и удаляли растворители в вакууме. Хроматографическая очистка (силикагель, простой эфир/гексан) давала (±)-

(iv) Оксалилхлорид (ех Aldrich) (0,22 мл) растворяли в дихлорметане (3 мл) и охлаждали до -70oC в атмосфере азота. По каплям добавляли раствор диметилсульфоксида (ех BDH) (0,36 мл) в дихлорметане (1 мл). Через 5 мин добавляли вышеуказанный спирт (0,53 мл) в дихлорметане (4 мл) и перемешивали суспензию при -70oC в течение 30 мин. Добавляли триэтиламин (ех Aldrich) (1,6 мл) и давали смеси нагреться в течение 1 ч до 0oC. Дальнейшая обработка полученной смеси, осуществленная обычным путем, давала (±)-

(v) Раствор диизопропиламида лития в сухом тетрагидрофуране, приготовленный из н-ьутиллития (ех Aldrich) (1,6 мл) и диизопропиламина (ех Aldrich) (0,4 мл), обрабатывали при -60oC в атмосфере азота раствором триэтил-4-фосфонокротоната (0,58 г) в тетрагидрофуране. Через 2 ч при -60oC добавляли вышеуказанный альдегид (0,52 г). После 18 ч при 25oC смесь разделяли между простым эфиром и водой, и эфирную фракцию обрабатывали так, как это описано выше. Хроматографическая очистка (силикагель, простой эфир/гексан) давала (±)-этил-5-[

(vi) Вышеуказанный сложный эфир (0,18 г) в сухом толуоле добавляли при -10oC к комплексу, приготовленному из триметилалюминия (ех Aldrich) (0,62 мл 2М раствора в толуоле) и 1,2-диметилпропиламина (ех Aldrich) (0,55 г в сухом толуоле). Полученную смесь нагревали с обратным холодильником в течение 3 ч, обрабатывали 2П соляной кислотой и отделяли органический слой, который далее обрабатывали так, как это описано выше. Хроматографическая очистка (силикагель, простой эфир/гексан) давал соединение, указанное в заглавии примера 1, в количестве 0,096 г. Тонкослойная хроматография (силикагель, этилацетат:гексан 3:7) Rf 0,25, т.пл. 141,9 143,2oC.
Соединения 2-17, 63, 64, 99 и 100, полученные аналогичным путем с использованием альдегида, реагента Виттига и амина, приведены в табл. 1 и 2.
Пример 2.
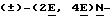
(i) Раствор


(ii vi) Данное соединение превращали в конечный продукт по аналогии со стадиями (ii)-(vi) примера 1, только вместо 1,2-диметилпропиламина использовали изобутиламин.
Соединения 19-43 и 95-98, полученные аналогичным путем, используя производное коричной кислоты, реагент Виттига и амин, представлены в табл. 3 и 4.
Пример 3.


(i) К раствору цис/транс (3: 1) этил-2-формилциклопропилкарбоксилата (1,42 г) (ех Aldrich) в дихлорметане в атмосфере азота добавляли при комнатной температуре трифенилфосфин (ех Aldrich) (12 г) и четырехбромистый углерод (6,6 г) (ех Aldrich). Раствор перемешивали при комнатной температуре в течение 3 ч перед его разделением между простым эфиром и водой. После обработки, осуществленной обычным способом, трифенилфосфиноксид удаляли фильтрованием, после чего хроматографическим путем выделяли этил-2-(2,2-диброэтенил)циклопропилкарбоксилат (2,9 г). ЯМР1H: 5, 92 (1Н, д), 4,16 (2Н, к), 2,44-0,95 (4Н, м), 1,26 (3Н, т).
(ii) Вышеуказанный сложный эфир (1,8 г) в дихлорметане охлаждали до -20oC и по каплям добавляли диизобутилалюминийгидрид (12 мл 1М раствора в гексане). Раствор нагревали до 0oC и выдерживали при этой температуре перед добавлением 2П соляной кислоты с последующей обработкой полученной смеси, которую осуществляли обычным путем. В результате получали 2-(2,2-дибромэтенил)-1-оксиметилциклопропан (1,58 г). ЯМР1H: 6,0, 5,7 (1Н, д), 3,44 (2Н, д), 2,52 (1Н, с), 1,8-1,0 (2Н, м), 0,8 (2Н, м).
(iii) Вышеуказанный спирт (1,58 г) окисляли, используя условия Swerh'a (оксалилхлорид, 0,6 мл; диметилсульфоксил) 1,0 мл; триэтиламин, 4 мл) в дихлорметане с получением 2-(2,2-дибромэтенил) циклопропилметаналь, который непосредственно использовали в следующей стадии. ЯМР1H: 9,6, 9,43 (1Н, д), 5,80 (1Н, д), 2,46-1,82 (2Н, м), 1,82-1,0 (2Н, м).
(iv) Раствор диизопропиламида лития, полученного из н-бутиллития (2,3 мл 1,6 М раствор в гексане) и диизопропиламина (0,55 мл), в сухом тетрагидрофуране, обрабатывали при -60oC триэтилфосфонокротонатом (0,85 г) в ТГФ в атмосфере азота. После выдерживания в течение 2 ч при -60oC к раствору добавляли вышеуказанный альдегид. После выдерживания в течение 18 ч при 25oC смесь разделяли между простым эфиром и водой и обрабатывали обычным путем. Хроматографической очисткой (силикагель, простой эфир/гексан) получали (+)-(2Е, 4Е)-этил-5-[цис/транс-2-(2, 2-дибромэтенил)циклопропил] цента-2,4-диено- ат (1,223 г). ЯМР1H: 7,24 (1Н, дд), 6,28 (1Н, дд), 5,87 (1Н, д), 5,80 (1Н, д), 5,67 (1Н, дд), 4,20 (2Н, к), 1,75 (2Н, м), 1,30 (3Н, т), 1,15 (м).
(v) К раствору вышеуказанного сложного эфира (1,223 г) в этаноле (5 мл) и воде (2 мл) добавляли гидроокись калия (0,25 г). Полученный раствор перемешивали в течение 18 ч перед удалением этанола в вакууме. После добавления разбавленной 2П соляной кислоты проводили экстракцию простым эфиром, сушили над сульфатом магния и концентрировали в вакууме, получая

(vi) Вышеуказанную кислоту (0,32 г) растворяли в дихлорметане (5 мл) и добавляли триэтиламин (0,14 мл). Добавляли фенил-

Пример 4.

Этерификацию коричной кислоты (7,4 г) проводили обычным путем (этанол, 120 мл; концентрированная серная кислота, 6 мл) с получением этилового эфира коричной кислоты (8,5 г). ЯМР1 H: 7,55 (1Н, д), 7,15 (5Н, м), 6,2 (1Н, д), 4,05 (2Н, к), 1,15 (3Н, т). Вышеуказанный эфир (3,52 г) обрабатывали диизобутилалюминийгидридом (40 мл 1М раствора в гексане) в дихлорметане (40 мл) обычным путем, получая 3-фенил-пропен-2-1-ол (2,8 г). ЯМР1H: 7,2 (5Н, м), 6,55 (1Н, д), 6,35 (йН, т), 4,25 (2Н, д), 1,97 (1Н, с).
Вышеуказанный спирт (2,05 г) в пиридине (1,6 мл) перемешивали с уксусным ангидридом (1,8 г) при 25oC в течение 3 ч перед разделением смеси между простым эфиром и разбавленной соляной кислотой. Последующей обработкой, осуществленной обычной путем, получали 3-фенил-пропенил-2-ацетат. (2,2 г) ЯМР1H: 7,15 (5Н, м), 6,52 (1Н, д), 6,22 (1Н, т), 4,57 (2Н, д), 2,00 (3Н, с).
Вышеуказанный ацетат (1,65 г) растворяли в диглиме (ех Aldrich) и добавляли хлордифторацетат натрия (ех Fluotochem) (8,4 г) при 25oC в атмосфере азота. Раствор нагревали до 180oC и выдерживали при этой температуре в течение 0,5 ч. После охлаждения до 40oC добавляли следующую порцию хлордифторацетата натрия (6,2 г) и снова нагревали смесь до 180oC, выдерживая при этой температуре еще 0,5 ч. Смесь охлаждали и разбавляли гексаном. Органическую фазу промывали водой, сушили над сульфатом магния и удаляли растворитель в вакууме. Хроматографической очисткой (силикагель; простой эфир/гексан) получали транс-2,2-дифтор-3-фенилциклопропилметилацетат (1,56 г). ЯМР1H: 7,30 (5Н, м), 4,37 (1Н, дд), 4,26 (1Н, д), 2,67 (1Н, дд), 2,29 [1Н, тройной дублет (тд)] 2,13 (3Н, с).
Вышеуказанный ацетат (1,56 г) перемешивали в течение 18 ч в водном метаноле (10 мл) с углекислым калием (2,94 г). Дальнейшей обработкой, осуществленной обычным путем, получали 2,2-дифтор-3-фенилциклопропилметанол. (1,08 г) ЯМР1H: 7,30 (5Н, м), 3,94 (2Н, м), 2,63 (1Н, м), 2,24 (1Н, м), 1,67 (1Н, с). Вышеуказанный спирт (0, 55 г) перемешивали в дихлорметане (6 мл) при 25oC и добавляли пиридиндихромат (2 г) и молекулярные сита

После удаления растворителя в вакууме получали 2,2-дифтор-3-фенилциклопропиленметаналь (0,255 г). ЯМР1H: 9,49 (1Н, дд), 7,2-7,65 (5Н, м), 3,61 (1Н, тд), 2,955 (1Н, тд). Раствор диизопропиламида лития, полученного из н-бутиллития (1 мл 1,6М раствора в гексане) и диизопропиламина (0,24 мл), в сухом тетрагидрофуране обрабатывали при -60oC триэтилфосфонокротонатом (0,373 г) в ТГФ в атмосфере азота. После выдерживания в течение 2 ч при -60oC добавляли вышеуказанный альдегид (0,255 г). После выдерживания в течение 18 ч при 25oC смесь разделяли между простым эфиром и водой и далее обрабатывали обычным путем. Хроматографическая очистка (силикагель; простой эфир/гексан) давала

Пример 5.

3-(4-бромфенил)пропен-2-1-ол (2,13 г (см. пример 1) реагировал с уксусным ангидридом обычным путем с образованием 3-(4-бромфенил)пропенил-2-ацетата (2,25 г) ЯМР1H: 7,35 (2Н, Д), 7,08 (2Н, д), 6,52 (1Н, д), 6,10 (1Н, дт), 4,65 (2Н, д), 2,1 (3Н, с). Вышеуказанный ацетат (2,25 г) реагировал обычным путем с хлордифторацетатом натрия с образованием трас-2, 2-дифтор-3-(4-бромфенил)циклопропилметилацетата (2,39 г). ЯМР1H: 7,48 (2Н, д), 7,1 (2Н, д), 4,30 (2Н, м), 2,62 (1Н, дд), 2,23 (2Н, м), 2,12 (3Н, с).
Вышеуказанный ацетат (2,39 г) реагировал обычным путем с углекислым калием 2,36 г с образованием 2,2-дифтор-3-(4-бромфенил)циклопропилметанола (1,93 г). ЯМР1H: 7,3 (2Н, д), 7,0 (2Н, д), 3,8 (2Н, м), 3,18 (1Н, с), 2,55 (1Н, м), 2,1 (1Н, м). Вышеуказанный спирт (1,93 г) превращали в целевое соединение способом, аналогичным описанному в стадиях (iii)-(vi) примера 3.

Пример 6.

(i) Бутин-4-он (0,31 г) нагревали при 60oC в течение 1 ч с трибутилоловогидридом (ех Aldrich) (1,6 г) и изобисизобутиронитрилом (0,04 г) (ех Aldrich). Охлаждением и дистилляцией (Kudelrohz 150oC, 1 мм рт.ст.) получали 4-трибутилоловобутен-3-1-ол (1, 17 г) в виде смеси 1:1 транс:цис изомеров олефина (J.K.Stille, ang. Chem. Inr. Ed. Engl. 1986, 25, 508). ЯМР1H: 5,95 (2Н, м), 3,60 (2Н, м), 2,3 (2Н, м), 0,9-2,0 (21Н, м).
(ii) Бис-ацетонитрилпаладийдихлорид (0,01 г) растворяли в сухом диметилформамиде (10 мл) при 25oC в атмосфере аргона. Добавляли 3-трифторметилиодбензол (1,03 г) (ех Fluorocgem) в ДМФА, после чего добавляли вышеуказанный спирт (1,17 г). После выдерживания в течение 72 ч раствор разделяли между простым эфиром и 10-ным раствором гидроокиси аммония, и затем обрабатывали обычным путем.
Хроматографической очисткой (силикагель, простой эфир/гексан) получали 4-(3-трифторметилфенил)бутен-3-1-ол (0,67 г) в виде смеси 1:1 цис:транс изомеров олефина (J.K. Stille and B.L.Groh. J.Am.Chem.Soc. 109, 1987, 815). ЯМР1H: 7,5 (4Н, м), 6,55 (1Н, д), 6,32 (1Н, дт), 3,78 (2Н, м), 2,55 (2Н, м), 1,50 (1Н, с).
(iii-vi) Вышеуказанный спирт превращали в целевое соединение по аналогии со стадиями (iii)-(vi) примера 1.
Пример 7.

(i) Этилпропионат (0,98 г) (ех Lancaster) и трибутилоловогидрид (3,01 г) с азобисизобутиронитрилом (0,01 г) нагревали при 60oC в течение 18 ч. Охлаждением и хроматографической очисткой (силикагель, простой эфир/гексан) получали (Z)-этил-3-трибутилоловопропеноат (1,9 г) (J.K.Stille et al, J. Amer. Chem. Soc. 109, 1987, 815). ЯМР1H: 7,14 (1Н, д), 6,73 (1Н, д), 4,22 (2Н, к), 1,38 (18Н, м), 0,9 (12Н, м).
(ii) Вышеуказанный сложный эфир (0,78 г) растворяли в дихлорметане (4 мл) и охлаждали до -20oC в атмосфере азота. По каплям добавляли диизобутилалюминийгидрид (4 мл 1М раствора в гексане). После 18 ч выдерживания при 25oC аккуратно добавляли разбавленную соляную кислоту, после чего обрабатывали смесь обычным путем, получая 3-трибутилолово-пропен-2-1-ол (0,75 г). ЯМР1H: 6,72 (1Н, дт), 6,10 (1Н, д), 4,15 (2Н, дд), 1,40 (18Н, м), 0,90 (9Н, м).
(iii-v) Вышеуказанный спирт (0,75 г) превращали в (± )-цис-2-(3-трифторметилфенил)-1-формилциклопропан (0,2 г) способом, аналогичным стадии (ii) примера 6 и стадиям (iii) и (iv) примера 1. ЯМР1H: 8,95 (1Н, д), 7,50 (4Н, м), 1,0-2,5 (4Н, м).
(vi) Вышеуказанный альдегид (0,2 г) перемешивали в дихлорметане (5 мл) с карбоэтоксиметилентрифенилфосфораном в атмосфере азота в течение 18 ч при 25oC, после концентрирования в вакууме остаток промывали гексаном, и после удаления гексана в вакууме получали

(vii) Вышеуказанный эфир превращали в целевое соединение по аналогии со стадией (vi) примера 1.
Пример 8.

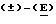
Вышеуказанный спирт (1,35 г) окисляли, используя способ Sweruia (оксалилхлорид, 0,54 мл; диметилсульфоксид, 0,86 мл; триэтиламин, 3,8 мл), в дихлорметане, получая цис-2-(3-трифторметилфенил)-1-(1-пропен-3-аллил)циклопропан (1,3 г). ЯМР1H: 9,21 (4Н, д), 7,50 (4Н, м), 6,28 (1Н, дд), 5,98 (1Н, дд), 2,79 (1Н, м), 2,12 (1Н, м), 1,68 (1Н, м), 1,42 (1Н, м).
Вышеуказанный альдегид (1,3 г) реагировал с карбоэтоксиметилентрифенилфосфораном (1,74 г) по аналогии с примером 7 (vi) с образованием


Пример 9.

К раствору изопропилциклогексиламида лития (получен из 12,5 мл 1,6М раствора н-бутиллития и изопропилциклогексиламина (3,3 мл) (ех aldrich) в ТГФ добавляли при -60oC этилтриметилсилилацетат (3,6 мл) (ех Fluka). После 30 мин выдерживания при -60oC добавляли 4-хлорацетофенон

Хроматографической очисткой (силикагель, простой эфир/гексан) получали этил-3-(4-хлорфенил)-бутен-2-оат (1,22 г) в виде смеси Е, Z изомеров олефина состава 1: 1, ЯМР1H: 7,2 (4Н, м), 6,0 и 5,0 (1Н, м), 4,12 (2Н, м), 2,51 и 1,90 (3Н, с), 1,25 (3Н, м). Вышеуказанный сложный эфир (1,44 г) растворяли в дихлорметане (13 мл) и охлаждали до -20oC. По каплям добавляли диизобутилалюминийгидрид (12,8 мл 1М раствора в гексане). После выдерживания в течение 18 ч при 25oC аккуратно добавляли разбавленную соляную кислоту и обрабатывали полученную смесь обычным путем, получая 3-(4-хлорфенил)бутен-2-1-ол. ЯМР1H: 7,18 (4Н, с), 5,85 (1Н, т), 4,25 (2Н, д), 3,05 (1Н, с), 2,05 (3Н, с). Вышеуказанный спирт превращали в целевое соединение способом, аналогичным стадиям (iii)-(vi) примера 1.
Пример 10.

Этиловый эфир 3-трифторметилкоричной кислоты (0,98 г) (пример 2) в тетрагидрофуране в атмосфере азота обрабатывали илидом, полученным из изопропилтрифенилфосфониййодида (2,12 г) и н-бутиллития (2,8 мл). После 20 ч выдерживания при 80oC смесь обрабатывали путем обычным. Хроматографической очисткой (силикагель; простой эфир/гексан) получали (± )-н-бутил-/транс-3-(3-трифторметилфенил)-2,2-диметилциклопропи- л/ -формат (0,78 г). ЯМР1H: 7,22 (4Н, м), 4,20 (2Н, м), 2,72 (1Н, м), 2,00 (1Н, м), 1,40 (7Н, м), 0,89 (6Н, м).
Вышеуказанный сложный эфир (0,78 г) растворяли в дихлорметане (12 мл) в атмосфере азота и охлаждали до -20oC. По каплям добавляли диизобутилалюминийгидрид (7,4 мл) и перемешивали раствор при 25oC в течение 18 ч. Аккуратно добавляли разбавленную соляную кислоту, после чего обрабатывали полученную смесь обычным путем, получая (± )-/транс-3-(3-трифторметилфенил)-2,2-диметилциклопропил/метанол (0,31 г). ЯМР1H: 7,5 (4Н, м), 3,65 (2Н, д), 2,55 (1Н, широкий (ш) с), 1,62 (1Н, д), 1,14 (1Н, м), 1,15 (3Н, с), 0,90 (3Н, с).
Вышеуказанный спирт превращен в целевое соединение способом, аналогичным стадиям (iv)-(vi) примера 1.

Пример 11.

4-хлорбензальдегид (6,8 г) (ех aldrich) в дихлорметане (250 мл) реагировал с карбоэтоксиметилентрифенилфосфораном (17,5 г) (ех aldrich) при 25oC в течение 18 ч. Проводили концентрирование в вакууме, затем обильно промывали остаток гексаном. Собранные гексановые промывки концентрировали, получая

Вышеуказанный спирт обрабатывали диэтилцинком (45,5 мл) и дийодметаном (8.1 мл) в гексане обычным способом, получая (±)-/трансу-2-(4-хлорфенил)-1-метилциклопропил/метанол (1,94 г). ЯМР1H: 8,94 (1Н, с), 7,30 (2Н, д), 7,06 (2Н, д), 2,68 (1Н, дд), 2,24 (1Н, дд), 1,46 (1Н, дд), 0,98 (3Н). Данный продукт был превращен в целевое соединение способом, аналогичным стадиям (iv)-(vi) примера 3.
Пример 12.
(-)

3-(3, 4-дихлорфенил)пропен-2-1-ол (1,0 г) (получен по аналогии со стадией (i) примера 2 и стадией (ii) примера 1) окисляли, используя способ Swernia (оксалилхлорид 0,5 мл; диметилсульфоксид 0,7 мл; триэтиламин 3,4 мл), получая 3-(3,4-дихлорфенил)-пропен-2-аль (0,9 г). ЯМР1H: 9,76 (1Н, д), 7,53 (3Н, м), 7,41 (1Н, д), 6,68 (2Н, дд).
Вышеуказанный альдегид (0,66 г) перемешивали в этаноле (5 мл) с триэтилортоформатом (0,6 мл) (ех aldrich) и нитратом аммония (ex aldrich) (0,01 г) в течение 3,5 ч при 25oC. Концентрированием в вакууме и обработкой обычным путем получали

Вышеуказанную ацеталь (0,67 г) растворяли в бензоле (25 мл) и обрабатывали (+)-L-диизопропилтартратом (0,7 г) (ех aldrich) и п-толуолсульфокислотой (0,01 г) (ех aldrich). Смесь нагревали при 80oC в течение 6 ч, используя прибор Дина-Старка. Раствор охлаждали и обрабатывали обычным путем, получая (-)-4, 5-дикарбоизопропокси-2-/

Вышеуказанная ацеталь (0,9 г) реагировала с диэтилцинком (11 мл) и дийодметаном (1,8 мл) в гексане обычным путем, давая (-)-4,5-дикарбоизопропрокси-2-/транс-
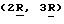
Вышеуказанную ацеталь (0,8 г) нагревали при 70o в течение 12 ч в тетрагидрофуране (5 мл) в присутствии разбавленной соляной кислоты (3 мл). Обработкой смеси обычным путем получали (-)-/транс-

Диизопропиламид лития, полученный из н-бутиллития (0,6 мл) и диизопропиламина (0,14 мл), обрабатывали при -60oC в среде тетрагидрофурана триэтил-4-фосфонокротонатом (0,21 г) в тетрагидрофуране; обработку проводили в атмосфере азота. После 2 ч обработки при -60oC добавляли вышеуказанный альдегид. После выдерживания в течение 18 ч при 25oC добавляли воду и обрабатывали смесь обычным путем. Хроматографической очисткой (силикагель, гексан/простой эфир) получали (-)-

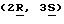
Вышеуказанный эфир превращали в целевое соединение способом, аналогичным стадии (D) примера 1.
(±)

Пример 13.

2,6-дихлоризоникотиновую кислоту (4,0 г) (приготовленную согласно М.М. Robinson, J. Amer. Chem.Soc. 80, 5481, 1958) растворяли в этаноле (20 мл) и концентрированной серной кислоте (1 мл). После 6 ч нагревания при 80oC раствор охлаждали, концентрировали в вакууме и остаток обрабатывали обычным путем, получая этил-2,6-дихлоризоникотинат (3,7 г). ЯМР1H: 7,84 (2Н, с), 4,48 (2Н, к), 1,48 (3Н, т).
Вышеуказанный сложный эфир растворяли в дихлорметане (60 мл) и охлаждали до -20oC в атмосфере азота. По каплям добавляли диизобутилалюминийгидрид (38 мл). После выдерживания в течение 2 ч при 0oC к смеси добавляли разбавленную соляную кислоту, и полученную смесь далее обрабатывали обычным путем, получая 2, 6-дихлор-4-оксиметилпиридин, ЯМР1H: 7,64 (2Н, с), 4,98 (2Н, с).
Вышеуказанный спирт (1,2 г) окисляли в условиях Swernia (оксалилхлорид, 0,33 мл; диметилсульфоксид, 0,54 мл; триэтиламин, 2,35 мл), получая (2,6-дихлор-4-пиридил)метаналь (1,2 г). ЯМР1H: 10,02 (1Н, с), 7,68 (2Н, с).
Вышеуказанный альдегид (1,2 г) растворяли в дихлорметане (40 мл) и добавляли карбоэтоксиметилентрифенилфосфоран (2,4 г). После 18 ч выдерживания при 25oC раствор концентрировали в вакууме и остаток промывали гексаном. Собранные гексановые промывки концентрировали в вакууме, получая этил-3-(2,6-дихлор-4-пиридил)пропиноат (1,2 г). ЯМР1H: 7,50 (2Н, д), 2,28 (2Н, с), 6,52 (2Н, д), 4,29 (2Н, к), 1,32 (3Н, т).
Вышеуказанный сложный эфир (0,25 г) добавляли при 25oC в атмосфере азота в диметилсульфоксиде (4 мл) к илиду, полученному из триметилсульфоксониййодида (0,24 г) и гидрида натрия (0,44 г 60-ной дисперсии в минеральном масле). После выдерживания в течение 18 ч при 25oC к смеси аккуратно добавляли воду, и полученную смесь обрабатывали обычным путем. Хроматографической очисткой (простой эфир/гексан, силикагель) получали (±)-этил-/транс-2-(2,6-дихлор-4-пиридил)циклопропил/формиат (0,12 г). ЯМР1H: 6,93 (2Н, с), 4,16 (2Н, к), 2,42 (1Н, тд), 1,99 (1Н, тд), 1,69 (1Н, тд), 1,30 (2Н, м), 1,25 (3Н, т).
Вышеуказанный сложный эфир (0,34 г) растворяли в дихлорметане (7 мл) в атмосфере азота и охлаждали до -20oC. По каплям добавляли метанол (0,5 мл), и затем 2М гидроокись натрия (5 мл). Полученную смесь далее обрабатывали обычным путем. ЯМР1H: 6,98 (2Н, с), 3,64 (2Н, м), 3,30 (1Н, шс), 0,9-2,0 (4Н, м). Полученный выше спирт (0,21 г) окисляли, используя условия Swernia (оксалилхлорид, 0,1 мл; диметилсульфоксид, 0,15 мл; триэтиламин, 0,66 мл), получая (±)-/транс-2-(2, 6-дихлор-4-пиридил)циклопропил/метаналь (0,2 г). ЯМР1H: 9,44 (1Н, д), 6,96 (2Н, с), 1,0-2,6 (4Н, м).
Раствор диизопропиламида лития в тетрагидрофуране (2 мл), полученный из н-бутиллития (0,7 мл) и диизопроипиламина (0,16 мл), обрабатывали при -60oC триэтил-4-фосфоно-3-метилкротонатом (0,26 г). После выдерживания смеси в течение 2 ч при -60oC к ней добавляли вышеуказанный альдегид (0,2 г). После выдерживания в течение 2,5 ч при 25oC к полученной смеси добавляли воду, после чего проводили обработку обычным путем. Хроматографической очисткой (силикагель, простой эфир/гексан) получали

Вышеуказанный сложный эфир превращали в целевое соединение по аналогии со стадией (vi) примера 1.
Пример 14.
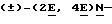
3-нитро-4-бромтолуол (54 г) (eх Lancaster) в смеси этанол-вода (100 мл) (1: 1) интенсивно перемешивали при 25oC и добавляли порошкообразное железо (84 г) (eх BDH). Полученную смесь нагревали с обратным холодильником до кипения и в течение 30 мин по каплям добавляли раствор хлористого водорода (2,19 г) в смеси вода-этанол (50 мл, 1:1). После 4 ч кипячения с обратным холодильником смесь охлаждали, подщелачивали 15-ным раствором гидроокиси калия и фильтровали через цеолит, промывая этанолом (2х50 мл). Полученную смесь разбавляли водой (1000 мл) и обрабатывали обычным путем, получая 3-амино-4-бромтолуол (43,6 г). ЯМР1H: 7,25 (1Н, д), 6,40 (2Н, м), 3,96 (2Н, шс), 2,2 (3Н, с).
Вышеуказанный аминотолуол (24 г) перемешивали в концентрированной бромистоводородной кислоте (230 мл) при 0oC. Добавляли раствор нитрита натрия (9,8 г (ех BDH) в воде (35 мл), поддерживая температуру реакции 0 - 5oC. Смесь выливали в раствор бромида меди (37 г) (ех BDH) в воде (230 мл) и бромистоводородной кислоте при 50oC. После выдерживания в течение 2 ч при 50oC и 18 ч при 25oC к смеси добавляли воду и полученную смесь обрабатывали обычным путем. После очистки дистилляцией (100oC, 0,5 мм рт.ст) получали 3,4-дибромтолуол (12,7 г). ЯМР1H: 7,53 (2Н, м), 6,95 (1Н, дд), 2,30 (3Н, с). Раствор вышеуказанного производного толуола (5 г) в ледяной уксусной кислоте (20 мл) (ех BDH) и уксусном ангидриде (32,6 г) охлаждали до -10oC. По каплям добавляли серную кислоту (7,8 г), поддерживая температуру реакции ниже -5oC. Порциями добавляли триоксид хрома (ех BDH) (6 г), поддерживая температуру реакции (-5) 0oC. После выдерживания в течение 15 мин при 0oC смесь выливали на лед (150 г) и далее обрабатывали обычным путем, получая диацетоксиметил-3,4-дибромбензол. ЯМР1H: 7,53 (2Н, м), 6,95 (1Н, дд), 2,30 (6Н, с).
Вышеуказанный диацетат растворяли в смеси вода (15 мл)-этанол (15 мл) и добавляли концентрированную серную кислоту (1,5 мл). После кипячения с обратным холодильником в течение 1 ч раствор обрабатывали обычным путем, получая 3, 4-дибромбензальдегид (2,25 г). ЯМР1H: 10,04 (1Н, с), 7,53 (2Н, м), 6,95 (1Н, дд). Вышеуказанный альдегид (2,25 г) растворяли в дихлорметане (25 мл) и добавляли карбоэтоксиметилентрифенилфосфоран (2,96 г). После выдерживания в течение 18 ч при 25oC раствор концентрировали в вакууме и остаток промывали гексаном. Собранные гексановые отмывки концентрировали в вакууме, получая этил-3-(3,4-дибромфенил)пропиноат (2,4 г). ЯМР1H: 7,7 (2Н, м), 7,50 (1Н, д), 7,15 (1Н, дд), 6,32 (1Н, д), 4,26 (2Н, к), 1,33 (3Н, т).
Вышеуказанный сложный эфир (2,4 г) растворяли в дихлорметане (25 мл) в атмосфере азота и охлаждали раствор до -20oC, после чего по каплям добавляли диизобутилалюминийгидрид (14,5 мл). После выдерживания в течение 18 ч при 25oC аккуратно добавляли к смеси разбавленную соляную кислоту, и полученную смесь обрабатывали обычным путем, получая 3-(3,4-диброфенил)пропен-2-1-ол (2,04 г). ЯМР1H: 7,43 (2Н, м), 7,13 (1Н, дд), 6,56 (1Н, д), 6,20 (1Н, дт), 4,30 (2Н, д), 1,98 (1Н, с).
Вышеуказанный спирт (2 г) обрабатывали в гексане диэтилцинком (35 мл) и дийодметилом (15,52 мл) обычным способом, получая (±)-/транс-2(3,4-дибромфенил)циклопропил/метанол (1,3 г). ЯМР1H: 7,40 (1Н, д), 7,30 (1Н, д), 6,76 (1Н, дд), 3,53 (2Н, д), 2, 30 (1Н, с), 1,68 (1Н, м), 1,33 (1Н, м), 0,87 (2Н, м).
Вышеуказанный спирт превращали в целевое соединение по аналогии со стадиями (iv)-(vi) примера 1.
(i)


Пример 15.

N-аминобензонитрил (11,8 г) (ех Albrich) в сухом хлороформе (250 мл) в атмосфере азота обрабатывали хлористым сульфурилом (4,05 г), (ех BDH), поддерживая температуру реакции ниже 35oC. После 2 ч кипячения с обратным холодильником смесь выливали на лед и подщелачивали 2М раствором гидроокиси натрия. Дальнейшей обработкой обычным способом получали 3,5-дихлор-4-аминобензонитрил (18,2 г). ЯМР1H: 7.35 (2Н, с), 4,70 (2Н, шс).
Вышеуказанный аминонитрил (18,7 г) в концентрированной бромистоводородной кислоте (190 мл) обрабатывали при 0oC раствором натрия нитрата (7,6 г) в воде (30 мл). Полученную смесь выливали в раствор бромида меди (28,7 г) в воде (180 мл) и бромистоводородной кислоте (30 мл) при 50oC. После 2 ч выдерживания при 50oC и 18 ч выдерживания при 25oC смесь разбавляли водой и далее обрабатывали обычным путем, получая 3,5-дихлор-4-бромбензонитрил (9,2 г). ЯМР1H: 7, 63 (2Н, с). Вышеуказанный нитрил (5 г) в простом эфире (100 мл) в атмосфере азота обрабатывали диизобутилалюминийгидридом (22 мл 1М раствора в толуоле). После выдерживания в течение 18 ч при 25oC к смеси добавляли 1,4-диоксан (150 мл) и воду (10 мл) и затем разбавленную соляную кислоту (250 мл). После 30 мин выдерживания при 25oC полученную смесь обрабатывали обычным путем, получая 3,5-дихлор-4-бромбензальдегид (4,52 г). ЯМР1H: 9,89 (1Н, с), 7,85 (2Н, с).
Вышеуказанный альдегид превращали в целевое соединение по аналогии с примером 1.

Пример 16.

Этил-4-формилбензоат (2,46 г) (ех Lancaster) в дихлорметане (30 мл) обрабатывали в атмосфере азота трифенилфосфином (15,7 г) и четырехбромистым углеродом (9,9 г) при 0oC. После выдерживания смеси в течение 1,5 ч при 25oC к ней добавляли воду, и полученную смесь обрабатывали обычным путем. Хроматографической очисткой (силикагель, простой эфир/гексан) получали этил-4-(2,2-дибромэтенил)бензоат (3,32 г). ЯМР1H: 8,0 (2Н, д), 7,50 (2Н, д), 7,45 (1Н, с), 3,85 (3Н, с).
Вышеуказанный сложный эфир (3,32 г) в дихлорметане (10 мл) обрабатывали в атмосфере азота при 0,20oC диизобутилалюминийгидридом (21 мл). После выдерживания в течение 1 ч при 0oC добавляли разбавленную соляную кислоту, и полученную смесь обрабатывали обычным путем, получая 4-(2, 2-дибромэтенил)бензиловый спирт (3,18 г). ЯМР1H: 7,50 (2Н, д), 7,41 (1Н, с), 7,20 (2Н, д), 4,33 (2Н, с), 3,65 (1Н, с).
Вышеуказанный спирт (3,18 г) окисляли, используя условия Swernia (оксалилхлорид, 0,96; диметилсульфоксид, 1,56 мл; триэтиламин, 6,9 мл); в среде дихлорметана, получая 4-(2,2-дибромэтенил)бензальдегид (2,04 г). ЯМР1H: 10,94 (1Н, с), 7,86 (2Н, д), 7,61 (2Н, д), 7,45 (1Н, с).
Вышеуказанный альдегид превращали в

Пример 17.

(±)-транс-2-/4-(2,2-дибромэтенил)фенил/циклопропилметанол (1,43 г) (получен так же, как в примере 16) обрабатывали в сухом тетрагидрофуране в атмосфере азота при -40oC н-бутиллитием (8,1 мл). После выдерживания смеси в течение 4 ч при 25oC добавляли воду, и полученную таким образом смесь обрабатывали обычным способом. Хроматографической очисткой (силикагель, простой эфир/гексан) получали (±)-транс-2-(4-этинилфенил)циклопропанметанол (0,62 г). ЯМР1H: 7,41 (2Н, д), 6,90 (2Н, д), 3,30 (2Н, д), 2,95 (1Н, с), 2,59 (1Н, с), 1,85 (1Н, м), 1,34 (1Н, м), 0,90 (2Н, м).
Вышеуказанный спирт превращали в целевое соединение по аналогии с примером 1.
Пример 18.

4-амино-3,5-дихлорбензонитрил превращали в целевое соединение по аналогии с примером 15, используя вместо бромистоводородной кислоты и бромида меди соляную кислоту и хлорид меди (ех BDH).
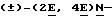
Пример 19.

Гидрид натрия (0,74 г 60-ной дисперсии в минеральном масле) (ех BDH) в среде ТГФ (30 мл) обрабатывали этилфторацетатом (2,7 мл) (ех Lancaster) и диэтилоксалатом (ех BDH) (3,8 мл). После 4 ч выдерживания при 80oC к смеси добавляли (±)-транс-2-(3,4-дихлорфенил)циклопропилметаналь (6 г) (пример 2) (i) и пример 1 (ii)-(iv). После 18 ч выдерживания при 25oC к смеси добавляли воду, и полученную в результате смесь обрабатывали обычным способом. После хроматографической очистки (силикагель, гексан/простой эфир) получали (±)-этил-(2Z-3-/транс-2-(3,4-дихлорфенил)циклопропил/2- фторпентен-2-оат (4 н). ЯМР1H: 7,30 (1Н, д), 7,15 (1Н, д), 6,90 (1Н, дд), 5,70 (1Н, дд), 4,30 (2Н, к), 2,08 (2Н, м), 1,35 (2Н, м), 1,30 (3Н, т).
Вышеуказанный сложный эфир (4 г) растворяли в дихлорметане (30 г) и охлаждали до -20oC в атмосфере азота. По каплям добавляли диизобутилалюминийгидрид (26 мл). После выдерживания в течение 18 ч при 25oC добавляли к смеси разбавленную соляную кислоту, и полученную таким образом смесь обрабатывали обычным путем, получая (±)-(2Z)-3-/транс-2-(3,4-дихлорфенил)циклопропил/-2-фторпропен-2- -1-ол (3,3 г). ЯМР1H: 7,32 (1Н, д), 7,17 (1Н, д), 6,90 (1Н, дд), 4,10 (2Н, дд), 3,60 (1Н, т), 1,90 (2Н, м), 1,20 (2Н, м).
Вышеуказанный спирт (3,3 г) окисляли, используя условия Swernia (оксалилхлорид, 1,2 мл; диметилсульфоксид, 2,0 мл; триэтиламин, 8,8 ил), в среде дихлорметана, получая (±)-(2Z)-3-/транс-2-(3,4-дихлорфенил)циклопропил/-2- фторпропен-2-аль (3,25 г). ЯМР1H: 9,20 (1Н, д)0 7,39 (1Н, д), 7,22 (1Н, д), 6,95 (1Н, дд), 5,60 (1Н, дд), 2,20 (2Н, м), 1,50 (2Н, м).
Вышеуказанный альдегид (0,5 г) растворяли в дихлорметане (5 мл) в атмосфере азота и обрабатывали при 25oC карбоэтоксиметилентрифенилфосфораном (0,67 г). После выдерживания при 25oC в течение 18 ч раствор концентрировали в вакууме и остаток промывали гексаном. Собранные гексановые промывки концентрировали в вакууме, получая (±)-(

Вышеуказанный сложный эфир превращали в целевое соединение по аналогии со стадией (vi) примера 1.
Пример 20.
(±)-(

(±)-(2Z)-2-фтор-3-/транс-2-(3,4-дихлорфенил)циклопропил/ пропен-2-аль (2,59 г) (пример 19) в простом эфире (10 мл) обрабатывали при 0oC в атмосфере азота метилмагниййодидом, полученным из магниевой стружки (0,26 г) и метилйодида (0,7 мл) в среде простого эфира (20 мл). После выдерживания в течение 18 ч при 25oC смесь обрабатывали обычным способом. Хроматографической очисткой (силикагель, простой эфир/гексан) получали (±)-(3Z)-4-/транс-2-(3,4-дихлорфенил)циклопропил/бутен-3,2-ол (2,0 г). ЯМР1H: 7,23 (1Н, д), 7,05 (1Н, д), 6, 90 (1Н, дд), 4,52 (1Н, м), 4,23 (1Н, м), 3,0 (1Н, м), 1,80 (2Н, м), 1,35 (3Н, д), 1,18 (2Н, м).
Вышеуказанный спирт (2,0 г) окисляли, используя условия Swernia (оксалилхлорид, 0,7 мл; диметилсульфоксид, 61 мл; триэтиламин, 5,1 мл), в среде дихлорметана, получая (±)-(3Z)-3-фтор-4-/транс-2-(3,4-дихлорфенил)циклопропил/ бутен-3,2-он (1,5 г). ЯМР1H: 7,30 (1Н, д), 7, 10 (2Н, д), 6,95 (1Н, дд), 5,70 (1Н, дд), 2,32 (3Н, д), 2,10 (2Н, м), 1,43 (2Н, м).
Хлорацетилхлорид (ех Albrich) (50 г) добавляли по каплям при перемешивании к изобутиламину (ех Albrich) (70 мл) в среде сухого простого эфира (250 мл) при 0oC. Когда смесь нагревалась до комнатной температуры, ее обработали обычным способом, получив


Раствор диизопропиламида лития в тетрагидрофуране, полученный из н-бутиллития (2,3 мл) и диизопропиламина (0,51 мл), в атмосфере азота при -70o C обработали диэтил-

(±)-(2Z,

Пример 21.

Получали по аналогии с примером 14, используя соляную кислоту и хлорид меди вместо бромистоводородной кислоты и бромида меди.



Пример 22.

Порошкообразный цинк (12,5 г) (ех BDH) в воде (15 мл) при 25oC обрабатывали хлоридом ртути (1,25 г) (ех Dedrich). Добавили концентрированную соляную кислоту, и избыток декантировали. Добавили 4-бензоилбензойную кислоту (5 г) (ех Lancaster), затем воду (15 мл), ледяную уксусную кислоту (2 мл) и толуол (15 мл). Добавили еще 20 мл концентрированной соляной кислоты. После 7 ч кипячения с обратным холодильником смесь фильтровали и промывали разбавленной соляной кислотой. Обработкой обычным путем получили 4-бензилбензойную кислоту (4 г). Вышеуказанную кислоту (4 г) растворяли в этаноле (50 мл) и обрабатывали концентрированной серной кислотой (0,5 мл). После 3 ч кипячения с обратным холодильником смесь концентрировали в вакууме и остаток обрабатывали обычным способом, получая этил-4-бензилбензоат (4 г). ЯМР1H: 8,00 (2Н, дд), 7,28 (7Н, м), 4,39 (2Н, с), 1,40 (3Н, т).
Вышеуказанный сложный эфир (4 г) в сухом простом эфире обрабатывали при 0oC в атмосфере азота литийалюминийгидридом (0,9 г). После 1 ч выдерживания при 0oC и 18 ч выдерживания при 25oC аккуратно добавляли воду и полученную смесь обрабатывали обычным путем, получая 4-бензилбензиловый спирт (2,52 г). ЯМР1H: 7,21 (9Н, м), 4,53 (2Н, с), 3,95 (2Н, с), 2,10 (1Н, шс).
Вышеуказанный спирт (2,52) окисляли, используя условия (оксалилхлорид, 1,2 мл; диметилсульфоксид, 1,8 мл; триэтиламин, 8,8 мл), в среде дихлорметана, получая 4-бензилбензальдегид (1,33 г). ЯМР1H: 9,93 (1Н, с), 7,78 (2Н, д), 7,33 (2Н, д), 7,20 (5Н, с), 4,04 (2Н, с).
Вышеуказанный альдегид превращали в целевое соединение по аналогии с примером 15.

Пример 23.

Этилбромфторацетат (Fluorochem) (25 г) и триэтилфосфит (ех Albrich) (29 г) нагревали вместе при 140oC в течение 6 ч в емкости, снабженной ректификационной колонкой. После отгонки всего этилбромида, остаток дистиллировали с получением триэтил-2-фтор-2-фосфоацетата (22 г) (т. кип. 98 - 108oC при 0,8 мм рт.ст.). Последний (20 г) по каплям добавляли к промытому гексаном гидриду натрия (3,3 г 60-ной дисперсии) в сухом простом эфире (85 мл). После 3 ч выдерживания при комнатной температуре и 30 мин кипячения с обратным холодильником добавляли ацетон, и полученную смесь перемешивали в течение 4 дн при комнатной температуре в атмосфере азота. После обработки, проведенной обычным способом, полученный сырой продукт дистиллировали, получая этил-2-фтор-3-метилбутен-2-оат (4 г) (т. кип. 60oC при 15 мм рт.ст.) (Macleidt and Wessendorf, Ann 674, 1, (1964)). Этил-2-фтор-3-метил-бутен-2-оат (4 г, 27,4 ммоль),



Вышеуказанный сложный эфир превращали в целевое соединение по аналогии с примером 1.

Пример 24.


Получали из сложного эфира - (Z)-этил-3-(3,4,5-трихлорфенил)-2-фторпропен-2-оата способом, аналогичным способу, описанному в примере 23. Указанный сложный эфир получали, обрабатывая суспензию гидрида натрия (0,33 г) в тетрагидрофуране (10 мл) диэтилоксалатом (1,83 г) и этилфторацетатом (1,33 г) в атмосфере азота. После 4 ч кипячения с обратным холодильником к охлажденной смеси добавляли 3,4,5-трихлорбензальдегид (2,62 г) (приготовлен так же, как в примере 18). После 18 ч выдерживания при 25oC добавляли воду, и полученную смесь обрабатывали обычным путем. Хроматографической очисткой (силикагель, гексан/простой эфир) получали (2,5 г). ЯМР1H: 7,63 (2Н, с), 6,77 (1Н, д), 4,35 (2Н, к), 1,38 (3Н, т).
Соединения 80 118 приготовленные, исходя из альдегида, реагента Виттига и амида, представлены в табл. 5 и 6.
Пример 25.


Карбоэтоксиметилентрифенилфосфоран (34,8 г) в дихлорметане (100 мл) обрабатывали при -70oC в атмосфере азота триэтиламистом углероде (100 мл) в течение 60 мин. Раствор нагревали до 25oC, добавляли воду, и полученную смесь обрабатывали обычным путем, получая карбоэтоксихлорметилентрифенилфосфоран (18,9 г) после перекристаллизации из смеси ацетон/гексан (Denney and Ross, J. Org. Chem. 1962, 27, 998). Карбоэтоксихлорметилентрифенилфосфоран (8,74 г) в дихлорметане (100 мл) обрабатывали в атмосфере азота при 25oC 3, 4-дихлорбензальдегидом. После выдерживания при 25oC в течение 18 ч и удаления растворителя в вакууме проводили тритурацию из гексана, и гексановые промывки концентрировали в вакууме. Хроматографической очисткой (силикагель, простой эфир/гексан) получали этил-3-(3,4-дихлорфенил)-2-хлорпропен-2-оат (6,3 г). Вышеуказанный сложный эфир превращали в целевое соединение по аналогии с примером 24.




Пример 26.

Транс-2-(3, 4-дихлорфенил)циклопропанметанметанол (3 г) (получен в примере 18) обрабатывали карбоэтоксиметилентрифенилфосфораном (4,85 г) в среде дихлорметана (30 мл). Концентрированием в вакууме и фильтрованием с последующим концентрированием получали (±)-этил-3-/транс-2-(3,4-дихлорфенил)циклопропил/пропен-2-оат (1,8 г).
Обработкой вышеуказанного сложного эфира (1,8 г) диизобутилалюминийгидридом (12,6 мл 1М раствора в гексане) в среде дихлорметана получали, после обработки реакционной смеси обычным способом, (±)-3-/транс-2-(3, 4-дихлорфенил)циклопропил/пропен-2-1-ол (1,33 г).
Вышеуказанный спирт (1,33 г) окисляли в условиях Swernia (оксалилхлорид 0,7 мл; диметилсульфоксид 1,15 мл; триэтиламин 3,8 мл) в среде дихлорметана, получая (±)-3-/транс-2-(3,4-дихлорфенил)циклопропил/пропен-2-1-аль, который непосредственно использовали в следующей стадии.
К диэтилметанфосфонату (15,2 г, 0,1 моль) в тетрагидрофуране (200 мл) добавляли при -70oC н-бутиллитий (62,5 мл, 0,1 моль). Через 30 мин добавляли изобутилизотиоцианат (5,8 г, 0,05 моль) в тетрагидрофуране (50 мл). Смесь оставляли на ночь при комнатной температуре, затем выливали на смесь лед-вода и экстрагировали простым эфиром. Раствор в простом эфире промывали рассолом, сушили и удаляли растворитель, получая


Полученный ранее (±)-3-/транс-2-(3, 4-дихлорфенил)циклопропил/пропен-2-аль в тетрагидрофуране (5 мл) добавляли к вышеуказанной смеси. Смесь оставляли на ночь при комнатной температурой, и затем обрабатывали ее обычным путем. Сырой продукт очищали колоночной хроматографией (силикагель, гексан: простой эфир 7:3), получая целевое соединение.








Данные ЯМР1H представлены в табл. 7.
Схема 1. Получение соединений формулы I

(i) Process (a) Z1=OR, X=O Способ (а)
(ii) Process (a) Z1=OH, X=O Способ (а)
(iii) Process (b) X=O,S Способ (в)
(iv) Process (b) X=O,S Способ (в)
(v) Process (b) X=O,S Способ (в)
Схема 2. Получение промежуточных сложных эфиров

(I)-(V) обозначают стадии (I)-(V) описанных способов получения промежуточных сложных эфиров
Схема 3. Получение промежуточных спиртов и альдегидов

Биологические данные
Нижеследующие примеры иллюстрируют, не ограничивая объема изобретения, пестицидную активность соединений формулы (I).
Пример А. Тесты с опрыскиванием.
Активность
предлагаемых соединений тестировали, растворяя соединения в
ацетоне (5) и затем разводя этот раствор смесью вода: "Synperonic" (94,50,5) с получением водной эмульсии. Затем полученный раствор
использовали для обработки следующих насекомых, для которых
наблюдалась активность при следующих дозах опрыскивания:
Musca domestica
20 самок Musca помещали в картонный цилиндр, оба
донышка которого были закрыты марлей. Раствором, содержащим
соединение, опрыскивали насекомых и определяли смертность через 48 ч при 25oC.
Следующие соединения оказались активными при 1000 ppm или менее: 1, 2, 3, 5, 6, 7, 8, 10, 11, 14, 15, 19, 20, 21, 36, 37, 38, 39, 40, 41, 96, 48, 55, 57, 65, 66, 78.
Следующие соединения оказались активными при 200 ppm или менее: 4, 9, 13, 16, 17, 100, 30, 31, 32, 33, 34, 35, 42, 95, 97, 56, 59, 60, 61, 62, 63, 64, 67, 68, 69, 70, 71, 72, 73, 74, 77, 93, 94, 79, 80, 81, 82, 83, 84, 85, 86, 89, 90, 92, 87.
Pluetella xylostella
Листья китайской
капусты, зараженные 8 личинками Plutella второй возрастной стадии, опрыскивали раствором, содержащим соединение. Смертность
определяли через 2 дня при 25oC.
Следующие соединения оказались активными при 100 ppm или менее: 12, 22, 25, 26, 45, 46, 47, 48, 51, 52, 53, 54, 58, 65, 76.
Следующие соединения оказались активными при 200 ppm или менее: 1, 2, 3, 4, 5, 6, 7, 9, 11, 13, 14, 15, 18, 19, 20, 21, 23, 24, 27, 28, 29, 30, 31, 32, 32, 34, 36, 41, 42, 95, 44, 50, 57, 61, 66.
Следующие соединения оказались активными при 40 ppm или менее: 8, 10, 16, 17, 33, 35, 37, 38, 39, 40, 97, 55, 56, 59, 60, 62, 63, 64, 67, 68, 69, 70, 71, 72, 73, 74, 77, 78, 93, 79, 80, 81, 90, 92, 87.
Tetranychus usticaе
Зараженные листья фасоли обыкновенной опрыскивали раствором, содержащим соединение. Смертность определяли через 2 дня при
25oC.
Следующие соединения оказались активными при 1000 pppm или менее: 8, 12, 13, 16, 17, 18, 21, 26, 28, 31, 33, 34, 37 54, 56, 57, 59, 60, 61, 63, 67, 69, 70, 77, 78, 93, 80, 82, 83, 84, 85, 92, 87.
Spodoptera littoralis
Незараженные листья опрыскивали тестируемым раствором, содержащим соединение, и давали листьям высохнуть. Затем листья
были заражены 10 новорожденными личинками. Смертность определяли через 3 дня.
Следующие соединения оказались активными при 1000 ppm или менее: 1, 5, 6, 7, 13, 14, 15, 100, 18, 20, 21, 29, 34, 36, 37, 38, 40, 41, 42, 95, 44, 46, 49, 50, 51, 53, 55, 63, 65, 66, 67, 91.
Следующие соединения оказались активными при 200 ppm или менее: 3, 4, 8, 9, 10, 11, 16, 17, 19, 30, 31, 32, 33, 35, 39, 96, 97, 56, 57, 59, 60, 61, 62, 64, 68, 69, 70, 71, 72, 73, 74, 77, 78, 93, 94, 79, 80, 81, 82, 83, 84, 86, 85, 89, 90, 92, 87.
Myzus persicae
20
взрослых Myzus помещали на лист китайской капусты. Через 24 ч лист опрыскивали раствором,
содержащим соединение. Смертность определяли через 2 дня при 25oC.
Следующие соединения оказались активными при 1000 ppm или менее: 8, 9, 13, 18, 19, 20, 22, 24, 30, 31, 34, 35, 95, 44, 50, 59, 60, 61, 66, 72, 75, 77, 78, 93, 82, 83, 84, 85, 86, 92, 87.
Diabrotica undecimpunctata
Личинки второй возрастной стадии и их пищу опрыскивали на
фильтровальной бумаге раствором, содержащим соединение. Активность определяли через 2 дня.
Следующие соединения оказались активными при 1000 ppm или менее: 3, 6, 9, 11, 12, 13, 14, 17, 28, 29, 30, 31, 32, 33, 35, 37, 39, 95, 96, 97, 44, 54, 55, 56, 59, 61, 62, 67, 69, 71, 72, 74, 77, 78, 94, 80, 81, 82, 83, 86, 92.
Следующие соединения оказались активными при 200 ppm или менее: 10, 16, 68, 73, 79, 84, 85, 89.
Пример В. Тесты с локальным применением Blatella germanica.
На самцов В. germanica локально воздействовали 0,5 мкл раствора соединения в бутаноле (с или без пиперонилбутоксида). Смертность определяли через 6 дн.
Следующие соединения оказались активными при 10 мкг или менее (+ пиперонилбутоксид):
10, 11, 13, 15, 17, 30, 35, 36, 37, 39, 40, 41, 42, 55, 56, 57, 59, 60, 61, 63, 64, 67, 68,
69, 70, 71, 72, 73, 74, 77, 78, 94, 79, 80, 81, 82, 83, 84, 85, 86, 92, 87
Следующие соединения
оказались активными при 10 мкг или менее (без пиперонилбутоксида) 1, 8, 9, 20, 21, 30, 31, 32,
33, 34, 95.
Далее приводятся сравнительные данные сопоставления для соединений 31 и 32 изобретения с аналогичными данными, содержащимися в известных заявках.
Кроме того, приводятся точные данные по биологическим тестам, указывающие на степень активности этих соединений, а именно, процент гибели для соединений 1 100 заявки.
Применение с направленным распылением в отношении мухи комнатной (Musca domestica). Соединения распыляли в виде смеси, состоящей из ацетона, воды и смачивающей эмульсии (взятых в соотношении (5:94:5)), и процент гибели за 2 дня приведен в табл. 10.
Реферат
Использование: в сельском хозяйстве, так как обладают инсектицидной активностью. Сущность изобретения: продукт - амиды ненасыщенных кислот формулы I: Q'QCR2 = CR3CR4 = CR5C(X)NHR' или их соли, где Q - фенил, нафтил, пиридил, дигаловинил, каждый из которых может быть замещен 1-3 заместителями, выбранными из группы: C1-6алкил, С1-6алкокси, СF3галоген, Q' - 1,2-циклопропил, возможно замещенный С1-4алкилом или галогеном, R2, R3, R4 и R5 являются одинаковыми или различными и означают водород, галоген, С1-6 алкил, гало(С1-4)алкил, при этом один из радикалов обязательно означает водород, R1 - водород, С1-6алкил, который может быть замещен диоксаланильной группой, цикло(С3-6)алкил, 2-метил-2-пропенил, Х = O, S. Реагент 1: Соединение формулы QQ'CR2 - CR3CR4Z, где Z - O или CR5C(X)Z'. Реагент 2: амин. Условия реакции: температура (-25) - (+150)oC в безводном апротонном растворителе. 2 с. и 4 з.п. ф-лы, 11 табл.
Формула
Q1QCR2 CR3CR4 CR5C(X)NHR1,
где Q фенил, нафтил, пиридил, дигаловинил, каждый из которых может быть замещен 1 3 заместителями, выбранными из группы: С1 - С6-алкил, С1 С6-алкокси, CF3, галоген, Q' - 1,2-циклопропил, возможно замещенный С1 С4-алкилом или галогеном;
R2, R3, R4 и R5 одинаковые или различные, водород, галоген, С1 С6-алкил, гало(С1 С4)-алкил, при этом один из радикалов обязательно означает водород;
R1 водород, С1 С6-алкил, который может быть замещен диоксаланильной группой, цикло(С3 С6)-алкил, 2-метил-2-пропенил;
X O, S,
или их соли.
QQ1CR2 CR3CR4Z,
где Z О или CR5C(X)Z1,
Q фенил, нафтил, пиридил, дигаловинил, каждый из которых может быть замещен 1 3 заместителями, выбранными из группы С1 С6-алкил, С1 С6-алкокси, CF3, галоген;
Q1 1,2-циклопропил, возможно замещенный С1 - С4-алкилом или галогеном;
R2, R3, R4 и R5 одинаковые или различные, водород, галоген, С1 С6-алкил, гало(С1 С4 )-алкил, при этом один из радикалов обязательно означает водород; X O, S;
Z1 ОН, С1 С6-алкокси, галоген или P(O)(O-Ph)NH-Ph, где Ph фенил.

Комментарии