Способ получения амидов ненасыщенных кислот - RU2010025C1
Код документа: RU2010025C1
Чертежи











Описание
Изобретение относится к области органической химии, а именно к способу получения амидов ненасыщенных кислот общей формулы 1
Q
Q1CR2= CR3CR4= CR5C(X) NHR1 (1) или их солей, где Q обозначает фенил, пиридил, нафтил, дигаловинил, каждый из которых может быть
замещен 1-3 заместителями, выбранными из группы: С1-С6 алкил, С1-С6 алкокси, СF3, галоген, Q1-1,2-циклопропильное кольцо, возможно
замещенное С1-С4 алкилом, R2, R3, R4 и R5 обозначают одинаковые или разные группы, включающие водород, С1-6 алкильная
группа, или С1-6 галоидалкильная группа; при этом один из радикалов
обязательно означает водород, Х обозначает атом кислорода, R1 обозначает водород или С1-6 алкил, возможно
содержащую в качестве заместителей диоксаланильную группу, цикло(С3-С6)алкил, обладающих инсектицидной активностью.
Известно использование амидов кислот в качестве инсектицидов [1] .
Целью изобретения является разработка доступного способа получения соединений общей формулы I, обладающих высокой инсектицидной активностью.
Поставленная цель достигается описываемым способом получения соединений I, который заключается в том, что осуществляют взаимодействие соответствующего карбонильного соединения с реактивом Виттига.
Общие синтетические способы и методики.
Разнообразные соединения были синтезированы и охарактеризованы в соответствии со следующими экспериментальными методиками.
1Н ЯМР-спектры были получены на спектрометре Bruker АМ-250 для растворов в дейтерохлороформе с использованием тетраметилсилана в качестве внутреннего стандарта; результаты приведены в виде ppm от количества ТМС, числа протонов, числа пиков, константы спин-спинового взаимодействия I, Гц.
За протеканием реакции удобно также следить с помощью алюминиевых пластинок, предварительно покрытых слоями силикагеля толщиной 0,25 мм, содержащими флюоресцентный индикатор, проявляемых в подходящем растворителе или в смеси растворителей.
Обычно обработку реакционной смеси проводили следующим образом.
Реакционную смесь разделяли между органическим растворителем и водой. Фазы отделяли друг от друга, органическую фазу промывали как минимум эквивалентным объемом разбавленного водного раствора основания, а затем насыщенным рассолом. Затем органическую фазу сушили над осушителем, обычно над сульфатом магния, и фильтровали. Удаляли летучие растворители, полученный продукт подвергали соответствующей очистке, после чего использовали в следующей стадии синтеза или анализировали как конечный продукт.
Исходные альдегид, коричную кислоту и амин получали от Aldrich, BDH, Fluorochem, Fluka Lancaster Sepethesis, исключая следующие исходные соединения, получение которых описано ниже.
а) 4-трифторметоксибензойную кислоту (5 г) (ex Fluorochem в этаноле (100 мл) обрабатывали концентрированной серной кислотой (1 мл). После часов кипячения с обратным холодильником смесь концентрировали в вакууме, остаток обрабатывали обычным путем с получением этил-4-трифторметоксибензоата (5 г). ЯМР1Н: 8,90 2Н, (дублет (д)/, 7,22 (2Н, д), 4,37 /2H, квартет, (к)/, 1,40 3Н, /триплет(т)/.
Указанный сложный эфир (5 г) в дихлорметане (40 мл) в атмосфере азота при -20оС обрабатывали диизобутилалюминийгидридом (43 мл). После 18 ч при 25о С добавляли разбавленную соляную кислоту, смесь обрабатывали обычным путем, получая 4-трифторметоксибензиловый спирт. ЯМР1Н: 7,24 (2Н, д), 7,15 (2Н, д), 4,52 /2H, синглет (с)/, 3,37 (3Н, с).
Указанный спирт окисляли, используя условия Swern'a (оксалилхлорид, 2,05 мл; диметилсульфоксид, 3,33 мл, триэтиламин, 14,8 мл), в дихлорметане, получая 4-трифторметоксибензальдегид (4 г). ЯМР1Н: 10,04 (2Н, с), 7,98 (2Н, д), 7,35 (2Н, д).
b) 4-бром-2-фтортолуол (ex Fluorochem) в ледяной уксусной кислоте (88 мл) и уксусном ангидриде (89,7 г) охлаждали до -10оС. По каплям добавляли серную кислоту (11,7 г), поддерживая температуру реакции ниже -5оС. Триоксид хрома (14,7 г) добавляли порциями при 0оС, смесь выливали в лед (300 г) и обрабатывали обычным путем, получая диацетоксиметил-2-фтор-4-бромбензол.
Указанный диацетат в этаноле (30 мл) и воде (30 мл) обрабатывали концентрированной серной кислотой (3 мл). После нескольких часов кипячения с обратным холодильником раствор концентрировали, остаток обрабатывали обычным путем, получая 2-фтор-4-бромбензальдегид (4,89 г). ЯМР1Н: 10,3 (1Н, с), 7,5 /3Н, мультиплет (м)/.
с) 4-бром-3-фторбензальдегид получали аналогичным путем. К суспензии 4-хлор-3-трифторметиланилина (ex Fluorochem) (15,9 г) в воде (16 мл) добавляли концентрированную соляную кислоту (18 мл). Добавляли лед (30 г), смесь охлаждали до 0оС и обрабатывали раствором нитрита натрия (5,6 г) в воде (8 мл). Через 15 мин смесь делали нейтральной по конго-рот добавлением раствора ацетата натрия (8 г) в воде (10 мл). Раствор формальдоксима, приготовленный из гидрохлорида формальдоксима (ex Lancaster) (9,9 г) и ацетата натрия (ex BOH), в воде (57 мл), при 10оС обрабатывали сульфатом меди (2 г) (ex BDH) и сульфитом натрия (0,34 г), затем раствором ацетата натрия (55 г) в воде (60 мл). Ранее приготовленную смесь (содержащую производное анилина) добавляли по каплям при 10-15оС. После 1 ч при 15оС добавляли соляную кислоту (77 мл) и смесь обрабатывали обычным путем. Очистка дистилляцией (80оС, 0,5 мм рт. ст. ) давала 4-хлор-3-трифторметилбензальдегид (1,5 г).
е) К нафтойной кислоте (50 г) (ex Aldrich) в ледяной уксусной кислоте при нагревании с обратным холодильником добавляли несколько капель брома (ex BDH), а затем йод (0,5 г) (ex BDH). В течение 1 ч по каплям добавляли бром (15 мл). Смесь охлаждали до 25оС и перемешивали при этой температуре в течение 18 ч. Образовавшийся белый осадок отфильтровывали, растворяли в горячей воде и обрабатывали концентрированной соляной кислотой. Осадок отфильтровывали и сушили над пятиокисью фосфора (ex BDH), получая 5-бром-2-нафтойную кислоту (перекристаллизация из этанола) (28 г). Температура плавления - 261± 2оС. ЯМР1Н: (ДМСО, С С3), 8,60 (1Н, с), 8,00 (5Н, м), 7,40 (1Н, м).
Указанную кислоту (34 г) в этаноле (240 мл) обрабатывали концентрированной серной кислотой (0,5 мл) при нагревании с обратным холодильником в течение 6 ч. Дальнейшая обработка реакционной смеси, осуществленная обычным путем, давала этил-5-бром-2-нафтоат (23 г). Температура плавления: 52-54оС. ЯМР1Н: 8,63 (1Н, с), 7,80-8,35 (4Н, м), 7,43 /1Н, двойной дублет (дд)/, 4,50 (2Н, к), 1,48 (3Н, т).
П р и м е р 1. (+)-(2Е, 4Е) N-(1, 2-диметилпропил)-5-/транс-2-(4-бромфенил)циклопропил/ пента-2,4-диенамид (соединение I).
(i) 4-бромбензальдегид (9,25 г) растворяли в сухом дихлорметане (250 мл) при 25оС в атмосфере азота. Карбометоксиметилентрифенилфосфоран (17,4 г) (ex Lancaster) добавляли к раствору и полученный раствор перемешивали при 25оС в течение 18 ч. Растворитель удаляли в вакууме. Остаток промывали гексаном и отфильтровывали. После удаления гексана в вакууме получали этиловый эфир 4-бромкоричной кислоты (12,12 г). ЯМР1Н: 7,35 (5Н, м), 6,38 (1Н, д), 4,1 (2Н, к), 1, 35 (3Н, т).
(ii) Этиловый эфир 4-бромкоричной кислоты (12,12 г) растворяли в сухом дихлорметане (50 мл) в атмосфере азота и охлаждали до -20оС. По каплям добавляли диизобутилалюминийгидрид (100 мл 1М раствора в дихлорметане) (ex Aldrich). Раствору давали нагреться до 25оС, затем перемешивали в течение 18 ч, разделяли раствор между простым эфиром и разбавленной соляной кислотой. Органическую фазу промывали насыщенным раствором бикарбоната натрия, рассолом, сушили над сульфатом магния и концентрировали в вакууме, получая 3-(4-бромфенил)пропен-2-1-ол (8,9 г). ЯМР1Н: 7,28 (2Н, д), 7,05 (2Н, д), 6,45 (1Н, д), 6,25 (1Н, т), 4,25 (2Н, д), 2,0 (1Н, с).
(iii) Указанный спирт (1,07 г) суспендировали в гексане (50 мл) при комнатной температуре и охлаждали до -20оС в атмосфере азота. Диэтилцинк (ex Aldrich) (22,7 мл 1,1 М раствора в гексане) добавляли по каплям, затем добавляли дийодметан (ex Aldrich) (4,1 мл). Давали смеси медленно нагреться до 25оС, затем перемешивали в течение 18 ч. Добавляли насыщенный раствор хлорида аммония и экстрагировали смесь простым эфиром. Совмещенные эфирные экстракты промывали насыщенным раствором тиосульфата натрия сушили над сульфатом магния и удаляли растворители в вакууме. Хроматографическая очистка (силикагель, простой эфир/гексан) давала (+)-транс-2-(4-бромфенил)-1-оксиметилциклопропан (0,53 г). ЯМР1Н: 7,38 (2Н, д), 6,95 (2Н, д), 3,65 (2Н, д), 1,8 (1Н, м), 1,55 (1Н, с), 1,44 (1Н, м), 0,95 (2Н, м).
(iv) Оксалилхлорид (ex Aldrich) (0,22 мл) растворяли в дихлорметане (3 мл) и охлаждали до -70оС в атмосфере азота. По каплям добавляли раствор диметилсульфоксида (ex BDH) (0,36 мл) в дихлорметане (1 мл). Через 5 мин добавляли указанный спирт (0,53 г) в дихлорметане (4 мл) и перемешивали суспензию при -70о, С в течение 30 мин. Добавляли триэтиламин (ex Aldrich) (1,6 мл) и давали смеси нагреться в течение 1 ч до 0оС. Дальнейшая обработка полученной смеси, осуществленная обычным путем, давала (± )-транс-/2-(4-бромфенил)циклопропил/-ме-таналь, который был использован непосредственно. ЯМР1Н: 9,4 (1Н, д), 7,33 (2Н, д), 6,9 (2Н, д), 2,54 (1Н, м), 2,20 (1Н, м), 1,0-1,9 (2Н, м).
(v) Раствор диизопропиламида лития в сухом тетрагидрофуране, приготовленный из н-бутиллития (ex Aldrich) (1,6 мл) и диизопропиламина (ex Aldrich) (0,4 мл), обрабатывали при -60оС в атмосфере азота раствором триэтил-4-фосфонокротоната (0,58 г) в тетрагидрофуране. Через 2 ч при -60оС добавляли указанный альдегид (0,52 г). После 18 ч при 25оС смесь разделяли между простым эфиром и водой, эфирную фракцию обрабатывали так, как описано выше. Хроматографическая очистка (силикагель, простой эфир/гексан) давала (± )-этил-5-/транс-2-(4-бромфенил)-циклопропил/пента-2,4-диеноат (0,36 г). ЯМР1Н: 7,4 (2Н, д), 7,26 (1Н, дд), 6,93 (2Н, д), 6,28 (1Н, дд), 5,80 (1Н, д), 5,76 (1Н, дд), 4,20 (2Н, к), 2,05 (1Н, м), 1,75 (1Н, м), 1,35 (2Н, м), 1,30 (3Н, т).
(vi) Указанный сложный эфир (0,18 г) в сухом толуоле добавляли при -10оС к комплексу, приготовленному из триметилалюминия (ex Aldrich) (0,62 мл 2М раствора в толуоле) и 1,2-диметилпропиламина (ex Aldrich) (0,55 г в сухом толуоле). Полученную смесь нагревали с обратным холодильником в течение 3 ч, обрабатывали 2н. соляной кислотой и отделяли органический слой, который далее обрабатывали так, как это описано выше. Хроматографическая очистка (силикагель, простой эфир/гексан) давал соединение, указанное в заглавии примера 1, в количестве 0,096 г. Тонкослойная хроматография (силикагель, этилацетат: гексан, 3: 7) Rf 0,25, т. пл. 141,9-143,2оС.
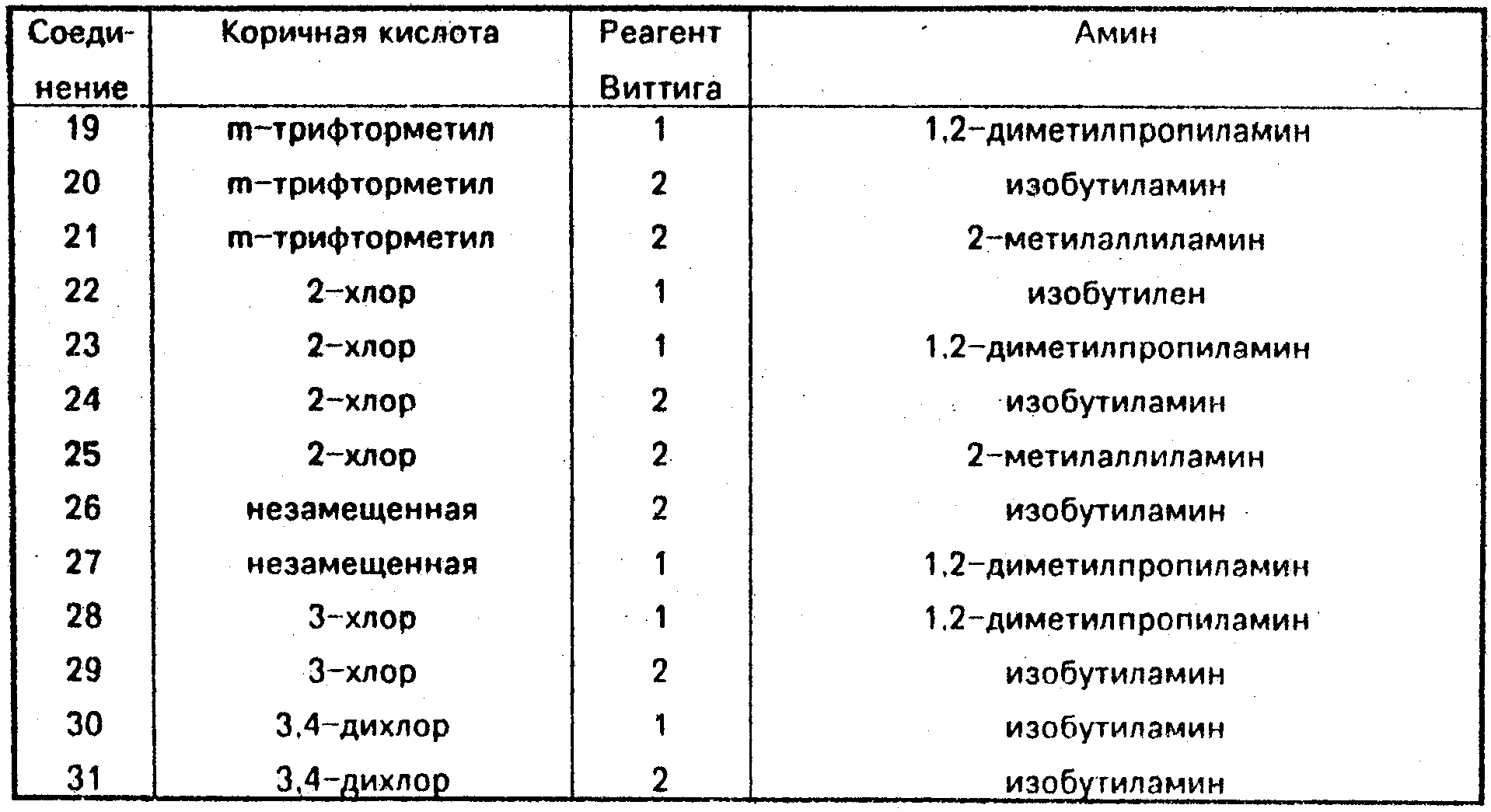
Соединения 2-17, 63, 64, 99 и 100,
полученные
аналогичным путем с использованием соответствующих, указанных ниже альдегида, реагента Виттига и амина, приведены ниже: Соединение Название соединения
2 (±)-(2Е, 4Е)
N-изобутил-5-/транс- -2-(4-бромфенил)циклопро-
пил/пента-2,4-диенамид
3 (±)-(2Е, 4Е) N-(1,2-диметилпро- пил)-5-/транс-2-(3,5-бистри-
фторметилфенил) цикло-
пропил/пента-2,4-диенамид
4 (±)-(2Е, 4Е) N-(1,2-димети-
лпропил)-5-/транс-2-(2-наф-
тил)циклопропил/пента-2,4-
-диенамид
5 (±)-(2Е, 4Е)
N-неопентил-5-
-/транс-2-(2-нафтил)цикло-
пропил/пента-2,4-диенамид
6 (±)-(2Е/Z, 4Е) N-изобутил-
-3-метил-5-/транс-2-(2-нафтил)
циклопропил/пента-2,
4-диенамид
7 (±)-(2Е, 4Е) N-неопентил-5-
-/транс-2-(4-бромфенил)-цикло-
пропил/пента-2,4-диенамид
8 (±)-(2Е/Z, 4Е) N-изобутил-
-3-метил-5-/транс-2-(4-бром-
фенил)циклопропил/пента-
-2,4-диенамид
9 ( ±)-(2Е/Z, 4E) N-изобутил-3-метил-
-5-/транс-2-(3,5-бис-трифторметил-
фенил)циклопропил/пента- 2,4-дие-
намид
10 (±)-(2Е, 4Е) N-(1,2-диметилпро-
пил)-5-/транс-2-(4-трифторметил-
фенил)циклопропил/пента -2,4-
- диенамид
11 (±)-(2Е, 4Е) N-Изобутил-5-
-/транс-2-(4-трифторметилфенил)
циклопропил/-3-метил-пента-
-2,4-диенамид
12 (±)-(2Е, 4Е) N-(1,
2-диметил-
пропил)-5-/транс-2-(4-метокси-
фенил)циклопропил/пента-
-2,4-диенамид
13 (±)-(2Е, 4Е) N-(1,2-диметил-
пропил)-5-/транс-2-(4-трифтор-
метоксифенил)циклопропил/пен-
та- 2,4-диенамид
14 (±)-(2Е, 4Е) N-(1,2-диметил-
пропил)-5-/транс-2-(4-бром-2-
-фторфенил)циклопропил /пен-
та-2,
4-диенамид
15 (±)-(2Е, 4Е) N-изобутил-3-ме-
тил-5-/транс-2-(2-фтор-4-бром-
фенил)циклопропил/пента- 2,4-
-диенамид
16 (±)-(2Е, 4Е) N-(1,
2-диметилпро-
пил)-5-/транс-2-(4-бром-3-фтор-
фенил)циклопропил/пента- 2,4-
-диенамид
17 (±)-(2Е, 4Е) N-изобутил-3-ме-
тил-5-/транс-2-(4-бром-3-фтор-
фенил)циклопропил/пента-2,4-
- диенамид
63 (±)-(2Е, 4Е) N-(1,2-диметил-
пропил)-5-/транс-2-(4-хлор-3-
-трифторметилфенил)цикло-
пропил /пента-2,4-диенамид
64 (±)-(2Е, 4Е) N-изобутил-3-ме-
тил-5-/транс-2-(4-хлор-3-трифтор-
метилфенил)циклопропил /пен-
та-2,4-диенамид
99 (±)-(2Е, 4Е) N-изобутил-3-метил-
-5-/транс-2-(5-бром-2-нафтил)
циклопропил/пента-2,4-диенамид
100 (±)-(2Е, 4Е)
N-(2-метилпропе-
нил-2)-3-метил-5/транс-2-(5-бром-
-2-нафтил) циклопропил/пента-
-2,4-диенамид
П р и м е р 2 (+)-(2Е, 4Е)
N-изобутил-5-транс-2-(3-трифторметилфенил)циклопропил пента-2,
4-диенамид (соединение 18).
(i) Раствор m-трифторметилкоричной кислоты (10,4 г) в этаноле (120 мл) нагревали с обратным холодильником в присутствии серной кислоты (6 мл) в течение 8 ч. После удаления растворителя в вакууме и обработки, осуществленной обычным путем, получали этиловый эфир m-трифторметилкоричной кислоты (12,1 г). ЯМР1Н: 7,58 (4Н, м), 6,4 (1Н, д), 4,25 (2Н, к), 1,3 (3Н, т).
(ii-vi) Данное соединение превращали в конечный продукт по аналогии со стадиями (ii)-(vi) примера 1, только вместо 1,2-диметилпропиламина использовали изобутиламин.
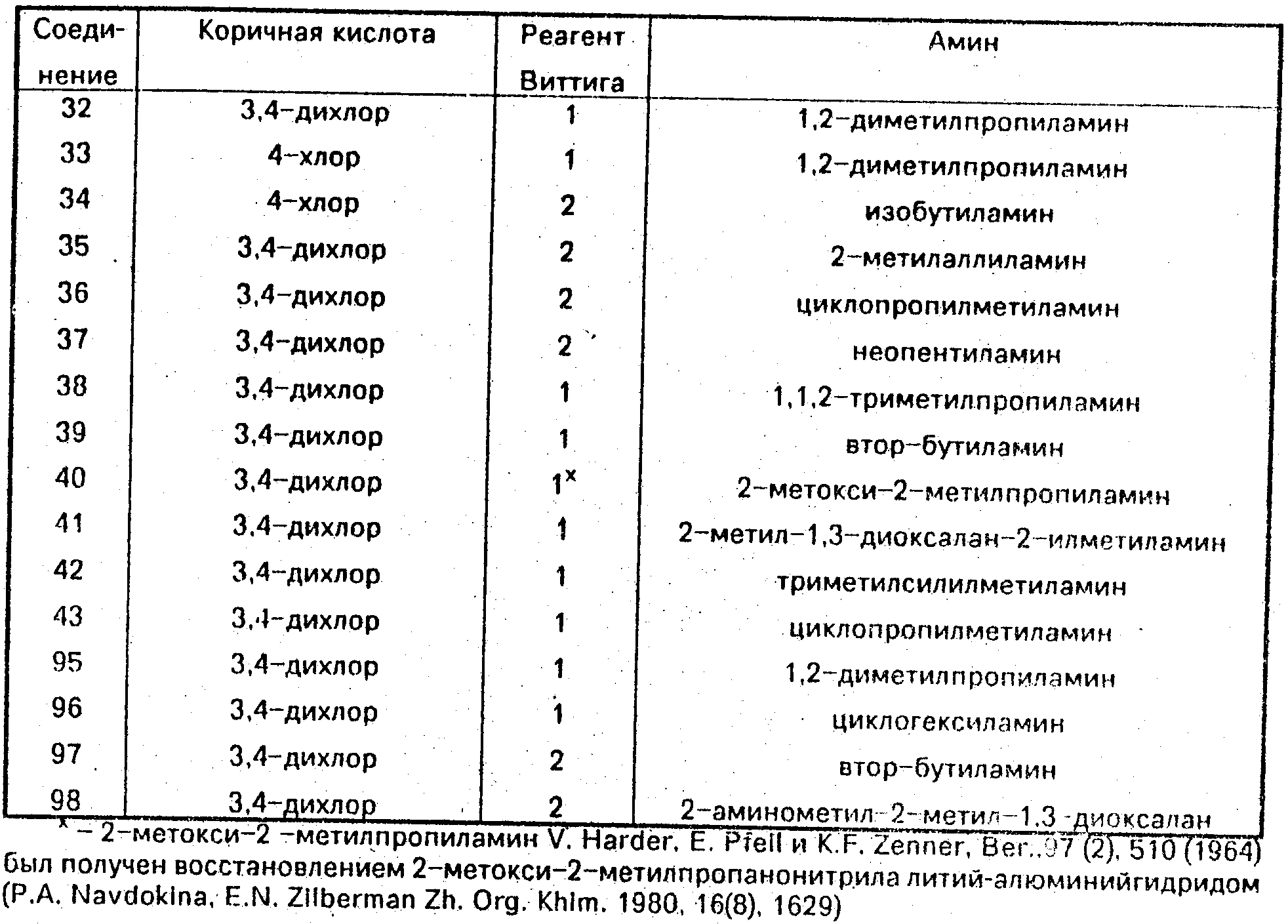
Соединения 19-43 и 95-98 получали аналогичным путем, используя производное коричной кислоты, реагент Виттига и амин,
указанные ниже. Соединение Название соединения
19 (±
)-(2Е, 4Е) N-(1,2-диметилпро-
пил)-5-/транс-2-(3-трифторметил-
фенил)циклопропил /пента-2,4-ди-
енамид
20 (±)-(2Е/Z, 4Е) N-изобутил-3-ме-
тил-5-/транс-2-(3-трифторметил-
фенил)циклопропил /пента-2,4-
-диенамид
21 (±)-(2Е/Z, 4Е)
N-(2-метилпропе-
нил-2)-3-метил-5-/транс-2- (3-три-
фторметилфенил)циклопро-
пил/пента-2,4-диенамид
22 (±)-(2Е, 4Е) N-изобутил-5-
/транс-2-(2-хлорфенил)-циклопро-
пил /пента-2,4-диенамид
23 (±
)-(2Е, 4Е) N-(1,2-диметилпро-
пил)-5-/транс-2-(2-хлорфенил)
циклопропил/пента-2,4-диенамид
24 (±)-(2Е/Z, 4Е) N-изобутил-3-ме-
тил-5-/транс-2-(2-хлорфенил)
цикло-
пропил/пента-2,4-диенамид
25 (±)-(2Е/Z, 4Е) N-(2-метилпропе-
нил-2-)-3-метил-5-/транс-2-(2- хлор-
фенил)циклопропил/пента-2,4-
-диенамид
26 (±)-(2Е, 4Е) N-изобутил-3-метил-
-5-/транс-2-фенилциклопропил /
пента-2,4-диенамид
27 (±)-(2Е, 4Е) N-(1,2-диметилпро-
пил)-5-/транс-2-фенилциклопро-
пил/пента-2,4-диенамид
28 (±)-(2Е, 4Е) N-(1,2-диметилпро-
пил)-5-/транс-2-(3-хлорфенил)
циклопропил/пента-2,4-диенамид
29 (±)-(2Е, 4Е) N-изобутил-3-метил-
-5-/транс-2-(3-хлорфенил) цикло-
пропил/пента-2,
4-диенамид
30 (±)-(2Е, 4Е) N-изобутил-5-/транс-
-2-(3,
4-дихлорфенил) циклопро-
пил/пента-2,4-диенамид
31 (±)-(2Е/Z, 4Е) N-изобутил-3-метил-
5-/транс-2-(3,4-дихлорфенил)цикло-
пропил/пента- 2,4-диенамид
32 (±)-(2Е, 4Е) N-(1,2-диметилпро-
пил)-5-/транс-2-(3,4-дихлорфенил)
циклопропил/ пента-2,
4-диенамид
33 (±)-(2Е, 4Е) N-(1,2-диметилпропил)-
-5-/транс)-2-(4-хлорфенилцикло-
пропил/ пента-2,4-диенамид
34 (±)-(2Е/Z, 4Е) N-изобутил-3-ме-
тил-5-/транс-2-(4-хлорфенил) цикло-
пропил/2,4-диенамид
35 (±)-(2Е/Z, 4Е) N-(2-метилпропе-
нил-2)-3-метил-5-/транс-2-(3,4-
-дихлорфенил)
циклопропил/
пента-2,4-диенамид
36 (±)-(2Е, 4Е) N-циклопропилме-
тил-5-/транс-2-(3,4-дихлорфенил)
циклопропил/-3-метил- пента-2,4-
-диенамид
37 (±)-(2Е, 4Е) N-(2,2-диметилпро-
пил)-3-метил-5-/транс-2-(3,4-ди-
хлорфенил) циклопропил/-3-метил-
-пента-2,4-диенамид
38 (±)-(2Е, 4Е) N-(1,1,
2-триметил-
пропил)-5-/транс-2-(3,4-дихлор-
фенил)циклопропил/пента- 2,4-
-диенамид
39 (±)-(2Е, 4Е) N-(2-бутил)-5-/транс-
-2-(3,
4-дихлорфенил)циклопро-
пил/пента-2,4- диенамид
40 (±)-(2Е, 4Е) N-(2-метокси-2-метил-
пропил)-5-/транс-2-(3,4-дихлор-
фенил)циклопропил /пента-2,4-
-диенамид
41 (±)-(2Е, 4Е) N-(2-метил-1,3-ди-
оксолан-2-илметил)-5-/транс-
-2- (3,
4-дихлорфенил)циклопро-
пил/пента-2,4-диенамид
42 (±)-(2Е,
4Е) N-(триметилсилилме-
тил)-5-/транс-2-(3,4-дихлорфенил)
циклопропил /пента-2,4-диенамид
43 (±)-(2Е, 4Е) N-циклопропилме-
тил-5-/транс-2-(3,
4-дихлорфенил)
циклопропил /пента-2,4-диенамид
95 (±)-(2Е, 4Е) N-(2,2-диметилпро-
пил)-5-/транс-2-(3,4-дихлорфенил)
циклопропил /пента-2,4-диенамид
96 (±)-(2Е, 4Е) N-циклогексил-5-/транс
-2-(3,4-дихлорфенил)циклопропил/
пента- 2,
4-диенамид
97 (±)-(2Е, 4Е) N-(2-бутил)-3-метил-
-5-/транс-2-(3,
4-дихлорфенил)
циклопропил/пента-2,4-диенамид
98 (±)-(2Е, 4Е) N-(2-метил-1,3-ди-
оксолан-2-илметил)-3-метил-5-
-/транс-2-(3,4- дихлорфенил)цикло-
пропил/пента-2,4-диенамид
П р и м е р 3. (±)-(2Е, 4Е) N-(1,2-диметилпропил)-5-/цис/транс-2-(2,
2-дибромэтенил)циклопропил /пента-2,4-диенамид (соединение 44).
(i) К раствору цис/транс (3: 1) этил-2-формилциклопропилкарбоксилата (1,42 г) (ex Aldrich) в дихлорметане в атмосфере азота добавляли при комнатной температуре трифенилфосфин (ex Aldrich) (12 г) и четырехбромистый углерод (6,6 г) (ex Aldrich). Раствор перемешивали при комнатной температуре в течение 3 ч перед его разделением между простым эфиром и водой. После обработки, осуществленной обычным способом, трифенилфосфиноксид удаляли фильтрованием, после чего хроматографическим путем выделяли этил-2-(2, 2-дибромэтенил)циклопропилкарбоксилат (2,9 г). ЯМР1Н: 5,92 (1Н, д), 4,16 (2Н, к), 2,44-0,95 (4Н, м), 1,26 (3Н, т).
(ii) Указанный сложный эфир (1,8 г) в дихлорметане охлаждали до -20оС и по каплям добавляли диизобутилалюминийгидрид (12 мл 1М раствора в гексане). Раствор нагревали до 0оС и выдерживали при этой температуре перед добавлением 2н. соляной кислоты с последующей обработкой полученной смеси, которую осуществляли обычным путем. В результате получали 2-(2,2-дибромэтенил)-1-оксиметилциклопропан (1,58 г). ЯМР1Н: 6,0, 5,7 (1Н, д), 3,44 (2Н, д), 2,52 (1Н, с), 1,8-1,0 (2Н, м), 0,8 (2Н, м).
(iii) Указанный спирт (1,58 г) окисляли, используя условия Swern'a (оксалилхлорид, 0,6 мл; диметилсульфоксил, 1,0 мл; триэтиламин, 4 мл) в дихлорметане с получением 2-(2,2-дибромэтенил) циклопропилметаналь, который непосредственно использовали в следующей стадии. ЯМР1Н: 9,6, 9,43 (1Н, д), 5: 80 (1Н, д), 2, 46 - 1,82 (2Н, м), 1,82-1,0/2Н, м).
(iv) Раствор диизопропиламида лития, полученного из н-бутиллития (2,3 мл 1,6 М раствор в гексане) и диизопропиламина (0,55 мл), в сухом тетрагидрофуране, обрабатывали при -60оС триэтилфосфонокротонатом (0,85 г) в ТГФ в атмосфере азота. После выдерживания в течение 2 ч при -60оС к раствору добавляли указанный альдегид. После выдерживания в течение 18 ч при 25оС, смесь разделяли между простым эфиром и водой и обрабатывали обычным путем. Хроматографической очисткой (силикагель, простой эфир/гексан) получали (+)-(2Е, 4Е)-этил-5-/цис/транс-2-(2,2-дибромэтенил)циклопропил/цента-2,4-диеноат (1, 223 г). ЯМР1Н: 7,24 (1Н, дд), 6,28 (1Н, дд), 5,87 (1Н, д), 5,80 (1Н, д), 5,67 (1Н, дд), 4,20 (2Н, к), 1,76 (2Н, м), 1,30 (3Н, т), 1,15 (М).
(v) К раствору указанного сложного эфира (1,233 г) в этаноле (5 мл) и воде (2 мл) добавляли гидроокись калия (0,25 г). Полученный раствор перемешивали в течение 18 ч перед удалением этанола в вакууме. После добавления разбавленной 2н. соляной кислоты проводили экстракцию простым эфиром, сушили над сульфатом магния и концентрировали в вакууме, получая (±)-(2Е, 4Е)-5-/цис/транс-2-(2, 2-дибромэтенил)циклопропил/пента-2,4-диеновую кислоту (0,74 г). ЯМР (С3О): 7,30 (1Н, дд), 6,45 (1Н, дд), 6,15 (1Н, д), 5,88 (1Н, д), 5,00 (1Н, с), 1,92 (2Н, м), 1,28 (2Н, м).
(vi) Указанную кислоту (0,32 г) растворяли в дихлорметане (5 мл) и добавляли триэтиламин (0,14 мл). Добавляли фенил-N-фенил-фосфорамидохлоридат (ex Lancaster). Через 30 минут выдерживания при комнатной температуре добавляли 1,2-диметилпропиламин (0,087 г) и триэтиламин (0,14 мл). Раствор перемешивали в течение 18 часов при комнатной температуре перед обработкой, которую осуществляли обычным путем. Хроматографической очисткой (силикагель, простой эфир/гексан) получали соединение, название которого указано в заглавии примера 3.
П р и м е р 4. (±)-(2Е, 4Е) N-(1,2-диметилпропил)-5-(транс-2,2-дифтор-3-фенилциклопропил)пента-2,4-диена мид (соединение 45).
Этерификацию коричной кислоты (7,4 г) проводили обычным путем (этанол, 120 мл; концентрированная серная кислота, 6 мл) с получением этилового эфира коричной кислоты (8,5 г). ЯМР1Н: 7,55 (1Н, д), 7,15 (5Н, м), 6,2 (1Н, д), 4,05 (2Н, к), 1,15 (3Н, т). Указанный эфир (3, 52 г) обрабатывали диизобутилалюминигидридом (40 мл 1М раствора в гексане) в дихлорметане (40 мл) обычным путем, получая 3-фенил-пропен-2-1-ол (2,8 г). ЯМР1Н: 7,2 (5Н, м), 6,55 (1Н, д), 6,35 (1Н, т), 4,25 (2Н, д), 1,97 (1Н, с).
Указанный спирт (2,05 г) в пиридине (1,6 мл) перемешивали с уксусным ангидридом (1,8 г) при 25оС в течение 3 ч перед разделением смеси между простым эфиром и разбавленной соляной кислотой. Последующей обработкой, осуществленной обычным путем, получили 3-фенил-пропенил-2-ацетат. (2,2 г) ЯМР1Н: 7,15 (5Н, м), 6,52 (1Н, д), 6,22 (1Н, т), 4,57 (2Н, д), 2,00 (3Н, с). Указанный ацетат (1,65 г) растворяли в диглиме (ex Aldrich) и добавляли хлордифторацетат натрия (ex Fluorochem) (8,4 г) при 25оС в атмосфере азота. Раствор нагревали до 180оС и выдерживали при этой температуре в течение получаса. После охлаждения до 40оС добавляли следующую порцию хлордифторацетата натрия (6,2 г) и снова нагревали смесь до 180оС, выдерживая при этой температуре еще полчаса. Смесь охлаждали и разбавляли гексаном. Органическую фазу промывали водой, сушили над сульфатом магния и удаляли растворитель в вакууме. Хроматографической очисткой (силикагель; простой эфир/гексан) получали транс-2, 2-дифтор-3-фенилциклопропилметилацетат (1,56 г).
ЯМР1Н: 7, 30 (5Н, м), 4,37 (1Н, дд), 4,26 (1Н, д), 2,67 (1Н, дд), 2,29 /1Н, тройной дублет (тд)/, 2,13 (3Н, с). Указанный ацетат (1,56 г) перемешивали в течение 18 ч в водном метаноле (10 мл) с углекислым калием (2,94 г). Дальнейшей обработкой, осуществленной обычным путем, получали 2,2-дифтор-3-фенилциклопропилметанол. (1,08 г) ЯМР1Н: 7,30 (5Н, м), 3,94 (2Н, м), 2,63 (1Н, м), 2,24 (1Н, м), 1,67 (1Н, с). Указанный спирт (0,55 г) перемешивали в дихлорметане (6 мл) при 25оС и добавляли пиридиндихромат (2 г) (ex Aldrich) и молекулярные сита 3 ADot (ex В1 Н) (1,5 г). После тречасового выдерживания при комнатной температуре смесь разбавляли простым эфиром и фильтровали через силикагель, промывая простым эфиром. После удаления растворителя в вакууме получали 2, 2-дифтор-3-фенилциклопропилметаналь (0,255 г). ЯМР1Н: 9,49 (1Н, дд), 7,2-7,65 (5Н, м), 3,61 (1Н, тд), 2,955 (1Н, тд). Раствор диизопропиламида лития, полученного из н-бутиллития (1 мл 1,6 М раствора в гексане) и диизопропиламина (0,24 мл), в сухом тетрагидрофуране обрабатывали при -60оС триэтилфосфонокротонатом (0,375 г) в ТГФ в атмосфере азота. После 2 ч выдерживания при -60оС добавляли указанный альдегид (0,255 г). После 18 ч выдерживания при 25оС смесь разделяли между простым эфиром и водой и далее обрабатывали обычным путем. Хроматографическая очистка (силикагель; простой эфир/гексан) давала (±)-(2Е, 4Е)-этил-5-/транс-2, 2-дифтор-3-фенилциклопропил/пента-2,4-диеноат, который превращали в целевое соединение по аналогии со стадией (vi) примера 3.
П р и м е р 5. (±)-(2Е, 4Е) N-(1, 2-диметилпропил-5-/транс-2,2-дифтор-3-(4-бромфе-нил)циклопропил/пента- 2,4-диенамид (соединение 46).
3-(4-бромфенил)пропен-2-1-ол (2,13 г (см. пример 1) реагировал с уксусным ангидридом обычным путем с образованием 3-(4-бромфенил)пропенил-2-ацетата (2,25 г), ЯМР1Н: 7,35 (2Н, д), 7,08 (2Н, д), 6,52 (1Н, д), 6,10 (1Н, дт), 4,65 (2Н, д), 2,1 (3Н, с). Указанный ацетат (2,25 г) реагировал обычным путем с хлордифторацетатом натрия с образованием транс-2, 2-дифтор-3-(4-бромфенил)циклопропилметилацетата (2,39 г). ЯМР1Н: 7,48 (2Н, д), 7,1 (2Н, д), 4,30 (2Н, м), 2,62 (1Н, дд), 2,23 (2Н, м), 2,12 (3Н, с).
Указанный ацетат (2,39 г) реагировал обычным путем с углекислым калием 2,36 г с образованием 2, 2-дифтор-3-(4-бромфенил)циклопропилметанола (1,93 г). ЯМР1Н: 7,3 (2Н, д), 7,0 (2Н, д), 3,8 (2Н, м), 3,18 (1Н, с), 2, 55 (1Н, м), 2,1 (1Н, м). Вышеуказанный спирт (1,93 г) превращали в целевое соединение способом, аналогичным описанному в стадиях (iii)-(vi) примера 3.
(±)-(2Е, 4Е) N-изобутил-3-метил-5-/транс-2,2-дифтор-3-(4-бромфенил)цикло-пропил/пента -2, 4-диенамид (соединение 47) получали аналогичным способом, используя триэтил-3-метилфосфонокротонат и изобутиламин.
П р и м е р 6. (±)-(2Е, 4Е) N-(1,2-диметилпропил)-6-/цис, транс-2, (3-трифторметил- фенил)циклопропил /гекса-2,4-диенамид (соединение 48).
(i) Бутин-4-он (0,31 г) нагревали при 60оС в течение одного часа с трибутилоловогидридом (ex Aldrich) (1,6 г) и изобисизобутиронитрилом (0,04 г) (ex Aldrich). Охлаждением и дистилляцией (Кugelrohr 150о, 1 мм рт. ст. ) получали 4-трибутилоловобутен-3-1-ол (1,17 г) в виде смеси 1: 1 транс: цис изомеров олефина. (I. K. Stille, Ang. Chem. , Int. Ed. Engl. 1986, 25, 508). ЯМР1Н: 5,95 (2Н, м), 3,60 (2Н, м), 2,3 (2Н, м), 0,9-2,0 (21Н, м).
(ii) Бис-ацетонитрилпалладийдихлорид (0,01 г) растворяли в сухом диметилформамиде (10 мл) при 25оС в атмосфере аргона. Добавляли 3-трифторметилиодбензол (1,03 г (ex Fluorochem) в ДМФА, после чего добавляли указанный спирт (1,17 г). После выдерживания в течение 72 ч раствор разделяли между простым эфиром и 10% -ным раствором гидроокиси аммония, и затем обрабатывали обычным путем.
Хроматографической очисткой (силикагель, простой эфир/гексан) получали 4-(3-трифторметилфенил)бутен-3-1-ол (0,67 г) в виде смеси 1: 1 цис: транс изомеров олефина (I. K. Stille and B. L. Groh, I. Am. Chem. Soc. , 109, 1987, 815). ЯМР1Н: 7,5 (4Н, м), 6,55 (1Н, д), 6,32 (1Н, дт), 3,78 (2Н, м), 2,55 (2Н, м), 1,50 (1Н, с).
(iii-vi) Указанный спирт превращали в целевое соединение по аналогии со стадиями (iii)-(vi) примера 1.
П р и м е р 7. (±)-(Е) N-(1, 2-диметилпропил)-3-/цис-2 (3-трифторметилфенил)циклопропил/пропен-2-амид (соединение 49).
(i) Этилпропионат (0,98 г) (ex Lancaster) и трибутиловогидрид (3,01 г) с азобисизобутиронитрилом (0,01 г) нагревали при 60оС в течение 18 ч. Охлаждением и хроматографической очисткой (силикагель, простой эфир/гексан) получали (Z)-этил-3-трибутилоловопропеноат (1,9 г) I. K. Stille et al. , I. Amer. Chem. Soc. 109, 1987, 815). ЯМР1Н: 7,14 (1Н, д), 6,73 (1Н, д), 4,22 (2Н, к), 1,38 (18Н, м), 0,9 (12Н, м).
(ii) Указанный сложный эфир (0,78 г) растворяли в дихлорметане (4 мл) и охлаждали до -20оС в атмосфере азота. По каплям добавляли диизобутилалюминийгидрид (4 мл 1М раствора в гексане). После 18 ч выдерживания при 25оС аккуратно добавляли разбавленную соляную кислоту, после чего обрабатывали смесь обычным путем, получая 3-трибутилолово-пропен-2-1-ол (0,75 г). ЯМР1Н: 6,72 (1Н, дт), 6, 10 (1Н, д), 4,15 (2Н, дд), 1,40 (18Н, м), 0,90 (9Н, м).
(iii-v) Указанный спирт (0,75 г) превращали в (±)-цис-2-(3-трифторметилфенил)-1-формилциклопропан (0,2 г) способом, аналогичным стадии (ii) примера 6 и стадиям (iii) и (iv) примера 1. ЯМР1Н: 8,95 (1Н, д), 7,50 (4Н, м), 1,0-2,5 (4Н, м).
(vi) Указанный альдегид (0,2 г) перемешивали в дихлорметане (5 мл) с карбоэтоксиметилентрифенилфосфораном в атмосфере азота в течение 18 ч при 25оС, после концентрирования в вакууме остаток промывали гексаном, и после удаления гексана в вакууме получали (±)-(Е)-этил-3-/цис-2-(3-трифторметилфенил)циклопропан/пропен-2-оат (0,18 г). ЯМР1Н: 7,43 (4Н, м), 6,18 (1Н, дд), 5,94 (1Н, д), 4,06 (2Н, к), 2,62 (1Н, м), 2,09 (1Н, м), 1,55 (1Н, м), 1,34 (1Н, м), 1,22 (3Н, т).
(vii) Указанный эфир превращали в целевое соединение по аналогии со стадией (vi) примера 1.
П р и м е р 8. (± )-(2Е, 4Е) N-(1,2-диметилпропил)-5-/цис, транс-2 (3-трифторметилфенил)циклопропил/пента-2,4-диенамид (соединение 50).
(± )-(Е)-этил-3-/цис-2-(3-трифторметилфенил)циклопропил/пропен-2-оат (0,18 г) (пример 7) растворяли в дихлорметане (3 мл) и охлаждали до -20оС в атмосфере азота. Добавляли диизобутилалюминийгидрид (1,3 мл 1М раствора в гексане) и раствор перемешивали при 25оС в течение 18 ч. Аккуратно добавляли разбавленную соляную кислоту, после чего обрабатывали смесь обычным путем, получая цис-2-(3-трифторметилфенил)-2-(3-оксипропен-2-1-ил)циклопропан (0,15 г). ЯМР1Н: 7,43 (4Н, м), 5,79 (1Н, дт), 4,98 (1Н, дд), 3,95 (2Н, д), 2, 40 (1Н, м), 1,94 (1Н, м), 1,33 (1Н, м), 1,10 (2Н, м).
Указанный спирт (1,35 г) окисляли, используя способ Swern'a (оксалилхлорид, 0,54 мл; диметилсульфоксид, 0,86 мл; триэтиламин, 3,8 мл), в дихлорметане, получая цис-2-(3-трифторметилфенил)-1-(1-пропен-3-аллил)циклопропан (1,3 г). ЯМР1Н: 9,21 (4Н, д), 7,50 (4Н, м), 6,28 (1Н, дд), 5,98 (1Н, дд), 2,79 (1Н, м), 2,12 (1Н, м), 1,68 (1Н, м), 1, 42 (1Н, м).
Указанный альдегид (1,3 г) реагировал с карбоэтоксиметилентрифенилфосфораном (1,74 г) по аналогии с примером 7 (vi) с образованием (±)-(2Е, 4Е)-этил-5-/цис-2, (3-трифторметилфенил)-циклопропил/пента-2,4-диеноата (1,1 г). ЯСР1Н: 7,42 (4Н, м), 7,05 (1Н, дд), 6,31 (1Н, дд), 5,73 (1Н, д), 5,31 (1Н, дд), 4,17 (2Н, к), 2,56 (1Н, м), 2,03 (1Н, м), 1, 48 (1Н, м), 1,25 (4Н, м). Указанный сложный эфир превращали в целевое соединение по аналогии с примером 1 (vi) с образованием смеси состава 6: 1 цис-транс циклопропильных изомеров.
(±)-(2Е, 4Е) N-изобутил-5-/цис, транс-2 (3-трифторметилфенил)-циклопропил/пента-2,4-диенамид (соединение 51) получали аналогичным способом в виде смеси цис: транс циклопропильных изомеров состава 4: 1, используя изопропиламин вместо 1,2-диметилпропиламина.
П р и м е р 9. (±)-(2Е, 4Е) N-(1,2-диметилпропил)-5-/цис, транс-2, (4-хлорфенил)-2-метилциклопропил/пента-2, 4-диенамид (соединение 52).
К раствору изопропилциклогексиламида лития (получен из 12,5 мл 1,6М раствора н-бутиллития и изопропилциклогексиламина (3,3 мл) (ex Aldrich)/в ТГФ добавляли при -60оС этилтриметилсилилацетат (3,6 мл) (ex Fluka). После 30 мин выдерживания при -60оС добавляли 4-хлорацетофенон (ex Aldrich) (1,55 г). После 18 ч выдерживания при 25оС смесь разделяли между простым эфиром и водой и обрабатывали обычным путем. Хроматографической очисткой (силикагель, простой эфир/гексан) получали этил-3-(4-хлорфенил)-бутен-2-оат (1,22 г) в виде смеси Е, Z изомеров олефина состава 1: 1, ЯМР1Н: 7,2 (4Н, м), 6,0 и 5,0 (1Н, м), 4,12 (2Н, м), 2,51 и 1,90 (3Н, с), 1,25 (3Н, м). Указанный сложный эфир (1,44 г) растворяли в дихлорметане (13 мл) и охлаждали до -20оС. По каплям добавляли диизобутилалюминийгидрид (12,8 мл 1М раствора в гексане). После выдерживания в течение 18 ч при 25оС аккуратно добавляли разбавленную соляную кислоту и обрабатывали полученную смесь обычным путем, получая 3-(4-хлорфенил)бутен-2-1-ол. ЯМР1Н: 7,18 (4Н, с), 5,85 (1Н, т), 4,25 (2Н, д), 3,05 (1Н, с), 2, 05 (3Н, с). Вышеуказанный спирт превращали в целевое соединение способом, аналогичным стадиям (iii)-(vi) примера 1.
П р и м е р 10. (±)-(2Е, 4Е) N-(1, 2-диметилпропил)-5-/транс-2,2-диметил-3-(3-трифторметилфенил)циклопропи л /пента-2,4-диенамид (соединение 53).
Этиловый эфир 3-трифторметилкоричной кислоты (0,98 г) (пример 2) в тетрагидрофуране в атмосфере азота обрабатывали илидом, полученным из изопропилтрифенилфосфониййодида (2,12 г) и н-бутиллития (2,8 мл). После 20 ч выдерживания при 80оС смесь обрабатывали обычным путем. Хроматографической очисткой (силикагель, простой эфир/гексан) получали (±)-н-бутил-/транс-3-(3-трифторметилфенил)-2, 2-диметилциклопропил/-формат (0,78 г). ЯМР1Н: 7, 22 (4Н, м), 4,20 (2Н, м), 2,72 (1Н, м), 2,00 (1Н, м), 1,40 (7Н, м), 0,89 (6Н, м).
Указанный сложный эфир (0,78 г) растворяли в дихлорметане (12 мл) в атмосфере азота и охлаждали до -20оС. По каплям добавляли диизобутилалюминийгидрид (7,4 мл) и перемешивали раствор при 25оС в течение 18 ч. Аккуратно добавляли разбавленную соляную кислоту, после чего обрабатывали полученную смесь обычным путем, получая (±)-/транс-3-(3-трифторметилфенил)-2,2-диметилциклопропил/метанол (0,31 г). ЯМР1Н: 7,5 (4Н, м), 3,65 (2Н, д), 2,55 1Н, (широкий (ш) с), 1,62 (1Н, д), 1,14 (1Н, м), 1,15 (3Н, с), 0,90 (3Н, с).
Указанный спирт превращали в целевое соединение способом, аналогичным стадиям (iv)-(vi) примера 1.
(±)-(2Е, 4Е) N-(1,2-диметилпропил)-5-/транс-2,2-диметил-3-(3,4-дихлорфенил) циклопропил/пента-2,4-диенамид (соединение 54) получали аналогичным способом, исходя из этилового эфира 3, 4-дихлоркоричной кислоты.
П р и м е р 11. (±)-(2Е, 4Е) N-(1, 2-диметилпропил)-5-/транс-2-(4-хлорфенил)-1-метилциклопропил/цента- 2,4-диенамид (соединение 55).
4-хлорбензальдегид (6,8 г) (ex Aldrich) в дихлорметане (250 мл) реагировал с карбоэтоксиметилентрифенилфосфораном (17,5 г) (ex Lancaster) при 25оС в течение 18 ч. Проводили концентрирование в вакууме, затем обильно промывали остаток гексаном. Собранные гексановые промывки концентрировали, получая (Е)-этил-3-(4-хлорфенил)-2-метилпропен-2-оат (11,6 г).
ЯМР1Н: 7,35 (4Н, м), 4,25 (2Н, к), 2,05 (3Н, с), 1,31 (3Н, т). Указанный сложный эфир (11,7 г) растворяли в дихлорметане (100 мл) и охлаждали до -20оС. По каплям добавляли диизобутилалюминийгидрид (100 мл). После 18 ч выдерживания при 25оС аккуратно добавляли разбавленную соляную кислоту. Полученную смесь обрабатывали обычным путем, получая (Е)-3-(4-хлорфенил)-2-метилпропен-2-1-ол (8,6 г). ЯМР1Н: 7,34 (2Н, д), 7,22 (2Н, д), 6,49 (1Н, с), 4,19 (1Н, с), 1,90 (3Н, с), 1,66 (1Н, с).
Указанный спирт обрабатывали диэтилцинком (45,5 мл) и дийодметаном (8,1 мл) в гексане обычным способом, получая (± )-/транс-2-(4-хлорфенил)-1-метилциклопропил/метанол (1,94 г). ЯМР1Н: 8,94 (1Н, с), 7,30 (2Н, д), 7,06 (2Н, д), 2,68 (1Н, дд), 2,24 (1Н, дд), 1,46 (1Н, дд), 0,98 (3Н, ). Данный продукт был превращен в целевое соединение способом, аналогичным стадиям (iv)-(vi) примера 3.
П р и м е р 12. (-) N-изобутил-5-/1S, 2R)-транс-2-(3,4-дихлорфенил)циклопропил/пента-2,4-диенамид (соединение 56).
3-(3,4-дихлорфенил)пропен-2-1-ол (1,0 г) получен по аналогии со стадией (i) примера 2 и стадией (ii) примера 1) окисляли, используя способ Swern'a (оксалилхлорид, 0,5 мл; диметилсульфоксид, 0,7 мл; триэтиламин, 3,4 мл), получая 3-(3,4-дихлорфенил)-пропен-2-аль (0,9 г), ЯМР1Н: 9,76 (1Н, д), 7,53 (3Н, м), 7,41 (1Н, д), 6,68 (2Н, дд).
Указанный альдегид (0,66 г) перемешивали в этаноле (5 мл) с триэтилортофоматом (0,6 мл) (ex Aldrich) и нитратом аммония (ex Aldrich) (0,01 г) в течение 3,5 ч при 25оС. Концентрированием в вакууме и обработкой обычным путем получали Е-1-(3,4-дихлорфенил)-3,3-диэтоксибутен-I (0,97 г). ЯМР1 Н: 7,32 (3Н, м), 6,79 (1Н, д), 6,19 (1Н, дд), 5,08 (1Н, д), 3,69 (4Н, м), 1,29 (6Н, м).
Указанную ацеталь (0,67 г) растворяли в бензоле (25 мл) и обрабатывали (+)-L-диизопропилтартратом (0,7 г) (ex Aldrich) и п-толуолсульфокислотой (0,01 г) (ex Aldrich). Смесь нагревали при 80оС в течение 6 ч, используя прибор Дина-Старка. Раствор охлаждали и обрабатывали обычным путем, получая (-)-4,5-дикарбоизопропокси-2-/(Е)-2-(3,4-дихлорфенил)этенил/-1, 3-диоксолан (0,92 г). ЯMР1Н: 7,50 (1Н, д), 7,40 (1Н, д), 7,25 (1Н, дд), 6,74 (1Н, д), 6, 26 (1Н, дд), 5,81 (1Н, д), 5,14 (2Н, м), 4,77 (1Н, д), 4,69 (1Н, д), 1,33 (12Н, м).
Указанная ацеталь (0,9 г) реагировала с диэтилцинком (11 мл) и дийодметаном (1,8 мл) в гексане обычным путем, давая (-)-4,5-дикарбоизопропокси-2-/транс-(2R, 3R)-2-(3,4-дихлорфенил)циклопропил-1/-1, 3-диоксолан (0,8 г). [α ] D-96,1о(с 0,96, этанол). ЯМР1Н: 7,21 (1Н, д), 7,13 (1Н, д), 6,85 (1Н, дд), 5,05 (1Н, д), 5,02 (2Н, м), 4,65 (1Н, д), 4,52 (1Н, д), 2,08 (1Н, дд), 5,05 (1Н, д), 5,02 (2Н, м), 4,65 (1Н, д), 4,52 (1Н, д), 2,08 (1Н, м), 1,47 (1Н, м), 1,21 (12Н, м), 1,14 (1Н, м), 0,92 (1Н, м).
Указанную ацеталь (0,8 г) нагревали при 70оС в течение 12 ч в тетрагидрофуране (5 мл) в присутствии разбавленной соляной кислоты (3 мл). Обработкой смеси обычным путем получали (-)-/транс-(2R, 3S)-2-(3,4-дихлорфенил)циклопропил/-метаналь (0,23 г). ЯМР1Н: 9,39 (1Н, д), 7,39 (2Н, м), 6,94 (1Н, дд), 2,56 (1Н, м), 1,65 (2Н, м).
Диизопропиламид лития, полученный из н-бутиллития (0,6 мл) и диизопропиламина (0,14 мл), обрабатывали при -60оС в среде тетрагидрофурана триэтил-4-фосфонокротонатом (0, 21 г) в тетрагидрофуране; обработку проводили в атмосфере азота. После 2 ч обработки при -60оС добавляли указанный альдегид. После выдерживания в течение 18 ч при 25оС добавляли воду и обрабатывали смесь обычным путем. Хроматографической очисткой (силикагель, гексан/простой эфир) получали (-)-(2Е, 4Е)-этил-5-/транс-(2R, 3S)-2-(3,4-дихлорфенил)циклопропил/пента-2,4-диеноат (0, 16 г). [α ] D - 304,7о (с 0,9, этанол), ЯМР1Н: 7,28 (3Н, м), 6,88 (1Н, дд), 6,18 (1Н, дд), 5,84 (1Н, дд), 5,78 (1Н, д), 4,10 (2Н, к), 1,90 (2Н, м), 1,20 (5Н, м).
Указанный эфир превращали в целевое соединение способом, аналогичным стадии (s) примера 1.
(+)-N-изобутил-5-/(1R, 2S)-транс-2-(3,4-дихлорфенил)циклопропил/пента-2,4-диенамид (соединение 57) получали аналогичным способом, используя (-)-D-диизопропилтартрат (ex Aldrich).
П р и м е р 13. (±)-(2Е, 4Е) N-изобутил-5-/транс-2-(2, 6-дихлор-4-пиридил)циклопропил/-3-метилпента- 2,4-диенамид (соединение 58).
2,6-дихлоризоникотиновую кислоту (4,0 г) (приготовленную согласно M. M. Robinson, I, Amer. Chem. Soc. , 80, 5481, 1958) растворяли в этаноле (20 мл) и концентрированной серной кислоте (1 мл). После 6 ч нагревания при 80оС раствор охлаждали, концентрировали в вакууме и остаток обрабатывали обычным путем, получая этил-2,6-дихлоризоникотинат (3,7 г). ЯМР1Н: 7,84 (2Н, с), 4,48 (2Н, к), 1,48 (3Н, т).
Указанный сложный эфир растворяли в дихлорметане (60 мл) и охлаждали до -20оС в атмосфере азота. По каплям добавляли диизобутилалюминийгидрид (38 мл). После выдерживания в течение 2 ч при 0оС к смеси добавляли разбавленную соляную кислоту, полученную смесь далее обрабатывали обычным путем, получая 2,6-дихлор-4-оксиметилпиридин. ЯМР 1Н: 7,64 (2Н, с), 4,98 (2Н, с).
Указанный спирт (1,2 г) окисляли в условиях Swern'a (оксалилхлорид, 0,33 мл; диметилсульфоксид, 0,54 мл; триэтиламин, 2,35 мл), получая (2,6-дихлор-4-пиридил)метаналь (1,2 г). ЯМР1Н: 10,02 (1Н, с), 7,68 (2Н, с).
Указанный альдегид (1,2 г) растворяли в дихлорметане (40 мл) и добавляли карбоэтоксиметилентрифенилфосфоран (2,4 г). После 18 ч выдерживания при 25оС раствор концентрировали в вакууме и остаток промывали гексаном. Собранные гексановые промывки концентрировали в вакууме, получая этил-3-(2,6-дихлор-4-пиридил)пропеноат (1,2 г). ЯМР1Н: 7,50 (2Н, д), 2,28 (2Н, с), 6,52 (2Н, д), 4,29 (2Н, к), 1,32 (3Н, т).
Указанный сложный эфир (0,25 г) добавляли при 25оС в атмосфере азота в диметилсульфоксиде (4 мл) к илиду, полученному из триметилсульфоксониййодида (0,24 г) и гидрида натрия (0,44 г 60% -ной дисперсии в минеральном масле). После выдерживания в течение 18 ч при 25о к смеси аккуратно добавляли воду, полученную смесь обрабатывали обычным путем. Хроматографической очисткой (простой эфир/гексан, силикагель) получали (±)-этил-/транс-2-(2, 6-дихлор-4-пиридил)циклопропил/формиат (0,12 г). ЯМР1 Н: 6,93 (2Н, с), 4,16 (2Н, к), 2,42 (1Н, тд), 1,99 (1Н, тд), 1,69 (1Н, тд), 1,30 (2Н, м), 1,25 (3Н, т).
Указанный сложный эфир (0,34 г) растворяли в дихлорметане (7 мл) в атмосфере азота и охлаждали до -20оС. По каплям добавляли диизобутилалюминийгидрид (2,8 мл). Через 0,5 ч добавляли метанол (0,5 мл), затем - 2М гидроокись натрия (5 мл). Полученную смесь далее обрабатывали обычным путем. ЯМР1Н: 6,98 (2Н, с), 3,64 (2Н, м), 3,30 (1Н, шс), 0,9-2,0 (4Н, м). Полученный спирт (0,21 г) окисляли, используя условия Swern'a (оксалилхлорид, 0,1 мл; диметилсульфоксид, 0,15 мл; триэтиламин, 0,66 мл), получая (±)-/транс-2-(2,6-дихлор-4-пиридил)циклопропил/метаналь (0,2 г). ЯМР1Н: 9,44 (1Н, д), 6,96 (2Н, с), 1,0-2,6 (4Н, м).
Раствор диизопропиламида лития в тетрагидрофуране (2 мл), полученный из н-бутиллития (0,7 мл) и диизопропиламина (0,16 мл), обрабатывали при -60оС триэтил-4-фосфоно-3-метилкротонатом (0,26 г). После выдерживания смеси в течение 2 ч при -60оС к ней добавляли указанный альдегид (0,2 г). После выдерживания в течение 2,5 ч при 25оС к полученной смеси добавляли воду, после чего проводили обработку обычным путем. Хроматографической очисткой (силикагель, простой эфир/гексан) получали (±)-(2Е, 4Е)-этил-3-метил-5-/транс-2-(2,6-дихлор-4-пиридил)циклопропил/пента-2,4-диен оат (0,18 г). ЯМР1Н: 6,92 (2Н, с), 6,22 (1Н, д), 5,75 (2Н, м), 4,14 (2Н, к), 2,24 (3Н, с), 1,94 (2Н, м), 1,41 (1Н, м), 1,28 (1Н, м), 1,22 (3Н, т).
Указанный сложный эфир превращали в целевое соединение по аналогии со стадией (vi) примера 1.
П р и м е р 14. (±)-(2Е, 4Е) N-(1,2-диметилпропил)-5-/транс-2-(3,4-дибромфенил)циклопропил//пента-2,4- диенамин (соединение 59).
3-нитро-4-бромтолуол (54 г) (ex Lancaester) в смеси этанол-вода (100 мл, 1: 1) интенсивно перемешивали при 25оС и добавляли порошкообразное железо (84 г) (ex BDH). Полученную смесь нагревали с обратным холодильником до кипения и в течение 30 мин по каплям добавляли раствор хлористого водорода (2,19 г) в смеси вода-этанол (50 мл, 1: 1). После 4 ч кипячения с обратным холодильником смесь охлаждали, подщелачивали 15% -ным раствором гидроокиси калия и фильтровали через цеолит, промывая этанолом (2х50 мл). Полученную смесь разбавляли водой (1000 мл) и обрабатывали обычным путем, получая 3-амино-4-бромтолуол (43,6 г). ЯМР1Н: 7,25 (1Н, д), 6,40 (2Н, м), 3,96 (2Н, сс), 2,2 (3Н, с).
Указанный аминотолуол (24 г) перемешивали в концентрированной бромистоводородной кислоте (230 мл) при 0оС. Добавляли раствор нитрита натрия (9,8 г (ex BDH) в воде (35 мл), поддерживая температуру реакции между 0 и 5оС. Смесь выливали в раствор бромида меди (37 г) (ex BDH) в воде (230 мл) и бромистоводородной кислоте при 50оС. После выдерживания в течение 2 ч при 50оС и 18 ч при 25оС к смеси добавляли воду и полученную смесь обрабатывали обычным путем. После очистки дистилляцией (100оС, 0,5 мм рт. ст. ) получали 3,4-дибромтолуол (12,7 г). ЯМР1Н: 7,53 (2Н, м), 6,95 (1Н, дд), 2,30 (3Н, с). Раствор указанного производного толуола (5 г) в деляной уксусной кислоте (20 мл) (ex BDH) и уксусном ангидриде (32,6 г) охлаждали до -10оС. По каплям добавляли серную кислоту (7,8 г), поддерживая температуру реакции ниже -5оС. Порциями добавляли триоксид хрома (ex BDH) (6 г), поддерживая температуру реакции между -5 и 0оС. После выдерживания в течение 15 мин при 0оС смесь выливали на лед (150 г) и далее обрабатывали обычным путем, получая диацетоксиметил-3,4-дибромбензол. ЯМР1Н: 7,53 (2Н, м), 6,95 (1Н, дд), 2,30 (6Н, с).
Указанный диацетат растворяли в смеси вода (15 мл) - этанол (15 мл) и добавляли концентрированную серную кислоту (1,5 мл). После кипячения с обратным холодильником в течение 1 ч раствор обрабатывали обычным путем, получая 3,4-дибромбензальдегид (2, 25 г). ЯМР1Н: 10,04 (1H, с), 7,53 (2Н, м), 6,95 (1Н, дд). Указанный альдегид (2,25 г) растворяли в дихлорметане (25 мл) и добавляли карбоэтоксиметилентрифенилфосфоран (2,96 г). После выдерживания в течение 18 ч при 25оС раствор концентрировали в вакууме и остаток промывали гексаном. Собранные гексановые отмывки концентрировали в вакууме, получая этил-3-(3, 4-дибромфенил)пропеноат (2,4 г). ЯМР1Н: 7,7 (2Н, м), 7,50 (1Н, д), 7,15 (1Н, дд), 6,32 (1Н, д), 4,26 (2Н, к), 1,33 (3Н, т).
Указанный сложный эфир (2,4 г) растворяли в дихлорметане (25 мл) в атмосфере азота и охлаждали раствор до -20оС, после чего по каплям добавляли диизобутилалюминийгидрид (14,5 мл). После выдерживания в течение 18 ч при 25оС аккуратно добавляли к смеси разбавленную соляную кислоту, полученную смесь обрабатывали обычным путем, получая 3-(3,4-дибромфенил) пропен-2-1-ол. (2,04 г). ЯМР1Н: 7,53 (2Н, м), 7,13 (1Н, дд), 6,56 (1Н, д), 6,20 (1Н, дт), 4,30 (2Н, д), 1,98 (1Н, с).
Указанный спирт (2 г обрабатывали в гексане диэтилцинком (35 мл) и дийодметилом (15,52 мл) обычным способом, получая (±)-/транс-2-(3, 4-дибромфенил)циклопропил/метанол (1,3 г). ЯМР1Н: 7,40 (1Н, д), 7,30 (1Н, д), 6,76 (1Н, дд), 3,53 (2Н, д), 2,30 (1Н, с), 1,68 (1Н, м), 1,33 (1Н, м), 0,87 (2Н, м).
Указанный спирт превращали в целевое соединение по аналогии со стадиями (iv)-(vi) примера 1.
(i) (±)-(2Е, 4Е) N-изобутил-3-метил-5-/транс-2-(3, 4-дибромфенил)циклопропил/пента-2,4-диенами д (соединение 60) и (ii) (±)-(2Е, 4Е) N-(2-метилбутенил-2)-3-метил-5-/транс-2- (3,4-дибромфенил)циклопропил/пента-2,4-диенамид (соединение 93) получали аналогичным способом, используя триэтил-3-метилфосфонокротонат и (i) изобутиламин и (ii) 2-метилпропенил-2-амин соответственно.
П р и м е р 15. (±)-(2Е, 4Е) N-1, 2-диметилпропил)-5-/транс-2-(3, 5-дихлор-4-бромфенил)циклопропил/пента- 2,4-диенамид (соединение 61).
N-аминобензонитрил (11,8 г) (Aldrich) в сухом хлороформе (250 мл) в атмосфере азота обрабатывали хлористым сульфурилом (4,05 г), (ex BDH), поддерживая температуру реакции ниже 35оС. После 2 ч кипячения с обратным холодильником смесь выливали на лед и подщелачивали 2М раствором гидроокиси натрия. Дальнейшей обработкой обычным способом получали 3,5-дихлор-4-аминобензонитрил (18,2 г). ЯМР1Н: 7,35 (2Н, с), 4,70 (2Н, шс).
Указанный аминонитрил (18,7 г) в концентрированной бромистоводородной кислоте (190 мл) обрабатывали при 0оС раствором нитрита (7,6 г) в воде (30 мл). Полученную смесь выливали в раствор бромида меди (28, 7 г) в воде (180 мл) и бромистоводородной кислоте (30 мл) при 50оС. После 2 ч выдерживания при 50оС и 18 ч выдерживания при 25оС смесь разбавляли водой и далее обрабатывали обычным путем, получая 3,5-дихлор-4-бромбензонитрил (9,2 г). ЯМР1Н: 7,63 (2Н, с). Указанный нитрил (5 г) в простом эфире (100 мл) в атмосфере азота обрабатывали диизобутилалюминийгидридом (22 мл 1М раствора в толуоле). После выдерживания в течение 18 ч при 25оС к смеси добавляли 1,4-диоксан (150 мл) и воду (10 мл) и затем разбавленную соляную кислоту (250 мл). После 30 мин выдерживания при 25оС полученную смесь обрабатывали обычным путем, получая 3,5-дихлор-4-бромбензальдегид (4,52 г). ЯМР1Н: 9,89 (1Н, с), 7,85 (2Н, с).
Указанный альдегид превращали в целевое соединение по аналогии с примером 1.
(±)-(2Е, 4Е) N-изопропил-3-метил-5-/транс-2-(4-бромдд-3, 5-дихлордфенил)циклопропил/ пента-2,4-диенамид (соединение 62) получали аналогичным способом, используя триэтил-4-фосфоно-3-метилкротонат и изобутиламин.
П р и м е р 16. (± )-(2Е, 4Е) N-1,2-диметилпропил)-5-/транс-2-(2, 2-дибромэтенил)фенил)циклопропил/пента 2,4-диенамид (соединение 65). Этил-4-формилбензоат (2,46 г) (ex Lancaster) в дихлорметане (30 мл) обрабатывали в атмосфере азота трифенилфосфином (15,7 г) и четырехбромистым углеродом (9,9 г) при 0оС. После выдерживания смеси в течение 1,5 ч при 25оС к ней добавляли воду, полученную смесь обрабатывали обычным путем. Хроматографической очисткой (силикагель, простой эфир/гексан) получали этил-4-(2,2дибромэтенил)бензоат (3,32 г). ЯМР1Н: 8,0 (2Н, д), 7,50 (2Н, д), 7,45 (1Н, с), 3,85 (3Н, с).
Указанный сложный эфир (3,32 г) в дихлорметане (10 мл) обрабатывали в атмосфере азота диизобутилалюминийгидридом (21 мл). После выдерживания в течение 1 ч при 0оС добавляли разбавленную соляную кислоту, полученную смесь обрабатывали обычным путем, получая 4-(2,2-дибромэтенил) бензиловый спирт (3,18 г). ЯМР1Н: 7,50 (2Н, д), 7,41 (1Н, с), 7, 20 (2Н, д), 4,33 (2Н, с), 3,65 (1Н, с).
Указанный спирт (3,18 г) окисляли, используя условия Swern'a (оксалилхлорид, 0,96 мл; диметилсульфоксид, 1,56 мл; триэтиламин, 6,9 мл), в среде дихлорметана, получая 4-(2,2-дибромэтенил)бензальдегид (2,04 г). ЯМР1Н: 10,94 (1Н, с), 7,86 (2Н, д), 7,61 (2Н, д), 7,45 (1Н, с).
Указанный альдегид превращали в (± )-(2Е, 4Е)-этил-5-/транс-(4-(2,2-диброэтенил)фенил)циклопропил/пента-2,4-диеноат по аналогии со стадиями (i)-(v) примера 1. Полученный слождный эфир превращали в целевое соединение по аналогии со стадиями (v) и (vi) примера 3.
П р и м е р 17. (±)-(2Е, 4Е) N-(1,2-диметилпропил)-5-/транс-2-(4-этинилфенил)циклопропил/пента-2,4- диенамид (соединение (66)
(±
)-транс-2-/4-(2,2-дибромэтенил) фенил/циклопропилметанол (1,43 г) (получен так же, как в примере 16) обрабатывали в сухом тетрагидрофуране в атмосфере азота при -40оС н-бутиллитием (8,1
мл). После выдерживания смеси в течение 4 ч при 25оС добавляли воду, и полученную таким образом смесь обрабатывали обычным способом. Хроматографической очисткой (силикагель, простой
эфир/гексан) получали (±)-транс-2-(4-этинилфенил)циклопропанметанол (0,62 г). ЯМР1Н: 7,41 (2Н, д), 6,90 (2Н, д), 3,30 (2Н, д), 2,95 (1Н, с), 2,59 (1Н, с), 1,85 (1Н, м), 1,34 (1Н,
м),
0,90 (2Н, м).
Указанный спирт превращали в целевое соединение по аналогии с примером 1.
П р и м е р 18. (±)-(2Е, 4Е) N-(1,2-диметилпропил)-5-/транс-2-(3,4, 5-трифенил)циклопропил/пента-2,4-диена мид (соединение 67) 4-амино-3,5-дихлорбензонитрил превращали в целевое соединение по аналогии с примером 15, используя вместо бромистоводородной кислоты и бромида меди соляную кислоту и хлорид меди (ex BDH).
(±)-(2Е, 4Е) N-изобутил-3-метил-5-(транс-2-(3,4,5-трихлорфенил)циклопропил/пента-2,4-диен амид(соединение 68) получали аналогичным способом, используя триэтил-3-метилфосфонокротонат и изобутиламин.
П р и м е р 19. (±)-(2Е, 4Е) N-(1,2-диметилпропил)-4-фтор-5-/транс-2-(3, 4-дихлорфенил)циклопропил/пента- 2,4-диенамид (соединение 69).
Гидрид натрия (0,74 г 60% -ной дисперсии в минеральном масле) (ex BDH) в среде ТГФ (30 мл) обрабатывали этилфторацетатом (2,7 мл) (ex Lancaster) и диэтилоксалатом ((ex BDH) (3,8 мл). После 4 ч выдерживания при 80оС к смеси добавляли (±)-транс-2-(3,4-дихлорфенил)циклопропилметаналь (6 г) (пример 2) (i) и пример 1 (ii)-(iv). После 18 ч выдерживания при 25оС к смеси добавляли воду, полученную в результате смесь обрабатывали обычным способом. После хроматографической очистки (силикагель, гексан/простой эфир) получали (±)-этил-(2Z)-3-/транс-2-(3,4-дихлорфенил)циклопропил/-2-фторпентен-2-оат (4 г). ЯМР1Н: 7,30 (1Н, д), 7,15 (1Н, д), 6,90 (1Н, дд), 5,70 (1Н, дд), 4,30 (2Н, к), 2,08 (2Н, м), 1,35 (2Н, м), 1,30 (3Н, т).
Указанный сложный эфир (4 г) растворяли в дихлорметане (30 г) и охлаждали до -20оС в атмосфере азота. По каплям добавляли диизобутилалюминийгидрид (26 мл). После выдерживания в течение 18 ч при 25оС добавляли к смеси разбавленную соляную кислоту, полученную таким образом смесь обрабатывали обычным путем, получая (±)-(2Z)-3-/транс-2-(3,4-дихлорфенил)циклопропил/-2-фторпропен-2-1-ол (3,3 г). ЯМР1Н: 7,32 (1Н, д), 7,17 (1Н, д), 6,90 (1Н, дд), 4,10 (2Н, дд), 3,60 (1Н, т), 1,90 (2Н, м), 1, 20 (2Н, м).
Указанный спирт (3,3 г) окисляли, используя условия Swern'a (оксалилхлорид, 1,2 мл; диметилсульфоксид, 2,0 мл; триэтиламин, 8,8 мл), в среде дихлорметана, получая (± )-(2Z)-3-/транс-2-(3,4-дихлорфенил)циклопропил/-2-фторпропен-2-аль (3,25 г). ЯМР1Н: 9,20 (1Н, д), 7,39 (1Н, д), 7,22 (1Н, д), 6,95 (1Н, дд), 5,60 (1Н, дд), 2,20 (2Н, м), 1,50 (2Н, м).
Указанный альдегид (0,5 г) растворяли в дихлорметане (5 мл) в атмосфере азота и обрабатывали при 25оС карбоэтоксиметилентрифенилфосфораном (0,67 г). После выдерживания при 25оС в течение 18 ч раствор концентрировали в вакууме и остаток промывали гексаном. Собранные гексановые промывки концентрировали в вакууме, получая (± )-(2Е, 4Z)-этил-4-фтор-5-/транс-2-(3,4-дихлорфенил)циклопропил/пента-2,4-диеноат (0,58 г). ЯМР1Н: 7,30 (1Н, д), 7,00 (3Н, м), 6,05 (1Н, д), 5,90 (1Н, м), 4,20 (2Н, к), 2,00 (2Н, м), 1,30 (3Н, т), 1,30 (2Н, м).
Указанный сложный эфир превращали в целевое соединение по аналогии со стадией (vi) примера 1.
П р и м е р 20. (±)-(2Е, 4Z) N-изобутил-3-метил-4-фтор-5-/транс-2-(3,4-дихлорфенил)циклопропил/пента- 2,4-диенамид (соединение 70).
(±)-(2Z)-2-фтор-3-/транс-2-(3,4 -дихлорфенил)циклопропил/пропен-2-аль (2, 59 г). (Пример 19) в простом эфире (10 мл) обрабатывали при 0оС в атмосфере азота метилмагниййодидом, полученным из магниевой стружки (0,26 г) и метилйодида (0,7 мл) в среде простого эфира (20 мл). После выдерживания в течение 18 ч при 25оС смесь обрабатывали обычным способом. Хроматографической очисткой (силикагель, простой эфир/гексан) получали (± )-(3Z)-4-/транс-2-(3, 4-дихлорфенил)циклопропил/бутен-3-2-ол (2,0 г). ЯМР1Н: 7,23 (1Н, д), 7,05 (1Н, д), 6,90 (1Н, дд), 4,52 (1Н, м), 4,23 (1Н, м), 3,0 (1Н, с), 1,80 (2Н, м), 1,35 (3Н, д), 1,18 (2Н, м).
Вышеуказанный спирт (2,0 г) окисляли, используя условия Swern'a (оксалилхлорид, 0,7 мл; диметилсульфоксид, 61 мл; триэтиламин, 5,1 мл), в среде дихлорметана, получая (± )-(3Z)-3-фтор-4-/транс-2-(3,4- дихлорфенил)циклопропил/бутен-3,2-он (1,5 г). ЯМР1Н: 7,30 (1Н, д), 7,10 (2Н, д), 6,95 (1Н, дд), 5,70 (1Н, дд), 2,32 (3Н, д), 2,10 (2Н, м), 1,43 (2Н, м).
Хлорацетилхлорид (ex Aldrich) (50 г) добавляли по каплям при перемешивании к изобутиламину (ex Aldrich) (70 мл) в среде сухого простого эфира (250 мл) при 0оС. Когда смесь нагревалась до комнатной температуры, ее обработали обычным способом, получив N-изобутил-2-хлорацетамид. Последнее соединение (20 г) нагревали в течение 3 ч при 120оС с триэтилфосфитом (23 г). Смесь подвергли дистилляции в вакууме, получив в результате N-изобутил-дифенилфосфоноацетамид (22,5 г, темп. кип. 140-142,5оС при 0,1 мм рт. ст. ).
Раствор диизопропиламида лития в тетрагидрофуране, полученный из н-бутиллития (2,3 мл) и диизопропиламина (0,51 мл), в атмосфере азота при -70оС обработали диэтил-N-изобутилфосфоноацетамидом (0,46 г) в сухом тетрагидрофуране. После 2 ч выдерживания смеси при 25оС к ней добавили указанный кетон (0,5 г). После выдерживания полученной смеси при 25оС в течение 18 ч добавили воду, смесь обработали обычным способом. После хроматографической очистки (силикагель, простой эфир/гексан) получили целевое соединение (0,24 г). (± )-(2Z, 4E) N-(2-метилпропенил)-3-метил-4-фтор-5-/транс-2-(3,4-дихлорфенил)циклопропил/ пента-2,4-диенамид (соединение 94) получали аналогичным способом, используя 2-метилпропенил-2-амин вместо изобутиламина.
П р и м е р 21. (±)-(2Е, 4Е) N-(1,2-диметилпропил)-5-/транс-2-(3-хлор-4-бромфенил)циклопропил/пента-2,4- диенамид (соединение 71).
Получали по аналогии с примером 14, используя соляную кислоту и хлорид меди вместо бромистоводородной кислоты и бромида меди.
(±)-(2Е, 4Е) N-изобутил-3-метил-5-/транс-2-(3-хлор-4-бромфенил)циклопропил/пента- 2,4-диенамид (соединение 72) получали аналогичным способом, используя триэтил-3-метил-4-фосфонокротонат и изобутиламин вместо триэтил-4-фосфонокротоната и 1,2-диметилпропиламина.
(±)-(2Е, 4Е) N-(1,2-диметилпропил)-5-/транс-2-(3-бром-4-хлорфенил)циклопропил/пента-2,4- диенамид (соединение 73) и (±)-(2Е, 4Е) N-изобутил-3-метил-5-/транс-2-(3-бром-4-хлорфенил)циклопропил/пента-2,4- диенамид (соединение 74) получали аналогичным способом, исходя из 4-хлор-3-нитротолуола.
П р и м е р 22. (±)-(2Е, 4Е) N-изобутил-3-метил-5-/транс-2-(4-бензилфенил)циклопропил/пента-2,4-диенамид (соединение 75).
Порошкообразный цинк (12,5 г (ex BDH) в воде (15 мл) при 25оС обрабатывали хлоридом ртути (1,25 г) (ex Aldrich). Добавили концентрированную соляную кислоту, избыток декантировали. Добавили 4-бензоилбензойную кислоту (5 г) (ex Lancaster), затем воду (15 мл), ледяную уксусную кислоту (2 мл) и толуол (15 мл). Добавили еще 20 мл концентрированной соляной кислоты. После 7 ч кипячения с обратным холодильником смесь фильтровали и промывали разбавленной соляной кислотой. Обработкой обычным путем получили 4-бензилбензойную кислоту (4 г). Указанную кислоту (4 г) растворяли в этаноле (50 мл) и обрабатывали концентрированной серной кислотой (0,5 мл). После 3 ч кипячения с обратным холодильником смесь концентрировали в вакууме и остаток обрабатывали обычным способом, получая этил-4-бензилбензоат (4 г). ЯМР1Н: 8,00 (2Н, дд), 7, 28 (7Н, м), 4,39 (2Н, к), 4,04 (2Н, с), 1,40 (3Н, т).
Указанный сложный эфир (4 г) в сухом простом эфире обрабатывали при 0оС в атмосфере азота литийалюминийгидридом (0,9 г). После 1 ч выдерживания при 0оС и 18 ч выдерживания при 25оС аккуратно добавляли воду и полученную смесь обрабатывали обычным путем, получая 4-бензилбензиловый спирт (2,52 г). ЯМР1Н: 7,21 (9Н, м), 4,53 (2Н, с), 3,95 (2Н, с), 2,10 (1Н, шс).
Указанный спир (2,52) окисляли, используя условия (оксалилхлорид, 1,2 мл; диметилсульфоксид, 1,8 мл; триэтиламин, 8,8 мл), в среде дихлорметана, получая 4-бензилбензальдегид (1,33 г). ЯМР1Н: 9,93 (1Н, с), 7,78 (2Н, д), 7,33 (2Н, д), 7,20 (5Н, с), 4,04 (2Н, с).
Указанный альдегид превращали в целевое соединение по аналогии с примером 15.
(±)-(2Е, 4Е) N-(1,2-диметилпропил)-5-/транс-2-(4-бензилфенил)циклопропил/пента-2,4- диенамид (соединение 76) получали аналогичным способом, используя триэтил-4-фосфонокротонат и 1,2-диметилпропиламин.
П р и м е р 23. (±)-(2Z, 4Е) N-изобутил-2-фтор-3-метил-5-/транс-2-(3, 4-дихлорфенил)циклопропил/пента- 2,4-диенамид (соединение 77).
Этилбромфторацетат (Fluorochem) (25 г) и триэтилфосфит (ex Aldrich) (29 г) нагревали вместе при 140± 5о С в течение 6 ч в емкости, снабженной ректификационной колонкой. После отгонки всего этилбромида остаток дистиллировали с получением триэтил-2-фтор-2-фосфоацетата (22 г) (темп. кип. 98-108о С при 0,8 мм рт. ст. ). Последний (20 г) по каплям добавляли к промытому гексаном гидриду натрия (3,3 г 60% -ной дисперсии) в сухом простом эфире (85 мл). После 3 ч выдерживания при комнатной температуре и 30 мин кипячения с обратным холодильником добавляли ацетон, полученную смесь перемешивали в течение 4 дней при комнатной температуре в атмосфере азота. После обработки, проведенной обычным способом, полученный сырой продукт дистиллировали, получая этил-2-фтор-3-метилбутен-2-оат (4 г) (темп. кип. 60± 2оС при 15 мм рт. ст. ) (Macleidt and Wessendorf, ann 674, 1, (1964)). Этил-2-фтор-3-метил-бутен-2-оат (4 г, 27,4 ммоль), N-бромсукцинимид (5,36 г, 30 ммоль) (ex Aldrich) и перекись бензоила (30 мг) подвергали совместному кипячению с обратным холодильником в среде тетрагидрофурана (60 мл) с одновременным освещением смеси ярким светом. По истечении 2 ч удаляли растворитель, переносили остаток в гексан, фильтровали через цеолит и концентрировали. Дистилляцией получали смесь (Е) и (Z) этил-4-бром-2-фтор-3-метил-бутен-2-оатов (4 г), которую кипятили с обратным холодильником в колбе Vigreaux с триэтилфосфитом (3,82 г, 23,07 ммоль) при 140-150оС. Через 2 ч кипячения полученный сырой продукт очищали перегонкой, получая триэтил-2-фтор-3-метил-4-фосфонокротонат (3,5 г, темп. кип. 160-170оС при 0,5 мм рт. ст. ). Раствор диизопропиламида лития, приготовленного из н-бутиллития (6,25 мл) и диизопропиламина (1,4 мл), в ТГФ (10 мл) при -70оС в атмосфере азота обрабатывали указанным фосфонокротонатом (2, 82 г). После 2 ч выдерживания при -70оС добавляли (±)-транс-2-(3,4-дихлорфенил) циклопропилметаналь (2,15 г). После 18 ч выдерживания при 25оС добавляли воду, полученную смесь обрабатывали обычным способом. После очистки хроматографированием (силикагель, простой эфир/гексан) получали (±)-(2Е, 4Е)-этил-2-фтор-3-метил-5-/транс-2-(3, 4-дихлорфенил)циклопропил/пента- 2, 4-диеноат (2,4 г). ЯМР1Н: 7,23 (1Н, д), 7,10 (1Н, д), 6,83 (1Н, дд), 6,75 (1Н, дд), 5,77 (1Н, дд), 4,28 (2Н, к), 2,27 (3Н, д), 1,87 (2Н, м), 1,33 (3Н, т), 1,33 (2Н, м).
Указанный сложный эфир превращали в целевое соединение по аналогии с примером 1.
(±)-(2Е, 4Е) N-(2-метилпропенил-2-)-2-фтор-3-метил-5-/транс-2-(3,4-дихлорфенил)циклопропи л/ пента-2,4-диенамид (соединение 78) получали аналогичным способом, используя 2-метилпропенил-2-амин вместо изобутиламина.
П р и м е р 24. (±)-(2Е, 4Е) N-1, 2-диметилпропил)-5-/r-1-фтор-с-2-(3,4,5-трихлорфенил)циклопропил)/ пента-2,4-диенамид (соединение 79) получали из сложного эфира - (Z)-этил-3-(3,4,5-трихлорфенил)-2-фторпропен-2-оата- способом, аналогичным способу, описанному в примере 23. Указанный сложный эфир получали, обрабатывая суспензию гидрида натрия (0,33 г) в тетрагидрофуране (10 мл) диэтилоксалатом (1,83 г) и этилфторацетатом (1, 33 г) в атмосфере азота. После 4 ч кипячения с обратным холодильником к охлажденной смеси добавляли 3,4,5-трихлорбензальдегид (2,62 г) (приготовлен так же, как в примере 10). После 18 ч выдерживания при 25оС добавляли воду, полученную смесь обрабатывали обычным путем. Хроматографической очисткой (силикагель, гексан/простой эфир) получали (2,5 г). ЯМР1Н: 7,63 (2Н, с), 6,77 (1Н, д), 4,35 (2Н, к), 1,38 (3Н, т).
Следующие соединения были приготовлены, исходя из альдегида,
реагента Виттига и амида, указанных ниже: Соединение Название соединения
80
(±)-(2Е, 4Е) N-изобутил-3-метил-
5-/r-1-фтор-с-2-(3,4,5-трихлор-
фенил)циклопропил/ пента-2,4-ди-
енамид
81 (±)-(2Е, 4Е) N-(1,2-диметилпропил)-
-5/r-1-фтор-с-2-(3,4-дихлорфенил)-
циклопропил/ пента-2,4-диенамид
82
(±)-(2Е/Z, 4Е) N-(2-метилпропенил-
-2)-3-метил-5-/r-1-фтор-с-2-(3,4-ди-
бромфенил)циклопропил/ пента-
2,4-диенамид, смесь 2Е: 2Z изоме-
ров состава 5: 4
83 (±)-(2Е/Z, 4Е) N-изобутил-3-метил-
-5-/r-1-фтор-с-2-(3,4-дибромфенил)
циклопропил/пента-2,4-диена-
мид, смесь изомеров 2Е: 2Z сос-
тава 1: 1
84 (±)-(2Е, 4Е) N-(1,2-диметилпропил)-
-5-/r-1-фтор-с-2-(3,4-дибромфенил)
циклопропил/пента-2,4-диенамид
85 (±)-(2Е/Z, 4E) N-изобутил-5-/
r-1-фтор-с-2-(3,4-дихлорфенил)
циклопропил/ -3-метилпента-2,4-
-диенамид, смесь
изомеров 2Е,
4Е: 2Z, 4Е состава 4: 1
86 (±)-(2Е/Z, 4Е) N-(2,2-диметил-
пропил)-3-метил-5-/r-1-фтор-с-2-
-(3,4- дихлорфенил)циклопропил/-
-пента-2,
4-диенамид, смесь изо-
меров 2Е, 4Е: 2Z, 4Е состава 2: 1
87 (±)-(2Е/Z, 4E)
N-(2-метилпропе-
нил-2)-3-метил-5-/r-1-фтор-с-2-
-(3,4,5- трихлорфенил)цикло-
пропил/пента-2,4-диенамид
88 (±)-(2Z, 4E) N-изобутил-3-метил-
-5-/r-1-фтор-с-2-(3,4,5-трихлор-
фенил) циклопропил пента-
-2,4-диенамид
101
(±)-(2Е/Z, 4E) N-изобутил-3-ме-
тил-5-/r-1-фтор-с-2-(3-хлор-4-
бромфенил)циклопропил/пента-
-2,4-диенамид, смесь изомеров
2Е, 4Е: 2Z, 4Е состава 1: 1
102 (±)-(2Е/Z, 4E) N-(2-метилпропе-
нил-2)-3-метил-5-/r-1-фтор-с-2-(3-
-хлор-4-бромфенил) циклопро-
пил/пента-2,4-диенамид, смесь
изомеров 2Е, 4Е: 2Z, 4Е
состава 2: 1
103 (±)-(2Z, 4E)
N-(2-метилпропе-
нил-2)-3-метил-5-/r-1-фтор-с-2-
-(3-хлор-4-бромфенил) цикло-
пропил/пента 2,4-диенамид
104 (±
)-(2Е, 4Е) N-изобутил-2-фтор-
-3-метил-5-/r-1-фтор-с-2-(3-хлор-
-4-бромфенил) циклопропил/пен-
та-2,4-диенамид
105 (±)-(2Е/Z, 4E) N-(2-метилпропе-
нил-2-)-2-фтор-3-метил-5-/r-1-фтор-
-с-2-(3-хлор-4-бромфенил) цикло-
пропил/пента-2,4-диенамид
92 (±)-(2Е/Z, 4E) N-(2-метилпропе-
нил-2)-3-метил-5-/r-1-фтор-с-2-(3,4-
-дихлорфенил)
циклопропил/пен-
та-2,4-диенамид
109 (±)-(2Е/Z, 4Е) N-(2-бутил)-2-фтор-
-3-метил-5-/r-1-фтор-с-2- (3,
4-ди-
хлорфенил)циклопропил/пен-
та-2,
4-диенамид, смесь изомеров
2 Z: 2E состава 7: 1
110 (±)-(2Е/Z, 4Е) N-(2-метилпропе-
нил-2)-2-фтор-3-метил-5-/r-1-фтор-
-с-2-(3,4-дихлорфенил) цикло-
пропил/пента-2,4-диенамид,
смесь изомеров 2: 2Е состава 6: 1
111 (±)-(2E/Z, 4E)
N-изобутил-2-фтор-
-3-метил-5-/r-1-фтор-с-2-(3,4-ди-
хлорфенил)циклопропил/ пента-
-2,4-диенамид, смесь изомеров
2Z: 2E cостава 3: 1
112 (±)-(2Е/Z,
4E) N-(2-бутил)-3-метил
-5-/r-1-фтор-с-2-(3,4-дихлорфе-
нил)циклопропил/пента- 2,4-
-диенамид, смесь изомеров
2Е: 2Z состава 3: 2
113 (±)-(2Z, 4E)
N-(2-бутил)-3-ме-
тил-5-/r-1-фтор-с-2-(3,4-дихлорфе-
нил)циклопропил/ пента-2,4-ди-
енамид
114 (±)-(2Е/Z, 4E) N-(2-бутил)-3-ме-
тил-5-/r-1-фтор-с-2-(3,4- ди-
бромфенил)циклопропил/пен-
та-2,
4-диенамид, смесь изоме-
ров 2Е: 2Z состава 5: 1
115 (±)-(2E/Z, 4Е) N-изобутил-1-фтор-
-3-метил-5-/r-1-фтор-с-2 (3,4-ди-
бромфенил)циклопропил/пента-
-2,4-диенамид, смесь изомеров
2Z: 2E состава 6: 1
116 (±)-(2Е/Z, 4E) N-(2-метилпропе
- нил-2-)-2-фтор-3-метил-5-/r-1-фтор-
-с-2-(3,4-дибромфенил)
цикло-
пропил/пента-2,4-диенамид,
смесь изомеров 2Z: 2E состава 5: 1
117 (±)-(2Е/Z, 4E)
N-(2-бутил)-2-фтор-
-3-метил-5-/r-1-фтор-с-2-(3,4-ди-
бромфенил)циклопропил/ пента-
-2,4-диенамид, смесь изомеров
2Z: 2Е состава 5: 1
118 (±)-(2Е,
4Е) N-изобутил-5-/r-1-
-фтор-с-2-(3,4-дибромфенил)
циклопропил/пента-2,4-диенамид
П р и м е р 25. (±)-(2Е, 4Е) N-(1,2-диметилпропил)-5/r-1-хлор-с-2-(3,
4-дихлорфенил)циклопропил/пента -2,4-диенамид (соединение 89).
Карбоэтоксиметилентрифенилфосфоран (34,8 г) в дихлорметане (100 мл) обрабатывали при -70оС в атмосфере азота триэтиламистом углероде (100 мл) в течение 60 мин. Раствор нагревали до 25оС, добавляли воду, полученную смесь обрабатывали обычным путем, получая карбоэтоксихлорметилентрифенилфосфоран (18, 9 г) после перекристаллизации из смеси ацетон/гексан. Denney and Ross. , I. Org. Chem. , 1962, 27, 998). Карбоэтоксихлорметилентрифенилфосфоран (8,74 г) в дихлорметане (100 мл) обрабатывали в атмосфере азота при 25оС 3,4-дихлорбензальдегидом. После выдерживания при 25оС в течение 18 ч и удаления растворителя в вакууме проводили тритурацию из гексана, и гексановые промывки концентрировали в вакууме. Хроматографической очисткой (силикагель, простой эфир/гексан) получали этил-3-(3,4-дихлорфенил)-2-хлорпропен-2-оат (6,3 г). Указанный сложный эфир превращали в целевое соединение по аналогии с примером 24.
(±)-(2Е, 4Е) N-изобутил-3-метил-5-/r-1-хлор-с-2-(3,4-дихлорфенил) циклопропил/пента-2,4-диенамид (соединение 90) и (±)-(2Z, 4E) N-изобутил-3-метил-5-/r-1-хлор-с-2-(3,4-дихлорфенил)циклопропил/пента-2, 4- диенамид (соединение 91) получали аналогичным способом, используя триэтил-4-фосфоно-3-метилкротонат и изобутиламин вместо триэтил-4-фосфонокротоната и 1,2-диметилпропиламина.
П р и м е р 26. (±)-(2Е, 4Е) N-изобутил-5-/транс-2-(3,4-дихлорфенил)циклопропил/пента-2,4-диентиоамид (соединение 106).
Транс-2-(3,4-дихлорфенил)циклопропанметанметанол (3 г) (получен в примере 18) обрабатывали карбоэтоксиметилентрифенилфосфораном (4,85 г) в среде дихлорметана (30 мл). Концентрированием в вакууме и фильтрованием с последующим концентрированием получали (±)-этил-3-/транс-2-(3,4-дихлорфенил)циклопропил/пропен-2-оат (1,8 г).
Обработкой указанного сложного эфира (1, 8 г) диизобутилалюминийгидридом (12,6 мл 1М раствора в гексане) в среде дихлорметана получали, после обработки реакционной смеси обычным способом, (±)-3-/транс-2-(3,4-дихлорфенил) циклопропил/пропен-2-1-ол (1,33 г).
Указанный спирт (1,33 г) окисляли в условиях Swern'a (оксалилхлорид, 0,7 мл; диметилсульфоксид, 1,15 мл, триэтиламин, 3,8 мл) в среде дихлорметана, получая (±)-3-/транс-2-(3,4-дихлорфенил)циклопропил/пропен-2-1-аль, который непосредственно использовали в следующей стадии.
К диэтилметанфосфонату (15,2 г, 0,1 моль) в тетрагидрофуране (200 мл) добавляли при -70оС н-бутиллитий (62,5 мл, 0,1 моль). Через 30 мин добавляли изобутилизотиоцианат (5,8 г, 0,05 моль) в тетрагидрофуране (50 мл). Смесь оставляли на ночь при комнатной температуре, затем выливали на смесь лед-вода и экстрагировали простым эфиром. Раствор в простом эфире промывали рассолом, сушили и удаляли растворитель, получая N-изобутил-2-(диэтоксифосфонил)ацетотиоамид.
N-изобутил-2-(диэтоксифосфорил)ацетотиоамид (0,7 г) в тетрагидрофуране (5 мл) добавляли при -70оС к диизопропиламиду лития (5,4 ммоль) в тетрагидрофуране (15 мл). Смеси давали нагреться до -20оС, затем охлаждали ее до -40оС.
Полученный ранее (±)-3-/транс-2-(3, 4-дихлорфенил)циклопропил/пропан-2-аль в тетрагидрофуране (5 мл) добавляли к указанной смеси. Смесь оставляли на ночь при комнатной температуре, затем обрабатывали ее обычным путем. Сырой продукт очищали колоночной хроматографией (силикагель, гексан: простой эфир 7: 3), получая целевое соединение.
(±)-(2Е, 4Е) N-(1,2-диметилпропил)-5-/транс-2-(3, 4-дихлорфенил)циклопропил/пента-2,4- диентиоамид (соединение 107) получали аналогичным способом, используя N-(1,2-диметилпропил)-2-(диэтоксифосфорил)ацетотиоамид вместо N-изобутил-2-(диэтоксифосфорил)ацетотиоамида.
(±)-(2Е, 4Е) N-(1,2-диметилпропил)-5-/c-2-(3, 4-дихлорфенил)-r-1-фторциклопропил/пента -2,4-диентиоамид (соединение 108) получали аналогичным способом, используя (с-2-(3,4-дихлорфенил)-r-1-фторциклопропил)метанметанол вместо транс-2-(3, 4-дихлорфенил)циклопропилметанметанола, по аналогии с примером 24.
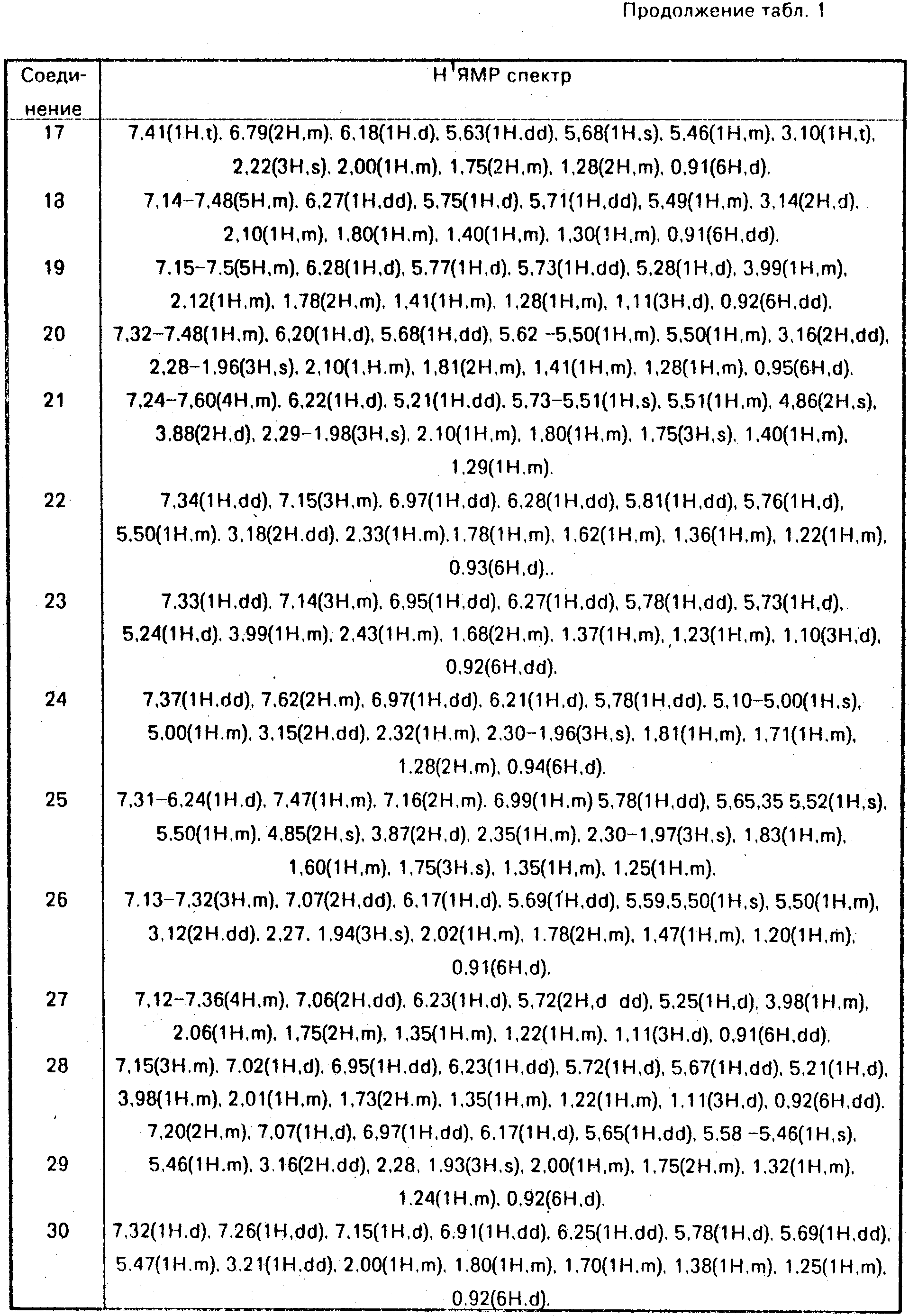
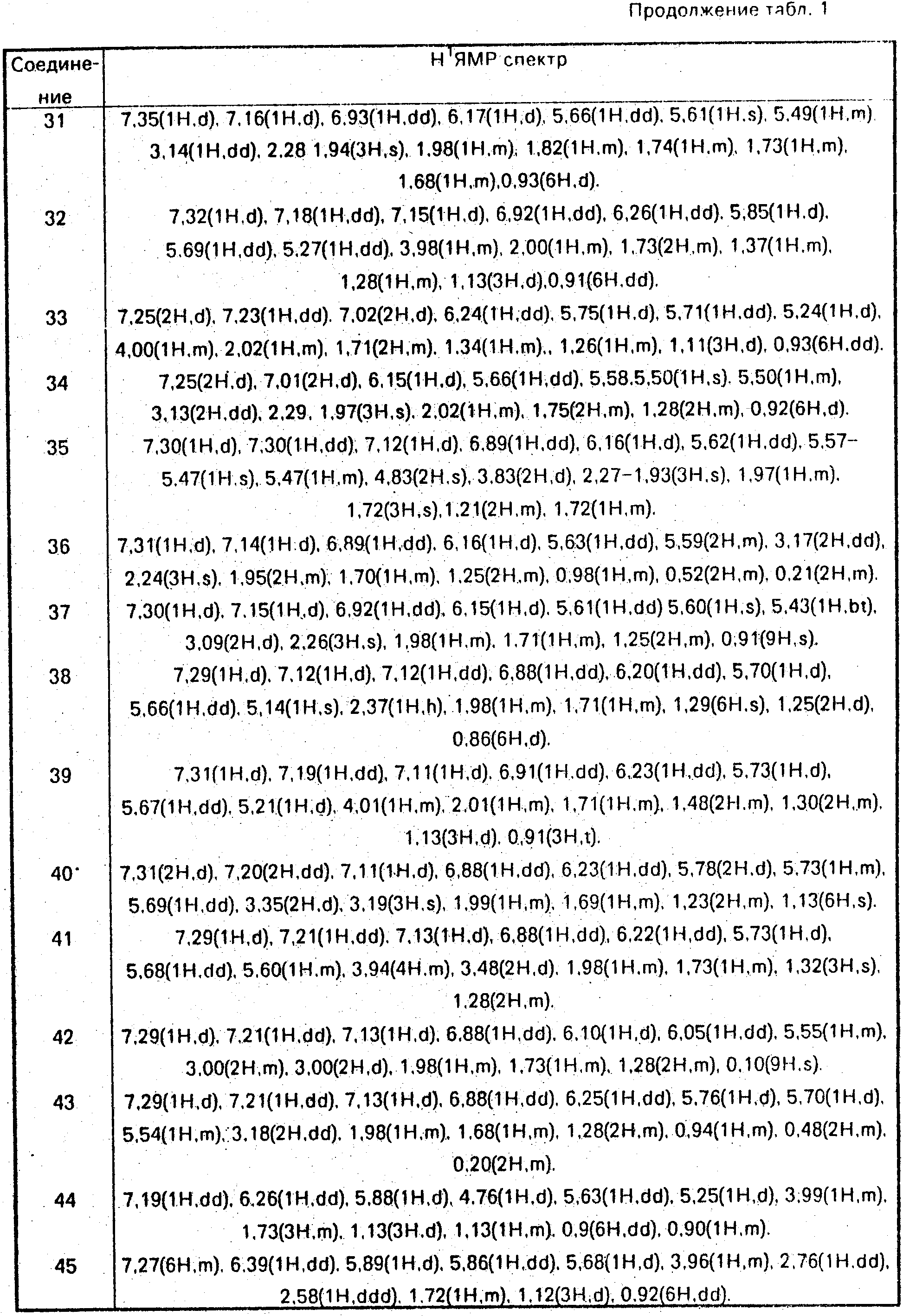
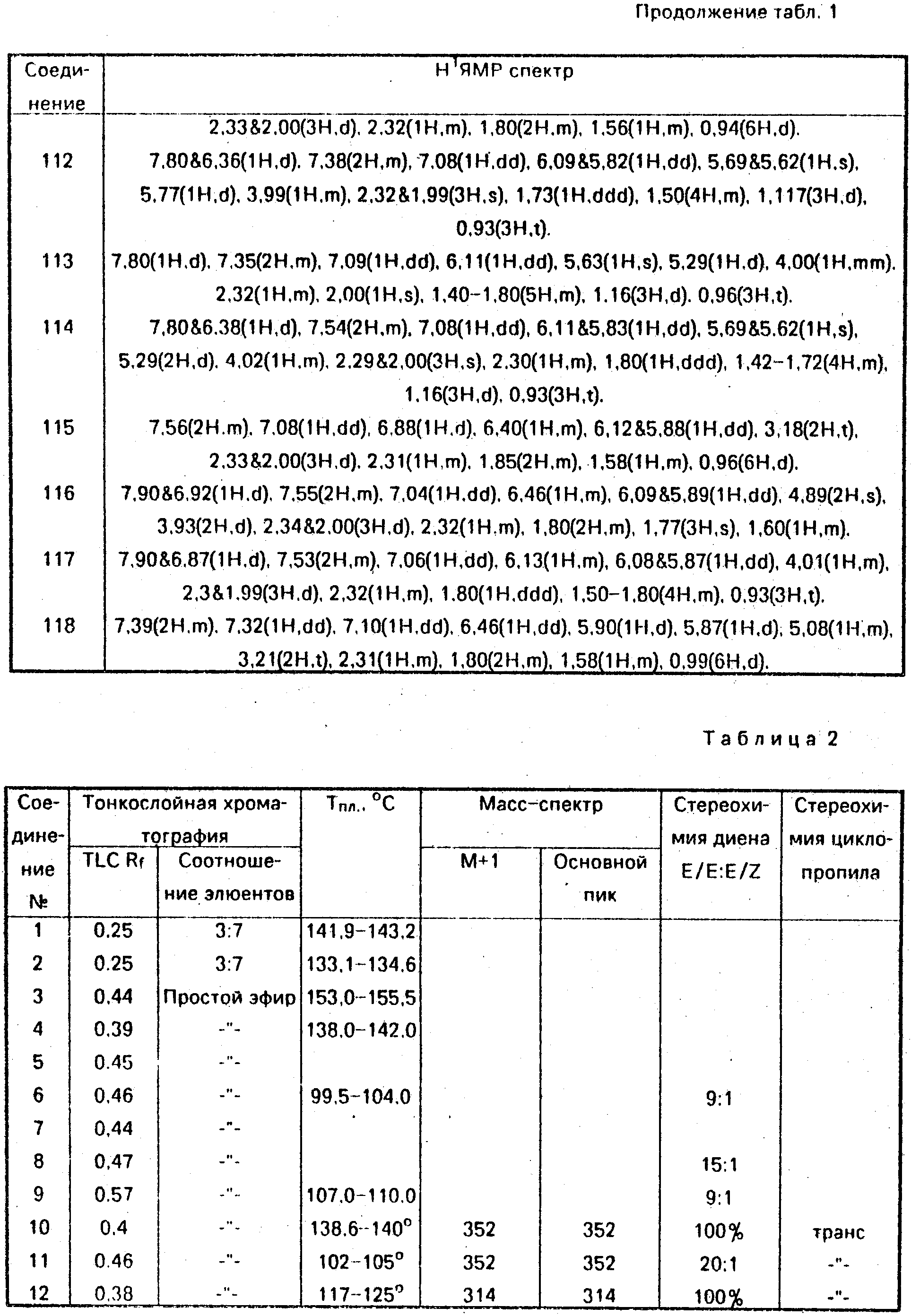
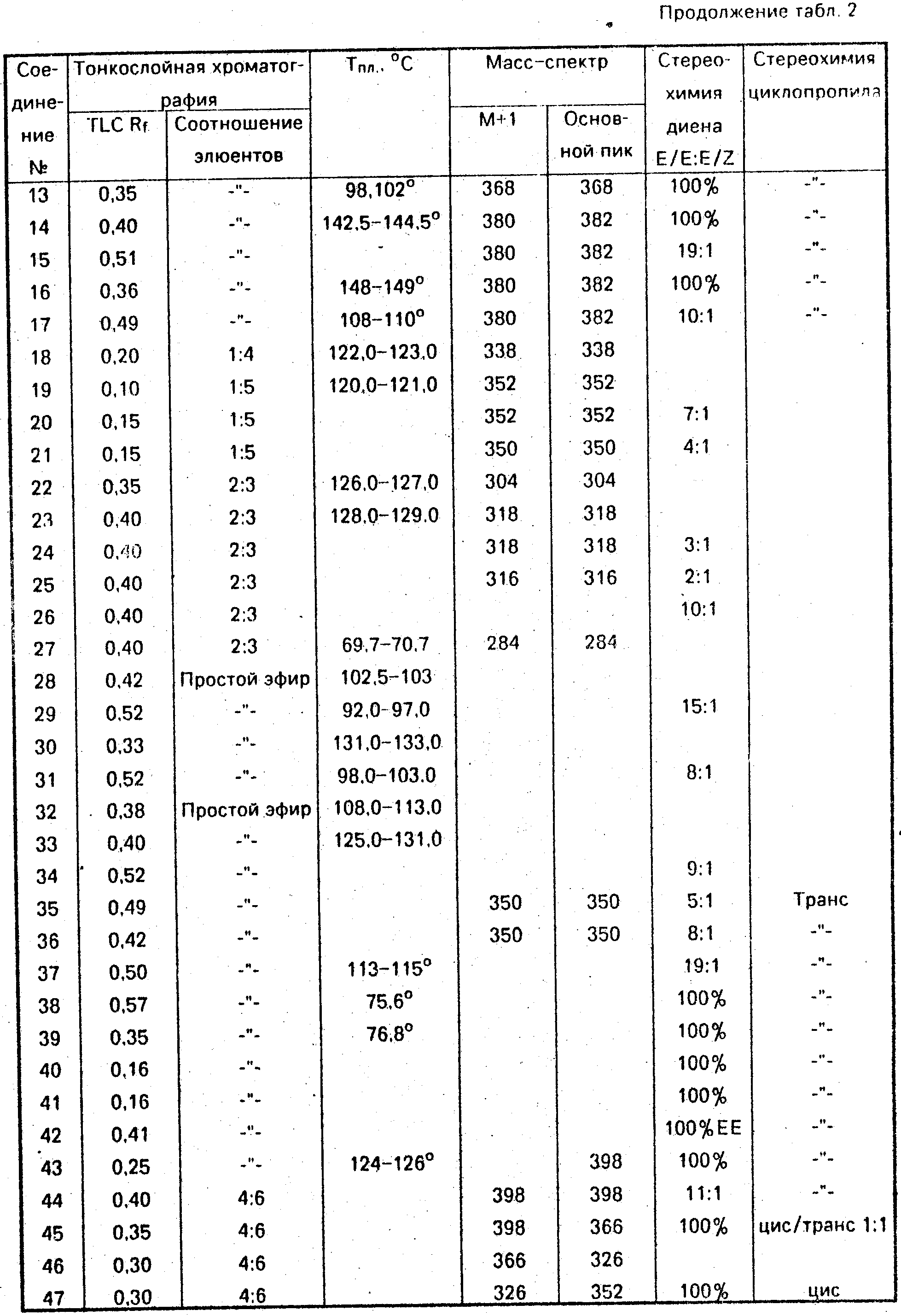
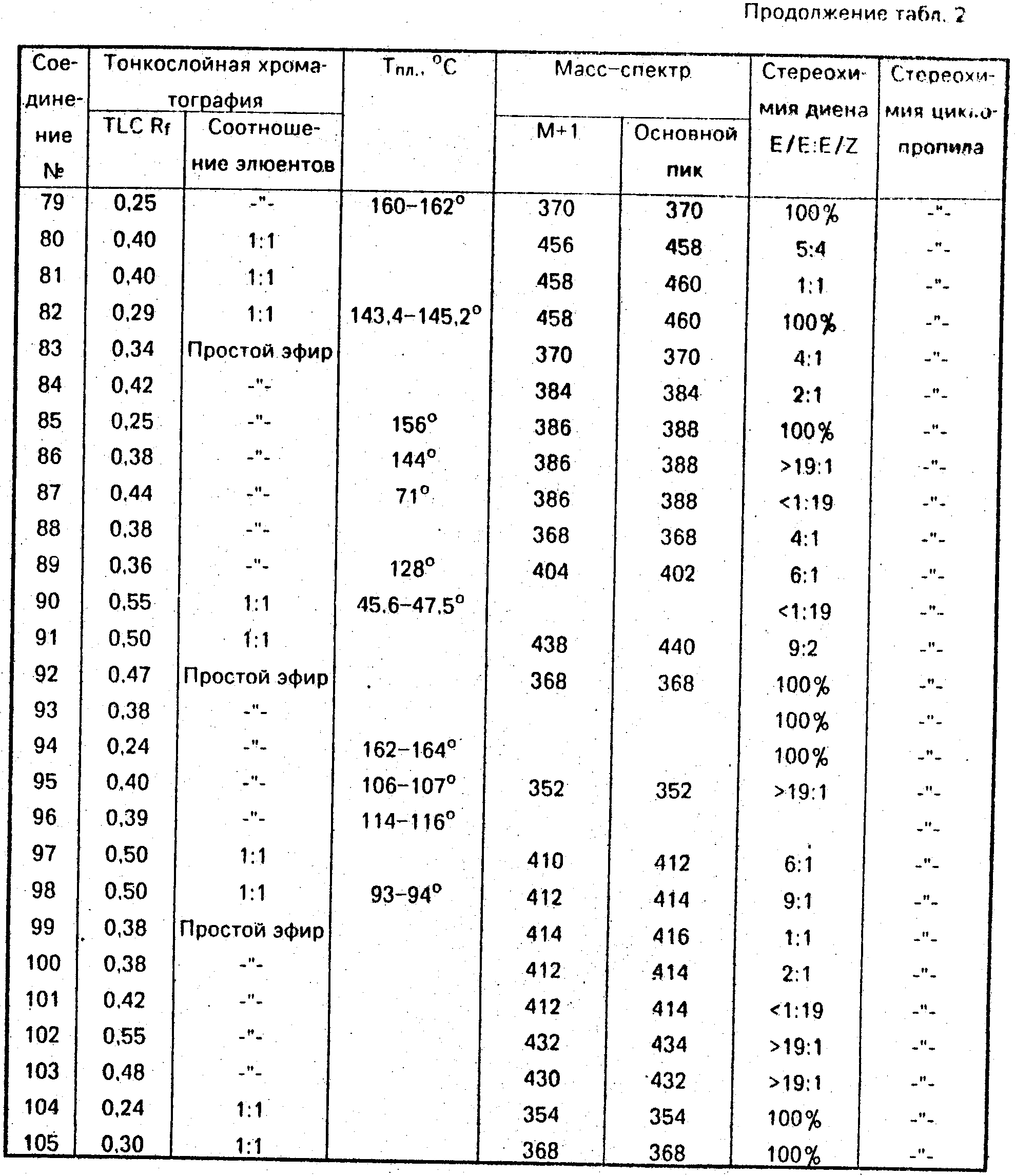
Данные ЯМР1Н и другие физико-химические характеристики полученных соединений приведены в табл. 1 и 2.
В таблицах приняты следующие обозначения:
S - синглет, d - дублет, dd
- двойной дублет, ddd - тройной дублет, t - триплет, q - квартет, m - мультиплет, b - широкий.
БИОЛОГИЧЕСКИЕ ДАННЫЕ
Нижеследующие примеры иллюстрируют, не ограничивая объема
настоящего изобретения, пестицидную активность соединений формулы I:
Пример А - тесты с
опрыскиванием.
Активность заявляемых соединений тестировали, растворяя соединения в
ацетоне (5% ) и затем разводя этот раствор смесью вода: "Synperonic" (94,5% : 0,5% ) с получением
водной эмульсии. Затем полученный раствор использовали для обработки следующих насекомых, для которых
наблюдалась активность при следующих дозах опрыскивания:
Musca domestica
20
самок Musca помещали в картонный цилиндр, оба донышка которого были закрыты марлей. Раствором, содержащим
соединение, опрыскивали насекомых и определяли смертность через 48 ч при 25оС.
Следующие соединения оказались активными при 1000 рр или менее: 1, 2, 3, 5, 6, 7, 8, 10, 11, 14, 15, 19, 20, 21, 36, 37, 38, 39, 40, 41, 96, 48, 55, 57, 65, 66, 78.
Следующие соединения оказались активными при 200 рр или менее: 4, 9, 13, 16, 17, 100, 30, 31, 32, 33, 34, 35, 42, 95, 97, 56, 59, 60, 61, 62, 63, 64, 67, 68, 69, 70, 71, 72, 73, 74, 77, 93, 94, 79, 80, 81, 82, 83, 84, 85, 86, 89, 90, 92, 87.
Plutella xylostella
Листья китайской
капусты, зараженные 8 личинками Plutella второй возрастной стадии, опрыскивали раствором,
содержащим соединение. Смертность определяли через 2 дня при 25оС.
Следующие соединения оказались активными при 1000 рр или менее: 12, 22, 25, 26, 45, 46, 47, 48, 51, 52, 53, 54, 58, 65, 76. Следующие соединения оказались активными при 200 рр или менее: 1, 2, 3, 4, 5, 6, 7, 9, 11, 13, 14, 15, 18, 19, 20, 21, 23, 24, 27, 28, 29, 30, 31, 32, 32, 34, 36, 41: 42, 95, 44, 50, 57, 61, 66.
Следующие соединения оказались активными при 40 рр или менее: 8, 10, 16, 17, 33, 35, 37, 38, 39, 40, 97, 55, 56, 59, 60, 62, 63, 64, 67, 68, 69, 70, 71, 72, 73, 74, 77, 78, 93, 79, 80, 81, 90, 92, 87.
Tetranychus urticae
Зараженные листья фасоли
обыкновенной опрыскивали раствором, содержащим соединение. Смертность определяли через 2 дня
при 25оС.
Следующие соединения оказались активными при 1000 рр или менее: 8, 12, 13, 16, 17, 18, 21, 26, 28, 31, 33, 34, 37, 54, 56, 57, 59, 60, 61, 63, 67, 69, 70, 77, 78, 93, 80, 82, 83, 84, 85, 92, 87.
Spodoptera littoralis
Незараженные листья
опрыскивали тестируемым раствором, содержащим соединение, и давали листьям высохнуть. Затем листья
были заражены 10 новорожденными личинками. Смертность определяли через 3 дня.
Следующие соединения оказались активными при 1000 рр или менее:
1, 5, 6, 7, 13, 14, 15, 100, 18,
20, 21, 29, 34, 36, 37, 38, 40, 41, 42, 95, 44, 46, 49, 50, 51, 53, 55, 63, 65, 66, 67, 91.
Следующие соединения оказались активными при 200 рр или менее:
3, 4, 8, 9, 10, 11,
16, 17, 19, 30, 31, 32, 33, 35, 39, 96, 97, 56, 57, 59, 60, 61, 62, 64, 68, 69, 70, 71, 72, 73,
74, 77, 78, 93, 94, 79, 80, 81, 82, 83, 84, 86, 85, 89, 90, 92, 87.
Myzus persicae
10 взрослых Myzus помещали на лист китайской капусты. Через 24 ч лист опрыскивали
раствором, содержащим соединение. Смертность определяли через 2 дня при 25оС.
Следующие соединения оказались активными при 1000 рр или менее: 8, 9, 13, 18, 19, 20, 22, 24, 30, 31, 34, 35, 95, 44, 50, 59, 60, 61, 66, 72, 75, 77, 78, 93, 94, 82, 83, 84, 85, 86, 92, 87.
Siabrotica undecimpunctata
Личинки второй возрастной стадии и их пищу
опрыскивали на фильтровальной бумаге раствором, содержащим соединение. Активность определяли через 2 дня.
Следующие соединения оказались активными при 1000 рр или менее: 3, 6, 9, 11, 12, 13, 14, 17, 28, 29, 30, 31, 32, 33, 35, 37, 39, 95, 96, 97, 44, 54, 55, 56, 59, 61, 62, 67, 69, 71, 72, 74, 77, 78, 94, 80, 81, 82, 83, 86, 92.
Следующие соединения оказались активными при 200 рр или менее: 10, 16, 68, 73, 79, 84, 85, 89.
Пример В - тесты с локальным применением.
Blatella germanica
На самцов B. germanica локально
воздействовали 0,5 мкл раствора соединения в бутаноле (с или без пиперонилбутоксида). Смертность определяли
через 6 дней.
Следующие соединения оказались активными при 10 мкг или менее
(+ пиперонилбутоксид):
10, 11, 13, 15, 16, 17, 30, 35, 36, 37, 39, 40, 41, 42, 55, 56, 57, 59, 60,
61, 63, 64, 67, 68, 69, 70, 71, 72, 73, 74, 77, 78, 94, 79, 80, 81, 82, 83, 84, 85, 86, 92,
87.
Следующие соединения оказались активными при 10 мкг или менее (без
пиперонилбутоксида)
1, 8, 9, 20, 21, 30, 31, 32, 33, 34, 95.
Сравнительные данные.
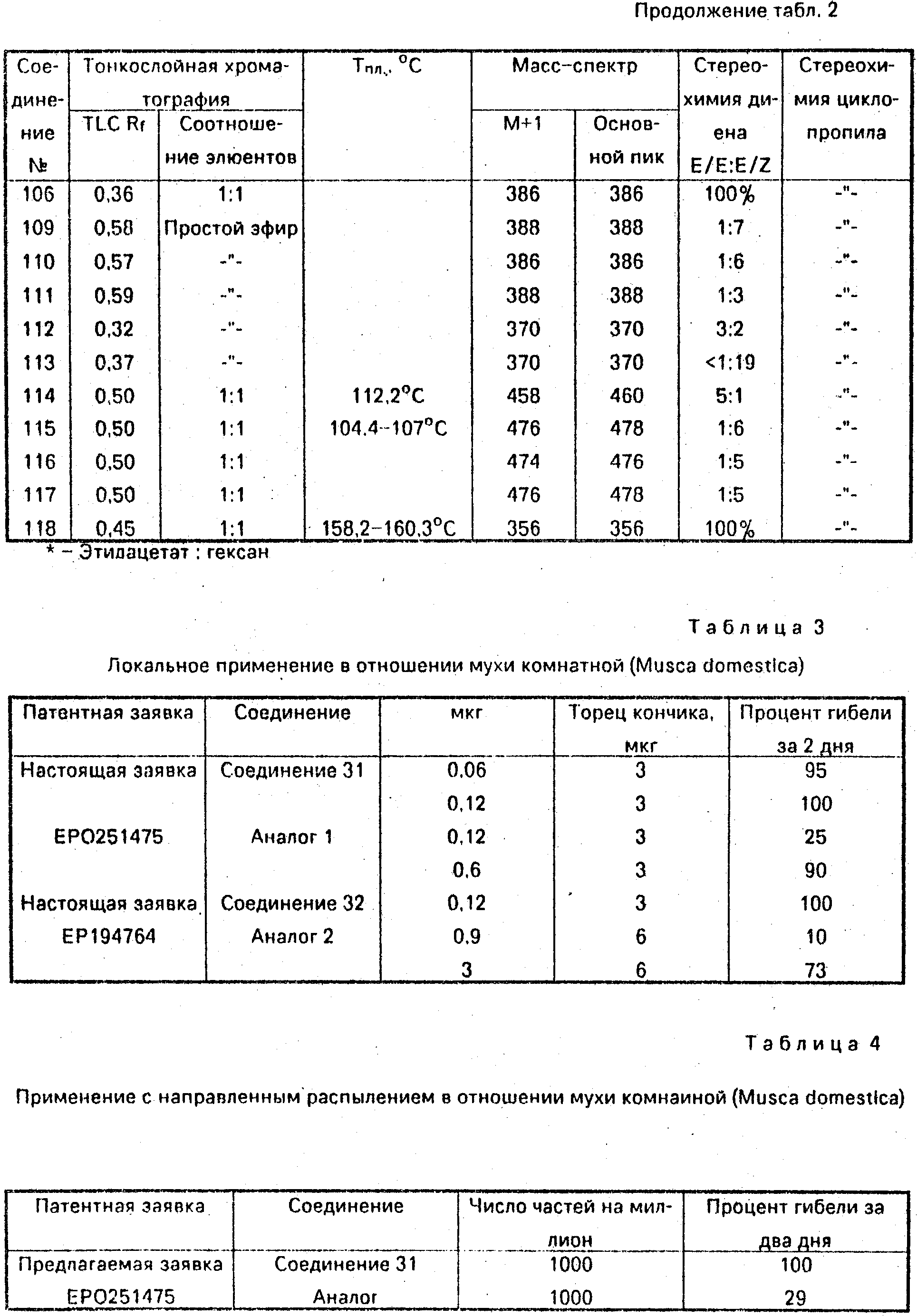
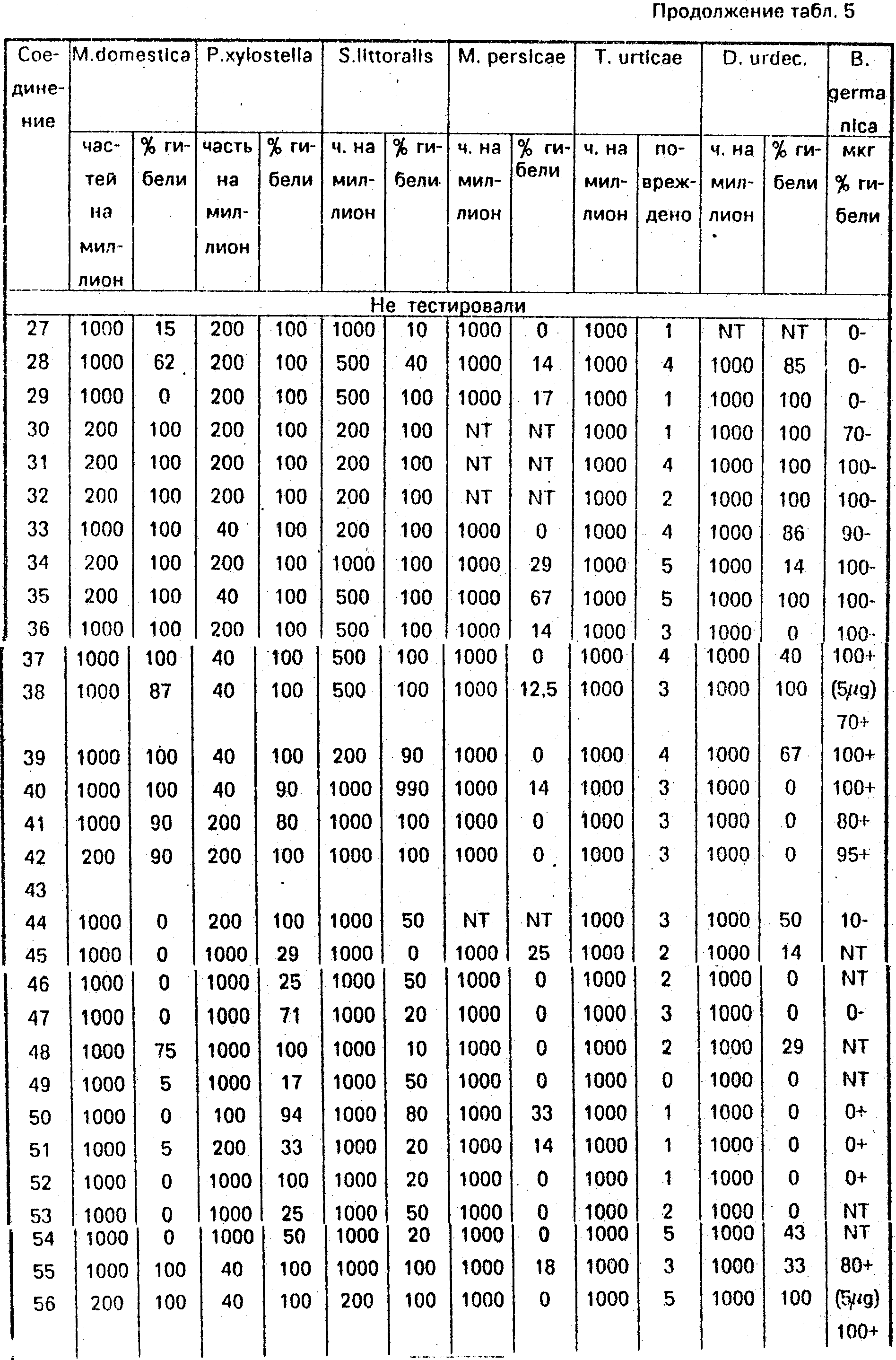
Соединение 31, отвечающее изобретению, и аналог, отвечающий Европейской патентной заявке N 0251475 (см. приведенные ниже структуры), были сопоставлены с проведением тестирования на Musca domestiсa. Аналогичным образом, соединение 32, отвечающее изобретению, было сопоставлено с аналогом, отвечающим Европейской патентной заявке ЕР194764 (табл. 3, 4, 5).
1. Локальное применение в отношении мухи комнатной (Musca domestica). Соединения применяли локально только в виде целлозольного раствора или в сочетании с синергистом (3 или 6 мкг пиперонилбутоксида) и процент гибели за два дня приведен в табл. 3.
2. Применение с направленным распылением в отношении мухи комнатной (Musca domestica). Соединения распыляли в виде смеси, состоящей из ацетона, воды и смачивающей эмульсии, взятых в соотношении 5: 94: 5, процент гибели за 2 дня приведен в табл. 4 и 5. (56) 1. ЕР N 0251472, кл. С 07 С 103/58, 1988.
2. ЕР N 194764, кл. С 07 103/30, 1987.
Реферат
Сущность изобретения: продукт - амиды ненасыщенных кислот QQ1CR2=CR3CR4=CR5C(X)NHR1, или их солей, где Q-C6H5- пиридил, нафтил, дигаловинил, каждый из которых может быть замещен 1 - 3 заместителями из группы: C1-C6 алкил, C1-C6 алкокси, CF3, галоген, Q1 -1.2-циклопропильное кольцо, возможно замещенное C1-C4-алкилом, R2, R3, R4 и R5 является одинаковыми или различными и означают Н, C1-C6-алкил, гало C1-C4 алкил, при этом один из радикалов обязательно означает водород, R1-H, C1-C6, который может быть замещен диоксаланильной группой, цикло (C3-C6) алкил, X = 0. Реагент 1 : карбонильное соединение. Реагент 1: реактив Виттига. 5 табл.
Формула
QQ′CR2 = CR3 CR4 = CR5 C(X) NHR1,
где Q - фенил, пиридил, нафтил, дигаловинил, каждый из которых может быть замещен 1 - 3 заместителями, выбранными из группы: C1 - C6-алкил, C1 - C6 - алкокси, CF3, галоген;
Q' - 1,2-циклопропильное кольцо, возможно замещенное C1 - C4-алкилом;
R2, R3, R4 и R5 - одинаковые или различные, водород, (C1 - C6)-алкил, гало(C1 - C4)-алкил, при этом один из радикалов обязательно означает водород;
R1 - водород, C1 - C6-алкил, который может быть замещен диоксаланильной группой, цикло- (C3 - C6 )-алкил;
X = 0,
или их солей,
отличающийся тем, что осуществляют взаимодействие соответствующего каpбонильного соединения с pеагентом Виттига.

Комментарии