Карбаматы, промежуточные продукты, фунгицидная композиция, способ борьбы с грибами - RU2129118C1
Код документа: RU2129118C1
Чертежи










































































































































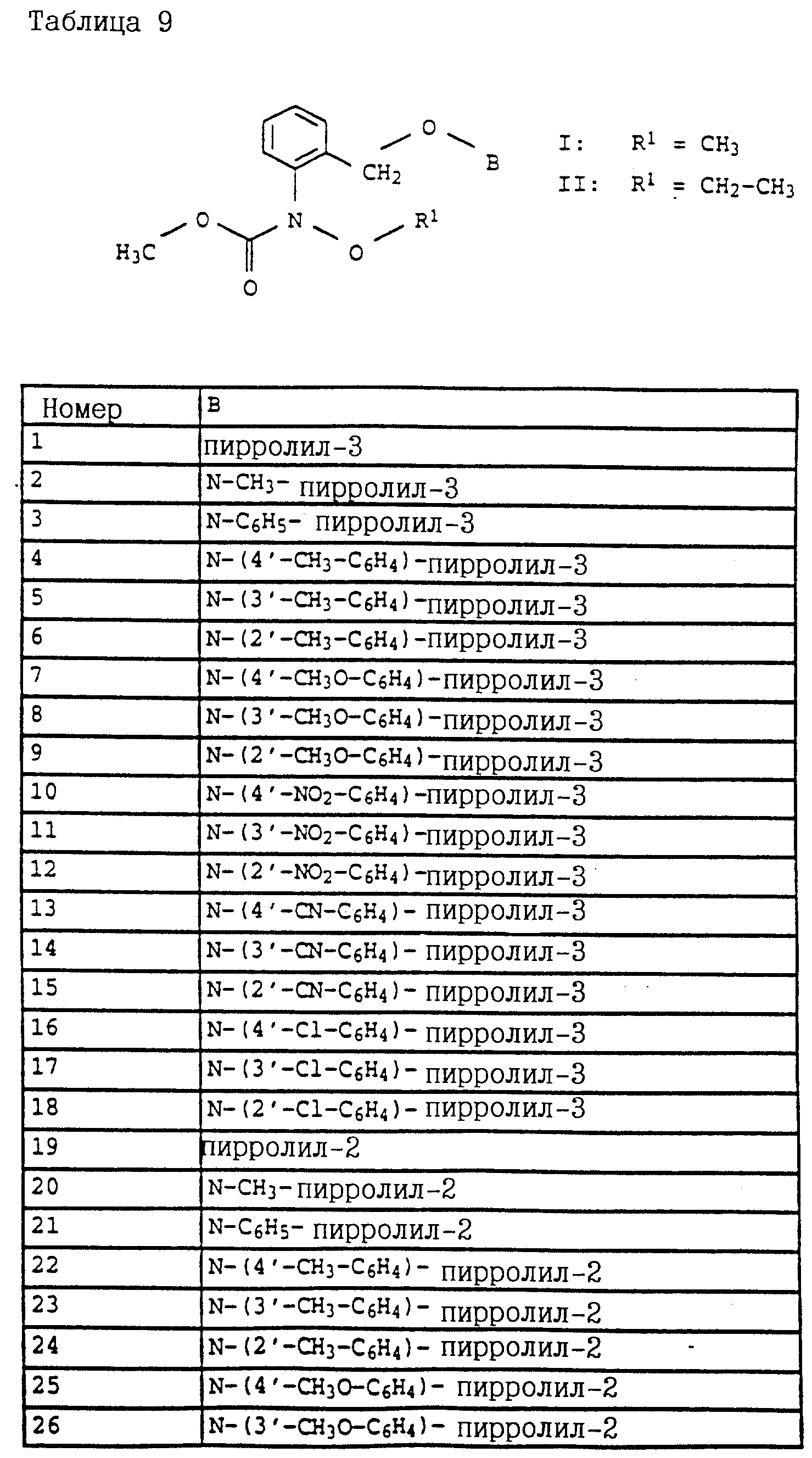








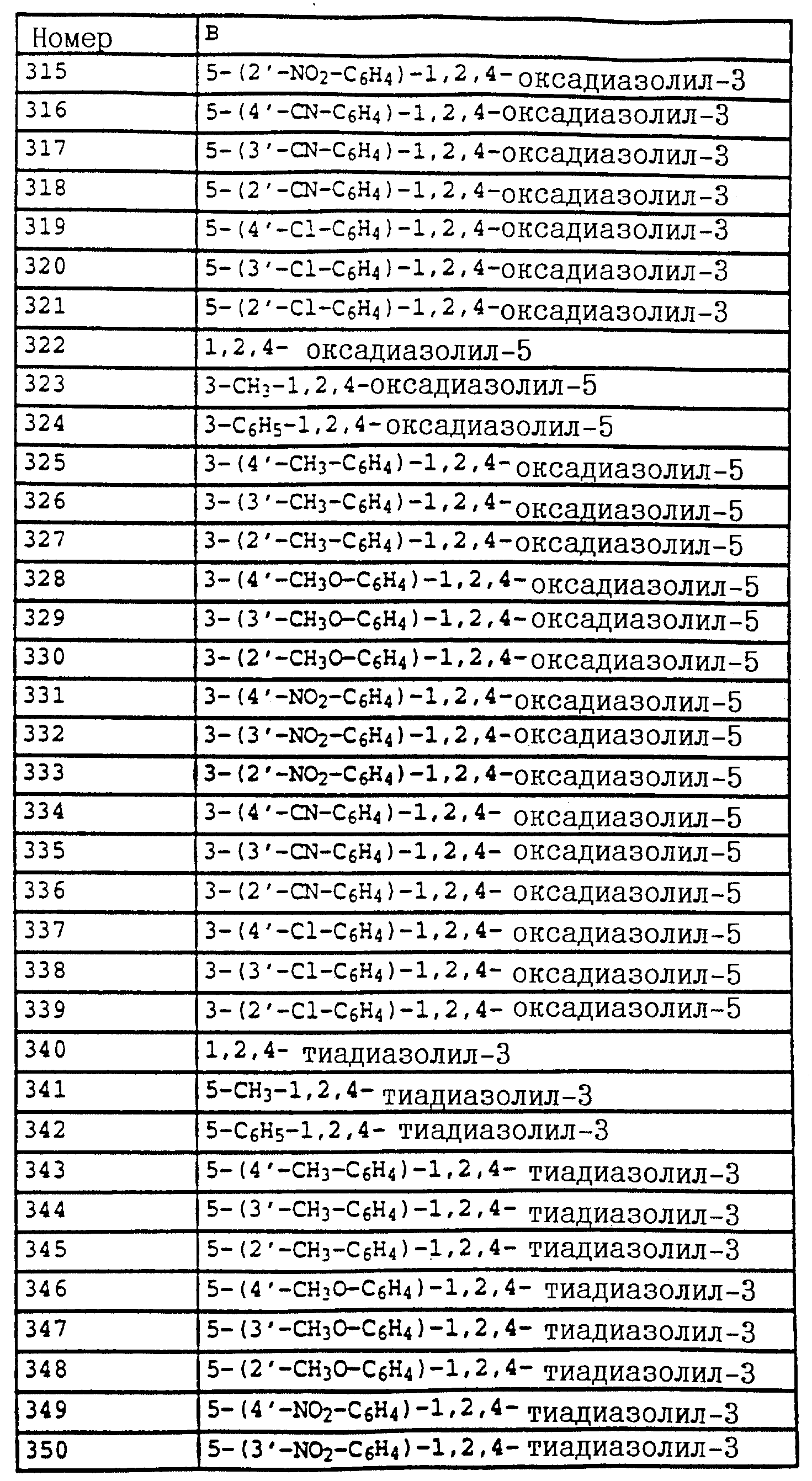

























































































































































































































































































































































































































































































































































































































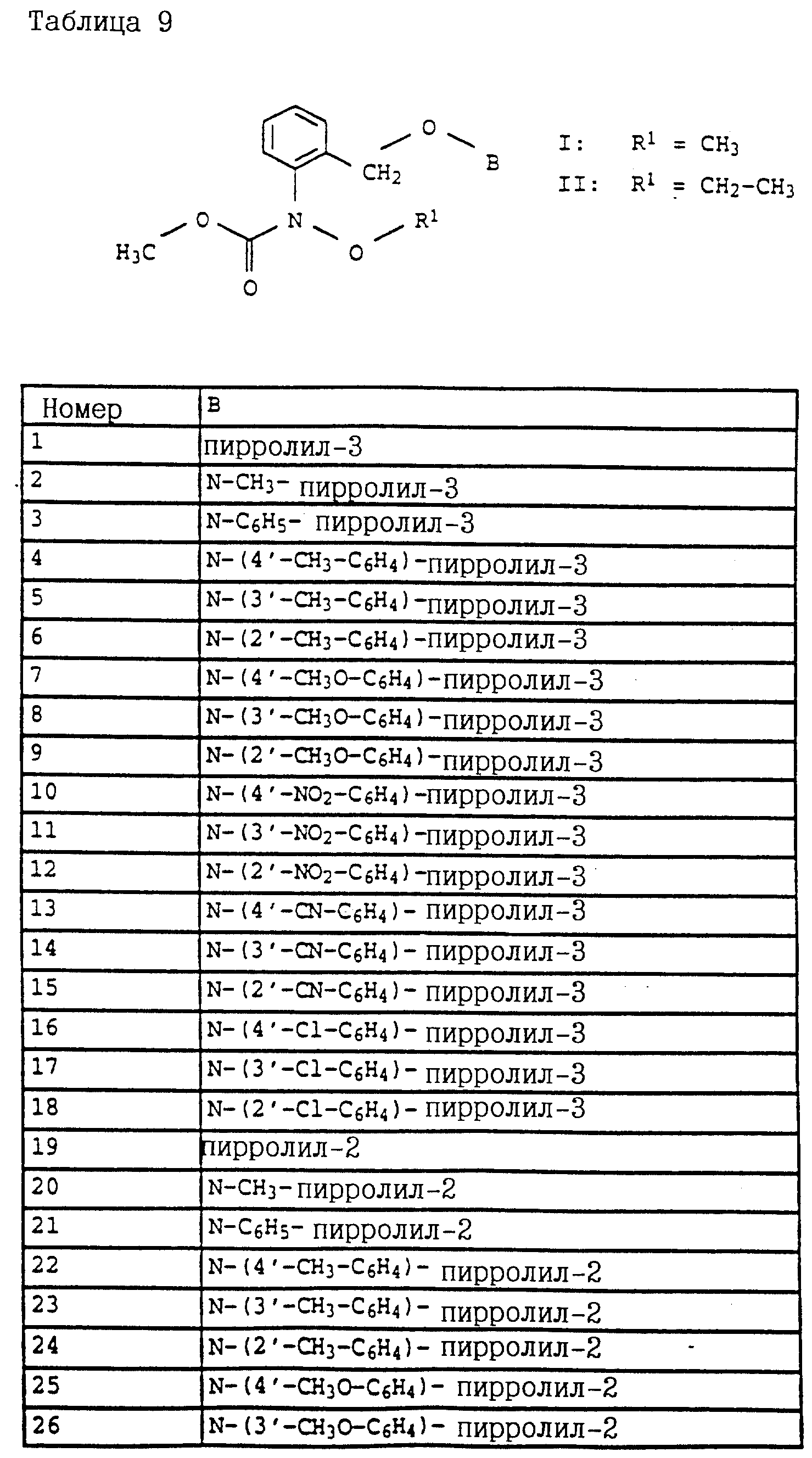




























































































































































































































































































































































































































































































Описание
Настоящее изобретение относится к новым карбаматам, новым промежуточным продуктам-производным бензола для их получения, фунгицидной композиции на основе карбаматов и способу борьбы с грибками.
Известно применение производных анилина, например, изопропилового эфира N-фенилкарбаминовой кислоты либо соответствующего сложного 3-хлорфенилового эфира (см. патент GB 574995) или метилового эфира N-3,4-дихлорфенилкарбаминовой кислоты (см. патент BE 612550) в качестве средств защиты растений. Однако их фунгицидная эффективность является 30 недостаточной.
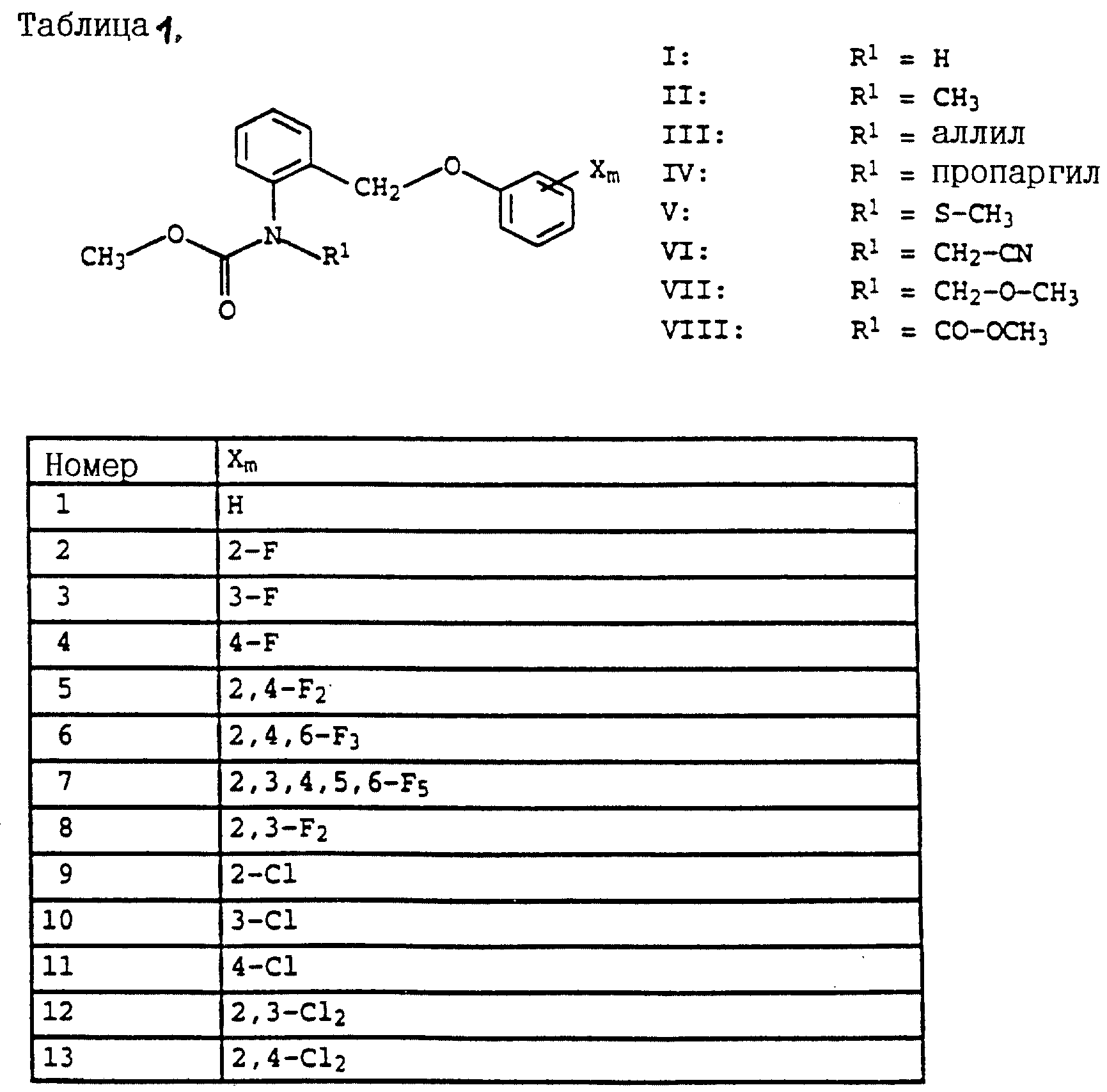
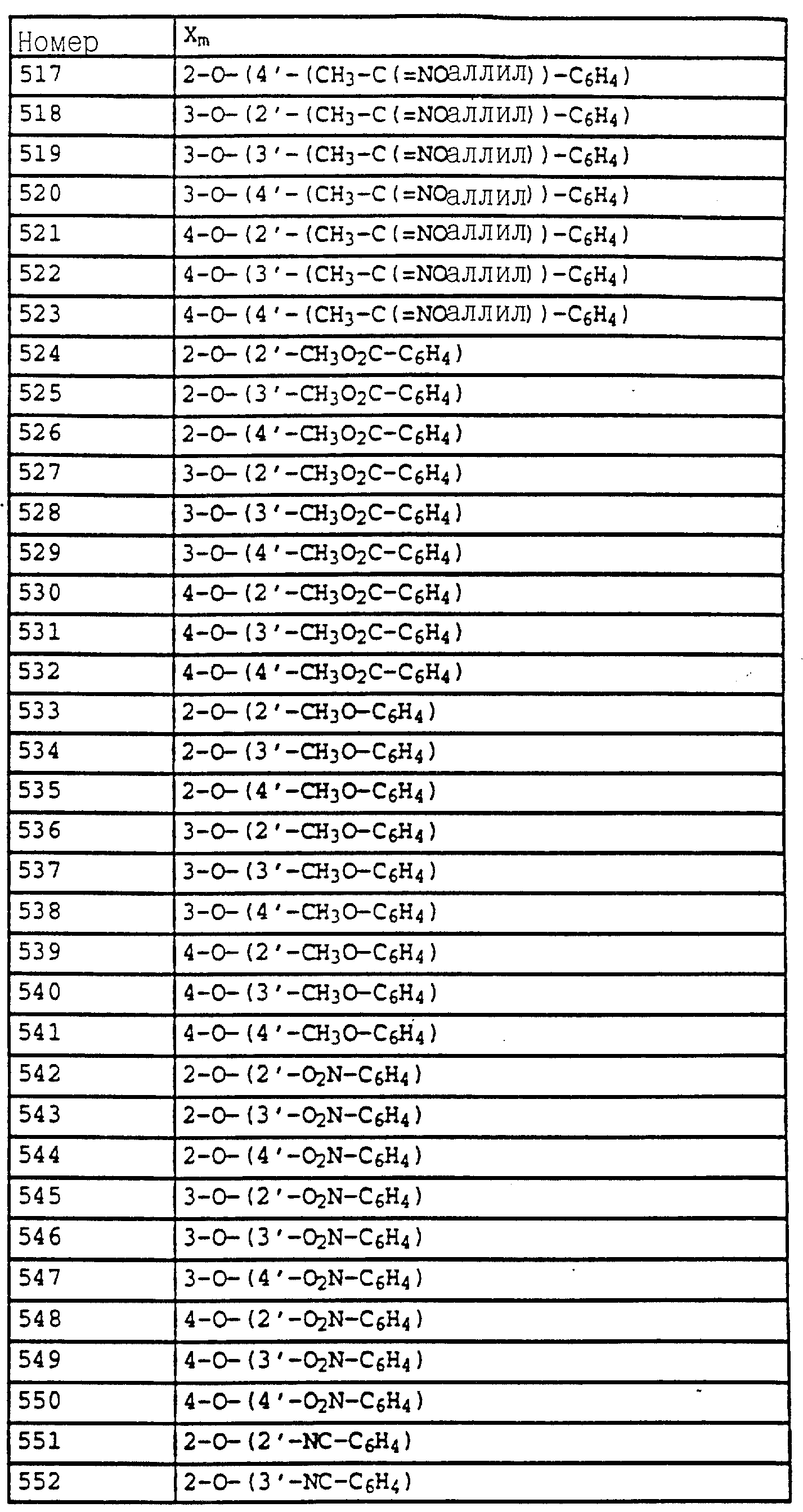
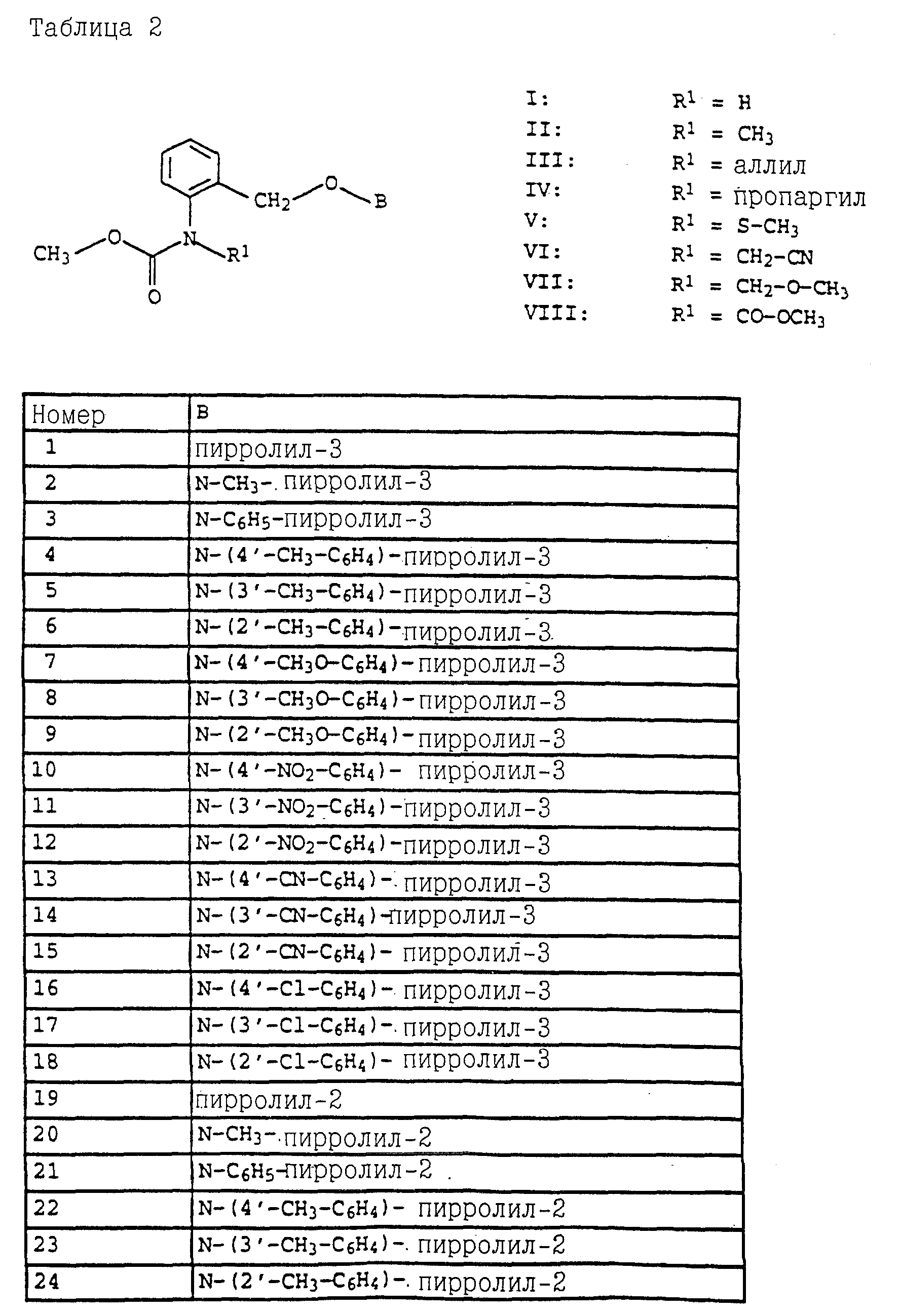
Согласно настоящему изобретению предлагаются новые карбаматы формулы 1 и их совместимые с растениями аддитивные соли кислот или оснований, обладающие хорошим фунгицидным действием, в частности, превосходной эффективностью против широкого спектра фитопатогенных грибов и обладают частично системным действием и могут использоваться в качестве листовых и почвенных фунгицидов.
Предлагаемые
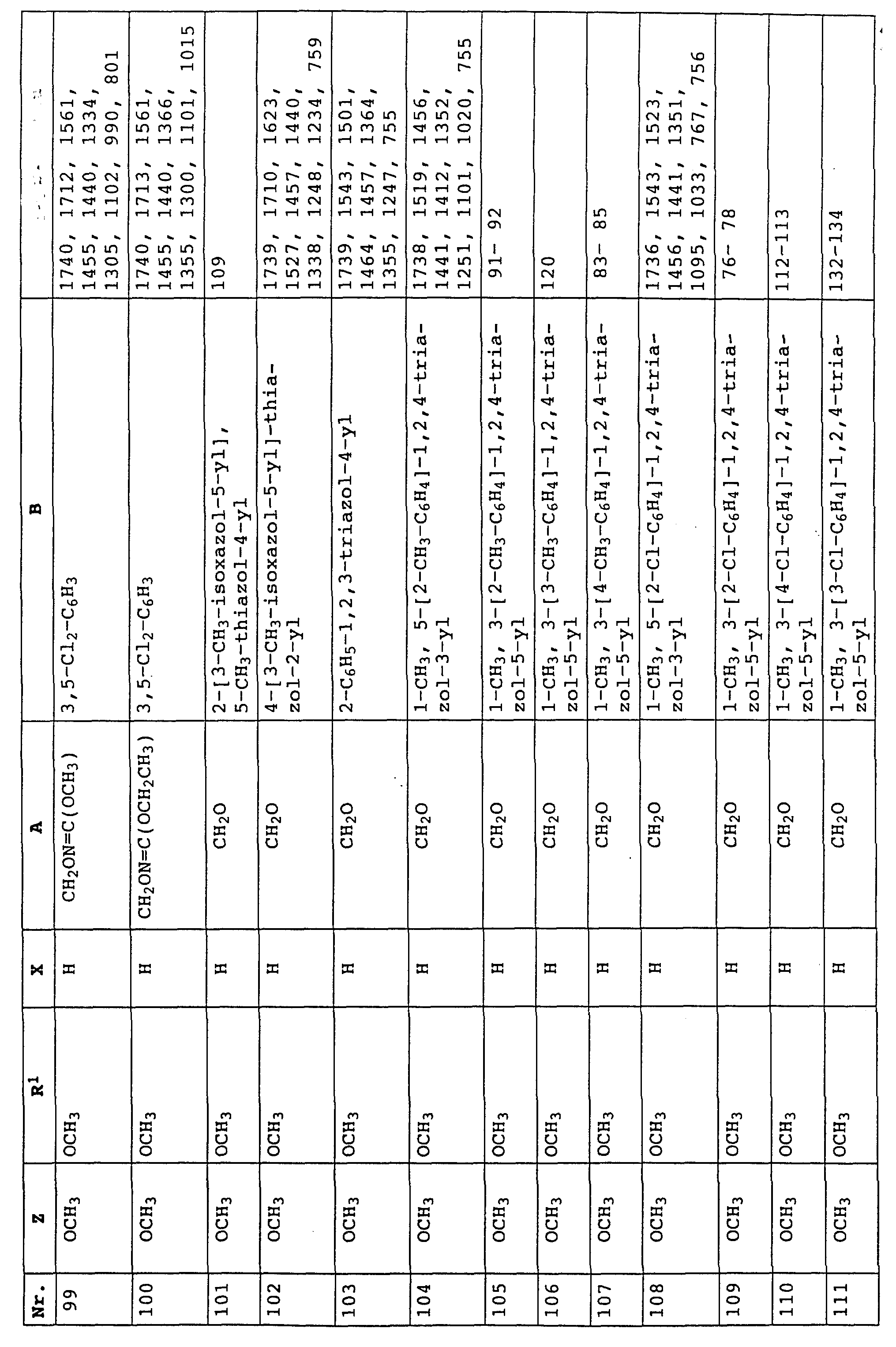
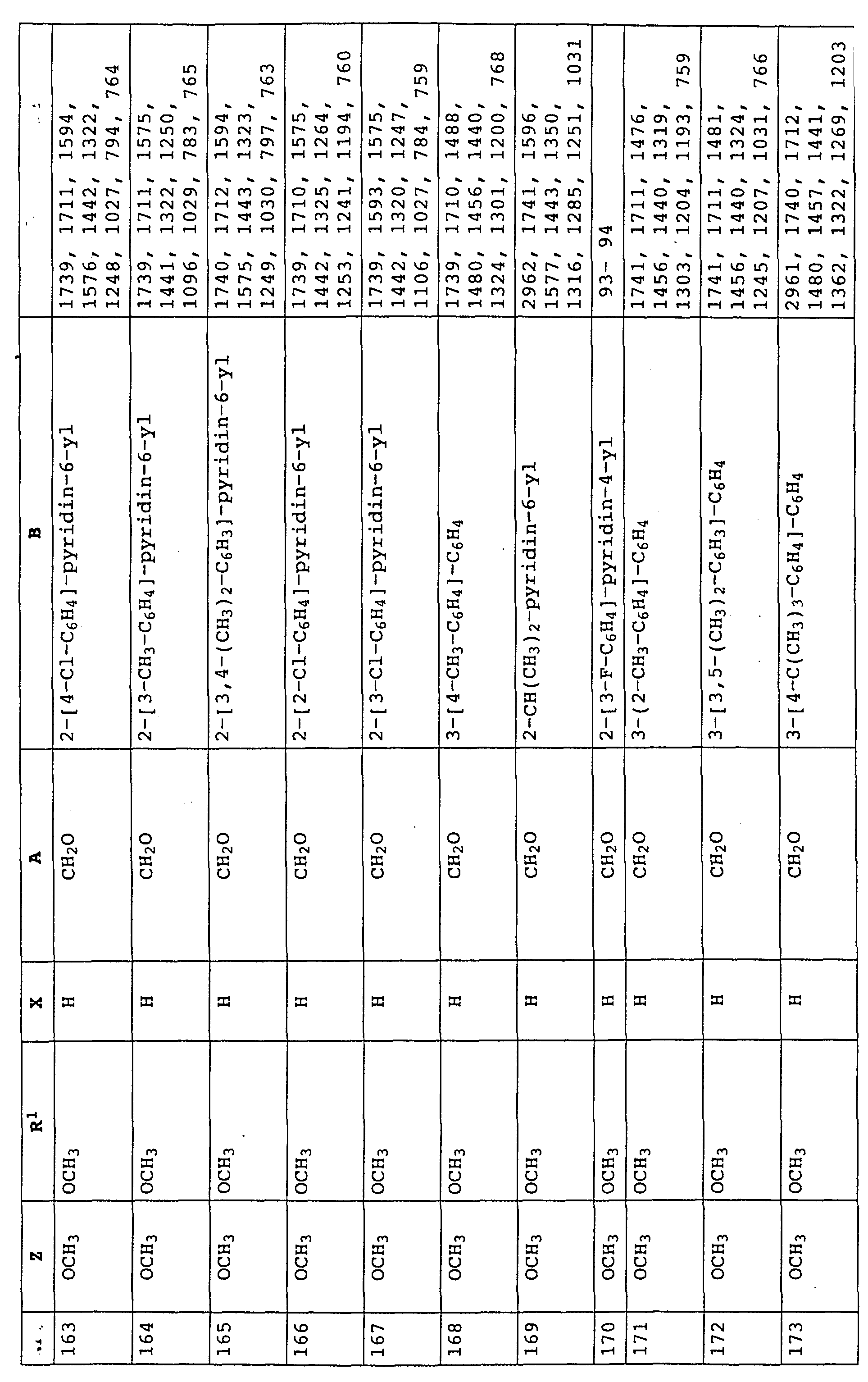
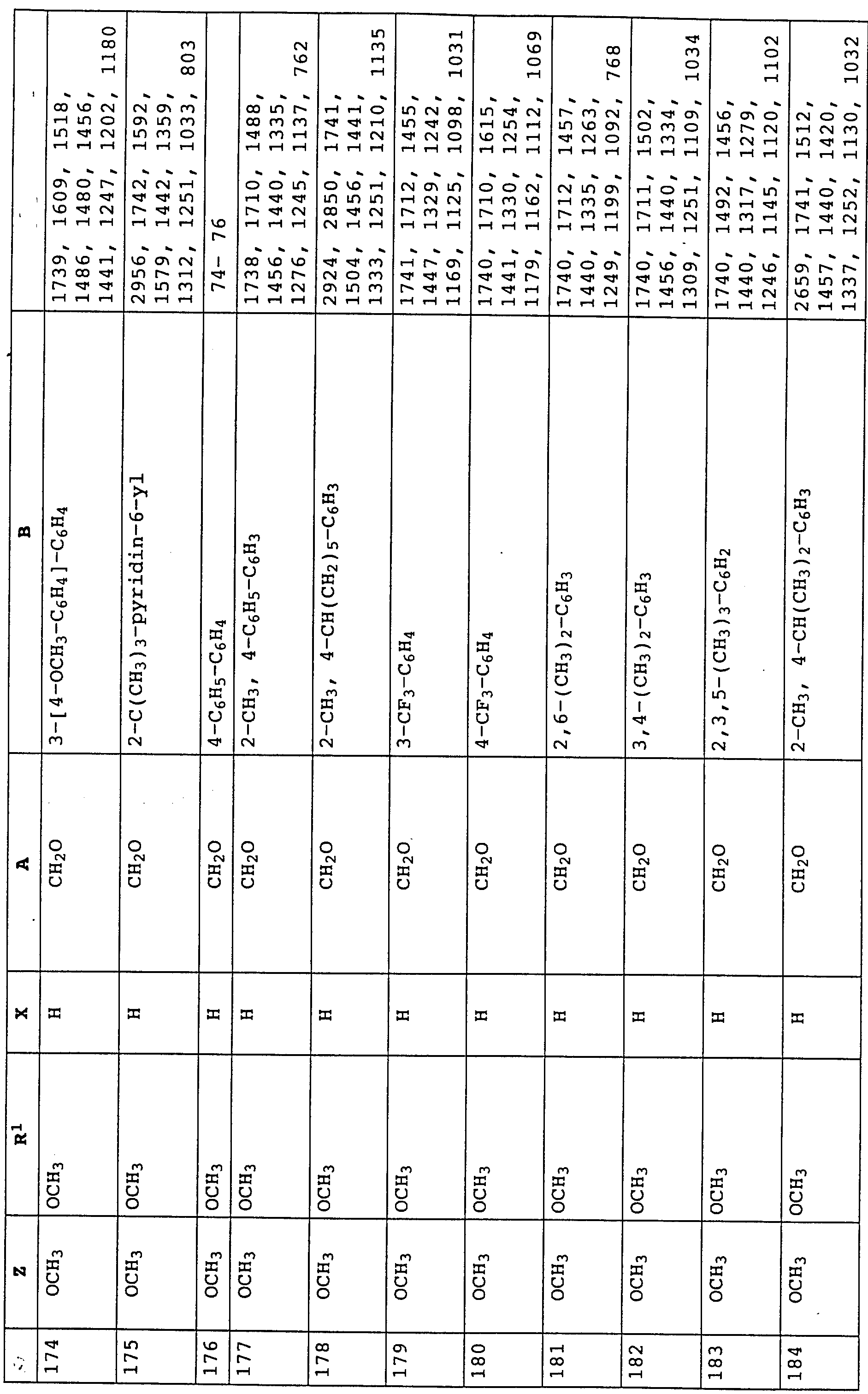
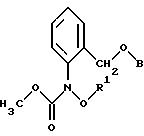
согласно настоящему изобретению карбаматы соответствуют общей формуле I

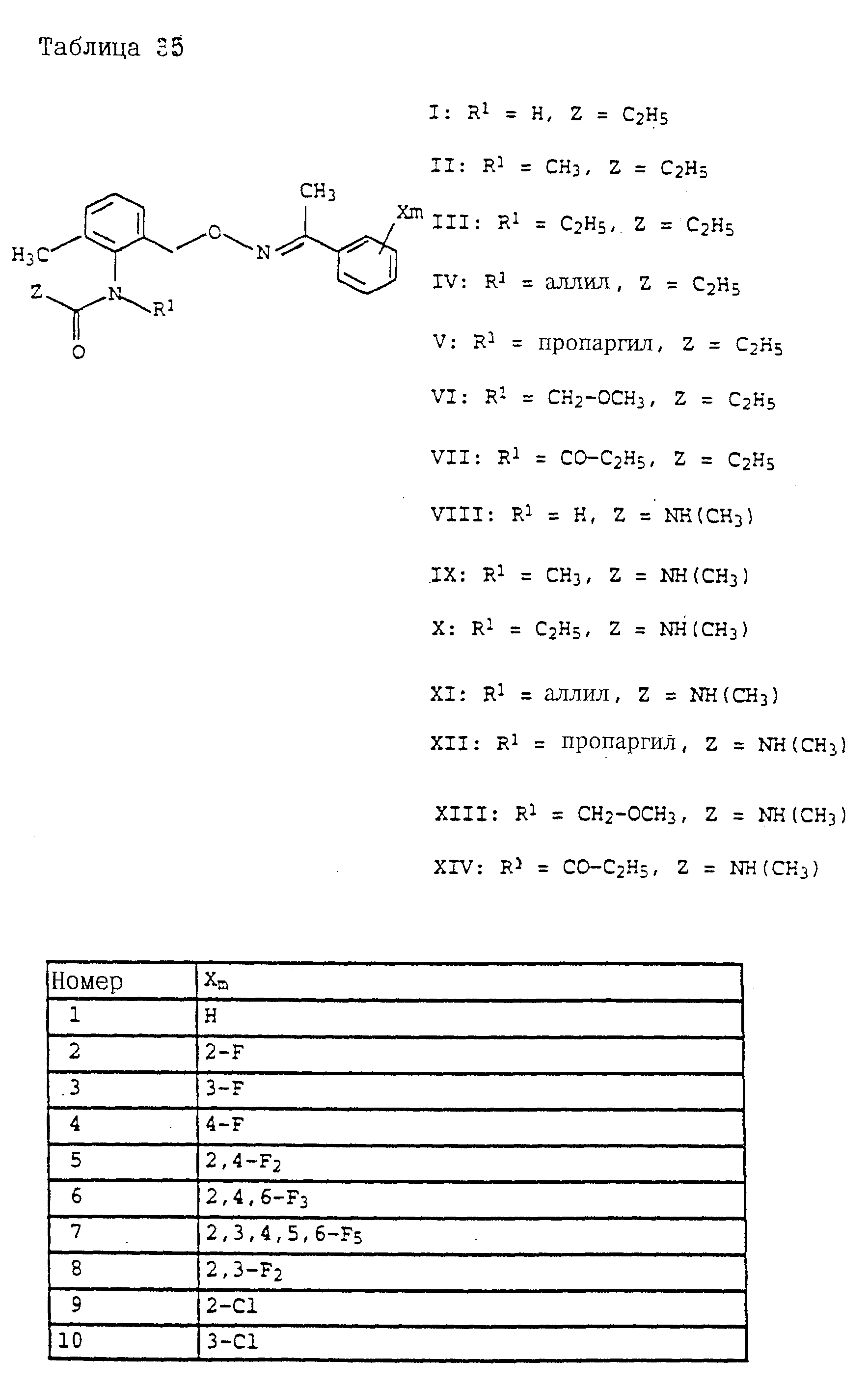
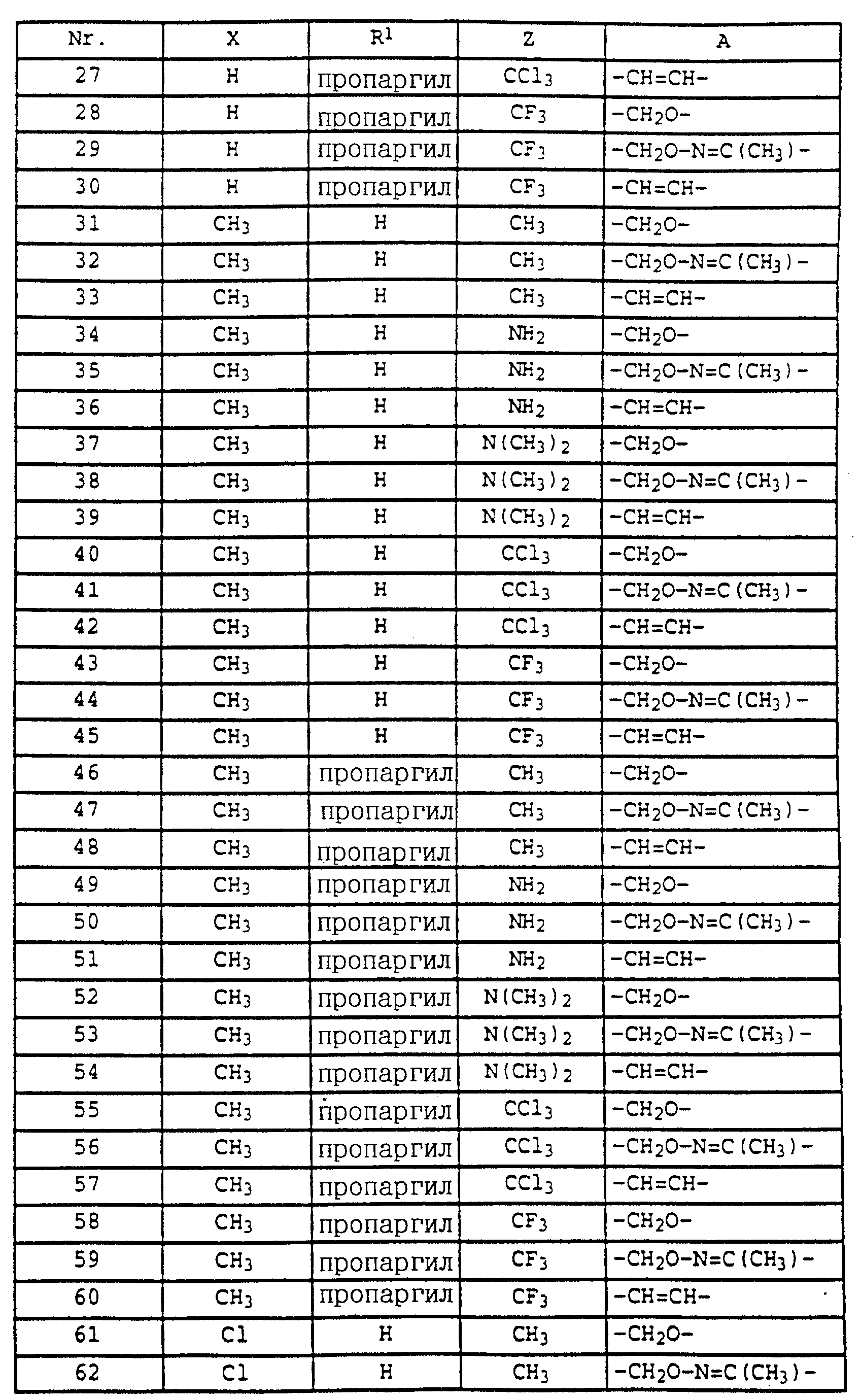
где Z - OCH3, NH2, NHCH3, N(CH3)2, CH3, C2H5, CF3;
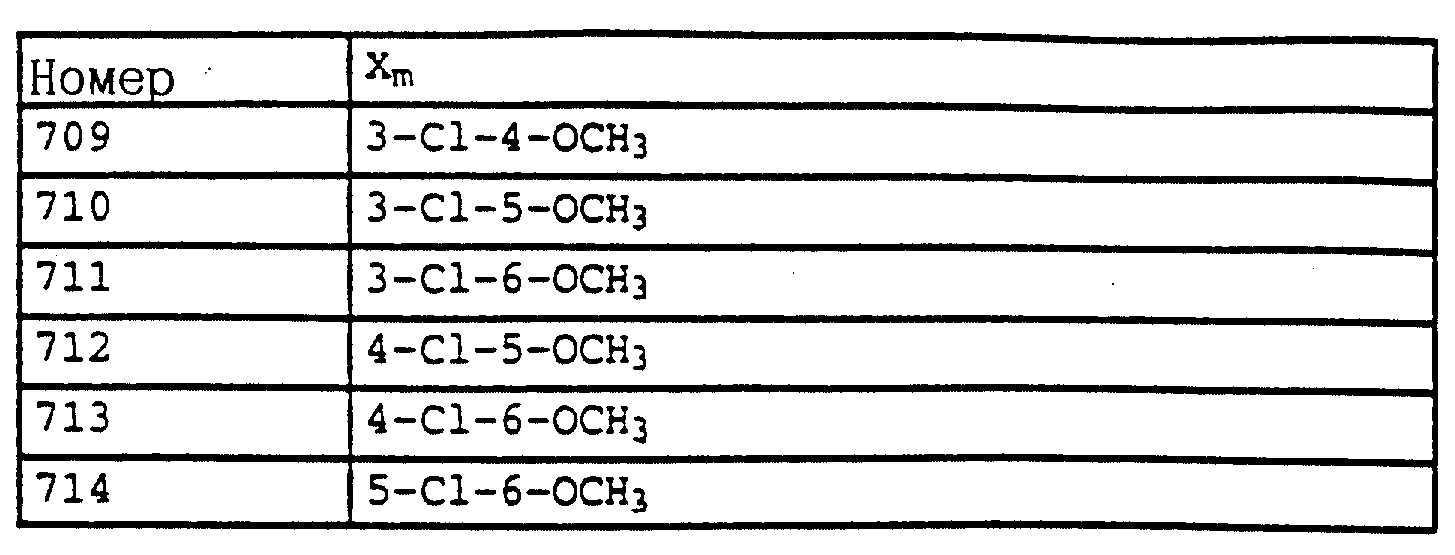
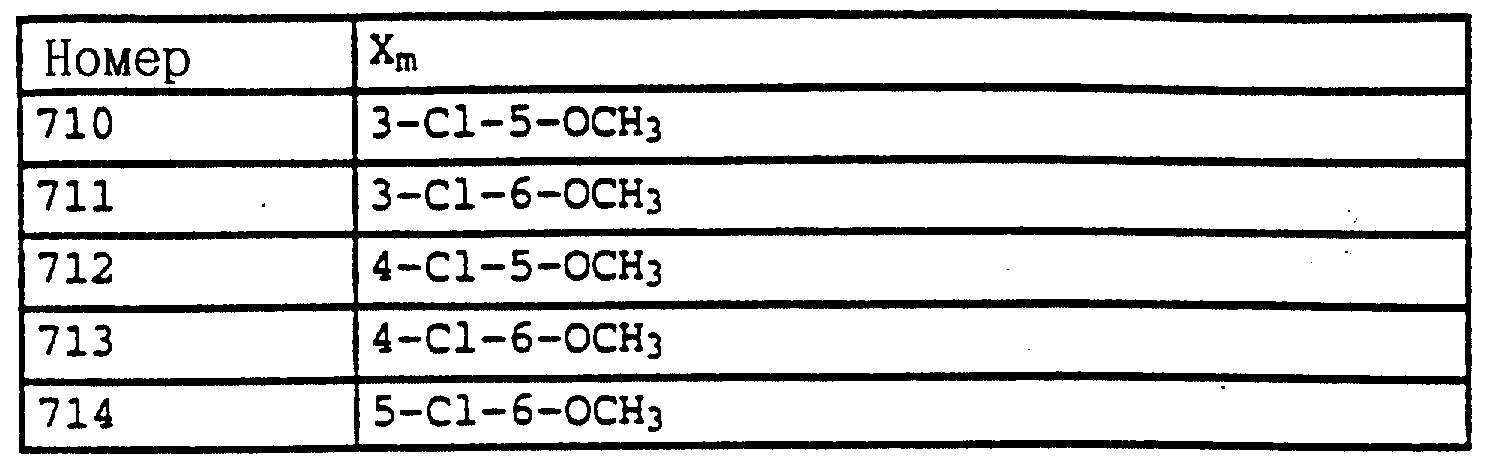
X и Y независимо друг от друга обозначают водород, F, Cl, Br, алкил;
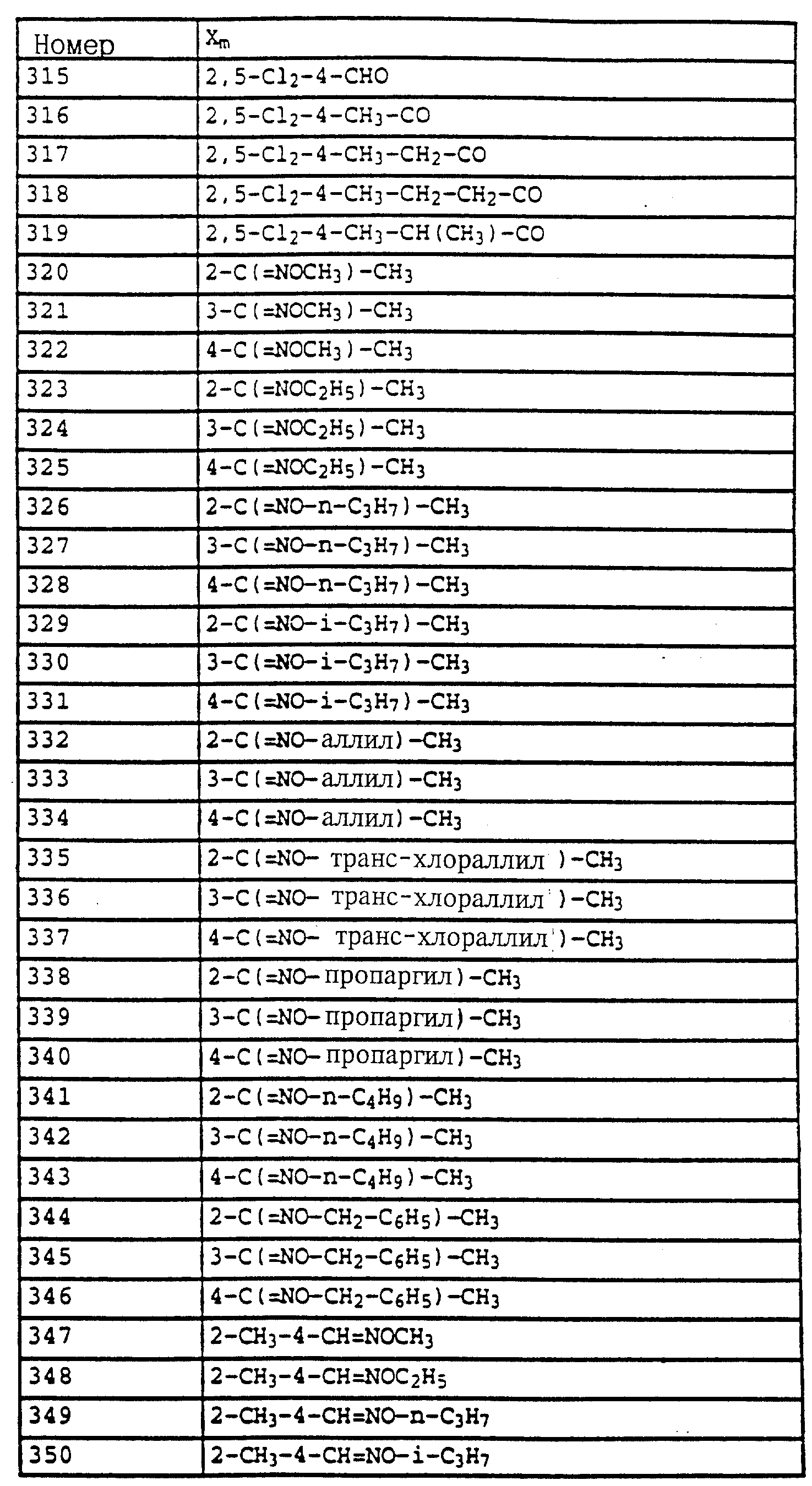
R - водород, алкил, галогензамещенный алкил, алкенил, алкинил, алкоксил, алкенилокси, алкинилокси, циклопропилметил, -CH2CN, -CH2OCH3, -CH2OCH3, -CO2CH3-, O-CO2-алкил или -S-R5, где R5 обозначает алкил, циклопропилметил;
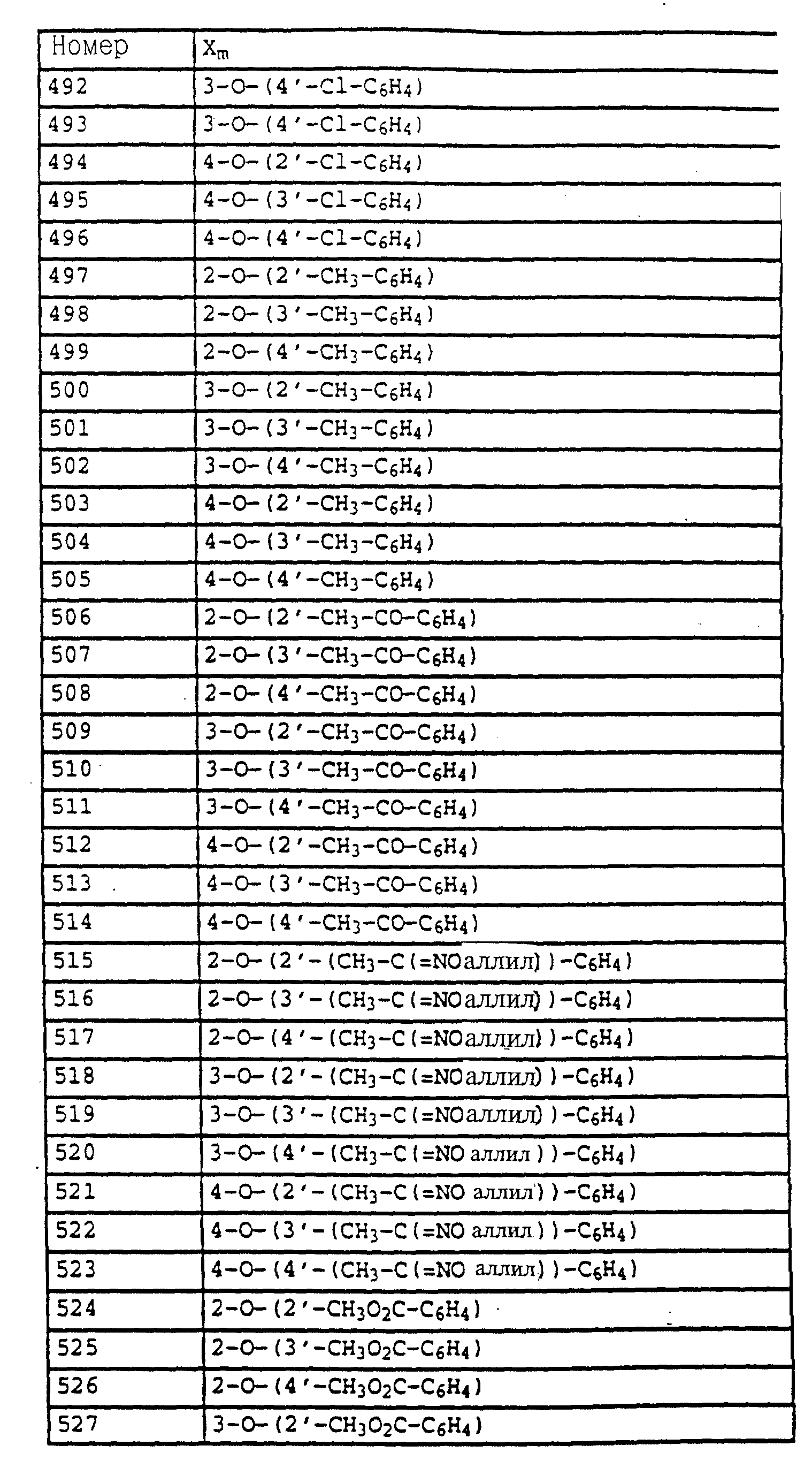
A обозначает -O-, -CH2-, CH=CH-, -CH2-O-N=C(R4)-, где R4 является алкилом, алкоксилом; -CH2O-, -CH=N-O-, -CHR2S-, где R2 - водород; CH2-O-CO- либо простую связь;
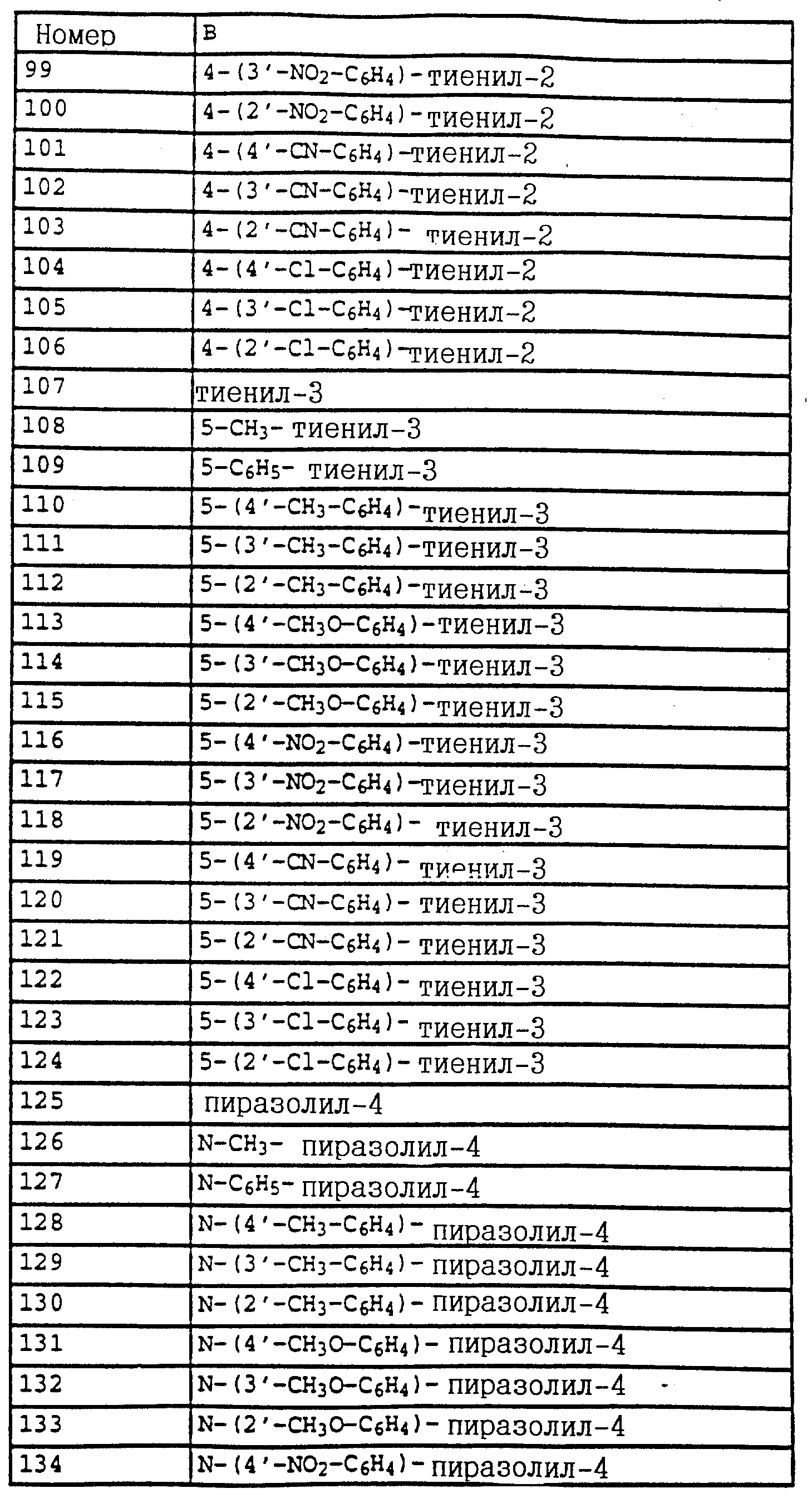
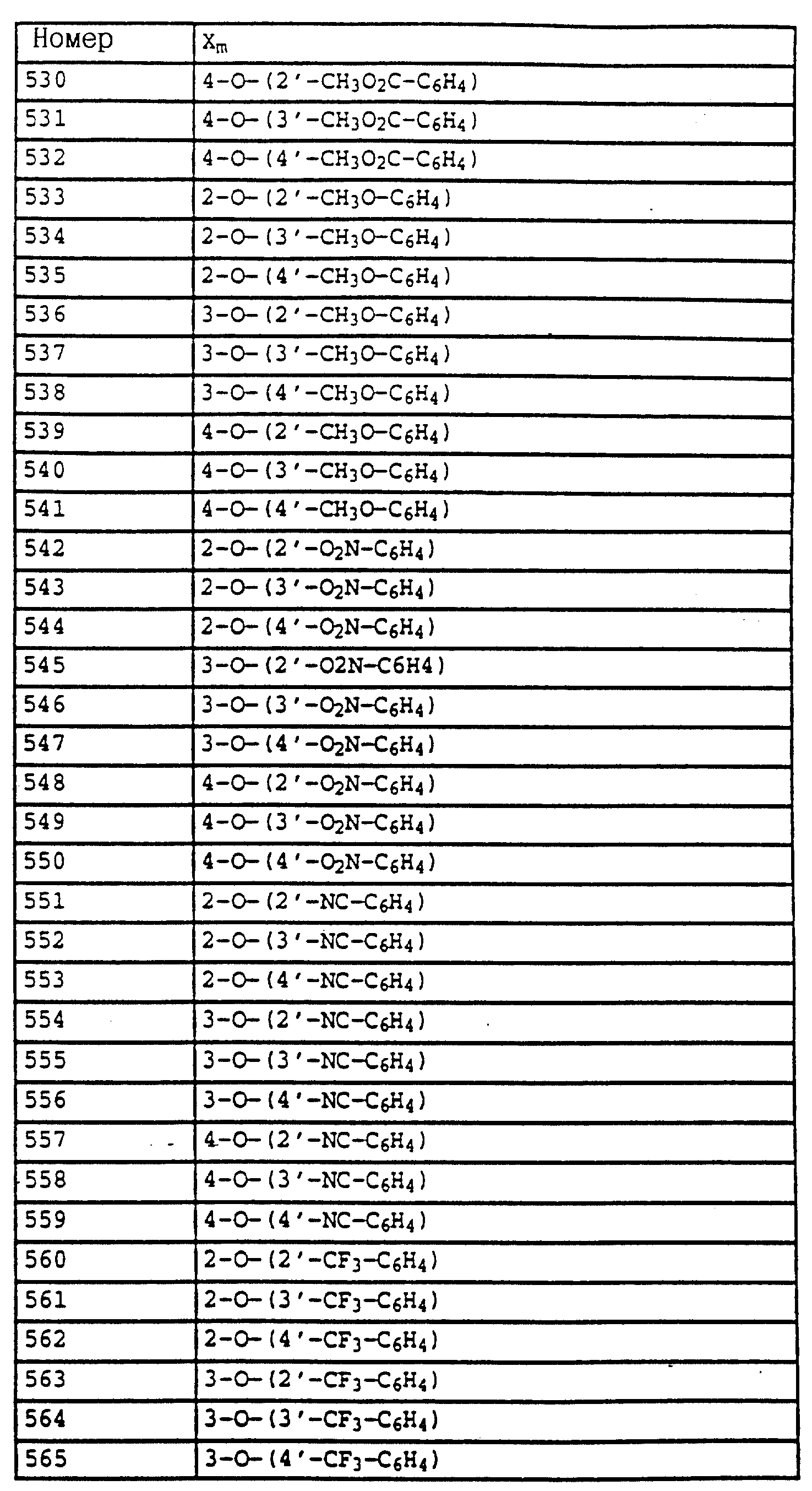
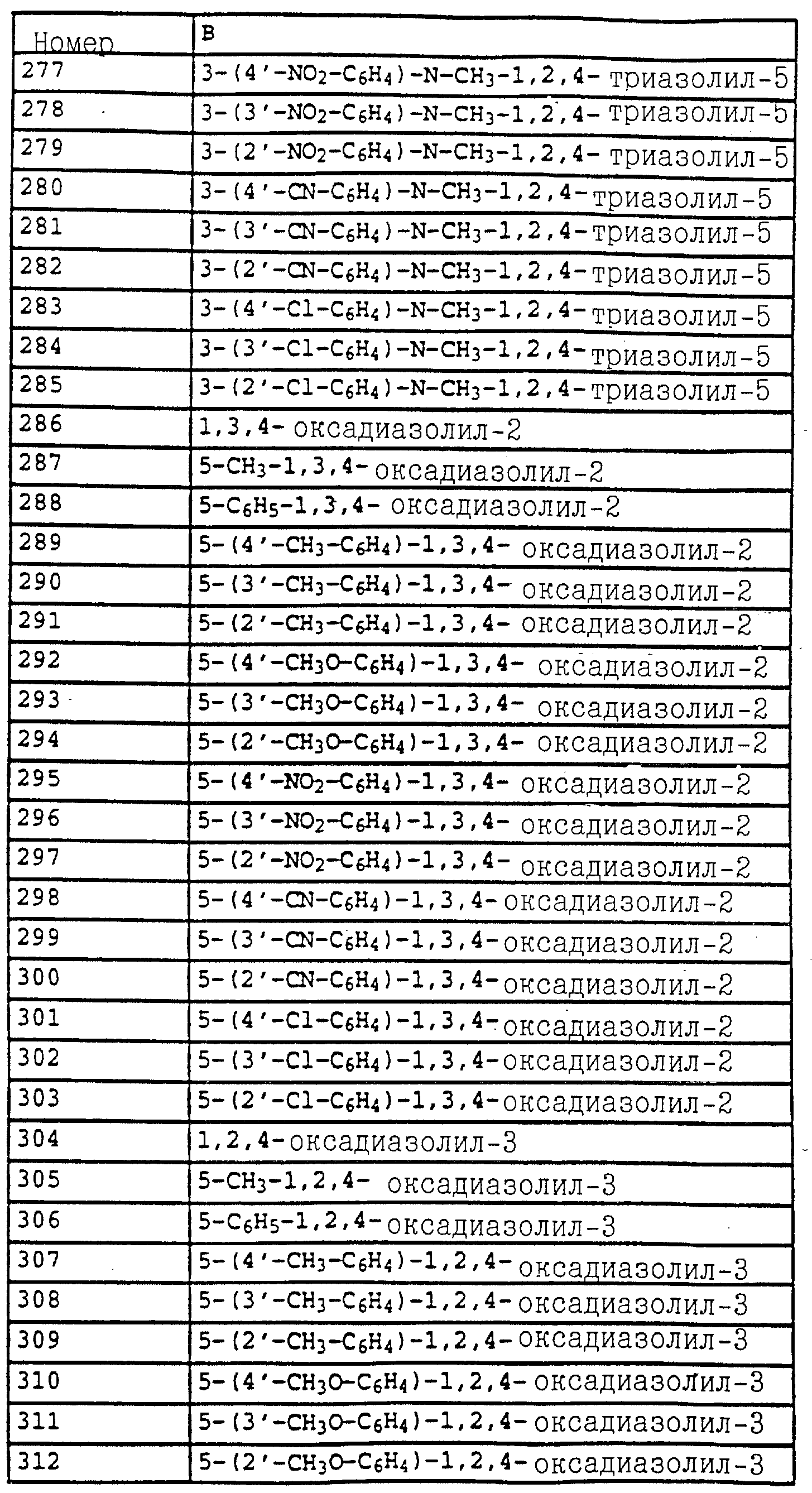
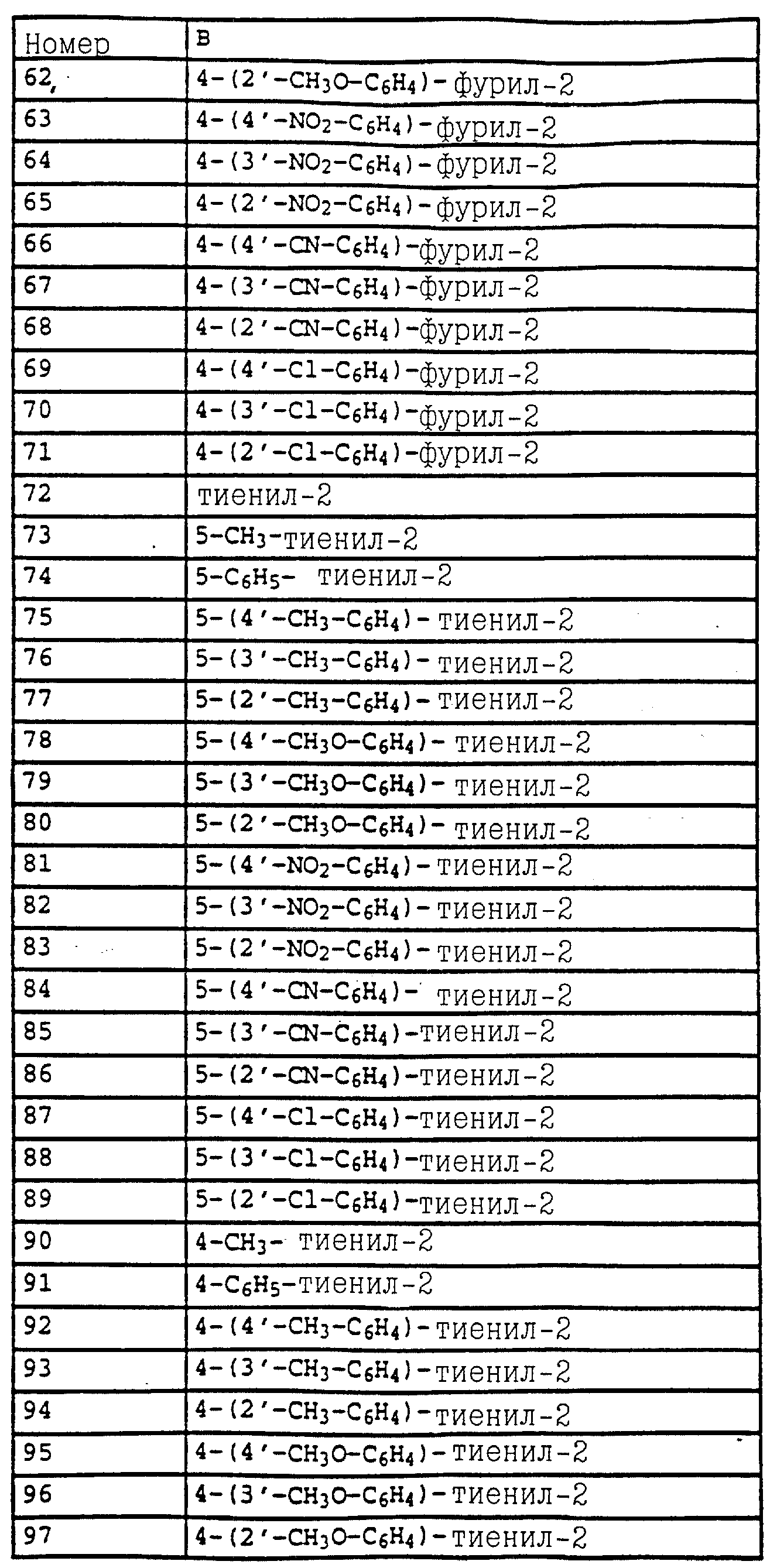
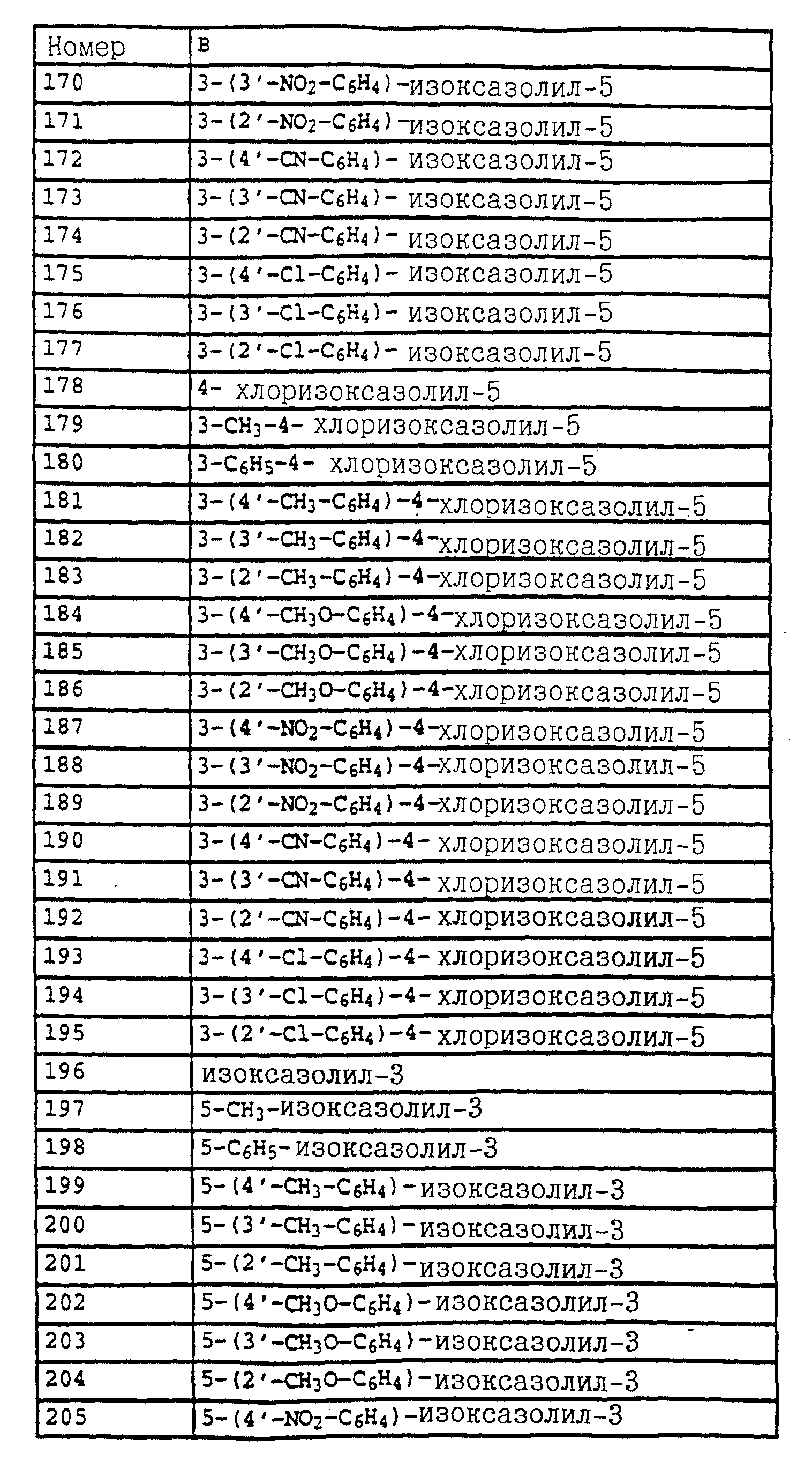
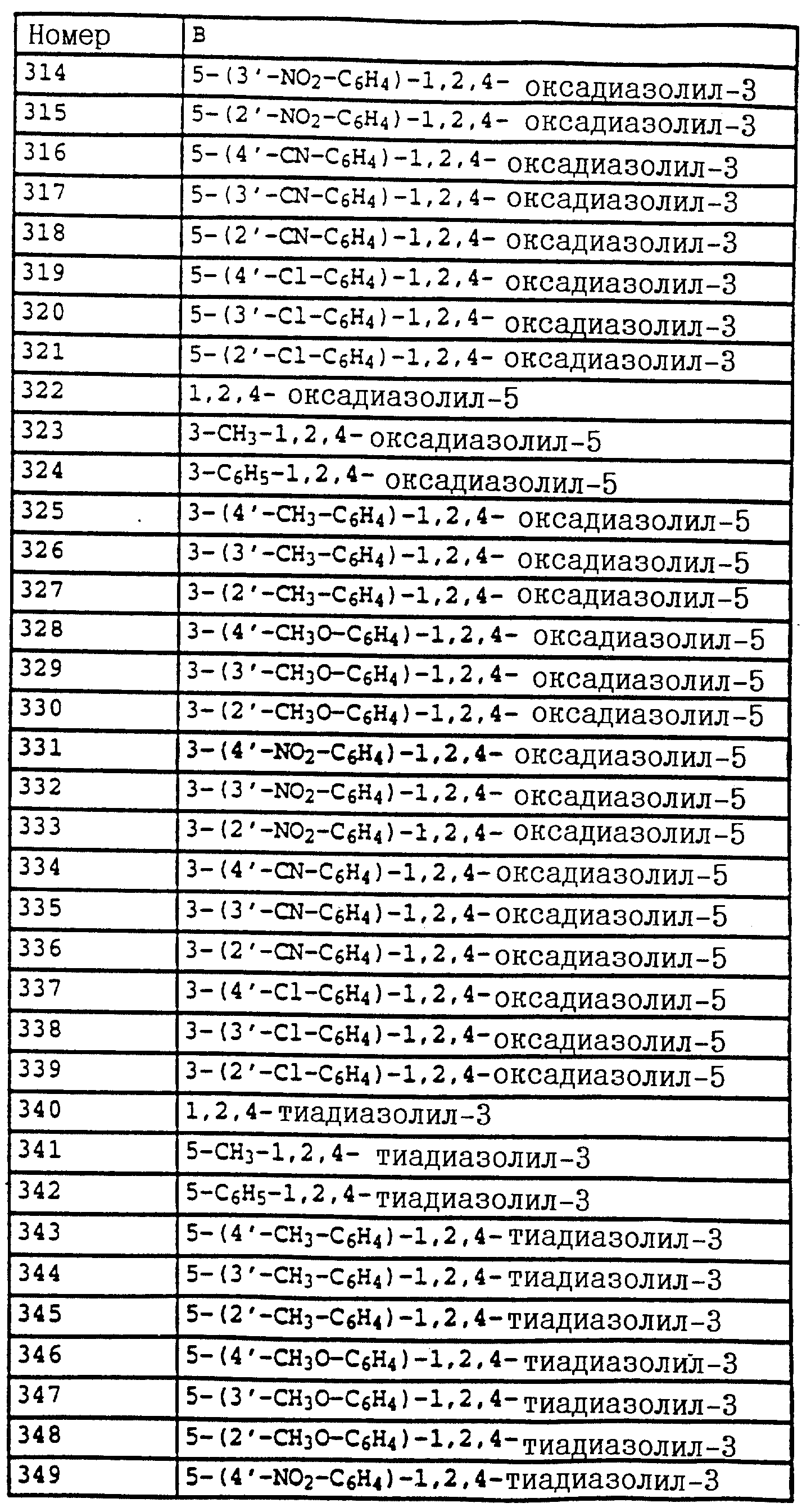
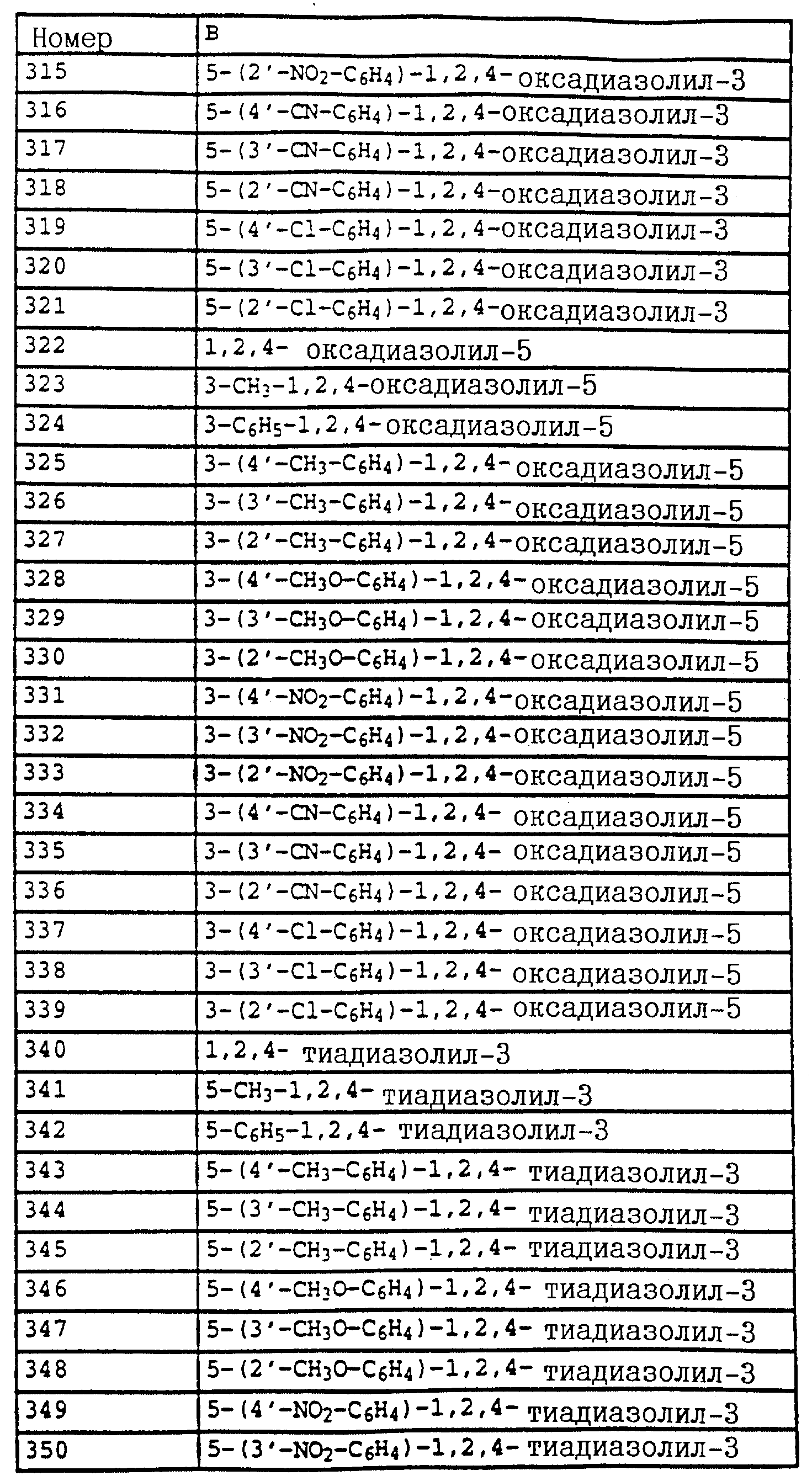
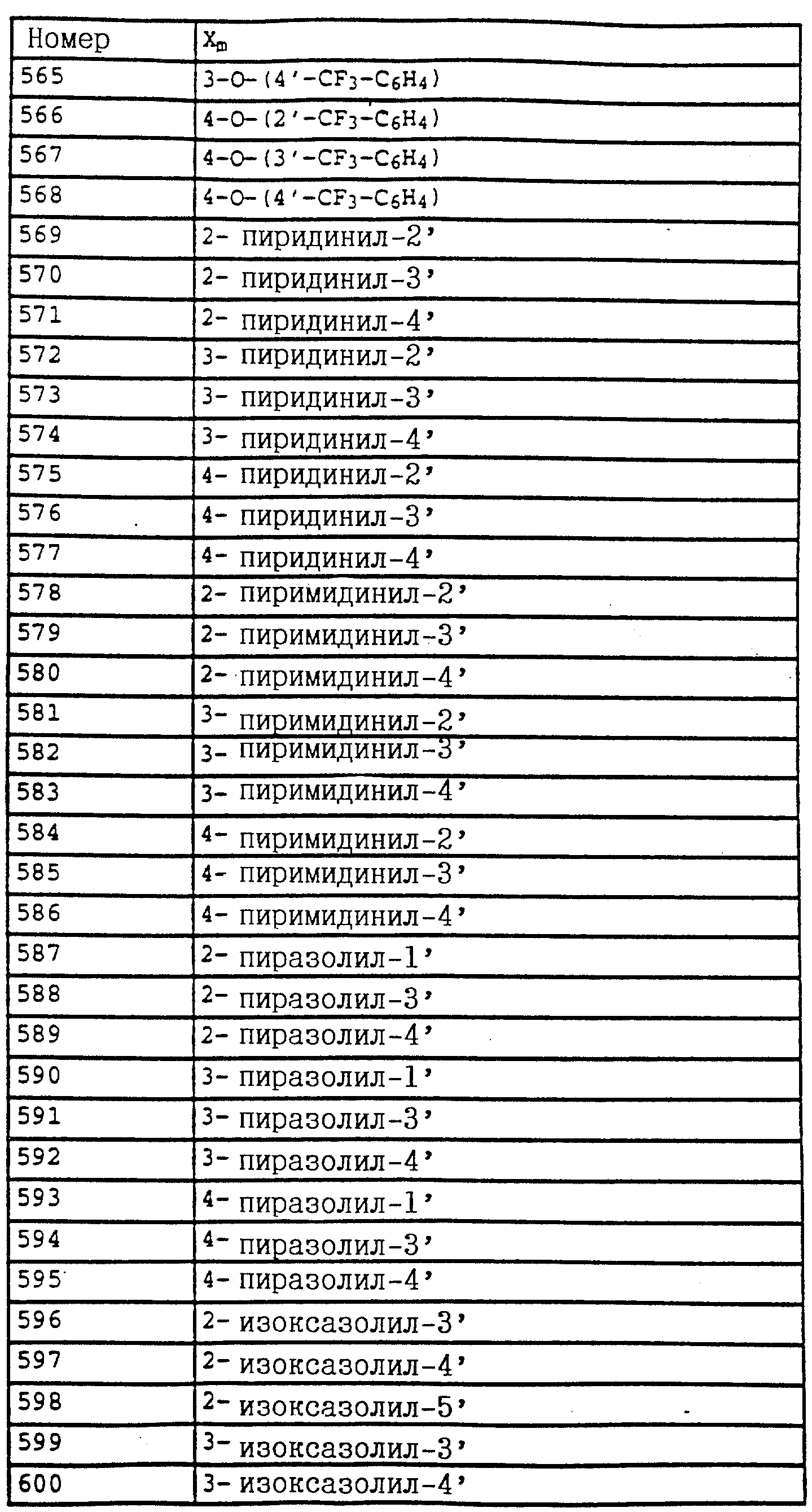
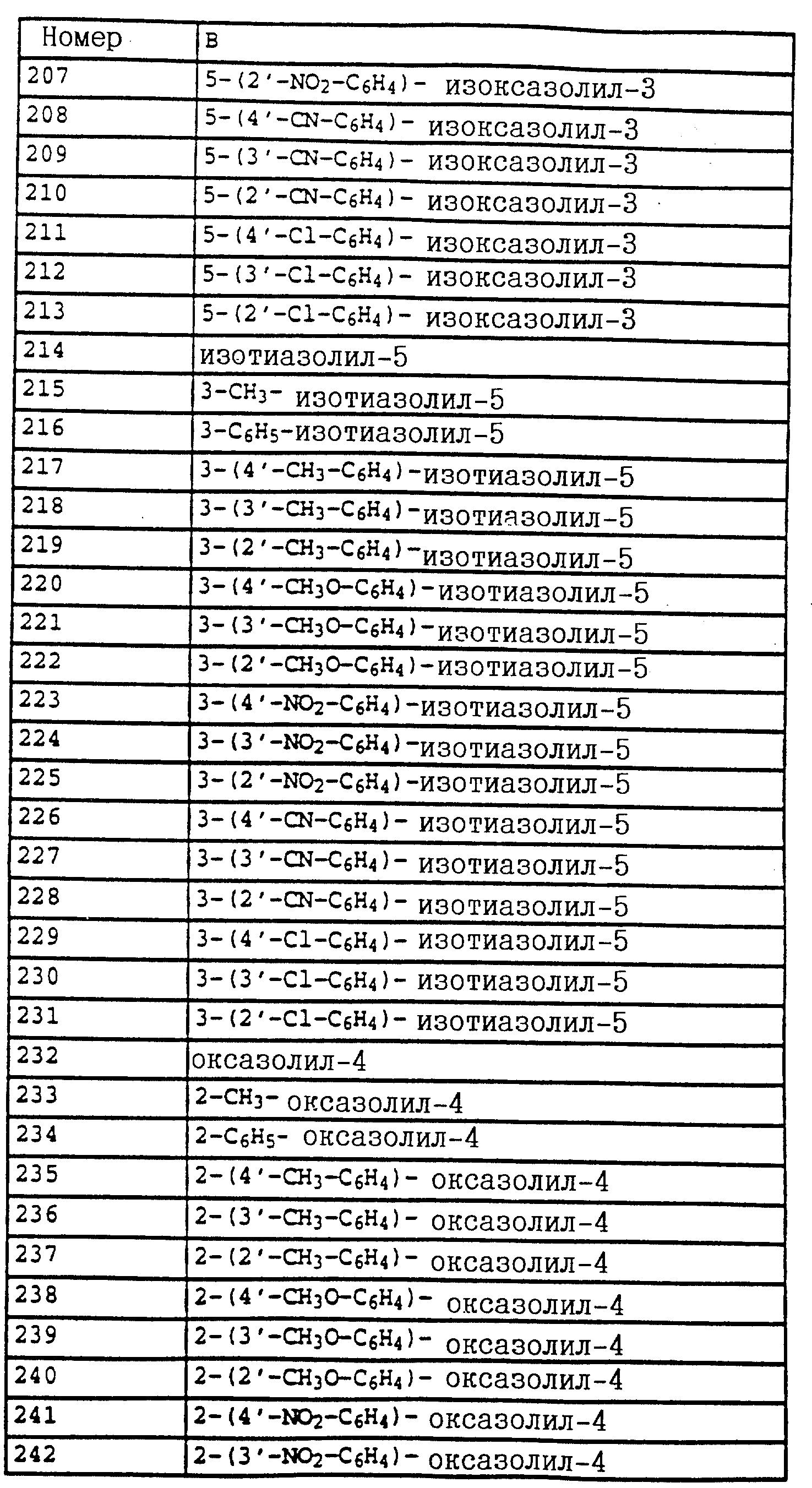
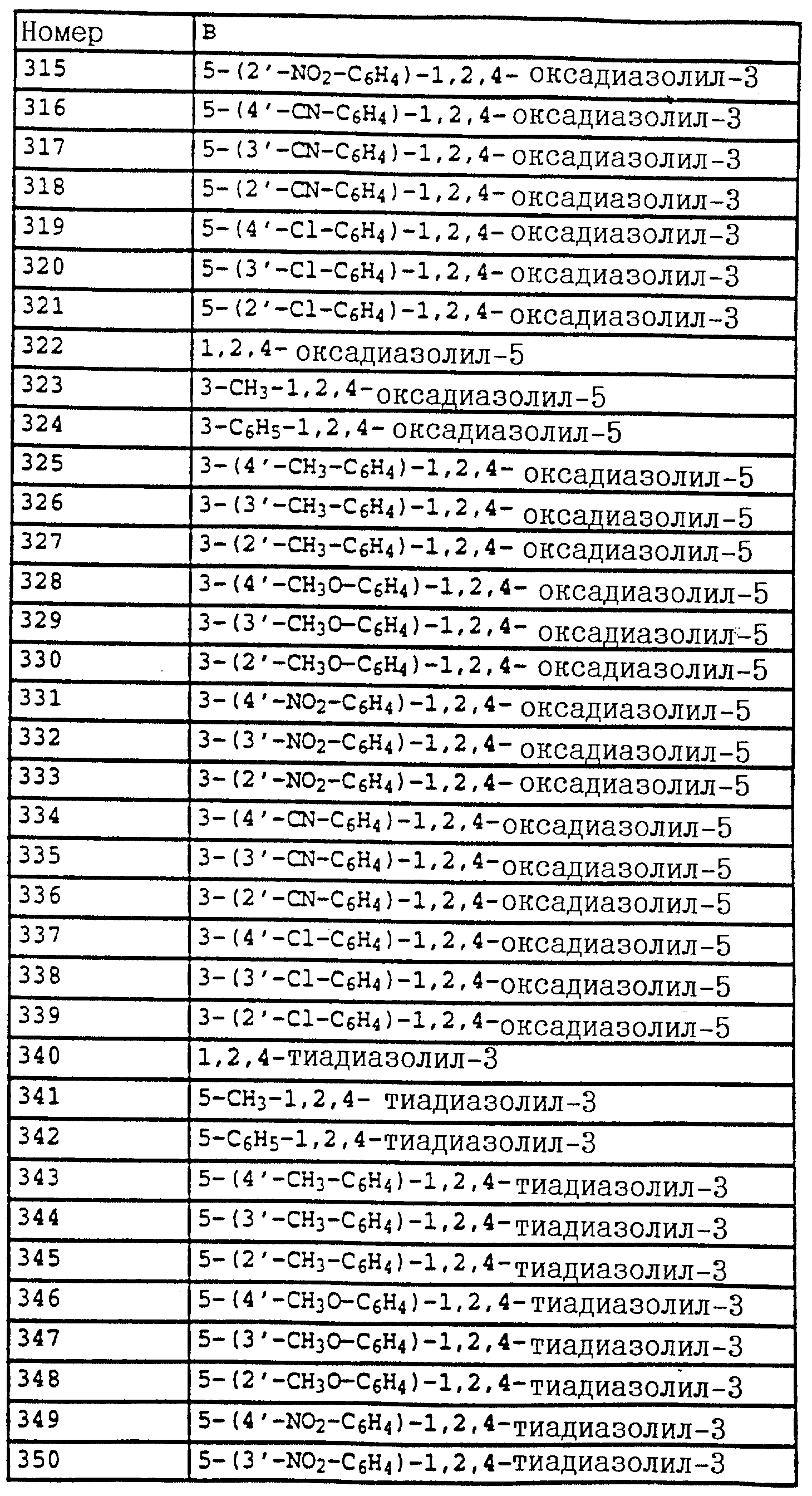
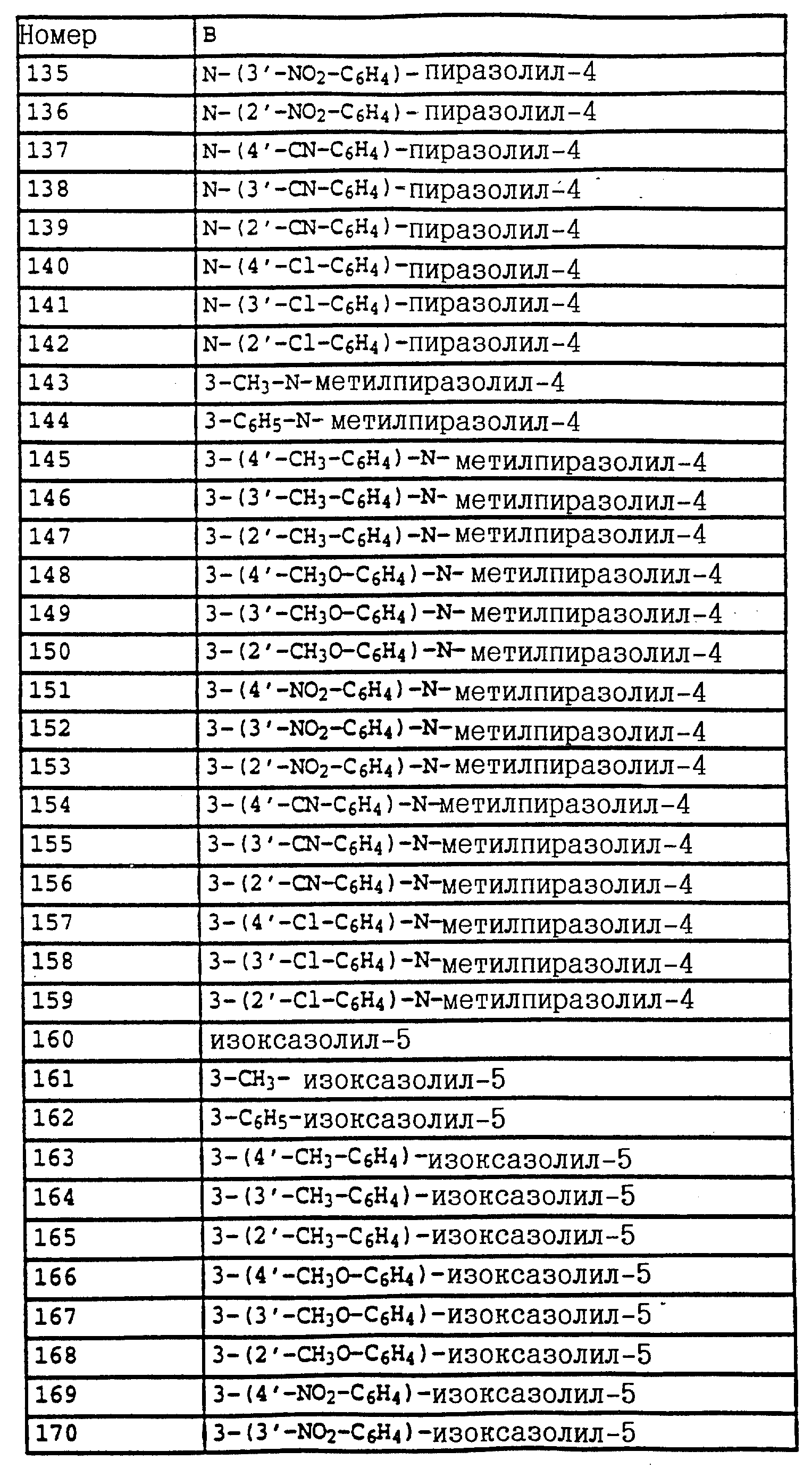
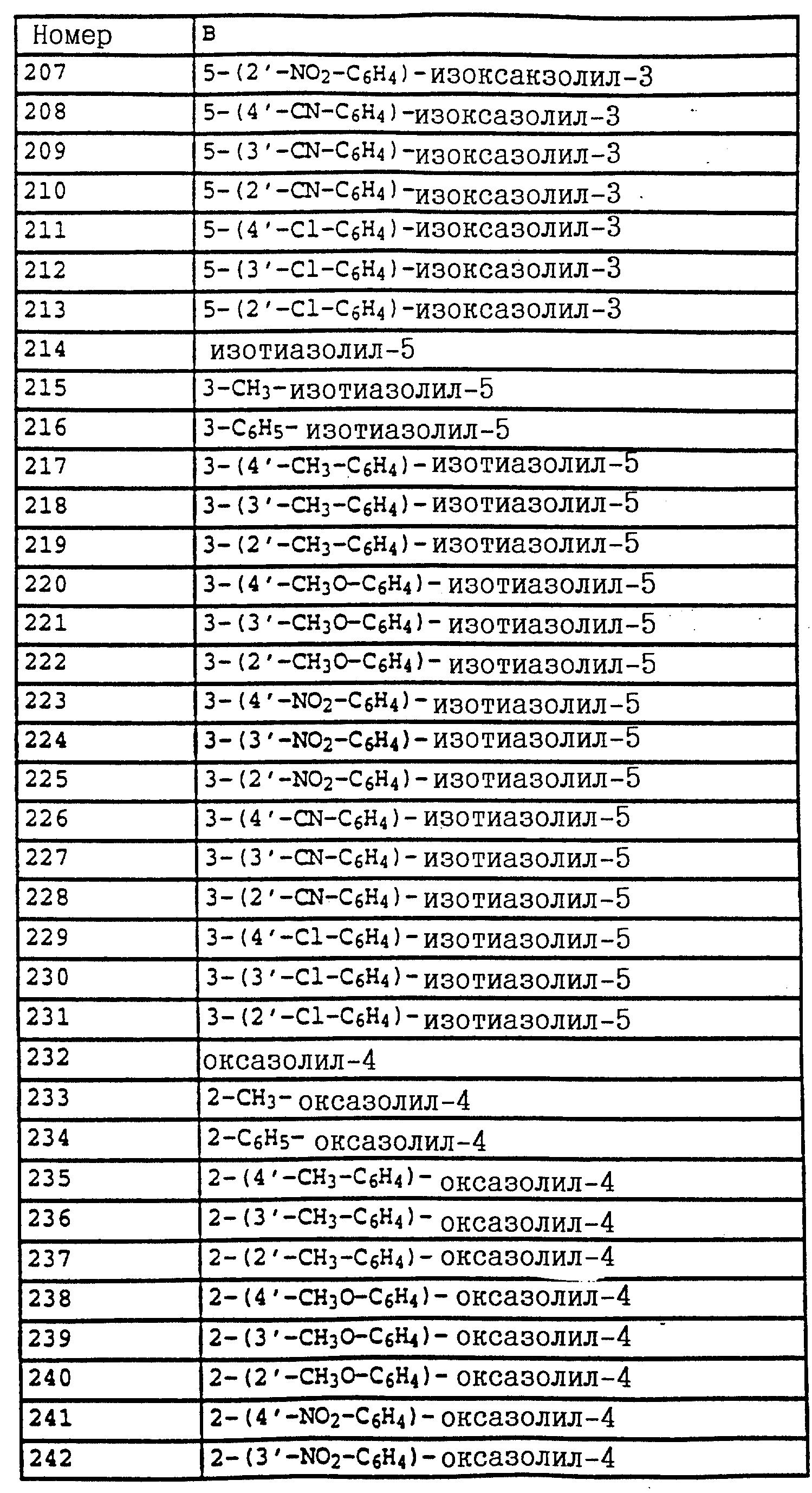
B - фенил, незамещенный или замещенный алкилом, галогеном, циано-, нитрогруппой, галоидалкилом, алкоксилом, галоидалкоксилом, цианзамещенным алкилом, фенилом, феноксигруппой, группой формулы CRa=N-ORb где Ra - водород или низший алкил, а Rb-алкил, алкенил, который может быть замещен галогеном; 5- или 6-членное гетероароматическое кольцо, содержащее от одного до трех атомов азота или атом серы или кислорода с одним или двумя атомами азота, причем гетероароматическое кольцо может быть замещено алкилом, галоидалкилом, изоксазолом, который может быть замещен, алкилом, фенилом, который может быть замещен галогеном и алкилом; пиридинилом, который может быть замещен галогеном, алкилом, галоидалкилом, группой формулы CRa =N-ORb и фенилом, который может быть при определенных условиях замещен галогеном и низшим алкилом; триазолилом, который может быть замещен алкилом, фуранилом, группой формулы CRa =N-ORb; алкил, который может быть замещен галогеном, фенилом, феноксигруппой; нафтил, бензотиазолил, бензоксазолил, хинолинил, которые могут быть замещены галоидалкилом; группа N = циклогексил.
Для получения совместимых с растениями аддитивных солей карбаматов формулы I с кислотами могут быть использованы, в частности, минеральные кислоты, такие, как, например, хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота, азотная кислота, или же карбоновые кислоты, такие как муравьиная кислота, уксусная кислота, щавелевая кислота, малоновая кислота, молочная кислота, яблочная кислота, янтарная кислота, винная кислота, лимонная кислота, салициловая кислота, п-толуолсульфокислота, додецилбензолсульфокислота, а также протоноазидные соединения, например, сахарин.
Для получения солей с основаниями могут быть использованы, например, гидроокись калия и натрия, карбонат калия и натрия, гидроокись аммония.
Новые соединения формулы I могут быть получены в виде смесей стереоизомеров (E/Z-изомеры, диастереомеры, энантиомеры), которые могут разделяться обычным путем, например, посредством кристаллизации или хроматографии, на отдельные компоненты. Как отдельные изомеры, так и их смеси могут использоваться в качестве фунгицидов, и они также являются объектом изобретения.
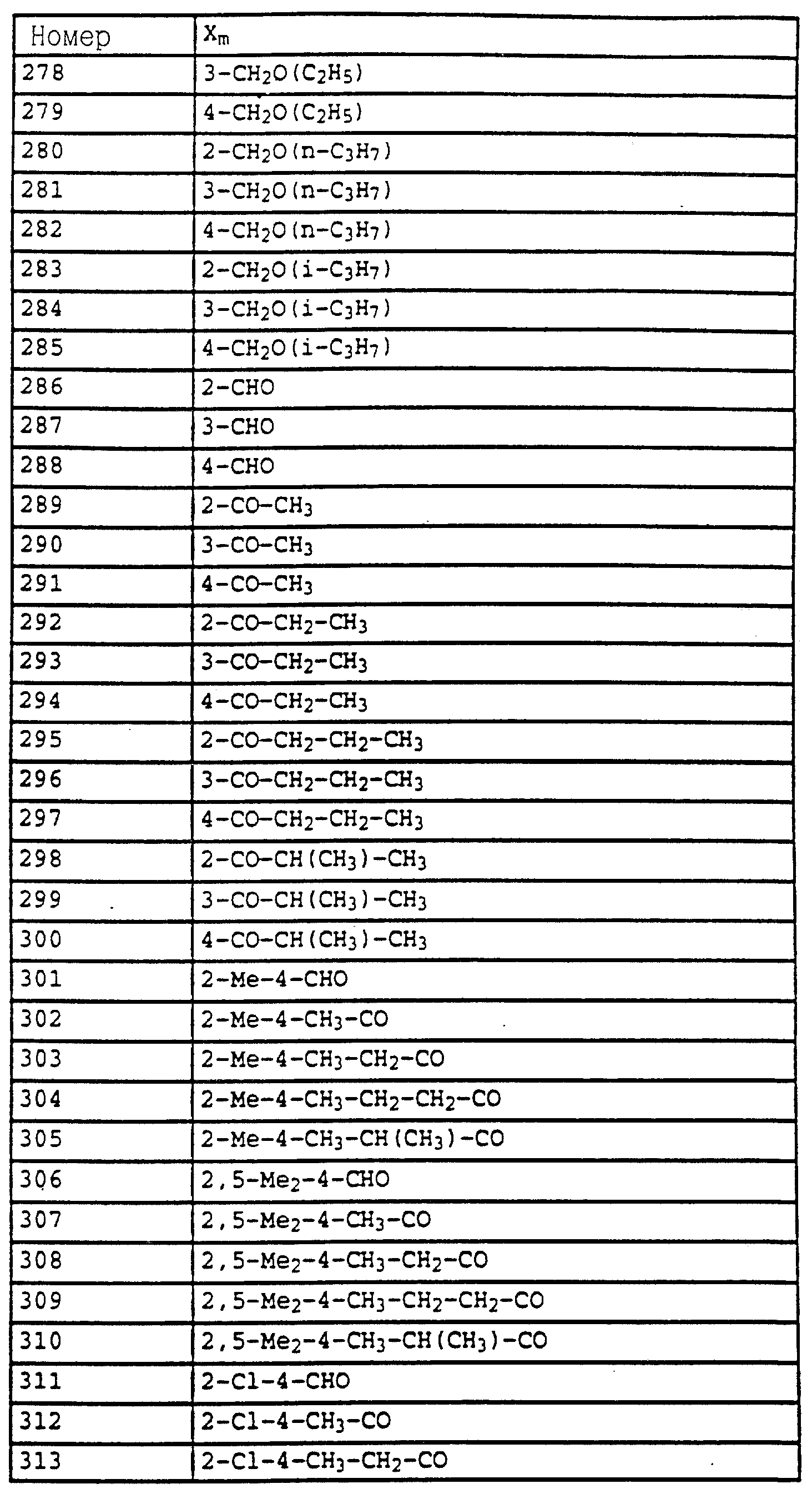
Названные выше алкилы могут быть замещены, имеют предпочтительно 1-6 атомов углерода и обозначают прежде всего метил, этил, пропил, н-пропил, изопропил, бутил, н-бутил, изобутил, трет. -бутил, s-бутил, пентил либо гексил.
Названные выше алкенилы могут быть замещены, имеют предпочтительно 2-6 атомов углерода и обозначают прежде всего этенил, пропенил, пропен-(1)-ил, пропен-(2)-ил, пропен-(1)-ил-(2), бутенил, бутен-(1)-ил, бутен-(2)-ил, бутен-(3)-ил, бутен-(1)-ил-(3), бутен-(2)- ил-(2), бутен-(1)-ил-(2), 2-метилпропенил-(1), 2-метилпропенил-(2), пентенил либо гексенил.
Названные выше алкинилы могут быть замещены, имеют предпочтительно 2-6 атомов углерода и обозначают прежде всего этинил, пропинил, пропин-(1)-ил, пропин-(3)-ил, бутинил, бутин-(1)-ил, бутин-(2)-ил, бутин-(3)-ил, 1-метилпропин-(2)-ил, пентенил либо гексенил.
Названные выше галогены представляют собой фтор, хлор, бром либо йод.
Названные выше галоалкильные радикалы обозначают предпочтительно C1-C4-галогеналкил, прежде всего C1-C2-галогеналкил, как хлорметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, хлорфторметил, дихлорфторметил, хлордифторметил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2-хлор-2-фторэтил, 2-хлор-2,2-дифторэтил, 2, 2-дихлор-2-фторэтил, 2,2,2-трихлорэтил либо пентафторэтил.
Названные выше галоалкоксирадикалы обозначают предпочтительно C1-C4-галогеналкокси, прежде всего C1-C4-галогеналкокси, как хлорметилокси, дихлорметилокси, трихлорметилокси, фторметилокси, дифторметилокси, трифторметилокси, хлорфторметилокси, дихлорфторметилокси, хлордифторметилокси, 1-фторэтилокси, 2- фторэтилокси, 2,2-дифторэтилокси, 2,2,2-трифторэтилокси, 2-хлор-2-фторэтилокси, 2-хлор-2,2-дифторэтилокси, 2,2-дихлор-2-фторэтилокси, 2,2,2-трихлорэтилокси либо пентафторэтилокси.
Названные выше нафтилы обозначают предпочтительно 1-нафтил, 2-нафтил.
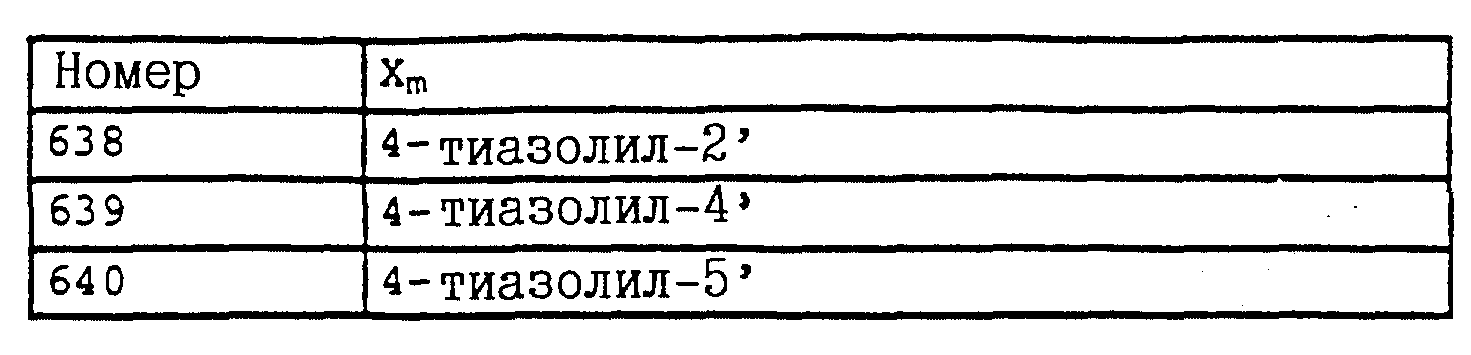
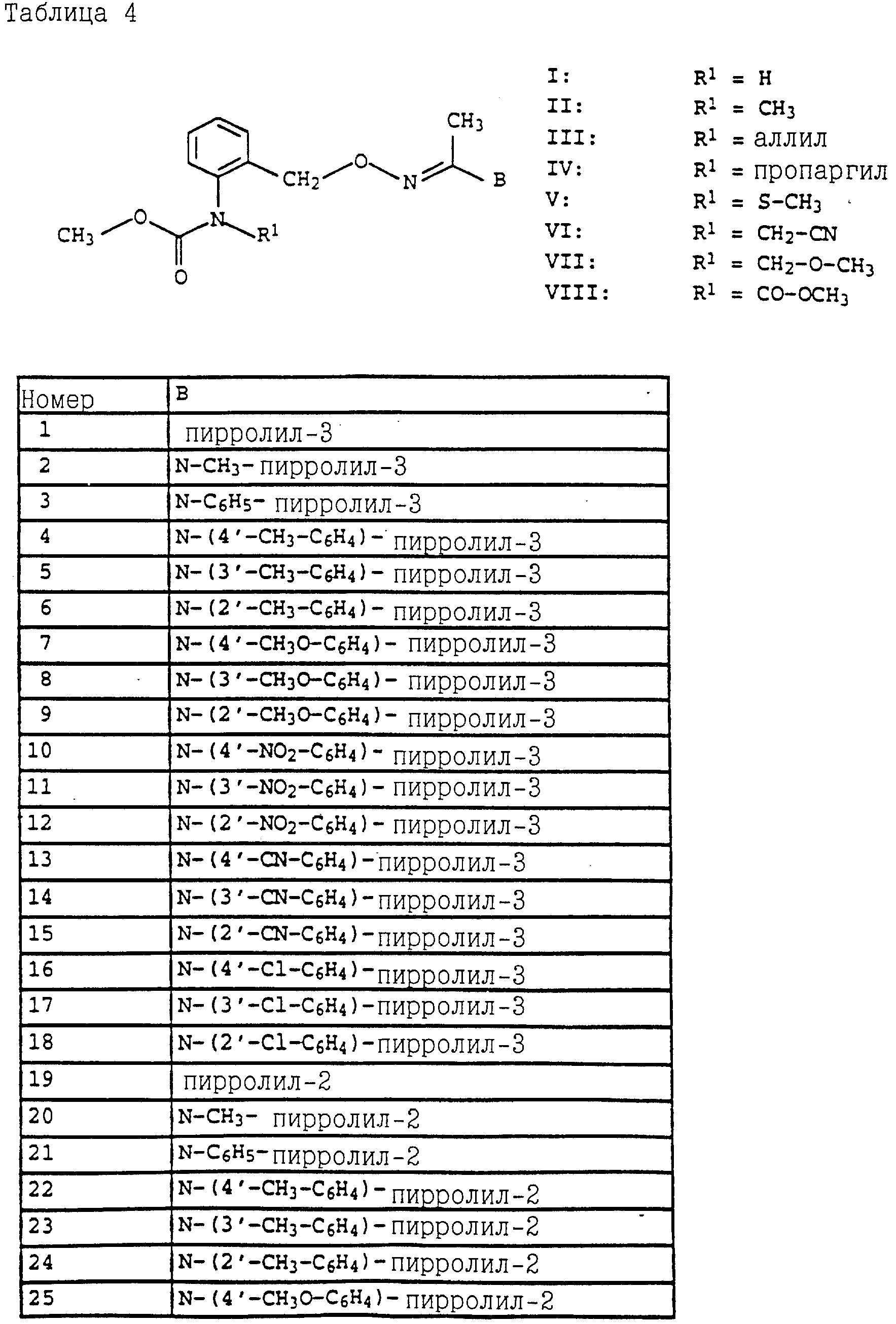
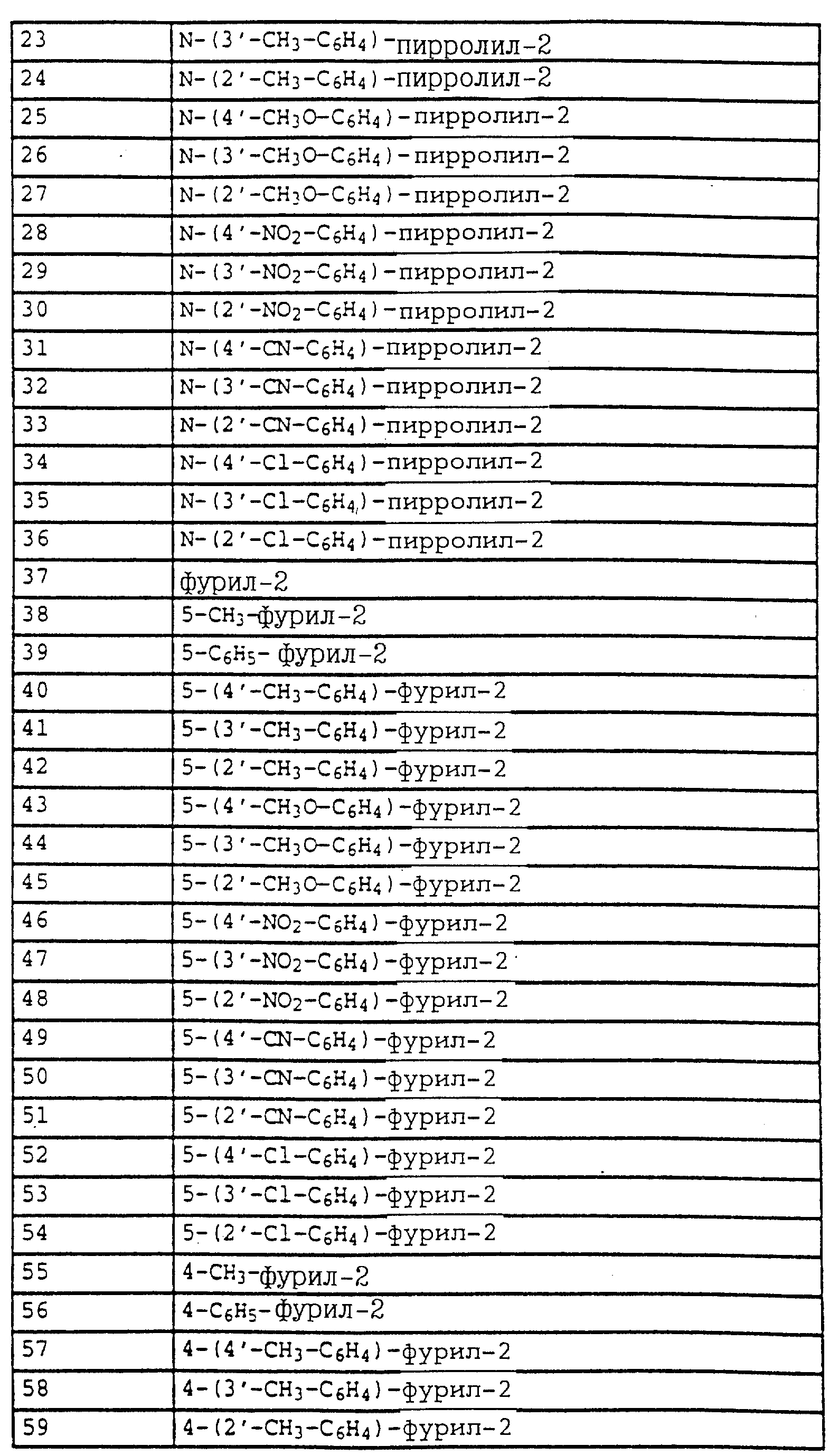
Названные выше гетарилы обозначают предпочтительно фурил, 2-фурил, 3-фурил, тиенил, 2-тиенил, 3-тиенил, пирролил, 1-пирролил, 2- пирролил, 3-пирролил, изоксазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, изотиазолил, 3-изотиазолил, 4-изотиазолил, 5-изотиазолил, пиразолил, 1-пиразолил, 3-пиразолил, 4-пиразолил, 5-пиразолил, оксазолил, 2- оксазолил, 4-оксазолил, 5-оксазолил, тиазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, имидазолил, 1-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, пиридил, 2-пиридил, 4-пиридил, пиридазинил, 3-пиридазинил, 4-пиридазинил, пиримидинил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, пиразинил, 2-пиразинил, 3-пиразинил, 1,2,4-триазинил, 1,3,5-триазинил.
Предпочтительны карбаматы формулы Ia

где Z - метоксигруппа
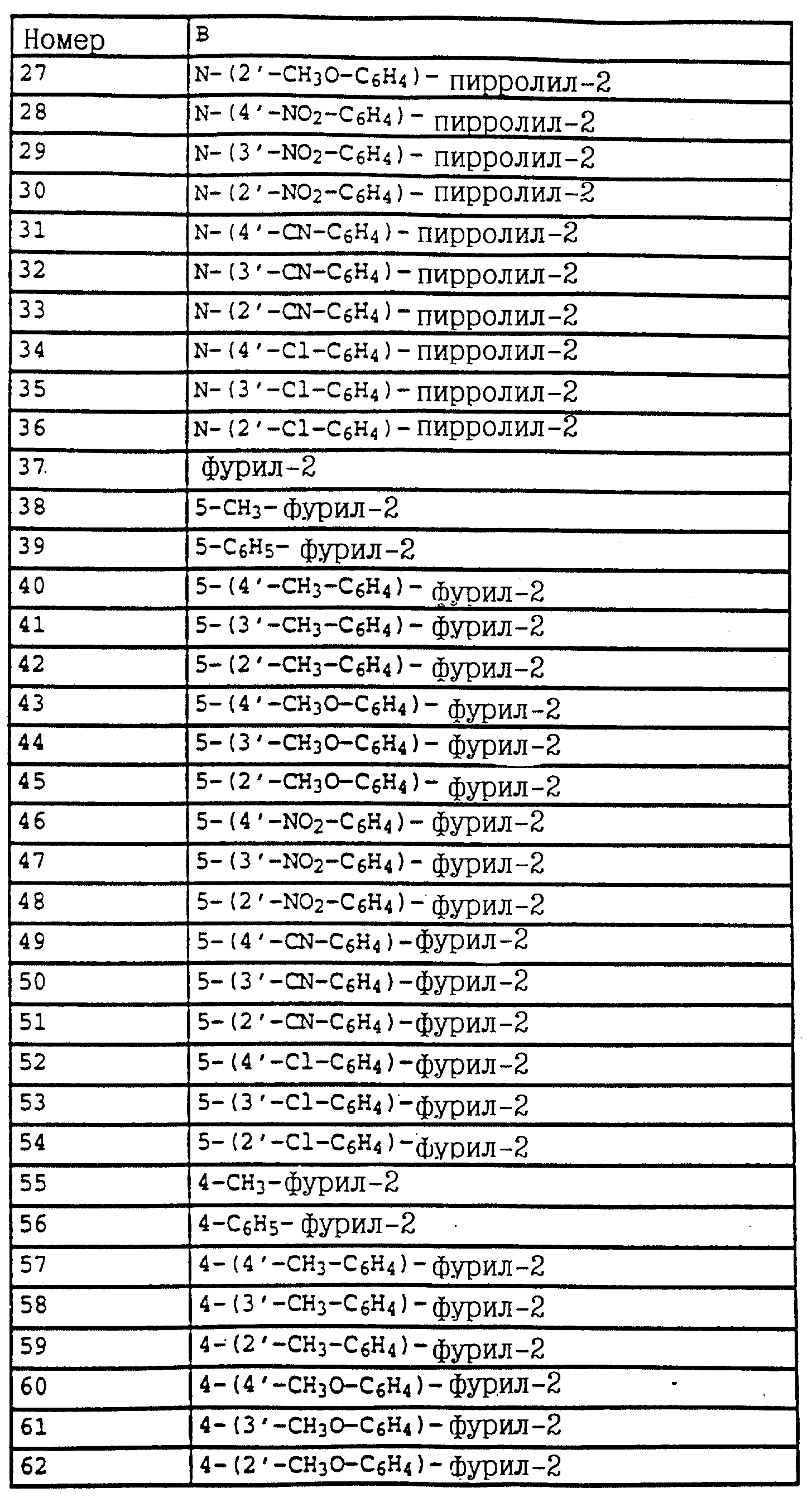
X и Y независимо друг от друга - водород, F, Cl, Br;
R1 - водород, алкил, алкенил, алкинил, циклопропилметил, -CH2-CN, CH2-O-CH3, -CO2CH3 либо -S-R5, где R5 - алкилциклопропилметил;
A - -О-, -CH=CH-, -CH2-O-, -CH2-S-, -CH=N-O-, -CH2-O-N=C(R4)-, где R4 является алкилом;
B обозначает: а) замещенный фенил, указанный выше, если A представляет собой -CH= CH-, -CH2-O-, -CH2-S-, -CH2-O-N=(CR4)-, где R4 является алкилом; -CH=N-O-, б) или B имеет значения, указанные выше,
и их совместимые с растениями аддитивные соли кислот и оснований.
Особенно предпочтительны карбаматы формулы Ia, в которой R1
- CH2-C≡CH, X и Y - водород, A - -CH2-O-N=CCH3- и B - 4-бромфенил, и карбаматы формулы Ia, в которой R1 - водород, X и Y - водород, A - -O- и B
- пиримидин-5-ил-4-O-2- метилфенил, в частности, карбаматы формулы II

в которой X, Y, R1 и B имеют значения, указанные для соединений формулы Ia,
или карбаматы формулы III
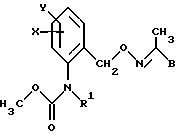
в которой X, Y, R1 и B имеют значения, указанные для соединений формулы Ia,
либо карбаматы формулы Ia, в которой A - радикал -CH=CH-, а X, Y, R1 и B имеют значения, указанные для соединений формулы Ia.
Предпочтительны также карбаматы формулы VII

где X и Y независимо друг от друга - водород, алкил, F, Cl, Br;
R1 - алкил, алкенил, алкинил;
A - -O-, -CH= CH-, -CH2-O-, -CH2-S-, -CH2-O-N=C(R4)-, где R4 - алкил, алкоксил; -CH2=N-O-, либо простую связь,
B имеет значения, указанные для соединений формулы I,
и их совместимые с растениями аддитивные соли с кислотами или основаниями, в частности карбаматы формулы VIII

в которой A, B и R1 имеют значения, указанные для соединений формулы VII,
или карбаматы формулы IX
в которой R1 и B имеют значения, указанные для соединений формулы VII,
или карбаматы формулы X

в которой R1 и B имеют значения, указанные для соединений формулы VII.
Среди предпочтительных карбаматов
можно назвать карбаматы формулы XIV

где Z - NH2 NHCH3, N(CH3 )2, CH3, C2H5, CF3 либо CCl3;
X и Y независимо друг от друга - водород, алкил, F, Cl, Br;
R1 обозначает алкил, алкенил, алкинил, возможно замещенный алкил;
A обозначает -O-, -CH=CH-, -CH2-O-, -CH2S- , -CH2-O-N=C(R4)-, где R4 - алкил, алкоксил, -CH2-O-CO-; или простую связь;
B имеет значения, указанные для соединений формулы I,
и их совместимые с растениями аддитивные соли кислот и основании;
либо карбаматы формулы XV

где A, B, Z и R1 имеют значения, указанные для соединений формулы I,
X и Y независимо друг от друга - водород, алкил, F, Cl или Br.
Особенно предпочтительны карбаматы формулы XV, где Y - водород, или X и Y - водород, или
карбаматы формулы XVI

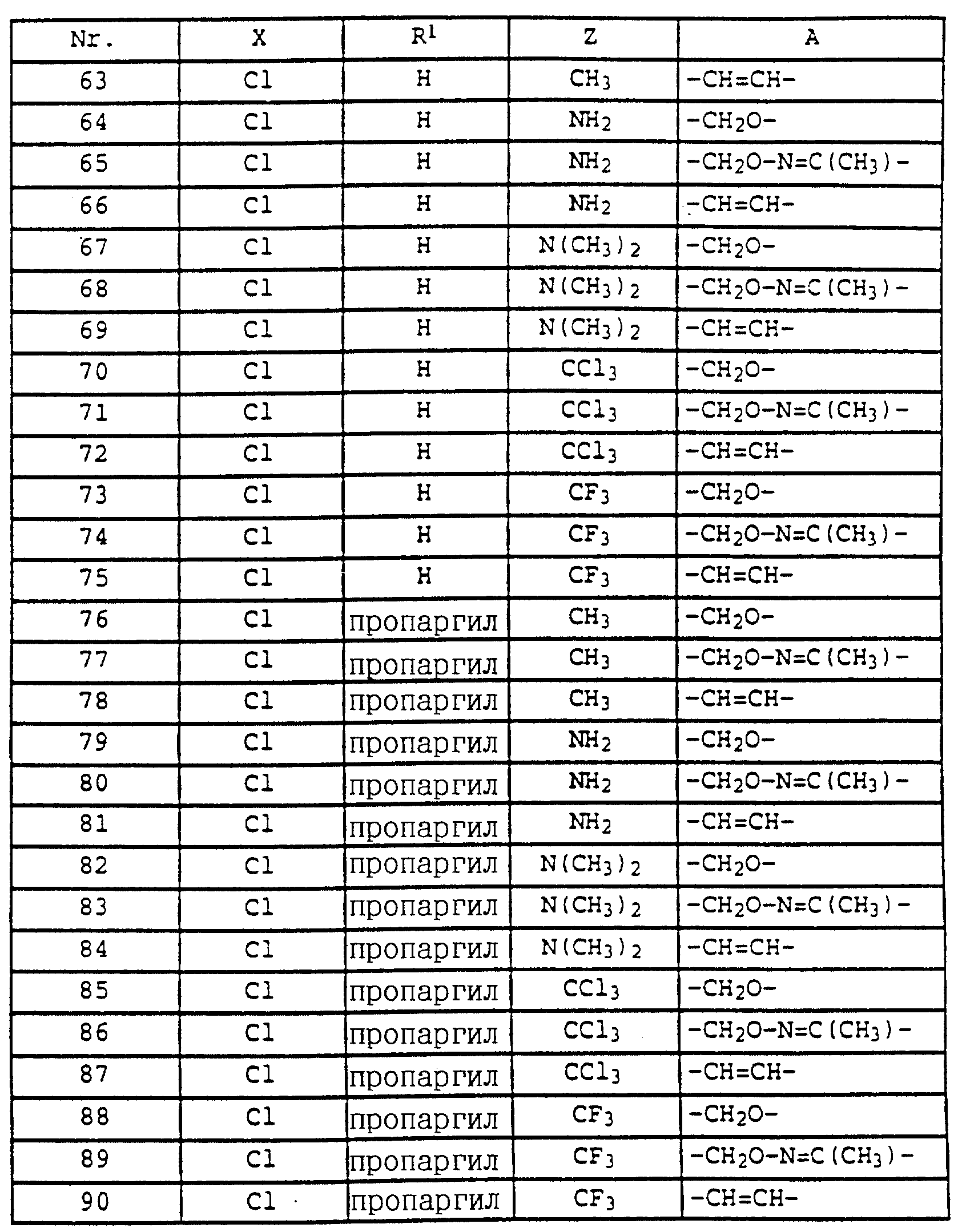
где R1, X, Y и B имеют значения, указанные для соединений формулы XV,
в частности карбаматы формулы XVI, в которой Y - водород или X и Y - водород, или карбаматы формулы XVII
в которой R1, X, Y, Z и B имеют значения, указанные для соединений формулы XV;
либо карбаматы формулы XVIII

в которой R1, X, Y, Z и B имеют значения, указанные для соединений формулы XV;
либо карбаматы формулы XIX

в которой R1, X, Y, Z и B имеют значения, указанные для соединений формулы Ia.
Предпочтительны также карбаматы формулы XXV
где X и Y независимо друг от друга - F, Cl, Br, алкил или Y - водород;
R1 - алкил, алкенил, алкинил, -CO2CH3, возможно замещенный алкил;
A обозначает -O-, -CH=CH-, -CH2 -O-, -CH2-S-, -CH2-O-N=C(R4)-, где R4 - алкил, алкоксил, -CH=N-O-, -CH2-O-CO-, либо простую связь;
B имеет значения, указанные для соединений формулы I,
в частности карбаматы формулы XXVI

в которой A, B и R1 имеют значения, указанные для соединений формулы XXV;
X и Y независимо друг от друга - F, Cl, Br, C1-C4-алкил, либо Y - водород;
или карбаматы формулы XXVII

в которой R1, X, Y и B имеют значения, указанные для соединений формулы XXV, в частности, те, в которой Y - водород;
или карбаматы формулы XXVIII

в которой R1, X, Y и B имеют значения, указанные для соединений формулы XXV
или карбаматы формулы XXIX

в которой R1, X, Y и B имеют значения, указанные для соединений формулы XXV,
или карбаматы формулы XXX

в которой R1, X, Y и B имеют значения, указанные для соединений формулы XXV.
Также предпочтительны карбаматы
формулы XXXVI

где Z - NH2, NHCH3, N(CH3)2, CH3, C2H5, CF3 либо CCl3;
X и Y независимо друг от друга - водород, алкил, F, Cl, Br;
R1 - водород, алкил, алкенил, алкинил, циклопропилметил, -CH2-CN, CH2-O-CH3, -CO2CH3, -S-R5, где R5 - алкил;
A обозначает -O-, -CH= CH-, -CH2 -O-, -CH2-S-, -CH=N-O- или -CH2-O-N= C(R4)-, где R4 - алкил;
B обозначает: а) замещенный фенил, если A представляет собой -CH=CH-, -CH2 -O-, -CH2-S-, -CH= N-O или -CH2-O-N=C(R4)-, где R4 - алкил; б) B имеет значения, указанные для соединений формулы I,
и их совместимые с растениями аддитивные соли кислот и оснований.
Предпочтительны также карбаматы формулы XXXVII

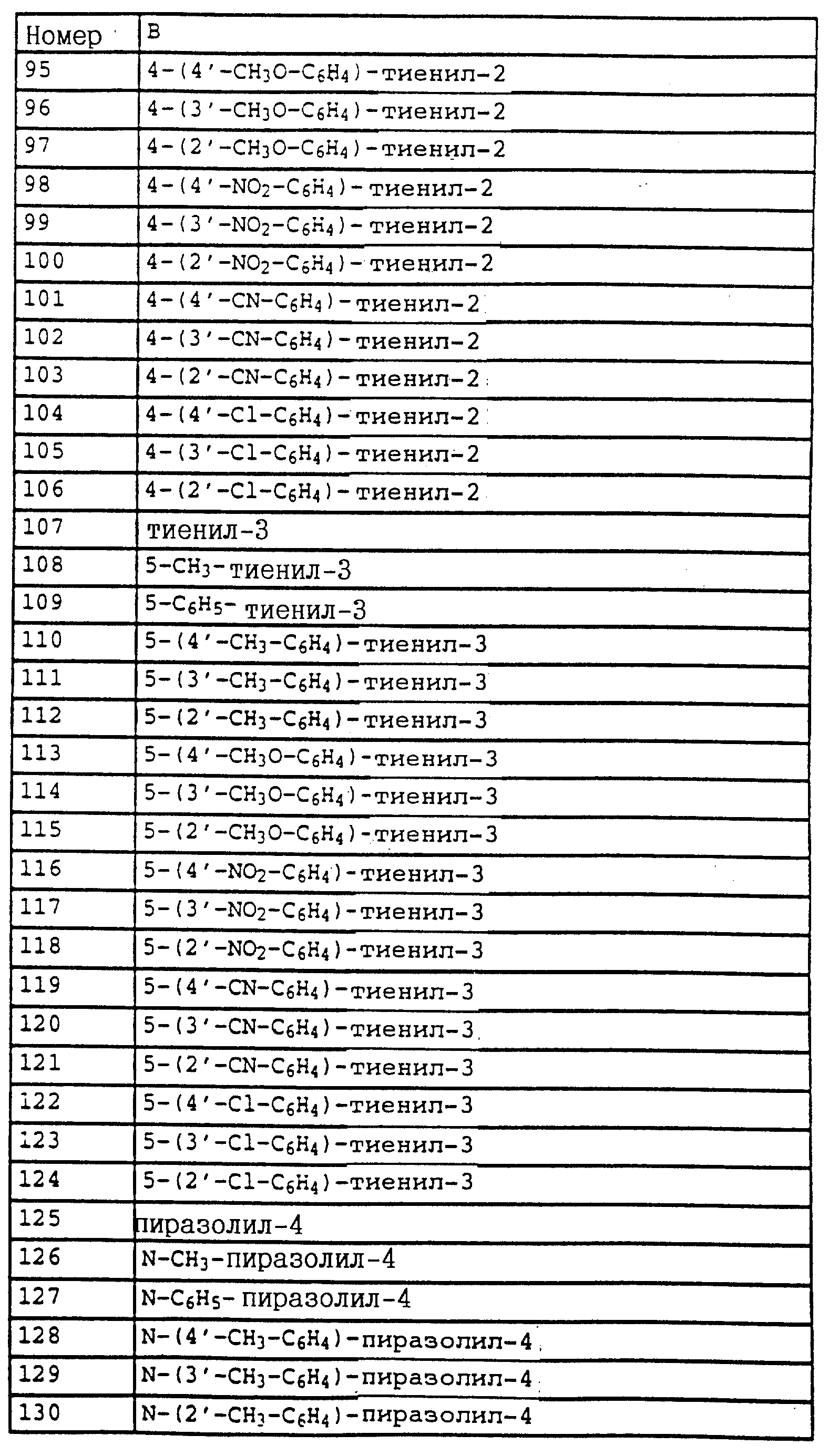
в которой X, Y, R1, Z и B имеют значения, указанные для соединений формулы XXXVI,
или карбаматы формулы XXXVIII

в которой X, Y, R1, Z и B имеют значения, указанные для соединений формулы XXXVI
или карбаматы формулы XXXVI, в которой A - радикал -CH=CH-, а X, Y, R1, Z и B имеют значения, указанные выше для этих карбаматов,
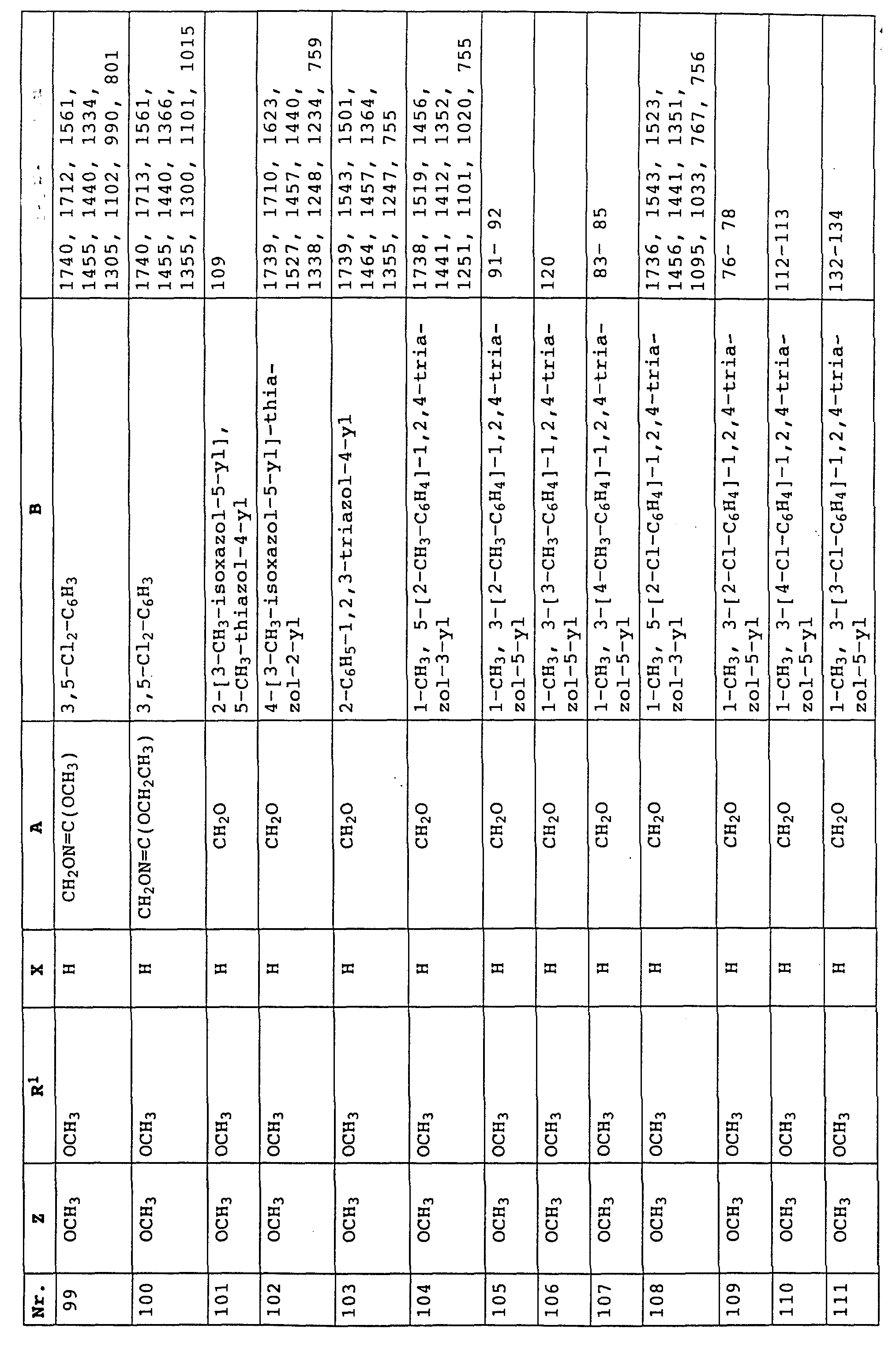
или карбаматы формулы XXXVI, в которой A - радикал -O-, а X, Y, R1, Z и B имеют значения, указанные выше для этих карбаматов,
либо карбаматы формулы XXXIX

в которой Z, Y, A, B и R1 имеют значения, указанные для соединений формулы XXXVI;
X - водород, F, Cl, C1-C4-алкил,
либо карбаматы формулы XL

в которой Z, A, B и R1 имеют значения, указанные для соединений формулы XXXVI;
X - водород, F, Cl, C1-C4-алкил,
либо карбаматы формулы XLI
в которой Z, A, B и R1 имеют значения, указанные для соединений формулы XXXVI,
либо карбаматы формулы XXXVI, в которой R1 - CH2-C≡CH;
X и Y - водород;
A - -CH2-O-N=CCH3-;
B - 4-бромфенил,
либо карбаматы формулы XXXVI, в которой R1 - H, X и Y - водород, A обозначает -O- и B - пиримидин-5-ил-4-O-2-метилфенил.
Предпочтительны карбаматы формулы XLVIII
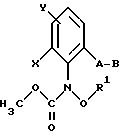
где X и Y независимо друг от друга - F, Cl, Br, алкил или Y - водород;
R1 - водород, алкил, алкенил, алкинил, циклопропилметил, -CH2-CN, CH2-O-CH3, - CO2CH3, -S-R5, где R5 - алкил;
A обозначает -O-, -CH= CH-, -CH2-O-, -CH2-S-, -CH=N-O или -CH2-O-N= C(R4)-, где R4 - алкил;
B обозначает: а) замещенный фенил, как указано для соединений формулы I, если A представляет собой -CH=CH-, -CH2-O-, -CH2-S-, -CH=N-O-, -CH2-O-N= C(R4)-, где R4 - алкил, или б) имеет значения, указанные для соединений формулы I,
и приемлемые для растений соли кислот и оснований,
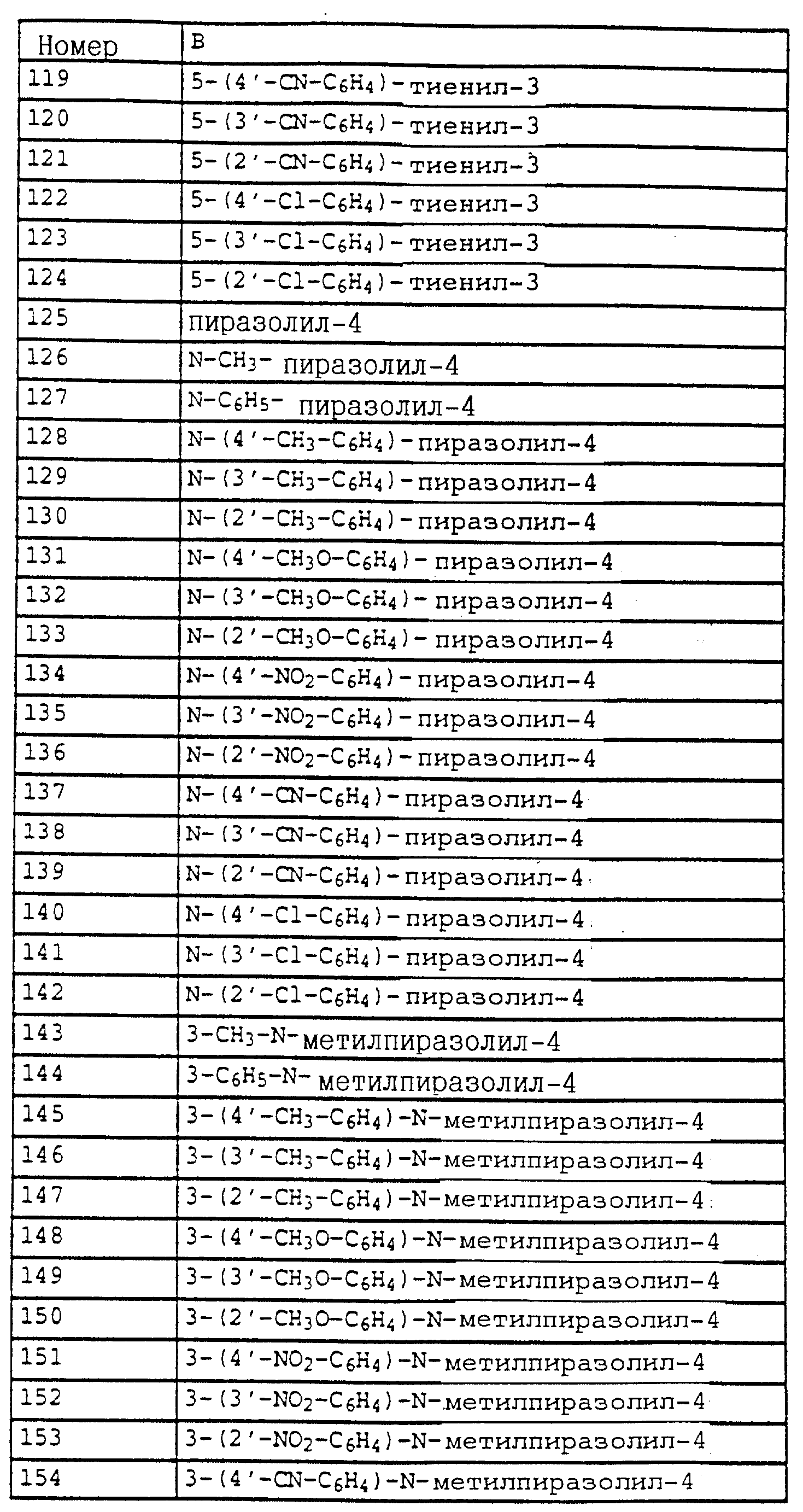
в частности карбаматы формулы IL

в которой X, Y, R1 и B имеют значения, указанные для соединений формулы XLVIII,
либо карбаматы формулы L
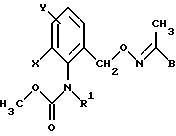
в которой X, Y, R1 и B имеют значения, указанные для соединений формулы XLVIII.
Особенно предпочтительны карбаматы формулы XLVIII, в которой A обозначает радикал -O-, а X, Y, R1 и B имеют значения, указанные для этих соединений выше, либо карбаматы формулы XLVIII, в которой A - радикал -CH=CH-, а X, Y, R1 и B имеют значения, указанные для этих соединений выше, либо карбаматы формулы XLVIII, в которой R1, A и B имеют значения, указанные выше, X и Y независимо друг от друга - F, Cl, C1-C4-алкил и Y дополнительно обозначает также водород, либо карбаматы формулы XLVIII, в которой R1, A и B имеют значения, указанные выше, X - F, Cl, C1-C4-алкил и Y - водород, либо карбаматы формулы XLVIII, в которой R1 обозначает CH2-C≡CH, X - CH3, Y - водород, A обозначает -CH2-O-N=CCH3- и B - 4-бромфенил.
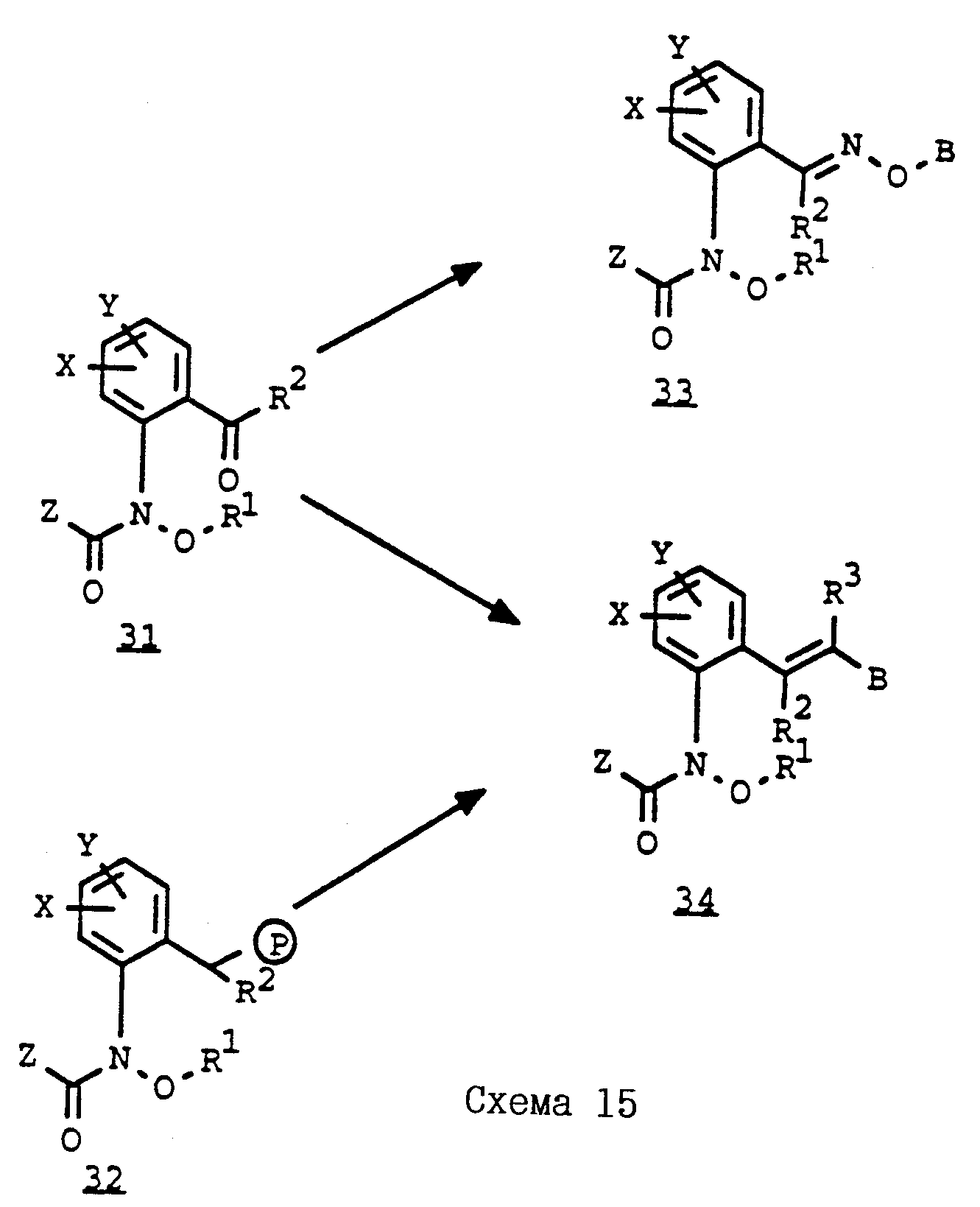
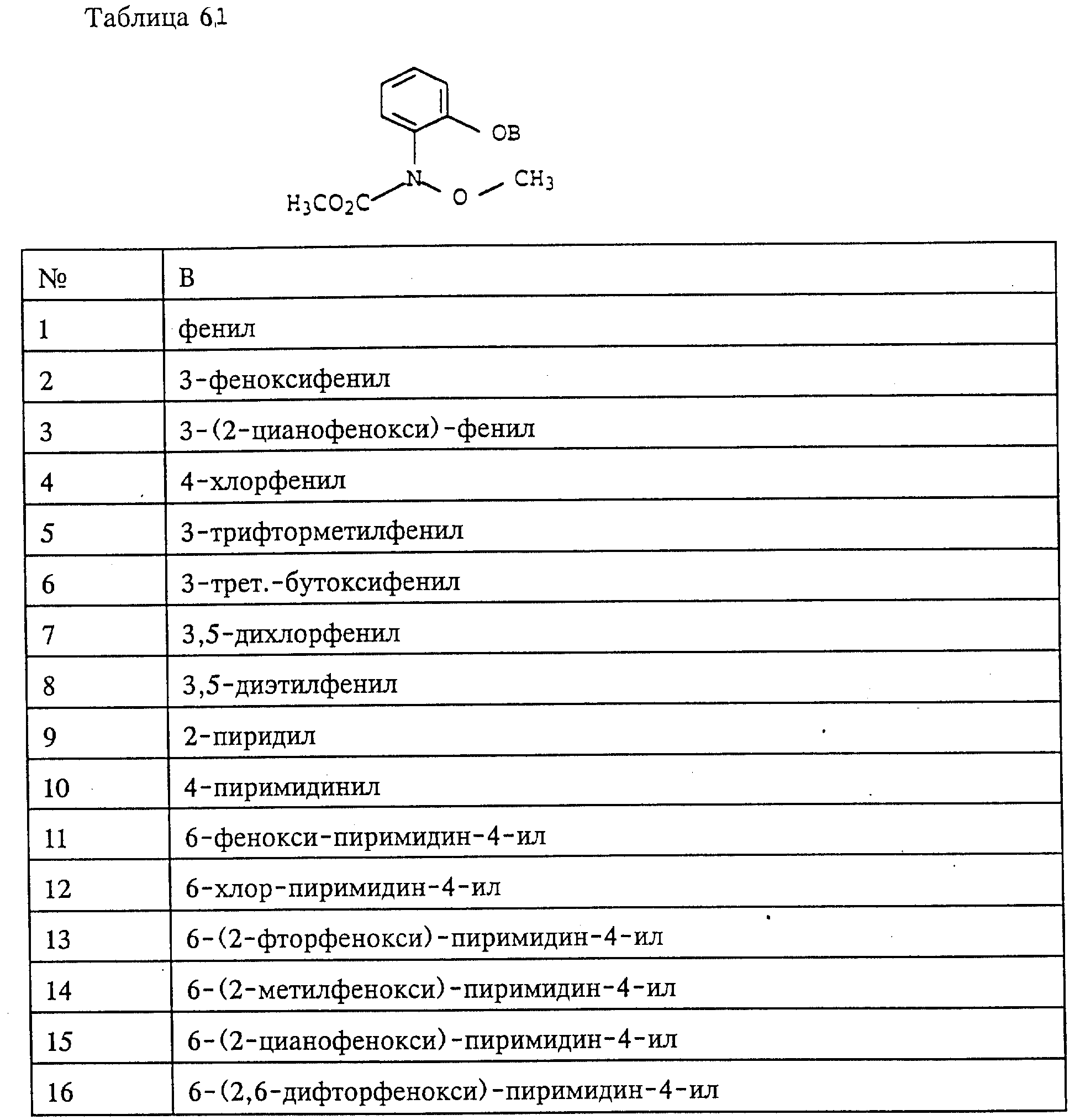
Объектом настоящего изобретения также являются промежуточные соединения - производные бензола общих формул E, F, G, указанных ниже, применяемые для способа получения карбаматов общей формулы I.
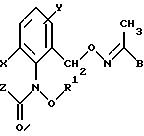
Предлагаемые согласно изобретению промежуточные производные бензола соответствуют общей формуле E.

в которой X и Y алкил;
Q - NO2, NH2, NHOR1 NHR1 NCO, NR1COZ, где Z обозначает метоксигруппу или NHCH3, R1 - водород, или алкил;
A - -CH2O-, -CH2ON(CH3), -CH2ON=CH(C2H5);
B - фенил, незамещенный или замещенный алкилом, галогеном, группой формулы -C(R3)=N-OR3, где R3 - алкил, алкенил.
Из производных бензола, соответствующих формуле E, следует выделить
соединения формулы IV

в которой X, Y, A и B имеют значения, указанные для соединений общей формулы E, а также производные бензола формулы XLII

в которой X, Y и B имеют значения, указанные выше;
A - -CH2O-, -CH2-O-N=C(CH3)-,
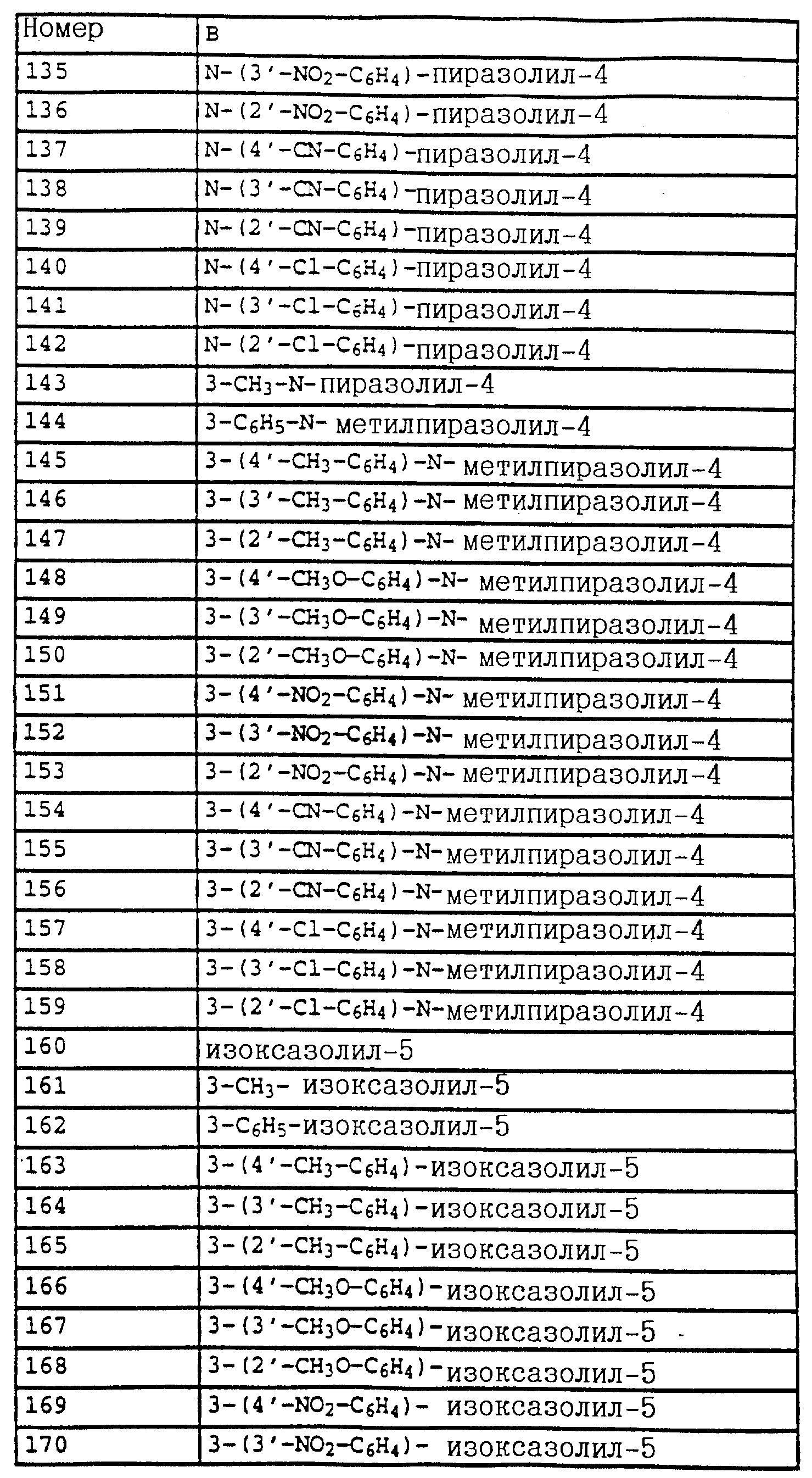
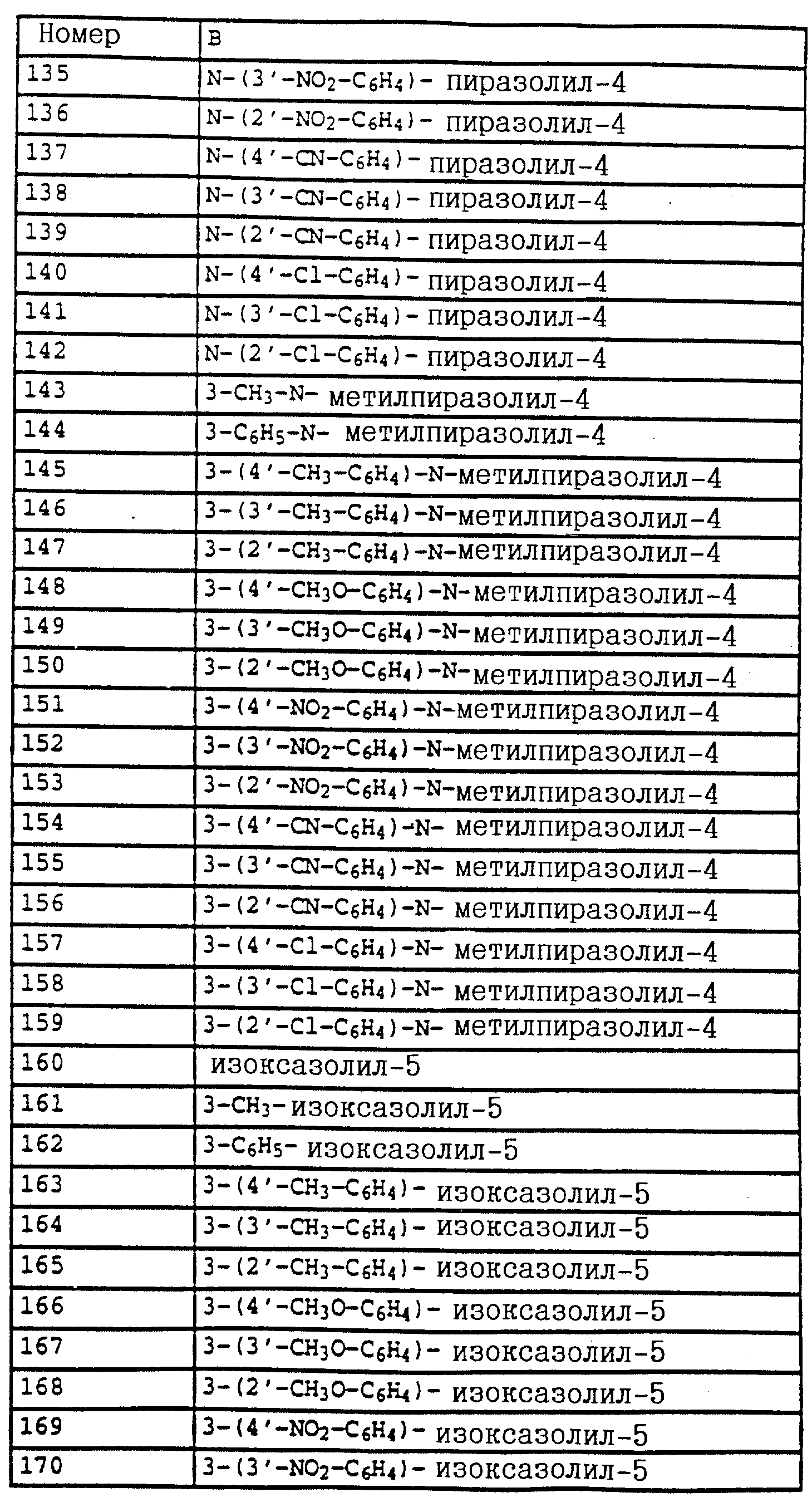
в частности, производные бензола формулы LI

в которой X, Y, A и B имеют значения, указанные для соединений формулы XLII.
К таким соединениям относятся производные бензола
формулы V

в которой X, Y, A и B имеют значения, указанные для соединений формулы E,
либо производные бензола формулы LII

в которой X, Y, A и B имеют значения, указанные для соединений формулы XLVIII,
либо производные бензола формулы XLIII

в которой X и Y - водород и B имеет значения, указанные для соединений E;
A обозначает -CH2O-, -CH2-O-N=C(CH3)-,
либо производные бензола формулы XXIV
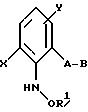
в которой A, B, X, Y и R1 имеют значения, указанные для соединений формулы E или R1 - водород,
либо производные бензола формулы XXXIV
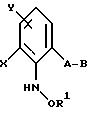
в которой X, Y, A, B и R1 имеют значения, указанные для соединений формулы XXV
либо производные бензола формулы XXXV

в которой A, B, X и Y имеют значения, указанные для соединений формулы XXXIV
либо производные бензола формулы XLIV

в которой X, Y, Z и R1 имеют значения, указанные для соединений формулы E;
Z - O-(C1-C4)-алкил,
либо производные бензола формулы LIII

в которой X, Y и R1 имеют значения, указанные для соединений формулы XLVIII;
Z - O-(C1-C4)-алкил,
либо производные бензола формулы XLV
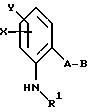
в которой X, Y, R1 и B имеют значения, указанные для соединений формулы XXXVI;
A - -CH2O-, -CH2 -O-N=C(CH3)-,
либо производные бензола формулы LIV

в которой A, B, X, Y и R1 имеют значения, указанные для соединений формулы XLVIII
или производные бензола формулы XLVII

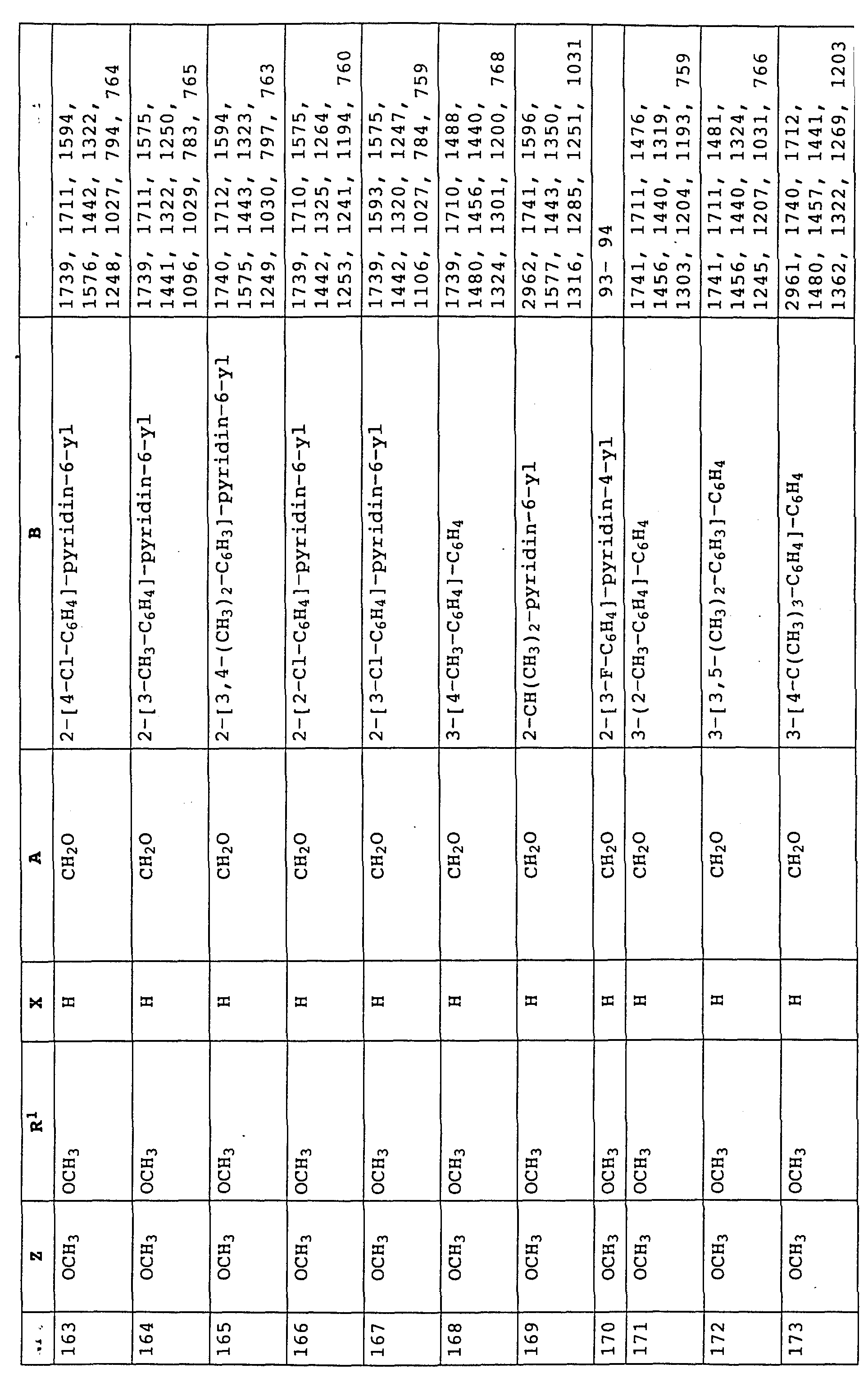
в которой X, Y и B имеют значения, указанные для соединений формулы E;
A - -CH2)-, -O-, -CH2-O-N=C(CH3)-,
или производные бензола формулы LV
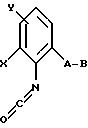
в которой A, B, X и Y имеют значения, указанные для соединений формулы XLVIII.
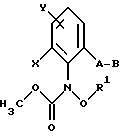
Предлагаемые согласно изобретению производные бензола формулы F 10 имеют общую формулу
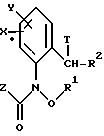
в которой X и Y - водород, галоген, алкил;
Z - метоксигруппа CH3 , NHCH3;
R1 и R2 - водород или алкил;
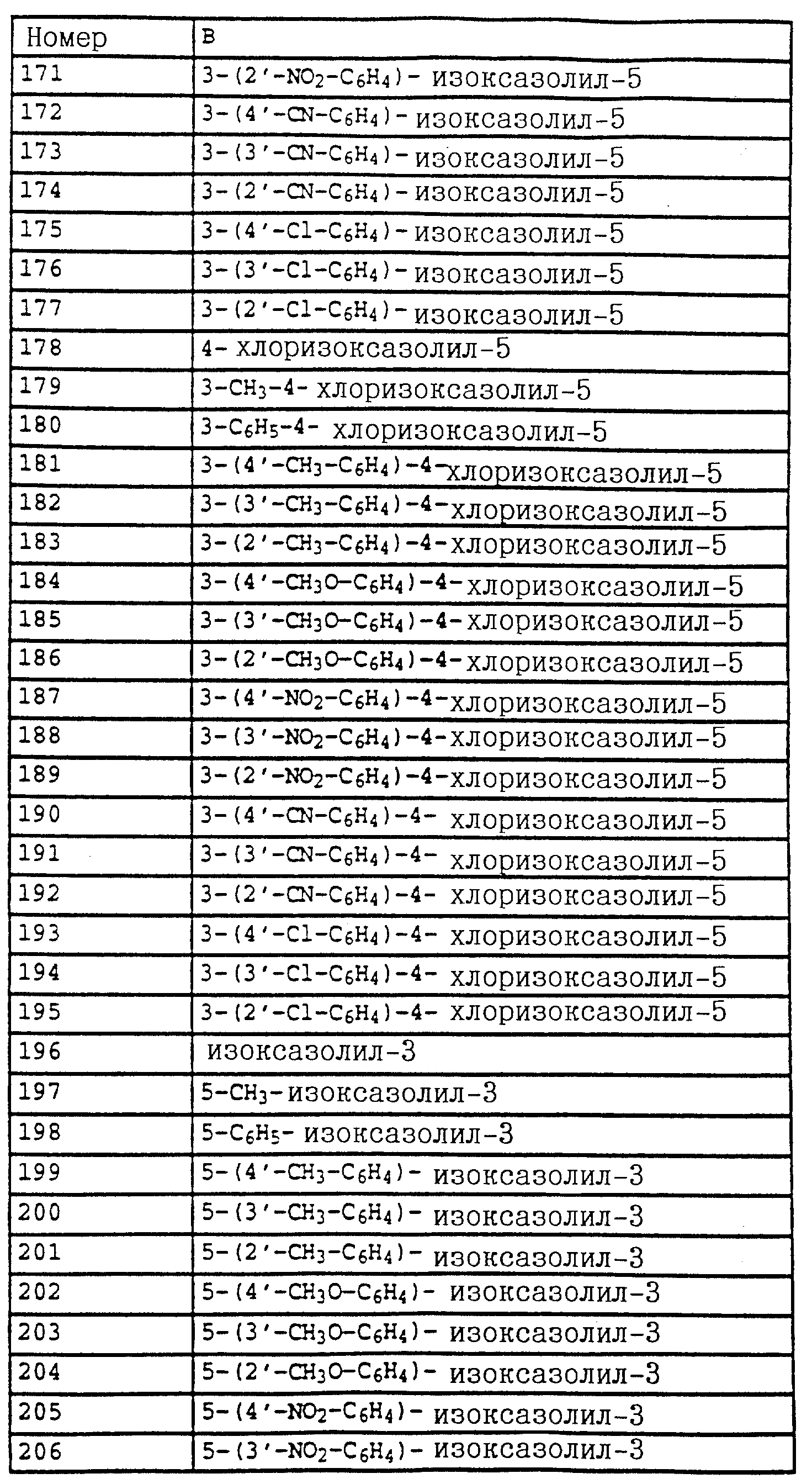
T означает водород или галоген.
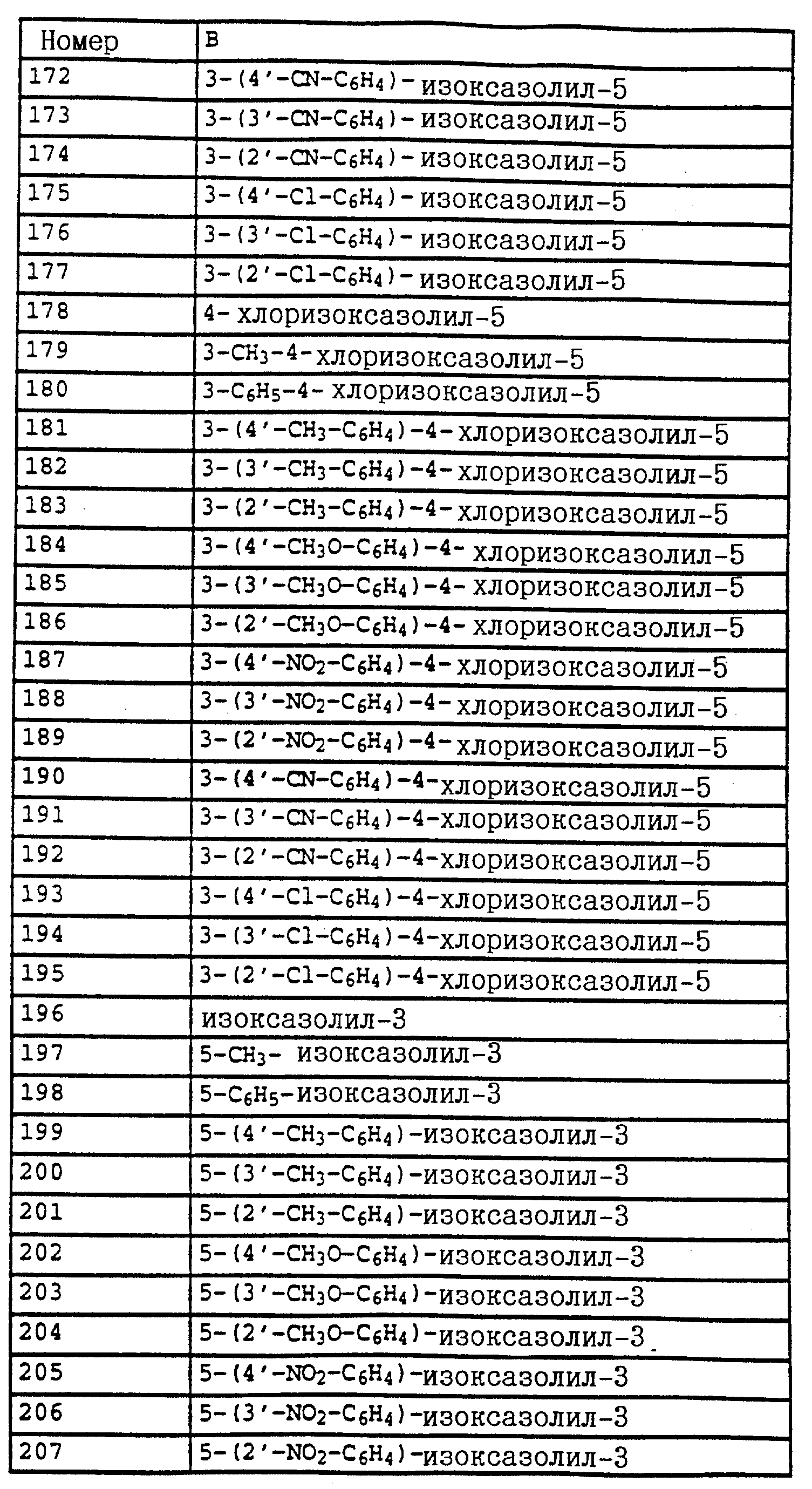
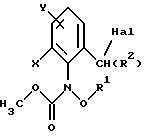
Из этой группы соединений следует выделить производные бензола формулы XI
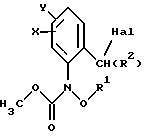
в которой X, Y, R1 и R2 имеют значения, указанные для соединений формулы F;
Hal - галоген,
либо производные бензола формулы XII

в которой X, Y, R1 и R2 имеют значения, указанные для соединений формулы F,
либо производные бензола формулы XXXI
в которой X, Y, R1 и R2 имеют значения, указанные для соединений формулы F,
Hal - галоген,
или производные бензола формулы XXXII

в которой X, Y, R1 и R2 имеют значения, указанные для соединений формулы XXV,
либо производные бензола формулы XXI

в которой X, Y, Z, R1 и R2 имеют значения, указанные для соединений формулы XIV, и Z дополнительно обозначает метокси,
или производные бензола формулы XX

в которой X, Y, Z, R1 и R2 имеют значения, указанные для соединений формулы F;
Z дополнительно обозначает метокси;
Hal - галоген.
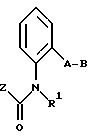
Предлагаемые согласно настоящему изобретению производные бензола соответствуют общей формуле G

в которой X и Y - водород;
Z - метильная, этильная или метоксильная группа;
A - простая связь;
B - алкил.
Производные бензола формулы XIII
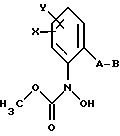
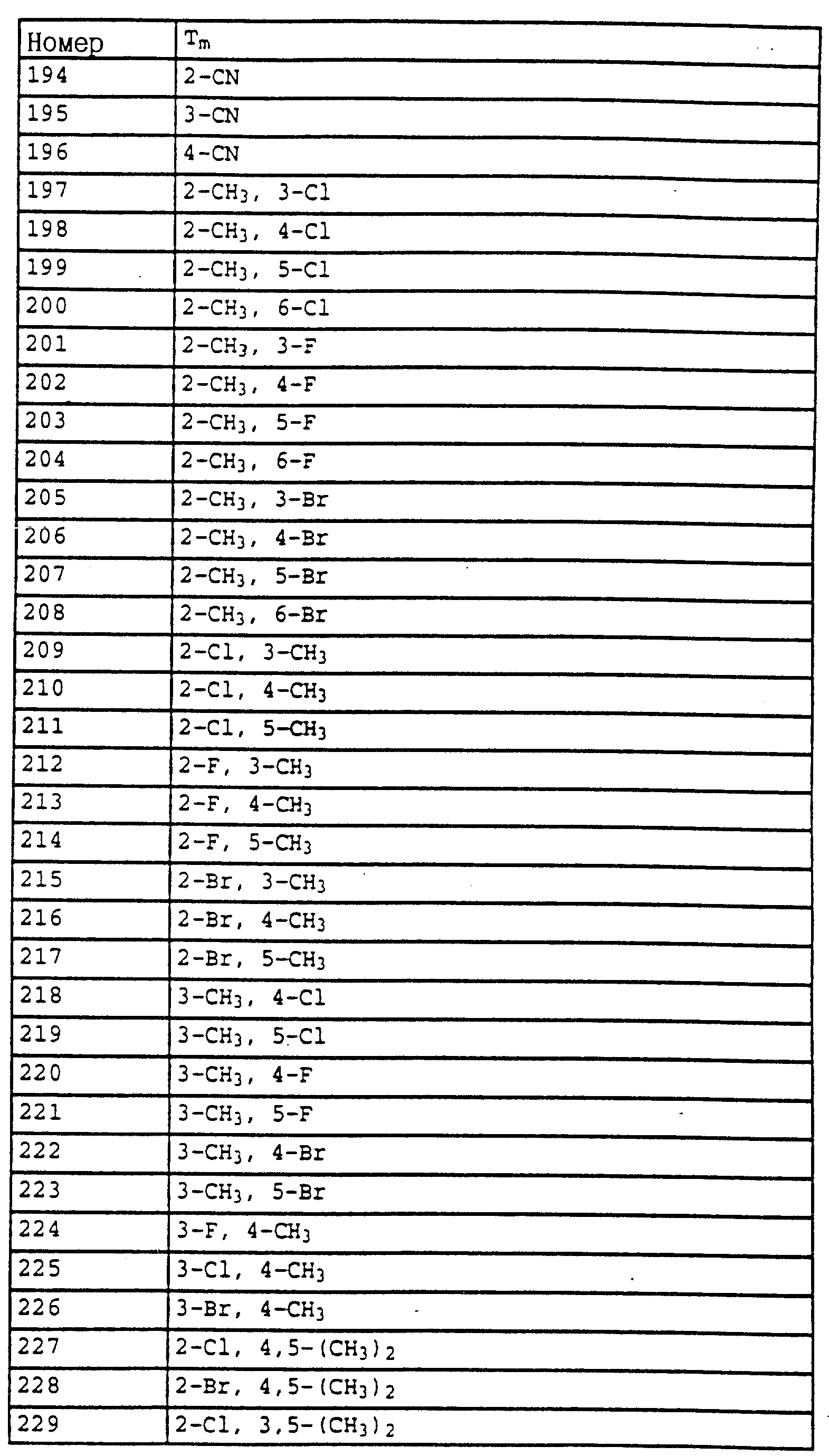
в которой X, Y, A и B имеют значения, указанные для соединений формулы G,
или производные бензола формулы XXII

в которой X, Y, Z, A и B имеют значения, указанные для соединений G;
Z дополнительно обозначает метокси,
или производные бензола формулы XXXIII

в которой X, Y, A и B имеют значения, указанные для соединений формулы G.
Объектом настоящего изобретения является также фунгицидная композиция, включающая активное вещество - производное N-фенилкарбаминовой кислоты и целевые добавки, особенность которой состоит в том, что в качестве активного вещества она содержит соединение формулы I в эффективном количестве.
Данное изобретение также включает способ борьбы с грибками путем обработки растений фунгицидной композицией на основе производного N-фенилкарбаминовой кислоты, особенностью которого является то, что в качестве фунгицидной композиции используют вышеуказанную композицию в эффективном количестве.
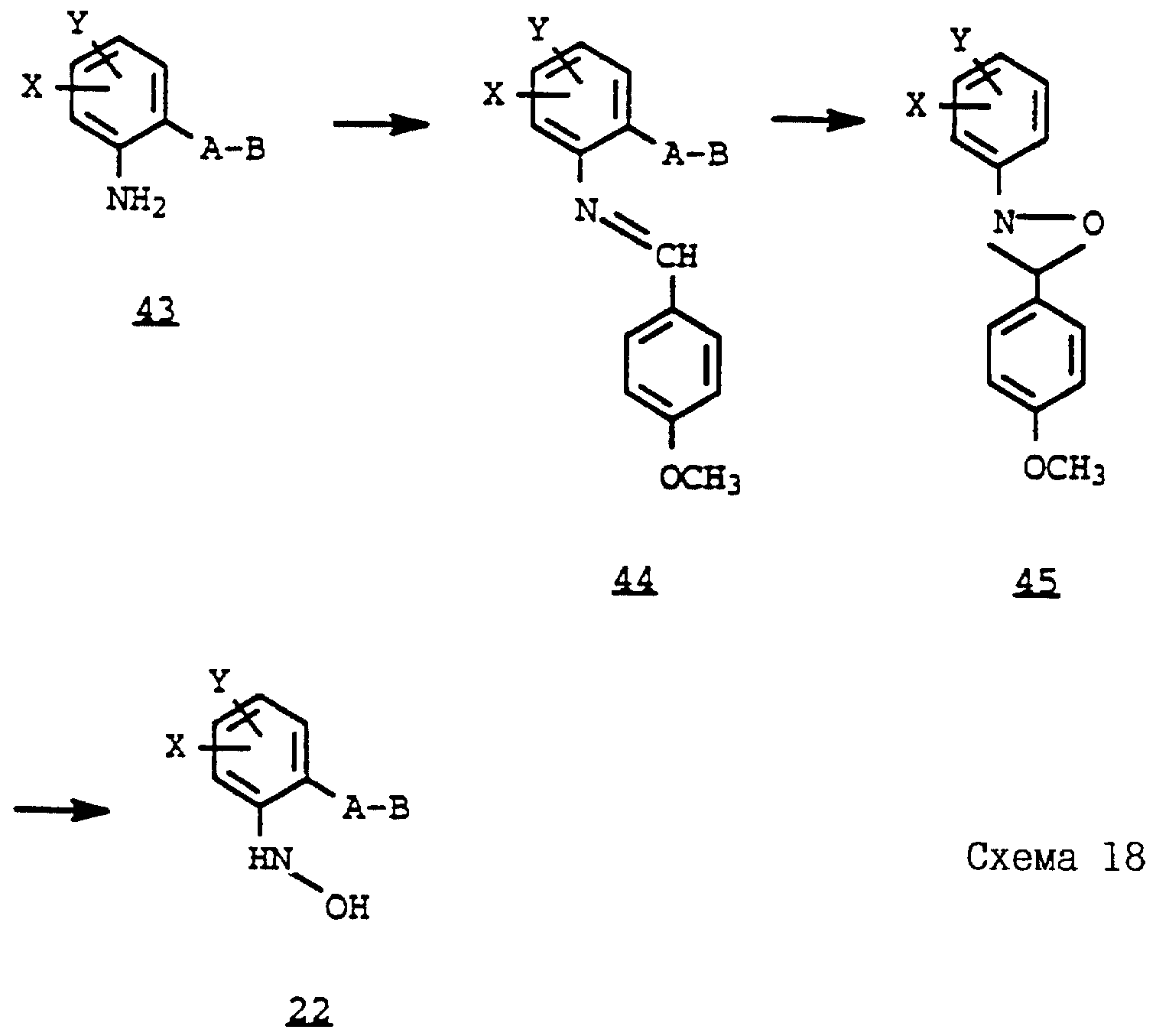
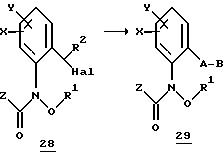
Новые соединения могут быть получены, например, с помощью следующих способов.
Получаемые обычными способами нитробензолы формулы



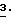




Аналогично схеме 1 нитробензолы




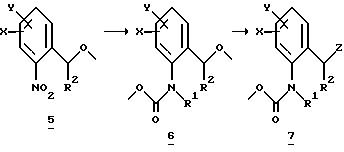
Либо галогенпроизводные

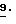


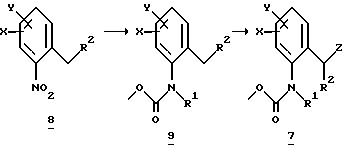
Галогенпроизводные



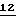
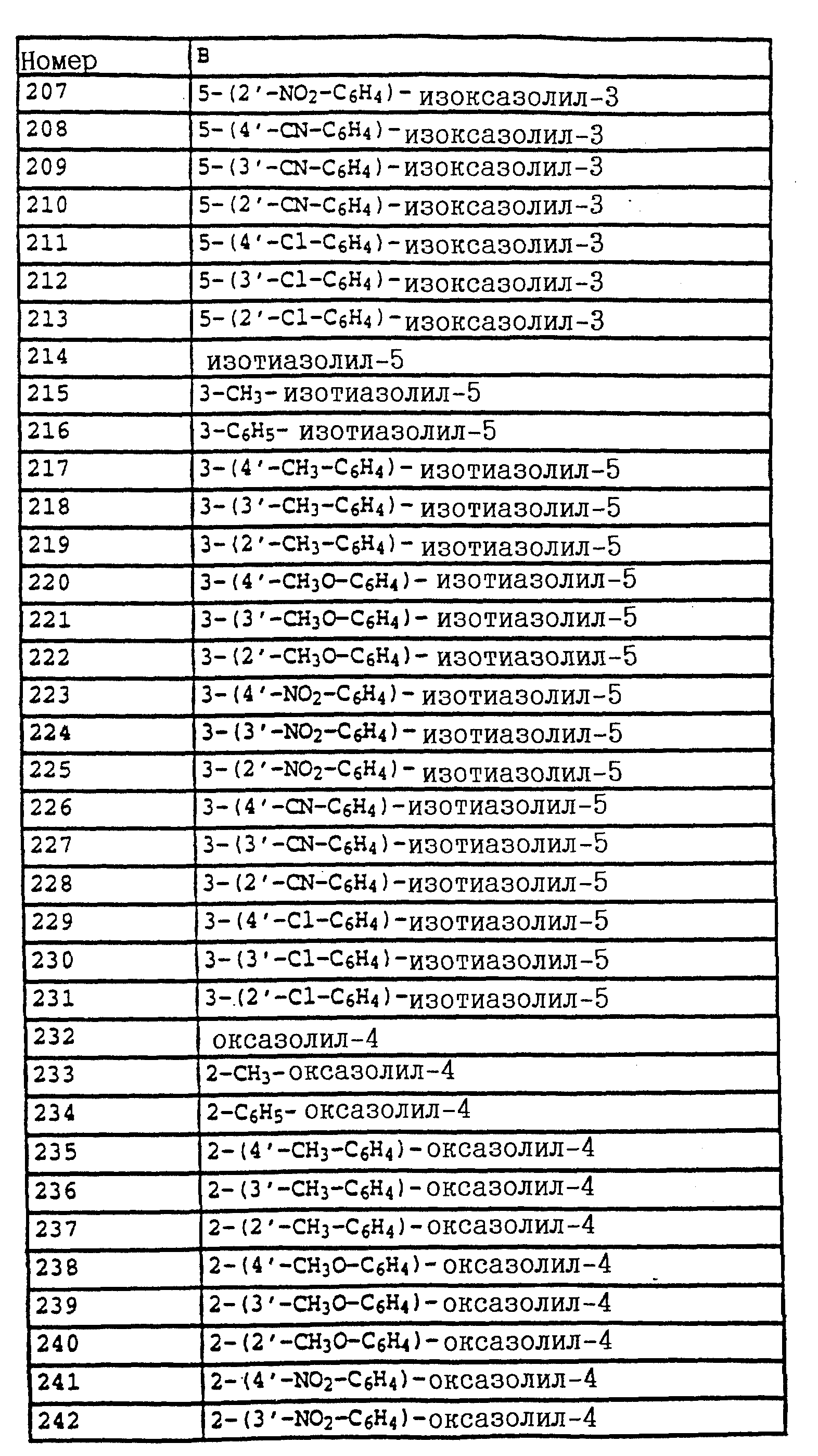
A обозначает -CH2-O-, -CH2-S-, -CH2-O-N=C(R4)-.
Из солей фосфония


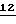

Путем частичного восстановления нитроароматических углеводородов






Гидроксиламин







Затем галогениды


Либо галогениды

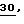


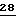

Карбонильные соединения
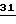


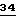

Из олефинов



Карбамиды
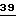

Либо карбамиды формулы



Карбамиды формулы


Соединения формулы


Кроме того, гидроксиламины



Получение новых соединений поясняется на следующих примерах.
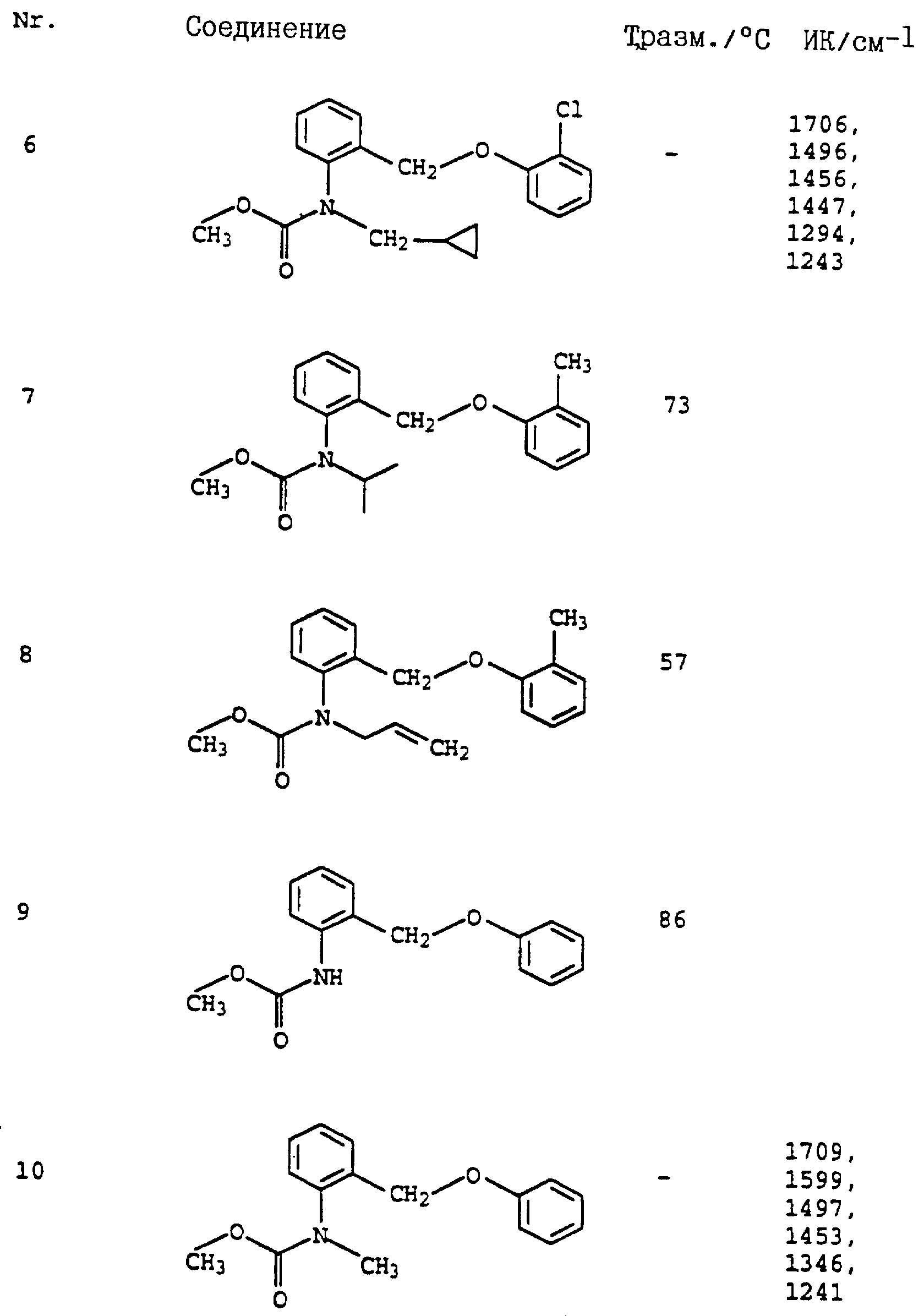
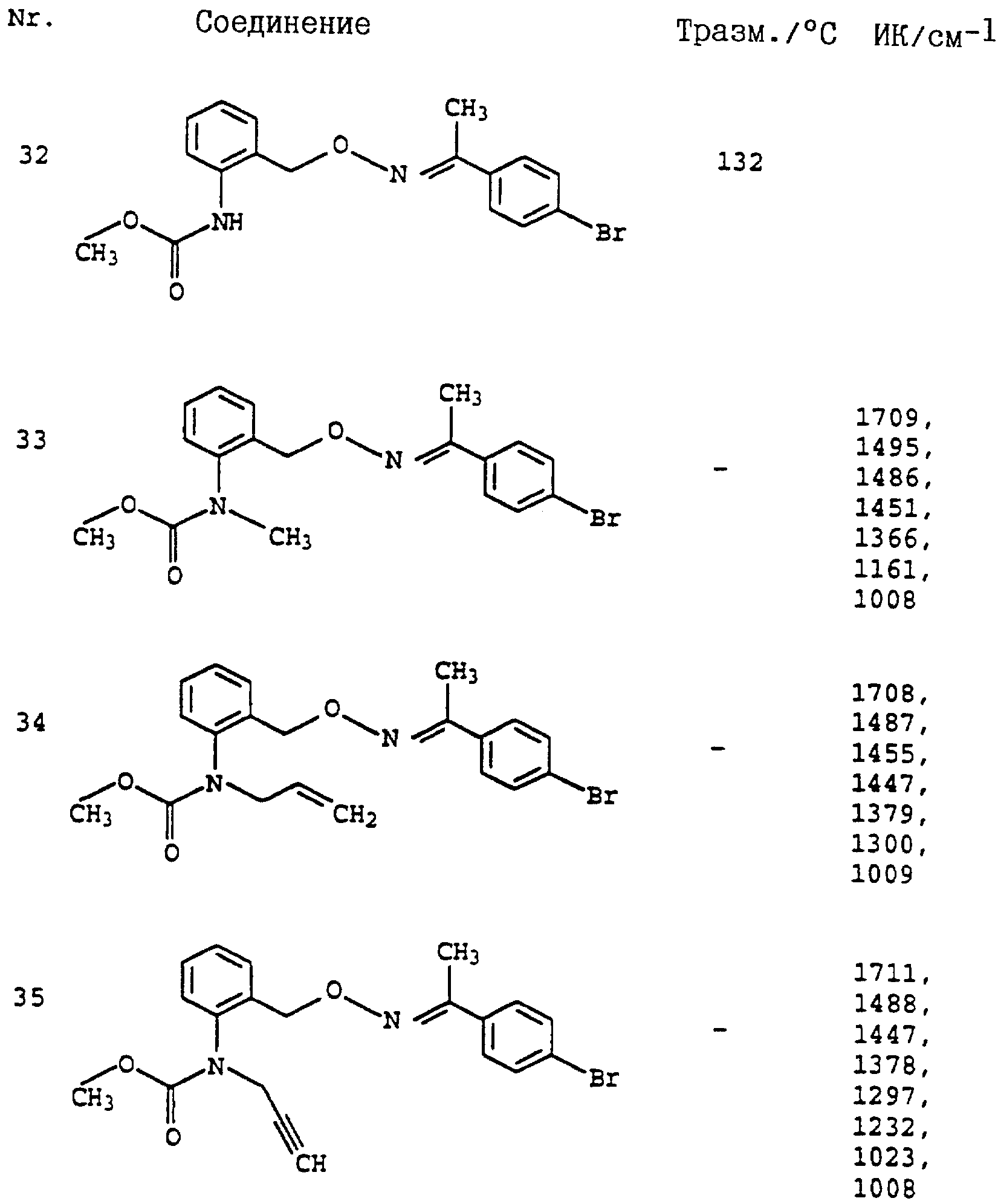
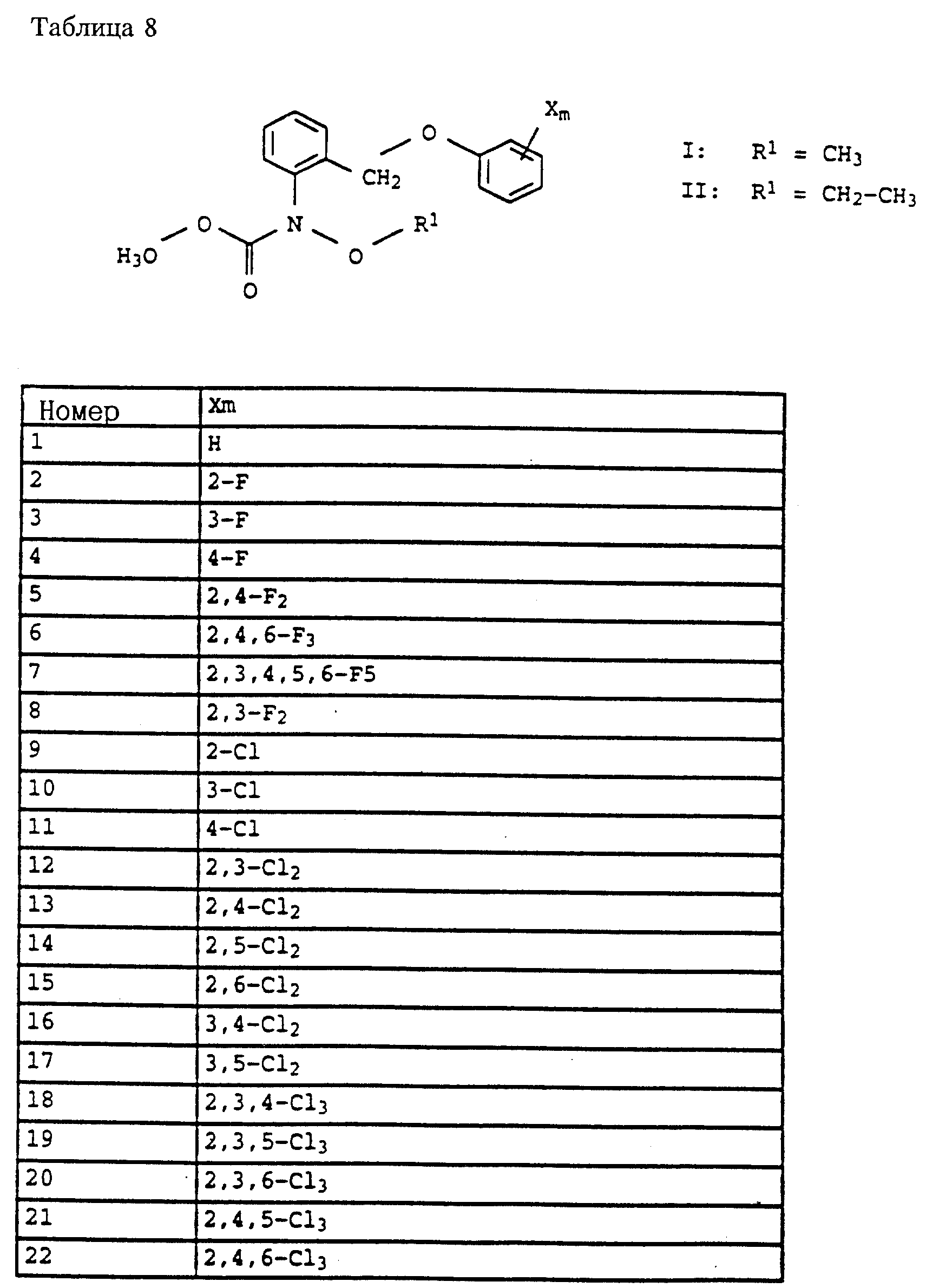
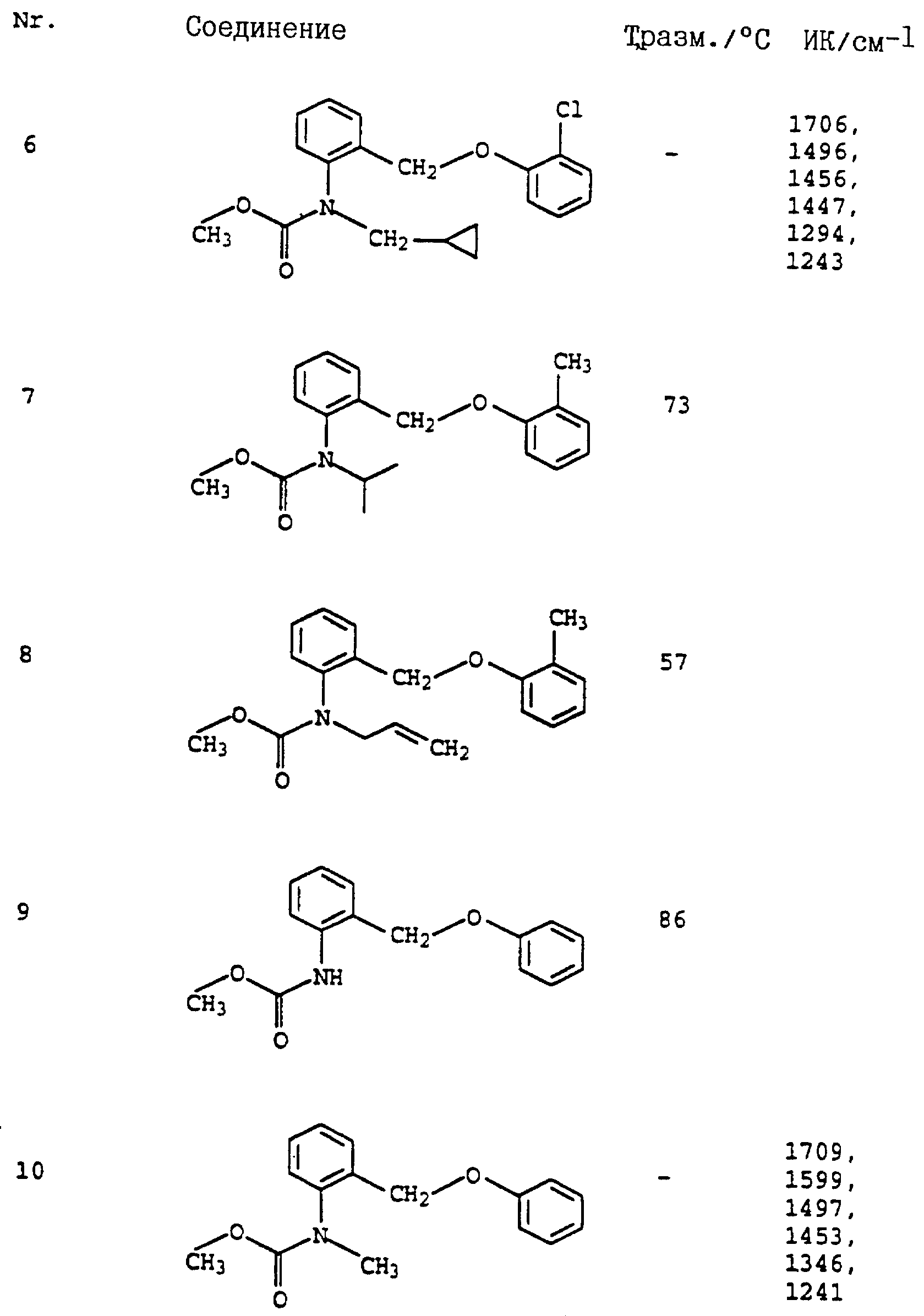
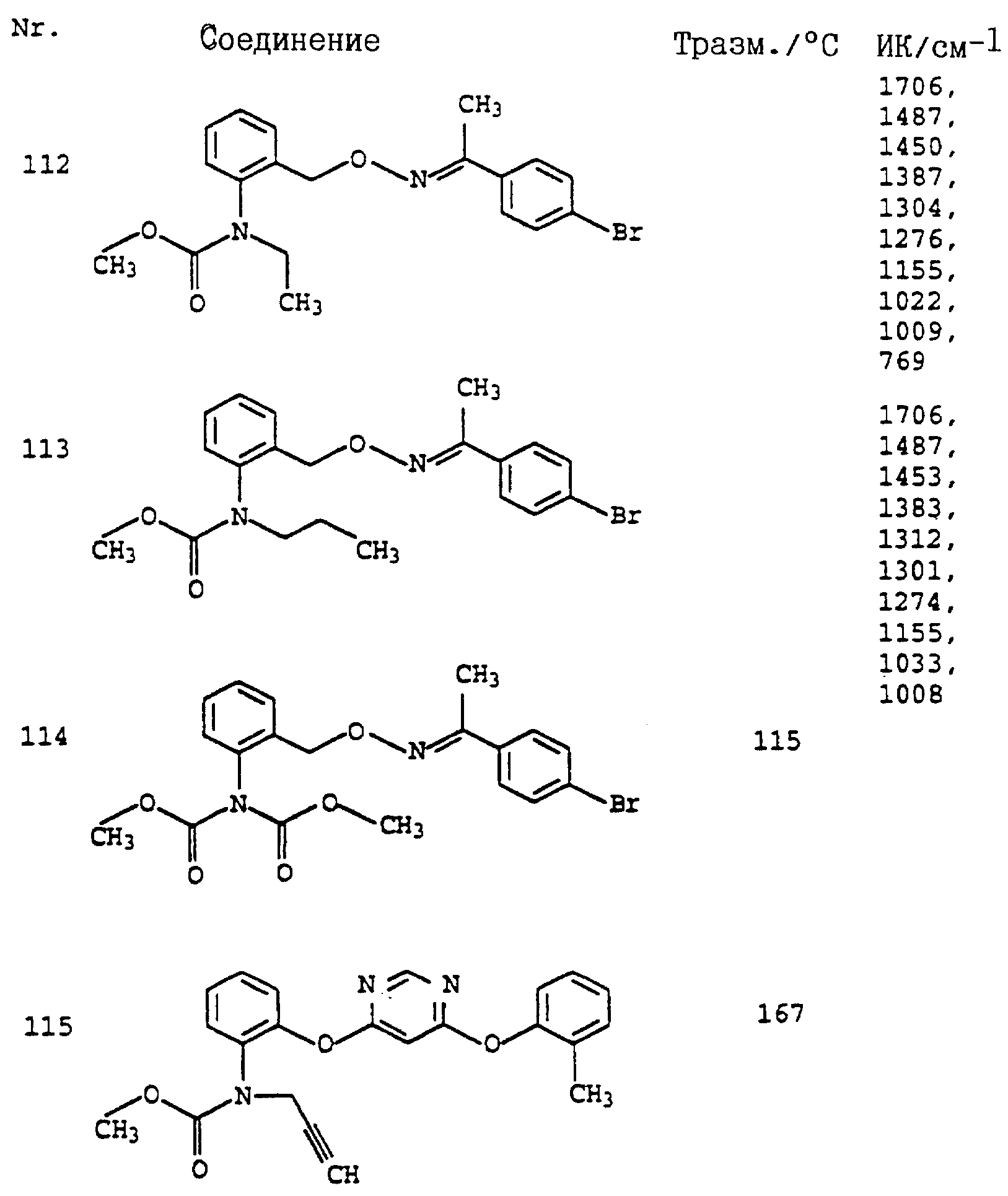
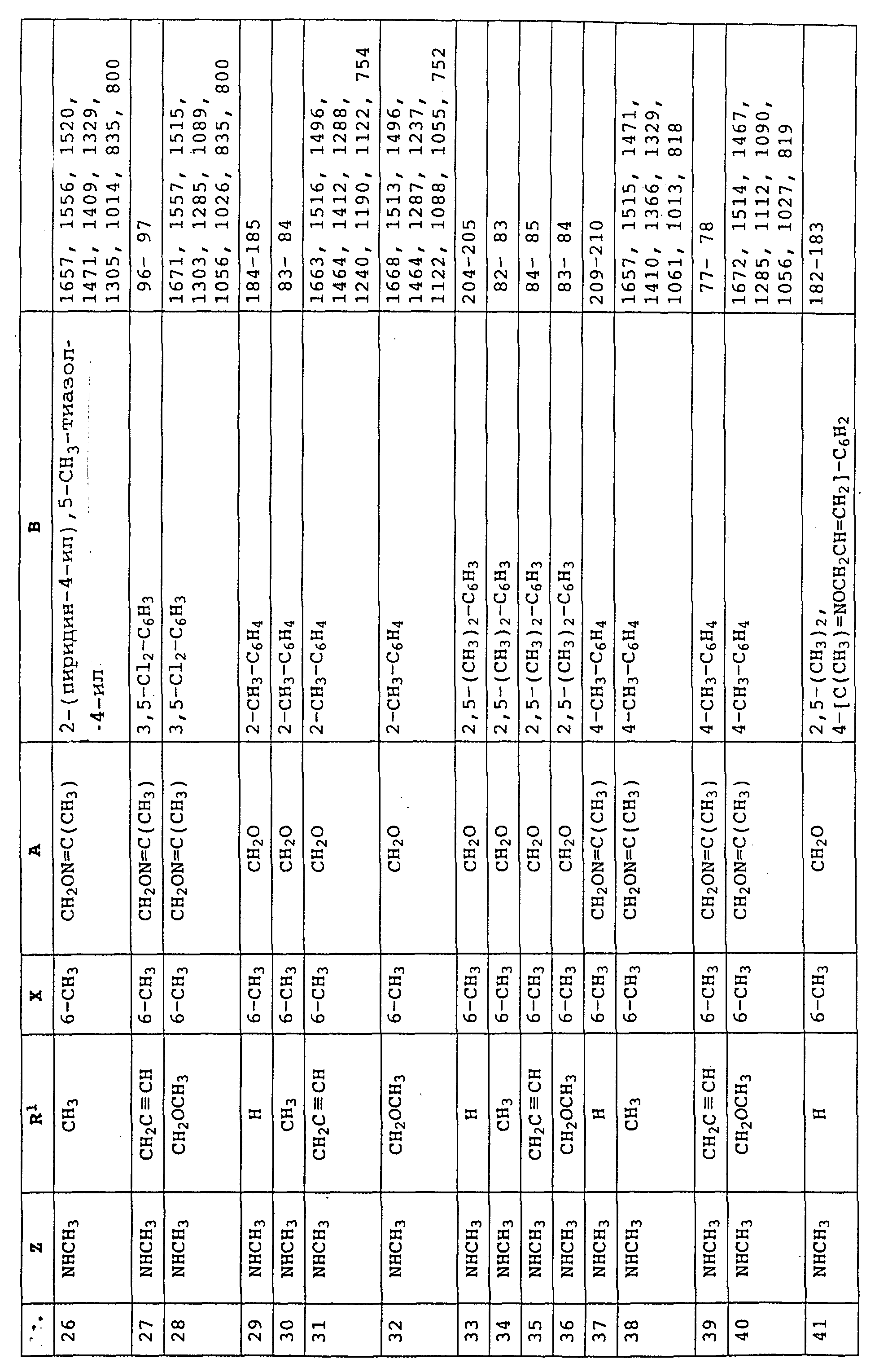
Пример 1. Метиловый эфир N-этил-N-[2-(2'-метилфеноксиметил)- фенил]-карбаминовой кислоты (таблица 7, N 2).
а) Метиловый эфир N-(o-метилфенил)-карбаминовой кислоты.
53 г (0,5 моля) о-толуидина в 500 мл хлористого метилена обрабатывают по каплям 50 г (0,53 моля) метилового эфира хлормуравьиной кислоты. При этом реакционный раствор нагревается до температуры кипения и в осадок выпадает бесцветное твердое вещество. Раствор перемешивают в течение одного часа и затем добавляют по каплям 200 мл 10%-ного натрового щелока, причем бесцветное твердое вещество растворяется. Органическую фазу сушат над MgSO4 и концентрируют в вакууме. Оставшееся твердое вещество тонко растирают и размешивают с н-гексаном, после чего отсасывают на нутче. В результате получают 84 г (0,5 моля; количественный выход) соединения, указанного в заголовке, в виде бесцветного твердого вещества.
Tразм= 61-62oC;1H-ЯМР (ДМCO-d6); δ (част./млн): 8,85 (s,1H, NH); 7,35 (d, шир., 1H, ароматич.); 7,1 (m, 3H, ароматич.); 3,6 (s, 3H, OCH3); 2,2 (s, 3H, CH3).
б) Метиловый эфир N-этил-N-(о-метилфенил)-карбаминовой кислоты.
30 г (0,18 моля) метилового эфира N-(о-метилфенил)-карбаминовой кислоты (пример 1а) в 200 мл диметилформамида порциями обрабатывают 5,1 г (0,2 моля) гидрида натрия. После окончания газообразования по каплям 10 добавляют 30 г (0,2 моля) этилйодида, причем реакционную смесь слегка охлаждают на водяной бане. При этом в осадок выпадает белое твердое вещество. Через приблизительно 4 ч реакционную смесь разбавляют водой и водную фазу трижды экстрагируют простым эфиром. Органическую фазу сушат над MgSO4 и концентрируют. Остаток отгоняют. В результате получают 32,5 г 15 (0,17 моля=93%) соединения, указанного в заголовке, в виде бесцветного масла.
Tкип0,5 =74oC,1H-ЯМР (CDCl3); δ (част./млн): 7,2 (m, 3H, аромат.); 7,1 (m, 1H, аромат.); 3,8 (m, 1H, N-CHA); 3,6 (s, 3H, OCH3); 3,5 (m, 1H, N-CHB); 2,2 (s, 3H, CH3); 1,1 (t, 3H, CH3).
в) Метиловый эфир N-этил-N-(о-бромметилфенил)-карбаминовой кислоты.
Смесь из 30 г (0,155 моля) метилового эфира N-этил-N- (о-метилфенил)-карбаминовой кислоты (пример 1б), 33 г (0,185 моля) N-бромсукцинимида и 0,1 г азоизобутиродинитрила в 300 мл тетрахлорметана облучают в течение 6 ч 25 УФ-лампой мощностью 300 Вт. При этом содержимое колбы нагревается до примерно 70oC. Затем реакционную смесь четырежды промывают водой, сушат и концентрируют. В качестве остатка получают 41 г коричневого масла, содержащего указанное в заголовке соединение примерно 50%-ной чистоты и используемого без дополнительной очистки в последующей реакции.
1H-ЯМР (CDCl3); δ (част. /млн): 7,2 (m, 4H, ароматич.); 4,45 (s, 2H, CH2 -Br); 3,8 (m, 1H, N-CHA); 3,6 (s, 3H, OCH3); 3,5 (m, 1H, N-CHB); 1,15 (t, 3H, J = 8 Гц, CH3).
г) Метиловый эфир N-этил-N-(2-(2'-метилфеноксиметил)-фенил)- карбаминовой кислоты (таблица 7, N 2).
8,6 г (80 ммолей) о-крезола в 100 мл диметилформамида порциями обрабатывают 2,4 г (17 ммолей) гидрида натрия. Смесь перемешивают в течение 30 мин при комнатной температуре (20oC), после чего добавляют 20,5 г метилового эфира N-этил-N-(о-бромметилфенил)-карбаминовой кислоты (пример 1в; приблизительно 50%-ная чистота, приблизительно 37 ммолей). Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем разбавляют водой и водную фазу трижды экстрагируют с помощью простого эфира. Соединенные эфирные фазы сушат над MgSO4 и выпаривают. Остаток отгоняют в печи, снабженной трубкой с шаровым расширением. При температуре 220oC и давлении 0,2 мбар получают 10 г желтого масла, которое затем очищают хроматографией на силикагеле с помощью смесей циклогексана/уксусного эфира и после этого на окиси алюминия. Полученный таким путем продукт повторно очищают отгонкой через трубку с шаровым расширением. В результате получают 3,6 г (12 молей = 32%) соединения, указанного в заголовке, в виде бесцветного масла.
1 H-ЯМР (CDCl3); δ (част. /млн): 7,6 (m, 1H, ароматич.); 7,35 (m, 2H, ароматич.); 7,15 (m, 3H, ароматич.); 6,85 (m, 2H, ароматич.); 5,0 (dd, шир., 2H, O-CH2); 3,8 (m, 1H, N-CHA); 3,6 (s, 3H, O-CH3); 3,5 (m, 1H, N-CHB); 2,3 (s, 3H, CH3); 1,15 (t, 3H, J = 8 Гц, CH3).
Пример 2. Метиловый эфир N-[2-(2'-метилфеноксиметил)-фенил]- N-метилтиокарбаминовой кислоты (таблица 7, N 89).
а) 2-(2'-Метилфеноксиметил)-нитробензол.
75 г (0,347 моля) 2-нитробензилбромида, 37 г (0,342 моля) о-крезола и 56 г (0,405 моля) карбоната калия в 500 мл диметилформамида перемешивают в течение 5 ч при комнатной температуре. Затем реакционную смесь разбавляют водой и водную фазу трижды экстрагируют с помощью простого эфира. Эфирную фазу сушат и концентрируют. Кристаллический остаток тонко растирают и размешивают, после чего отсасывают на нутче. В результате получают 73 г (0, 300 моля= 88%) соединения, указанного в заголовке, в виде бесцветного твердого вещества.
Tразм=83oC,1H-ЯМР (CDCl3); δ (част./млн): 8, 15 (d, 1H, J = 8 Гц, ароматич. ); 7,95 (d, 1H, J =8 Гц, ароматич.); 7,7 (t, 1H, J = 8 Гц, ароматич.); 7,45 (t, 1H, J =8 Гц, ароматич.); 7,15 (m, 2H, ароматич.); 6,9 (m, 2H, ароматич.); 5,45 (s, 2H, O-CH2; 2,35 (s, 3H, CH3).
б) 2-(2'-Метилфеноксиметил)-анилин.
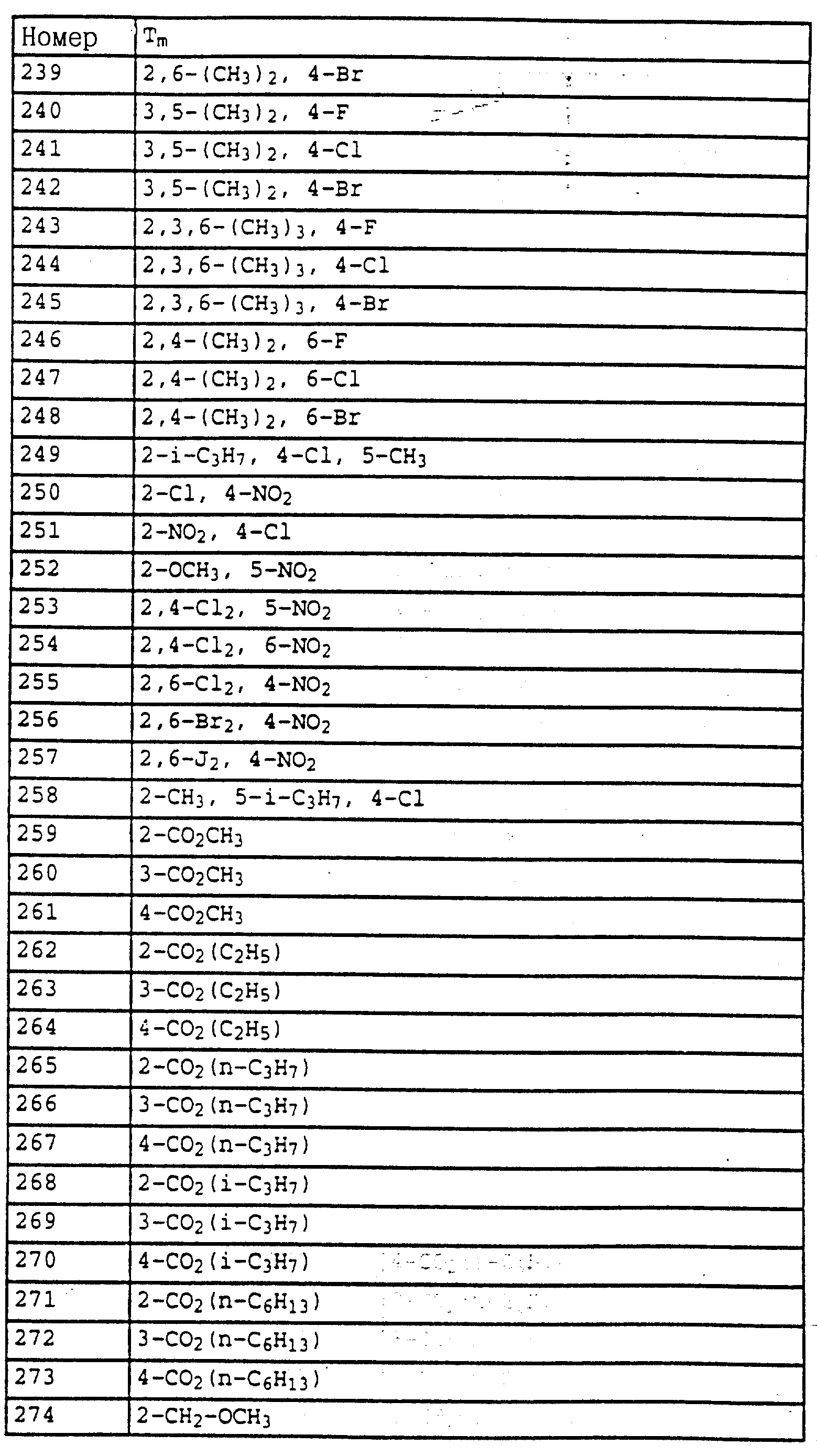
75 г (0,308 моля) 2-(2'-метилфеноксиметил)-нитробензола (пример 2а) и 10 г 5%-ной Pt/C (платина, адсорбированная на активированном угле) в 50 мл метанола энергично перемешивают в атмосфере H2 в течение двух часов, после чего добавляют еще 2 г 5%-ной Pt/C и перемешивают в течение ночи. Затем катализатор отсасывают на нутче и заменяют 10 г свежего катализатора. Перемешивание продолжают в течение ночи, затем отсасывают на нутче и выпаривают фильтрат в вакууме. Остаток очищают хроматографией на колонке с помощью смесей гексана/уксусного эфира. В результате получают 61 г (0,286 моля = 93%) соединения, указанного в заголовке, в виде бесцветного твердого вещества.
Tразм= 56oC,1H-ЯМР (COCl3); δ (част./млн): 7,2 (m, 4H, ароматич.); 6,95 (d, 1H, J = 8 Гц, ароматич.); 6,9 (t, 1H, J = 6 Гц, ароматич.); 6,7 (m, 2H, ароматич.); 5,0 (s, 2H, O-CH2); 4,05 (s, шир., 2H, NH2); 2,2 (s, 3H, CH3).
в) Метиловый эфир N-[2-(2'-метилфеноксиметил)-фенил]- карбаминовой кислоты (таблица 7, N 3).
10 г (47 ммолей) 2-(2'-метилфеноксиметил)-анилина в 500 мл хлористого метилена при 20-30oC по каплям обрабатывают 6 г (63 ммоля) метилового эфира хлормуравьиной кислоты. В течение 3 ч перемешивают при комнатной температуре, при этом в осадок выпадает твердое вещество белого цвета, затем реакционную смесь перемешивают с 20 мл 10%-ного натрового щелока. Органическую фазу отсасывают через силикагель, концентрируют и остаток тонко растирают и размешивают с метанолом и отсасывают на нутче. В результате получают 10,5 г (39 ммолей = 82%) соединения, указанного в заголовке, в виде бесцветного твердого вещества.
Tразм= 111oC,1H-ЯМР (CDCl3); δ (част./млн): 8,0 (d, шир., 1H, ароматич. ); 7,7 (s, шир. , 1H, ароматич.); 7,7 (s, шир., 1H, NH); 6,8-7,5 (m, 6H, ароматич.); 5,0 (s, 2H, O-CH3; 3,75 (s, 3H, O-CH3); 2,25 (s, 3H, CH3).
г) Метиловый эфир N-[2-(2'-метилфеноксиметил)-фенил]-N- метилтиокарбаминовой кислоты (таблица 7, N 89).
4,9 г (17,3 ммоля) метилового эфира N-[2-(2'- метилфеноксиметил)-фенил] -карбаминовой кислоты (пример 2в) в 80 мл толуола порциями обрабатывают 0,5 г (20,8 ммолей) гидрида натрия. После окончания газообразования добавляют 2,4 г (19 ммолей) метилового эфира метантиосульфокислоты и перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь экстрагируют с помощью воды, сушат над MgSO4 и выпаривают в вакууме. Остаток очищают посредством хроматографии на колонке с помощью смесей гексана/уксусного эфира на силикагеле. В результате получают 3 г (9,1 ммолей = 53%) соединения, указанного в заголовке, в виде желтого масла.
1H-ЯМР (CDCl3); δ (част./млн): 7,65 (d, шир., 1H, ароматич.); 7,35 (m, 2H, ароматич. ); 7,15 (m, 3H, ароматич.); 6,85 (m, 2H, ароматич.); 5,0 (m, 2H, O-CH2); 3,75 (s, 3H, O-CH3); 2,55 (s, 3H, S-CH3); 2,3 (s, 3H, CH3).
Пример 3. Метиловый эфир N-аллил-N-[2-(3''-бромфенил-1'- метилиминооксиметил-4')-фенил]-карбаминовой кислоты (таблица 7, N 91).
а) о-Метоксиметилнитробензол.
130 г (0,6 моля) о-нитробензилбромида в 200 мл метанола по каплям обрабатывают 125 г 30%-ного раствора метанолята натрия (0,69 моля) в метаноле. При этом реакционная смесь нагревается до приблизительно 50o C. Перемешивание продолжается еще в течение 3 ч, причем реакционная смесь охлаждается до комнатной температуры, затем в реакционный сосуд добавляют ледяную воду и реакционную смесь нейтрализуют добавлением разбавленной соляной кислоты. Водную фазу экстрагируют трижды с помощью простого эфира, органическую фазу сушат над MgSO4 и выпаривают ее. В качестве остатка получают 101 г (0,6 моля; количественный выход) соединения, указанного в заголовке, в виде масла коричневатого цвета.
1H-ЯМР (CDCl3); δ (част. /млн): 8,1 (d, шир., 1H, ароматич.); 7,8 (d, шир. , 1H, ароматич. ); 7,65 (t, шир., 1H, ароматич.); 7,45 (t, шир., 1H, ароматич.); 4,85 (s, 2H, O-CH2); 3,5 (s, 3H, OCH3).
б) Метиловый эфир N-(2-метоксиметилфенил)-карбаминовой кислоты, 101 г (0,6 моля) о-метоксиметилнитробензола (пример 3а) в 1 л метанола при 20-30oC по каплям обрабатывают 528 г 21,8%-ного раствора Na2[Fe(CO)4] (0,6 моля; 1 кг раствора содержит 633 г воды, 218 г Na2[Fe(CO)4], 108 г Na2CO3 и 41 г NaOH). Реакционную смесь перемешивают в течение 1 ч при комнатной температуре, после чего разбавляют ее простым эфиром. При этом в реакционном сосуде образуется осадок в виде коричневого масла. Всю реакционную смесь подают на колонку с силикагелем и элюируют простым эфиром. Затем эфир выпаривают, остаток растворяют в хлористом метилене и сушат над MgSO4. После этого повторно отсасывают через силикагель и растворитель выпаривают в вакууме. Остаток очищают хроматографией на колонке с помощью гексана и хлористого метилена. В результате получают 83,8 г о-метоксиметиланилина в виде коричневого масла, которое непосредственно преобразуют дальше.
Полученный сырой продукт растворяют в 700 мл хлористого метилена, после чего добавляют сначала 62,4 г (0,66 моля) метилового эфира хлормуравьиной кислоты и затем по каплям 52,2 г (0,66 моля) пиридина. Реакционную смесь перемешивают в течение ночи при комнатной температуре и затем экстрагируют ее с помощью разбавленной соляной кислоты и воды. Органическую фазу сушат над MgSO4 и выпаривают. Остаток очищают посредством хроматографии на колонке с помощью смесей гексана/уксусного эфира. В результате получают со степенью чистоты около 90% 89,4 г (0,41 моля=69% по отношению к 2-метоксиметилнитробензолу) соединения, указанного в заголовке, в виде желтого масла.
1H-ЯМР (CDCl3); δ (част./млн): 8,0 (m, 2H, 1 x ароматич., NH), 7,35 (t, шир., 1H, ароматич.); 7,15 (d, шир., 1H, ароматич.); 7,0 (t, шир., 1H, ароматич.); 4,5 (s, 2H, OCH2); 3,8 (s, шир., 3H, OCH3 ); 3,4 (s, шир., 3H, OCH3).
в) Метиловый эфир N-(2-бромметилфенил)-карбаминовой кислоты.
10 г (51 ммолей) метилового эфира N-(2-метоксиметилфенил)- карбаминовой кислоты (пример 2б) в 100 мл хлористого метилена по каплям обрабатывают 38,6 г (150 ммолей) трибромида бора. Реакционную смесь перемешивают в течение 2 ч и затем при энергичном перемешивании добавляют ее по каплям в раствор из 11,8 г (0,17 моля) NaHCO3 в воде. Органическую фазу отделяют, а водную фазу экстрагируют один раз с помощью хлористого метилена и один раз с помощью этилового эфира уксусной кислоты. Соединенные органические фазы сушат над MgSO4 и выпаривают. В результате получают 9,5 г (39 ммолей = 76%) соединения, указанного в заголовке, в виде бесцветного твердого вещества.
Tразм=132oC,1H-ЯМР (CDCl3); δ (част./млн): 7,85 (d, шир., 1H, ароматич. ); 7,3 (m, 2H, ароматич.); 7,1 (t, шир., 1H, ароматич.); 6,9 (s, шир., 1H, NH); 4,5 (s, 2H, CH2-Br); 3,8 (s, 3H, OCH3).
г) Метиловый эфир
N-[2-(3''-бромфенил-1'-метилиминооксиметил- 4')-фенил] -карбаминовой кислоты (таблица 7, N 88),
7 г (33 ммоля) м-бромацетофеноноксима в 100 мл диметилформамида порциями обрабатывают 0,95 г
(39 ммоля) гидрида натрия. После того, как заканчивается газообразование, по каплям добавляют 8 г (33 ммоля) метилового эфира N-(2-бромметилфенил)-карбаминовой кислоты (пример 3в), растворенных в 10
мл диметилформамида. Затем перемешивают в течение 3 ч при комнатной температуре, разбавляют реакционную смесь водой и экстрагируют водную фазу трижды с помощью простого эфира. Органическую фазу трижды
промывают водой, сушат и концентрируют. Остаток выпадает в виде кристаллов и его тонко растирают и размешивают с метанолом. В результате получают 5,1 г (13,5 ммолей = 41%) соединения, указанного в
заголовке, в виде бесцветного твердого вещества.
Tразм= 124-125oC,1H-ЯМР (CDCL3); δ (част./млн): 8,6 (s, шир., 1H, NH); 7,8-8,1 (m, 2H, ароматич.); 7-7,6 (m, 6H, ароматич); 5,2 (s, 2H, O-CH2); 3,8 (s, 3H, O-CH3); 2,2 (s, 3H, CH3).
д) Метиловый эфир N-аллил-N-[2-(3''бромфенил-1'-метил- иминооксиметил-4')-фенил]-карбаминовой кислоты (таблица 7, N 91).
1,3 г (3,5 ммоля) метилового эфира N-(3''-бромфенил)-1'-метил- иминооксиметил-4'-фенил-2] -карбаминовой кислоты (пример 3г) в 20 мл диметилформамида порциями обрабатывают 0,1 г (4,1 ммоля) гидрида натрия. После окончания газообразования добавляют 0,5 г (3,8 ммоля) аллилбромида и перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь разбавляют водой и трижды экстрагируют простым эфиром. Соединенные эфирные фазы трижды промывают водой, сушат над MgSO4 и концентрируют. В качестве остатка получают 1,5 г (количественный выход) соединения, указанного в заголовке, в виде желтого масла.
1H-ЯМР (CDCl3); δ (част./млн): 7,8 (s, шир., 1H, ароматич.); 7,1-7,6 (m, 7H, ароматич.); 6,0 (m, 1H, C-CH=C); 5,1 (m, 4H, O-CH2 и C=CH2); 4,4 (m, 1H, N-CHA); 4,0 (m, 1H, N-CHB); 3,6-3,8 (s, шир., 2H, O-CH3); 2,2 (s, 3H, CH3).
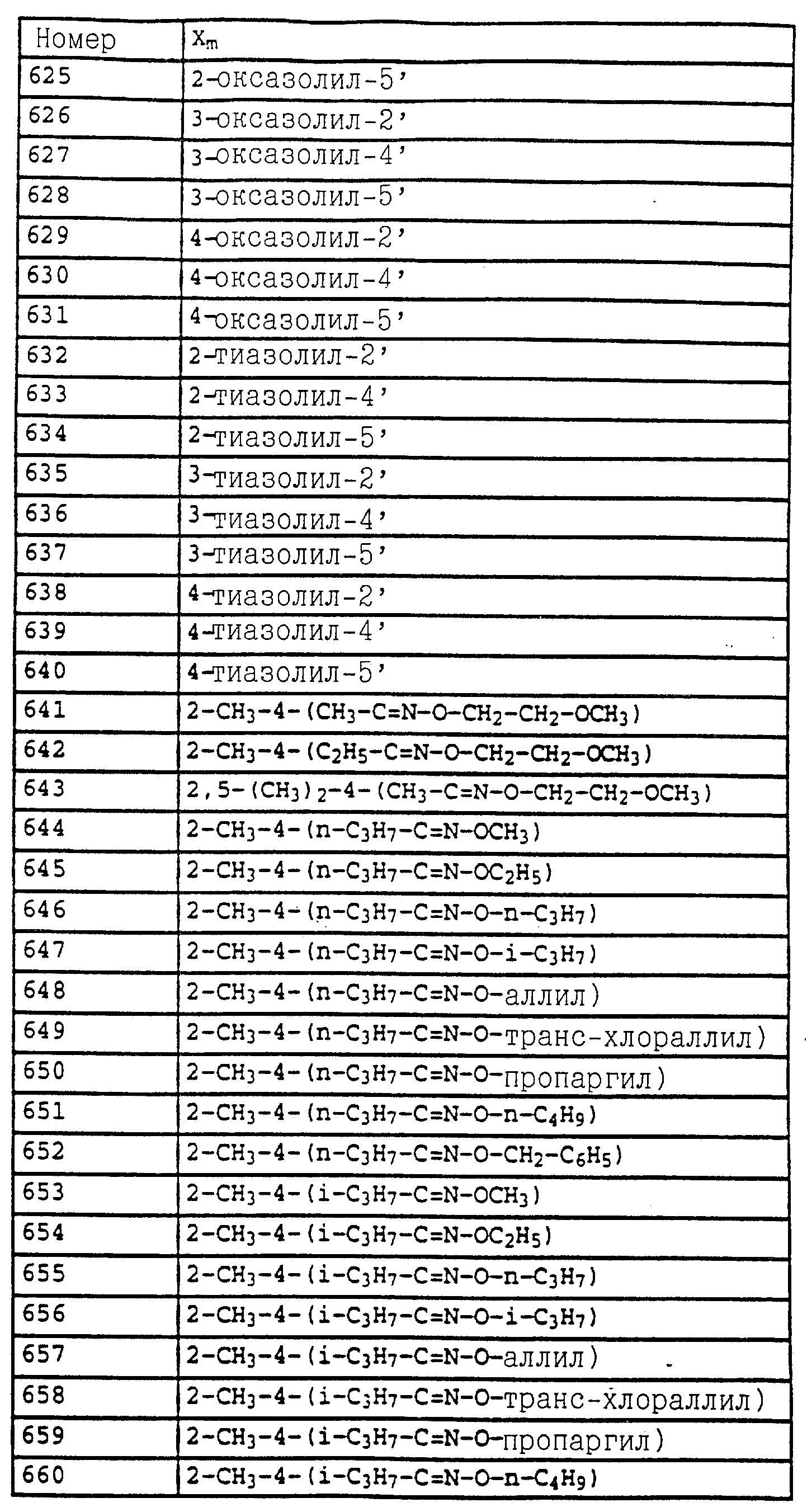
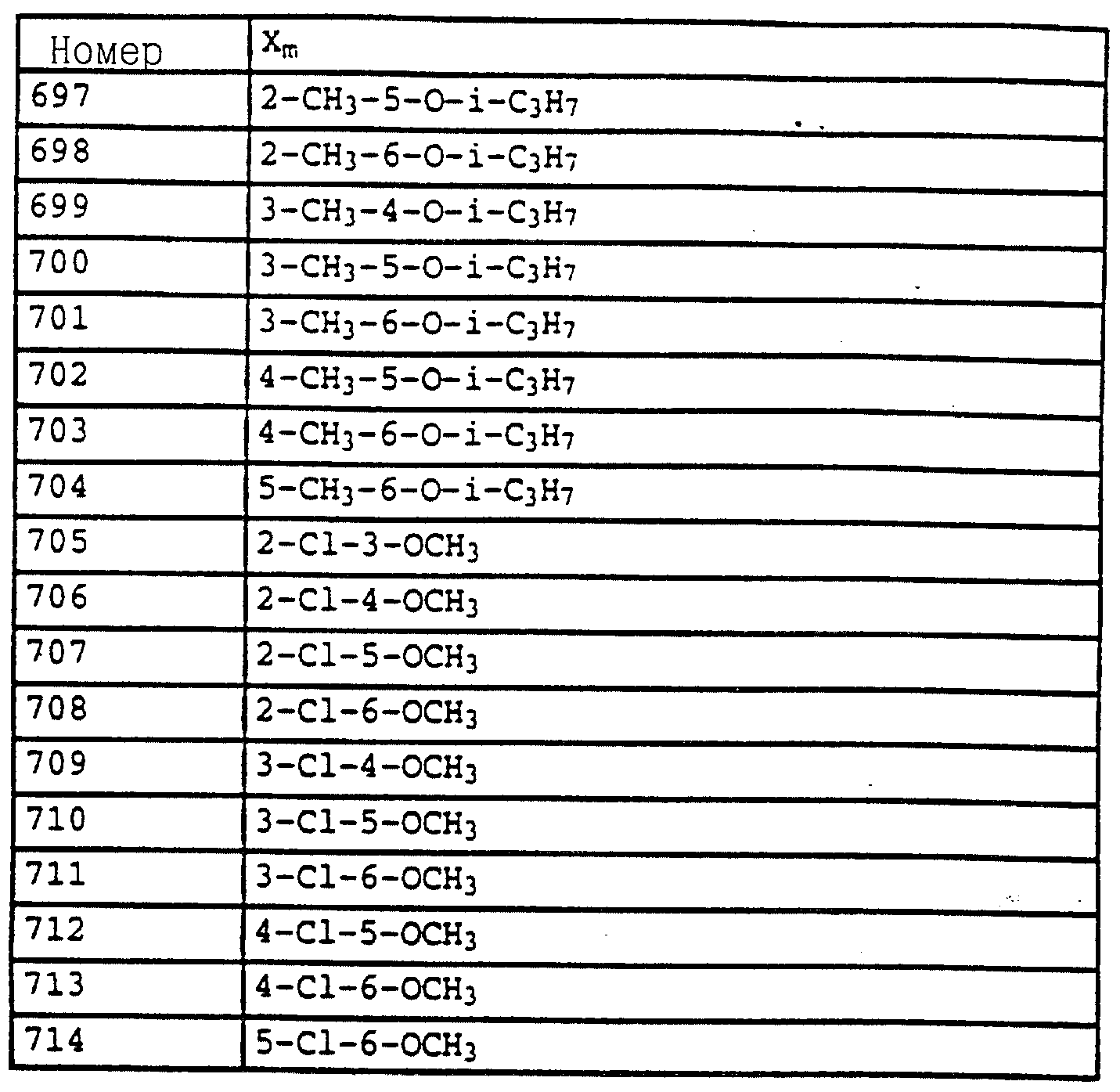
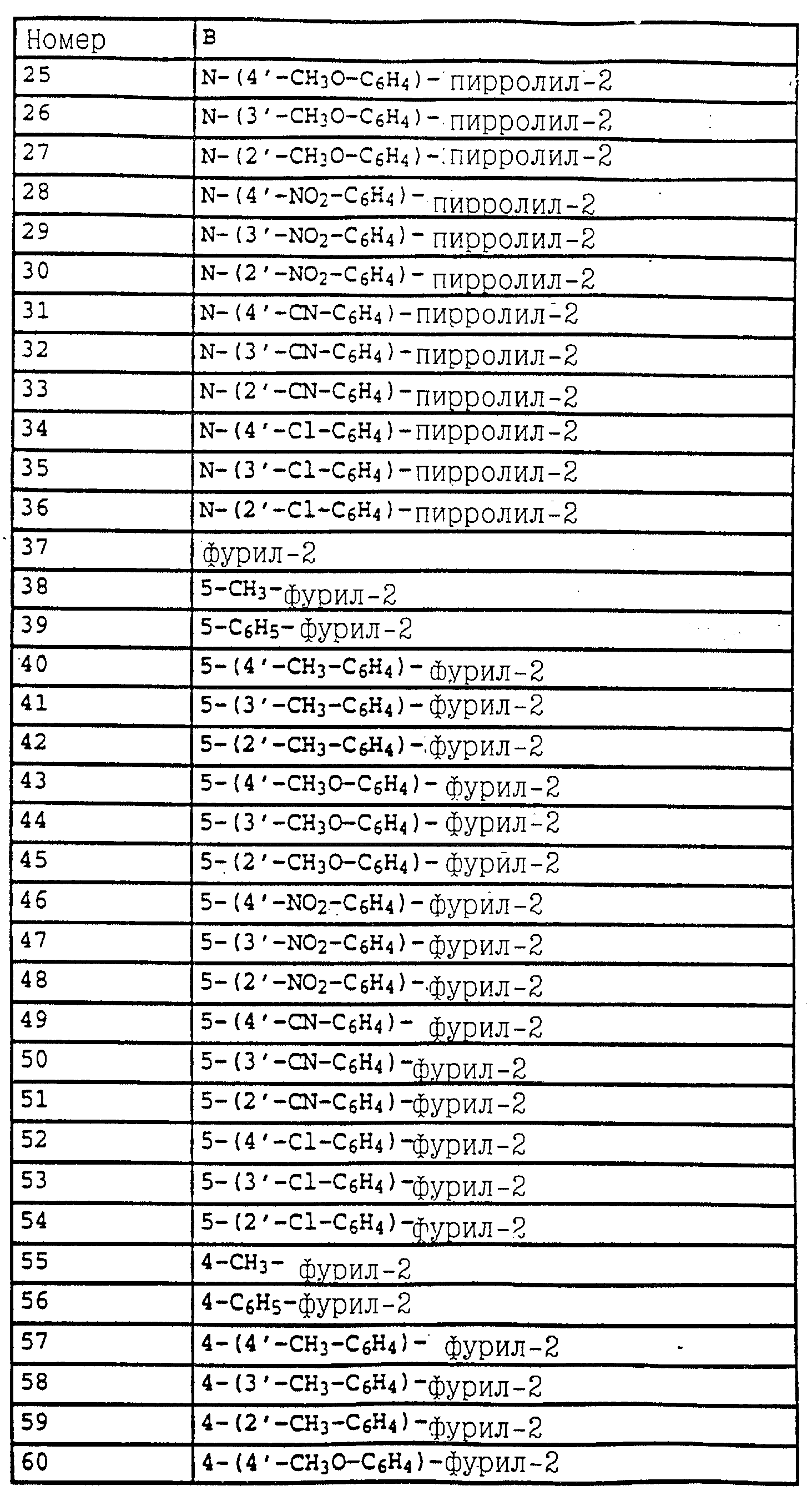
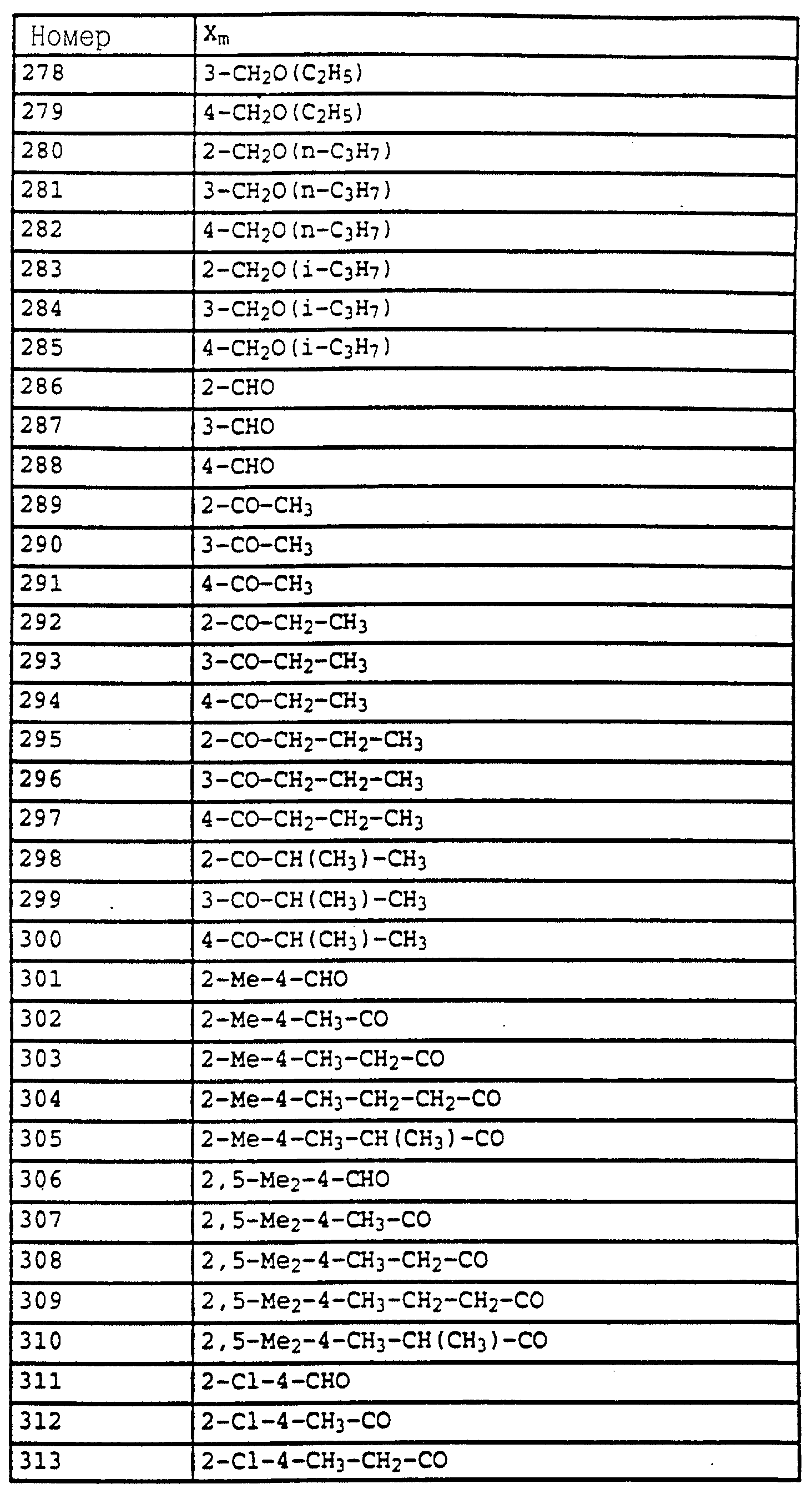
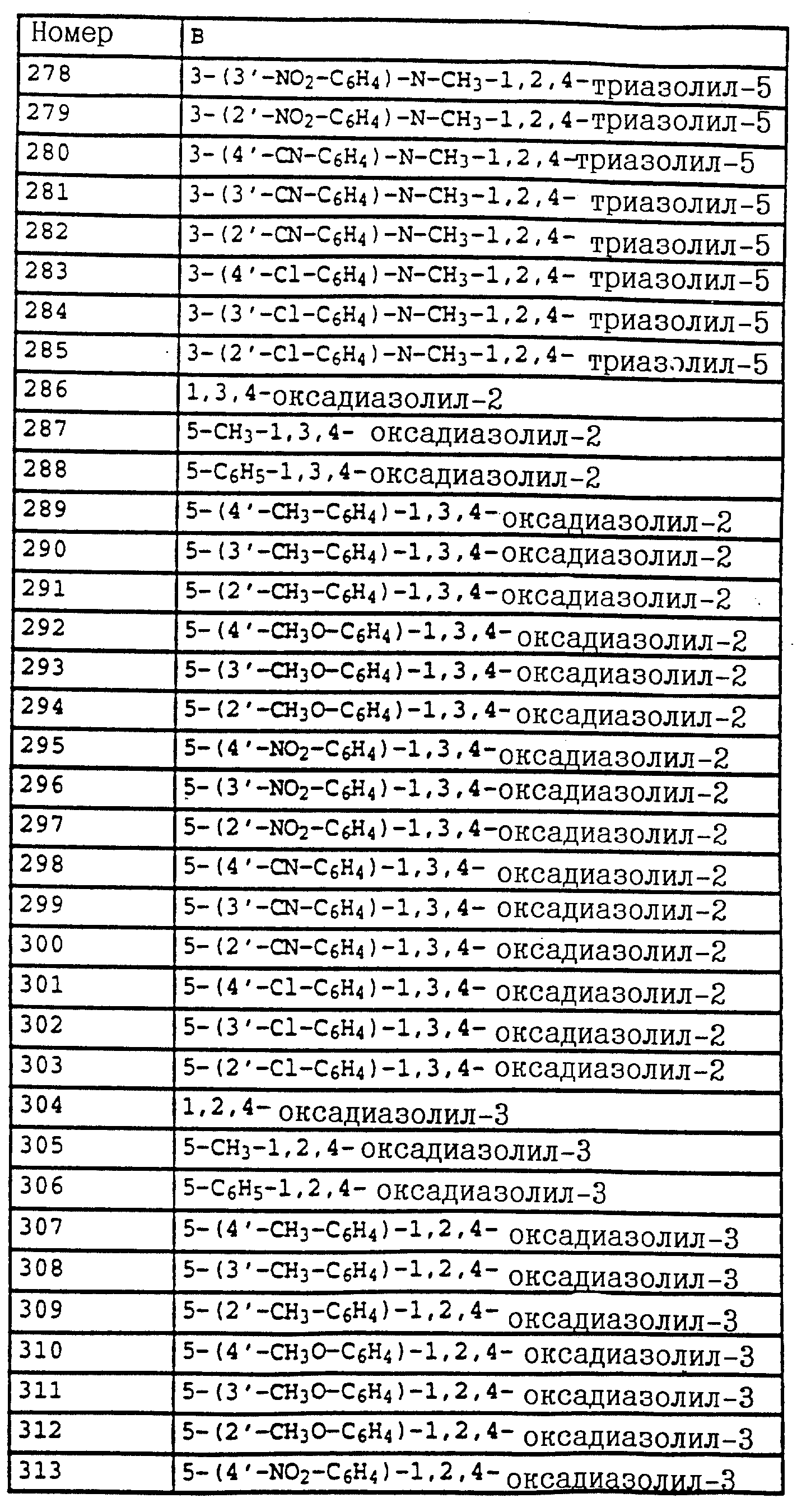
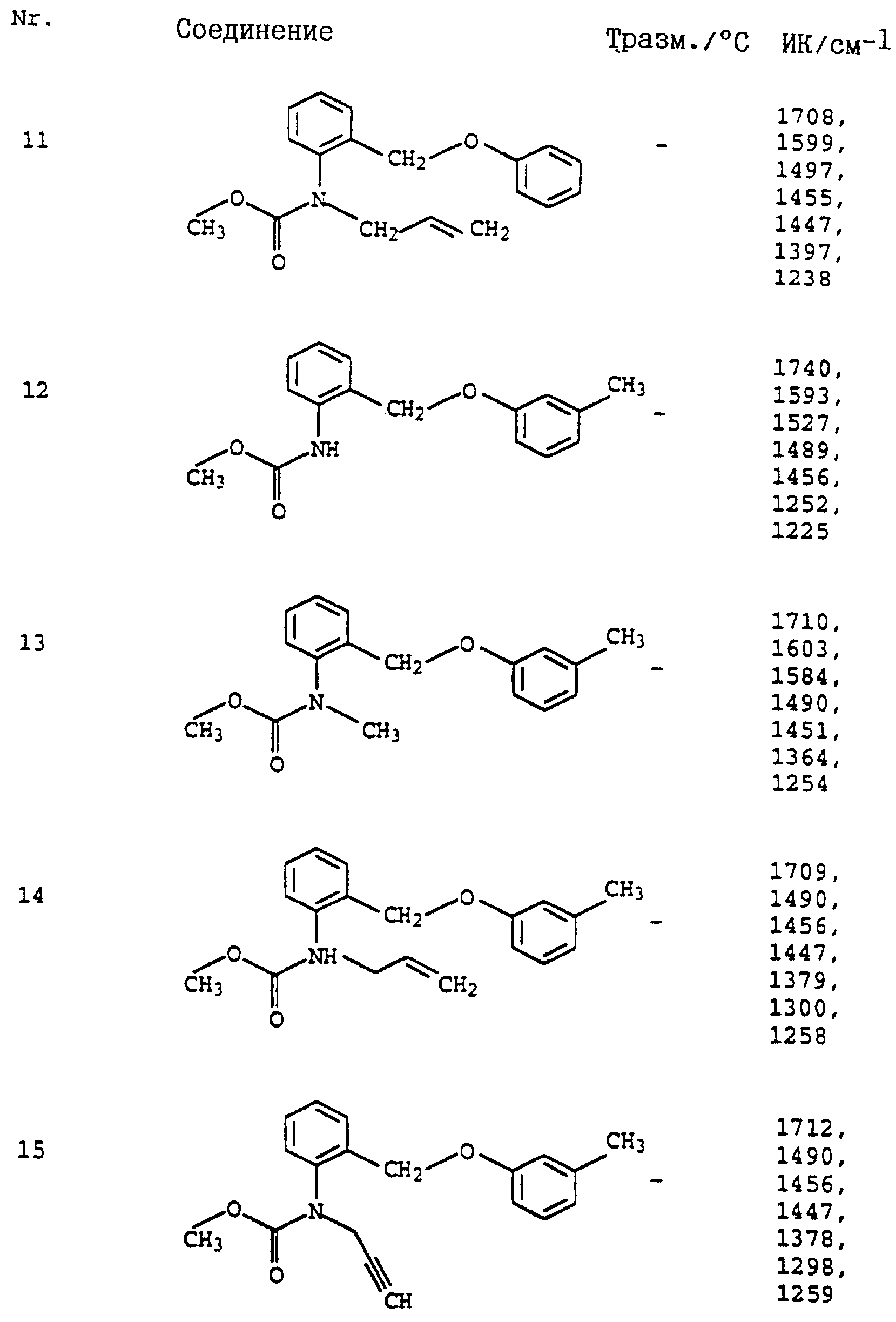
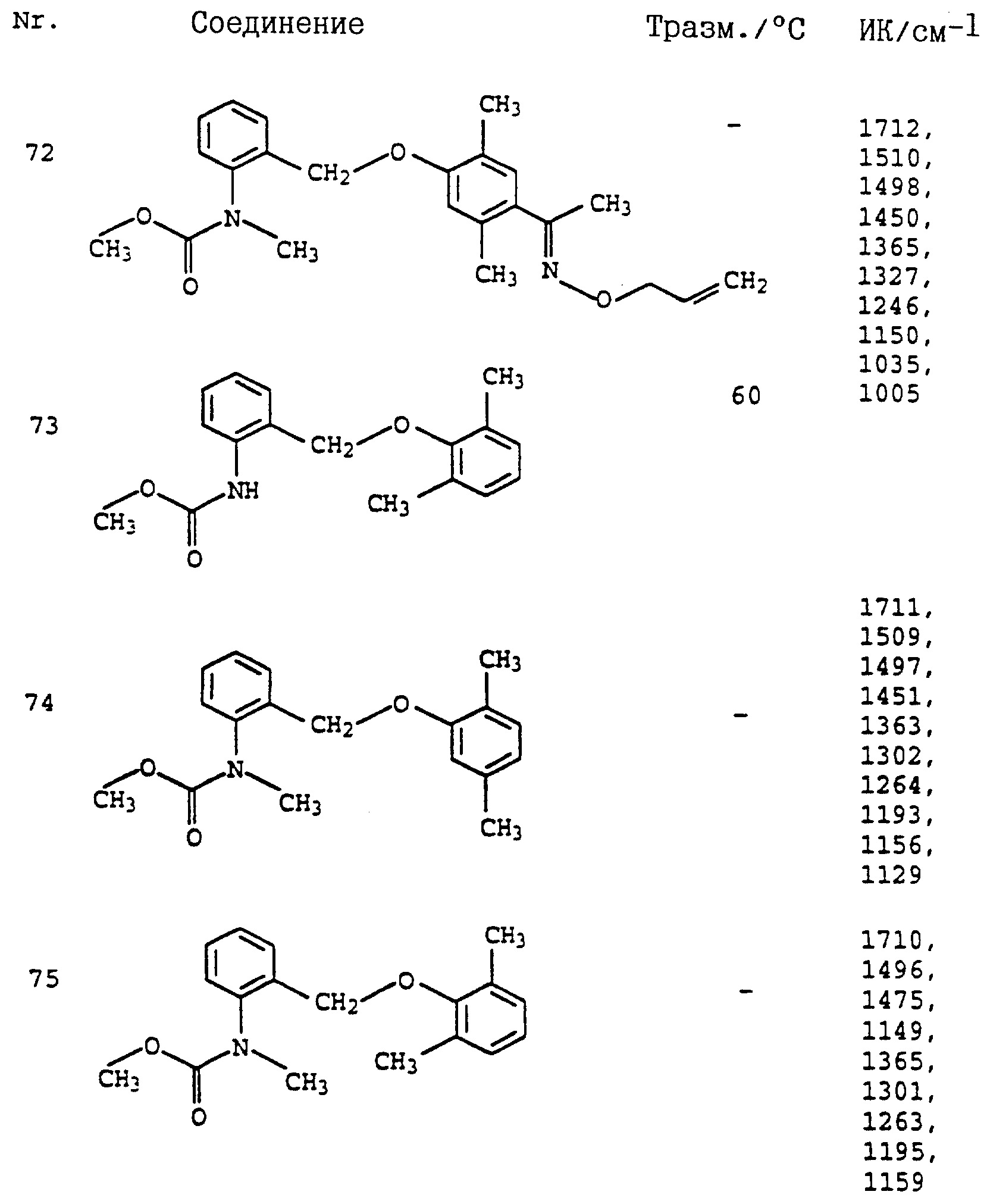
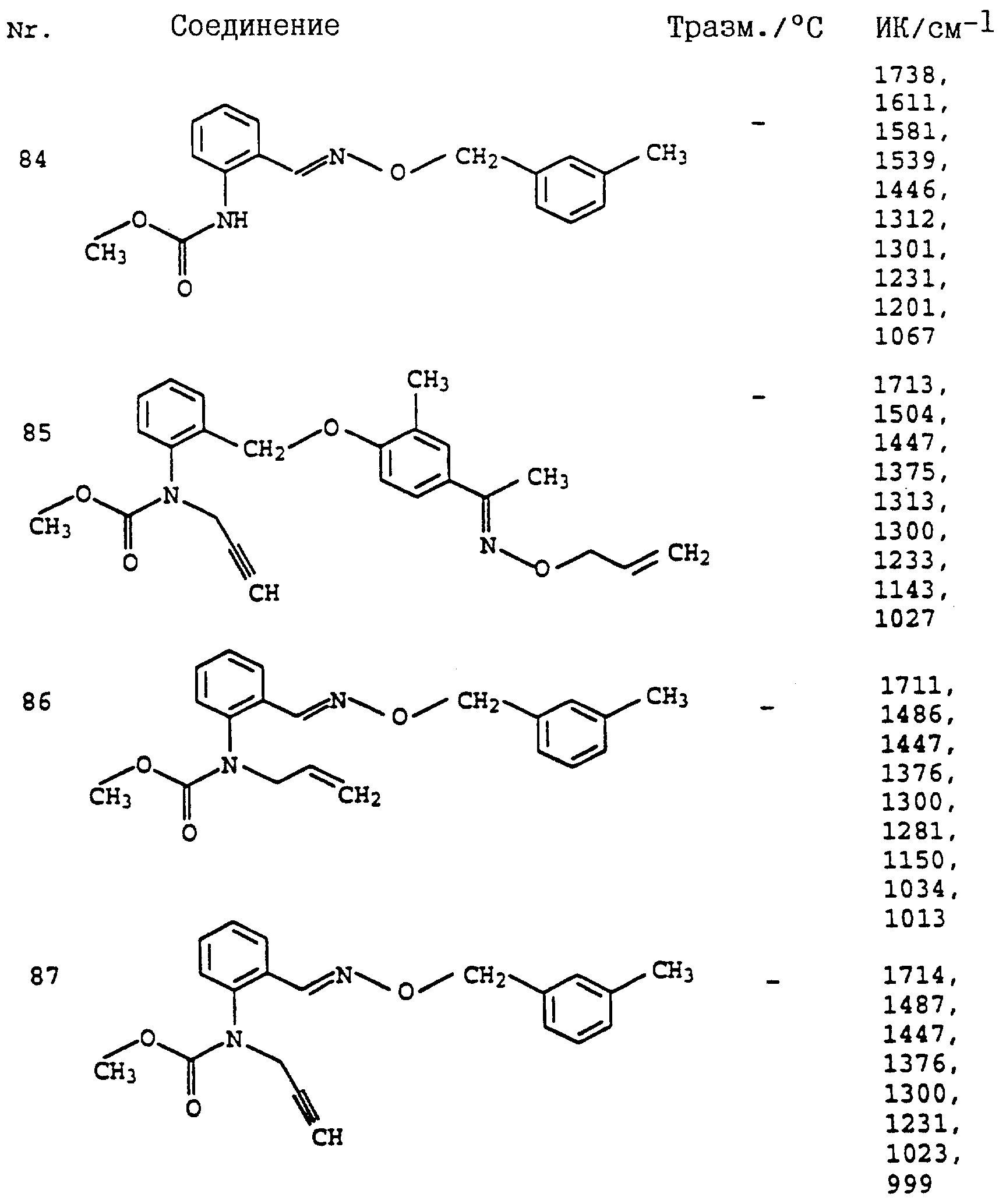
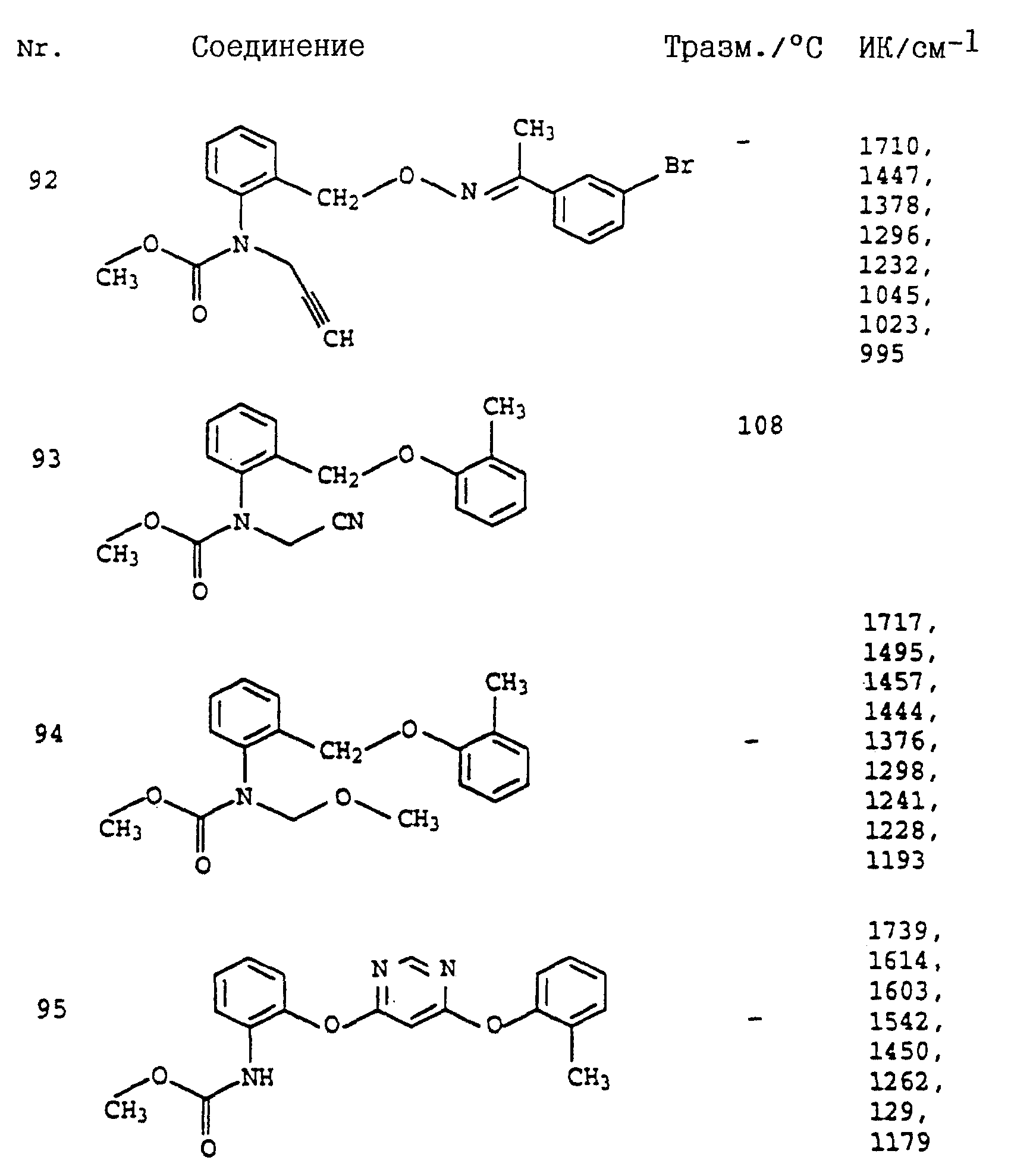
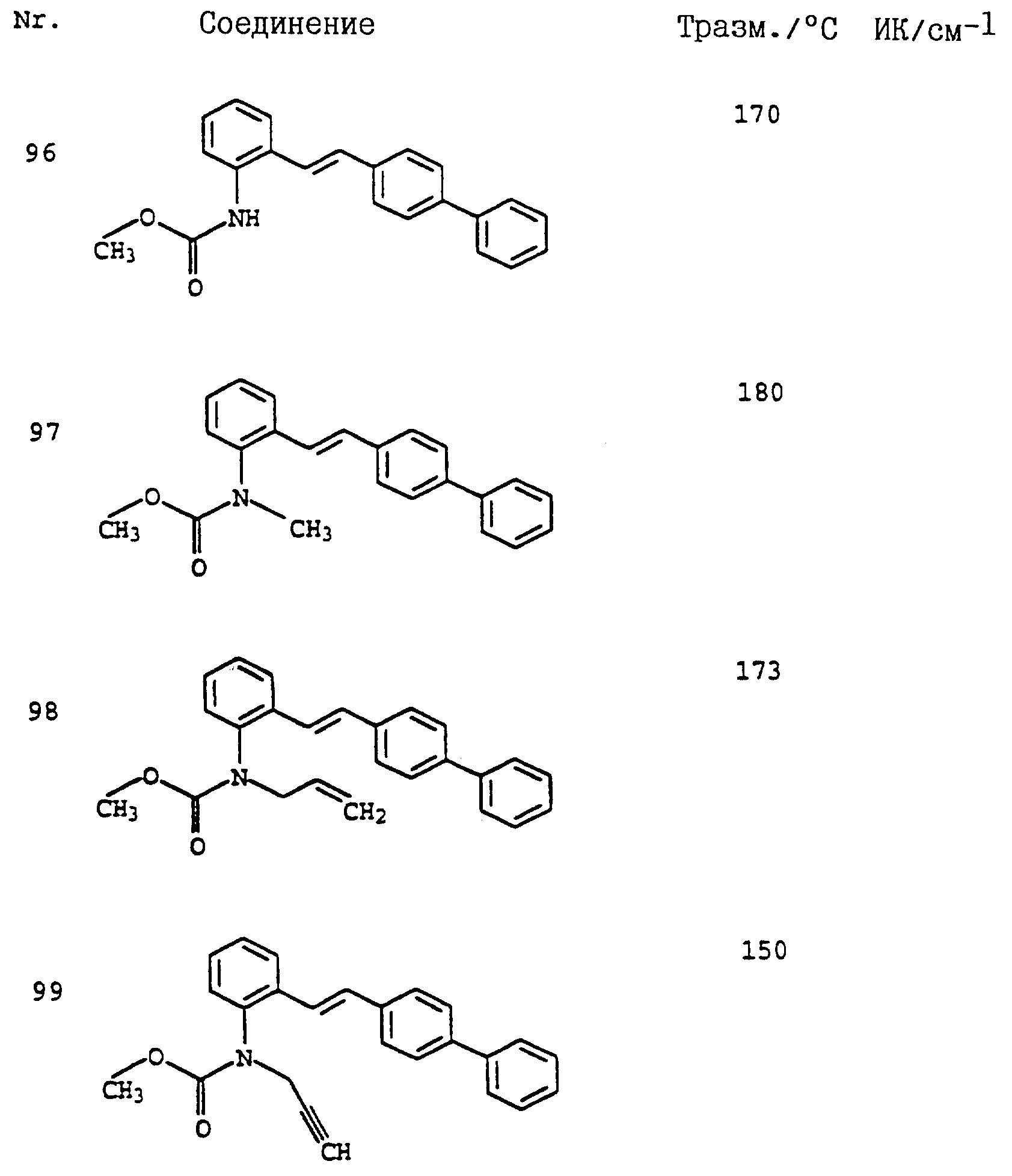
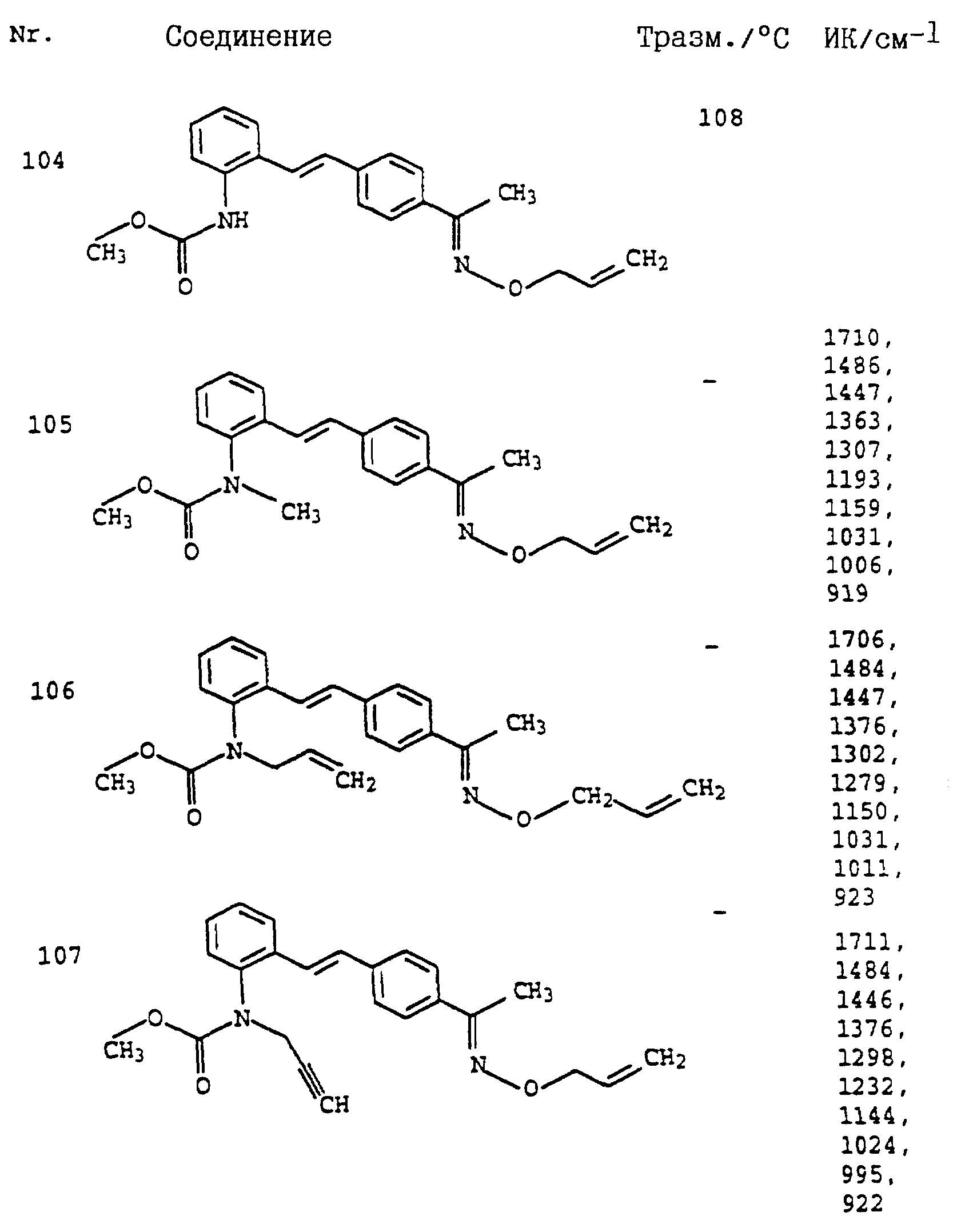
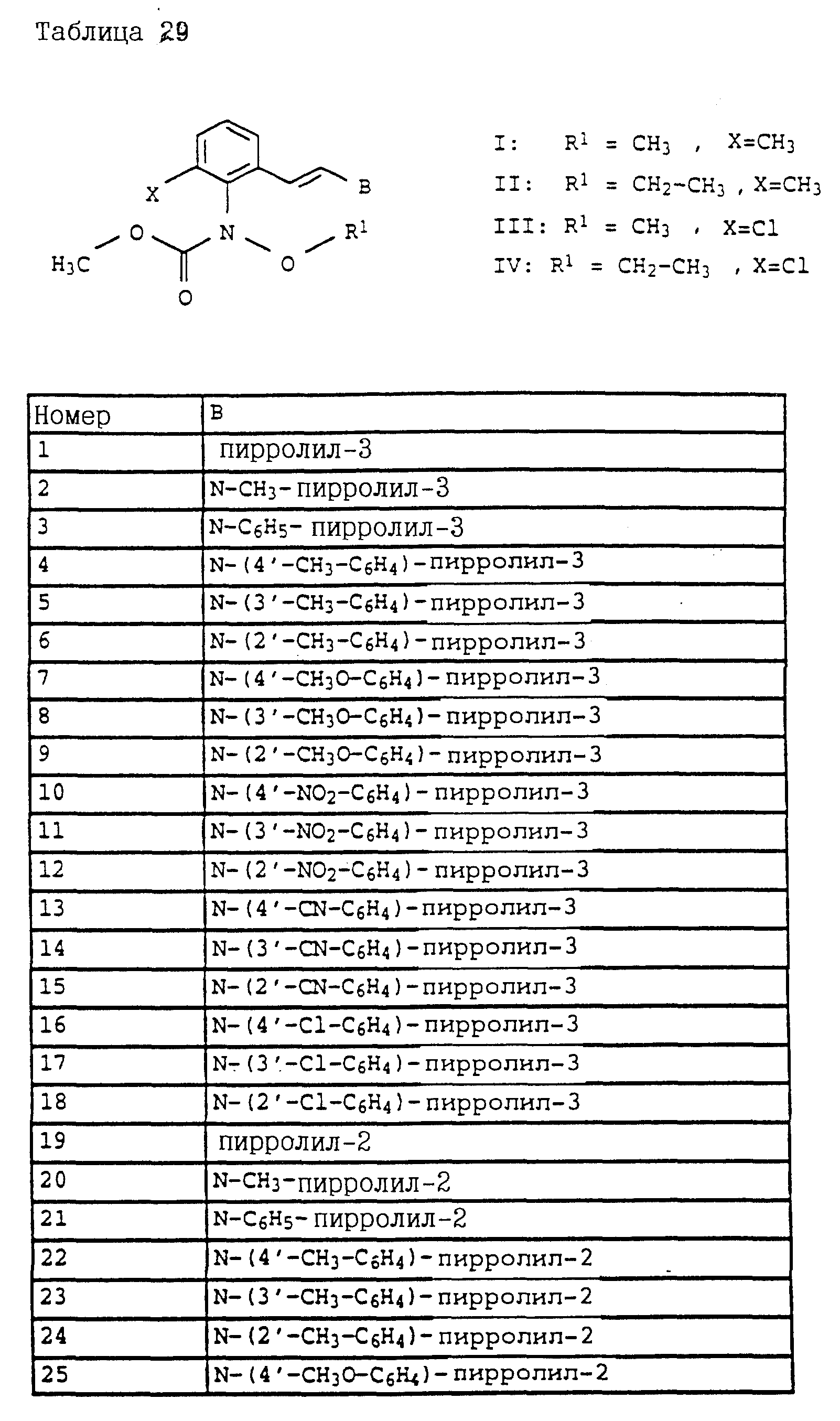
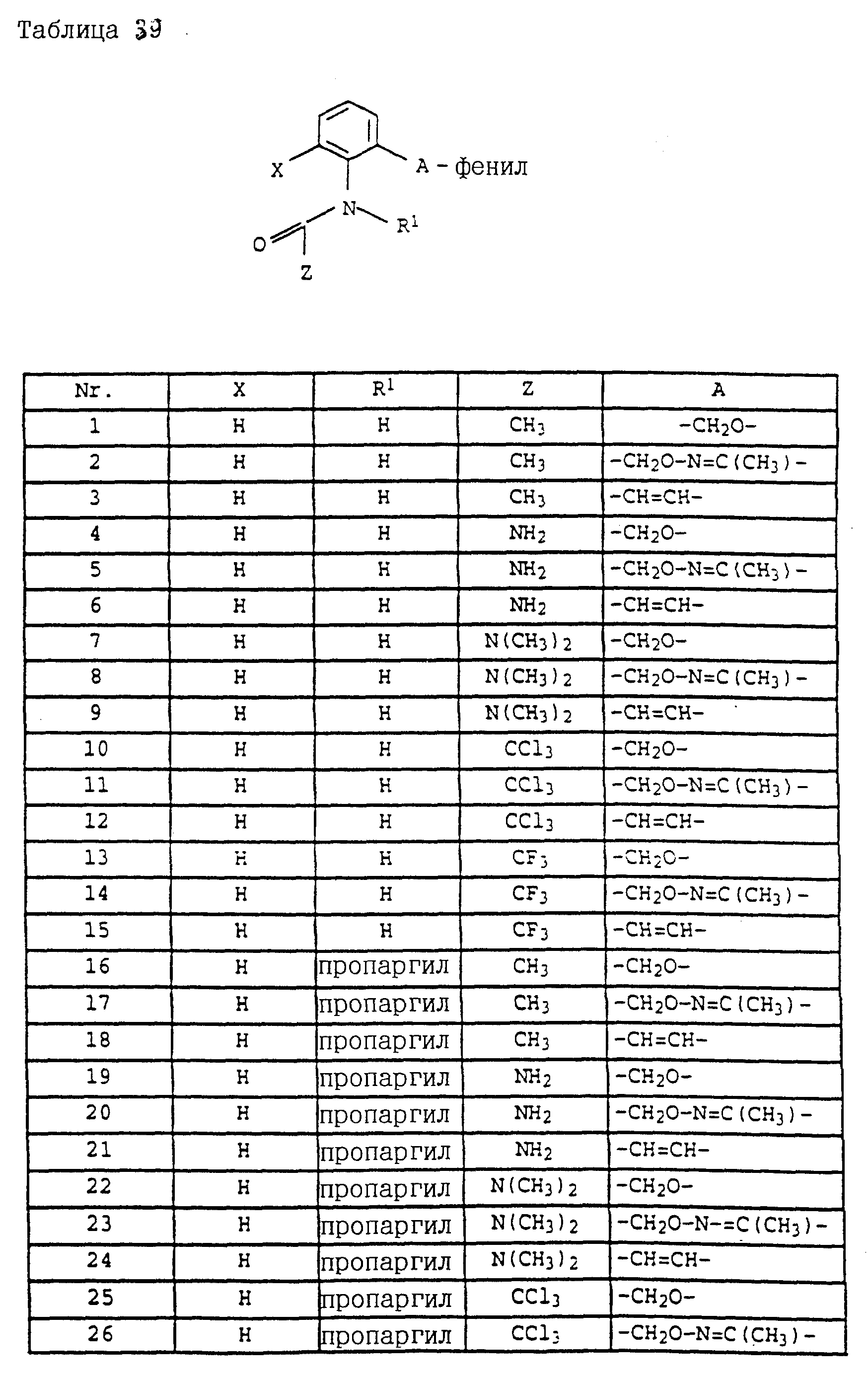
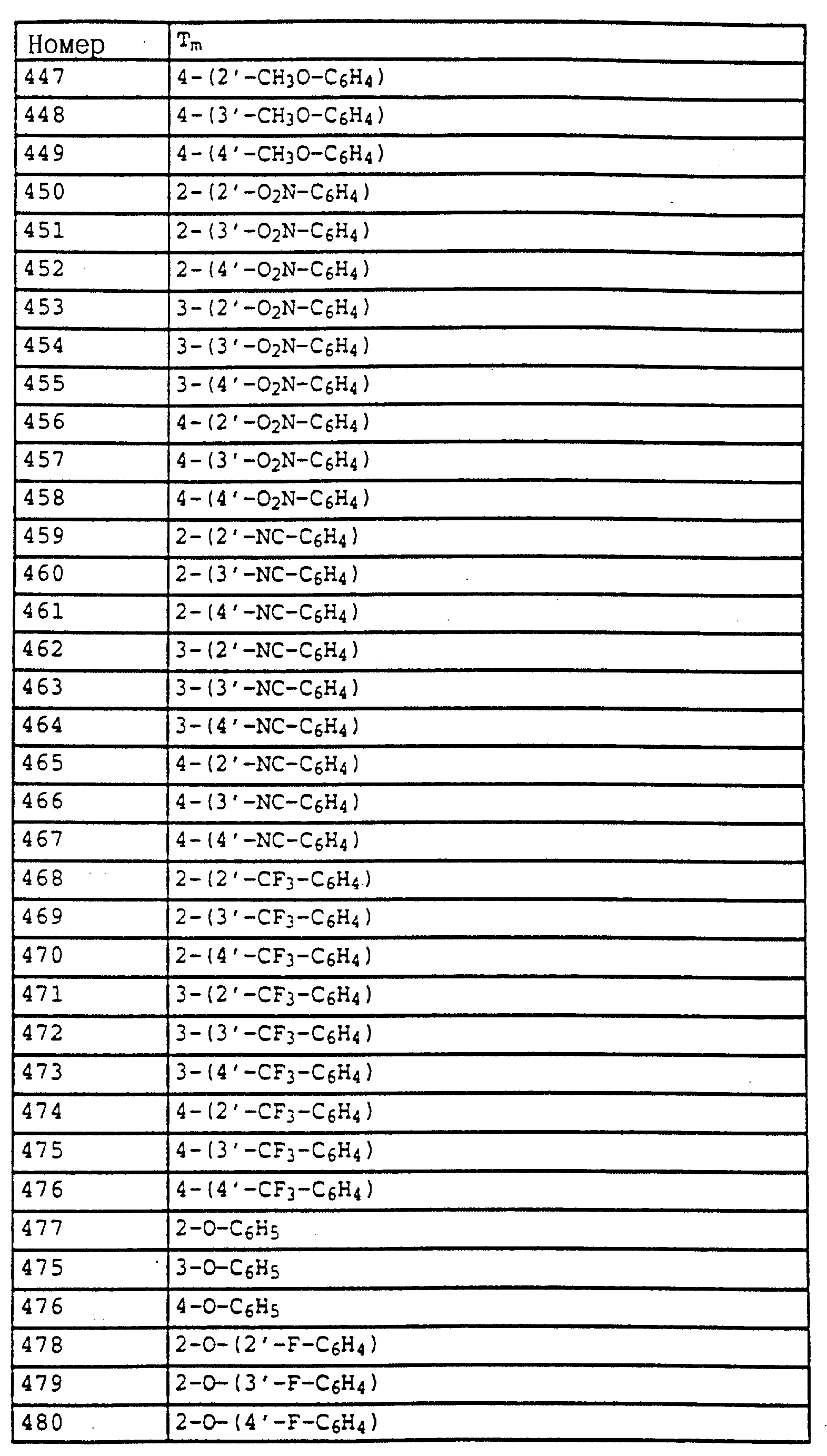
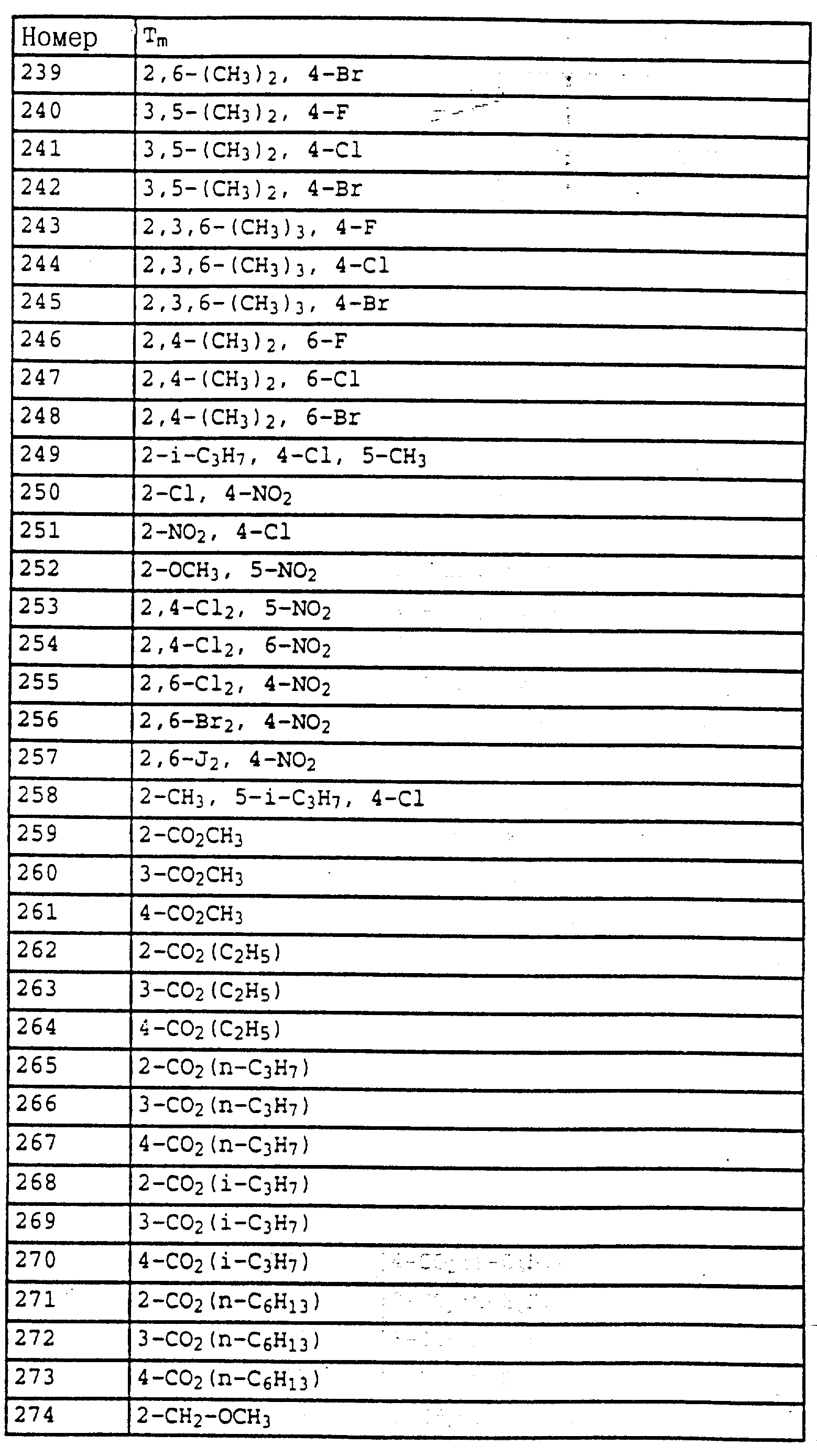
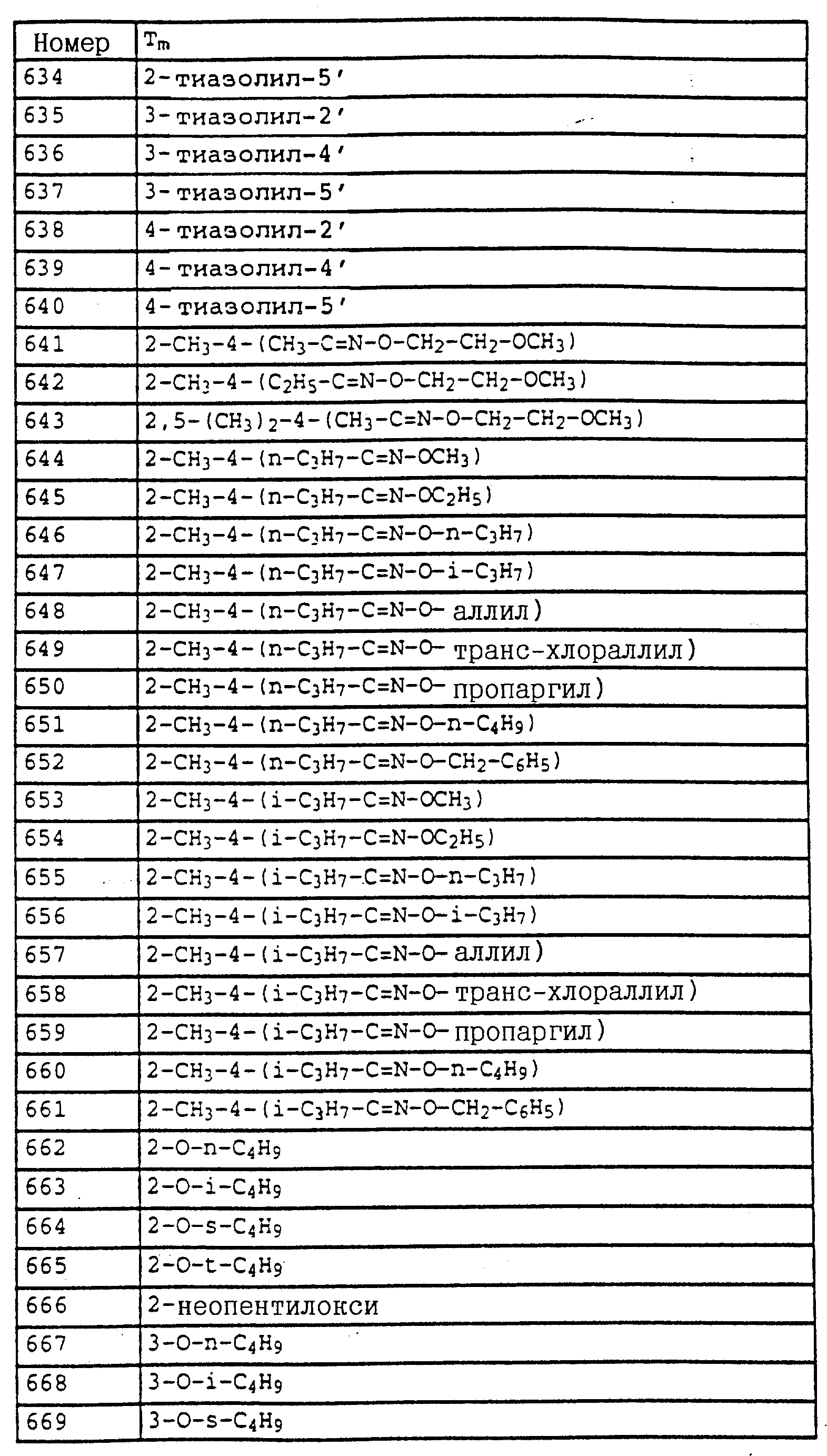
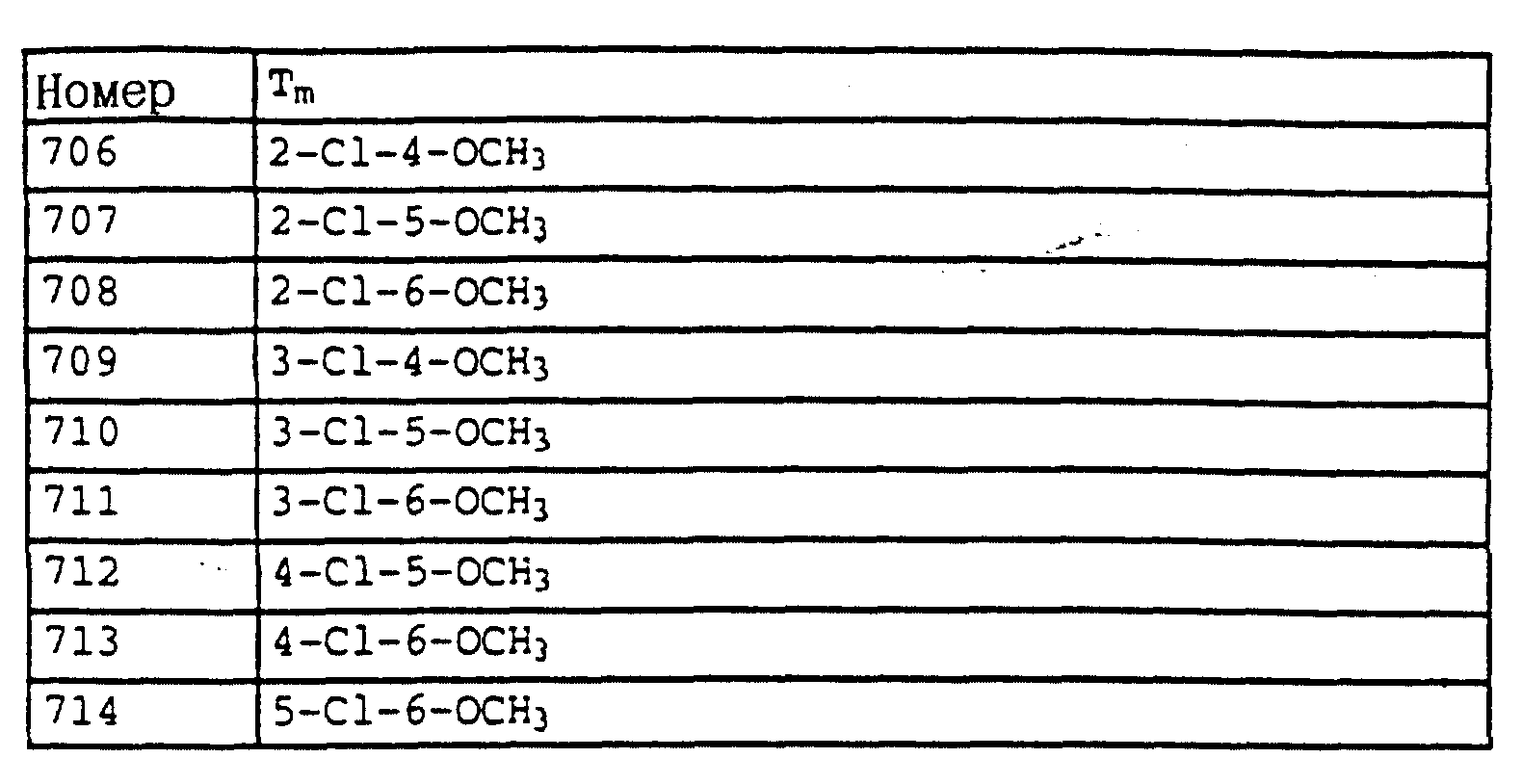
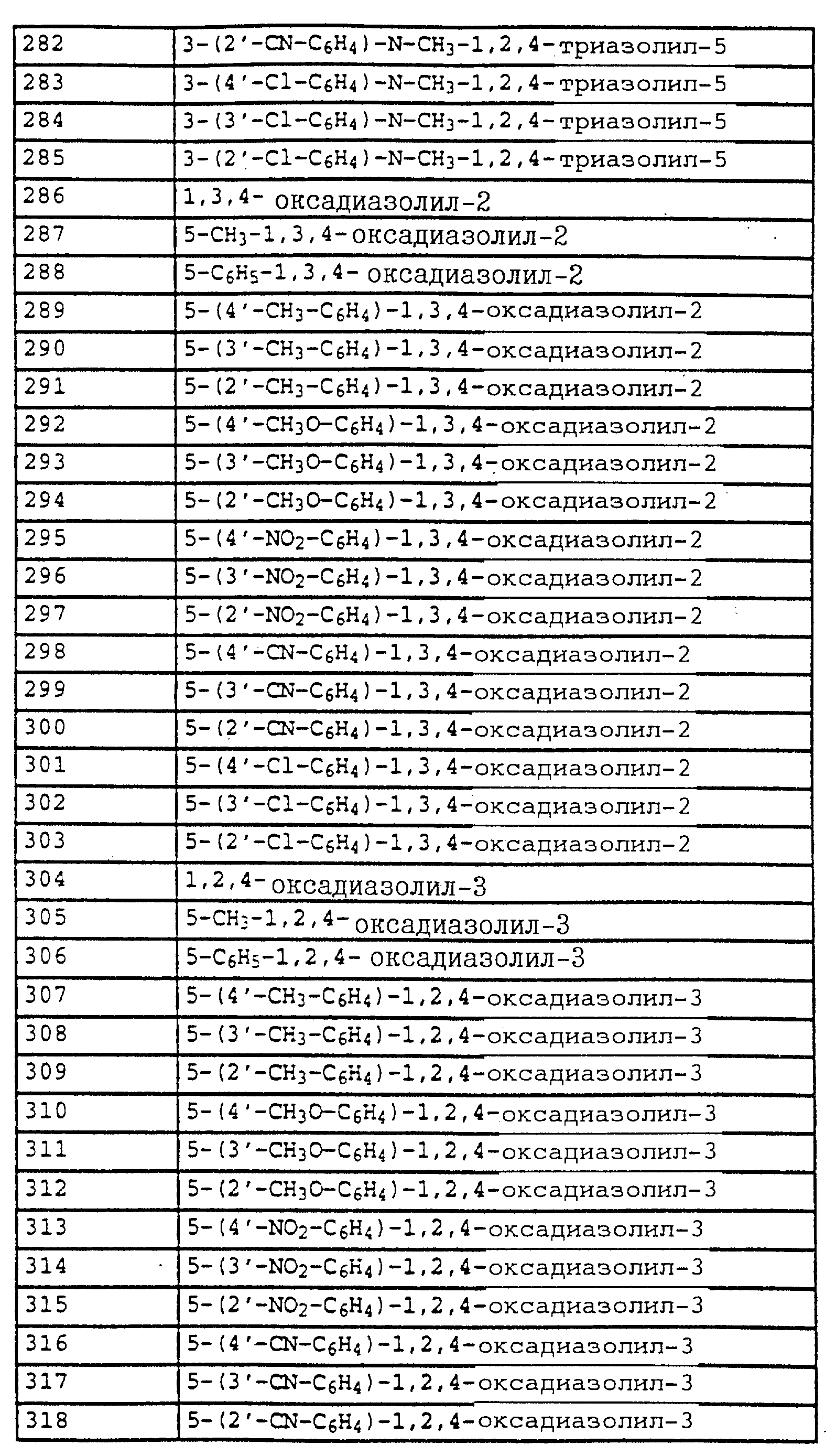
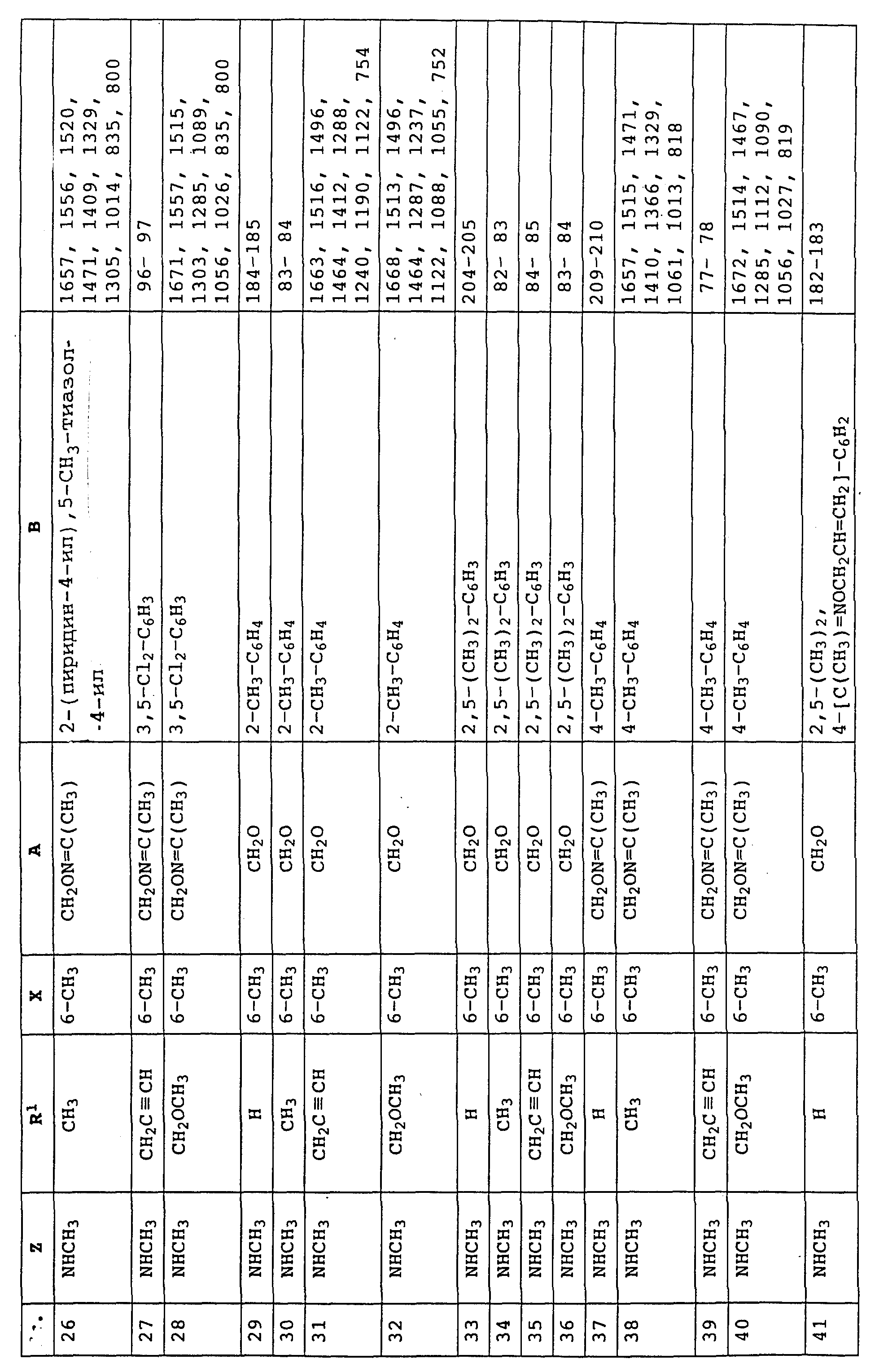
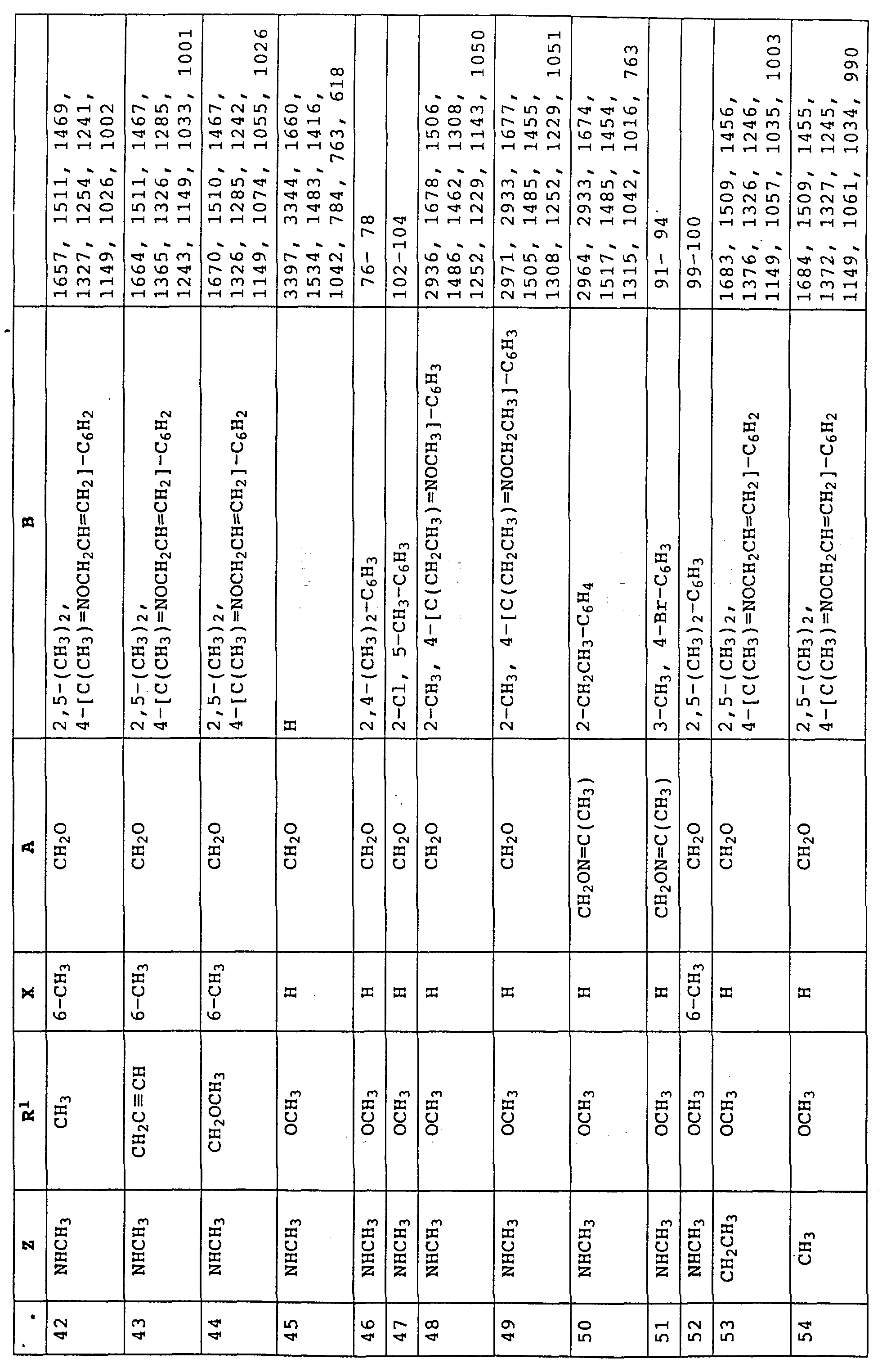
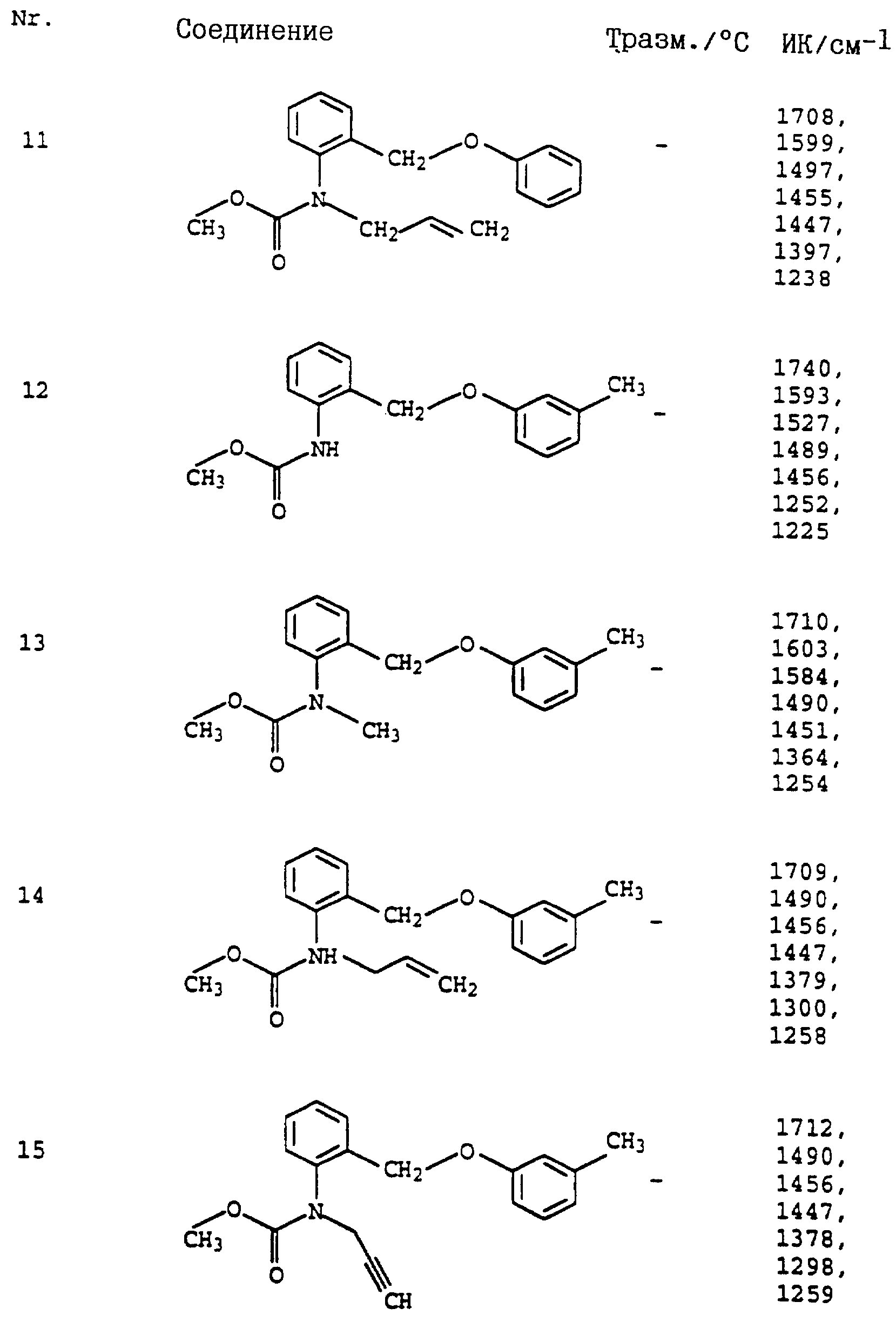
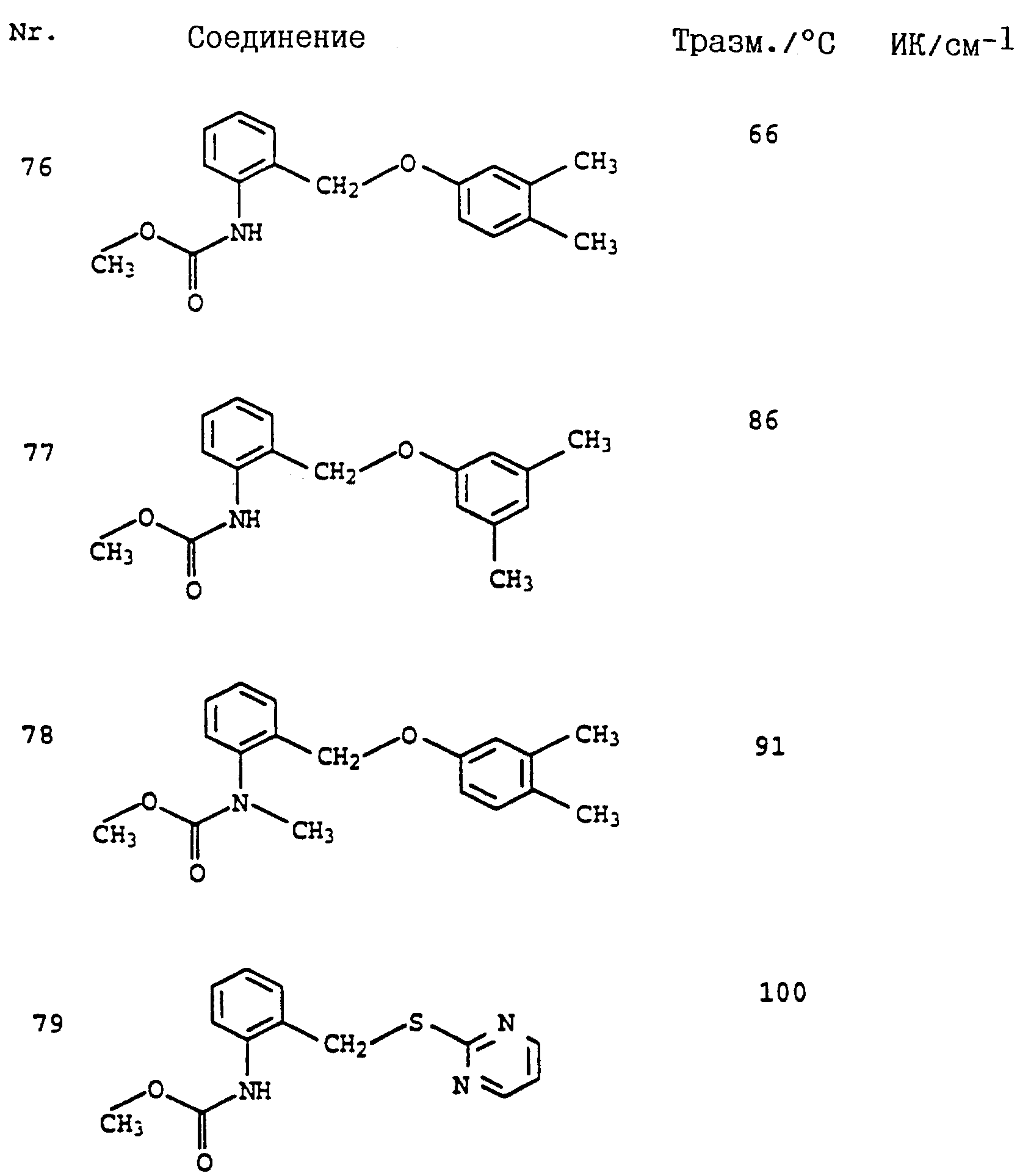
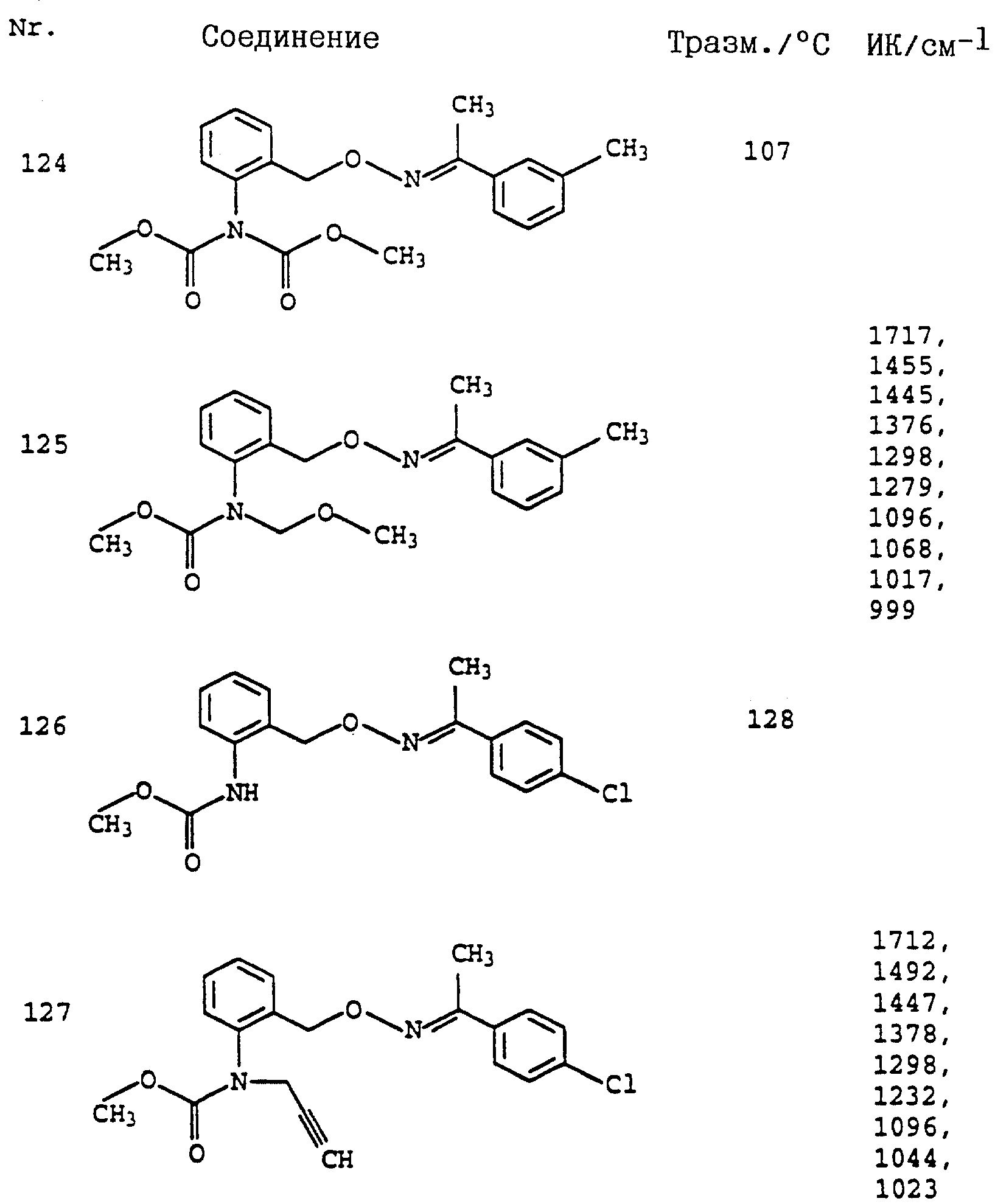
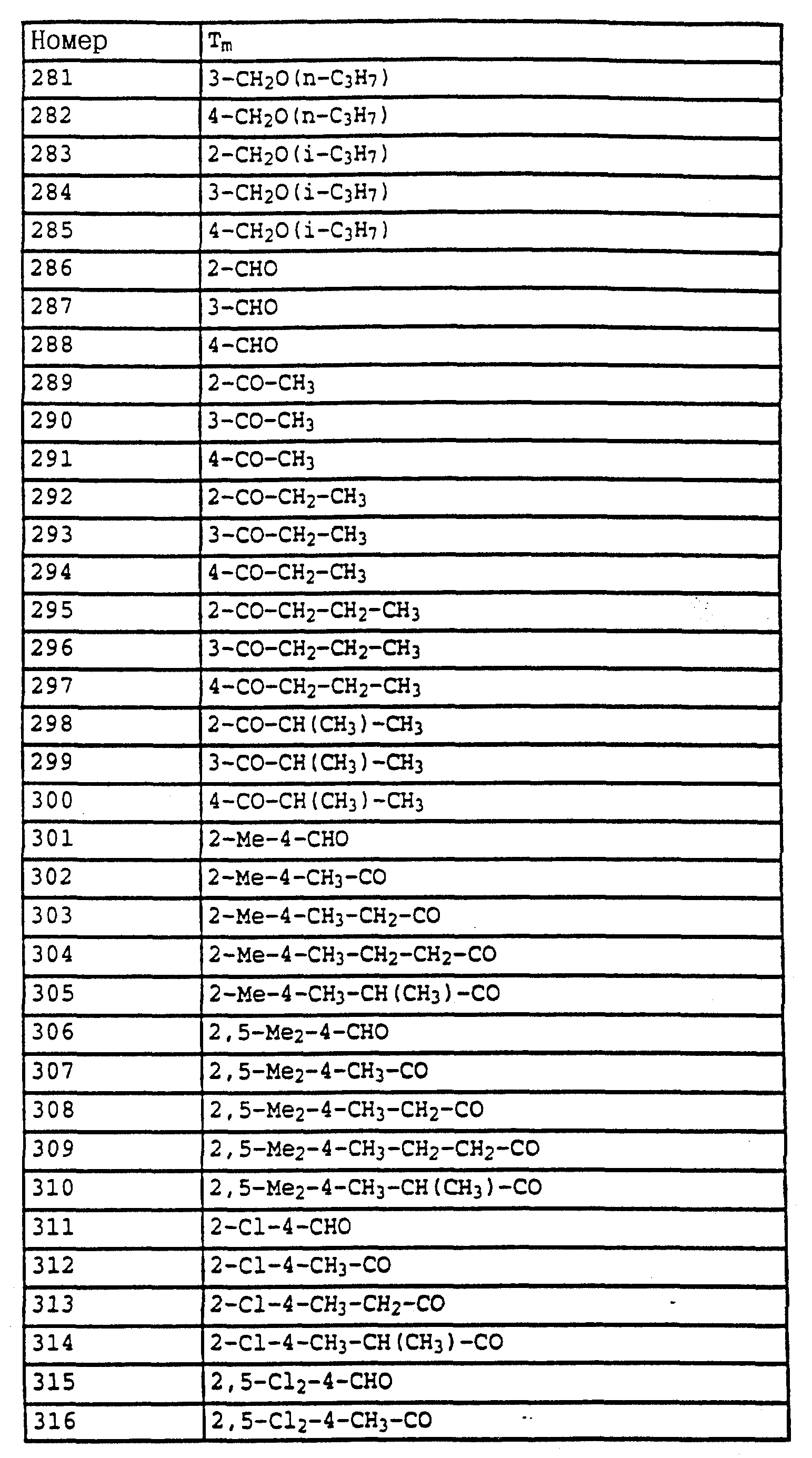
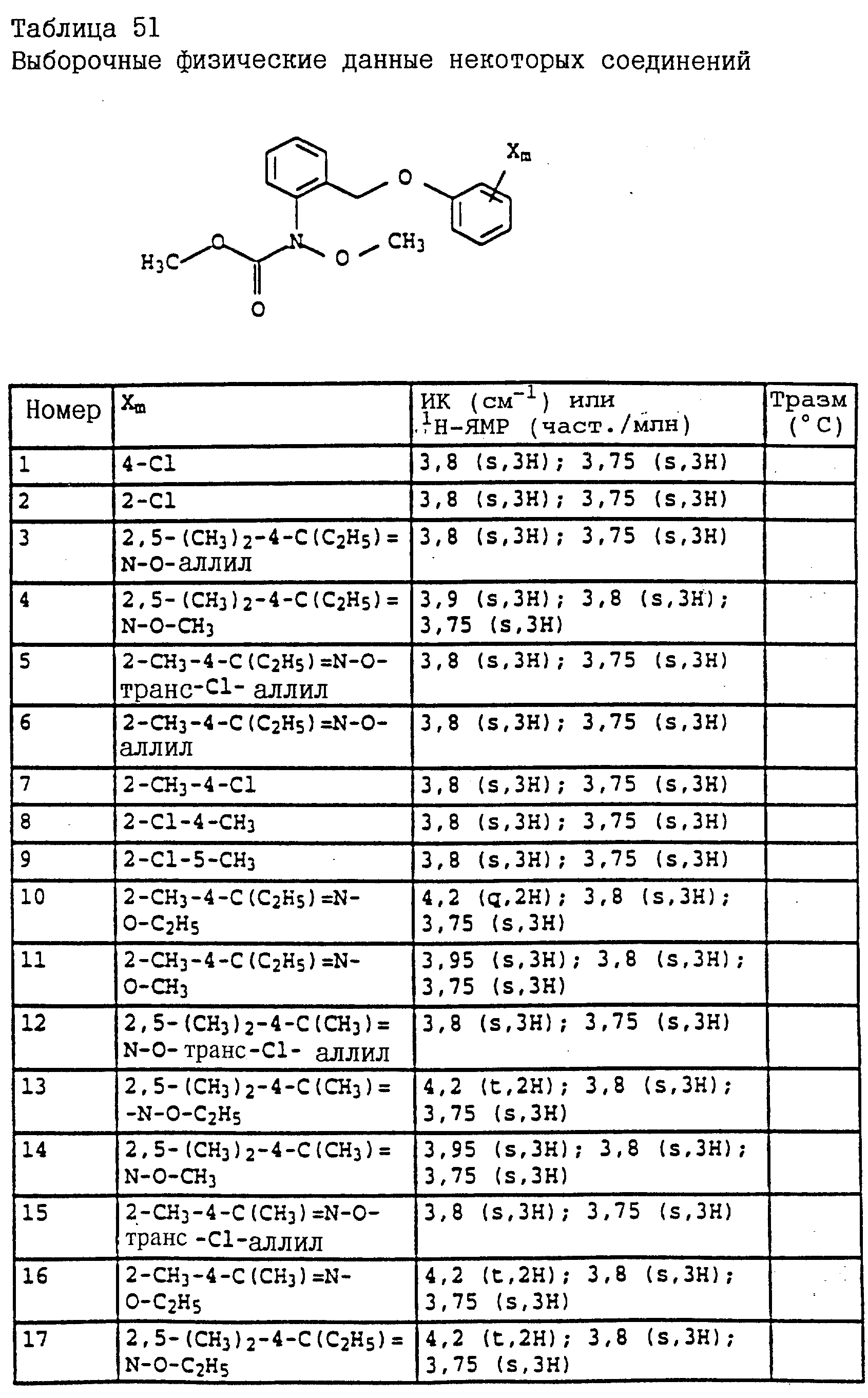
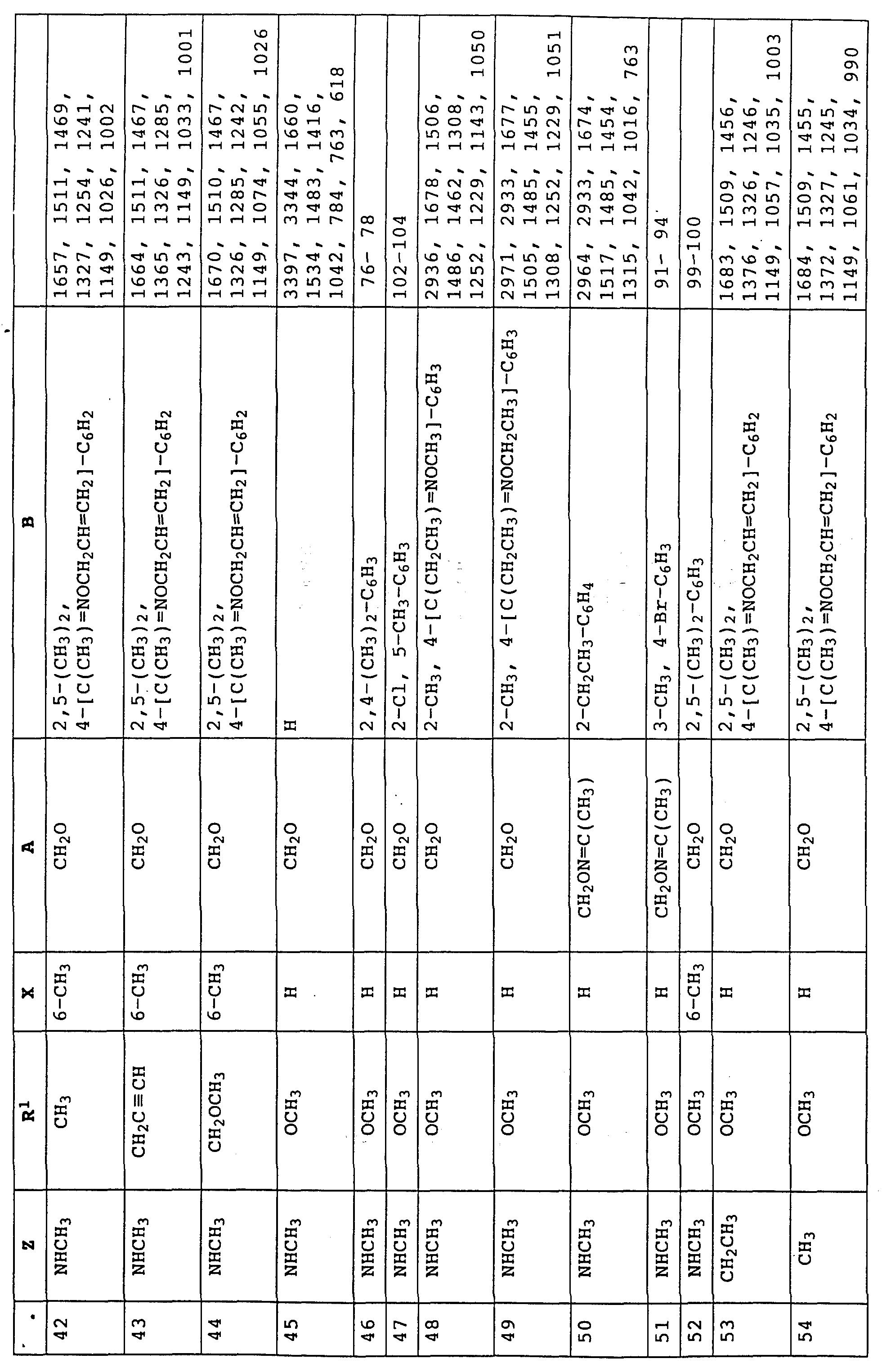
Аналогичным образом могут быть получены соединения, представленные в табл. 1-7 (см. в конце описания).
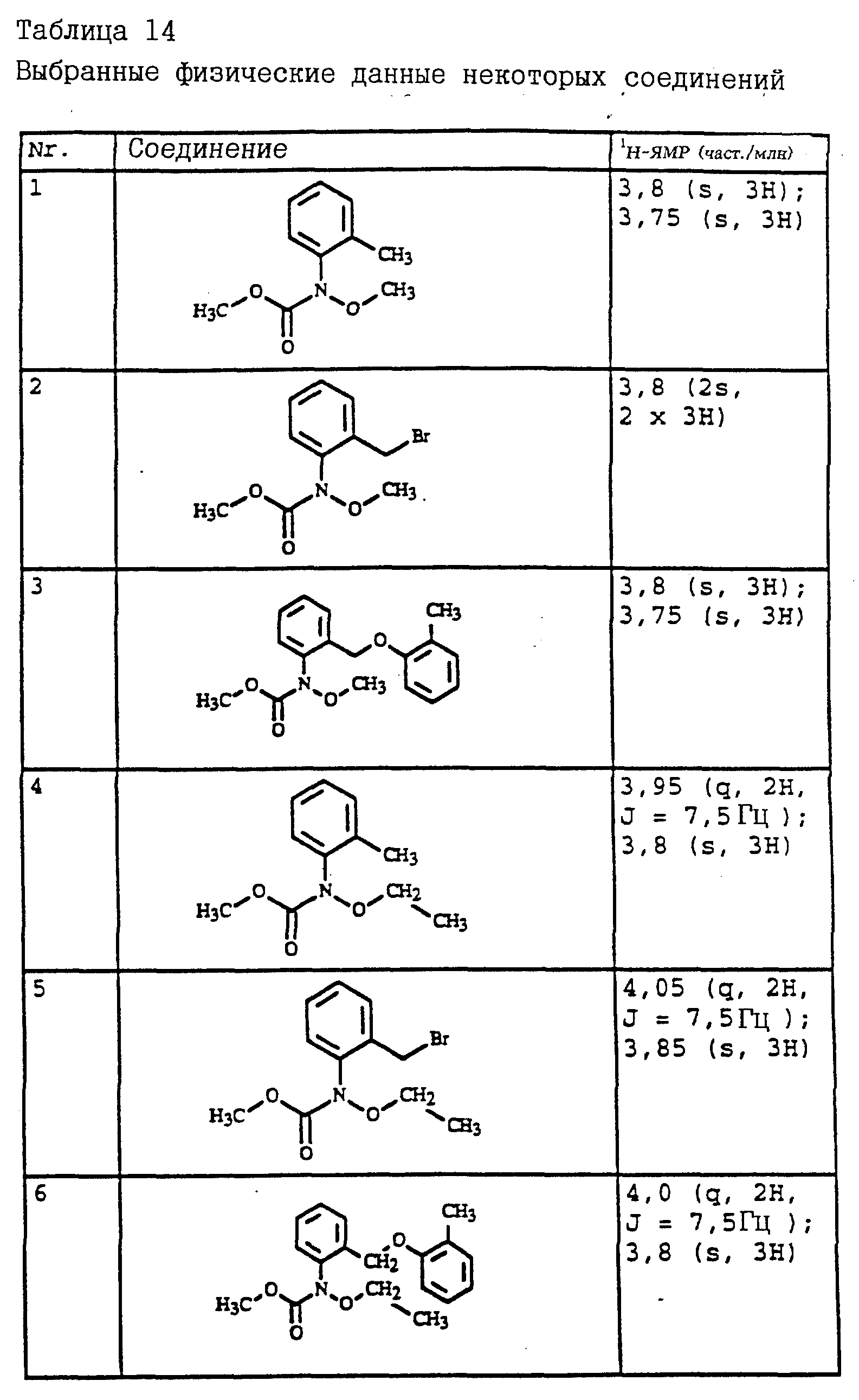
Пример 4. Метиловый эфир N-(2-мeтилфeнил)-N- мeтoкcикapбaминoвoй кислоты (таблица 14, N 1).
а) Метиловый эфир N-(2-метилфенил)-N-гидроксикарбаминовой кислоты, 16,4 г N-(2-метилфенил)-гидроксиламина (сырой продукт, получаемый согласно Bamberger et al., Ann. Chem. 316 (1901), 278) и 12,9 г (0,163 моля) пиридина в 100 мл хлористого метилена обрабатывают при 25-30oC по каплям 14,0 г (0,148 моля) метилового эфира хлоругольной кислоты. Затем в течение ночи перемешивают при комнатной температуре (20oC), после чего реакционную смесь экстрагируют с помощью разбавленной соляной кислоты и воды. Органическую фазу сушат над MgSO4 и концентрируют. Остаток очищают посредством колоночной хроматографии с помощью смеси гексана/уксусного эфира. Таким путем получают 7 г (39 ммолей) указанного в заголовке соединения в виде желтого масла.
1
H-ЯМР (CDCl3; δ в част./млн):
8,6 (s, шир., OH); 7,3 (m, 4H, фенил); 3,75 (s, 3H, OCH3); 2,3 (s, 3H, CH3).
б) Метиловый эфир N-(2-метилфенил)-N-метоксикарбаминовой кислоты (таблица 14, N 1).
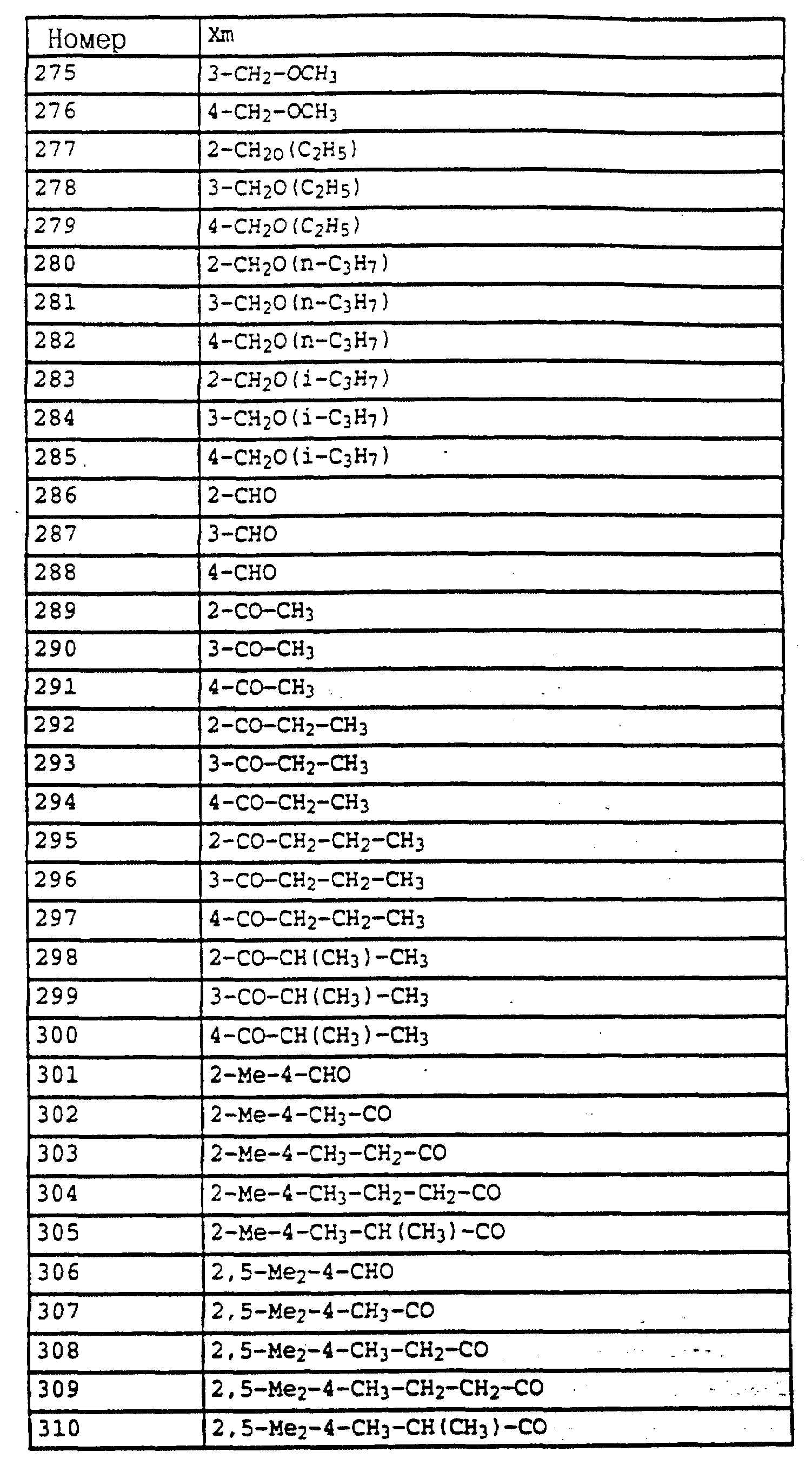
6,6 г (36,5 ммолей) гидроксильного соединения из примера 4а в 50 мл диметилформамида при 20-30oC порциями обрабатывают 1,1 г (44,1 ммолей) гидрида натрия. После закончившегося газообразования добавляют 5,7 г (40,1 ммолей) йодистого метила и перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь разбавляют водой и водную фазу трижды экстрагируют с помощью метил-трет-бутилового эфира. Соединенные органические фазы сушат над MgSO4 и концентрируют. Остаток очищают посредством колоночной хроматографии с помощью смеси гексана/уксусного эфира. В результате получают 5,2 г (27 ммолей= 73%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (CDCl3; δ в част./млн):
7,25 (m, 4H, фенил); 3,8; 3,75 (s, 3H, OCH3); 3,75 (s, 3H, OCH3); 2,3 (s, 3H, CH3).
Пример 5. Метиловый эфир N-(2-бромметилфенил)-N- метоксикарбаминовой кислоты (таблица 14, N 2).
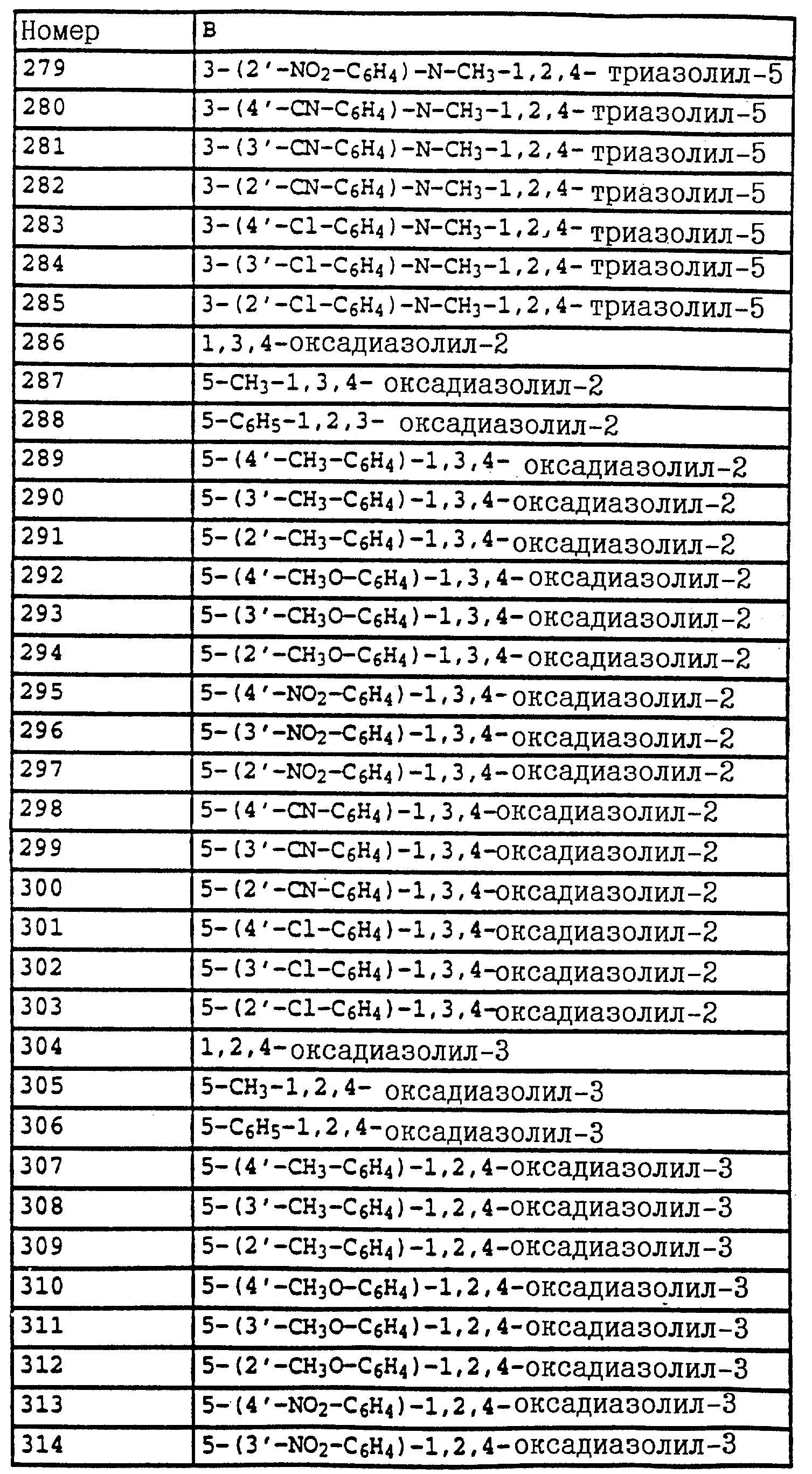
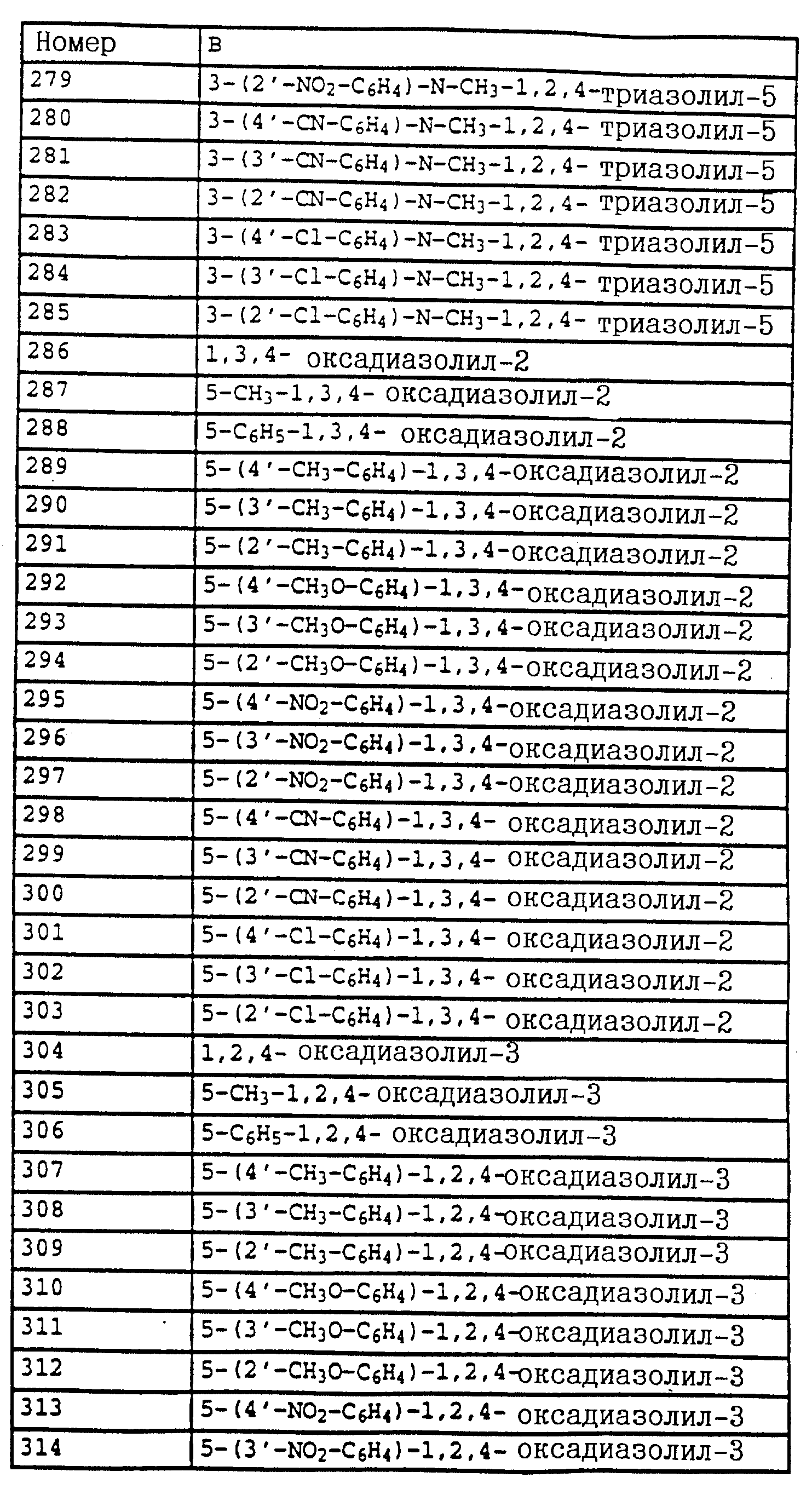
2,5 г (12,8 ммолей) N-метоксикарбамата из примера 4б, 2,5 г (14,1 ммолей) N-бромсукцинимида и 1 г (на кончике шпателя) азоизобутиродинитрила в 20 мл четыреххлористого углерода облучают УФ-лампой мощностью 300 Вт, причем реакционная смесь нагревается до 30-40oC. Через три часа реакционную смесь экстрагируют дважды с помощью воды. Органическую фазу сушат над MgSO4 и концентрируют. Остаток очищают посредством колоночной хроматографии с помощью смеси гексана/уксусного эфира. В результате получают 1,4 г (5,1 ммолей = 40%) указанного в заголовке соединения в виде желтого масла.
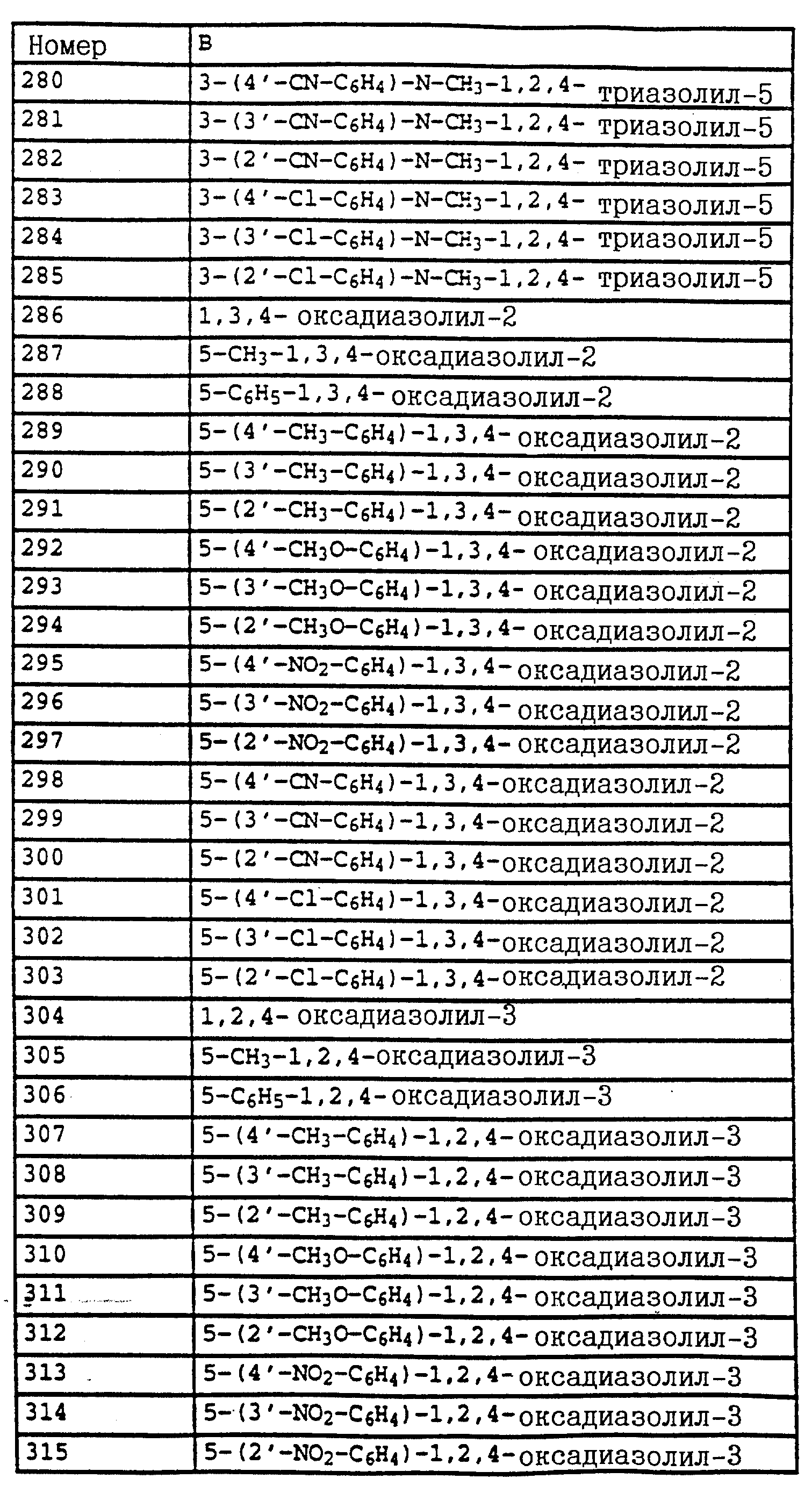
1H-ЯМР (CDCl3; δ в
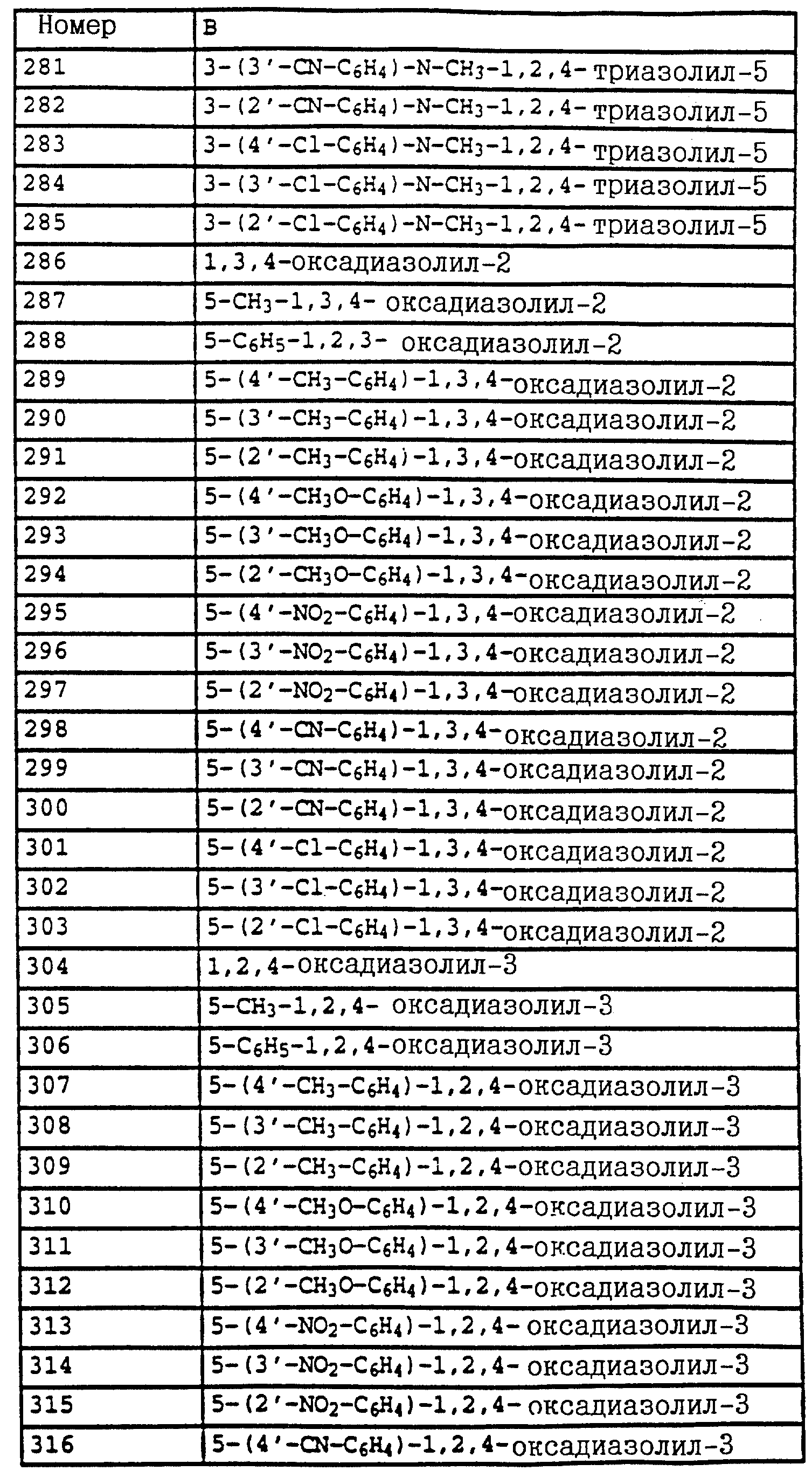
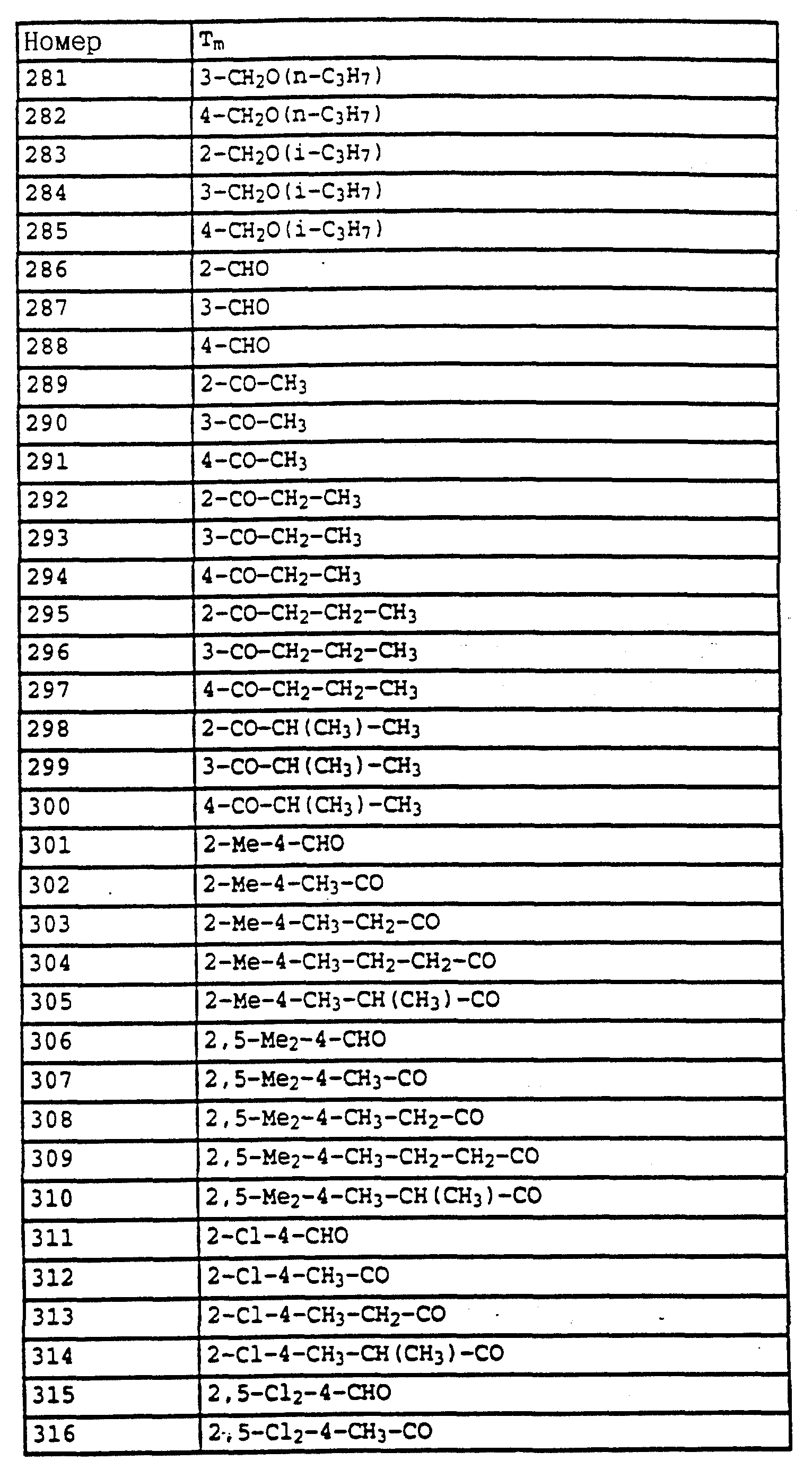
част./млн):
7,5 (m, 1H, фенил); 7,35 (m, 3H, фенил); 4,55 (s, 2H, CH2-Br); 3,8 (2, 6H, 2 х OCH3).
Пример 6. Метиловый эфир N-[2-(2'-метилфеноксиметил)-фенил]-N- метоксикарбаминовой кислоты (таблица 14, N 3).
1,2 г (4,4 ммоля) бромистого метила из примера 5, 0,45 г (4,2 ммоля) о-крезола и 0,7 г (4,8 ммоля) K2CO3 в 30 мл диметилформамида перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь разбавляют водой и водную фазу трижды экстрагируют с помощью метил-трет.- бутилового эфира. Соединенные органические фазы сушат над MgSO4 и концентрируют. Остаток очищают посредством колоночной хроматографии с помощью смеси гексана/уксусного эфира. В результате получают 1,2 г указанного в заголовке соединения с примесями о-крезола. Смесь нагревают приблизительно в течение 1 ч в печи с трубкой с шаровым расширением при давлении примерно 1 мбар до 125oC. В качестве остатка получают 0,9 г (3 ммоля = 68%) указанного в заголовке соединения в виде желтого масла.
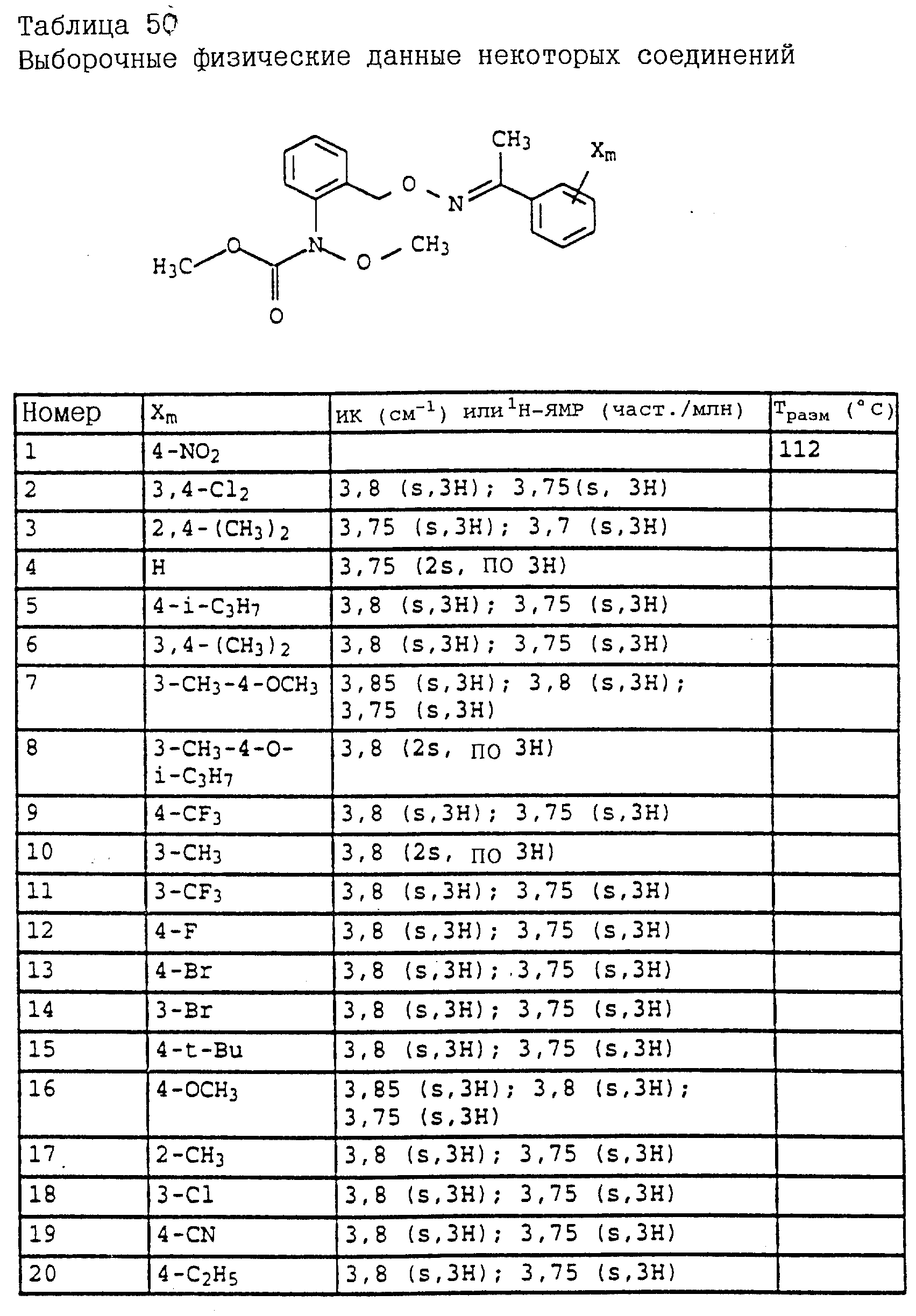
1H-ЯМР(CDCl3; δ в част./млн): 7, 7 (m, 1H, фенил); 7,4 (m, 3H, фенил); 7,15 (m, 2H, фенил); 6,9 (t, шир., 2H, фенил); 5,15 (s, 2H, O-CH2); 3,8 (s, 3H, OCH3); 3,75 (s, 3H, OCH3); 2,3 (s, 3H, CH3) (см. табл. 8-17, 55 в конце описания).
O-метил-N-(2-метилфенил)-N-пропионилгидроксиламин (таблица 21, N 1).
a) N-(2-метилфенил)-N-пропионилгидроксиламин.
30 г N-(2-метилфенил)-гидроксиламина (сырой продукт, получаемый согласно Bamberger et al., Ann. Chem. 316 (1901), 278; содержание приблизительно 80% = 0,2 моля) в 500 мл хлористого метилена при 25-30oC по каплям обрабатывают последовательно 12,5 г (0,135 моля) хлорида пропионовой кислоты и 10,7 г (0,135 моля) пиридина. Затем перемешивают в течение 30 мин при комнатной температуре, после чего реакционную смесь экстрагируют с помощью разбавленной соляной кислоты и воды. Органическую фазу сушат над MgSO4 и концентрируют. Остаток очищают посредством колоночной хроматографии с помощью смеси циклогексана/уксусного эфира. В результате получают 22,7 г (0,127 моля = 63%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (CDCl3; δ в част./млн):
9,4 (s, шир. , 1H, OH); 7,2 (m, 4H, фенил); 2,4 (s, 3H, CH3); 2,1 (q, шир., 2H, CH2); 1,1 (t, 3H, J = 7 Гц, CH3).
б) O-метил-N-(2-метилфенил)-N-пропионилгидроксиламин (таблица 21, N 1)
В перемешанный раствор из 3,4 г (0,14 моля) NaH в 150 мл диметилформамида при 25-30oC по каплям добавляют раствор из 22,7 г (0,127 моля) N-(2-метилфенил)-N-пропионилгидроксиламина (пример 6а) в 50 мл диметилформамида. После окончания газообразования (15 мин) по каплям
добавляют 18,4 г (0,13 моля) йодистого метила и перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь разбавляют водой и водную фазу экстрагируют трижды с помощью
метил-трет.-бутилового эфира. Соединенные органические фазы экстрагируют водой, сушат над MgSO4 и концентрируют. Остаток очищают посредством хроматографии на колонке с помощью смеси
циклогексана/уксусного эфира. Таким путем получают 18 г (0,081 моля = 64%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (CDCl3; δ в
част./млн):
7,2 (m, 4H, фенил); 3,7 (s, шир., 3H, OCH3); 2,6 (s, очень шир., 2H, CH2); 2,3 (s, 3H, CH3); 1,2 (s, шир., 3H, CH3).
Пример 7. O-Метил-N-(2-бромметилфенил)-N-пропионилгидроксиламин (таблица 21, N 2).
Смесь из 10 г (51,8 ммоля) гидроксиламинопроизводного из примера 1, 11 г (61 ммоль) N-бромсукцинимида и 0,1 г азоизобутиродинитрила в 100 мл CCl4 нагревают с обратным холодильником. Затем добавляют одну каплю брома и продолжают нагревать дальше в течение 2,5 ч. Затем реакционную смесь охлаждают до комнатной температуры, промывают водой, сушат над MgSO4 и концентрируют. Остаток очищают посредством хроматографии на колонке с помощью смеси циклогексана/уксусного эфира. В результате такой последовательной обработки получают 3,4 г (7,9 ммоля = 15%) O-метил-N-(2-бромметилфенил)-N- -(α,α- дибромпропионил)-гидроксиламина, 3,8 г (10,8 ммоля = 21%) O-метил-N-(2-бромметилфенил)-N-( α -бромпропионил)-гидроксиламина, 2,3 г (8,5 ммолей= 16%) соединения, указанного в заголовке, и 3,5 г исходного материала, все продукты соответственно в виде масел коричневого цвета.
а) O-Метил-N-(2-бромметилфенил)-N -(α,α- дибромпропионил)- гидроксиламин.
7,55 (m, 1H, фенил); 7,4 (m, 3H, фенил); 4,5 (s, 2H, CH2-Br); 3,8 (s, 3H, OCH3); 2,75 (s, 3H, CH3).
б) O-Метил-N-(2-бромметилфенил)-N -(α- бромпропионил)- гидроксиламин.
7,5 (s, шир., 1H, фенил); 7,4 (s, шир., 3H, фенил); 5,15 (s, шир., 1H, CH-Br): 4,5 (dd, шир., 2H, CH2-Br); 3,8 (s, 3H, OCH3); 1,85 (s, шир., 3H, CH3).
в) O-Метил-N-(2-бромметилфенил)-N-пропионил-гидроксиламин.
7,5 (m, 1H, фенил); 7,35 (m, 3H, фенил); 4,5 (s, шир., 2H, CH2-Br); 3,75 (s, 3H, OCH3); 2, 55 (s, очень шир., CH2); 1,2 (t, 3H, J = 7 Гц, CH3).
Пример 8. O-Метил-N-(2-(2'-метилфенилоксиметил)-фенил)-N- пропионилгидроксиламин (таблица 21, N 3).
Раствор из 0,4 г (3,7 ммоля) о-крезола в 5 мл диметилформамида обрабатывают 0,12 г (5 ммолей) гидрида натрия. Когда газообразование заканчивается, добавляют 1 г (3,6 ммоля) бензилбромида из примера 2в и перемешивают в течение 2 ч при комнатной температуре. Затем реакционную смесь разбавляют водой и трижды экстрагируют с помощью метил-трет.-бутилового эфира. Соединенные органические фазы промывают водой, сушат над MgSO4 и концентрируют. Остаток хроматографируют с помощью смеси циклогексана/уксусного эфира один раз на Al2O3 и один раз на силикагеле. В результате получают 0,4 г (1,33 ммоля = 37%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (CDCl3; δ в част./млн):
7,7 (d, шир.,
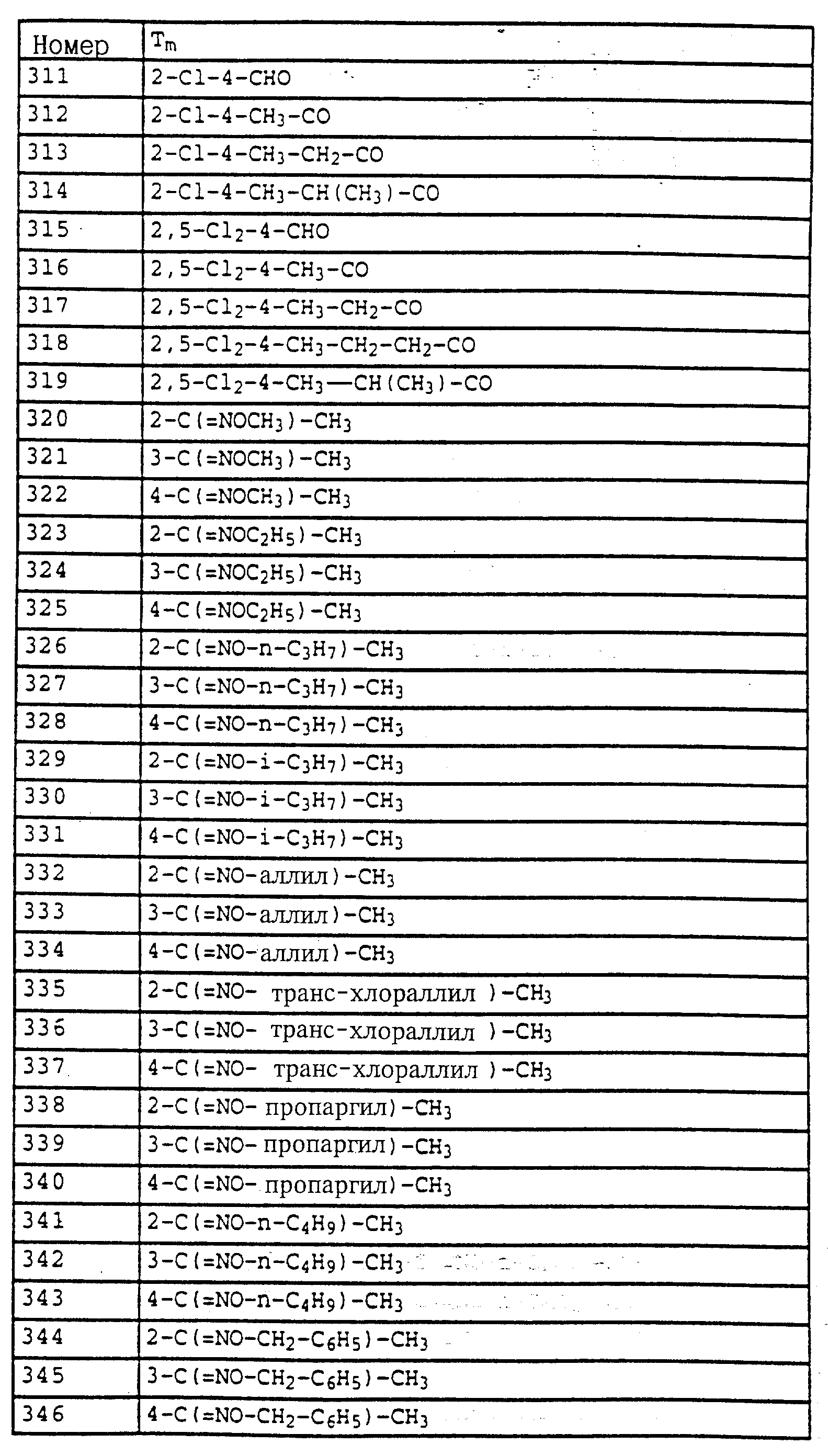
1H, фенил); 7,35 (m, 3H, фенил); 7,1 (m, 2H, фенил); 6,85 (t, шир., 2H, фенил); 5,05 (s, 2H, OCH3); 3,7 (s, 3H, OCH3); 2,55 (s, очень шир., 2H, CH2); 2,3 (s, 3H,
CH3); 1,2 (t, шир., 3H, CH3).
Пример 9. N-Метил-N'-метокси-N'-2-метилфенилмочевина (таблица 21, N 5).
a) Фениловый эфир N-гидрокси-N-(2-метилфенил)-карбаминовой кислоты.
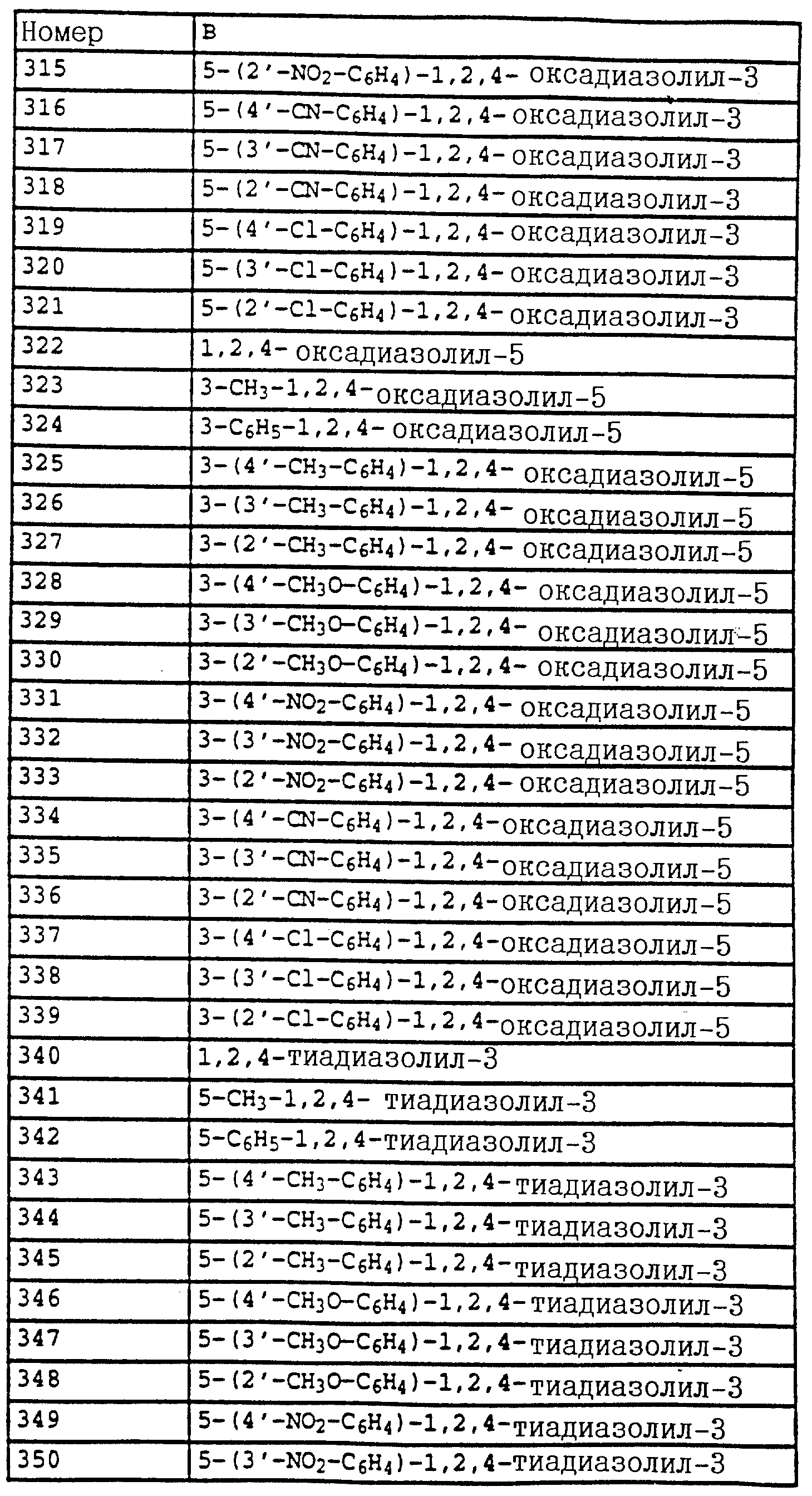
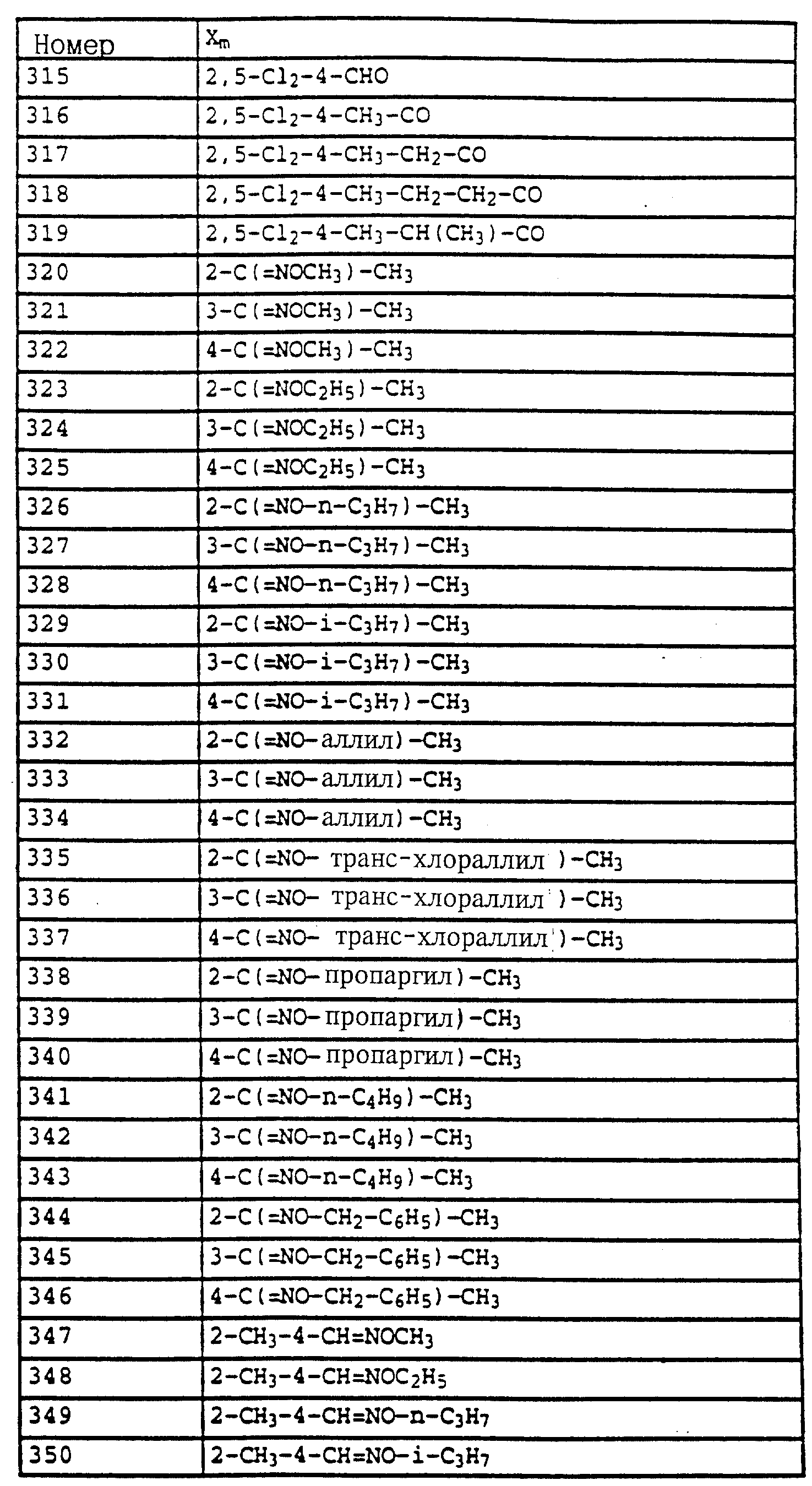
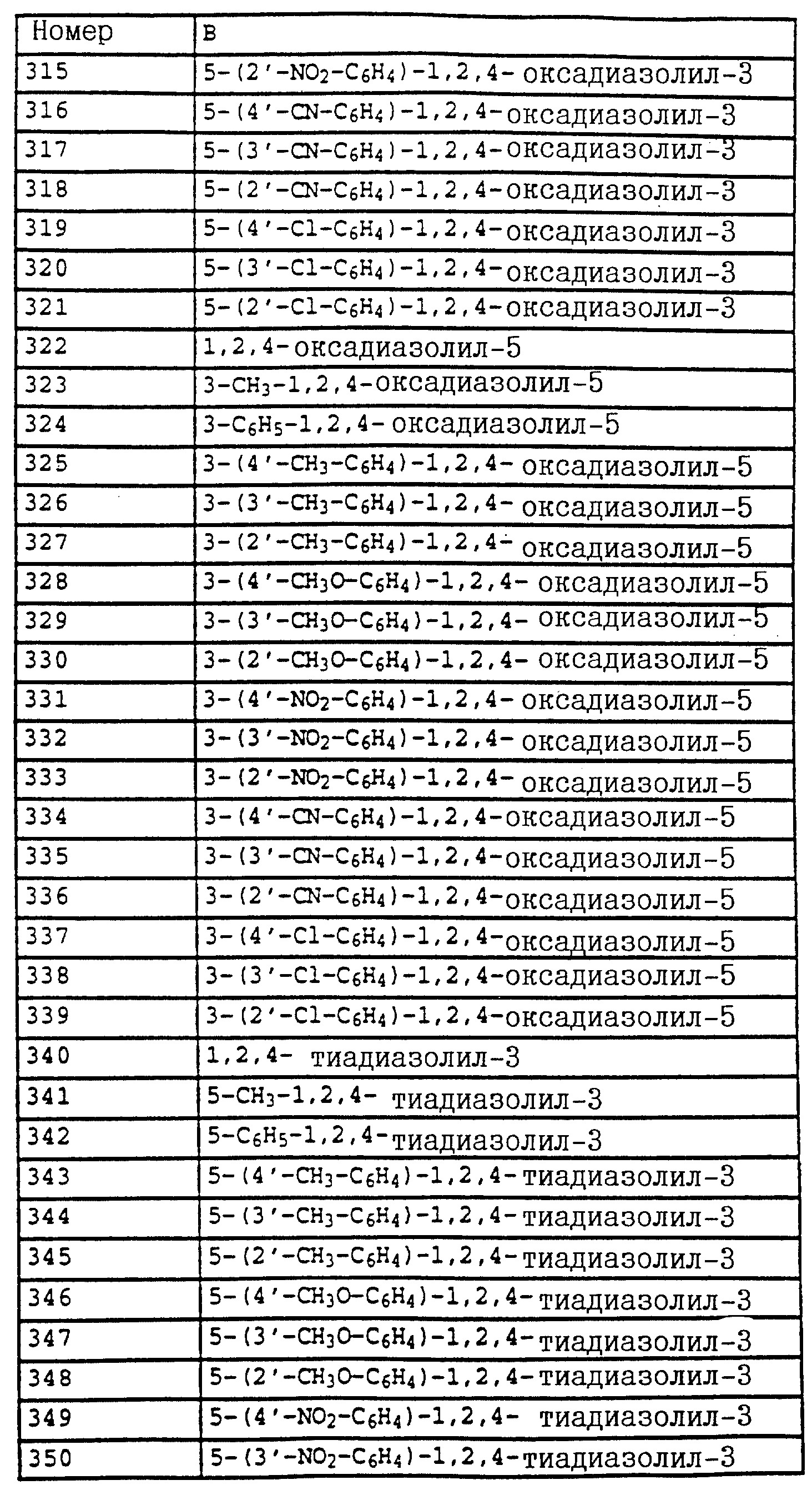
Смесь из 2,5 г (20 ммолей) N-(2-метилфенил)-гидроксиламина (сырой продукт, получаемый согласно Bamberger et al., Ann. Chem. 316 (1901), 278), 3,5 г (25 ммолей) K2CO3 и 3,5 г (22 ммоля) фенилхлорформиата в 20 мл CH2Cl3 перемешивают в течение 2 ч при комнатной температуре. Затем реакционную смесь экстрагируют с помощью воды, сушат над MgSO4 и концентрируют. Остаток очищают посредством хроматографии на колонке с помощью смеси циклогексана/уксусного эфира. В результате получают 2,0 г (8,2 ммоля = 42%) указанного в заголовке соединения в виде бесцветного твердого вещества (Tраз=98oC).
1H-ЯМР (CDCl3
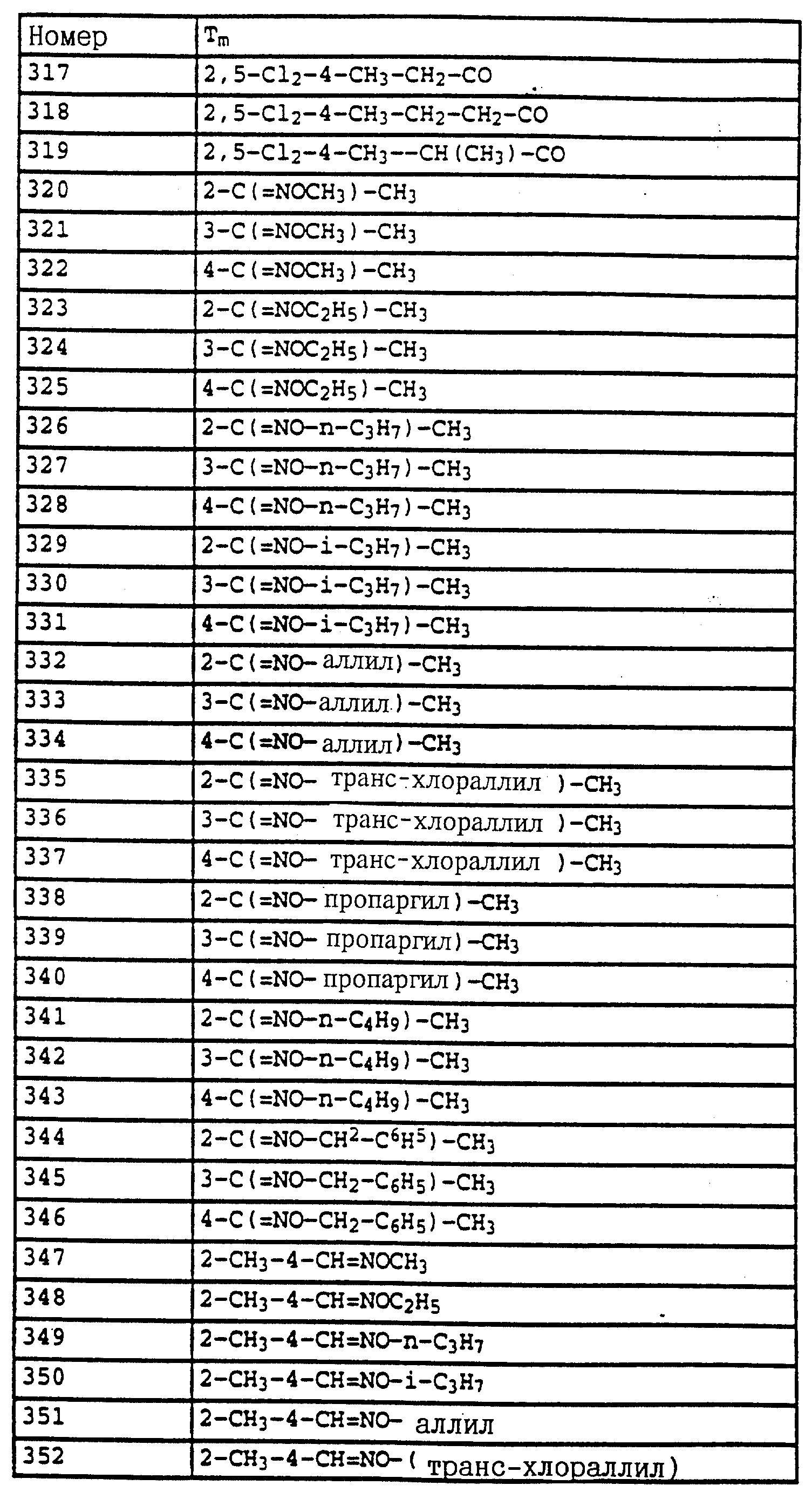
; δ в част./млн):
7-7,6 (m, 10H, фенил, OH); 2,35 (s, 3H, CH3).
б) Фениловый эфир N-метокси-N-(2-метилфенил)-карбаминовой кислоты.
Смесь из 2,0 г (8,2 ммоля) фенилового эфира карбаминовой кислоты из примера 4а, 2 г (15 ммолей) K2CO3 и 1,3 г (10 ммолей) диметилсульфата в 20 мл ацетона перемешивают в течение 3 ч при комнатной температуре. Затем реакционную смесь фильтруют, концентрируют и остаток очищают посредством r хроматографии на колонке с помощью смеси циклогексана/уксусного эфира. В результате получают 1,5 г (5,8 ммолей = 71%) указанного в заголовке соединения в виде бесцветного масла, которое медленно кристаллизуется (Тразм=60oC).
1H-ЯМР (CDCl3
; δ в част./млн):
7,1-7,5 (m, 9H, фенил); 3,8 (s, 3H, OCH3); 2,4 (s, 3H, CH3).
в) N-Метил-N'-метокси-N'-2-метилфенилмочевина (таблица 21, N 5).
1,5 г (5,8 ммолей) фенилового эфира карбаминовой кислоты из примера 4б в 20 мл 40%-ного водного раствора метиламина перемешивают в течение 1 ч при 50oC. Затем реакционную смесь охлаждают и экстрагируют с помощью CH2Cl2. Соединенные органические фазы сушат над MgSO4 и концентрируют. Остаток очищают посредством колоночной хроматографии с помощью смеси циклогексана/уксусного эфира. В результате получают 0,6 г (3,1 ммоля=53%) указанного в заголовке соединения в виде бесцветного твердого вещества (Tразм=99oC).
1H-ЯМР (CDCl3; δ в част./млн):
7,2 (m, 4H, фенил); 5,9 (s, шир., 1H, NH); 3,6 (s, 3H, OCH3); 2,9 (d, 3H, J = приблиз. 2 Гц,
N-CH3); 2,3 (s, 3H, CH3).
Пример 10. N-Метил-N'-метокси-N'-(2-(2', 5'- диметилфеноксиметил)-фенил)-мочевина.
a) Фениловый эфир N-метокси-N-(2-бромметилфенил)-карбаминовой кислоты.
Смесь из 125 г (0,486 моля) метилового эфира N-метокси-М-(2- метилфенил)-карбаминовой кислоты (пример 4б), 88 г (0,494 моля) N-бромсукцинимида и 1 г азоизобутиродинитрила (АИБН) в 800 мл CCl4 нагревают в течение приблизительно 12 ч с обратным холодильником. Затем дополнительно добавляют еще 10 г N-бромсукцинимида, после чего продолжают нагрев еще в течение 4 ч. Затем реакционную смесь экстрагируют с помощью воды и раствора тиосульфата натрия, органическую фазу сушат над MgSO4 и концентрируют в вакууме. После кристаллизации остатка этот последний тонко растирают и размешивают с гексаном/простым метил-трет.-бутиловым эфиром и просасывают до сухого состояния. В результате получают 107 г (63%) указанного в заголовке соединения в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3; δ в част./млн):
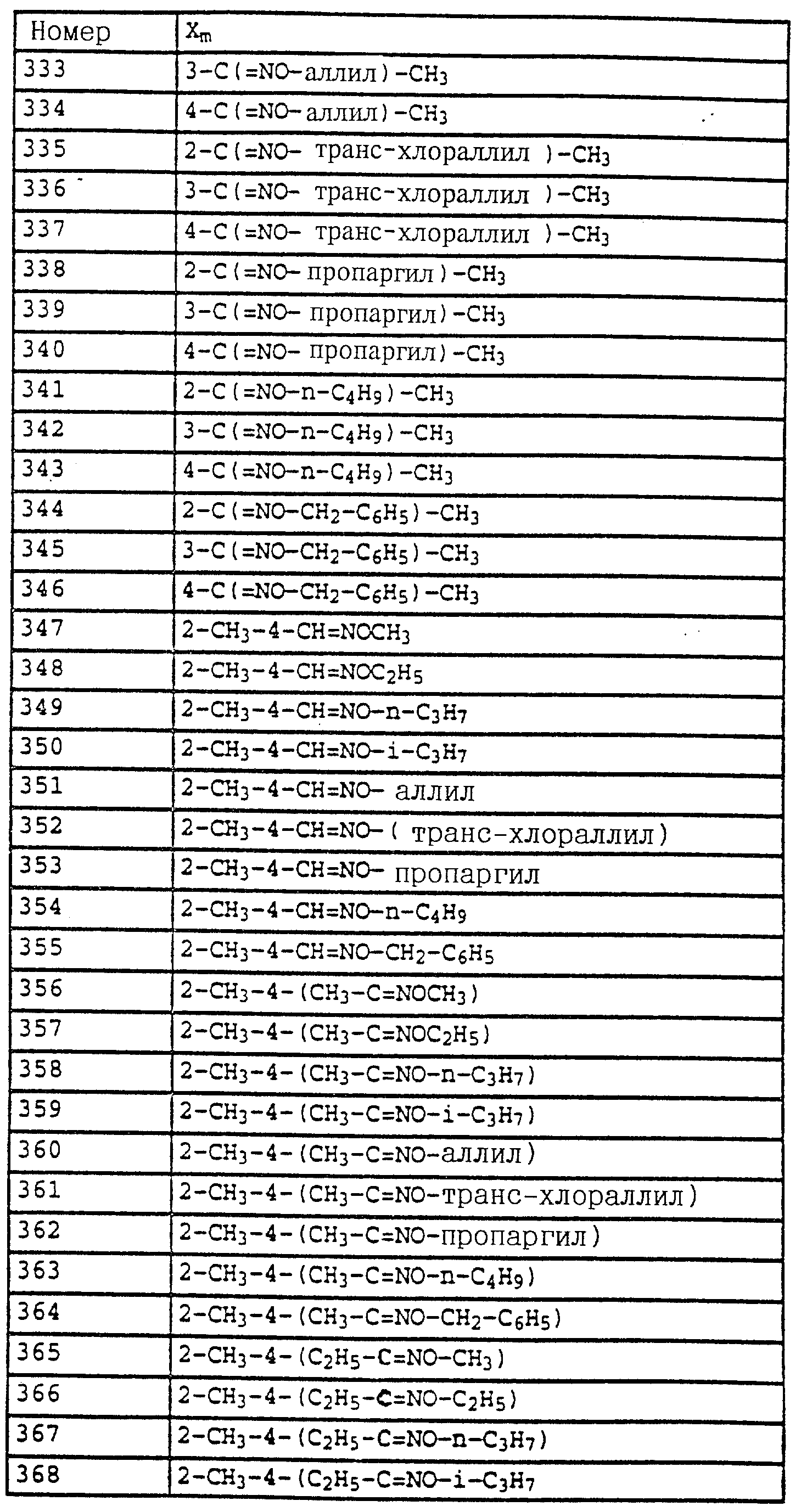
7,1-7,6 (m, 9H, фенил); 4,65 (s, 2H, CH2Br); 3,9 (s, 3H, OCH3).
б) Фениловый эфир N-метокси-N-(2-(2',5'-диметилфеноксиметил)- фенил)-карбаминовой кислоты.
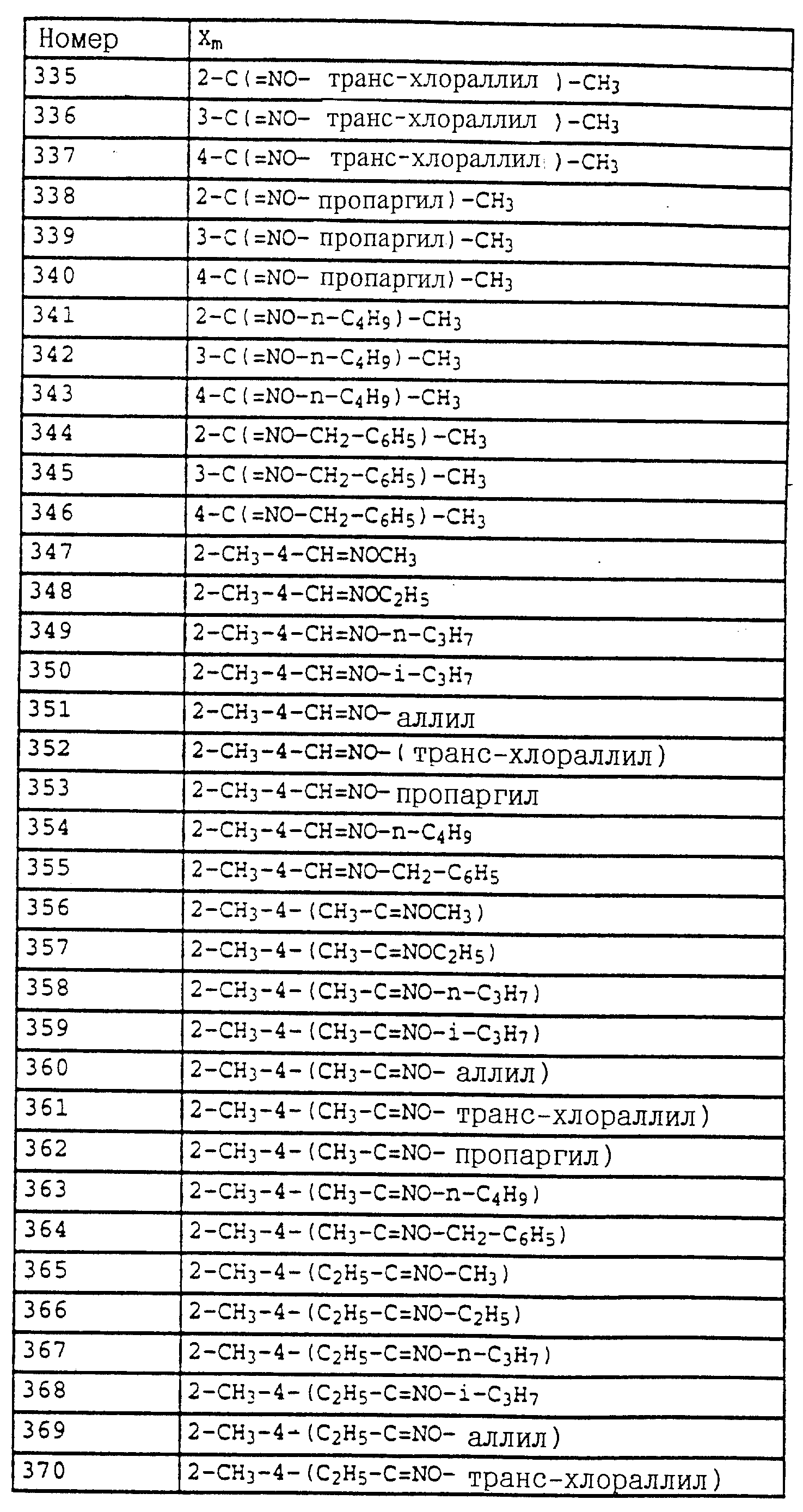
Смесь из 7 г (20 ммолей) бромида из примера 5а и 3,3 г (22 ммоля) йодистого натрия в 50 мл ацетона нагревают в течение 30 мин с обратным холодильником. Затем отфильтровывают выпавшее в осадок твердое вещество и концентрируют органическую фазу в вакууме. В качестве сырого продукта получают соответствующий примеру 5а йодид, который без последующей очистки используют в последующей реакции.
Полученный описанным выше способом сырой продукт растворяют в 100 мл диметилформамида, добавляют 3 г (21,6 ммоля) K2CO3 и 7,3 г (60 ммолей) 2,5-диметилфенола и перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь разбавляют водой и водную фазу экстрагируют трижды с помощью метил-трет. -бутилового эфира. Соединенные органические фазы экстрагируют с помощью воды, сушат над MgSO4 и концентрируют. Остаток очищают посредством колоночной хроматографии с помощью хлористого метилена/циклогексана 1:2 над Al2O3. В результате получают 7,3 г (94%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (CDCl3; δ в част./млн):
7,7 (d, шир., 1H, фенил); 7-7,6 (m, 9H, фенил);
6,7 (m, 2H, фенил); 5,2 (s, 2H, OCH2); 3,85 (s, 3H, OCH3); 2,3 (s, 6H, 2 x CH3).
в) N-Метил-N'-метокси-N'-(2-(2',5'-диметилфеноксиметил)- фенил) мочевина (таблица 1, N V.71).
Смесь из 3,4 г (8,8 ммолей) фенилового эфира карбаминовой кислоты из примера 5б и 20 мл 40%-ного водного раствора метиламина перемешивают в течение 2 ч при 50oC. Затем реакционную смесь охлаждают и экстрагируют с помощью хлористого метилена. Органическую фазу концентрируют и полученный остаток очищают посредством хроматографии на колонке с помощью смеси циклогексана-уксусного эфира. В результате получают 1 г (36%) указанного в заголовке соединения в виде бесцветного твердого вещества (Tразм=101oC).
1H-ЯМР (CDCl3; δ в част./млн):
7,75 (m, 1H, фенил); 6,6-7,4 (m, 6H, фенил); 6,0 (s, шир., NH); 5,15 (s, 2H, OCH2); 3,65 (s, 3H, OCH3); 2,9
(d, 3H, N-CH2); 2,3 (s, 3H, CH3); 2,25 (s, 3H, CH3).
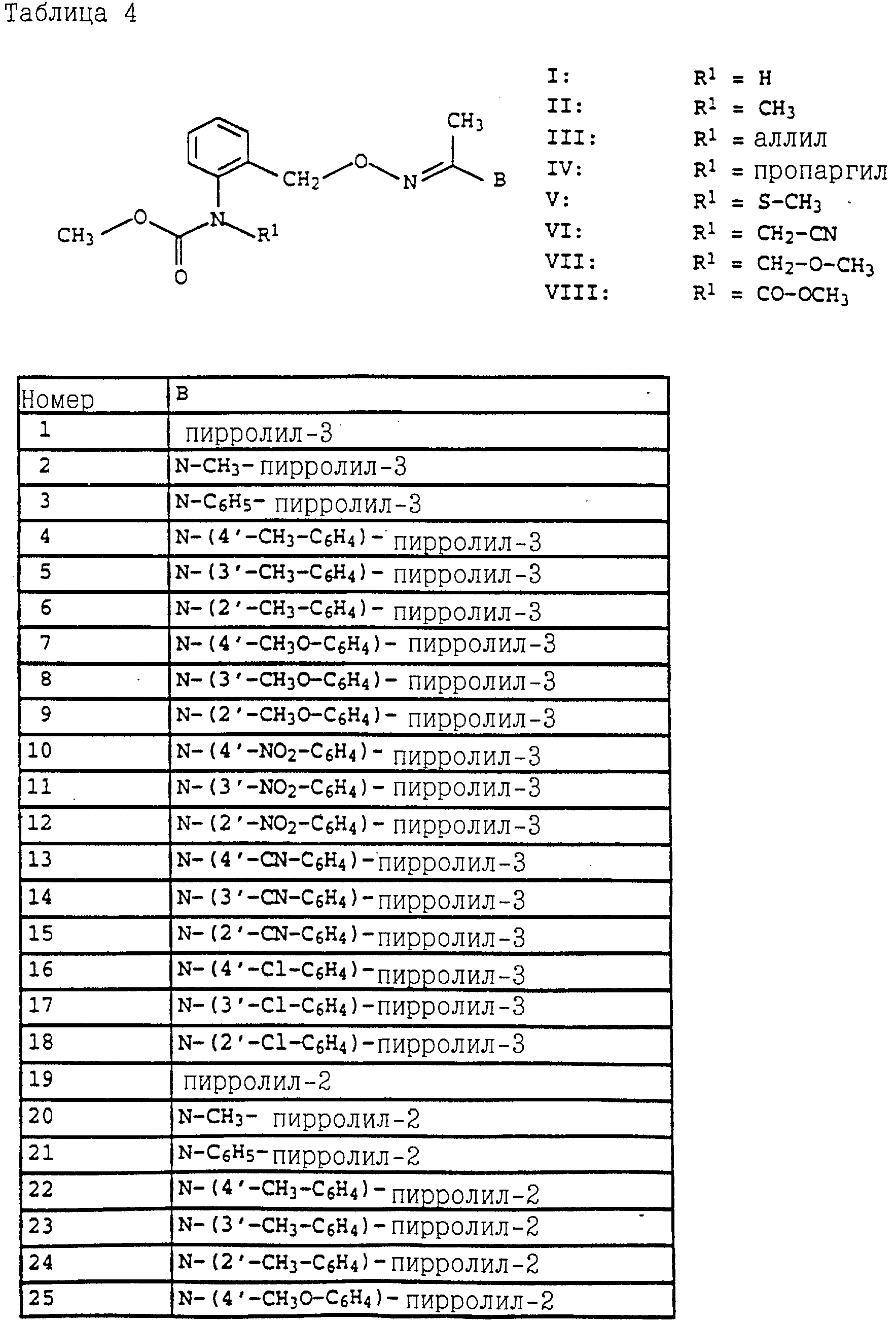
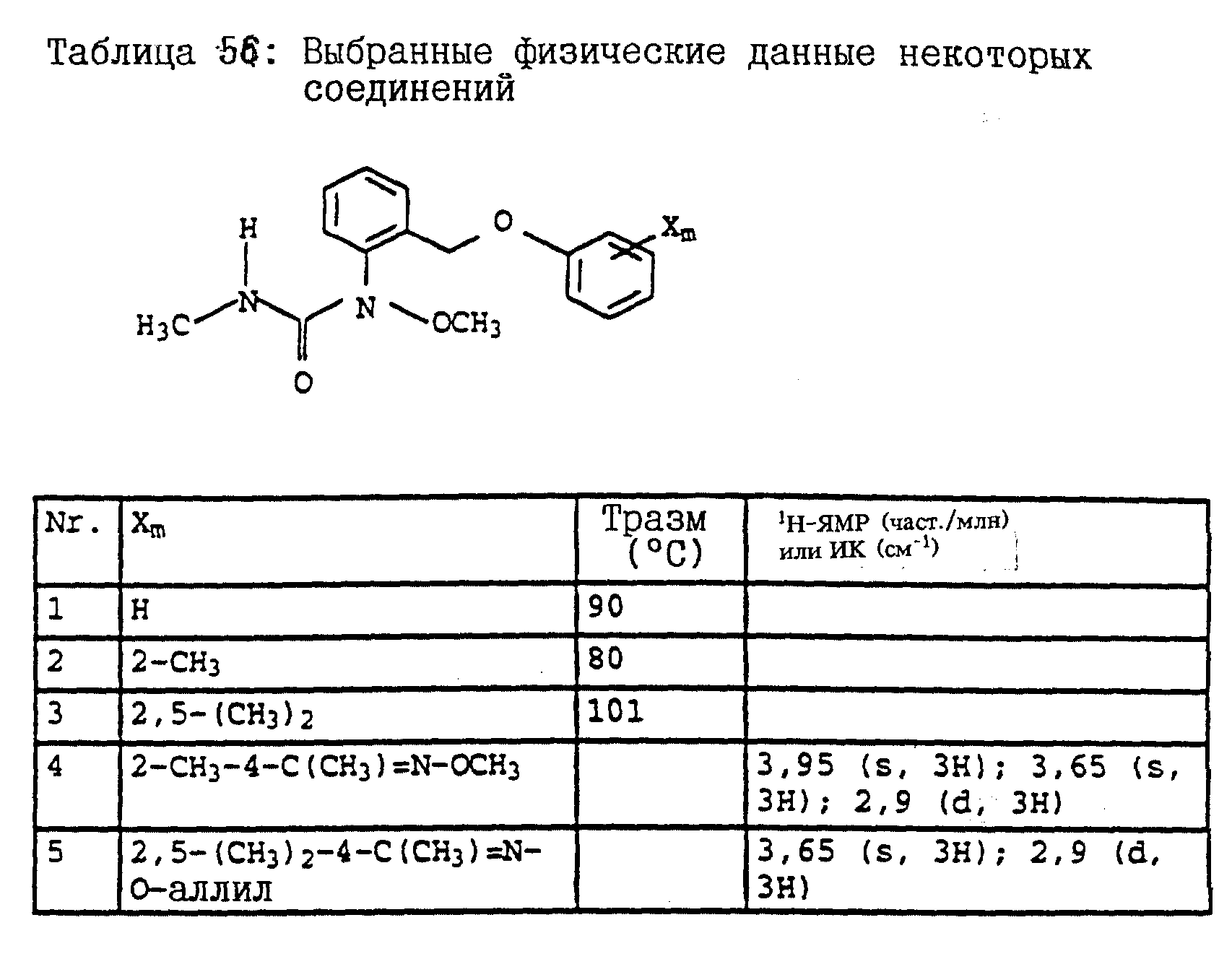
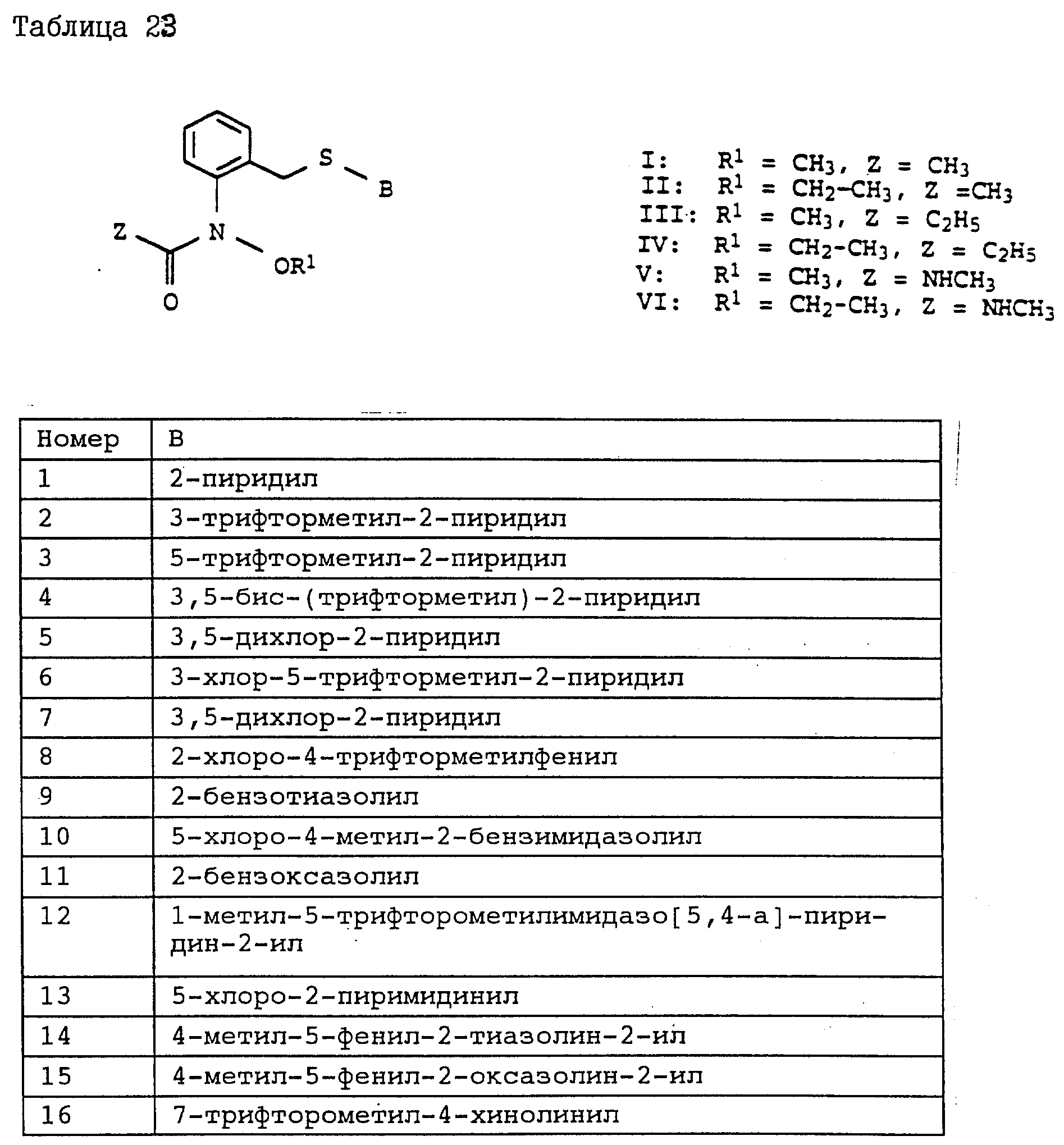
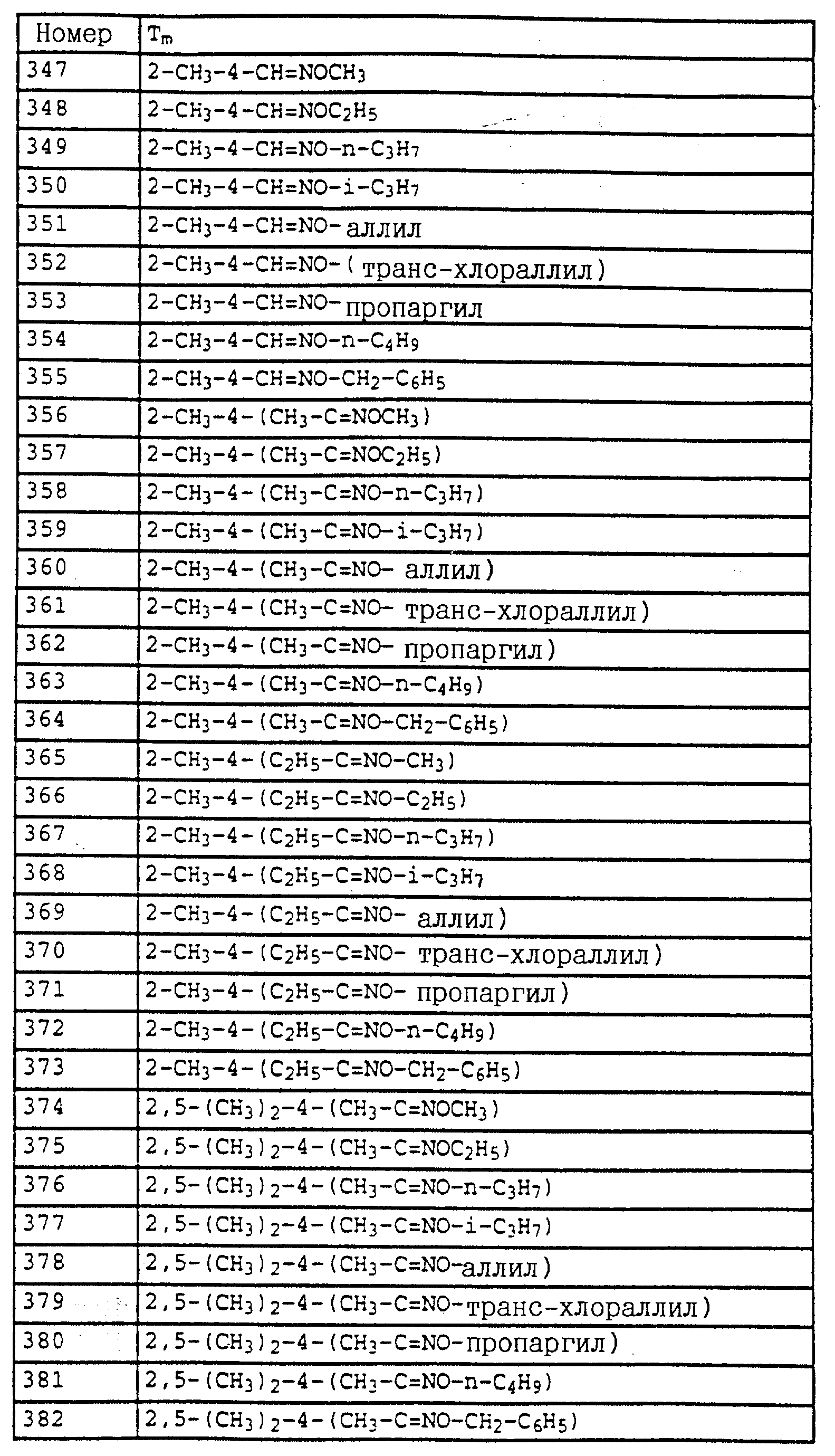
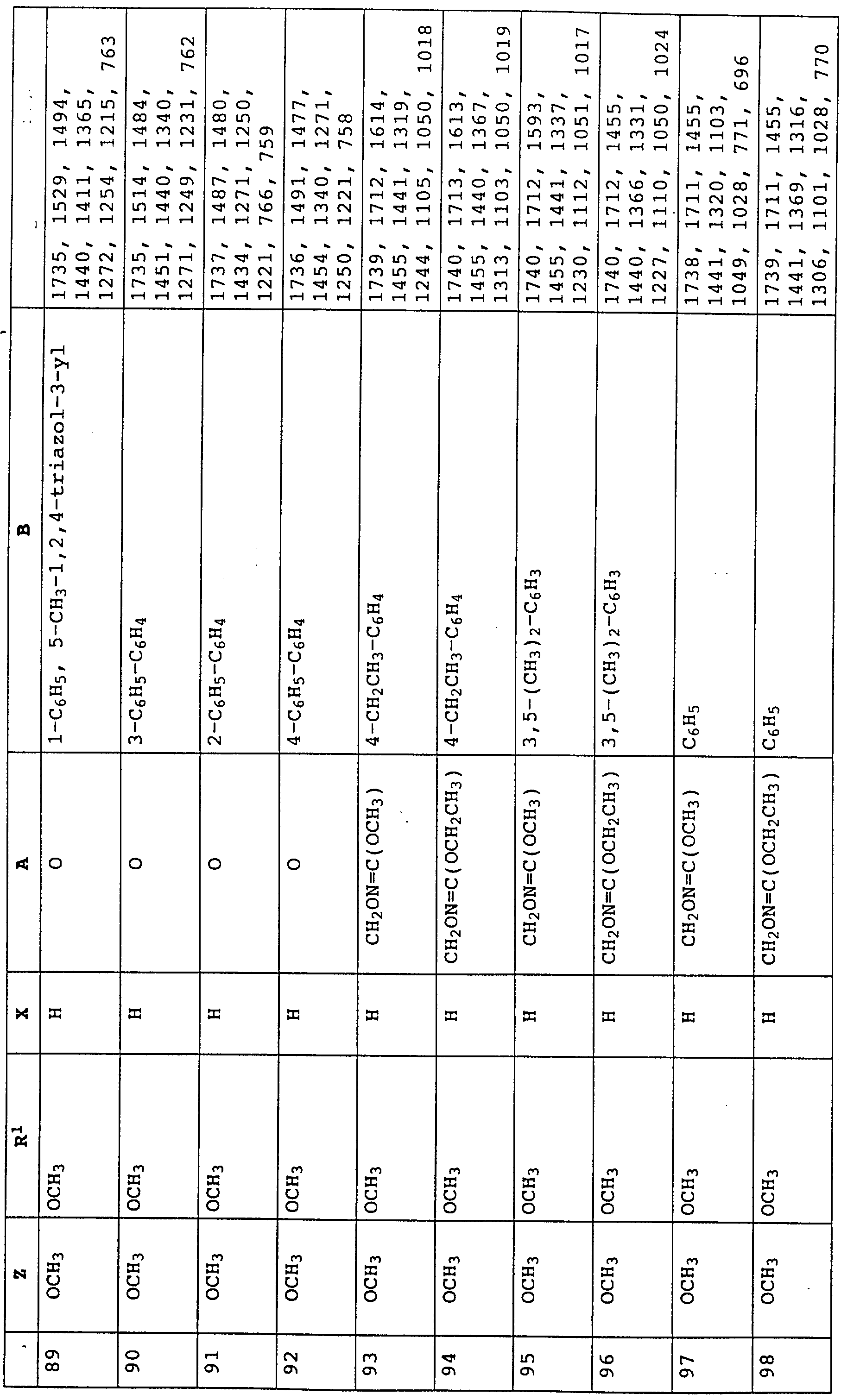
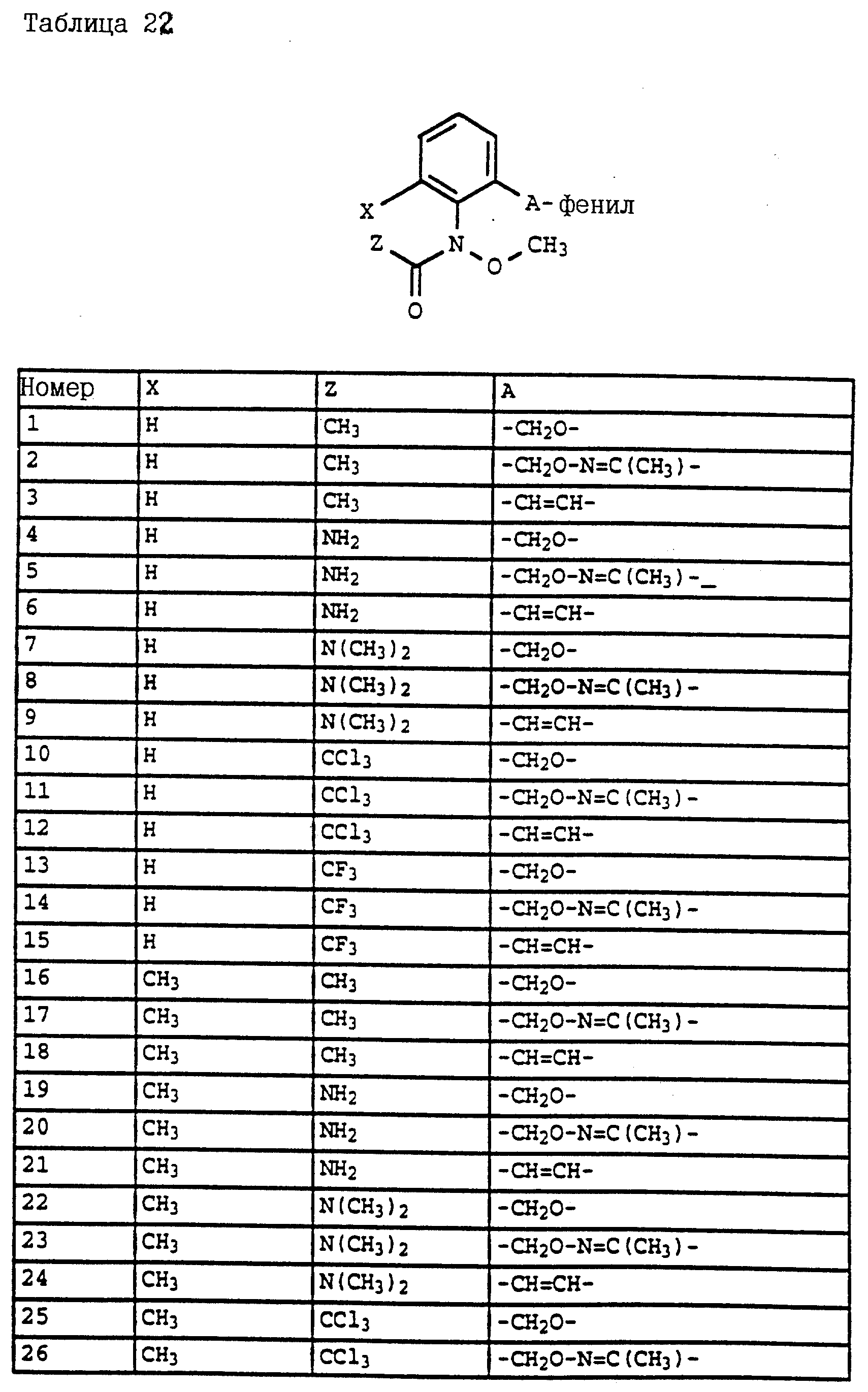
Аналогичным образом могут быть получены соединения, представленные в табл. 15-21, 56, 22, 23 (в
конце описания). Соединение I.1 из таблицы 15 имеет, например, следующую формулу:

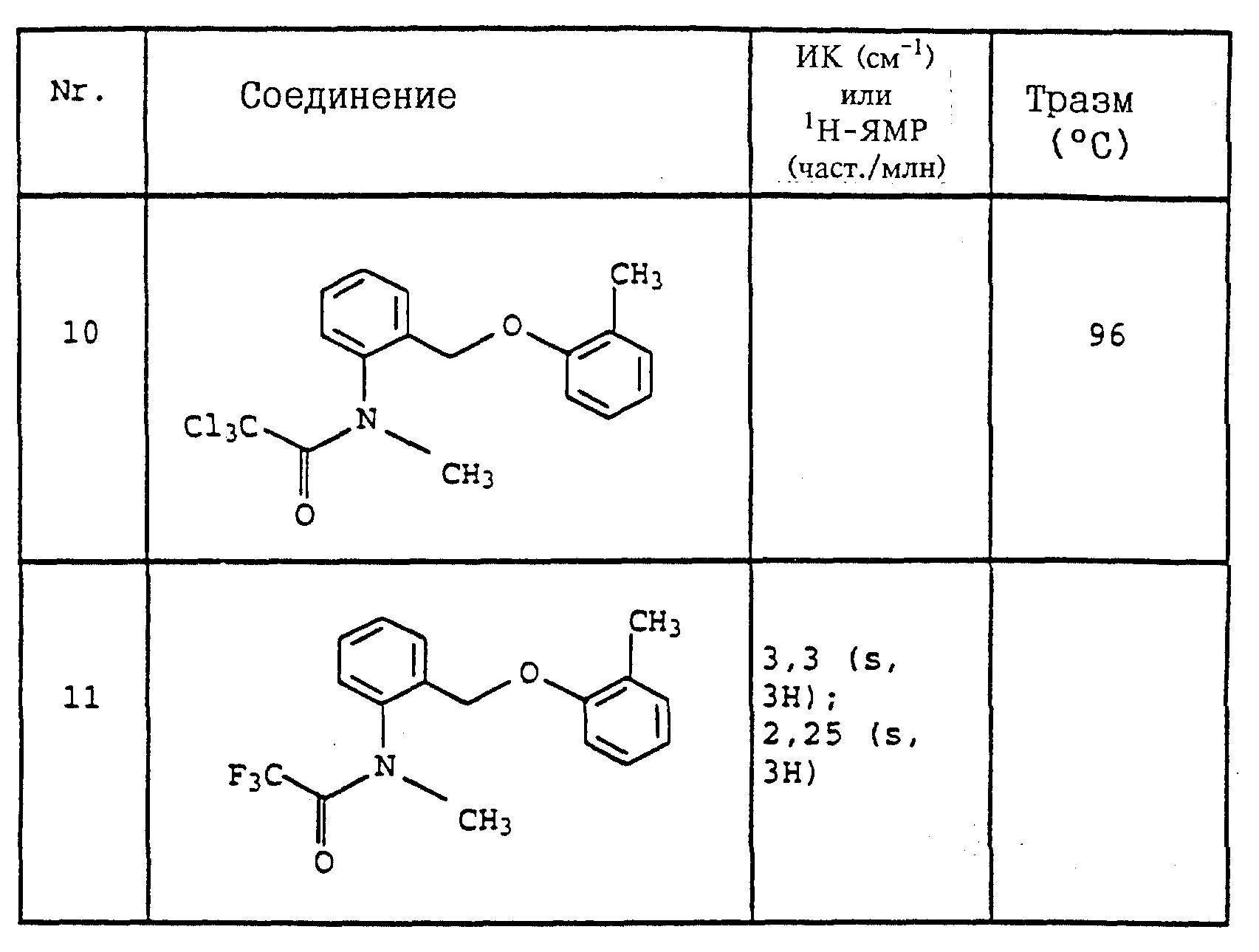
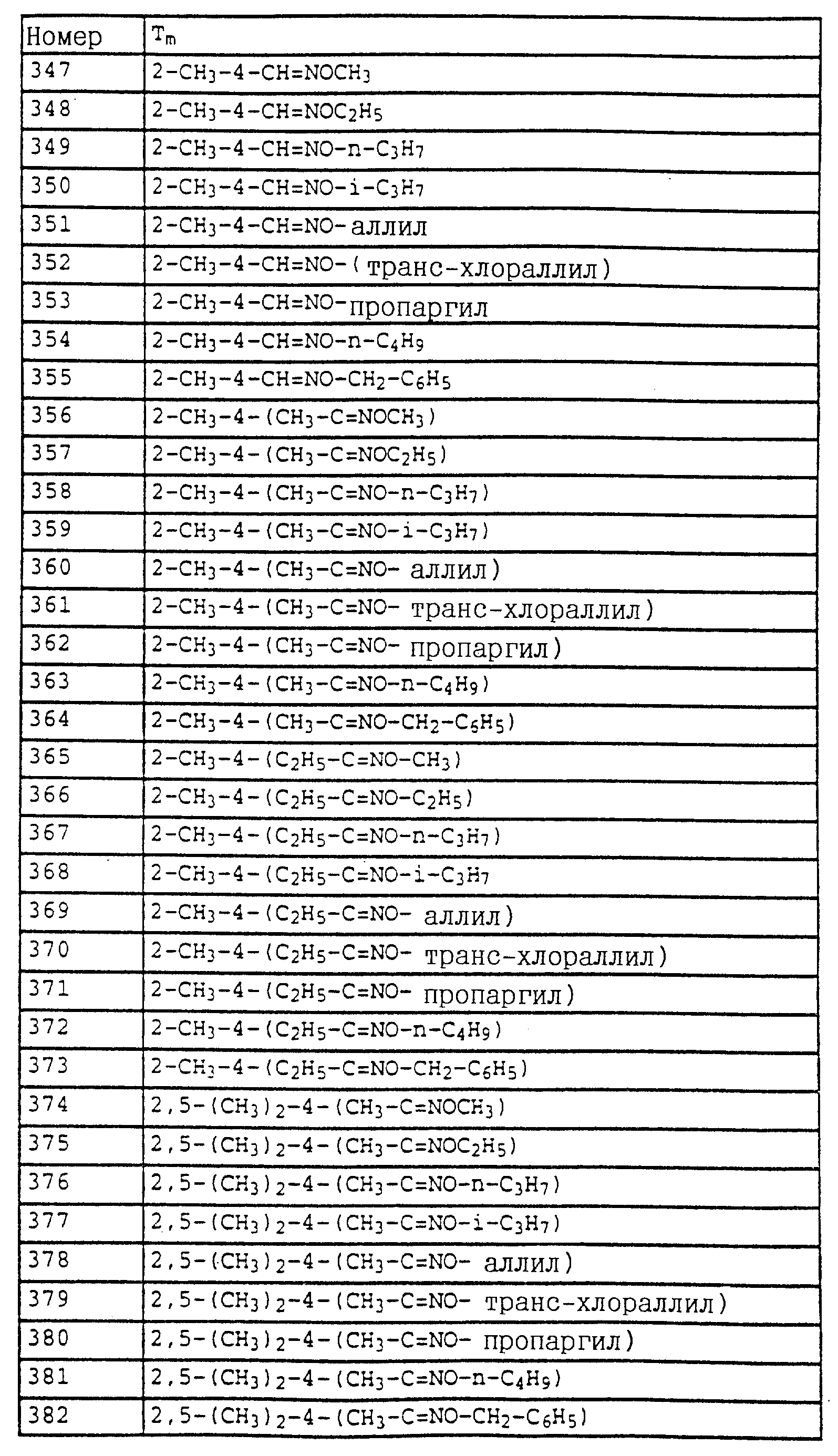
Пример 11. N-(2,6-Диметилфенил)-N-метоксикарбонил- O-метилгидроксиламин (таблица 30, N 1),
a) N-(2,6-диметилфенил)-N-метоксикарбонилгидроксиламин.
11,3 г (80 ммолей) N-2, 6-димeтилфeнилгидpoкcилaминa (получение согласно Bamberger et al., Ann. Chem. 316 (1901), 278) и 12,5 г (90 ммолей) К2CO3 в 30 мл хлористого метилена при 0-5oC по каплям обрабатывают 7,0 г (70 ммолей) метилового эфира хлормуравьиной кислоты. Затем перемешивают в течение 30 мин при 0-5oC, отфильтровывают нерастворимое твердое вещество и фильтрат выпаривают в вакууме. Остаток очищают хроматографией на колонке с помощью смеси циклогексана/уксусного эфира. В результате получают 1,4 г (7,2 ммоля=9%) указанного в заголовке соединения в виде темного масла.
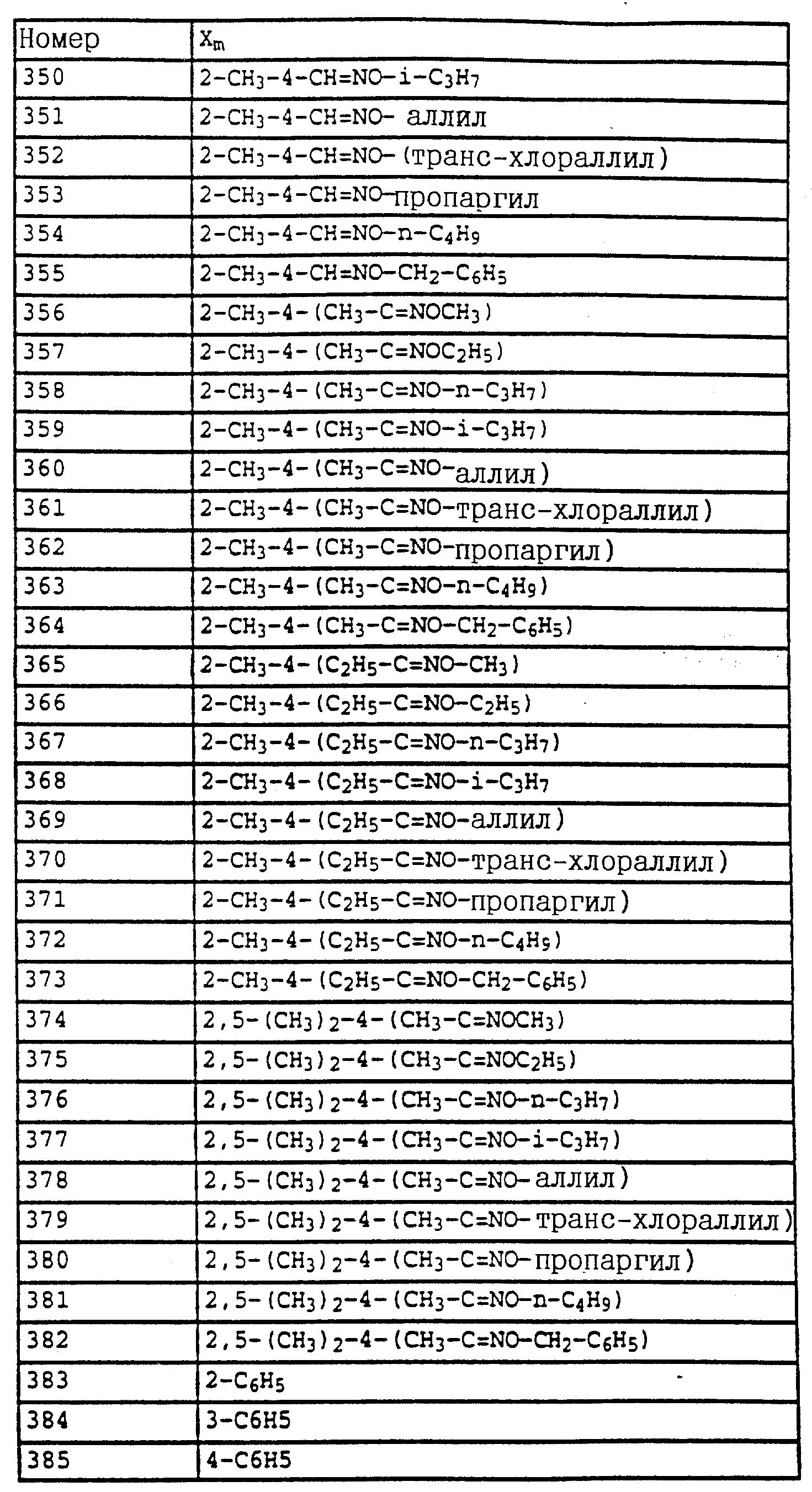
1H-ЯМР (CDCl3); δ в част./млн):
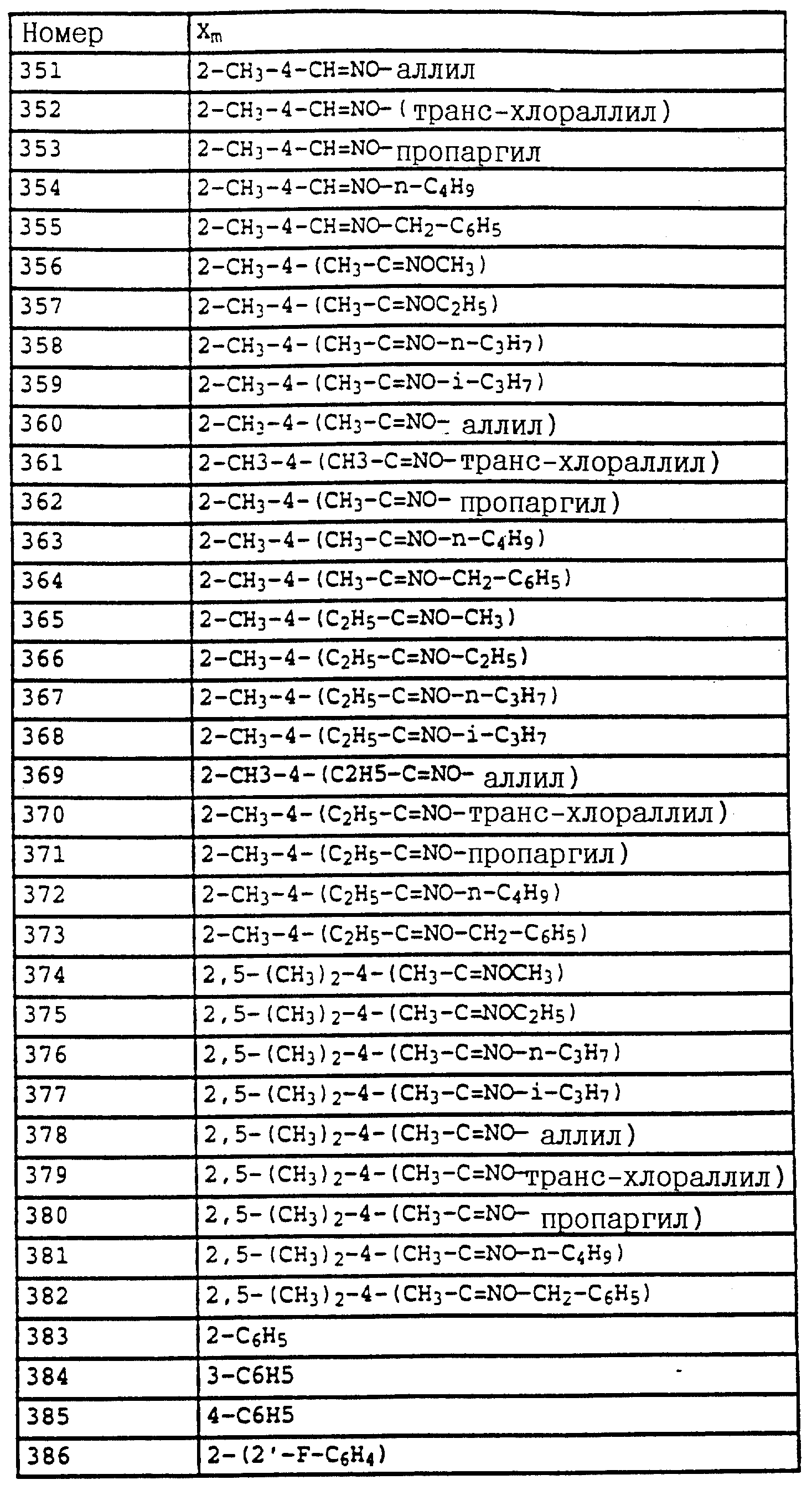
8,85 (s, шир., 1H, OH); 7,1 (m, 3H, фенил); 3,75 (s, 3H, OCH3); 2,3 (s, 6H, 2 x CH3).
б) N-(2,6-Диметилфенил)-N-метоксикарбонил-O-метилгидроксиламин (таблица 7, N 1).
Смесь из 1,4 г (7,2 ммолей) N-(2, 6-диметилфенил)-N- метоксикарбонилгидроксиламина (пример 1а), 1,3 г (9 ммолей) К2CO3 и 10 г (8 ммолей) диметилсульфата в 10 мл ацетона перемешивают в течение ночи при комнатной температуре. После этого реакционную смесь разбавляют CH2Cl2 и перемешивают с разбавленным раствором NH3. Затем фазы разделяют и органическую фазу экстрагируют еще дважды с помощью воды. Органическую фазу сушат над MgSO4 и концентрируют и остаток очищают хроматографией на колонке с помощью смеси циклогексана/уксусного эфира. В результате получают 1,2 г (6 ммолей = 83%) указанного в заголовке соединения в виде бесцветного твердого вещества (Tразм = 81oC).
1H-ЯМР (CDCl3; δ в
част./млн):
7,1 (m, 3H, фенил); 3,75 (s, шир., 6H, 2 x OCH3); 2,3 (s, 3H, CH3).
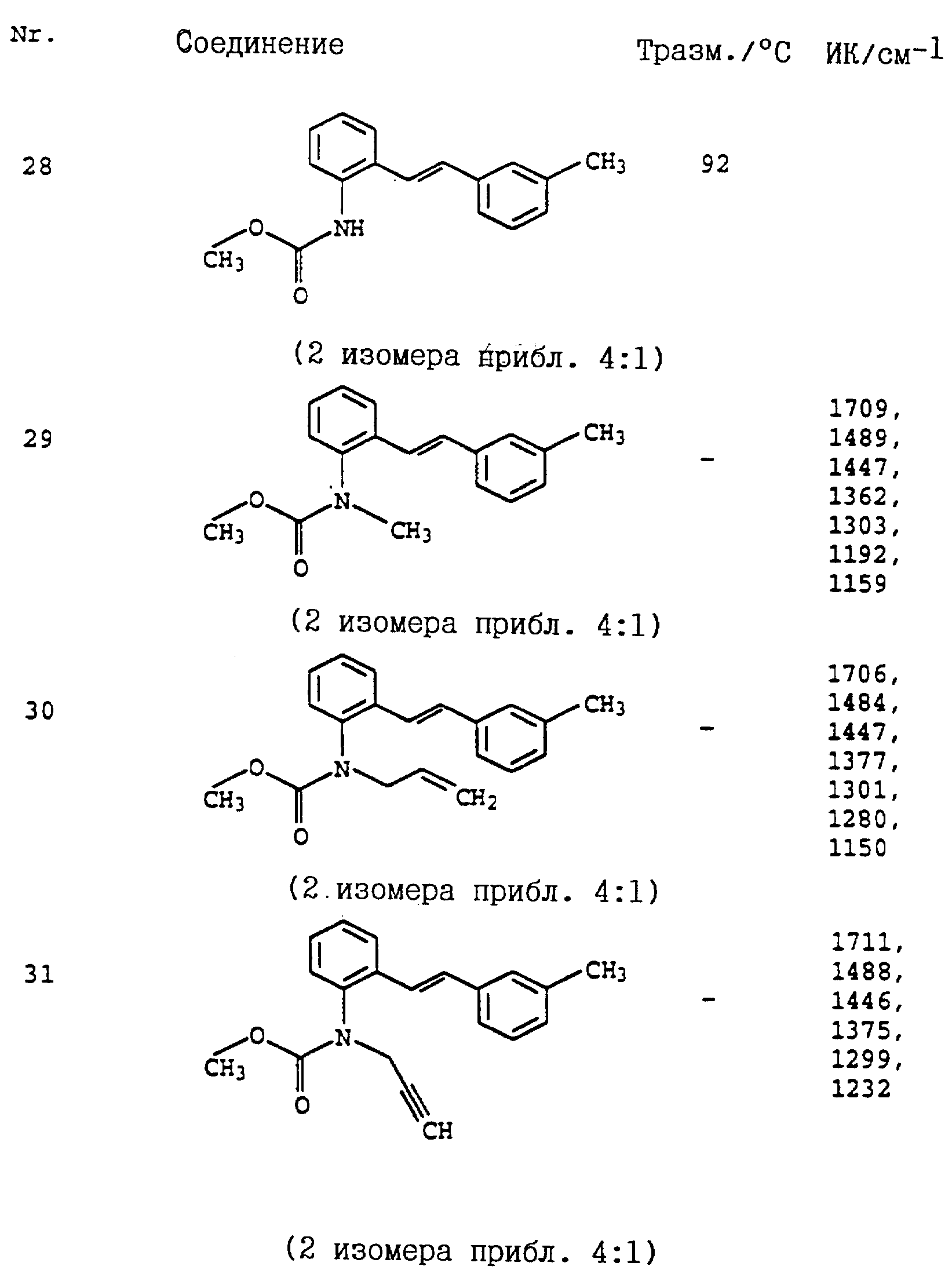
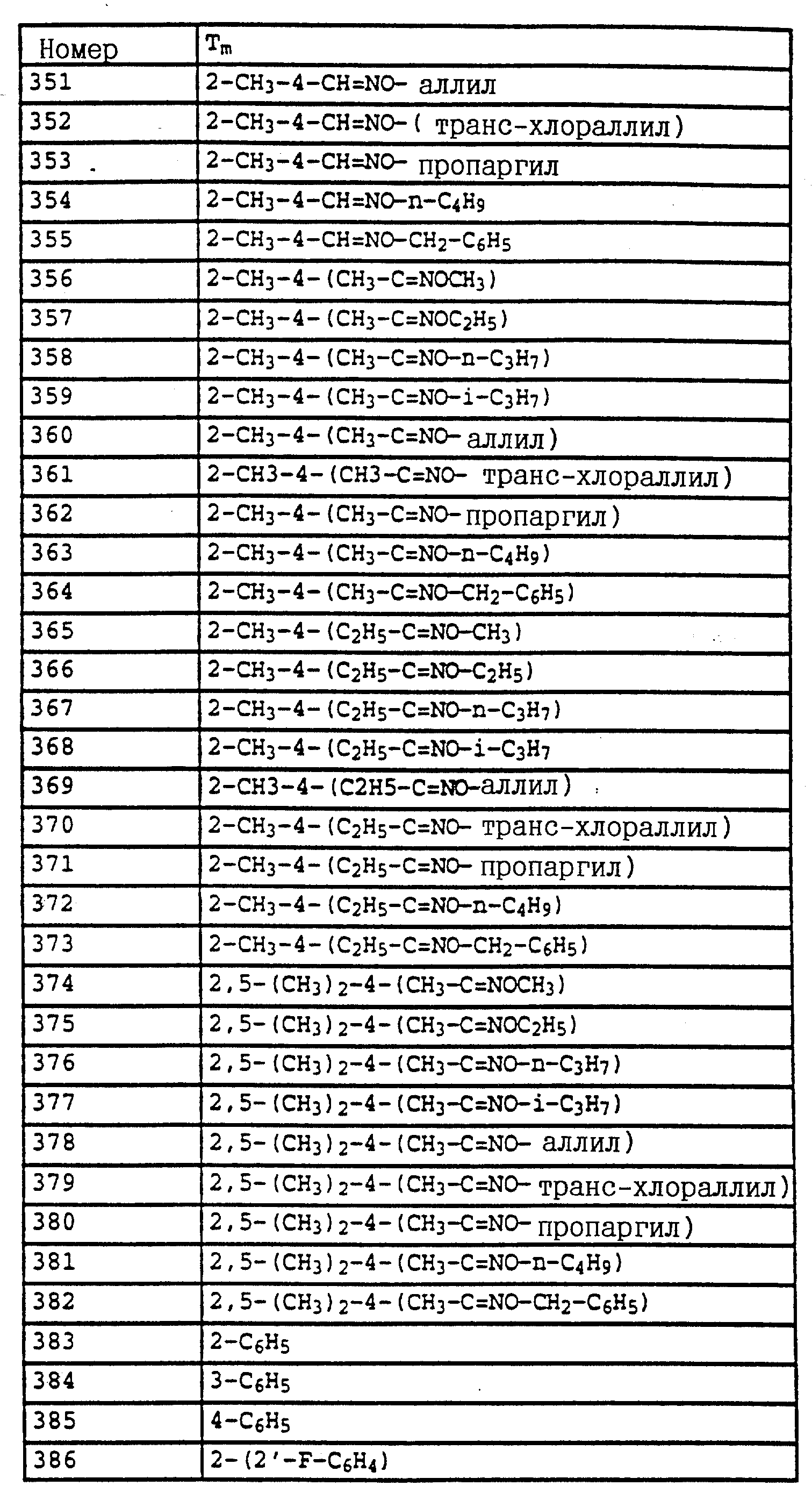
По методике, соответствующей описанной, могут быть получены соединения,
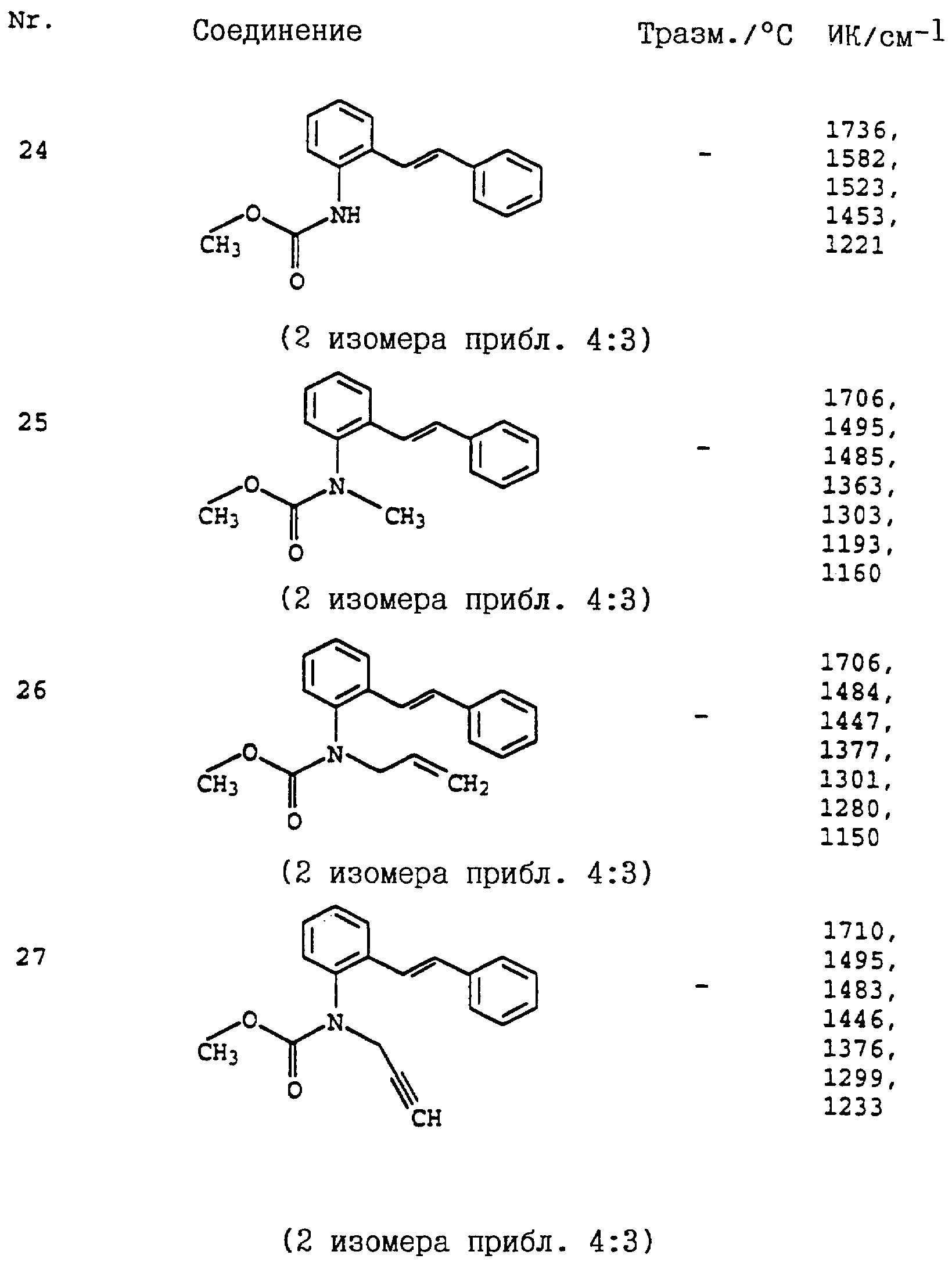
представленные в табл. 24-31 (см. в конце описания). Соединение I, N 1 из табл. 24 имеет, например, следующую формулу

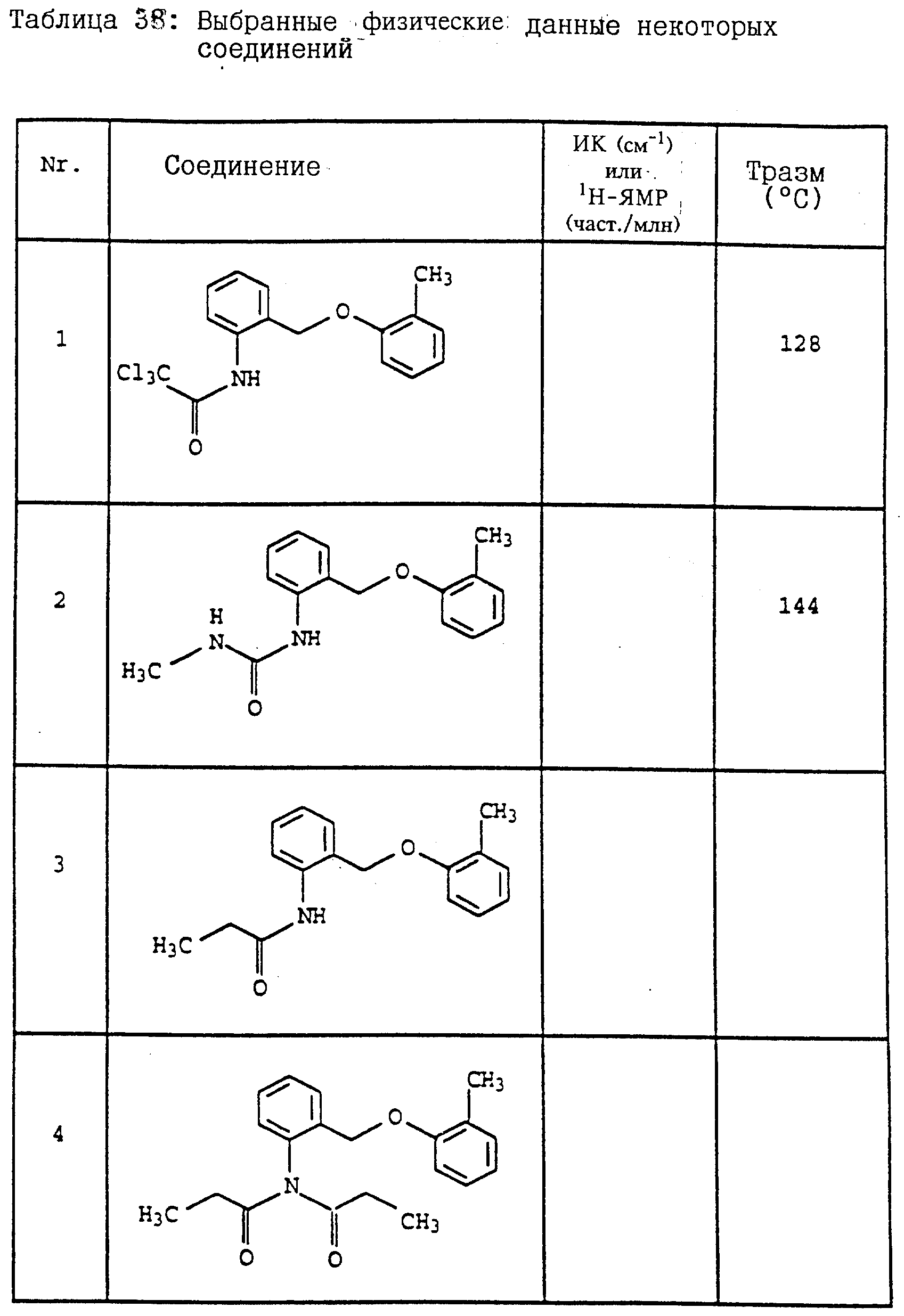
Пример 12. 2-(2'-Метилфеноксиметил)-трихлорацетанилид (таблица 38, N 1).
a) 2-(2'-Метилфеноксиметил)-нитробензол.
75 г (0,347 моля) 2-нитробензилбромида, 37 г (0,342 моля) о-крезола и 56 г (0,405 моля) карбоната калия в 500 мл диметилформамида перемешивают в течение 5 ч при комнатной температуре (20oC). Затем реакционную смесь разбавляют водой и водную фазу трижды экстрагируют с помощью простого эфира. Эфирную фазу сушат и концентрируют. Кристаллический остаток тонко растирают, размешивают и отсасывают. Таким путем получают 73 г (0,300 моля = 88%) указанного в заголовке соединения в виде бесцветного твердого вещества.
Tразм=83oC.
1
H-ЯМР (CDCl3; δ (част./млн)):
8,15 (d, 1H, J = 8 Гц, аромат.); 7,95 (d, 1H, J = 8 Гц, аромат.); 7,7 (t, 1H, J = 8 Гц, аромат.); 7,45 (t, 1H, J = 8 Гц, аромат.); 7,15 (m, 2H,
аромат.); 6,9 (m, 2H, аромат.); 5,45 (s, 2H, O-CH2); 2,35 (s, 3H, CH3).
б) 2-(2'-Метилфеноксиметил)-анилин.
75 г (0,308 моля) 2-(2'-метилфеноксиметил)-нитробензола (пример 11а) и 10 г 5%-ной Pt/C (платина, адсорбированная на активированном угле) в 50 мл метанола энергично перемешивают в атмосфере H2 в течение 2 ч. Затем добавляют еще 2 г 5%-ной Pt/C и перемешивают в течение ночи. Затем катализатор отсасывают и заменяют десятью г свежего катализатора.
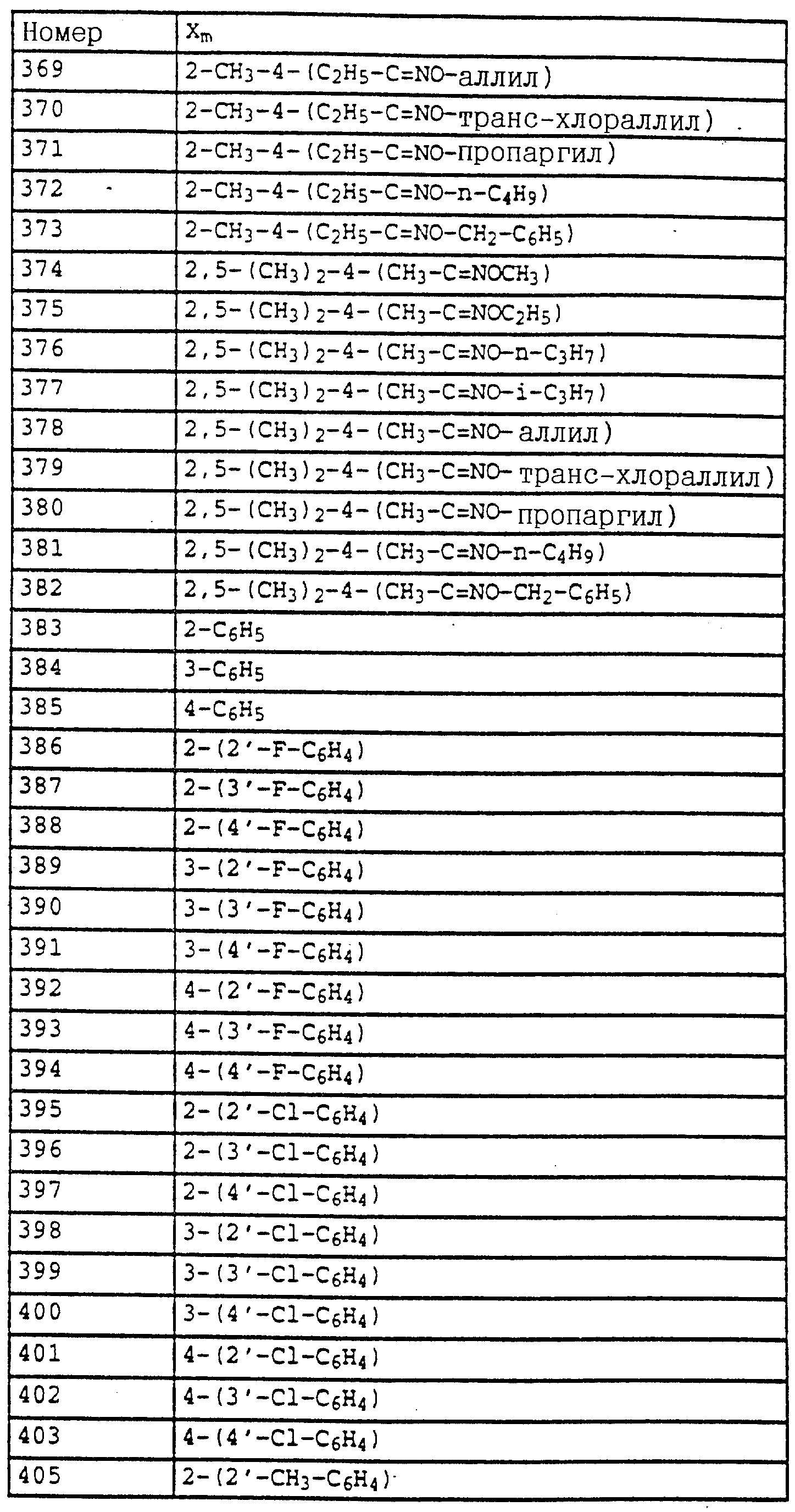
Перемешивание продолжают в течение ночи, отсасывают и фильтрат выпаривают в вакууме. Остаток очищают колоночной хроматографией с помощью смеси гексана/уксусного эфира. В результате получают 61 г (0,286 моля=93%) указанного в заголовке соединения в виде бесцветного твердого вещества.
Tразм=56oC.
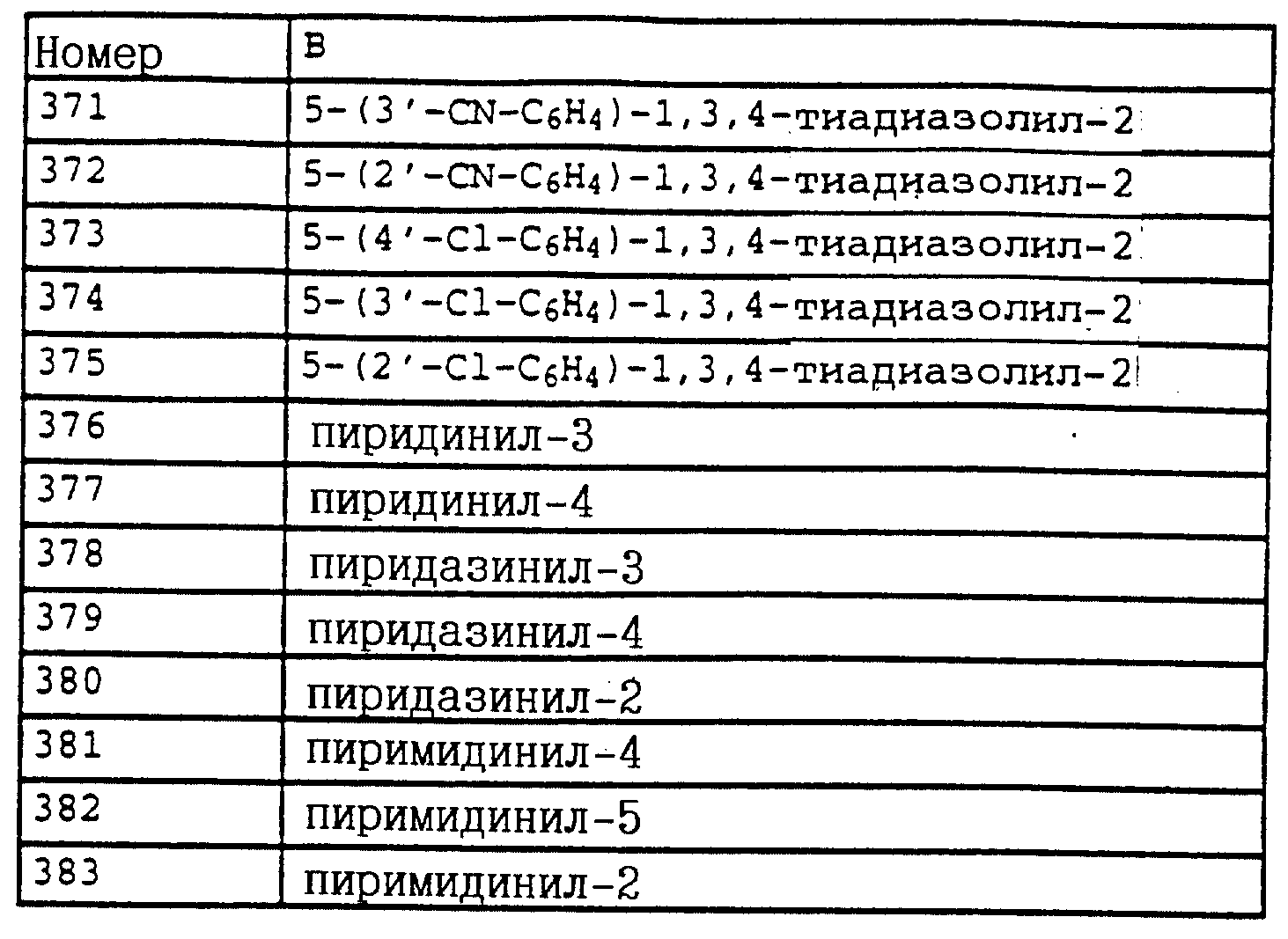
1H-ЯМР (CDCl3); δ (част./млн)):
7,2 (m, 4H,
аромат.); 6,95 (d, 1H, J = 8 Гц, аромат); 6,9 (t, 1H, J = 6 Гц, аромат. ); 6,7 (m, 2H, аромат.); 5,0 (s, 2H, O-CH2); 4,05 (s, шир., 2H, NH2); 2,2 (s, 3H, CH3).
в) 2-(2'-Метилфеноксиметил)-трихлорацетанилид (таблица 38, N 1).
Смесь из 6,6 г (36 ммолей) трихлорацетилхлорида и 3 г (38 ммолей) пиридина в 50 мл CH2Cl2 при 10-15oC по каплям обрабатывают раствором из 6 г 2-(2'-метилфеноксиметил)-анилина (пример 1б) в 20 мл CH2Cl2. Затем перемешивают в течение 1 ч при комнатной температуре. Реакционную смесь экстрагируют с помощью воды, сушат над MgSO4 и концентрируют. Остаток отсасывают через силикагель и полученный фильтрат концентрируют. После кристаллизации остаток тонко растирают и размешивают с гексаном. Таким путем получают 7,9 г (22 ммолей = 78%) указанного в заголовке соединения в виде твердого кристаллического вещества, Tразм=128oC.
1H-ЯМР (CDCl3; δ (част./млн)):
9,6 (s, шир., 1H, NH); 8,1 (d, 1H, J = 8 Гц, фенил); 7,5 (t, шир., 1H, фенил); 7,4 (d, шир., 1H, фенил);
7,2 (m, 3H, фенил); 6,95 (m, 2H, фенил); 5,1 (s, 2H, OCH2; 2,2 (s, 3H, CH3).
Пример 13. N-Метил-N'-[2-(2'-метилфеноксиметил)-фенил] - мочевина (таблица 7, N 2).
В лабораторном автоклаве к 2 г (5,5 ммолей) трихлорацетанилида из примера 1в добавляют примерно 10 мл метиламина. Затем автоклав закрывают и реакционную смесь в течение приблизительно 6 ч нагревают до 80oC. После этого реакционную смесь охлаждают и автоклав открывают. Метиламину дают испариться и твердый остаток перемешивают с простым метил-трет.-бутиловым эфиром. Нерастворимое твердое вещество отсасывают и сушат в вакууме. В результате получают 1,4 г (5,2 ммолей = 94%) указанного в заголовке соединения в виде твердого кристаллического вещества. (Tразм = 144oC).
1H-ЯМР (DMSO-d6; δ (част./млн)):
8,05 (s, 1H, NH); 7,8 (d, 1H, J = 8 Гц, фенил); 7,4 (d, 1H, J = 8 Гц, фенил); 6,
8-7,3 (m, 6H, фенил); 6,7 (s, 1H, NH); 5,1 (s, 2H, OCH2); 2,65 (d, 3H, J = 5 Гц, N-CH3); 2,2 (s, 3H, CH3).
Пример 14. Анилид 2-(2'-метилфеноксиметил)-пропионовой кислоты (таблица 38, N 3).
Смесь из 3 г (14,1 ммолей) анилина из примера 11б, 1,35 г (17 ммолей) пиридина и 1,4 г (15,5 ммолей) хлорида пропионовой кислоты в 30 мл хлористого метилена перемешивают в течение 1 ч при комнатной температуре. Затем реакционную смесь экстрагируют с помощью разбавленной соляной кислоты и воды, сушат над MgSO4 и концентрируют. В качестве остатка получают 3,8 г (количественный выход) соединения, указанного в заголовке.
1H-ЯМР (CDCl3; δ
(част./млн)):
8,25 (s, шир., 1H, NH); 8,15 (d, 1H, J = 8 Гц, фенил); 6,9-7,5 (m, 7H, фенил); 5,1 (s, 2H, OCH2); 2,35 (q, 2H, J = 8 Гц, CH2); 2,25 (s, 3H, CH3);
1,2 (t, 3H, J = 8 Гц, CH3).
Пример 15. Анилид N-пропионил-2-(2'-метилфеноксиметил)- пропионовой кислоты (таблица 38, N 4),
3,8 г (14 ммолей) анилида пропионовой
кислоты из примера 13 в 40 мл диметилформамида порциями обрабатывают 0,41 г (17,1 ммолей) гидрида натрия. После завершения газообразования добавляют 1,4 г (15,9 ммолей) хлорида пропионовой кислоты и
перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь разбавляют водой и водную фазу трижды экстрагируют с помощью простого метил-трет.-бутилового эфира. Соединенные
органические фазы экстрагируют водой, сушат над MgSO4 и концентрируют. Остаток очищают хроматографией на колонке с помощью смеси гексана/уксусного эфира. В результате получают 2,6 г (8
ммолей = 57%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (CDCl3; δ (част./млн)):
7,6 (m, 1H, фенил); 7,4 (m, 2H, фенил); 7,15
(m, 3H, фенил); 6,85 (m, 2H, фенил); 4,85 (m, 2H, OCH2; 2,6 (m, 4H, 2 x CH2); 2,2 (s, 3H, CH3); 1,1 (t, 6H, J = 8 Гц, 2 x CH3).
Пример 16. Анилид N-метил-2-(2'-метилфеноксиметил)- пропионовой кислоты (таблица 38, N 5).
4,0 г (14,8 ммолей) анилида пропионовой кислоты из примера 13 в 50 мл диметилформамида порциями обрабатывают 0,45 г (19 ммолей) гидрида натрия. После завершения газообразования добавляют 3,0 г (21 ммоль) метилйодида и перемешивают в течение 2 ч при комнатной температуре. Затем реакционную смесь разбавляют водой и водную фазу трижды экстрагируют с помощью простого метил-трет. -бутилового эфира. Соединенные органические фазы экстрагируют с помощью воды, сушат над MgSO4 и концентрируют. Остаток после кристаллизации тонко растирают и размешивают с гексаном. В результате получают 3,7 г (11,7 ммолей = 90%) указанного в заголовке соединения в виде бесцветного твердого вещества (Tразм= 80oC).
1H-ЯМР (CDCl3; δ (част./млн)):
7,7 (m, 1H, фенил); 7,4 (m, 2H, фенил); 7,2 (m, 3H, фенил); 6,9 (m,
2H, фенил); 5,0 (s, 2H, OCH2); 3,2 (s, 3H, N-CH3); 2,2 (s, 3H, CH3); 2,0 (m, 2H, CH2; 1,0 (t, 3H, J = 8 Гц, CH3).
Пример 17. N-Метил-2-(2'-метилфеноксиметил)-ацетанилид.
a) N-Метил-2-(2'-метилфеноксиметил)-анилин.
Смесь из 5 г (23 ммоля) 2-(2'-метилфеноксиметил)-анилина (пример 16), 5 г (36 ммолей) K2CO3 и 3,4 г (24 ммоля) метилйодида в 50 мл диметилформамида перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь разбавляют водой и водную фазу трижды экстрагируют с помощью простого метил-трет. -бутилового эфира. Соединенные органические фазы экстрагируют водой, сушат над MgSO4 и концентрируют. Остаток очищают колоночной хроматографией с помощью смеси гексана/хлористого метилена. В результате получают 3,0 г (чистота 70%, выход приблизительно 40%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (CDCl3; δ част./млн):
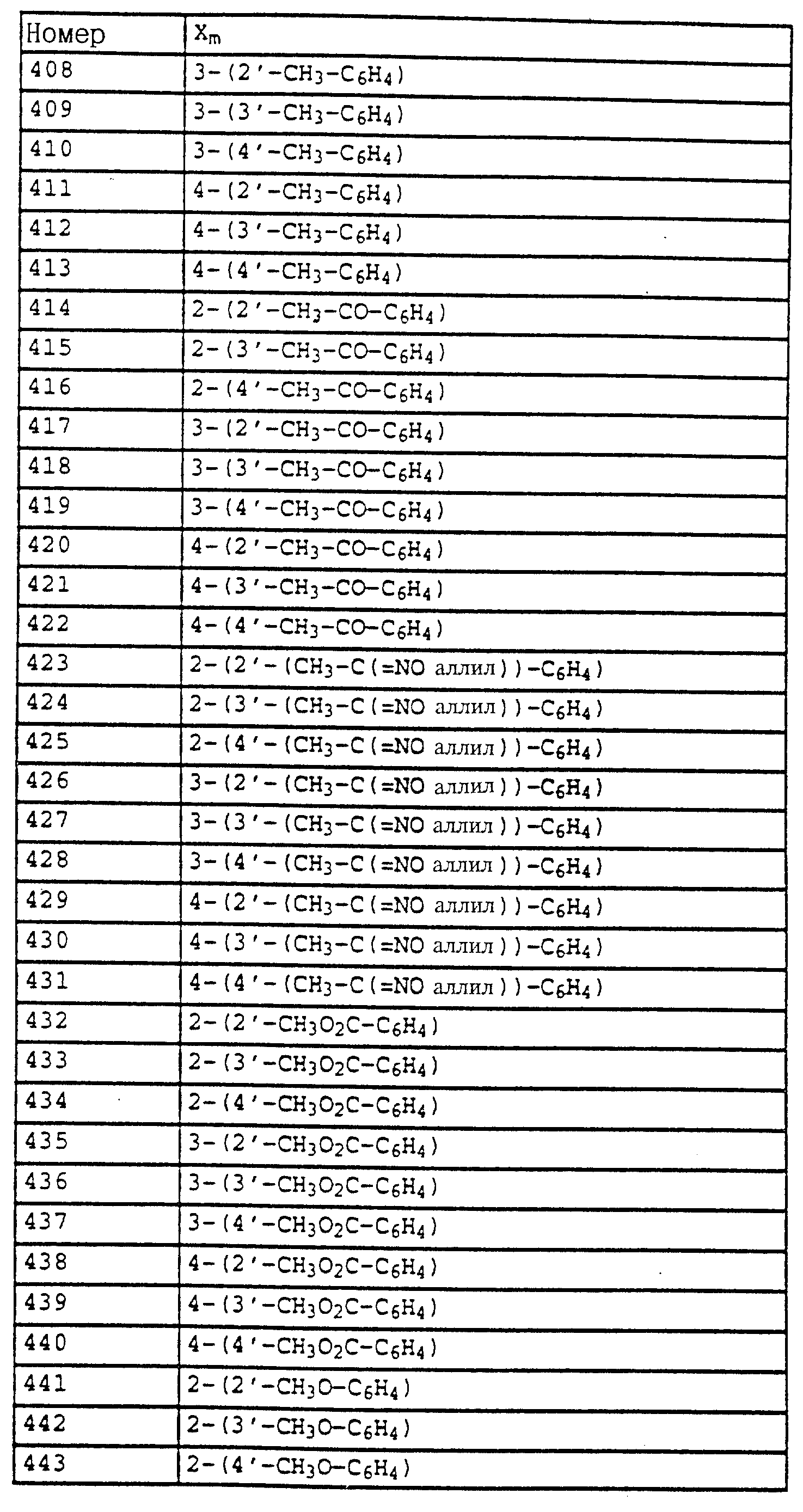
6,6-7,4 (m, 8H, фенил); 5,0 (s, 2H, OCH2); 4,6 (s, шир., 1H, NH); 2,9 (d, 3H, N-CH3); 2,2 (s, 3H, CH3
).
б) N-метил-2-(2'-метилфеноксиметил)-ацетанилид (таблица 7, N 9).
Смесь из 1,6 г (16 ммолей) ацетангидрида и 1,3 г (16 ммолей) пиридина в 20 мл хлористого метилена обрабатывают 3 г (приблизительно 9,3 ммолей) N-метил-2-(2'-метилфеноксиметил)-анилина (из примера 5а). Реакционную смесь перемешивают в течение 1 ч при комнатной температуре, после чего экстрагируют с помощью разбавленной соляной кислоты и воды. Затем органическую фазу концентрируют и остаток очищают колоночной хроматографией с помощью смеси гексана/уксусного эфира. В результате получают 2 г (80%) указанного в заголовке соединения в виде бесцветного твердого вещества (Tразм= 76oC).
1H-ЯМР (CDCl3; δ в част./млн):
7,7 (m,
1H, фенил); 7,4 (m, 2H, фенил); 7,2 (m, 3H, фенил); 6,9 (m, 2H, фенил); 5,0 (s, 2H, OCH2); 3,25 (s, 3H, CH3); 2,25 (s, 3H, CH3); 1,8 (s, 3H, CH3).
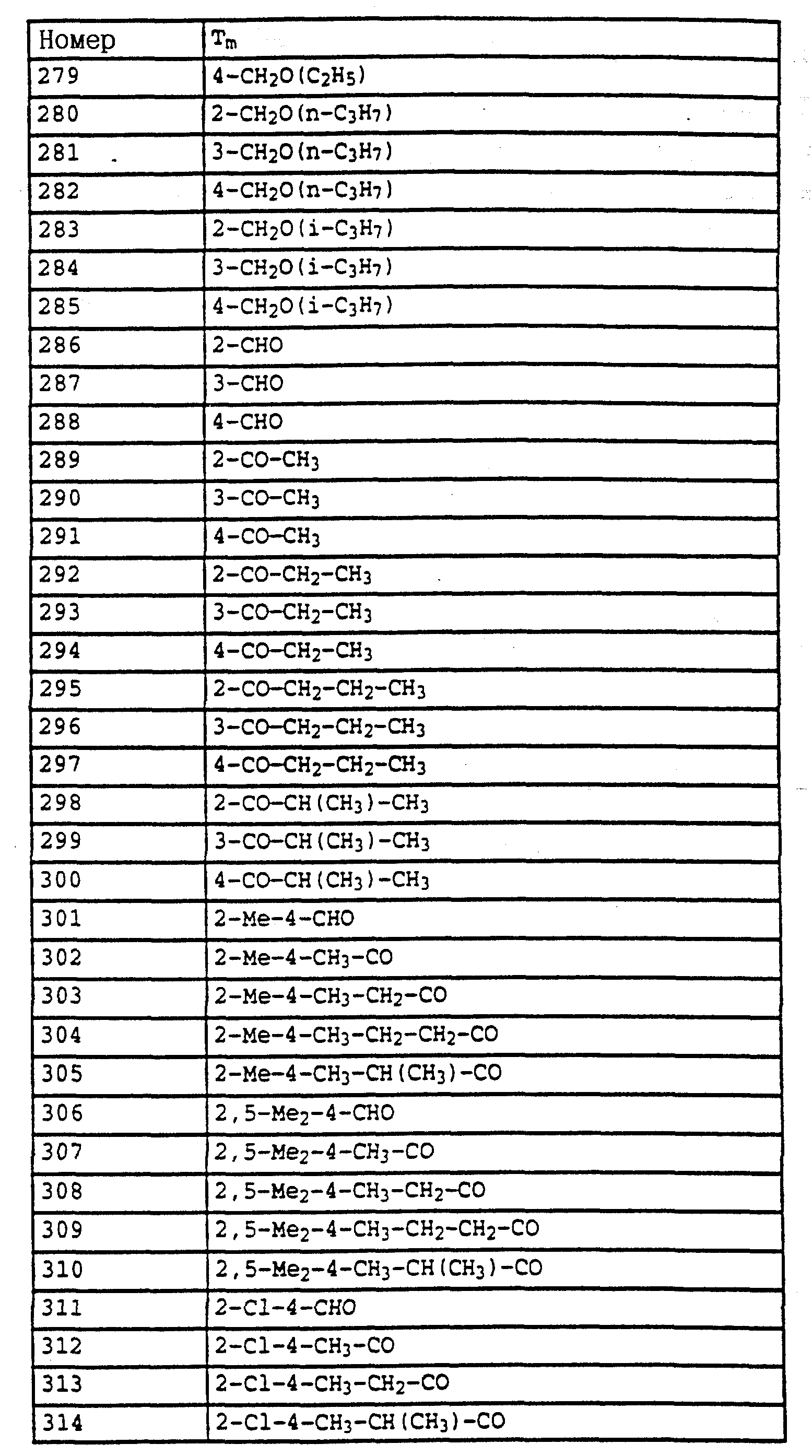
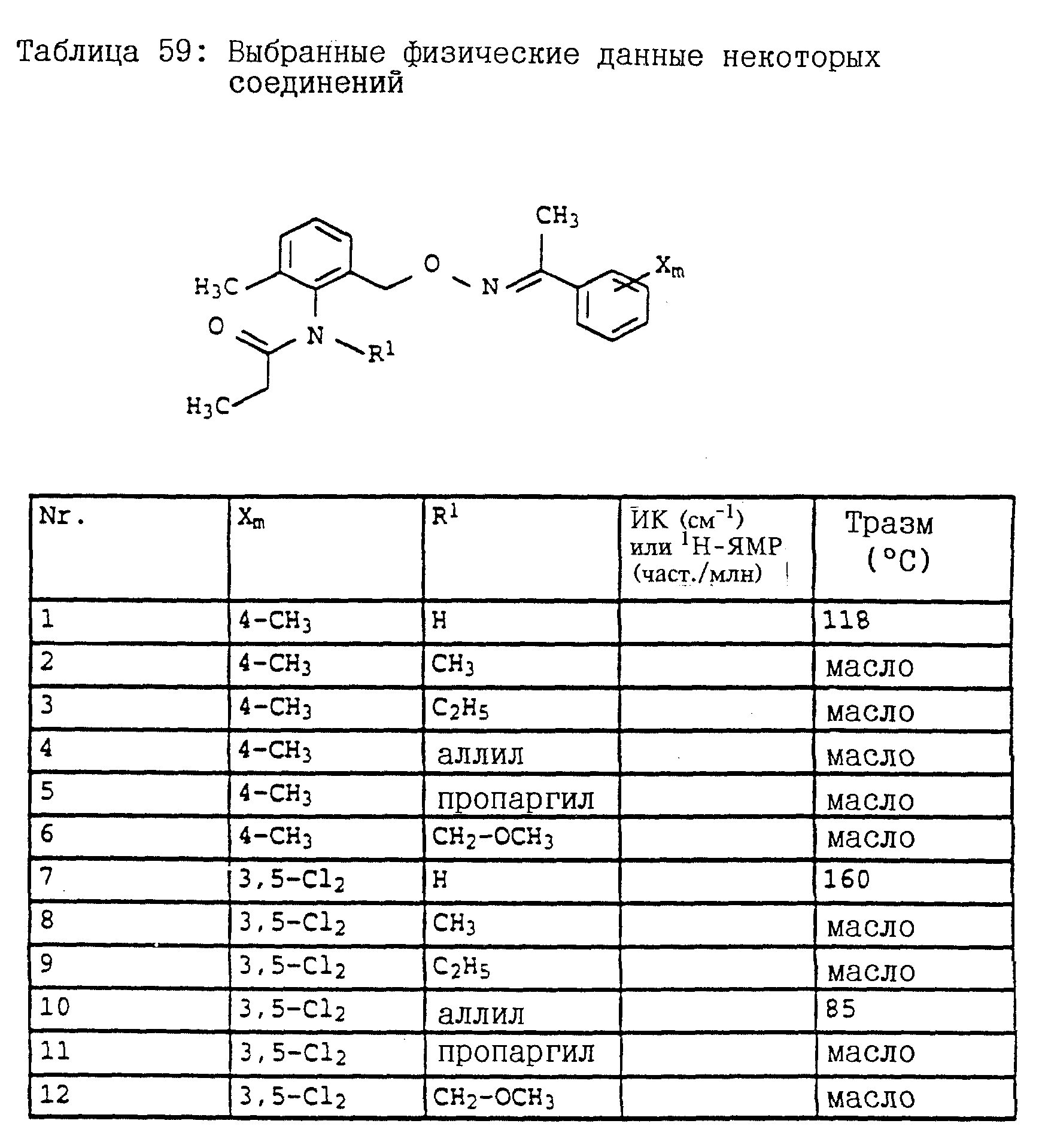
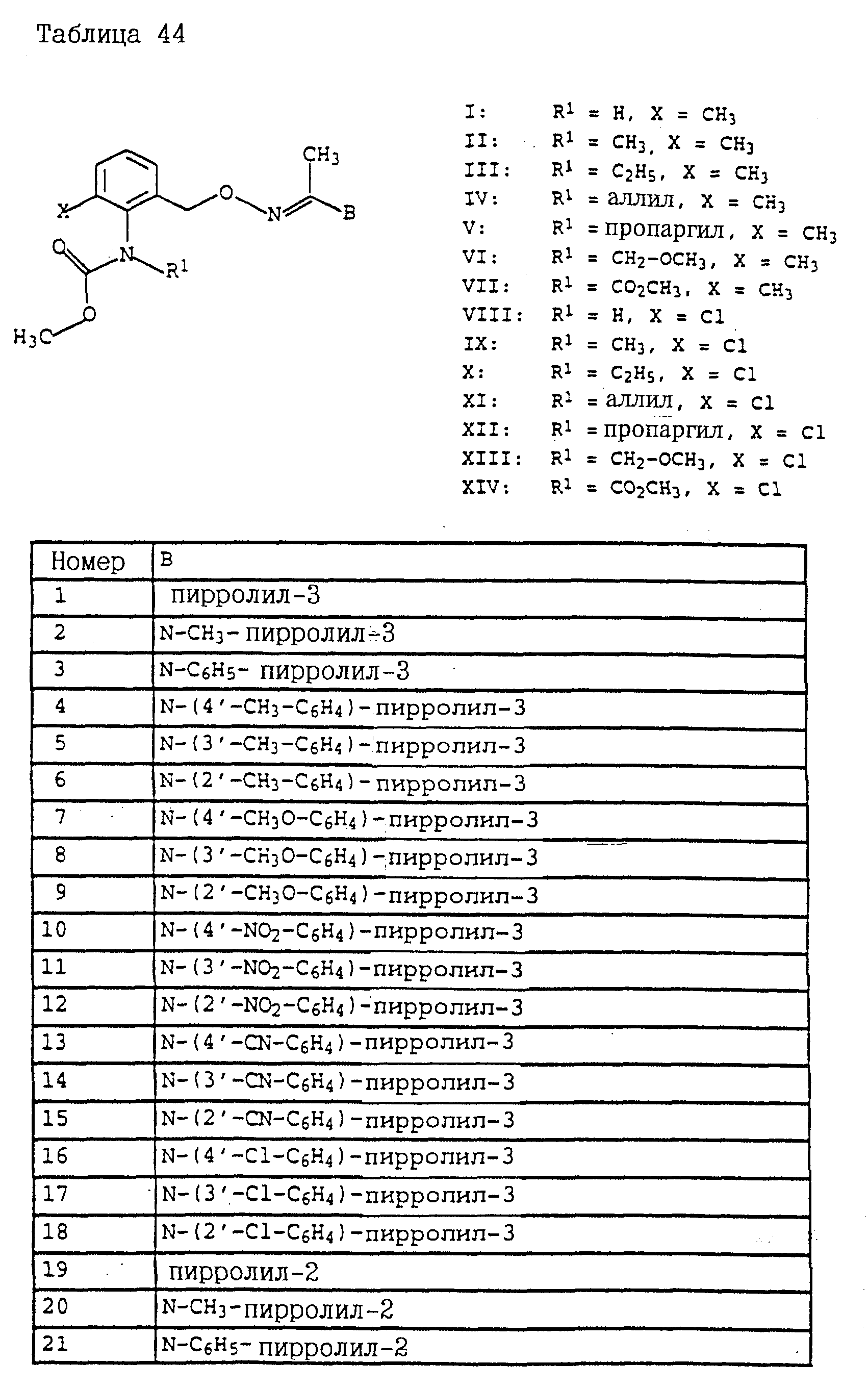
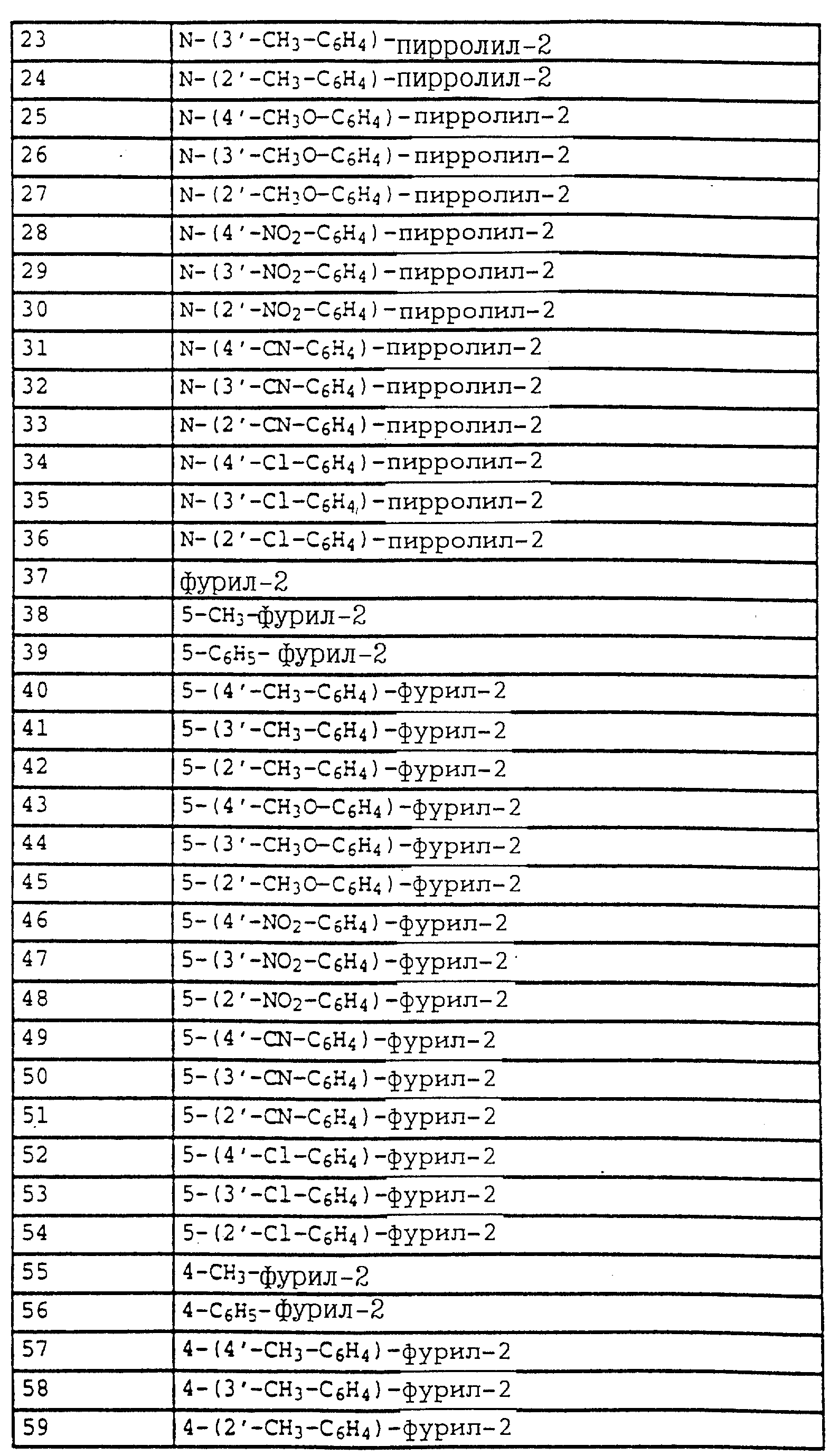
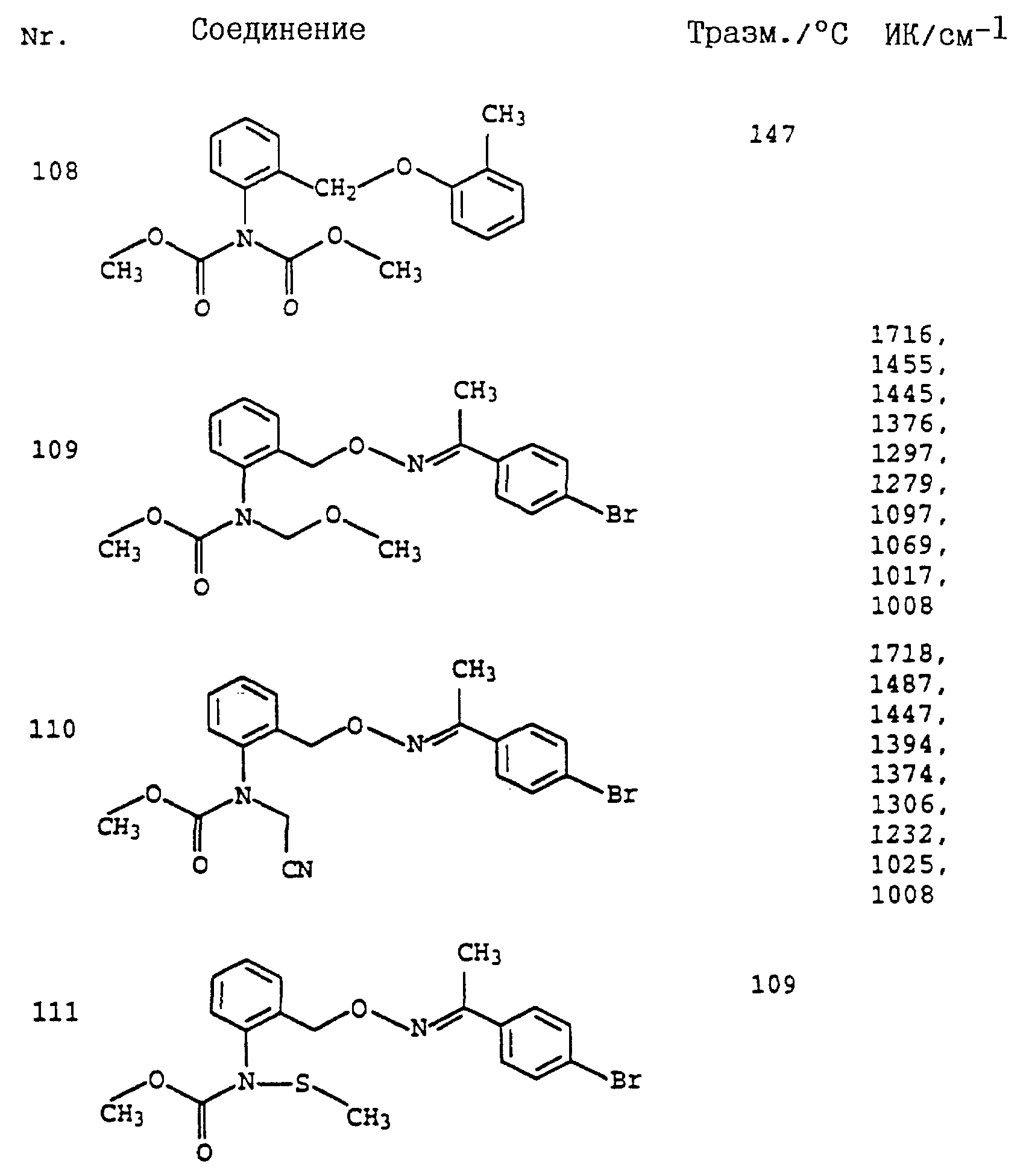
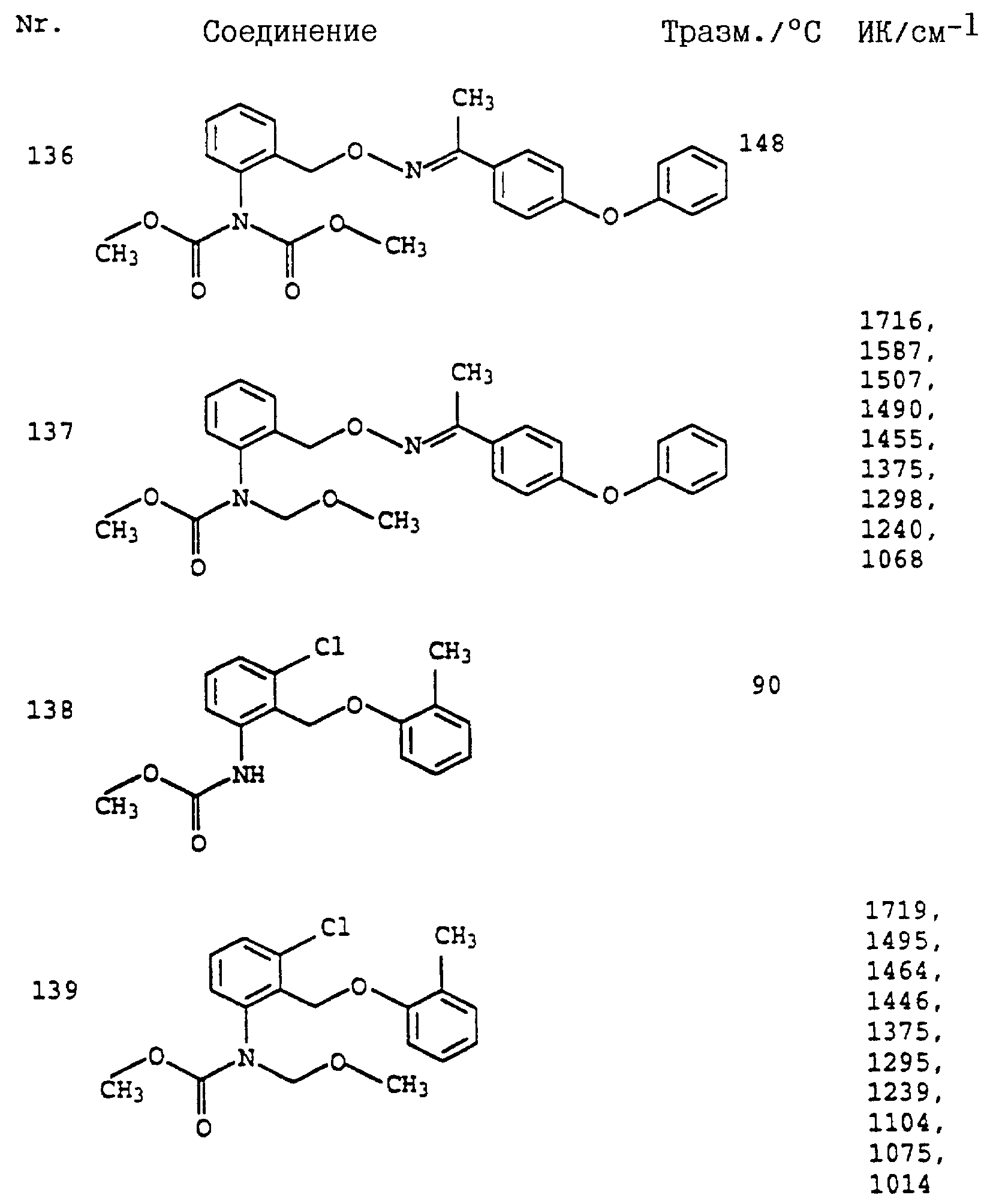
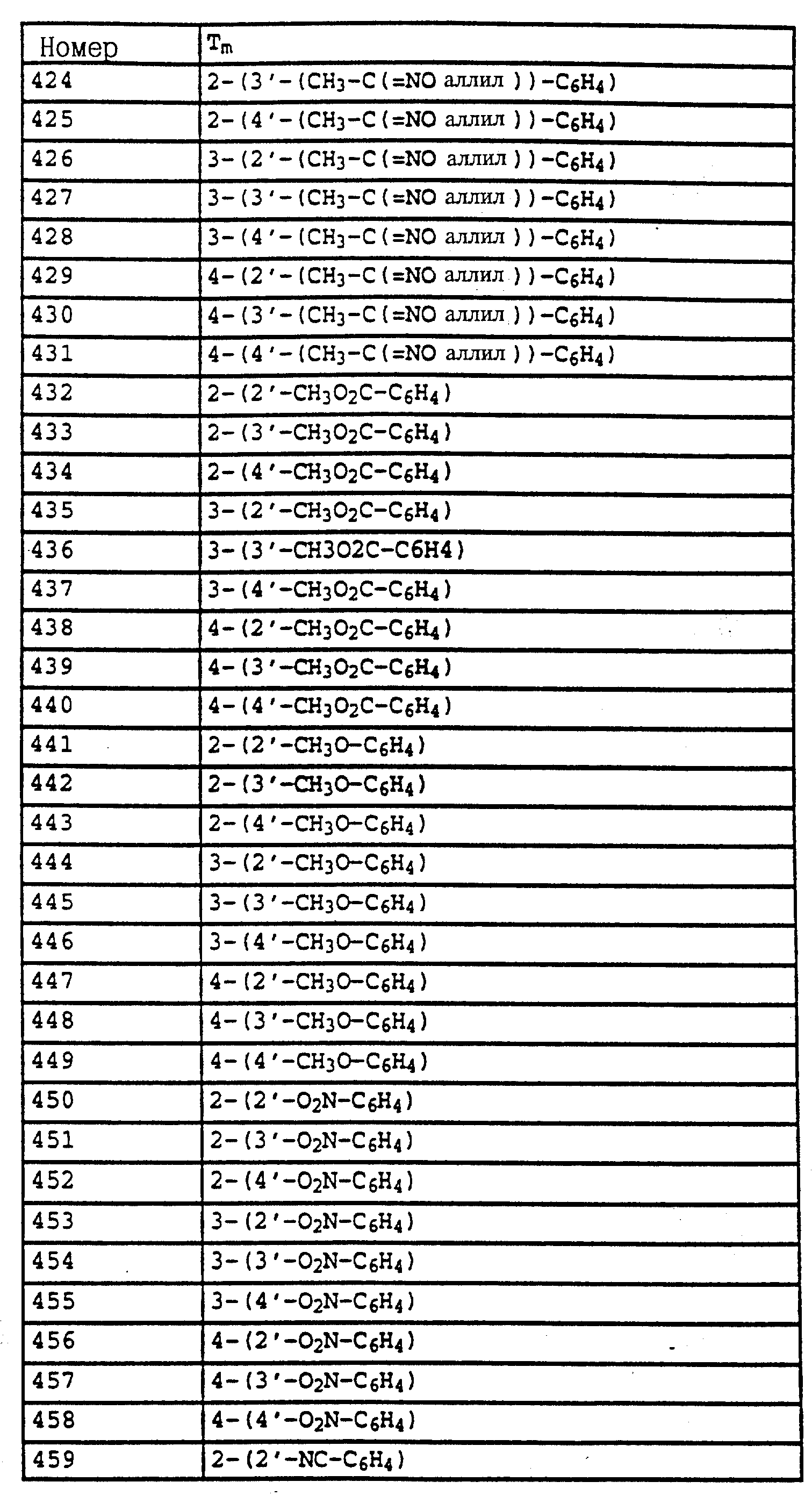
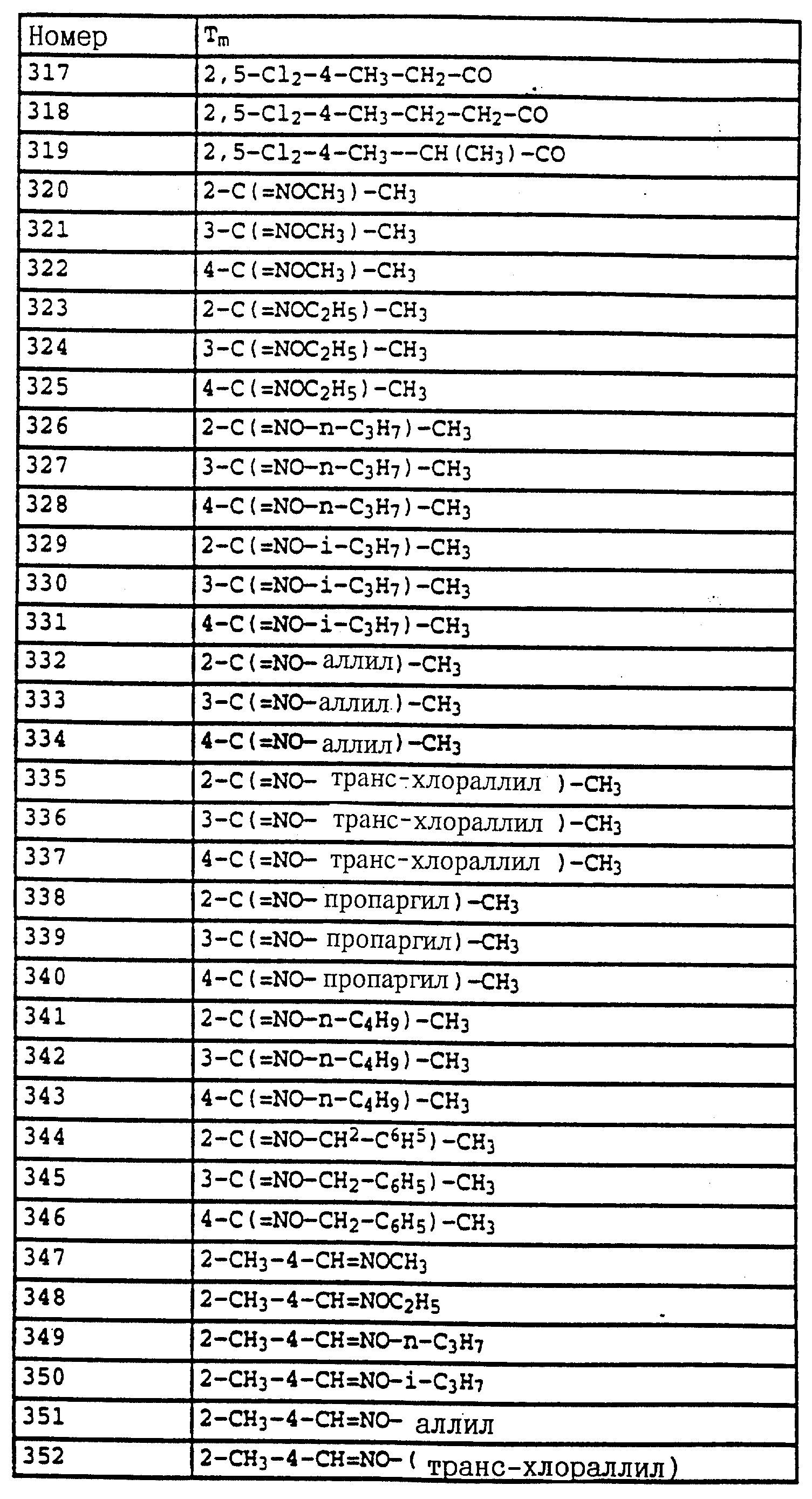
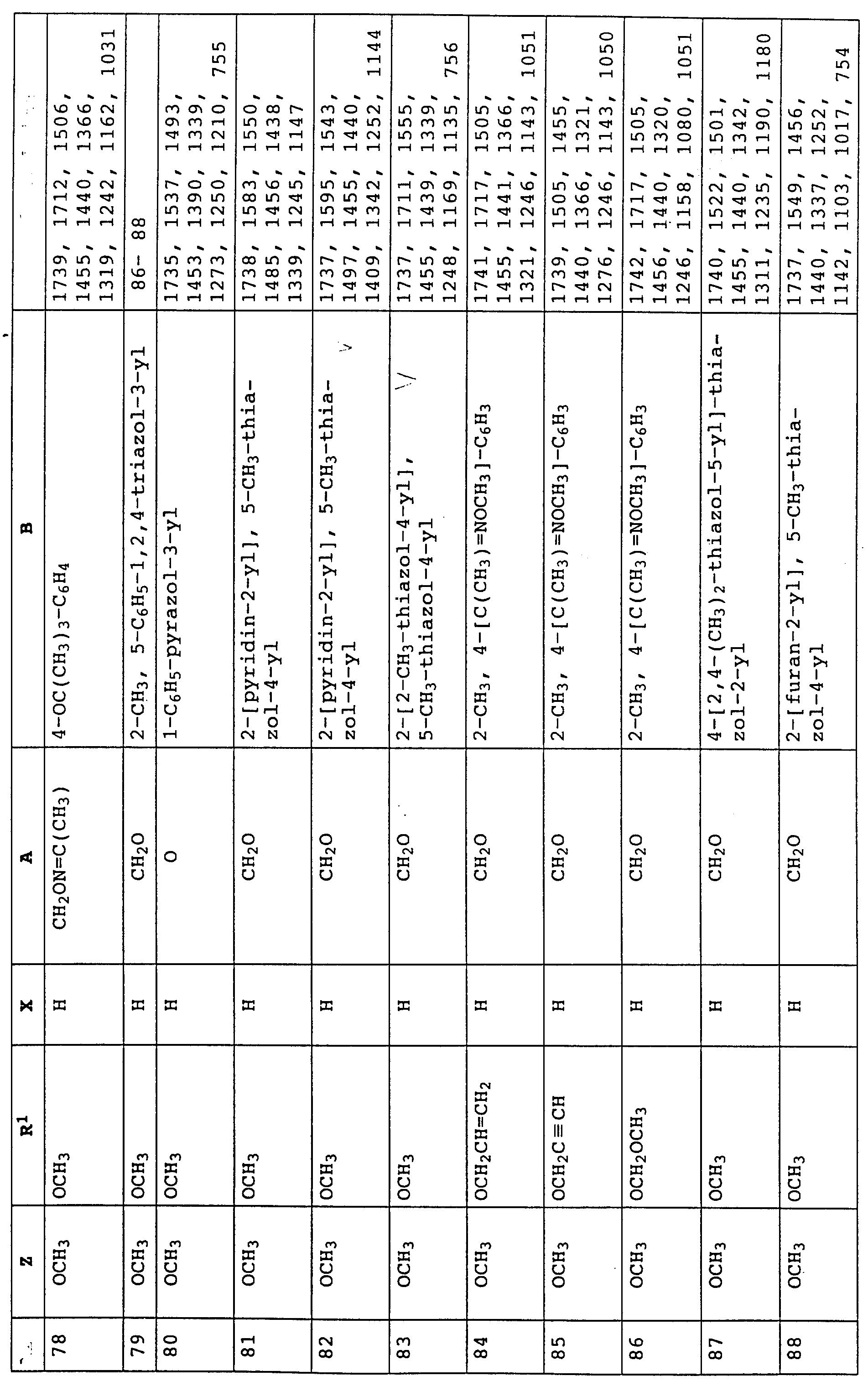
По методике, соответствующей описанной, могут быть получены соединения, представленные в 32-38, 58, 59, 39, 40 (см. в конце описания).
Соединение I из таблице 32, N 1 имеет,
например, следующую структурную формулу:
Аналогичным образом могут быть получены соединения, описанные в нижеследующих таблицах.
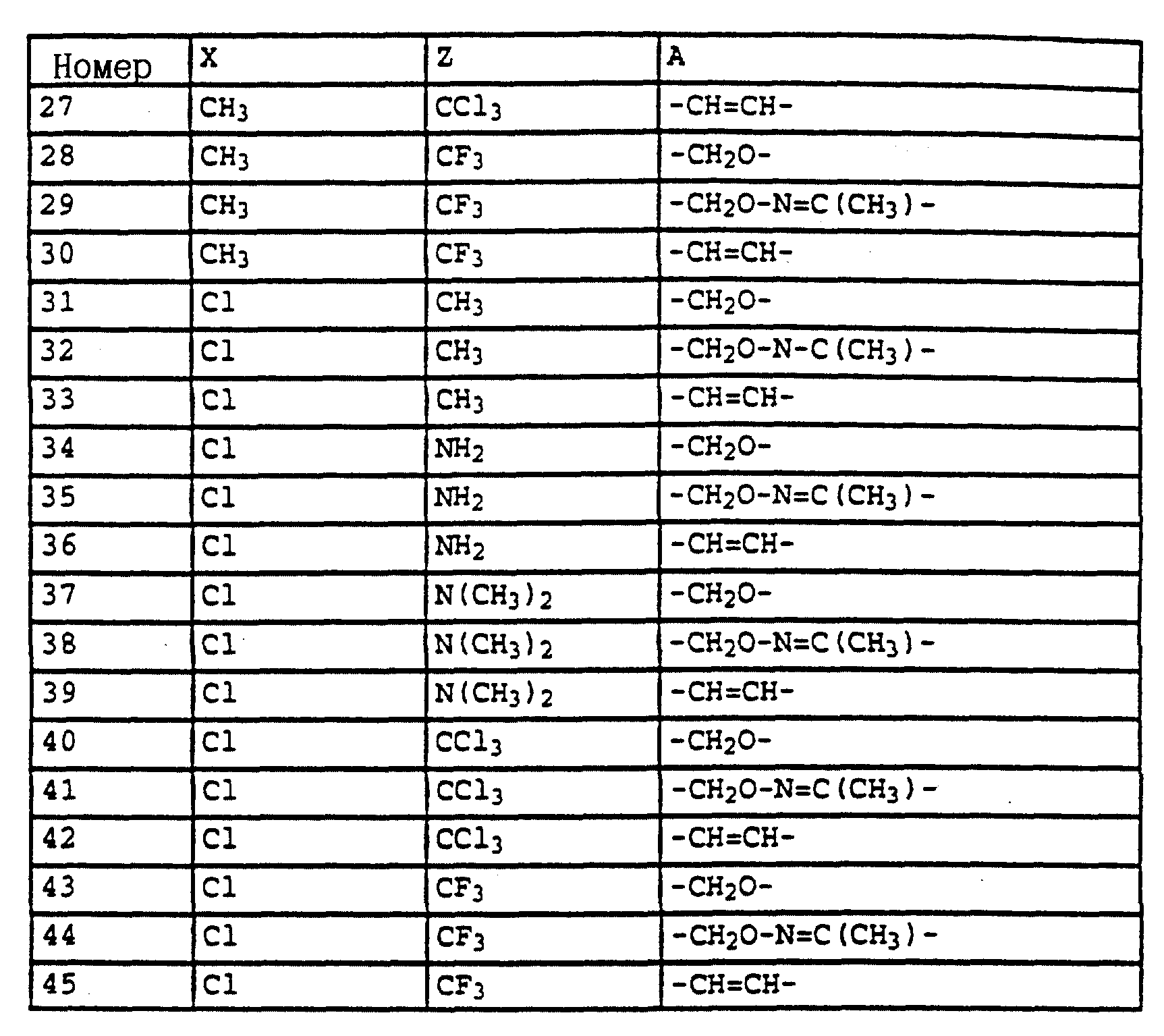
Пример 19. Метиловый эфир N-[2-(3'',4''- дихлорфенил-1'-метилиминооксиметил-4')-6-метилфенил]-карбаминовой кислоты (таблица 47, N 2).
а) 2-(Метансульфонилоксиметил)-6-метилнитробензол.
В смесь из 34 г (0,2 моля) 3-метил-2-нитробензилового спирта и 27 г (0,27 моля) триэтиламина в 100 мл CH2 Cl2 при 10-15oC по каплям добавляют 27 г (0,23 моля) метансульфонилхлорида, растворенных в 20 мл CH2Cl2. Реакционную смесь перемешивают в течение 1 ч при комнатной температуре, после чего экстрагируют водой. Органические фазы сушат над MgSO4 и 10 концентрируют. В качестве остатка получают 48 г указанного в заголовке соединения в виде желтого масла с примесями около 10% соответствующего бензилхлорида. Сырой продукт без дальнейшей очистки используют для последующей реакции.
1H-ЯМР (CDCl3; δ в
част./млн):
7,3-7,6 (m, 3H, фенил); 5,3 (s, 2H, OCH2; 3,0 (s, 3H, CH3-SO3); 2,4 (s, 3H, CH3).
б) 2-(3'', 4''-дихлорфенил-1'-метилиминооксиметил-4')-6- метилнитробензол.
В раствор из 13 г (64 ммоля) 3,4-дихлорацетофеноноксима в 100 мл диметилформамида при комнатной температуре порциями добавляют 1,8 г (75 ммолей) гидрида натрия. После того, как завершается газообразование, при 25-30oC по каплям добавляют раствор из 16 г (65 ммолей) мезилата из примера 1а в 30 мл диметилформамида и затем перемешивают еще в течение 1 ч при комнатной температуре. Затем реакционную смесь разбавляют водой и водную фазу трижды экстрагируют с помощью простого метил-трет.-бутилового эфира. Соединенные органические фазы промывают водой, сушат над MgSO4 и концентрируют. Остаток после кристаллизации тонко растирают и размешивают с метанолом. Маточный раствор очищают хроматографией на колонке с помощью смеси циклогексана/уксусного эфира. Таким путем получают в общей сложности 20,4 г (58 ммолей = 90%) указанного в заголовке соединения в виде светложелтых кристаллов.
1H-ЯМР (CDCl3; δ в част./млн):
7,7, (s, шир. , 1H, фенил); 7,2-7,6 (m, 5H, фенил); 5,3 (s, 2H, OCH2); 2,4 (s, 3H, CH3); 2,2 (s, 3H, CH3).
в) 2-(3'',4''-Дихлорфенил-1'-метилиминооксиметил-4')-6- метиланилин.
19 г (53,8 ммолей) нитробензола из примера 16б в 150 мл метанола при 20-30oC по каплям обрабатывают 53 г 21,8%-ного раствора Na2[Fe(CO)4] (1 кг раствора содержит 633 г воды, 218 г Na2[Fe(CO)4], 108 г NaCO3 и 41 г NaOH). Коричневую суспензию перемешивают в течение 2 ч при комнатной температуре, затем реакционную смесь разбавляют хлористым метиленом и эту смесь отсасывают через силикагель. Остаток повторно промывают CH2Cl2 и соединенные фильтраты экстрагируют водой, сушат над MgSO4 и концентрируют. Остаток коричневого цвета очищают колоночной хроматографией с помощью смеси циклогексана/уксусного эфира. В результате получают 14,3 г (44,3 ммоля=82%) указанного в заголовке соединения в виде твердого вещества бежевого цвета.
1H-ЯМР(CDCl3; δ в част./млн):
7,7 (s, 1H, фенил); 7,5 (m, 2H, фенил); 7,1 (t, шир., 2H, фенил); 6,7 (t, 1H, J = 8 Гц, фенил); 5,2 (s, 2H, OCH2; 4,15 (s,
2H, NH2; 2,2 (s, 3H, CH3).
г) Метиловый эфир N-[2-(3'',4''-дихлорфенил-1'- метилиминооксиметил-4')-б-метилфенил]-карбаминовой кислоты (таблица 47, N 2).
В раствор из 14,3 г (44 ммоля) анилина из примера 1в в 150 мл CH2CloC при 20-30oC последовательно добавляют по каплям 4,8 г (50 ммолей) метилхлорформиата и 4,8 г (60 ммолей) пиридина. Затем перемешивают в течение ночи при комнатной температуре, после чего реакционную смесь экстрагируют с помощью разбавленной соляной кислоты и воды. Затем реакционную смесь отсасывают через силикагель, сушат над MgSO4 и концентрируют. После кристаллизации осадка этот последний тонко растирают и размешивают с циклогексаном. В результате получают 13,8 г (36 ммолей = 82%) указанного в заголовке соединения в виде бесцветного твердого вещества (Tразм = 109oC).
1H-ЯМР (CDCl3; δ в
част./млн):
7,8 (s, 1H, фенил); 7,6 (s, шир., 1H, NH); 7,4 (s, 2H, фенил); 7,2 (m, 3H, фенил); 5,2 (s, 2H, OCH2); 3,8 (s, 3H, OCH3); 2,3 (s, 3H, CH3); 2,2 (s,
3H, CH3).
Пример 18. Метиловый эфир N-[2-(3'',4''-дихлорфенил-1'- метилиминооксиметил- 4')- 6-метилфенил]-N-пропаргилкарбаминовой кислоты (таблица 47, N 13).
Раствор из 1,9 г (5 ммолей) эфира карбаминовой кислоты из примера 16г в 20 мл диметилформамида при 25-30oC порциями обрабатывают 0,15 г (6,3 ммоля) гидрида натрия. После того, как газообразование заканчивается, добавляют 0,75 г (6,3 ммоля) пропаргилбромида и перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь разбавляют водой и водную фазу трижды экстрагируют с помощью простого метил-трет.-бутилового эфира. Соединенные органические фазы экстрагируют водой, сушат над MgSO4 и концентрируют. В результате получают 1,4 г (3,3 ммоля = 67%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР(CDCl3; δ в част./млн):
7,75 (s, шир., 1H, фенил); 7,2-7,6 (m, 5H, фенил); 5,2
(dd, 2H, J = 12 Гц, OCH2); 4,4 (dd, шир., J = 16 Гц, NCH2; 3,65 (s, 3H, OCH3); 2,3 (s, 3H, CH3); 2,25 (s, шир. , 1H, C≡CH ); 2,2 (s, 3H, CH3); кроме того, в спектре1H-ЯМР имеются сигналы примерно 20% амид-ротамера.
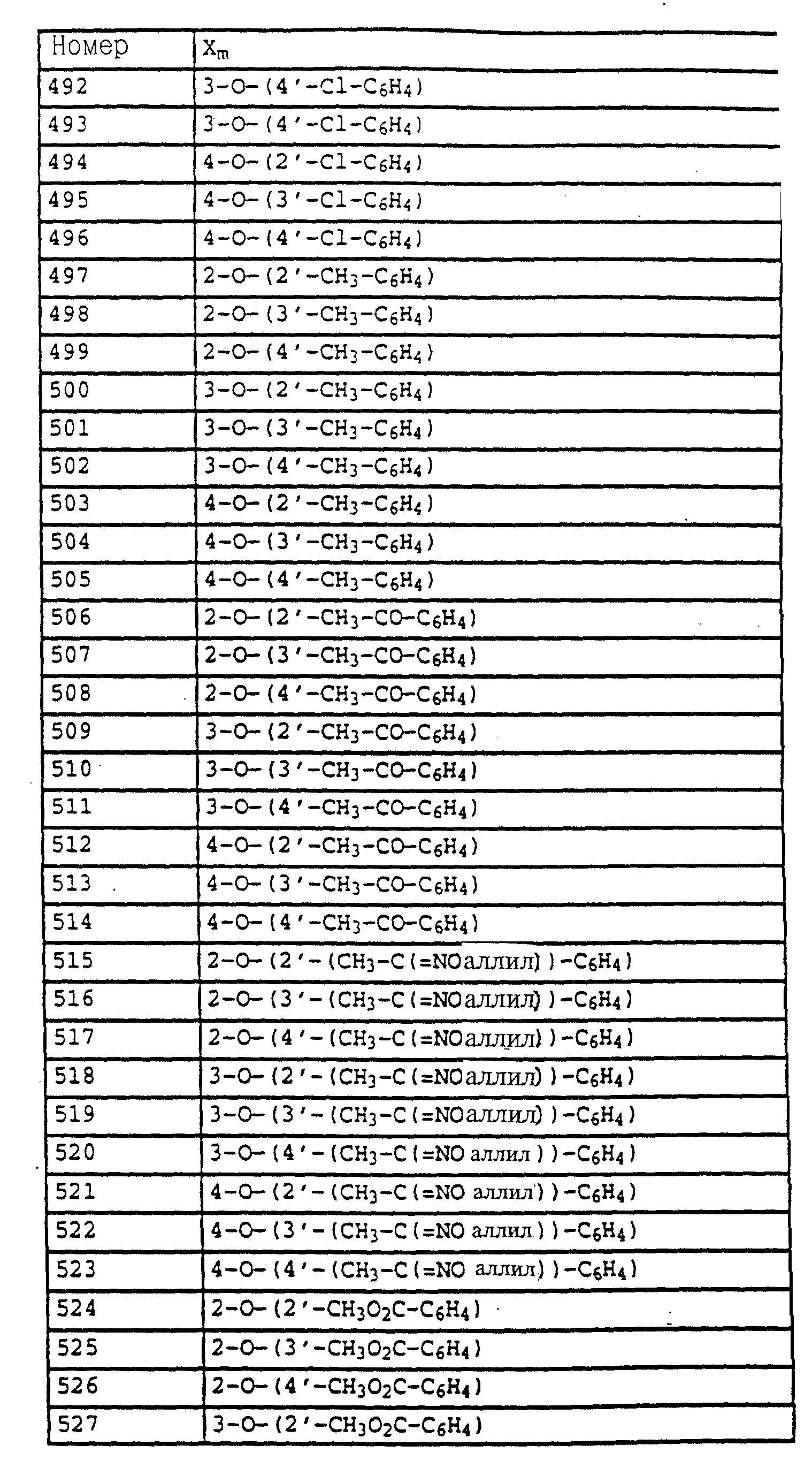
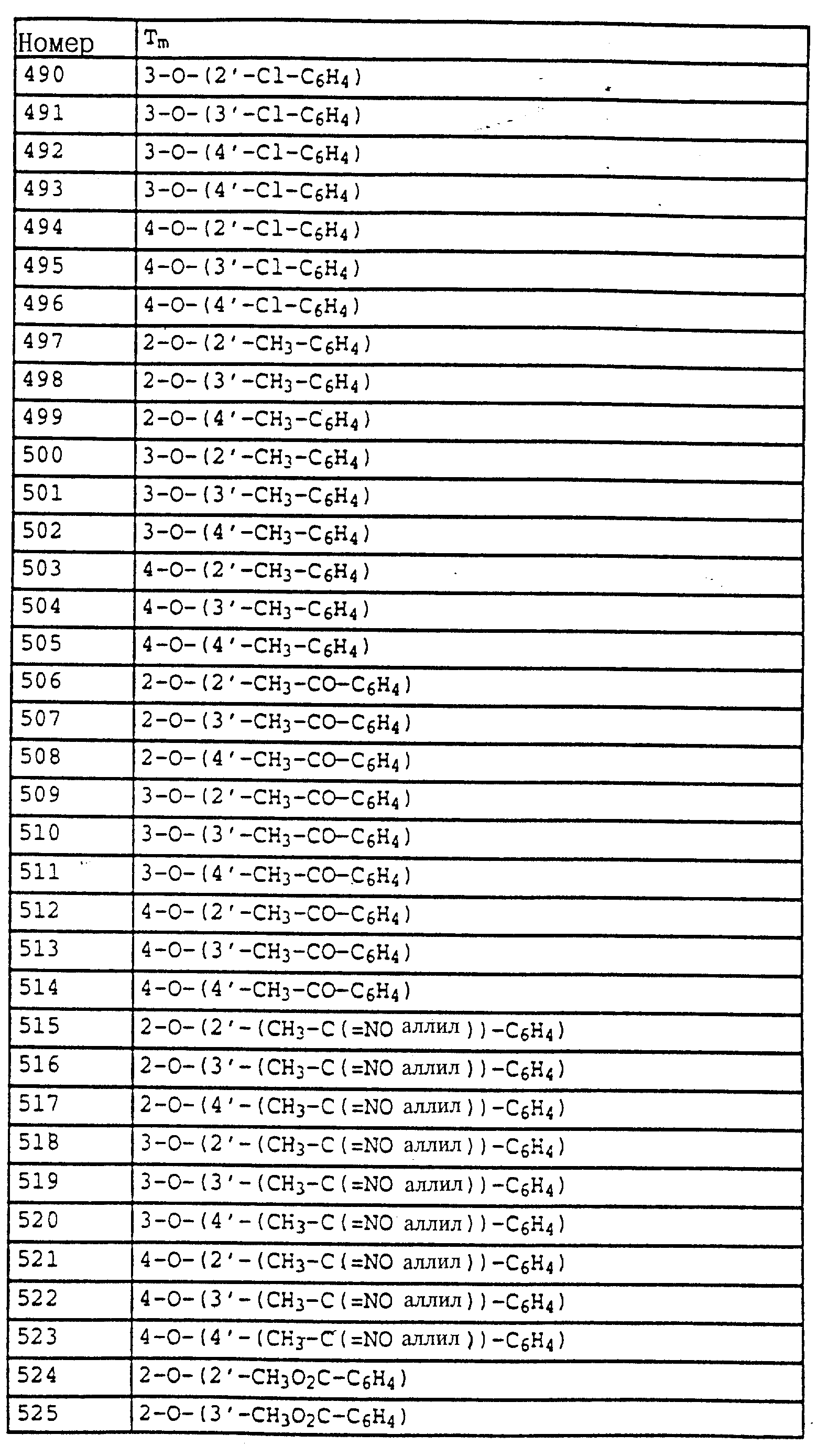
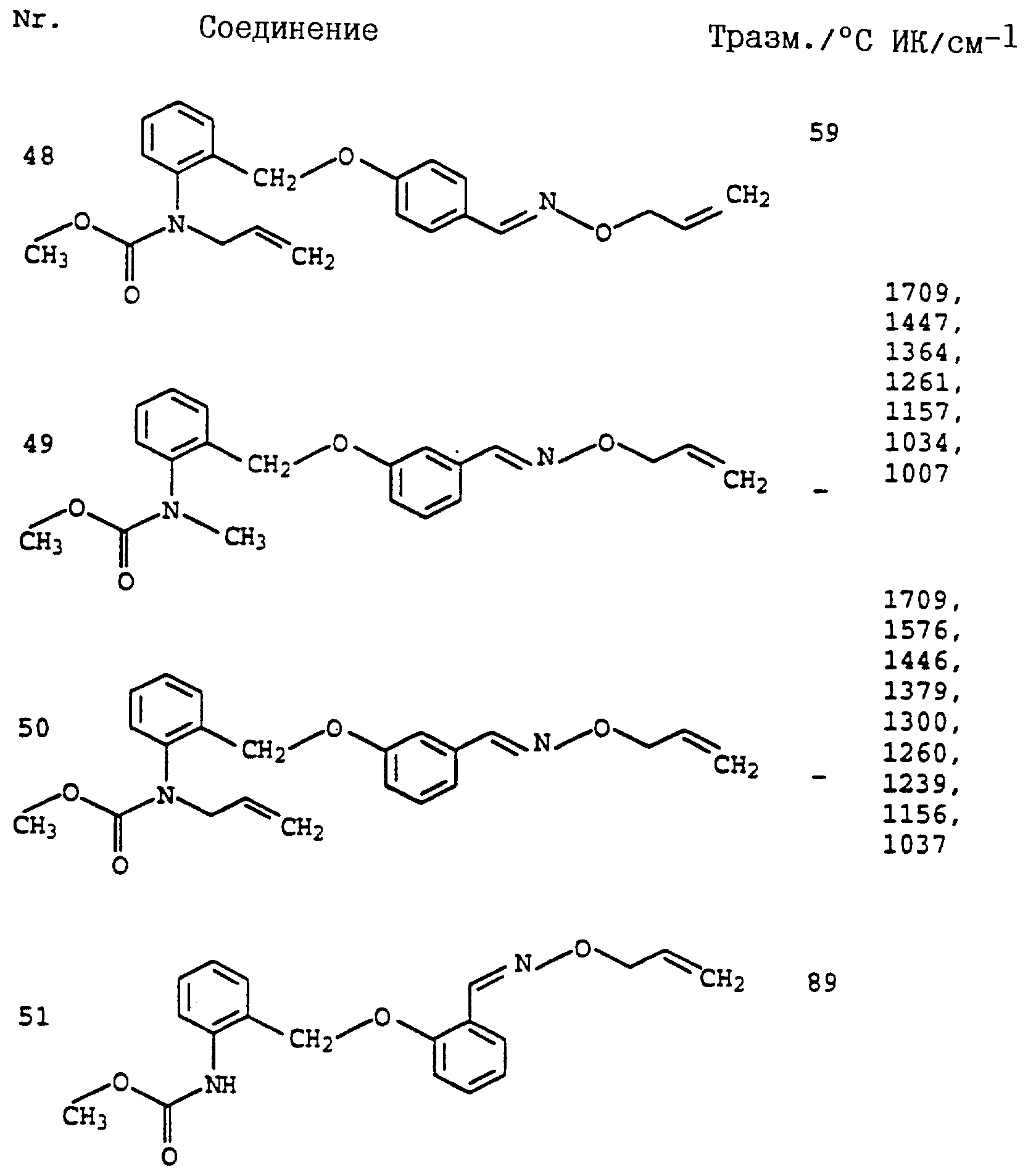
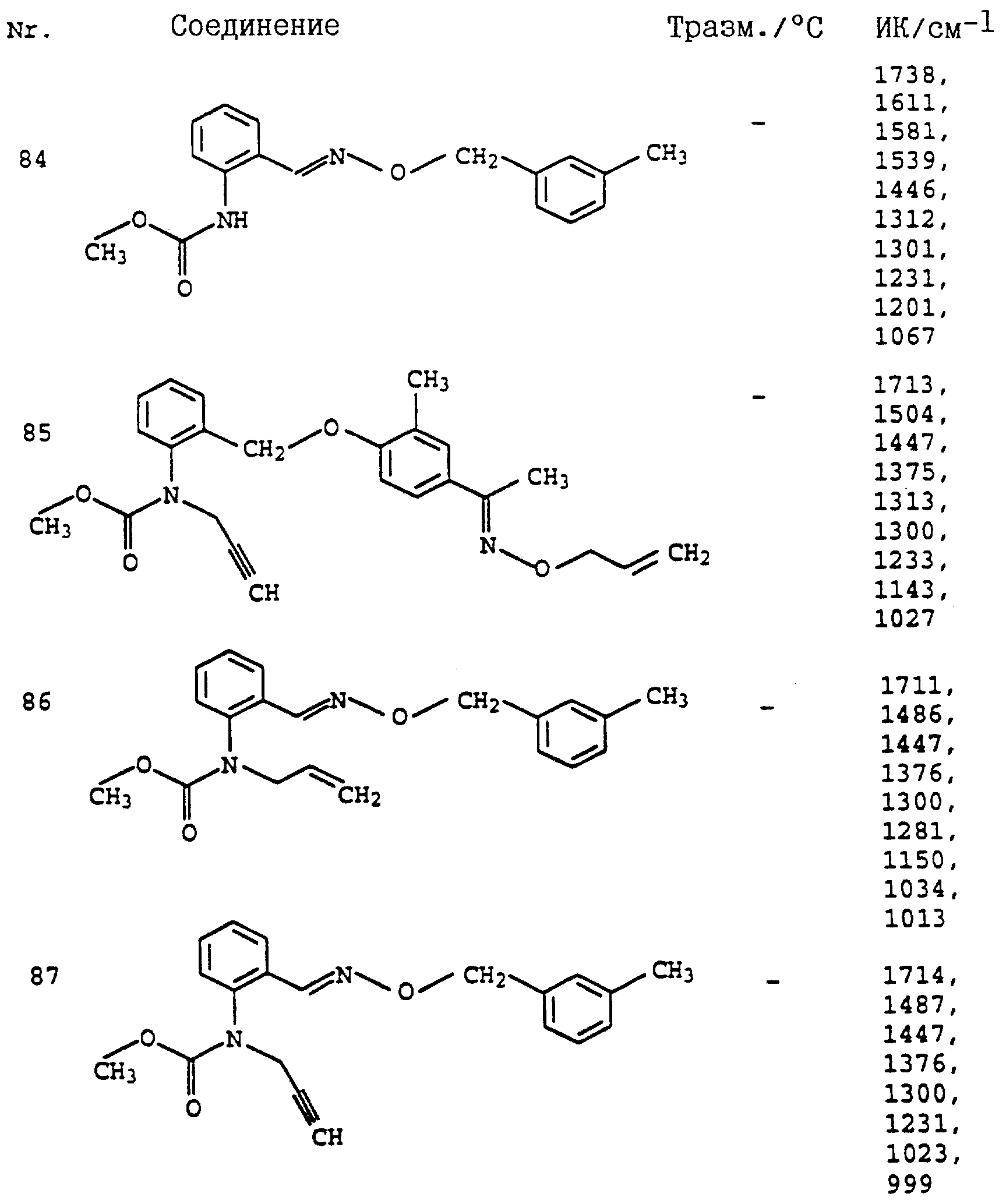
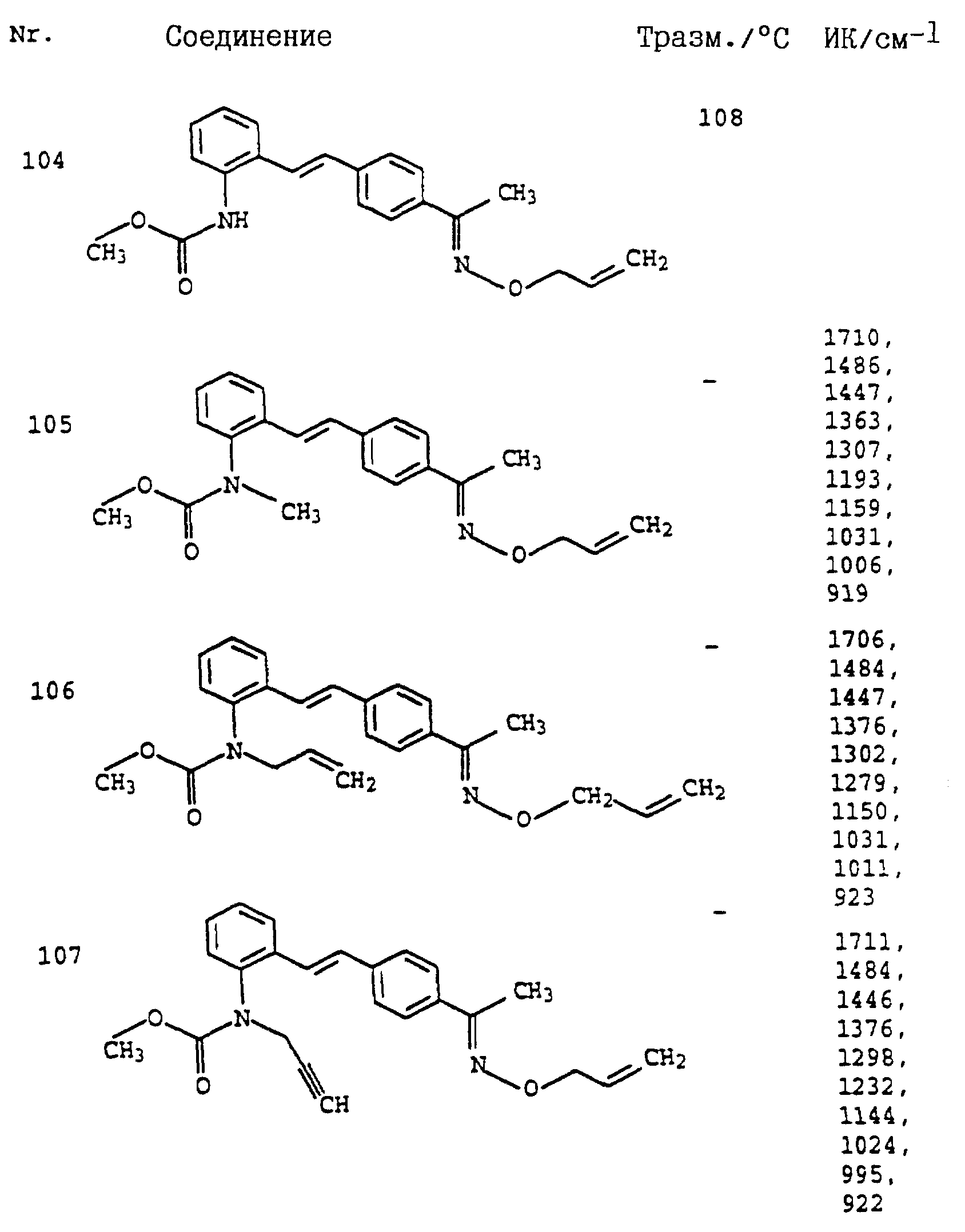
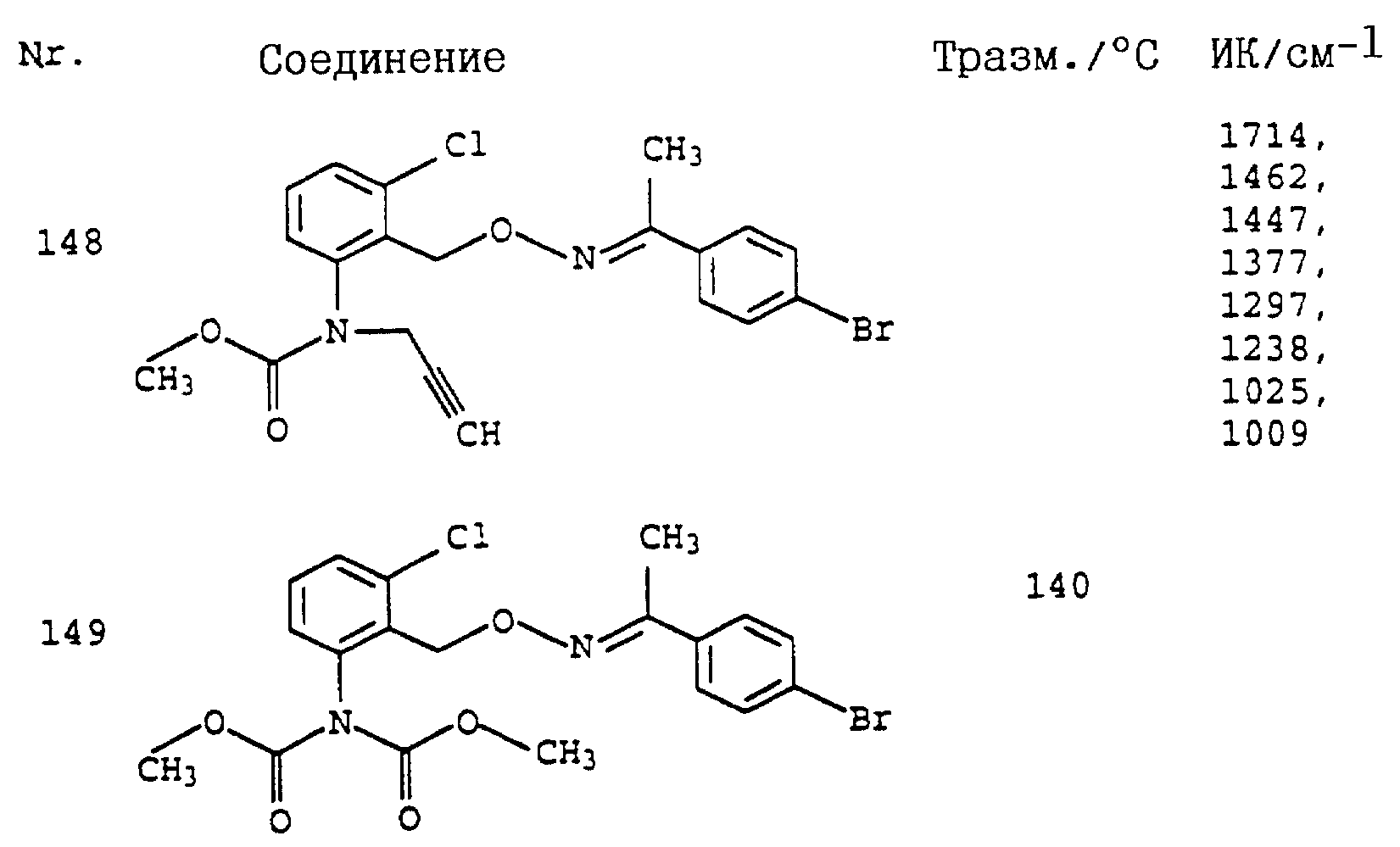
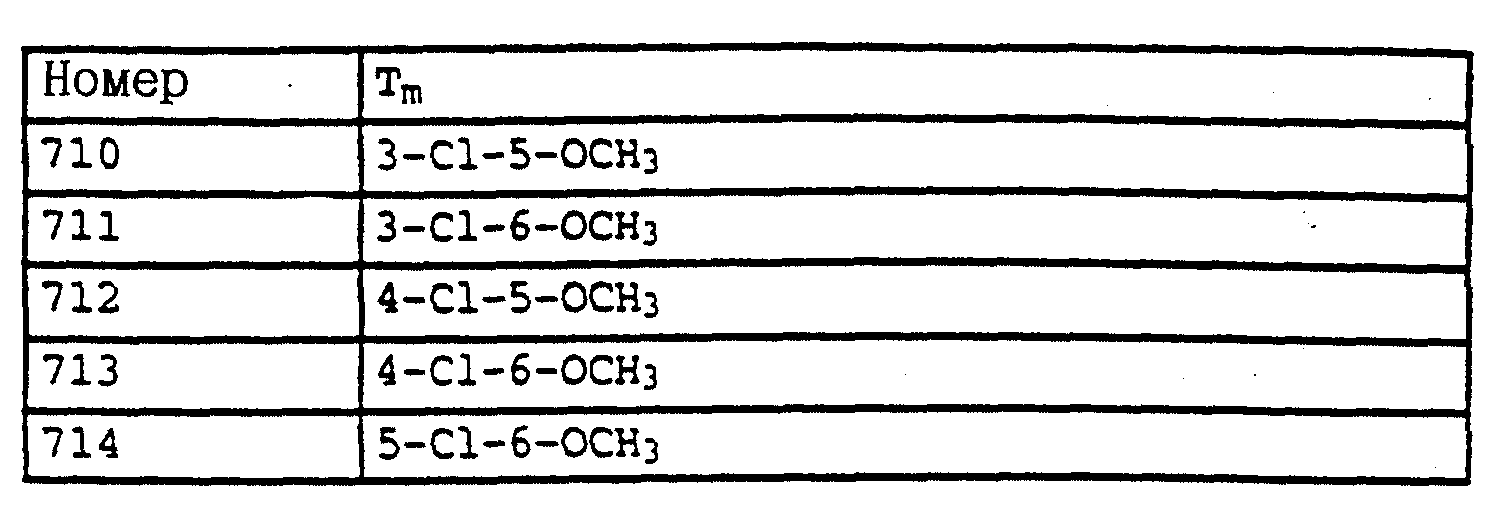
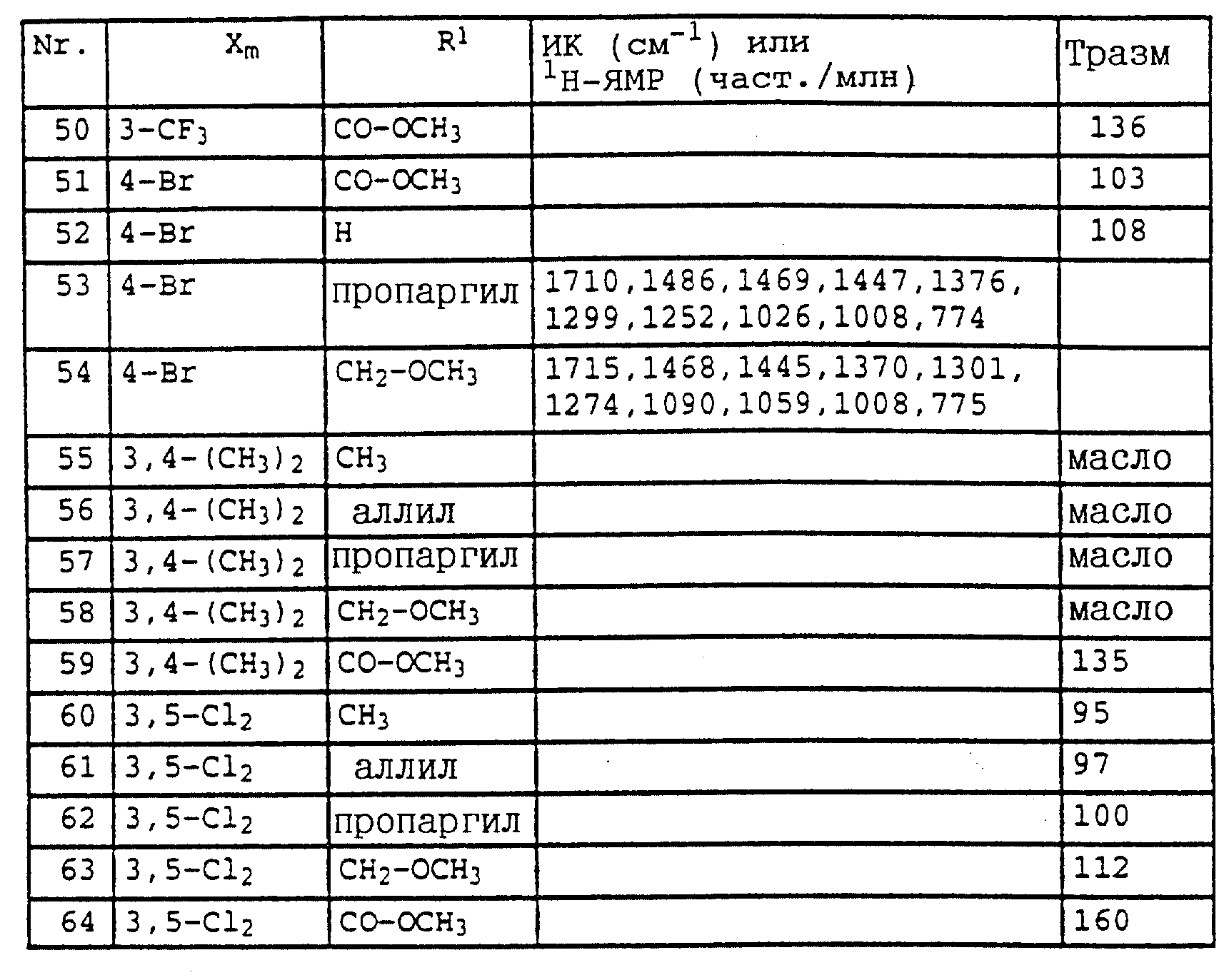
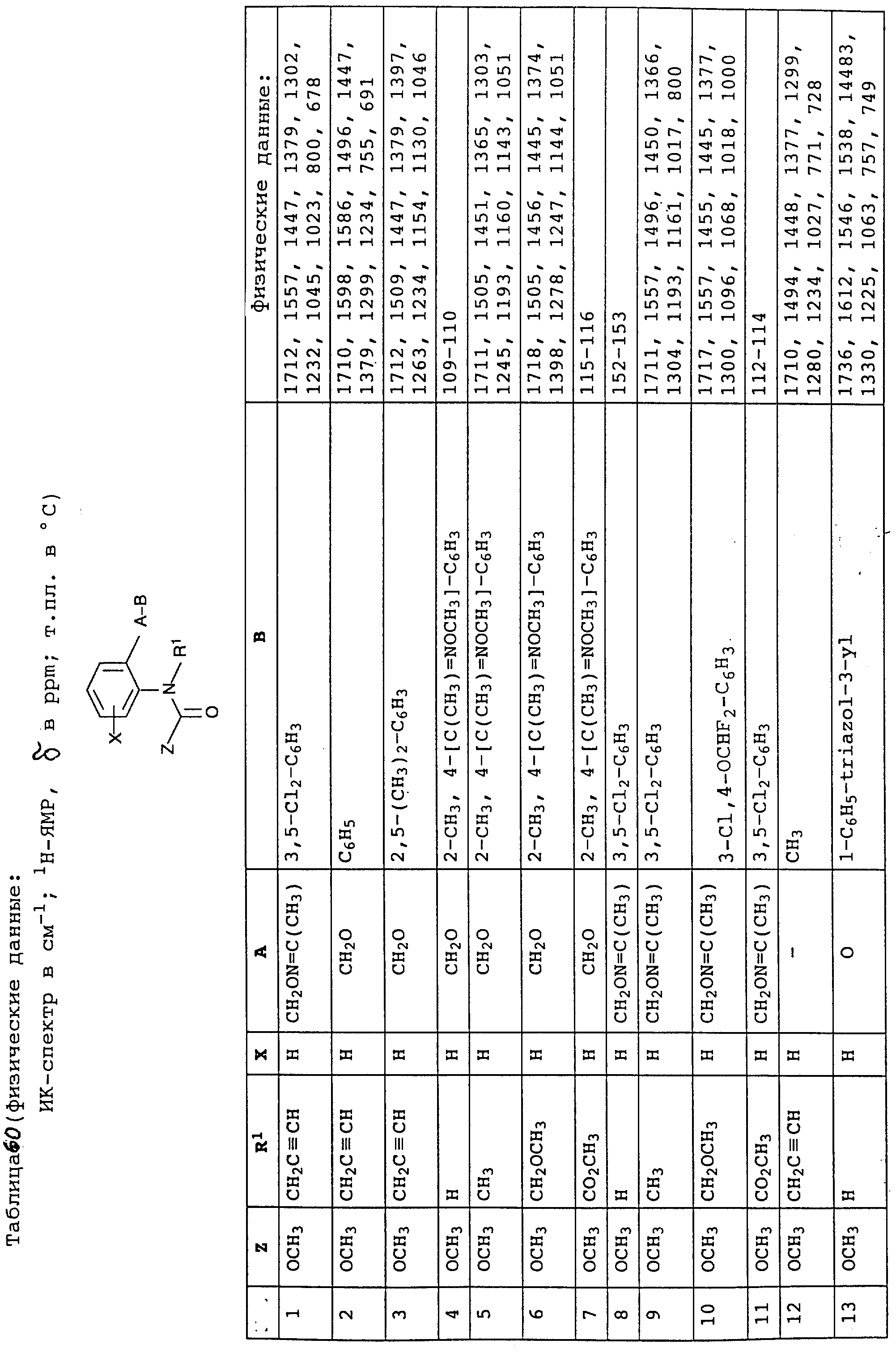
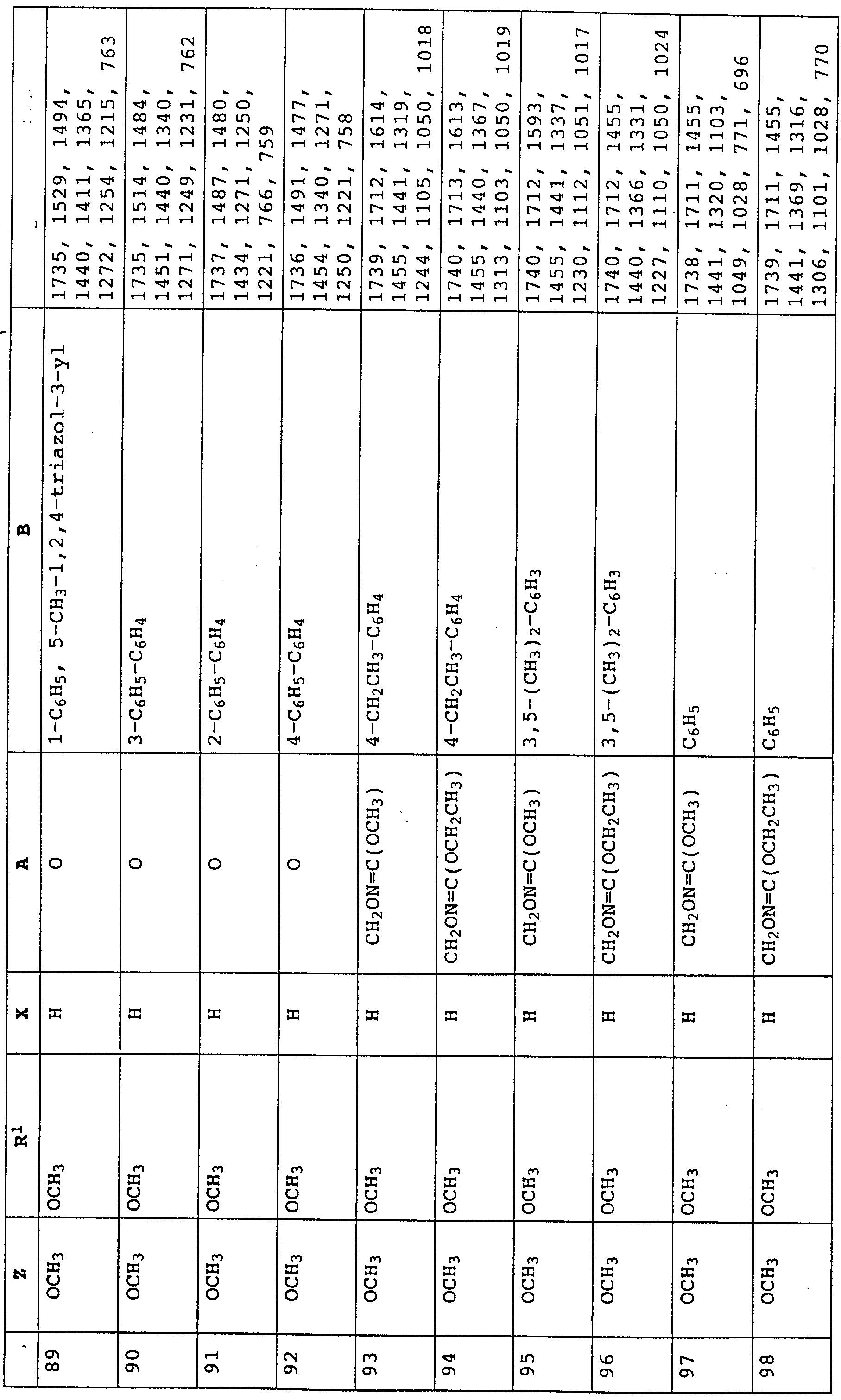
По методике, соответствующей описанной, могут быть получены соединения, представленные в табл. 41-51, 60. (см. в конце описание).
Новые соединения пригодны для использования в качестве фунгицидов.
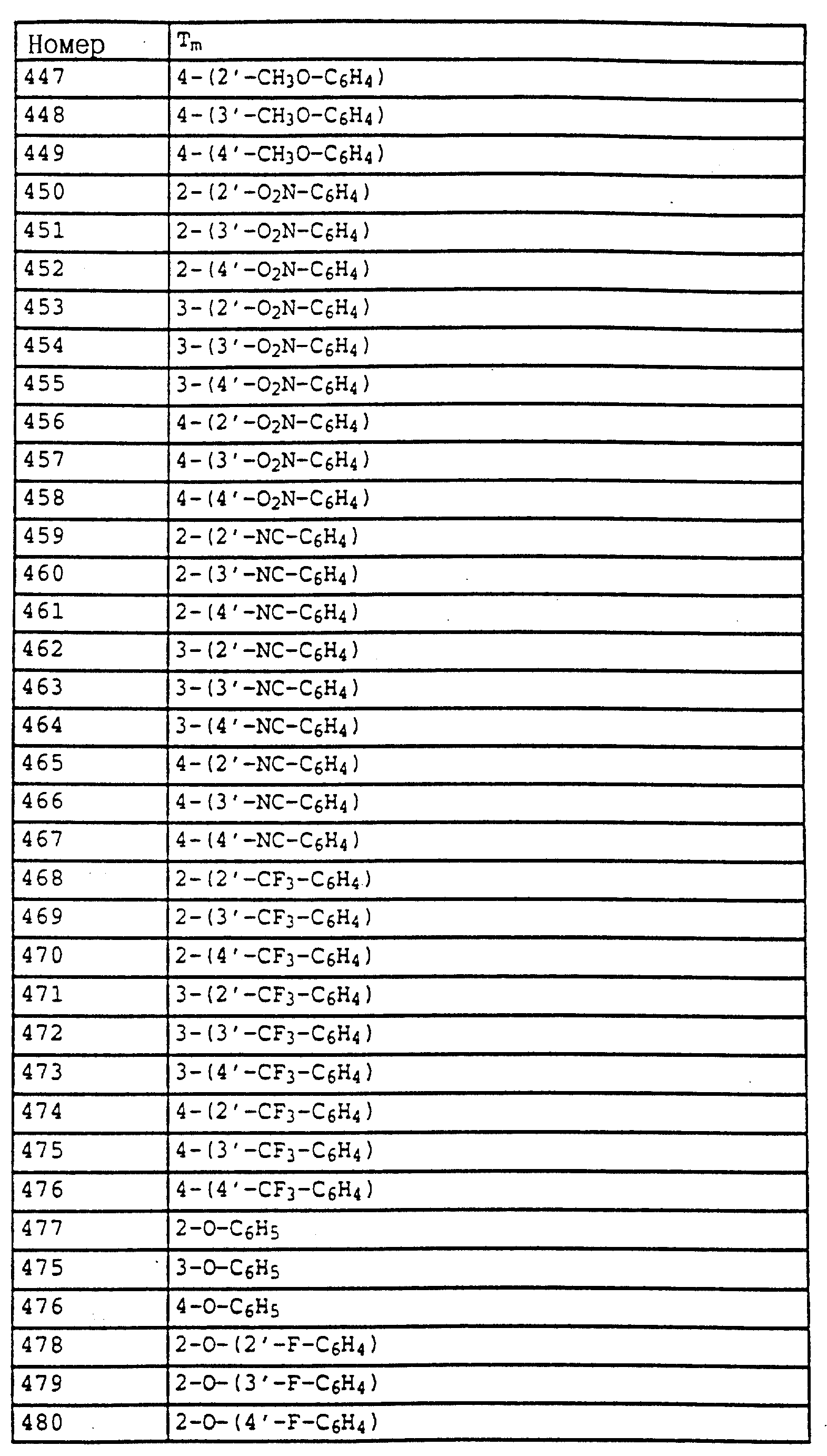
Предлагаемые согласно изобретению фунгицидные соединения, соответственно содержащие их средства могут применяться, например, в виде непосредственно разбрызгиваемых растворов, порошков, суспензий, а также высокопроцентных водных, масляных либо иных суспензий или же дисперсий, эмульсий, масляных дисперсий, паст, опыливающих средств, препаратов для внесения в почву либо гранулятов с использованием при этом различных методов, как разбрызгивание, опрыскивание, опыливание, внесение в почву или полив. Выбор указанных форм применения определяется целями применения, но во всех случаях должно быть обеспечено максимально равномерное распределение активных веществ согласно изобретению.
Обычно растения опрыскивают или опыливают активными веществами либо ими обрабатывают семена соответствующих растений.
Композиции изготавливают по известной методике, например, разбавлением активного вещества растворителями и/или наполнителями, при необходимости с применением эмульгаторов и диспергаторов, причем в случае использования воды в качестве разбавителя могут применять также и другие органические растворители в качестве вспомогательных средств. В качестве последних могут быть использованы в основном: растворители, такие как ароматические углеводороды (например, ксилол), хлорированные ароматические углеводороды (например, хлорбензолы), парафины (например, нефтяные фракции), спирты (например, метанол, бутанол), кетоны (например, циклогексанон), амины (например, этаноламин, диметилформамид) и вода; наполнители, различные виды природной минеральной муки (например, каолины, глиноземы, тальк, мел) и синтетическая минеральная мука (например, высокодисперсная кремневая кислота, силикаты); эмульгаторы, такие как неионогенные и анионные эмульгаторы (например, эфир полиоксиэтилена и жирного спирта, алкилсульфонаты и арилсульфонаты) и диспергаторы, такие как отработанный лигнинсульфитный щелок и метилцеллюлоза.
В качестве поверхностно-активных веществ могут использоваться соли щелочных и щелочноземельных металлов, аммониевые соли ароматических сульфокислот, например, лигнинсульфокислоты, фенолсульфокислоты, нафталинсульфокислоты и дибутилнафталинсульфокислоты, а также соли жирных кислот, алкил- и алкиларилсульфонатов, алкиловые, лауриловые эфиры сульфатов и сульфатов спиртов жирного ряда, а также соли сульфатированных гекса-, гепта- и октадеканолов, и гликолевого эфира жирных спиртов, продукты конденсации сульфированного нафталина и его производных и формальдегида, продукты конденсации нафталина, нафталинсульфокислот и фенола и, формальдегида, эфир полиоксиэтилена и октилфенола, этоксилированный изооктил-, октил- либо нонилфенол, алкилфенол-, трибутилфенилполигликолевые эфиры, алкиларилполиэфиры спиртов, изотридециловый спирт, конденсаты жирных спиртов и окиси этилена, этоксилированное касторовое масло, полиоксиэтиленалкиловый эфир или полиоксипропилен, ацетат полигликолевого эфира и лаурилового спирта, сложные сорбитовые эфиры, отработанный лигнинсульфитный щелок или метилцеллюлоза.
Порошковые препараты, препараты для внесения в почву и препараты для опыливания могут изготавливаться путем смешивания либо совместного измельчения активных веществ с твердым наполнителем.
Грануляты, например, грануляты в оболочке, пропиточные и гомогенные грануляты могут быть получены путем связывания активных веществ с твердыми наполнителями. В качестве твердых наполнителей могут использоваться минеральные земли, такие как силикагель, кремневые кислоты, кизельгур, силикаты, тальк, каолин, известняк, известь, мел, болюс, лесс, глина, доломит, диатомовая земля, сульфат кальция и магния, окись магния, измельченные синтетические материалы, удобрения, как сульфат аммония, фосфат аммония, нитрат аммония, мочевина и растительные продукты, как мука зерновых, мука из древесной коры, древесная мука и мука из ореховой скорлупы, целлюлозные порошки или какие-либо другие твердые наполнители.
Примерами таких композиций являются:
I. раствор из 90 мас.частей соединения из таблицы 7, N 1 (7/1) и 10 мас. частей N-метил- -α- пирролидона, пригодный для применения в
виде мельчайших капель;
II. смесь из 20 мас.частей соединения 7/2, 80 мас.частей ксилола, 10 мас.частей продукта присоединения 8-10 молей окиси этилена к 1 молю N-моноэтаноламида олеиновой
кислоты, 5 мас.частей кальциевой соли додецилбензолсульфокислоты, 5 мас.частей продукта присоединения 40 молей окиси этилена к 1 молю касторового масла; благодаря равномерному распределению раствора в
воде получают дисперсию;
III. водная дисперсия из 20 мас.частей соединения 7/3, 40 мас.частей циклогексанона, 30 мас.частей изобутанола, 20 мас.частей продукта присоединения 40 молей окиси
этилена к 1 молю касторового масла;
IV. водная дисперсия из 20 мас.частей соединения 7/4, 25 мас.частей циклогексанола, 65 мас.частей минерально-масляной фракции с температурой кипения
210-280oC и 10 мас.частей продукта присоединения 40 молей окиси этилена к 1 молю касторового масла;
V. измельченная в молотковой мельнице смесь из 80 мас.частей соединения, 7/5, 3
мас. частей натриевой соли диизобутилнафталин -α- сульфокислоты, 10 мас. частей натриевой соли лигнинсульфокислоты из отработанного сульфитного щелока и 7 мас.частей геля кремневой кислоты;
благодаря равномерному распределению смеси в воде получают раствор для опрыскивания;
VI. тщательно перемешанная смесь из 3 мас.частей соединения 7/6 и 97 мас.частей тонко измельченного
каолина; этот препарат для опыливания содержит 3 мас.% активного вещества;
VII. тщательно перемешанная смесь из 30 мас.частей соединения 7/7, 92 мас.частей геля кремневой кислоты и 8
мас.частей парафинового масла, которое набрызгивают на поверхность этого геля; описанная композиция придает активному веществу хорошую адгезионную способность;
VIII. стабильная водная
дисперсия из 40 мас.частей соединения 7/8, 10 мас. частей натриевой соли конденсата фенолсульфокислоты-мочевины-формальдегида, 2 мас. частей силикагеля и 48 мас.частей воды, которую (дисперсию) можно
разбавлять дальше;
IX. стабильная масляная дисперсия из 20 мас.частей соединения 7/9, 2 мас. частей кальциевой соли додецилбензолсульфокислоты, 8 мас.частей полигликолевого эфира жирного
спирта, 20 мас.частей натриевой соли конденсата фенолсульфокислоты-мочевины-формальдегида и 68 мас.частей 25 парафинового минерального масла.
Новые соединения отличаются превосходной эффективностью против широкого спектра фитопатогенных грибов, прежде всего класса Ascomyceten и Basidiomyceten. Они обладают частично системным действием и могут применяться в качестве листовых и почвенных фунгицидов.
Особое значение они имеют для борьбы с целым рядом грибов при возделывании различных культурных растений, таких, как пшеница, рожь, ячмень, овес, рис, кукуруза, травы, хлопчатник, соя, кофе, сахарный тростник, виноград, фруктовые и декоративные растения, овощные растения, как огурцы, бобовые и тыквенные, а также для обработки семян указанных растений.
Предлагаемые соединения применяют для обработки грибов либо пораженных грибами семян, растений, материалов или почвы обладающим 5 фунгицидным действием необходимым количеством активных веществ. Такую обработку проводят до либо после заражения материалов, растений или семян грибами.
Соединения I особенно пригодны для борьбы со следующими болезнями растений:
Erysiphe graminis (настоящая мучнистая роса) на зерновых культурах,
Erysiphe cichoracearum и Sphaerotheca fuliginea на тыквенных,
Podosphaera leucotricha на яблоках,
Uncinula necator на виноградных,
Puccinia на зерновых,
Rhizoctonia на хлопчатнике и дернине,
Ustilago на зерновых и сахарном тростнике,
Venturia inaequalis на
яблоках,
Helminthosporium на зерновых,
Septoria nodorum на пшенице,
Botrytis cinerea (серая гниль) на землянике и виноградных,
Cercospora arachidicola на земляном
орехе,
Pseudocercosporella herpotrichoides на пшенице, ячмене,
Pyricularia oryzae на рисе,
Phytophthora infestans на картофеле и томатах,
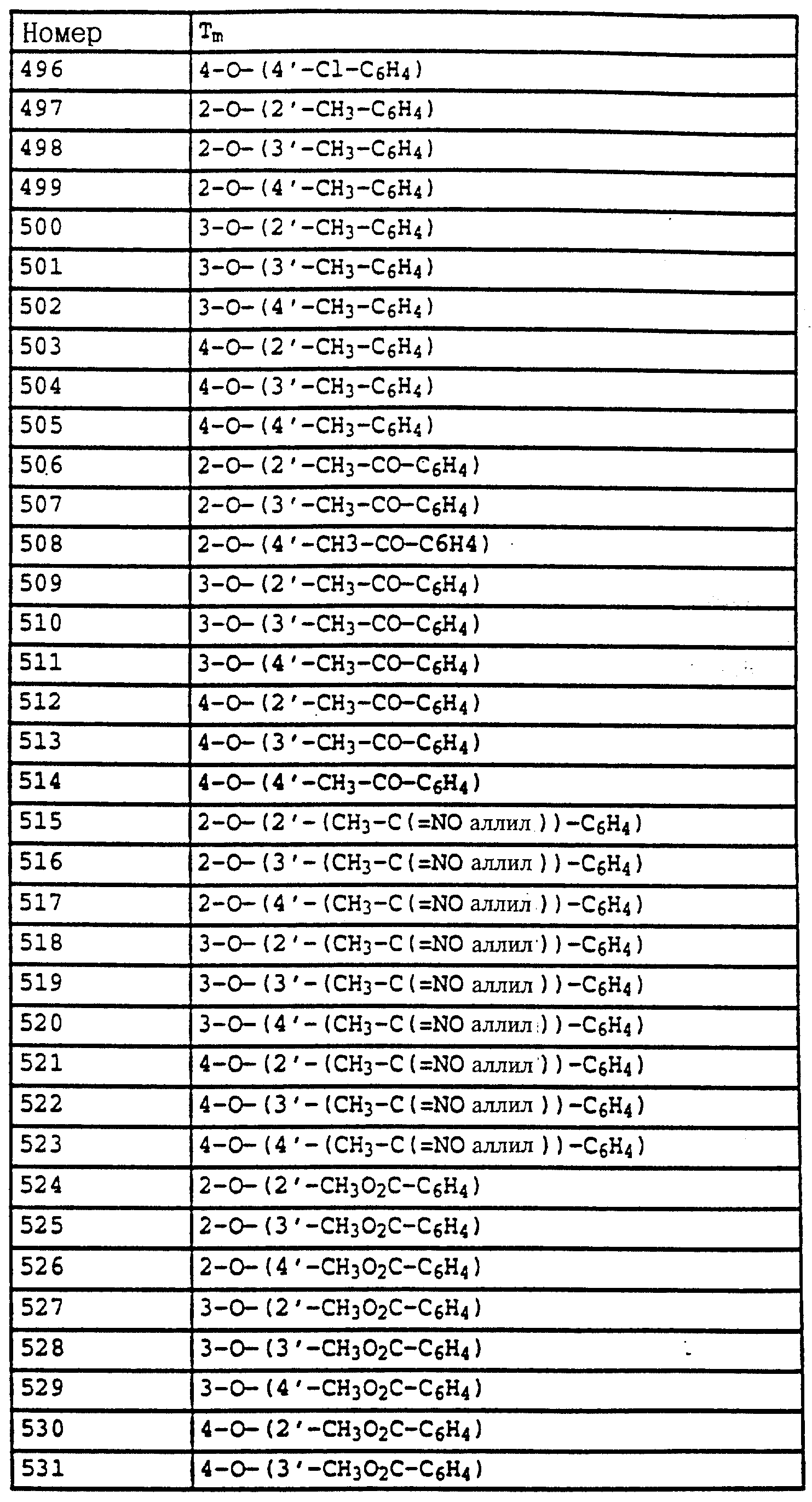
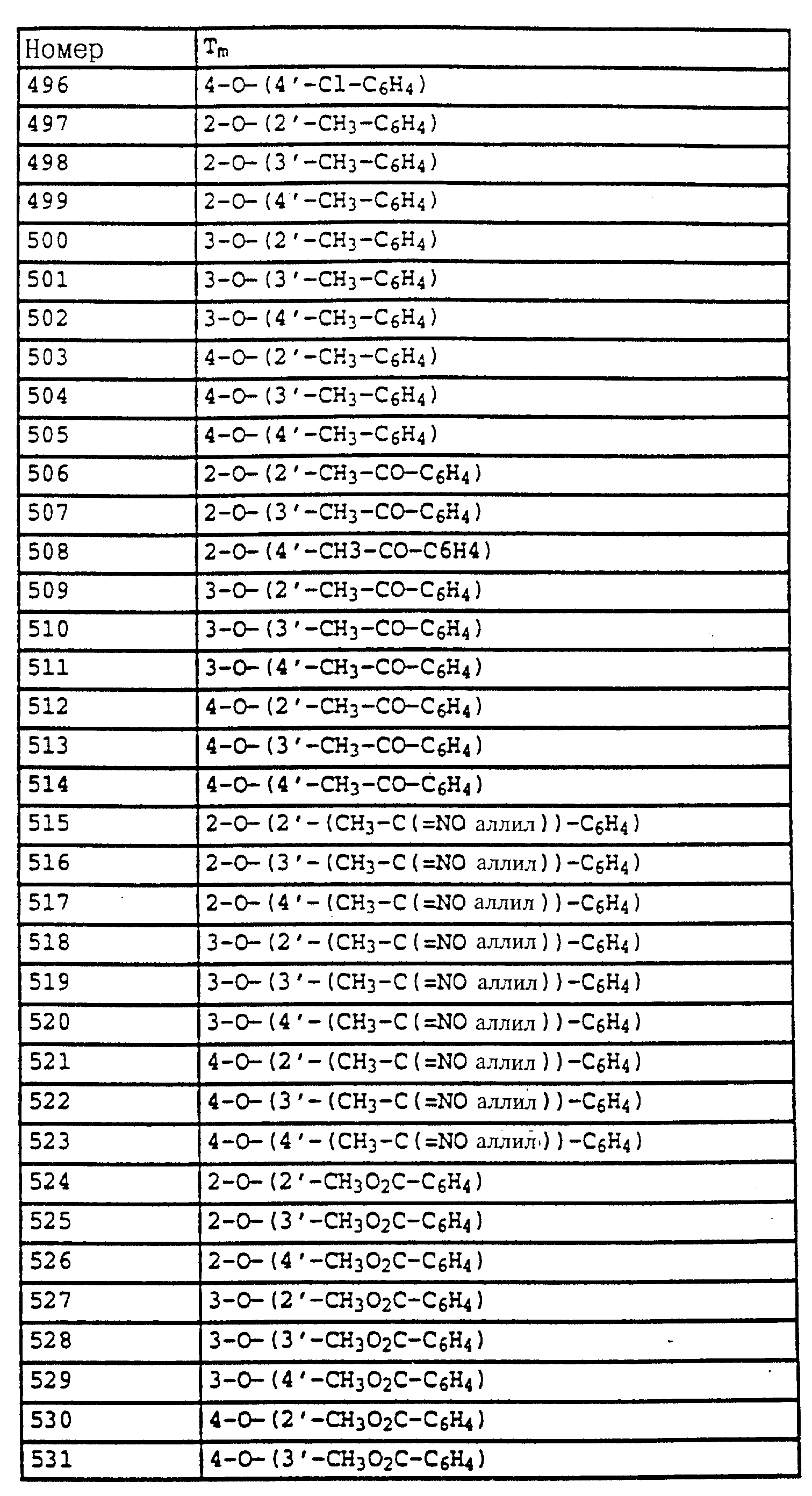
Fusarium и Verticillium на
различных растениях,
Plasmopara viticola на виноградных,
Alternaria на овощах и фруктах.
Новые соединения могут находить применение также для защиты материалов, в частности, при сохранении древесины, например, против Paecilomyces variotii.
Фунгицидные препараты содержат, как правило, от 0,1 до 95 мас.%, предпочтительно от 0,5 до 90 мас.% активного вещества. Применяемые количества активного вещества в зависимости от желаемого эффекта составляют 0,02-3,0 кг/га.
При обработке семенного материала активное вещество используют, как правило, в количествах от 0,001 до 50 г, предпочтительно от 0,01 до 10 г на 1 кг семян.
Предлагаемые согласно изобретению средства, используемые в качестве фунгицидов, могут применяться также вместе с другими активными веществами, например, с гербицидами, инсектицидами, регуляторами роста, фунгицидами или же с удобрениями. При этом во многих случаях при смешивании с фунгицидами получают заметное расширение спектра фунгицидной эффективности.
Примеры применения.
В качестве сравнительных активных веществ использовали (A) изопропиловый эфир N-фенилкарбаминовой кислоты - известный из патента GB 574995, (Б) изопропиловый эфир N-3-хлорфенилкарбаминовой кислоты - известный из 15 патента GB 574995 - и (В) метиловый эфир N-3, 4-дихлорфенилкарбаминовой кислоты - известный из патента BE 612550.
Примеры применения.
Пример 1. Эффективность против мучнистой росы пшеницы.
Листья выращенных в горшках проростков пшеницы сорта "Friihgold" опрыскивали водным раствором, содержащим в сухом веществе 80% активного вещества и 20% эмульгатора, и через 24 часа, после того как нанесенная жидкость для опрыскивания высыхала, производили опыливание спорами мучнистой росы пшеницы (Erysiphe graminis var. tritici). Затем опытные растения помещали в теплицу и выдерживали там при температуре 20-22oC и 75-80% относительной влажности воздуха. Через 7 дней определяли степень поражения мучнистой росой.
Полученные результаты показывают, что активные вещества из таблицы 7 N 1-4, 8, 9 20, 23, 31, 33-36, 42, 43, 44, 47, 48, 52-57, 60-64, 67, 69, 70-72, 74, 78, 79, 85, 87, 89, 90-95, 104-107 при их применении в виде раствора для опрыскивания, содержащего 250 част./млн активного вещества, обладают более эффективным фунгицидным действием (95%) по сравнению с известными активными веществами: А (45%), Б (45%) и В (45%).
Пример 2. Эффективность против Pyricularia oryzae (протективно).
Листья выращенных в горшках проростков риса сорта "Bahia" опрыскивали до появления капельного слоя водными эмульсиями, содержащими в сухом веществе 80% активного вещества и 20% эмульгатора, и через 24 часа инокулировали водной суспензией из спор Pyricularia oryzae. Затем опытные растения помещали в климатические камеры и выдерживали там при температуре 22-24oC и 95-99% относительной влажности воздуха. Через 6 дней определяли степень поражения растений.
Полученные результаты показывают, что активные вещества из таблицы 7, N 1, 2, 12, 18, 19, 22, 29, 39, 40, 42, 47, 49, 50, 52-54, 60-63, 69-74, 81, 83, 85, 87, 89-92, 94, 95, 104-107 при их применении в виде раствора для опрыскивания, содержащего 250 част./млн активного вещества, обладают более высокой фунгицидной эффективностью (95%) по сравнению с известными активными веществами: А (30%), 6 (30%) и В (30%).
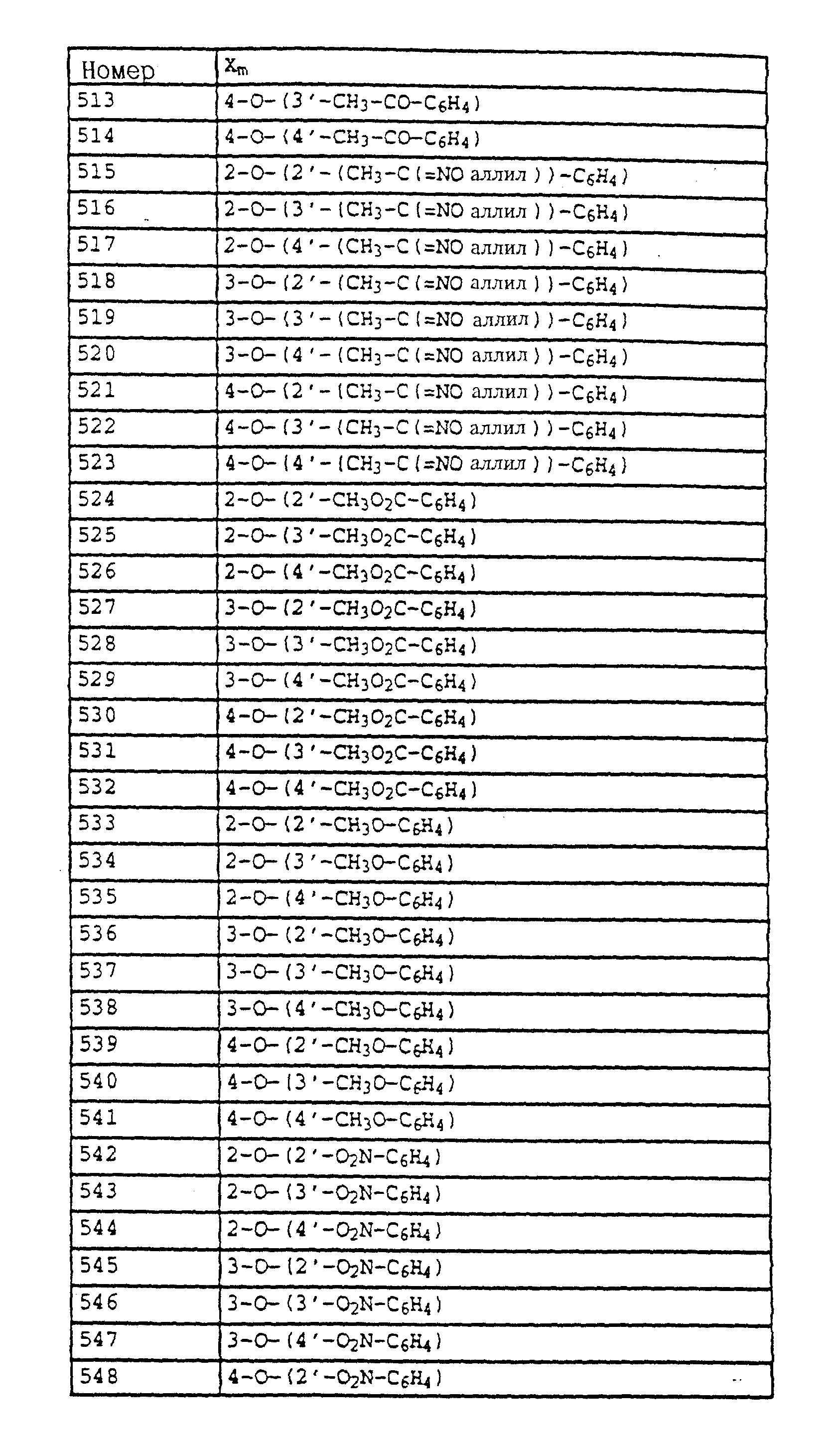
Пример применения 3. Эффективность против мучнистой росы пшеницы.
Листья выращенных в горшках проростков пшеницы сорта "Fruhgold" опрыскивали водным раствором, содержащим в сухом веществе 80% активного вещества и 20% эмульгатора, и через 24 часа, после того как нанесенная жидкость для опрыскивания высыхала, производили опыливание спорами мучнистой росы (Erysiphe graminis var. tritici) пшеницы. Затем опытные растения помещали в теплицу и выдерживали там при температуре 20-22oC и 75-80% относительной влажности воздуха. Через 7 дней определяли степень поражения мучнистой росой.
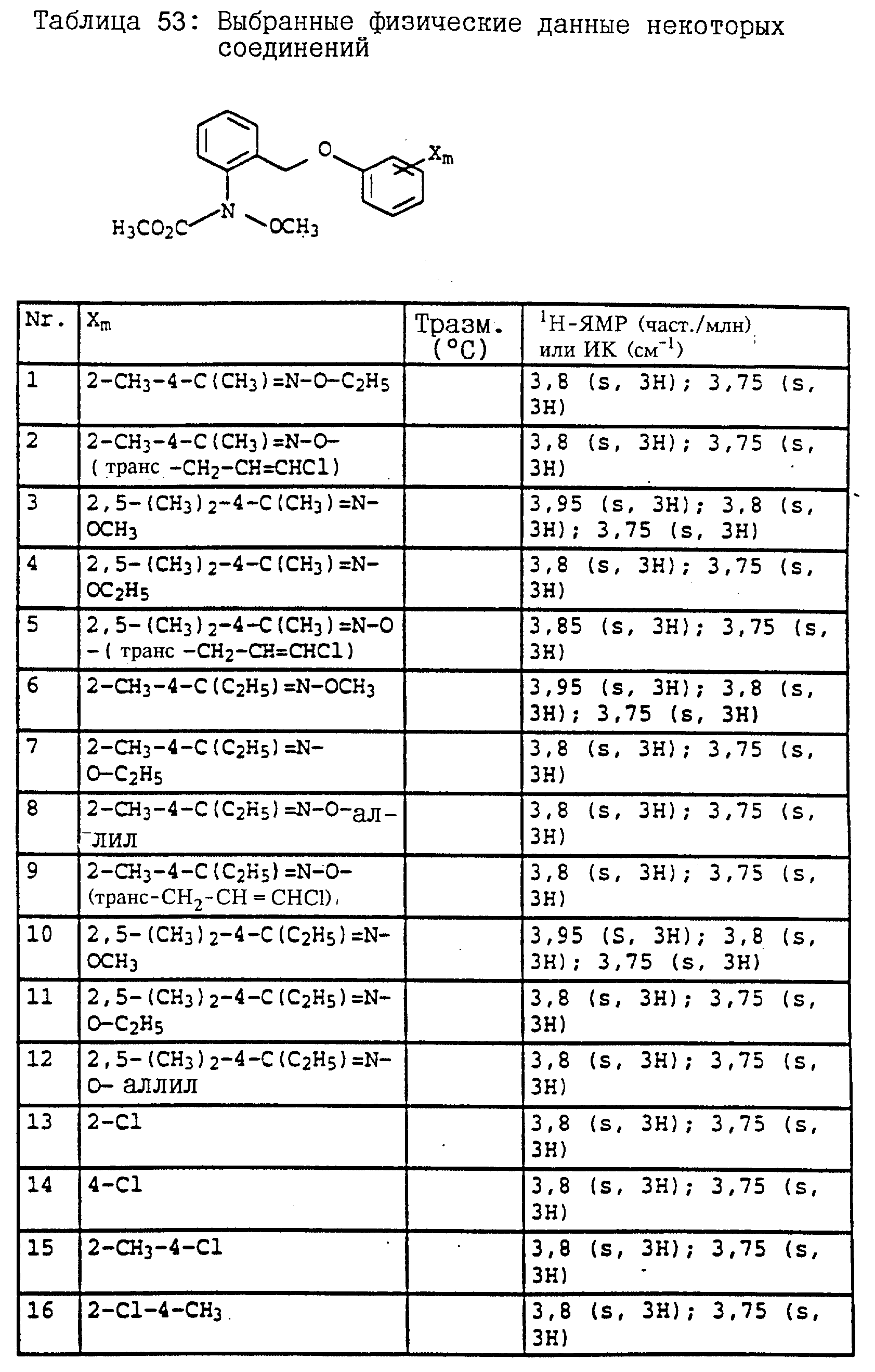
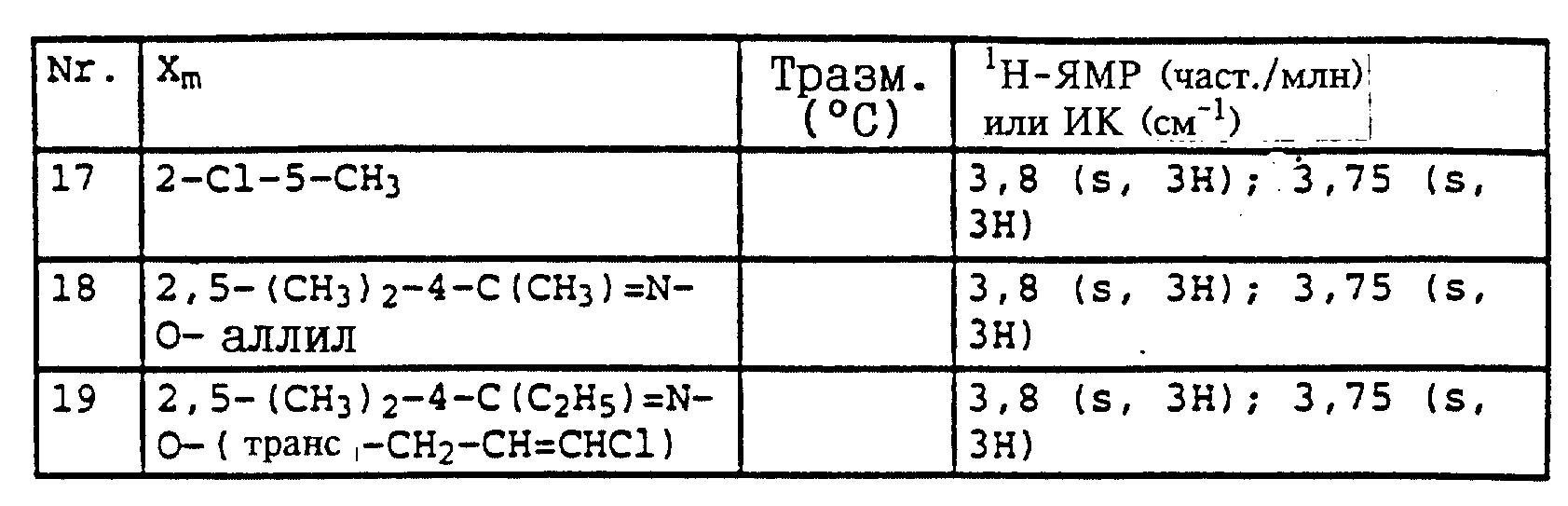
Полученные результаты показывают, что активные вещества из таблицы 14, N 3, из таблицы 21, N 3 и 4, из таблицы 48, N 1, 3-11, 15, 17-44, из таблицы 14, N 3, 7-11, 13-18, 20, 23, из таблицы 52, N 1-19, из таблицы 53, N 1-17, при их применении в виде раствора для опрыскивания, содержащего 250 част. /млн активного вещества, обладает более эффективным фунгицидным 5 действием (100%) по сравнению с известными активными веществами А, Б и В: (все соответственно 15%).
Пример применения 4. Эффективность против Pyricularia oryzae (протективно), Листья выращенных в горшках проростков риса сорта "Bahia" опрыскивали до появления капельного слоя водными эмульсиями, содержащими в сухом веществе 80% активного вещества и 20% эмульгатора, и через 24 часа инокулировали водной суспензией из спор Pyricularia oryzae. Затем опытные растения помещали в климатические камеры и выдерживали там при температуре 22-24oC и 95-99% относительной влажности воздуха. Через 6 дней определяли степень поражения растений.
Полученные результаты показывают, что активное вещество из таблицы 14, N 3, из таблицы 14 N 3, 7-11, 13-18, 20, 21, 22, 24, из таблицы 52, N 1-20, из таблицы 53, N 1-17, из таблицы 21, N 3 и 4, из таблицы 38, N 4 и 5, из таблицы 47, N 4, 7, 10, 16, 20-25, 41, 42, 55-59, из таблицы 48, N 1, 4-8, 11, 20-44 при его применении в виде раствора для опрыскивания, содержащего 250 част. /млн, обладает более эффективным фунгицидным действием (100%) по сравнению с известными активными веществами А, Б и В: все соответственно 0%.
Пример применения 5. Эффективность против Botrytis cinerea
Сеянцы стручкового перца сорта "Neusiedler Ideal Elite" после фазы полного
образования 4-5 листьев опрыскивали до появления капельного слоя водными суспензиями, содержащими в сухом веществе 80% активного вещества и 20% эмульгатора. После высыхания слоя нанесенной жидкости
растения опрыскивали взвесью конидий гриба Botrytis cinerea, после чего их при температуре 22-24oC помещали в камеру с высокой влажностью воздуха. Через 5 дней болезнь на необработанных
контрольных растениях развивалась настолько сильно, что образовавшийся на листьях некроз покрывал большую часть этих последних.
Активное вещество - Поражение (в%) листьев после
обработки водной композицией с содержанием 500 част./млн активного вещества
Таблица 30, активное вещество N 2 - 5
Сравнительное вещество А - 100
Сравнительное вещество Б
- 100
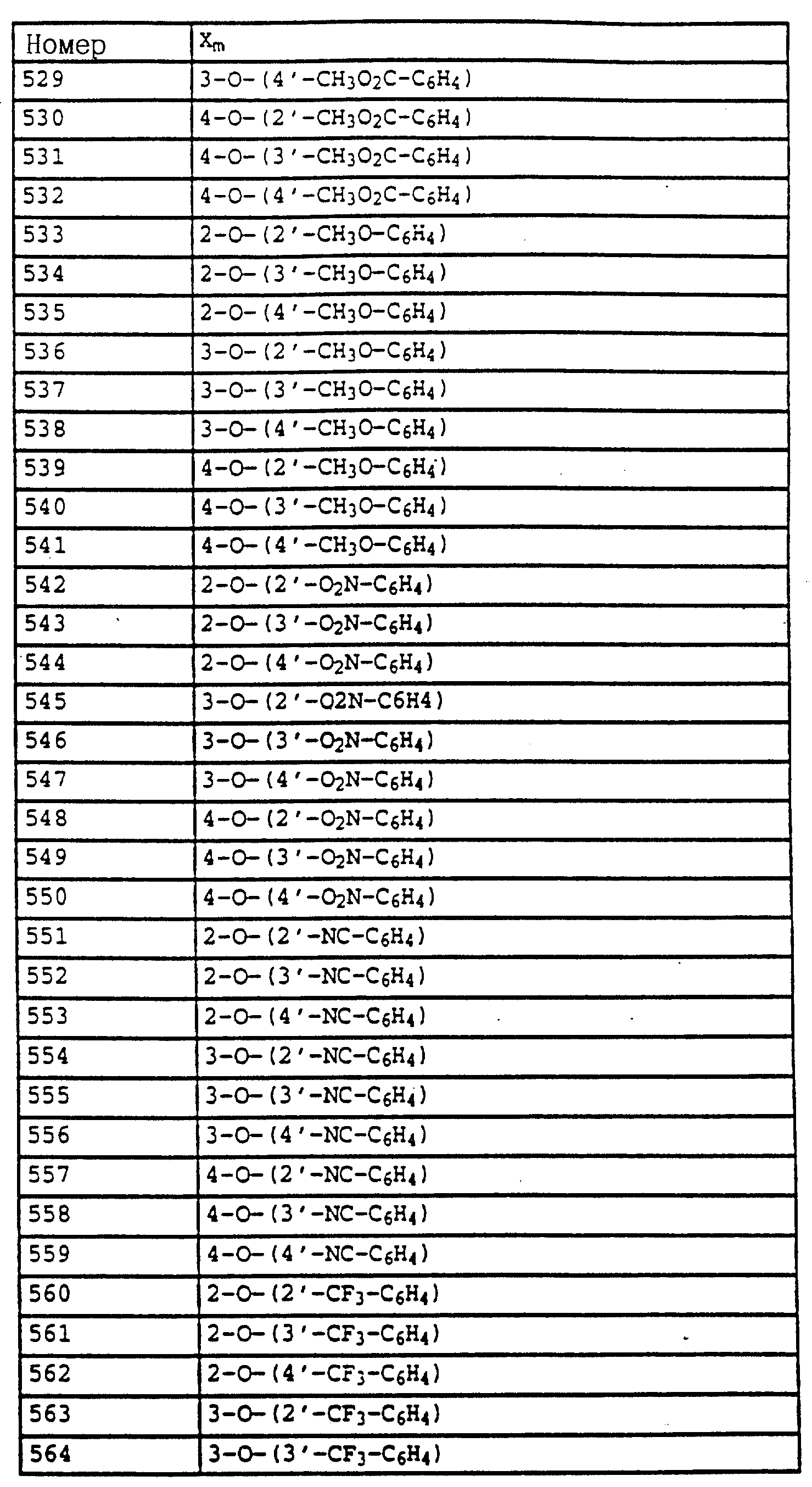
Сравнительное вещество В - 100
Без обработки - 100
Пример применения 6.Эффективность против Plasmopara viticola Листья выращенных в горшках виноградных сорта "Muller
Thurgau" опрыскивали водным раствором, содержащим в сухом веществе 80% активного вещества и 20% эмульгатора. Для выявления продолжительности действия активных веществ растения после высыхания слоя
нанесенной жидкости на 8 дней помещали в теплицу. Лишь после этого листья инфицировали взвесью из зооспор Plasmopara viticola (ложная мучнистая роса виноградных). Затем растения помещали сначала на 48
часов в насыщенную водяными парами камеру и выдерживали там при температуре 24oC, а затем на 5 дней в теплицу, где 1 выдерживали при температуре 20-30oC. По истечении указанного
времени для ускорения высыпания спорангия растения повторно помещали на 16 часов во влажную камеру. После этого производили оценку степени поражения растений грибами на нижней поверхности листьев.
Активное вещество - Поражение (в%) листьев после обработки водной композицией с содержанием 500 част./млн активного вещества
Таблица 21, активное вещество N 3 - 5
Таблица 21, активное вещество N 4 - 0
Таблица 30, активное вещество N 1 - 15
Сравнительное вещество А - 65
Сравнительное вещество Б - 40
Сравнительное вещество В
- 25
Без обработки - 650
Реферат
Предложены карбаматы формулы I где Z обозначает OCH3, NH2, NHCH3, N(CH3)2, CH3, C2H5, CF3 и CCl3; X и Y - водород, F, Cl, Br, алкил; R1 - водород, алкил, галогензамещенный алкил, алкенил, алкинил, алкокси и др., А - -O-, -CH2-, -CH=CH-, -CH2O-, -CH=N-O и др.; B - фенил, незамещенный или замещенный алкилом, галогеном, нитрогруппой, фенилом и др., 5- или 6-членное ароматическое кольцо, содержащее 1-3 атома азота, или серы, или кислорода с одним или двумя атомами азота, причем гетероароматическое кольцо может быть замещено алкилом, галоидалкилом, изоксазолом и др., и их совместимые с растениями активные соли кислот или оснований. Промежуточные производные бензола формулы Е, где X и Y являются алкилом; Q - NO2, NH2, NHOR1, NHR1, NCO, NR1COZ, где Z обозначает метоксигруппу NHCH3; а R1 является водородом или алкилом, А обозначает -CH2O-, -CH2ON=CH(CH3), -CH2ON=CH(C2H5); B - фенил, незамещенный или замещенный алкилом, галогеном, -C(R3)=NOR3, где R3 - алкил или алкенил. Производные бензола формулы F, где X и Y являются водородом, галогеном или алкилом; Z обозначает группы OCH3, CH3, NHCH3; R1 и R2 являются водородом или алкилом, T - водород или галоген. Производное бензола формулы G, где X и Y являются водородом; Z - CH3, C2H5, OCH3, А обозначает простую связь и В является алкилом. Фунгицидная композиция и способ борьбы с грибками путем обработки растений фунгицидной композицией на основе N-фенилкарбаминовой кислоты. 6 с. и 70 з.п. ф-лы, 61 табл.
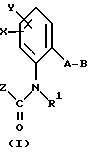
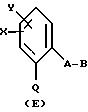


Формула
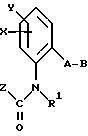
где Z - OCH3, NH2, NHCH3, N(CH3)2, CH3, C2H5, CF3 либо CCI3;
X и Y независимо друг от друга - водород, F, Cl, Br, алкил;
R1 - водород, алкил, галогензамещенный алкил, алкенил, алкинил, алкоксил, алкенилокси, алкинилокси, циклопропилметил-, CH2-CH2OCH3 CO2CH3, -OCO2- алкил или -S-R5, где R5 - обозначает алкил, циклопропилметил;
A обозначает -O-, -CH2-, CH=CH-, -CH2-O-N = C(R4)-, где R4 является алкилом, алкоксилом; -CH2O-, -CH = N-O-, -CH R2S-, где R2 является водородом; CH2-O-CO- либо простую связь;
B - фенил, незамещенный или замещенный алкилом, галогеном, циано-, нитрогруппой, галоидалкилом, алкоксилом, галоидалкоксилом, цианозамещенным алкилом, фенилом, феноксигруппой, группой формулы CRa=N-ORb, где Ra - водород или низший алкил, а Rb-алкил, алкенил, который может быть замещен галогеном; 5- или 6-членное гетероароматическое кольцо, содержащее от одного до трех атомов азота или атом серы или кислорода с одним или двумя атомами азота, причем гетероароматическое кольцо может быть замещено алкилом, галоидалкилом, изоксазолом, который может быть замещен алкилом, фенилом, который может быть замещен галогеном или алкилом; пиридинилом, который может быть замещен галогеном, алкилом, галоидалкилом, группой формулы CRa=N-ORb или фенилом, который может быть при определенных условиях замещен галогеном или низшим алкилом; триазолилом, который может быть замещен алкилом, фуранилом, группой CRa=N-ORb; алкил, который может быть замещен галогеном, фенилом, феноксигруппой; нафтил, бензотиазолил, бензоксазолил, хинолинил, которые могут быть замещены галоидалкилом; группа N - циклогексил;
и их совместимые с растениями аддитивные соли кислот или оснований.

где Z - метоксигруппа;
X и Y независимо друг от друга - водород, алкил, F, Cl, Br;
R1 - водород, алкил, алкенил, алкинил, циклопропилметил, -CH2-CN, -CH2-O-CH3, -CO2CH3 либо -S-R5, где R5-алкилциклопропилметил;
A - -O-; -CH= CH-, -CH2-O-, -CH2-S-, -CH2-O -N=C(R4), где R4 является алкилом;
B обозначает: а) замещенный фенил, указанный в п.1, если А представляет собой - CH=CH-, -CH2-O-, -CH2-S-, -CH2-O -N=C(R4), где R4 является алкилом; б) или B имеет значения, указанные в п.1,
или их совместимые с растениями аддитивные соли кислот и оснований.

в которой X, Y, R1 и B имеют значения, указанные в п.2.

в которой X, Y, R1 и B имеют значения, указанные в п.2.

где X и Y независимо друг от друга - водород, алкил, F, Cl, Br;
R1 - алкил, алкенил, алкинил;
A - -O-, -CH=CH-, -CH2 -O-, -CH2-S-, -CH2-O -N=C(R4)-, где R4 является алкоксил;
B имеет значения, указанные в п.1,
и их совместимые с растениями аддитивные соли с кислотами или основаниями.

в которой A, B и R1 имеют значения, указанные в п.8.

в которой R1 и B имеют значения, указанные в п.8.

в которой R1 и B имеют значения, указанные в п.8.

где Z - NH2, NHCH3, N(CH3)2, CH3, C2H5, CF3 либо CCI3;
X и Y независимо друг от друга - водород, алкил, F, Cl, Br;
R1 - алкил, алкенил, алкинил, возможно замещенный алкил;
A - -O-, -CH= CH-, -CH2-O-, -CH2S-, -CH2 -O- N=C(R4)-, где R4-алкил, алкоксил; -CH2-O-CO- или простая связь;
B имеет значения, указанные в п.1,
и их совместимые с растениями аддитивные соли кислот и оснований.

где A, B, Z и R1 имеют значения, указанные в п.1;
X и Y независимо друг от друга - водород, алкил, F, Cl, или Br.

где R1, X, Y, Z и B имеют значения, указанные в п.13.

в которой R1, X, Y, Z и B имеют значения, указанные в п.13.

в которой R1, X, Y, Z и B имеют значения, указанные в п.13.

в которой R1, X, Y, Z и B имеют значения, указанные в п.2.

где X и Y независимо друг от друга - F, Cl, Br, алкил, или Y - водород;
R1-алкил, алкенил, алкинил, -CO2CH3, возможно замещенный алкил;
А обозначает -O-, -CH= CH-, -CH2-O-, -CH2-S-, -CH2-O -N=C(R4)-, где R4-алкил, алкоксил;
B имеет значения, указанные в п.1.
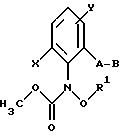
в которой A, B, и R1 имеют значения в п.22;
X и Y независимо друг от друга - F, Cl, Br, C1-C4-алкил.

в которой R1, X, Y и B имеют значения, указанные в п.22.

в которой R1, X, Y и B имеют значения, указанные в п.22.
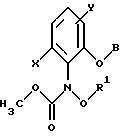
в которой R1, X, Y и B имеют значения, указанные в п.22.

в которой R1, X, Y и B имеют значения, указанные в п.22.

где Z - NH2, NHCH3, N(CH3)2, CH3, C2 H5, CF3 либо CCI3;
X и Y независимо друг от друга - водород, алкил, F, Cl, Br;
R1 - водород, алкил, алкенил, алкинил, циклопропилметил, -CH2-CN, -CH2-O-CH3, -CO2CH3, -S-R5, где R5-алкил;
A обозначает -O-, CH=CH-, -CH2-O-, -CH2 -S-, -CH=N-O или -CH2-O-N=C(R4)-, где R4-алкил;
B обозначает: а) замещенный фенил, если А - -CH=CH-, -CH2-O-, -CH2-S-, -CH=N-O- или -CH2-O-N=C/R4/-, где R4-алкил; б) имеет значения, приведенные в п.1,
и их совместимые с растениями аддитивные соли кислот и оснований.

в которой X, Y, R1, Z и B имеют значения, указанные в п.30.

в которой X, Y, R1, Z и B имеют значения, указанные в п.30.

в которой Z, Y, A, B и R1 имеют значения, указанные в п.30;
X - водород, F, Cl, C1-C4-алкил.
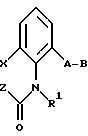
в которой Z, A, B и R1 имеют значения, указанные в п.30;
X - водород, F, Cl, C1-C4-алкил.

в которой Z, A, B и R1 имеют значения, указанные в п.30.

где X и Y независимо друг от друга - F, Cl, Br, алкил или Y - водород;
R1 - водород, алкил, алкенил, алкинил, циклопропилметил, -CH2-CN, -CH2-O-CH3, -CO2CH3, -S-R5, где R5 -алкил;
A обозначает -O-, -CH= CH-, -CH2-O-, -CH2-S-, -CH=CN-O-, -CH2-O-N=C (R4)-, где R4 - алкил;
B обозначает: а) замещенный фенил по п.1, если А - -CH=CH-, -CH2-O-, -CH2-S-, -CH= N-O-, -CH2-O-N=C(R4)-, где R4-алкил; б) или B имеет значения, указанные в п.1,
и приемлемые для растений соли кислот и оснований.

в которой X, Y, R1 и B имеют значения, указанные в п.40.

в которой X, Y, R1 и B имеют значения, указанные в п.40.

в которой X и Y - алкил;
Q - NO2, NH2, NHOR1, NCO, NR1COZ, NHR1, где Z - метоксигруппа или NHCH3, а R1 - водородом или алкил;
А - -CH2-O-, -CH2O N =CH(CH3), -CH2 ON = CH (C2H5 );
B - фенил, незамещенный или замещенный алкилом, галогеном, группой формулы -C(R3)-N=OR3, где R3 является алкилом, алкенилом.
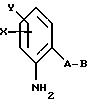
в которой X, Y, A и B имеют значения, указанные в п.48.

в которой X, Y и B имеют значения, указанные в п.48;
А - -CH2-O-, -CH2-O-N =C(CH3)-,
51. Производные бензола по п.50 формулы LI

в которой X, Y, A и B имеют значения, указанные в п.50.
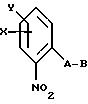
в которой X, Y, A и B имеют значения, указанные в п.48.

в которой X, Y, A и B имеют значения, указанные в п.48.

в которой X, Y и B имеют значения, указанные в п.48;
А - -CH2O-, CH2-O-N =C(CH3).
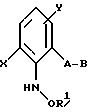
в которой A, B, X, Y и R1 имеют значения, указанные в п.48, или R1 - водород.

в которой X, Y, A, B и R1 имеют значения, указанные в п.22.

в которой A, B, X и Y имеют значения, указанные в п.56.
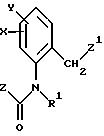
в которой X, Y, Z и R1 имеют значения, указанные в п.48;
Z1 - O-(C1-C4 )-алкил.

в которой X, Y и R1 имеют значения, указанные в п.40;
Z - O-(C1-C4)-алкил.
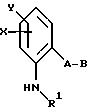
в которой X, Y, R1 и B имеют значения, указанные в п.30;
А - -CH2O-, -O-, -CH2-O-N =C(CH3)-.
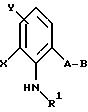
в которой A, B, X и Y и R1 имеют значения, указанные в п.40.
в которой X, Y и B имеют значения, указанные в п.48;
А - -CH2O-, -O-, -CH2-O-N =C(CH3 )-.

в которой A, B, X и Y имеют значения, указанные в п.40.

в которой X и Y - водород, галоген, алкил;
Z - метоксигруппа, CH3, NHCH3;
R1 и R2 - водород или алкил;
Т - водород или галоген.

в которой X, Y, R1 и R2 имеют значения, указанные в п.64;
Hal - галоген.

в которой X, Y, R1 и R2 имеют значения, указанные в п.64.

в которой X, Y, R1 и R2 имеют значения, указанные в п.64;
Hal - галоген.

в которой X, Y, R1 и R2 имеют значения, указанные в п.64.
в которой X, Y, Z, R1 и R2 имеют значения, указанные в п.12;
Z дополнительно обозначает метокси.
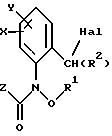
в которой X, Y, Z, R1 и R2 имеют значения, указанные в п.64;
Z дополнительно обозначает метокси;
Hal - галоген.

в которой X и Y - водород;
Z обозначает метильную, этильную или метоксильную группу;
A - простая связь;
B - алкил.

в которой X, Y, A и B имеют значения, указанные в п.71.
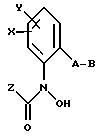
в которой X, Y, Z, A и B имеют значения, указанные в п.71;
Z дополнительно обозначает метокси.

в которой X, Y, A и B имеют значения, указанные в п.71.
29.01.92 при Z - OCH3;
09.10.92 при Z - NH2, NHCH3, N(CH3)2, CH3, C2H5, CF3, CCl3;
29.04.92 X, Y все (без исключения); -O-, -CH=CH-, -CH2-O-N=(R4)-, -CH2O-, -CH=N-O-, -CHR2-S-;
26.06.92 при А -CH2-O -CO-;
29.01.92 при B необязательно замещенный фенил, необязательно замещенное 5- или 6-членное гетероароматическое кольцо;
29.01.92 при R1 - водород, алкил, галоидалкил, алкенил, алкинил, циклопропилметил, CH2CN, CH2OCH3, CO2, SR5;
26.06.92 при R1 - алкокси, алкенилокси, OCO2-алкил;
29.01.92 при R2 - водород;
29.01.92 при R4 - алкил;
26.06.92 при R4 - алкоксил;
29.06.92 при R5 - алкил, циклопропилметил.

Комментарии