Замещенные гетероциклические соединения, способы их получения, промежуточные соединения, способ борьбы с нежелательными растениями - RU2125050C1
Код документа: RU2125050C1
Чертежи
































































Описание
Данное изобретение относится к химическим соединениям, полезным в качестве гербицидов, к процессам получения их и к гербицидным композициям и способам их использования.
Гербицидные соединения на основе карбонил-замещенных азот-содержащих гетероциклических колец известны, например, из британского патента N 1345159 и DE OS 2212558.
Заявители обнаружили группу соединений, которые имеют особый характер заместителей и являются активными в качестве гербицидов.
Согласно
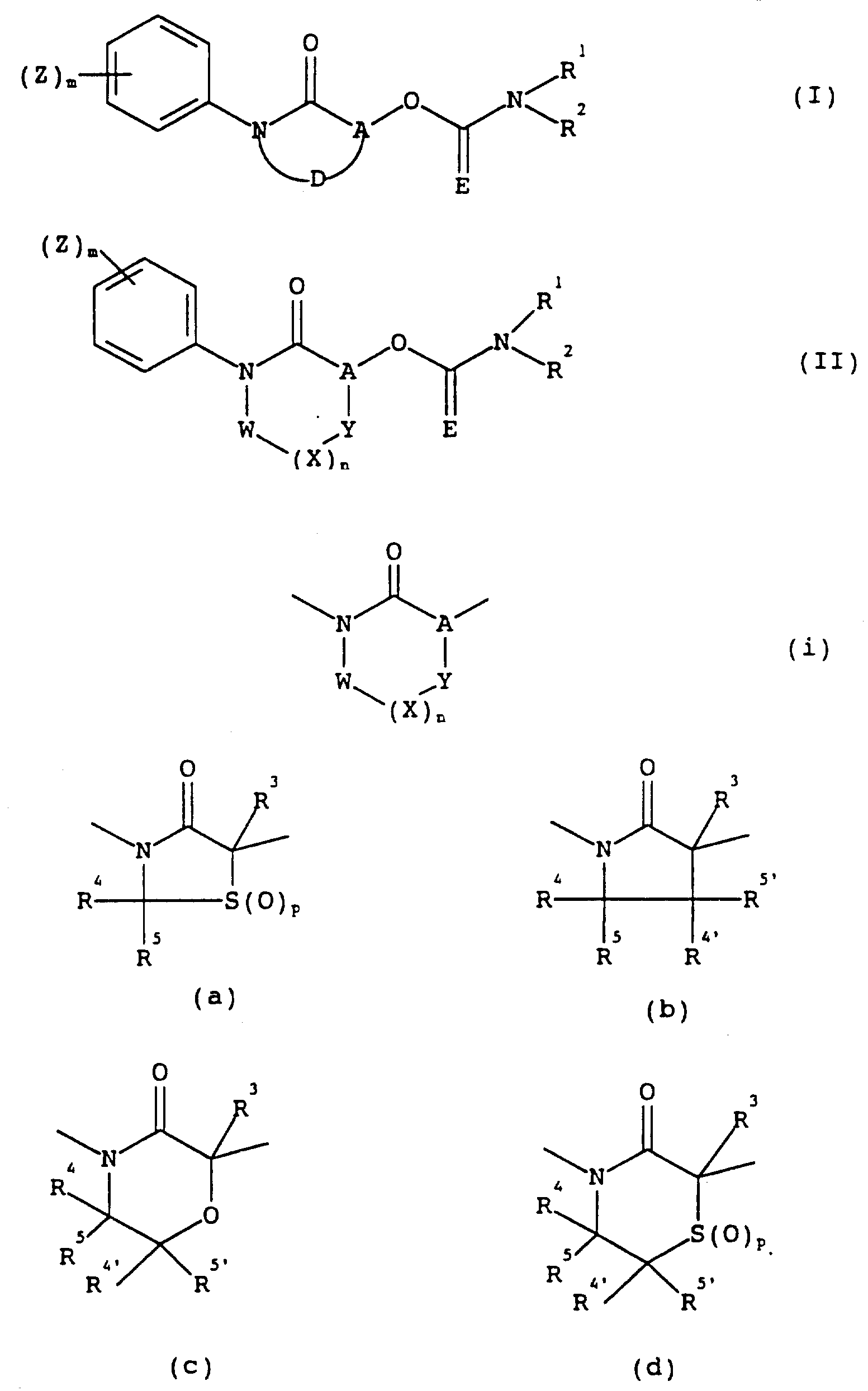
настоящему изобретению предоставляются соединения формулы /I/:

в которой
E представляет кислород или серу;
A представляет CR3 или N, где R3 представляет водород или гидрокарбил;
D завершает 5- или 6-членное неароматическое гетероциклическое кольцо, которое необязательно содержит дополнительные гетероатомы, выбранные из кислорода, азота или серы, и которое является необязательно замещенной низшей гидрокарбонильной группой, или необязательно замещенную гетероарильную группу;
R1 и R2 представляют каждый независимо водород, необязательно замещенный низший гидрокарбил, или необязательно замещенный гетероарил, или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо;
Z представляет галоген, необязательно замещенный низший гидрокарбил, необязательно замещенный низший гидрокарбилокси, необязательно замещенный низший гидрокарбилтио, гидрокарбилсульфинил или гидрокарбилсульфонил, циано, нитро, CHO, NHOH, ONR7'R7'', SF5, CO /необязательно замещенный низший гидрокарбил/, ациламино, COOR7, SO2NR8R9, CONR10R11, OR12 или NR13R14, где R7, R7', R7'', R8, R9, R10 и R11 представляют независимо H или низший гидрокарбил; R12 представляет водород, SO2 низший гидрокарбил или COR15; R13 и R14 независимо представляют низший гидрокарбил, низший гидрокарбилокси или группу R12; R15 представляет OR16, NR17R18, водород или низший гидрокарбил; R16 представляет низший гидрокарбил, R17 и R18 независимо представляют водород или низший гидрокарбил, при условии, что, когда имеется два или более заместителей Z, они могут быть одинаковыми или различными;
m представляет 0 или целое число от 1 до 5.
D завершает насыщенный или ненасыщенный гетероциклический фрагмент. Предпочтительно D завершает насыщенное гетероциклическое кольцо.
Особенными примерами соединений формулы /I/ являются соединения формулы /II/, где A, E, R1, R2, Z и m имеют значения, определенные в отношении формулы /I/, и W, X и Y независимо выбраны из CR4R5, NR6, O и S(O)p, где p представляет 0, 1 или 2, R4, R5 и R6 независимо выбраны из водорода, необязательно замещенного низшего гидрокарбила, или необязательно замещенного гетероарила, или R4 и R5 вместе с атомом углерода, к которому они присоединены, могут образовывать карбоциклическое кольцо; и n представляет 0 или 1, при условии, что не более, чем два из A, W, X и Y включают гетероатомы в кольце; и когда более чем один из W, X и Y представляет CR4R5, R4 и R5 могут быть одинаковыми или различными; и когда более чем один из W, X и Y представляет NR6, каждый R6 может быть одним и тем же или различным.
Выражение низший гидрокарбил в предшествующих определениях, независимо от того, используется ли оно само по себе или как часть более крупного радикала, такого как, например, низший гидрокарбилокси, предназначен для включения гидрокарбильных (углеводородных) радикалов, например, с числом атомов углерода до 10. Подклассы таких гидрокарбильных радикалов включают радикалы, содержащие до 4 или до 6 атомов углерода. Выражение гидрокарбонил включает алифатические, алициклические и ароматические гидрокарбильные или углеводородные группы и их сочетания. Данное определение включает, таким образом, например, алкил, алкенил и алкинильные радикалы, циклопропил, циклопропилметил, циклобутил, циклопентил и циклогексильный радикалы, адамантильный и фенильные радикалы.
Когда низшая гидрокарбильная группа является замещенной, заместители могут включать, например, галоген (например, хлор, бром, фтор или иод), циано, нитро, амино, моно- и диалкиламино, в котором алкильные группы имеют от 1 до 6 или более атомов углерода, ациламино, (1-6)C алкокси, (1-6)C галоидалкокси, (1-6)C алкилтио, (1-6)C алкилсульфинил, (1-6)C алкилсульфонил, карбокси, карбоксиамид, в котором группы, присоединенные к N атому, могут представлять водород или необязательно замещенный низший гидрокарбил; алкоксикарбонил, в котором алкокси группа может иметь от 1 до 6 или более атомов углерода, и арил, такой как фенил.
Выражение гетероарил в приведенных выше определениях включает такие радикалы, как пиридил, триазинил, тиенил, фурил и тиазолил. Когда гетероарильный радикал является замещенным, заместители могут включать радикалы, перечисленные выше для замещенного низшего гидрокарбила.
Конкретные примеры значений для R4 и R5 включают водород, метил, этил, пропил и бутил. Когда R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют карбоциклическое кольцо, кольцом может быть, например, циклобутил, циклопентил или циклогексильное кольцо.
Конкретные примеры значений R1 и R2 включают водород, метил, этил, пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, н-пентил и их изомеры, н-гексил и его изомеры, н-гептил и его изомеры C(CH3)2C=CH, C(CH3)2CH= CH2, C(CH3)2CN, альфаметилбензил, циклогексил, циклопентил, циклобутил, циклопропил, 1-метил-циклогексил, 1-метилциклопентил, 1-метил-циклобутил, 1-метилциклопропил, 1-циано-циклогексил, 1-циано-циклопентил, 1-циано-циклобутил, 1-циано-циклопропил, 1-этинилциклогексил, 1-этинил, циклопентил, 1-этинил-циклобутил, 1-этинил-циклопропил, фенил, п-хлорфенил и бензил. Когда R1 и R2 вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, кольцом может быть, например, пирролидино, пиперидино, тиоморфолино или морфолиновое кольцо, каждое из которых может быть замещено, например, одной или более метильными группами.
Примеры конкретных значений Z включают метил, этил, н-пропил, изо-пропил, трифторметил, дифторметил, пентафторэтил, трихлорметил, этоксивинил, фтор, хлор, бром, иод, метокси, этокси, н-пропокси, изо-пропокси, трифторметокси, тетрафторэтокси, циано, нитро, амино, моно- или диалкиламино, в котором каждая алкильная группа может иметь от 1 до 6 или более атомов углерода, гидроксиламино, ацил (например, ацетил или трифторацетил), метилтио, метилсульфинил, метилсульфонил, трифторметилтио, трифторметилсульфинил, трифторметилсульфонил, сульфонамидо, карбокси, алкоксикарбонил, в котором алкокси группа может иметь от 1 до 6 или более атомов углерода, карбоксамид, в котором группами, присоединенными к атому азота, может быть водород или необязательно замещенный низший гидрокарбил; или ациламино (например, ацетамидо). Когда имеется более, чем один заместитель Z, заместители могут быть одинаковыми или различными.
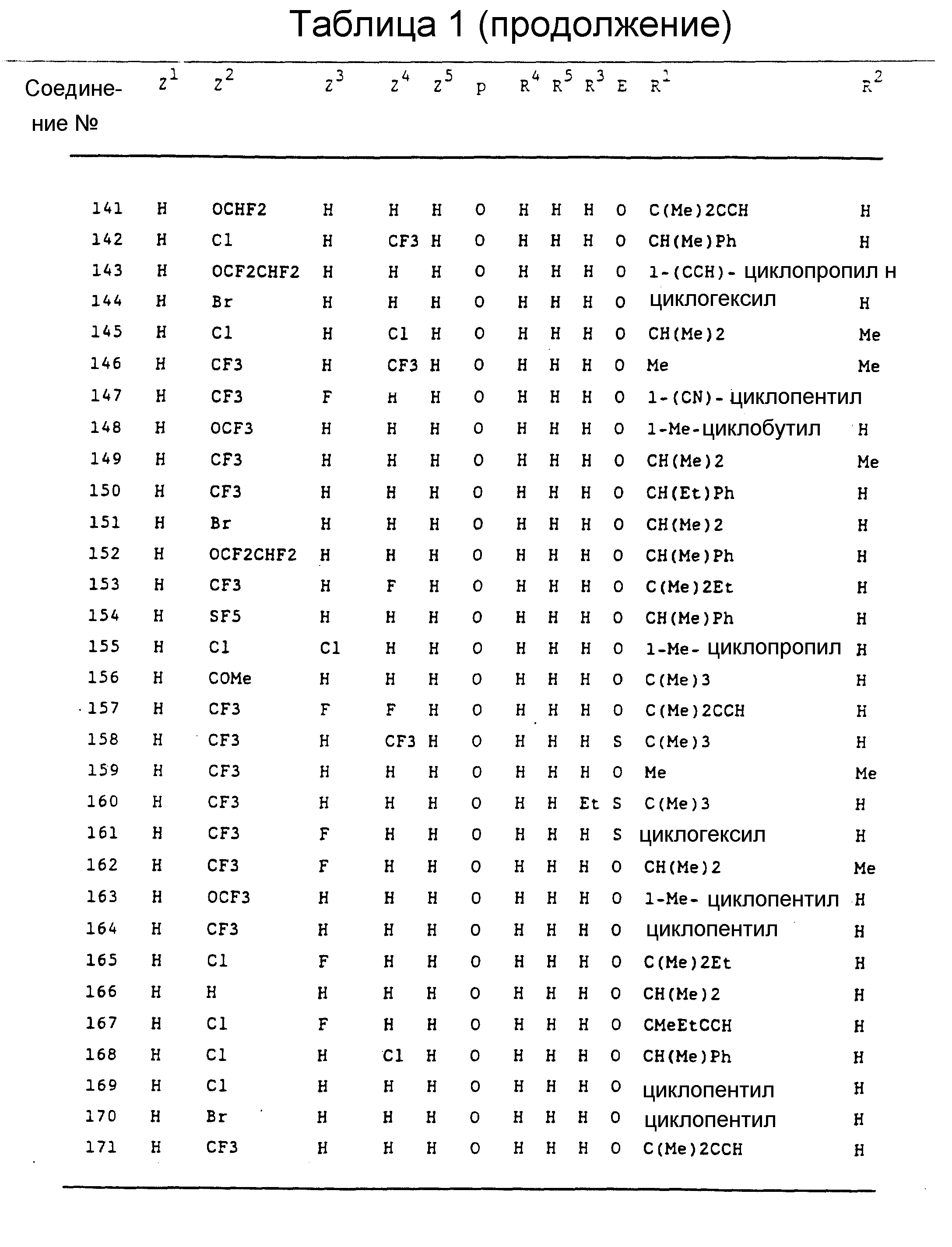
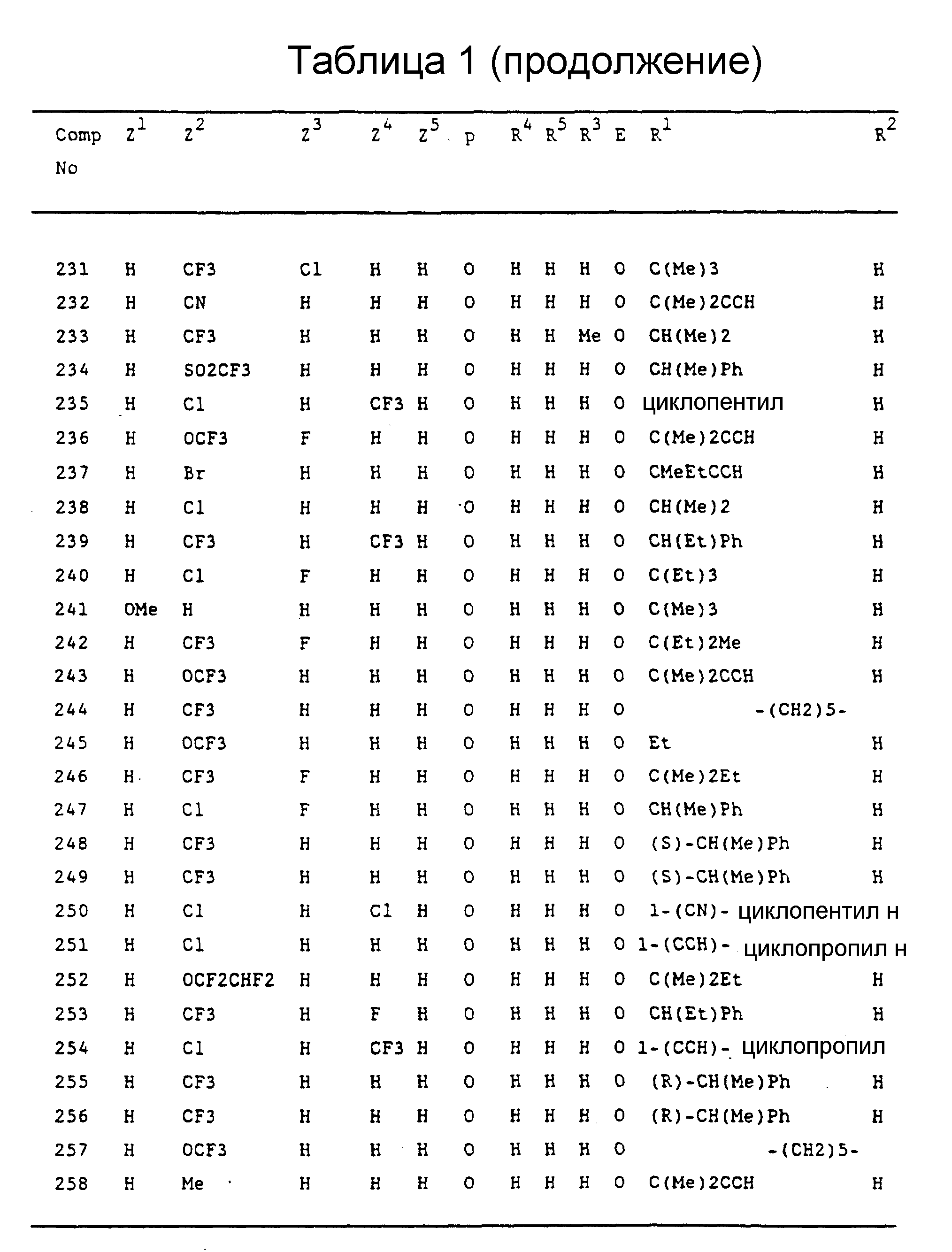
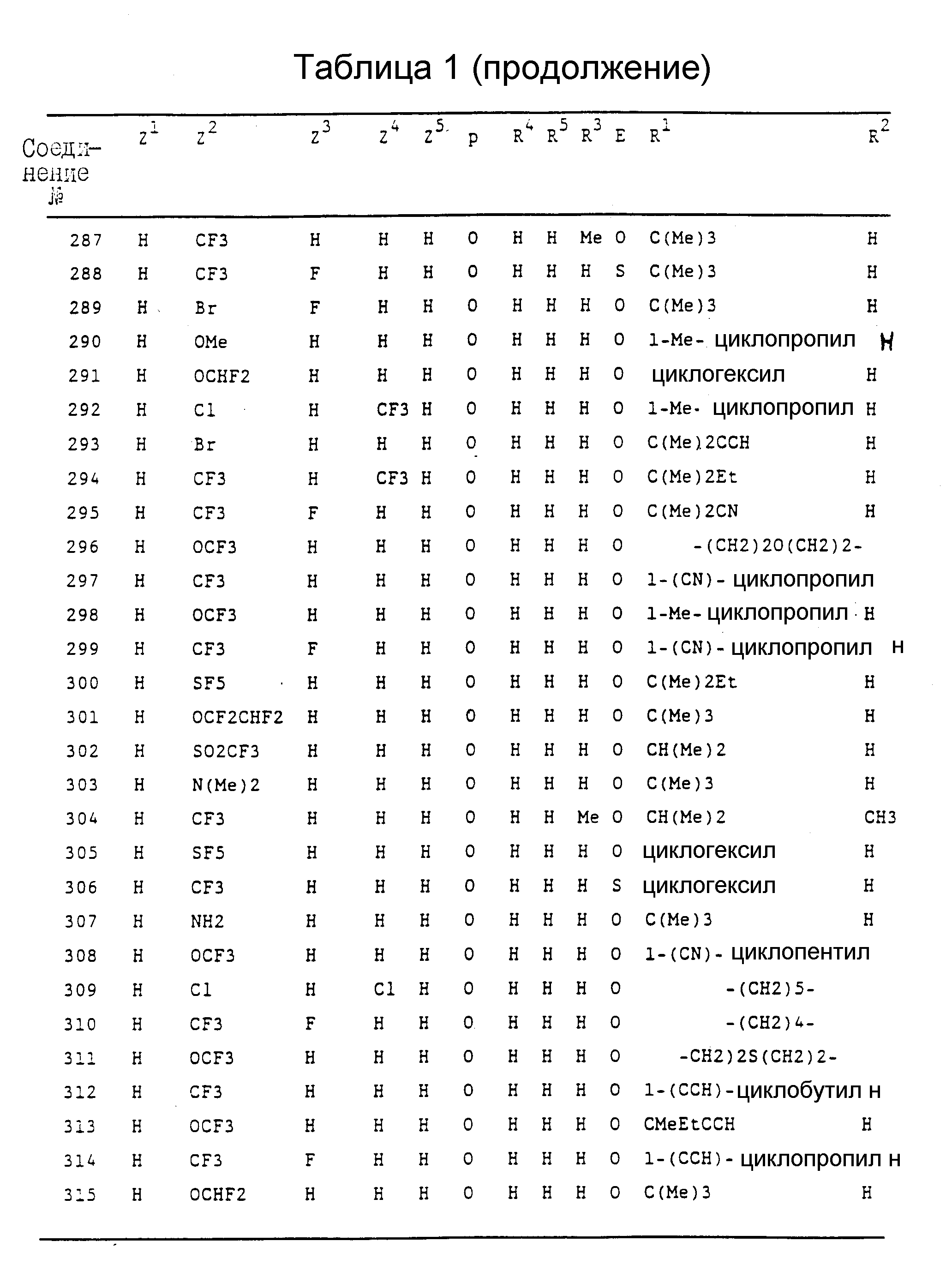
Примерами гетероциклического кольца, содержащего W, X и Y, являются кольца подформулы /I/, включающие группы формул (а) - (о), в которых R3, R4, R5 и R6 имеют значения, определенные выше, и R4' и R4'' и R5' и R5'' имеют значения, определенные выше, соответственно для R4 и R5.
Конкретными примерами соединений формулы /I/ являются соединения, в которых D завершает тиазолидиновое кольцо формулы (а), E представляет O, R3 представляет группу CH; m, p, R1, R2, R4 и R5 имеют значения, определенные выше, и Z представляет галоген, необязательно замещенный низший гидрокарбил, необязательно замещенный низший гидрокарбилокси, необязательно незамещенный низший гидрокарбил-тио, -сульфинил, или -сульфонил, циано, нитро, ацил, амино или ациламино, при условии, что, когда имеется два или более заместителей Z, они могут быть одними и теми же различными.
A представляет предпочтительно CR3, особенно CH.
Предпочтительно группой формулы (I) является тиазолидиноновая группа формулы (а) или пирролидиноновая группа формулы (b).
E предпочтительно представляет кислород.
Предпочтительными значениями для Z являются CF3'', OCF3, OCHF2, CHF2, OMe, F, Cl, Br, I, NH2, NO2, CN, (1-4)C алкокси, CO(1-4)C алкил, NHCO(1-4)C алкил, SO2(1-4)C алкил, OCF2CHF2, CF2CF3 и SO2NR8 R9.
Особенно предпочтительными значениями Z являются CF3, OCF3, OCH3, F, Cl, Br и иод.
m предпочтительно представляет 1, 2 или 3.
Предпочтительным характером замещения для Z групп является замещение для единственной Z группы в 3-положении; или двух Z групп в 3,4- и 3, 5-положениях; трех Z групп в 3-, 4- и 5-положениях; причем, группа Z в 4-положении представляет галоид, особенно фтор.
R1 представляет предпочтительно изо-пропил, втор-бутил, трет-бутил, C(CH3)2C


R2 предпочтительно представляет водород или (1-4)C алкил, особенно, водород.
Предпочтительным значением R3 является водород.
R4, R4' и R4'' предпочтительно представляют водород или (1-4)C алкил.
R5, R5' и R5'' представляют предпочтительно водород или (1-4)C алкил.
R6 представляет предпочтительно (1-4)C алкил, особенно, метил.
Формула /I/, приведенная выше, включает таутомерные формы представленной структуры, а также физически различные модификации соединений. которые могут возникнуть, например, вследствие различных путей, по которым молекулы перегруппировываются в кристаллической решетке, или неспособности частей молекулы свободно вращаться относительно других частей, или вследствие геометрического изомеризма, или внутри-молекулярной или меж-молекулярной связи водорода, или вследствие других факторов.
Некоторые из соединений изобретения могут существовать в энантиомерной или диастереомерной формах. Данное изобретение охватывает все индивидуальные изомеры и их смеси во всех соотношениях.
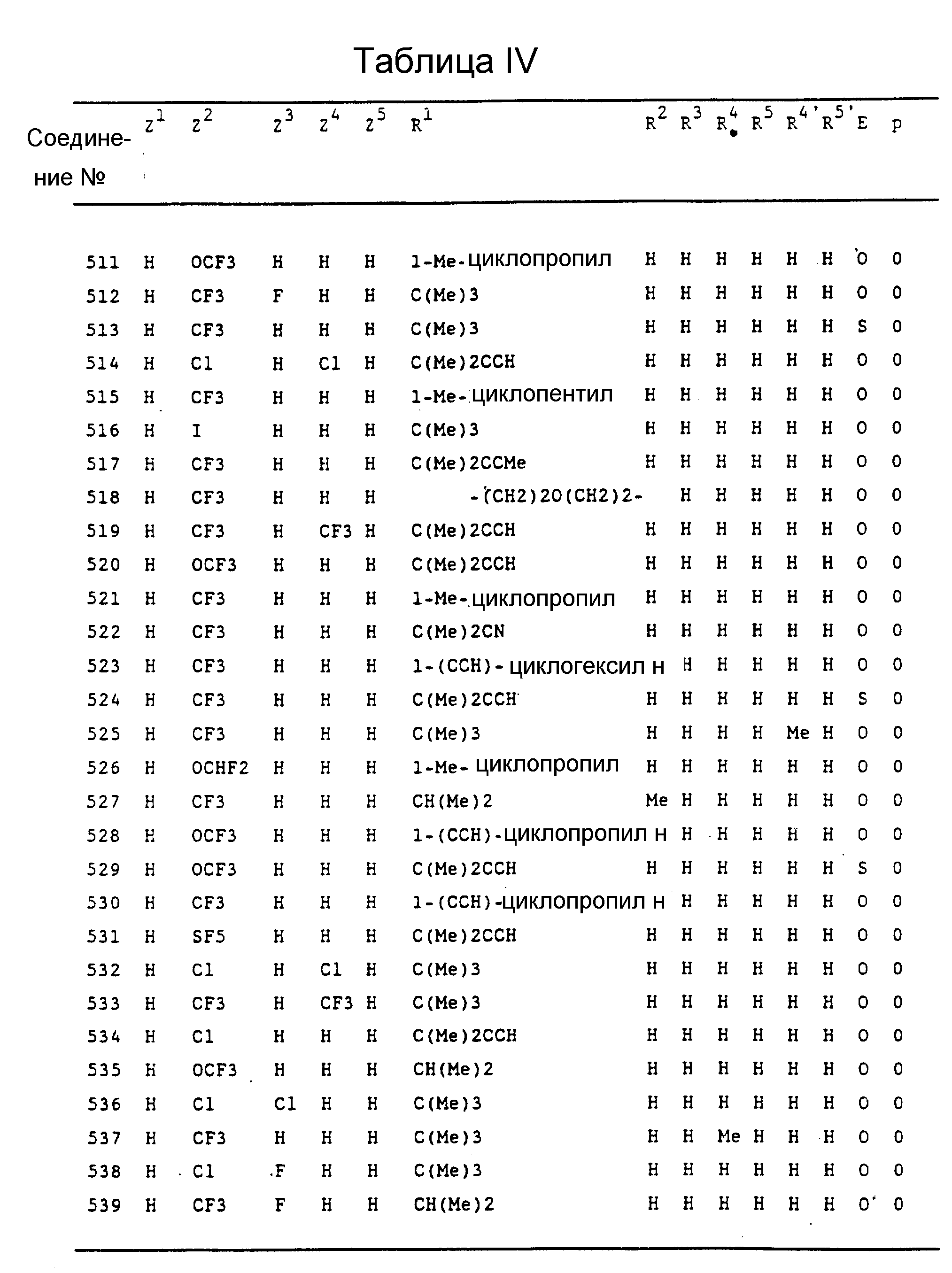
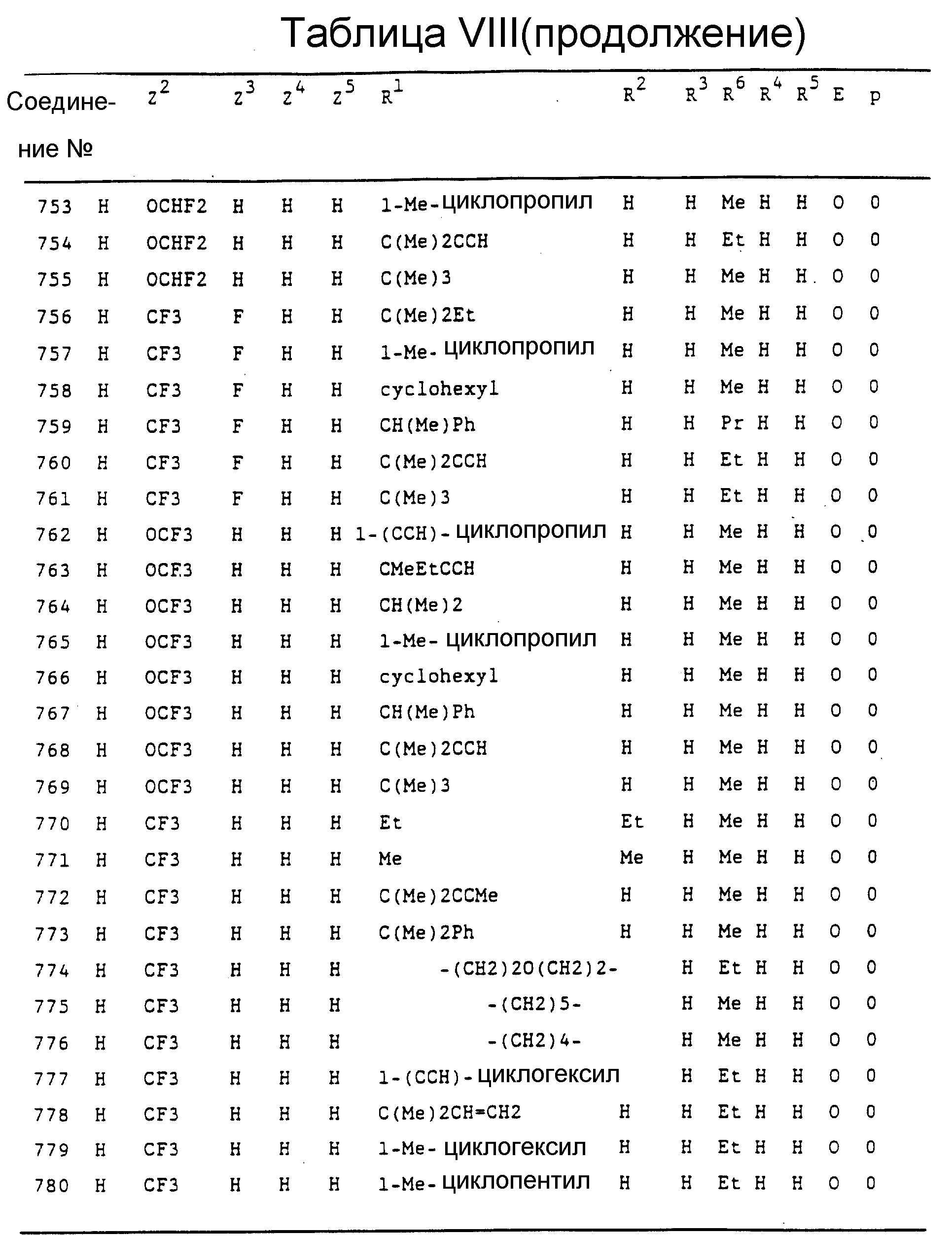
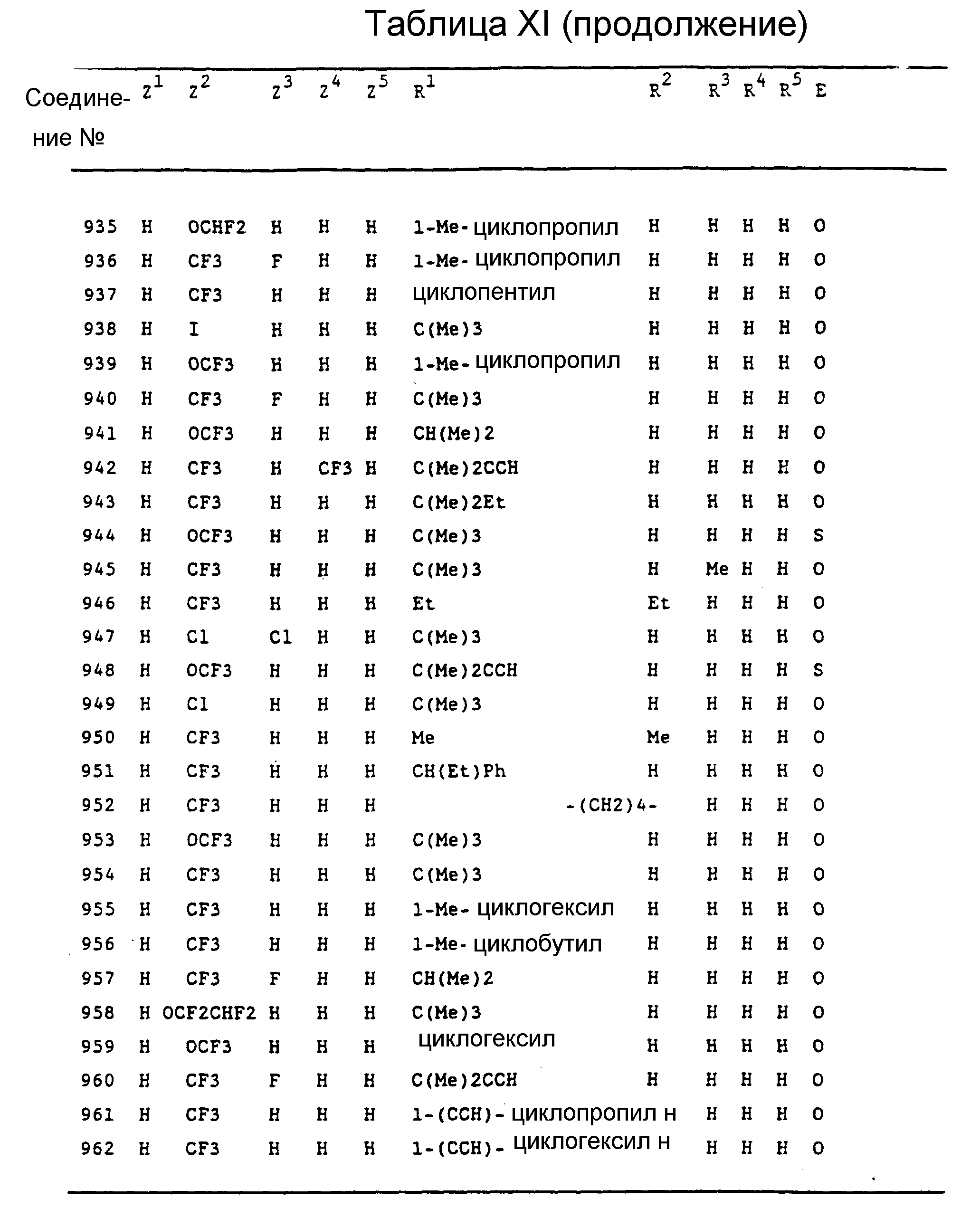
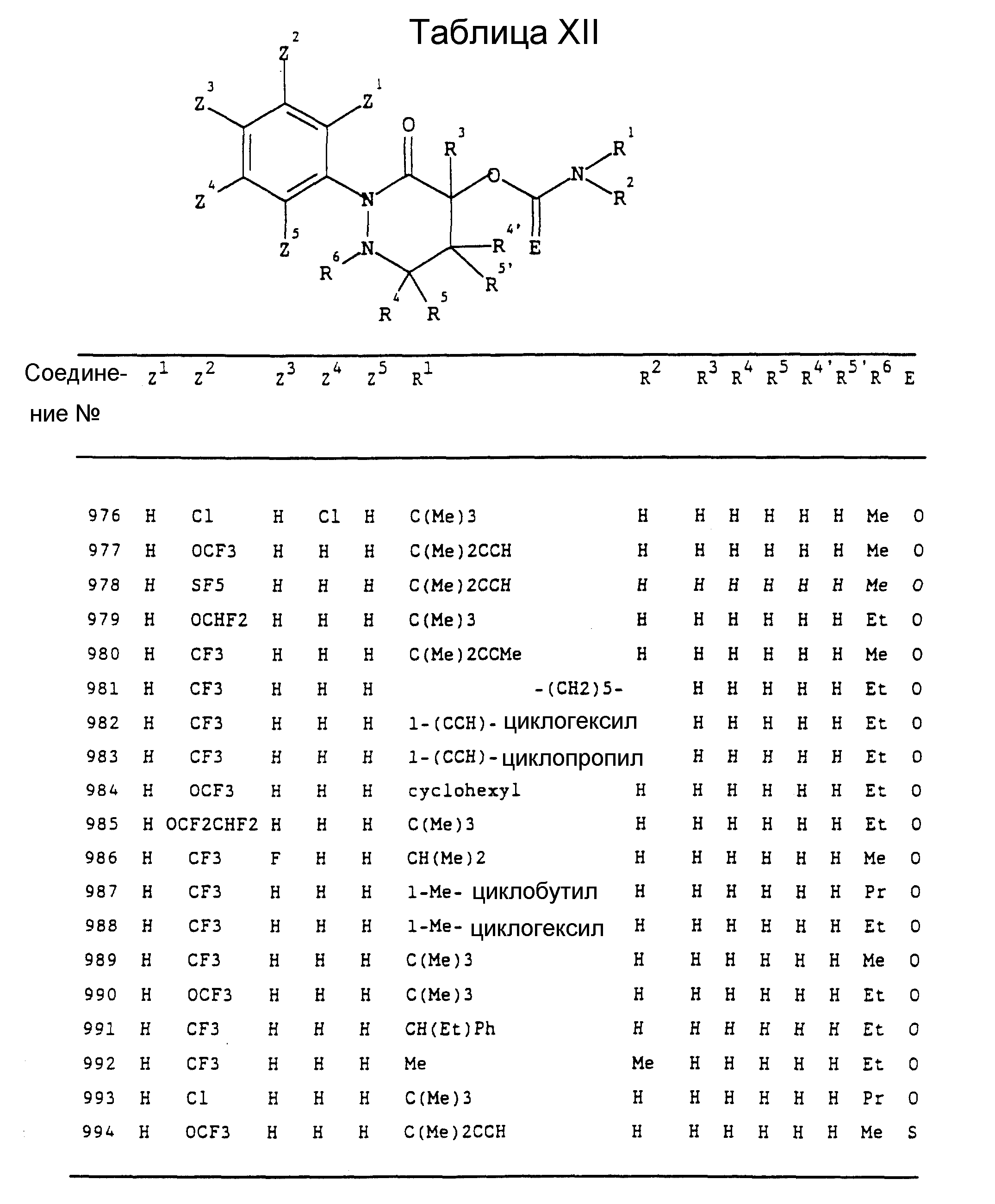
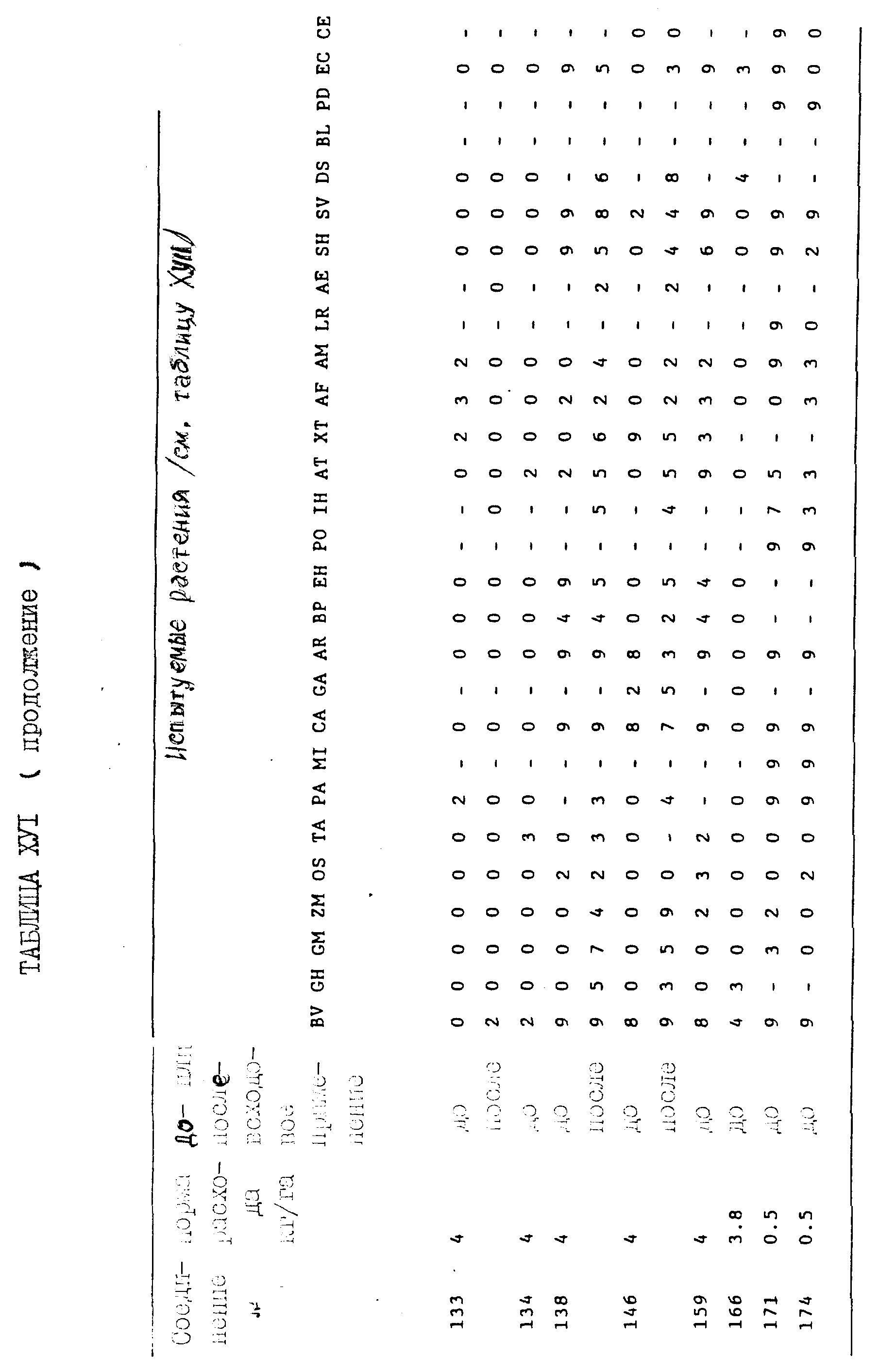
Конкретные примеры соединений изобретения перечислены в Таблицах I-XV.
Соединения формулы /I/ получаются подходящим образом с помощью большого разнообразия процессов.
В частности, соединения формулы /I/ могут быть получены с помощью реакции соединения формулы /III/, в которой A, D, Z и m имеют значения, определенные в отношении формулы /I/: с соединением формулы /IV/ или, когда R2 представляет водород, соединением формулы /V/, в которой R1 имеет значения, определенные для формулы /I/, а R19 представляют уходящую или удаляемую группу, в присутствии основания.
Подходящие основания включают слабые основания, такие как триэтиламин, пиридин или N-этил-N, N-диизопропиламин.
Подходящие удаляемые группы R19 включают галоген, такой как хлор.
Реакция осуществляется подходящим образом в органическом растворителе, таком как дихлорметан, трихлорметан, тетрагидрофуран или диэтиловый эфир, при температурах от 0 до 80oC, предпочтительно при температуре окружающей среды.
Некоторые соединения формулы /III/ являются новыми и, являясь таковыми, образуют дальнейший аспект изобретения. Соединения формулы /IV/ и /V/ являются известными соединениями или могут быть получены из известных соединений с помощью общепринятых способов. Соединения формулы /V/ могут получаться и использоваться на месте с использованием стандартных приемов.
С использованием тех же реакций NCO группа соединений (V) может быть заменена NCS группой. Если необходимо, NCS группа может образовываться на месте при использовании стандартных технологических приемов.
Альтернативный способ получения соединений формулы /I/ из соединений формулы /III/ заключается во взаимодействии соединения формулы /III/ с соединением ClC(O)OCH(Cl)CCl3 в присутствии основания, давая соединение формулы /XIII/, в которой Z, D, A и m имеют значения, определенные выше в отношении формулы /I/. Реакция подходящим образом осуществляется при температуре от -10 до 10oC, в присутствии растворителя. Подходящими основаниями являются гетероароматические азотные основания, такие как пиридин. Подходящими растворителями являются дихлорметан или хлороформ. Соединения формулы /XIII/ затем подвергаются реакции с амином формулы /VIII/ HNR1R2, где R1 и R2 имеют значения, определенные в отношении формулы /I/, давая соединения формулы /I/. Реакция подходящим образом осуществляется при температуре от -10 до 30oC, в присутствии основания и растворителя. Подходящими основаниями являются пиридин и триэтиламин. Подходящими растворителями являются дихлорметан и хлороформ. Соединения формулы /XIII/ не нуждаются в выделении, а могут подвергаться реакции на месте с соединением формулы /VIII/.
Вместо ClC(O)OCH(Cl)CCl3 соединения формулы /III/ могут подвергаться реакции с фосгеном, давая соединения формулы /XIV/, в которой Z, A, D и m имеют значения, определенные в отношении формулы /I/. Соединения формулы /XIV/ затем подвергаются взаимодействию с амином формулы /VIII/, определенной здесь выше, давая соединение формулы /I/. Реакция подходящим образом осуществляется при температуре от -20 до 50oC в присутствии основания и растворителя.
Подходящими основаниями являются пиридин или триэтиламин. Подходящими растворителями являются хлороформ, дихлорметан или тетрагидрофуран. Соединение формулы /XIV/ не нуждается в том, чтобы выделяться, и может повергаться на месте реакции с соединением формулы /VIII/.
Некоторые соединения формулы /III/, в которой Y представляет серу, а A представляет CR3, подходящим образом получаются с помощью реакции соединения формулы /VI/, в которой Z, D и m имеют значения, определенные в отношении формулы /I/, а R20 представляет удаляемую группу, такую как галоид, особенно хлор; с водой в присутствии основания и смешиваемого с водой растворителя.
Подходящие основания включают слабые неорганические основания, такие как бикарбонат натрия.
Реакция осуществляется подходящим образом в растворителе, таком как тетрагидрофуран или диоксан: при температурах от 0 до 50oC.
Некоторые соединения формулы /III/, в которой A, D, Z и m имеют значения, определенные в отношении формулы /I/, получаются с помощью гидролиза соединения формулы /VI/, в которой A, D, Z и m имеют значения, определенные в отношении формулы /I/, а R20 представляет OCOR21. Реакция удобным образом осуществляется в присутствии спирта, такого как метанол, и силикагеля.
Подходящей группой R21 является трифторметил. Реакция подходящим образом проводится в растворителе, таком как дихлорметан, при температурах от 0 до 50oC, предпочтительно, при температуре окружающей среды.
Некоторые соединения формулы /VI/, в которой Y представляет серу и A представляет CR3, a D, Z и m имеют значения, определенные в отношении формулы /I/, и R20 представляет галоген, могут получаться с помощью галоидирования соединения формулы /X/ галоидирующим агентом. Подходящие галоидирующие агенты включают сульфурилхлорид или хлор.
Реакция подходящим образом проводится в органическом растворителе, таком как дихлорметан или хлороформ, при температурах от 0 до 50oC, предпочтительно, при температуре окружающей среды.
Некоторые соединения формулы /III/ могут получаться с помощью окисления соединения формулы /X/, в которой A, D, Z и m имеют значения, определенные в связи с формулой /I/, с сильным основанием, таким как LiN(SiMe3)2 или LiN(изоPr)2, с последующей реакцией с соединением формулы /XVII/.
Реакция подходящим образом проводится в растворителе, таком как тетрагидрофуран, при температурах от -100 до 30oC, предпочтительно от -80 до 0oC. В соединениях формулы /XVII/ Ar представляет подходящим образом п-толильную группу, а Ar' представляет подходящим образом фенил.
Некоторые соединения формулы /III/, особенно соединения, в которых A представляет N, а D, Z и m имеют значения, определенные в отношении формулы /I/, подходящим образом получаются с помощью гидрогенолиза соединения формулы /VI/, в которой R20 представляет OCH2Ph, и Z, D и m имеют значения, определенные в отношении формулы /I/.
Реакции подходящим образом проводится в протонном растворителе, таком как спирт (например, метанол) в присутствии катализатора. Подходящим катализатором является палладий на угле. Реакция подходящим образом проводится при температурах от 0 до 50oC, предпочтительно при температуре окружающей среды.
Соединения формулы /X/ могут получаться с помощью разнообразных способов в зависимости от конкретной природы кольца, завершенного группой Д.
Это возможно, когда заместители Z имеют природу и распределение, позволяющее активировать фенильное кольцо для нуклеофильного замещения, чтобы сочетаться с соединением формулы /XI/; когда Z и m имеют значения, определенные выше, и R22 представляет удаляемую группу, с соединением формулы /XII/; когда A представляет CR3, и D имеет значения, определенные здесь ранее: в присутствии основания.
Подходящие удаляемые группы R22 включают галоген, такой как фтор.
Подходящие основания включают сильные основания, такие как гидроокись калия или гидроокись натрия.
Реакция подходящим образом проводится в органическом растворителе, таком как диметилсульфоксид или диметилформамид, при температурах от 0 до 90oC.
Примеры подходящих соединений формулы /XI/ включают 3,4-дифтор-5-хлор-α, α, α-трифтортолуол и 3,4,5-трифтор-α, α, α- трифтортолуол.
Альтернативный и обычно более приемлемый путь получения соединений формулы /III/, /VI/ и /X/ включает введение соответствующей боковой цепи в замещенном подходящим образом фенильном производном и циклизацию боковой цепи с образованием желаемого гетероциклического фрагмента. Например, изоксазолидиноновое кольцо и дигидро-1,2-оксазиноновая кольцевая система могут получаться из соединений формулы /XV/, в которой Z и m имеют значения, определенные в отношении формулы /I/.
С помощью реакции с ClCO(CH2)2Br соединения формулы /XV/ могут превращаться в соединения формулы /XVI/, в которой Z и m имеют значения, определенные в отношении формулы /I/. Реакция подходящим образом осуществляется при температуре от -20 до 40oC, предпочтительно, при 0 - 25oC, в присутствии основания и растворителя. Подходящими основаниями являются триэтиламин или пиридин. Подходящими растворителями являются тетрагидрофуран или дихлорметан. Соединения формулы /XVI/ могут превращаться в соединения формулы /III/, в которой D завершает изоксазолидиновое кольцо, а Z и m имеют значения, определенные в отношении формулы /I/, с помощью реакции с сильным основанием с последующей реакцией с соединением формулы /XVII/, в которой Ar представляет п-толил, и Ar' представляет фенил. Реакция подходящим образом осуществляется при температуре от -80 до 10oC в присутствии растворителя. Подходящими основаниями являются гексаметилдисилазид лития или диизопропиламид лития. Подходящим растворителем является тетрагидрофуран.
С помощью реакции с ClC(O)CH(Br)CH2CH2Br соединения формулы /XV/ могут превращаться в соединения формулы /XVIII/, в которой Z и m имеют значения, определенные в отношении формулы /I/. Реакция подходящим образом осуществляется в растворителе, в присутствии основания, при температуре от -20 до 40oC, предпочтительно, при 0-25oC. Подходящими основаниями являются третичные амины, такие как триэтиламин, а подходящими растворителями являются простые эфиры, такие как тетрагидрофуран. Группы хлор и бром могут превращаться в иодные группы по реакции с иодидом натрия при температурах от 0 до 80oC, в растворителях, таких как ацетон. Иод группа может далее превращаться в OCOCF3 группу с помощью реакции с (бис(трифторацетокси)иод) бензолом в растворителе. Подходящим образом реакция осуществляется при температуре от 0 до 30oC, предпочтительно при температуре окружающей среды. Подходящими растворителями являются хлорированные углеводороды, такие как метилендихлорид. Группы OCOCF3 могут превращаться в OH группы, т.е. в соединения формулы /III/, в которой D завершает дигидро-1,2-оксазиноновое кольцо, и Z и m имеют значения, определенные в отношении формулы /I/, с помощью обработки метанолом, при температуре от 0 до 80oC, предпочтительно при температуре окружающей среды, в присутствии силикагеля и растворителя. Подходящими растворителями являются хлорированные углеводороды, такие как метилендихлорид.
Соединения формулы /XV/ являются известными или могут быть получены из известных соединений с помощью общепринятых способов.
С помощью реакции с ClC(O)CH2Cl соединения формулы (XXX), в которой Z и m имеют значения, определенные для формулы /I/, могут превращаться в соединения формулы /XIX/, в которой Z и m имеют значения, определенные в отношении формулы /I/. Реакция подходящим образом проводится при температуре от 0 до 50oC предпочтительно в растворителе, в присутствии основания. Подходящими основаниями являются сильные основания, такие как гидрид натрия, а подходящим растворителем является тетрагидрофуран, Соединения формулы /XIX/ могут превращаться в соединения формулы /III/, что завершает дигидро-1,4-оксазиновое кольцо, в котором Z и m имеют значения, определенные в отношении формулы /I/, с помощью реакции с LiN(SiMe3 )2 в растворителе, таком как тетрагидрофуран, при температуре от -80 до 20oC, предпочтительно при 0oC, с последующей обработкой соединением формулы /XVII/ (в которой Ar и Ar' имеют значения, определенные выше) при температуре от 0 до 30oC, в растворителе, таком как тетрагидрофуран.
Соединения формулы /XXX/ являются известными или могут быть получены из известных соединений с помощью общепринятых способов.
Соединения формулы /X/, в которых D завершает дигидро-1,4-1,4-тиазиноновое кольцо и в которых Z и m имеют значения, определенные в отношении формулы /I/, могут получаться из соединений формулы /XXVIII/, в которой Z и m имеют значения, определенные в отношении формулы /I/, с помощью нагревания в растворителе, таком как ксилол или толуол, при температуре дефлегмации, в присутствии п-толуолсульфоновой кислоты. Соединения формулы /XXVIII/ могут быть получены из соединений формулы /XXIX/, в которой Z и m имеют значения, определенные в отношении формулы /I/, с помощью обработки этилтиогликолятом в присутствии сильного основания, такого как гидрид натрия, в растворителе, таком как диметилформамид, при температурах от 0 до 50oC, предпочтительно при температуре окружающей среды. Соединения формулы /XXIX/ могут быть получены из соединений формулы/XXX/, в которой Z и m имеют значения, определенные в отношении формулы /I/, с помощью реакции с бромирующим агентом, предпочтительно, с тетрабромуглеродом, и трифенилфосфином при температурах от 0 до 50oC, предпочтительно при температуре окружающей среды, в основном растворителе, таком как пиридин.
Соединения формулы /III/, в которой D завершает 2-имидазолидиноновое кольцо и в которой Z и m имеют значения, определенные в отношении формулы /I/, могут получаться из соединений формулы /XX/ с помощью реакции с водородом в присутствии палладиевого катализатора на угле в соответствующем растворителе, таком как метанол, при температурах от 0 до 30oC, предпочтительно при температуре окружающей среды.
Соединения формулы /XX/, в которой Z и m имеют значения, определенные в отношении формулы /I/, могут получаться из соединений формулы /XXI/, в которой Z и m имеют значения, определенные в отношении формулы /I/, по реакции с Br(CH2 )2 Br, в присутствии основания, в растворителе. Подходящими основаниями являются сильные основания, такие как гидрид натрия, подходящим растворителем является диметилформамид, и реакция подходящим образом осуществляется при температуре от 0 до 50oC, предпочтительно при температуре окружающей среды. Соединения формулы /XXI/, в которой Z и m имеют значения, определенные в отношении формулы /I/, могут получаться из соединений формулы /XXII/, в которой Z и m имеют значения, определенные в отношении формулы /I/, с помощью реакции с C6H5CH2 ONH2 при температурах от 0 до 50oC, предпочтительно при температуре окружающей среды.
Соединения формулы /XXII/ являются известными соединениями или могут быть получены из известных соединений с помощью общепринятых методов.
Соединения формулы /III/, в которой D завершает насыщенное 2-пиримидиноновое кольцо, и где Z и m имеют значения, определенные в отношении формулы /I/, могут быть получены из соединений формулы /XXI/ аналогичным образом с использованием Br(CH2)3Br вместо Br(CH2)2Br.
Соединения формулы /III/, в которой D завершает 2-пиперидиноновое кольцо, а Z и m имеют значения, определенные в отношении формулы /I/, могут быть получены из соединения формулы /X/, в которой D завершает 2-пиперидиноновое кольцо, а Z и m имеют значения, определенные в отношении формулы /I/, с помощью реакции с сильным основанием, таким как LiN(SiMe3)2 с последующей реакцией с соединением формулы /XVII/ /в которой Ar и Ar' имеют значения, определенные выше/ при температуре от -100 до +20oC, предпочтительно при 0oC, в растворителе. Подходящим растворителем является тетрагидрофуран.
Пиперидиноновые соединения формулы /X/ могут быть получены из соединений формулы /XXIII/, в которой Z и m имеют значения, определенные в отношении формулы /I/, при температуре от 0 до 80oC, предпочтительно 25 - 60oC, в растворителе в присутствии основания. Подходящими основаниями являются сильные основания, такие как гидрид натрия. Подходящим растворителем является диметилформамид. Соединения формулы /XXIII/ могут получаться из соединений формулы /XXIV/, в которой Z и m имеют значения, определенные в отношении формулы /I/, с помощью взаимодействия с ClC(O)(CH2)3Cl при температуре окружающей среды.
Соединения формулы /XXIV/ являются известными или могут быть получены из известных соединений с помощью обычных методов.
Соединения формулы /III/, в которой D завершает 2-пирролидиноновое кольцо, а Z и m имеют значения, определенные в отношении формулы /I/, могут получаться из соединения формулы /X/, в которой D завершает пирролидиноновое кольцо, и Z и m имеют значения, определенные в отношении формулы /I/, с помощью взаимодействия с сильным основанием, таким как LiN(SiMe3)2, с последующим взаимодействием формулы /XVII/ (где Ar и Ar' имеют значения, определенные выше) при температуре от -100 до +20oC, предпочтительно при 0oC, в растворителе. Подходящим растворителем является тетрагидрофуран. Пирролидиновые соединения формулы /X/ могут получаться с помощью нагревания и декарбоксилирования соединения формулы /XXV/, в которой Z и m имеют значения, определенные в отношении формулы /I/. Соединения формулы /XXV/ могут быть получены с помощью реакции соединения формулы /XXIV/, в которой Z и m имеют значения, определенные в отношении формулы /I/, с соединением формулы /XXXI/, полученным согласно методу, описанному в Organic Synthesis, том 60, страницы 66 - 68.
Соединения формулы /X/, в которой D завершает тиазолидиноновое кольцо, а Z и m имеют значения, определенные в отношении формулы /I/, могут быть получены из анилинов формулы /XXIV/, в которой Z и m имеют значения, определенные в отношении формулы /I/, с помощью реакции с тиогликолевой кислотой или тиомолочной кислотой, и карбонильным соединением R4 R5CO, давая тиазолидинон /XXVI/, в котором Z и m имеют значения, определенные в отношении формулы /I/, R3 представляет H или метил. Реакция предпочтительно проводится в растворителе или разбавителе и иногда осуществляется в присутствии сильного основания, такого как п-толуолсульфокислота. Предпочтительным растворителем является растворитель, который способен смешиваться с водой. Растворителем может быть удобным образом растворитель, который образует с водой азеотропную смесь и имеет точку кипения в интервале от 100 до 150oC, например, толуол или ксилол. Удобным образом реакция может осуществляться с помощью нагревания реакционной смеси в условиях дефлегмации, и сбор воды осуществляется в дефлегмирующем растворителе с помощью подходящего устройства (например, ловушки Дина-Старка). Нагревание в условиях дефлегмации может прерываться, когда объем собранной воды указывает на то, что реакция прошла в требуемой степени. Продукт может выделяться обычным путем, упариванием растворителя (например, при пониженном давлении), давая сырой 4-тиазолидинон в виде остатка. Данное вещество может очищаться, если необходимо, с помощью общепринятых способов, например, перекристаллизацией или с помощью хроматографии.
Реакция может варьироваться путем введения в реакцию анилина формулы /XXIV/, в которой Z и m имеют значения, определенные в отношении формулы /I/, и тиогликолевой кислоты в растворителе, таком как толуол или ксилол, при температурах 100 - 150oC, давая соединение формулы /XXXVI/, в которой Z и m имеют значения, определенные в отношении формулы /I/. Реакция может осуществляться в присутствии кислотного катализатора, такого как п-толуолсульфокислота.
Тиазолидиноны формулы /X/, в которой D завершает 4-тиазолидиноновое кольцо, и Z и m имеют значения, определенные в отношении формулы /I/, могут затем получаться с помощью реакции соединения формулы /XXXVI/, в которой Z и m имеют значения, определенные в отношении формулы /I/, с карбонильным соединением R4R5CO. Реакция предпочтительно осуществляется в растворителе, таком как толуол или ксилол, при температурах от 100 до 150oC. Реакция может катализироваться добавлением незначительного количества сильной кислоты, такой как п-толуолсульфоновая кислота.
Альтернатива, тиазолидиноны формулы /X/, в которой D завершает 4-тиазолидиноновое кольцо, и Z и m имеют значения, определенные в отношении формулы /I/, могут получаться с помощью реакции соединения формулы /XXXVI/, в которой Z и m имеют значения, определенные в отношении формулы /I/, с 1,1-дииодалканом, таким как дииодметан, в присутствии сильного основания и растворителя. Подходящими основаниями являются неорганические основания, такие как гидроокись натрия или гидроокись калия. Подходящими растворителями являются простые эфиры, такие как трагидрофуран или ацетон. Реакция проводится при температурах порядка 30 - 100oC, предпочтительно при температуре дефлегмации растворителя.
Альтернативно анилины формулы /XXIV/, в которой Z и m имеют значения, определенные в отношении формулы /I/, могут превращаться в соединение формулы /XXVI/, в которой Z и m имеют значения, определенные в отношении формулы /I/, и R3 представляет H, с помощью реакции с тиогликолевой кислотой и карбонильным соединением R4R5CO в растворителе, таком как этанол, при температуре от 0 до 50oC, предпочтительно при температуре окружающей среды, с последующей обработкой тионилхлоридом в органическом растворителе, таком как метиленхлорид.
Реакция подходящим образом осуществляется при температурах от 0 до 50oC, предпочтительно при температуре окружающей среды, в присутствии органического основания, такого как триэтиламин.
4-тиазолидинон /XXVI/ обрабатывается хлорирующим агентом /например, сульфурилхлоридом/ для превращения его в соответствующее хлорное соединение /XXVII/, в которой Z и m имеют значения, определенные доля формулы /I/. Удобным образом реакция осуществляется в растворителе, например, хлорированном углеводородном растворителе (например, дихлорметане, хлороформе или тетрахлоруглероде) при пониженной температуре (например, при температуре в интервале от 0 до 10oC). Реакция является обычно экзотермической и необходимо охлаждение (например, на ледяной бане) для поддержания температуры в предпочтительном интервале. Продукт может выделяться с помощью выпаривания растворителя (например, при пониженном давлении), оставляя сырое хлор-соединение в виде остатка. Неочищенный или сырой продукт /XXVII/ может очищаться при желании с помощью общепринятых методов /например, путем перекристаллизации/ или использоваться непосредственно на следующей стадии.
Хлор-соединение /XXVII/ превращается в соответствующее гидрокси-соединение /III/, в котором D завершает 4-тиазолидиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/ с помощью гидролиза в мягких условиях /например, при температуре окружающей среды, например, при 15 - 25oC, и при умеренном значении pH, например, при pH 8 - 9/. Реакция удобным образом осуществляется в растворителе. Растворителем может быть, например, смешиваемый с водой растворитель (например, тетрагидрофуран) или смесь такого растворителя с водой. Гидролиз может осуществляться, например, с помощью обработки хлор-соединения в растворе с водным бикарбонатом натрия при температуре окружающей среды и перемешивания смеси до тех пор, пока реакция по существу не завершится; это может занимать до нескольких дней. Гидрокси-соединение /III/ может выделяться с помощью общепринятых процедур, например, с помощью разбавления реакционной смеси водой, экстрагирования смеси не смешиваемым с водой органическим растворителем, сушкой органического экстракта и выпариванием его с получением гидрокси-соединения в виде остатка. Данный остаток может затем очищаться, если необходимо, с помощью общепринятых методов (например, с помощью перекристаллизации).
Соединения формулы /III/, в которой D завершает насыщенное 1,3,4-тиазолидиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/, могут также получаться из соединения формулы /XXXII/, в которой D завершает насыщенное тиазолидиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/, с помощью реакции сначала с сульфурилхлоридом в растворе дихлорметана при 0-25oC, с последующим гидролизом промежуточного хлор-соединения с использованием водного раствора бикарбоната натрия и смешиваемого с водой растворителя, такого как тетрагидрофуран.
Соединения формулы /XXXII/ могут получаться с помощью реакции соединения формулы /XXXIII/, в которой Z и m имеют значения, определенные в отношении формулы /I/, с сильным основанием, таким как гидрид натрия, с последующей обработкой соединением формулы /XXXIV/, в которой R30 представляет удаляемую группу, такую как галоид. Реакция проводится при 0 - 50oC, предпочтительно при температуре окружающей среды, в растворителе, таком как диметилформамид.
Соединения формулы /XXXIII/ могут получаться из соединений формулы /XXXV/, в которой Z и m имеют значения, определенные в отношении формулы /I/, с помощью реакции с тиогликолевой кислотой или тиомолочной кислотой и карбонильным соединением формулы COR4 R5 по способу, аналогичному способу получения соединений формулы /XXVI/.
Соединения формулы /XXV/ являются или известными соединениями, или могут быть получены из известных соединений с помощью общепринятых способов.
Соединения изобретения, в которых p представляет 1 или 2, могут быть получены с помощью обработки соответствующих соединений формулы /I/, в которой p равно 0, окисляющим агентом. Окисляющим агентом может быть, например, м-хлорнадбензойная кислота. Когда используется данный окисляющий агент, реакция может удобным образом осуществляться в растворителе, например, хлорированном углеводородном растворителе. Примеры таких растворителей включают дихлорметан и хлороформ. Реакция может проводиться при температуре окружающей среды (например, 15-25oC). При использовании одно-молярной пропорции м-хлорнадбензойной кислоты соединение формулы /I/, в которой p=0, может превращаться в соединение формулы /I/, в которой p=0. Точно таким же образом соединение формулы /I/, в которой p= 1, может превращаться в соединение формулы /I/, в которой р=2, с помощью обработки одно-молярным количеством м-хлорнадбензойной кислоты. Альтернативно, соединение формулы /I/, в которой р= 0, может превращаться непосредственно в соответствующее соединение, в котором p= 2, с помощью обработки двумя молярными пропорциями м-хлорнадбензойной кислоты.
Соединения формулы /X/, в которой D завершает 4-оксазолидиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/, могут получаться по способам, аналогичным способам, описанным для получения соединений формулы /X/, в которой D завершает 4-тиазолидиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/, но с использованием гликолевой кислоты вместо тиогликолевой кислоты и молочной кислоты вместо тиомолочной кислоты. Соединения формулы /III/, в которой D завершает форму 4-оксазолидинонового кольца, и Z и m имеют значения, определенные в отношении формулы /I/, могут получаться из соединений формулы /X/, в которой D завершает 4-оксазолидиноновое кольцо и Z и m имеют значения, определенные в отношении формулы /I/, по методам, аналогичным методам, описанным выше.
Соединения формулы /X/, в которой D завершает 4-имидазолидиноновое кольцо, и Z и m имеют значения, определенные в отношении формулы /I/, могут быть получены по способам, аналогичным способам, описанным для получения соединений формулы /X/, в которой D завершает 4-тиазолидиноновое кольцо, и Z и m имеют значения, определенные в отношении формулы /I/, с использованием альфа-амино кислотных производных вместо тиогликолевых кислот.
Соединения формулы /III/, в которой D завершает 4-имидазолидиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/, могут быть получены из соединений формулы /X/, в которой D завершает 4-имидазолидиноновое кольцо, и Z и m имеют значения, определенные в отношении формулы /I/, по способам, аналогичным тем, что описаны выше.
Соединения формулы /X/, в которой D завершает насыщенное пиразиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/, могут быть получены по способам, аналогичным способам, описанным для получения соединений (X), в которых D завершает дигидро-4-тиазиноновое кольцо, и Z и m имеют значения, описанные для формулы /I/, но с использованием альфа-амино сложного эфира вместо этилтиогликолята. Подходящим образом альфа-амино эфиром является этиловый эфир саркозина.
Соединения формулы /III/, в которой D завершает насыщенное пиразиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/, могут быть получены из соединений формулы /X/, в которой D завершает насыщенное пиразиноновое кольцо, и Z и m имеют значения, описанные для формулы /I/, по способам, аналогичным способам, описанным выше.
Соединения формулы /X/, в которой D завершает 3-пиразолидиноновое кольцо, и Z и m имеют значения, определенные в отношении формулы /I/, могут быть получены с помощью сочетания способов, аналогичных описанным для получения соединений формулы /XVI/, в которой Z и m имеют значения, определенные для формулы /I/, и соединений формулы /X/, в которой D завершает насыщенное 1,3,4-тиадиазиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/, но с использованием соединений формулы /XXXV/, в которой Z и m имеют значения, определенные в отношении формулы /I/, вместо соединения формулы /XV/, в которой Z и m имеют значения, определенные в отношении формулы /I/.
Соединения формулы /III/, в которой D завершает 3-пиразолидиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/, могут получаться из соединений формулы /X/, в которой D завершает 3-пиразолидиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/, по способам, аналогичным описанным выше.
Соединения формулы /VI/, в которой D завершает 3-пиридазиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/, и R20 представляет иод, могут быть получены с помощью сочетания методов, аналогичных способам, описанным для получения соединений формулы /XVIII/, в которой Z и m имеют значения, определенные для формулы /I/, и соединений формулы /X/, в которой D завершает насыщенное 1,3,4-тиадиазиноновое кольцо, и X и m имеют значения, определенные для формулы /I/, но с использованием соединений формулы /XXXV/, в которой Z и m имеют значения, определенные для формулы /I/, вместо соединений формулы /XV/, в которой Z и m имеют значения, определенные в отношении формулы /I/.
Соединения формулы /III/, в которой D завершает насыщенное пиридазиноновое кольцо, и Z и m имеют значения, определенные в отношении формулы /I/, могут быть получены из соединений формулы /I/, в которой D завершает насыщенное пиридазиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/, и R20 представляет иод, по способу, аналогичному способу, описанному для получения соединений формулы /III/, в которой D завершает насыщенное 1,2-оксазиноновое кольцо, и Z и m имеют значения, определенные для формулы /I/.
Специалистам в данной области техники очевидны видоизменения приведенных выше процедур, а также альтернативные способы получения соединений данного изобретения.
Соединения формулы /I/, приведенной выше, являются активными как гербициды, и изобретение, следовательно, предоставляет в соответствии со следующим аспектом способ сильного повреждения или уничтожения нежелательных растений, который предусматривает применение по отношению к растениям или к среде для роста растений гербицидно эффективного количества соединения формулы /I/, определенной здесь ранее.
Соединения формулы /I/ являются активными против широкого ряда сорняковых видов, включая однодольные и двудольные виды сорняков. Они показывают некоторую селективность в отношении некоторых видов; они могут использоваться, например, в качестве селективных гербицидов в посевах сои и кукурузы или маиса. Соединения формулы /I/ применяются непосредственно к нежелательным растениям (послевсходовое применение), но они предпочтительно применяются по отношению к почве перед тем, как появляются всходы нежелательных растений (предвсходовое применение).
Соединения формулы /I/ могут использоваться сами по себе для уничтожения или нанесения сильного ущерба нежелательным растениям, но предпочтительно они используются в виде композиций, включающих соединение формулы /I/ в смеси с носителем, включающим твердый или жидкий разбавитель.
Композиции, содержащие соединения формулы /I/, включают как разбавленные композиции, которые готовы для немедленного использования, так и концентрированные композиции, которые требуют разбавления перед использованием, обычно водой. Предпочтительно композиции содержат от 0,01% до 90% по весу активного ингредиента. Разбавленные композиции, готовые для использования, предпочтительно содержат от 0,01 до 2% активного ингредиента, в то время как концентрированные композиции могут содержать от 20 до 90% активного ингредиента, хотя обычно предпочитается от 20 до 70%.
Твердые композиции могут быть в форме гранул или пылящих порошков, в которых активный ингредиент смешан с тонко измельченным твердым разбавителем, например, каолином, бентонитом, кизельгуром, доломитом, карбонатом кальция, тальком, порошкообразной двуокисью магния, фуллеровой землей и гипсом. Они могут быть также в форме диспергируемых порошков или зернистых препаратов, включающих смачивающий агент для облегчения диспергирования порошка или зерен в жидкости. Твердые композиции в форме порошка могут применяться для опыления листвы в виде дустов.
Жидкие композиции могут включать раствор или суспензию активного ингредиента в воде, необязательно содержащей поверхностно-активный агент, или они могут включать раствор или дисперсию активного ингредиента в смешиваемом с водой органическом растворителе, который диспергируется в виде капелек в воде.
Поверхностно-активные агенты могут быть катионного, анионного или неионного типа или в виде смеси их. Катионными агентами являются, например, четвертичные аммониевые соединения /например, цетилтриметиламмоний бромид/. Подходящими анионными агентами являются мыла; соли алифатических моно-эфиров серной кислоты, например, лаурилсульфат натрия; и соли сульфированных ароматических соединений, например, додецилбензолсульфонат натрия, лигносульфонат натрия, кальция и аммония, бутилнафталинсульфонаты, и смеси натриевых солей диизопропил- и триизопропилнафталинсульфокислоты. Подходящими неионными агентами являются продукты конденсации окиси этилена с жирными спиртами, такими как олеиоловый спирт и цетиловый спирт, или с алкилфенолами, такими как октил- или нонил-фенол /например, Аграл 90/ или октилкрезол. Другими неионными агентами являются частичные сложные эфиры, получаемые из жирных кислот с длинной цепью и гекситол-ангидридов, например, монолаурат сорбитана; продукты конденсации частичных сложных эфиров с окисью этилена; лецитины; и силиконовые поверхностно-активные агенты /растворимые в воде поверхностно-активные агенты, имеющие скелет, который включает силоксановую цепь (например, Силвет L 77)). Подходящей смесью в минеральном масле является Атплюс 411F.
Водные растворы или дисперсии могут приготавливаться с помощью растворения активного ингредиента в воде или в органическом растворителе, необязательно содержащем смачивающий или диспергирующий агент/ы/, а затем, когда используются органические растворители, добавления полученной таким образом смеси к воде, необязательно содержащей смачивающий или диспергирующий агент(ы). Подходящие органические растворители включают, например, этиленхлорид, изопропиловый спирт, пропиленгликоль, диацетоновый спирт, толуол, керосин, метилнафталин, ксилолы и трихлорэтилен.
Композиции для использования в форме водных растворов или дисперсий обычно поставляются в форме концентрата, содержащего высокую пропорцию активного ингредиента, и концентрат затем разбавляется перед использованием водой. Концентраты обычно требуются для того, чтобы выдерживать хранение в течение длительных периодов, и после такого хранения они должны быть способны к разбавлению водой для образования водных препаратов, которые остаются гомогенными в течение достаточного времени, чтобы была возможность применять их с помощью обычного опрыскивающего оборудования. Концентраты удобным образом содержат 20 - 90%, предпочтительно 20-70%, по весу активного ингредиента (или ингредиентов). Разбавленные препараты, готовые для использования, могут содержать различные количества активного ингредиента в зависимости от цели, для которой предназначается препарат; обычно используются количества от 0,01 до 10,0% и предпочтительно 0,1-2%, по весу активного ингредиента.
Предпочтительная форма концентрированной композиции включает активный ингредиент, который тонко измельчен и диспергирован в воде, в присутствии поверхностно-активного агента и суспендирующего агента. Подходящими суспендирующими агентами являются гидрофильные коллоиды и включают они, например, поливинилпирролидон и карбоксиметилцеллюлозу натрия, и растительные камеди, например, камедь акации и камедь трагаканта. Предпочтительными суспендирующими агентами являются агенты, которые придают тиксотропные свойства препаратам и увеличивают вязкость концентрата. Примеры предпочтительных суспендирующих агентов включают гидратированные коллоидные силикаты, такие как монтмориллонит, бейделит, нонтронит, гекторит, сапонит и саукорит. Особенно предпочтительным является бентонит. Другие суспендирующие агенты включают производные целлюлозы и поливиниловый спирт.
Степень применения или норма расхода соединений данного изобретения зависит от ряда факторов, включающих например, соединение, выбранное для использования, вид растений, рост которых предполагается ингибировать, препаративная форма, выбранная для использования, и применяется ли соединение по отношению к листве или для поглощения корнями.
Однако, обычно норма расхода от 0,001 до 20 кг на гектар является подходящей, при этом, может быть предпочтительной норма расхода от 0,025 до 10 кг /на гектар.
Композиции данного изобретения могут включать в дополнение к одному или более соединениям настоящего изобретения одно или более соединений, не относящихся к изобретению, но которые обладают биологической активностью. Соответственно согласно еще одному воплощению изобретение предоставляет гербицидные композиции, включающие смесь по крайней мере одного гербицидного соединения формулы /I/, определенной выше, с по крайней мере одним другим гербицидом.
Другим гербицидом может быть любой гербицид, не имеющий формулу /1/. Им обычно является гербицид, оказывающий дополнительное действие при конкретном применении.
Примеры полезных дополнительных гербицидов включают:
А. бензо-2,1,3-тиадиазин-4-он-2,
2-диоксиды: такие как бентазон,
B. гербицидные гормоны, особенно фенокси-алкановые
кислоты, такие как MCPA, MCPA-тиоэтил, дихлорпроп, 2,4,5-Т, МСРВ, 2,4-Д, 2,4-ДВ, мекопроп, трихлопир,
клопиралид и их производные (например, соли, сложные эфиры и амиды).
C. 1,
3-диметилпиразольные производные, такие как пиразоксифен, пиразолат и бензофенап,
D. динитрофенолы
и их производные (например, ацетаты), такие как динотерб, диносеб и их эфиры, диносеб-ацетат,
E. динитроанилиновые гирбициды, такие как динитрамин, трифлуралин, этафлуролин, пендиметалин,
оризалин,
F. арилмочевиновые гербициды, такие как диурон, флуметурон, метоксурон,
небурон, изопротурон, хлортолурон, хлороксурон, линурон, монолинурон, хлорбромурон, даймурон,
метабензтиазурон,
G. фенилкарбамоилоксифенилкарбаматы, такие как фенмедифам и десмедифам,
H. 2-фенилпиридазин-2-она, такие как хлоридазон и норфлуразон,
I. урациловые
гербициды, такие как ленацил, бромацил и тербацил,
J. триазиновые гербициды, такие как атразин, симазин,
азипротрин, цианазин, прометрин, диметаметрин, симетрин и тербутрин,
К.
фосфортиоатные гербициды, такие как пиперофос, бензулид и бутамифос.
L. тиокарбаматные гербициды,
такие как циклоат, вернолат, молинат, тиобенкарб, бутилат, EPТC, три-аллат, ди-аллат,
эспрокарб, тиокарбазил, пиридат и димепиперат,
M. 1,2,4-триазин-5-оновые гербициды, такие как метамитрон
и метрибуцин,
N. Бензойнокислотные гербициды, такие как 2,3,6-ТВА, дикамба
и хлорамбен,
O. анилиновые гербициды, такие как претилахлор, бутахлор, атахлор, пропахлор, пропанил,
метазахлор, метолахлор, ацетохлор и диметахлор,
P. дигалоидбензонитрильные
гербициды, такие как дихлобенил, бромоксинил и иоксинил,
Q. галоидалкановые гербициды, такие как делапон,
ТСА и их соли,
R. дифениловоэфирные гербициды, такие как лактофен,
флурогликофен или их соли или сложные эфиры, нитрофен, бифенокс, ацифлурофен и его соли и сложные эфиры, оксифторфен,
фомезафен, хлорнитрофен и хлорметоксифен,
S. феноксифеноксипропионатные
гербициды, такие как диклофоп и его сложные эфиры, такие как метиловый эфир, флуазифоп и его эфиры, галоксифоп и его
эфиры, квазалофоп и его эфиры и феноксапроп и его эфиры, такие как этиловый эфир,
T. циклогександионовые гербициды, такие как аллоксидим и его соли, сетоксидим, циклоксидим, триалкоксидим и
клетодим,
U. сульфонилмочевиновые гербициды, такие как хлорсульфурон,
сульфометурон, метсульфурон и его эфиры, бензсульфурон, и его эфиры, такие как DPX-М6313, хлоримурон и его эфиры, такие
как этиловый эфир, пиримисульфурон и его сложные эфиры, такие как его метиловый
эфир, 2-[3-(4-метокси-6-метил-1,3,5-триазин-2-ил)-3-метилуреидосульфонил] бензойнокислотные сложные эфиры, такие как
метиловый эфир (DPX-LS300) и пиразосульфурон,
V. имидазолидиноновые
гербициды, такие как имазахин, имазаметабенз, имазапир и изопропиламмониевые соли его, имазетапир,
W.
ариланилидные гербициды, такие как флампроп и его эфиры, бензоилпроп-этил, дифлуфеникан,
X. аминокислотные гербициды, такие как глифосфат и глуфосинат и их соли и сложные эфиры, сульфосам и
биалафос,
Y. мышьякорганические гербициды, такие как мононатрийметанарсонат
/MSMA/,
Z. гербицидные амидные производные, такие как напропамид, пропизамид, карбетамид, тебутам,
бромбутид, изоксабен, напроанилид и напталам,
AA. дополнительные гербициды,
включающие этолсумезат, цинметилин, дифенокват, и его соли, такие как метилсульфатная соль, кломазон, оксадиазон,
бромфеноксим, барбан, тридифан, флурохлоридон, квинхлорак, мефанацет и трикетоновые
гербициды, такие как сулькотрион,
BB. Примеры контактных гербицидов включают:
бипиридилиевые
гербициды, такие как гербициды, в которых активной частью является паракват, и гербициды,
в которых активной частью является дикват,
* Эти соединения предпочтительно применяются в
сочетании с агентом безопасности, таким как дихлормид.
Данное
изобретение иллюстрируется примерами. /Получение промежуточных соединений описывается в Препаративных примерах или
примерах Получения/. Сокращения, используемые в примерах, имеют следующие
значения:
ЯМР спектр: спектр ядерно-магнитного резонанса, который регистрировался при 270 или 400 МГц. /Это относится
к спектру протонного магнитного резонанса, если не указано иное/.
Следующие сокращения используются для указания на множественность пиков в спектре ЯМР:
c. s (синглет), д. d (дублет), т. t
(триплет), кв. q (квартет), квин. quin (квинтет), м. m (мультиплет),
шир. br (широкий).
ИК спектр: спектр инфракрасного поглощения.
МС: масс-спектр
ГХ:
газовая хроматография
ТСХ: тонкослойная хроматография
т. пл: точка плавления, т.к.: точка кипения
Препаративный пример 1
Получение 3-(3,
4-дихлор)фенил-5-гидрокси-4-диазолидинона
Стадия 1
Получение 3-(3,
4-дихлор)фенил-4-тиазолидинона
Перемешиваемый раствор 3,4-дихлоранилина /10,00 г/ в толуоле /120
мл/ обрабатывался тиогликолевой кислотой /5,68 г/. Спустя 10 минут, раствор обрабатывался по
каплям 37% водным формальдегидом /4,75 мл/, а затем п-толуолсульфоновой кислотой /10 мг/. Смесь затем
нагревалась в условиях дефлегмации, и вода собиралась в аппарате Дина-Старка, через 4 часа смесь
охлаждалась и экстрагировалась насыщенным водным раствором бикарбоната натрия /100 мл/. Белое твердое
вещество выпадало в осадок, отфильтровывалось, сушилось и перекристаллизовывалось из смеси
этилацетат/гексан, давая целевое соединение в виде белого кристаллического твердого вещества, выход 5,70 г,
т.пл. 151 - 152oC.
1H ЯМР /CDCl3/: δ 3,71 /2H, c/, 4,79 /2H, c/, 7,37 /1H, дд./, 7,47 /1H, д./, 7,64 /1H, д/.
Стадия 2
Получение 3-(3,4-дихлор)фенил-5-гидрокси-4-тиазолидинона
Перемешиваемый раствор
3-(3,4-дихлор)фенил-4-тиазолидинона /полученного, как описано на стадии 1 выше/ /4,50 г/ в дихлорметане /130
мл/ охлаждался на ледяной бане. Через раствор барботировался поток азота, и по каплям
добавлялся раствор сульфурилхлорида /2,47 г/ в дихлорметане /5 мл/. После добавления раствор оставлялся
подогреваться до комнатной температуры и перемешивался в течение дополнительных 2 часов при
поддержании потока азота, раствор после растирания с гексаном растворялся в тетрагидрофуране /50 мл/. Данный
раствор обрабатывался водным раствором бикарбоната натрия /50 мл/, и смесь энергично
перемешивалась в течение 2 часов. Органический слой отделялся, разбавлялся этилацетатом /50 мл/, промывался солевым
раствором /50 мл/, затем сушился /сульфатом магния/. Выпаривание растворителя при
пониженном давлении давало смолу, которая хроматографировалась на силикагеле при элюировании смесями
гексан/этилацетат, давая целевое соединение в виде смолы, которая затвердевала при стоянии, давая
3,40 г.
1H ЯМР /CDCl3/: δ 4,78 /1H, д./, 5,06 /1H, д./, 5,58 /1H, д./, 6,98 /1H, д./, 7,40 - 7,50 /2H, м./, 7,80 /1H, д./.
Препаративный
пример 2
Получение 5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона
Стадия 1
Получение 3-(3-трифторметил)фенил-4-тиазолидинона
Перемешиваемый раствор
3-трифторметиланилина /43,50 г/ в толуоле /275 мл/ обрабатывался тиогликолевой кислотой /24,90 г/. Спустя 10
минут, по каплям добавлялся к раствору 37% водный формальдегид /20,8 мл/ с последующим
добавлением п-толуолсульфокислоты /30 мг/. Смесь затем нагревалась в условиях дефлегмации, и вода собиралась в
аппарате Дина-Старка. После того, как собиралось 23,5 мл воды, смесь охлаждалась,
экстрагировалась насыщенным водным раствором бикарбоната натрия /100 мл/ и сушилась /сульфатом магния/. Выпаривание
при пониженном давлении давало желтое масло, которое давало целевое соединение в
виде белого твердого вещества после растирания с гексаном, выход 44,50 г, т.пл. 59-60oC.
1H ЯМР /CDCl3/: δ 3,76 /2H, с./, 4,85 /2H, с./, 7,47 - 7,58 /2H, м./. 7,68 - 7,76 /2H, м./.
Стадия 2
Получение
5-хлор-3-(3-трифторметил)фенил-4-тиазолидинона
Перемешиваемый раствор
3-(3-трифторметил)фенил-4-тиазолидинона /полученного, как на стадии 1 выше/ /10,00 г/ в дихлорметане /150 мл/ охлаждался
на ледяной бане. Через раствор барботировался поток азота, и по каплям
добавлялся раствор сульфурилхлорида /5,47 г/ в дихлорметане /5 мл/. После добавления раствор оставался подогреваться до комнатной
температуры и перемешивался в течение еще одного часа при поддержании
струи азота. Раствор выпаривался при пониженном давлении, оставляя продукт в виде твердого остатка. Данный продукт использовался
непосредственно в последующих реакциях.
1H ЯМР /CDCl3 /: δ 4,72 /1H, д./, 5,24 /1H, д./, 5,77 /1H, с./, 7,50 - 7,61 /2H, м./, 7,70 - 7,82 /2H, м./.
Стадия 3
Получение
5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона
Перемешиваемый раствор 5-хлор-3-(3-трифторметил)фенил-4-тиазолидинона /полученного на стадии 2
выше/ в тетрагидрофуране /100
мл/ обрабатывался водным раствором бикарбоната натрия /100 мл/, и смесь перемешивалась энергично в течение 3 часов. Органический слой отделялся, разбавлялся этилацетатом
/50 мл/, промывался солевым
раствором /50 мл/, затем сушился /сульфатом магния/. Выпаривание растворителя при пониженном давлении оставляло смолу. Растирание с гексаном давало желтовато-коричневое
твердое вещество, которое
перекристаллизовывалось из смеси этилацетат/гексан, давая целевое соединение в виде белого кристаллического твердого вещества, выход 7,08 г, т. пл. 87 - 88oC.
1H ЯМР /CDCl3/: δ 4,70 /1H, д./, 5,00 /1H, широкий с./, 5,05 /1H, д./, 5,74 /1H, с./, 7,48 -7,59 /2H, м./, 7,64-7,76 /2H, м./.
Препаративный
пример 3
Получение 3-[3,5-бис(трифторметил)]фенил-5-гидрокси-4-тиазолидинона
Стадия 1
Получение 3-[3,5-бис(трифторметил)]фенил-4-тиазолидинона
С помощью процедуры,
аналогичной
процедуре, описанной в препаративном примере 2, стадия 1, выше, но при использовании 3,5-бис/трифторметил/анилина /10,42 г/, тиогликолевой кислоты /4,10 г/, 37% водного формальдегида /4,1
мл/ и
толуола /100 мл/ данное соединение получалось в виде белого твердого вещества, выход 10,80 г, т.пл. 49 - 51oC.
1H ЯМР /CDCl3/: δ 3,78 /2H, с./, 4,90 /2H, с./, 7,73 /1H, с./, 8,00 /2H, с./.
Стадия 2
Получение 5-хлор-3-[3,5-бис(трифторметил)]фенил-4-тиазолидинона
Данное соединение получалось с помощью
процедуры, сходной с процедурой, описанной в препаративном примере 2, стадия 2, выше, но с использованием 3-[3,5-бис(трифторметил)]фенил-4-тиазолидинона /полученного, как на стадии 1 выше/ /9,00 г/,
сульфурилхлорида /3,86 г/ и дихлорметана /25 мл/. Данный продукт использовался непосредственно на стадии 3
Стадия 3
Получение 5-гидрокси-3-[3,
5-бис(трифторметил)]фенил-4-тиазолидинона
С помощью процедуры, сходной с процедурой, описанной в препаративном примере 2, стадия 3 выше, но с использованием 5-хлор-3-[3,5-бис-(трифторметил)]
-фенил-4-тиазолидинона /полученного, как на стадии 2 выше/ целевое соединение получалось в виде белого твердого вещества, выход 7,10 г, т.пл. 138 - 139oC.
1H ЯМР /CDCl3/: δ 4,41 /1H, д./, 5,16 /1H, д./, 5,65 /1H, д./, 6,42 /1H, д./, 7,73 /1H, с./, 8,08 /1H, с./.
Препаративный пример 4
Получение
5-гидрокси-3-(4-трифторметил)фенил-4-тиазолидинона
Стадия 1
Получение 5-хлор-3-(4-трифторметил)фенил-4-тиазолидинона
Данное соединение получалось с помощью процедуры,
аналогичной процедуре, описанной в препаративном примере 2, стадия 2 выше, но при использовании 3-(4-трифторметил)фенил-4-тиазодлидинона /0,78 г/, сульфурилхлорида /0,25 мл/ и дихлорметана /5 мл/.
Данный продукт использовался непосредственно на стадии 2.
Стадия 2
Получение 5-гидрокси-3-(4-трифторметил)фенил-4-тиазолидинона
С помощью процедуры, сходной с
процедурой, описанной в препаративном примере 2, стадия 3 выше, но с использованием 5-хлор-3-/4-трифторметил/фенил-4-тиазолидинона /полученного, как на стадии 1 выше/ и хроматографирования сырого
продукта на силикагеле с элюированием диэтиловым эфиром получалось целевое соединение в виде белого твердого вещества, выход 0,22 г, т.пл. 100 - 101oC.
1H ЯМР /CDCl3: δ 4,47 /1H, широкий с./, 4,73 /1H, д./, 5,05 /1H, д./, 5,75 /1H, с./, 7,62 - 7,73 /4H, м./.
Препаративный пример 5
Получение
3-(3-хлор)фенил-5-гидрокси-4-тиазолидинона
Стадия 1
Получение 3-(3-хлор)фенил-4-тиазолидинона
С помощью процедуры, аналогичной процедуре, описанной в препаративном примере
2,
стадия 1 выше, но при использовании 3-хлоранилина /30,10 г/, тиогликолевой кислоты /21,7 г/, 37% водного раствора формальдегида /18,3 мл/, толуола /350 мл/ и п-толуолсульфокислоты /30 мг/ и
перекристаллизации неочищенного продукта из смеси этилацетат/гексан получалось данное соединение в виде бледно-желтого твердого вещества, выход 36,80 г, т.пл. 79oC.
1H ЯМР /CDCl3/: δ 3,72 /2H, с./, 4,80 /2H, с./, 7,22 /1H, м./, 7,28 - 7,40 /2H, м./, 7,50 /1H, м./.
Стадия 2
Получение
5-хлор-3-(3-хлор)фенил-4-тиазолидинона
Данное соединение получалось с помощью процедуры, сходной с процедурой, описанной в препаративном примере 2, стадия 2 выше, но с использованием
3-(3-хлор)фенил-4-тиазолидинона /полученного, как на стадии 1 выше/ /34,70 г/, сульфурилхлорида /13,20 мл/ и дихлорметана /150 мл/. Данный продукт использовался непосредственно на стадии 3.
Стадия 3
Получение 3-(3-хлор)фенил-5-гидрокси-4-тиазолидинона
С помощью процедуры сходной с процедурой, описанной в препаративном примере 2, стадия 3 выше, но с
использованием 5-хлор-3-(3-хлор)-фенил-4-тиазолидинона /полученного, как на стадии 2 выше/, тетрагидрофурана /150 мл/ и насыщенного водного раствора бикарбоната натрия /150 мл/ и очистки сырого
продукта с помощью хроматографии на силикагеле при элюировании смесью этилацетат/гексан получалось целевое соединение, выход 19,90 г, т.пл. 112 - 114oC.
1H ЯМР /CDCl3/: δ 4,64 /1H, д./, 5,00 /1H, д./, 5,39 /1H, широкий с./, 5,75 /1H, с./, 7,20 - 7,38 /3H, м./, 7,50 /1H, с./.
Препаративный пример 6
Получение 3-(3,
5-дихлор)фенил-5-гидрокси-4-тиазолидинона
Стадия 1
Получение 3-(3,5-дихлор)фенил-4-тиазолидинона
С помощью процедуры, сходной с процедурой, описанной в препаративном
примере
2, стадия 1 выше, но с использованием 3,5-дихлоранилина /28.70 г/, тиогликолевой кислоты /16.30 г/ 37% водного раствора формальдегида /13.7 мл/, толуола /350 мл/ и п-толуолсульфоновой кислоты
/30
мг/ и перекристаллизации неочищенного продукта из смеси этилацетат/гексан данное соединение получалось в виде бледно-желтого твердого вещества, выход 28,70 г.
1H ЯМР /CDCl3/: δ 3,72 /2H, с./, 4,78 /2H, с./, 7,21 /1H, т./, 7,45 /2H, д./.
Стадия 2
Получение 5-хлор-3-(3,5-дихлор)фенил-4-тиазолидинона
Данное
соединение получалось с помощью процедуры, сходной с процедурой, описанной в препаративном примере 2, стадии 2 выше, но с использованием 3-(3,5-дихлор)фенил-4-тиазолидинона /полученного, как описано
на стадии 1 выше/ /28.30г/, сульфурилхлорида /9,2 мл/ и дихлорметана /100 мл/. Данный продукт использовался непосредственно на стадии 3.
Стадия 3
Получение 3-(3,
5-дихлор)фенил-5-гидрокси-4-тиазолидинона
С помощью процедуры, сходной с процедурой, описанной в препаративном примере 2, стадия 3, выше, но с использованием 5-хлор-3-(3,
5-дихлор)фенил-4-тиазолидинона /полученного, как описано на стадии 2 выше/, тетрагирофурана /125 мл/ и насыщенного водного бикарбоната натрия /125 мл/ и растирания неочищенного продукта с диэтиловым
эфиром получалось целевое соединение, выход 16,70 г, т.пл. 107 - 111oC.
1H ЯМР /CDCl3/: δ 4,61 /1H, д./, 4,98 /1H, д./, 5,19 /1H, широкий с./, 5, 71 /1H, с./, 7,21 /1H, м./, 7,42 /2H, м./.
Препаративный пример 7
Получение 3-(3-хлор-4-фтор)фенил-5-гидрокси-4-тиазолидинона
Стадия 1
Получение
3-(3-хлор-4-фтор)фенил-4-тиазолидинона
С помощью процедуры, сходной с процедурой, описанной в препаративном примере 2, стадия 1 выше, но с использованием 3-хлор-4-фторанилина /19,46 г/,
тиогликолевой кислоты /12,50 г/, 37% водного раствора формальдегида /10,5 мл/ и толуола /150 мл/ и растирания неочищенного продукта со смесью диэтиловый эфир/гексан получалось данное соединение в
виде
бледно-желтого твердого вещества, выход 22,30 г, т. пл. 95 - 97oC.
1H ЯМР /CDCl3/: δ 3,72 /2H, с./, 4,78 /2H, с./, 7,18 /1H, м./, 7,31 /1H, м./, 7,55 /1H, м./.
Стадия 2
Получение 5-хлор-3-(3-хлор-4-фтор)фенил-4-тиазолидинона
Данное соединение получалось с помощью процедуры, сходной с процедурой,
описанной в
препаративном примере 2, стадия 2 выше, но с использованием 3-(3-хлор-4-фтор)фенил-4-тиазолидинона /полученного, как описано на стадии 1 выше/ /20,00 г/, сульфурилхлорида /11,2 мл/ и
дихлорметана /100
мл/. Данный продукт использовался непосредственно на стадии 3.
1H ЯМР /CDCl3/: δ 4,63 /1H, д./, 5,27 /1H, д./, 5,75 /1H, с./, 7,21 /1H, м./, 7,37 /1H, м./, 7,61 /1H, м./.
Стадия 3
Получение 3-(3-хлор-4-фтор)-фенил-5-гидрокси-4-тиазолидинона
Целевое соединение получалось в виде белого твердого
вещества с помощью
процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 3 выше, но с использованием 5-хлор-3-(3-хлор-4-фтор)-фенил-4-тиазолидинона /полученного, как описано
на стадии 2 выше/,
тетрагидрофурана /50 мл/ и насыщенного водного бикарбоната натрия /50 мл/ и очистки сырого продукта с помощью хроматографии на силикагеле при элюировании смесью этилацетат/гексан с
последующим
растиранием с четыреххлористым углеродом, выход 12,50 г, т. пл. 118 - 121oC.
1H ЯМР /CDCl3/: δ 4,63 /1H, д./, 4,85 /1H, широкий с./, 4,95 /1H, д./, 5,73 /1H, с./, 7,19 /1H, м./, 7,33 /1H, м./, 7,58 /1H, м./.
Препаративный пример 8
Получение 3-(2-хлор)-фенил-5-гидрокси-4-тиазолидинона
Стадия
1
Получение 3-(2-хлор)фенил-4-тиазолидинона
Данное соединение получалось в виде белого твердого вещества с выходом 5,70 г/ т. пл. 62 - 63oC/ с помощью процедуры, сходной
с процедурой,
описанной в препаративном примере 2, стадия 1 выше, но с использованием 2-хлоранилина /12,75 г/, тиогликолевой кислоты /9,2 г/, 37% водного раствора формальдегида /7,8 мл/ и толуола
/100 мл/ и
очистки сырого продукта с помощью хроматографии на силикагеле при элюировании смесью этилацетат/гексан.
1H ЯМР /CDCl3/: δ 3,72 /2H, с./, 4,69 /2H, с./, 7, 28-7,40 /3H, м./, 7,49 /1H, м./.
Стадия 2
Получение 5-хлор-3-(2-хлор)фенил-4-тиазолидинона
Данное соединение получалось с помощью процедуры, аналогичной
процедуре,
описанной в препаративном примере 2, стадия 2 выше, но при использовании 3-(2-хлор)фенил-4-тиазолидинона /полученного на стадии 1 выше/ /5,20 г/, сульфурилхлорида /2,0 мл/ и дихлорметана
/50 мл/.
Данный продукт использовался непосредственно на стадии 3.
Стадия 3
Получение 3-(2-хлор)фенил-5-гидрокси-4-тиазолидинона
Целевое соединение получалось в
виде белого
твердого вещества с помощью процедуры, сходной с процедурой, описанной в препаративном примере 2, стадия 3 выше, но с использованием 5-хлор-3-/2-хлор/фенил-4-тиазолидинона /полученного,
как описано в
стадии 2 выше/, тетрагидрофурана /25 мл/ и насыщенного водного бикарбоната натрия /25 мл/ и перекристаллизации неочищенного продукта из толуола, выход 3,80 г, т. пл. 117 - 119oC.
1H ЯМР /CDCl3/: δ 4,58 /1H, д/, 4,83 /1H, д./, 5,05 /1H, с./, 5,78 /1H, с./, 7,30 - 7,21 /3H, м./, 7,52 /1H, м./.
Препаративный
пример 9
Получение 5-гидрокси-3-(4-метокси)фенил-4-тиазолидинона
Стадия 1
Получение 3-(4-метокси)фенил-4-тиазолидинона
Данное соединение получалось с помощью
процедуры, сходной с
процедурой, описанной в препаративном примере 2, стадия 1 выше, но с использованием 4-метоксианилина /8,43 г/, тиогликолевой кислоты /6,30 г/, 37% водного раствора формальдегида
/5,3 мл/ и толуола
/100 мл/ и перекристаллизации сырого продукта из смеси этилацетат/гексан, белое твердое вещество, выход 7,00 г, т. пл. 95 - 97oC.
1H ЯМР /CDCl3/: δ 3,72 /2H, с./, 3,80 /3H, с./, 4,77 /2H, с./, 6,90 - 6,96 /2H, м./, 7,27 - 7,33 /2H, м./.
Стадия 2
Получение
5-хлор-3-(4-метокси)фенил-4-тиазолидинона
Данное
соединение получалось с помощью процедуры, сходной с процедурой, описанной в препаративном примере 2, стадия 2 выше, но при использовании
3-(4-метокси)фенил-4-тиазолидинона /полученного, как описано в
стадии 1 выше/, /6.20 г/, сульфурилхлорида /2.4 мл/ и дихлорметана /50 мл/. Данный продукт использовался непосредственно на стадии 3.
Стадия 3
Получение
5-гидрокси-3-(4-метокси)фенил-4-тиазолидинона
Целевое соединение получалось в виде рыжевато-коричневого твердого вещества с помощью процедуры,
аналогичной процедуре, описанной в препаративном
примере 2, стадия 3 выше, но при использовании 5-хлор-3-/4-метокси/фенил-4-тиазолидинона /полученного, как описано на стадии 2 выше/, тетрагидрофурана
/30 мл/ и насыщенного водного бикарбоната натрия
/60 мл/ и очистки сырого продукта с помощью хроматографии на силикагеле при элюировании смесью этилацетат/гексан с последующей перекристаллизацией из
толуола, выход 3,20 г, т. пл. 126 - 128o
C.
1H ЯМР /CDCl3/: δ 3,81 /3H, с./, 4,63 /1H, д/, 4,87 /1H, д./, 4,94 /1H, д./, 5,75 /1H, д./, 6,89-6, 97 /2H, м./, 7,28-7,36 /2H, м./.
Препаративный пример 10
Получение 3-(2,3-дихлор)фенил-5-гидрокси-4-тиазолидинона
Стадия 1
Получение 3-(2,
3-дихлор)фенил-4-тиазолидинона
Данное соединение получалось
в виде белого твердого вещества с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 1 выше, но
с использованием 2,3-дихлоранилина /10,00 г/, тиогликолевой кислоты
/5,68 г/, 37% водного раствора формальдегида /4,75 мл/, толуола /120 мл/ и п-толуолсульфокислоты /10 мг/ и растирания сырого
продукта со смесью диэтиловый эфир/гексан, выход 1,43 г.
1H ЯМР /CDCl3/: δ 3,73 /2H, с./, 4,67 /2H, с./, 7,15-7,32 /2H, м./, 7,51 /1H, м./.
Стадия 2
Получение 5-хлор-3-(2,
3-дихлор)фенил-4-тиазолидинона
Данное соединение получалось с помощью процедуры, сходной с процедурой, описанной в препаративном примере 2, стадия 2
выше, но при использовании 3-(2,
3-дихлор)фенил-4-тиазолидинона /полученного на стадии 1 выше/ /1,20 г/, сульфурилхлорида /0,65 г/ и дихлорметана /20 мл/. Данный продукт использовался непосредственно
на стадии 3.
Стадия 3
Получение 3-(2,3-дихлор)фенил-5-гидрокси-4-тиазолидинона
Целевое соединение получалось в виде бледно-желтого твердого вещества с выходом 0,66
г с помощью процедуры, сходной
с процедурой, описанной в препаративном примере 2, стадия 3 выше, но с использованием 5-хлор-3-(2,3-дихлор)фенил-4-тиазолидинона /полученного, как описано на стадии 2
выше), тетрагидрофурана /30 мл/ и
насыщенного водного бикарбоната натрия /25 мл/ и растирания неочищенного продукта с диэтиловым эфиром.
1H ЯМР /CDCl3/: δ 4,52 /1H, д./, 4,85 /1H, д./, 5,60 /1H, д./, 6,99 /1H, д./, 7,30 - 7,40 /2H, м./, 7,55 /1H, м./.
Препаративный пример 11
Получение
5-гидрокси-3-(4-метил)фенил-4-тиазолидинона
Стадия 1
Получение 3-(4-метил)фенил-4-тиазолидинона
Данное соединение получалось в виде белого твердого вещества с помощью
процедуры, сходной с процедурой, описанной в препаративном примере 1, стадия
1 выше, но при использовании 4-метиланилина /14,30 г/, тиогликолевой кислоты /12,30 г/, 37% водного раствора формальдегида
/10,4 мл/ и толуола /150 мл/, выход 10,50 г, т. пл. 138 - 141o
C.
1H ЯМР /CDCl3/: δ 2,34 /3H, с./, 3,72 /2H, с./, 4,79 /2H, с./, 7,15 - 7,32 /4H, м./.
Стадия 2
Получение
5-хлор-3-(4-метил)фенил-4-тиазолидинона
Данное соединение получалось с помощью процедуры, сходной с процедурой, описанной в препаративном
примере 2, стадия 2 выше, но при использовании
3-(4-метил)фенил-4-тиазолидинона /полученного, как описано на стадии 1 выше/ /9,00 г/, сульфурилхлорида /3,8 мл/ и дихлорметана /100 мл/. Данный продукт
использовался непосредственно на стадии 3.
Стадия 3
Получение 5-гидрокси-3-(4-метил)фенил-4-тиазолидинона
Целевое соединение получалось в виде бледно-желтого
твердого вещества с помощью процедуры, сходной с
процедурой, описанной в препаративном примере 2, стадия 3 выше, но при использовании 5-хлор-3-(4-метил)фенил-4-тиазолидинона /полученного, как описано
на стадии 2 выше/, тетрагидрофурана /75 мл/ и
насыщенного водного бикарбоната натрия /100 мл/ и перекристаллизации сырого продукта из толуола, выход 5,00 г, т. пл. 137 - 138oC.
1H ЯМР /CDCl3/: δ 2,37 /3H, с./, 4,60 /1H, д./, 4,95 /1H, д./, 5,71 /2H, с. + широкий с./, 7,12 - 7,31 /4H, м./.
Препаративный пример 12
Получение
3-(3-хлор)фенил-5-гидрокси-4-тиазолидинона
Стадия 1
Получение 3-(4-хлор)фенил-4-тиазолидинона
Данное соединение получалось в виде белого твердого вещества с
помощью
процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 1 выше, но при использовании 4-хлоранилина /14,50 г/, тиогликолевой кислоты /10,50 г/, 37% водного раствора
формальдегида
/8,9 мл/ и толуола /150 мл/ и растирания сырого продукта с диэтиловым эфиром, выход 17,0 г, т. пл. 96 - 98oC.
1H ЯМР /CDCl3/: δ 3, 72 /2H, с./, 4, 79 /2H, с./, 7,32-7,43 /4H, м./.
Стадия 2
Получение 5-хлор-3-(4-хлор)фенил-4-тиазолидинона
Данное соединение получалось с помощью процедуры,
аналогичной процедуре,
описанной в препаративном примере 2, стадия 2, выше, но при использовании 3-(4-хлор)фенил-4-тиазолидинона /полученного, как описано выше на стадии 1/ /15,00 г/,
сульфурилхлорида /5,7 мл/ и
дихлорметана /150 мл/. Данный продукт использовался непосредственно на стадии 3.
Стадия 3
Получение 3-(4-хлор)фенил-5-гидрокси-4-тиазолидинона
Целевое соединение
получалось с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 3 выше, но при использовании 5-хлор-3-(4-хлор)фенил-4-тиазолидинона
/полученного на стадии 2 выше/,
тетрагидрофурана /50 мл/ и насыщенного водного бикарбоната натрия /50 мл/ и перекристаллизации неочищенного продукта из толуола, выход 9,80 г, т. пл. 118 - 120oC.
1H ЯМР /CDCl3/: δ 4,62 /1H, д./, 4,96 /1H, д./, 5,05 /1H, широкий с./, 5,72 /1H, с./, 7,33 - 7,45 /4H, м./.
Препаративный
пример 13
Получение 3-(2,
5-дихлор)фенил-5-гидрокси-4-тиазолидинона
Стадия 1
Получение 3-(2,5-дихлор)фенил-4-тиазолидинона
Данное соединение поучалось в виде белого
твердого вещества с помощью
процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 1 выше, но при использовании 2,5-дихлоранилина /10,00 г/, тиогликолевой кислоты /5,68 г/, 37%
водного раствора
формальдегида /4,75 мл/, толуола /120 мл/ и п-толуолсульфокислоты /10 мг/ и растирания сырого продукта со смесью диэтиловый эфир/гексан, выход 0,78 г.
1H ЯМР /CDCl3/: δ 3,71 /2H, с./, 4,66 /2H, с./, 7,29 - 7,46 /3H, м./.
Стадия 2
Получение 5-хлор-3-(2,5-дихлор)фенил-4-тиазолидинона
Данное соединение
получалось с
помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 2 выше, но при использовании 3-(2,5-дихлор)фенил-4-тиазолидинона /полученного, как описано выше, на
стадии 1/ /0,
68 г/, сульфурилхлорида /0,37 г/ и дихлорметана /15 мл/. Данный продукт использовался непосредственно на стадии 3.
Стадия 3
Получение 3-(2,
5-дихлор)фенил-5-гидрокси-4-тиазолидинона
Целевое соединение получалось в виде рыжевато-коричневого твердого вещества с помощью процедуры, аналогичной процедуре, описанной в препаративном
примере 2, стадия 3 выше, но при использовании 5-хлор-3-(2,5-дихлор)фенил-4-тиазолидинона /полученного на стадии 2 выше/, тетрагидрофурана /20 мл/ и насыщенного водного бикарбоната натрия /30 мл/ и
растирания сырого продукта с диэтиловым эфиром, выход 0,36 г.
1H ЯМР /CDCl3/: δ 4,55 /1H, д/, 4,87 /1H, д./, 5,68 /1H, д./, 6,31 /1H, д./, 7,25 - 7,46 /3H, м./.
Препаративный пример 14
Получение 4-гидрокси-2-(3-трифторметил)фенил-3-изоксазолидинона
Стадия 1
Получение N-(3-трифторметил)фенилгидроксиламина.
Получение его описано в препаративном примере 50.
Стадия 2
Получение 4-бром-2-(3-трифторметил)фенил-3-изоксазолидинона
Раствор
N-/3-трифторметил/фенилгидроксиламина /4,69 г/ и триэтиламина /2,94 г/ в сухом тетрагидрофуране /5 мл/ добавлялся по каплям на протяжении 30 минут к энергично перемешиваемому раствору 2,
3-дихромпропионилхлорида /6,63 г/ в сухом тетрагидрофуране /20 мл/, охлажденном до 0oC. Смесь оставалась подогреваться медленно до комнатной температуры и стоять на протяжении ночи. Смесь
затем фильтровалась через Гифло Суперцел, и фильтрат энергично перемешивался с водным раствором карбоната натрия /2 мл, насыщенный/ в течение 2 часов. Смесь оставлялась стоять на протяжении ночи,
разбавлялась этилацетатом, промывалась солевым раствором, сушилась над сульфатом магния и выпаривалась при пониженном давлении. Остаток хроматографировался на двуокиси кремния с использованием смеси
дихлорметан-гексан /3,1/, а затем дихлорметана в качестве элюентов, давая целевое соединение /2,84 г/ в виде масла.
1H ЯМР /CDCl3/: δ 4,6 /1H, дд./, 4,75 /1H, дд./, 4,8 /1H, дд./, 7,4 /2H, м./, 7,9 /2H, м./.
M/C: 309 /M+, Br = 79/.
Стадия 3
Получение
4-иод-2-(3-трифторметил)фенил-3-изоксазолидинона
Смесь 4-бром-2-(3-трифторметил)фенил-3-изоксазолидинона /0,28 г/ и иодида натрия /0,36 г/ в ацетоне /10 мл/ перемешивалась в отсутствии света
в течение двадцати часов при комнатной температуре. Затем она фильтровалась через Гифло Суперцел и выпаривалась при пониженном давлении. Остаток растворялся в этилацетате, промывался водой и солевым
раствором, сушился над сульфатом магния и выпаривался при пониженном давлении, давая целевое соединение /0,28 г/ в виде бледно-желтого масла, по существу чистого по данным ГХ.
1H ЯМР /CDCl3/: δ 4,6 /1H, дд./, 4,75 /1H, дд./, 4,95 /1H, дд./, 7,5 /2H, м./, 8,0 /2H, м./.
М/С: 357 /M+/
Стадия 4
Получение
2-(3-трифторметил)фенил-3-изоксазолидинона
Раствор 4-иод-2-(3-трифторметил)фенил-3-изоксазолидинона /0,20 г/, гидрида трибутилолова /0,16 г/ и α, α-азоизобутиронитрила /0,01
г/ в толуоле /10 мл/ нагревался в условиях дефлегмации в течение двух часов. Смесь выпаривалась при пониженном давлении, и остаток хроматографировался на двуокиси кремния с использованием гексана, а
затем смеси этилацетат-гексан /1:3/ в качестве элюентов. Целевое соединение получалось /0,09 г/ в виде бледно-желтого масла.
1H ЯМР (CDCl3/: δ 3,05 /2H, т/, 4,6 /2H, т./, 7,5 /2H, м./, 8,0 /2H, м. /.
M/C: 231 /M+/
Данное вещество может быть получено более удобным образом с помощью сочетания арилгидроксиламина
непосредственно с 3-бромпропионилхлоридом. Хотя очистка является крайне утомительной, на стадии 5 может непосредственно использоваться частично очищенный материал.
Так, раствор N-(3-трифторметил)фенилгидроксиламина /0,50 г/ и триэтиламина /0,59 г/ в сухом тетрагидрофуране /5 мл/ добавлялся по каплям к перемешиваемому раствору 3-бромпропионилхлорида /0,48 г/ в сухом тетрагидрофуране /20 мл/, охлажденном до 0oC. Смесь перемешивалась при 0oC в течение 2 часов, оставлялась подогреваться до комнатной температуры, разбавлялась этилацетатом и промывалась водным раствором карбоната натрия, а затем солевым раствором. Экстракт сушился над сульфатом магния, упаривался при пониженном давлении, и остаток хроматографировался на двуокиси кремния с использованием смеси этилацетат-гексан /1:3/ в качестве элюента, давая бледно-желтое масло /0,22 г/. Данное масло содержало приблизительно 30% целевого соединения, по данным1H ЯМР, при этом имелось несколько загрязняющих веществ.
Стадия 5
Получение 4-гидрокси-2-(3-трифторметил)фенил-3-изоксазолидинона
Бис/триметилсилил/амид лития /0,29 мл, 1M
раствор в тетрагидрофуране/ добавлялся медленно к перемешиваемому раствору чистого 2-(3-трифторметил)фенил-3-изоксазолидинона /0,06 г/ в сухом тетрагидрофуране /5 мл/, температура при этом
поддерживалась ниже -75oC. Смесь перемешивалась в течение десяти минут при -78oC, оставлялась подогреваться до -25oC, повторно охлаждалась до -78oC, затем
обрабатывалась N-(4-толуолсульфонил)-3- фенилоксазиридином /0,08 г, полученным, как описано в J. Org. Chem., 1988, 53, 2087/. Смесь перемешивалась при -78oC в течение еще 1 часа,
оставлялась подогреваться до комнатной температуры, выливалась в насыщенный водный раствор хлористого аммония и экстрагировалась этилацетатом. Экстракты промывались солевым раствором, сушились над
сульфатом магния и выпаривались при пониженном давлении. Остаток хроматографировался на двуокиси кремния с использованием в качестве элюентов смеси гексан-этилацетат /3:1/, а затем этилацетата, давая
бледно-желтое твердое вещество /0,05 г/, включающее смесь целевого соединения и толуол-п-сульфонамида. Данный материал может непосредственно использоваться для карбамоилирования, и трет-бутилкарбамат
легко отделяется от толуол-п-сульфонамида.1H ЯМР /CDCl3/: сигналы только целевого соединения: δ 4,0 /1H, широкий с./, 4,35 /1H, т./, 4,8 /1H, т./, 4,95 /1H, т./, 7,5 /2H,
м./, 7,95 /2H, м./.
ГХ/МС: M+ 247.
Препаративный пример 15
Получение 3-(2-фтор-5-трифторметил)фенил-5-гидрокси-4-тиазолидинона
Стадия
1
Получение 3-(2-фтор-5-трифторметил)фенил-4-тиазолидинона
С помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 1 выше, но при использовании
2-фтор-5-трифторметиланилина /10,20 г/, тиогликолевой кислоты /5,80 г/, 37% водного раствора формальдегида /4,8 мл/ и толуола /100 мл/ и перегонки Кугельрора сырого продукта при пониженном давлении
получалось данное соединение в виде бесцветного масла, которое кристаллизовалось при стоянии, выход 2,80 г, т. пл. 40 - 43oC.
1H ЯМР /CDCl3/: δ 3,71 /2H, с./, 4,74 /2H, с./, 7,30 /1H, м./, 7,58 - 7,70 /2H, м./.
Стадия 2
Получение 5-хлор-3-(2-фтор-5-трифторметил)фенил-4-тиазолидинона
Данное соединение
получалось с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 2 выше, но при использовании 3-(2-фтор-5-трифторметил)фенил-4-тиазолидинона /полученного на стадии 1
выше/, сульфурилхлорида /0,85 мл/ и дихлорметана /25 мл/. Данный продукт использовался непосредственно на стадии 3.
Стадия 3
Получение
3-(2-фтор-5-трифторметил)фенил-5-гидрокси-4- тиазолидинона
Целевое соединение получалось в виде белого твердого вещества с помощью процедуры, аналогичной процедуре, описанной в препаративном
примере 2, стадия 3 выше, но при использовании 5-хлор-3-(2-фтор-5-трифторметил)фенил-4-тиазолидинона /полученного на стадии 2 выше/, тетрагидрофурана /30 мл/ и насыщенного водного бикарбоната натрия
/50 мл/, перекристаллизации неочищенного продукта из хлороформа, выход 2,10 г, т. пл. 145 - 147oC.
1H ЯМР /CDCl3/: δ 4,69 /1H, д./, 4,96 /1H, д./, 5,64 /1H, д./, 6,85 /1H, д./, 7,28 - 7,38 /1H, м./, 7,61 /1H, м./, 7,75 /1H, м./.
Препаративный пример 16
Получение
3-(3-хлор-4-метил)фенил-5-гидрокси-4-тиазолидинона
Стадия 1
Получение 3-(3-хлор-4-метил)фенил-4-тиазолидинона
Данное соединение получалось в виде кристаллического твердого
вещества с помощью процедуры, аналогичной процедуре,
описанной в препаративном примере 2, стадия 1 выше, но с использованием 3-хлор-4-метилфениланилина /14,15 г/, тиогликолевой кислоты /9,20 г/, 37%
водного раствора формальдегида /7,88 мл/ и толуола
/120 мл/ и растирания сырого продукта со смесью диэтиловый эфир/гексан с последующей перекристаллизацией из смеси этилацетат:гексан, выход 10,50 г,
т. пл. 90 - 91oC.
1H ЯМР /CDCl3/: δ 2,32 /3H, с./, 3,71 /2H, с./, 4,76 /2H, с./, 7,25 /2H, с./, 7,47 /1H, с./.
Стадия 2
Получение
5-хлор-3-(3-хлор-4-метил)фенил-4-тиазолидинона
Данное соединение получалось с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 2 выше, но
при
использовании 3-(3-хлор-4-метил)фенил-4-тиазолидинона /полученного, как на стадии 1 выше/ /8,80 г/, сульфурилхлорида /3,13 мл/ и дихлорметана /50 мл/. Данный продукт использовался непосредственно
на
стадии 3.
Стадия 3
Получение 3-(3-хлор-4-метил)фенил-5-гидрокси-4-тиазолидинона
Целевое соединение получалось в виде белого твердого вещества с помощью процедуры,
аналогичной процедуре, описанной в препаративном примере 2, стадия 3 выше, но при использовании 5-хлор-3-(3-хлор-4-метил)фенил-4-тиазолидинона /полученного, как на стадии 2 выше/, тетрагидрофуран
/50
мл/ и насыщенного водного бикарбоната натрия /50 мл/ и перекристаллизации сырого продукта из смеси этилацетат/гексан, выход 6,20 г, т. пл. 91 - 93oC.
1H ЯМР /CDCl3/: δ 2,33 /3H, с./, 4,61 /1H, д./, 4,97 /1H, д./, 5,39 /1H, с./, 5,73 /1H, с./, 7,23 /2H, с./, 7,46 /1H, с./.
Препаративный пример
17
Получение
5-гидрокси-3-фенил-4-тиазолидинона
Стадия 1
Получение 3-фенил-4-тиазолидинона
Данное соединение получалось в виде бесцветных игл с выходом 0,38 г с помощью процедуры,
аналогичной процедуре, описанной в препаративном примере 2, стадия 1 выше, но с использованием анилина /4,65 г/, тиогликолевой кислоты /4,60 г/, 37% водного раствора формальдегида /4,5 мл/, толуола
/100 мл/ и п-толуолсульфокислоты /10 мг/ и очистки сырого продукта с помощью хроматографии на силикагеле /элюирование хлороформом/ с последующей перекристаллизацией из смеси хлороформ/гексан.
1H ЯМР /CDCl3/: δ 3,73 /2H, м./, 4,81 /2H, м./, 7,25 /1H, м./, 7,37-7,47 /2H, м./.
Стадия 2
Получение 5-хлор-3-фенил-4-тиазолидинона
Данное соединение получалось с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 2 выше, но при использовании 3-фенил-4-тиазолидинона /полученного, как в
стадии 1 выше/ /0,38 г/, сульфурилхлорида /0,29 г/ и дихлорметана /5 мл/. Данный продукт использовался непосредственно на стадии 3.
Стадия 3
Получение
5-гидрокси-3-фенил-4-тиазолидинона
С помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 3 выше, но при использовании 5-хлор-3-фенил-4-тиазолидинона
/полученного, как на стадии 2 выше/, тетрагидрофурана /10 мл/ и насыщенного водного бикарбоната натрия /15 мл/ получалось целевое соединение в виде маслянистого твердого вещества, выход 0,24 г.
1H ЯМР /CDCl3/: δ 4,52 /1H, д./, 4,89 /1H, д./, 5,65 /1H, д./, 5,76 /1H, широкий с./, 7,19 /1H, м./, 7,25-7,34 /4H, м./.
Препаративный пример
18
Получение 3-(4-фтор-3-трифторметил)фенил-5-гидрокси-4-тиазолидинона
Стадия 1
Получение 3-(4-фтор-3-трифторметил)фенил-4-тиазолидинона
С помощью процедуры,
аналогичной процедуре, описанной в препаративном примере 2, стадия 1 выше, но при использовании 4-фтор-3-трифторметиланилина /17,90 г/, тиогликолевой кислоты /9,20 г/, 37% водного раствора
формальдегида /7,7 мл/ и толуола /110 мл/ и растирания сырого продукта со смесью диэтиловый эфир/гексан получалось данное соединение в виде белого твердого вещества, выход 16,00 г, т. пл. 83 - 85oC.
1H ЯМР /CDCl3/: δ 3,73 /2H, с./, 4,80 /2H, с./, 7,25 /1H, м./, 7,64 - 7,72 /2H, м./.
Стадия 2
Получение
5-хлор-3-(4-фтор-3-трифторметил)фенил-4-тиазолидинона
Данное соединение получалось с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 2 выше, но при
использовании 3-(4-фтор-3-трифторметил)фенил-4-тиазолидинона /полученного как на стадии 1 выше/ /14,00 г/, сульфурилхлорида /4,3 мл/ и дихлорметана /100 мл/. Данный продукт использовался
непосредственно на стадии 3.
1H ЯМР /CDCl3/: δ 4,68 /1H, д./, 5,21 /1H, д./, 5,77 /1H, с./, 7,29 /1H, м./, 7,69 - 7,78 /2H, м./.
Стадия
3
Получение 3-(4-фтор-3-трифторметил)фенил-5-гидрокси-4-тиазолидинона
Целевое соединение получалось в виде белого твердого вещества с помощью процедуры, аналогичной процедуре,
описанной в препаративном примере 2, стадия 3 выше, но при использовании 5-хлор-3-(4-фтор-3- трифторметил)фенил-4-тиазолидинона /полученного на стадии 2, выше/, тетрагидрофурана /50 мл/ и насыщенного
водного раствора бикарбоната натрия /50 мл/ и перекристаллизации сырого продукта из хлороформа, выход 12,00 г, т. пл. 118 - 121oC.
1H ЯМР /CDCl3/: δ 4,40 /1H, д./, 4,69 /1H, д./, 4,99 /1H, д./, 5,75 /1H, д./, 7,28 /1H, м./, 7,67 - 7,77 /2H, м./.
Препаративный пример 19
Получение
3-(3-пентафторсульфанил)фенил-5-гидрокси-4-тиазолидинона
Стадия 1
Получение 3-пентафторсульфаниланилина
Порошок восстановленного железа /8,60 г/ добавлялся к
перемешиваемому
раствору 3-пентафторсульфанилнитробензола /2.65 г/ в смеси изопропанола /27 мл/, воды /6 мл/ и концентрированной соляной кислоты /0,3 мл/. Получающаяся смесь нагревалась в условиях
дефлегмации в
течение 1 часа и затем оставлялась слегка охладиться перед тем, как она фильтровалась через Гифло. Гифло фильтр промывался дополнительной порцией изопропанола, и объединенные фильтраты
выпаривались
при пониженном давлении. Остаток растворялся в небольшом количестве диэтилового эфира, и раствор обрабатывался твердым бикарбонатом натрия, затем сушился над сульфатом магния. После
фильтрования с
удалением неорганических веществ раствор выпаривался при пониженном давлении, и в аппарате Кугельрора перегонялся маслянистый остаток. Целевое соединение собиралось в виде бесцветного
масла, т. кип.
110oC /температура печи/ при 12 мм рт.ст., которое кристаллизовалось при стоянии, выход 1,90 г, т. пл. 32 - 35oC.
Стадия 2
Получение
3-(3-пентафторсульфанил)фенил-4-тиазолидинона
С помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 1 выше, но при использовании пентафторсульфаниланилина
/полученного, как описано выше, на стадии 1/ /1,90 г/, тиогликолевой кислоты /0,80 г/, 37% водного раствора формальдегида /0,7 мл/, толуола /20 мл/ и п-толуолсульфокислоты /2 мг/ и очистки сырого
продукта с помощью хроматографии на силикагеле при элюировании смесью этилацетат/гексан получалось данное соединение в виде белого твердого вещества, выход 1,45 г, т. пл. 48 - 50oC.
1H ЯМР /CDCl3/: δ 3,75 /2H, с./, 4,84 /2H, с./, 7,52 /1H, м./, 7,60 - 7,69 /2H, м./, 7,89 /1H, м./.
Стадия 3
Получение
5-хлор-3-(3-пентафторсульфанил)фенил-4-тиазолидинона
Данное соединение получалось с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 2 выше, но при
использовании 3-(3-пентафторсульфанил)фенил-4-тиазолидинона /полученного как описано выше, на стадии 2/ /1,14 г/, сульфурихлорида /0,3 мл/ и дихлорметана /10 мл/. Данный продукт использовался
непосредственно на стадии 4.
Стадия 4.
Получение 3-(3-пентафторсульфанил)фенил-5-гидрокси-4- тиазолидинона
С помощью процедуры, аналогичной процедуре,
описанной в препаративном примере 2, стадия 3 выше, но при использовании 5-хлор-3-(3-пентафторсульфанил)фенил-4-тиазолидинона /полученного, как на стадии 3, выше/, тетрагидрофурана /20 мл/ и
насыщенного водного бикарбоната натрия /20 мл/ и очистки сырого продукта с помощью хроматографии на силикагеле при элюировании смесью этилацетат/гексан с последующей перекристаллизацией из смеси
четыреххлористый углерод/гексан получалось целевое соединение в виде белого твердого вещества, выход 1,19 г, т. пл. 122 - 124oC.
1H ЯМР /CDCl3 / δ 4,70 /1H, д./, 4,92 /1H, с./, 5,03 /1H, д./, 5,73 /1H, с./, 7,51 /1H, м./, 7,57 - 7,68 /2H, м./, 7,89 /1H, м./.
Препаративный пример 20
Получение
3-(2-фтор-3-трифторметил)фенил-5-гидрокси-4- тиазолидинона
Стадия 1
Получение 3-(2-фтор-3-трифторметил)фенил-5-тиазолидинона
Целевое соединение получалось в виде светлого
твердого вещества с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 1 выше, но при использовании 2-фтор-3-трифторметиланилина /10,00 г/, тиогликолевой кислоты /5,
14 г/, 37% водного раствора /4,30 мл/, толуола /110 мл/ и п-толуолсульфокислоты и перегонки сырого продукта в аппарате Кугельрора при пониженном давлении, выход 10,60 г.
1H ЯМР /CDCl3/ δ 3,72 /2H, с./, 4,77 /2H, с/, 7,32 /1H, м./, 7,55 - 7,63 /2H, м./.
Стадия 2
Получение
5-хлор-3-(2-фтор-3-трифторметил)фенил-4- тиазолидинона
Данное соединение получалось с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 2 выше, но с
использованием 3-(2-фтор-3-трифторметил)фенил-4-тиазолидинона
/полученного, как на стадии 1 выше/ /9,00 г/, сульфурилхлорида /4,59 г/ и дихлорметана /120 мл/. Данный продукт использовался
непосредственно на стадии 3.
Стадия 3
Получение
3-(2-фтор-3-трифторметил)фенил-5-гидрокси-4- тиазолидинона
Целевое соединение получалось в виде белого твердого
вещества с помощью процедуры, аналогичной процедуре, описанной в препаративном
примере 2, стадия 3 выше, но при использовании 5-хлор-3-(2-фтор-3-трифторметал)фенил-4-тиазолидинона /полученного, как
описано выше на стадии 2/, тетрагидрофурана /100 мл/ и насыщенного водного
бикарбоната натрия /50 мл/ и перекристаллизации неочищенного продукта из стадии этилацетат/гексан, выход 4,40 г.
1H ЯМР /CDCl3/: δ/ 4,58 /1H, д./, 5,00 /1H, д./, 5,63 /1H, д./, 6,86 /1H, д./, 7,32 /1H, м./, 7,57 - 7,70 /2H, м./.
Препаративный пример 21
Получение 5-гидрокси-2-фенил-3-(3-трифторметил)фенил-4- тиазолидинона
Стадия 1
Получение 2-фенил-3-(3-трифторметил)фенил-4-тиазолидинона
Перемешиваемый раствор
бензальдегида /5,0 мл/ и 3-трифторметиланилина /6,14 мл/ в толуоле /100 мл/ нагревался
в условиях дефлегмации, и вода собиралась в аппарате Дина-Старка. Спустя 1 час, добавлялась тиогликолевая
кислота /4,53 г/, и нагревание продолжалось еще в течение 1 часа. ГХ анализ показал, что
реакция прошла только приблизительно до 50% завершения. К реакционной смеси порциями добавлялись небольшие
количества тиогликолевой кислоты, и нагревание продолжалось до тех пор, пока анализ ГХ не
показал 99% реакции. Раствор охлаждался и выпаривался при пониженном давлении. Маслянистый остаток
растворялся в диэтиловом эфире, тщательно промывался насыщенным водным раствором бикарбоната натрия,
солевым раствором, затем сушился /сульфатом магния/. Выпаривание растворителя при пониженном
давлении давало желтое масло, которое очищалось с помощью хроматографии на силикагеле, при элюировании
смесью этилацетат/гексан, давая бесцветное масло, которое медленно кристаллизовалось при
стоянии. Растирание с гексаном давало продукт в виде белого кристаллического твердого вещества, выход 6,90 г,
т. пл. 53 - 55oC.
1H ЯМР /CDCl3/: δ 3,86 /1H, д./, 3,98 /1H, д./, 6,10 /1H, с./, 7,20 - 7,31 /5H, м./, 7,32 - 7,40 /3H, м./, 7,48 /1H, м./.
Стадия 2
Получение
5-гидрокси-2-фенил-3-(3-трифторметил)фенил-4- тиазолидинона
С помощью процедуры, аналогичной процедуре, описанной в препаративном примере 1, стадия 2
выше, но с использованием
2-фенил-3-(3-трифторметил)фенил-4-тиазолидинона /полученного, как на стадии 1, выше/ /3,50 г/, сульфурилхлорида /0,88 мл/, дихлорметана /25 мл/, затем тетрагидрофурана /50
мл/ и насыщенного водного
раствора бикарбоната натрия /50 мл/ и очистки с помощью хроматографии на силикагеле с элюированием смесью этилацетат /гексан получался сырой продукт в виде смеси
диастереоизомеров, выход 0,036 г.
1H ЯМР /CDCl3/: между прочим δ 5,91 /1H, с./, 5,95 /1H, с./, 6,01 /1H, с./, 6,32 /1H, с./.
Препаративный
пример 22
Получение
3-(4-хлор-3-трифторметил)фенил-5-гидрокси-4- тиазолидинона
Стадия 1
Получение 3-(4-хлор-3-трифторметил)фенил-4-тиазолидинона
С помощью процедуры,
аналогичной процедуре,
описанной в препаративном примере 2, стадия 1 выше, но с использованием 4-хлор-3-трифторметиланилина /19,60 г/, тиогликолевой кислоты /9,20 г/, 37% водного раствора
формальдегида /7,80 мл/ и толуола
/100 мл/ и перекристаллизации сырого продукта из смеси этилацетат/гексан, получалось целевое соединение в виде твердого вещества, выход 14,80 г, т.пл. 94 - 95oC.
1H ЯМР /CDCl3/: δ 3,72 /2H, с./, 4,80 /2H, с./, 7,51 /1H, д./, 7,65 /1H, дд./, 7,80 /1H, д./.
Стадия 2
Получение
5-хлор-3-(4-хлор-3-трифтометил)фенил-4-тиазолидинона
Данное соединение получалось с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 2 выше, но при
использовании 3-(4-хлор-3-трифторметил)фенил-4-тиазолидинона /полученного выше, как на стадии 1/ /12,00 г/, сульфурилхлорида /3,50 мл/ и дихлорметана /50 мл/. Данный продукт использовался
непосредственно на стадии 3.
Стадия 3
Получение 3-(4-хлор-3-трифторметил)фенил-5-гидрокси-4- тиазолидинона
С помощью процедуры, аналогичной процедуре, описанной в
препаративном примере 2, стадия 3 выше, но при использовании 5-хлор-3-(4-хлор-3-трифторметил)фенил-4-тиазолидинона /полученного как описано выше, на стадии 2/, тетрагидрофурана /250 мл/ и насыщенного
водного бикарбоната натрия /50 мл/ и перекристаллизации сырого продукта из смеси этилацетата и гексана получалось целевое соединение в виде твердого вещества, выход 8,10 мг, т.пл. 148 - 151o
C.
1H ЯМР /CDCl3/: δ 4,63 /1H, д./, 5,08 /1H, д./, 5,64 /1H, д./, 6,62 /1H, д./, 7,52 /1H, д./, 7,69 /1H, дд./, 7,90 /1H, д./.
Препаративный пример 23
Получение 5-гидрокси-5-метил-3-(3-трифторметил)фенил-4-тиазолидинона
Стадия 1
Получение 5-метил-3-(3-трифторметил)фенил-4-тиазолидинона
С
помощью процедуры, аналогичной процедуре, описанной в препаративном примере 2, стадия 1 выше, но при использовании 3-трифтометиланилина /16,10 г/, тиомолочной кислоты /10,60 г/, 37% водного раствора
формальдегида /7,50 мл/, толуола /150 мл/ и п-толуолсульфокислоты /20 мг/ и перегонки в аппарате Кугельрора сырого продукта при пониженном давлении получалось целевое соединение в виде бледно-желтого
масла, выход 20,10 г.
1H ЯМР /CDCl3/: δ 1,63 /3H, д./, 3,98 /1H, кв./, 4,70 /1H, д./, 4,86 /1H, д./, 7,45 - 7,58 /2H, д./, 7,68 - 7,79 /2H, д./.
Стадия 2
Получение 5-гидрокси-5-метил-3-(3-трифторметил)фенил-4- тиазолидинона
Перемешиваемый раствор 5-метил-3-(3-трифторметил)фенил-4- тиазолидинона /полученного, как
описано выше, на стадии 1/ /2,61 г/ в дихлорметане /65 мл/ охлаждался в ледяной ванне. Через раствор барботировалась струя азота, и по каплям добавлялся раствор сульфурилхлорида /0,89 мл/. После
добавления раствор перемешивался в течение дополнительных 1,5 часов при поддержании потока азота. Затем добавлялась вода, и смесь перемешивалась энергично в течение 10 минут. Органическая фаза затем
отделялась, промывалась солевым раствором, сушилась /сульфатом магния/ и выпаривалась при пониженном давлении, давая желтое масло /3,33 г/. Очистка 1,63 г данного масла с помощью хроматографии на
силикагеле при элюировании смесями хлороформа и метанола давала целевое соединение в виде бледно-желтого масла, которое кристаллизовалось при стоянии, выход 1,18 г, т. пл. 98 - 101oC.
1H ЯМР /CDCl3/: δ 1,85 /3H, с./, 4,10 /1H, широкий с./, 4,61 /1H, д./, 4,95 /1H, д./, 7,45 - 7,55 /2H, м./, 7,65 - 7,79 /1H, м./.
Препаративный
пример 24
Получение 5-гидрокси-3-(2-метокси)фенил-4-тиазолидинона
Стадия 1
Получение S-(2-метоксифениламино)метилтиогликолевой кислоты
Перемешиваемый
раствор
орто-анизидина /18,00 г/ и тиогликолевой кислоты /13,40 г/ в этаноле /50 мл/ обрабатывался 37% водным раствором формальдегида /11,4 мл/, и получающийся раствор затем перемешивался в течение
дальнейших
5 часов. Добавлялась вода, и смесь экстрагировалась дихлорметаном. Дихлорметановые экстракты промывались 2 М соляной кислоты /2 х 50 мл/ и водой, сушились /сульфатом магния/ и выпаривались
при
пониженном давлении, давая бесцветное масло /13,70 г/. Данное масло содержало неочищенный продукт и использовалось непосредственно на следующей стадии.
Стадия 2.
Получение 3-(2-метокси)фенил-4-тиазолидинона
Перемешиваемый раствор триэтиламина /8,40 мл/ и дихлорметане /50 мл/ охлаждался до 5oC, и к нему добавлялся по каплям тионилхлорид /4,
40 мл/, с последующим добавлением раствора сырого S-(2-метоксифениламино)метилтиогликолевой кислоты /полученной на стадии 1 выше/ /13,70 г/ в дихлорметане /50 мл/. Смесь перемешивалась в течение
дальнейших 2 часов, а затем оставлялась стоять в течение 18 часов. Добавлялось дополнительное количество триэтиламина /8,40 мл/, и смесь перемешивалась в течение 5 часов. Добавлялась вода, и смесь
фильтровалась через Гифло. Фильтрат собирался, и органический слой отделялся, промывался солевым раствором и сушился /сульфатом магния/. Раствор выпаривался при пониженном давлении, давая коричневую
смолу, которая очищалась с помощью хроматографии на силикагеле при элюировании смесями этилацетата и гексана, давая продукт в виде смолы, выход 0,73 г.
1H ЯМР /CDCl3/: δ 3,72 /2H, с./, 3,85 /3H, с./, 4,67 /2H, с./, 6,94 - 7,02 /2H, м./, 7,24 /1H, м./, 7,33 /1H, м./.
Стадия 3
Получение
5-гидрокси-3-(2-метокси)фенил-4-тиазолидинона
Перемешиваемый раствор 3-(2-метокси)фенил-4-тиазолидинона /полученного, как описано выше, на стадии 2/ /0,73 г/ в дихлорметане /20
мл/ охлаждался
в ледяной ванне в атмосфере азота, и по каплям добавлялся сульфурилхлорид /0,28 мл/. После добавления раствор оставлялся медленно подогреваться до комнатной температуры. Раствор
выпаривался при
пониженном давлении, давая красное масло, которое растворялось в тетрагидрофуране /10 мл/ и обрабатывалось водным раствором бикарбоната натрия /20 мл/. Данная смесь перемешивалась
энергично в течение
30 минут, а затем экстрагировалась дихлорметаном /2 х 50 мл/. Объединенные органические экстракты промывались солевым раствором, сушились /сульфатом магния/ и выпаривались при
пониженном давлении,
давая твердый остаток. Хроматография на силикагеле при элюировании смесями гексана и этилацетата давала указанное в заголовке соединение в виде белого кристаллического твердого
вещества, выход 0,29
г.
1H ЯМР /CDCl3/: δ 3,82 /3H, с./, 4,18 /1H, широкий д./, 4,60 /1H, д./, 4,80 /1H, дд. /, 5,73 /1H, д./, 6,94 - 7,04 /2H, м./, 7,25 /1H, м./, 7,34 /1H, м./.
Препаративный пример 25
Получение 5-гидрокси-3-(3-нитро)фенил-4-тиазолидинона
Стадия 1
Получение
3-(3-нитро)фенил-4-тиазолидинона.
Перемешиваемая смесь 3-нитроанилина /6,575 г/ в толуоле /100 мл/ обрабатывалась тиогликолевой кислотой /3,48 мл/ в атмосфере азота. Спустя 15 минут суспензия обрабатывалась по каплям 37% водным формальдегидом /4,05 мл/, приводя в результате к легкой экзотермии /начальная температура поднималась до 30oC/. Реакционная смесь затем нагревалась до температуры дефлегмации, и вода собиралась в аппарат Дина-Старка. Через 3 часа смесь охлаждалась и оставлялась стоять при комнатной температуре на протяжении ночи, в течение этого периода от реакционной смеси отделялось небольшое количество кристаллов и темное масло. Толуол декантировался, и остаток растворялся в этилацетате. Объединенные органические фазы промывались насыщенным раствором бикарбоната натрия /х 2/ и солевым раствором. Органический слой сушился /Na2SO4/, а растворитель удалялся при пониженном давлении, давая оранжево-коричневое твердое вещество /3,781 г/. Данное вещество перекристаллизовывалось с использованием толуола, давая оранжево-коричневые кристаллы, выход 1,921 г, т. пл. 142oC.
1 H ЯМР /CDCl3/: δ 3,77 /2H, с./, 4,90 /2H, с./, 7,60 /1H, т./, 7,95 /1H, дд./, 8,10 /1H, дд./, 8,31 /1H, т./.
Стадия 2
Получение
5-хлор-3-(3-нитро-)фенил-4-тиазолидинона
Перемешиваемый раствор
3-(3-нитро)фенил-4-тиазолидинона /полученного, как описано выше, на стадии 1/ /2,626 г/ в дихлорметане /50 мл/ охлаждался в
ледяной ванне, а затем обрабатывался сульфурилхлоридом /1,74 г/. Реакционная
смесь становилась коричневой, а спустя 15 минут ТСХ не показывала никакого исходного материала. Реакционная смесь
концентрировалась при пониженном давлении, и продукт использовался непосредственно на
стадии 3.
Стадия 3
Получение 5-гидрокси-3-(3-нитрофенил)-4-тиазолидинона
5-Хлор-3-(3-нитро)фенил-4-тиазолидинон /полученный, как описано выше, на стадии
2/ суспендировался в смеси /1 : 1/ тетрагидрофурана и насыщенного водного раствора бикарбоната натрия /60 мл/ и
перемешивалась энергично при комнатной температуре на протяжении ночи. Тетрагидрофуран
удалялся при пониженном давлении, и добавлялись этилацетат и вода. Органический слой отделялся, а водный слой
экстрагировался этилацетатом /дважды/. Объединенные органические вещества сушились
/сульфатом натрия/, и растворитель удалялся при пониженном давлении, давая оранжевое твердое вещество /2,265 г/.
Данное вещество очищалось на силикагеле с использованием в качестве элюента смеси
этилацетат : гексан /45 - 55% этилацетат/, давая целевое соединение в виде твердого вещества выход 1,837 г, т. пл.
129 - 131oC.
1H ЯМР /CDCl3/ /d6DMCO/: δ 4,72 /1H, д./, 5,15 /1H, д./, 5,65 /1H, д./, 6,89 /1H, д./, 7,61 /1H, т./, 7,96 /1H, дд./, 8, 10 /1H, дд./, 8,45 /1H, т./.
Препаративный пример 26
Получение 5-гидрокси-3-(3-циано)фенил-4-тиазолидинона
Стадия 1
Получение
3-(3-циано)фенил-4-тиазолидинона
3-Аминобензонитрил /перекристаллизованный из смеси этилацетата и
гексана/ /4,6 г/, этанол /15 мл/ и тиогликолевая кислота /2,71 мл/ перемешивались вместе при
комнатной температуре в течение 30 минут. Затем добавлялся 37% водный раствор формальдегида /3,16 мл/,
вызывая мягкую экзотермию. Образовывался твердый осадок и перемешивание продолжалось на
протяжении ночи. Затем добавлялась вода, образуя эмульсию, и смесь экстрагировалась этилацетатом /три раза/.
Объединенные экстракты сушились /сульфатом магния/ и выпаривались при пониженном давлении,
давая остаток /9 г/, который брался в дихлорметан /150 мл/. К данному раствору добавлялся тионилхлорид /2,85
мл/, а через 45 минут триэтиламин /5,43 мл/ при охлаждении в ледяной ванне. Происходило
образование дыма, и спустя 1 час реакционная смесь выливалась на лед, и продукт экстрагировался дихлорметаном.
Органический слой промывался солевым раствором, сушился /сульфатом магния/ и выпаривался
при пониженном давлении, давая темное масло /6,4 г/, которое хроматографировалось на силикагеле с
использованием смесей этилацетат/гексан. Целевое соединение получалось в виде желтого твердого
вещества, выход 2,3 г, и имело данные:
1H ЯМР /CDCl3/: δ 3,75 /2H,
с./, 4,84 /2H, с./, 7,51 /2H, м./, 7,75 /1H, м./, 7,84 /1H, с./.
MC: м/e 204
/M+/
Стадия 2
Получение 5-хлор-3-(3-циано)фенил-4-тиазолидинона
3-(3-циано)фенил-4-тиазолидинон /полученный, как описано выше, на стадии 1/ /1,935 г/ превращался
в целевое соединение с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 25,
стадия 2, с использованием дихлорметана /21 мл/ и сульфурилхлорида /0,762 мл/. Целевое
соединение сразу же использовалось на стадии 3.
1H ЯМР /CDCl3/: δ 4, 71 /1H, д./, 5,23 /1H, д./, 5,78 /1H, с./, 7,59 /2H, м./, 7,82 /1H, м/, 7,89 /1H, с./.
Стадия 3
Получение 5-гидрокси-3-(3-циано)фенил-4-тиазолидинона
5-хлор-(3-циано)фенил-4-тиазолидинон /полученный, как описано выше, на стадии 2/ превращался в
целевое соединение с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 25,
стадия 3, с использованием смеси тетрагидрофурана /6 мл/ и насыщенного раствора бикарбоната натрия
/10 мл/. Сырой продукт /1,73 г/ очищался на силикагеле с использованием смеси этилацетат: гексан /2:
3/ в качестве элюента. Целевое соединение /1,627 г/ имело:
1H ЯМР /CDCl3/ d6-DMCO/: δ 4,67 /1H, д./, 5,12 /1H, д./, 5,62 /1H, д./, 6,88 /1H, д./, 7,54
/2H, м./, 7,80 /1H, м./, 7,97 /1H, широкий с./.
MC: м/e 220 /M+/
Препаративный пример 27
Получение 5-гидрокси-3-(3-фтор)фенил-4-тиазолидинона
Стадия 1
Получение 3-(3-фтор)фенил-4-тиазолидинона
3-фторанилин /9,344
г/ превращался в целевое соединение с использованием толуола /180 мл/, тиогликолевой кислоты /5,85 мл/ и 37%
водного раствора формальдегида /6,83 мл/ с помощью процедуры, аналогичной процедуре,
описанной в препаративном примере 25, стадия 1. Прозрачный толуольный слой декантировался с осажденного темного
масла и промывался насыщенным раствором бикарбоната натрия. Органический слой сушился
/сульфатом магния/ и выпаривался, давая сырой продукт 3,5 г. Данное вещество очищалось с помощью хроматографии на
силикагеле с использованием смеси этилацетат-гексан /1:3/ в качестве элюента, давая
твердое вещество, которое перекристаллизовывалось из горячего гексана (содержащего несколько капель хлороформа),
давая целевое соединение в виде белого твердого вещества, вход 0,880 г.
1H ЯМР /CDCl3/: δ 3,74 /2H, с./, 4,83 /2H, с./, 6,94 /1H, тд./, 7,19 - 7,42 /3 3H, м./.
Стадия 2
Получение
5-хлор-(3-фтор)фенил-4-тиазолидинона
3-(3-фтор)фенил-4-тиазолидинон /полученный, как описано выше, на стадии 1/ превращался в целевое
соединение с помощью процедуры, аналогичной процедуре,
описанной в препаративном примере 25, стадия 2, с использованием дихлорметана /10 мл/ и сульфурилхлорида /0,36 мл/. Целевое соединение
использовалось сразу же на стадии 3.
1 H ЯМР /CDCl3/: δ 4,70 /1H, д./, 5,22 /1H, д./, 5,77 /1H, с./, 7,03 /1H, м./, 7,25 - 7,50 /3H, м./.
Стадия 3
Получение
5-гидрокси-3-(3-фтор)фенил-4-тиазолидинона
5-Хлор-3-(3-фтор)фенил-4-тиазолидинон /полученный, как описано выше, на стадии 2/ превращался в целевое соединение с
помощью процедуры, аналогичной
процедуре, сходной с процедурой, описанной в препаративном примере 25, стадия 3, с использованием смеси тетрагидрофурана /5 мл/ и насыщенного раствора бикарбоната натрия
/10 мл/. Сырой продукт /0,75
г/ очищался на силикагеле с использованием смеси этилацета и гексана в качестве элюента /35:65 до 40:60/. Целевое соединение /0,42 г/ имело:
1H ЯМР
/CDCl3/ d6
DMCO/: δ 4,65 /1H, д./, 5,09 /1H, д./, 5,62 /1H, д./, 6,80 /1H, д./, 6,95 /1H, тд./, 7,23 - 7,48 /3H, м./.
Препаративный пример 28
Получение 5-гидрокси-3-(3-(1,1,2,
2-тетрафторэтокси))фенил-4- тиазолидинона
Стадия 1
Получение 3-(3-(1,1,2,2-тетрафторэтокси))фенил-4-тиазолидинона
3-(1,1,2,
2-тетрафторэтокси)анилин /12,095 г/ превращался в
целевое соединение с использованием толуола /140 мл/, тиогликолевой кислоты /4,03 мл/ и 37% водного раствора формальдегида /4,7 мл/ с помощью
процедуры, аналогичной процедуре, описанной в
препаративном примере 25, стадия 1. Сырой продукт очищался с помощью хроматографии на силикагеле с использованием в качестве элюента смеси
этилацетат-гексан /5:95 - 15:85/, давая целевое соединение,
выход 3,45 г, которое имело:
1H ЯМР /CDCl3/: δ 3,74 /2H, с./, 4,84 /2H, с./, 5,91 /1H, тт./, 7,11 /1H,
м./, 7,41 /3H, м./.
MC: м/e 295 /M+/
Стадия 2
Получение 5-хлор-3-(3-(1,1,2,2-тетрафторэтокси)фенил-4- тиазолидинона
3-(3-(1,1,2,
2-тетрафторэтокси)фенил-4-тиазолидинон /полученный, как описано выше, на
стадии 1/ /3,45 г/ превращался в целевое соединение с помощью процедуры, аналогичной процедуре, описанной в препаративном
примере 25, стадия 2, с использованием дихлорметана /26 мл/ и
сульфурилхлорида /0,94 мл/. Целевое соединение использовалось сразу же на стадии 3.
1H ЯМР /CDCl3/: δ 4,71 /1H, д./, 5,23 /1H, д./, 5,77 /1H, с./, 5,92 /1H, тт./, 7,07 /1H, м./, 7,46 /3H, м./.
Стадия 3
Получение 5-гидрокси-3-(3-(1,1,2,
2-тетрафторэтокси)фенил-4- тиазолидинона
5-Хлор-3-(3-(1,1,2,
2-тетрафторэтокси))фенил-4-тиазолидинон /полученный, как описано выше, на стадии 2/ превращался в целевое соединение с помощью
процедуры, аналогичной процедуре, описанной в препаративном пример 25,
стадия 3, с использованием смеси тетрагдирофурана /7 мл/ и насыщенного раствора бикарбоната натрия /10 мл/. Сырой продукт /4
г/ хроматографировался на силикагеле с использованием смеси
этилацетат-гексан /35:65/ в качестве элюента. Целевое соединение получалось в виде золотистого масла, выход 2,942 г.
1H ЯМР /CDCl3/: δ 4,20 /1H, широкий с./, 4,71 /1H, д./, 5,02 /1H, дд./, 5,72 /1H, с./, 5,92 /1H, тт./, 7,14 /1H, м./, 7,44 /3H, м./.
MC: м/e 311 /M+
/
Препаративный пример 29
Получение
5-гидрокси-3-(3-метил)фенил-4-тиазолидинона
Стадия 1
Получение 2-маркапто-N-(3-метилфенил)ацетамида
Свежеперегнанный
мета-толуидин /10,168 г/ растворялся в толуоле /50
мл/ и обрабатывался тиогликолевой кислотой /7 мл/. Смесь нагревалась в условиях дефлегмации, и вода собиралась в аппарате Дина-Старка на протяжении
ночи. Реакционная смесь затем охлаждалась и
выливалась в гексан /50 мл/. Продукт отделялся в виде масла, и растворители удалялись при пониженном давлении, давая белое твердое вещество /17,975 г/.
Попытки перекристаллизации не удались, и
остаток хроматографировался на силикагеле. Продукт /14,84 г/, еще загрязненный мета-толуидином, брался в этилацетат и промывался 2 М соляной кислотой. Целевое
соединение затем выделялось обычным
образом в виде белого твердого вещества, выход 13,13 г, т. пл. 58 - 60oC.
1H ЯМР /CDCl3/: δ 2,00 /1H, т., обменивается с D2O/; 2,35 /3H, с./, 3,40 /2H, д./, 6,95 /1H, д./, 7,20 - 7,30 /2H, м./, 7,35 /1H, д./, 7,40 /1H, с./, 8,4 - 8,55 /1H, широкий с., обменивается с D2O/.
Стадия 2
Получение
3-(3-метил)фенил-4-тиазолидинона
2-Меркапто-N-(3-метилфенил)ацетамид /полученный, как описано выше на стадии 1/ /2,0455 г/ растворялся /при
нагревании/ в толуоле /25 мл/, и раствор
обрабатывался п-толуолсульфокислотой /0,215 г/ и пара-формальдегидом /0,339 г/. Происходила экзотермия, и в результате получалась густая белая суспензия.
Реакционная смесь затем нагревалась до
дефлегмации, и вода собиралась в аппарате Дина-старка. Осаждалось оранжевое масло, и после 3 часов нахождения в условиях дефлегмации реакционная смесь
оставлялась охлаждаться до комнатной
температуры. Толуол декантировался с осажденного красноватого масла и выпаривался, давая масло /0,707 г/. Данное вещество хроматографировалось на силикагеле с
использованием смеси этилацетат-гексан
/35:65/, давая целевое соединение в виде масла, выход 0,388 г.
1H ЯМР /CDCl3/: δ 2,38 /3H, с./, 3,75 /2H, с./, 4,81 /2H, с./, 7,08 /1H, д./, 7,15 - 7,35 /3H, м./.
MC: м/e 193 /M+/
Стадия 3
Получение 5-хлор-3-(3-метил)фенил-4-тиазолидинона
3-(3-Метил)фенил-4-тиазолидинон /полученный, как описано
на стадии 2/ /0,369 г/ превращалось в целевое соединение с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 25,
стадия 2, с использованием дихлорметана /5 мл/ и
сульфурилхлорида /0,169 мл/. Целевое соединение использовалось сразу же на стадии 4.
1H ЯМР /CDCl3/: δ 2, 41 /3H, с./, 4,67 /1H, д./, 5,19 /1H, д./, 5,77 /1H, с./, 7,11 /1H, д./, 7,20 - 7,40 /3H, м./.
Стадия 4
Получение 5-гидрокси-3-(3-метил)фенил-4-тиазолидинона
5-Хлор-3-(3-метил)фенил-4-тиазолидинон /полученный,
как описано выше, на стадии 3/ превращался в целевое соединение с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 25,
стадия 3, с использованием смеси /1 :
1/ тетрагидрофурана и насыщенного раствора бикарбоната натрия /15 мл/. Целевое соединение получалось в виде оранжевого масла, выход 0,309 г.
1H ЯМР /CDCl3/: δ 2,35 /3H, с./, 4,45 - 4,60 /1H, широкий с./, 4,67 /1H, д./, 4,95 /1H, д./, 5,74 /1H, с./, 7,10 /1H, д./, 7,20 - 7,40 /3H, м./.
Препаративный
пример 30
Получение
5-гидрокси-3-(3-метокси)фенил-4-тиазолидинона
Стадия 1
Получение 2-меркапто-N-3(метоксифенил)ацетамида
Свежеперегнанный 3-метоксианилин /7,6615
г/ растворялся в толуоле /35
мл/ и обрабатывался тиогликолевой кислотой /4,75 мл/. Смесь нагревалась в условиях дефлегмации, и вода собиралась в аппарате Дина-Старка на протяжении ночи. После
охлаждения до комнатной температуры
образовывались кристаллы, которые собирались с помощью насоса. Целевое соединение /которое было достаточно чистым для следующей реакции/ получалось в виде белого
твердого вещества, выход 9,233 г.
1H ЯМР /CDCl3/: δ 2,03 /1H, т./, 3,38 /2H, д./, 3,80 /3H, с./, 6,70 /1H, дд./, 7,00 /1H, д./, 7,20 - 7,34 /2H, м./, 8,4 - 8,65 /1H, широкий с./.
MC: м/e 197 /M+/
Стадия 2
Получение 3-(3-метокси)фенил-4-тиазолидинона
Сухой ацетон /250 мл/ вводился через трубочку в
3-горлую колбу, снабженную
конденсором, капельной воронкой и входным отверстием с мембраной. Капельная воронка загружалась раствором 2-меркапто-N-(3-метоксифенил)ацетамида /полученного, как описано
выше, на стадии 1/ /2,36
г/ и дииодметана /2 мл/ в ацетоне /100 мл/. Свежеизмельченная гидроокись калия быстро добавлялась к ацетону в 3-горловой колбе, и перемешиваемая суспензия затем помещалась в
масляную баню,
предварительно нагретую до 60oC. Когда растворитель начинал дефлегмировать, на протяжении 30 минут вводилось содержимое капельной воронки. После того, как добавление
завершалось,
реакционная смесь оставлялась охлаждаться до комнатной температуры и фильтровалась через слой целита. Раствор затем смешивался с хлороформом и водой, и органический слой отделялся. Водный
слой
экстрагировался дополнительной порцией хлороформа, и объединенные органические слои промывались солевым раствором, а затем сушились /сульфатом натрия/. Растворитель удалялся при пониженном
давлении,
давая коричневое масло /5,36 г/, которое хроматографировалось на силикагеле с использованием смесей этилацетата и гексана /3:7 - 10:0/ в качестве элюента, давая целевое соединение, выход 0,
659 г.
1H ЯМР /CDCl3/: δ 3,74 /2H, с./, 3,82 /3H, с./, 4,81 /2H, с./, 6,80 /1H, дд./, 6,98 /1H, дд./, 7,08 /1H, т./, 7,31 /1H, т./.
MC:
м/e 209
/M+/
Стадия 3
Получение 5-хлор-3-(3-метокси)фенил-4-тиазолидинона
3-(3-метокси)фенил-4-тиазолидинон /полученный, как описано выше, на стадии 2/ /0,629
г/ превращался в целевое соединение с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 25, стадия 2, с использованием дихлорметана /10 мл/ и сульфурилхлорида /0,266 мл/.
Целевое соединение использовалось непосредственно на стадии 4.
Стадия 4
Получение 5-гидрокси-3-(3-метокси)фенил-4-тиазолидинона
5-Хлор-3-(3-метокси)фенил-4-тиазолидинон /полученный, как описано выше, на стадии 3/ превращался в целевое соединение с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 25,
стадия 3, с использованием /1:1/ смеси тетрагидрофурана и насыщенного раствора бикарбоната натрия /20 мл/. Целевое соединение /0,37 г/ имело:
1H ЯМР /CDCl3/: δ 3,
81 /3H, с./, 4,67 /1H, д./, 4,75 - 4,95 /1H, широкий с./, 4,99 /1H, д./, 5,75 /1H, с./, 6,83 /1H, дд./, 7,00 /1H, дд./, 7,09 /1H, т./, 7,35 /1H, м./.
MC: м/e 225 /M+/
Препаративный пример 31
Получение 5-гидрокси-3-(3-метоксикарбонил)фенил-4- тиазолидинона
Стадия 1
Получение 3-(3-метоксикарбонил)фенил-4-тиазолидинона
3-Метоксикарбониланилин /5 г/ превращался в целевое соединение с использованием толуола /125 мл/, тиогликолевой кислоты /2,3 мл/ и 37% водного раствора формальдегида /2,68 мл/ с помощью процедуры,
аналогичной процедуре, описанной в препаративном примере 25, стадия 1. Неочищенный продукт /3,95 г/ перекристаллизовывался из смеси этилацетата и гексана, давая целевое соединение в виде белого
твердого вещества, выход 3,322 г, т. пл. 118 - 119,5oC.
1H ЯМР /CDCl3/: δ 3,76 /2H, с./, 3,94 /3H, с./, 4,87 /2H, с./, 7,50 /1H, т./, 7,80 /1H, дд./, 7,93 /1H, д./, 8,02 /1H, широкий с./.
Стадия 2
Получение 5-хлор-3-(3-метоксикарбонил)фенил-4-тиазолидинона
3-(3-Метоксикарбонил)фенил-4-тиазолидинон
/полученный как описано выше, на стадии 1/ /3,08 г/ превращался в целевое соединение с помощью процедуры, аналогичной процедуре. описанной в препаративном примере 25, стадия 2, с использованием
дихлорметана /25 мл/ и сульфурилхлорида /1,04 мл/. Целевое соединение использовалось сразу же на стадии 3.
1H ЯМР /CDCl3/: δ 3,94 /3H, с./, 4,74 /1H, д./, 5,25 /1H, д./, 5,79 /1H, д./, 7,53 /1H, т./, 7,85 /1H, дд./, 7,97 /1H, д./, 8,08 /1H, м./.
Стадия 3
Получение 5-гидрокси-3-(3-метоксикарбонил)фенил-4-тиазолидинона
5-Хлор-3-(3-метоксикарбонил)фенил-4-тиазолидинон /полученный, как описано выше, на стадии 2/ превращался в целевое соединение с помощью процедуры, аналогичной процедуре, описанной в препаративном
примере 25, стадия 3, с использованием смеси тетрагидрофурана /20 мл/ и насыщенного раствора бикарбоната натрия /15 мл/. Неочищенный продукт /2,95 г, красно-коричневое масло/ очищалось на силикагеле
с
использованием смеси этилацетат-гексан /1:1, затем 6:4/ в качестве элюента. Целевое соединение получалось в виде клейкого оранжевого твердого вещества, выход 2,34 г.
1H ЯМР /CDCl3/: δ 3,92 /1H, с./, 4,05 /1H, широкий с./, 4,75 /1H, д./, 5,03 /1H, д./, 5,75 /1H, с./, 7,51 /1H, т./, 7,82 /1H, дд./, 7,96 /1H, д./, 8,06 /1H, широкий с./.
Препаративный пример 32
Получение 5-гидрокси-3-(3-бром)фенил-4-тиазолидинона
Стадия 1
Получение 3-(3-бром)фенил-4-тиазолидинона
3-Броманилин /13,315
г/ превращался
в целевое соединение с использованием толуола /170 мл/, тиогликолевой кислоты /5,4 мл/ и 37% водного раствора формальдегида /6,24 мл/ с помощью процедуры, аналогичной процедуре,
описанной в
препаративном примере 25, стадия 1. Толуольный слой декантировался с осажденного оранжевого масла и промывался насыщенным раствором бикарбоната натрия. Органический слой сушился
/сульфатом магния/ и
выпаривался, давая масло /7,92 г/, которое хроматографировалось на силикагеле с использованием смеси этилацетата и гексана /15:85/ в качестве элюента. Целевое соединение /3,81
г/ имело:
1H ЯМР /CDCl3/: δ 3,73 /2H, с./, 4,80 /2H, с./, 7,24 - 7,45 /3H, м./, 7,65 /1H, м./.
MC: м/e 257 /M+; Br = 79/
Стадия 2
Получение
5-хлор-3-(3-бром)фенил-4-тиазолидинона
3-(3-бром)фенил-4-тиазолидинон (полученный, как описано выше, на стадии 1) /3,08 г/ превращалось в целевое соединение с
помощью процедуры, аналогичной
процедуре, описанной в препаративном примере 25, стадия 2, с использованием дихлорметана /25 мл/ и сульфурилхлорида /0,96 мл/. Целевое соединение использовалось
непосредственно на стадии 3.
1H ЯМР /CDCl3/: δ 4,68 /1H, д./, 5,20 /1H, д./, 5,75 /1H, с./, 7,30 /1H, т./, 7,45 /2H, м./, 7,70 /1H, м./.
Стадия 3
Получение
5-гидрокси-3-(3-бром)фенил-4-тиазолидинона
5-Хлор-3-(3-бром)фенил-4-тиазолидинон /полученный, как описано выше, на стадии 2/ смешивался с тетрагидрофураном /15
мл/ и насыщенным раствором
бикарбоната натрия /10 мл/ и перемешивался при комнатной температуре в течение 45 минут. Реакционная смесь обрабатывалась, как в препаративном примере 25, стадия 3, но ЯМР
показал неполную реакцию, а
также примеси. Материал хроматографировался на силикагеле с использованием смеси этилацетата и гексана /35: 65/, что показало как продукт, так и исходное вещество. Данное
вещество подвергалось далее
реакции в тетрагидрофуране /15 мл/ и насыщенном растворе бикарбоната натрия /10 мл/, на протяжении ночи, а затем снова обрабатывалась как в препаративном примере 25,
стадия 3. Остаток /2
г/ хроматографировался на двуокиси кремния с использованием в качестве элюента смеси /3:7/ этилацетата и гексана, давая целевое соединение, выход 0,964 г, которое имело:
1H ЯМР
/CDCl3/: δ 4,08 /1H, широкий с./, 4,69 /1H, д./, 4,99 /1H, д./, 5,71 /1H, с./, 7,23 - 7,48 /3H, м./, 7,69 /1H, м./.
Препаративный пример 33
Получение
5-гидрокси-3-(3-иод)фенил-4-тиазолидинона
Стадия 1
Получение 3-(3-иод)фенил-4-тиазолидинона
3-Иоданилин /11,757 г/ превращался в целевое соединение с
использованием толуола
/140 мл/, тиогликолевой кислоты /3,73 мл/ и 37% водного раствора формальдегида /4,35 мл/ с помощью процедуры, аналогичной процедуре, описанной в препаративном примере 25,
стадия 1. Толуольный слой
декантировался с осажденного красного масла и промывался 2 М соляной кислотой, бикарбонатом натрия и солевым раствором. Толуольный слой сушился /сульфатом магния/ и
выпаривался, давая остаток /6,5 г/,
который хроматографировался на двуокиси кремния с использованием смеси этилацетат:гексан /15:85/ в качестве элюента. Целевое соединение получалось в виде не совсем
белого твердого вещества, выход 4,00
г, т. пл. 88 - 88.5oC.
1H ЯМР /CDCl3/: δ 3,73 /2H, с./, 4,79 /2H, с./, 7,12 /1H, т./, 7,43 /1H, дд./, 7,59 /1H, д./, 7,80 /1H, м./.
MC: м/e 305 /M+/
Стадия 2
Получение 5-хлор-3-(3-иод)фенил-4-тиазолидинона
3-(3-Иод)фенил-4-тиазолидинон /полученный, как
описано выше, на стадии 1/ /2,
91 г/ превращался в целевое соединение с помощью процедуры аналогичной процедуре, описанной в препаративном примере 25, стадия 2, с использованием дихлорметана /27 мл/ и
сульфурилхлорида /0,77 мл/.
Целевое соединение сразу же использовалось на стадии 3.
1H ЯМР /CDCl3/: δ 4,66 /1H, д./, 5,19 /1H, д./, 5,75 /1H, с./, 7,17 /1H, т./, 7,50 /1H, м./, 7,64 /1H, д./, 7,98 /1H, м./.
Стадия 3
Получение 5-гидрокси-3-(3-иод)фенил-4-тиазолидинона
5-Хлор-3-(3-иод)фенил-4-тиазолидинон /полученный,
как описано выше, на стадии
2/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в препаративном примере 25, стадия 3, с использованием смеси тетрагидрофурана /7 мл/ и
насыщенного раствора бикарбоната
натрия /10 мл/. Неочищенный продукт /3,04 г/ очищался на силикагеле с использованием смеси этилацетата и гексана /35:65/ в качестве элюента. Целевое соединение
получалось в виде желтого твердого
вещества, выход 1,85 г, т. пл. 141 - 142oC.
1H ЯМР /CDCl3/: δ 3,59 /1H, д./, 4,69 /1H, д./, 4,96 /1H, д./, 5, 70 /1H, д./, 7,15 /1H, т./, 7,49 /1H, дд./, 7,63 /1H, д./, 7,84 /1H, м./.
Препаративный пример 34
Получение 5-гидркоси-3-(3-фенокси)фенил-4-тиазолидинона
Стадия
1
Получение
2-меркапто-N-(3-феноксифенил)ацетамида
Свежеперегнанный 3-феноксианилин /5,94 г/ растворялся в толуоле /30 мл/ в атмосфере азота и обрабатывался тиогликолевой кислотой
/2,45 мл/. Смесь
нагревалась с обратным холодильником, и вода собиралась на протяжении ночи в аппарате Дина-Старка. Растворитель удалялся при пониженном давлении, а остаток брался в этилацетат.
Данное вещество
промывалось последовательно 2М соляной кислотой, насыщенным раствором бикарбоната натрия и солевым раствором. Органический слой обрабатывался обычным образом, давая целевое соединение
/которое было
достаточно чистым для следующей реакции/ в виде бледно-желтого масла, выход 6,824 г.
1H ЯМР /CDCl3/: δ 1,95 - 2,10 /1H, широкий с./, 3,3 - 3, 45 /2H, широкий с./, 6,80 /1H, м./, 7,03 /2H, д./, 7,12 /1H, т./, 7,25 - 7,40 /5H, м./, 8,40 - 8,60 /1H, широкий с./.
Стадия 2
Получение
3-(3-фенокси)фенил-4-тиазолидинона
2-Меркапто-N-(3-феноксифенил)ацетамид /полученный, как описано выше, на стадии 1/ /3,102 г/ превращался в целевое соединение с помощью процедуры,
аналогичной процедуре, описанной в препаративном
примере 30, стадия 2, с использованием дииодметана /2 мл/ и измельченной гидроокиси калия /4,0 г/ за исключением того, что вместо ацетона в качестве
растворителя использовался тетрагидрофуран /350
мл/. Неочищенный продукт очищался на силикагеле с использованием смеси этилацетата и гексана /15:85/, давая целевое соединение, выход 0,505 г.
1H ЯМР /CDCl3/: δ 3,72 /2H, с./, 4,80 /2H, с./, 6,87 /1H, дд./, 7,00 - 7,40 /8H, м./.
Стадия 3
Получение
5-хлор-3-(3-фенокси)фенил-4-тиазолидинона
3-(3-фенокси)фенил-4-тиазолидинон /полученный, как описано выше, на стадии 2/ /0,500 г/ превращался в целевое соединение с помощью процедуры,
аналогичной описанной в препаративном примере 25, стадия 2,
с использованием дихлорметана /5 мл/ и сульфурилхлорида /0,163 мл/. Целевое соединение использовалось сразу же на стадии 4.
Стадия 4
Получение
5-гидрокси-3-(3-фенокси)фенил-4-тиазолидинона
5-Хлор-3-(3-фенокси)фенил-4-тиазолидинон /полученный, как описано выше, на стадии 3/ превращался в целевое
соединение с помощью процедуры
аналогичной описанной в препаративном примере 25, стадия 3, с использованием смеси тетрагидрофурана /10 мл/ и насыщенного раствора бикарбоната натрия /5 мл/. Целевое
соединение очищалось на силикагеле
с использованием в качестве элюента смеси этилацетата и гексана /35:65/ и получалось в виде масла, которое медленно кристаллизовалось при стоянии, выход 0,263 г.
1H ЯМР /CDCl3/: δ 4,15-4,30 /1H, широкий с./, 4,67 /1H, д./, 4,96 /1H, д./, 5,70 /1H, с./, 6,90 /1H, дд./, 7,00-7,40 /8H, м./.
MC: м/e 287
/M+/
Препаративный пример 35
Получение 5-гидрокси-3-(3-метансульфонил)фенил-4-тиазолидинона
Стадия 1
Получение (3-нитро)фенил-метил-сульфона
Фенилметилсульфон /4,0
г/ добавлялся порциями к дымящей азотной кислоте, перемешиваемой при 0oC. Реакционная смесь оставлялась подогреваться до комнатной температуры, перемешивалась в
течение 1 часа, а затем
выливалась осторожно на лед. Раствор осторожно нейтрализовался бикарбонатом натрия, и смесь фильтровалась с использованием насоса. Собиралось твердое вещество, которое
промывалось водой и сушилось при
пониженном давлении над гидроокисью калия, давая целевое соединение в виде белого твердого вещества /5,63 г/ в состоянии достаточной чистоты для следующей реакции.
1H ЯМР /CDCl3/: δ 3,13 /3H, с./, 7,83 /1H, т./, 8,30 /1H, д./, 8,54 /1H, д./, 8,82 /1H, с./.
Стадия 2
Получение
(3-амино)фенилметилсульфона
(3-Нитро)фенилметилсульфон (полученный выше на стадии 1) /5,396 г/, восстановленное железо /7,5 г/ и хлористый аммоний /7,18 г/ смешивались вместе в смеси этанола
и воды /2:1/ /150 мл/ и нагревались в
условиях дефлегмации в течение 2 часов. Черный раствор фильтровался через "Целит", и фильтровальное средство промывалось этилацетатом. Растворители удалялись при
пониженном давлении, а остаток брался
в смесь этилацетата и воды. Органический слой отделялся, а водный слой экстрагировался 3 дополнительными порциями этилацетата. Объединенные органические слои
промывались солевым раствором, и
растворитель удалялся при пониженном давлении, давая темно-оранжевое масло /3,9275 г/. Данное масло хроматографировалось на силикагеле с использованием смеси
этилацетата и гексана 45:55 до 50:50 в
качестве элюента, давая целевое соединение в виде оранжевого масла, выход 3,607 г.
1H ЯМР /CDCl3/: δ 3,02 /3H, с./, 3,8-4,2 /2H, широкий с./, 6,90 /1H, м. /, 7,18 - 7,38 /3H, м./.
Стадия 3
Получение 3-(3-метансульфонил)фенил-4-тиазолидинона
(3-Амино)фенилметилсульфон (полученный,
как описано выше, на стадии 2) /3,6
г/ превращался в целевое соединение с использованием толуола /175 мл/, тиогликолевой кислоты /1,46 мл/ и 37% водного раствора формальдегида /1,71 мл/ с помощью
процедуры, аналогичной описанной в
препаративном примере 25, стадия 1. Сырой продукт очищался с помощью хроматографии на силикагеле с использованием смеси этилацетата и гексана /1:1/ в качестве
элюента. Целевое соединение получалось в
виде бледно-желтого твердого вещества, выход 1,105 г, т. пл. 92 - 95.5oC.
1H ЯМР /CDCl3/: δ 3,08 /3H, с./, 3,77 /2H, с./, 4,88 /2H, с./, 7,63 /1H, т./, 7,82 /1H, д./, 7,89 /1H, д./, 7,99 /1H, м./.
Стадия 4
Получение 5-хлор-3-(3-метансульфонил)фенил-4-тиазолидинона
3-(3-метансульфонил)фенил-4-тиазолидинон
/полученный, как описано выше, на стадии 3/ /1 г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в препаративном примере 25,
стадия 2, с использованием дихлорметана /10
мл/ и сульфурилхлорида /0,31 мл/. Целевое соединение сразу же использовалось на стадии 5.
Стадия 5
Получение
5-гидрокси-3-(3-метансульфонил)фенил-4-тиазолидинона
5-Хлор-3-(3-метоксифенил)тиазолидин-4-он (полученный, как описано выше, на стадии 4) превращался в целевое соединение с помощью процедуры,
аналогичной описанной в препаративном примере 25, стадия 3, с
использованием смеси тетрагидрофурана /15 мл/ и насыщенного раствора бикарбоната натрия /5 мл/. Сырой продукт /0,892 г/ очищался с
помощью хроматографии на силикагеле с использованием смеси
этилацетата и гексана /3:1/ в качестве элюента. Целевое соединение получалось в виде мягкого желтого твердого вещества, выход 0,679 г.
1H ЯМР /CDCl3/: δ 3, 09 /3H, с./, 4,25 - 4,35 /1H, широкий с./, 4,75 /1H, д. /, 5,08 /1H, д./, 5,72 /1H, с./, 7,63 /1H, т./, 7,84 /2H, м./, 8,07 /1H, м./.
Препаративный пример 36
Получение
5-гидрокси-3-(3,4,5-трихлор)фенил-4-тиазолидинона
Стадия 1
Получение 3-(3,4,5-трихлор)фенил-4-тиазолидинона
3,4,
5-трихлоранилин /5,167 г/ превращался в целевое соединение с
использованием толуола /250 мл/, тиогликолевой кислоты /2,75 мл/ и 37% водного раствора формальдегида /2,35 мл/ с помощью процедуры,
аналогичной процедуре, описанной в препаративном примере 25, стадия
1. В данной реакции не осаждалось никакого масла, но при охлаждении образовалось немного бледно-коричневых игл, которые удалялись
фильтрованием. Фильтрат концентрировался, давая белое твердое вещество,
которое бралось в дихлорметан и промывалось последовательно 2М соляной кислотой, насыщенным раствором бикарбоната натрия и
солевым раствором. Органический слой сушился /сульфатом магния/ и
выпаривался, давая не совсем белое твердое вещество /2,8 г/. Неочищенный продукт хроматографировался на силикагеле с использованием в
качестве элюента смесь этилацетата и гексана /15:85/, давая
целевое соединение в виде белого твердого вещества, выход 2,27 г, т. пл. 161 - 163oC.
1H ЯМР /CDCl3/: δ 3,73 /2H, с./, 4,79 /2H, с./, 7,61 /2H, с./.
Стадия 2
Получение 5-хлор-3-(3,4,5-трихлор)фенил-4-тиазолидинона
3-(3,4,
5-Трихлор)фенил-4-тиазолидинон (полученный, как описано выше на стадии 1) /2,00
г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в препаративном примере 25, стадия 2, с
использованием дихлорметана /20 мл/ и сульфурилхлорида /0,63 мл/. Целевое
соединение использовалось сразу же на стадии 3.
Стадия 3
Получение 5-гидрокси-3-(3,4,
5-трихлор)фенил-4-тиазолидинона
5-Хлор-3-/3,4,5-трихлор/фенил-4-тиазолидинон
/полученный, как описано выше, на стадии 2/ превращался в целевое соединение, с помощью процедуры, аналогичной
описанной в препаративном примере 25, стадия 3, с использованием смеси тетрагидрофурана
/10 мл/ и насыщенного раствора бикарбоната натрия /10 мл/. Неочищенный продукт /2,15 г/ очищался на силикагеле
с использованием смеси этилацетата и гексана /35:65/ в качестве элюента. Целевое
соединение получалось в виде коричневого твердого вещества /1,3 г/ и имело:
1H ЯМР /CDCl3
/ d6DMCO/: δ 4,63 /1H, д./, 5,05 /1H, д./, 5,59 /1H, д./, 6,96
/1H, д./, 7,72 /2H, с./.
Препаративный пример 37
Получение
5-гидрокси-3-(3-метилтио)фенил-4-тиазолидинона
Стадия 1
Получение
2-меркапто-N-(3-метилтиофенил)ацетамида
3-Метилмеркаптоанилин /5,041 г/ превращался в целевое соединение с
помощью процедуры, аналогичной описанной в препаративном примере 34, стадия 1, с
использованием толуола /25 мл/ и тиогликолевой кислоты /3,78 мл/. Сырой продукт очищался на силикагеле с
использованием смеси этилацетата и гексана /0:1 -> 1:7 -> 1:3/ в качестве
элюента. Целевое соединение получалось в виде кремовато-белого твердого вещества, выход 6,55 г.
1H ЯМР /CDCl3/: δ 2,03 /1H, т./, 2,50 /3H, с./, 3,40 /2H, д./, 7,02 /1H, м./, 7,25 /2H, м./, 7,53 /1H, м./, 8,50 /1H, широкий с./.
Стадия 2
Получение 3-(3-метилтио)фенил-4-тиазолидинона
2-Меркапто-N-(3-метилтиофенил)ацетамид /полученный, как описано выше, на стадии 1/ /5 г/ превращался в целевое соединение с помощью процедуры,
аналогичной описанной в препаративном примере 30, стадия
2, с использованием дииодметана /3,89 мл/ и измельченной гидроокиси калия /7,89 г/ за исключением того, что в качестве растворителя вместо
ацетона использовался тетрагидрофуран /500 мл/. Сырой продукт
очищался на силикагеле с использованием смеси этилацетата и гексана /1: 4/ в качестве элюента, давая коричневое масло /1,302 г/, все еще
загрязненного небольшим количеством анилина, который удалялся
экстрагированием этилацетатного раствора материала 2М соляной кислотой. Данный раствор обрабатывался обычным образом, давая целевое
соединение в виде оранжево-коричневого масла /0,97 г/ в достаточно
чистом состоянии для следующей стадии синтеза.
1H ЯМР /CDCl3/: δ 2,48 /3H, с./, 3,75 /2H, с./, 4,81 /2H, с./, 7,10 - 7,37 /4H, м./.
Стадия
3
Получение 5-хлор-3-(3-метилтио)фенил-4-тиазолидинона
3-(3-Метилтио)фенил-4-тиазолидинон /полученный, как
описано выше, на стадии 3/ /0,97 г/ превращался в целевое соединение с
помощью процедуры, аналогичной описанной в препаративном примере 25, стадия 2, с использованием дихлорметана /20 мл/ и
сульфурилхлорида /0,35 мл/. Целевое соединение использовалось сразу же на стадии
4.
1H ЯМР /CDCl3/: δ 2,48 /3H, с./, 4,68 /1H, д./, 5,19 /1H, д./, 5,77 /1H, с./, 7,15 - 7,45 /4H, м./.
Стадия 4
Получение
5-гидрокси-3-(3-метилтио)фенил-4-тиазолидинона
5-Хлор-3-(3-метилтио)фенил-4-тиазолидинон (полученный, как описано
выше, на стадии 3) превращался в целевое соединение с помощью процедуры,
аналогичной описанной в препаративном примере 25, стадия 3, с использованием смеси тетрагидрофурана /20 мл/ и насыщенного
бикарбоната натрия /15 мл/. Сырой продукт очищался с помощью хроматографии на
силикагеле с использованием смеси этилацетата и гексана /1:1/ в качестве элюента. Целевое соединение получалось в виде
коричневой смолы, выход 0,578 г.
1H ЯМР /CDCl3/: δ 2,48 /3H, с./, 4,14 /1H, широкий с./, 4,70 /1H, д./, 4,98 /1H, д./, 5,72 /1H, с/, 7,10-7,40 /4H, м./.
Препаративный пример 38
Получение
5-гидрокси-3-(3-трифторметокси)фенил-4-тиазолидинона
Стадия 1
Получение 3-(3-трифторметокси)фенил-4-тиазолидинона
3-(Трифторметокси)анилин /5,076 г/ превращался в целевое
соединение с использованием толуола /150 мл/, тиогликолевой кислоты /2,99 мл/ и 37% водного раствора формальдегида /2,56 мл/ с помощью
процедуры, аналогичной описанной в препаративном примере 25,
стадия 1. Сырой продукт /8,583 г/ очищался с помощью хроматографии на силикагеле с использованием смеси этилацетата и гексана /15:85/ в
качестве элюента. Целевое соединение получалось в виде
подвижного бледно-желтого масла, выход 3,818 г.
1H ЯМР /CDCl3/: δ 3,73 /2H, с./, 4,82 /2H, с./, 7, 10 /1H, м./, 7,42 /3H, м./.
MC: м/e 263
/M+/
Стадия 2
Получение 5-хлор-3-(3-трифторметокси)фенил-4-тиазолидинона
3-(3-Трифторметокси)фенил-4-тиазолидинон (полученный, как описано выше, на стадии 1) /3,
468 г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в препаративном примере 25,
стадия 2, с использованием дихлорметана /25 мл/ и сульфурилхлорида /1,06 мл/. Целевое
соединение использовалось сразу же на стадии 3.
1H ЯМР /CDCl3/: δ 4, 70 /1H, д./, 5,22 /1H, д./, 5,76 /1H, с./, 7,16 /1H, м./, 7,48 /3H, м./.
Стадия 3
Получение 5-гидрокси-3-(3-трифторметокси)фенил-4-тиазолидинон
5-Хлор-3-(3-трифторметокси)фенил-4-тиазолидинон /полученный, как описано выше, на стадии
2/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в препаративном примере 25,
стадия 3, с использованием 1: 1 смеси тетрагидрофурана и насыщенного раствора бикарбоната
натрия /40 мл/. Сырой продукт /4,512 г/ очищался с помощью хроматографии на силикагеле с использованием смеси
этилацетата и гексана в качестве элюента. Целевое соединение получалось в виде желтого
твердого вещества, выход 1,514 г.
1H ЯМР /CDCl3/: δ 3,63 /1H, широкий с./, 4,73 /1H, д./, 5,00 /1H, д./, 5,72 /1H, с./, 7,15 /1H, м./, 7,47 /3H, м./.
Препаративный пример 39
Получение
5-гидрокси-3-(3-метокси-5-трифторметил)фенил-4-тиазолидинона
Стадия 1
Получение
3-(3-Метокси-5-трифторметил)фенил-4-тиазолидинона
5-Метокси-α, α, α
-трифтор-м-толуидин /5,286 г/ превращался в целевое соединение с использованием толуола /80 мл/,
тиогликолевой кислоты /2,1 мл/ и 37% водного раствора формальдегида /2,51 мл/ с помощью процедуры,
аналогичной описанной в препаративном примере 25, стадия 1. Выпаривание толуола давало желтое твердое
вещество, которое растворялось в диэтиловом эфире и промывалось последовательно 2М соляной
кислотой, насыщенным раствором бикарбоната натрия и солевым раствором. Органический слой сушился /сульфатом
магния/, и растворитель удалялся при пониженном давлении, давая остаток /4,2 г/, который
хроматографировался на двуокиси кремния с использованием смеси этилацетат-гексан /2: 8 - 25: 75/ в качестве
элюента. Целевое соединение /3,459 г/ имело:
1H ЯМР /CDCl3/:
δ 3,75 /2H, с./, 3,87 /3H, с./, 4,85 /2H, с./, 7,01 /1H, с./, 7,25 /1H, с./, 7,34 /1H, с./.
MC: м/e 277 /M+/
Стадия 2
Получение
5-хлор-3-(3-метокси-5-трифторметил)фенил-4-тиазолидинона
3-(3-Метокси-5-трифторметил)фенил-4-тиазолидинон
/полученный, как описано выше, на стадии 1/ /3,45 г/ превращался в целевое
соединение с помощью процедуры, аналогичной описанной в препаративном примере 25, стадия 2, с использованием дихлорметана /24
мл/ и сульфурилхлорида /1,05 мл/. Целевое соединение использовалось сразу
же на стадии 3.
Стадия 3
Получение 5-гидрокси-3-(3-метокси-5-трифторметил)фенил-4-тиазолидинона
5-Хлор-3-(3-метокси-5-трифторметил)фенил-4-тиазолидинон (полученный,
как описано выше, на стадии 2) превращался в целевое соединение с помощью процедуры, аналогичной описанной в препаративном
примере 25, стадия 3, с использованием смеси тетрагидрофурана /10 мл/ и
насыщенного раствора бикарбоната натрия /10 мл/. Сырой продукт /3,2 г/ очищался на силикагеле с использованием смеси
этилацетат-гексан /2:3/ давая целевое соединение /2,56 г/, которое имело:
1H ЯМР /CDCl3/: δ 3,87 /3H, с./, 4,15 /1H, широкий с./, 4,72 /1H, д./, 5,01 /1H, д./, 5,
71 /1H, с./, 7,03 /1H, с./, 7,27 /1H, д./, 7,36 /1H, д./.
MC: м/e
293 /M+/
Препаративный пример 40
Получение
5-гидрокси-3-(3-нитро-5-трифторметил)фенил-4-тиазолидинона
Стадия 1
Получение 3-нитро-5-трифторметиланилина
/см. J. Med. Chem., 1981, 24, 742/
3,5-Динитробензотрифторид /10
г/ растворялся в смеси метанола /200 мл/ и 1,4-диоксана /125 мл/ и нагревался с обратным холодильником. К данному раствору
добавлялась концентрированная соляная кислота /30 мл/, а затем небольшими
порциями порошок восстановленного железа /9 г/. Предосторожность необходима: бурное выделение газа. Нагревание с обратным
холодильником продолжалось еще в течение 1 часа, и реакционная смесь
оставлялась охлаждаться до комнатной температуры. Смесь фильтровалась через целит, и фильтровальное средство промывалось
дихлорметаном. Растворители удалялись при пониженном давлении, давая остаток,
который распределялся между дихлорметаном и водой. Органический слой промывался солевым раствором, сушился /сульфатом
магния/ и выпаривался при пониженном давлении, давая коричневое полутвердое
вещество /8 г/. Данное вещество хроматографировалось на силикагеле, давая целевое соединение в виде тонких золотистых
кристаллов, выход 4,98 г.
1H ЯМР /CDCl3/: δ 4,10-4,40 /2H, широкий с./, 7,15 /1H, широкий с./, 7,63 /1H, м./, 7,81 /1H, широкий с./.
Стадия 2
Получение 3-(3-нитро-5-трифторметил)фенил-4-тиазолидинона
3-Нитро-5-трифторметиланилин (полученный, как описано выше, на стадии 1) /4,98 г/ превращался в целевое соединение
с использованием толуола /90 мл/, тиогликолевой кислоты /2,30 мл/ и 37% водного
раствора формальдегида /2,75 мл/ с помощью процедуры, аналогичной описанной в препаративном примере 25, стадия 1. После
охлаждения осаждалось твердое вещество, которое удалялось с помощью фильтрования,
и фильтрат выпаривался при пониженном давлении, давая полутвердый остаток /3,965 г/. Данный остаток брался в
этилацетат и промывался последовательно 2 М соляной кислотой, насыщенным раствором
бикарбоната натрия и солевым раствором. Органический слой сушился сульфатом магния и выпаривался при пониженном
давлении, давая неочищенный продукт /2,82 г/. Данный продукт хроматографировался на
силикагеле с использованием смеси этилацетата и гексана /3:7/ в качестве элюента, давая целевое соединение, выход 1,
78 г.
1H ЯМР /CDCl3/: δ 3,81 /2H, с./, 4,94 /2H, с./, 8,28 /1H, с./, 8,34 /1H, с./, 8,58 /1H, м./.
MC: м/e 292 /M+/
Стадия 3
Получение 5-хлор-3-(3-нитро-5-трифторметил)фенил-4-тиазолидинона
3-(3-Нитро-5-трифторметил)фенил-тиазолидин-4-он (полученный, как описано выше на стадии 1) /1,78
г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в препаративном
примере 2, стадия 2, с использованием дихлорметана /20 мл/ и сульфурилхлорида /0,54 мл/. Целевое
соединение сразу же использовалось на стадии 4.
Стадия 4
Получение
5-гидрокси-3-(3-нитро-5-трифторметил)фенил-4-тиазолидинона
5-Хлор-3-(3-нитро-5-трифторметил)фенил-4-тиазолидинон /полученный, как описано выше, на стадии 1/ превращался в целевое соединение с
помощью процедуры, аналогичной описанной в препаративном примере
25, стадия 3, с использованием смеси тетрагидрофурана /10 мл/ и насыщенного раствора бикарбоната натрия /10 мл/. Неочищенный продукт /1,
67 г/ очищался на силикагеле с использованием этилацетата и
гексана /2:3/ в качестве элюента. Целевое соединение получалось в виде желтого твердого вещества, выход 1,118 г.
1 H ЯМР /CDCl3/: δ/ 4,78 /1H, д./, 5,21 /1H, д./, 5,65 /1H, д./, 6,94 /1H, д./, 8,33 /2H, с./, 8,67 /1H, м./.
MC: м/e 308 /M+/
Препаративный
пример 41
Получение
5-гидрокси-3-(3-трифторметансульфонилфенил)тиазолидин-4-она
Стадия 1
Получение 3-нитробензолсульфонилфторида
3-Нитробензолсульфонилхлорид /10
г/ растворялся в 1,4-диоксане
/30 мл/ и перемешивался при комнатной температуре. К данному раствору добавлялся раствор фторида калия /3,9 г/ в воде /5 мл/, и перемешивание продолжалось при комнатной
температуре в
течение 5
часов. Реакционная смесь оставлялась стоять при комнатной температуре на протяжении ночи и выливалась в смесь льда с водой. Продукт экстрагировался дихлорметаном, растворитель
сушился /сульфатом
магния/ и выпаривался при пониженном давлении, давая целевое соединение /8 г/. Данное вещество было достаточно чистым для следующей стадии синтеза.
1H ЯМР /CDCl3 /: δ 7,93 /1H, т./, 8,37 /1H, д./, 8,67 /1H, дд./, 8,89 /1H, м./.
MC: м/e 205 /M+/
Стадия 2
Получение
3-трифторметилсульфонилнитробензола /см.
Synthesis, 1990, 1151/.
3-Нитробензолсульфонилфторид (полученный, как описано выше, на стадии 1), /6,79 г/ суспендировался в петролейном эфире
/60/80/ /35 мл/ и перемешивался при
комнатной температуре в атмосфере азота. К данному раствору добавлялся трис/диметиламино/сера/триметилсилил/дифторид /0,92 г/, а затем /трифторметил/триметилсилан
/9,77 мл/, растворенный в сухом
тетрагидрофуране /35 мл/. Реакционная смесь перемешивалась при комнатной температуре в течение 3,5 часов, после этого анализ ГХ обнаружил 25% исходного материала и 75%
продукта. Смесь затем
обрабатывалась водой, и продукт и непревращенный исходный материал экстрагировались в гексане. Объединенные органические слои сушились и выпаривались, давая остаток /4,62 г/,
который обрабатывался
смесью водного аммиака и тетрагидрофурана для превращения неизменившегося сульфонилфторида в соответствующий сульфонамид. Когда ТСХ показала, что весь сульфонилфторид подвергся
превращению, смесь
разбавлялась водой, органический слой отделялся, сушился /сульфатом магния/ и выпаривался при пониженном давлении, давая остаток /3,8 г/, который хроматографировался на силикагеле с
использованием в
качестве элюента смеси /1:9/ этилацетата и гексана. Целевое соединение /2,77 г/ имело:
1H ЯМР /CDCl3/: δ 7,96 /1H, т./, 8,39 /2H, д./, 8,71 /1H,
д./, 8,90 /1H,
с./.
MC: м/e 255 /M+/
Стадия 3
Получение 3-(трифторметансульфонил)анилина
3-Трифторметилсульфонилнитробензол (полученный, как
описано выше, на
стадии 2) /3,27 г/ смешивался с водой /30 мл/, этанолом /60 мл/, хлористым аммонием /3,4245 г/ и восстановленным железом /3,584 г/, и смесь нагревалась с обратным холодильником в
течение 30 минут.
Реакционная смесь оставлялась охлаждаться до комнатной температуры и фильтровалась через целит. Фильтрат разбавлялся водой, и продукт экстрагировался дихлорметаном /три раза/.
Объединенные
органические слои сушились и выпаривались при пониженном давлении, давая остаток /2,752 г/, который объединялся с аналогичным остатком от более раннего получения с использованием /0,2
г/ 3-трифторметансульфонилнитробензола. Данное вещество хроматографировалось на силикагеле с использованием смеси этилацетата и гексана /1:4/ в качестве элюента, давая целевое соединение /2,466 г/,
которое имело:
1H ЯМР /CDCl3/: δ 3,90 - 4,20 /2H, широкий с./, 7,05 /1H, м./, 7,25 /1H, с./, 7,40 /2H, м./.
MC: м/e 225 /M+/
Стадия 4
Получение 3-(3-трифторметансульфонил)фенил-4-тиазолидинона
3-(Трифторметансульфонил)анилин /полученный, как описано выше, на стадии 3/ /2,46 г/ превращался в целевое
соединение с использованием толуола /30 мл/, тиогликолевой кислоты /1,386 г/ и 37% водного раствора формальдегида /1,25 мл/ с помощью процедуры, аналогичной процедуре, описанной в препаративном
примере 25, стадия 1. Растворитель удалялся, давая золотисто окрашенное масло, которое бралось в этилацетат и промывалось 2M соляной кислотой, насыщенным раствором бикарбоната натрия и солевым
раствором. Этилацетат сушился и выпаривался, давая остаток /0,87 г/, который содержал продукт. Вследствие плохого выделения продукта натрийбикарбонатные промывные воды доводились до pH 4 с
использованием 2 М соляной кислоты и экстрагировались в этилацетат. Полученный материал сушился /сульфатом магния/ и выпаривался при пониженном давлении, давая остаток /2,90 г/, который, как было
найдено, представляет промежуточную ациклическую кислоту, S-(N-(3-(трифторметансульфонил)фениламино)метил)тиогликолевую кислоту. Данное вещество превращалось в целевое соединение с помощью процедуры,
аналогичной описанной в препаративном примере 26, стадия 1, с использованием дихлорметана /50 мл/, тионилхлорида /0,65 мл/ и триэтиламина /1,25 мл/. Это давало дополнительный образец /2,07 г/,
содержащий целевое соединение, которое объединялось с ранним остатком /0,87 г/ и очищался на силикагеле с использованием смеси этилацетата и гексана /35:65/ в качестве элюента. Целевое соединение /1,
634 г/ получалось в виде желтого твердого вещества и имело:
1H ЯМР /CDCl3/: δ 3,78 /2H, с./, 4,90 /2H, с./, 7,72 /1H, т/, 7,89 /1H, д./ 8,05 /1H, с./, 8,15 /1H,
д./.
MC: м/e 311 /M+/
Стадия 5
Получение 5-хлор-3-(3-трифторметансульфонил)фенил-4- тиазолидинона
3-(3-Трифторметилсульфонил)фенил-4-тиазолидинон,
полученный, как описано выше на стадии 4, /1,63 г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в препаративном примере
25, стадия 2, с использованием дихлорметана /20
мл/ и сульфорилхлорида /0,46 мл/. Целевое соединение использовалось сразу же на стадии 6.
Стадия 6
Получение
5-гидрокси-3-(3-трифторметансульфонил)-4-тиазолидинона
5-Хлор-3-(3-трифторметансульфонил)фенил-4-тиазолидинон (полученный, как описано выше, на стадии 5) превращался в целевое соединение с
помощью процедуры, аналогичной описанной в препаративном примере
25, стадия 3, с использованием смеси тетрагидрофурана /10 мл/ и насыщенного раствора бикарбоната натрия /10 мл/. Сырой продукт /1,09
г/ очищался на силикагеле с использованием смеси этилацетат-гексан
/1:1/ в качестве элюента. Целевое соединение /0,47 г/ имело:
1H ЯМР /CDCl3/: δ 3,64 /1H,
широкий с./, 4,79 /1H, д/. 5,10 /1H, д./, 5,75 /1H, с./, 7,76 /1H, т./, 7,
93 /1H, д./, 8,18 /2H, м./.
MC: м/e 327 /M+/
Препаративный пример 42
Получение
3-гидрокси-1-(3-трифторметил)фенил-2-пирролидинона
Стадия 1
Получение 1-(3-трифторметил)фенил-2-пирролидинон-3-карбоновой кислоты
Суспензия 6,6-диметил-5,
7-диоксаспиро/2.5/октан-4,8-диона /полученного, как описано в Organic Synthesis, том 60,
стр. 66 - 68/ /8,00 г/ в 3-трифторметиланилине /8,05 г/ перемешивалась при комнатной температуре в течение 24
часов. Смесь фильтровалась, и нерастворимое твердое вещество промывалось хлороформом.
Объединенные фильтраты промывались 2 M соляной кислотой, солевым раствором, а затем сушились /сульфатом магния/.
Выпаривание растворителя при пониженном давлении давало коричневое твердое вещество,
которое перекристаллизовывалось из смеси хлороформа и гексана, давая продукт в виде белого кристаллического
твердого вещества, выход 4,10 г, т. пл. 135 - 136oC /разл./.
1H ЯМР /CDCl3/: δ 2,47 - 2,67 /2H, м./, 3,70 /1H, т./, 3,92 - 4,01 /2H, м./, 7,00 /широкий/, 7,45 - 7,60 /2H, м./, 7,81 - 7,90 /2H, м./.
Стадия 2
Получение 1-(3-трифторметил)фенил-2-пирролидинона
1-(3-трифторметил)фенил-2-пирролидинон-3-карбоновая кислота /полученная, как описано выше, на стадии 1/ /3,60 г/ нагревалась до ее точки
плавления, и нагревание продолжалось до тех пор, пока не
прекратится бурное выделение газа /приблизительно 50 минут/. Расплав охлаждался, растворялся в диэтиловом эфире и обрабатывался обесцвечивающим
древесным углем. Уголь отфильтровывался, и растворитель
удалялся при пониженном давлении, давая твердый остаток. Данное вещество перекристаллизовывалось из гексана, давая продукт в виде бесцветных игл,
выход 2,20 г, т. пл. 67 - 68oC.
1H ЯМР /CDCl3/: δ 2,19 /2H, квинт./, 2,62 /2H, т./, 3,89 /2H, т./, 7,35 - 7,53 /2H, м./, 7,81 - 7,93 /2H, м./.
MC: м/e 229 /M+/
Стадия 3
Получение 3-гидрокси-1-(3-трифторметил)фенил-2-пирролидинона
Перемешиваемый раствор
1-(3-трифторметил)фенил-2-пирролидинона /полученного, как описано выше, на стадии
2/ /1,10 г/ в сухом тетрагидрофуране /5 мл/ охлаждался до -70oC в атмосфере азота, и добавлялся по каплям
раствор гексаметилдисилазида лития в гексане /1,04 M, 4,9 мл/. Полученная в
результате бледно-желтая суспензия затем обрабатывалась раствором N-толуолсульфонил-3-фенилоксазиридина /полученного, как
описано в Journal of Organic Chemistiy, 1988, 53, 1087/ /2,00 г/ в сухом
тетрагидрофуране /5 мл/. Полученный в результате бледно-желтый раствор оставлялся подогреваться до комнатной температуры, и
затем гасился водой и подкислялся до pH 5 с использованием 2 M соляной
кислотой. Смесь экстрагировалась диэтиловым эфиром /дважды/, и объединенные экстракты промывались водой, сушились /сульфатом
магния/ и выпаривались при пониженном давлении, давая масло. Очистка с
помощью хроматографии на силикагеле, при элюировании смесями этилацетата и гексана, давала целевое соединение в виде светлой
смолы, выход 0,26 г.
1H ЯМР /CDCl3/: δ 1,62 /1H, широкий с./, 2,12 /1H, м./, 2,63 /1H, м./, 3,72 - 3,90 /2H, м./, 4,51 /1H, м./, 7,39 - 7,58 /2H, м./, 7,77 - 8,02 /2H, м./.
MC: м/e 245 /M+/
Препаративный пример 43
Получение 1-(2-хлор-6-фтор-4-трифторметил)фенил-3-гидрокси-2-пирролидинона
Стадия 1
Получение
1-(2-хлор-6-фтор-4-трифторметил-фенил-2-пирролидинона
Перемешиваемая суспензия 2-пирролидинона /2,60 г/ и тонко измельченной гидроокиси калия /1,80 г/ в сухом
диметилсульфоксиде 40
м/ обрабатывалась 1-хлор-2,3-дифтор-5-трифторметилбензолом /6,50 г/. Смесь перемешивалась при комнатной температуре в течение 1 часа, затем слегка подкислялась с помощью 2 М
соляной кислоты.
Кристаллический осадок, который образовывался, отфильтровывался, промывался водой и сушился, давая продукт в виде белого кристаллического соединения, выход 6,30 г, т. пл. 115
- 116oC.
1H ЯМР /CDCl3/: δ 2,22-2,37 /2H, м./, 2,56-2,66 /2H, м./, 3,70 /1H, м./, 3,79 /1H, м./, 7,38 /1H, м./, 7,57 /1H, м./.
Стадия 2
Получение 1-(2-хлор-6-фтор-4-трифторметил)фенил-3-гидрокси-2-пиррилидинона
С помощью процедуры, аналогичной процедуре, описанной в препаративном примере 42, стадия 3, но с
использованием
1-(2-хлор-6-фтор-4-трифторметил)фенил-2-пирролидинона /полученного, как описано выше, на стадии 1/ /11,40 г/ N-толуолсульфонил-3-фенилоксазиридина /полученного, как описано в Journal of
Organic
Chemistry, 1988, 53, 2087/ /15.00 г/ тетрагидрофурана /200 мл/ и раствора гексаметилдисилизида лития в тетрагидрофуране /1,0 М, 41,0 мл/ и очистки сырого продукта с помощью хроматографии на
силикагеле при элюировании смесями этилацетата и гексана, получалось целевое соединение в виде кристаллического твердого вещества, выход 2,40 г, т. пл. 102 - 104oC.
1H ЯМР /CDCl3/: δ 2,28 /1H, м./, 2,64 /1H, м./, 3,52-3,81 /3H, м./, 5,52 /1H, м./, 7,38 /1H, м./, 7,59 /1H, м./.
Препаративный пример 44
Получение
дигидро-2-гидрокси-4-(3-трифторметил)фенил-4H-1,4-оксазин-3/2H/-она
Стадия 1
Получение дигидро-4-(3-трифторметил)фенил-4H-1,4-оксазин-3/2H/-она
Перемешиваемый раствор
N-(3-трифторметилфенил)этаноламина /8,20 г/ в сухом тетрагидрофуране /25 мл/ обрабатывался добавлением по каплям хлорацетилхлорида /4,50 г/. Полученный в результате раствор охлаждался в ледяной ванне,
и порциями добавлялся гидрид натрия /3,20 г, 60% дисперсия в минеральном масле/. Смесь затем оставлялась подогреваться до комнатной температуры и перемешивалась в течение дальнейших 5 часов.
Добавлялась вода, и смесь экстрагировалась тщательно диэтиловым эфиром. Объединенные эфирные экстракты промывались солевым раствором, сушились /сульфатом магния/ и выпаривались при пониженном
давлении,
давая коричневое масло. Очистка с помощью хроматографии на силикагеле при элюировании смесями этилацетата и гексана давала целевое соединение в виде кристаллического твердого вещества,
выход 2,80 г,
т. пл. 47 - 48oC.
1H ЯМР /CDCl3/: δ 3,79 /2H, м./, 4,05 /2H, м./, 4,37 /2H, с./, 7,50 - 7,58 /3H, м./, 7,62 /1H, м./.
Стадия
2
Получение дигидро-2-гидрокси-4-(3-трифторметил)фенил-4H-1,4-оксазин-3/2H/-она
Перемешиваемый раствор дигидро-4-(3-трифторметил)фенил-4H-1,4-оксазин-3/2H/-она
/полученного, как
описано выше, на стадии 1/ /0,49 г/ в сухом тетрагидрофуране /20 мл/ охлаждался до 0oC в атмосфере азота, и по каплям добавлялся раствор гексаметилдисилазида лития в
тетрагидрофуране /1,0 М,
2,1 мл/. Полученная в результате бледно-желтая суспензия затем добавлялась к раствору N-толуолсульфонил-3-фенилоксазиридина /полученного, как описано в Journal of Organic
Chemistry, 1988, 53,
2087/ /1,10 г/ в сухом тетрагидрофуране /10 мл/. Полученный в результате бледно-желтый раствор оставлялся подогреваться до комнатной температуры и перемешивался в течение 1 часа
перед тем, как гасился
водой и подкислялся до pH 5 с использованием 2 М соляной кислоты. Смесь экстрагировалась диэтиловым эфиром /два раза/, и объединенные экстракты промывались солевым раствором,
сушились /сульфатом
магния/ и выпаривались при пониженном давлении, давая масло. Очистка с помощью хроматографии на силикагеле при элюировании смесями этилацетата и гексана давала целевое соединение
в виде белого
твердого вещества, выход 0,14 г, т. пл. 113 - 119oC.
1H ЯМР /CDCl3/: δ 3,59 /1H, м./, 3,91 - 4,05 /2H, м./, 4,49 /1H, м./, 5,04 /1H, широкий с./, 5,43 /1H, с./, 7,50 - 7,63 /4H, м./.
Препаративный пример 45
Получение дигидро-2-гидрокси-4-(3-трифторметил)фенил-4H-1,4-тиазин-3/2H-она
Стадия
1
Получение N-(2-бромэтил)-α, α, α-трифтор-м-толуидина
N-(3-трифторметилфенил)этаноламин /4,17 г/ и трифенилфосфин /5,50 г/ растворялись в сухом пиридине /35
мл/ и
перемешивались при 0oC. К данному раствору порциями добавлялся четырехбромистый углерод /7,08 г/. Перемешивание продолжалось в течение 1 часа, и реакционная смесь оставлялась стоять
при
комнатной температуре на протяжении ночи. Добавлялось еще немого трифенилфосфина /0,20 г/ и, когда фактически весь исходный спирт был потреблен, пиридин удалялся при пониженном давлении, давая
коричневый остаток /14,10 г/. Данное вещество хроматографировалось на силикагеле при элюировании смесью этилацетата и гексана /1:9/ в качестве элюента, давая целевое соединение в виде
светло-коричневого масла, выход 3,35 г.
1H ЯМР /CDCl3/: δ 3,58 /4H, м./, 4,25 /1H, широкий с./, 6,77 /1H, д./, 6,81 /1H, с./, 6,98 /1H, д./, 7,29 /1H, д./.
Стадия 2
Получение этил S-(2-(3-трифторметилфениламино)этил)тиогликолята
Раствор N-(2-бромэтил)-α, α, α-трифтор-м-толуидина (полученного,
как описано выше, на стадии 1) /2,80 г/ в диметилформамиде добавлялся к раствору натриевого аниона этилтиогликолята /полученного с использованием этилтиогликолята /1,25 г/ и гидрид натрия /1,25 г 60%
дисперсии в минеральном масле/ в диметилформамиде /общий объем 100 мл/, и оставлялся перемешиваться при комнатной температуре в течение приблизительно 2 часов. Реакционная смесь осторожно гасилась 5%
водным раствором хлористого аммония, и продукт экстрагировался диэтиловым эфиром /3 раза/. Объединенные органические слои промывались последовательно водой /x 2/ и солевым раствором, затем сушились
/сульфатом натрия/ и выпаривались при пониженном давлении. Остаток /3,00 г/ хроматографировался на силикагеле, с элюированием смесью этилацетата и гексана /15: 85/, давая целевое соединение в виде
масла, выход 2,07 г.
1H ЯМР /CDCl3/: δ 1,36 /3H, т./, 2,92 /2H, т./, 3,25 /2H, с./, 3,40 /1H, кв. /, 4,29 /2H, кв./, 4,39 /1H, широкий т./, 6,77 /1H, д./, 6,82 /1H, с./, 6,95 /1H, д./, 7,27 /1H, т./.
MC: м/e 307 /M+/
Стадия 3
Получение дигидро-4-(3-трифторметил)фенил-4H-1,4-тиазин-3/2/-она
Этил
S-(2-(3-трифторметилфениламино)этил)тиогликолят (полученный, как описано выше, на стадии 2) /2,05 г/ растворялся в ксилоле /25 мл/, и добавлялась п-толуолсульфоновая кислота /0,127 г/. Раствор
нагревался при мягком дефлегмировании в течение 28 часов, затем охлаждался, и растворитель удалялся при пониженном давлении, давая коричневое масло /1,88 г/. Данное вещество хроматографировалось на
силикагеле с элюированием смесью этилацетата и гексана /45:65/, давая целевое соединение в виде светло-коричневого твердого вещества, выход 1,31 г.
1H ЯМР /CDCl3 /: δ 3,05 /2H, т./, 3,48 /2H, с./, 4,02 /2H, т./, 7,52 /4H, м./.
MC: м/e 261 /M+/
Стадия 4
Получение дигидро-2-хлор-4-(3-трифторметил)фенил-4H-1,
4-тиазин-3/2H/-она
Дигидро-4-(3-трифторметил)фенил-4H-1,4-тиазин-3/2H/-он (полученный, как описано выше, на стадии 3) /1,31 г/ превращался в целевое соединение с помощью процедуры,
аналогичной описанной в препаративном примере 25, стадия 2, с использованием дихлорметана /17 мл/ и сульфурилхлорида /0,403 мл/. Данный продукт использовался непосредственно на стадии 5.
Стадия 5
Получение дигидро-2-гидрокси-4-(3-трифторметил)фенил-4H-1,4-тиазин-3/2H/-она
Дигидро-2-хлор-4-(3-трифторметил)фенил-4H-1,4-тиазин-3/2H/-он (полученный, как
описано выше, на стадии 4) превращался в целевое соединение с помощью процедуры, аналогичной описанной в препаративном примере 25, стадия 3, с использованием тетрагидрофурана /7 мл/ и насыщенного
раствора бикарбоната натрия /10 мл/. Сырой продукт /1,33 г/ очищался с помощью хроматографии на силикагеле при элюировании смесью этилацетата и гексана /35:65/. Целевое соединение /0,68 г/ имело:
1H ЯМР /CDCl3/: δ 3,20 /2H, м./, 4,10 /3H, м./, 5,62 /1H, д./, 7,55 /4H, м./.
MC: м/e 277 /M+/
Препаративный пример 46
Получение 3-гидрокси-1-(3-трифторметил)-фенил-2-имидазолидинона
Стадия 1
Получение N-безоилокси-N'-(3-трифторметил)фенилмочевины
Хлоргидрат 0-бензилгидроксиламина /1,71
г/ суспендировался в этилацетате, и смесь тщательно промывалась насыщенным водным раствором бикарбоната натрия. Органический слой сушился /сульфатом магния/ и выпаривался при пониженном давлении,
давая 0-бензилгидроксиламин в виде масла. Данное масло добавлялось по каплям к 3-трифторметилфенилизоцианату /2,00 г/, и смесь оставалась стоят в течение 1 часа. Смесь затем растворялась в
этилацетате
и промывалась 2 М соляной кислотой. Органический слой отделялся, сушился /сульфатом магния/ и выпаривался при пониженном давлении, давая продукт, выход 2,91 г.
1 H ЯМР /CDCl3/: δ 4,90 /2H, с./, 7,18 - 7,59 /11H, м./.
Стадия 2
Получение 1-бензилокси-3-(3-трифторметил)фенил-2-имидазолидинона
Перемешиваемый
раствор
N-бензилокси-N'-(3-трифторметил)фенилмочевины (полученной, как описано выше, на стадии 1) /0,815 г/ в диметилформамиде /30 мл/ обрабатывался добавлением порциями гидрида натрия /0,113 г 55%
дисперсии
в минеральном масле/. Раствор перемешивался в течение 30 минут, затем добавлялся 1,2-дибромэтан /0,494 г/. Смесь перемешивалась еще в течение 30 минут, а затем обрабатывалась порционно
гидридом натрия
/0,113 г 55% дисперсии в минеральном масле/. Смесь перемешивалась еще в течение 18 часов, затем добавлялся диэтиловый эфир, и смесь промывалась тщательно водой, сушилась /сульфатом
магния/ и
выпаривалась при пониженном давлении. Очистка с помощью хроматографии на силикагеле при элюировании смесями этилацетата и гексана давала целевое соединение, выход 0,410 г.
1 H ЯМР /CDCl3/: δ 3,43 /2H, т./, 3,70 /2H, т./, 5,05 /2H, с./, 7,22 - 7,52 /7H, м./, 7,74 - 7,89 /2H, м./.
Стадия 3
Получение
3-гидрокси-1-(3-трифторметил)фенил-2-имидазолидинона
Перемешиваемый раствор 1-бензилокси-3-(3-трифторметил)фенил-2-имидазолидинона /полученного, как описано выше, на стадии 2/ /0,223 г/ в
метаноле /30 мл/ гидрировался над 5% палладиевым катализатором на угле /0,025 г/ в течение 1 часа. Затем добавлялось дополнительное количество катализатора /0,025 г/, и смесь гидрировалась в течение
дополнительного часа. Смесь фильтровалась через Гифло, промывалась дополнительным метанолом, и объединенные фильтраты выпаривались при пониженном давлении, давая смолу. Очистка с помощью
хроматографии
на силикагеле при элюировании смесями этилацетата и гексана давала целевое соединение, выход 0,049 г.
1H ЯМР /CDCl3/: δ 3,65 - 3,76 /2H, м./, 3,76 - 3,87 /2H, м./, 7,38 /1H, д./, 7,48 /1H, т./, 7,75 /1H, с./, 7,80 /1H, д./, 8,72 /1H, широкий/.
MC: м/e 246 /M+/
Препаративный пример 47
Получение
тетрагидро-3-гидрокси-1-(3-трифторметил)фенил-2/1H/-пиримидинона
Стадия 1
Получение тетрагиро-1-бензилокси-3-(3-трифторметил)фенил-2/1H/-пиримидинона
С помощью
процедуры,
аналогичной описанной в препаративном примере 46, стадия 2, но с использованием N-бензилокси-N'-/3-трифторметил/фенилмочевины /полученной, как описано в препаративном примере 46, стадия 1
выше/ /0,714
г/, диметилформамида /30 мл/, гидрида натрия /0,100 г 55% дисперсии в минеральном масле/, 1,3-дибромпропана /0,465 г/ и дополнительного количества гидрида натрия /0,100 г 55% дисперсии в
минеральном
масле/, и с помощью очистки сырого продукта с помощью хроматографии на силикагеле при элюировании смесями этилацетата и гексана получалось целевое соединение, 0,510 г.
1H ЯМР /CDCl3/: δ 2,11 /2H, квинт./, 3,52 /2H, т./, 3,63 /2H, т./, 4,99 /2H, с./, 7,30 - 7,58 /9H, м./.
Стадия 2
Получение
тетрагидро-3-гидрокси-1-(3-трифторметил)фенил-2-/1H/-пиримидинона
С помощью процедуры, аналогичной описанной в предварительном примере 46, стадия 3 выше, но при гидрировании
тетрагидро-1-бензилокси-3-/3-трифторметил/фенил-2/1H/-пиримидинона /полученного на стадии 2 выше/ /0,75 г/ над 5% палладиевым катализатором на угле /0,015 г/ в метаноле /5 мл/ получалось целевое
соединение.
1H ЯМР /CDCl3/: δ 2,28 /2H, квинт./, 3,74 /4H, т./, 7,40 - 7,53 /4H, м. /, /OH, широкий - не наблюдался/.
MC: м/e 260 /M+/
Препаративный пример 48
Получение 3-гидрокси-1-(3-трифторметил)фенил/2-пиперидинона
Стадия 1
Получение N-(3-трифторметил)фенил-5-хлорвалерамида
5-Хлорвалерилхлорид /4,00 г/ добавлялся к 3-трифторметиланилину /5,00 г/. Полученная в результате твердая масса растворялась в этилацетате, и раствор промывался 2 М соляной кислотой, водой и
насыщенным раствором бикарбоната натрия. Органический слой сушился /сульфатом магния/ и выпаривался при пониженном давлении, давая продукт в виде масла, выход 8,06 г.
1H ЯМР /CDCl3/: δ 1,78-1,95 /4H, м./, 2,42 /2H, т./, 3,55 /2H, т./, 7,31-7,47 /2H, м./, 7,59 /1H, широкий с./, 7,71 /1H, д./, 7,82 /1H, с./.
Стадия 2
Получение
1-(3-трифторметил)фенил-2-пиперидинона
Раствор N-(3-трифторметил)фенил-5-хлорвалерамида (полученного, как описано выше, на стадии 1) /7,91 г/ в диметилформамиде /100
мл/ обрабатывался
порциями гидрида натрия /1,23 г 55% дисперсии в минеральном масле/. Смесь перемешивалась при комнатной температуре в течение 16 часов, затем нагревалась до 60oC в течение
2 часов. Смесь
затем охлаждалась, разбавлялась диэтиловым эфиром и экстрагировалась тщательно водой, и органическая фаза затем сушилась /сульфатом магния/. Выпаривание растворителя при пониженном
давлении давало
продукт в виде твердого вещества, выход 3,24 г.
1H ЯМР /CDCl3/: δ 1,88-2,03 /4H, м./, 2,58 /2H, т./, 3,67 /2H, т./, 7,44-7,56 /4H, м./.
Стадия 3
Получение 3-гидрокси-1-(3-трифторметил)фенил-2-пиперидинона
Перемешиваемый раствор 1-(3-трифторметил)фенил-2-пиперидинона (полученного, как описано выше, на
стадии 2) /1,03
г/ в тетрагидрофуране /15 мл/ охлаждался до 0oC в атмосфере азота, и по каплям добавлялся литийгексаметилдисилазид /4,2 мл 1 М раствора в тетрагидрофуране/. Полученный в
результате
оранжевый раствор затем обрабатывался раствором N-толуолсульфонил-3-фенилоксазиридина /полученного как описано в Journal of Organic Chemistry, 1988, 53, 2087/ /1,16 г/ в тетрагидрофуране
/5 мл/. Смесь
оставалась стоять в течение 66 часов, затем разбавлялась водой и экстрагировалась диэтиловым эфиром. Эфирный экстракт сушился /сульфатом магния/, выпаривался при пониженном давлении, и
смесь
разделялась с помощью хроматографии на силикагеле при элюировании смесями этилацетата и гексана, давая продукт, который получался в виде 2:1 смеси с непрореагировавшим
1-(3-трифторметил)фенил-2-пиперидиноном, от которого он не смог быть отделен. Данная смесь использовалась непосредственно в примере 91.
1H ЯМР /CDCl3/: между прочим δ 1,80-2,12 /3H, м./, 2,43 /1H, м./, 3,60-3,71 /2H, м./, 3,79 /1H, м./, 4,25 /1H, м./, 7,42-7,58 /4H, м/.
Препаративный пример 49
Получение
дигидро-6-гидрокси-3-метил-4-(3,5-бис(трифторметил))фенил-2H-1,3,4- триадиазин-5/6H/-она
Стадия 1
Получение дигидро-4-(3,5-бис(трифторметил))фенил-2H-1,3,4-тиадиазин-5/6H/-она
Перемешиваемый раствор 3,5-бис/трифторметил/гидразина /1,22 г/ в толуоле /20 мл/ обрабатывался по каплям 37% водным формальдегидом /0,385 мл/, затем добавлялась паратолуолсульфоновая кислота /2
мг/. Смесь перемешивалась в течение 10 минут, затем добавлялась тиогликолевая кислота /0,46 г/, и смесь нагревалась в условиях дефлегмации, и вода собиралась в аппарате Дина-Старка. Через 3,5 часа
смесь охлаждалась, разбавлялась этилацетатом /30 мл/, промывалась водой /30 мл/, 2 М соляной кислотой /30 мл/, сушилась /сульфатом магния/ и выпаривалась при пониженном давлении, давая бледно-желтое
твердое вещество. Растирание с диэтиловым эфиром давало целевое соединение, выход 0,821 г.
1H ЯМР /CDCl3/: δ 3,65 /2H, с./, 4,57 /2H, с./, 6,99 /1H, с./, 7, 05 /2H, с./, 7,39 /1H, с./.
Стадия 2
Получение дигидро-3-метил-4-(3,5-бис(трифторметил))фенил- 2H,1,3,4-тиадиазин-5-/6H/-она
Раствор дигидро-4-(3,
5-бис(трифторметил))фенил-2H-1,3,4-тиадиазин -5-/6H/-она /полученного, как описано выше, на стадии 1/ /0,330 г/ в тетрагидрофуране /2 мл/ добавлялся по каплям к перемешиваемой суспензии гидрида
натрия
/24 мг/ в тетрагидрофуране /3 мл/. Спустя 15 минут красный раствор обрабатывался метилиодидом /0,142 г/, и смесь перемешивалась в течение 2 часов. Добавлялось дополнительное количество
метилиодида /1,
0 мл/, и смесь перемешивалась еще в течение 30 минут перед тем, как она разбавлялась диэтиловым эфиром /30 мл/ и промывалась водой /30 мл/. Органический слой отделялся, сушился
/сульфатом магния/ и
выпаривался при пониженном давлении, давая целевое соединение в виде бледно-желтого твердого вещества, выход 0,321 г.
1H ЯМР /CDCl3/: δ 3,29 /3H, с./, 3,59 /2H, с./, 4,50 /2H, широкий/, 7,03 /2H, с./, 7,37 /1H, с./.
Стадия 3
Получение дигидро-6-гидрокси-3-метил-4-(3,5-бис(трифторметил))фенил-2H-1,3,
4-тиадиазин-5-/6H/-она
Перемешиваемый дигидро-3-метил-4-(3,5-бис(трифторметил))фенил- 2H, 1,3,4-тиадиазин-5-/6H/-она /полученного, как описано выше, на стадии 2/ /0,321 г/ в дихлорметане /8
мл/ охлаждался на ледяной бане.
Через раствор барботировалась струя азота и добавлялся сульфурилхлорид /0,08 мл/. После добавления раствор перемешивался при охлаждении в течение 10 минут, оставлялся
подогреваться до комнатной
температуры, а затем перемешивался в течение еще 30 минут при поддержании тока азота. Раствор выпаривался при пониженном давлении, и остаток растворялся в тетрагидрофуране
/5 л/. Данный раствор
обрабатывался водным раствором бикарбоната натрия /5 мл/, и смесь перемешивалась энергично в течение 15 минут, затем оставлялась стоять в течение 16 часов. Смесь
экстрагировалась этилацетатом /2 х 30
мл/, и объединенные экстракты сушились /сульфатом магния/. Выпаривание растворителя при пониженном давлении давало смолу, которая растиралась со смесью
этилацетата и гексана и фильтровалась с
удалением твердого вещества. Фильтрат выпаривался при пониженном давлении, и остаток хроматографировался на силикагеле при элюировании смесями этилацетата и
гексана, давая целевое соединение в виде
смолы, выход 0,037 г.
1H ЯМР /CDCl3/: δ 3,30 /3H, с./, 3,95 /1H, широкий с./, 4,39 /1H, широкий д./, 4,78 /1H, д./, 5,55 /1H, с./, 7,02 /2H, с/, 7,36 /1H, с/.
Препаративный пример 50
Получение дигидро-4-гидрокси-2-(3-трифторметил)фенил-2H-1,2- оксазин-3/4H/-она
Стадия 1
Получение
N-(3-трифторметил)фенил-гидроксиламина
Раствор 3-нитро-α, α, α-трифтортолуола /4,95 г/ в этаноле /100 мл/ перемешивался энергично с помощью воздушной
мешалки и
обрабатывался последовательно раствором хлорида аммония /15,00 г/ в воде /50 мл/, затем порошком цинка /12,00 г/. Спустя 5 минут, когда экзотермия начала затухать, смесь фильтровалась через
Гифло
Супер-цел, разбавлялась водой /100 мл/ и экстрагировалась этилацетатом /3 х 100 мл/. Объединенные экстракты промывались солевым раствором, сушились /сульфатом магния/ и выпаривались при
пониженном
давлении, давая желтое масло. Данное масло хроматографировалось на силикагеле при элюировании смесью дихлорметан/этилацетат /19:1/, давая целевое соединение, выход 3,75 г, т. пл. 44
- 45o
C.
Стадия 2
Получение смеси дигидро-4-бром-2-(3-трифторметил)фенил-2H-1,2-оксазин-3/4H/-она и дигидро-4-хлор-2-(3-трифторметил)фенил-2H-1,
2-оксазин-3/4H/-она
Раствор
N-(3-трифторметил)фенилгидроксиламина (полученного, как описано выше, на стадии 1) /3,60 г/ и триэтиламина /4,12 г/ в сухом тетрагидрофуране /10 мл/ добавлялся на
протяжении 20 минут к перемешиваемому,
охлажденному льдом раствору 2,4-дибромбутаноилхлорида /92% чистоты, полученного, как описано в Journal of Medical Chemistry, 1987, 30, 1995/ /5,81 г/ в сухом
тетрагидрофуране /10 мл/. Смесь
перемешивалась в течение следующих 3 часов, фильтровалась, и фильтрат выпаривался при пониженном давлении. Остаток разбавлялся этилацетатом, промывался 2 М соляной
кислотой, водой, водным карбонатом
натрия /три раза и солевым раствором, сушился /сульфатом магния/ и выпаривался при пониженном давлении. Остаток хроматографировался на силикагеле при элюировании
смесью этилацетата и гексана /1:5/,
давая 1:1 смесь целевых соединений в виде оранжевого масла, выход 1,42 г.
1H ЯМР /CDCl3/: δ 2,4 - 2,7 /1H, м./, 2,8 - 3,0 /1H, 2 м./, 4,3 - 4,5 /2H, 2 м./, 4,8 - 4,9 /1H, 2 м./, 7,4 - 7,6 /2H, 2 м./.
Стадия 3
Получение дигидро-4-иод-2-(3-трифторметил)фенил-2H-1,2-оксазин-3/4H/-она
Смесь 1: 1
/дигидро-4-бром-2-(3-трифторметил)фенил-2H-1,2-оксазин-3/4H/-она и дигидро-4-хлор-2-(3-трифторметил)фенил-2H-1,2-оксазин-3/4H/-она /полученная, как описано выше, на стадии 2/ /1,20 г/,
иодида натрия
/1,11 г/ и сухого ацетона /25 мл/ нагревалась в условиях дефлегмации в течение 2 часов, оставлялась охлаждаться, разбавлялась водой и экстрагировалась этилацетатом /трижды/.
Объединенные органические
экстракты промывались солевым раствором, сушились /сульфатом магния/ и выпаривались досуха при пониженном давлении. Было показано, что остаток представляет 93%
дигидро-4-иод-2-(3-трифторметил)фенил-2H-1,2- оксазин-3/4H/-она и 7% дигидро-4-хлор-2-(3-трифторметил)фенил-2H-1,2- оксазин-/4/-она, выход 1,50 г.
1H ЯМР /CDCl3 /: между прочим δ 2,86 /1H, м/, 2,84 /1H, м./, 4,33 /1H, м. /, 4,46 /1H, м./, 4,88 /1H, т./, 7,40 - 7,55 /2H, м./, 7,92 - 8,00 /2H, д. и с./.
MC: м/e 371 /М+/
Стадия 4
Получение дигидро-4-гидрокси-2-(3-трифторметил)фенил-2H-1,2- оксазин-3/4H/-она
Смесь дигидро-4-иод-2-(3-трифторметил)фенил-2H-1,2-оксазин- 3/4H/-она (полученного, как
описано выше, на стадии 3) /1,20 г/ и бис(трифторацетокси)иодбензола /1,68 г/ в сухом дихлорметане /25 мл/ и перемешивалась в течение 24 часов. Смесь затем разбавлялась диэтиловым эфиром, промывалась
водным бисульфитом натрия, водным бикарбонатом натрия и солевым раствором, сушилась /сульфатом магния/ и выпаривалась при пониженном давлении, давая трифторацетатный эфир целевого соединения. Данное
вещество фильтровалось через силикагель в смеси дихлорметана и метанола /49:1/, давая спирт, затем хроматографировалась на силикагеле при элюировании смесью этилацетат/гексан /1: 3/, давая целевое
соединение в виде масла, которое кристаллизовалось при стоянии, выход 0,44 г, т. пл. 45 - 46oC.
1H ЯМР /CDCl3/: δ 1,97 /1H, м./, 2,87 /1H, м./, 3,55 /1H, д./, 4,30 /1H, м./, 4,45 /1H, м./, 4,69 /1H, дт/, 7,49 /2H, д.+т./, 8,00 /2H, с.+д./.
MC: м/e 261 /M+/
Препаративный пример 51
Получение
5-гидрокси-3-(3-N,N-дибензил)сульфонамино)фенил-4- тиазолидинона
Стадия 1
Получение 3-(N,N-дибензилсульфонамино)нитробензола
Дибензиламин /10,9 мл/ растворялся в сухом
дихлорметане /40 мл/ и перемешивался при 0oC. К данном раствору добавлялся по каплям 3-нитрофенилсульфонилхлорид /4,18 г/, и перемешивание продолжалось при 0oC в течение 30
минут. Охлаждающая ванна затем удалялась, и реакционная смесь оставлялась подогреваться при комнатной температуре на протяжении 2 часов. Затем добавлялась вода, и продукт экстрагировался в
дихлорметан
/3 х/. Объединенные органические слои промывались 2 М соляной кислотой и солевым раствором, а затем сушились /сульфатом магния/ .Растворитель удалялся при пониженном давлении, давая
остаток /11,60 г/,
который хроматографировался на силикагеле с использованием смеси этилацетат-гексан /1: 4/ в качестве элюента. Целевое соединение /3,2 г/ имело:
1H ЯМР /CDCl3/: δ 4,
42 /4H, с./, 7,12 /4H, м./, 7,24 /6H, м./, 7,65 /1H, т./, 8,06 /1H, д./, 8,38 /1H, д/, /8,51 /1H, с./.
MC: м/e 382 /М+/
Стадия 2
Получение 2-((N,
N-дибензил)сульфонамидо)анилина
3-(Дибензилсульфонамидо)нитробензол /полученный, как описано выше на стадии 1/, железо /2,35 г/, хлористый аммоний /2,24 г/, этанол /140 мл/ и
вода смешивались,
а затем нагревались с обратным холодильником вместе в течение 1,5 часов. Реакционная смесь охлаждалась до комнатной температуры, а затем фильтровалась через целит. Фильтрат
смешивался с водой, и
продукт экстрагировался в дихлорметан /3 х/. Объединенные органические слои сушились /сульфатом магния/ и упаривались при пониженном давлении, давая остаток /3,022 г/. Остаток
хроматографировался на
силикагеле с использованием этилацетата и гексана /от 1:4 до 1:3/, давая целевое соединение /2,47 г/, которое имело:
1H ЯМР /CDCl3/: δ 3,90
/2H, широкий с./, 4,33
/4H, с./, 6,85 /1H, дд./, 7,15 /5H, м./, 7,25 /8H, м./.
MC: 352 /М+/
Стадия 3
Получение 3-(3-N,
N-дибензил)сульфонамидо)фенил-4-тиазолидинона
3-/Дибензилсульфонамидо/анилин /полученный, как описано выше на стадии 3/ /2,664 г/ превращался в целевое соединение с использованием толуола
/20 мл/, тиогликолевой кислоты /0,63 мл/ и 37% водного
раствора формальдегида /0,74 мл/ с помощью процедуры, аналогичной описанной в препаративном примере 25, стадия 1. Растворитель удалялся при
пониженном давлении, давая смолу, которая бралась в
дихлорметан и промывалась 2 М соляной кислотой, насыщенным раствором бикарбоната натрия и водой. Растворитель сушился /сульфатом магния/ и
выпаривался при пониженном давлении, давая не совсем белое
твердое вещество /1,5 г/, которое было достаточно чистым для следующей стадии синтеза.
1H ЯМР /CDCl3/: δ 3,75 /2H, с./, 4,35 /4H, с./, 4,75 /2H, с/, 7,09 /4H, м. /, 7,23 /6H, м./, 7,53 /1H, т./, 7,69 /1H, д./, 7,75 /1H, с./, 7,82 /1H, д./.
Стадия 4
Получение
5-хлор-3-(3-N,N-дибензил)сульфонамидофенил)-4-тиазолидинона
3-(Дибензилсульфонамидо)фенил-4-тиазолидинон /полученный, как описано выше, на стадии 3/ /1,5 г/ превращался в целевое соединение
с помощью процедуры, аналогичной описанной в препаративном примере 25,
стадия 2, с использованием дихлорметана /15 мл/ и сульфонилхлорида /0,29 мл/. Целевое соединение использовалось сразу же на
стадии 5.
Стадия 5
Получение
5-гидрокси-3-/дибензилсульфонамидо/фенил-4-тиазолидинона.
5-Хлор-3-(3-N,N-дибензил)сульфонамидо)фенил)-4-тиазолидинон
/полученный, как описано выше, на стадии 4/ превращался в целевое
соединение с помощью процедуры, аналогичной описанной в препаративном примере 25, стадия 3, с использованием смеси тетрагидрофурана
/10 мл/ и насыщенного раствора бикарбоната натрия /10 мл/. Сырой
продукт /1,34 г/ очищался на силикагеле с использованием смеси этилацетат : гексан /55:45/ в качестве элюента, давая целевое
соединение в виде хрупкой желтой пены /0,83 г/, которая имела:
1H ЯМР /CDCl3/: δ 3,83 /1H, широкий с./, 4,35 /4H, с./, 4,62 /1H, д./, 4,93 /1H, д./, 5,71 /1H,
с./, 7,09 /4H, м./, 7,23 /6H, м./, 7,54 /1H, т./, 7,71 /1H, д./, 7,80 /2H,
м./.
Пример 1
Получение соединения 1
5-трет-бутилкарбамоилокси-3-(3,
4-дихлор)фенил-4-тиазолидинон
Перемешиваемый раствор 3-(3,
4-дихлор)фенил-5-гидрокси-4- тиазолидинона /полученного, как описано выше, в препаративном примере 1/ /1,50 г/ в дихлорметане /40
мл/ обрабатывался по каплям трет-бутилизоцианатом /0,56 г/ и
триэтиламином /0,58 г/. Раствор перемешивался в течение 6 часов, а затем оставлялся стоять еще в течение 18 часов. Раствор затем
промывался 2 М соляной кислотой /30 мл/, сушился /сульфатом магния/ и
растворитель удалялся при пониженном давлении, давая бледно-желтое твердое вещество. Перекристаллизация из смеси хлороформ/гексан
давала целевое соединение в виде кристаллического твердого вещества,
выход 1,31 г, т. пл. 133 - 134oC.
1H ЯМР /CDCl3/: δ 1,32 /9H, с./, 4,62 /1H, д./, 4,89 /1H, широкий с./, 4,98 /1H, д./, 6,18 /1H, с./, 7,33 - 7, 50 /2H, м./, 7,68 /1H, с./.
Пример 2
Получение соединения 5
5-изо-пропилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
Перемешиваемый раствор
5-гидрокси-3-(3-трифторметил)фенил-4- тиазолидинона (полученного, как описано выше, в препаративном
примере 2) /3,00 г/ и триэтиламина /0,1 мл/ в хлороформе /40 мл/ обрабатывался по каплям раствором
изопропилизоцианата /1,08 г/ в хлороформе /10 мл/. Смесь перемешивалась в течение 2 часов, затем
добавлялось дополнительное количество изопропилизоцианата /1 мл/. Смесь перемешивалась еще в течение 30
минут, затем выпаривалась при пониженном давлении, давая белое твердое вещество. Данное
вещество растиралось с гексаном и перекристаллизовывалось из смеси этилацетат/гексан, давая целевое соединение в
виде белого кристаллического твердого вещества, выход 2,88 г, т. пл. 167 - 168oC.
1H ЯМР /CDCl3/: δ 1,19 /6H, д./, 3,83 /1H, м./, 4,69 /1H, д./, 4,78 /1H, широкий д./, 5,07 /1H, д./, 6,21 /1H, с./, 7,51 - 7,62 /2H, м./, 7,71 - 7,79 /2H, м./.
Пример 3
Получение соединения 9
5-метилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
С помощью процедуры, аналогичной процедуре,
описанной в примере 2, но с использованием
5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона (полученного, как описано выше в препаративном примере 2), метилизоцианата и триэтиламина получалось
целевое соединение, т. пл. 156oC.
Пример 4
Получение соединения 16
5-этилкарбамоилокси-3-(3-трифторметил)фенил-4-триазолидинон
С помощью
процедуры, аналогичной описанной в примере 2, но с
использованием 5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона (полученного, как описано в препаративном примере 2, выше) /1,00 г/,
этилизоцианата /0,25 мл/, триэтиламина /0,01 мл/ и хлороформа /5
мл/, получалось целевое соединение, т. пл. 152 - 153oC.
1H ЯМР /CDCl3/: δ 1,25 /3H, т./, 3,36 /2H, м./, 4,69 /1H, д./, 4,89 /1H, широкий т./, 5, 08 /1H, дд./, 6,21 /1H, д./, 7,51 - 7,59 /2H, м/, 7,71 - 7,80 /2H, м./.
Пример 5
Получение соединения 17
5-бензилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
С помощью процедуры, аналогичной процедуре, описанной в примере 2, но с использованием
5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона /полученного, как описано в примере получения 2 выше/ /0,90 г/, бензилизоцианата /0,46 г/ триэтиламина /0,01 мл/ и хлороформа /3 мл/ получалось
целевое соединение, т.пл. 153 - 154oC.
1H ЯМР /CDCl3/: δ 4,39 /2,H д./, 4,68 /1H, д./, 5,07 /1H, дд/, 5,25 /1H, широкий т. /, 6,24 /1H, д./, 7, 23-7,38 /5H, м./, 7,50-7,60 /2H, м,/, 7,70-7,79 /2H, м./.
Пример 6
Получение соединения 20
5-фенилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
С
помощью процедуры, аналогичной описанной в примере 2, но с использованием 5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона (полученного, как описано в препаративном примере 2 выше) /0,80 г/,
фенилизоцианата /0,33 мл/, триэтиламина /0,01 мл/ и хлороформа /2 мл/ получалось целевое соединение, т. пл. 192 - 194oC.
1H ЯМР /CDCl3/ d6- DMCO/: δ 4,71 /1H, дд./, 5,12 /1H, дд./, 6,29 /1H, дд. /, 7,02 /1H, м. /, 7,20-7,31 /2H, м./, 7,40-7,65 /4H, м./, 7,72 /1H, м./, 7,85 /1H, м/, 9,01 /1H, широкий с./.
Пример
7
Получение соединения 26
5-трет-бутилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
Перемешивая суспензию 5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона
/полученного, как описано в препаративном примере 2 выше/ /0,84 г/ в хлороформе /5 мл/ обрабатывалась триэтиламином /0,01/, затем трет-бутилизоцианатом /0,32 г/. Полученный в результате раствор
перемешивался в течение 2 часов, затем выпаривался при пониженном давлении. Твердый остаток перекристаллизовывался из гексана, давая целевое соединение в виде белого кристаллического соединения,
выход
0,90 г, т. пл. 98 - 99oC.
1H ЯМР /CDCl3/: δ 1,32 /9H, с./, 4,69 /1H, д./, 4,90 /1H, широкий с./, 5,04 /1H, д./, 6,21 /1H, с./, 7,52-7,59 /2H, м./, 7,71-7,79 /2H, м./.
MC: м/e 361 /M+/
Пример 8
Получение соединения 30
5-изо-пропилкарбамоилокси-3-(3,
5-бис(трифторметил))фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 2, но с использованием 5-гидрокси-3-(3,5-бис(трифторметил)) фенил-4-тиазолидинона /полученного,
как описано в препаративном примере 3 выше/ /1,50/, изо-пропилизоцианата /0,39 г/, триэтиламина /0,01 мл/ и хлороформа /5 мл/ и при перекристаллизации сырого продукта из смеси хлороформа и гексана,
получалось целевое соединение в виде белого твердого вещества, выход 1,30 г, т. пл. 141-142oC.
1H ЯМР /CDCl3/: δ 1,19 /6H, д./, 3,82 /1H, м./, 4, 72 /1H, д./, 4,76 /1H, широкий д./, 5,13 /1H, д./, 6,20 /1H, с./, 7,78 /1H, с./, 8,04 /2H, с/.
Пример 9
Получение соединения 33
5-изо-пропилкарбамоилокси-3-(4-трифторметил)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 2, но с использованием
5-гидрокси-3-(4-трифторметил)фенил-4-тиазолидинона
/полученного, как описано выше в препаративном примере 4/ /0,185 г/, изо-пропилизоцианата /0,060 г/, триэтиламина /0,01 мл/ и хлороформа /5 мл/ и
перекристаллизации неочищенного продукта из смеси
хлороформа и гексана получалось целевое соединение в виде белого твердого вещества, выход 0,180 г, т. пл. 198oC.
1H ЯМР /CDCl3/: δ 1,19 /6H, д./, 3,81 /1H, м./, 4,69 /1H, д/, 4,76 /1H, широкий д./, 5,09 /1H, д./, 6,21 /1H, с./, 7,63-7,71 /4H, м./.
Пример 10
Получение соединения 35
5-трет-бутилкарбамоилокси-3-(3-хлор)фенил-4-тиазолидинон
Перемешиваемая суспензия 3-(3-хлор)фенил-5-гидрокси-4-тиазолидинона /полученного, как описано выше в
препаративном примере 5/ /16,60
г/ в дихлорметане /100 мл/ обрабатывалась триэтиламином /10 мл/ с последующим добавлением трет-бутилизоцианата /8,5 мл/. Раствор перемешивался в течение 8 часов, затем
оставлялся стоять в течение 18
часов. Раствор промывался 2 М соляной кислотой /50 мл/, затем солевым раствором, и затем сушился /сульфатом магния/. Выпаривание растворителя при пониженном давлении
давало твердый остаток, который
перекристаллизовывался из четыреххлористого углерода, давая целевое соединение в виде белого твердого вещества, выход 21,20 г, т. пл. 117 - 118oC.
1H ЯМР /CDCl3/: δ 1,32 /9H, с,/, 4,76 /1H, д./, 4,90 /1H, широкий с./, 4,98 /1H, д./, 6,19 /1H, с./, 7,20-7,40 /3H, м./, 7,53 /1H, м./.
Пример
11
Получение
соединения 40
5-трет-бутилкарбамоилокси-3-(3,5-дихлор)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с использованием 3-(3,
5-дихлор)фенил-5-гидрокси-4-тиизолидинона (полученного, как описано выше в препаративном примере 6) /14,30 г/, трет-бутилизоцианата /7,0 мл/, триэтиламина /7,6 мл/ и хлороформа в качестве
растворителя
/100 мл/ и при осуществлении перекристаллизации сырого продукта из четыреххлористого углерода, получалось целевое соединение в виде белого твердого вещества, выход 17,00 г, т. пл. 150
- 152o
C.
1H ЯМР /CDCl3/: δ 1,32 /9H, с./, 4,61 /1H, д./, 4,88 /1H, широкий с./, 4,99 /1H, д./, 6,14 /1H, с./, 7,25 /1H, т./, 7,47 /2H, д/.
Пример 12
Получение соединения 44
3-(3-хлор-4-фтор)фенил-5-изо-пропилкарбамоилокси-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но
с
использованием 3-(3-хлор-4-фтор)фенил-5-гидрокси-4- тиазолидинона (полученного, как описано выше в препаративном примере 7) /2,50 г/, изопропилизоцианата /0,86 г/, триэтиламина /1,3 мл/ и
дихлорметана
/25 мл/ и перекристаллизации сырого продукта из хлороформа, получалось целевое соединение в виде белого твердого вещества, выход 3,20 г, т. пл. 190 - 191oC.
1H ЯМР /CDCl3/: δ 1,18 /6H, д./, 3,83 /1H, м./, 4,61 /1H, д/, 4,78 /1H, широкий д. /, 4,99 /1H, д./, 6,18 /1H, с./, 7,20 /1H, м./, 7,36 /1H, м./, 7,60 /1H, м./.
Пример
13
Получение соединения 45
5-трет-бутилкарбамоилокси-3-(3-хлор-4-фтор)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с
использованием
3-(3-хлор-4-фтор)фенил-5-гидрокси-4-тиазолидинона (полученного, как описано выше в препаративном примере 7) /2,50 г/, третбутилизоцианата /1,00 г/, триэтиламина /1,3 мл/ и дихлорметана
/25 мл/ и
перекристаллизации сырого продукта из смеси толуол/гексан, получалось целевое соединение в виде белого твердого вещества, выход 2,60 г, т. пл. 130 - 133oC.
1H ЯМР /CDCl3/: δ 1,32 /9H, с./, 4,61 /1H, д./, 4,89 /1H, широкий с./, 4,95 /1H, д/, 6,18 /1H, с./, 7,21 /1H, м./, 7,36 /1H, м./, 7,60 /1H, м/.
Пример 14
Получение
соединения 48
5-трет-бутилкарбамоилокси-3-(2-хлор)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с использованием
3-(2-хлор)фенил-5-гидрокси-4-тиазолидинона (полученного как описано в препаративном примере 8 выше) /2,74 г/, трет-бутилизоцианата /1,20 г/, триэтиламина /1,6 мл/ и дихлорметана /20 мл/, получалось
целевое соединение в виде смолы.
1H ЯМР /CDCl3/: δ 1,31 /9H, с./, 4,65 /1H, д./, 4,82 /1H, д./, 4,91 /1H, широкий с./, 6,21 /1H, с./, 7,33-7,42 /3H, м./, 7, 51 /1H, м./.
Пример 15
Получение Соединения 52
5-трет-бутилкарбамоилокси-3-(4-метокси)фенил-4-тиазолидинон
С помощью процедуры, аналогичной, процедуре,
описанной в примере 10, но с использованием 5-гидрокси-3-(4-метокси)фенил-4-тиазолидинона (полученного, как описано в препаративном примере 9 выше) /1,60 г/, трет-бутилизоцианата /0,70 г/,
триэтиламина /0.94 мл/ и дихлорметана /25 мл/ и растирания сырого продукта с диэтиловым эфиром получалось целевое соединение в виде белого твердого вещества, выход 1,90 г, т. пл. 127 - 129o
C.
1H ЯМР /CDCl3/: δ 1,32 /9H, с./, 3,80 /3H, с./, 4,62 /1H, д./, 4,89 /1H, широкий с./, 4,92 /1H, д./, 6,20 /1H, с./, 6,95 /2H, м./, 7,33 /2H, м./.
Пример 16
Получение соединения 56
5-трет-бутилкарбамоилокси-3-(2,3-дихлор)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с
использованием 3-(2,3-дихлор)фенил-5-гидрокси-4-тиазолидинона (полученного, как описано в препаративном примере 10 выше) /0,50 г/, трет.-бутилизоцианата /0,19 г/, триэтиламина /0,26 мл/ и
дихлорметана
/15 мл/ и растирания сырого продукта с гексаном получалось целевое соединение в виде белого твердого вещества, выход 0,58 г, т. пл. 145 - 147oC.
1H ЯМР /CDCl3/: δ 1,32 /9H, с./, 4,63 /1H, д./, 4,82 /1H, д./, 4,93 /1H, широкий с./, 6,19 /1H, с./, 7,21-7,36 /2H, м./, 7,53 /1H, м./.
Пример 17
Получение
соединения 59
5-изо-пропилкарбамоилокси-3-(3,5-дихлор)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с использованием 3-(3,
5-дихлор)фенил-5-гидрокси-4-тиазолидинона
(полученного, как описано в препаративном примере 6 выше), изо-пропилизоцианата и триэтиламина получалось целевое соединение, т. пл. 195 - 198o
C.
Пример 18
Получение соединения 61
3-(2-хлор)фенил-5-изо-пропилкарбамоилокси-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с
использованием
3-(2-хлор)фенил-5-гидрокси-4-тиазолидинона (полученного, как описано в препаративном примере 8 выше), изопропилизоцианата и триэтиламина получалось целевое соединение.
1H ЯМР /CDCl3/: δ 1,19 /3H, д./, 1,20 /3H, д./, 3,87 /1H, м./, 4,58 /1H, д. /, 4,83 /1H, широкий/, 4,86 /1H, дд./, 6,12 /1H, д./, 7,33-7,41 /3H, м./, 7,51 /1H, м./.
Пример 19
Получение соединения 62
5-циклогексилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с
использованием 5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона (полученного в препаративном примере 2 выше) /0,53 г/, циклогексилизоцианата /0,25 г/, триэтиламина /0,28 мл/ и дихлорметана /10
мл/ и
перекристаллизации сырого продукта из смеси этилацетата и гексана получалось целевое соединение в виде белого кристаллического твердого вещества, выход 0,52 г, т. пл. 183 - 185oC.
1H ЯМР /CDCl3/: δ 1,05-1,45 /5H, м./, 1,52-1,78 /3H, м./, 1,87-2,00 /2H, м. /, 3,50 /1H, м./, 4,69 /1H, д./, 4,78 /1H, широкий д./, 5,07 /1H, д./, 6,19 /1H, с./, 7,49-7,61 /2H, м./, 7,71-7,80 /2H, м./.
Пример 20
Получение соединения 66
5-(1-метилциклопропил)карбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
Перемешиваемый раствор 1-метилциклопропан-1-карбоновой кислоты /0,057 г/ и дифенилфосфорилазида /0,165 г/ в толуоле /15 мл/ обрабатывался триэтиламином /0,079 мл/. Смесь перемешивалась в течение 1
часа, затем добавлялся 5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинон (полученный, как описано выше в препаративном примере 2) /0,150 г/, и смесь нагревалась в условиях дефлегмации в течение 3
часов. Смесь охлаждалась, экстрагировалась 2 М соляной кислотой, сушилась /сульфатом магния/ и выпаривалась при пониженном давлении, давая смолу. Сырой продукт отделялся с помощью хроматографии на
силикагеле при элюировании смесями этилацетата и гексана. Данный продукт растворялся в этилацетате, промывался насыщенным раствором карбоната натрия, сушился /сульфатом магния/ и выпаривался при
пониженном давлении, давая чистое целевое соединение в виде белого твердого вещества, выход 0,016 г, т. пл. 203 - 206oC.
1H ЯМР /CDCl3/: δ 0, 60-0,67 /2H, м./, 0,77-0,84 /2H, м./, 1,38 /3H, с./, 4,70 /1H, д./, 5,07 /1H, д./, 5,25 /1H, широкий с./, 6,20 /1H, с./, 7,50-7,60 /2H, м./, 7,69-7,80 /2H, м./.
Пример 21
Получение соединения 69
5-(α, α-диметилбензил)карбамоилокси-3-(3-трифторметил)фенил- 4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с
использованием 5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона (полученного, как описано выше в препаративном примере 2) /0,53 г/, α, α-/ диметилбензилизоцианата /0,26 г/,
триэтиламина /0,28 мл/ и дихлорметана /10 мл/ и очистки сырого продукта с помощью хроматографии на силикагеле при элюировании смесью этилацетат/гексан с последующей кристаллизацией из смеси
хлороформа
и гексана, получалось целевое соединение в виде белого твердого кристаллического вещества, выход 0,42 г, т. пл. 100 - 101oC.
1H ЯМР /CDCl3 /: δ 1, 69 /6H, с./, 4,68 /1H, д./, 5,02 /1H, д./, 5,30 /1H, широкий с. /, 6,18 /1H, с./, 7,18-7,42 /5H, м./, 7,48-7,58 /2H, м./, 7,61-7,78 /2H, м./.
Пример 22
Получение соединения
77
5-трет-бутилкарбамоилокси-3-(4-метил)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с использованием
5-гидрокси-3-(4-метил)фенил-4-тиазолидинона
(полученного, как описано выше в препаративном примере 11) /2,00 г/, трет-бутилизоцианата /0,95 г/, триэтиламина /1,3 мл/ и дихлорметана /25 мл/, и
перекристаллизации сырого продукта из смеси
хлороформа и гексана получалось целевое соединение в виде белого кристаллического твердого вещества, выход 1,90 г, т. пл. 142 - 143oC.
1H ЯМР /CDCl3/: δ 1,31 /9H, с./, 2,38 /3H, с./, 4,63 /1H, д./, 4,89 /1H, широкий с. /, 4,94 /1H, д./, 6,20 /1H, с./, 7,18-7,26 /2H, м./, 7,29-7,35 /2H, м./.
Пример 23
Получение
соединения 84
5-трет-бутилкарбамоилокси-3-(4-хлор)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с
использованием
3-(4-хлор)фенил-5-гидрокси-4-тиазолидинона (полученного, как описано выше в препаративном примере 12) /2,00 г/, трет-бутилизоцианата /0,86 г/, триэтиламина /1,16 мл/ и дихлорметана /25
мл/ и
перекристаллизации сырого продукта из смеси хлороформа и гексана, получалось целевое соединение в виде белого кристаллического твердого вещества, выход 2,80 г, т. пл. 152-153oC.
1H ЯМР /CDCl3/: δ 1,31 /9H, с./, 4,62 /1H, д./, 4,88 /1H, широкий с./, 4,98 /1H, д./, 6,19 /1H, с./, 7,35-7,49 /4H, м./.
Пример 24
Получение соединения 91
5-трет-бутилкарбамоилокси-3-(2,5-дихлор)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с использованием 3-(2,
5-дихлорфенил-5-гидрокси-4-тиазолидинона (полученного, как описано в препаративном примере 13 выше) /0,36 г/, трет-бутилизоцианата /0,14 г/, триэтиламина /0,19 мл/ и дихлорметана /15 мл/ и с
растиранием сырого продукта со смесью диэтилового эфира и гексана получалось целевое соединение в виде белого твердого кристаллического вещества, выход 0,25 г, т. пл. 146-147oC.
1H ЯМР /CDCl3/: δ 1,34 /9H, с./, 4,55 /1H, д./, 4,82 /1H, д./, 4,90 /1H, широкий с./, 6,19 /1H, с./, 7,31-7,48 /3H, м./.
Пример 25
Получение соединения 890
4-трет-бутилкарбамоилокси-2-(3-трифторметил)фенил-3-изоксазолидинон
Раствор 4-гидрокси-2-(3-трифторметил)фенил-3-изоксазолидинона /0,05 г, полученного, как
описано в препаративном примере 14, и содержащего толуол-п-сульфонамид/, трет-бутилизоцианата /0,042 г/ и триэтиламина /0,043 г/ в дихлорметане /2 мл/ оставлялся стоять на протяжении ночи при
комнатной температуре. Добавлялись дополнительные количества изоцианата и триэтиламина, и еще через 4 часа смесь выпаривалась при пониженном давлении. Остаток растворялся в этилацетате, промывался
водой и солевым раствором, сушился над сульфатом магния и выпаривался при пониженном давлении. Хроматография на силикагеле с использованием смеси гексана и этилацетата /3:1/ давала продукт /0,02
г/ свободный от толуол-п-сульфонамида, но загрязненный N,N'-ди-трет-бутилмочевиной.
1H ЯМР /CDCl3/: сигналы только целевого соединения: δ 1,35 /9H, с./, 4, 4 /1H, дд/, 4,85 /1H, дд/, 5,0 /1H, шир, с./, 5,6 /1H, т./, 7,5 /2H, м./, 8,0 /2H, м./.
MC: м/e 346 М+
Пример 26
Получение соединения 100
5-трет-бутилкарбамоилокси-3-(2-фтор-5-трифторметил)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с использованием
3-(2-фтор-5-трифторметил)фенил-5-гидрокси-4-тиазолидинона /полученного, как описано в препаративном примере 15 выше/ /1,40 г/, трет-бутилизоцианата /0,5 г/, триэтиламина /0,70 мл/ и дихлорметана /10
мл/ и хроматографии на силикагеле сырого продукта при элюировании смесью этилацетат/гексан получалось целевое соединение в виде прозрачного стекла, выход 1,90 г.
1H ЯМР /CDCl3/: δ 1,32 /9H, с./, 4,60 /1H, д./, 4,91 /2H, д. + широкий с./, 6,19 /1H, с./, 7,34 /1H, м./, 7,60-7,75 /2H, м./.
Пример 27
Получение соединений 107 и
108
5-трет-бутилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон-S, S -диоксид и 5-трет-бутилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон-S-оксид.
Перемешиваемый раствор соединения 26 /3,62 г/ в дихлорметане /70 мл/ обрабатывалась порциями твердой 50 - 60% м-хлорнадбензойной кислотой /3,10 г/ на протяжении 1 часа. Полученная в результате суспензия экстрагировалась насыщенным водным бикарбонатом натрия, и органический слой сушился /сульфатом магния/ и выпаривался при пониженном давлении, давая белую пену. Хроматография на силикагеле при элюировании смесями этилацетата и гексана давала сначала соединение 107, 5-трет-бутилкарбамоилокси-3-/3-трифторметил/фенил-4-тиазолидинон-S,S -диоксид, в виде белого твердого вещества, выход 1,20 г, т.пл. 181 - 184oC.
1H ЯМР /CDCl3/: δ 1,33 /9H. с./, 4,98 /1H, д./, 5,04 /1H, д./, 5,71 /1H, с. /, 5,96 /1H, широкий с./, 7,55-7,66 /3H, м./, 7, 75 /1H, м./, а затем соединение 108, 5-трет-бутилкарбамоилокси-3-(3-трифторметил)-фенил-4-тиазолидинон-S-оксид, выход 2,70 г, который получался в виде 3:1 смеси диастереоизомеров.
1H ЯМР /CDCl3/: главный диастереоизомер δ 1,36 /9H, с./, 4,69 /1H, д./, 4,99 /1H, д. /, 5,59 /1H, широкий с./, 6,18 /1H, с./, 7,49-7,59 /2H, м./, 7.62-7.78 /2H, м. /, второстепенный диастереоизомер δ 1,30 /9H, с./, 4,59 /1H, д. /, 5,31 /1H, д./, 5,35 /1H, широкий с./, 5,44 /1H, с./, 7,55- 7,66 /3H, м./, 7,75 /1H, м./.
Пример 28
Получение соединения 112
5-трет-бутилкарбамоилокси-3-(3-хлор-4-метил)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с использованием
3-(3-хлор-4-метил)фенил-5-гидрокси-4-тиазолидинона (полученного, как описано в препаративном примере 16 выше) /2,44 г/ трет-бутилизоцианата /1,0 г/, триэтиламина /1,4 мл/ и дихлорметана /25 мл/ и при
помощи перекристаллизации сырого продукта из смеси этилацетата и гексана получалось целевое соединение в виде белого твердого вещества, выход 2,80 г, т.пл. 144 - 147oC.
1H ЯМР /CDCl3/: δ 1,32 /9H, с./, 4,62 /1H, д./, 4,90 /1H, широкий с./, 4,95 /1H, д./, 6,19 /1H, с./, 7,22-7,30 /2H, м./, 7,50 /1H, с./.
Пример 29
Получение соединения 119
5-(N-(1,1-диметил)пропил)карбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
Перемешиваемый раствор 5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона
/полученного, как описано выше в препаративном примере 2) /0,56 г/ в дихлорметане /10 мл/ охлаждался на ледяной бане и обрабатывался по каплям тетрахлорэтилхлорформиатом /0,62 г/, а затем пиридином
/0,
20 г/. Смесь перемешивалась в течение дальнейших 2 часов, обрабатывалась 1,1-диметил-1-пропиламином /0,44 г/, затем оставлялась стоять в течение 65 часов. Раствор промывался 2 М соляной кислотой
/2 х
20 мл/, сушился /сульфатом магния/ и выпаривался при пониженном давлении, давая смолу. Хроматография на силикагеле при элюировании смесью этилацетата и гексана давала сырой продукт в виде
твердого
вещества, который растирался дважды с диэтиловым эфиром, давая целевое соединение в виде белого твердого вещества, выход 0,14 г.
1H ЯМР /CDCl3/: δ 0,89 /3H, т./, 1,28 /6H, с./, 1,67 /2H, м./, 4,68 /1H, д. /, 4,82 /1H, широкий с./, 5,04 /1H, д./, 6,19 /1H, с./, 7,49 - 7,58 /2H, м./, 7,68-7,79 /2H, м./.
Пример 30
Получение
соединения 122
5-(N,N-диэтил)карбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 29, но с использованием
5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона /полученного, как описано в препаративном примере 2 выше/ /0,30 г/, тетрахлорэтилхлорформиата /0,31 г/, пиридина /0,13 мл/ и диэтиламина /0,10 г/ и
хроматографии сырого продукта на силикагеле /элюирование смесью этилацетата и гексана/ получалось целевое соединение, выход 0,10 г.
1H ЯМР /CDCl3/ : δ 1, 14 /6H, т./, 3,20-3,45 /4H, м./, 4,68 /1H, д./ 5,12 /1H, дд./, 6,21 /1H, д./, 7,49-7,61 /2H, м./, 7,68 - 7,85 /2H, м./.
Пример 33
Получение соединений 133 и 134
5-изо-пропилкарбамоилокси-3-(3-трифторметил)фенил-тиазолидинон-S,S-диоксид и 5-изо-пропилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон-S-оксид
С помощью процедуры, аналогичной
описанной в примере 27, но с использованием соединения 5 вместо соединения 26, получалось соединение 133 (5-изо-пропилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон-S,S-диоксид):
1H ЯМР /CDCl3/D6-DMCO/: δ 1.06 /6H, д./, 3.56 /1H, м./, 5.29 /1H, д./, 5.43 /1H, д./, 6.36 /1H, с./, 7.30-8.10 /5H, м./
и соединение 134
(5-изо-пропилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон-S-оксид):
1H ЯМР /CDCl3/d6- DMCO/: δ 1,19 /6H, 2 д./, 3,76 /1H, м./, 4,82 /1H, д. /,
5,
27 /1H, д./, 6,51 /1H, с./, 7,53 - 7,69 /2H, м./, 7,75-7,89 /2H, м./, 7,95 /1H, м./.
Пример 34
Получение соединения 138
5-трет-бутилкарбамоилокси-3-(3,
5-бис(трифторметил))фенил-4-тиазолидинон
С помощью процедуры, аналогичной в примере 10, но с использованием 5-гидрокси-3-(3,5-бис(трифторметил))фенил-4-тиазолидинона /полученного, как в
препаративном примере 3 выше/ /1,70 г/, третбутилизоцианата /0,51 г/, триэтиламина /0,7 мл/ и дихлорметана /10 мл/ и перекристаллизации сырого продукта из четыреххлористого углерода получалось
целевое
соединение в виде белого твердого вещества, выход 1,90 г, т. пл. 147 - 148oC.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 4,74 /1H, д./, 4,88 /1H, широкий с./, 5,11 /1H, д./, 6,20 /1H, с./, 7,78 /1H, с./, 8,05 /2H, с./.
Пример 35
Получение соединения 146
5-(N,N-диметил)карбамоилокси-3-(3,5-бис(трифторметил))
фенил-4-тиазолидинон
Перемешиваемый
раствор 5-гидрокси-3-(3,5-бис(трифторметил))фенил-4-тиазолидинона (полученного, как в препаративном примере 3 выше) /1,55 г/ и триэтиламина /0,68 мл/ в
дихлорметане /10 мл/ обрабатывался диметилкарбамоилхлоридом /0,50 г/. Смесь перемешивалась в течение 24 часов, затем выпаривалась при пониженном давлении. Остаток растирался со смесью дихлорметана и
гексана, твердое вещество отфильтровывалось. Выпаривание фильтрата при пониженном давлении давало масло, которое отделялось с помощью хроматографии на силикагеле /элюирование смесью хлороформа и
метанола/, давала целевое соединение в виде смолы, выход 0,41 г.
1H ЯМР /CDCl3/ : δ 2,95 /6H, с./, 4,71 /1H, д./, 5,17 /1H, д./, 6,19 /1H, с./, 7,77 /1H, с./, 8,07 /2H, с./.
Пример 36
Получение соединения 159
5-(N,N-диметил)карбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
Перемешиваемый раствор
5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинон (полученный, как описано в препаративном примере 2 выше) /1,00 г/ в пиридине /2 мл/ обрабатывался диметилкарбамоилхлоридом /0,48 г/. Спустя 20 минут
добавлялась вода, и смесь экстрагировалась диэтиловым эфиром. Эфирный слой отделялся, промывался 2 М соляной кислотой и солевым раствором, затем сушился /сульфатом магния/. Выпаривание растворителя
при пониженном давлении давало смолу, которая отделялась с помощью хроматографии на силикагеле (элюирование смесью хлороформа и метанола), давая сырой продукт в виде желтого твердого вещества.
Растирание со смесью диэтилового эфира и гексана давало целевое соединение в виде бледно-желтого твердого вещества, выход 0,60 г, т. пл. 67-69oC.
1H ЯМР /CDCl3/: δ 2,94 /6H, с./, 4,68 /1H, д./, 5,10 /1H, дд./, 6,21 /1H, д./, 7,50-7,60 /2H, м./, 7,72-7,81 /2H, м./.
Пример 37
Получение соединения 166
5-изо-пропилкарбамоилокси-3-фенил-4-тиазолидинон
Перемешиваемый раствор 5-гидрокси-3-фенил-4-тиазолидинона (полученного, как в препаративном примере 17, выше) /0,24 г/ и триэтиламина /0,01
мл/ в хлороформе /5 мл/ обрабатывался изо-пропилизоцианатом /0,116 г/. Смесь перемешивалась в течение 4 часов, затем выпаривалась при пониженном давлении. Перекристаллизация твердого остатка из смеси
диэтилового эфира и гексана давала целевое соединение в виде бесцветных игл, выход 0,14 г, т. пл. 130-132oC.
1H ЯМР /CDCl3/: δ 1,18 /6H, д./, 3, 82 /1H, м./, 4,66 /1H, д./, 4,75 /1H, широкий д./, 5,02 /1H, дд./, 6,22 /1H, д./, 7,29 /1H, м./, 7,39-7,51 /4H, м. /.
Пример 38
Получение соединения 171
5-(N-(1,
1-диметил)-2-пропинил)карбамоилокси-3-(3-трифторметил) фенил-4-тиазолидинон
Перемешиваемый раствор фосгена в толуоле /1,93 М, 7,25 мл/ охлаждался в ледяной ванне и медленно обрабатывался
растворами 1-амино-1,1-диметил-2-пропина /1,00 г/ в диэтиловом эфире /5 мл/ и гидроокиси натрия /1,15 г/ в воде /4 мл/. Смесь перемешивалась энергично в течение 20 минут, при охлаждении, затем
органический слой отделялся и пропускался через фазо-разделительную бумагу для сушки его. Инфракрасный спектр показал присутствие изоцианата в растворе /2200 см-1/. К данному раствору
добавлялись 5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинон (полученный, как в препаративном примере 2 выше) /0,10 г/ триэтиламина /1,0 мл/, и смесь оставлялась стоять в течение 18 часов, перед тем,
как она выпаривалась досуха при пониженном давлении. Остаток растирался со смесью этилацетата и гексана, и твердое вещество отфильтровывалось. Фильтрат выпаривался при пониженном давлении, и
остаточная смесь разделялась с помощью хроматографии на силикагеле /элюирование смесью этилацетата/гексана/, давая целевое соединение в виде белого твердого вещества, выход 0,10 г, т. пл. 97-99oC.
1H ЯМР /CDCl3/: δ 1,63 /6H, с./, 1,37 /1H, с./, 4,69 /1H, д./, 5,05 /1H, д. /, 5,21 /1H, широкий с./, 6,24 /1H, с./, 7,51-7,60 /2H, м./, 7,70-7, 78 /2H, м./.
Пример 39
Получение соединения 174
5-(N-1-циано-1-метил)этил)карбамоилокси-3-(3-трифторметил) фенил-4-тиазолидинон
С помощью процедуры,
аналогичной описанной в примере 38, но с использованием альфа-аминоизобутиронитрила /1,00 г/ вместо 1-амино-1,1-диметил-2-пропина, получалось целевое соединение в виде белого твердого вещества, выход
0,08 г, т.пл. 119 - 122oC.
1H ЯМР /CDCl3/: δ 1,70 /6H, с./, 4,71 /1H, д./, 5,09 /1H, д./, 5,37 /1H, широкий с./, 6,27 /1H, с./, 7,51-7,62 /2H, м./, 7,68-7,79 /2H, м./.
MC: м/e 373 /М+/
Пример 40
Получение соединения 178
5-(N-(1-циано)циклопентил)карбамоилокси-3-(3-трифторметил)
фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 38, но с использованием 1-амино-1-циано-циклопентана /1,00 г/ вместо 1-амино-1,1-диметил-2-пропина, получалось
целевое соединение, выход 0,18 г.
1H ЯМР /CDCl3/: δ 1,75-1,92 /4H, м./, 2,02-2,18 /2H, м./, 2,27-2,43 /2H, м. /, 4,69 /1H, д./, 5,09 /1H, м./, 5,24 /1H, широкий с./, 6,26 /1H, с./, 7,52-7,61 /2H, м./, 7,68-7,78 /2H, м./.
Пример 41
Получение соединения 197
3-(4-фтор-3-трифторметил)фенил-5-изо-пропилкарбамоилокси-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с использованием
3-(4-фтор-3-трифторметил)фенил-5-гидрокси-4-тиазолидинона /полученного, как в препаративном примере 18 выше/ /2,00 г/, изо-пропилизоцианата /0,64 г/, триэтиламина /1,0 мл/ и дихлорметана /25 мл/ и
при
перекристаллизации сырого продукта из смеси четыреххлористого углерода с хлороформом получалось целевое соединение в виде бесцветных кристаллов, выход 2,15 г, т. пл. 186-188oC.
1H ЯМР /CDCl3/: δ 1,19 /6H, д./, 3,82 /1H, м./, 4,61 /1H, д./, 4,73 /1H, широкий д./, 5,01 /1H, д./, 6,17 /1H, с./, 7,27 /1H, м./, 7,68-7,76 /2H, м. /.
Пример 42
Получение соединения 206
5-трет-бутилкарбамоилокси-3-(4-фтор-3-трифторметил)фенил-4- тиазолидинон
С помощью процедуры, аналогичной описанной в примере
10, но с использованием 3-(4-фтор-3-трифторметил)фенил-5-гидрокси-4-тиазолидинона (полученного, как описано в препаративном примере 18 выше/ /2,00 г/, третбутилизоцианата /0,75 г/, триэтиламина /1,0
мл/ и дихлорметана /25 мл/ и перекристаллизации сырого продукта из смеси четыреххлористого углерода и гексана получалось целевое соединение в виде белых кристаллов, выход 2,20 г, т.пл. 116 - 118oC.
1H ЯМР /CDCl3/: δ 1,34 /9H, с./, 4,65 /1H, д./, 4,88 /1H, широкий с./, 4,99 /1H, д./, 6,18 /1H, с./, 7,28 /1H, м./, 7,65-7,76 /2H, м./.
Пример 43
Получение соединения 211
3-(3-пентафторсульфанил)фенил-5-изопропилкарбамоилокси-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10,
но с использованием 3-(3-пентафторсульфанил)фенил-5-гидрокси-4-тиазолидинона /полученного, как в препаративном примере 19 выше/ /0,42 г/, изо-пропилизоцианата /0,16 г/, триэтиламина /0,1 мл/ и
дихлорметана /10 мл/ и растирания сырого продукта с диэтиловым эфиром получалось целевое соединение в виде белого твердого кристаллического вещества, выход 0,36 г, т. пл. 171-173oC.
1H ЯМР /CDCl3/: δ 1,19 /6H, д./, 3,83 /1H, м/, 4,70 /1H, д./, 4,74 /1H, широкий д./, 5,07 /1H, д./, 6,20 /1H, с./, 7,55 /1H, м./, 7,63-7,73 /2H, м. /, 7,91 /1H, м./.
Пример 44
Получение соединения 216
5-трет-бутилкарбамоилокси-3-(3-пентафторсульфанил)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в
примере 10, но с использованием 3-(3-пентафторсусльфанил)фенил-5-гидрокси-4-тиазолидинона /полученного, как описано в препаративном примере 19/ /0,42 г/, трет-бутилизоцианата /0,16 г/, триэтиламина
/0,
1 мл/ и дихлорметана /10 мл/ и перекристаллизации сырого продукта из смеси этилацетата и гексана получалось целевое соединение в виде белого кристаллического твердого вещества, выход 0,34 г, т.
пл.
131 - 133oC.
1H ЯМР /CDCl3/: δ 1,31 /9H, c./, 4,69 /1H, д/, 4,86 /1H, широкий с./, 5,04 /1H, д./, 6,20 /1H, с./, 7,55 /1H, м./, 7,64-7,72 /2H, м./, 7,92 /1H. м./.
Пример 45
Получение соединения 220
3-(3-трифторметил)фенил-5-(N-(1,1-диметил)-2-бутинил) карбамоилокси-4-тиазолидинон
Перемешиваемая
суспензия 1-амино-1,1-диметил-2-бутин-хлоргидрата /0,84 г/ в растворе фосгена в толуоле /12,5% вес./объем, 10 мл/ обрабатывалась триэтиламином /1,83 мл/, и получающаяся смесь
нагревалась в условиях
дефлегмации в течение 2 часов, затем охлаждалась. Добавлялся раствор 5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона (полученного, как описано выше в препаративном примере
2) /1,65 г/ в толуоле /54
мл/, и смесь перемешивалась при комнатной температуре в течение 3 дней. Раствор экстрагировался водой, затем сушился /сульфатом магния/ и выпаривался при пониженном
давлении. Хроматография на
силикагеле при элюировании смесью диэтилового эфира и гексана с последующей кристаллизацией из гексана давала целевое соединение в виде белого твердого кристаллического
вещества, выход 0,07 г.
1H ЯМР /CDCl3/: δ 1,58 /6H, c./, 1,80 /3H, с./, 4,69 /1H, д./, 5,06 /1H, д. /, 5,13 /1H, широкий с./, 6,23 /1H, с./, 7,50-7,60 /2H, м./, 7,71-7,79 /2Н, м./.
Пример 46
Получение соединения 221
5-трет-бутилкарбамоилокси-3-(2-фтор-3-трифторметил)фенил-4-тиазолидинон
С помощью процедуры,
аналогичной описанной в примере
10, но с использованием 3-(2-фтор-3-трифторметил)фенил-5-гидрокси-4-тиазолидинона (полученного, как описано в препаративном примере 20 выше) /4,00 г/,
трет-бутилизоцианата /1,41 г/, триэтиламина /1,43
г/ и дихлорметана /60 мл/ и растирания сырого продукта со смесью диэтилового эфира и гексана получалось целевое соединение в виде белых кристаллов,
выход 4,70 г, т. пл. 136-137oC.
1H ЯМР /CDCl3/: δ 1,32 /9H, c./, 4,59 /1H, д./, 4,92 /2H, д. + широкий с./, 6,18 /1H, с./, 7,33 /1H, м./, 7,58-7, 69 /2H, м./.
Пример 47
Получение соединения 227
5-трет-бутилкарбамоилокси-2-фенил-3-(3-трифторметил)фенил-4-тиазолидинон
С помощью процедуры, аналогичной
описанной в примере 10, но с использованием
5-гидрокси-2-фенил-3-(3-трифторметил)фенил-4-тиазолидинона /полученного, как описано выше в препаративном примере 21/ /36 мл/, трет-бутилизоцианата /11
мг/, триэтиламина /0,01 мл/ и дихлорметана /5
мл/ и очистки сырого продукта с помощью хроматографии на силикагеле при элюировании смесью этилацетата и гексана получалось целевое соединение в виде
смеси диастереоизомеров.
1H ЯМР /CDCl3/: основной диастереоизомер δ 1,33 /9H, с./, 4,95 /1H, широкий с./, 6,00 /1H, с./, 6,49 /1H, с./, 7,22-7,35 /5H, м./, 7,35-7,50 /4H, м. /; второстепенный диастереоизомер δ 1,30 /9H, с./, 4,89 /1H, широкий с./, 6,27 /1H, с./, 6,38 /1H, с./, 7,22-7,35 /5H, м./, 7,35-7,50 /4H, м./.
Пример
48
Получение соединения 231
5-трет-бутилкарбамоилокси-3-(4-хлор-3-трифторметил)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с
использованием
3-(4-хлор-3-трифтометил)фенил-5-гидрокси-3-тиазолидинона (полученного, как описано в препаративном примере 22 выше) /2,00 г/, трет-бутилизоцианата /0,66 г/, триэтиламина /0,93 мл/ и
дихлорметана /20
мл/ и перекристаллизации сырого продукта из смеси этилацетата и гексана получалось целевое соединение в виде белых кристаллов, выход 1,90 г, т. пл. 141-143oC.
1H ЯМР /CDCl3/: δ 1,31 /9H, с./, 4,65 /1H, д./, 4,89 /1H, широкий с./, 5,02 /1H, д./, 6,19 /1H, с./, 7,56 /1H, д./, 7,69 /1H, дд./, 7,84 /1H, д./.
Пример 49
Получение соединения 233
5-метил-5-изо-пропилкарбамоилокси-3-(3-трифторметил)фенил-4- тиазолидинон
С помощью процедуры, аналогичной описанной в примере
10, но с использованием
5-гидрокси-5-метил-3-(3-трифторметил)фенил-4-тиазолидинона /полученного, как описано выше в препаративном примере 23/ /1,70 г/, изо-пропилизоцианата /0,52 г/, триэтиламина /0,
83 мл/ и дихлорметана /10
мл/ и очистки сырого продукта с помощью хроматографии на силикагеле получалось целевое соединение в виде белого твердого вещества, выход 0,28 г, т. пл. 77-83o
C.
1 H ЯМР /CDCl3/: δ 1,16 /6H, д./, 1,91 /3H, с./, 3,78 /1H, м./, 4,58 /1H, д./, 4,72 /1H, широкий д./, 5,07 /1H, д./, 7,49-7,58 /2H, м/, 7,68-7,80 /2H, м./.
Пример
50
Получение соединения 241
5-трет-бутилкарбамоилокси-3-(2-метокси)фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10,
но с использованием
5-гидрокси-3-(2-метокси)фенил-тиазолидинона /полученного, как описано выше в препаративном примере 24/ /0,29 г/, трет-бутилизоцианата /0,13 г/, триэтиламина /0,18 мл/ и
дихлорметана /10 мл/ и очистки
сырого продукта с помощью хроматографии на силикагеле при элюировании смесью этилацетат/гексан получалось целевое соединение в виде бесцветной смолы, которая содержала
этилацетат, выход 0,40 г.
1H ЯМР /CDCl3/: δ 1,34 /9H, с./, 3,85 /3H, с./, 4,57 /1H, дд./, 4,81 /1H, д. /, 4,92 /1H, широкий с./, 6,21 /1H, д./, 6,94-7,05 /2H, м./, 7,26 /1H, м/, 7,37 /1H, м./.
Пример 51
Получение соединений 248 и 249
Диастереоизомеры 5-((S)-α
-метилбензил)карбамоилокси-3-(3-трифторметил)-фенил-4-тиазолидинон
С помощью
процедуры, аналогичной описанной в примере 10, но с использованием
5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона /полученного, как описано в препаративном примере 2, выше/ /0,975 г/,
/S/-альфа-метилбензилизоцианата /0,545 г/, триэтиламина /0,20 мл/ и
дихлорметана /5 мл/ получались целевые соединения в виде 3:2 смеси диастереоизомеров. Фракционная кристаллизация сырой смеси
продуктов из этанола /х 2/ давала один диастереоизомер /Соединение
248/ чистый, выход 0,140 г, т. пл. 178 - 179oC.
1H ЯМР /CDCl3/: δ 1,53 /3H, д./, 4,68 /1H, д./, 4,88 /1H, м./, 5,05 /1H, д./, 5,19 /1H, широкий д./, 6,25 /1H, с./, 7,21 - 7,40 /5H, м./, 7,51 - 7,60 /2H, м./, 7,68 - 7,78 /2H, м./.
Перекристаллизация вещества, оставшегося в маточных жидкостях, в результате указанных выше процедур кристаллизации из смеси этилацетата и гексана давала 1:1 смесь диастереоизомеров /Соединения 248 и 249/, выход 0,150 г, т. пл. 148 - 151oC.
1H ЯМР /CDCl3/: /Соединение 249 только/ δ 1,55 /3H, д./, 4,68 /1H, д./, 4,88 /1H, м./, 5,08 /1H, д./, 5,20 /1H, широкий/, 6,18 /1H, с./, 7,21 - 7,40 /5H, м./, 7,51 - 7,60 /2H, м./, 7,68 - 7,78 /2H, м./.
Пример 52
Получение соединений 255 и 256
Диастереоизомеры
5-((R)-альфа-метилбензил)карбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
С
помощью процедуры, аналогичной процедуре, описанной в примере 10, но с использованием
5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона /полученного, как описано выше в препаративном примере 2/ /2,
00 г/, /R/-альфа-метилбензилизоцианата /1,10 мл/, триэтиламина /0,10 мл/ и дихлорметана
/25 мл/, получались целевые соединения в виде 3:2 смеси диастереоизомеров. Фракционная кристаллизация смеси
сырого продукта из этанола /х 2/ давала один диастереоизомер чистый /соединение 255/, выход
0,368 г, т. пл. 176 - 179oC.
1H ЯМР /CDCl3/: δ 1,52 /3H, д./, 4,68 /1H, д./, 4,88 /1H, м./, 5,05 /1H, д./, 5,20 /1H, широкий д./, 6,25 /1H, с./, 7,21 - 7,40 /5H, м./, 7,51 - 7,60 /2H, м./, 7,68 - 7,78 /2H, м./.
Перекристаллизация материала, оставшегося в маточных жидкостях от вышеуказанных кристаллизаций из смеси этилацетата и гексана, давала 1:1 смесь диастереоизомеров /соединения 255 и 256/, выход 0,163 г, т. пл. 148 - 151oC.
1H ЯМР /CDCl3/: /только соединение 256/ δ 1,55 /3H, д./, 4,68 /1H, д./, 4,88 /1H, м./, 5,07 /1H, д./, 5,18 /1H, широкий/, 6,18 /1H, с./, 7,21 - 7,40 /5H, м./, 7,51 - 7,60 /2H, м./, 7,68 - 7,78 /2H, м./.
Пример 53
Получение соединения 260
5-(3-морфолино)карбонилокси-3-(3-трифторметил)фенил-4- тиазолидинон
С помощью процедуры, аналогичной описанной в примере 35, но с использованием
5-гидрокси-(3-трифторметил)фенил-4-тиазолидинона /полученного, как описано выше в препаративном примере 2 выше/ /0,100 г/, морфолинокарбамоилхлорида /0,057 г/, триэтиламина /0,055 мл/ и дихлорметана
/10 мл/ и очистки сырого продукта с помощью хроматографии на силикагеле при элюировании смесью этилацетата и гексана получалось целевое соединение, выход 0,092 г.
1H ЯМР /CDCl3/: δ 3,45 - 3,56 /4H, м./, 3,60 - 3,72 /4H, м./, 4,69 /1H, д./, 5,09 /1H, д./, 6,22 /1H, с./, 7,50 - 7,61 /2H, м./, 7,70 - 7,81 /2H, м. /.
Пример 54
Получение соединения 262
5-(N-(2-хлор)этил)карбамоилокси-3-(3-трифторметил)фенил-4- тиазолидинон
С помощью процедуры, аналогичной процедуре, описанной в примере 10, но с
использованием 5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона /полученного, как описано в препаративном примере 2, выше/ /0,25 г/, 2-хлорэтилизоцианата /0,11 г/, триэтиламина /0,13 мл/ и
хлороформа /10 мл/ в качестве растворителя получалось целевое соединение в виде бледно-желтого твердого вещества, выход 0,30 г.
1H ЯМР /CDCl3/: δ 3,47 - 3, 69 /4H, м./, 4,69 /1H, д./, 5,08 /1H, д./, 5,32 /1H, широкий т./, 6,23 /1H, с./, 7,50 - 7,60 /2H, м./, 7,69 - 7,80 /2H, м./.
Пример 55
Получение соединения 270
5-(4-(2,6-дихлорпиридил)амино)карбонилокси-3-(3-трифторметил) фенил-4-тиазолидинон
С помощью процедуры, аналогичной описанной в примере 10, но с использованием
5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона /полученного, как описано выше в препаративном примере 2/ /0,100 г/, 4-(2,6-дихлор)пиридилизоцианата /0,072 г/, триэтиламина /0,056 мл/ и хлороформа
/10 мл/ в качестве растворителя и очистки сырого продукта с помощью хроматографии на силикагеле при элюировании смесями диэтилового эфира получалось целевое соединение, выход 0,035 г.
1H ЯМР /CDCl3/: δ 4,77 /1H, д./, 5,13 /1H, дд./, 6,30 /1H, д./, 7,17 /1H, широкий с./, 7,33 /2H, с./, 7,56 - 7,67 /2H, м./, 7,72 - 7,80 /2H, м./.
Пример
56
Получение соединения 274
5-(N-(1,1-диметил)-2-пропенил)карбамоилокси-3-(3-трифторметил) фенил-4-тиазолидинон
Перемешиваемый раствор соединения 171 /0,150 г/ в
этилацетате
/10 мл/ обрабатывался отравленным свинцом 5% палладиевым катализатором на карбонате кальция /0,015 г/, и смесь гидрировалась в течение 4 часов.
Добавлялось дополнительное количество /0,015 г/ катализатора, и смесь затем гидрировалась в течение дополнительных 5 часов. Смесь фильтровалась через целит, и фильтрат выпаривался при пониженном давлении, давая целевое соединение в виде смолы, которая кристаллизовалась при стоянии, выход 0,090 г, т. пл. 106 - 108oC.
1H ЯМР /CDCl3/: δ 1,42 /6H, с./, 4,69 /2H, д./, 4,92 - 5,21 /4H, м./, 5,95 /1H, дд./, 6,21 /1H, с./, 7,51 - 7,60 /2H, м./, 7,69 - 7,80 /2H, м./.
MC: м/e 374 /M+/
Пример 57
Получение соединения
278
5-(N-(дифенилметил)карбамоилокси-3-(3-трифторметил)фенил-4- тиазолидинон
С помощью процедуры, аналогичной описанной в примере 38, но с использованием
5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона /полученного, как в препаративном примере 2 выше/ /0,109 г/, триэтиламина /0,20 мл/ и изоцианата, полученного на месте из дифенилметиламина /1,00
г/,
фосгена в толуоле /1,93 М, 3,21 мл/, диэтилового эфира /5 мл/ и водной гидроокиси натрия /0,480 г в 10 мл/ и очистки сырого продукта с помощью хроматографии на силикагеле, при элюировании смесями
этилацетата и гексана получалось целевое соединение в виде белого твердого вещества, выход 0,058 г, т. пл. 170 - 172oC.
1H ЯМР /CDCl3/: δ 4,69 /1H, д./, 5,07 /1H, д./, 5,55 /1H, широкий д./, 5,96 /1H, д./, 6,24 /1H, д./, 7,15 - 7,39 /10H, м./, 7,51 - 7,59 /2H, м./, 7,67 - 7,77 /2H, м./.
Пример 58
Получение
соединения 281
5-трет-бутилкарбамоилокси-3-(3-нитро)фенил-4-тиазолидинон
5-Гидрокси-3-(3-нитро)фенил-4-тиазолидинон /полученный, как описано в препаративном примере 25, выше/ /1,
7088
г/ суспендировался в сухом дихлорметане /30 мл/ и перемешивался при комнатной температуре. Добавлялся триэтиламин /1 мл/, а затем, по каплям, трет-бутилизоцианат /0,812 мл/. Суспензия постепенно
переходила в раствор, и перемешивание продолжалось в течение 4 часов. Реакционная смесь разбавлялась дихлорметаном и промывалась последовательно 2 М соляной кислотой, насыщенным раствором бикарбоната
натрия и солевым раствором. Органический слой сушился /сульфатом магния/ и выпаривался при пониженном давлении, давая желтое твердое вещество /2,268 г/. Данный материал очищался с помощью
хроматографии на силикагеле с использованием смеси этилацетат-гексан /3:7/ в качестве элюента. Целевое соединение получалось в виде желтого твердого вещества, выход 2,176 г, т. пл. 157 - 158oC.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 4,72 /2H, д./, 4,89 /1H, широкий с./, 5,10 /1H, д./, 6,21 /1H, с./, 7,62 /1H, т./, 8,00 /1H, дд./, 8,15 /1H, дд./, 8,35 /1H, т./.
Пример 59
Получение соединения 282
5-трет-бутилкарбамоилокси-3-(3-циано)фенил-4-тиазолидинон
5-Гидрокси-3-(3-циано)фенил-4-тиазолидинон
/полученный, как описано в препаративном примере 26, выше/ /1,62 г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в примере 58,
с использованием дихлорметана /15 мл/,
триэтиламина /1,02 мл/ и трет-бутилизоцианата /0,84 мл/. Сырой продукт очищался с помощью хроматографии на силикагеле с использованием смеси этилацетат-гексан
/3:7/ в качестве элюента. Целевое
соединение получалось в виде твердого вещества, выход 2,20 г, т. пл. 149 - 151oC.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 4,68 /1H, д./, 4,89 /1H, широкий с./, 5,06 /1H, д./, 6,20 /1H, с./, 7,58 /2H, м./, 7,80 /1H, м./, 7,88 /1H, с/.
Пример 60
Получение соединения 285
5-трет-бутилкарбамоилокси-3-(3-фтор)фенил-4-тиазолидинон
5-Гидрокси-3-(3-фтор)фенил-4-тиазолидинон /полученный, как описано в препаративном примере 27, выше/ /0,42 г/ превращался в целевое
соединение с помощью процедуры, аналогичной описанной в примере 58, с использованием дихлорметана /4 мл/, триэтиламина /0,274 мл/ и трет-бутилизоцианата /0,225 мл/. Сырой продукт очищался с помощью
хроматографии на силикагеле с использованием этилацетата и гексана /1:4/ в качестве элюента. Целевое соединение получалось в виде белого твердого вещества, выход 0,56 г, т. пл. 112 - 114o
C.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 4,66 /1H, д./, 4,87 /1H, широкий с./, 5,02 /1H, дд./, 6,20 /1H, широкий с./, 6,99 /1H, тд./, 7,22 - 7,45 /3H, м./.
Пример 61
Получение соединения 301
5-трет-бутилкарбамоилокси-3-(3-(1,1,2,2-тетрафторэтокси)) фенил-4-тиазолидинон
5-Гидрокси-3-(3-(1,1,2,
2-тетрафторэтокси))фенил-4-тиазолидинон /полученный, как описано в препаративном примере 28, выше/ /1,9 г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в примере 58, с
использованием дихлорметана /20 мл/, триэтиламина /0,85 мл/ и трет-бутилизоцианата /0,70 мл/. Сырой продукт очищался с помощью хроматографии на силикагеле с использованием смеси этилацетата и гексана
/1:4/ в качестве элюента. Целевое соединение /2,063 г/ получалось в виде белого твердого вещества, которое дополнительно очищалось с помощью перекристаллизации из смеси этилацетата и гексана, давая
белые кристаллы, выход 1,338 г, т. пл. 74 - 75oC.
1H ЯМР /CDCl3/: δ 1,34 /9H, с./, 4,68 /1H, д./, 4,86 /1H, широкий с./, 5,03 /1H, д./, 5,92 /1H, тт./, 6,21 /1H, с./, 7,15 /1H, м./, 7,46 /3H, м./.
Пример 62
Получение соединения 307
5-трет-бутилкарбамоилокси-3-(3-амино)фенил-4-тиазолидинон
5-Трет-Бутилкарбамоилокси-3-(3-нитро)фенил-4-тиазолидинон /полученный, как описано, в примере 58, выше/ /1,424 г/ растворялся в этилацетате /25 мл/ и вводился 5% палладий на угле /0,25 г/.
Реакционная
смесь перемешивалась энергично в атмосфере водорода на протяжении ночи, и катализатор затем удалялся с помощью фильтрования через целит. После удаления растворителя при пониженном
давлении остаток
повторно растворялся в этилацетате /25 мл/ и вводился свежий 5% палладий на угле /0,25 г/. Гидрирование продолжалось в течение 72 часов, и катализатор снова удалялся фильтрованием
через целит.
Растворитель удалялся при пониженном давлении, давая твердое вещество /1,166 г/. Данное вещество перекристаллизовывалось из смеси этилацетата и гексана, давая целевое соединение в виде
твердого
вещества, выход 0,488 г, т. пл. 134 - 136oC.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 3,80 /2H, широкий с./, 4,63 /1H, д./, 4,85 - 5,0 /2H, м./, 6,20 /1H, с./, 6,60 /1H, дд./, 6,75 /1H, дд./, 6,9 /1H, т./, 7,18 /1H, т./.
Пример 63
Получение соединения 316
5-трет-бутилкарбамоилокси-3-(3-метил)фенил-4-тиазолидинон
5-Гидрокси-3-(3-метил)фенил-4-тиазолидинон /полученный, как описано в препаративном примере 29, выше/ /0,300 г/ растворялся в сухом
дихлорметане /5 мл/ и перемешивался при комнатной температуре в атмосфере азота. Добавлялся триэтиламин /0,220 мл/, и затем, по каплям, трет-бутилизоцианат /0,180 мл/. Смесь перемешивалась при
комнатной температуре в течение приблизительно 72 часов, а затем разбавлялась дихлорметаном. Данное вещество промывалось последовательно 2M соляной кислотой, насыщенным раствором бикарбоната натрия и
солевым раствором. Органический слой сушился /сульфатом натрия/ и выпаривался при пониженном давлении, давая сырой продукт /0,401 г/. Данное вещество очищалось с помощью хроматографии на силикагеле с
использованием смеси этилацетат-гексан /3:7/ в качестве элюента, давая белое полутвердое вещество /0,357 г/, которое перекристаллизовывалось из смеси этилацетата и гексана. Получалось целевое
соединение в виде белого твердого вещества, выход 0,300 г, т. пл. 141 - 142oC.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 2,38 /3H, с./, 4,66 /1H, д./, 4, 89 /1H, широкий с. /, 4,97 /1H, д./, 6,21 /1H, с./, 7,11 /1H, д./, 7,20 - 7,36 /3H, м/.
Пример 64
Получение соединения 318
5-трет-бутилкарбамоилокси-3-(3-N,
N-(бисметансульфонил)амино) фенил-4-тиазолидинон
5-трет-бутилкарбамоилокси-3-(3-амино)фенил-4-тиазолидинон /полученный, как описано выше в примере 62/ /0,3447 г/ растворялся в дихлорметане
/5
мл/ и перемешивался при комнатной температуре в атмосфере азота. Добавлялись триэтиламин /0,194 мл/ и метансульфонилхлорид /0,095 мл/, и реакционная смесь перемешивалась при комнатной температуре
в
течение 72 часов. Добавлялись дополнительные порции триэтиламина /0,194 мл/ и метансульфонилхлорида /0,095 мл/, и, спустя 1 час, реакционная смесь разбавлялась дихлорметаном и промывалась
последовательно 2 M соляной кислотой, насыщенным раствором бикарбоната натрия и солевым раствором. Органический слой сушился /сульфатом натрия/ и выпаривался, давая желтое твердое вещество /0,464 г/.
Данное вещество хроматографировалось на силикагеле с использованием смеси этилацетат-гексан /2: 3/ в качестве элюента, давая целевое соединение, выход 0,236 г, которое имело:
1H
ЯМР
/CDCl3/: δ 1,33 /9H, c./, 3,44 /6H, c./, 4,72 /1H, д./, 4,86 /1H, широкий с. /, 5,06 /1H, д./, 6,22 /1H, с./, 7,28 /1H, м./, 7,53 /2H, м./, 7,77 /1H, с./.
MC:
м/e
465 /M+/
Пример 65
Получение соединения 321
5-трет-бутилкарбамоилокси-3-(3-метокси)фенил-4-тиазолидинон
5-гидрокси-3-(3-метокси)фенил-4-тиазолидинон
/полученный, как описано в препаративном примере 30/ /0,350 г/ превращался в целевое соединение с помощью процедуры, аналогичной процедуре, описанной в примере 58 с использованием дихлорметана /5
мл/,
триэтиламина /0,26 мл/ и трет-бутилизоцианата /0,195 мл/. Сырой продукт /0,45 г/ очищался с помощью хроматографии на силикагеле с использованием смеси этилацетат-гексан /3:7/, давая пену /0,389
г/,
которая в свою очередь очищалась на силикагеле с использованием смеси метанол-дихлорметан /0,5:99,5/. Целевое соединение получалось в виде гигроскопичного белого твердого вещества, выход 0,227
г.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 3,82 /3H, с./, 4,67 /1H, д./, 4,85 - 4,95 /1H, широкий с. /, 4,99 /1H, д./, 6,21 /1H, с./, 6,84 /1H, дд/, 7,00 /1H, дд./, 7, 12 /1H, т./, 7,34 /1H, т./.
MC: м/e 324 /M+/
Пример 66
Получение соединения 326
5-трет-бутилкарбамоилокси-3-(3-метоксикарбонил)фенил-4- тиазолидинон
5-Гидрокси-3-(3-метоксикарбонил)фенил-4-тиазолидинон (полученный, как описано в препаративном примере 31 выше) /2,258
г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в примере 58 с использованием дихлорметана /35 мл/, триэтиламина /1,37 мл/ и трет-бутилизоцианата /1,12 мл/. Сырой
продукт очищался с помощью хроматографии на силикагеле с использованием смеси этилацетата и гексана /1:3/. Целевое соединение получалось в виде белого твердого вещества, выход 2,881 г, т. пл. 123
- 125oC.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 3,93 /3H, с./, 4,70 /1H, д./, 4,90 /1H, широкий с./, 5,07 /1H, д/, 6,22 /1H, с/, 7,52 /1H, т./, 7,83 /1H, дд./, 7,97 /1H, дд/, 8,0 /1H, м./.
Пример 67
Получение соединения 328
5-трет-бутилкарбамоилокси-3-(3-бром)фенил-4-тиазолидинон
5-Гидрокси-3-(3-бром)фенил-4-тиазолидинон (полученный, как описано выше в препаративном примере 32) /0,964 г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в примере 58,
с использованием дихлорметана /10 мл/, триэтиламина /0,48 мл/ и трет-бутилизоцианата /0,39 мл/. Сырой продукт очищался с помощью хроматографии на силикагеле с использованием смеси этилацетат-гексан
/2:4/ в качестве элюента, давая твердый остаток /1,07 г/. Данное вещество в свою очередь дополнительно очищалось с помощью перекристаллизации из смеси этилацетата и гексана, давая целевое соединение
в
виде белого порошкообразного твердого вещества, выход 0,83 г, т. пл. 153 - 155oC.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 4,64 /1H, д./, 4,85 /1H, широкий с./, 5,00 /1H, д./, 6,19 /1H, с./, 7,30 /1H, т./, 7,45 /2H, м./, 7,69 /1H, т./.
Пример 68
Получение соединения 331
5-трет-бутилкарбамоилокси-3-(3-иод)фенил-4-тиазолидинона
5-Гидрокси-3-(3-иод)фенил-4-тиазолидинон (полученный, как описано выше в препаративном примере 33) /1,68 г/ превращался в целевое
соединение с помощью процедуры, аналогичной описанной в примере 58, с использованием дихлорметана /15 мл/, триэтиламина /0,73 мл/ и трет-бутилизоцианата /0,59 мл/. Сырой продукт очищался с помощью
хроматографии на силикагеле с использованием смеси этилацетат-гексан /1:4/, давая целевое соединение в виде твердого вещества, выход 1,2 г, т. пл. 161 - 162,5oC.
1 H ЯМР /CDCl3/: δ 1,33 /9H, с./, 4,62 /1H, д./, 4,85 /1H, широкий с./, 4,98 /1H, д./, 6,19 /1H, с./, 7,16 /1H, дд./, 7,49 /1H, дд./, 7,63 /1H, д./, 7,84 /1H, м./.
Пример 69
Получение соединения 336
5-трет-бутилкарбамоилокси-3-(3-фенокси)фенил-4-тиазолидинон
5-Гидрокси-3-(3-фенокси)фенил-4-тиазолидинон /полученный, как
описано выше в
препаративном примере 34/ /0,255 г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в примере 58, с использованием дихлорметана /5 мл/, триэтиламина /0,136
мл/ и
трет-бутилизоцианата /0,111 мл/. Сырой продукт очищался с помощью хроматографии на силикагеле с использованием смеси этилацетат/гексан /1:4/ в качестве элюента, давая липкое оранжевое твердое
вещество. Данное вещество перекристаллизовывалось из смеси этилацетат-гексан, давая целевое соединение в виде белого твердого вещества, выход 0,195 г, т. пл. 131 - 132oC.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 4,63 /1H, д./, 4,80 - 4,95 /1H, широкий с./, 4,98 /1H, д./, 6,20 /1H, с./, 6,92 /1H, дд./, 7,00-7,42 /8H, м./.
Пример
70
Получение соединения 337
5-трет-бутилкарбамоилокси-3-фенил-4-тиазолидинон
5-гидрокси-3-фенил-4-тиазолидинон (полученный, как описано выше в препаративном примере 17) /0,
095 г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в примере 58, с использованием дихлорметана /2 мл/, триэтиламина /0,068 мл/ и трет-бутилизоцианата /0,056 мл/. Сырой
продукт очищался с помощью хроматографии на силикагеле с использованием смеси этилацетат-гексан /1:4/ в качестве элюента. Целевое соединение дополнительно очищалось с помощью перекристаллизации из
смеси этилацетата и гексана /2 х/ /0,065 г/, т. пл. 146 - 148oC /но еще загрязненный 9% ди-трет-бутилмочевины/.
1H ЯМР /CDCl3/: между прочим δ 1, 33 /9H, с./, 4,67 /1H, д./, 4,88 /1H, широкий с./, 5,01 /1H, д./, 6,22 /1H, с./, 7,28 /1H, м./, 7,45 /4H, м./.
MC: м/e 294 /M+/
Пример 71
Получение
соединения 339
5-трет-бутилкарбамоилокси-3-(3-(N-ацетил)амино)фенил-4-тиазолидинон
5-трет-бутилкарбамоилокси-3-(3-амино)фенил-4-тиазолидинон /полученный, как описано выше в примере
62/ /0,350 г/ растворялся в сухом дихлорметане /5 мл/ и обрабатывался сухим триэтиламином /0,198 мл/ в атмосфере азота. Осторожно добавлялся ацетилхлорид /0,089 мл/, и реакционная смесь
перемешивалась
при комнатной температуре в течение 72 часов. Реакционная смесь разбавлялась дихлорметаном и промывалась последовательно 2 М соляной кислотой, насыщенным бикарбонатом натрия и солевым
раствором.
Органический слой сушился сульфатом натрия и выпаривался при пониженном давлении, давая не совсем белое твердое вещество /0,349 г/. Сырой продукт очищался с помощью хроматографии на
силикагеле с
использованием смеси этилацетат-гексан /7:3/ в качестве элюента, давая твердое вещество /0,261 г/. Данное вещество перекристаллизовывалось из смеси этилацетат-гексан, давая целевое
соединение в виде
белого твердого вещества, выход 0,176 г, т. пл. 160 - 162oC.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 2,08 /3H, с./, 4,62 /1H, д./, 4, 78 /1H, широкий с./, 4,97 /1H, д./, 5,05 /1H, широкий с./, 6,22 /1H, с./, 7,11 /1H, м./, 7,30 /2H, м./, 7,75 /1H, широкий с./, 7,98 /1H, широкий с./.
Пример 72
Получение
соединения 340
5-трет-бутилкарбамоилокси-3-(3-метансульфонил)фенил-4-тиазолидинон
5-гидрокси-3-(3-метансульфонил)-4-тиазолидинон (полученный, как описано выше в препаративном примере
35) /0,67
г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в примере 58, с использованием дихлорметана /17 мл/, триэтиламина /0,38 мл/ и трет-бутилизоцианата /0,31 мл/.
Сырой
продукт /0,917 г/ очищался на силикагеле с использованием смеси этилацетат-гексан /1:1/ в качестве элюента. Целевое соединение получалось в виде белого твердого вещества, выход 0,845 г, и
имело:
1H ЯМР /CDCl3/: δ/ 1,33 /9H, с./, 3,08 /3H, с./, 4,72 /1H, д./, 4,87 /1H, широкий с./, 5,09 /1H, д./, 6,21 /1H, с./, 7,66 /1H, т./, 7,88 /2H, м. /, 8,04
/1H, м./.
MC: м/e 372 /M+/
Пример 73
Получение соединения 341
5-трет-бутилкарбамоилокси-3-(3,4,5-трихлор)фенил-4-тиазолидинон
5-Гидрокси-3-(3,4,
5-трихлор)фенил-4-тиазолидинон (полученный, как описано выше в препаративном примере 36) /1,2 г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в
примере 58, с
использованием дихлорметана /20 мл/, триэтиламина /0,6 мл/ и трет-бутилизоцианата /0,48 мл/. Сырой продукт /1,57 г/ очищался с помощью хроматографии на силикагеле с использованием смеси
этилацетат-гексан /15:85 до 20:80/ в качестве элюента, давая оранжевое твердое вещество /1,35 г/. Данное вещество, в свою очередь, дополнительно очищалось с помощью перекристаллизации из смеси
этилацетат-гексан, давая целевое соединение в виде светло-розового твердого вещества, т. пл. 163 - 165oC.
1H ЯМР /CDCl3/: δ 1,34 /9H, с./, 4,62 /1H, д./, 4,85 /1H, широкий с./, 4,99 /1H, д./, 6,16 /1H, с./, 7,64 /2H, с./.
Пример 74
Получение соединения 342
5-трет-бутилкарбамоилокси-3-(3-метилтио)фенил-4-тиазолидинон
5-Гидрокси-3-(3-метилтио)фенил-4-тиазолидинон (полученный, как описано выше в препаративном примере 37) /0,578 г/ превращался в
целевое соединение с помощью процедуры, аналогичной описанной в примере 58, с использованием дихлорметана /20 мл/, триэтиламина /0,37 мл/ и трет-бутилизоцианата /0,30 мл/. Сырой продукт /0,765
г/ хроматографировался на силикагеле с использованием смеси этилацетат-гексан /1:3/ в качестве элюента, но данное вещество все еще содержало некоторые примеси, и образец вещества повторно
хроматографировался с использованием смеси этилацетата и гексана /18:88/. Данная процедура давала желто-белое твердое вещество /0,42 г/, которое перекристаллизовывалось из смеси этилацетата и
гексана.
Целевое соединение получалось в виде белых игл, выход 0,32 г, т. пл. 144,2-146,2oC.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 2,50 /3H, с./, 4, 65 /1H, д./, 4,88 /1H, широкий с./, 5,00 /1H, д./, 6,21 /1H, с./, 7,15 - 7,42 /4H, м./.
Пример 75
Получение соединения 344
5-трет-бутилкарбамоилокси-3-(3-трифторметокси)фенил-4-тиазолидинон
5-гидрокси-3-(3-трифторметокси)фенил-4-тиазолидинон (полученный, как описано выше в препаративном примере 38) /2,698
г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в примере 58, с использованием дихлорметана /70 мл/, триэтиламина /1,48 мл/ и трет-бутилизоцианата /1,21 мл/. Сырой
продукт /3,483 г/ очищался на силикагеле с использованием смеси этилацетата и гексана /20:80/ в качестве элюента. Полученное бледно-желтое твердое вещество дополнительно очищалось с помощью
перекристаллизации из смеси этилацетата и гексана, давая целевое соединение в виде белого твердого вещества, выход 2,62 г, т. пл. 103 - 105oC.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 4,68 /1H, д./, 4,87 /1H, широкий с./, 5,03 /1H, д./, 6,21 /1H, с./, 7,15 /1H, м./, 7,47 /3H, м./.
Пример 76
Получение соединения 346
5-трет-бутилкарбамоилокси-3-(3-метокси-5-трифторметил)фенил-4- тиазолидинон
5-Гидрокси-3-(3-метокси-5-трифторметил)фенил-4-тиазолидинон (полученный, как описано в препаративном примере
39
выше) /2,49 г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в примере 58, с использованием дихлорметана /25 мл/, триэтиламина /1,25 мл/ и трет-бутилизоцианата /1,02
мл/.
Сырой продукт /3,521 г/ очищался с помощью хроматографии на силикагеле с использованием смеси этилацетата и гексана /1:4 до 3:7/ в качестве элюента, давая белое твердое вещество /3,0 г/. Данное
вещество, в свою очередь, очищалось с помощью перекристаллизации из смеси этилацетат-гексан, давая целевое соединение в виде белого твердого вещества, выход 2,673 г, т. пл. 111 - 112oC.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 3,87 /3H, с./, 4,69 /1H, д./, 4,89 /1H, широкий с. /, 5,04 /1H, д./, 6,21 /1H, с./, 7,05 /1H, с./, 7,29 /1H, с./, 7,38 /1H, с./.
Пример 77
Получение соединения 348
5-трет-бутилкарбамоилокси-3-(3-нитро-5-трифторметил)фенил-4- тиазолидинон
5-Гидрокси-3-(3-нитро-5-трифторметил)фенил-4-тиазолидинон /полученный, как в препаративном примере 40 выше/ /1,11 г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в
примере 58, с использованием дихлорметана /30 мл/, триэтиламина /0,53 мл/ и трет-бутилизоцианата /0,43 мл/. Сырой продукт /1,43 г/ очищался с помощью хроматографии на силикагеле с использованием
этилацетата-гексана /1:3/ в качестве элюента, давая желто-оранжевое твердое вещество /1,17 г/. Данное вещество в свою очередь дополнительно очищалось с помощью перекристаллизации из смеси этилацетата
и гексана, давая целевое соединение в виде бледно-желтого твердого вещества, выход 0,437 г.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 4,76 /1H, д./, 4,87 /1H, широкий с./, 5,16 /1H, д./, 6,20 /1H, с./, 8,31 /1H, с./, 8,38 /1H, с./, 8,61 /1H, м./.
MC: м/e 408 /M++H/
Пример 78
Получение соединения 350
5-трет-бутил-3-(3-трифторметансульфонил)фенил-4-тиазолидинон
5-Гидрокси-3-(3-трифторметансульфонил)фенил-4-тиазолидинон (полученный, как в препаративном примере 41 выше) /0,46 г/ превращался
в целевое соединение с помощью процедуры, аналогичной описанной в примере 58, с использованием дихлорметана /10 мл/, триэтиламина /0,21 мл/ и трет-бутилизоцианата /0,17 мл/. Сырой продукт /0,65
г/ очищался с помощью хроматографии на силикагеле с использованием смеси этилацетата и гексана /35:65/ в качестве элюента. Целевое соединение получалось в виде белого твердого вещества, выход 0,47
г.
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 4,73 /1H, д./, 4,88 /1H, широкий с./, 5,12 /1H, д./, 6,21 /1H, с./, 7,76 /1H, т./, 7,94 /1H, д./, 8,12 /1H, с./, 8,18 /1H, д./.
MC: 427 /M++H/
Пример 79
Получение соединений 359 и 360
(+)-5-трет-бутилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон и
(-)-5-трет-бутилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
Рацемическое соединение 26 (полученное, как описано в примере 7) разделялось на ковалентно связанной D-фенилглициновой
колонке Pirkle, с элюированием смесью гексан/тетрагидрофуран/ацетонитрил /90:10:0,26/. Размеры колонки были 25 мл /длина/ х 0,8 см /диаметр/, и соединение отделялось в количествах приблизительно 0,4
- 0,5 мг за цикл /всего 75 циклов/. По данному методу соединение 359, /+/-5-трет-бутилкарбамоилокси-3-/3-трифторметил/фенил-4-тиазолидинон, получалось в виде белого твердого вещества, выход 14,0 мг,
(α) = +118o /с = 0,14 г /100 мл; толуол/, с последующим получением соединения
360, (-)-5-трет-бутилкарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон, также белое твердое вещество, выход 11.8 мг, (α)
Пример 80
Получение соединения 361
3-трет-бутилкарбамоилокси-3-(3-трифторметил)фенил-2-пирролидинон
Перемешиваемый раствор 3-гидрокси-1-(3-трифторметил)фенил-2- пирролидинона /полученный, как описано в препаративном примере
42,
выше/ /0,220 г/ в дихлорметане /2 мл/ обрабатывался трет-бутилизоцианатом /0,063 г/, а затем триэтиламином /0,084 мл/. Раствор перемешивался в течение 24 часов, затем выпаривался при пониженном
давлении. Очистка остатка с помощью хроматографии на силикагеле при элюировании смесями этилацетата и гексана, давала целевое соединение в виде прозрачной смолы, выход 0,060 г.
1H ЯМР /CDCl3/: δ 1,35 /9H, с./, 2,13 /1H, м./, 2,73 /1H, м./, 3,80 - 3,89 /2H, м./, 4,94 /1H, широкий с./, 5,38 /1H, т./, 7,38 - 7,53 /2H, м./, 7,89 - 7,95 /2H, м./.
Пример 81
Получение соединения 369
3-изо-пропилкарбамоилокси-1-(3-трифторметил)фенил-2-пирролидинон
С помощью процедуры, аналогичной описанной в примере 80, с
использованием 3-гидрокси-1-(3-трифторметил)фенил-2-пирролидинона (полученного, как в препаративном примере 42, выше) /0,085 г/, изо-пропилизоцианата /0,030 г/, триэтиламина /0,01 мл/ и дихлорметана
/1 мл/ и очистки остатка с помощью хроматографии на силикагеле, при элюировании смесями этилацетата и гексана, получалось целевое соединение в виде белого твердого кристаллического вещества, выход 0,
095 г, т. пл. 114 - 117oC.
1H ЯМР /CDCl3/: δ 1,19 /3H, д./, 1,20 /3H, д./, 2,18 /1H, м./, 2,78 /1H, м./, 3,77 - 3,93 /3H, м./, 4,79 /1H, широкий д./, 5,41 /1H, т./, 7,40 - 7,58 /2H, м./, 7,88 - 7,96 /2H, м./.
Пример 82
Получение соединения 383
1-(2-хлор-6-фтор-4-трифторметил)фенил-3-изо-пропилкарбамоилокси-2- пирролидинон
Перемешиваемый раствор 1-(2-хлор-6-фтор-4-трифторметил)фенил-3-гидрокси-2-пирролидинона (полученного, как
описано выше, в препаративном примере 43) /0,500 г/ в хлороформе /5 мл/ обрабатывался триэтиламином /0,25 мл/, а затем изо-пропилизоцианатом /0,150 г/. Прозрачный раствор перемешивался при комнатной
температуре в течение 24 часов, а затем резко охлаждался водой и подкислялся 2 М соляной кислотой. Органическая фаза отделялась, промывалась 2 М соляной кислотой, сушилась /сульфатом магния/ и
выпаривалась при пониженном давлении, давая белое твердое вещество. Данное вещество перекристаллизовывалось из смеси хлороформа и гексана, давая целевое соединение в виде бесцветных игл, выход 0,507
г,
т. пл. 133 - 136oC.
1H ЯМР /CDCl3/: δ 1,18 /6H, д./, 2,26 /1H, м./, 2,79 /1H, м./, 3,68 /1H, м. /, 3,75 - 3,92 /2H, м./, 4,81 /1H, широкий д./, 5,45 /1H, дт./, 7,39 /1H, д./, 7,59 /1H, с./.
Пример 83
Получение соединения 390
1-(2-хлор-6-фтор-4-трифторметил)фенил-3-трет-бутилкарбамоилокси-2- пирролидинон
С помощью процедуры, аналогичной описанной в примере 82, но с использованием
1-(2-хлор-6-фтор-4-трифторметил)фенил-3-гидрокси-2- пирролидинона (полученного, как описано выше в препаративном
примере 43) /0,500 г/, трет-бутилизоцианата /0,174 г/, триэтиламина /0,25 мл/ и
хлороформа /5 мл/ и перекристаллизации сырого продукта из смеси хлороформа и гексана получалось целевое соединение в
виде бесцветных кристаллов, выход 0,355 г, т. пл. 134 - 137oC.
1H ЯМР /CDCl3/: δ 1,31 /9H, с./, 2,28 /1H, м./, 2,79 /1H, м./, 3,59 - 3,82 /2H, м. /, 4,92 /1H, широкий с./, 5,40 /1H, м./, 7,39 /1H, д./, 7,58 /1H, с./.
Пример 84
Получение соединения 404
3-(N,
N-диметиламино)карбамоилокси-1-(3-трифторметил)фенил-2- пирролидинон
Перемешиваемый раствор
3-гидрокси-1-(3-трифторметил)фенил-2- пирролидинона (полученного, как описано выше в препаративном
примере 42) /0,175 г/ в пиридине /1 мл/ обрабатывался диметилкарбамоилхлоридом /0,084 г/. Смесь
перемешивалась при комнатной температуре в течение 24 часов, затем добавлялась 2 М соляная кислота.
Эмульсия экстрагировалась хлороформом, и экстракт промывался солевым раствором, сушился /сульфатом
магния/ и выпаривался при пониженном давлении, давая смолу. Очистка с помощью хроматографии на
силикагеле, при элюировании смесями хлороформа и метанола, давала целевое соединение в виде смолы, выход
0,178 г.
1H ЯМР /CDCl3/: δ 2,18 /1H, м./, 2,72 /1H, м./, 2,95 /3H, с./, 2,97 /3H, с. /, 3,77 - 3,92 /2H, м./, 5,43 /1H, т/, 7,39 - 7,53 /2H, м./, 7,88 - 7, 98 /2H, м/.
Пример 85
Получение соединения 409
1-(2-хлор-6-фтор-4-трифторметил)фенил-3-(N, N-диметиламино) карбамоилокси-2-пирролидинон
Перемешиваемый
раствор 1-(2-хлор-6-фтор-4-трифторметил)фенил-3- гидрокси-2-пирролидинона (полученного,
как в препаративном примере 43, выше), /0,400 г/ в пиридине /2 мл/ обрабатывался гидридом натрия /0,071 г 50%
эмульсии в масле/, а затем диметилкарбамоилхлоридом /0,159 г/. Смесь перемешивалась при
комнатной температуре в течение 5 часов, затем добавлялась 2 М соляная кислота. Эмульсия экстрагировалась
диэтиловым эфиром /х 2/, и объединенные экстракты промывались солевым раствором, сушились
/сульфатом магния/ и выпаривались при пониженном давлении, давая смолу. Очистка с помощью хроматографии на
силикагеле при элюировании смесями хлороформа и метанола давала целевое соединение в виде
белого твердого вещества, выход 0,104 г, т. пл. 121 - 122oC.
1H ЯМР /CDCl3/: δ 2,30 /1H, м./, 2,75 /1H, м./, 2,93 /3H, м./, 2,95 /3H, м./, 3,58 - 3,85 /2H, м./, 5,44 /1H, м./, 7,38 /1H, д./, 7,58 /1H, с./.
Пример 86
Получение соединения 421
1-(3-трифторметил)фенил-3-(N-(1,1-диметил)-2-бутинил)
карбамоилокси-2-пирролидинон
Перемешиваемый раствор
3-гидрокси-1-(3-трифторметил)фенил-2- пирролидинона /полученного, как в препаративном примере 42, выше/ /0,090 г/ и хинолина /0,050 г/ в
толуоле /2 мл/ обрабатывался раствором фосгена в толуоле /0,65
мл 12,5% вес/объем раствора/, и полученная в результате суспензия перемешивалась при комнатной температуре в течение 2 часов. Смесь затем
фильтровалась, и фильтрат обрабатывался триэтиламином /0,06
мл/, а затем 1-амино-1,1-диметил-2-бутин-хлоргидратом /0,41 г/. Данная смесь перемешивалась в течение 24 часов, затем добавлялась 2 М
соляная кислота, и органическая фаза отделялась. Водный слой
дополнительно экстрагировался диэтиловым эфиром, и объединенные органические фазы промывались солевым раствором, сушились /сульфатом
магния/ и выпаривались при пониженном давлении, давая смолу.
Очистка с помощью хроматографии на силикагеле при элюировании смесями этилацетата и гексана, а затем смесями хлороформа и метанола, давая
целевое соединение, выход 0,004 г.
1H ЯМР /CDCl3/: δ 1,62 /6H, с./, 1,79 /3H, с./, 2,15 /1H, м./, 3,76 /1H, м./, 3,80 - 3,91 /2H, м./, 5,19 /1H, широкий с./, 5,39 /1H, т./, 7,38 - 7,54 /2H, м./, 7,85 - 7,95 /2H, м./.
Пример 87
Получение соединения 448
Дигидро-2-трет-бутилкарбамоилокси-4-(3-трифторметил)фенил-4H- 1,
4-оксазин-3/2H/-он
Перемешиваемый раствор
дигидро-2-гидрокси-4-(3-трифторметил) фенил-4H-1,4-оксазин-3/2H/-она /полученного, как в препаративном примере 44 выше/ /0,140 г/ в дихлорметане /2
мл/ обрабатывался трет-бутилизоцианатом /0,054 г/,
а затем триэтиламином /0,08 мл/. Раствор перемешивания в течение 24 часов, затем выпаривался при пониженном давлении. Перекристаллизация из смеси
этилацетата и гексана давала целевое соединение в
виде белого твердого вещества, выход 0,091 г, т. пл. 160 - 162oC.
1H ЯМР /CDCl3/: δ 1,34 /9H, с./, 3,59 /1H, м./, 3,98 - 4,18 /2H, м./, 4,35 /1H, м./, 4,87 /1H, широкий с./, 6,18 /1H, с./, 7,52 - 7,60 /3H, м./, 7,65 /1H, м./.
MC: м/e 360 /M+/
Пример 88
Получение соединения 508
Дигидро-2-трет-бутилкарбамоилокси-4-(3-трифторметил)фенил-4H-1,4-тиазин-3/2H/-он
Дигидро-2-гидрокси-4-(3-трифторметил)фенил-4H-1,4-тиазин-3/2H/-он
Дигидро-2-гидрокси-4-(3-трифтометил)фенил-4H-1,4-тиазин-3/2H/-он /полученный, как описано выше в препаративном примере 45/ /0,66 г/ превращался в целевое соединение с помощью процедуры,
аналогичной
описанной в примере 58, с использованием дихлорметана /10 мл/, триэтиламина /0,33 мл/ и трет-бутилизоцианата /0,27 мл/. Сырой продукт /0,877 г/ перекристаллизовывался из смеси этилацетата
и гексана,
давая целевое соединение в виде белых игл, выход 0,562 г, т. пл. 113 - 114oC.
1H ЯМР /CDCl3/: δ 1,34 /9H, с./, 3,11 /2H, м./, 4,03 /1H, м./, 4, 27 /1H, м./, 4,83 /1H, широкий с./, 6,23 /1H, с./, 5,53 /4H, м./.
Пример 89
Получение соединения 561
3-трет-бутилкарбамоилокси-1-(3-трифторметил)фенил-2- имидазолидинон
Перемешиваемый раствор 3-гидрокси-1-(3-трифторметил)фенил-2- имидазолидинона /полученного, как описано выше в
препаративном
примере 46/ /0,049 г/ в дихлорметане /5 мл/ обрабатывался триэтиламином /0,03 мл/, а затем трет-бутилизоцианатом /0,020 г/. Раствор перемешивался в течение 30 минут, а затем промывался
2 М соляной
кислотой, сушился /сульфатом магния/ и выпаривался при пониженном давлении, давая целевое соединение, выход 0,060 г.
1H ЯМР /CDCl3/: δ 1,37 /9H, с./, 3,78 - 3,85 /2H, м./, 3,87 - 3,94 /2H, м. /, 5,10 /широкий с./, 7,38 /1H, д./, 7,49 /1H, т./, 7,79 /1H, с./, 7,84 /1H, д./.
Пример 90
Получение соединения 667
Тетрагидро-3-трет-бутилкарбамоилокси-1-(3-трифторметил)фенил- 2/1H/-пиримидинон
С помощью процедуры, аналогичной описанной в примере 89, но с использованием
тетрагидро-3-гидрокси-1-(3-трифторметил)фенил-2/1H/- пиримидинона /полученного, как описано выше в препаративном примере 47/ /0,075 г/, трет-бутилизоцианата /0,029 г/, триэтиламина /0,039 мл/ и
дихлорметана /54 мл/ и очистки сырого продукта с помощью хроматографии на силикагеле при элюировании смесями этилацетата и гексана получалось целевое соединение, выход 0,053 г, т. пл. 156 - 158oC.
1H ЯМР /CDCl3/: δ 1,34 /9H, с./, 2,25 - 2,36 /2H, м./, 3,72 - 3,87 /4H, м./, 4,95 /1H, широкий с./, 7,38 - 7,56 /4H, м./.
Пример
91
Получение соединения 700
3-трет-бутилкарбамоилокси-1-(3-трифторметил)фенил-2-пиперидинон
Перемешиваемый раствор 3-гидрокси-1-(3-трифторметил)фенил-2- пиперидинона
/полученного, как описано выше в препаративном примере 48/ /0,247 г 2:1 смеси 3-гидрокси-1-(3-трифторметил)фенил-2- пиперидинона и 1-(3-трифторметил)фенил-2-пиперидиона/ в дихлорметане /10
мл/ обрабатывался трет-бутилизоцианатом /0,094 г/ и триэтиламином /0,13 мл/. Раствор нагревался с обратным холодильником в течение 4 часов, а затем охлаждался и оставлялся стоять в течение 16 часов.
Раствор затем выпаривался при пониженном давлении, и остаток очищался с помощью хроматографии на силикагеле, при элюировании смесями этилацетата и гексана, давая целевое соединение в виде прозрачной
смолы, выход 0,124 г.
1H ЯМР /CDCl3/: δ 1,32 /9H, с./, 1,98 - 2,14 /3H, м./, 2,33 /1H, м./, 3,65 /1H, м./, 3,75 /1H, м./, 4,85 /1H, широкий с./, 5,29 /1H, м./, 7,45 - 7,55 /4H, м./.
Пример 92
Получение соединения 796
Дигидро-6-трет-бутилкарбамоилокси-3-метил-4-(3,5-бис (трифторметил))фенил-2H-1,3,
4-тиадиазин-5/6H/-он
Перемешиваемый раствор дигидро-6-гидрокси-3-метил-4-(3,5-бис (трифторметил))фенил-2H-1,3,4-тиадиазин-5/6H//-она /полученного, как описано выше в препаративном примере 49
/0,037 г/ в дихлорметане /1 мл/ обрабатывался последовательно триэтиламином /0,013 мл/ и трет-бутилизоцианатом /0,011 мл/. Раствор оставлялся стоять в течение 18 часов перед тем, как он выпаривался
при пониженном давлении и растворялся в этилацетате /5 мл/. Раствор промывался 2М соляной кислотой /2 х 10 мл/, насыщенным раствором бикарбоната натрия /2 х 10 мл/, сушился /сульфатом магния/ и
выпаривался при пониженном давлении, давая целевое соединение в виде бледно-желтой смолы, выход 0,042 г.
1H ЯМР /d6- DMCO, 120oC/: δ 1,37 /9H, с./, 3,38 /3H, с./, 4,61 /1H, д./, 4,82 /1H, д./, 6,18 /1H, с./, 7,03 /1H, широкий с./, 7,37 - 7,41 /2H, с./, 7,48 - 7,51 /1H, с./.
MC: м/e/ 469 /M+/
Пример 93
Получение соединения 813
Дигидро-4-трет-бутилкарбамоилокси-2-(3-трифторметил)фенил-2H-1,2 -оксазин-3/4H/-он
Перемешиваемый раствор
дигидро-4-гидрокси-2-(3-трифторметил)фенил-2H-1,2-оксазин-3/4H/-она /полученный, как описано выше, в препаративном примере 50/ /0,26 г/ в дихлорметане /5 мл/ обрабатывался последовательно
дихлорметановыми растворами трет-бутилизоцианата /0,099 г в 1 мл/ и триэтиламина /0,101 г в 1 мл/. На протяжении ночи происходила частичная реакция. Смесь оставлялась на 5 дней, производилось
добавление дополнительных аналогичных количеств трет-бутилизоцианата и триэтиламина с суточными интервалами. Смесь затем выпаривалась при пониженном давлении, разбавлялась водой и этилацетатом и
экстрагировалась несколько раз этилацетатом. Объединенные экстракты промывались солевым раствором, сушились /сульфатом магния/ и выпаривались при пониженном давлении. Остаток растворялся в
этилацетате
и N,N'-ди-трет-бутилмочевина осаждалась гексаном и отфильтровывалась. Фильтрат выпаривался при пониженном давлении, и процедура осаждения повторялась еще два раза, после чего, наконец, не
получалась
мочевина. Фильтрат выпаривался при пониженном давлении, и остаток хроматографировался на силикагеле при элюировании смесью этилацетата и гексана /1:4/, давая целевое соединение в виде
смолы, которая
кристаллизовалась при стоянии, выход 0,147 г, т. пл. 83 - 84oC.
1H ЯМР /CDCl3/: δ 1,38 /9H, с./, 2,16 /1H, м./, 4,28 /1H, м./, 4, 46 /1H, м./, 5, 00 /1H, с./, 5,68 /1H, дд./, 7,46 /2H, д.+т./, 7,98 /с. + д./.
MC: м/e 360 /M+/
Пример 94
Получение соединения 353
5-трет-бутилкарбамоилокси-3-(3-1-этоксивинил)фенил-4-тиазолидинон
5-трет-Бутилкарбамоилокси-3-(3-иод)фенил-4-тиазолидинон /полученный, как описано в примере 68/ /0,19 г/ растворялся в сухом
диметилформамиде /10 мл/ и перемешивался при комнатной температуре в атмосфере азота. К данному раствору добавлялся альфа-этоксивинил-три-н-бутилстаннан /0,163 г/, а затем
бис/ трифенилфосфин/палладий/2/хлорид /0,125 г/. Реакционная смесь нагревалась в масляной ванне /температура ванны 130oC/ в течение 4 часов. Нагревающая ванна затем удалялась, и
реакционная
смесь оставлялась стоять при комнатной температуре на протяжении ночи. Смесь затем выливалась в 1 М водный раствор фторида калия /50 мл/ и разбавлялась диэтиловым эфиром /30 мл/. Смесь
перемешивалась
при комнатной температуре в течение 2 часов, и осажденные твердые вещества удалялись фильтрованием через целит. Органический слой отделялся, а водная фаза экстрагировалась еще
диэтиловым эфиром /х 2/.
Объединенные органические слои промывались водой /х 2/, сушились /сульфатом магния/ и выпаривались при пониженном давлении, давая сырой продукт /0,28 г/. Данное вещество
хроматографировалось на
силикагеле /предосторожность: продукт довольно нестабильный, чтобы подвергаться длительному воздействию силикагеля/ с использованием смеси этилацетат/гексан /1:4 до 3:7/ в
качестве элюента, давая
целевое соединение /0,042 г/, которое имело:
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 1,41 /3H, т./, 3,92 /2H, кв./, 4,24 /1H, д./. 4,67 /2H, м./,
4,90 /1H, широкий с./, 5,
01 /1H, д./, 6,22 /1H, с. /, 7,40 /2H, м./, 7,56 /1H, м./, 7,69 /1H, м./.
Пример 95
Получение соединения 156
5-трет-Бутилкарбамоилокси-3-(3-ацетил)фенил-4-тиазолидинон
5-трет-Бутилкарбамоилокси-3-(3-1-этоксивинил))фенил-4-тиазолидинон (полученный, как описано в примере 94 выше) /0,40 г/ растворялся
в ацетоне /2 мл/ и перемешивался при комнатной температуре. Добавлялась 2 М соляная кислота /0,1 мл/, и смесь перемешивалась в течение 30 минут. Растворитель удалялся при пониженном давлении, а
остаток распределялся между этилацетатом и водным раствором бикарбоната натрия. Органический слой отделялся, а водная фаза экстрагировалась дополнительными порциями этилацетата /х 2/. Объединенные
этилацетатные слои промывались водой, сушились /сульфатом магния/ и выпаривались при пониженном давлении, давая остаток /0,039 г/. Данное вещество хроматографировалось на силикагеле с использованием
смеси этилацетат/гексан /3: 7/ в качестве элюента, давая целевое соединение /0,020 г/, которое имело:
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 2,62 /3H, с./, 4,72 /1H,
д./, 4,90 /1H, широкий с. /, 5,07 /1H, д./, 6,22 /1H, с./, 7,54 /1H, т./, 7,80 /1H, д./, 7,87 /1H, д./, 8,03 /1H, с./. \\\ MC: м/e 336 /M+/
Пример 96
Получение соединения
354
5-(N-1-адамантил)карбамоилокси-3-(3-трифторметил)фенил-4-тиазолидон
С помощью процедуры, аналогичной описанной в примере 10, но с использованием
5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидона /полученного, как в препаративном примере 2, выше/ /0,100 г/, 1-адамантилизоцианата /0,067 г/, триэтиламина /0,053 мл/ и хлороформа /10 мл/ и очистки
сырого продукта с помощью хроматографии на силикагеле при элюировании смесью этилацетат/гексан получалось целевое соединение, выход 0,121 г/.
1H ЯМР /CDCl3/: δ 1,68 /6H, широкий/, 1,94 /6H, широкий/ 2,05 /3H, широкий/, 4,71 /1H, д./, 4,78 /1H, широкий с./, 5,06 /1H, дд./, 6,19 /1H, д./, 7,55-7,61 /2H, м./, 7,71-7,79 /2H, м./.
MC:
м/e 440 /M+/
Пример 97
Получение соединения 319
5-(N-1-этинил)циклогексил)карбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
С помощью процедуры,
аналогичной описанной в примере 38, но с использованием фосгена в толуоле /1,93 М, 0,93 мл/, 1-этинилциклогексиламина /0,200 г/, диэтилового эфира /2 мл/, гидроокиси натрия /0,144 г/ в воде /3 мл/,
затем 5-гидрокси-3-/3-трифторметил/фенил-4-тиазолидинона /полученного, как описано выше в препаративном примере 2/ /0,156 г/ и триэтиламина /0,278 мл/ и очистки сырого продукта с помощью
хроматографии
на силикагеле получалось целевое соединение, выход 0,181 г.
1H ЯМР /CDCl3/: δ 1,51-1,79 /7H, м./, 2,03-2,17 /2H, м./, 2,42 /1H, с./, 4,69 /1H, д/, 5,04 /1H, широкий с./, 5,07 /1H, дд./, 6,23 /1H, д./, 7,52-7,60 /2H, м./, 7,70-7,80 /2H, м./.
MC: м/e 412 /M+/
Пример 98
Получение соединения
355
5-трет-Бутилкарбамоилокси-3-(3-(N, N-дибензил)сульфонамидо)фенил- 4-тиазолидинон
5-Гидрокси-3-(3-N,N-дибензил)сульфонамидо)фенил-4-тиазолидинон /полученный, как описано выше в
препаративном
примере 51 /0,823 г/ превращался в целевое соединение с помощью процедуры, аналогичной описанной в примере 58 с использованием дихлорметана /25 мл/, триэтиламина /0,265 мл/ и
трет-бутилизоцианата /0,
127 мл/. Сырой продукт /0,95 г/ очищался с помощью хроматографии на силикагеле с использованием смеси этилацетат-гексан /3:7/ в качестве элюента. Целевое соединение /0,745
г/ получалось в виде хрупкой
белой пены, которая имела:
1H ЯМР /CDCl3/: δ 1,34 /9H, с./, 4,36 /4H, с./, 4,59 /1H, д./, 4,89 /12H, широкий с./, 4,97 /1H, д./, 6,21
/1H, с,/, 7,09 /4H, м./, 7,22
/6H, м. /, 7,55 /1H, т./, 7,72 /1H, д./, 7,81 /2H, м./.
Пример 99
Получение соединения 356
5-трет-бутилкарбамоилокси-3-(3-гидроксиамино-5-трифторметил)фенил- 4-тиазолидинон
5-трет-Бутилкарбамоилокси-3-(3-нитро-5-трифторметил)фенил- 4-тиазолидинон (полученный, как описано в примере
77) /0,792 г/ растворялся в этилацетате /20 мл/ и добавлялся 10% палладий на активированном угле /0,2 г/. Реакционная смесь перемешивалась в атмосфере водорода в течение 5 часов /продолжительная
обработка в этих условиях дает амин, см. пример 100/. Катализатор удалялся фильтрованием через целит, и осадок на фильтре хорошо промывался этилацетатом. Растворитель удалялся при пониженном давлении,
давая целевое соединение по существу с количественным выходом. Небольшое количество пробы /0,108 г/ отбиралось и хроматографировалось на силикагеле с использованием смеси этилацетата и гексана
/45:55/ в качестве элюента. Получалось белое твердое вещество, которое имело:
1H ЯМР /CDCl3/: δ 1,33 /9H, с./, 4,68 /1H, д./, 4,88 /1H, широкий с./, 5,03 /1H,
д./,
5,32 /1H, широкий с./, 6,20 /1H, с./, 6,96 /1H, широкий с./, 7,14 /1H, с./, 7,22 /1H, с./, 7,42 /1H, с./.
FAB MC: 393 /MH+/
Пример 100
Получение
соединения 357
5-трет-Бутилкарбамоилокси-3-(3-амино-3-трифторметил)-4-тиазолидинон
5-трет-Бутилкарбамоилокси-3-(3-гидроксиламино-5-трифторметилфенил)-4-тиазолидинон /полученный, как
в примере 99/ /0,68 г/ растворялся в этилацетате /20 мл/, и добавлялся 10% палладий на активированном угле /0,4 г/. Реакционная смесь перемешивалась в атмосфере водорода в течение 22 часов. ЯМР
обнаруживал, что присутствует исходный материал, и процесс повторялся /после удаления катализатора через целит и введения свежей порции/ в течение 72 часов. Реакция снова оказалась незавершенной, и
процесс повторялся в течение еще 48 часов. Катализатор удалялся на целите, и растворитель выпаривался при пониженном давлении, давая пену /0,579 г/, которая содержала приблизительно 10% неизменного
исходного материала вместе с несколькими другими примесями. Целевое соединение приблизительно 80% чистоты имело:
1H ЯМР /CDCl3/: δ наряду с другими 1,33 /9H, с./,
4,00 /2H, широкий с./, 4,64 /1H, д. /, 4,91 /1H, широкий с./, 4,99 /1H, д./, 6,20 /1H, с./, 6,79 /1H, с./, 6,96 /1H, с./, 7,12 /1H, с./.
Пример 101
Получение соединения
306
5-Циклогексилтиокарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
Перемешиваемый раствор 5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона (полученного, как описано выше в
препаративном примере 2) /0,50 г/ в дихлорметане /15 мл/ обрабатывался по каплям циклогексилизотиоцианатом /0,28 мл/ и триэтиламином /0,28 мл/. Раствор перемешивался в течение 24 часов, после чего
добавлялись дополнительно циклогексилизотиоцианат /0,28 мл/ и триэтиламин /0,28 мл/. По прошествии 72 часов растворитель удалялся при пониженном давлении, и остаточная смесь отделялась с помощью
хроматографии на силикагеле /элюирование смесью этилацетата и гексана/ с последующей перекристаллизацией из смеси эфира и гексана, давая целевое соединение в виде очень бледно-розового твердого
кристаллического вещества, выход 0,14 г, т. пл. 132-132,5oC.
1H ЯМР показал 5:1 соотношение конформациональных изомеров.
1H ЯМР /CDCl3/: /основной конформер/ δ: 1,10-2,20 /10H, м./, 3,96-4,10 /1H, м. /, 4,71 /1H, д./, 4,98 /1H, д./, 6,42 /1H, широкий/, 6,70 /1H, д./, 7,55-7,62 /2H, м./, 7,74-7.,2 /2H, м./; /второстепенный конформер/ δ 1,10-2,20 /10H, м./, 3,81-3,71 /1H, м./, 4,71 /1H, д./, 5,06 /1H, д./, 6,68 /1H, широкий/, 6,77 /1H, д./, 7,55-7,62 /2H, м./, 7,74-7,82 /2H, м./.
Пример 102
Получение соединения 358
5-изопропилтиокарбамоилокси-3-(3-трифторметил)фенил-4-тиазолидинон
С помощью процедуры, аналогичной процедуре, описанной в примере 101,
но с использованием 5-гидрокси-3-(3-трифторметил)фенил-4-тиазолидинона (полученного, как описано выше в препаративном примере 2), изопропилизотиоцианата и триэтиламина получалось целевое соединение,
т. пл. 138-139oC.
1H ЯМР показал 5:1 соотношение конформациональных изомеров.
1H ЯМР /CDCl3/: /основной конформер/ δ 1,27 /6H, д./, 4,36 /1H, м./, 4,71 /1H, д./, 4,98 /1H, д./, 6,38 /1H, широкий/, 6,70 /1H, д./, 7,52-7,62 /2H, м. /, 7,74-7,82 /2H, м./; /второстепенный конформер/ δ 1,21 /6H, дд./, 4,07 /1H, м./, 4,71 /1H, д./, 5,05 /1H, д./, 6,64 /1H, широкий/, 6,76 /1H, д./, 7,52-7,62 /2H, м./, 7,74-7,82 /2H, м./.
Биологические данные
Гербицидная активность соединений
испытывалась следующим образом.
Каждое химическое соединение преобразовывалось в готовую препаративную форму одним из двух способов. Химическое вещество или растворялось в соответствующем количестве воды, в зависимости от требуемого количества смеси растворителя и поверхностно-активного вещества таким образом, чтобы общий объем составил 5 см3. Затем смесь с растворителем, включающая 78,2 г/л Твин 20 и 21,8 г/л Спан 80, доведенная до 1 л с использованием метилциклогексанона, добавлялась к раствору. Альтернативно, химическое вещество растворялось в воде до требуемой концентрации и добавлялся 0,1% Твин. Твин 20 - торговая марка поверхностно-активного агента, включающего конденсат 20 молярных количеств окиси этилена с сорбитанлауратом. Спан 80 - торговая марка поверхностно-активного агента, включающего сорбитан-монолаурат. Если химическое соединение не растворялось, объем доводился до 5 см3 водой, добавлялись стеклянные шарики, и данная смесь затем встряхивалась для растворения или суспендирования химического агента, после чего шарики удалялись. Во всех случаях смесь затем разбавлялась до требуемого объема спрея. При независимом опрыскивании, для послевсходовых испытаний требовались объемы 25 и 30 см3; если опрыскивание производилось совместно, требовалось 45 см3. Водная эмульсия для опрыскивания содержала 4% начальной смеси растворителя и поверхностно-активного вещества и испытываемого химического соединения в соответствующей концентрации.
Композиции спрея, приготовленные таким образом, распылялись на молодые растения в горшках /послевсходовое испытание/ при объеме распыления, эквивалентном 1000 л на гектар. Повреждение растений оценивалось через 13 дней после опрыскивания путем сравнения с необработанными растениями, по шкале от 0 до 9, где 0 соответствует 0% ущерба, 1 означает ущерб в 1-5%, 2 - 6-15%, 3 - 16-25% ущерб, 4 - 26-35%, 5 - ущерб или повреждение на 36-59%, 6 - на 60-69%, 7 - 70-79%, 8 - на 80-89%, и 9 означает 90-100% повреждение.
В испытании, осуществляемом для определения предвсходовой гербицидной активности, семена культур высевались на глубину 2 см, а семена сорняков на глубину 1 см под компост, и опрыскивались композициями при норме расхода 1000 л на гектар. Через 20 дней после опрыскивания сеянцы в обработанных пластиковых лотках сравнивались с неопрысканными сеянцами в контрольных лотках, при этом ущерб или повреждение оценивалось по той же шкале от 0 до 9.
Результаты испытаний даны ниже в Таблице XVI.
Химические формулы (используемые в описании)о
Реферат
Замещенные гетероциклические соединения формулы I, где Е - кислород или сера, A представляет CR3 или N, R3 - водород или низший алкил; D завершает 5- или 6- членное неароматическое гетероциклическое кольцо, которое необязательно содержит дополнительные гетероатомы, выбранные из кислорода, азота или серы, возможно замещено C1-C10 -алкилом или фенилом; R1 и R2 - водород, алкил, алкенил, алкинил, циклопропил, циклопропилметил, циклогексил, адамантил, фенил или пиридил, или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют морфолиновое кольцо; Z - галоген, циано, NHOH, SF5, ациламино, COOR7, NR13R14, дибензиламиносульфонил или Z - алкил, алкенил, алкокси, фенокси, алкилтио, алкилсульфонил или CO-алкил, каждый из которых может быть замещен галогеном или C1-6-алкокси; R7 - C1-10-алкил; R13 и R14 - водород или SO2-алкил; m = 0, 1 или 2. Соединения формулы I являются активными против широкого ряда сорняковых видов, включая однодольные и двудольные виды сорняков.

5 с. и 10 з.п. ф-лы, 9 ил., 17 табл.
Формула

в которой E представляет кислород или серу;
А представляет CR3 или N, где R3 представляет водород или низший алкил;
D завершает 5- или 6-членное неароматическое гетероциклическое кольцо, которое необязательно содержит дополнительные гетероатомы, выбранные из кислорода, азота или серы, и которое является незамещенным или замещено C1-C10-алкилом или фенилом;
R1 и R2 представляют каждый независимо водород, C1-C10-алкильную, C2-C10-алкенильную, C2-C10-алкинильную, циклопропильную, циклопропилметильную, циклогексильную, адамантильную, фенильную или пиридильную группу, каждая из которых может быть замещена галогеном, циано или фенилом; или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют морфолино кольцо;
Z представляет галоген, циано, NHOH, SF5, ациламино, COOR7, NR13R14, дибензиламиносульфонил, или Z представляет C1-C10-алкил, C2-C10-алкенил, C1-C10-алкокси, фенокси, C1-C10 -алкилтио, C1-C10-алкилсульфонил или CO(C1-C10)алкил, каждый из которых может быть замещен галогеном или C1-C6-алкокси;
R7 представляет C1-C10алкил;
R13 и R14 каждый независимо представляет водород или SO2 (C1-C10)алкил;
при условии, что, когда имеется два заместителя Z, они могут быть одинаковыми или различными;
m представляет 0 или целое число 1 или 2.

в которой A, E, R1, R2, Z и m имеют значения, определенные для формулы I в п.1;
W, X и Y выбраны независимо из CR4R5, NR6, 0 и S(O)p, где p представляет 0, 1 или 2;
R4, R5 и R6 выбраны независимо из водорода, C1-C10-алкила и фенила;
n представляет 0 или 1 при условии, что не более, чем два из A, W, X и Y включает гетероатомы в кольце, и, когда более, чем один W, X и Y представляет NR6, R6 могут быть одинаковыми или различными.
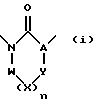
выбрана из любой из кольцевых систем (а) - (о)






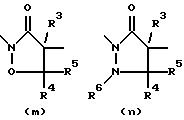

в которых R3 имеет значения, определенные в п.1;
R4, R5 и R6 независимо выбраны из водорода, C1-C10-алкила и фенила;
R4 и R5 могут быть одинаковыми или разными;
R4', R4'', R5' и R5'' имеют значения, определенные соответственно для R4 и R5.

представляет тиазолидин под-формулы (а) или пирролидин под-формулы (b), где R3, R4, R4', R5 и R5' имеют значения, определенные в п.3.
m представляет 1 или 2.

E представляет кислород;
R3 представляет водород;
R1, R2 и m имеют значения, определенные в п.1,
R4 и R5 имеют значения, определенные в п.3, при условии, что, когда имеется два заместителя Z они могут одинаковыми или различными.

в которой Z представляет галоген, дибензиламиносульфонил, нитро, циано, SF5, COOR7, или Z представляет C1-C10-алкил, C1-C10 -алкокси, C1-C10-алкилтио или C1-C10-алкилсульфонил, каждый из которых может быть замещен галогеном;
R7 представляет C1 -C10-алкил;
R4 и R5 каждый независимо представляет водород или фенил;
m представляет 0, 1 или 2;
при условии, что, когда имеется два заместителя Z, они могут быть одинаковыми или различными.

в которой Z, m, А и D имеют значения, определенные в отношении формулы I,
подвергают реакции с соединением формулы IV

в которой R1 и R2 имеют значения, определенные для формулы I в п.1;
R19 - удаляемая группа.

в которой Z, m, А и D имеют значения, определенные в отношении формулы I,
подвергают реакции с соединением формулы V
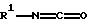
в которой R1 имеет значения, определенные для формулы (I) в п.1.

Комментарии