Удаление азота из азотных соединений в водной фазе - RU2104951C1
Код документа: RU2104951C1
Описание
Изобретение относится к способу денитрификации азотсодержащих соединений, таких как нитраты, аммиак, азотно-органические соединения, амиды и амины. Такие соединения обнаружены в отходящих водных потоках обработки сточных вод и металлоперерабатывающих заводов, а переработка данным способом дает снижение вредности газообразных азота, кислорода, гидроксидов, спиртов и углеводородов. Термин "водный" использован здесь в значении "имеющий отношение" или "сходный" с водой, то есть находящийся в жидкой или надкритической фазе.
Азотсодержащие соединения, включая нитраты, нитриты, азотно-органические соединения, аммиак, амины и амиды и др., часто присутствуют вместе в различных комбинациях в нерадиоактивных смешанных отходящих водных потоках, таких как сточные воды, сточные грязи, отходы нитратов и нитритов на металлоперерабатывающих, химических и военных заводах. Производство радиоактивных веществ также приводит к образованию стоков, содержащих как соединения азота, так и радиоактивные вещества.
Во многих сточных и промышленных потоках концентрация азотсодержащих соединений ниже 1%, что является недостаточным для эффективного удаления их традиционными методами. Удалению азота из азотсодержащих потоков с более высокой концентрацией может препятствовать присутствие вредных химических продуктов и/или радиоактивности. Кроме того, присутствие в сточных водах азотсодержащих соединений в любой концентрации порождает такие проблемы, как выделение оксида азота (NOx) при уничтожении отходов сжиганием и цветение морских водорослей, вызываемое эвтрофикацией при сливе отходов в водные массивы.
Из многих методов денитрификации лишь несколько эффективны в отношении не только соединений, содержащих одиночный азот, но и некоторых других. Например, в [1] (с. 6-11) указано, что "единственный химический процесс, который удаляет нитраты - это анионный обмен". Однако процессу анионного обмена присущ ряд недостатков: 1) анионный обмен неэффективен для других соединений азота; 2) требуются дополнительные химикаты для регенерации анионнообменной смолы; и 3) требуются дополнительные химикаты для регенерации анионнообменной смолы и при регенерации образуются отходы.
Далее, примеры выделения соединений с одиночным азотом включают способы выделения аммиака. В [1] (с.6-10) также сообщают, что "аммиак может быть выделен дегазацией, катионным обменом в водородном цикле и адсорбцией на некоторых глинах, таких как клиноптилолит". Недостатком этих процессов является то, что они в первую очередь направлены на выделение аммиака, а другие азотсодержащие соединения, в основном, не затрагиваются. Другой недостаток этих процессов заключается в необходимости повышения pH стоков для увеличения давления паров водного аммиака.
Другой способ выделения аммиака состоит в добавлении хлора с целью образования газообразного азота и соляной кислоты. С целью деактивации токсичных стоков нежелательно употребление хлора и образование соляной кислоты, кроме того, не все азотные соединения выделяют газообразный азот при добавлении хлора.
Гидразин (N2H4) может быть удален реакцией с растворенным кислородом, в результате которой образуются газообразный азот и вода. Однако любое другое азотное соединение эта реакция не затрагивает.
Каждый из описанных ранее процессов денитрификации эффективен только для одного типа азотсодержащих соединений. Удаление же нескольких соединений азота требует применения комбинации этих методов.
Распространены два метода, пригодные для удаления нескольких азотсодержащих соединений. Это бактериальная обработка и сжигание. В стандартных бактериальных системах обычно требуются осадительные резервуары (водоемы) или биологические реакторы, температура в которых поддерживается на уровне ниже 30oC, оборудование для циркуляции значительных объемов воздуха и время порядка нескольких дней для снижения концентраций азотсодержащих соединений до приемлемого уровня.
В случае сжигания азотсодержащих отходов недостатком является выделение оксидов азота
(NOx), являющихся
компонентами смога. NO можно смешать с аммиаком и подвергнуть либо реакции разложения в газовой фазе при температурах 1000-1100oC (что известно как термическое
удаление NOx),
либо подвергнуть выборочному каталитическому восстановлению при температуре 650-750oC в присутствии катализатора, приводящего к превращению NOx в азот,
кислород и воду.
Недостатки обработки оксидов азота в газовой фазе состоят в следующем:
1) большой объем оборудования, требующегося для обработки газов:
2) высокая температура
процесса;
3)
воздействие потенциально коррозийного конденсата при охлаждении газового потока;
4) издержки на уничтожение отработанного катализатора после обработки радиоактивных
отходов, и др.
Азотсодержащие соединения могут быть превращены во вторичные соединения азота, но это не дает их полного удаления. Так например, в случае, когда к отходам предъявляют высокие требования по химическому показателю кислорода (ХПК) из-за присутствия углерод- и азотсодержащих соединений, обработку влажным воздухом можно использовать для окисления большей части или всей доли углерода в отходах. Как указано в [2] (с. 192): "Значительное преимущество окисления влажным воздухом состоит в том, что проблемы с загрязнением воздуха сводятся к минимуму. Загрязнения остаются в водной фазе. Небольшое количество отходящего газа содержит в основном отработанный воздух и диоксид углерода CO Выделение оксидов азота NO не обнаружено, так как соединения азота превращаются в аммиак". Таким образом, несмотря на то, что окисление влажным воздухом эффективно при разложении углеродной фракции отходов и превращения азотной составляющей в аммиак, эта обработка, в том виде как ее широко применяют, не удаляет из водных потоков азот аммиака.
В случае присутствия в отходах большого количества соединений азота, удаление азота является трудной и дорогостоящей задачей. До настоящего изобретения только бактериальная обработка и сжигание были пригодны для удаления большого количества соединений азота из водных отходов. Однако ни один из указанных подходов не дает газообразный азот в качестве преобладающего конечного продукта, и кроме того, им присущи вышеупомянутые недостатки, в особенности когда речь идет о радиоактивных отходах.
Поэтому предлагаемое изобретение направлено на разработку способа удаления большого количества азотсодержащих соединений из водных отходов, результатом которого является выделение азота в газообразном виде без образования оксидов азота, таких как NO, NO2, и N2O4. Изложенный в представленном изобретении способ основывается на реакциях в водной фазе, происходящих при средних температуре и давлении, без использования катализатора и без последующих регенерации и/или удаления катализатора, как в случае обработки нерадиоактивных, так и радиоактивных отходов.
Изобретение включает способ удаления азота по реакциям в водной фазе из множества азотсодержащих соединений, включая нитраты, нитриты, аммиак, амиды, амины, органические соединения азота и др. Такие соединения могут присутствовать в нерадиоактивных и радиоактивных стоках и могут быть обработаны по способу настоящего изобретения, который приводит к получению менее вредных продуктов, включая газообразные азот и кислород, гидроксиды, спирты и углеводороды. Гидроксиды могут впоследствии взаимодействовать с диоксидом углерода с образованием твердых безводных карбонатов. Спирты и углеводороды могут быть выделены из отходов для последующего использования.
Способ, предлагаемый в данном изобретении, может быть использован как сам по себе, так и в сочетании с уже существующими процессами, такими, например, как окисление влажным воздухом. Сочетание процессов может быть выполнено как в отдельных, так и в едином совмещенном реакторе. В последнем случае предварительно можно провести окисление влажным воздухом, а затем применить способ настоящего изобретения.
Способ, предлагаемый в данном изобретении, включает операции идентификации типа и концентрации азотсодержащих соединений в отходах, приведение в равновесие окисленных и восстановленных форм азота добавлением соответствующего азотсодержащего реагента, такого как аммиак или нитритное или нитратное соединение, и нагревание смеси под давлением для проведения желаемой реакции.
Приведение в равновесие, достигаемое добавлением азотсодержащего соединения, такого как азотная кислота, к отходам, содержащим аммиак и амины, будет способствовать образованию воды и газообразных азота и кислорода.
Нагревание требуется для преодоления энергии активации реакций между приведенными в равновесие азотсодержащими соединениями. Нагревание может быть выполнено до или после операции уравновешивания.
Приведенную в равновесие и нагретую смесь помещают под давление и выдерживают при этих условиях до полного завершения реакций. Этот способ может быть распространен на последующую обработку остающихся водных продуктов.
Преимущества процесса, предлагаемого в данном изобретении, состоят в том, что:
1) удаление азота из множества азотсодержащих соединений происходит в водной фазе;
2)
продукты реакции являются относительно безвредными и стабильными, что дает возможность рецикла, или дальнейшей обработки, или удаления обычными способами;
3) меньший объем реактора по
сравнению с бактериальной или газофазной обработкой оксидов азота;
4) более низкая температура процесса по сравнению с газофазной обработкой;
5) процесс занимает меньше времени, чем
в случае бактериальной обработки; и
6) не требуется катализатор.
Предмет данного изобретения конкретно указан и четко сформулирован в заключительной части данного описания. Тем не менее как организация процесса, так и способ его осуществления вместе с другими преимуществами и решаемыми задачами могут стать более понятными из дальнейшего подробного описания изобретения.
В предпочтительном варианте процесса азотсодержащие соединения, присутствующие в таких отходах, как сточные воды, нитратные отходы окончательной обработки металлов,
радиоактивные нитратные отходы, подвергают идентификации и определяют их концентрации. Идентификация и определение концентраций азотсодержащих соединений могут включать в себя одну или несколько
операций:
1) оценка первичных потоков и расчет состава композиции;
2) выпаривание с последующим рентгеновским анализом;
3) прямое электродное измерение:
4) метод
Кьелдала и его варианты;
5) ИК-, видимая и УФ-спектрометрия;
6) газовая хроматография;
7) масс-спектрометрия;
8) определение химической потребности в кислороде
(ХПК);
9) другие стандартные лабораторные методики, которые могут потребоваться и являются общепринятыми.
Если реагенты, входящие в группу, содержащую нитраты, нитриты, азотную кислоту, соли аммония, аммиак и др. добавляют к азотсодержащим отходам, и смесь нагревают до заданной самой низкой температуры реакции под давлением, достаточным для сохранения жидкой фазы и выдерживают при этих условиях в течение заданного времени, происходит выделение газообразного азота. Очередность операций приведения в равновесие и нагревания может быть изменена таким образом, чтобы нагревание предшествовало уравновешиванию. В качестве добавки к реагентам можно использовать pH-модификаторы, такие как минеральные кислоты, диоксид углерода или органические кислоты, для снижения pH и увеличения тем самым выхода газообразного азота.
Реакции, используемые при денитрификации, включают, но не ограничиваются, нижеприведенными уравнениями. В этих уравнениях символ M соответствуют водорастворимому катиону, X - водорастворимому аниону, а R - ковалентно связанному органическому радикалу (в виде цепи или кольца).
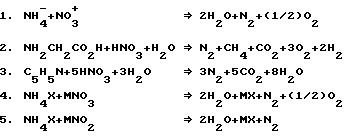

Так, например, отходы, содержащие аммиак, ионы аммония, амины, глицин и пиридин, могут быть обработаны добавлением азотной кислоты, в результате чего образуется вода и газообразные азот и кислород (ур. 1-4, 6 и 8). Добавление нитрита натрия дает те же самые продукты, но с меньшим содержанием кислорода (ур. 5, 7 и 9). Добавление R-NO и R-NO2 к NH4X дает газообразный азот и остаточные углеводороды, которые могут быть обработаны отдельно (ур. 10-13). Не представленные в уравнениях амид-ионы, азосоединения, нитропроизводные и аминокислоты могут быть обработаны добавлением азотной кислоты, нитратов или нитритов. В предпочтительном способе первое заранее выбранное соединение азота добавляют к водному потоку, содержащему несколько азотных соединений. Количество первого заранее выбранного азотсодержащего соединения эквивалентно мольной доле второго, содержащего несколько соединений азота, которые могут варьироваться в пределах от TKN-обнаружения (общий азот Кьелдала) до насыщенного раствора.
Варианты основного процесса включают альтернативные способы уравновешивания окисленной и восстановленной форм азота. Второй пример конкретной реализации представленного изобретения включает приведение в равновесие окисленной и восстановленной форм азота путем добавления соответствующего реагента, не содержащего азота (такого как водород, сульфид водорода, пероксид водорода или перманганат калия, ур. 14-16) в количестве по существу эквивалентном половине мольной доли присутствующих в отходах азотных соединений. Добавление достаточного количества окислительного или восстановительного агента к отходам приводит к установлению равновесия между окисленной и восстановленной формами соединений азота, а затем протекают требуемые реакции между азотными соединениями и выделяется газообразный азот, а возможно и другие компоненты, такие как газообразный кислород и/или вода.
В случае, если сток содержит избыток восстановленных соединений азота, таких как амины или аммиак, могут быть использованы такие окислители как воздух, кислород, пероксид водорода или перманганат калия. Реакция 14 иллюстрирует пример, в котором водный сток, содержащий соединение аммония частично подвергается воздействию окислителя, превращающего некоторое количество аммоний-ионов в азотную или азотистую кислоту. Далее взаимодействие между оставшимися ионами аммония и вновь образовавшейся азотной кислотой приводит к образованию газообразного азота, воды, кислорода и водородного соединения.
Там, где сточные воды содержат избыток окисленных соединений азота, таких как нитраты или нитриты, в качестве восстановителя может быть использован сульфид водорода. Реакции 15a, 15b и 16 иллюстрируют пример, в котором водные стоки, содержащие нитратное соединение, частично подвергаются воздействию восстановителя, который превращает некоторые нитраты либо в нитраты аммония, либо в серу и газообразный азот. После образования нитрата аммония возможно дальнейшее взаимодействие по реакции 1 с образованием газообразных азота и кислорода. То, по какому из предложенных в ур. 15a, 15b и 16 путей будет протекать реакция, зависит от того, какое количество сульфида водорода добавлено к обработанным стокам.
Один из вариантов второго примера реализации включает разделение водного стока на равноценные первый и второй потоки. Восстановленные соединения первого потока окисляются до окисленных азотных соединений, таких как азотная кислота или нитраты и нитриты. Такое окисление может быть выполнено при помощи различных сильных окислителей, таких как перекись водорода, гидроксильный радикал, перманганат калия и др. Например, окислить аммиак до азотной кислоты можно пероксидом водорода при температуре от 90 до 150oC. Наконец, подвергшийся окислению первый поток и необработанный второй поток соединяют, что и приводит к установлению равновесия между окисленными и восстановленными формами азотных соединений. Установлено, что многие варианты могут быть использованы без отступления от области изобретения, в зависимости от очередности операций: нагревания до 350oC, разделения стока, нагревания или охлаждения первого потока от 90 до 150oC.
Третий пример реализации представленного изобретения касается обработки потоков, содержащих соединения азота и углерода. В этом случае, углеродную составляющую превращают в диоксид углерода посредством окисления влажным воздухом. Затем окисленные и восстановленные формы азота приводят в равновесие добавлением соответствующего азотсодержащего реагента. Такой реагент может быть, например, азотной кислотой, аммиаком или другим соединением.
Простое уравновешивание окисленной и восстановленной форм соединений азота в водных отходах в естественных условиях неэффективно из-за энергии активации реакций. Поэтому такая смесь должна быть нагрета до заданной температуры реакции, составляющей примерно от 300 до 600oC для преодоления энергии активации реакций при давлении, достаточном для поддержания водного потока в жидкой или надкритической фазе. Предпочтительно использование температур около 300-350oC для восстановления количества энергии, потребляемой в ходе процесса, и давления, соответствующего или превышающего давление насыщенного пара при данной температуре. Нагревание производится электричеством, паром, излучающим и/или конвективным пламенем или же в теплообменнике горячим маслом. Водный поток нагревают при давлении, достаточном для предотвращения кипения, или при давлении, равном или превышающем критическое для воды. Для денитрификации NH4NO3, который является одним из самых сложных с химической точки зрения в ряду реакций 1-16, минимальная температура реакции составляет 350oC. Предполагается, что другие соединения имеют такую же или более низкую температуру реакции. Более высокие температуры (порядка 600oC) могут быть использованы для уменьшения времени, требующегося для завершения реакций. Нагрев до температуры, меньшей, чем самая низкая реакционная температура, был бы неэффек- тивен, так как либо реакция вообще не пройдет, либо скорость реакции будет слишком мала для практического использования.
Способ настоящего изобретения, проиллюстрированный тремя примерами его конкретной реализации, требует поддержания в течение заданного времени повышенной температуры и давления. Это время может составлять от 1 минуты до 2 часов, что достаточно для завершения реакций. Так как реакции являются экзотермическими, реакционный поток можно направить через теплообменник для утилизации тепла. Образующиеся азот, диоксид углерода и кислород выделяют путем охлаждения и/или мгновенного испарения, используя стандартные нагнетально-расширительные клапаны давления.
Полученный в результате поток может быть смешан с
газообразным
диоксидом углерода при нормальных или повышенных температуре и давлении для проведения реакции с присутствующими гидроксидами с образованием карбонатов в соответствии с одним из
нижеприведенных
уравнений 17 или 18:
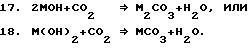
Пример 1. Для подтверждения того, что реакция 1 происходит при 350oC и ниже в водных условиях, был проведен эксперимент, заключающийся в том, что 3,34 г нитрата аммония растворили в 300 мл воды, а полученный раствор поместили в перемешиваемый автоклав емкостью 1 л. Затем автоклав постепенно нагревали до 350oC, отбирая пробы газа при повышении температуры на каждые 50oC. Давление в автоклаве поддерживали на уровне 2400 фунтов на кв.дюйм, что является достаточным для удержания раствора в водной фазе. По данным газовой хроматографии взаимодействие аммиака с нитратом происходит в температурных пределах от 300 до 350oC.
Процентную долю азота в водном растворе, переходящую в газообразный азот, рассчитывали в два этапа. На первом этапе вычисляется количество азота в отходящем газе, то есть того, который действительно выделяется из водного раствора. Вторым этапом является определение соотношения выделившегося газообразного азота к количеству азота, первоначально присутствовавшего в водном растворе, которое затем умножается на 100, в результате чего определяют процент превращенного азота, то есть степень денитрификации.
В данном примере 3,34 г водного нитрата аммония содержат 1, 169 г азота. Объем газа, выделившегося из автоклава в сочетании с газом внутри автоклава, соответствует 6,1 л, причем объемная концентрация азота составляет в нем 15,7%, то есть 1,197 г газообразного азота. Степень денитрификации составила таким образом 102%, что можно считать несомненно полной в пределах ошибки эксперимента. Объем газа был измерен пропусканием его из автоклава через психрометр и затем добавлением к известному объему автоклава. В то время как газ, проходящий через психрометр, имел комнатную температуру (приблизительно 20oC), газ, оставшийся в автоклаве, мог быть теплее. Именно это и могло внести незначительную ошибку при расчете объема газа.
Пример 2. Эксперимент по подтверждению того, что денитрификация глицина (реакция 2) происходит в водных условиях при температуре 350oC или ниже, был проведен в соответствии с процедурой, описанной в примере 1. Глицин (NH2CH2CO2H) в количестве 15,8 г (0,21 г/моль) вместе с азотной кислотой NHO в количестве 49,3 мл 70%-ной кислоты (0,773 г/моль) добавили к 285 г воды. Так как азотную кислоту берут в избытке, выход газообразного азота в реакции 2 определяется количеством азота в 0,21 г/моле глицина и 0,21 г/моле азотной кислоты, что составляет 5,90 г азота.
Объем отходящего из реактора газа составил 17,7 литра, а доля газообразного азота в нем - 19,8%, то есть 4,38 г газообразного азота. Степень денитрификации, таким образом, 74,2%.
Пример 3. Эксперимент, демонстрирующий, что простое нагревание раствора глицина не дает существенной денитрификации, был проведен в соответствии с процедурой, описанной в примере 1, добавлением 15,8 г глицина к 300 г воды. 15,8 г (0,21 г/моль) глицина содержат 2, 95 г азота. Объем отходящего из реактора газа составил 4,1 л, а доля азота в нем - 1,5%, то есть 0,077 г газообразного азота. Степень денитрификации, следовательно, 2,6%.
Эта степень денитрифакации (2,6%) глицина, достигаемая нагреванием в отсутствии окислителя (азотной кислоты) намного меньше степени денитрификации (74,2%), достигаемой в присутствии азотной кислоты в качестве окислителя.
Пример 4. Эксперимент по подтверждению того, что денитрификация пиридина (C5H5N) проходит в водных условиях при температуре 350oC или ниже, был проведен в соответствии с процедурой, описанной в примере 1. Пиридин в количестве 15,8 г (0,20 г/моль) вместе с азотной кислотой (HNO3) в количестве 56,0 мл 70%-ной кислоты (0,878 г/моль) добавлении к 285 г воды. Так как реакция происходила в избытке пиридина, выход газообразного азота в реакции 3 определялся количеством азота в 0,878 г/моль азотной кислоты и 0,878/5 г (0,176 г/моль) пиридина, то есть в общем 14,76 г азота.
Объем отходящего из реактора газа составил 34,0 л, а для газообразного азота в нем - 21,1%, то есть 11,5 г газообразного азота. Степень денитрификации, следовательно, 77,9%.
Пример 5. Эксперимент, демонстрирующий, что процесс нагревания раствора пиридина не дает существенной денитрификации, был проведен в соответствии с процедурой, описанной в примере 1. Пиридин в количестве 15,8 г добавили к 285 г воды. 15,8 г (0,20 г/моль) пиридина содержат 2,80 г азота. Объем отходящего из реактора газа составил 7,5 л, а доля азота в нем - 1,4% объема, то есть 0,13 г газообразного азота. Степень денитрификации, таким образом, 4,6%.
Степень денитрификации пиридина (4,6%), достигаемая нагреванием в отсутствии окислителя (азотной кислоты), намного меньше достигаемой в присутствии азотной кислоты в качестве окислителя (77,9%).
Эти примеры иллюстрируют значительную денитрификацию соединений азота, которая может быть достигнута уравновешиванием восстановленных форм азота с такими окисленными формами, как азотная кислота, и нагреванием до температуры реакции. Однако 100% денитрификация достигается только в примере 1. Ограничение денитрификации в других примерах обусловлено присутствием углерода. Таким образом, в предпочтительном варианте углерод может быть удален до того, как будет выполнено приведение в равновесие и нагревание, что позволит достигнуть 100% денитрификации.
Несмотря на то что существует множество методов денитрификации соединений, содержащих азот, только сжигание и бактериальная обработка были пригодны для удаления азота из различных азотных соединений. Представленное изобретение предлагает третий способ денитрификации разнообразных соединений азота. Этот способ обладает такими неоспоримыми преимуществами, как быстрота процесса, средняя температура операции, меньшее количество оборудования и отсутствие потребности в катализаторе. Процесс может проводится как в емкости, отдельной от других промышленных процессов, так и вместе с ними ( например, вместе с окислением влажным воздухом). В результате предлагаемого процесса образуется азот, диоксид углерода, метан и кислород, которые могут быть сброшены в атмосферу, гидроксиды, которые могут подвергаться дальнейшей переработке, и спирты и углеводы, которые можно отделить. В то время как ряд аспектов данного изобретения здесь не представлен, очевидно, что они не ограничивают область изобретения, изложенную в приведенной формуле изобретения.
Реферат
Изобретение относится к удалению различных азотсодержащих соединений из водной фазы. Для осуществления способа проводят идентификацию типа азотсодержащих соединений, присутствующих в водных отходах, определение их концентраций, приведение в равновесие окисленной и восстановленной форм азота добавлением соответствующего реагента и нагревание смеси до заданной температуры реакции примерно от 300oC до 600oC, с выделением менее вредных газообразных азота, кислорода, гидроксидов, спиртов и углеводородов. Нагревание осуществляют под давлением, достаточным для поддержания потока в жидкой или надкритической фазе. При уравновешивании окисленной и восстановленной форм азота добавляют соединение из группы, включающей водород, сульфид водорода, пероксид водорода и перманганат калия в количестве, эквивалентном половине мольной доли азотсодержащего соединения. Способ предлагает извлечение азотсодержащего соединения, выбранного из группы, включающей ионы аммония, амид-ионы, амиды, амины, аминокислоты, аммиак, нитропроизводные, азосоединения, глицин, пиридин, азотную кислоту, нитриты и нитраты. 27 з.п. ф-лы.

Комментарии