Пестицидно активные полициклические производные с серосодержащими заместителями - RU2738359C2
Код документа: RU2738359C2
Описание
Настоящее изобретение относится к пестицидно активным, в частности к инсектицидно активным полициклическим производным с серосодержащими заместителями, к промежуточным соединениям для получения данных соединений, к композициям, содержащим данные соединения, и к их применению для контроля животных-вредителей (в том числе членистоногих и, в частности, насекомых или представителей отряда Acarina).
Гетероциклические соединения с пестицидным действием известны и описаны, например, в WO 2012/086848 и WO 2013/018928.
В настоящее время были обнаружены новые пестицидно активные полициклические кольцевые производные с серосодержащими фенил- и пиридил-заместителями.
Настоящее изобретение относится, соответственно, к соединениям формулы (I),

где
А представляет собой СН или N;
Q представляет собой фенил, который может быть моно- или полизамещенным заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-С4галогеналкила, C1-C4галогеналкокси, C1-C4алкокси, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, C1-C4галогеналкилсульфонила и -C(O)C1-С4галогеналкила; или
Q представляет собой пяти-десятичленную моноциклическую или конденсированную бициклическую кольцевую систему, соединенную посредством атома углерода с кольцом, которое содержит группу А, при этом указанная кольцевая система может быть ароматической, частично насыщенной или полностью насыщенной и содержит 1-4 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы, при условии, что каждая кольцевая система не может содержать более 2 атомов кислорода и более 2 атомов серы, при этом указанная пяти-десятичленная кольцевая система может быть моно- или полизамещенной заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-C4галогеналкила, C1-C4галогеналкокси, С1-С4алкокси, C1-C4алкилсульфанила, C1-C4алкилсульфинила, C1-C4алкилсульфонила, -C(O)C1-C4алкила, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, С1-С4галогеналкилсульфонила и -C(O)C1-C4 галогеналкила; или
Q представляет собой пяти-шестичленную, ароматическую, частично насыщенную или полностью насыщенную кольцевую систему, соединенную посредством атома азота с кольцом, которое содержит группу А, при этом указанная кольцевая система может быть моно- или полизамещенной заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-C4галогеналкила, C1-C4галогеналкокси, C1-C4алкокси, C1-C4алкилсульфанила, C1-C4алкилсульфинила, C1-C4алкилсульфонила, -C(O)C1-C4алкила, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, C1-C4галогеналкилсульфонила и -C(O)С1-С4галогеналкила; и при этом указанная кольцевая система содержит 1, 2 или 3 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы, при условии, что указанная кольцевая система не может содержать более одного атома кислорода и более одного атома серы;
или Q представляет собой С3-С6циклоалкил или С3-C6циклоалкил, моно- или полизамещенный заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-C4галогеналкила, C3-C6циклоалкила и фенила, причем фенильная группа может быть моно- или полизамещенной заместителями, выбранными из группы, состоящей из галогена, циано, гидроксикарбонила, амидокарбонила, C1-C4алкила, C1-C4галогеналкила, C1-C4галогеналкокси, C1-C4алкокси, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, С1-С4галогеналкилсульфонила и -C(O)C1-C4галогеналкила;
или Q представляет собой С2-С6алкенил или С2-С6алкенил, моно- или полизамещенный заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-С4галогеналкила, С3-С6циклоалкила и фенила, причем указанная фенильная группа может быть моно- или полизамещенной заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-C4галогеналкила, C1-C4галогеналкокси, С1-С4алкокси, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, C1-C4галогеналкилсульфонила и -С(O)С1-С4галогеналкила;
или Q представляет собой C2-C6алкинил или C2-C6алкинил, моно- или полизамещенный заместителями, выбранными из группы, состоящей из галогена, циано, С1-С4алкила, С1-С4галогеналкила, C3-C6циклоалкила, три(C1-C4алкил)силила и фенила, причем указанная фенильная группа может быть моно- или полизамещенной заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-C4галогеналкила, C1-C4галогеналкокси, С1-С4алкокси, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, C1-С4галогеналкилсульфонила и -C(O)C1-C4галогеналкила;
или Q представляет собой C1-C4алкил, который может быть моно- или полизамещенным заместителями, выбранными из группы, состоящей из галогена, циано, С3-С6циклоалкила, C1-C4галогеналкокси, С1-С4алкокси, С1-С4сульфанила, С1-С4алкилсульфинила, C1-сульфонила и -С(O)C1-C4алкила;
X представляет собой S, SO или SO2;
R1 представляет собой С1-С4алкил, C1-C4галогеналкил, C3-C6циклоалкил, C3-C6циклоалкил-C1-C4алкил; или
R1 представляет собой C3-C6циклоалкил-C1-C4алкил, моно- или полизамещенный заместителями, выбранными из группы, состоящей из галогена, циано и C1-С4алкила; или
R1 представляет собой С2-С6алкенил, С2-С6галогеналкенил или С2-С6алкинил;
R2 представляет собой галоген, циано, С1-C6галогеналкил или C1-С6галогеналкил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из гидроксила, метокси и циано; или
R2 представляет собой C1-C4галогеналкилсульфанил, C1-C4галогеналкилсульфинил, C1-С4галогеналкилсульфонил, O(C1-C4галогеналкил) или -С(O)C1-C4галогеналкил; или
R2 представляет собой C3-C6циклоалкил, который может быть моно- или полизамещенным заместителями, выбранными из группы, состоящей из галогена, циано и C1-C4алкила;
X1 представляет собой CR3, где R3 представляет собой водород, C1-C4алкил, С2-С6алкенил, С2-С6алкинил, C1-C4алкокси-C1-C4алкил или С3-С6циклоалкил;
и к агрохимически приемлемым солям, стереоизомерам, энантиомерам, таутомерам и N-оксидам данных соединений.
Соединения формулы I, которые содержат по меньшей мере один основный центр, способны образовывать, например, соли присоединения кислоты, например, с сильными неорганическими кислотами, такими как минеральные кислоты, например, хлорная кислота, серная кислота, азотная кислота, фосфорная кислота или галогенводородная кислота, с сильными органическими карбоновыми кислотами, такими как C1-C4алканкарбоновые кислоты, которые являются незамещенными или замещенными, например, галогеном, например, уксусная кислота, такими как насыщенные или ненасыщенные дикарбоновые кислоты, например, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая или фталевая кислота, такими как гидроксикарбоновые кислоты, например, аскорбиновая кислота, молочная кислота, яблочная кислота, винная кислота или лимонная кислота, или такими как бензойная кислота, либо с органическими сульфокислотами, такими как С1-С4алкан- или арилсульфоновые кислоты, которые являются незамещенными или замещенными, например, галогеном, например, метан- или п-толуолсульфоновая кислота. Соединения формулы I, которые содержат по меньшей мере одну кислотную группу, способны образовывать, например, соли с основаниями, например минеральные соли, такие как соли щелочных металлов или соли щелочноземельных металлов, например, соли натрия, калия и магния, или соли с аммиаком или органическим амином, таким как морфолин, пиперидин, пирролидин, низший моно-, ди- или триалкиламин, например, этил-, диэтил-, триэтил- или диметилпропиламин, либо низший моно-, ди- или тригидроксиалкиламин, например, моно-, ди- или триэтаноламин.
Алкильные группы, которые встречаются в определениях заместителей, могут быть с прямой цепью или разветвленными и представлять собой, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, пентил, гексил и их разветвленные изомеры. Алкилсульфанильные, алкилсульфинильные, алкилсульфонильные, алкокси-, алкенильные и алкинильные радикалы получают из упомянутых алкильных радикалов. Алкенильные и алкинильные группы могут быть моно- или полиненасыщенными. C1-диалкиламино представляет собой диметиламино.
Галоген, как правило, представляет собой фтор, хлор, бром или йод. Это также применимо, соответственно, к галогену в комбинации с другими значениями, такими как галогеналкил или галогенфенил.
Галогеналкильные группы предпочтительно характеризуются длиной цепи от 1 до 6 атомов углерода. Галогеналкил представляет собой, например, фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, 2,2,2-трифторэтил, 2-фторэтил, 2-хлорэтил, пентафторэтил, 1,1-дифтор-2,2,2-трихлорэтил, 2,2,3,3-тетрафторэтил и 2,2,2-трихлорэтил.
Алкокси представляет собой, например, метокси, этокси, пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси, а также изомерные радикалы пентилокси и гексилокси.
Алкоксиалкильные группы предпочтительно характеризуются длиной цепи от 1 до 6 атомов углерода.
Алкоксиалкил представляет собой, например, метоксиметил, метоксиэтил, этоксиметил, этоксиэтил, н-пропоксиметил, н-пропоксиэтил, изопропоксиметил или изопропоксиэтил.
Алкоксикарбонил представляет собой, например, метоксикарбонил (который представляет собой С1алкоксикарбонил), этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, трет-бутоксикарбонил, н-пентоксикарбонил или гексоксикарбонил.
Циклоалкильные группы предпочтительно содержат от 3 до 6 атомов углерода в кольце, например, циклопропил, циклобутил, циклопентил и циклогексил.
В контексте настоящего изобретения, примерами пяти - шестичленной, ароматической, частично насыщенной или полностью насыщенной кольцевой системы, которая соединена посредством атома азота с кольцом, которое содержит группу A, являются пиразол, пиррол, пирролидин, пирролидин-2-он, пиперидин, морфолин, имидазол, триазол и пиридин-2-он.
В контексте настоящего изобретения "моно- или полизамещенный" в определении заместителей означает, как правило, в зависимости от химической структуры заместителей, от монозамещенного до семикратно замещенного, предпочтительно от монозамещенного до пятикратно замещенного, более предпочтительно моно-, двух- или трехзамещенный.
Соединения формулы I согласно настоящему изобретению также включают гидраты, которые могут быть образованы в ходе солеобразования.
В предпочтительной группе соединений формулы I
Q представляет собой фенил, который может быть моно- или полизамещенным заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, С1-С4галогеналкила, С1-С4галогеналкокси, C1-C4алкокси, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, C1-C4галогеналкилсульфонила и -C(O)C1-C4галогеналкила; или
Q представляет собой пяти - десятичленную моноциклическую или конденсированную бициклическую кольцевую систему, соединенную посредством атома углерода с кольцом, которое содержит группу А, при этом указанная кольцевая система может быть ароматической, частично насыщенной или полностью насыщенной и содержит 1-4 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы, при условии, что каждая кольцевая система не может содержать более 2 атомов кислорода и более 2 атомов серы, при этом указанная пяти - десятичленная кольцевая система может быть моно- или полизамещенной заместителями, независимо выбранными из группы, состоящей из галогена, циано, С1-С4алкила, С1-С4галогеналкила, С1-С4галогеналкокси, C1-C4алкокси, C1-C4алкилсульфанила, С1-С4алкилсульфинила, C1-C4алкилсульфонила, -С(O)C1-C4алкила, C1-С4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, С1-С4галогеналкилсульфонила и -С(O)C1-C4галогеналкила; или
Q представляет собой пяти-шестичленную, ароматическую, частично насыщенную или полностью насыщенную кольцевую систему, соединенную посредством атома азота с кольцом, которое содержит группу А, при этом указанная кольцевая система может быть моно- или полизамещенной заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-C4галогеналкила, C1-C4галогеналкокси, C1-C4алкокси, C1-C4алкилсульфанила, C1-C4алкилсульфинила, C1-C4алкилсульфонила, -С(O)С1-С4алкила, C1-C4галогеналкилсульфанила, С1-С4галогеналкилсульфинила, С1-C4галогеналкилсульфонила и
-С(O)С1-С4галогеналкила; и при этом указанная кольцевая система содержит 1, 2 или 3 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы, при условии, что указанная кольцевая система не может содержать более одного атома кислорода и более одного атома серы;
или Q представляет собой C3-C6циклоалкил или C3-C6циклоалкил, моно- или полизамещенный заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-C4галогеналкила, C3-C6циклоалкила и фенила, причем фенильная группа может быть моно- или полизамещенной заместителями, выбранными из группы, состоящей из галогена, циано, С1-С4алкила, C1-C4галогеналкила, C1-C4галогеналкокси, C1-C4алкокси, C1-C4галогеналкилсульфанила, C1-С4галогеналкилсульфинила, C1-C4галогеналкилсульфонила и -С(O)C1-C4галогеналкила; или
Q представляет собой С2-С6алкенил или С2-С6алкенил, моно- или полизамещенный заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, С1-С4галогеналкила, C3-C6циклоалкила и фенила, причем фенильная группа может быть моно- или полизамещенной заместителями, выбранными из группы, состоящей из галогена, циано, С1-С4алкила, C1-C4галогеналкила, C1-C4галогеналкокси, C1-C4алкокси, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, C1-C4галогеналкилсульфонила и -С(O)C1-C4галогеналкила; или
Q представляет собой С2-С6алкинил или С2-С6алкинил, моно- или полизамещенный заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-C4галогеналкила, C3-C6циклоалкила, три(С1-С4алкил)силила и фенила, причем фенильная группа может быть моно- или полизамещенной заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-C4галогеналкила, C1-С4галогеналкокси, C1-C4алкокси, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, С1-С4галогеналкилсульфонила и -С(O)C1-С4галогеналкила.
В предпочтительном варианте осуществления настоящего изобретения пяти-десятичленная моноциклическая или конденсированная бициклическая гетерокольцевая система, которая может быть ароматической, частично насыщенной или полностью насыщенной и содержит 1-4 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы, при условии, что каждая кольцевая система не может содержать более 2 атомов кислорода и более 2 атомов серы, или трех-десятичленная, моноциклическая или конденсированная бициклическая кольцевая система, которая может быть ароматической, частично насыщенной или полностью насыщенной; выбрана из группы, состоящей из
пирролила, пиразолила, изоксазолила, фуранила, тиенила, имидазолила, оксазолила, тиазолила, изотиазолила, триазолила, оксадиазолила, тиадиазолила, тетразолила, фурила, пиридила, пиримидила, пиразинила, пиридазинила, триазинила, пиранила, хиназолинила, изохинолинила, индолизинила, изобензофуранилнафтиридинила, хиноксалинила, циннолинила, фталазинила, бензотиазолила, бензоксазолила, бензотриазолила, индазолила, индолила, (1Н-пиррол-1-ил)-, (1Н-пиррол-2-ил)-, (1Н-пиррол-3-ил)-, (1Н-пиразол-1-ил)-, (1H-пиразол-3-ил)-, (3Н-пиразол-3-ил)-, (1Н-пиразол-4-ил)-, (3-изоксазолил)-, (5-изоксазолил)-, (2-фуранил)-, (3-фуранил)-, (2-тиенил)-, (3-тиенил)-, (1Н-имидазол-2-ил)-, (1Н-имидазол-4-ил)-, (1H-имидазол-5-ил)-, (2-оксазол-2-ил)-, (оксазол-4-ил)-, (оксазол-5-ил)-, (тиазол-2-ил)-, (тиазол-4-ил)-, (тиазол-5-ил)-, (изотиазол-3-ил)-, (изотиазол-5-ил)-, (1Н-1,2,3-триазол-1-ил)-, (1Н-1,2,4-триазол-3-ил)-, (4Н-1,2,4-триазол-4-ил)-, (1Н-1,2,4-триазол-1-ил)-(1,2,3-оксадиазол-2-ил)-, (1,2,4-оксадиазол-3-ил)-, (1,2,4-оксадиазол-4-ил)-, (1,2,4-оксадиазол-5-ил)-, (1,2,3-тиадиазол-2-ил)-, (1,2,4-тиадиазол-3-ил)-, (1,2,4-тиадиазол-4-ил)-, (1,3,4-тиадиазол-5-ил)-, (1Н-тетразол-1-ил)-, (1Н-тетразол-5-ил)-, (2Н-тетразол-5-ил)-, (2-пиридил)-, (3-пиридил)-, (4-пиридил)-, (2-пиримидинил)-, (4-пиримидинил)-, (5-пиримидинил)-, (2-пиразинил)-, (3-пиридазинил)-, (4-пиридазинил)-, (1,3,5-триазин-2-ил)-, (1,2,4-триазин-5-ил)-, (1,2,4-триазин-6-ил)-, (1,2,4-триазин-3-ил)-, (фуразан-3-ил)-, (2-хинолинил)-, (3-хинолинил)-, (4-хинолинил)-, (5-хинолинил)-, (6-хинолинил)-, (3-изохинолинил)-, (4-изохинолинил)-, (2-хинозолинил)-, (2-хиноксалинил)-, (5-хиноксалинил)-, (пиридо[2,3-b]пиразин-7-ил)-, (бензоксазол-5-ил)-, (бензотиазол-5-ил)-, (бензо[b]тиен-2-ил)- и (бензо[1,2,5]оксадиазол-5-ил)-, индолинила и тетрагидрохинолинила.
Предпочтительно Q представляет собой фенил, который может быть моно- или полизамещенным заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-C4галогеналкила, C1-C4галогеналкокси, C1-C4алкокси, С1-С4галогеналкилсульфанила, С1-С4алогеналкилсульфинила, C1-C4галогеналкилсульфонила и -С(O)C1-С4галогеналкила; или
Q представляет собой пяти-десятичленную моноциклическую или конденсированную бициклическую кольцевую систему, соединенную посредством атома углерода с кольцом, которое содержит группу А, при этом указанная кольцевая система может быть ароматической, частично насыщенной или полностью насыщенной и содержит 1-4 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы, при условии, что каждая кольцевая система не может содержать более 2 атомов кислорода и более 2 атомов серы, при этом указанная пяти-десятичленная кольцевая система может быть моно- или полизамещенной заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-С4галогеналкила, C1-C4галогеналкокси, C1-C4алкокси, C1-C4алкилсульфанила, C1-C4алкилсульфинила, C1-C4алкилсульфонила, -С(O)C1-C4алкила, C1-С4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, C1-C4галогеналкилсульфонила и -С(O)C1-C4галогеналкила; или
Q представляет собой пяти-шестичленную, ароматическую, частично насыщенную или полностью насыщенную кольцевую систему, соединенную посредством атома азота с кольцом, которое содержит группу А, при этом указанная кольцевая система может быть моно- или полизамещенной заместителями, выбранными из группы, состоящей из галогена, циано, С1-С4алкила, C1-C4галогеналкила, C1-C4галогеналкокси, C1-C4алкокси, C1-C4алкилсульфанила, C1-C4алкилсульфинила, C1-C4алкилсульфонила, -С(O)С1-С4алкила, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, С1-С4галогеналкилсульфонила и
-С(O)С1-С4 галогеналкила; и при этом указанная кольцевая система содержит 1, 2 или 3 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы, при условии, что указанная кольцевая система не может содержать более одного атома кислорода и более одного атома серы.
В предпочтительных соединениях формулы I Q выбран из группы, состоящей из J-1 - J-47:

где каждая группа J-1 - J-47 является моно-, ди- или тризамещенной Rx, где каждый Rx независимо выбран из группы, состоящей из водорода, галогена, циано, С1-С4алкила, C1-C4галогеналкила, C1-C4галогеналкокси, C1-C4алкокси, С1-C4алкилсульфанила, C1-C4алкилсульфинила, С1-С4алкилсульфонила, -С(O)C1-C4алкила, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, C1-С4галогеналкилсульфонила и -С(O)C1-C4галогеналкила, и R001 представляет собой водород или С1-С2алкил, предпочтительно водород.
Дополнительная предпочтительная группа соединений формулы I представлена соединениями формулы I-1,

где R2 и Q являются такими, как определено под формулой I выше; и где Xa1 представляет собой S, SO или SO2; Ra1 представляет собой метил, этил, н-пропил, изопропил или циклопропилметил; и агрохимически приемлемыми солями, стереоизомерами, энантиомерами, таутомерами и N-оксидами таких соединений. В этой предпочтительной группе соединений формулы I-1 R2 предпочтительно представляет собой C1-С4галогеналкил, Xa1 предпочтительно представляет собой SO2 и Ra1 предпочтительно представляет собой этил. В этой предпочтительной группе соединений формулы I Q выбран из группы, состоящей из J-1 - J-47, более предпочтительно J-1 - J42 (где стрелка обозначает точку присоединения заместителей к радикалу Q):

где каждая группа J-1 - J-47 является моно-, ди- или тризамещенной Rx, где каждый Rx независимо выбран из группы, состоящей из водорода, галогена, циано, C1-C4алкила, С1-C4галогеналкила, C1-C4галогеналкокси, C1-C4алкокси, С1-С4алкилсульфанила, С1-С4алкилсульфинила, C1-C4алкилсульфонила, -С(O)C1-C4алкила, C1-C4галогеналкилсульфанила, С1-С4галогеналкилсульфинила, C1-С4галогеналкилсульфонила и -С(O)C1-C4галогеналкила, и R001 представляет собой C1-С2алкил. В другом варианте осуществления настоящего изобретения R001 представляет собой водород.
Дополнительная предпочтительная группа соединений формулы I представлена соединениями формулы I-2,

где R2 и Q являются такими, как определено под формулой I выше; и где Ха2 представляет собой S, SO или SO2; Ra2 представляет собой метил, этил, н-пропил, изопропил или циклопропилметил; и агрохимически приемлемыми солями, стереоизомерами, энантиомерами, таутомерами и N-оксидами таких соединений. В этой предпочтительной группе соединений формулы I-2 R2 предпочтительно представляет собой C1-С4галогеналкил, Ха2 предпочтительно представляет собой SO2 и Ra2 предпочтительно представляет собой этил.
Особенно предпочтительные соединения формулы I представлены соединениями формулы Ia-1,
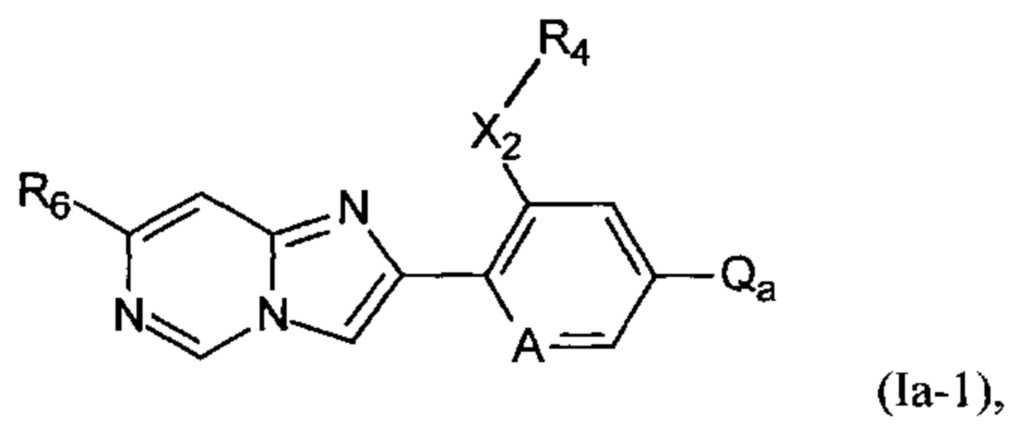
где
А представляет собой СН или N;
Х2 представляет собой S или SO2;
R4 представляет собой C1-C4алкил;
R6 представляет собой C1-C4галогеналкил; и
Qa выбран из группы, состоящей из заместителей:

где каждая предпочтительная группа Qa является моно-, ди- или тризамещенной Rx, где каждый Rx независимо выбран из группы, состоящей из водорода, галогена, циано, C1-C4алкила, С1-С4галогеналкила, C1-C4галогеналкокси, C1-C4алкокси, C1-С4алкилсульфанила, C1-С4алкилсульфинила, C1-C4алкилсульфонила, -С(O)C1-C4алкила, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, C1-C4галогеналкилсульфонила и -С(O)C1-C4галогеналкила.
В указанных предпочтительных соединениях формулы I-1 Qa предпочтительно является моно- или дизамещенным Rx, причем каждый Rx предпочтительно независимо выбран из группы, состоящей из водорода, галогена, C1-C4алкила, C1-C4галогеналкила, C1-C4алкокси и C1-C4галогеналкокси, и R001 представляет собой водород или C1-С2алкил, предпочтительно R001 представляет собой С1-С2алкил. В другом варианте осуществления настоящего изобретения в формуле Ia-1 R001 представляет собой водород. В конкретных предпочтительных соединениях Qa выбран из группы, состоящей из заместителей:

Еще более предпочтительные соединения формулы I представлены соединениями формулы Iа-2,
где

А представляет собой СН или N;
Х4 представляет собой SO2;
R7 представляет собой C1-C4алкил;
R8 представляет собой C1-C4галогеналкил; и
Qb предпочтительно выбран из группы, состоящей из заместителей:

где каждый Rx независимо выбран из группы, состоящей из водорода, галогена, циано, С1-С4алкила, С1-С4галогеналкила, C1-C4галогеналкокси, C1-C4алкокси, C1-C4алкилсульфанила, C1-C4алкилсульфинила, C1-C4алкилсульфонила, -С(O)C1-C4алкила, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, C1-C4галогеналкилсульфонила и -С(O)C1-C4галогеналкила. В особенно предпочтительных соединениях Qb выбран из группы, состоящей из заместителей:

В указанных предпочтительных соединениях формулы Ia-2 Rx, в особенности, выбран из группы, состоящей из водорода, циано, галогена, C1-C4алкила, С1-С4галогеналкила, С1-С4алкокси и C1-C4галогеналкокси; в частности, из водорода, галогена, С1-С4алкила, С1-С4галогеналкила, C1-C4алкокси и С1-С4галогеналкокси.
Особенно предпочтительная группа соединений формулы I представлена соединениями формулы Iа-3,

где
А представляет собой СН или N;
R9 представляет собой С1-С4алогеналкил;
R10 представляет собой водород или С1-С2алкил, и Qc выбран из группы, состоящей из заместителей:

где Rx выбран из группы, состоящей из водорода, галогена, циано, C1-C4алкила, C1-C4галогеналкила, С1-С4алкокси и C1-C4галогеналкокси, в частности, из водорода, галогена, C1-C4алкила, C1-C4галогеналкила, C1-C4алкокси и C1-C4галогеналкокси. В указанных предпочтительных соединениях формулы Ia-3 Rx предпочтительно независимо выбран из группы, состоящей из водорода, циано, C1-C4галогеналкила и галогена.
В каждом из соединений формул I-1, I-2, Ia-1 и Ia-2 Q наиболее предпочтительно представляет собой J-0a, J-0c, J-30b или J43c

где Rx представляет собой водород, галоген, циано или C1-C4алкил, C1-C4галогеналкил.
В примечательных соединениях формулы I
X1 представляет собой СН;
X представляет собой SO2;
А представляет собой СН или N;
R1 представляет собой C1-C4алкил;
R2 представляет собой C1-C4галогеналкил и
Q представляет собой пиразолил, который может быть монозамещенным С1-С4галогеналкилом, или представляет собой фенил, который может быть моно- или дизамещенным заместителями, выбранными из группы, состоящей из С1-С4галогеналкила, галогена, C1-C4алкилсульфанила, циано и C1-C4галогеналкокси; или представляет собой пиримидинил; или представляет собой C3-C6циклоалкил, который может быть монозамещенным циано; или представляет собой С2-С6алкенил; или представляет собой C1-C4галогеналкил, который может быть замещенным циано.
Способ получения соединений формулы I согласно настоящему изобретению осуществляют с помощью способов, известных специалистам в данной области. Соединения формулы I, где R2, R1, X, X1, А и Q являются такими, как определено для формулы I, можно получать (как показано на схеме 1) посредством реакции Сузуки, которая предусматривает, например, проведение реакции соединений формулы II, где Xb1 представляет собой уходящую группу, такую как, например, хлор, бром или йод, или арил- или алкилсульфонат, такой как трифторметансульфонат, с соединениями формулы IIIа, где Vb1 может представлять собой функциональную группу на основе бора, как например B(OH)2 или B(ORb1)2, где Rb1 может представлять собой С1-С4алкильную группу, или две группы ORb1 могут образовывать вместе с атомом бора пятичленное кольцо, как например сложный пинаколиновый эфир бороновой кислоты. Реакцию можно катализировать с помощью катализатора на основе палладия, например, тетракис(трифенилфосфин)палладия или (1,1'-бис(дифенилфосфино)ферроцен)дихлорпалладий-дихлорметана (комплекс 1:1), в присутствии основания, такого как карбонат натрия или фторид цезия, в растворителе или в смеси растворителей, такой как, например, смесь 1,2-диметоксиэтана и воды или диоксана и воды, предпочтительно в инертной атмосфере. Температура реакции предпочтительно может находиться в диапазоне от температуры окружающей среды до температуры кипения реакционной смеси. Такие реакции Сузуки хорошо известны специалистам в данной области и были рассмотрены, например, в J. Orgmet. Chem. 576, 1999, 147-168.
Схема 1

В качестве альтернативы, соединения формулы I можно получать с помощью реакции Стилле соединений формулы IIIb, где Yb2 представляет собой производное триалкилолова, предпочтительно три-н-бутилолово, с соединениями формулы II. Такие реакции Стилле обычно проводят в присутствии палладиевого катализатора, например, тетракис(трифенилфосфин)палладия(0) или (1,1'-бис(дифенилфосфино)-ферроцен)дихлорпалладий-дихлорметана (комплекс 1:1), в инертном растворителе, таком как DMF, ацетонитрил или диоксан, необязательно в присутствии добавки, такой как фторид цезия или хлорид лития, и необязательно в присутствии дополнительного катализатора, например йодида меди(I). Такие реакции сочетания Стилле также хорошо известны специалистам в данной области и были описаны, например, в J. Org. Chem., 2005, 70, 8601-8604, J. Org. Chem., 2009, 74, 5599-5602, и Angew. Chem. Int. Ed., 2004, 43, 1132-1136.
Соединения формулы I, где Q представляет собой азотсодержащую гетероциклическую систему, и X, X1, R1, R2 и А являются такими, как определено для формулы I, можно получать из соединений формулы II, где X, X1, R1, R2 и А являются такими, как определено для формулы I, и Xb1 представляет собой уходящую группу, такую как хлор, бром или йод, или арил- или алкилсульфонат, такой как трифторметансульфонат, посредством проведения реакции с гетероциклом Q (который содержит соответствующую функциональную NH-группу), в присутствии основания, такого как K2CO3 или Cs2CO3, необязательно в присутствии медного катализатора, например йодида меди(I) в инертном растворителе, таком как N-метилпирролидинон или DMF, при температурах 30-150°C. Реакция проиллюстрирована для гетероцикла J-30b на схеме 2, что обеспечивает получение соединений формулы Iаа, где R2, R1, X, X1, А и Rx являются такими, как ранее определено.
Схема 2

Соединения формулы I также можно получать (как показано на схеме 3) посредством реакции Сузуки, как описано выше, которая предусматривает проведение реакции соединений формулы IV с соединениями формулы V, где Xb2 может представлять собой галоген, предпочтительно хлор, бром или йод, или сульфонат, такой как, например, трифторметансульфонат, и Yb3 может представлять собой функциональную группу на основе бора, как например B(OH)2 или B(ORb2)2, где Rb2 может представлять собой C1-C4алкильную группу или две группы ORb2 могут образовывать вместе с атомом бора пятичленное кольцо, как например сложный пинаколиновый эфир бороновой кислоты. В формуле IV A, X1, R1, R2 и X являются такими, как описано для формулы I. Реакцию можно катализировать с помощью катализатора на основе палладия, например, тетракис(трифенилфосфин)палладия, в присутствии основания, такого как карбонат натрия, в растворителе или в смеси растворителей, такой как, например, смесь 1,2-диметоксиэтана и воды, предпочтительно в инертной атмосфере. Температура реакции предпочтительно может находиться в диапазоне от температуры окружающей среды до температуры кипения реакционной смеси.
Схема 3

Подобным образом, соединения формулы I можно получать с помощью реакции сочетания Стилле (схема 3) соединений формулы V с соединениями формулы VI, где R1, R2, X1, А, X являются такими, как описано выше, и Yb4 представляет собой производное триалкилолова, предпочтительно три-н-бутилолово, в условиях, описанных для схемы 1.
Соединения формулы I-b3, где A, R1, R2, X1 и Q имеют значения, определенные в формуле I, и X представляет собой -SO2-, можно получать посредством окисления соединений формулы I-b2, где A, R1, R2, и X1 имеют значения, определенные в формуле I, и X представляет собой -SO- (как показано на схеме 4). Реакцию можно осуществлять с помощью реагентов, таких как например перкислота, такая как перуксусная кислота или м-хлорпербензойная кислота, или гидропероксид, такой как, например, пероксид водорода или трет-бутилгидропероксид, или неорганический окислитель, такой как монопероксодисульфатная соль или перманганат калия. Подобным образом, соединения формулы I-b2, где A, R1, R2 и X1 имеют значения, определенные в формуле I, и X представляет собой -SO-, можно получать посредством окисления соединений формулы I-b1, где A, R1, R2, X1 и Q имеют значения, определенные в формуле I, и X представляет собой -S-, в условиях, аналогичных описанным выше. Данные реакции можно осуществлять в различных органических или водных растворителях, совместимых с этими условиями, при температурах от ниже 0°C до температуры кипения системы растворителей. Преобразование соединений формулы 1-b1 в соединения формул 1-b2 и 1-b3 представлено на схеме 4. Реакции можно осуществлять постадийным образом через соединения формулы I-b2. Специалистам в данной области будет понятно, что таким образом можно контролировать прохождение реакции (в зависимости от количества добавленного окислителя, температуры и продолжительности реакции) для обеспечения выделения соединений формулы I-b2. Соединения формулы I-b1 можно получать (схема 4) посредством проведения реакции соединения формулы VII с соединением формулы VIIIa, где A, R1, R2 и X1 имеют значения, определенные в формуле I, и X представляет собой серу, и М представляет собой катион металла или неметалла. На схеме 4, подразумевают, что катион М является одновалентным, но можно также рассматривать поливалентные катионы, связанные с более чем одной S-R1-группой. Предпочтительными катионами являются, например, литий, натрий, калий или цезий. Для успешного осуществления этого преобразования Хb3 представляет собой уходящую группу, такую как, например, фтор, хлор, бром или йод, или арил- или алкилсульфонат, но можно также рассматривать ряд других уходящих групп (например, NO2). Реакцию можно осуществлять в растворителе, предпочтительно в апротонном растворителе, при температурах ниже 0°C или не выше температуры кипения реакционной смеси.
Схема 4

Соединения формулы VII, где Хb3 представляет собой уходящую группу, такую как, например, фтор, хлор, бром или йод, или арил- или алкилсульфонат, такой как трифторметансульфонат, или любую другую подобную уходящую группу, можно получать (схема 5) посредством проведения реакции соединений формулы V с соединениями формулы VIII, где Хb3 может представлять собой галоген, предпочтительно хлор, бром или йод, или сульфонат, такой как, например, трифторметансульфонат, наиболее предпочтительно бром или йод, и Yb5 может представлять собой функциональную группу на основе бора, как например B(ОН)2 или B(ORb4)2, где Rb4 может представлять собой C1-C4алкильную группу или две группы ORb4 могут образовывать вместе с атомом бора пятичленное кольцо, как например сложный пинаколиновый эфир бороновой кислоты. В формулах VIII и V A, X1, R2 и Q являются такими, как описано для формулы I. Реакцию можно катализировать с помощью катализатора на основе палладия, например, тетракис(трифенилфосфин)палладия, в присутствии основания, такого как карбонат натрия, в растворителе или в смеси растворителей, такой как, например, смесь 1,2-диметоксиэтана и воды, предпочтительно в инертной атмосфере. Температура реакции предпочтительно может находиться в диапазоне от температуры окружающей среды до температуры кипения реакционной смеси. Подобным образом, соединения формулы VII можно получать из соединений формулы X, где А, X1, R2 и Xb3 являются такими, как ранее определено, и Yb6 представляет собой производное триалкилолова, предпочтительно три-н-бутилолово, с соединениями формулы V, в условиях, описанных для таковых, описанных для химических реакций, показанных на схеме 1.
Схема 5

В качестве альтернативного пути, показанного на схеме 6, соединения формулы VII также можно получать посредством проведения реакции соединений формулы X, где Хb3 и Хb4 представляют собой уходящие группы, например, фтор, хлор, бром или йод, или арил- или алкилсульфонат, такой как трифторметансульфонат, или любую другую подобную уходящую группу, с соединениями формулы IIIа (реакция Сузуки) или IIIb (реакция Стилле). Химическую реакцию проводят аналогично реакциям, рассматриваемым для схемы 1.
Схема 6

Дополнительный путь получения соединений формулы II, соответственно II-с1, предусматривает проведение реакции соединений формулы X с соединениями формулы VIIIa, как показано на схеме 7.
Схема 7

На схеме 7 соединения формулы X вводят в реакцию с соединениями формулы VIIIa с получением соединений формулы II-с1 согласно условиям, описанным для схемы 4, что в зависимости от условий, известных специалистам в данной области, обеспечит образование соединений формул II-с2 и II-c3. Особенно предпочтительно в таких реакциях иметь в распоряжении соединения формулы X с Xb3, представляющим собой фтор или нитро, для обеспечения селективного введения -SR1-группы. Соединения формулы I также можно получать согласно химическим реакциям, показанным на схеме 8.
Схема 8
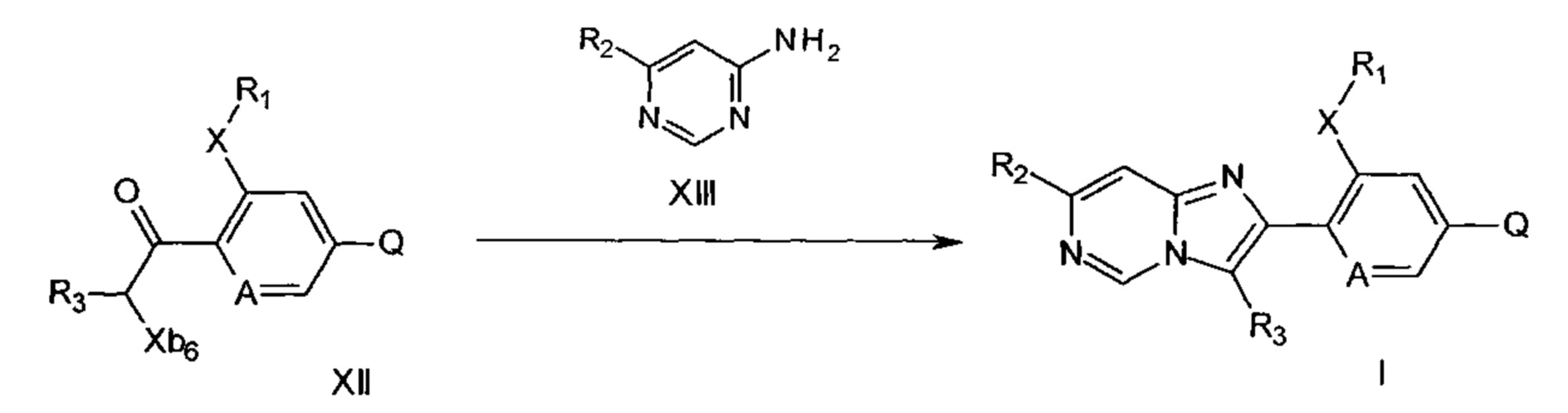
На схеме 8, соединения формулы XIII, где R2 является таким, как описано для формулы I, вводят в реакцию с соединениями формулы XII, где Хb6 представляет собой галоген, и Q, X, A, R1 и R3 являются такими, как определено выше, в инертном растворителе, например, в этаноле или ацетонитриле, необязательно в присутствии подходящего основания при температурах 80-150°C с получением соединений формулы I. Необязательно реакцию можно проводить в микроволновой печи, необязательно в микроволновой печи, с получением соединений формулы I. Такие реакции хорошо описаны в литературе, например, в WO 2012/49280 или WO 03/031587. Дополнительный способ получения соединений формулы I предусматривает проведение реакции соединения формулы XIII с соединением формулы XIV,

в присутствии кислоты Льюиса, такой как йодид цинка(II) или трифлат индия(III), в инертном растворителе, таком как хлорбензол или 1,2-дихлорбензол, с каталитической солью меди(II), такой как ацетат Cu(II), в атмосфере кислорода или воздуха, при температурах 100-180°C, предпочтительно 110-140°C, с получением соединений формулы I, где R3 представляет собой водород. Такие реакции были ранее описаны в литературе (см. Adv. Synth. Catal. 2013, 355, 1741-1747, и J. Org. Chem., 2013, 78, 12494-12504). Галогенирование соединений формулы I, где R3 представляет собой водород, с помощью галогенирующего средства, такого как N-хлорсукцинамид, N-бромсукцинамид или N-йодсукцинамид, в полярном апротонном растворителе, таком как ацетонитрил или диметилформамид, при температуре окружающей среды, приводит к получению соединений формулы I-u,

где Q, R1, R2, X и А являются такими, как описано для формулы (I), и Xb7 представляет собой галоген. Соединения формулы I-u можно вводить в реакцию с соединениями R3-Yb7, где Yb7 представляет собой функциональную группу на основе бора, как например В(ОН)2 или B(ORb4)2, где Rb4 может представлять собой C1-C4алкильную группу или две группы ORb4 могут образовывать вместе с атомом бора пятичленное кольцо, как например сложный пинаколиновый эфир бороновой кислоты, в присутствии палладиевого катализатора с получением соединений формулы I-u1, где R1, R2, R3, А, X и Q являются такими, как определено для формулы I. Реакцию обычно проводят в присутствии основания, например, карбоната калия, карбоната цезия или фосфата калия, в инертном растворителе, таком как диоксан, необязательно в присутствии воды, с катализатором на основе палладия(0), например, тетракис(трифенилфосфин)палладия, при температуре 80-120°C. Такие реакции Сузуки хорошо описаны в литературе, см. например Masuda, Naoyuki et al., WO 2012133607. Химические реакции проиллюстрированы на схеме 9.
Схема 9

Соединения формул XII и XIV можно получать из соединений формулы XVI с помощью, например, способов, показанных на схеме 10.
Схема 10
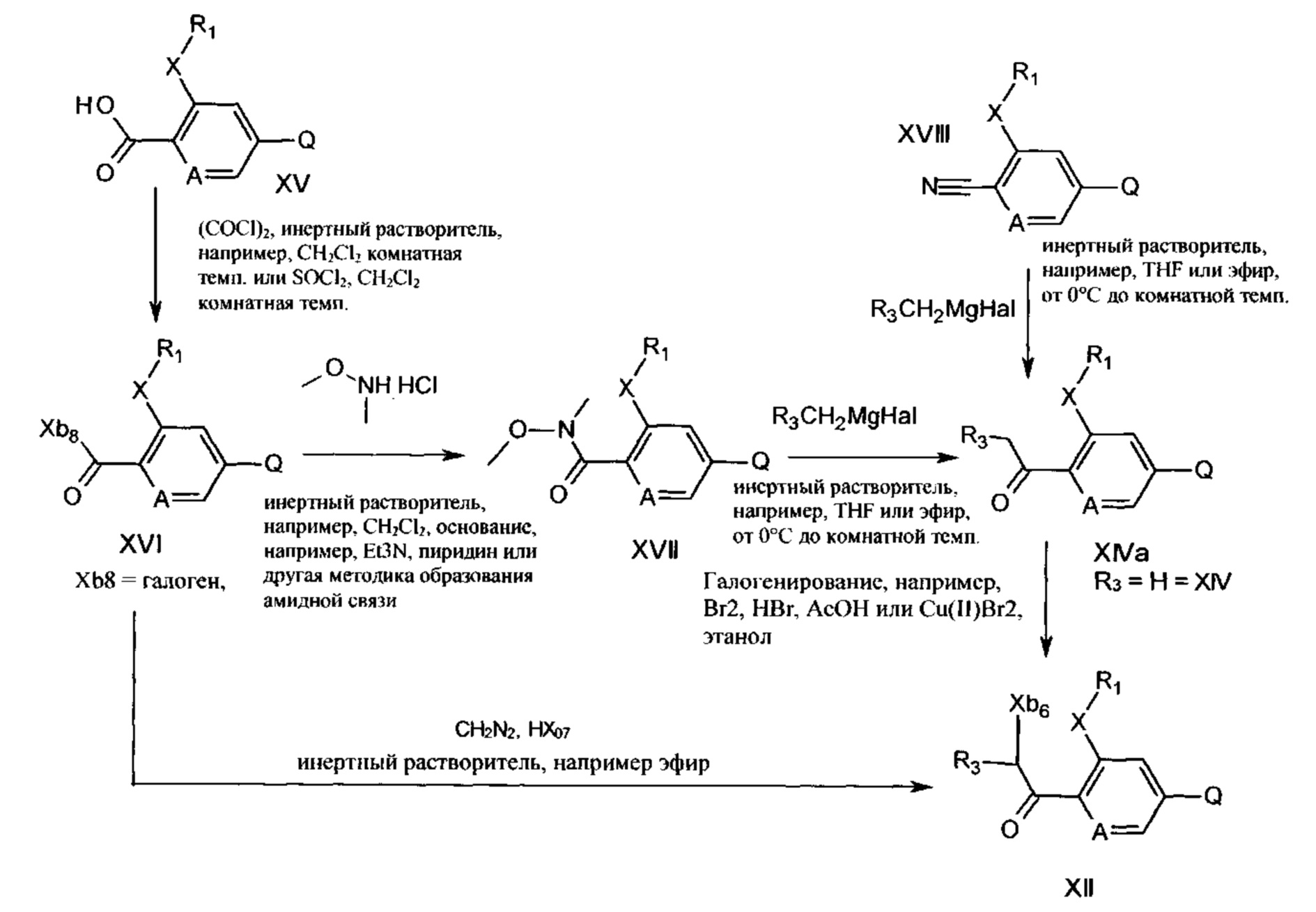
На схеме 10 ацилгалогенид формулы XVI (легко получаемый из соединений формулы XV с помощью способов, известных специалистам в данной области) превращают в амид Вайнреба XVII посредством введения в реакцию с N,О-диметилгидроксиламином с помощью способов, описанных, например, в С. Ferri, "Reaktionen der Organischen Synthese", Georg Thieme Verlag, Stuttgart, 1978, page 223ff. Затем амид Вайнреба формулы XVII вводят в реакцию с реагентом Гриньяра формулы R3CH2MgHal согласно способу Вайнреба (Tetrahedron Letters 1981, 22, 3815-3818) с получением соединений формул XIVa и XIV. Соединения формул XIVa и XIV также можно получать посредством обработки нитрильных соединений формулы XVIII, где Q, X, R1 и А являются такими, как описано для формулы I, с помощью реактива Гриньяра формулы R3CH2MgHal, с последующим кислотным гидролизом (как описано в С. Ferri, "Reaktionen der Organischen Synthese", Georg Thieme Verlag, Stuttgart, 1978, page 223ff.).
Соединения формулы XIII,

где R2 представляет собой C2-C3галогеналкил или C1галогеналкилсульфанил, являются новыми, специально разработанными для получения соединений формулы I по настоящему изобретению и, таким образом, представляют собой дополнительную цель настоящего изобретения.
Соединения формулы Z0,

где R01 представляет собой C1-C4алкил, C3-C6циклоалкил или C3-C6циклоалкил-C1-C4алкил;
R1a представляет собой C1-C4алкил, гидрокси, C1-C4алкокси или C1-C4 галогеналкил; и А представляет собой азот или СН, являются новыми, специально разработанными для получения соединений формулы I по настоящему изобретению и, таким образом, представляют собой дополнительную цель настоящего изобретения.
Соединения формул XIVa и XIV можно галогенировать до соединений формулы XII с помощью, например, смесей брома и бромистоводородной кислоты в уксусной кислоте (как описано в Phosphorus, Sulfur and Silicon and the Related Elements, 2013, 188(12), 1835-1844) или с помощью, например, бромида меди(II) в инертном растворителе, например, в хлороформе, этилацетате и т.п., как описано в J. Med. Chem., 2013, 56(1), 84-96. В качестве альтернативы, соединения формулы XII, где R3 представляет собой водород, можно получать непосредственно из соединений формулы XVI посредством обработки диазометаном или триметилсилилдиазометаном и последующей обработки галогенводородной кислотой, например, бромистоводородной кислотой или хлористоводородной кислотой, в инертном растворителе, таком как диэтиловый эфир. Такие процедуры хорошо известны в литературе, например см. Eu. J. Med. Chem., 1987, 22(5), 457-62 и WO 2009010455.
Соединения формулы XV можно получать (как показано на схеме 11) посредством сложноэфирного гидролиза соединений формулы XX, где А, Xb3 и R1 являются такими, как ранее определено, и R11 представляет собой C1-С6алкил, с помощью способов, известных специалистам в данной области, например, посредством обработки основанием щелочноземельного металла, такого как гидроксид лития, как правило, в воде с достаточно смешивающимся органическим растворителем, например, THF или ацетоном, для растворения соединений формулы XX. Соединения XX можно получать посредством реакции Сузуки, которая предусматривает, например, проведение реакции соединений формулы XIX, где Xb3 представляет собой уходящую группу, такую как, например, хлор, бром или йод, или арил- или алкилсульфонат, такой как трифторметансульфонат (особенно предпочтительными являются таковые, где Vb1 представляет собой атом фтора или брома), с соединениями формулы IIIа, где Vb1 может представлять собой функциональную группу на основе бора, как например В(ОН)2 или B(ORb1)2, где Rb1 может представлять собой C1-C4алкильную группу или две группы ORb1 могут образовывать вместе с атомом бора пятичленное кольцо, как например сложный пинаколиновый эфир бороновой кислоты. Реакцию можно катализировать с помощью катализатора на основе палладия, например, тетракис(трифенилфосфин)палладия или (1,1'-бис(дифенилфосфино)ферроцен)дихлорпалладий-дихлорметана (комплекс 1:1), в присутствии основания, такого как карбонат натрия или фторид цезия, в растворителе или в смеси растворителей, такой как, например, смесь 1,2-диметоксиэтана и воды или диоксана и воды, предпочтительно в инертной атмосфере. Температура реакции предпочтительно может находиться в диапазоне от температуры окружающей среды до температуры кипения реакционной смеси. Такие реакции Сузуки хорошо известны специалистам в данной области и были рассмотрены, например, в J. Orgmet. Chem. 576, 1999, 147-168.
Схема 11

В качестве альтернативы, соединения формулы XX можно получать с помощью реакции Стилле соединений формулы IIIb, где Yb2 представляет собой производное триалкилолова, предпочтительно три-н-бутилолово, с соединениями формулы XIX. Такие реакции Стилле обычно проводят в присутствии палладиевого катализатора, например, тетракис(трифенилфосфин)палладия(0) или (1,1'-бис(дифенилфосфино)-ферроцен)дихлорпалладий-дихлорметана (комплекс 1:1), в инертном растворителе, таком как DMF, ацетонитрил или диоксан, необязательно в присутствии добавки, такой как фторид цезия или хлорид лития, и необязательно в присутствии дополнительного катализатора, например йодида меди(I). Такие реакции сочетания Стилле также хорошо известны специалистам в данной области и были описаны, например, в J. Org. Chem., 2005, 70, 8601-8604, J. Org. Chem., 2009, 74, 5599-5602, и Angew. Chem. Int. Ed., 2004, 43, 1132-1136.
Очень подобным образом, соединения формулы Xa аналогично можно получать, как показано на схеме 12, с применением процедур и стратегий, аналогичных описанным для схемы 8.
Схема 12

Промежуточные соединения, необходимые для синтеза соединений формулы XXI, можно получать с помощью химических реакций, аналогичных показанным на схеме 10 и проиллюстрированным далее снова на схеме 13.
Схема 13

Большое количество соединений формулы V являются коммерчески доступными или могут быть получены специалистами в данной области. Можно применять ряд химических преобразований, хорошо известных специалистам в данной области, для получения производных бороновой кислоты формулы IIIа, исходя из различных и легкодоступных исходных веществ, как например, цитируя лишь несколько (схема 13), удаление водорода из гетероароматического соединения формулы V, где Vb2 представляет собой водород, с помощью сильного основания (стадия А), такого как бутиллитий, или диизопропиламид лития, или (i-PrMgCl. LiCl), с последующей реакцией металлированного промежуточного соединения формулы IIIc, где Zh2 представляет собой металл, такой как Li+ или MgCl+, например, с, например, триалкилборатом (стадия В) или хлоридом три-н-бутилолова (стадия В). Другой способ получения металлоорганического промежуточного соединения формул IIIа или IIIb заключается в получении соединения формулы IIIс, которое получают посредством реакции обмена металл-галоген соединения формулы V с металлоорганическими соединениями (стадия С), с применением, например, бутиллития или магнийорганического соединения, или непосредственного металлирования с помощью металла, такого как магний.
Введение пинаколборатной функциональной группы посредством катализированной палладием реакции с биспинаколдибораном или гекса-н-бутилдистаннаном, в соединение формулы V, где Xb2 с, представляет собой другую общепринятую стратегию (схема 13, стадия D). В соединениях формул IIIа и IIIb на схеме 13 Q имеет значение, определенное для формулы I. Специалист в данной области сможет выбрать подходящий способ получения для получения соединений формул IIIа и IIIb, в зависимости от значений Q.
Схема 13

Соединения формулы IV, где А, X, X1, R1 и R2 являются такими, как описано для формулы I, можно получать из соединений формулы II (схема 14), где А, X, Х1, R1 и R2 являются такими, как описано для формулы I. Фактически, соединения формулы II, где Xb1 представляет собой хлор, бром или йод, можно обрабатывать металлоорганическими соединениями, такими как, например, бутиллитий или магнийорганическое соединение, с образованием промежуточного соединения формулы II-а, где Zb3 является таким, как определено на схеме, посредством проведения реакции обмена металл-галоген. Эту реакцию предпочтительно осуществляют в безводном апротонном растворителе, таком как THF, при низкой температуре (от -120°C до 0°C), предпочтительно от -110°C до -60°C). Промежуточное металлоорганическое соединение формулы II-а предпочтительно непосредственно превращают в соединение формулы IV посредством проведения реакции с боронатным соединением В(ORb2)3, где Rb2 представляет собой C1-C4алкильную группу. В зависимости от природы бороната, условий обработки в ходе осуществления реакции и условий дополнительной обработки, может образоваться бороновая кислота IV, где Yb3 представляет собой -В(ОН)2, или диалкилборонат IV, где Yb3 представляет собой -B(ORb2)2.
Схема 14

Введение пинаколборатной функциональной группы посредством катализированной палладием реакции с биспинаколдибораном в соединение формулы II, где Xb1 представляет собой хлор, бром, йод или трифлат, представляет собой другую общепринятую стратегию (схема 14). В соединениях формулы II на схеме 14 A, R1, R2, X и X1 имеют значения, определенные для формулы I, и Xb1 представляет собой хлор, бром, фтор, йод или трифлат. Специалист в данной области сможет выбрать подходящий способ получения для получения соединений формулы IIа из соединений формулы II, в зависимости от значений A, R1, R2, X и X1.
С помощью аналогичных химических реакций, показанных на схеме 14, можно получать соединения формулы VIII из соединений формулы X (схема 15).
Схема 15

Очень подобные способы получения, описанные для схем 14 и 15, можно применять для синтеза промежуточных соединений формул IX и VI, но в данном случае вместо применения бороновых соединений, например, формулы В(ОRb2)3, как известно специалистам в данной области, применяют соединения олова формулы (н-бутил)3SnCl (как описано, например, в Eu. J. Chem., 4098-4104, 20, 2014) или вместо биспинаколдиборана применяют гексабутилолово (как описано, например, в Eur. Pat. Appl., 2749561, 2014). Для соединений VI это проиллюстрировано на схеме 16.
Схема 16

Конкретный вариант соединений формулы I представлен соединениями формулы I-c, где A, R1, R2, X и X1 являются такими, как описано для формулы I, и Q представляет собой 1-алкинильную группу со структурой -C≡C-Qd:

где Qd представляет собой водород, галоген, циано, C1-C4алкил, C1-C4галогеналкил, С3-С6циклоалкил, три(C1-C4алкил)силил или фенил или представляет собой фенил, который может быть моно- или полизамещенным заместителями, выбранными из группы, состоящей из галогена, циано, С1-С4алкила, C1-C4галогеналкила, C1-С4галогеналкокси, C1-C4алкокси, C1-C4галогеналкилсульфанила, C1-C4галогеналкилсульфинила, C1-C4галогеналкилсульфонила и -С(O)C1-C4галогеналкила. Соединения формулы I-c можно получать, например, посредством проведения реакции соединений формулы II с концевыми алкинами формулы H-C≡C-Qd (схема 17), где Xb1 может представлять собой галоген, предпочтительно хлор, бром или йод, или сульфонат, такой как, например, трифторметансульфонат. В формуле II и H-C≡C-Qd, А, X, X1, R1, R2 и Qd являются такими, как описано выше для формулы I-c. Данный тип реакции хорошо известен специалисту в данной области и обычно описан как реакция кросс-сочетания Соногаширы. В данной реакции замещенный ароматический компонент формулы II вводят в реакцию с концевым алкином формулы H-C≡C-Qd в присутствии соли меди(I), такой как CuI, предпочтительно в каталитическом количестве, и в присутствии катализатора на основе палладия, например дихлорида бис(трифенилфосфин)палладия или (1,1'-бис(дифенилфосфино)ферроцен)дихлорпалладий-дихлорметана (комплекс 1:1), предпочтительно в каталитическом количестве, и в присутствии основания, такого как третичный амин, например, триэтиламин или основание Хунига (N,N-диизопропилэтиламин), предпочтительно в эквивалентном количестве или в избытке. Реакцию можно осуществлять в амине в качестве растворителя или можно применять другой совместимый растворитель в качестве разбавителя, как например эфир, такой как тетрагидрофуран. Лучше всего осуществлять реакцию в инертной атмосфере и она может протекать при температурах в диапазоне от ниже 0°C до температуры кипения реакционной смеси.
Схема 17

Дополнительный конкретный пример соединений формулы I представлен соединениями формулы I-d,
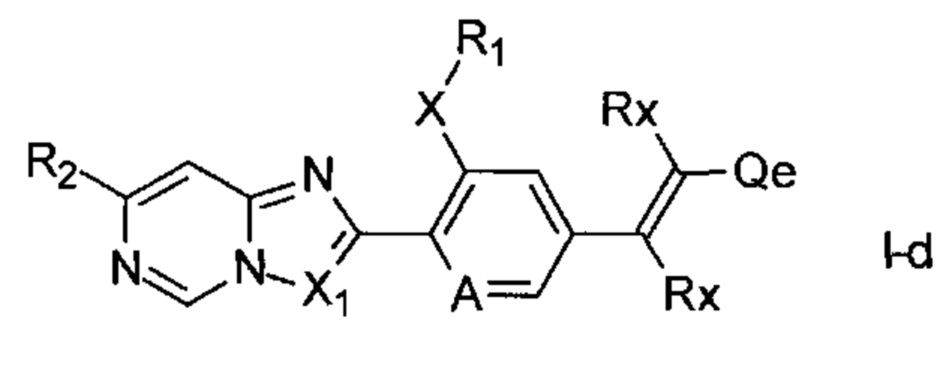
где Rx является таким, как описано выше, и Qe представляет собой водород, галоген, циано, C1-C4алкил, C1-C4галогеналкил, C3-C6циклоалкил или представляет собой фенил, который может быть моно- или полизамещенным заместителями, выбранными из группы, состоящей из галогена, циано, C1-C4алкила, C1-C4галогеналкила, С1-С4галогеналкокси, C1-C4алкокси, C1-C4галогеналкилсульфанила, C1-С4 галогеналкилсульфинила, C1-C4галогеналкилсульфонила и -С(O)C1-C4галогеналкила. Соединения формулы I-d можно получать, например, посредством проведения реакции соединений формулы II с концевыми алкенами формулы CH(RX)=C(RX)-Qe (схема 18), где Xb1 может представлять собой галоген, предпочтительно хлор, бром или йод, или сульфонат, такой как, например, трифторметансульфонат. В формуле II и CH(RX)=C(RX)-Qe А, X, X1, R1, R2 и Qe являются такими, как описано выше для формулы I-d. Данный тип реакции хорошо известен специалисту в данной области и обычно описан как реакция кросс-сочетания Хека.
Схема 18

В данной реакции замещенный ароматический компонент формулы II вводят в реакцию с концевым алкином формулы CH(RX)=C(RX)-Qe в присутствии палладиевого катализатора, необязательно в присутствии лиганда и основания в растворителе (например диметилформамид) при повышенных температурах. Катализатор может представлять собой, например, тетракис(трифенилфосфин)палладий(0), хлорид палладия или ацетат палладия(II). Лиганд может представлять собой, например, трифенилфосфин или BINAP, и основание может представлять собой, например, триэтиламин, карбонат калия или ацетат натрия. Такие реакции хорошо известны в литературе и были описаны, например, в Chem. Rev. 100 (8): 3009-3066. 2000. Образованные соединения могут характеризоваться стереохимической транс-конфигурацией, показанной на схеме 18, но в зависимости от условий реакции, специалист в данной области также может получить соединения формулы I-d с цис-конфигурацией двойной связи.
Соединения формулы I-d можно дополнительно обработать до соединений формулы 1-е (схема 19) посредством циклопропанирования, например, с помощью диазометана в присутствии палладиевого катализатора (например, Pd(OAc)2 (например, как описано в J. Org. Chem., 1980, 45, 695 и Synthesis, 1981, 714) или посредством образования цинк-карбенового комплекса в ходе реакции Симмонса-Смита (см. Org. React. 1973, 20, page 1). Специалисты в данной области поймут, что существует много других способов циклопропанировать двойные связи.
Схема 19

Соединения формулы I, где Q представляет собой C3-C6циклоалкил, моно- или полизамещенный заместителями, выбранными из группы, состоящей из галогена, циано, гидроксикарбонила, амидокарбонила, C1-C4галогеналкила и фенила, можно получать с помощью описанных выше способов. В особенном случае соединений формулы I, где Q представляет собой циклоалкил, замещенный циано и C1-С4галогеналкилом, соединения можно получать с помощью способов, показанных на схеме 20.
Схема 20
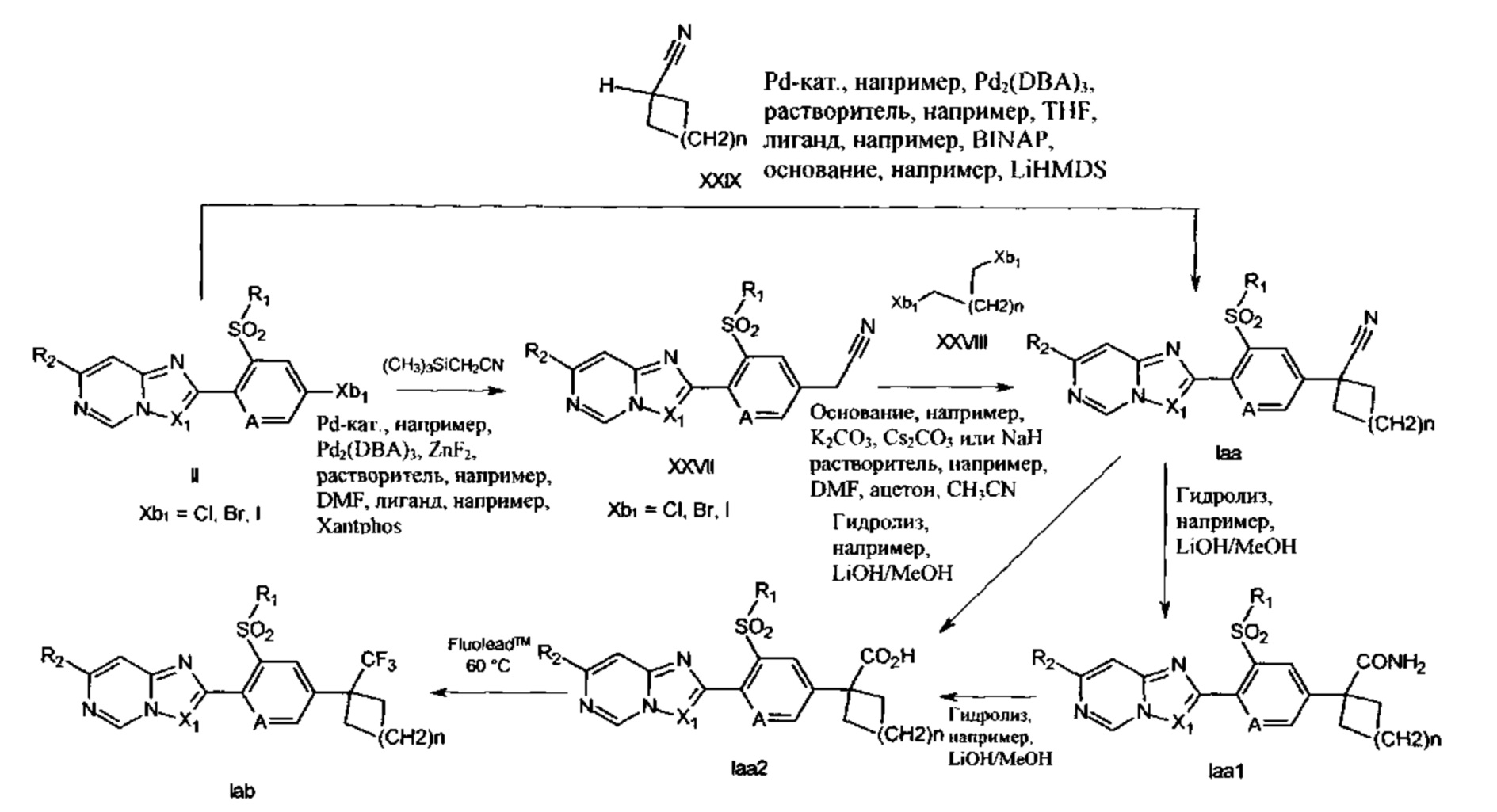
Как показано на схеме 20, обработка соединений формулы II, где X представляет собой SO2, с помощью триметилсилил-ацетонитрила, в присутствии фторида цинка(II) и катализатора на основе палладия(0), такого как аддукт трис(дибензилиденацетон)дипалладия(0)-хлороформа (Pd2(dba)3), лиганда, например, Xantphos, в инертном растворителе, таком как DMF, при температурах 100-160°C, необязательно при микроволновом нагревании приводит к получению соединений формулы XXVII. Такие химические реакции были описаны в литературе, например, в Org. Lett., 16(24), 6314-6317; 2014. Соединения формулы XXVII можно обрабатывать соединениями формулы XXVIII, где n равняется 1, 2 или 3, в присутствии основания, такого как гидрид натрия, K2CO3 или Cs2CO3, в инертном растворителе, таком как DMF, ацетон или ацетонитрил, с получением соединений формулы Iаа. В качестве альтернативы, соединения формулы Iаа можно получать непосредственно из соединений формулы II посредством обработки соединениями формулы XXIX, где n равняется 1, 2 или 3, в присутствии Pd2(dba)3, лиганда, такого как BINAP, сильного основания, такого как LiHMDS, в инертном растворителе, таком как THF при температурах 40-70°C. Такие химические реакции были описаны, например, в J. Am. Chem. Soc., 127(45), 15824-15832; 2005. Соединения формулы Iaa можно превращать в соединения формул Iaa1 и Iаа2 посредством основного гидролиза, как известно специалистам в данной области. Соединения формулы Iаа3, где Q представляет собой С1-С6алкил, замещенный циано и галогеном, можно получать из соединений формулы Iaa посредством обработки с помощью источника атомов галогена, например, Cu(II)Br2, Br2 или HBr, в инертном растворителе, например, EtOH или уксусной кислоте (схема 21).
Схема 21

В качестве альтернативы, соединения формулы Iaa можно получать, как показано на схеме 22.
Схема 22

Как показано на схеме 22, применяемые химические реакции идентичны таковым, описанным для схемы 20, лишь субстраты для реакций являются различными. Следовательно, реакция ранее описанного соединения ХIХа с TMS-ацетонитрилом, как описано для схемы 20, приводит к получению соединений формулы ХХа. Реакция соединений формулы ХХа с реагентом Гриньяра R3CH2MgHal приводит к получению соединений формулы XIVb. Их можно превращать в соединения формулы XXVII с помощью химических реакций, описанных для схемы 8. Соединения формулы XIVb можно вводить в реакцию с соединениями формулы XXVIII с получением соединений формулы XIVc, как описано vide supra. Соединения формулы XIVc можно превращать в соединения формулы Iаа с помощью химических реакций, аналогичных описанным для схемы 8.
Промежуточные соединения формулы XIII известны в литературе или их можно получать из известных специалистам в данной области соединений. Соединения формулы XIII, где R2 представляет собой C1-С2галогеналкил, С1галогеналкилсульфанил, С1галогеналкилсульфинил, С1галогеналкилсульфонил или C3-C6циклоалкил, можно получать, как показано на схеме 20.
Схема 23

Как показано на схеме 23, реакция известного соединения ХШа с (Phen)CuCF3 или (Phen)Cu CF2CF3 в инертном растворителе, таком как DMF или NMP, при температурах 50-120°C приводит к получению соединений формул XIIIb и XIIIс соответственно. Такие реакции хорошо описаны в литературе, см., например, Angew. Chem. Int. Ed. 2011, 50, 3793, и Org. Lett. 2014, 16, 1744 (R2 представляет собой CF3), и Angew. Chem. Int. Ed. 2012, 51, 536 (R2 представляет собой CF2CF3). Соединения формулы XIIIа можно превращать в соединения формулы XIIId посредством обработки йодистоводородной кислотой, необязательно в присутствии йодида натрия, как известно специалистам в данной области и как описано, например, в Bio. Med.Chem., 15(4), 1586-1605, 2007. Реакция соединений формулы XIIId с (bpy)CuSCF3 в инертном растворителе, таком как DMF или NMP, при температурах 50-120°C приводит к получению соединений формулы XIIIf. Такие реакции ранее были описаны в литературе, например, в Angew. Chem. Int. Ed. 2013, 52, 1548-1552. Соединения формулы XIIIf можно дополнительно окислять до соединений формул XIIIg и XIIIh посредством окисления, например, с помощью МСРВА или с помощью других способов, известных специалистам в данной области. Соединения формулы XIII, где R2 представляет собой C3-C6циклоалкил, можно получать из соединений формулы ХIIIа или XIIId с помощью реакций Сузуки с соединением формулы R2B(OH)2 или реакций Стилле с соединениями формулы R2Sn(n-Bu)3. Реакции Сузуки и Стилле являются общими реакциями, которые уже обсуждались в данной заявке, а также хорошо известны специалистам в данной области.
Существует большое количество подходящих известных стандартных способов для получения всех дополнительных соединений формулы I, функционализированных согласно определениям R1, R2, Q, X1 и Х2, например, алкилирование, галогенирование, ацилирование, амидирование, оксимирование, окисление и восстановление, доступны реакции сочетания С-С и С-гетероатома, катализируемые металлами (например, палладием, медью и никелем), выбор подходящих способов получения зависит от свойств (реакционной способности) заместителей в промежуточных соединениях. Реагенты можно вводить в реакцию в присутствии основания. Примерами подходящих оснований являются гидроксиды щелочных металлов или щелочноземельных металлов, гидриды щелочных металлов или щелочноземельных металлов, амиды щелочных металлов или щелочноземельных металлов, алкоксиды щелочных металлов или щелочноземельных металлов, ацетаты щелочных металлов или щелочноземельных металлов, карбонаты щелочных металлов или щелочноземельных металлов, диалкиламиды щелочных металлов или щелочноземельных металлов или алкилсилиламиды щелочных металлов или щелочноземельных металлов, алкиламины, алкилендиамины, свободные или N-алкилированные насыщенные или ненасыщенные циклоалкиламины, основные гетероциклы, гидроксиды аммония и карбоциклические амины. Примерами, которые можно упомянуть, являются гидроксид натрия, гидрид натрия, амид натрия, метоксид натрия, ацетат натрия, карбонат натрия, трет-бутоксид калия, гидроксид калия, карбонат калия, гидрид калия, диизопропиламид лития, бис(триметилсилил)амид калия, гидрид кальция, триэтиламин, диизопропилэтиламин, триэтилендиамин, циклогексиламин, N-циклогексил-N,N-диметиламин, N,N-диэтиланилин, пиридин, 4-(N,N-диметиламино)пиридин, хинуклидин, N-метилморфолин, гидроксид бензилтриметиламмония и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU).
Реагенты можно вводить в реакцию друг с другом как таковые, т.е. без добавления растворителя или разбавителя. Однако в большинстве случаев преимущественным является добавление инертного растворителя, или разбавителя, или их смеси. Если реакцию проводят в присутствии основания, то основания, которые применяют в избытке, такие как триэтиламин, пиридин, N-метилморфолин или N,N-диэтиланилин, могут также выступать в качестве растворителей или разбавителей.
Реакцию преимущественно проводят при температуре в диапазоне от примерно -80°C до примерно +140°C, предпочтительно от примерно -30°C до примерно +100°C, во многих случаях в диапазоне от температуры окружающей среды до примерно +80°C.
Соединение формулы I можно превращать известным способом per se в другое соединение формулы I посредством замещения одного или нескольких заместителей исходного соединения формулы I традиционным способом другим(другими) заместителем(заместителями) согласно настоящему изобретению.
В зависимости от выбора условий реакции и исходных веществ, которые являются подходящими в каждом случае, можно, например, на одной стадии реакции заменить только один заместитель на другой заместитель согласно настоящему изобретению или можно заменить несколько заместителей на другие заместители согласно настоящему изобретению на одной стадии реакции.
Соли соединений формулы I можно получать известным способом per se. Следовательно, например, соли присоединения кислоты соединений формулы I получают посредством обработки подходящей кислотой или подходящим ионообменным реагентом, а соли с основаниями получают посредством обработки подходящим основанием или подходящим ионообменным реагентом.
Соли соединений формулы I можно превращать традиционным способом в свободные соединения I, соли присоединения кислоты, например, посредством обработки подходящим основным соединением или подходящим ионообменным реагентом, а соли с основаниями, например, посредством обработки подходящей кислотой или подходящим ионообменным реагентом.
Соли соединений формулы I можно превращать способом, известным per se, в другие соли соединений формулы I, соли присоединения кислот, например, в другие соли присоединения кислот, например, посредством обработки соли неорганической кислоты, например, гидрохлорида, подходящей солью металла и кислоты, такой как соль натрия, бария или серебра, например, ацетатом серебра, в подходящем растворителе, в котором неорганическая соль, которая образуется, например, хлорид серебра, является нерастворимой и, таким образом, осаждается из реакционной смеси.
В зависимости от процедуры или условий реакции соединения формулы I, которые обладают солеобразующими свойствами, можно получать в свободной форме или в форме солей.
Соединения формулы I и, при необходимости, их таутомеры, в каждом случае в свободной форме или в форме соли, могут присутствовать в форме одного из возможных изомеров или в виде их смеси, например, в форме чистых изомеров, таких как антиподы и/или диастереомеры, или в виде смесей изомеров, таких как смеси энантиомеров, например, рацематов, смесей диастереомеров или смесей рацематов в зависимости от числовой, абсолютной или относительной конфигурации асимметричных атомов углерода, которые находятся в молекуле, и/или в зависимости от конфигурации неароматических двойных связей, которые находятся в молекуле; настоящее изобретение относится к чистым изомерам, а также ко всем возможным смесям изомеров, и его следует понимать в каждом случае выше и ниже в этом смысле, даже если стереохимические подробности не были упомянуты конкретно в каждом случае.
Смеси диастереомеров или смеси рацематов соединений формулы I, в свободной форме или в форме соли, которые могут быть получены в зависимости от того, какие исходные вещества и процедуры были выбраны, могут быть разделены известным способом на чистые диастереомеры или рацематы на основе физико-химических различий компонентов, например, с помощью фракционной кристаллизации, дистилляции и/или хроматографии.
Смеси энантиомеров, такие как рацематы, которые можно получать аналогичным способом, можно разделять на оптические антиподы с помощью известных способов, например, с помощью перекристаллизации из оптически активного растворителя, с помощью хроматографии на хиральных адсорбентах, например, высокоэффективной жидкостной хроматографии (HPLC) на ацетилцеллюлозе, с помощью подходящих микроорганизмов, путем расщепления специфичными иммобилизованными ферментами, посредством образования соединений включения, например, с использованием хиральных краун-эфиров, где только один энантиомер участвует в образование комплекса, или посредством превращения в диастереомерные соли, например, путем проведения реакции рацемата основного конечного продукта с оптически активной кислотой, такой как карбоновая кислота, например камфорная, винная или яблочная кислота, или сульфоновая кислота, например камфорсульфоновая кислота, и разделения смеси диастереомеров, которая может быть получена таким образом, например, путем фракционной кристаллизации, основываясь на их разной растворимости, с получением диастереомеров, из которых необходимый энантиомер может быть высвобожден под действием подходящих средств, например основных средств.
Чистые диастереомеры или энантиомеры можно получать согласно настоящему изобретению не только путем разделения подходящих смесей изомеров, но также с помощью общеизвестных способов диастереоселективного или энантиоселективного синтеза, например, посредством осуществления способа согласно настоящему изобретению с исходными веществами с подходящей стереохимической конфигурацией.
N-оксиды можно получать посредством проведения реакции соединения формулы I с подходящим окислителем, например, аддуктом H2O2/мочевина, в присутствии ангидрида кислоты, например, ангидрида трифторуксусной кислоты. Такие реакции окисления известны из литературы, например, из J. Med. Chem., 32 (12), 2561-73, 1989 или WO 00/15615.
Преимущественным является выделение или синтез в каждом случае биологически более эффективного изомера, например, энантиомера или диастереомера, или смеси изомеров, например, смеси энантиомеров или смеси диастереомеров, если отдельные компоненты характеризуются различной биологической активностью.
Соединения формулы I и, при необходимости, их таутомеры, в каждом случае в свободной форме или в форме соли, могут быть, если необходимо, также получены в форме гидратов и/или могут включать другие растворители, например, которые могли быть использованы для кристаллизации соединений, присутствующих в твердой форме.
Соединения согласно следующим ниже таблицам 1-6 можно получить согласно способам, описанным выше. Следующие примеры предназначены для иллюстрации настоящего изобретения и показывают предпочтительные соединения формулы I.
Таблица X. В данной таблице раскрыто 44 определения заместителей Х.001-Х.0044 формулы I-1а:

где Ra1, R2 и QRx являются такими, как определено ниже, и стрелка показывает место присоединения к ароматическому кольцу.






и N-оксиды соединений из таблицы X.
Таблица 1. В данной таблице раскрыто 44 соединения 1.001-1.044 формулы I-1а, где Xa1 представляет собой S и Ra1, R2 и QRx являются такими, как определено в таблице X. Например, соединение №1.001 характеризуется следующей структурой:
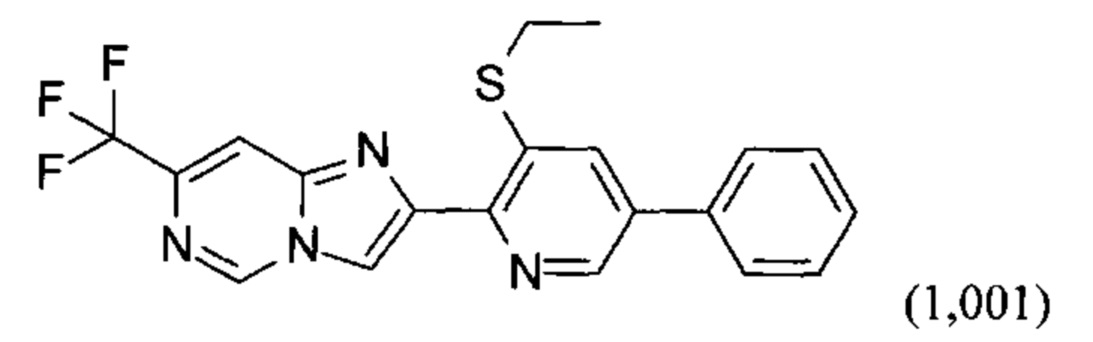
Таблица 2. В данной таблице раскрыто 44 соединения 2.001-2.044 формулы I-1а, где Xa1 представляет собой SO и Ra1, R2 и QRx являются такими, как определено в таблице X.
Таблица 3. В данной таблице раскрыто 44 соединения 3.001-3.044 формулы I-1а, где Xa1 представляет собой SO2 и Ra1, R2 и QRx являются такими, как определено в таблице X.
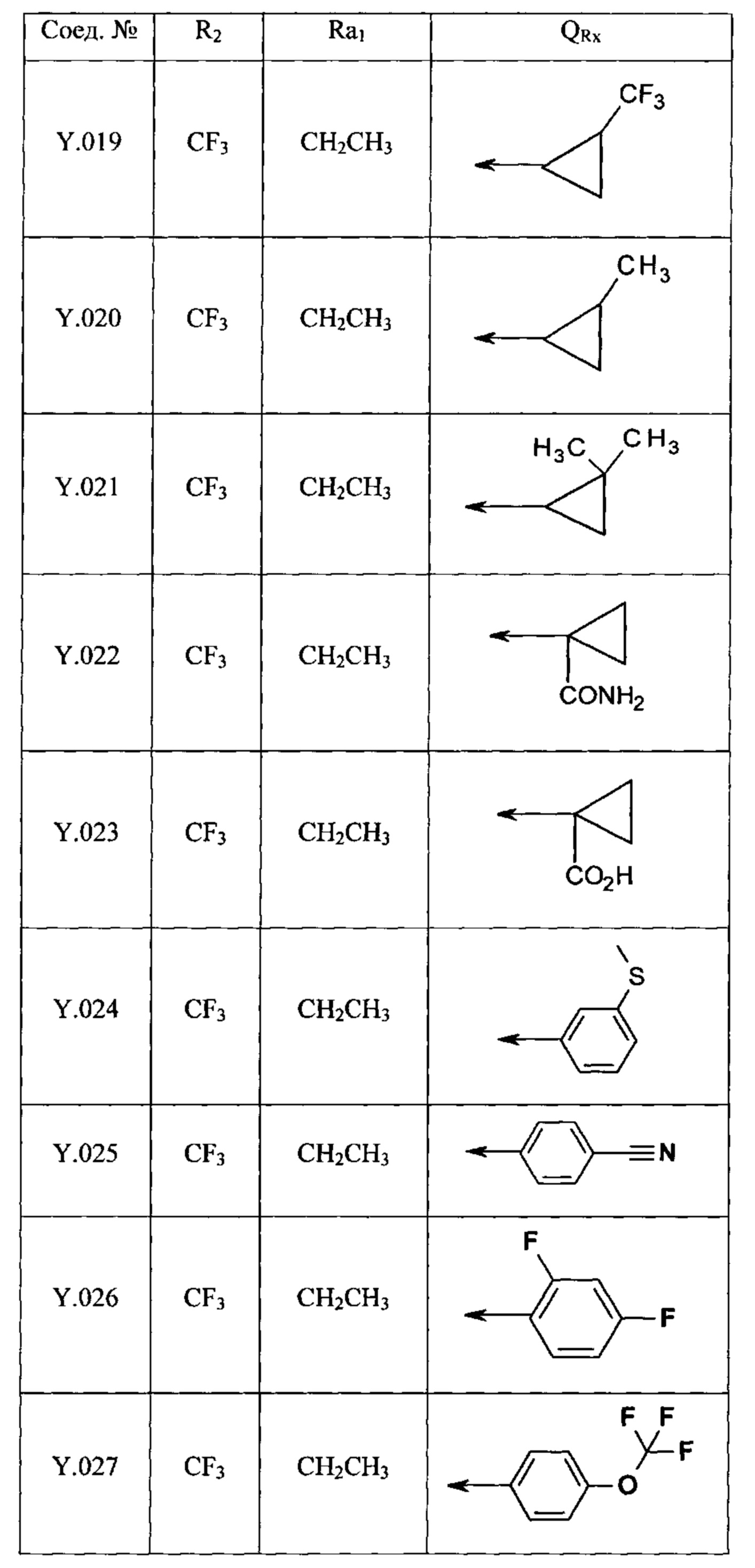
Таблица Y. В данной таблице раскрыто 44 определения заместителей Y.001-Y.044 формулы I-2а:

где Ra2, R2 и QRx являются такими, как определено ниже, и стрелка показывает место присоединения к ароматическому кольцу.




и N-оксиды соединений из таблицы Y.
Таблица 4. В данной таблице раскрыто 44 соединения 4.001-4.044 формулы I-2а, где Ха2 представляет собой S и Ra2, R2 и QRx являются такими, как определено в таблице Y.
Таблица 5. В данной таблице раскрыто 44 соединения 5.001-5.044 формулы I-2а, где Ха2 представляет собой SO и Ra2, R2 и QRx являются такими, как определено в таблице Y.
Таблица 6. В данной таблице раскрыто 44 соединения 6.001-6.044 формулы I-2а, где Ха2 представляет собой SO2 и Ra2, R2 и QRx являются такими, как определено в таблице Y.
Соединения формулы I согласно настоящему изобретению представляют собой активные ингредиенты, имеющие важное значение для профилактики и/или излечения, в области контроля вредителей, даже при низких нормах применения, которые обладают весьма подходящим биоцидным спектром и хорошо переносятся теплокровными видами, рыбой и растениями. Активные ингредиенты согласно настоящему изобретению воздействуют на все или отдельные стадии развития обладающих нормальной чувствительностью, но также обладающих устойчивостью животных-вредителей, таких как насекомые или представители отряда Acarina. Инсектицидная или акарицидная активность активных ингредиентов согласно настоящему изобретению может проявляться непосредственно, т.е. в уничтожении вредителей, которое происходит либо немедленно, либо только по прошествии некоторого времени, например, во время линьки, или косвенно, например, в уменьшенной яйцекладке и/или вылуплении.
Примерами вышеупомянутых животных-вредителей являются:
из отряда Acarina, например,
Acalitus spp, Aculus spp, Acaricalus spp, Aceria spp, Acarus siro, Amblyomma spp., Argas spp., Boophilus spp., Brevipalpus spp., Bryobia spp, Calipitrimerus spp., Chorioptes spp., Dermanyssus gallinae, Dermatophagoides spp, Eotetranychus spp., Eriophyes spp., Hemitarsonemus spp, Hyalomma spp., Ixodes spp., Olygonychus spp, Ornithodoros spp., Polyphagotarsone latus, Panonychus spp., Phyllocoptruta oleivora, Phytonemus spp, Polyphagotarsonemus spp, Psoroptes spp., Rhipicephalus spp., Rhizoglyphus spp., Sarcoptes spp., Steneotarsonemus spp, Tarsonemus spp. и Tetranychus spp.;
из отряда Anoplura, например,
Haematopinus spp., Linognathus spp., Pediculus spp., Pemphigus spp. и Phylloxera spp.;
из отряда Coleoptera, например,
Agriotes spp., Amphimallon majale, Anomala orientalis, Anthonomus spp., Aphodius spp, Astylus atromaculatus, Ataenius spp, Atomaria linearis, Chaetocnema tibialis, Cerotoma spp, Conoderus spp, Cosmopolites spp., Cotinis nitida, Curculio spp., Cyclocephala spp, Dermestes spp., Diabrotica spp., Diloboderus abderus, Epilachna spp., Eremnus spp., Heteronychus arator, Hypothenemus hampei, Lagria vilosa, Leptinotarsa decemLineata, Lissorhoptrus spp., Liogenys spp, Maecolaspis spp, Maladera castanea, Megascelis spp, Melighetes aeneus, Melolontha spp., Myochrous armatus, Orycaephilus spp., Otiorhynchus spp., Phyllophaga spp, Phlyctinus spp., Popillia spp., Psylliodes spp., Rhyssomatus aubtilis, Rhizopertha spp., Scarabeidae, Sitophilus spp., Sitotroga spp., Somaticus spp, Sphenophorus spp, Sternechus subsignatus, Tenebrio spp., Tribolium spp. и Trogoderma spp.;
из отряда Diptera, например,
Aedes spp, Anopheles spp, Antherigona soccata, Bactrocea oleae, Bibio hortulanus, Bradysia spp, Calliphora erythrocephala, Ceratitis spp, Chrysomyia spp., Culex spp., Cuterebra spp., Dacus spp., Delia spp, Drosophila melanogaster, Fannia spp., Gastrophilus spp., Geomyza tripunctata, Glossina spp., Hypoderma spp., Hyppobosca spp., Liriomyza spp., Lucilia spp., Melanagromyza spp., Musca spp., Oestrus spp., Orseolia spp., Oscinella frit, Pegomyia hyoscyami, Phorbia spp., Rhagoletis spp, Rivelia quadrifasciata, Scatella spp, Sciara spp., Stomoxys spp., Tabanus spp, Tannia spp. и Tipula spp.;
из отряда Hemiptera, например,
Acanthocoris scabrator, Acrosternum spp, Adelphocoris lineolatus, Amblypelta nitida, Bathycoelia thalassina, Blissus spp, Cimex spp., Clavigralla tomentosicollis, Creontiades spp, Distantiella theobroma, Dichelops furcatus, Dysdercus spp., Edessa spp, Euchistus spp., Eurydema pulchrum, Eurygaster spp., Halyomorpha halys, Horcias nobilellus, Leptocorisa spp., Lygus spp, Margarodes spp., Murgantia histrionic, Neomegalotomus spp, Nesidiocoris tenuis, Nezara spp., Nysius simulans, Oebalus insularis, Piesma spp., Piezodorus spp, Rhodnius spp., Sahlbergella singularis, Scaptocoris castanea, Scotinophara spp., Thyanta spp, Triatoma spp., Vatiga illudens;
Acyrthosium pisum, Adalges spp, Agalliana ensigera, Agonoscena targionii, Aleurodicus spp, Aleurocanthus spp, Aleurolobus barodensis, Aleurothrixus floccosus, Aleyrodes brassicae, Amarasca biguttula, Amritodus atkinsoni, Aonidiella spp., Aphididae, Aphis spp., Aspidiotus spp., Aulacorthum solani, Bactericera cockerelli, Bemisia spp, Brachycaudus spp, Brevicoryne brassicae, Cacopsylla spp., Cavariella aegopodii Scop., Ceroplaster spp., Chrysomphalus aonidium, Chrysomphalus dictyospermi, Cicadella spp, Cofana spectra, Cryptomyzus spp, Cicadulina spp, Coccus hesperidum, Dalbulus maidis, Dialeurodes spp, Diaphorina citri, Diuraphis noxia, Dysaphis spp., Empoasca spp., Eriosoma larigerum, Erythroneura spp., Gascardia spp., Glycaspis brimblecombei, Hyadaphis pseudobrassicae, Hyalopterus spp., Hyperomyzus pallidus, Idioscopus clypealis, Jacobiasca lybica, Laodelphax spp., Lecanium corni, Lepidosaphes spp., Lopaphis erysimi, Lyogenys maidis, Macrosiphum spp., Mahanarva spp., Metcalfa pruinosa, Metopolophium dirhodum, Myndus crudus, Myzus spp., Neotoxoptera sp, Nephotettix spp., Nilaparvata spp., Nippolachnus piri Mats, Odonaspis ruthae, Oregma lanigera Zehnter, Parabemisia myricae, Paratrioza cockerelli, Parlatoria spp., Pemphigus spp., Peregrinus maidis, Perkinsiella spp, Phorodon humuli, Phylloxera spp, Planococcus spp., Pseudaulacaspis spp., Pseudococcus spp., Pseudatomoscelis seriatus, Psylla spp., Pulvinaria aethiopica, Quadraspidiotus spp., Quesada gigas, Recilia dorsalis, Rhopalosiphum spp., Saissetia spp., Scaphoideus spp., Schizaphis spp., Sitobion spp., Sogatella furcifera, Spissistilus festinus, Tarophagus Proserpina, Toxoptera spp, Trialeurodes spp, Tridiscus sporoboli, Trionymus spp, Trioza erytreae, Unaspis citri, Zygina flammigera, Zyginidia scutellaris,;
из отряда Hymenoptera, например,
Acromyrmex, Arge spp, Atta spp., Cephus spp., Diprion spp., Diprionidae, Gilpinia polytoma, Hoplocampa spp., Lasius spp., Monomorium pharaonis, Neodiprion spp., Pogonomyrmex spp, Slenopsis invicta, Solenopsis spp. и Vespa spp.;
из отряда Isoptera, например,
Coptotermes spp, Corniternes cumulans, Incisitermes spp, Macrotermes spp, Mastotermes spp, Microtermes spp, Reticulitermes spp.; Solenopsis geminate
из отряда Lepidoptera, например,
Acleris spp., Adoxophyes spp., Aegeria spp., Agrotis spp., Alabama argillaceae, Amylois spp., Anticarsia gemmatalis, Archips spp., Argyresthia spp, Argyrotaenia spp., Autographa spp., Bucculatrix thurberiella, Busseola fusca, Cadra cautella, Carposina nipponensis, Chilo spp., Choristoneura spp., Chrysoteuchia topiaria, Clysia ambiguella, Cnaphalocrocis spp., Cnephasia spp., Cochylis spp., Coleophora spp., Colias lesbia, Cosmophila flava, Crambus spp, Crocidolomia binotalis, Cryptophlebia leucotreta, Cydalima perspectalis, Cydia spp., Diaphania perspectalis, Diatraea spp., Diparopsis castanea, Earias spp., Eldana saccharina, Ephestia spp., Epinotia spp., Estigmene acrea, Etiella zinckinella, Eucosma spp., Eupoecilia ambiguella, Euproctis spp., Euxoa spp., Feltia jaculiferia, Grapholita spp., Hedya nubiferana, Heliothis spp., Hellula undalis, Herpetogramma spp, Hyphantria cunea, Keiferia lycopersicella, Lasmopalpus lignosellus, Leucoptera scitella, Lithocollethis spp., Lobesia botrana, Loxostege bifidalis, Lymantria spp., Lyonetia spp., Malacosoma spp., Mamestra brassicae, Manduca sexta, Mythimna spp., Noctua spp, Operophtera spp., Orniodes indica, Ostrinia nubilalis, Pammene spp., Pandemis spp., Panolis flammea, Papaipema nebris, Pectinophora gossypiela, Perileucoptera coffeella, Pseudaletia unipuncta, Phthorimaea operculella, Pieris rapae, Pieris spp., Plutella xylostella, Prays spp., Pseudoplusia spp, Rachiplusia nu, Richia albicosta, Scirpophaga spp., Sesamia spp., Sparganothis spp., Spodoptera spp., Sylepta derogate, Synanthedon spp., Thaumetopoea spp., Tortrix spp., Trichoplusia ni, Tuta absoluta, и Yponomeuta spp.;
из отряда Mallophaga, например,
Damalinea spp. и Trichodectes spp.;
из отряда Orthoptera, например,
Blatta spp., Blattella spp., Gryllotalpa spp., Leucophaea maderae, Locusta spp., Neocurtilla hexadactyla, Periplaneta spp., Scapteriscus spp., и Schistocerca spp.;
из отряда Psocoptera, например,
Liposcelis spp.;
из отряда Siphonaptera, например,
Ceratophyllus spp., Ctenocephalides spp. и Xenopsylla cheopis;
из отряда Thysanoptera, например,
Calliothrips phaseoli, Frankliniella spp., Heliothrips spp, Hercinothrips spp., Parthenothrips spp, Scirtothrips aurantii, Sericothrips variabilis, Taeniothrips spp., Thrips spp;
из отряда Thysanura, например, Lepisma saccharina.
Активные ингредиенты согласно настоящему изобретению можно применять для контроля, т.е. сдерживания или уничтожения, вредителей вышеуказанного типа, которые встречаются, в частности, на растениях, особенно на полезных растениях и декоративных растениях в сельском хозяйстве, в садоводстве и в лесоводстве, или на органах таких растений, таких как плоды, цветки, листья, стебли, клубни или корни, и в некоторых случаях даже на органах растений, которые образуются в более поздние сроки и при этом остаются защищенными от данных вредителей.
Подходящими целевыми сельскохозяйственными культурами являются, в частности, зерновые культуры, такие как пшеница, ячмень, рожь, овес, рис, маис или сорго; свекла, такая как сахарная свекла или кормовая свекла; плодовые культуры, например, семечковые, косточковые или ягодные культуры, такие как сорта яблони, груши, сливы, персика, миндаля, вишни или ягод, например, сорта клубники, малины или ежевики; бобовые культуры, такие как сорта бобов, чечевицы, гороха или сои; масличные культуры, такие как масличный рапс, горчица, мак, маслины, сорта подсолнечника, кокосовая пальма, клещевина, какао или сорта арахиса; тыквенные культуры, такие как тыквы, огурцы или дыни; волокнистые растения, такие как хлопчатник, лен, конопля или джут; цитрусовые, такие как апельсины, лимоны, грейпфрут или мандарины; овощи, такие как шпинат, салат-латук, спаржа, сорта капусты, моркови, лука, томата, картофеля или болгарского перца; Lauraceae, такие как авокадо, Cinnamonium или камфорное дерево; а также табак, орехи, кофе, сорта баклажана, сахарный тростник, чай, перец, сорта культурного винограда, хмеля, подорожниковые и каучуконосные растения.
Композиции и/или способы по настоящему изобретению также можно применять по отношению к любым декоративным и/или овощным культурам, в том числе по отношению к цветам, кустарникам, лиственным деревьям и вечнозеленым растениям. Например, настоящее изобретение можно применять по отношению к любому из следующих декоративных видов растений: Ageratum spp., Alonsoa spp., Anemone spp., Anisodontea capsenisis, Anthemis spp., Antirrhinum spp., Aster spp., Begonia spp. (например, В. elatior, В. semperflorens,

Например, настоящее изобретение можно применять по отношению к любому из следующих видов овощей: Allium spp. (A. sativum, А. сера, A. oschaninii, А. Porrum, А. ascalonicum, A. fistulosum), Anthriscus cerefolium, Apium graveolus, Asparagus officinalis, Beta vulgarus, Brassica spp. (B. Oleracea, B. Pekinensis, B. rapa), Capsicum annuum, Cicer arietinum, Cichorium endivia, Cichorum spp. (C. intybus, С endivia), Citrillus lanatus, Cucumis spp. (C. sativus, C. melo), Cucurbita spp. (С. реро, С. maxima), Cyanara spp. (C. scolymus, C. cardunculus), Daucus carota, Foeniculum vulgare, Hypericum spp., Lactuca sativa, Lycopersicon spp. (L. esculentum, L. lycopersicum), Mentha spp., Ocimum basilicum, Petroselinum crispum, Phaseolus spp. (P. vulgaris, P. coccineus), Pisum sativum, Raphanus sativus, Rheum rhaponticum, Rosemarinus spp., Salvia spp., Scorzonera hispanica, Solanum melongena, Spinacea oleracea, Valerianella spp. (V. locusta, V. eriocarpa) и Vicia faba. Предпочтительные декоративные виды растений включают африканскую фиалку, Begonia, Dahlia, Gerbera, Hydrangea, Verbena, Rosa, Kalanchoe, Poinsettia, Aster, Centaurea, Coreopsis, Delphinium, Monarda, Phlox, Rudbeckia, Sedum, Petunia, Viola, Impatiens, Geranium, Chrysanthemum, Ranunculus, Fuchsia, Salvia, Hortensia, розмарин, шалфей, зверобой, мята, сладкий перец, томат и огурец.
Активные ингредиенты согласно настоящему изобретению являются особенно подходящими для контроля Aphis craccivora, Diabrotica balteata, Heliothis virescens, Myzus persicae, Plutella xylostella и Spodoptera littoralis в хлопчатнике, овощных, кукурузных, рисовых и соевых культурах. Активные ингредиенты согласно настоящему изобретению являются дополнительно особенно подходящими для контроля Mamestra (предпочтительно в овощах), Cydia pomonella (предпочтительно в яблоках), Empoasca (предпочтительно в овощах, на виноградарских хозяйствах), Leptinotarsa (предпочтительно в разновидностях картофеля) и Chilo supressalis (предпочтительно в рисе).
В дополнительном аспекте настоящее изобретение может также относиться к способу контроля повреждения растения и его частей паразитирующими на растении нематодами (эндопаразитными, полуэндопаразитными и эктопаразитными нематодами), в частности, паразитирующими на растении нематодами, такими как клубеньковые нематоды, Meloidogyne hapla, Meloidogyne incognita, Meloidogyne javanica, Meloidogyne arenaria и другие виды Meloidogyne; образующие цисты нематоды, Globodera rostochiensis и другие виды Globodera; Heterodera avenae, Heterodera glycines, Heterodera schachtii, Heterodera trifolii и другие виды Heterodera; галловые нематоды семян, виды Anguina; стеблевые и листовые нематоды, виды Aphelenchoides; жалящие нематоды, Belonolaimus longicaudatus и другие виды Belonolaimus; нематоды хвойных, Bursaphelenchus xylophilus и другие виды Bursaphelenchus; кольцевые нематоды, виды Criconema, виды Criconemella, виды Criconemoides, виды Mesocriconema; стеблевые и луковичные нематоды, Ditylenchus destructor, Ditylenchus dipsaci и другие виды Ditylenchus; шилоносые нематоды, виды Dolichodorus; спиральные нематоды, Heliocotylenchus multicinctus и другие виды Helicotylenchus; оболочковые и оболочкоподобные нематоды, виды Hemicycliophora и виды Hemicriconemoides; виды Hirshmanniella; ланцетоподобные нематоды, виды Hoploaimus; нематоды ненастоящих корневых наростов, виды Nacobbus; игольчатые нематоды, Longidorus elongatus и другие виды Longidorus; короткотелые нематоды, виды Pratylenchus; ранящие нематоды, Pratylenchus neglectus, Pratylenchus penetrans, Pratylenchus curvitatus, Pratylenchus goodeyi и другие виды Pratylenchus; роющие нематоды, Radopholus similis и другие виды Radopholus; почковидные нематоды, Rotylenchus robustus, Rotylenchus reniformis и другие виды Rotylenchus; виды Scutellonema; нематоды щетинистых корнеплодов, Trichodorus primitivus и другие виды Trichodorus, виды Paratrichodorus; карликовые нематоды, Tylenchorhynchus claytoni, Tylenchorhynchus dubius и другие виды Tylenchorhynchus; цитрусовые нематоды, виды Tylenchulus; ксифинема американская, виды Xiphinema; а также другие паразитирующие на растениях виды нематод, такие как Subanguina spp., Hypsoperine spp., Macroposthonia spp., Melinius spp., Punctodera spp. и Quinisulcius spp.
Соединения по настоящему изобретению также могут обладать активностью по отношению к моллюскам. Примеры данных моллюсков включают, например, Ampullariidae; Arion (A. ater, A. circumscriptus, A. hortensis, A. rufus); Bradybaenidae (Bradybaena fruticum); Cepaea (C. hortensis, C. Nemoralis); ochlodina; Deroceras (D. agrestis, D. empiricorum, D. laeve, D. reticulatum); Discus (D. rotundatus); Euomphalia; Galba (G. trunculata); Helicelia (H. itala, H. obvia); Helicidae Helicigona arbustorum); Helicodiscus; Helix (H. aperta); Limax (L. cinereoniger, L. flavus, L. marginatus, L. maximus, L. tenellus); Lymnaea; Milax (M. gagates, M. marginatus, M. sowerbyi); Opeas; Pomacea (P. canaticulata); Vallonia и Zanitoides.
Термин "сельскохозяйственные культуры" следует понимать, как также включающий культурные растения, трансформированные путем применения технологий рекомбинантной ДНК таким образом, что они стали способными синтезировать один или несколько токсинов избирательного действия, таких как известные, например, у токсин-продуцирующих бактерий, особенно бактерий рода Bacillus.
Токсины, которые могут экспрессироваться такими трансгенными растениями, включают, например, инсектицидные белки, например, инсектицидные белки из Bacillus cereus или Bacillus popilliae; или инсектицидные белки из Bacillus thuringiensis, такие как δ-эндотоксины, например, Cry1Ab, Cry1Ac, Cry1F, Cry1Fa2, Cry2Ab, Cry3A, Cry3Bb1 или Cry9C, или вегетативные инсектицидные белки (Vip), например, Vip1, Vip2, Vip3 или Vip3A; или инсектицидные белки бактерий, колонизирующих нематод, например, Photorhabdus spp. или Xenorhabdus spp., таких как Photorhabdus luminescens, Xenorhabdus nematophilus; токсины, продуцируемые животными, такие как токсины скорпионов, токсины паукообразных, токсины ос и другие специфические по отношению к насекомым нейротоксины; токсины, продуцируемые грибами, такие как токсины Streptomycetes, растительные лектины, такие как лектины гороха, лектины ячменя или лектины подснежника; агглютинины; ингибиторы протеиназы, такие как ингибиторы трипсина, ингибиторы серинпротеазы, пататин, цистатин, ингибиторы папаина; белки, инактивирующие рибосому (RIP), такие как рицин, RIP маиса, абрин, люффин, сапорин или бриодин; ферменты метаболизма стероидов, такие как 3-гидроксистероидоксидаза, экдистероид-UDP-гликозилтрансфераза, холестеролоксидазы, ингибиторы экдизона, HMG-COA-редуктаза, блокаторы ионных каналов, такие как блокаторы натриевых или кальциевых каналов, эстераза ювенильного гормона, рецепторы диуретических гормонов, стильбенсинтаза, дибензилсинтаза, хитиназы и глюканазы.
В контексте настоящего изобретения под δ-эндотоксинами, например, Cry1Ab, Cry1Ac, Cry1F, Cry1Fa2, Cry2Ab, Cry3A, Cry3Bb1 или Cry9C, или вегетативными инсектицидными белками (Vip), например, Vip1, Vip2, Vip3 или Vip3A, определенно следует понимать также гибридные токсины, усеченные токсины и модифицированные токсины. Гибридные токсины получают рекомбинантным способом с помощью новой комбинации различных доменов этих белков (см., например, WO 02/15701). Известны усеченные токсины, например, усеченный Cry1Ab. В случае модифицированных токсинов замещена одна или несколько аминокислот токсина, встречающегося в природе. При таких аминокислотных заменах в токсин предпочтительно вводят не встречающиеся в природном токсине последовательности, распознаваемые протеазами, так, например, в случае Cry3A055 в токсин Cry3A вводят последовательность, распознаваемую катепсином G (см. WO 03/018810).
Примеры таких токсинов или трансгенных растений, способных синтезировать такие токсины, раскрыты, например, в ЕР-А-0374753, WO 93/07278, WO 95/34656, ЕР-А-0427529, ЕР-А-451878 и WO 03/052073.
Способы получения таких трансгенных растений, в целом, известны специалисту в данной области и описаны, например, в публикациях, упомянутых выше.
Дезоксирибонуклеиновые кислоты CryI-типа и их получение известны, например, из WO 95/34656, ЕР-А-0367474, ЕР-А-0401979 и WO 90/13651.
Токсин, содержащийся в трансгенных растениях, придает растениям выносливость по отношению к вредным насекомым. Такие насекомые могут принадлежать к любой таксономической группе насекомых, но особенно часто встречаются среди жуков (Coleoptera), двукрылых насекомых (Diptera) и мотыльков (Lepidoptera). Трансгенные растения, содержащие один или несколько генов, которые кодируют устойчивость к насекомым и экспрессируют один или несколько токсинов, известны, и некоторые из них коммерчески доступны. Примерами таких растений являются YieldGard® (сорт маиса, экспрессирующий токсин Cry1Ab); YieldGard Rootworm® (сорт маиса, экспрессирующий токсин Cry3Bb1); YieldGard Plus® (сорт маиса, экспрессирующий токсин Cry1Ab и токсин Cry3Bb1); Starlink® (сорт маиса, экспрессирующий токсин Cry9C); Herculex I® (сорт маиса, экспрессирующий токсин Cry1Fa2 и фермент фосфинотрицин N-ацетилтрансферазу (PAT) с достижением выносливости к гербициду глюфосинат аммония); NuCOTN 33В® (сорт хлопчатника, экспрессирующий токсин Cry1Ac); Bollgard I® (сорт хлопчатника, экспрессирующий токсин Cry1Ac); Bollgard II® (сорт хлопчатника, экспрессирующий токсин Cry1Ac и токсин Cry2Ab); VipCot® (сорт хлопчатника, экспрессирующий токсин Vip3A и токсин Cry1Ab); NewLeaf® (сорт картофеля, экспрессирующий токсин Cry3A); NatureGard® Agrisure® GT Advantage (GA21 с признаком выносливости к глифосату), Agrisure® СВ Advantage (Bt11 с признаком устойчивости к кукурузному мотыльку (СВ)) и Protecta®. Дополнительными примерами таких трансгенных сельскохозяйственных культур являются следующие.
1. Маис Bt11 от Syngenta Seeds SAS, Chemin de

2. Маис Bt176 от Syngenta Seeds SAS, Chemin de

3. Маис MIR604 от Syngenta Seeds SAS, Chemin de

4. Маис MON 863 от Monsanto Europe S.A. 270-272 Avenue de Tervuren, B-1150 Брюссель, Бельгия, регистрационный номер C/DE/02/9. MON 863 экспрессирует токсин Cry3Bb1 и обладает устойчивостью к некоторым насекомым из отряда Coleoptera.
5. Хлопчатник IPC 531 от Monsanto Europe S.A. 270-272 Avenue de Tervuren, B-1150 Брюссель, Бельгия, регистрационный номер C/ES/96/02.
6. Маис 1507 от Pioneer Overseas Corporation, Avenue Tedesco, 7 B-1160 Брюссель, Бельгия, регистрационный номер C/NL/00/10. Генетически модифицированный маис для экспрессии белка Cry1F для достижения устойчивости к некоторым насекомым отряда Lepidoptera и белка PAT для достижения выносливости к гербициду глюфосинату аммония.
7. Маис NK603×MON 810 от Monsanto Europe S.A. 270-272 Avenue de Tervuren, B-1150 Брюссель, Бельгия, регистрационный номер C/GB/02/M3/03. Состоит из сортов гибридного маиса, традиционно выведенных путем скрещивания генетически модифицированных сортов NK603 и MON 810. Маис NK603×MON 810 трансгенным путем экспрессирует белок СР4 EPSPS, полученный из Agrobacterium sp. штамма СР4, который придает выносливость к гербициду Roundup® (содержит глифосат), а также токсин Cry1Ab, полученный из Bacillus thuringiensis, подвид kurstaki, который обеспечивает выносливость к некоторым представителям отряда Lepidoptera, включая кукурузного мотылька.
Трансгенные сельскохозяйственные культуры растений, устойчивых к насекомым, также описаны в отчете BATS за 2003 год (Zentrum fur Biosicherheit und Nachhaltigkeit, Zentrum BATS, Clarastrasse 13, 4058 Базель, Швейцария) (http://bats.ch). Термин "сельскохозяйственные культуры" следует понимать как включающий также культурные растения, которые были трансформированы с помощью применения методик рекомбинантной ДНК так, что они способны синтезировать антипатогенные вещества с селективным действием, такие как, например, так называемые "связанные с патогенезом белки" (PRP, смотри, например, ЕР-А-0 392 225). Примеры таких антипатогенных веществ и трансгенных растений, способных синтезировать такие антипатогенные вещества, известны, например, из ЕР-А-0392225, WO 95/33818 и ЕР-А-0353191. Способы получения таких трансгенных растений, в целом, известны специалисту в данной области и описаны, например, в публикациях, упомянутых выше.
Сельскохозяйственные культуры также могут быть модифицированными для повышенной устойчивости к грибным (например, Fusarium, Anthracnose или Phytophthora), бактериальным (например, Pseudomonas) или вирусным (например, вирус скручивания листьев картофеля, вирус пятнистой бронзовости томата, вирус мозаики огурца) патогенам.
Сельскохозяйственные культуры также включают таковые с повышенной устойчивостью к нематодам, таким как соевая цистообразующая нематода. Сельскохозяйственные культуры, которые являются выносливыми по отношению к стрессу, вызванному абиотическими факторами, включают такие, которые характеризуются повышенной выносливостью по отношению к засухе, высокому содержанию соли, высокой температуре, холоду, заморозкам или световому излучению, например, посредством экспрессии NF-YB или других белков, известных в данной области.
Антипатогенные вещества, которые могут быть экспрессированы такими трансгенными растениями, включают, например, блокаторы ионных каналов, такие как блокаторы натриевых и кальциевых каналов, например, вирусные токсины КР1, КР4 или КР6; стильбенсинтазы; дибензилсинтазы; хитиназы; глюканазы; так называемые "белки, связанные с патогенезом" (PRP; см., например, ЕР-А-0392225); антипатогенные вещества, вырабатываемые микроорганизмами, например, пептидные антибиотики или гетероциклические антибиотики (см., например, WO 95/33818) или белковые или полипептидные факторы, играющие активную роль в защите растения от патогенов (так называемые "гены устойчивости растений к заболеваниям", которые описаны в WO 03/000906).
Дополнительными областями применения композиций согласно настоящему изобретению являются защита хранящихся товаров и хранилищ, и защита сырьевых материалов, таких как древесина, ткани, напольные покрытия или строительные материалы, а также применение в области здравоохранения, в частности защиты человека, домашних животных и продуктивного скота от вредителей упомянутого типа. В настоящем изобретении также предусмотрен способ контроля вредителей (таких как комары и другие переносчики заболеваний; см. также http://www.who.int/malaria/vector_control/irs/en/). В одном варианте осуществления способ контроля вредителей включает применение композиций по настоящему изобретению по отношению к целевым вредителям, по отношению к их месторасположению или по отношению к поверхности или субстрату путем нанесения кистью, нанесения валиком, опрыскивания, растекания или протравливания погружением. В качестве примера, способ по настоящему изобретению предполагает IRS-применение (опрыскивание пестицидами остаточного действия внутри помещений) по отношению к поверхности, такой как стена, потолок или поверхность пола. В другом варианте осуществления предполагается применение таких композиций по отношению к субстрату, такому как нетканый или тканый материал в форме (или который может применяться в производстве) сетки, одежды, постельных принадлежностей, занавесок и палаток.
В одном варианте осуществления способ контроля таких вредителей включает применение пестицидно эффективного количества композиций по настоящему изобретению по отношению к целевым вредителям, по отношению к их месторасположению или по отношению к поверхности или субстрату так, чтобы обеспечивать эффективную активность пестицидов остаточного действия на поверхности или субстрате. Такое применение пестицидной композиции по настоящему изобретению можно осуществлять путем нанесения кистью, нанесения валиком, опрыскивания, растекания или протравливания погружением. В качестве примера, способ по настоящему изобретению предполагает IRS-применение по отношению к поверхности, такой как стена, потолок или поверхность пола так, чтобы обеспечивать эффективную активность пестицидов остаточного действия на поверхности. В другом варианте осуществления предполагается применение таких композиций по отношению к субстрату, такому как тканый материал в форме (или который может применяться в производстве) сетки, одежды, постельных принадлежностей, занавесок и палаток, для контроля вредителей благодаря остаточному действию.
Субстраты, включая подлежащие обработке нетканые материалы, тканые материалы или сетку, могут быть изготовленными из натурального волокна, такого как хлопок, рафия, джут, лен, сизаль, мешковина или шерсть, или из синтетического волокна, такого как полиамид, полиэстер, полипропилен, полиакрилонитрил или подобное. Полиэстеры являются особенно подходящими. Способы обработки тканей известны, например, WO 2008/151984, WO 2003/034823, US 5631072, WO 2005/64072, WO 2006/128870, ЕР 1724392, WO 2005113886 или WO 2007/090739.
Другими областями применения композиций согласно настоящему изобретению являются область введения в дерево/обработки ствола всех декоративных деревьев, а также всех сортов плодовых и ореховых деревьев.
В области введения в дерево/обработки ствола соединения согласно настоящему изобретению являются особенно подходящими против насекомых-древоточцев из отряда Lepidoptera, как упоминалось выше, и из отряда Coleoptera, особенно против древоточцев, перечисленных в следующих таблицах А и В.



Настоящее изобретение также можно применять для контроля любых насекомых-вредителей, которые могут присутствовать в газонной траве, в том числе, например, жуки, гусеницы, огненные муравьи, червецы, двупарноногие многоножки, мокрицы, клещи, медведки, щитовки, войлочники, иксодовые клещи, пенницы, Blissus insularis и личинки хруща. Настоящее изобретение можно применять для контроля насекомых-вредителей на различных стадиях их жизненного цикла, в том числе на стадии яиц, личинок, нимф и взрослых особей.
В частности, настоящее изобретение можно применять для контроля насекомых-вредителей, которые питаются корнями газонной травы, в том числе личинки хруща (такие как Cyclocephala spp. (например, масковый хрущ, С. lurida), Rhizotrogus spp.(например, хрущ европейский, R. majalis), Cotinus spp. (например, хрущ блестящий зеленый, С. nitida), Popillia spp. (например, хрущик японский, P. japonica), Phyllophaga spp. (например, майский/июньский хрущ), Ataenius spp. (например, Black turfgrass ataenius, A. spretulus), Maladera spp. (например, хрущик азиатский садовый М. Castaned) и Tomarus spp.), червецы (Margarodes spp.), медведки (темно-желтая, южная и короткокрылая; Scapteriscus spp., Gryllotalpa africana) и личинки комаров долгоножек (долгоножка болотная, Tipula spp.).
Настоящее изобретение также можно применять для контроля насекомых-вредителей газонной травы, которые обитают в соломине, в том числе "походные черви" (такие как совка травяная Spodoptera frugiperda и совка луговая Pseudaletia unipuncta), гусеницы озимой совки, долгоносики (Sphenophorus spp., такие как S. venatus verstitus и S. parvulus) и луговые мотыльки (такие как Crambus spp.и тропические луговые мотыльки, Herpetogramma phaeopteralis).
Настоящее изобретение также можно применять для контроля насекомых-вредителей газонной травы, которые живут над землей и питаются листьями газонной травы, в том числе земляные клопы (такие как земляные клопы, Blissus insularis), клещ бермудской травы (Eriophyes cynodoniensis), червец хлорис гвианской (Antonina graminis), пенница двухполосая (Propsapia bicincta), цикадки, гусеницы озимой совки (семейства Noctuidae) и тли злаковые.
Настоящее изобретение также можно применять для контроля других вредителей газонной травы, таких как муравьи огненные импортные красные (Solenopsis invicta), которые создают муравейники на поверхности газона.
В отношении гигиены композиции согласно настоящему изобретению являются активными по отношению к эктопаразитам, таким как твердые клещи, мягкие клещи, чесоточные зудни, краснотелки, мухи (кусающие и лижущие), паразитические личинки мух, вши, волосяные вши, пухоеды и блохи.
Примерами таких паразитов являются:
из отряда Anoplurida: Haematopinus spp., Linognathus spp., Pediculus spp. и Phtirus spp., Solenopotes spp.;
из отряда Mallophagida: Trimenopon spp., Menopon spp., Trinoton spp., Bovicola spp., Werneckiella spp., Lepikentron spp., Damalina spp., Trichodectes spp. и Felicola spp.;
из отряда Diptera и подотрядов Nematocerina и Brachycerina, например, Aedes spp., Anopheles spp., Culex spp., Simulium spp., Eusimulium spp., Phlebotomus spp., Lutzomyia spp., Culicoides spp., Chrysops spp., Hybomitra spp., Atylotus spp., Tabanus spp., Haematopota spp., Philipomyia spp., Braula spp., Musca spp., Hydrotaea spp., Stomoxys spp., Haematobia spp., Morellia spp., Fannia spp., Glossina spp., Calliphora spp., Lucilia spp., Chrysomyia spp., Wohlfahrtia spp., Sarcophaga spp., Oestrus spp., Hypoderma spp., Gasterophilus spp., Hippobosca spp., Lipoptena spp. и Melophagus spp.;
из отряда Siphonapterida, например, Pulex spp., Ctenocephalides spp., Xenopsylla spp., Ceratophyllus spp.;
из отряда Heteropterida, например, Cimex spp., Triatoma spp., Rhodnius spp., Panstrongylus spp.;
из отряда Blattarida, например Blatta orientalis, Periplaneta americana, Blattela germanica и Supella spp.;
из подкласса Acaria (Acarida) и отрядов мета- и Meso-stigmata, например, Argas spp., Ornithodorus spp., Otobius spp., Ixodes spp., Amblyomma spp., Boophilus spp., Dermacentor spp., Haemophysalis spp., Hyalomma spp., Rhipicephalus spp., Dermanyssus spp., Raillietia spp., Pneumonyssus spp., Sternostoma spp. и Varroa spp.;
из отрядов Actinedida (Prostigmata) и Acaridida (Astigmata), например Acarapis spp., Cheyletiella spp., Ornithocheyletia spp., Myobia spp., Psorergatesspp., Demodex spp., Trombicula spp., Listrophorus spp., Acarus spp., Tyrophagus spp., Caloglyphus spp., Hypodectes spp., Pterolichus spp., Psoroptes spp., Chorioptes spp., Otodectes spp., Sarcoptes spp., Notoedres spp., Knemidocoptes spp., Cytodites spp. и Laminosioptes spp.
Композиции согласно настоящему изобретения также являются подходящими для защиты против заражения насекомыми в случае материалов, таких как древесина, текстиль, пластики, адгезивы, клей, краски, бумага и картон, кожа, покрытия для пола и постройки.
Композиции согласно настоящему изобретению можно применять, например, против следующих вредителей: жуков, таких как Hylotrupes bajulus, Chlorophoras pilosis, Anobium punctatum, Xestobium rufovillosum, Ptilinuspecticornis, Dendrobium pertinex, Emobius mollis, Priobium carpini, Lyctus brunneus, Lyctus africanus, Lyctus planicollis, Lyctus linearis, Lyctus pubescens, Trogoxylon aequale, Minthesrugicollis, Xyleborus spec, Tryptodendron spec., Apate monachus, Bostrychus capucins, Heterobostrychus brunneus, Sinoxylon spec. и Dinoderus minutus, а также перепончатокрылых насекомых, таких как Sirex juvencus, Urocerus gigas, Urocerus gigas taignus и Urocerus augur, и термитов, таких как Kalotermes flavicollis, Cryptotermes brevis, Heterotermes indicola, Reticulitermes flavipes, Reticulitermes santonensis, Reticulitermes lucifugus, Mastotermes darwiniensis, Zootermopsis nevadensis и Coptotermes formosanus, и щетинохвосток, таких как Lepisma saccharina.
Таким образом, настоящее изобретение относится также к пестицидным композициям, таким как эмульгируемые концентраты, суспензионные концентраты, микроэмульсии, диспергируемые в масле композиции, непосредственно разбрызгиваемые или разбавляемые растворы, легко намазываемые пасты, разбавленные эмульсии, растворимые порошки, диспергируемые порошки, смачиваемые порошки, пылевидные препараты, гранулы или инкапсуляции в полимерных веществах, которые содержат по меньшей мере один активный ингредиент согласно настоящему изобретению и которые необходимо выбирать для удовлетворения предполагаемых целей и преобладающих обстоятельств.
В этих композициях активный ингредиент используют в чистой форме, твердый активный ингредиент, например, с определенным размером частиц, или предпочтительно по меньшей мере вместе с одним из вспомогательных средств, традиционно применяемых в области составления, таким как наполнители, например, растворители или твердые носители, или таким как поверхностно-активные соединения (поверхностно-активные вещества).
Примерами подходящих растворителей являются негидрогенизированные или частично гидрогенизированные ароматические углеводороды, предпочтительно фракции C8-C12алкилбензолов, такие как ксилоловые смеси, алкилированные нафталины или тетрагидронафталин, алифатические или циклоалифатические углеводороды, такие как парафины или циклогексан, спирты, такие как этанол, пропанол или бутанол, гликоли и их эфиры и сложные эфиры, такие как пропиленгликоль, дипропиленгликолевый эфир, этиленгликоль или этиленгликолевый монометиловый эфир или этиленгликолевый моноэтиловый эфир, кетоны, такие как циклогексанон, изофорон или диацетоновый спирт, сильнополярные растворители, такие как N-метилпирролид-2-он, диметилсульфоксид или N,N-диметилформамид, вода, неэпоксидированные или эпоксидированные растительные масла, такие как неэпоксидированные или эпоксидированные рапсовое, касторовое, кокосовое или соевое масла, и силиконовые масла.
Твердые носители, которые применяют, например, для пылевидных препаратов и диспергируемых порошков, представляют собой, как правило, измельченные природные минералы, такие как кальцит, тальк, каолин, монтмориллонит или аттапульгит. Для улучшения физических свойств также возможно добавление высокодисперсных кремнеземов или высокодисперсных абсорбционных полимеров. Приемлемые абсорбционные носители для гранул представляют собой носители пористого типа, такие как пемза, кирпичная крошка, сепиолит или бентонит, а подходящие несорбционные материалы-носители представляют собой кальцит или песок. Кроме того, можно применять множество гранулированных материалов неорганической или органической природы, в частности, доломит или измельченные растительные остатки.
Подходящие поверхностно-активные соединения, в зависимости от типа активного ингредиента, подлежащего включению в состав, представляют собой неионогенные, катионные и/или анионные поверхностно-активные вещества или смеси поверхностно-активных веществ, которые обладают хорошими свойствами эмульгирования, диспергирования и смачивания. Поверхностно-активные вещества, упомянутые ниже, следует рассматривать только в качестве примеров; множество дополнительных поверхностно-активных веществ, которые традиционно применяются в области составления и являются подходящими в соответствии с настоящим изобретением, описаны в соответствующей литературе.
Подходящие неионогенные поверхностно-активные вещества представляют собой, главным образом, полигликольэфирные производные алифатических или циклоалифатических спиртов, насыщенных или ненасыщенных жирных кислот или алкилфенолов, которые могут содержать от примерно 3 до примерно 30 гликольэфирных групп и от примерно 8 до примерно 20 атомов углерода в (цикло)алифатическом углеводородном радикале или от примерно 6 до примерно 18 атомов углерода в алкильном фрагменте алкилфенолов. Подходящими также являются водорастворимые аддукты полиэтиленоксида с полипропиленгликолем, этилендиаминополипропиленгликолем или алкилполипропиленгликолем с от 1 до примерно 10 атомами углерода в алкильной цепи и от примерно 20 до примерно 250 этиленгликольэфирными группами и от примерно 10 до примерно 100 полипропиленгликольэфирными группами. Как правило, вышеупомянутые соединения содержат от 1 до примерно 5 единиц этиленгликоля на единицу пропиленгликоля. Примерами, которые могут быть упомянуты, являются нонилфеноксиполиэтоксиэтанол, полигликолевый эфир касторового масла, аддукты полипропиленгликоля/полиэтиленоксида, трибутилфеноксиполиэтоксиэтанол, полиэтиленгликоль или октилфеноксиполиэтоксиэтанол. Также подходящими являются сложные эфиры жирных кислот и полиоксиэтиленсорбитана, такие как полиоксиэтиленсорбитантриолеат.
Катионные поверхностно-активные вещества представляют собой, главным образом, соли четвертичного аммония, которые, в основном, в качестве заместителей содержат по меньшей мере один алкильный радикал, содержащий от примерно 8 до примерно 22 атомов С, и в качестве дополнительных заместителей (негалогенированных или галогенированных) низшие алкильные, или гидроксиалкильные, или бензильные радикалы. Соли предпочтительно находятся в форме галогенидов, метилсульфатов или этилсульфатов. Примерами являются хлорид стеарилтриметиламмония и бромид бензилбис(2-хлорэтил)этиламмония.
Примеры подходящих анионных поверхностно-активных веществ представляют собой водорастворимые мыла или водорастворимые синтетические поверхностно-активные соединения. Примеры приемлемых мыл представляют собой соли щелочных, щелочноземельных металлов или (незамещенного или замещенного) аммония жирных кислот с от примерно 10 до примерно 22 атомами С, такие как натриевые или калиевые соли олеиновой или стеариновой кислот, или смесей природных жирных кислот, которые можно получить, например, из кокосового или таллового масла; следует также упомянуть о метилтауратах жирных кислот. Однако чаще применяют синтетические поверхностно-активные вещества, в частности сульфонаты жирных кислот, сульфаты жирных кислот, сульфированные производные бензимидазола или алкиларилсульфонаты. Как правило, сульфонаты жирных кислот и сульфаты жирных кислот присутствуют в виде солей щелочных, щелочноземельных металлов или (замещенного или незамещенного) аммония, и они в основном содержат алкильный радикал, содержащий от примерно 8 до примерно 22 атомов С, также следует понимать, что алкил включает алкильный участок ацильных радикалов; примеры, которые можно упомянуть, представляют собой натриевые или кальциевые соли лигносульфоновой кислоты, сложного эфира додецилсерной кислоты или смеси сульфатов жирных спиртов, полученные из природных жирных кислот. Эта группа также включает соли сложных эфиров серной кислоты и сульфокислот аддуктов жирного спирта/этиленоксида. Сульфированные бензимидазольные производные предпочтительно содержат 2 сульфонильные группы и радикал жирной кислоты, включающий от примерно 8 до примерно 22 атомов С. Примерами алкиларилсульфонатов являются натриевые, кальциевые или триэтаноламмонийные соли децилбензолсульфоновой кислоты, дибутилнафталинсульфоновой кислоты или продукта конденсации нафталинсульфоновой кислоты/формальдегида. Кроме того, также возможными являются подходящие фосфаты, такие как соли сложного эфира фосфорной кислоты с аддуктом пара-нонилфенола/(4-14)этиленоксида, или фосфолипиды.
Как правило, композиции содержат 0,1-99%, в особенности 0,1-95%, активного ингредиента и 1-99,9%, в особенности 5-99,9%, по меньшей мере одного твердого или жидкого вспомогательного вещества, при этом, как правило, 0-25%, в особенности 0,1-20% композиции могут составлять поверхностно-активные вещества (% в каждом случае означает процент по весу). Поскольку концентрированные композиции обычно являются предпочтительными для коммерческих товаров, конечный потребитель, как правило, применяет разбавленные композиции, которые характеризуются существенно более низкими концентрациями активного ингредиента.
Как правило, предварительно смешанный состав для внекорневого применения содержит 0,1-99,9%, в частности, 1-95% необходимых ингредиентов и 99,9-0,1%, в частности, 99-5% твердого или жидкого вспомогательного вещества (в том числе, например, растворителя, такого как вода), при этом вспомогательные средства могут представлять собой поверхностно-активное вещество в количестве 0-50%, в частности, 0,5-40% в пересчете на количество предварительно смешанного состава.
Обычно смешиваемый в баке состав для применения для обработки семян содержит 0,25-80%, в частности, 1-75% необходимых ингредиентов и 99,75-20%, в частности, 99-25% твердых или жидких вспомогательных средств (в том числе, например, растворитель, такой как вода), при этом вспомогательные средства могут представлять собой поверхностно-активное вещество в количестве 0-40%, в частности, 0,5-30% в пересчете на количество состава баковой смеси.
Как правило, предварительно смешанный состав для применения для обработки семян содержит 0,5-99,9%, в частности, 1-95% необходимых ингредиентов и 99,5-0,1%, в частности, 99-5%, твердого или жидкого вспомогательного вещества (в том числе, например, растворителя, такого как вода), при этом вспомогательные средства могут представлять собой поверхностно-активное вещество в количестве 0-50%, в частности, 0,5-40% в пересчете на количество предварительно смешанного состава. Тогда как коммерческие продукты предпочтительно будут составлены в виде концентратов (например, предварительно смешанной композиции (состава)), конечный пользователь обычно будет использовать разбавленные составы (например, смешиваемую в баке композицию).
Предпочтительными предварительно смешанными составами для обработки семян являются водные суспензионные концентраты. Состав можно применять по отношению к семенам с использованием традиционных методик обработки и устройств, таких как методики псевдоожиженного слоя, метод валковой мельницы, ротостатические протравливатели семян и барабаны для нанесения покрытий. Также можно использовать другие способы, такие как фонтанирующие слои. Перед нанесением покрытия семена могут быть предварительно разделены по размерам. После нанесения покрытия семена, как правило, сушат, а затем переносят в сортирующую по размеру машину для сортировки по размеру. Такие процедуры известны из уровня техники.
Как правило, предварительно смешанные композиции по настоящему изобретению содержат 0,5-99,9, в частности, 1-95, преимущественно 1-50% по массе необходимых ингредиентов и 99,5-0,1, в частности, 99-5% по массе твердого или жидкого вспомогательного вещества (в том числе, например, растворителя, такого как вода), при этом вспомогательные средства (или вспомогательного вещества) могут представлять собой поверхностно-активное вещество в количестве 0-50, в частности, 0,5-40% по массе в пересчете на массу предварительно смешанного состава.
Примерами типов состава для применения по отношению к листве для предварительно смешанных композиций являются следующие:
GR: Гранулы
WP: смачиваемые порошки
WG: диспергируемые в воде гранулы (порошки)
SG: растворимые в воде гранулы
SL: растворимые концентраты
ЕС: эмульгируемый концентрат
EW: эмульсии, "масло в воде"
ME: микроэмульсия
SC: водный суспензионный концентрат
CS: водная капсульная суспензия
OD: суспензионный концентрат на основе масла и
SE: водная суспо-эмульсия.
При этом примерами типов состава для обработки семян для предварительно смешанных композиций являются:
WS: смачиваемые порошки в виде взвеси для обработки семян
LS: раствор для обработки семян
ES: эмульсии для обработки семян
FS: суспензионный концентрат для обработки семян
WG: диспергируемые в воде гранулы и
CS: водная капсульная суспензия.
Примерами типов состава, подходящих для смешанных в баке композиций, являются растворы, разбавленные эмульсии, суспензии или их смесь и пылевидные препараты.
Примеры получения
Пример H1. 2-[2-Этилсульфонил-4-[3-(трифторметил)пиразол-1-ил]фенил]-7-(трифторметил)имидазо[1,2-с]пиримидин (соединение Р1, таблица Р)

Стадия А. 1-(4-Бром-2-этилсульфанилфенил)этанон

К раствору 1-(4-бром-2-фторфенил)этанона (0,6 г, 2,76 ммоль, CAS [625446-22-2]) в THF (5 мл) по частям добавляли NaSEt (0,31 г, 3,32 ммоль) и в конце несколько кристаллов 18-краун-6. Реакционную смесь перемешивали в течение 1 часа при -10°C и в течение 1 часа при температуре окружающей среды. По прошествии этого времени LCMS анализ показал завершение реакции. Реакционную смесь разбавляли насыщенным водным NH4Cl (30 мл) с последующим разбавлением водой (5 мл) и этилацетатом (20 мл). Органический слой декантировали и водную фазу снова экстрагировали с помощью этилацетата (2×30 мл). Органический слой промывали водой и солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo с получением указанного в заголовке продукта в виде желтого твердого вещества, который применяли на следующей стадии без дополнительной очистки. LCMS (Способ 1); Rt=1,03 минуты, [М+Н] 259/261.1Н ЯМР (400 МГц, хлороформ-d) δ ppm: 1,39 (t, J=7,52 Гц, 3 Н); 2,60 (s, 3 Н); 2,93 (q, J=7,58 Гц, 2 Н); 7,32 (dd, J=8,44, 1,83 Гц, 1 Н); 7,47 (d, J=1,83 Гц, 1 Н); 7,66 (d, J=8,44 Гц, 1 Н).
Стадия В. 1-[2-Этилсульфанил-4-[3-(трифторметил)пиразол-1-ил]фенил]этанон

В сосуде от Supelco к раствору 3-(трифторметил)-1h-пиразола (0,58 г, 4,24 ммоль) и 1-(4-бром-2-этилсульфанилфенил)этанона (1,0 г, 3,86 ммоль) в диметилформамиде (4 мл) добавляли йодид меди(I) (0,038 г, 0,193 ммоль), N,N'-диметилэтан-1,2-диамин (0,034 г, 0,042 мл, 0,39 ммоль) и карбонат калия (0,108 г, 0,77 ммоль). Полученную в результате смесь перемешивали при 120°C в атмосфере аргона в течение 12 часов. По прошествии этого времени LCMS показала, что реакция не завершена, и, следовательно, добавляли N,N'-диметилэтан-1,2-диамин (0,034 г, 0,042 мл, 0,39 ммоль) и карбонат калия (0,108 г, 0,77 ммоль), и полученную в результате смесь перемешивали одну в течение дополнительных 12 часов при 120°C. Неочищенную реакционную смесь (содержащую DMF) очищали непосредственно с помощью хроматографии на системе Combiflash с применением 24 г колонки и градиента циклогексан 0-30% этилацетата с получением указанного в заголовке соединения.
LCMS (Способ 1); Rt=1,08 минуты, [М+Н] 315,1Н ЯМР (400 МГц, хлороформ-d) δ ppm 1,44 (t, J=7,34 Гц, 3 Н); 2,66 (s, 3 Н); 3,03 (q, J=7,58 Гц, 2 Н); 6,78 (d, J=2,57 Гц, 1 Н); 7,47 (dd, J=8,44, 2,20 Гц, 1 Н); 7,77 (d, J=2,20 Гц, 1 Н); 7,94 (d, J=8,44 Гц, 1 Н); 8,03 (dd, J=2,57, 0,73 Гц, 1 Н).
Стадия С. 1-[2-Этилсульфонил-4-[3-(трифторметил)пиразол-1-ил]фенил]этанон

В трехгорлой колбе в атмосфере аргона 1-[2-этилсульфанил-4-[3-(трифторметил)пиразол-1-ил]фенил]этанон (1,02 г, 2,92 ммоль) растворяли в дихлорметане (20 мл) и охлаждали до 0°C. К этому раствору добавляли мета-хлорпербензойную кислоту (1,51 г, 6,13 ммоль) и реакционную смесь перемешивали в течение 30 мин. при 0°C, затем обеспечивали нагревание до температуры окружающей среды и перемешивали в течение 18 часов. Реакционную смесь гасили 1 М водным гидроксидом натрия (10 мл) и насыщенным водным тиосульфатом натрия (5 мл). Водный слой 3 раза экстрагировали с помощью дихлорметана и объединенные органические фазы последовательно промывали 1 М водным гидроксидом натрия (10 мл), 1 М водной HCl и солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo с получением указанного в заголовке соединения в виде желтого масла. LCMS (Способ 1); Rt=0,94 минуты, [М+Н] 347,1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,37 (t, J=7,34 Гц, 3 Н); 2,69 (s, 3 Н); 3,48 (q, J=7,34 Гц, 2 Н); 6,82 (d, J=2,57 Гц, 1 Н); 7,62 (d, J=8,44 Гц, 1 Н); 8,08-8,13 (m, 1 Н); 8,16 (dd, J=8,44, 2,20 Гц, 1 Н); 8,30 (d, J=2,20 Гц, 1 Н).
Стадия D. 2-Бром-1-[2-этилсульфонил-4-[3-(трифторметил)пиразол-1-ил]фенил]этанон

Раствор 1-[2-этилсульфонил-4-[3-(трифторметил)пиразол-1-ил]фенил]этанона (0,9 г, 2,599 ммоль) в хлороформе (4,5 мл) и этилацетате (4,5 мл) в сосуде для микроволновой обработки от Supelco обрабатывали бромидом меди(II) (1,16 г, 5,2 ммоль) и реакционную смесь перемешивали в микроволновой печи в течение 50 мин. при 140°C. По прошествии этого времени реакционную смесь разбавляли этилацетатом, промывали водой, органическую фазу высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Посредством очистки с помощью хроматографии на системе Combiflash с 24 г колонкой и градиентом циклогексана 0-60% этилацетата обеспечивали получение указанного в заголовке соединения в виде белого твердого вещества.
LCMS (Способ 1); Rt=1,01 минуты, [М+Н] 425/427,1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,36 (t, J=7,52 Гц, 3 Н); 3,35 (q, J=7,34 Гц, 2 Н); 4,50 (s, 2 Н); 6,83 (d, J=2,93 Гц, 1 Н); 7,69 (d, J=8,44 Гц, 1 Н); 8,12 (dd, J=2,57, 0,73 Гц, 1 Н); 8,17 (dd, J=8,44, 2,20 Гц, 1 Н); 8,32 (d, J=2,20 Гц, 1 Н).
Стадия D. 2-[2-Этилсульфонил-4-[3-(трифторметил)пиразол-1-ил]фенил]-7-(трифторметил)имидазо[1,2-с]пиримидин (соединение Р1, таблица Р)

Раствор 6-(трифторметил)пиримидин-4-амина (0,143 г, 0,877 ммоль) и 2-бром-1-[2-этилсульфонил-4-[3-(трифторметил)пиразол-1-ил]фенил]этанона (0,34 г, 0,80 ммоль) в ацетонитриле (7 мл) в сосуде для микроволновой обработки от Supelco перемешивали в течение 1 ч. при 150°C. LC-MS показала наличие необходимого продукта и исходного вещества. Следовательно, реакционную смесь перемешивали в течение еще 1 часа при 150°C, после чего LCMS показала наличие большего количества продукта, меньшего количества исходного вещества. Через дополнительный 1 час при 150°C реакционную смесь разбавляли этилацетатом, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный продукт очищали посредством хроматографии на системе Combiflash с 12 г колонкой и градиентом циклогексан 0-60% этилацетата с получением указанного в заголовке соединения в виде бежевого твердого вещества.
LCMS (Способ 1); Rt=1,05 минуты, [М+Н] 425/427.
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,26 (t, J=7,34 Гц, 3 Н); 3,37 (q, J=7,34 Гц, 2 Н); 6,84 (d, J=2,57 Гц, 1 Н); 7,96 (d, J=8,44 Гц, 1 Н); 7,98 (s, 1 Н); 8,16 (d, J=1,83 Гц, 1 Н) 8,24 (dd, J=8,44, 2,20 Гц, 1 Н) 8,33 (s, 1 Н) 8,52 (d, J=2,57 Гц, 1 Н) 9,19 (s, 1 Н)
Пример Н2. 2-[2-Этилсульфонил-4-[4-(трифторметил)фенил]-фенил]-7-(трифторметил)имидазо[1,2-с]пиримидин (соединение Р2, таблица Р)

Стадия А. Метил-2-фтор-4-[4-(трифторметил)фенил]бензоат

Метил-4-бром-2-фторбензоат (1,92 г, 8,24 ммоль, CAS [179232-29-2]) растворяли в 1,4-диоксане (48,0 мл). К этому раствору добавляли [4-(трифторметил)фенил]бороновую кислоту (2,03 г, 1,30 экв., 10,7 ммоль) и карбонат калия (3,42 г, 24,7 ммоль) и смесь продували аргоном в течение 10 мин. К этому раствору добавляли Pd(PPh3)4 (0,954 г, 0,824 ммоль) и коричневый раствор нагревали при 100°C в течение 17 ч. Затем реакционную смесь разбавляли насыщенным водным NH4Cl, водой и этилацетатом. Органический слой отделяли, промывали солевым раствором, высушивали над Na2SO4, фильтровали, концентрировали in vacuo при 40°C с получением желтого твердого вещества. Неочищенный продукт растворяли в дихлорметане, адсорбировали на тефлоновых объемных сорбентах, а затем очищали на картридже с силикагелем (Rf200) с элюированием циклогексаном/этилацетатом с получением указанного в заголовке продукта в виде желтого твердого вещества.
LCMS (Способ 1); Rt=1,19 минуты, [М+Н] 299.1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,26 (t, J=7,15 Гц, 2 Н); 3,96 (s, 3 Н); 4,12 (q, J=6,97 Гц, 1 Н); 7,34-7,41 (m, 1 Н); 7,44 (dd, J=8,07, 1,83 Гц, 1 Н); 7,66-7,77 (m, 4 Н); 8,04 (t, J=7,70 Гц, 1 Н).
Стадия В. 2-Фтор-4-[4-(трифторметил)фенил]бензойная кислота

Метил-2-фтор-4-[4-(трифторметил)фенил]бензоат (1,5 г, 5,0 ммоль) растворяли в тетрагидрофуране/H2O 3:1 (53 мл) и желтый прозрачный раствор обрабатывали гидратом гидроксида лития (0,22 г, 5,3 ммоль) при температуре окружающей среды. Реакция была завершена после 2 часов при этой температуре. Реакционную смесь частично концентрировали in vacuo и оставшийся раствор подкисляли 1 н. HCl и экстрагировали с помощью этилацетата, органическую фазу высушивали над Na2SO4, фильтровали, концентрировали in vacuo с получением указанного в заголовке соединения в виде белого твердого вещества, Mpt: 231-233°C.
LCMS (Способ 1); Rt=1,00 минуты, [М-Н] 283.1Н ЯМР (400 МГц, DMSO-d6) δ ppm 7,55 (d, J=8,44 Гц, 2 H); 7,77 (br. s., 1 H); 7,82 (d, J=8,44 Гц, 2 H); 7,95 (d, J=8,07 Гц, 2 H).
Стадия С. 2-Фтор-N-метокси-N-метил-4-[4-(трифторметил)фенил]бензамид

Метил-2-фтор-4-[4-(трифторметил)фенил]бензоат (1,3 г, 4,6 ммоль) растворяли в дихлорметане (26 мл) в атмосфере аргона. К этому раствору добавляли 2 капли диметилформамида, а затем оксалилхлорид (0,75 г, 0,50 мл, 5,9 ммоль). Реакционную смесь перемешивали в течение 3 ч. при температуре окружающей среды, после этого времени LCMS анализ аликвоты, обработанной с помощью МеОН, показал осуществление полного превращения в 2-фтор-4-[4-(трифторметил)фенил]бензоилхлорид. Реакционную смесь концентрировали in vacuo и применяли без дополнительной очистки на следующей стадии. Суспензию гидрохлорида N-метоксиметанамина (0,3308 г, 3,392 ммоль) растворяли в смеси сухого дихлорметана/THF (23,325 мл) в атмосфере аргона. Суспензию охлаждали до 0°C и обрабатывали пиридином (0,7317 г, 0,744 мл, 9,250 ммоль). К этой суспензии по каплям добавляли 2-фтор-4-[4-(трифторметил)фенил]бензоилхлорид (0,933 г, 3,083 ммоль), растворенный в 10 мл тетрагидрофурана, при 0°C. Реакционную смесь перемешивали 1 ч. при 0°C, затем 2 дня при rt. По прошествии этого времени реакционную смесь Реакционную смесь разбавляли насыщенным водным NH4Cl и водный слой экстрагировали (Х2) раза с помощью этилацетата. Объединенные органические слои последовательно промывали водой и солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали in vacuo с получением неочищенного продукта. Его очищали с помощью Combiflash с 24 г колонкой и градиентом циклогексан +0-70% этилацетата с получением указанного в заголовке соединения в виде белого твердого вещества.
LCMS (Способ 1); Rt=1,04 минуты, [M+H] 328.1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 3,39 (s, 3 Н); 3,62 (br. s., 3 Н), 7,35 (dd, J=10,45, 1,65 Гц, 1 Н), 7,44 (dd, J=8,07, 1,47 Гц, 1 Н), 7,51-7,59 (m, 1 Н), 7,67-7,78 (m, 4 Н).
Стадия D. 1-[2-Фтор-4-[4-(трифторметил)фенил]фенил]этанон

Раствор бром(метил)магния (1,4 М в ТНF : толуол 1:3 (1,2 мл, 1,680 ммоль) в сухом толуоле (7,5 мл) охлаждали до 0°C и обрабатывали 2-фтор-N-метокси-N-метил-4-[4-(трифторметил)фенил]бензамидом (0,5 г, 1,528 ммоль), растворенным в 3 мл толуола. Теперь красную, реакционную смесь перемешивали 30 мин. при 0°C, а затем 1 час при температуре окружающей среды. По прошествии этого времени LCMS анализ показал завершение реакции. Реакционную смесь медленно гасили насыщенным водным NH4Cl и 10% HCl (30 мл) и полученную в результате смесь энергично перемешивали в течение 15 мин. при температуре окружающей среды. Водный слой экстрагировали с помощью этилацетата (х2). Органическую фазу последовательно промывали 10% водн. раств. HCl, водой и солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный продукт очищали с помощью Combiflash с 12 г колонкой и градиентом циклогексан +0-40% этилацетата с получением указанного в заголовке соединения в виде белого твердого вещества.
LCMS (Способ 1); Rt=1,00 минуты, [М+Н] 283.1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 2,70 (d, J=5,14 Гц, 3 Н); 7,39 (dd, J=11,92, 1,65 Гц, 1 Н); 7,48 (dd, J=8,07, 1,83 Гц, 1 Н); 7,68-7,78 (m, 4 Н); 8,00 (t, J=7,89 Гц, 1 Н).
Стадия Е. 1-[2-Этилсульфанил-4-[4-(трифторметил)фенил]фенил]этанон

1-[2-Фтор-4-[4-(трифторметил)фенил]фенил]этанон (300 мг, 1,063 ммоль) растворяли в диметилформамиде (9 мл) и обрабатывали с помощью NaSEt (109,3 мг, 1,169 ммоль) при 0°С. Реакционную смесь перемешивали 30 мин. при 0°С, и LCMS показала завершение реакции. Реакционную смесь гасили водой и добавляли трет-бутилметиловый эфир (ТВМЕ). Водный слой снова 2 раза экстрагировали с помощью ТВМЕ и объединенные органические слои последовательно промывали водой (2 раза), солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Это обеспечивало получение указанного в заголовке соединения в виде желтого твердого вещества (Mpt. 108-109°С), которое применяли на следующей стадии без дополнительной очистки.
1Н ЯМP (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,42 (t, J=7,34 Гц, 3 Н); 2,67 (s, 3 Н); 3,01 (q, J=7,34 Гц, 2 Н); 7,40 (dd, J=8,07, 1,83 Гц, 1 Н); 7,54 (d, J=1,83 Гц, 1 Н); 7,69-7,73 (m, 2 Н); 7,73-7,77 (m, 2 Н); 7,90 (d, J=8,07 Гц, 1 Н).
Стадия F. 1-[2-Этилсульфонил-4-[4-(трифторметил)фенил]фенил]этанон

Раствор 1-[2-этилсульфанил-4-[4-(трифторметил)фенил]фенил]этанона (0,3 г, 0,9248 ммоль) в дихлорметане (9 мл) охлаждали до 0°С и обрабатывали мета-хлорпербензойной кислотой (0,4560 г, 1,850 ммоль). Реакционную смесь перемешивали 30 мин при 0°С, а затем нагревали при температуре окружающей среды и перемешивали в течение ночи. По прошествии этого времени реакционную смесь гасили с помощью 1 М NaOH (5 мл) и раств. тиосульфата натрия (3 мл). Водный слой 3 раза экстрагировали с помощью дихлорметана и объединенные органические фазы последовательно промывали с помощью 1 М NaOH, солевого раствора, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный продукт очищали посредством хроматографии на системе Combiflash с 12 г колонкой и градиентом циклогексан +0-55% этилацетата с получением указанного в заголовке продукта в виде белого твердого вещества.
LCMS (Способ 1); Rt=1,04 минуты, [М+Н] 357.
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,35 (t, J=7,52 Гц, 3 Н); 2,70 (s, 3 Н); 3,44 (q, J=7,58 Гц, 2 Н); 7,55-7,61 (m, 1 Н); 7,71-7,80 (m, 4 Н); 7,91 (dd, J=7,70, 1,83 Гц, 1 Н); 8,25 (d, J=1,83 Гц, 1 Н).
Стадия G. 2-Бром-1-[2-этилсульфонил-4-[4-(трифторметил)фенил]фенил]этанон

1-[2-Этилсульфонил-4-[4-(трифторметил)фенил]фенил]этанон (0,29 г, 0,8137 ммоль) растворяли в хлороформе (1,45 мл) и этилацетате (1,45 мл) в сосуде для микроволновой обработки и обрабатывали бромидом меди(II) (0,2726 г). Затем реакционную смесь перемешивали в микроволновой печи в течение 1 ч. при 140°С. По прошествии этого времени добавляли дополнительные 0,5 экв. CuBr2 и реакционную смесь перемешивали в микроволновой печи в течение 1 ч при 140°С. По прошествии этого времени реакционную смесь растворяли в этилацетате, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенное вещество очищали посредством хроматографии на системе Combiflash с 24 г колонкой и градиентом циклогексан +0-20% этилацетата с получением указанного в заголовке соединения.
LCMS (Способ 1); Rt=1,08 минуты, [М-Н] 433/435.1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,34 (t, J=7,34 Гц, 3 Н); 3,32 (q, J=7,58 Гц, 2 Н); 4,53 (s, 2 Н); 7,65 (d, J=7,70 Гц, 1 Н); 7,72-7,82 (m, 4 Н); 7,94 (dd, J=8,07, 1,83 Гц, 1 Н); 8,23 (d, J=1,83 Гц, 1 Н).
Стадия Н. 2-[2-Этилсульфонил-4-[4-(трифторметил)фенил]фенил]-7-(трифторметил)имидазо[1,2-c]пиримидин (соединение Р2, таблица Р)

В сосуде для микроволновой обработки от Supelco 6-(трифторметил)пиримидин-4-амин (0,1321 г, 0,8098 ммоль) и 2-бром-1-[2-этилсульфонил-4-[4-(трифторметил)фенил]фенил]этанон (0,235 г, 0,5399 ммоль) растворяли в ацетонитриле (4,7 мл). Полученную в результате смесь перемешивали в течение 1 часа при 150°С. LCMS анализ показал наличие необходимого продукта и исходного материала. Эту процедуру повторяли дополнительно три раза таким образом, что общее время нагревания при 150°С составляло 4 часа. Реакционную смесь концентрировали in vacuo и остаток растворяли в этилацетате, который последовательно промывали насыщенным водным NaHCO3, солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный защищенный очищали посредством хроматографии на системе Combiflash с 12 г колонкой и градиентом циклогексан +0-50% EtOAc с получением указанного в заголовке соединения в виде белого твердого вещества (Mpt. 179-180°С).
LCMS (Способ 1); Rt=1,13 минуты, [М+Н] 500.1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,28 (t, J=7,34 Гц, 3 H); 3,41 (m, J=7,34 Гц, 2 H); 7,47-7,68 (m, 6 Н); 8,01 (dd, J=7,89, 2,02 Гц, 1 H); 8,10 (d, J=1,10 Гц, 1 Н); 8,39 (d, J=1,83 Гц, 1 Н); 8,96 (s, 1 Н).
Пример Н3. 2-[3-Этилсульфонил-5-[3-(трифторметил)пиразол-1-ил]-2-пиридил1-7-(трифторметил)имидазо[1,2-с]пиримидин (соединение Р4, таблица Р)

Стадия А. 5-Бром-3-этилсульфанилпиридин-2-карбонитрил

5-Бром-3-нитропиридин-2-карбонитрил (75 г, 0,329 моль, полученный, как описано в J. Org Chem, 74, 4547-4553; 2009) растворяли в N,N-диметилформамиде (1,3 л) и охлаждали до - 40°С. Этот желтый раствор обрабатывали по частям с помощью NaSEt (36,3 г, 0,345 моль), а затем обеспечивали его нагревание до температуры окружающей среды. Через 12 часов перемешивания при температуре окружающей среды реакция была завершена (LCMS анализ). Реакционную смесь разбавляли с помощью AcOEt и гасили водой. Органический слой промывали водой, а затем высушивали над сульфатом натрия и концентрировали in vacuo. Посредством очистки с применением устройства Torrent с элюированием градиентом циклогексан/ЕА получали указанный в заголовке продукт в виде оранжевых кристаллов. LCMS (Способ 1); Rt=0,95 минуты, [М+Н] 243/245.1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm: 1,42 (t, J=7,34 Гц, 3 Н); 3,08 (q, J=7,34 Гц, 2 Н); 7,84 (d, J=1,83 Гц, 1 Н); 8,50 (d, J=1,83 Гц, 1 Н).
Стадия В. 5-Бром-3-этилсульфанилпиридин-2-карбоновая кислота

Раствор 5-бром-3-этилсульфанилпиридин-2-карбонитрила (61 г, 240,87 ммоль) в концентрированной хлористоводородной кислоте (1132 мл) и 50 мл диоксана нагревал до 60°С и перемешивали в течение 12 часов. По прошествии этого времени LCMS анализ показал завершение реакции. Реакционную смесь охлаждали до 0°-5°С, обрабатывали с помощью 30% водного раствора NaOH до значения рН 11, а затем экстрагировали с помощью этилацетата (2 × 300 мл). Водную фазу подкисляли с помощью конц. НСl до значения рН 4 и твердое вещество фильтровали, промывали водой и высушивали in vacuo. Это обеспечило получение указанного в заголовке соединения в виде бежевого твердого вещества.. LCMS (Способ 1); Rt=0,77 минуты, [М+Н] 262/264.1Н ЯМР (400 МГц, DMSO-d6) δ ppm: 1,25 (t, J=7,34 Гц, 3 H); 3,03 (q, J=7,34 Гц, 2 H); 8,06 (d, J=2,20 Гц, 1 Н); 8,50 (d, J=1,83 Гц, 1 Н); 13,40 (br. s., 1 Н).
Стадия С. 5-Бром-3-этилсульфанил-N-метокси-N-метилпиридин-2-карбоксамид

При температуре окружающей среды раствор 5-бром-3-этилсульфанилпиридин-2-карбоновой кислоты (2 г, 7,63 ммоль) в дихлорметане (30 мл) обрабатывали оксалилдихлоридом (1,259 г, 9,92 ммоль), а затем 2-3 каплями диметилформамида (образование газа). Реакционную смесь перемешивали при температуре окружающей среды до окончания выделения газа, а затем растворитель удаляли путем выпаривания. Остаток, 5-бром-3-этилсульфанилпиридин-2-карбонилхлорид, (1,82 г, 6,49 ммоль) растворяли в дихлорметане (10 мл) и добавляли к раствору гидрохлорида N-метоксиметанамина (0,633 г, 6,49 ммоль) и триэтиламина (1,66 г, 2,28 мл, 16,2 ммоль) в дихлорметане (27,3 мл) при 0°С в атмосфере аргона. Обеспечивали нагревание реакционной смеси до температуры окружающей среды и перемешивали до завершения реакции. Реакционную смесь гасили водой, органический слой отделяли и водный слой снова экстрагировали с помощью дихлорметана (Х2). Объединенные органические слои промывали водой, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный продукт очищали посредством хроматографии на системе Combiflash с 40 г колонкой и градиентом циклогексан +0-60% этилацетата с получением указанного в заголовке соединения в виде бежевого твердого вещества. Mpt 69-71°С. LCMS (Способ 1); Rt=0,77 минуты, [М+Н] 305/307.1Н ЯМР (400 МГц, хлороформ-d) δ ppm: 1,33 (t, J=7,52 Гц, 3 Н); 2,96 (q, J=7,34 Гц, 2 Н); 3,39 (br. s., 3 Н); 3,58 (br. s., 3 Н); 7,84 (d, J=1,83 Гц, 1 Н); 8,47 (d, J=1,83 Гц, 1 Н).
Стадия D. 1-(5-Бром-3-этилсульфанил-2-пиридил)этанон

Раствор бром(метил)магния (1,4 моль/л в ТНF:толуол (1:3), 7,8 мл, 10,9 ммоль) в толуоле (42 мл) охлаждали до 0°С и при этой температуре по каплям добавляли раствор 5-бром-3-этилсульфанил-N-метокси-N-метилпиридин-2-карбоксамида (2,78 г, 9,11 ммоль) в 10 мл толуола. Затем обеспечивали нагревание реакционной смеси до температуры окружающей среды и перемешивали в течение 1 часа. По прошествии этого времени LCMS анализ показал завершение реакции. Неочищенное вещество медленно гасили с помощью нас. водн. NH4Cl (20 мл) и 10% НСl (10 мл) и полученную в результате смесь энергично перемешивали в течение 15 мин. при температуре окружающей среды. Водный слой дважды экстрагировали с помощью этилацетата и объединенные органические фазы последовательно промывали 10% водн. раств. НСl, водой и солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Это обеспечивало получение указанного в заголовке соединения, которое применяли без дополнительной очистки на следующей стадии. LCMS (Способ 1); Rt=1,01 минуты, [М+Н] 260/262.1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm: 1,42 (t, J=7,34 Гц, 3 Н); 2,68 (s, 3 Н); 2,91 (q, J=7,34 Гц, 2 Н); 7,77 (d, J=2,20 Гц, 1 Н); 8,42 (d, J=2,20 Гц, 1 Н).
Стадия Е. 1-[3-Этилсульфанил-5-[3-(трифторметил)пиразол-1-ил]-2-пиридил]этанон

В сосуде от Supelco добавляли йодид меди(I) (0,110 г, 0,561 ммоль) N,N'-диметилэтан-1,2-диамин (0,0989 г, 1,12 ммоль) и карбонат калия (0,313 г, 2,24 ммоль) к раствору 3-(трифторметил)-1h-пиразола (0,840 г, 6,17 ммоль) и 1-(5-бром-3-этилсульфанил-2-пиридил)этанона (1,46 г, 5,61 ммоль) в диметилформамиде (6 мл). Полученную в результате смесь перемешивали при 120°С в атмосфере аргона в течение 48 ч. Посредством водной обработки и очистки неочищенного вещества с помощью хроматографии на системе Combiflash с 24 г колонкой и градиентом циклогексан 0-30% этилацетата получали указанное в заголовке соединение в виде белого твердого вещества. LCMS (Способ 1); Rt=1,09 минуты, [М+Н] 316.1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm: 1,40 (t, J=7,52 Гц, 3 Н); 4,00 (q, J=7,46 Гц, 2 Н); 7,97 (s, 1 Н); 8,36 (s, 1 Н); 8,69 (d, J=2,20 Гц, 1 Н); 8,95 (d, J=2,20 Гц, 1 Н); 9,17 (s, 1 Н).
Стадия F. 1-[3-Этилсульфонил-5-[3-(трифторметил)пиразол-1-ил]-2-пиридил]этанон

Раствор 1-[3-этилсульфанил-5-[3-(трифторметил)пиразол-1-ил]-2-пиридил]этанона (1,36 г, 3,88 ммоль) в дихлорметане (27 мл) охлаждали до 0°С и по частям обрабатывали мета-хлорпероксибензойной кислотой (1,79 г, 7,76 ммоль). Реакционную смесь перемешивали в течение 30 мин при 0°С, затем нагревали до температуры окружающей среды и перемешивали в течение дополнительных 3 часов. Реакционную смесь гасили с помощью 1 М NaOH (10 мл) и раств. тиосульфата натрия (5 мл). Водный слой 3 раза экстрагировали с помощью дихлорметана. Объединенный органический слой последовательно промывали с помощью 1 М NaOH и солевого раствора, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Это обеспечивало получение указанного в заголовке соединения в виде желтого твердого вещества. Mpt: 82-84°С.
LCMS (Способ 1); Rt=0,96 минуты, [М+Н] 348.1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,40 (t, J=7,52 Гц, 3 Н) 2,76 (s, 3 Н) 3,68 (q, J=7,34 Гц, 2 Н) 6,87 (d, J=2,57 Гц, 1 Н) 8,15 (dd, J=2,75, 0,92 Гц, 1 Н) 8,68 (d, J=2,57 Гц, 1 Н) 9,27 (d, J=2,57 Гц, 1 Н).
Стадия G. 2-Бром-1-[3-этилсульфонил-5-[3-(трифторметил)пиразол-1-ил]-2-пиридил]этанон

Раствор 1-[3-этилсульфонил-5-[3-(трифторметил)пиразол-1-ил]-2-пиридил]этанона (1,03 г, 2,97 ммоль) в хлороформе (5 мл) и этилацетате (5 мл) помещали в сосуд для микроволновой обработки и добавляли бромид меди(II) (0,994 г, 4,45 ммоль). Реакционную смесь перемешивали в микроволновой печи в течение 50 мин при 140°С. Затем реакционную смесь растворяли в этилацетате, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный продукт очищали посредством обращенно-фазовой флэш-хроматографии с получением указанного в заголовке соединения в виде белого твердого вещества.
LCMS (Способ 1); Rt=1,01 минуты, [М+Н] 426/428.1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm: 1,42 (t, J=7,52 Гц, 3 Н); 3,71 (q, J=7,70 Гц, 2 Н); 4,78 (s, 2 Н); 6,89 (d, J=2,57 Гц, 1 Н); 8,14-8,22 (m, 1 Н); 8,74 (d, J=2,57 Гц, 1 Н).
Стадия Н. 2-[3-Этилсульфонил-5-[3-(трифторметил)пиразол-1-ил]-2-пиридил]-7-(трифторметил)имидазо[1,2-с]пиримидин (соединение Р4, таблица Р)

Раствор 6-(трифторметил)пиримидин-4-амина (0,21 г, 1,290 ммоль) и 2-бром-1-[3-этилсульфонил-5-[3-(трифторметил)пиразол-1-ил]-2-пиридил]этанона (0,5 г, 1,173 ммоль) в ацетонитриле (10 мл) перемешивали в течение 1,5 ч при 150°С в микроволновой печи. Затем реакционную смесь растворяли в этилацетате, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный продукт очищали посредством хроматографии на системе Combiflash с 40 г колонкой и градиентом циклогексан +0-60% этилацетата с получением указанного в заголовке соединения в виде белого твердого вещества. Mpt: 229-230°С.
LCMS (Способ 1); LCMS (Способ 1); Rt=1,01 минуты, [М+Н] 491.1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,47 (t, J=7,52 Гц, 3 Н); 4,11 (q, J=7,34 Гц, 2 Н); 6,91 (d, J=2,57 Гц, 1 Н); 8,02 (s, 1 Н); 8,20 (dd, J=2,57, 0,73 Гц, 1 Н); 8,45 (s, 1 Н); 8,85 (d, J=2,20 Гц, 1 Н); 9,22 (s, 1 Н); 9,40 (d, J=2,57 Гц, 1 Н).
Пример Н4. 2-[5-(4-Хлорфенил)-3-этилсульфонил-2-пиридил]-7-(трифторметил)имидазо[1,2-с]пиримидин (соединение Р5, таблица Р)

Стадия А. 1-(5-Бром-3-этилсульфонил-2-пиридил)этанон

Раствор 1-(5-бром-3-этилсульфанил-2-пиридил)этанона (2,31 г, 8,88 ммоль, полученный как описано в примере Н3, стадии D) в дихлорметане (46 мл) охлаждали до 0°С и обрабатывали по частям мета-хлорпероксибензойной кислотой (4,09 г, 17,8 ммоль). Реакционную смесь перемешивали в течение 30 мин при 0°С, а затем обеспечивали ее нагревание до температуры окружающей среды и перемешивали в течение дополнительных 3 часов. По прошествии этого времени LCMS анализ показал завершение реакции. Реакционную смесь гасили с помощью 1 М NaOH (10 мл) и раствора тиосульфата натрия (5 мл). Водный слой экстрагировали с помощью дихлорметана (х3) и объединенные органические слои последовательно промывали с помощью 1 М NaOH, солевого раствора, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный продукт очищали посредством хроматографии на системе Combiflash с 40 г колонкой и градиентом циклогексан +0-60% этилацетата с получением указанного в заголовке соединения.1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm: 1,42 (t, J=7,34 Гц, 3 Н); 2,68 (s, 3 Н); 2,91 (q, J=7,34 Гц, 2 Н); 7,77 (d, J=2,20 Гц, 1 Н); 8,42 (d, J=2,20 Гц, 1 Н).
Стадия В. 2-Бром-1-(5-бром-3-этилсульфонил-2-пиридил)этанон

Раствор 1-(5-бром-3-этилсульфонил-2-пиридил)этанона (1,7 г, 5,8 ммоль) в хлороформе (8,5 мл) и ацетонитриле (8,5 мл) в сосуде для микроволновой обработки обрабатывали бромидом меди(II) (2,6 г, 12 ммоль) и смесь перемешивали в микроволновой печи в течение 55 мин. при 140°С. По прошествии этого времени реакционную смесь растворяли в этилацетате, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный продукт очищали посредством хроматографии на системе Combiflash с 24 г колонкой и градиентом циклогексан +0-30% этилацетата с получением указанного в заголовке соединения. LCMS (Способ 1); Rt=1,01 минуты, [М+Н] 370/372/374.
1Н ЯМР (400 МГц, хлороформ-d) δ ppm: 370/372/374 1,38 (t, J=7,52 Гц, 3 Н); 3,63 (q, J=7,70 Гц, 2 Н); 4,72 (s, 2 Н); 8,58 (d, J=1,83 Гц, 1 Н); 8,90 (d, J=1,83 Гц, 1 Н).
Стадия С. 2-(5-Бром-3-этилсульфонил-2-пиридил)-7-(трифторметил)имидазо[1,2-с] пиримидин

Раствор 6-(трифторметил)пиримидин-4-амина (0,14544 г, 0,89175 ммоль) и 2-бром-1-(5-бром-3-этилсульфонил-2-пиридил)этанона (0,3 г, 0,81 ммоль) в ацетонитриле (9 мл) нагревали в течение 1 ч при 150°С в микроволновой печи. По прошествии этого времени реакционную смесь выпаривали. Полученное твердое вещество растворяли в дихлорметане и промывали нас. раств. NaHCO3. Затем органический слой промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Посредством очистки с помощью хроматографии на системе Combiflash с 12 г колонкой и градиентом дихлорметан +0-10% этилацетата получали указанный в заголовке продукт в виде белого порошка.
LCMS (Способ 1); Rt=0,91 минуты, [М+Н] 435/437.1Н ЯМР (400 МГц, хлороформ-d) δ ppm: 1,40 (t, J=7,52 Гц, 3 Н); 4,00 (q, J=7,46 Гц, 2 Н); 7,97 (s, 1 Н); 8,36 (s, 1 Н); 8,69 (d, J=2,20 Гц, 1 Н); 8,95 (d, J=2,20 Гц, 1 Н); 9,17 (s, 1 Н).
Стадия D. 2-[5-(4-Хлорфенил)-3-этилсульфонил-2-пиридил]-7-(трифторметил)имидазо[1,2-с] пиримидин

Смесь 2-(5-бром-3-этилсульфонил-2-пиридил)-7-(трифторметил)имидазо[1,2-с]пиримидина (47 мг, 0,08640 ммоль), (4-хлорфенил)бороновой кислоты (0,01621 г, 0,1037 ммоль), карбоната натрия (0,2160 ммоль) и 1,1-диметоксиэтана (2 мл) смешивали в сосуде, и аргон барботировали в течение 5 мин. через смесь. К этой смеси добавляли тетракис(трифенилфосфин)палладий(0) (0,01997 г, 0,01728 ммоль) и светло-коричневую смесь перемешивали в течение одной ночи при 95°С. Затем реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата (2Х), и объединенные органические слои последовательно промывали водой и солевым раствором, высушивали над Na2SO4 и концентрировали in vacuo. Неочищенный продукт очищали посредством хроматографии на системе Combiflash с 4 г колонкой и градиентом циклогексан +0-60% этилацетата с получением указанного в заголовке соединения в виде белого твердого вещества. Mpt: 185-187°С.
LCMS (Способ 1); Rt=0,91 минуты, [М+Н] 467/469,1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm; 1,40 (t, J=7,34 Гц, 3 Н); 3,97 (q, J=7,58 Гц, 2 Н); 7,52-7,57 (m, 2 Н); 7,63-7,68 (m, 2 Н); 7,99 (s, 1 Н); 8,42 (s, 1 Н); 8,71 (d, J=2,20 Гц, 1 Н); 9,10 (d, J=2,20 Гц, 1 Н); 9,19 (s, 1 Н).
Пример Н5. 2-[3-Этилсульфонил-5-[4-(трифторметил)фенил]-2-пиридил]-7-(трифторметил)имидазо[1,2-с]пиримидин (соединение Р6, таблица Р)

Раствор 2-(5-бром-3-этилсульфонил-2-пиридил)-7-(трифторметил)имидазо[1,2-с]пиримидина (0,047 г, 0,1080 ммоль), [4-(трифторметил)фенил]бороновой кислоты (0,0246 г, 0,1296 ммоль) и карбоната натрия (0,1350 мл, 0,2700 ммоль) в 1,1-диметоксиэтане (2 мл) помещали в сосуд, и аргон барботировали в течение 5 мин. через смесь. К этому дегазированному раствору добавляли тетракиспалладий (0,02496 г, 0,02160 ммоль) и светло-коричневую смесь перемешивали в течение 1 ч при 90°С. Через 3 ч добавляли дополнительные части [4-(трифторметил)фенил]бороновой кислоты (0,0246 г, 0,1296 ммоль) и тетракиспалладия (0,02496 г, 0,02160 ммоль) и реакционную смесь перемешивали в течение дополнительных 2 часов при 95°С.
Разбавляли RM 10 мл воды и экстрагировали 2х с помощью ЕtOАс. Объединенные органические слои промывали водой, а затем солевым раствором. Посредством высушивания над Na2SO4 и концентрирования in vacuo получали неочищенный продукт, который очищали с помощью хроматографии на системе Combiflash с 4 г колонкой и градиентом циклогексан +0-60% этилацетата. Посредством дополнительной очистки с помощью обращенно-фазовой препаративной HPLC получали указанный в заголовке продукт в виде бежевого твердого вещества. Mpt 230-232°С.
LCMS (Способ 1); Rt=1,08 минуты, [М+Н] 501.1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm: 1,42 (t, J=7,34 Гц, 3 Н); 4,01 (q, J=7,34 Гц, 2 Н); 7,84 (s, 4 Н); 7,86 (s, 1 Н); 8,00 (s, 1 Н); 8,44 (s, 1 Н); 8,76 (d, J=2,20 Гц, 1 Н); 9,14 (d, J=2,20 Гц, 1 Н); 9,20 (s, 1 Н).
Пример Н6. 2-(3-Этилсульфонил-5-винил-2-пиридил)-7-(трифторметил)имидазо[1,2-с] пиримидин

В сосуд для микроволновой обработки помещали дибутокси(винил)боран (0,070 г, 0,3676 ммоль) и карбонат натрия (0,2757 мл 2 М водного раствора, 0,5515 ммоль), добавляли 2-(5-бром-3-этилсульфонил-2-пиридил)-7-(трифторметил)имидазо[1,2-с]пиримидин (0,08 г, 0,184 ммоль) в ацетонитриле (4 мл). Сосуд продували аргоном и добавляли хлор(2-дициклогексилфосфино-2',4',6'-триизопропил-1,1'-бифенил)[2-(2'-амино-1,1'-бифенил)]палладий(II), предкатализатор X-Phos аминобифенилпалладия хлорид, XPhos-Pd-G2 (0,01476 г, 0,0184 ммоль), сосуд закупоривали и его содержимое перемешивали в микроволновой печи при 120°С в течение 10 мин. Реакционную смесь разбавляли водным NаНСО3 и экстрагировали с помощью дихлорметана (2х). Объединенный органический слой высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный продукт растворяли в дихлорметане и адсорбировали на тефлоновых объемных сорбентах, а затем очищали на картридже с силикагелем (Rf200) с элюированием градиентом циклогексан/этилацетат с получением указанного в заголовке соединения в виде белого твердого вещества. Mpt 174-176°С. LCMS (Способ 1); 0,88 минуты (М+Н) 383.
1Н ЯМР (400 МГц, хлороформ-d) δ ppm 1,37 (t, J=7,34 Гц, 3 Н); 3,93 (q, J=7,46 Гц, 2 Н); 5,63 (d, J=11,00 Гц, 1 Н); 6,07 (d, J=17,61 Гц, 1 Н); 6,47-6,75 (m, 1 Н); 7,96 (s, 1 Н); 8,36 (s, 1 Н); 8,54 (d, J=2,20 Гц, 1 Н); 8,88 (d, J=2,20 Гц, 1 Н); 9,16 (s, 1 Н).
Пример Н7. 2-(5-Циклопропил-3-этилсульфонил-2-пиридил)-7-(трифторметил)имидазо[1,2-с]пиримидин (соединение Р16, таблица Р)

Стадия А. 1-(5-Циклопропил-3-этилсульфонил-2-пиридил)этанон

Порцию 1-(5-бром-3-этилсульфонил-2-пиридил)этанона (2 г, 6,85 ммоль, полученного, как описано в стадии А, пример Н4) растворяли в 1,4-диоксане (50 мл) растворяли в 1,4-диоксане (50 мл). Затем добавляли циклопропилбороновую кислоту (1,21 г, 13,7 ммоль) и карбонат калия (2,83 г, 20,53 ммоль) и смесь 5 раз продували вакуумом/аргоном. Затем к этой смеси добавляли тетракис(трифенилфосфин)палладий(0) (0,951 г, 0,82150 ммоль) и полученную в результате смесь нагревали при 90°С и перемешивали в течение 12 часов. По прошествии этого времени реакционную смесь обрабатывали водой, а затем экстрагировали с помощью этилацетата (три раза). Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный продукт очищали посредством хроматографии на системе Combiflash с 40 г колонкой и градиентом циклогексан +0-25% этилацетата с получением указанного в заголовке соединения (1,21 г) в виде бесцветного масла. LCMS (Способ 1); Время удерживания=1,10 минуты, [М+Н] 254
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 0,88-0,94 (m, 2 Н) 1,20-1,27 (m, 2 Н) 1,36 (t, J=7,52 Гц, 3 Н) 2,02-2,12 (m, 1 Н) 2,73 (s, 3 Н) 3,62 (q, J=7,34 Гц, 2 Н) 7,95 (d, J=2,20 Гц, 1 Н) 8,59 (d, J=2,20 Гц, 1 Н)
Стадия В. 2-Бром-1-(5-циклопропил-3-этилсульфонил-2-пиридил)этанон

Порцию 1-(5-циклопропил-3-этилсульфонил-2-пиридил)этанона (0,9 г, 3,553 ммоль) растворяли в хлороформе (15 мл) и ацетонитриле (15 мл) и обрабатывали бромидом меди(II) (1,59 г, 7,1 ммоль). Полученную в результате смесь перемешивали при 140°С в течение 55 мин в системе для микроволнового облучения. По прошествии этого времени LCMS показала образование необходимого продукта. Реакционную смесь выпаривали, остаток растворяли в 100 мл дихлорметана +5 мл метанола. Осадок фильтровали через Hyflo и фильтрат промывали насыщенным водным NaHCO3, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенное вещество очищали посредством хроматографии на системе Combiflash с 40 г колонкой и градиентом дихлорметан +0-10% этилацетата с получением указанного в заголовке соединения в виде белого твердого вещества.
LCMS (Способ 1); Rt=0,93 минуты, [М+Н] 333
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 0,92-0,98 (m, 2 Н) 1,24-1,31 (m, 2 Н) 1,38 (t, J=7,52 Гц, 3 Н) 2,05-2,14 (m, 1 Н) 3,65 (q, J=7,34 Гц, 2 Н) 4,79 (s, 2 Н) 8,01 (d, J=2,20 Гц, 1 Н) 8,61 (d, J=2,20 Гц, 1 Н)
Стадия С. 2-(5-Циклопропил-3-этилсульфонил-2-пиридил)-7-(трифторметил)имидазо[1,2-c]пиримидин (соединение Р16, таблица Р)
Порцию 6-(трифторметил)пиримидин-4-амина (73,7 мг, 0,45 ммоль, номер по СAS: [672-41-3]) и 2-бром-1-(5-циклопропил-3-этилсульфонил-2-пиридил)этанона (150 мг, 0,45 ммоль) растворяли в ацетонитриле (3 мл) и полученную в результате смесь перемешивали в течение 1 ч при 150°С в системе для микроволнового облучения. По прошествии этого времени LCMS показала образование продукта. Реакционную смесь концентрировали in vacuo и полученный остаток растворяли в дихлорметане и промывали насыщенным водным NаНСО3. Водный слой снова экстрагировали (2 раза) с помощью дихлорметана и объединенные органические слои промывали с помощью 1 н. NH4OH, солевого раствора, высушивали над Na2SO4 и концентрировали in vacuo. Неочищенный продукт очищали посредством хроматографии на системе Combiflash с 12 г колонкой и градиентом дихлорметан +0-20% этилацетата. Полученный таким образом продукт растирали в порошок с этилацетатом с получением указанного в заголовке соединения в виде белого твердого вещества.
LCMS (Способ 1); Rt=0,98 минуты, [М+Н] 397
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 0,87-0,94 (m, 2 Н) 1,18-1,24 (m, 2 Н) 1,34 (t, J=7,34 Гц, 3 Н) 2,03-2,12 (m, 1 Н) 3,84 (q, J=7,34 Гц, 2 Н) 7,95 (s, 1 Н) 8,10 (d, J=2,20 Гц, 1 Н) 8,31 (s, 1 Н) 8,68 (d, J=2,20 Гц, 1 Н) 9,15 (s, 1 Н)
Пример Н8. 2-[5-[2-(3,5-Дифторфенил)этинил]-3-этилсульфонил-2-пиридил]-7-(трифторметил)имидазо[1,2-с]пиримидин (соединение Р29, таблица Р)

Смешивали вместе 2-(5-хлор-3-этилсульфонил-2-пиридил)-7-(трифторметил)имидазо[1,2-c]пиримидин (100 мг, 0,26 ммоль), 1-этинил-3,5-дифторбензол (0,126 мл, 1,02 ммоль), йодид меди (5 мг, 0,026 ммоль), триэтиламин (1 мл), диметилформамид (2 мл), трифенилфосфин (13 мг, 0,051 ммоль) и дихлорид бис(трифенилфосфин)палладия (36 мг, 0,051 ммоль). Сосуд продували аргоном и помещали в микроволновую печь в течение 80 мин при 120°С. LCMS анализ показал образование необходимого продукта. Добавляли ТВМЕ. Смесь три раза экстрагировали с помощью воды и один раз с помощью солевого раствора. Объединенный органический слой высушивали с помощью Na2SO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали посредством флэш-хроматографии на силикагеле с получением указанного в заголовке соединения.
LCMS (Способ 1); Rt=1,24 минуты, [М+Н] 493.
Пример Н9. Синтез 2-(3-этилсульфонил-5-пиримидин-2-ил-2-пиридил)-7-(1,1,2,2,2-пентафторэтил)имидазо[1,2-с]пиримидина (соединения Р19, таблица Р)

Стадия А. Синтез соединения 5 (chenjx20150723-2)

Порцию трибутил(пиримидин-2-ил)станнана (1,1 г, 3 ммоль) добавляли к смеси соединения 1-(5-бром-3-этилсульфанил-2-пиридил)этанона (520 мг, 3 ммоль, полученного как описано в стадии D, пример Н3), CuI (76 мг, 0,4 ммоль) и PdCl2(PPh3)2 (140 мг, 0,2 ммоль) в 1,4-диоксане (20 мл). Реакционную смесь нагревали с обратным холодильником в течение 2 часов, а затем концентрировали in vacuo. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с получением указанного в заголовке соединения.
1Н-ЯМР (400 Mz, CDCl3) δ (ppm): 1,44 (t, 3 Н), 2,74(s, 3 Н), 3,06(q, 2 Н), 7,28 (t, 3 Н), 8,72 (s, 1 Н), 8,85 (d, 2 Н), 9,37(s, 1 Н). ESI-MS(+): 282(М+23).
Стадия В. Синтез 1-(3-этилсульфонил-5-пиримидин-2-ил-2-пиридил)этанона

При температуре окружающей среды перемешивали 1-(3-этилсульфанил-5-пиримидин-2-ил-2-пиридил)этанон (1,16 ммоль, 301 мг) и m-СРВА (998 мг, 5,8 ммоль) в 20 мл DCM в течение 3 ч. Затем смесь выливали в насыщенный раствор NaHCO3 и Na2SO3 в воде и три раза экстрагировали с помощью этилацетата. Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с получением 1-(3-этилсульфонил-5-пиримидин-2-ил-2-пиридил)этанона.1Н-ЯМР (400 Mz, CDCl3) δ (ррm): 1,38 (t, 3 Н), 2,74 (s, 3 Н), 3,58 (q, 2 Н), 7,33 (t, 3 Н), 8,87 (s, 1 Н), 8,33 (d, 2 Н), 9,78 (s, 1 Н). ESI-MS(+): 314 (М+23).
Стадия С. Синтез 2-бром-1-(3-этилсульфонил-5-пиримидин-2-ил-2-пиридил)этанона

Перемешивали 1-(3-этилсульфонил-5-пиримидин-2-ил-2-пиридил)этанон (1 ммоль, 291 мг) и CuBr2 (12 ммоль, 447 мг) в 2 мл этилацетата и 2 мл CHCl3 под действием микроволнового облучения при 140°С в течение 1,5 ч. Затем смесь концентрировали в вакууме. Неочищенный продукт применяли на следующей стадии.
Стадия D. Синтез 6-бромпиримидин-4-амина

К раствору 4,6-дибромпиримидина (12 г, 50,6 ммоль, CAS: 36847-10-6) в 300 мл CH3CN добавляли NH3.H2O (240 мл). Смесь перемешивали при температуре окружающей среды в течение 16 часов. Затем смесь выливали в воду и четыре раза экстрагировали с помощью этилацетата. Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт перекристаллизовывали с помощью РЕ/ЕА с получением 6-бромпиримидин-4-амина.1Н ЯМР (400 Mz, DMSO-d6) δ (ррm): 6,58 (s, 1 Н), 7,17(s, 2 Н), 8,10(s, 1 Н).
Стадия Е. Синтез 6-йодпиримидин-4-амина

К раствору 6-бромпиримидин-4-амина (4,17 г, 24 ммоль) в 100 мл HI добавляли NaI (14,4 г, 96 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 дней. Затем смесь регулировали до значения рН=10 с помощью раствора NaOH, и твердое вещество отделяли и фильтровали с получением 6-йодпиримидин-4-амина.1Н ЯМР (400 Mz, DMSO-d6) δ (ррm): 6,85 (s, 1 Н), 6,99(s, 2 Н), 7,99 (s, 1 Н).
Стадия F. Синтез 6-(1,1,2,2,2-пентафторэтил)пиримидин-4-амина

К раствору 6-йодпиримидин-4-амина (442 мг, 2 ммоль) в 5 мл DMF добавляли (Phen)CuCF2CF3 (1,14 г, 3 ммоль, приобретенный у Aspira scientific). Смесь перемешивали при 90°С в течение 2 часов. Затем смесь выливали в воду и экстрагировали с помощью этилацетата. Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с получением 6-(1,1,2,2,2-пентафторэтил)пиримидин-4-амина.
1Н ЯМР (400 Mz, DMSO-d6) δ (ррm): 6,80 (s, 1 Н), 7,50(s, 2 Н), 8,47 (s, 1 Н).19F-ЯМР (300 Mz, DMSO-d6) δ: -79,41 (s, 3 F), -116,10 (s, 2 F); ESI-MS(+): 214(M+1), ESI-MS(-): 212(M-1).
Стадия G. Синтез 2-(3-этилсульфонил-5-пиримидин-2-ил-2-пиридил)-7-(1,1,2,2,2-пентафторэтил)имидазо[1,2-с]пиримидина (соединения Р19, таблица Р)

Перемешивали 2-бром-1-(3-этилсульфонил-5-пиримидин-2-ил-2-пиридил)этанон (0,27 ммоль, 100 мг) и 6-(1,1,2,2,2-пентафторэтил)пиримидин-4-амин (0,47 ммоль, 100 мг) в 4 мл CH3CN под действием микроволнового облучения при 140°С в течение 2 ч. Затем смесь концентрировали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с получением 2-(3-этилсульфонил-5-пиримидин-2-ил-2-пиридил)-7-(1,1,2,2,2-пентафторэтил)имидазо[1,2-с]пиримидина.
lH ЯМР (400 Mz, CDCl3) δ (ppm): 1,42 (t, 3 H), 4,02 (q, 2 H), 7,34 (t, 1 H), 8,00 (s, 1 H), 8,44 (s, 1 H), 8,89 (d, 2 H), 9,17 (s, 1 H), 9,88 (s, 1 H);19F-ЯМР (300 Mz, CDCl3) δ: -81,21 (s, 3 F), -116,03 (s, 2 F); ESI-MS(+): 485 (M+1).
Пример Н10. Синтез 2-[3-этилсульфонил-5-[4-(трифторметил)фенил1-2-пиридил]-7-(1,1,2,2,2-пентафторэтил)имидазо[1,2-с]пиримидина (соединения Р20, таблица Р)

Стадия А. Синтез 1-(5-бром-3-этилсульфонил-2-пиридил)этанона

Порцию 1-(5-бром-3-этилсульфанил-2-пиридил)этанона (4 ммоль, 1,04 г, полученного как описано в стадии D, пример Н3) и мета-хлорпероксибензойной кислоты (2,06 г, 12 ммоль) в 20 мл дихлорметана перемешивали при температуре окружающей среды в течение 4 часов. Смесь выливали в насыщенный раствор NаНСО3 и Na2SO3 в воде и экстрагировали с помощью этилацетата (три раза). Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали in vacuo. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с получением 1-(5-бром-3-этилсульфонил-2-пиридил)этанона.1Н ЯМР (400 Mz, CDCl3) δ (ррm): 1,34 (t, 3 Н), 2,66 (s, 3 Н), 3,58 (q, 2 Н), 8,47(s, 1 Н), 8,83 (s, 1 Н).
Стадия В. Синтез 1-[3-этилсульфонил-5-[4-(трифторметил)фенил]-2-пиридил1этанона

Добавляли 1-(5-бром-3-этилсульфонил-2-пиридил)этанон (507 мг, 2,67 ммоль) к смеси [4-(трифторметил)фенил]бороновой кислоты (520 мг, 1,78 ммоль), Pd(PPh3)4 (206 мг, 0,178 ммоль), K2СО3 (738 мг, 5,34 ммоль) в 20 мл 1,4-диоксана в атмосфере N2. Смесь нагревали с обратным холодильником в течение ночи, а затем концентрировали in vacuo. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с получением указанного в заголовке соединения.
1Н-ЯМР (400 Mz, CDCl3) δ (ррm): 1,37 (t, 3 Н), 2,73 (s, 3 Н), 3,62 (q, 2 Н), 7,78 (t, 4 Н), 8,53 (s, 1 Н), 9,00(s, 1 Н).19F-ЯМР (300 Mz, CDCl3) δ: -61,04 (s, 3 F); ESI-MS(+): 380 (M+23).
Стадия С. Синтез 2-бром-1-[3-этилсульфонил-5-[4-(трифторметил)фенил]-2-пиридил]этанона

Порцию 1-[3-этилсульфонил-5-[4-(трифторметил)фенил]-2-пиридил]этанона (1 ммоль, 357 мг) и CuBr2 (12 ммоль, 447 мг) в 2 мл этилацетата и 2 мл СНСl3 перемешивали в запаянной пробирке при 140°С в течение 20 ч. Смесь концентрировали in vacuo и неочищенный продукт применяли как таковой на следующей стадии.
Стадия D. Синтез 2-[3-этилсульфонил-5-[4-(трифторметил)фенил]-2-пиридил]-7-(1,1,2,2,2-пентафторэтил)имидазо[1,2-с]пиримидина (соединения Р20, таблица Р)

Порцию 2-бром-1-[3-этилсульфонил-5-[4-(трифторметил)фенил]-2-пиридил]этанона (0,27 ммоль, 118 мг) и 6-(1,1,2,2,2-пентафторэтил)пиримидин-4-амина (0,5 ммоль, 107 мг, полученный как описано в стадии F, пример Н9) в 4 мл CH3CN перемешивали под действием микроволнового облучения при 140°С в течение 2 ч. Затем смесь концентрировали in vacuo и неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с получением указанного в заголовке соединения.
1Н ЯМР (400 Mz, CDCl3) δ 1,41 (t, 3 Н), 4,02 (q, 2 Н), 7,81 (s, 4 Н), 8,01 (s, 1 Н), 8,43 (s, 1 Н), 8,74(s, 1 Н), 9,12 (s, 1 Н), 9,18 (s, 1 Н);19F-ЯМР (300 Mz, CDCl3) δ: -61,13 (s, 3 F), -81,18 (s, 3F), -116,04 (s, 2 F); ESI-MS(+): 551 (M+1).
Пример Н11. Синтез 2-[5-(5,6-дихлор-2-пиридил)-3-этилсульфонил-2-пиридил]-7-(трифторметилсульфанил)имидазо[1,2-с]пиримидина (соединения Р26, таблица Р)

Стадия А. Синтез 6-бром-2-хлорпиридин-3-амина

Порцию 2-хлорпиридин-3-амина (10 ммоль, 1,28 г CAS: [169833-70-9]) и N-бромсукцинамида (20 ммоль, 3,56 г) в 40 мл DMF перемешивали при температуре окружающей среды в течение 4 ч. По прошествии этого времени смесь выливали в воду и экстрагировали с помощью этилацетата (три раза). Объединенные органические слои высушивали над сульфатом натрия, фильтровали и концентрировали in vacuo. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с получением указанного в заголовке соединения.
1Н-ЯМР (400 Mz, DMSO-d6) δ: 5,71 (s, 2 Н), 7,10 (d, 1H), 7,31(d, 1H).
Стадия В. Синтез 6-бром-2,3-дихлорпиридина

Добавляли изоамилнитрит (2,64 г, 22,56 ммоль) к смеси 6-бром-2,3-дихлорпиридина (1,55 г, 7,52 ммоль) и СuCl2 (2,03 г, 15,04 ммоль) в 30 мл CH3CN, и смесь перемешивали при температуре окружающей среды в течение 4 ч. По прошествии этого времени растворитель удаляли in vacuo и неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с получением указанного в заголовке соединения.
1Н-ЯМР (400 Mz, DMSO-d6) δ: 7,71 (d, 1H), 8,05 (d, 1Н).
Стадия С. Синтез трибутил-(5,6-дихлор-2-пиридил)станнана

К раствору 6-бром-2,3-дихлорпиридина (1,125 г, 5 ммоль) в 40 мл сухого толуола при -60°С добавляли н-бутиллитий (2,4 мл 2,5 М раствора в гексане, 6 ммоль) в атмосфере азота. После перемешивания в течение 30 мин. медленно добавляли Bu3SnCl (1,8 г, 5,5 ммоль) в течение периода 10 мин. и смесь перемешивали при -60°С в течение 1 ч. Охлаждающую баню удаляли и обеспечивали нагревание раствора до температуры окружающей среды в течение 1 часа. Реакционную смесь выливали в воду, и экстрагировали с помощью простого эфира (3×100 мл), и объединенные органические слои промывали водой, высушивали над MgSO4 и концентрировали in vacuo. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с получением указанного в заголовке соединения.
1Н ЯМР (400 Mz, CDCl3) δ (ррm): 0,87 (t, 9Н), 1,15 (m, 6Н), 1,32 (m, 6Н), 1,55 (m, 6 Н), 7,28 (d, 1H), 7,55 (d, 1H).
Стадия D. Синтез 6-(трифторметилсульфанил)пиримидин-4-амина

К раствору 6-бромпиримидин-4-амина (1,75 г, 10 ммоль) в 45 мл сухого CH3CN добавляли (bpy)CuSCF3 (4,8 г, 15 ммоль, приобретенный у Aspira Scientific). Смесь нагревали с обратным холодильником при 100°С в течение 2 ч в атмосфере азота. Затем смесь фильтровали и концентрировали in vacuo. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с получением указанного в заголовке соединения, 6-(трифторметилсульфанил)пиримидин-4-амина.
1Н-ЯМР (400 Mz, DMSO-d6) δ: 6,60 (s, 1H), 7,26 (s, 2H), 8,29 (s, 1H).19F-ЯМР (300 Mz, DMSO-d6) δ: -42,45 (s, 3F).
Стадия E. Синтез 2-(5-бром-3-этилсульфонил-2-пиридил)-7-(трифторметилсульфанил)имидазо[1,2-с]пиримидина

2-Бром-1-(5-бром-3-этилсульфонил-2-пиридил)этанон (370 мг, 1 ммоль) и 6-(трифторметилсульфанил)пиримидин-4-амин (234 мг, 1,2 ммоль) в 5 мл CH3CN перемешивали при действием микроволнового облучения при 135°С в течение 2 часов. Затем смесь концентрировали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с получением указанного в заголовке соединения.
1Н ЯМР (400 Mz, CDCl3) δ 1,35 (t, 3Н), 3,91 (q, 2Н), 7,89 (s, 1H), 8,28 (s, 1H), 8,65 (s, 1Н), 8,92 (s, 1H), 9,06 (s, 1Н);19F-ЯМР (300 Mz, CDCl3) δ: -38,47 (s, 3F); ESI-MS(+): 491 (M+Na).
Стадия F. Синтез соединения 2-[5-(5,6-дихлор-2-пиридил)-3-этилсульфонил-2-пиридил]-7-(трифторметилсульфанил)имидазо[1,2-с]пиримидина (соединения Р26, таблица Р)

Порцию трибутил-(5,6-дихлор-2-пиридил)станнана (262 мг, 0,6 ммоль) добавляли к смеси 2-(5-бром-3-этилсульфонил-2-пиридил)-7-(трифторметилсульфанил)имидазо[1,2-с]пиримидина (140 мг, 0,3 ммоль), CuI (57 мг, 0,3 ммоль) и PdCl2(PPh3)2 (42 мг, 0,06 ммоль) в 30 мл 1,4-диоксана и смесь нагревали с обратным холодильником при 120°С в течение 8 часов. Посредством концентрирования in vacuo, очистки с помощью колоночной хроматографии на силикагеле получали указанное в заголовке соединение.
1Н ЯМР (400 Mz, DMSO-d6) δ: 1,30 (t, 3Н), 4,19 (q, 2Н),8,27 (s, 1Н), 8,36 (d, 2H), 8,69(s, 1H), 9,01 (s, 1H), 9,60(d, 2H);19F-ЯМР (300 Mz, DMSO-d6) δ: -37,41 (s, 3F); ESI-MS(-): 570 (M+Cl); LC-MS: 534 (M+1).
Пример H12. Синтез 2-[3-этилсульфонил-5-[4-(трифторметил)-2-пиридил]-2-пиридил1-7-(трифторметилсульфанил)имидазо[1,2-с]пиримидина (соединения Р27, таблица Р)
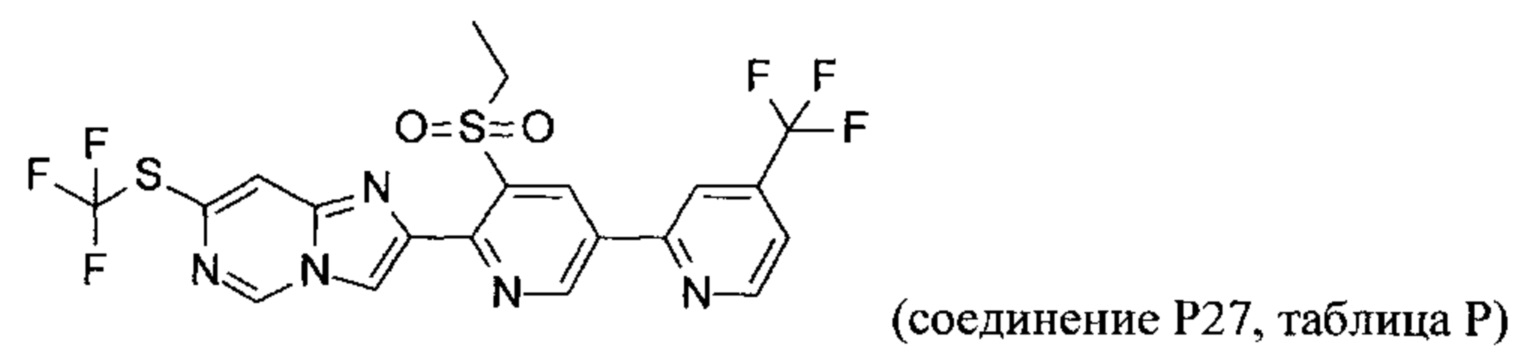
Стадия А. Синтез трибутил-[4-(трифторметил)-2-пиридил]станнана

К смеси 2-бром-4-(трифторметил)пиридина (1,827 г, 8 ммоль) в толуоле (20 мл), охлажденной до -70°С, по каплям добавляли н-бутиллитий (0,9 мл, 9,6 ммоль) в защитной атмосфере азота. Через 30 минут к смеси медленно добавляли хлорид три-н-бутилолова (2,58 мл, 8,8 ммоль). Затем смесь перемешивали при температуре окружающей среды. Через 1 ч раствор промывали и экстрагировали с помощью этилацетата. Остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат=20:1) с получением трибутил-[4-(трифторметил)-2-пиридил]станнана.
1Н ЯМР (400 Mz, CDCl3) δ 8,90 (d, 1 Н, J=12 Гц), 7,56 (m, 1 Н), 7,28 (m, 1 Н), 1,54 (m, 6 Н), 1,30 (m, 6 Н), 1,14 (m, 6 Н), 0,86 (m, 9 Н).
Синтез 1-[3-этилсульфонил-5-[4-(трифторметил)-2-пиридил]-2-пиридил]этанона

Смесь трибутил-[4-(трифторметил)-2-пиридил]станнана (1,5 г, 3,4 ммоль), 1-(5-бром-3-этилсульфонил-2-пиридил)этанона (1 г, 3,4 ммоль), йодида меди (131 мг, 0,68 ммоль) и дихлорида бис(трифенилфосфин)палладия(II) (241 мг, 0,34 ммоль) в 1,4-диоксане (15 мл) нагревали до температуры флегмы в течение ночи в атмосфере азота. После охлаждения смеси до температуры окружающей среды растворитель выпаривали in vacuo. Остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат=4:1) с получением 1-[3-этилсульфонил-5-[4-(трифторметил)-2-пиридил]-2-пиридил]этанона.
1Н ЯМР (300 Mz, CDCl3) δ(ppm): 9,47 (s, 1 Н), 8,98 (s, 2 Н), 8,045 (s, 1 Н), 7,926 (s, 1 Н), 3,636 (m, 2 Н), 2,772 (s, 3 Н), 1,394 (m, 3 Н).19F (300 Mz, CDCl3) δ(ppm): -63,04 (s, 3H); ESI-MS(Na+): 381.
Стадия В. Синтез 1-бром-3-[(Z)-2-[4-(трифторметил)-2-пиридил]проп-2-енилиденамино]пропан-2-она

Смесь 1-[3-этилсульфонил-5-[4-(трифторметил)-2-пиридил]-2-пиридил]этанона (358 мг, 1 моль) и CuBr2 (446 мг, 2 ммоль) в ацетонитриле и трихлорметане нагревали при 130°С в запаянной пробирке в течение 8 ч. После охлаждения реакционной смеси до температуры окружающей среды растворитель выпаривали in vacuo. Остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат=4:1) с получением неочищенного 1-бром-3-[(2)-2-[4-(трифторметил)-2-пиридил]проп-2-енилиденамино]пропан-2-она, который применяли на следующей стадии без дополнительной очистки.
Стадия С. Синтез соединения 2-[3-этилсульфонил-5-[4-(трифторметил)-2-пиридил]-2-пиридил]-7-(трифторметилсульфанил)имидазо[1,2-с]пиримидина (соединения Р27, таблица Р)
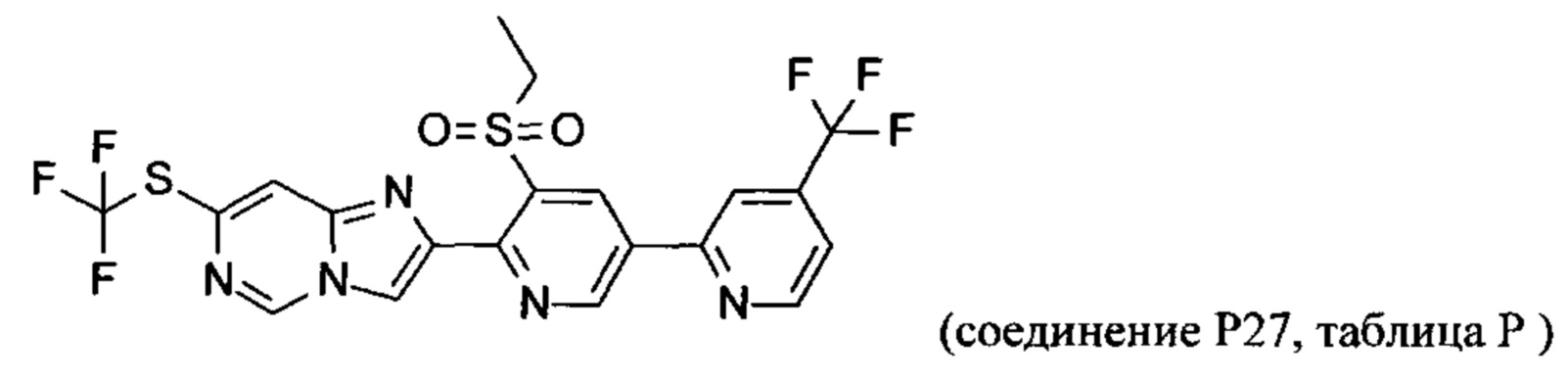
Смесь соединения 5 (184 мг, 0,42 моль) и 6-(трифторметилсульфанил)пиримидин-4-амина (82,1 мг, 0,42 ммоль) в ацетонитриле нагревали при 140°С в реакторе для микроволновой обработки в течение 2 ч. После охлаждения реакционной смеси до температуры окружающей среды растворитель выпаривали in vacuo. Остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат=1:3) с получением 2-[3-этилсульфонил-5-[4-(трифторметил)-2-пиридил]-2-пиридил]-7-(трифторметилсульфанил)имидазо[1,2-с]пиримидина.
1Н ЯМР (400 Mz, CDCl3) δ(ppm): 9,578 (br, 1 Н), 9,1 (br, 2 Н), 8,973 (d, J=4,4 Гц, 1 Н), 8,398 (br, 1 Н), 8,062 (s, 1 Н), 7,92 (br, 1 Н), 7,589 (d, J=5,2 Гц, 1H), 3,975 (m, 2 Н), 1,628 (br, 3 Н).19F (400 Mz, CDCl3) δ (ррm): -39,4 (s, 3 Н), -63,7(s, 3 Н). ESI-MS(H+): 534.
Пример Н13. 1-[5-Этилсульфонил-6-[7-(трифторметил)имидазо[1,2-с]пиримидин-2-ил]-3-пиридил]циклопропанкарбонитрил (соединение Р8, таблица Р)

Стадия А. Синтез 1-(5-хлор-3-этилсульфанил-2-пиридил)этанона
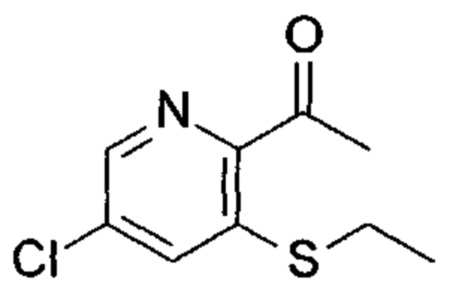
Смешивали 1-(5-хлор-3-фтор-2-пиридил)этанон (50 г, 288,07 ммоль) и карбонат калия (79,628 г, 576,14 ммоль) в N,N-диметилформамиде (576,14 мл) и охлаждали при -10°С. Добавляли этантиол (22 мл, 288,07 ммоль) и реакционную смесь перемешивали при температуре окружающей среды в течение 16 часов. Добавляли воду и водный слой экстрагировали с помощью этилацетата. Объединенные органические слои промывали водой, высушивали над безводным сульфатом магния, а затем концентрировали при пониженном давлении. Неочищенное вещество очищали посредством флэш-хроматографии на силикагеле с получением 1-(5-хлор-3-этилсульфанил-2-пиридил)этанона.
LCMS (Способ 1): 216 (М+Н)+; время удерживания: 1,01 минуты
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ(ppm) 1,41 (t, J=7,52 Гц, 4 Н) 2,68 (s, 3 Н) 2,90 (q,
J=7,34 Гц, 2 Н) 7,61 (d, J=l,83 Гц, 1 Н) 8,31 (d, J=2,20 Гц, 1 Н)
Стадия В. Синтез 1-(5-хлор-3-этилсульфонил-2-пиридил)этанона

В трехгорлой колбе в атмосфере аргона растворяли 1-(5-хлор-3-этилсульфанил-2-пиридил)этанон (24 г, 111,27 ммоль) в дихлорметане (480 мл) и охлаждали при 0°С. Затем добавляли 3-хлорпероксибензойную кислоту (57,602 г, 233,66 ммоль) и реакционную смесь перемешивали 30 мин. при 0°С, затем нагревали при температуре окружающей среды и перемешивали в течение одной ночи. LCMS показала завершение реакции. Реакционную смесь гасили с помощью 1 М NaOH и раств. тиосульфата натрия. Водный слой 3 раза экстрагировали с помощью дихлорметана. Объединенные органические слои промывали 1 М NaOH (5 раз), солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали в вакууме с получением 1-(5-хлор-3-этилсульфонил-2-пиридил)этанона.
LCMS (Способ 1): 248 (М+Н)+; время удерживания: 0,84 минуты
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ(ppm) 1,36 (t, J=7,34 Гц, 3 Н) 2,70 (s, 3 Н) 3,60 (q, J=7,70 Гц, 2 Н) 3,56-3,65 (m, 2 Н) 8,36 (d, J=2,20 Гц, 1 Н) 8,75 (d, J=2,20 Гц, 1 Н)
Стадия С. Синтез 2-бром-1-(5-хлор-3-этилсульфонил-2-пиридил)этанона
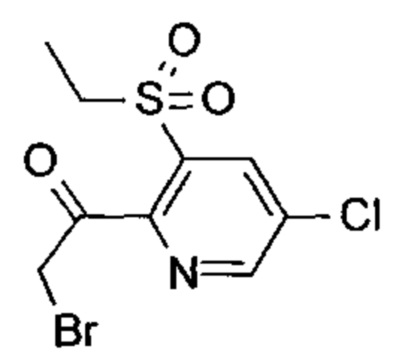
В сосуде для микроволновой обработки смешивали вместе 1-(5-хлор-3-этилсульфонил-2-пиридил)этанон (6 г, 24,223 ммоль), дибромид меди (10,820 г, 48,446 ммоль), ацетонитрил (21 мл) и хлороформ (21 мл) и реакционную смесь перемешивали 55 мин. при 140°С в системе для микроволнового облучения. LCMS анализ показал образование продукта. Реакционную смесь выпаривали в вакууме. Остаток растворяли в дихлорметане (200 мл) и метаноле (5 мл) и фильтровали. Маточный раствор промывали с помощью NаНСО3 и 1 н. NH4OH. Водный слой экстрагировали с помощью этилацетата (100 мл). Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Неочищенное вещество очищали посредством флэш-хроматографии на силикагеле с получением 2-бром-1-(5-хлор-3-этилсульфонил-2-пиридил)этанона.
LCMS (Способ 1): 327 (М+Н)+; время удерживания: 0,89 минуты
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ(ppm) 1,40 (t, J=7,52 Гц, 3 Н) 3,66 (q, J=7,58 Гц, 2 Н) 4,75 (s, 2 Н) 8,45 (d, J=2,20 Гц, 1 Н) 8,81 (d, J=2,20 Гц, 1 Н)
Стадия D. Синтез 2-(5-хлор-3-этилсульфонил-2-пиридил)-7-(трифторметил)имидазо[1,2-с]пиримидина

В сосуде для микроволновой обработки 2-бром-1-(5-хлор-3-этилсульфонил-2-пиридил)этанон (1,05 г, 3,21 ммоль) и 4-(трифторметил)-1,6-дигидропиримидин-6-амин (0,541 г, 3,21 ммоль) растворяли в ацетонитриле (10,5 мл). Перемешивали содержимое сосудов в течение 1 часа при 150°С в системе для микроволнового облучения. LCMS анализ показал массу продукта. Реакционную смесь выпаривали в вакууме. Остаток растворяли в дихлорметане и промывали с помощью нас.раств. NаНСО3 и 1 н. NH4OH. Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный продукт очищали посредством флэш-хроматографии на силикагеле с получением указанного в заголовке соединения.
LCMS (Способ 1): 391 (М+Н)+; время удерживания: 0,95 минуты
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,39 (t, J=7,34 Гц, 3 Н) 3,99 (q, J=7,34 Гц, 2 Н) 7,96 (s, 1 Н) 8,35 (s, 1 Н) 8,54 (d, J=2,20 Гц, 1 Н) 8,84 (d, J=2,57 Гц, 1 Н) 9,17 (s, 1 Н)
Стадия D. Синтез 2-[5-этилсульфонил-6-[7-(трифторметил)имидазо[1,2-с]пиримидин-2-ил]-3-пиридил]ацетонитрила (соединения Р30, таблица Р)

В сосуде для микроволновой обработки, в атмосфере аргона, разбавляли 2-(5-хлор-3-этилсульфонил-2-пиридил)-7-(трифторметил)имидазо[1,2-с]пиримидин (0,3 г, 0,7677 ммоль) диметилформамидом (1,5 мл). Добавляли TMSAN (0,321 мл, 2,303 ммоль), дифторид цинка (0,04761 г, 0,4606 ммоль), XANTPHOS (0,0181 г, 0,03071 ммоль) и PD2(DBA)3 (0,01406 г, 0,01535 ммоль) и сосуд закупоривали и нагревали при 140°С в течение 45 мин. в системе для микроволнового облучения. LCMS анализ показал образование продукта. Реакционную смесь разбавляли этилацетатом и фильтровали через Hyflo. Маточный раствор экстрагировали с помощью смеси воды и хлорида аммония, затем солевого раствора, высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Неочищенное вещество очищали посредством флэш-хроматографии на силикагеле с получением 2-[5-этилсульфонил-6-[7-(трифторметил)имидазо [1,2-с]пиримидин-2-ил]-3-пиридил]ацетонитрила. LCMS (Способе 1): 396 (М+Н)+; время удерживания: 0,82 минуты
1-[5-Этилсульфонил-6-[7-(трифторметил)имидазо[1,2-с]пиримидин-2-ил]-3-пиридил]циклопропанкарбонитрил (соединение Р8, таблица Р)

Порцию 2-[5-этилсульфонил-6-[7-(трифторметил)имидазо[1,2-с]пиримидин-2-ил]-3-пиридил]ацетонитрила (0,075 г, 0,1897 ммоль) растворяли в ацетонитриле (2,25 мл). Добавляли карбонат дицезия (0,1234 г, 0,3794 ммоль) и 1,2-дибромэтан (0,0334 мл, 0,3794 ммоль) при температуре окружающей среды. Полученную в результате смесь перемешивали при 80°С в течение 1 часа. LCMS анализ показал образование продукта. Реакционную смесь выпаривали. Остаток разбавляли этилацетатом и водой. Водный слой 3 раза экстрагировали с помощью этилацетата. Объединенный органический слой один раз промывали водой и солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали посредством флэш-хроматографии на силикагеле с получением 1-[5-этилсульфонил-6-[7-(трифторметил)имидазо[1,2-с]пиримидин-2-ил]-3-пиридил]циклопропанкарбонитрила. LCMS (Способе 1): 422 (М+Н)+; время удерживания: 0,89 минуты
Пример I2. Получение метил-5-(1-цианоциклопропил)-3-этилсульфонилпиридин-2-карбоксилата (соединения I8, таблица I)

Стадия 1. Получение метил-5-бром-3-этилсульфонилпиридин-2-карбоксилата

Метил-5-бром-3-этилсульфанилпиридин-2-карбоксилат (24,4 г, 88,4 ммоль, стадия В1 в примере Р1)) суспендировали в дихлорметане (250 мл), охлаждали до 0°С и обрабатывали по частям с помощью mСРВА (37,6 г, 185,7 ммоль). Смесь перемешивали при температуре окружающей среды в течение 18 часов. Смесь разбавляли водой и дихлорметаном, водную фазу снова экстрагировали с помощью дихлорметана (два раза) и объединенные органические фазы промывали с помощью Na2S2O4 и высушивали над Na2SO4. Посредством частичного концентрирования растворителя получали твердое вещество (необходимое, указанное в заголовке соединение), которое фильтровали. Фильтрат выпаривали досуха, очищали посредством хроматографии на силикагеле с получением дополнительно чистого указанного в заголовке соединения в виде белого твердого вещества.
LCMS (Способ 1): 308/310 (М+Н)+; время удерживания: 0,76 минуты
(d6-DMSO, 400 МГц): 9,08 (d, J=2,4 Гц, 1Н), 8,58 (d, J=2,4 Гц, 1Н), 3,87 (s, 3Н), 3,52 (q, J=7,8 Гц, 2Н), 1,18 (t, J=7,8 Гц, 3Н).
Стадия 2. Получение метил-5-(цианометил)-3-этилсульфонилпиридин-2-карбоксилата

Раствор метил-5-бром-3-этилсульфонилпиридин-2-карбоксилата (2,00 г, 6,49 ммоль) в DMF (13,0 мл) обрабатывали с помощью TMS-ацетонитрила (2,25 г, 2,71 мл, 19,5 ммоль), дифторида цинка (0,403 г, 3,89 ммоль), XANTPHOS (0,153 г, 0,260 ммоль) и Pd2(dba)3 (0,119 г, 0,130 ммоль) в атмосфере аргона. Полученную в результате смесь перемешивали в течение 5 часов при 100°С. По прошествии этого времени LCMS показала отсутствие дальнейшего прохождения реакции. Смесь охлаждали, разбавляли с помощью EtOAc и фильтровали через Hyflo. Фильтрат промывали водой/NH4Cl, солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный продукт очищали посредством хроматографии на системе Combiflash с 40 г колонкой и градиентом циклогексан +0-50% этилацетата. Это обеспечивало получение указанного в заголовке соединения в виде желтого масла.
LCMS (Способ 1): 269 (М+Н)+; время удерживания: 0,58 минуты
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm: 1,38 (t, J=7,5 Гц, 3 Н), 3,58 (q, J=7,5 Гц, 2 Н), 3,95 (s, 2 Н), 4,06 (s, 3 Н), 8,37 (d, J=2,20 Гц, 1 Н), 8,86 (d, J=2,20 Гц, 1 Н).
Стадия 3. Получение метил-5-(1-цианоциклопропил)-3-этилсульфонилпиридин-2-карбоксилата (соединения I-8, таблица I)

Метил-5-(цианометил)-3-этилсульфонилпиридин-2-карбоксилат (0,63 г, 2,3 ммоль) растворяли в ацетонитриле (19 мл) и карбонат цезия (2,3 г, 7,0 ммоль) добавляли к бесцветному раствору (раствор потемнел) с последующим добавлением 1,2-дибромэтана (0,90 г, 0,41 мл, 4,7 ммоль). Коричневый раствор перемешивали при температуре бани 80°С. При помощи LC/MS обнаружили необходимую массу при 0,73 через 1,5 ч. Реакционную смесь концентрировали in vacuo и разбавляли с помощью EtOAc и воды. Органический слой отделяли, последовательно промывали водой и солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный продукт растворяли в дихлорметане и адсорбировали на тефлоновых объемных сорбентах. Посредством очистки на картридже с силикагелем (Rf200) с элюированием циклогексаном/EtOAc получали указанное в заголовке соединение в виде бежевой смолы.
LCMS (Способ 1): 295 (М+Н)+; время удерживания: 0,72 минуты
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm: 1,36 (t, J=7,5 Гц, 3 Н), 1,57-1,62 (m, 2 Н), 1,95-2,00 (m, 2 Н), 2,05 (s, 2 Н), 4,04 (s, 4 Н), 8,13 (d, J=2,20 Гц, 1 Н), 8,87 (d, J=2,20 Гц, 1Н).
Пример I-3. Получение 5-(1-цианоциклопропил)-3-этилсульфонилпиридин-2-карбоновой кислоты

Раствор метил-5-(1-цианоциклопропил)-3-этилсульфонилпиридин-2-карбоксилата (0,27 г, 0,92 ммоль) растворяли в THF (4 мл) и воде (1,5 мл) (красный раствор), а затем обрабатывали с помощью LiOH⋅Н2О (0,058 г, 1,4 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов, после этого времени LCMS анализ показал завершение реакции (лишь необходимый продукт при Rt=0,32, способ 1). THF выпаривали in vacuo и остаток подкисляли с помощью 1 М НСl и экстрагировали с помощью ЕtOАс.Органический слой промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo с получением чистого указанного в заголовке продукта в виде бежевого твердого вещества.
LCMS (Способ 1): 281 (М+Н)+; время удерживания: 0,30 минуты
1Н ЯМР (400 МГц, метанол-d4) δ ppm: 1,31 (t, J=7,3 Гц, 3Н), 1,71-1,78 (m, 2 Н), 1,92-1,98 (m, 2 Н), 3,60 (q, J=7,3 Гц, 2 Н), 8,28 (d, J=2,20 Гц, 1 Н), 8,83 (d, J=2,20 Гц, 1 Н).
Пример Н13. Синтез 4-бром-2-[5-этилсульфонил-6-[7-(трифторметил)имидазо[1,2-с] пиримидин-2-ил]-3-пиридил]бутаннитрила (соединения Р13, таблица Р)

Стадия А. Синтез 2-(6-ацетил-5-этилсульфонил-3-пиридил)ацетонитрила

В сосуде разбавляли 1-(5-хлор-3-этилсульфонил-2-пиридил)этанон (2 г, 8,0743 ммоль) диметилформамидом (14,534 мл, 187 ммоль). В атмосфере аргона добавляли 2-триметилсилилацетонитрил (3,38 мл, 24,223 ммоль), дифторид цинка (0,51098 г, 4,8446 ммоль), XANTPHOS (0,191 г, 0,32297 ммоль) и PD2(DBA)3 (0,15245 г, 0,16149 ммоль). Сосуд закупоривали и нагревали при 140°С в течение 45 мин. в системе для микроволнового облучения. LCMS анализ показал образование продукта. Реакционную смесь разбавляли этилацетатом и фильтровали через Hyflo. Маточный раствор промывали с помощью NH4Cl/воды и солевого раствора, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали посредством флэш-хроматографии на силикагеле с получением указанного в заголовке соединения.
LCMS (Способ 1); Rt=0,64 минуты, [М+Н] 253
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,17 (t, J=7,34 Гц, 4 Н) 2,53 (s, 3 Н) 3,40 (q, J=7,34 Гц, 2 Н) 3,74 (s, 2 Н) 8,15 (d, J=1,83 Гц, 1 Н) 8,63 (d, J=1,83 Гц, 1 Н)
Стадия В. Синтез 1-(6-ацетил-5-этилсульфонил-3-пиридил)циклопропанкарбонитрила (соединения I9, таблица I)

2-(6-Ацетил-5-этилсульфонил-3-пиридил)ацетонитрил (0,75 г, 2,973 ммоль) растворяли в ацетонитриле (22,5 мл, 430 ммоль) и карбонат дицезия (2,901 г, 8,918 ммоль) добавляли к бесцветному раствору (раствор потемнел) с последующим добавлением 1,2-дибромэтана (0,523 мл, 5,945 ммоль). Полученную в результате смесь перемешивали при 80°С в течение 3 часов. LCMS анализ показал образование продукта. Реакционную смесь выпаривали и остаток разбавляли этилацетатом и водой.
Водный слой 3 раза экстрагировали с помощью этилацетата. Объединенный органический слой промывали водой, затем солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали посредством флэш-хроматографии на силикагеле с получением указанного в заголовке соединения.
LCMS (Способ 1); Rt=0,76 минуты, [М+Н] 279
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,38 (t, J=7,52 Гц, 3 Н) 1,60-1,66 (m, 2 Н) 1,97-2,03 (m, 2 Н) 2,76 (s, 3 Н) 3,62 (q, J=7,46 Гц, 2 Н) 8,12 (d, J=2,20 Гц, 1 Н) 8,90 (d, J=2,20 Гц, 1 Н)
Стадия С. Синтез 4-бром-2-[6-(2-бромацетил)-5-этилсульфонил-3-пиридил]бутаннитрила
Порцию 1-(6-ацетил-5-этилсульфонил-3-пиридил)циклопропанкарбонитрила (0,34 г, 1,222 ммоль), дибромида меди (0,5457 г, 2,443 ммоль), ацетонитрила (1,19 мл) и хлороформа (1,19 мл) смешивали вместе и полученную в результате смесь перемешивали в течение 55 мин. при 140°С в микроволновой печи. LCMS анализ показал образование продукта. Реакционную смесь выпаривали в вакууме и полученный остаток растворяли в дихлорметане, NаНСО3 и 1 н. NH4OH. Водный слой 3 раза экстрагировали с помощью дихлорметана. Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали в вакууме. Неочищенное вещество очищали посредством флэш-хроматографии на силикагеле, а затем на колонке с обращенной фазой с получением указанного в заголовке соединения.
LCMS (Способ 1); Rt=0,94 минуты, [М+Н] 5041Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,41 (t, J=7,34 Гц, 3 Н) 2,38-2,49 (m, 1 Н) 2,59-2,70 (m, 1 Н) 3,51 (ddd, J=10,91, 5,96, 4,77 Гц, 1 Н) 3,61-3,73 (m, 3 Н) 4,46 (dd, J=9,17, 6,24 Гц, 1 Н) 8,46 (d, J=2,20 Гц, 1 Н) 8,92 (d, J=2,20 Гц, 1 Н)
Стадия D. Синтез 4-бром-2-[5-этилсульфонил-6-[7-(трифторметил)имидазо[1,2-с]пиримидин-2-ил]-3-пиридил]бутаннитрила (соединения Р13, таблица Р)

Порцию 4-бром-2-[6-(2-бромацетил)-5-этилсульфонил-3-пиридил]бутаннитрила (0,085 г, 0,1940 ммоль) и 6-(трифторметил)пиримидин-4-амина (0,03262 г, 0,1940 ммоль) растворяли в ацетонитриле (0,85 мл, 16,3 ммоль) и полученную в результате смесь перемешивали в течение 1 часа при 150°С в микроволновой печи. LCMS анализ показал образование продукта. Реакционную смесь выпаривали в вакууме и неочищенное вещество очищали посредством флэш-хроматографии на силикагеле, а затем на колонке с обращенной фазой с получением указанного в заголовке соединения.
LCMS (Способ 1); Rt=0,93 минуты, [М+Н] 438
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 1,44 (t, J=7,52 Гц, 3 Н) 2,42-2,53 (m, 1 Н) 2,61-2,72 (m, 1 Н) 3,48-3,56 (m, 1 Н) 3,64-3,74 (m, 1 Н) 4,05 (dd, J=7,52, 5,32 Гц, 2 Н) 4,45 (dd, J=8,80, 6,60 Гц, 1 Н) 8,01 (s, 1 Н) 8,42 (s, 1 Н) 8,58 (d, J=2,57 Гц, 1 Н) 8,98 (d, J=2,20 Гц, 1 Н) 9,22 (s, 1 Н)
Предпочтительные композиции составлены, в частности, следующим образом (%=процент по весу).
Эмульгируемые концентраты:
Пылевидные препараты
Суспензионные концентраты:
Смачиваемые порошки:
Грануляты:
Примеры получения
"Мр" означает температуру плавления в °С. Свободные радикалы представляют собой метальные группы.1Н ЯМР измерения регистрировали на спектрометре Brucker 400 МГц, химические сдвиги приведены в ppm согласно со стандартом TMS. Указаны спектры, измеренные в дейтерированных растворителях.
Способы LCMS
Способ 1:
Спектры регистрировали на масс-спектрометре от Waters (одинарном квадрупольном масс-спектрометре SQD, SQDII или ZQ), оснащенном источником электрораспыления (полярность: положительные или отрицательные ионы, капиллярность: 3,00 кВ, диапазон конуса: 30-60 В, экстрактор: 2,00 В, температура источника: 150°С, температура десольватации: 350°С, газовый поток в конусе: 0 л/час, газовый поток десольватации: 650 л/час, диапазон массы: 100-900 Да) и Acquity UPLC от Waters: насос для двухкомпонентных смесей, нагреваемый участок колонки и детектор на диодной матрице. Дегазатор растворителя, насос для двухкомпонентных смесей, нагреваемый участок колонки и детектор на диодной матрице. Колонка: Waters UPLC HSS Т3, 1,8 мм, 30×2,1 мм, температура: 60°С, диапазон длин волн DAD (нм): 210-500; градиент растворителя: А = вода + 5% МеОН + 0,05% НСООН, В = ацетонитрил + 0,05% НСООН; градиент: 10-100% В за 1,2 мин; скорость потока (мл/мин) 0,85.
Способ 2 - Стандартный по продолжительности
Спектры регистрировали на масс-спектрометре от Waters (одинарном квадрупольном масс-спектрометре SQD или ZQ), оснащенном источником электрораспыления (полярность: положительные или отрицательные ионы, капиллярность: 3,00 кВ, диапазон конуса: 30-60 В, экстрактор: 2,00 В, температура источника: 150°С, температура десольватации: 350°С, газовый поток в конусе: 0 л/час, газовый поток десольватации: 650 л/час, диапазон массы: 100-900 Да) и Acquity UPLC от Waters: насос для двухкомпонентных смесей, нагреваемый участок колонки и детектор на диодной матрице. Дегазатор растворителя, насос для двухкомпонентных смесей, нагреваемый участок колонки и детектор на диодной матрице. Колонка: Waters UPLC HSS Т3, 1,8 мм, 30×2,1 мм, температура: 60°С, диапазон длин волн DAD (нм): 210-500; градиент растворителя: А = вода + 5% МеОН + 0,05% НСООН, В = ацетонитрил + 0,05% НСООН: градиент: 0 мин. 0% В, 100% А; 2,7-3,0 мин. 100% В; поток (мл/мин) 0,85.
Способ ESI MS
Способ масс-спектроскопии MS
Масс-спектрометр LC-20AD от Shimadzu (одинарный квадрупольный масс-спектрометр).
Параметры прибора:
способ ионизации: электрораспыление;
полярность: положительные и отрицательные ионы;
капиллярность (kВ) 1,50;
напряжение на конусе (В) неизвестно
экстрактор (В) 5,00;
температура источника (°С) 200;
температура десольватации (°С) 250;
газовый поток конуса (л/ч.) 90
газовый поток для десольватации (л/ч.) 90;
диапазон масс: 50-1000 Да.

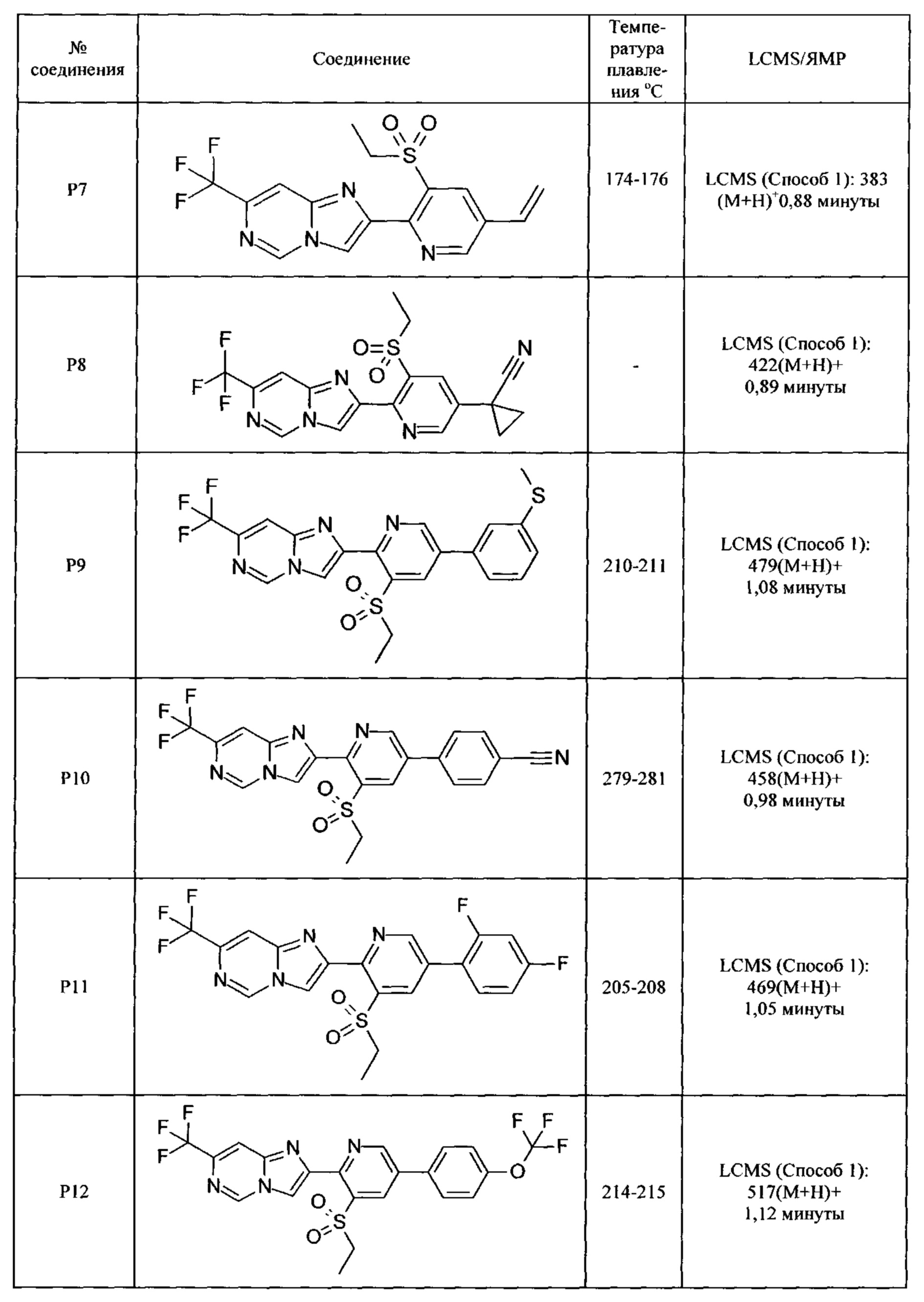


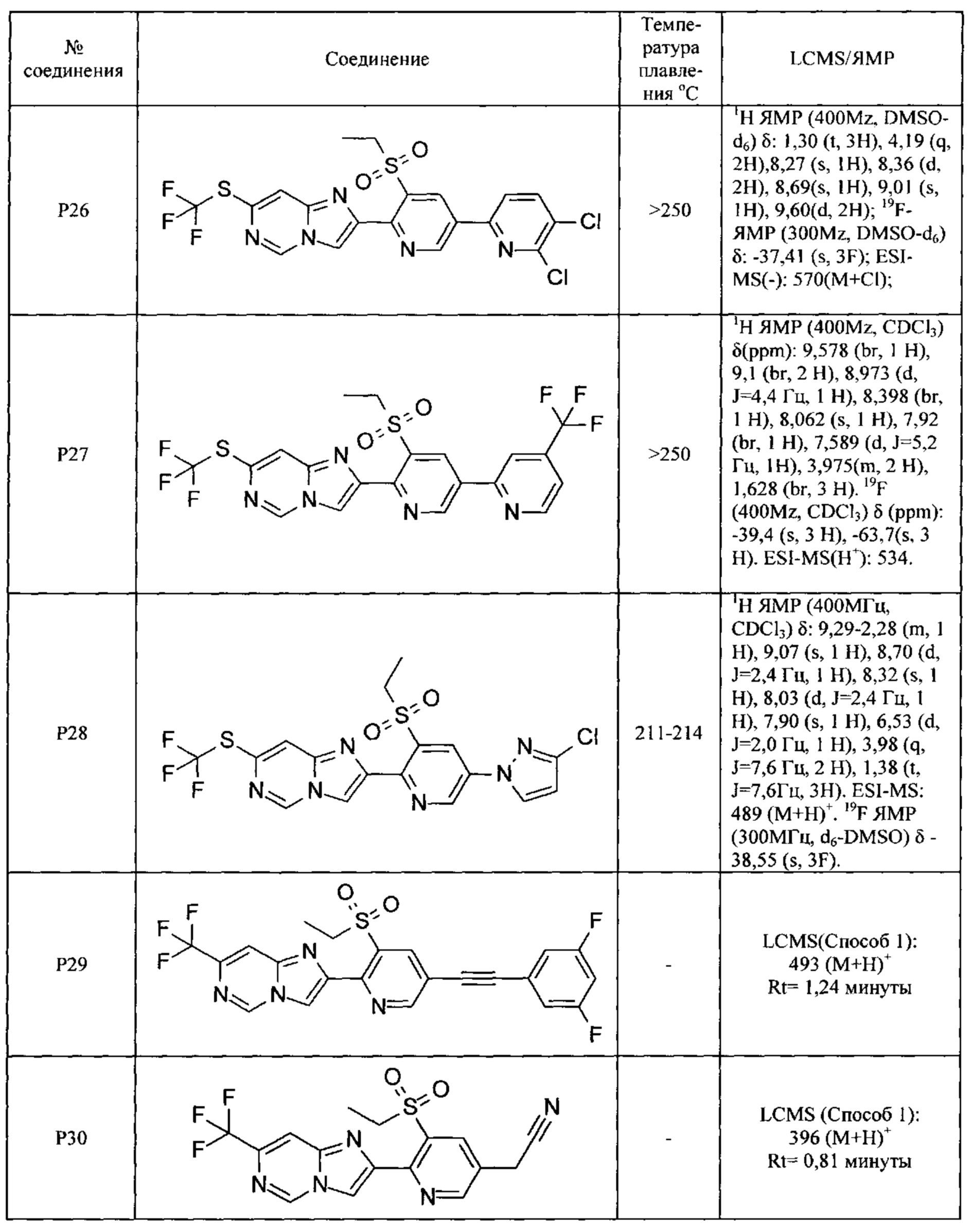
Все другие соединения, перечисленные в таблицах 1-6, можно получать с помощью способов, аналогичных описанным в данном документе в экспериментальной части, и с применением способов, известных специалистам в данной области.


Примеры составов (%=процент по весу)

Эмульсии любой требуемой концентрации можно получить из таких концентратов путем разбавления водой.


Эти растворы пригодны для применения в виде микрокапель.

Активный ингредиент растворяли в дихлорметане, раствор распыляли на носитель(носители) и растворитель затем выпаривали в вакууме.

Готовые к применению пылевидные препараты получают путем тщательного смешивания носителей и активного ингредиента.

Активный ингредиент смешивали с добавками и смесь тщательно размалывали на подходящей мельнице. Благодаря этому получали смачиваемые порошки, которые можно разбавлять водой с получением суспензий любой требуемой концентрации.

Активный ингредиент смешивали с добавками, смесь размалывали, увлажняли водой, экструдировали, гранулировали и сушили в потоке воздуха.

В мешалке мелкоизмельченный активный ингредиент равномерно наносили на каолин, увлажненный полиэтиленгликолем. Благодаря этому получали беспыльные гранулы, покрытые оболочкой.

Мелкоизмельченный активный ингредиент равномерно смешивали с добавками. Суспензии любой требуемой концентрации можно получать из полученного таким образом суспензионного концентрата путем разбавления водой.

Комбинацию тщательно смешивали со вспомогательными веществами и смесь тщательно измельчали в подходящей мельнице с получением порошков, которые можно использовать непосредственно для обработки семян.

Из этого концентрата путем разбавления водой можно получить эмульсии любого необходимого разведения, которые можно применять для защиты растений.

Мелкоизмельченную комбинацию тщательно смешивали со вспомогательными веществами, при этом получали суспензионный концентрат, из которого можно получать суспензии любого необходимого разведения путем разбавления водой.
Используя такие разбавления, живые растения, а также материал для размножения растений можно обработать и защитить от инфицирования микроорганизмами путем распыления, полива или погружения.
Активность композиций согласно настоящему изобретению можно значительно расширить и адаптировать применительно к преобладающим условиям путем добавления других инсектицидно, акарицидно и/или фунгицидно активных ингредиентов. Смеси соединений формулы I с другими инсектицидно, акарицидно и/или фунгицидно активными ингредиентами также могут обладать дополнительными неожиданными преимуществами, которые также могут быть описаны в более широком смысле как синергическая активность. Например, можно контролировать лучшую выносливость у растений, пониженную фитотоксичность, вредителей на разных стадиях их развития или лучшие характеристики при их получении, например, при измельчении или смешивании, при их хранении или при их использовании. Приемлемыми дополнениями к активным ингредиентам являются, например, представители следующих классов активных ингредиентов: фосфорорганические соединения, производные нитрофенола, тиомочевины, ювенильные гормоны, формамидины, производные бензофенона, мочевины, производные пиррола, карбаматы, пиретроиды, хлорированные углеводороды, ацилмочевины, производные пиридилметиленамина, макролиды, неоникотиноиды и препараты Bacillus thuringiensis.
Предпочтительными являются следующие смеси соединений формулы I с активными ингредиентами (аббревиатура "ТХ" означает "одно соединение, выбранное из группы, состоящей из соединений, описанных в таблицах 1-6 настоящего изобретения"):
вспомогательное вещество, выбранное из группы веществ, состоящей из нефтяных масел (628) + ТХ,
акарицид, выбранный из группы веществ, состоящей из 1,1-бис(4-хлорфенил)-2-этоксиэтанола (название согласно IUPAC) (910) + ТХ, 2,4-дихлорфенилбензолсульфоната (название согласно IUPAC/Химической реферативной службе) (1059) + ТХ, 2-фтор-N-метил-N-1-нафтилацетамида (название согласно IUPAC) (1295) + ТХ, 4-хлорфенилфенилсульфона (название согласно IUPAC) (981) + ТХ, абамектина (1) + ТХ, ацеквиноцила (3) + ТХ, ацетопрола [CCN] + ТХ, акринатрина (9) + ТХ, альдикарба (16) + ТХ, альдоксикарба (863) + ТХ, альфа-циперметрина (202) + ТХ, амидитиона (870) + ТХ, амидофлумета [CCN] + ТХ, амидотиоата (872) + ТХ, амитона (875) + ТХ, амитона гидрооксалата (875) + ТХ, амитраза (24) + ТХ, арамита (881) + ТХ, оксида мышьяка (882) + ТХ, AVI 382 (код соединения) + ТХ, AZ 60541 (код соединения) + ТХ, азинфос-этила (44) + ТХ, азинфос-метила (45) + ТХ, азобензола (название по IUPAC) (888) + ТХ, азоциклотина (46) + ТХ, азотоата (889) + ТХ, беномила (62) + ТХ, беноксафоса [CCN] + ТХ, бензоксимата (71) + ТХ, бензилбензоата (название по IUPAC) [CCN] + ТХ, бифеназата (74) + ТХ, бифентрина (76) + ТХ, бинапакрила (907) + ТХ, брофенвалерата+ТХ, бромоциклена (918) + ТХ, бромофоса (920) + ТХ, бромофос-этила (921) + ТХ, бромопропилата (94) + ТХ, бупрофезина (99) + ТХ, бутокарбоксима (103) + ТХ, бутоксикарбоксима (104) + ТХ, бутилпиридабена+ТХ, полисульфида кальция (название согласно IUPAC) (111) + ТХ, камфехлора (941) + ТХ, карбанолата (943) + ТХ, карбарила (115) + ТХ, карбофурана (118) + ТХ, карбофенотиона (947) + ТХ, CGA 50'439 (код разработки) (125) + ТХ, хинометионата (126) + ТХ, хлорбензида (959) + ТХ, хлордимеформа (964) + ТХ, хлордимеформа гидрохлорида (964) + ТХ, хлорфенапира (130) + ТХ, хлорфенетола (968) + ТХ, хлорфенсона (970) + ТХ, хлорфенсульфида (971) + ТХ, хлорфенвинфоса (131) + ТХ, хлоробензилата (975) + ТХ, хлоромебуформа (977) + ТХ, хлорометиурона (978) + ТХ, хлорпропилата (983) + ТХ, хлорпирифоса (145) + ТХ, хлорпирифос-метила (146) + ТХ, хлортиофоса (994) + ТХ, цинерина I (696) + ТХ, цинерина II (696) + ТХ, цинеринов (696) + ТХ, клофентезина (158) + ТХ, клозантела [CCN] + ТХ, кумафоса (174) + ТХ, кротамитона [CCN] + ТХ, кротоксифоса (1010) + ТХ, куфранеба (1013) + ТХ, циантоата (1020) + ТХ, цифлуметофена (Регистрационный №СAS: 400882-07-7) + ТХ, цигалотрина (196) + ТХ, цигексатина (199) + ТХ, циперметрина (201) + ТХ, DCPM (1032) + ТХ, DDT (219) + ТХ, демефиона (1037) + ТХ, демефиона-O (1037) + ТХ, демефиона-S (1037) + ТХ, деметона (1038) + ТХ, деметон-метила (224) + ТХ, деметона-О (1038) + ТХ, деметон-О-метила (224) + ТХ, деметона-S (1038) + ТХ, деметон-S-метила (224) + ТХ, деметон-S-метилсульфона (1039) + ТХ, диафентиурона (226) + ТХ, диалифоса (1042) + ТХ, диазинона (227) + ТХ, дихлофлуанида (230) + ТХ, дихлорфоса (236) + ТХ, диклифоса + ТХ, дикофола (242) + ТХ, дикротофоса (243) + ТХ, диенохлора (1071) + ТХ, димефокса (1081) + ТХ, диметоата (262) + ТХ, динактина (653) + ТХ, динекса (1089) + ТХ, динекс-диклексина (1089) + ТХ, динобутона (269) + ТХ, динокапа (270) + ТХ, динокапа-4 [CCN] + ТХ, динокапа-6 [CCN] + ТХ, диноктона (1090) + ТХ, динопентона (1092) + ТХ, диносульфона (1097) + ТХ, динотербона (1098) + ТХ, диоксатиона (1102) + ТХ, дифенилсульфона (название по IUPAC) (1103) + ТХ, дисульфирама [CCN] + ТХ, дисульфотона (278) + ТХ, DNOC (282) + ТХ, дофенапина (1113) + ТХ, дорамектина [CCN] + ТХ, эндосульфана (294) + ТХ, эндотиона (1121) + ТХ, EPN (297) + ТХ, эприномектина [CCN] + ТХ, этиона (309) + ТХ, этоат-метила (1134) + ТХ, этоксазола (320) + ТХ, этримфоса (1142) + ТХ, феназафлора (1147) + ТХ, феназаквина (328) + ТХ, оксида фенбутатина (330) + ТХ, фенотиокарба (337) + ТХ, фенпропатрина (342) + ТХ, фенпирада + ТХ, фенпироксимата (345) + ТХ, фензона (1157) + ТХ, фентрифанила (1161) + ТХ, фенвалерата (349) + ТХ, фипронила (354) + ТХ, флуакрипирима (360) + ТХ, флуазурона (1166) + ТХ, флубензимина (1167) + ТХ, флуциклоксурона (366) + ТХ, флуцитрината (367) + ТХ, флуенетила (1169) + ТХ, флуфеноксурона (370) + ТХ, флуметрина (372) + ТХ, фторбензида (1174) + ТХ, флювалината (1184) + ТХ, FMC 1137 (код разработки) (1185) + ТХ, форметаната (405) + ТХ, гидрохлорида форметаната (405) + ТХ, формотиона (1192) + ТХ, формпараната (1193) + ТХ, гамма-НСН (430) + ТХ, глиодина (1205) + ТХ, галфенпрокса (424) + ТХ, гептенофоса (432) + ТХ, гексадецилциклопропанкарбоксилата (название по IUPAC/Химической реферативной службе) (1216) + ТХ, гекситиазокса (441) + ТХ, йодметана (название согласно IUPAC) (542) + ТХ, изокарбофоса (473) + ТХ, изопропил-O-(метоксиаминотиофосфорил)салицилата (название согласно IUPAC) (473) + ТХ, ивермектина [CCN] + ТХ, жасмолина I (696) + ТХ, жасмолина II (696) + ТХ, йодофенфоса (1248) + ТХ, линдана (430) + ТХ, люфенурона (490) + ТХ, малатиона (492) + ТХ, малонобена (1254) + ТХ, мекарбама (502) + ТХ, мефосфолана (1261) + ТХ, месульфена [CCN] + ТХ, метакрифоса (1266) + ТХ, метамидофоса (527) + ТХ, метидатиона (529) + ТХ, метиокарба (530) + ТХ, метомила (531) + ТХ, метилбромида (537) + ТХ, метолкарба (550) + ТХ, мевинфоса (556) + ТХ, мексакарбата (1290) + ТХ, милбемектина (557) + ТХ, оксима мильбемицина [CCN] + ТХ, мипафокса (1293) + ТХ, монокротофоса (561) + ТХ, морфотиона (1300) + ТХ, моксидектина [CCN] + ТХ, наледа (567) + ТХ, NC-184 (код соединения) + ТХ, NC-512 (код соединения) + ТХ, нифлуридида (1309) + ТХ, никкомицинов [CCN] + ТХ, нитрилакарба (1313) + ТХ, комплекса нитрилакарба и хлорида цинка 1:1 (1313) + ТХ, NNI-0101 (код соединения) + ТХ, NNI-0250 (код соединения) + ТХ, ометоата (594) + ТХ, оксамила (602) + ТХ, оксидепрофоса (1324) + ТХ, оксидисульфотона (1325) + ТХ, pp'-DDT (219) + ТХ, паратиона (615) + ТХ, перметрина (626) + ТХ, нефтяных масел (628) + ТХ, фенкаптона (1330) + ТХ, фентоата (631) + ТХ, фората (636) + ТХ, фозалона (637) + ТХ, фосфолана (1338) + ТХ, фосмета (638) + ТХ, фосфамидона (639) + ТХ, фоксима (642) + ТХ, пиримифос-метила (652) + ТХ, полихлортерпенов (традиционное название) (1347) + ТХ, полинактинов (653) + ТХ, проклонола (1350) + ТХ, профенофоса (662) + ТХ, промацила (1354) + ТХ, пропаргита (671) + ТХ, пропетамфоса (673) + ТХ, пропоксура (678) + ТХ, протидатиона (1360) + ТХ, протоата (1362) + ТХ, пиретрина I (696) + ТХ, пиретрина II (696) + ТХ, пиретринов (696) + ТХ, пиридабена (699) + ТХ, пиридафентиона (701) + ТХ, пиримидифена (706) + ТХ, пиримитата (1370) + ТХ, квиналфоса (711) + ТХ, квинтиофоса (1381) + ТХ, R-1492 (код разработки) (1382) + ТХ, RA-17 (код разработки) (1383) + ТХ, ротенона (722) + ТХ, шрадана (1389) + ТХ, себуфоса+ТХ, селамектина [CCN] + ТХ, SI-0009 (код соединения) + ТХ, софамида (1402) + ТХ, спиродиклофена (738) + ТХ, спиромезифена (739) + ТХ, SSI-121 (код разработки) (1404) + ТХ, сульфирама [CCN] + ТХ, сульфлурамида (750) + ТХ, сульфотепа (753) + ТХ, серы (754) + ТХ, SZI-121 (код разработки) (757) + ТХ, тауфлювалината (398) + ТХ, тебуфенпирада (763) + ТХ, ТЕРР (1417) + ТХ, тербама + ТХ, тетрахлорвинфоса (777) + ТХ, тетрадифона (786) + ТХ, тетранактина (653) + ТХ, тетрасула (1425) + ТХ, тиафенокса+ТХ, тиокарбоксима (1431) + ТХ, тиофанокса (800) + ТХ, тиометона (801) + ТХ, тиоквинокса (1436) + ТХ, турингиенсина [CCN] + ТХ, триамифоса (1441) + ТХ, триаратена (1443) + ТХ, триазофоса (820) + ТХ, триазурона+ТХ, трихлорфона (824) + ТХ, трифенофоса (1455) + ТХ, тринактина (653) + ТХ, вамидотиона (847) + ТХ, ванилипрола [CCN] и YI-5302 (код соединения) + ТХ, альгицид, выбранный из группы веществ, состоящей из бетоксазина [CCN] + ТХ, диоктаноата меди (название согласно IUPAC) (170) + ТХ, сульфата меди (172) + ТХ, цибутрина [CCN] + ТХ, дихлона (1052) + ТХ, дихлорфена (232) + ТХ, эндотала (295) + ТХ, фентина (347) + ТХ, гашеной извести [CCN] + ТХ, набама (566) + ТХ, квинокламина (714) + ТХ, квинонамида (1379) + ТХ, симазина (730) + ТХ, ацетата трифенилолова (название согласно IUPAC) (347) и гидроксида трифенилолова (название согласно IUPAC) (347) + ТХ, антигельминтик, выбранный из группы веществ, состоящей из абамектина (1) + ТХ, круфомата (1011) + ТХ, дорамектина [CCN] + ТХ, эмамектина (291) + ТХ, бензоата эмамектина (291) + ТХ, эприномектина [CCN] + ТХ, ивермектина [CCN] + ТХ, оксима мильбемицина [CCN] + ТХ, моксидектина [CCN] + ТХ, пиперазина [CCN] + ТХ, селамектина [CCN] + ТХ, спиносада (737) и тиофаната (1435) + ТХ, авицид, выбранный из группы веществ, состоящей из хлоралоза (127) + ТХ, эндрина (1122) + ТХ, фентиона (346) + ТХ, пиридин-4-амина (название согласно IUPAC) (23) и стрихнина (745) + ТХ, бактерицид, выбранный из группы веществ, состоящей из 1-гидрокси-1H-пиридин-2-тиона (название согласно IUPAC) (1222) + ТХ, 4-(хиноксалин-2-иламино)бензолсульфонамида (название согласно IUPAC) (748) + ТХ, 8-гидроксихинолина сульфата (446) + ТХ, бронопола (97) + ТХ, диоктаноата меди (название согласно IUPAC) (170) + ТХ, гидроксида меди (название согласно IUPAC) (169) + ТХ, крезола [CCN] + ТХ, дихлорфена (232) + ТХ, дипиритиона (1105) + ТХ, додицина (1112) + ТХ, фенаминосульфа (1144) + ТХ, формальдегида (404) + ТХ, гидраргафена [CCN] + ТХ, касугамицина (483) + ТХ, гидрата гидрохлорида касугамицина (483) + ТХ, никеля бис(диметилдитиокарбамата) (название согласно IUPAC) (1308) + ТХ, нитрапирина (580) + ТХ, октилинона (590) + ТХ, оксолиновой кислоты (606) + ТХ, окситетрациклина (611) + ТХ, калия гидроксихинолина сульфата (446) + ТХ, пробеназола (658) + ТХ, стрептомицина (744) + ТХ, стрептомицина сесквисульфата (744) + ТХ, теклофталама (766) + ТХ и тиомерсала [CCN] + ТХ, биологическое средство, выбранное из группы веществ, состоящей из Adoxophyes orana GV (12) + ТХ, Agrobacterium radiobacter (13) + ТХ, Amblyseius spp. (19) + ТХ, Anagrapha falcifera NPV (28) + ТХ, Anagrus atomus (29) + TX, Aphelinus abdominalis (33) + TX, Aphidius colemani (34) + TX, Aphidoletes aphidimyza (35) + TX, Autographa californica NPV (38) + TX, Bacillus firmus (48) + TX, Bacillus sphaericus Neide (научное название) (49) + TX, Bacillus thuringiensis Berliner (научное название) (51) + TX, Bacillus thuringiensis подвид aizawai (научное название) (51) + TX, Bacillus thuringiensis подвид israelensis (научное название) (51) + TX, Bacillus thuringiensis подвид japonensis (научное название) (51) + TX, Bacillus thuringiensis подвид kurstaki (научное название) (51) + TX, Bacillus thuringiensis подвид tenebrionis (научное название) (51) + TX, Beauveria bassiana (53) + TX, Beauveria brongniartii (54) + TX, Chrysoperla carnea (151) + TX, Cryptolaemus montrouzieri (178) + TX, Cydia pomonella GV (191) + TX, Dacnusa sibirica (212) + TX, Diglyphus isaea (254) + TX, Encarsia formosa (научное название) (293) + TX, Eretmocerus eremicus (300) + TX, Helicoverpa zea NPV (431) + TX, Heterorhabditis bacteriophora и H. megidis (433) + TX, Hippodamia convergens (442) + TX, Leptomastix dactylopii (488) + TX, Macrolophus caliginosus (491) + TX, Mamestra brassicae NPV (494) + TX, Metaphycus helvolus (522) + TX, Metarhizium anisopliae разновидность acridum (научное название) (523) + TX, Metarhizium anisopliae разновидность anisopliae (научное название) (523) + TX, Neodiprion sertifer NPV и N. lecontei NPV (575) + TX, Orius spp. (596) + TX, Paecilomyces fumosoroseus (613) + TX, Phytoseiulus persimilis (644) + TX, мультикапсидный вирус ядерного полиэдроза Spodoptera exigua (научное название) (741) + ТХ, Steinernema bibionis (742) + ТХ, Steinernema carpocapsae (742) + ТХ, Steinernema feltiae (742) + TX, Steinernema glaseri (742) + TX, Steinernema riobrave (742) + TX, Steinernema riobravis (742) + TX, Steinernema scapterisci (742) + TX, Steinernema spp.(742) + TX, Trichogramma spp.(826) + TX, Typhlodromus occidentalis (844) и Verticillium lecanii (848) + TX, стерилизатор почвы, выбранный из группы веществ, состоящей из йодметана (название согласно IUPAC) (542) и метилбромида (537) + ТХ,
хемостерилизатор, выбранный из группы веществ, состоящей из афолата [CCN] + ТХ, бисазира [CCN] + ТХ, бусульфана [CCN] + ТХ, дифлубензурона (250) + ТХ, диматифа [CCN] + ТХ, хемел [CCN] + ТХ, хемпы [CCN] + ТХ, метепы [CCN] + ТХ, метиотепы [CCN] + ТХ, метилафолата [CCN] + ТХ, моР3ида [CCN] + ТХ, пенфлурона [CCN] + ТХ, тепы [CCN] + ТХ, тиохемпы [CCN] + ТХ, тиотепы [CCN] + ТХ, третамина [CCN] и уредепы [CCN] + ТХ,
феромон насекомых, выбранный из группы веществ, состоящей из (E)-дец-5-ен-1-илацетата с (E)-дец-5-ен-1-олом (название согласно IUPAC) (222) + ТХ, (E)-тридец-4-ен-1-илацетата (название согласно IUPAC) (829) + ТХ, (E)-6-метилгепт-2-ен-4-ола (название согласно IUPAC) (541) + ТХ, (E,Z)-тетрадека-4,10-диен-1-илацетата (название согласно IUPAC) (779) + ТХ, (Z)-додец-7-ен-1-илацетата (название согласно IUPAC) (285) + ТХ, (2)-гексадец-11-еналя (название согласно IUPAC) (436) + ТХ, (Z)-гексадец-11-ен-1-илацетата (название согласно IUPAC) (437) + ТХ, (Z)-гексадец-13-ен-11-ин-1-илацетата (название согласно IUPAC) (438) + ТХ, (Z)-икоз-13-ен-10-она (название согласно IUPAC) (448) + ТХ, (Z)-тетрадец-7-ен-1-аля (название согласно IUPAC) (782) + ТХ, (Z)-тетрадец-9-ен-1-ола (название согласно IUPAC) (783) + ТХ, (Z)-тетрадец-9-ен-1-илацетата (название согласно IUPAC) (784) + ТХ, (7E,9Z)-додека-7,9-диен-1-илацетата (название согласно IUPAC) (283) + ТХ, (9Z,11E)-тетрадека-9,11-диен-1-илацетата (название согласно IUPAC) (780) + ТХ, (9Z, 12E)-тетрадека-9,12-диен-1-илацетата (название согласно IUPAC) (781) + ТХ, 14-метилоктадец-1-ена (название согласно IUPAC) (545) + ТХ, 4-метилнонан-5-ола с 4-метилнонан-5-оном (название согласно IUPAC) (544) + ТХ, альфа-мультистриатина [CCN] + ТХ, бревикомина [CCN] + ТХ, кодлелура [CCN] + ТХ, кодлемона (167) + ТХ, куелура (179) + ТХ, диспарлура (277) + ТХ, додец-8-ен-1-илацетата (название согласно IUPAC) (286) + ТХ, додец-9-ен-1-илацетата (название согласно IUPAC) (287) + ТХ, додека-8 + ТХ, 10-диен-1-илацетата (название согласно IUPAC) (284) + ТХ, доминикалура [CCN] + ТХ, этил-4-метилоктаноата (название согласно IUPAC) (317) + ТХ, эвгенола [CCN] + ТХ, фронталина [CCN] + ТХ, госсиплура (420) + ТХ, грандлура (421) + ТХ, грандлура I (421) + ТХ, грандлура II (421) + ТХ, грандлура III (421) + ТХ, грандлура IV (421) + ТХ, гексалура [CCN] + ТХ, ипсдиенола [CCN] + ТХ, ипсенола [CCN] + ТХ, японилура (481) + ТХ, линеатина [CCN] + ТХ, литлура [CCN] + ТХ, луплура [CCN] + ТХ, медлура [CCN] + ТХ, мегатомоевой кислоты [CCN] + ТХ, метилэвгенола (540) + ТХ, мускалура (563) + ТХ, октадека-2,13-диен-1-илацетата (название согласно IUPAC) (588) + ТХ, октадека-3,13-диен-1-илацетата (название согласно IUPAC) (589) + ТХ, орфралура [CCN] + ТХ, орикталура (317) + ТХ, острамона [CCN] + ТХ, сиглура [CCN] + ТХ, сордидина (736) + ТХ, сулкатола [CCN] + ТХ, тетрадец-11-ен-1-илацетата (название согласно IUPAC) (785) + ТХ, тримедлура (839) + ТХ, тримедлура А (839) + ТХ, тримедлура B1 (839) + ТХ, тримедлура В2 (839) + ТХ, тримедлура С (839) и транк-кола [CCN] + ТХ,
репеллент для насекомых, выбранный из группы веществ, состоящей из 2-(октилтио)этанола (название согласно IUPAC) (591) + ТХ, бутопироноксила (933) + ТХ, бутокси(полипропиленгликоля) (936) + ТХ, дибутиладипата (название согласно IUPAC) (1046) + ТХ, дибутилфталата (1047) + ТХ, дибутилсукцината (название согласно IUPAC) (1048) + ТХ, диэтилтолуамида [CCN] + ТХ, диметилкарбата [CCN] + ТХ, диметилфталата [CCN] + ТХ, этилгександиола (1137) + ТХ, гексамида [CCN] + ТХ, метоквин-бутила (1276) + ТХ, метилнеодеканамида [CCN] + ТХ, оксамата [CCN] и пикаридина [CCN] + ТХ,
инсектицид, выбранный из группы веществ, состоящей из 1-дихлор-1-нитроэтана (название согласно IUPAC/Химической реферативной службе) (1058) + ТХ, 1,1-дихлор-2,2-бис(4-этилфенил)этана (название согласно IUPAC) (1056) + ТХ, 1,2-дихлорпропана (название согласно IUPAC/Химической реферативной службе) (1062) + ТХ, 1,2-дихлорпропана с 1,3-дихлорпропеном (название согласно IUPAC) (1063) + ТХ, 1-бром-2-хлорэтана (название согласно IUPAC/Химической реферативной службе) (916) + ТХ, 2,2,2-трихлор-1-(3,4-дихлорфенил)этилацетата (название согласно IUPAC) (1451) + ТХ, 2,2-дихлорвинил-2-этилсульфинилэтил-метилфосфата (название согласно IUPAC) (1066) + ТХ, 2-(1,3-дитиолан-2-ил)фенилдиметилкарбамата (название согласно IUPAC/Химической реферативной службе) (1109) + ТХ, 2-(2-бутоксиэтокси)этилтиоцианата (название согласно IUPAC/Химической реферативной службе) (935) + ТХ, 2-(4,5-диметил-1,3-диоксолан-2-ил)фенилметилкарбамата (название согласно IUPAC/Химической реферативной службе) (1084) + ТХ, 2-(4-хлор-3,5-ксилилокси)этанола (название согласно IUPAC) (986) + ТХ, 2-хлорвинилдиэтилфосфата (название согласно IUPAC) (984) + ТХ, 2-имидазолидона (название согласно IUPAC) (1225) + ТХ, 2-изовалерилиндан-1,3-диона (название согласно IUPAC) (1246) + ТХ, 2-метил(проп-2-инил)аминофенилметилкарбамата (название согласно IUPAC) (1284) + ТХ, 2-тиоцианатоэтиллаурата (название согласно IUPAC) (1433) + ТХ, 3-бром-1-хлорпроп-1-ена (название согласно IUPAC) (917) + ТХ, 3-метил-1-фенилпиразол-5-илдиметилкарбамата (название согласно IUPAC) (1283) + ТХ, 4-метил(проп-2-инил)амино-3,5-ксилилметилкарбамата (название согласно IUPAC) (1285) + ТХ, 5,5-диметил-3-оксоциклогекс-1-енилдиметилкарбамата (название согласно IUPAC) (1085) + ТХ, абамектина (1) + ТХ, ацефата (2) + ТХ, ацетамиприда (4) + ТХ, ацетиона [CCN] + ТХ, ацетопрола [CCN] + ТХ, акринатрина (9) + ТХ, акрилонитрила (название согласно IUPAC) (861) + ТХ, аланикарба (15) + ТХ, альдикарба (16) + ТХ, альдоксикарба (863) + ТХ, альдрина (864) + ТХ, аллетрина (17) + ТХ, аллосамидина [CCN] + ТХ, алликсикарба (866) + ТХ, альфа-циперметрина (202) + ТХ, альфа-экдизона [CCN] + ТХ, фосфида алюминия (640) + ТХ, амидитиона (870) + ТХ, амидотиоата (872) + ТХ, аминокарба (873) + ТХ, амитона (875) + ТХ, амитона гидрооксалата (875) + ТХ, амитраза (24) + ТХ, анабазина (877) + ТХ, атидатиона (883) + ТХ, AVI 382 (код соединения) + ТХ, AZ 60541 (код соединения) + ТХ, азадирахтина (41) + ТХ, азаметифоса (42) + ТХ, азинфос-этила (44) + ТХ, азинфос-метила (45) + ТХ, азотоата (889) + ТХ, дельта-эндотоксинов Bacillus thuringiensis (52) + ТХ, бария гексафторсиликата [CCN] + ТХ, бария полисульфида (название согласно IUPAC/Химической реферативной службе) (892) + ТХ, бартрина [CCN] + ТХ, Bayer 22/190 (код разработки) (893) + ТХ, Bayer 22408 (код разработки) (894) + ТХ, бендиокарба (58) + ТХ, бенфуракарба (60) + ТХ, бенсултапа (66) + ТХ, бета-цифлутрина (194) + ТХ, бета-циперметрина (203) + ТХ, бифентрина (76) + ТХ, биоаллетрина (78) + ТХ, изомера биоаллетрин-^-циклопентенила (79) + ТХ, биоэтанометрина [CCN] + ТХ, биоперметрина (908) + ТХ, биоресметрина (80) + ТХ, бис(2-хлорэтил)эфира (название согласно IUPAC) (909) + ТХ, бистрифлурона (83) + ТХ, боракса (86) + ТХ, брофенвалерата+ТХ, бромфенвинфоса (914) + ТХ, бромоциклена (918) + ТХ, бром-DDT [CCN] + ТХ, бромофоса (920) + ТХ, бромофос-этила (921) + ТХ, буфенкарба (924) + ТХ, бупрофезина (99) + ТХ, бутакарба (926) + ТХ, бутатиофоса (927) + ТХ, бутокарбоксима (103) + ТХ, бутоната (932) + ТХ, бутоксикарбоксима (104) + ТХ, бутилпиридабена+ТХ, кадусафоса (109) + ТХ, арсената кальция [CCN] + ТХ, цианида кальция (444) + ТХ, полисульфида кальция (название согласно IUPAC) (111) + ТХ, камфехлора (941) + ТХ, карбанолата (943) + ТХ, карбарила (115) + ТХ, карбофурана (118) + ТХ, сероуглерода (название согласно IUPAC/Химической реферативной службе) (945) + ТХ, тетрахлорметана (название согласно IUPAC) (946) + ТХ, карбофенотиона (947) + ТХ, карбосульфана (119) + ТХ, картапа (123) + ТХ, гидрохлорида картапа (123) + ТХ, цевадина (725) + ТХ, хлорбициклена (960) + ТХ, хлордана (128) + ТХ, хлордекона (963) + ТХ, хлордимеформа (964) + ТХ, хлордимеформа гидрохлорида (964) + ТХ, хлорэтоксифоса (129) + ТХ, хлорфенапира (130) + ТХ, хлорфенвинфоса (131) + ТХ, хлорфлуазурона (132) + ТХ, хлормефоса (136) + ТХ, хлороформа [CCN] + ТХ, хлорпикрина (141) + ТХ, хлорфоксима (989) + ТХ, хлорпразофоса (990) + ТХ, хлорпирифоса (145) + ТХ, хлорпирифос-метила (146) + ТХ, хлортиофоса (994) + ТХ, хромафенозида (150) + ТХ, цинерина I (696) + ТХ, цинерина II (696) + ТХ, цинеринов (696) + ТХ, цис-ресметрина + ТХ, цисметрина (80) + ТХ, клоцитрина+ТХ, клоэтокарба (999) + ТХ, клозантела [CCN] + ТХ, клотианидина (165) + ТХ, ацетоарсенита меди [CCN] + ТХ, арсената меди [CCN] + ТХ, олеата меди [CCN] + ТХ, кумафоса (174) + ТХ, кумитоата (1006) + ТХ, кротамитона [CCN] + ТХ, кротоксифоса (1010) + ТХ, круфомата (1011) + ТХ, криолита (177) + ТХ, CS 708 (код разработки) (1012) + ТХ, цианофенфоса (1019) + ТХ, цианофоса (184) + ТХ, циантоата (1020) + ТХ, циклетрина [CCN] + ТХ, циклопротрина (188) + ТХ, цифлутрина (193) + ТХ, цигалотрина (196) + ТХ, циперметрина (201) + ТХ, цифенотрина (206) + ТХ, циромазина (209) + ТХ, цитиоата [CCN] + ТХ, d-лимонена [CCN] + ТХ, d-тетраметрина (788) + ТХ, DAEP (1031) + ТХ, дазомета (216) + ТХ, DDT (219) + ТХ, декарбофурана (1034) + ТХ, дельтаметрина (223) + ТХ, демефиона (1037) + ТХ, демефиона-О (1037) + ТХ, демефиона-S (1037) + ТХ, деметона (1038) + ТХ, деметон-метила (224) + ТХ, деметона-O (1038) + ТХ, деметон-О-метила (224) + ТХ, деметона-S (1038) + ТХ, деметон-S-метила (224) + ТХ, деметон-S-метилсульфона (1039) + ТХ, диафентиурона (226) + ТХ, диалифоса (1042) + ТХ, диамидафоса (1044) + ТХ, диазинона (227) + ТХ, дикаптона (1050) + ТХ, дихлофентиона (1051) + ТХ, дихлорфоса (236) + ТХ, диклифоса+ТХ, дикрезила [CCN] + ТХ, дикротофоса (243) + ТХ, дицикланила (244) + ТХ, диелдрина (1070) + ТХ, диэтил-5-метилпиразол-3-илфосфата (название согласно IUPAC) (1076) + ТХ, дифлубензурона (250) + ТХ, дилора [CCN] + ТХ, димефлутрина [CCN] + ТХ, димефокса (1081) + ТХ, диметана (1085) + ТХ, диметоата (262) + ТХ, диметрина (1083) + ТХ, диметилвинфоса (265) + ТХ, диметилана (1086) + ТХ, динекса (1089) + ТХ, динекс-диклексина (1089) + ТХ, динопропа (1093) + ТХ, диносама (1094) + ТХ, диносеба (1095) + ТХ, динотефурана (271) + ТХ, диофенолана (1099) + ТХ, диоксабензофоса (1100) + ТХ, диоксакарба (1101) + ТХ, диоксатиона (1102) + ТХ, дисульфотона (278) + ТХ, дитикрофоса (1108) + ТХ, DNOC (282) + ТХ, дорамектина [CCN] + ТХ, DSP (1115) + ТХ, экдистерона [CCN] + ТХ, EI 1642 (код разработки) (1118) + ТХ, эмамектина (291) + ТХ, бензоата эмамектина (291) + ТХ, ЕМРС (1120) + ТХ, эмпентрина (292) + ТХ, эндосульфана (294) + ТХ, эндотиона (1121) + ТХ, эндрина (1122) + ТХ, ЕРВР (1123) + ТХ, EPN (297) + ТХ, эпофенонана (1124) + ТХ, эприномектина [CCN] + ТХ, эсфенвалерата (302) + ТХ, этафоса [CCN] + ТХ, этиофенкарба (308) + ТХ, этиона (309) + ТХ, этипрола (310) + ТХ, этоат-метила (1134) + ТХ, этопрофоса (312) + ТХ, этилформиата (название согласно IUPAC) [CCN] + ТХ, этил-DDD (1056) + ТХ, этилендибромида (316) + ТХ, этилендихлорида (химическое название) (1136) + ТХ, этиленоксида [CCN] + ТХ, этофенпрокса (319) + ТХ, этримфоса (1142) + ТХ, EXD (1143) + ТХ, фамфура (323) + ТХ, фенамифоса (326) + ТХ, феназафлора (1147) + ТХ, фенхлорфоса (1148) + ТХ, фенетакарба (1149) + ТХ, фенфлутрина (1150) + ТХ, фенитротиона (335) + ТХ, фенобукарба (336) + ТХ, феноксакрима (1153) + ТХ, феноксикарба (340) + ТХ, фенпиритрина (1155) + ТХ, фенпропатрина (342) + ТХ, фенпирада+ТХ, фенсульфотиона (1158) + ТХ, фентиона (346) + ТХ, фентион-этила [CCN] + ТХ, фенвалерата (349) + ТХ, фипронила (354) + ТХ, флоникамида (358) + ТХ, флубендиамида (регистрационный №CAS: 272451-65-7) + ТХ, флукофурона (1168) + ТХ, флуциклоксурона (366) + ТХ, флуцитрината (367) + ТХ, флуенетила (1169) + ТХ, флуфенерима [CCN] + ТХ, флуфеноксурона (370) + ТХ, флуфенпрокса (1171) + ТХ, флуметрина (372) + ТХ, флювалината (1184) + ТХ, FMC 1137 (код разработки) (1185) + ТХ, фонофоса (1191) + ТХ, форметаната (405) + ТХ, гидрохлорида форметаната (405) + ТХ, формотиона (1192) + ТХ, формпараната (1193) + ТХ, фосметилана (1194) + ТХ, фоспирата (1195) + ТХ, фостиазата (408) + ТХ, фостиэтана (1196) + ТХ, фуратиокарба (412) + ТХ, фуретрина (1200) + ТХ, гамма-цигалотрина (197) + ТХ, гамма-НСН (430) + ТХ, гуазатина (422) + ТХ, ацетатов гуазатина (422) + ТХ, GY-81 (код разработки) (423) + ТХ, галфенпрокса (424) + ТХ, галофенозида (425) + ТХ, НСН (430) + ТХ, HEOD (1070) + ТХ, гептахлора (1211) + ТХ, гептенофоса (432) + ТХ, гетерофоса [CCN] + ТХ, гексафлумурона (439) + ТХ, HHDN (864) + ТХ, гидраметилнона (443) + ТХ, циановодорода (444) + ТХ, гидропрена (445) + ТХ, хиквинкарба (1223) + ТХ, имидаклоприда (458) + ТХ, имипротрина (460) + ТХ, индоксакарба (465) + ТХ, йодметана (название согласно IUPAC) (542) + ТХ, IPSP (1229) + ТХ, исазофоса (1231) + ТХ, изобензана (1232) + ТХ, изокарбофоса (473) + ТХ, изодрина (1235) + ТХ, изофенфоса (1236) + ТХ, изолана (1237) + ТХ, изопрокарба (472) + ТХ, изопропил-O-(метоксиаминотиофосфорил)салицилата (название согласно IUPAC) (473) + ТХ, изопротиолана (474) + ТХ, изотиоата (1244) + ТХ, изоксатиона (480) + ТХ, ивермектина [CCN] + ТХ, жасмолина I (696) + ТХ, жасмолина II (696) + ТХ, йодофенфоса (1248) + ТХ, ювенильного гормона I [CCN] + ТХ, ювенильного гормона II [CCN] + ТХ, ювенильного гормона III [CCN] + ТХ, келевана (1249) + ТХ, кинопрена (484) + ТХ, лямбда-цигалотрина (198) + ТХ, арсената свинца [CCN] + ТХ, лепимектина (CCN) + ТХ, лептофоса (1250) + ТХ, линдана (430) + ТХ, лиримфоса (1251) + ТХ, люфенурона (490) + ТХ, литидатиона (1253) + ТХ, м-куменилметилкарбамата (название согласно IUPAC) (1014) + ТХ, фосфида магния (название согласно IUPAC) (640) + ТХ, малатиона (492) + ТХ, малонобена (1254) + ТХ, мазидокса (1255) + ТХ, мекарбама (502) + ТХ, мекарфона (1258) + ТХ, меназона (1260) + ТХ, мефосфолана (1261) + ТХ, хлористой ртути (513) + ТХ, месульфенфоса (1263) + ТХ, метафлумизона (CCN) + ТХ, метама (519) + ТХ, метам-калия (519) + ТХ, метам-натрия (519) + ТХ, метакрифоса (1266) + ТХ, метамидофоса (527) + ТХ, метансульфонилфторида (название согласно IUPAC/Химической реферативной службе) (1268) + ТХ, метидатиона (529) + ТХ, метиокарба (530) + ТХ, метокротофоса (1273) + ТХ, метомила (531) + ТХ, метопрена (532) + ТХ, метоквин-бутила (1276) + ТХ, метотрина (533) + ТХ, метоксихлора (534) + ТХ, метоксифенозида (535) + ТХ, метилбромида (537) + ТХ, метилизотиоцианата (543) + ТХ, метилхлороформа [CCN] + ТХ, метиленхлорида [CCN] + ТХ, метофлутрина [CCN] + ТХ, метолкарба (550) + ТХ, метоксадиазона (1288) + ТХ, мевинфоса (556) + ТХ, мексакарбата (1290) + ТХ, милбемектина (557) + ТХ, оксима мильбемицина [CCN] + ТХ, мипафокса (1293) + ТХ, мирекса (1294) + ТХ, монокротофоса (561) + ТХ, морфотиона (1300) + ТХ, моксидектина [CCN] + ТХ, нафталофоса [CCN] + ТХ, нал еда (567) + ТХ, нафталина (название согласно IUPAC/Химической реферативной службе) (1303) + ТХ, NC-170 (код разработки) (1306) + ТХ, NC-184 (код соединения) + ТХ, никотина (578) + ТХ, сульфата никотина (578) + ТХ, нифлуридида (1309) + ТХ, нитенпирама (579) + ТХ, нитиазина (1311) + ТХ, нитрилакарба (1313) + ТХ, комплекса нитрилакарба и хлорида цинка 1:1 (1313) + ТХ, NNI-0101 (код соединения) + ТХ, NNI-0250 (код соединения) + ТХ, норникотина (традиционное название) (1319) + ТХ, новалурона (585) + ТХ, новифлумурона (586) + ТХ, O-5-дихлор-4-йодфенил-O-этилэтилфосфонотиоата (название согласно IUPAC) (1057) + ТХ, О,О-диэтил-О-4-метил-2-оксо-2H-хромен-7-илфосфоротиоата (название согласно IUPAC) (1074) + ТХ, O,О-диэтил-O-6-метил-2-пропилпиримидин-4-илфосфоротиоата (название согласно IUPAC) (1075) + ТХ, O,O,O',O'-тетрапропилдитиопирофосфата (название согласно IUPAC) (1424) + ТХ, олеиновой кислоты (название согласно IUPAC) (593) + ТХ, ометоата (594) + ТХ, оксамила (602) + ТХ, оксидеметон-метила (609) + ТХ, оксидепрофоса (1324) + ТХ, оксидисульфотона (1325) + ТХ, pp'-DDT (219) + ТХ, парадихлорбензола [CCN] + ТХ, паратиона (615) + ТХ, паратион-метила (616) + ТХ, пенфлурона [CCN] + ТХ, пентахлорфенола (623) + ТХ, пентахлорфениллаурата (название согласно IUPAC) (623) + ТХ, перметрина (626) + ТХ, нефтяных масел (628) + ТХ, РН 60-38 (код разработки) (1328) + ТХ, фенкаптона (1330) + ТХ, фенотрина (630) + ТХ, фентоата (631) + ТХ, фората (636) + ТХ, фозалона (637) + ТХ, фосфолана (1338) + ТХ, фосмета (638) + ТХ, фоснихлора (1339) + ТХ, фосфамидона (639) + ТХ, фосфина (название согласно IUPAC) (640) + ТХ, фоксима (642) + ТХ, фоксим-метила (1340) + ТХ, пириметафоса (1344) + ТХ, пиримикарба (651) + ТХ, пиримифос-этила (1345) + ТХ, пиримифос-метила (652) + ТХ, полихлордициклопентадиеновых изомеров (название согласно IUPAC) (1346) + ТХ, полихлортерпенов (традиционное название) (1347) + ТХ, арсенита калия [CCN] + ТХ, тиоцианата калия [CCN] + ТХ, праллетрина (655) + ТХ, прекоцена I [CCN] + ТХ, прекоцена II [CCN] + ТХ, прекоцена III [CCN] + ТХ, примидофоса (1349) + ТХ, профенофоса (662) + ТХ, профлутрина [CCN] + ТХ, промацила (1354) + ТХ, промекарба (1355) + ТХ, пропафоса (1356) + ТХ, пропетамфоса (673) + ТХ, пропоксура (678) + ТХ, протидатиона (1360) + ТХ, протиофоса (686) + ТХ, протоата (1362) + ТХ, протрифенбута [CCN] + ТХ, пиметрозина (688) + ТХ, пираклофоса (689) + ТХ, пиразофоса (693) + ТХ, пиресметрина (1367) + ТХ, пиретрина I (696) + ТХ, пиретрина II (696) + ТХ, пиретринов (696) + ТХ, пиридабена (699) + ТХ, пиридалила (700) + ТХ, пиридафентиона (701) + ТХ, пиримидифена (706) + ТХ, пиримитата (1370) + ТХ, пирипроксифена (708) + ТХ, квассии [CCN] + ТХ, квиналфоса (711) + ТХ, квиналфос-метила (1376) + ТХ, квинотиона (1380) + ТХ, квинтиофоса (1381) + ТХ, R-1492 (код разработки) (1382) + ТХ, рафоксанида [CCN] + ТХ, ресметрина (719) + ТХ, ротенона (722) + ТХ, RU 15525 (код разработки) (723) + ТХ, RU 25475 (код разработки) (1386) + ТХ, риании (1387) + ТХ, рианодина (традиционное название) (1387) + ТХ, сабадиллы (725) + ТХ, шрадана (1389) + ТХ, себуфоса+ТХ, селамектина [CCN] + ТХ, SI-0009 (код соединения) + ТХ, SI-0205 (код соединения) + ТХ, SI-0404 (код соединения) + ТХ, SI-0405 (код соединения) + ТХ, силафлуофена (728) + ТХ, SN 72129 (код разработки) (1397) + ТХ, арсенита натрия [CCN] + ТХ, цианида натрия (444) + ТХ, фторида натрия (название согласно IUPAC/Химической реферативной службе) (1399) + ТХ, гексафторсиликата натрия (1400) + ТХ, пентахлорфеноксида натрия (623) + ТХ, селената натрия (название согласно IUPAC) (1401) + ТХ, тиоцианата натрия [CCN] + ТХ, софамида (1402) + ТХ, спиносада (737) + ТХ, спиромезифена (739) + ТХ, спиротетрамата (CCN) + ТХ, сулкофурона (746) + ТХ, сулкофурон-натрия (746) + ТХ, сульфлурамида (750) + ТХ, сульфотепа (753) + ТХ, сульфурилфторида (756) + ТХ, сульпрофоса (1408) + ТХ, дегтярных масел (758) + ТХ, тау-флювалината (398) + ТХ, тазимкарба (1412) + ТХ, TDE (1414) + ТХ, тебуфенозида (762) + ТХ, тебуфенпирада (763) + ТХ, тебупиримфоса (764) + ТХ, тефлубензурона (768) + ТХ, тефлутрина (769) + ТХ, темефоса (770) + ТХ, ТЕРР (1417) + ТХ, тераллетрина (1418) + ТХ, тербама+ТХ, тербуфоса (773) + ТХ, тетрахлорэтана [CCN] + ТХ, тетрахлорвинфоса (777) + ТХ, тетраметрина (787) + ТХ, тета-циперметрина (204) + ТХ, тиаклоприда (791) + ТХ, тиафенокса+ТХ, тиаметоксама (792) + ТХ, тикрофоса (1428) + ТХ, тиокарбоксима (1431) + ТХ, тиоциклама (798) + ТХ, тиоциклама гидрооксалата (798) + ТХ, тиодикарба (799) + ТХ, тиофанокса (800) + ТХ, тиометона (801) + ТХ, тионазина (1434) + ТХ, тиосултапа (803) + ТХ, тиосултап-натрия (803) + ТХ, турингиенсина [CCN] + ТХ, толфенпирада (809) + ТХ, тралометрина (812) + ТХ, трансфлутрина (813) + ТХ, трансперметрина (1440) + ТХ, триамифоса (1441) + ТХ, триазамата (818) + ТХ, триазофоса (820) + ТХ, триазурона+ТХ, трихлорфона (824) + ТХ, трихлорметафоса-3 [CCN] + ТХ, трихлороната (1452) + ТХ, трифенофоса (1455) + ТХ, трифлумурона (835) + ТХ, триметакарба (840) + ТХ, трипрена (1459) + ТХ, вамидотиона (847) + ТХ, ванилипрола [CCN] + ТХ, вератридина (725) + ТХ, вератрина (725) + ТХ, ХМС (853) + ТХ, ксилилкарба (854) + ТХ, YI-5302 (код соединения) + ТХ, зета-циперметрина (205) + ТХ, зетаметрина + ТХ, фосфида цинка (640) + ТХ, золапрофоса (1469) и ZXI 8901 (код разработки) (858) + ТХ, циантранилипрола [736994-63-19 + ТХ, хлорантранилипрола [500008-45-7] + ТХ, циенопирафена [560121-52-0] + ТХ, цифлуметофена [400882-07-7] + ТХ, пирифлуквиназона [337458-27-2] + ТХ, спинеторама [187166-40-1+187166-15-0] + ТХ, спиротетрамата [203313-25-1] + ТХ, сульфоксафлора [946578-00-3] + ТХ, флуфипрола [704886-18-0] + ТХ, меперфлутрина [915288-13-0] + ТХ, тетраметилфлутрина [84937-88-2] + ТХ, трифлумезопирима (раскрытый в WO 2012/092115) + ТХ,
моллюскоцид, выбранный из группы веществ, состоящей из оксида бис(трибутилолова) (название согласно IUPAC) (913) + ТХ, бромацетамида [CCN] + ТХ, арсената кальция [CCN] + ТХ, клоэтокарба (999) + ТХ, ацетоарсенита меди [CCN] + ТХ, сульфата меди (172) + ТХ, фентина (347) + ТХ, фосфорнокислого железа (название согласно IUPAC) (352) + ТХ, метальдегида (518) + ТХ, метиокарба (530) + ТХ, никлозамида (576) + ТХ, никлозамид-оламина (576) + ТХ, пентахлорфенола (623) + ТХ, пентахлорфеноксида натрия (623) + ТХ, тазимкарба (1412) + ТХ, тиодикарба (799) + ТХ, оксида трибутилолова (913) + ТХ, трифенморфа (1454) + ТХ, триметакарба (840) + ТХ, ацетата трифенилолова (название согласно IUPAC) (347) и гидроксида трифенилолова (название согласно IUPAC) (347) + ТХ, пирипрола [394730-71-3] + ТХ, нематоцид, выбранный из группы веществ, состоящей из AKD-3088 (код соединения) + ТХ, 1,2-дибром-3-хлорпропана (название согласно IUPAC/Химической реферативной службе) (1045) + ТХ, 1,2-дихлорпропана (название согласно IUPAC/Химической реферативной службе) (1062) + ТХ, 1,2-дихлорпропана с 1,3-дихлорпропеном (название согласно IUPAC) (1063) + ТХ, 1,3-дихлорпропена (233) + ТХ, 3,4-дихлортетрагидротиофен-1,1-диоксида (название согласно IUPAC/Химической реферативной службе) (1065) + ТХ, 3-(4-хлорфенил)-5-метилродамина (название согласно IUPAC) (980) + ТХ, 5-метил-6-тиоксо-1,3,5-тиадиазинан-3-илуксусной кислоты (название согласно IUPAC) (1286) + ТХ, 6-изопентениламинопурина (210) + ТХ, абамектина (1) + ТХ, ацетопрола [CCN] + ТХ, аланикарба (15) + ТХ, альдикарба (16) + ТХ, альдоксикарба (863) + ТХ, AZ 60541 (код соединения) + ТХ, бенклотиаза [CCN] + ТХ, беномила (62) + ТХ, бутилпиридабена+ТХ, кадусафоса (109) + ТХ, карбофурана (118) + ТХ, сероуглерода (945) + ТХ, карбосульфана (119) + ТХ, хлорпикрина (141) + ТХ, хлорпирифоса (145) + ТХ, клоэтокарба (999) + ТХ, цитокининов (210) + ТХ, дазомета (216) + ТХ, DBCP (1045) + ТХ, DCIP (218) + ТХ, диамидафоса (1044) + ТХ, дихлофентиона (1051) + ТХ, диклифоса + ТХ, диметоата (262) + ТХ, дорамектина [CCN] + ТХ, эмамектина (291) + ТХ, бензоата эмамектина (291) + ТХ, эприномектина [CCN] + ТХ, этопрофоса (312) + ТХ, этилендибромида (316) + ТХ, фенамифоса (326) + ТХ, фенпирада+ТХ, фенсульфотиона (1158) + ТХ, фостиазата (408) + ТХ, фостиэтана (1196) + ТХ, фурфурала [CCN] + ТХ, GY-81 (код разработки) (423) + ТХ, гетерофоса [CCN] + ТХ, йодметана (название согласно IUPAC) (542) + ТХ, изамидофоса (1230) + ТХ, исазофоса (1231) + ТХ, ивермектина [CCN] + ТХ, кинетина (210) + ТХ, мекарфона (1258) + ТХ, метама (519) + ТХ, метам-калия (519) + ТХ, метам-натрия (519) + ТХ, метилбромида (537) + ТХ, метилизотиоцианата (543) + ТХ, оксима мильбемицина [CCN] + ТХ, моксидектина [CCN] + ТХ, композиции с Myrothecium verrucaria (565) + ТХ, NC-184 (код соединения) + ТХ, оксамила (602) + ТХ, фората (636) + ТХ, фосфамидона (639) + ТХ, фосфокарба [CCN] + ТХ, себуфоса+ТХ, селамектина [CCN] + ТХ, спиносада (737) + ТХ, тербама+ТХ, тербуфоса (773) + ТХ, тетрахлортиофена (название согласно IUPAC/Химической реферативной службе) (1422) + ТХ, тиафенокса + ТХ, тионазина (1434) + ТХ, триазофоса (820) + ТХ, триазурона + ТХ, ксиленолов [CCN] + ТХ, YI-5302 (код соединения) и зеатина (210) + ТХ, флуенсульфона [318290-98-1] + ТХ,
ингибитор нитрификации, выбранный из группы веществ, состоящей из этилксантата калия [CCN] и нитрапирина (580) + ТХ;
активатор роста растений, выбранный из группы веществ, состоящей из ацибензолара (6) + ТХ, ацибензолар-S-метила (6) + ТХ, пробеназола (658) и экстракта Reynoutria sachalinensis (720) + ТХ,
родентицид, выбранный из группы веществ, состоящей из 2-изовалерилиндан-1,3-диона (название согласно IUPAC) (1246) + ТХ, 4-(хиноксалин-2-иламино)бензолсульфонамида (название согласно IUPAC) (748) + ТХ, альфа-хлоргидрина [CCN] + ТХ, фосфида алюминия (640) + ТХ, АНТУ (880) + ТХ, оксида мышьяка (882) + ТХ, карбоната бария (891) + ТХ, бистиосеми (912) + ТХ, бродифакума (89) + ТХ, бромадиолона (91) + ТХ, брометалина (92) + ТХ, цианида кальция (444) + ТХ, хлоралоза (127) + ТХ, хлорофацинона (140) + ТХ, холекальциферола (850) + ТХ, кумахлора (1004) + ТХ, кумафурила (1005) + ТХ, куматетралила (175) + ТХ, кримидина (1009) + ТХ, дифенакума (246) + ТХ, дифетиалона (249) + ТХ, дифацинона (273) + ТХ, эргокальциферола (301) + ТХ, флокумафена (357) + ТХ, фторацетамида (379) + ТХ, флупропадина (1183) + ТХ, гидрохлорида флупропадина (1183) + ТХ, гамма-НСН (430) + ТХ, НСН (430) + ТХ, циановодорода (444) + ТХ, йодметана (название согласно IUPAC) (542) + ТХ, линдана (430) + ТХ, фосфида магния (название согласно IUPAC) (640) + ТХ, метилбромида (537) + ТХ, норбормида (1318) + ТХ, фосацетима (1336) + ТХ, фосфина (название согласно IUPAC) (640) + ТХ, фосфора [CCN] + ТХ, пиндона (1341) + ТХ, арсенита калия [CCN] + ТХ, пиринурона (1371) + ТХ, сциллирозида (1390) + ТХ, арсенита натрия [CCN] + ТХ, цианида натрия (444) + ТХ, фторацетата натрия (735) + ТХ, стрихнина (745) + ТХ, сульфата таллия [CCN] + ТХ, варфарина (851) и фосфида цинка (640) + ТХ,
синергист, выбранный из группы веществ, состоящей из 2-(2-бутоксиэтокси)этилпиперонилата (название согласно IUPAC) (934) + ТХ, 5-(1,3-бензодиоксол-5-ил)-3-гексилциклогекс-2-енона (название согласно IUPAC) (903) + ТХ, фарнезола с неролидолом (324) + ТХ, МВ-599 (код разработки) (498) + ТХ, MGK 264 (код разработки) (296) + ТХ, пиперонилбутоксида (649) + ТХ, пипротала (1343) + ТХ, изомера пропила (1358) + ТХ, S421 (код разработки) (724) + ТХ, сезамекса (1393) + ТХ, сезасмолина (1394) и сульфоксида (1406) + ТХ,
средство для отпугивания животных, выбранное из группы веществ, состоящей из антрахинона (32) + ТХ, хлоралоза (127) + ТХ, нафтената меди [CCN] + ТХ, оксихлорида меди (171) + ТХ, диазинона (227) + ТХ, дициклопентадиена (химическое название) (1069) + ТХ, гуазатина (422) + ТХ, ацетатов гуазатина (422) + ТХ, метиокарба (530) + ТХ, пиридин-4-амина (название согласно IUPAC) (23) + ТХ, тирама (804) + ТХ, триметакарба (840) + ТХ, нафтената цинка [CCN] и зирама (856) + ТХ, вируцид,
выбранный из группы веществ, состоящей из иманина [CCN] и рибавирина [CCN] + ТХ;
защитное средство для ран, выбранное из группы веществ, состоящей из оксида ртути (512) + ТХ, октилинона (590) и тиофанат-метила (802) + ТХ;
и биологически активные соединения, выбранные из группы, состоящей из азаконазола (60207-31-0] + ТХ, битертанола [70585-36-3] + ТХ, бромуконазола [116255-48-2] + ТХ, ципроконазола [94361-06-5] + ТХ, дифеноконазола [119446-68-3] + ТХ, диниконазола [83657-24-3] + ТХ, эпоксиконазола [106325-08-0] + ТХ, фенбуконазола [114369-43-6] + ТХ, флуквинконазола [136426-54-5] + ТХ, флусилазола [85509-19-9] + ТХ, флутриафола [76674-21-0] + ТХ, гексаконазола [79983-71-4] + ТХ, имазалила [35554-44-0] + ТХ, имибенконазола [86598-92-7] + ТХ, ипконазола [125225-28-7] + ТХ, метконазола [125116-23-6] + ТХ, миклобутанила [88671-89-0] + ТХ, пефуразоата [101903-30-4] + ТХ, пенконазола [66246-88-6] + ТХ, протиоконазола [178928-70-6] + ТХ, пирифенокса [88283-41-4] + ТХ, прохлораза [67747-09-5] + ТХ, пропиконазола [60207-90-1] + ТХ, симеконазола [149508-90-7] + ТХ, тебуконазола [107534-96-3] + ТХ, тетраконазола [112281-77-3] + ТХ, триадимефона [43121-43-3] + ТХ, триадименола [55219-65-3] + ТХ, трифлумизола [99387-89-0] + ТХ, тритиконазола [131983-72-7] + ТХ, анцимидола [12771-68-5] + ТХ, фенаримола [60168-88-9] + ТХ, нуаримола [63284-71-9] + ТХ, бупиримата [41483-43-6] + ТХ, диметиримола [5221-53-4] + ТХ, этиримола [23947-60-6] + ТХ, додеморфа [1593-77-7] + ТХ, фенпропидина [67306-00-7] + ТХ, фенпропиморфа [67564-91-4] + ТХ, спироксамина [118134-30-8] + ТХ, тридеморфа [81412-43-3] + ТХ, ципродинила [121552-61-2] + ТХ, мепанипирима [110235-47-7] + ТХ, пириметанила [53112-28-0] + ТХ, фенпиклонила [74738-17-3] + ТХ, флудиоксонила [131341-86-1] + ТХ, беналаксила [71626-11-4] + ТХ, фуралаксила [57646-30-7] + ТХ, металаксила [57837-19-1] + ТХ, R-металаксила [70630-17-0] + ТХ, офураса [58810-48-3] + ТХ, оксадиксила [77732-09-3] + ТХ, беномила [17804-35-2] + ТХ, карбендазима [10605-21-7] + ТХ, дебакарба [62732-91-6] + ТХ, фуберидазола [3878-19-1] + ТХ, тиабендазола [148-79-8] + ТХ, хлозолината [84332-86-5] + ТХ, дихлозолина [24201-58-9] + ТХ, ипродиона [36734-19-7] + ТХ, миклозолина [54864-61-8] + ТХ, процимидона [32809-16-8] + ТХ, винклозолина [50471-44-8] + ТХ, боскалида [188425-85-6] + ТХ, карбоксина [5234-68-4] + ТХ, фенфурама [24691-80-3] + ТХ, флутоланила [66332-96-5] + ТХ, мепронила [55814-41-0] + ТХ, оксикарбоксина [5259-88-1] + ТХ, пентиопирада [183675-82-3] + ТХ, тифлузамида [130000-40-7] + ТХ, гуазатина [108173-90-6] + ТХ, додина [2439-10-3] [112-65-2] (свободное основание) + ТХ, иминоктадина [13516-27-3] + ТХ, азоксистробина [131860-33-8] + ТХ, димоксистробина [149961-52-4] + ТХ, энестробурина {Proc. ВСРС, Int. Congr., Glasgow, 2003,1, 93} + ТХ, флуоксастробина [361377-29-9] + ТХ, крезоксим-метила [143390-89-0] + ТХ, метоминостробина [133408-50-1] + ТХ, трифлоксистробина [141517-21-7] + ТХ, оризастробина [248593-16-0] + ТХ, пикоксистробина [117428-22-5] + ТХ, пираклостробина [175013-18-0] + ТХ, фербама [14484-64-1] + ТХ, манкозеба [8018-01-7] + ТХ, манеба [12427-38-2] + ТХ, метирама [9006-42-2] + ТХ, пропинеба [12071-83-9] + ТХ, тирама [137-26-8] + ТХ, зинеба [12122-67-7] + ТХ, зирама [137-30-4] + ТХ, каптафола [2425-06-1] + ТХ, каптана [133-06-2] + ТХ, дихлофлуанида [1085-98-9] + ТХ, фторимида [41205-21-4] + ТХ, фолпета [133-07-3] + ТХ, толилфлуанида [731-27-1] + ТХ, бордосской смеси [8011-63-0] + ТХ, гидроксида меди [20427-59-2] + ТХ, оксихлорида меди [1332-40-7] + ТХ, сульфата меди [7758-98-7] + ТХ, оксида меди [1317-39-1] + ТХ, манкоппера [53988-93-5] + ТХ, оксин-меди [10380-28-6] + ТХ, динокапа [131-72-6] + ТХ, нитротал-изопропила [10552-74-6] + ТХ, эдифенфоса [17109-49-8] + ТХ, ипробенфоса [26087-47-8] + ТХ, изопротиолана [50512-35-1] + ТХ, фосдифена [36519-00-3] + ТХ, пиразофоса [13457-18-6] + ТХ, толклофос-метила [57018-04-9] + ТХ, ацибензолар-Б-метила [135158-54-2] + ТХ, анилазина [101-05-3] + ТХ, бентиаваликарба [413615-35-7] + ТХ, бластицидина-S [2079-00-7] + ТХ, хинометионата [2439-01-2] + ТХ, хлоронеба [2675-77-6] + ТХ, хлороталонила [1897-45-6] + ТХ, цифлуафенамида [180409-60-3] + ТХ, цимоксанила [57966-95-7] + ТХ, дихлона [117-80-6] + ТХ, диклоцимета [139920-32-4] + ТХ, дикломезина [62865-36-5] + ТХ, диклорана [99-30-9] + ТХ, диэтофенкарба [87130-20-9] + ТХ, диметоморфа [110488-70-5] + ТХ, SYP-LI90 (флуморфа) [211867-47-9] + ТХ, дитианона [3347-22-6] + ТХ, этабоксама [162650-77-3] + ТХ, этридиазола [2593-15-9] + ТХ, фамоксадона [131807-57-3] + ТХ, фенамидона [161326-34-7] + ТХ, феноксанила [115852-48-7] + ТХ, фентина[668-34-8] + ТХ, феримзона [89269-64-7] + ТХ, флуазинама [79622-59-6] + ТХ, флуопиколида [239110-15-7] + ТХ, флусульфамида [106917-52-6] + ТХ, фенгексамида [126833-17-8] + ТХ, фосетил-алюминия [39148-24-8] + ТХ, химексазола [10004-44-1] + ТХ, ипроваликарба [140923-17-7] + ТХ, IKF-916 (циазофамида) [120116-88-3] + ТХ, касугамицина [6980-18-3] + ТХ, метасульфокарба [66952-49-6] + ТХ, метрафенона [220899-03-6] + ТХ, пенцикурона [66063-05-6] + ТХ, фталида [27355-22-2] + ТХ, полиоксинов [11113-80-7] + ТХ, пробеназола [27605-76-1] + ТХ, пропамокарба [25606-41-1] + ТХ, проквиназида [189278-12-4] + ТХ, пироквилона [57369-32-1] + ТХ, квиноксифена [124495-18-7] + ТХ, квинтозена [82-68-8] + ТХ, серы [7704-34-9] + ТХ, тиадинила [223580-51-6] + ТХ, триазоксида [72459-58-6] + ТХ, трициклазола [41814-78-2] + ТХ, трифорина [26644-46-2] + ТХ, валидамицина [37248-47-8] + ТХ, зоксамида (RH7281) [156052-68-5] + ТХ, мандипропамида [374726-62-2] + ТХ, изопиразама [881685-58-1] + ТХ, седаксана [874967-67-6] + ТХ, (9-дихлорметилен-1,2,3,4-тетрагидро-1,4-метанонафтален-5-ил)-амида 3-дифторметил-1 -метил-1Н-пиразол-4-карбоновой кислоты (раскрытого в WO 2007/048556) + ТХ, (3',4',5'-трифторбифенил-2-ил)-амида 3-дифторметил-1-метил-1Н-пиразол-4-карбоновой кислоты (раскрытого в WO 2006/087343) + ТХ, [(3S,4R,4aR,6S,6aS,12R,12aS,12bS)-3-[(циклопропилкарбонил)окси]-1,3,4,4а,5,6,6а,12,12а,12b-декагидро-6,12-дигидрокси-4,6а,12b-триметил-11-оксо-9-(3-пиридинил)-2H,11H-нафто[2,1-b]пирано[3,4-е]пиран-4-ил]метилциклопропанкарбоксилата [915972-17-7] + ТХ и 1,3,5-триметил-N-(2-метил-1-оксопропил)-N-[3-(2-метилпропил)-4-[2,2,2-трифтор-1-метокси-1-(трифторметил)этил]фенил]-1Н-пиразол-4-карбоксамида [926914-55-8] + ТХ; и микроорганизмы, в том числе Acinetobacter lwoffii + ТХ, Acremonium alternatum + ТХ + ТХ, Acremonium cephalosporium + ТХ + ТХ, Acremonium diospyri + ТХ, Acremonium obclavatum + TX, Adoxophyes orana granulovirus (AdoxGV) (Capex®) + TX, Agrobacterium radiobacter, штамм K84 (Galltrol-A®) + TX, Alternaria alternate + TX, Alternaria cassia + TX, Alternaria destruens (Smolder®) + TX, Ampelomyces quisqualis (AQ10®) + TX, Aspergillus flavus AF36 (AF36®) + TX, Aspergillus flavus NRRL 21882 (Aflaguard®) + TX, Aspergillus spp. + TX, Aureobasidium pullulans + TX, Azospirillum + TX, (MicroAZ® + TX, TAZO B®) + TX, Azotobacter + TX, Azotobacter chroocuccum (Azotomeal®) + TX, Azotobacter cysts (Bionatural Blooming Blossoms®) + TX, Bacillus amyloliquefaciens + TX, Bacillus cereus + TX, Bacillus chitinosporus, штамм CM-1 + TX, Bacillus chitinosporus, штамм AQ746 + TX, Bacillus licheniformis, штамм HB-2 (Biostart™ Rhizoboost®) + TX, Bacillus licheniformis, штамм 3086 (EcoGuard® + TX, Green Releaf®) + TX, Bacillus circulans + TX, Bacillus firmus (BioSafe® + TX, BioNem-WP® + TX, VOTiVO®) + TX, Bacillus firmus, штамм I-1582 + TX, Bacillus macerans + TX, Bacillus marismortui + TX, Bacillus megaterium + TX, Bacillus mycoides, штамм AQ726 + TX, Bacillus papillae (Milky Spore Powder®) + TX, Bacillus pumilus spp. + TX, Bacillus pumilus, штамм GB34 (Yield Shield®) + TX, Bacillus pumilus, штамм AQ717 + TX, Bacillus pumilus, штамм QST 2808 (Sonata® + TX, Ballad Plus®) + TX, Bacillus spahericus (VectoLex®) + TX, Bacillus spp. + TX, Bacillus spp., штамм AQ175 + TX, Bacillus spp., штамм AQ177 + TX, Bacillus spp., штамм AQ178 + TX, Bacillus subtilis, штамм QST 713 (CEASE® + TX, Serenade® + TX, Rhapsody®) + TX, Bacillus subtilis, штамм QST 714 (JAZZ®) + TX, Bacillus subtilis, штамм AQ153 + TX, Bacillus subtilis, штамм AQ743 + TX, Bacillus subtilis, штамм QST3002 + TX, Bacillus subtilis, штамм QST3004 + TX, Bacillus subtilis разновидность amyloliquefaciens, штамм FZB24 (Taegro® + TX, Rhizopro®) + TX, Bacillus thuringiensis Cry 2Ae + TX, Bacillus thuringiensis Cry1Ab + TX, Bacillus thuringiensis aizawai GC 91 (Agree®) + TX, Bacillus thuringiensis israelensis (BMP 123® + TX, Aquabac® + TX, VectoBac®) + TX, Bacillus thuringiensis kurstaki (Javelin® + TX, Deliver® + TX, CryMax® + TX, Bonide® + TX, Scutella WP® + TX, Turilav WP ® + TX, Astuto® + TX, Dipel WP® + TX, Biobit® + TX, Foray®) + TX, Bacillus thuringiensis kurstaki BMP 123 (Baritone®) + TX, Bacillus thuringiensis kurstaki HD-1 (Bioprotec-CAF / 3P®) + TX, Bacillus thuringiensis, штамм BD№32 + TX, Bacillus thuringiensis, штамм AQ52 + TX, Bacillus thuringiensis разновидность aizawai (XenTari® + TX, DiPel®) + TX, bacteria spp. (GROWMEND® + TX, GROWSWEET® + TX, Shootup®) + TX, бактериофаг Clavipacter michiganensis (AgriPhage®) + TX, Bakflor® + TX, Beauveria bassiana (Beaugenic® + TX, Brocaril WP®) + TX, Beauveria bassiana GHA (Mycotrol ES® + TX, Mycotrol O® + TX, BotaniGuard®) + TX, Beauveria brongniartii (Engerlingspilz® + TX, Schweizer Beauveria® + TX, Melocont®) + TX, Beauveria spp. + TX, Botrytis cineria + TX, Bradyrhizobium japonicum (TerraMax®) + TX, Brevibacillus brevis + TX, Bacillus thuringiensis tenebrionis (Novodor®) + TX, BtBooster + TX, Burkholderia cepacia (Deny® + TX, Intercept® + TX, Blue Circle®) + TX, Burkholderia gladii + TX, Burkholderia gladioli + TX, Burkholderia spp. + TX, грибок полевого бодяка (CBH Canadian Bioherbicide®) + TX, Candida butyri + TX, Candida famata + TX, Candida fructus + TX, Candida glabrata + TX, Candida guilliermondii + TX, Candida melibiosica + TX, Candida oleophila, штамм О + TX, Candida parapsilosis + TX, Candida pelliculosa + TX, Candida pulcherrima + TX, Candida reukaufii + TX, Candida saitoana (Bio-Coat® + TX, Biocure®) + TX, Candida sake + TX, Candida spp. + TX, Candida tenius + TX, Cedecea dravisae + TX, Cellulomonas flavigena + TX, Chaetomium cochliodes (Nova-Cide®) + TX, Chaetomium globosum (Nova-Cide®) + TX, Chromobacterium subtsugae, штамм PRAA4-1T (Grandevo®) + TX, Cladosporium cladosporioides + TX, Cladosporium oxysporum + TX, Cladosporium chlorocephalum + TX, Cladosporium spp. + TX, Cladosporium tenuissimum + TX, Clonostachys rosea (EndoFine®) + TX, Colletotrichum acutatum + TX, Coniothyrium minitans (Cotans WG®) + TX, Coniothyrium spp. + TX, Cryptococcus albidus (YIELDPLUS®) + TX, Cryptococcus humicola + TX, Cryptococcus infirmo-miniatus + TX, Cryptococcus laurentii + TX, Cryptophlebia leucotreta granulovirus (Cryptex®) + TX, Cupriavidus campinensis + TX, Cydia pomonella granulovirus (CYD-X®) + TX, Cydia pomonella granulovirus (Madex® + TX, Madex Plus® + TX, Madex Max/ Carpovirusine®) + TX, Cylindrobasidium laeve (Stumpout®) + TX, Cylindrocladium + TX, Debaryomyces hansenii + TX, Drechslera hawaiinensis + TX, Enterobacter cloacae + TX, Enterobacteriaceae + TX, Entomophtora virulenta (Vektor®) + TX, Epicoccum nigrum + TX, Epicoccum purpurascens + TX, Epicoccum spp. + TX, Filobasidium floriforme + TX, Fusarium acuminatum + TX, Fusarium chlamydosporum + TX, Fusarium oxysporum (Fusaclean® / Biofox C®) + TX, Fusarium proliferatum + TX, Fusarium spp. + TX, Galactomyces geotrichum + TX, Gliocladium catenulatum (Primastop® + TX, Prestop®) + TX, Gliocladium roseum + TX, Gliocladium spp. (SoilGard®) + TX, Gliocladium virens (Soilgard®) + TX, Granulovirus (Granupom®) + TX, Halobacillus halophilus + TX, Halobacillus litoralis + TX, Halobacillus trueperi + TX, Halomonas spp. + TX, Halomonas subglaciescola + TX, Halovibrio variabilis + TX, Hanseniaspora uvarum + TX, вирус ядерного полиэдроза Helicoverpa armigera (Helicovex®) + TX, вирус ядерного полиэдроза Helicoverpa zea (Gemstar®) + TX, изофлавон - формононетин (Myconate®) + TX, Kloeckera apiculata + TX, Kloeckera spp. + TX, Lagenidium giganteum (Laginex®) + TX, Lecanicillium longisporum (Vertiblast®) + TX, Lecanicillium muscarium (Vertikil®) + TX, вирус ядерного полиэдроза Lymantria Dispar (Disparvirus®) + TX, Marinococcus halophilus + TX, Meira geulakonigii + TX, Metarhizium anisopliae (Met52®) + TX, Metarhizium anisopliae (Destruxin WP®) + TX, Metschnikowia fruticola (Shemer®) + TX, Metschnikowia pulcherrima + TX, Microdochium dimerum (Antibot®) + TX, Micromonospora coerulea + TX, Microsphaeropsis ochracea + TX, Muscodor albus 620 (Muscudor®) + TX, Muscodor roseus, штамм A3-5 + TX, Mycorrhizae spp. (AMykor® + TX, Root Maximizer®) + TX, Myrothecium verrucaria, штамм AARC-0255 (DiTera®) + TX, BROS PLUS® + TX, Ophiostoma piliferum, штамм D97 (Sylvanex®) + TX, Paecilomyces farinosus + TX, Paecilomyces fumosoroseus (PFR-97® + TX, PreFeRal®) + TX, Paecilomyces linacinus (Biostat WP®) + TX, Paecilomyces lilacinus, штамм 251 (MeloCon WG®) + TX, Paenibacillus polymyxa + TX, Pantoea agglomerans (BlightBan C9-1®) + TX, Pantoea spp. + TX, Pasteuria spp. (Econem®) + TX, Pasteuria nishizawae + TX, Penicillium aurantiogriseum + TX, Penicillium billai (Jumpstart® + TX, TagTeam®) + TX, Penicillium brevicompactum + TX, Penicillium frequentans + TX, Penicillium griseofulvum + TX, Penicillium purpurogenum + TX, Penicillium spp. + TX, Penicillium viridicatum + TX, Phlebiopsis gigantean (Rotstop®) + TX, фосфат солюбилизирующие бактерии (Phosphomeal®) + TX, Phytophthora cryptogea + TX, Phytophthora palmivora (Devine®) + TX, pichia anomala + TX, pichia guilermondii + TX, pichia membranaefaciens + TX, pichia onychis + TX, pichia stipites + TX, Pseudomonas aeruginosa + TX, Pseudomonas aureofasciens (Spot-Less Biofungicide®) + TX, Pseudomonas cepacia + TX, Pseudomonas chlororaphis (AtEze®) + TX, Pseudomonas corrugate + TX, Pseudomonas fluorescens, штамм A506 (BlightBan A506®) + TX, Pseudomonas putida + TX, Pseudomonas reactans + TX, Pseudomonas spp. + TX, Pseudomonas syringae (Bio-Save®) + TX, Pseudomonas viridiflava + TX, Pseudomons fluorescens (Zequanox®) + TX, Pseudozyma flocculosa, штамм PF-A22 UL (Sporodex L®) + TX, Puccinia canaliculata + TX, Puccinia thlaspeos (Wood Warrior®) + TX, Pythium paroecandrum + TX, Pythium oligandrum (Polygandron® + TX, Polyversum®) + TX, Pythium periplocum + TX, Rhanella aquatilis + TX, Rhanella spp. + TX, Rhizobia (Dormal® + TX, Vault®) + TX, Rhizoctonia + TX, Rhodococcus globerulus, штамм AQ719+TX, Rhodosporidium diobovatum + TX, Rhodosporidium toruloides + TX, Rhodotorula spp. + TX, Rhodotorula glutinis + TX, Rhodotorula graminis + TX, Rhodotorula mucilagnosa + TX, Rhodotorula rubra + TX, Saccharomyces cerevisiae + TX, Salinococcus roseus + TX, Sclerotinia minor + TX, Sclerotinia minor (SARRITOR®) + TX, Scytalidium spp. + TX, Scytalidium uredinicola + TX, вирус ядерного полиэдроза Spodoptera exigua (Spod-X® + TX, Spexit®) + TX, Serratia marcescens + TX, Serratia plymuthica + TX, Serratia spp. + TX, Sordaria flmicola + TX, вирус ядерного полиэдроза Spodoptera littoralis (Littovir®) + TX, Sporobolomyces roseus + TX, Stenotrophomonas maltophilia + TX, Streptomyces ahygroscopicus + TX, Streptomyces albaduncus + TX, Streptomyces exfoliates + TX, Streptomyces galbus + TX, Streptomyces griseoplanus + TX, Streptomyces griseoviridis (Mycostop®) + TX, Streptomyces lydicus (Actinovate®) + TX, Streptomyces lydicus WYEC-108 (ActinoGrow®) + TX, Streptomyces violaceus + TX, Tilletiopsis minor + TX, Tilletiopsis spp. + TX, Trichoderma asperellum (T34 Biocontrol®) + TX, Trichoderma gamsii (Tenet®) + TX, Trichoderma atroviride (Plantmate®) + TX, Trichoderma hamatum TH 382 + TX, Trichoderma harzianum rifai (Mycostar®) + TX, Trichoderma harzianum T-22 (Trianum-P® + TX, PlantShield HC® + TX, RootShield® + TX, Trianum-G®) + TX, Trichoderma harzianum T-39 (Trichodex®) + TX, Trichoderma inhamatum + TX, Trichoderma koningii + TX, Trichoderma spp. LC 52 (Sentinel®) + TX, Trichoderma lignorum + TX, Trichoderma longibrachiatum + TX, Trichoderma polysporum (Binab T®) + TX, Trichoderma taxi + TX, Trichoderma virens + TX, Trichoderma virens (ранее Gliocladium virens GL-21) (SoilGuard®) + TX, Trichoderma viride + TX, Trichoderma viride, штамм ICC 080 (Remedier®) + TX, Trichosporon pullulans + TX, Trichosporon spp. + TX, Trichothecium spp. + TX, Trichothecium roseum + TX, Typhula phacorrhiza, штамм 94670 + TX, Typhula phacorrhiza, штамм 94671 + TX, Ulocladium atrum + TX, Ulocladium oudemansii (Botry-Zen®) + TX, Ustilago maydis + TX, различные бактерии и дополнительные микроэлементы (Natural II®) + ТХ, различные грибы (Millennium Microbes®) + ТХ, Verticillium chlamydosporium+ТХ, Verticillium lecanii (Mycotal® + TX, Vertalec®) + TX, Vip3Aa20 (VIPtera®) + TX, Virgibaclillus marismortui + TX, Xanthomonas campestris pv. Poae (Camperico®) + TX, Xenorhabdus bovienii + TX, Xenorhabdus nematophilus; и экстракты растений, в том числе сосновое масло (Retenol®) + ТХ, азадирахтин (Plasma Neem Oil® + ТХ, AzaGuard® + ТХ, MeemAzal® + ТХ, Molt-X® + ТХ, Botanical IGR (Neemazad® + TX, Neemix®) + TX, каноловое масло (Lilly Miller Vegol®) + TX, Chenopodium ambrosioides near ambrosioides (Requiem®) + TX, экстракт Chrysanthemum (Crisant®) + TX, экстракт масла маргозы (Trilogy®) + TX, эфирные масла Labiatae (Botania®) + TX, экстракты масла гвоздики, розмарина, перечной мяты и тимьяна (Garden insect killer®) + ТХ, глицинбетаин (Greenstim®) + ТХ, чеснок + ТХ, масло лемонграсса (GreenMatch®) + ТХ, масло маргозы + ТХ, Nepeta cataria (масло котовника кошачьего) + ТХ, Nepeta catarina + ТХ, никотин + ТХ, масло душицы (MossBuster®) + ТХ, масло Pedaliaceae (Nematon®) + ТХ, пиретрум + ТХ, Quillaja saponaria (NemaQ®) + ТХ, Reynoutria sachalinensis (Regalia® + TX, Sakalia®) + TX, ротенон (Eco Roten®) + TX, экстракт растения Rutaceae (Soleo®) + TX, соевое масло (Ortho ecosense®) + TX, масло чайного дерева (Timorex Gold®) + TX, масло тимьяна + TX, AGNIQUE® MMF + TX, BugOil® + TX, смесь экстрактов розмарина, кунжута, перечной мяты, тимьяна и корицы (EF 300®) + ТХ, смесь экстрактов гвоздики, розмарина и перечной мяты (EF 400®) + ТХ, смесь гвоздики, перечной мяты, масла чеснока и мяты (Soil Shot®) + ТХ, каолин (Screen®) + ТХ, глюкан, который запасают бурые водоросли, (Laminarin®); и
феромоны, в том числе феромон листовертки черноголовой (3М Spray able Blackheaded Fireworm Pheromone®) + TX, феромон яблоневой плодожорки (Paramount dispenser-(CM)/ Isomate C-Plus®) + TX, феромон листовертки виноградной (3М MEC-GBM Sprayable Pheromone®) + TX, феромон листовертки (3М MEC - LR Sprayable Pheromone®) + TX, Muscamone (Snip7 Fly Bait® + TX, Starbar Premium Fly Bait®) + TX, феромон листовертки восточной персиковой (3М oriental fruit moth sprayable pheromone®) + TX, феромон стеклянницы персиковой (Isomate-P®) + TX, феромон томатной острицы (3М Sprayable pheromone®) + ТХ, Entostat в виде порошка (экстракт пальмового дерева) (Exosex СМ®) + ТХ, (Е + TX,Z + TX,Z)-3 + ТХ,8 + ТХ,11 тетрадекатриенилацетат + ТХ, (Z + TX,Z + ТХ,Е)-7 + ТХ,11 + ТХ,13-гексадекатриеналь + ТХ, (Е + TX,Z)-7 + ТХ,9-додекадиен-1-илацетат + ТХ, 2-метил-1-бутанол + ТХ, ацетат кальция + ТХ, Scenturion® + ТХ, Biolure® + ТХ, Check-Mate® + ТХ, лавандулилсенеционат; и
макроорганизмы, в том числе Aphelinus abdominalis + ТХ, Aphidius ervi (Aphelinus-System®) + TX, Acerophagus papaya + TX, Adalia bipunctata (Adalia-System®) + TX, Adalia bipunctata (Adaline®) + TX, Adalia bipunctata (Aphidalia®) + TX, Ageniaspis citricola + TX, Ageniaspis fuscicollis + TX, Amblyseius andersoni (Anderline® + TX, Andersoni-System®) + TX, Amblyseius californicus (Amblyline® + TX, Spical®) + TX, Amblyseius cucumeris (Thripex® + TX, Bugline cucumeris®) + TX, Amblyseius fallacis (Fallacis®) + TX, Amblyseius swirskii (Bugline swirskii® + TX, Swirskii-Mite®) + TX, Amblyseius womersleyi (WomerMite®) + TX, Amitus hesperidum + TX, Anagrus atomus + TX, Anagyrus fusciventris + TX, Anagyrus kamali + TX, Anagyrus loecki + TX, Anagyrus pseudococci (Citripar®) + TX, Anicetus benefices + TX, Anisopteromalus calandrae + TX, Anthocoris nemoralis (Anthocoris-System®) + TX, Aphelinus abdominalis (Apheline® + TX, Aphiline®) + TX, Aphelinus asychis + TX, Aphidius colemani (Aphipar®) + TX, Aphidius ervi (Ervipar®) + TX, Aphidius gifuensis + TX, Aphidius matricariae (Aphipar-M®) + TX, Aphidoletes aphidimyza (Aphidend®) + TX, Aphidoletes aphidimyza (Aphidoline®) + TX, Aphytis lingnanensis + TX, Aphytis melinus + TX, Aprostocetus hagenowii + TX, Aiheta coriaria (Staphyline®) + TX, Bombus spp. + TX, Bombus terrestris (Natupol Beehive®) + TX, Bombus terrestris (Beeline® + TX, Tripol®) + TX, Cephalonomia stephanoderis + TX, Chilocorus nigritus + TX, Chrysoperla carnea (Chrysoline®) + TX, Chrysoperla carnea (Chrysopa®) + TX, Chrysoperla rufilabris + TX, Cirrospilus ingenuus + TX, Cirrospilus quadristriatus + TX, Citrostichus phyllocnistoides + TX, Closterocerus chamaeleon+TX, Closterocerus spp. + TX, Coccidoxenoides perminutus (Planopar®) + TX, Coccophagus cowperi + TX, Coccophagus lycimnia + TX, Cotesia flavipes + TX, Cotesia plutellae + TX, Cryptolaemus montrouzieri (Cryptobug® + TX, Cryptoline®) + TX, Cybocephalus nipponicus + TX, Dacnusa sibirica + TX, Dacnusa sibirica (Minusa®) + TX, Diglyphus isaea (Diminex®) + TX, Delphastus catalinae (Delphastus®) + TX, Delphastus pusillus + TX, Diachasmimorpha krausii + TX, Diachasmimorpha longicaudata + TX, Diaparsis jucunda + TX, Diaphorencyrtus aligarhensis + TX, Diglyphus isaea + TX, Diglyphus isaea (Miglyphus® + TX, Digline®) + TX, Dacnusa sibirica (DacDigline® + TX, Minex®) + TX, Diversinervus spp. + TX, Encarsia citrina + TX, Encarsia formosa (Encarsia max® + TX, Encarline® + TX, En-Strip®) + TX, Eretmocerus eremicus (Enermix®) + TX, Encarsia guadeloupae + TX, Encarsia haitiensis + TX, Episyrphus balteatus (Syrphidend®) + TX, Eretmoceris siphonini + TX, Eretmocerus californicus + TX, Eretmocerus eremicus (Ercal® + TX, Eretline e®) + TX, Eretmocerus eremicus (Bemimix®) + TX, Eretmocerus hayati + TX, Eretmocerus mundus (Bemipar® + TX, Eretline m®) + TX, Eretmocerus siphonini + TX, Exochomus quadripustulatus + TX, Feltiella acarisuga (Spidend®) + TX, Feltiella acarisuga (Feltiline®) + TX, Fopius arisanus + TX, Fopius ceratitivorus + TX, формононетин (Wirless Beehome®) + TX, Franklinothrips vespiformis (Vespop®) + TX, Galendromus occidentalis + TX, Goniozus legneri + TX, Habrobracon hebetor + TX, Harmonia axyridis (HarmoBeetle®) + TX, Heterorhabditis spp.(Lawn Patrol®) + TX, Heterorhabditis bacteriophora (NemaShield HB® + TX, Nemaseek® + TX, Terranem-Nam® + TX, Terranem® + TX, Larvanem® + TX, B-Green® + TX, NemAttack ® + TX, Nematop®) + TX, Heterorhabditis megidis (Nemasys H® + TX, BioNem H® + TX, Exhibitline hm® + TX, Larvanem-M®) + TX, Hippodamia convergens + TX, Hypoaspis aculeifer (Aculeifer-System® + TX, Entomite-A®) + TX, Hypoaspis miles (Hypoline m® + TX, Entomite-M®) + TX, Lbalia leucospoides + TX, Lecanoideus Jloccissimus + TX, Lemophagus errabundus + TX, Leptomastidea abnormis + TX, Leptomastix dactylopii (Leptopar®) + TX, Leptomastix epona + TX, Lindorus lophanthae + TX, Lipolexis oregmae + TX, Lucilia caesar (Natufly®) + TX, Lysiphlebus testaceipes + TX, Macrolophus caliginosus (Mirical-N® + TX, Macroline c® + TX, Mirical®) + TX, Mesoseiulus longipes + TX, Metaphycus flavus + TX, Metaphycus lounsburyi + TX, Micromus angulatus (Milacewing®) + TX, Microterys flavus + TX, Muscidifurax raptorellus и Spalangia cameroni (Biopar®) + TX, Neodryinus typhlocybae + TX, Neoseiulus californicus + TX, Neoseiulus cucumeris (THRYPEX®) + TX, Neoseiulus fallacis + TX, Nesideocoris tenuis (NesidioBug® + TX, Nesibug®) + TX, Ophyra aenescens (Biofly®) + TX, Orius insidiosus (Thripor-I® + TX, Oriline i®) + TX, Orius laevigatus (Thripor-L® + TX, Oriline l®) + TX, Orius majusculus (Oriline m®) + TX, Orius strigicollis (Thripor-S®) + TX, Pauesia juniperorum + TX, Pediobius foveolatus + TX, Phasmarhabditis hermaphrodita (Nemaslug®) + TX, Phymastichus coffea + TX, Phytoseiulus macropilus + TX, Phytoseiulus persimilis (Spidex® + TX, Phytoline p®) + TX, Podisus maculiventris (Podisus®) + TX, Pseudacteon curvatus + TX, Pseudacteon obtusus + TX, Pseudacteon tricuspis + TX, Pseudaphycus maculipennis + TX, Pseudleptomastix mexicana + TX, Psyllaephagus pilosus + TX, Psyttalia concolor (комплекс видов) + TX, Quadrastichus spp. + TX, Rhyzobius lophanthae + TX, Rodolia cardinalis + TX, Rumina decollate + TX, Semielacher petiolatus + TX, Sitobion avenae (Ervibank®) + TX, Steinernema carpocapsae (Nematac C® + TX, Millenium® + TX, BioNem C® + TX, NemAttack® + TX, Nemastar® + TX, Capsanem®) + TX, Steinernema feltiae (NemaShield® + TX, Nemasys F® + TX, BioNem F® + TX, Steinemema-System® + TX, NemAttack® + TX, Nemaplus® + TX, Exhibitline sf® + TX, Scia-rid® + TX, Entonem®) + TX, Steinernema kraussei (Nemasys L® + TX, BioNem L® + TX, Exhibitline srb®) + TX, Steinernema riobrave (BioVector® + TX, BioVektor®) + TX, Steinernema scapterisci (Nematac S®) + TX, Steinernema spp. + TX, Steinernematid spp.(Guardian Nematodes®) + TX, Stethorus punctillum (Stethorus®) + TX, Tamarixia radiate + TX, Tetrastichus setifer + TX, Thripobius semiluteus + TX, Torymus sinensis + TX, Trichogramma brassicae (Tricholine b®) + TX, Trichogramma brassicae (Tricho-Strip®) + TX, Trichogramma evanescens + TX, Trichogramma minutum + TX, Trichogramma ostriniae + TX, Trichogramma platneri + TX, Trichogramma pretiosum + TX, Xanthopimpla stemmator; и
другие биологические вещества, в том числе абсцизовая кислота+ТХ, bioSea® + ТХ, Chondrostereum purpureum (Chontrol Paste®) + TX, Colletotrichum gloeosporioides (Collego®) + TX, октаноат меди (Cueva®) + TX, дельтовидные ловушки (Trapline d®) + TX, Erwinia amylovora (харпин) (ProAct® + TX, Ni-HIBIT Gold CST®) + TX, феррофосфат (Ferramol®) + TX, воронковидные ловушки (Trapline у®) + TX, Gallex® + TX, Grower's Secret® + TX, гомобрассинолид + TX, фосфат железа (Lilly Miller Worry Free Ferramol Slug & Snail Bait®) + TX, ловушка MCPhail (Trapline f®) + TX, Microctonus hyperodae + TX, Mycoleptodiscus terrestris (Des-X®) + TX, BioGain® + TX, Aminomite® + TX, Zenox® + TX, феромонная ловушка (Thripline ams®) + TX, бикарбонат калия (MilStop®) + TX, калиевые соли жирных кислот (Sanova®) + ТХ, раствор силиката калия (Sil-Matrix®) + ТХ, йодид калия + тиоцианат калия (Enzicur®) + ТХ, SuffOil-X® + ТХ, яд паука+ТХ, Nosema locustae (Semaspore Organic Grasshopper Control®) + TX, клеевые ловушки (Trapline YF® + TX, Rebell Amarillo®) + TX и ловушки (Takitrapline у + b®) + TX.
Ссылки в квадратных скобках после активных ингредиентов, например, [3878-19-1], относятся к номеру согласно регистрационного номера Химической реферативной службы. Вышеописанные участники смешивания являются известными. Если активные ингредиенты включены в "The Pesticide Manual" [The Pesticide Manual - A World Compendium; Thirteenth Edition; Editor: C. D. S. TomLin; The British Crop Protection Council], то они описаны в нем под номером записи, приведенном в данном документе выше в круглых скобках, для конкретного соединения; например, соединение "абамектин" описано под номером записи (1). Если в данном документе выше добавлено "[CCN]" к конкретному соединению, то рассматриваемое соединение включено в "Compendium of Pesticide Common Names", который доступен в Интернете [A. Wood; Compendium of Pesticide Common Names, Copyright © 1995-2004]; например, соединение "ацетопрол" описано по адресу в Интернете http://www.alanwood.net/pesticides/acetoprole.html.
Большинство активных ингредиентов, описанных выше, называются выше по так называемому "общепринятому названию", соответствующему "общепринятому названию согласно ISO" или другому "общепринятому названию", которое используют в отдельных случаях. Если обозначение не является "общим названием", сущность обозначения, применяемого вместо него, дана в круглых скобках для конкретного соединения; в этом случае название по IUPAC, IUPAC/Название по Химической реферативной службе, "химическое название", "традиционное название", "название соединения" или "код разработки" применяют или, если не применяют ни одно из этих обозначений, ни "общее название", используют "альтернативное название". "Регистрационный номер по СAS" означает регистрационный номер по Химической реферативной службе.
Смесь активных ингредиентов соединений формулы I, выбранных из таблиц 1-6 с активными ингредиентами, описанными выше, содержит соединение, выбранное из таблиц 1-6, и активный ингредиент, описанный выше, предпочтительно в соотношении компонентов смеси от 100:1 до 1:6000, особенно от 50:1 до 1:50, более предпочтительно в соотношении от 20:1 до 1:20, даже более предпочтительно от 10:1 до 1:10, очень предпочтительно от 5:1 до 1:5, при этом особое предпочтение отдают соотношению от 2:1 до 1:2, и при этом соотношение от 4:1 до 2:1 является также предпочтительным, прежде всего в соотношении 1:1, или 5:1, или 5:2, или 5:3, или 5:4, или 4:1, или 4:2, или 4:3, или 3:1, или 3:2, или 2:1, или 1:5, или 2:5, или 3:5, или 4:5, или 1:4, или 2:4, или 3:4, или 1:3, или 2:3, или 1:2, или 1:600, или 1:300, или 1:150, или 1:35, или 2:35, или 4:35, или 1:75, или 2:75, или 4:75, или 1:6000, или 1:3000, или 1:1500, или 1:350, или 2:350, или 4:350, или 1:750, или 2:750, или 4:750. Эти соотношения компонентов смеси указаны по весу.
Смеси, описанные выше, можно использовать в способе контроля вредителей, который предусматривает применение композиции, содержащей смесь, описанную выше, по отношению к вредителям или окружающей их среде, за исключением способа лечения организма человека или животного путем хирургического вмешательства или терапии и способов диагностики, применяемых по отношению к организму человека или животного.
Смеси, содержащие соединение формулы I, выбранное из таблиц 1-6, и один или несколько активных ингредиентов, которые описаны выше, можно применять, например, в форме отдельной "готовой смеси", в объединенной смеси для опрыскивания, состоящей из отдельных составов отдельных компонентов, представляющих собой активные ингредиенты, такой как "баковая смесь", и в объединенном применении отдельных активных ингредиентов, при применении последовательным образом, т.е. один за другим с приемлемым коротким периодом, таким как несколько часов или дней. Порядок применения соединений формулы I, выбранных из таблиц 1-6, и активных ингредиентов, как описано выше, не важен для работы настоящего изобретения.
Композиции согласно настоящему изобретению также могут содержать дополнительные твердые или жидкие вспомогательные средства, такие как стабилизаторы, например, неэпоксидированные или эпоксидированные растительные масла (например, эпоксидированное кокосовое масло, рапсовое масло или соевое масло), противовспениватели, например, кремнийорганическое масло, консерванты, регуляторы вязкости, связывающие и/или придающие липкость средства, удобрения или другие активные ингредиенты для достижения особых эффектов, например, бактерициды, фунгициды, нематоциды, активаторы растения, моллюскоциды или гербициды.
Композиции согласно настоящему изобретению получают способом, известным per se, в отсутствии вспомогательных средств, например, посредством измельчения, просеивания и/или прессования твердого активного ингредиента, и в присутствии по меньшей мере одного вспомогательного средства, например, посредством тщательного перемешивания и/или измельчения активного ингредиента со вспомогательным средством (вспомогательными средствами). Эти способы получения композиций, а также применение соединений I для получения этих композиций также являются объектом настоящего изобретения.
Способы применения композиций, которые являются способами контроля вредителей вышеупомянутых типов, такие как распыление, разбрызгивание, опудривание, нанесение кистью, дражирование, разбрасывание или полив, которые подлежат выбору для удовлетворения намеченных целей в преобладающих обстоятельствах, и применение композиций для контроля вредителей вышеупомянутого типа являются другими объектами настоящего изобретения. Типичные нормы концентрации активного ингредиента составляют от 0,1 до 1000 ppm, предпочтительно от 0,1 до 500 ppm. Норма применения на гектар, как правило, составляет от 1 до 2000 г активного ингредиента на гектар, в частности, от 10 до 1000 г/га, предпочтительно, от 10 до 600 г/га.
Предпочтительным способом нанесения в области защиты культур является нанесение на листву растений (внекорневое внесение), при этом можно выбрать частоту и норму внесения в соответствии с опасностью заражения рассматриваемым вредителем. В качестве альтернативы, активный ингредиент может достигать растений посредством корневой системы (системное действие), с помощью орошения места произрастания растений жидкой композицией или с помощью внедрения активного ингредиента в твердой форме в место произрастания растений, например в почву, например, в виде гранул (внесение в почву). В случае сельскохозяйственной культуры риса-падди такие гранулы могут подаваться в определенном количестве в затопляемое рисовое поле.
Соединения согласно настоящему изобретению и композиции на их основе также являются подходящими для защиты материала для размножения растений, например, семян, таких как плод, клубни или зерна, или саженцев, от вредителей упомянутого выше в данном документе типа. Материал для размножения можно обрабатывать с помощью соединения перед посадкой, например, семена можно обрабатывать перед посевом. В качестве альтернативы, соединение можно применять по отношению к косточкам семени (нанесение покрытия), либо с помощью замачивания косточек в жидкой композиции, либо с помощью нанесения слоя твердой композиции. Также возможно вносить композиции при посадке материала для размножения в место внесения, например, в борозду для семян во время рядового сева. Данные способы обработки материала для размножения растений и обработанный таким образом материал для размножения растений являются дополнительными объектами настоящего изобретения. Типичные нормы обработки будут зависеть от растения и вредителя/гриба, подлежащих контролю, и, как правило, они составляют от 1 до 200 грамм на 100 кг семян, предпочтительно от 5 до 150 грамм на 100 кг семян, например, от 10 до 100 грамм на 100 кг семян.
Термин "семя" охватывает семена и вегетативные части растения всех видов, в том числе без ограничения истинные семена, кусочки семян, корневые побеги, зерно злаковых, луковицы, плод, клубни, зерна, ризомы, черенки, нарезанные побеги и т.п., и согласно предпочтительному варианту осуществления означает истинные семена.
Настоящее изобретение также предусматривает семена, покрытые или обработанные с помощью соединения формулы I или содержащие таковое. Термин "покрытый или обработанный и/или содержащий" обычно означает, что активный ингредиент находится на большей части поверхности семени во время применения, хотя большая или меньшая часть ингредиента может проникать в семенной материал в зависимости от способа применения. При высаживании (пересаживании) указанного семенного продукта он может абсорбировать активный ингредиент. В одном варианте осуществления при помощи настоящего изобретения получают материал для размножения растений с возможностью прилипания к нему соединения формулы (I). Кроме того, в настоящем документе представлен содержащий композицию материал для размножения растений, обработанный соединением формулы (I).
Обработка семян предусматривает все приемлемые методики обработки семян, известные в уровне техники, такие как дражирование семян, покрытие семян, опудривание семян, пропитывание семян и гранулирование семян. Применение соединения формулы (I) при обработке семян может быть выполнено любыми известными способами, такими как разбрызгивание или опудривание семян перед посевом или во время посева/высаживания семян.
Биологические примеры
Пример B1. Bemisia tabaci (белокрылка табачная)
Листовые диски хлопка помещали на агар в 24-луночных микротитровальных планшетах и опрыскивали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания листовые диски заражали взрослыми особями белокрылки. Через 6 дней после инкубирования образцы проверяли в отношении смертности.
Следующие соединения приводили в результате по меньшей мере к 80% смертности при норме применения 200 ppm:
Р10, Р13, Р15 и Р4.
Пример В2. Diabrotica balteata (блошка длинноусая)
Ростки кукурузы, помещенные на слой агара в 24-луночные микротитровальные планшеты, обрабатывали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO, путем распыления. После высушивания планшеты заражали личинками L2 (6-10 на лунку). Образцы оценивали в отношении смертности и ингибирования роста по сравнению с необработанными образцами через 4 дня после заражения.
Следующие соединения давали эффект, как минимум, 80%, по меньшей мере в одной из двух категорий (смертность или ингибирование роста) при норме применения 200 ppm:
Р8, Р9, Р10, P11, Р12, Р13, Р30, Р14, Р15, Р16, Р6, Р5, Р4, P1, Р3 и Р2.
Пример В3. Diabrotica balteata (блошка длинноусая)
Ростки кукурузы, помещенные на слой агара в 24-луночные микротитровальные планшеты, обрабатывали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO, путем распыления. После высушивания планшеты заражали личинками L2 (6-10 на лунку). Через 4 дня после заражения образцы оценивали в отношении смертности.
Следующие соединения приводили в результате по меньшей мере к 80% смертности при норме применения 200 ppm:
Р8, Р9, Р10, Р11, Р12, Р13, Р30, Р14, Р16, Р6, Р5, Р4, Р1, Р3 и Р2.
Пример В4. Euschistus heros (неотропический коричневый клоп-щитник)
Листья сои на агаре в 24-луночных микротитровальных планшетах опрыскивали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания листья заражали нимфами N2. Образцы оценивали в отношении ингибирования роста по сравнению с необработанными образцами через 5 дней после заражения. Контроль Euschistus heros исследуемыми образцами присутствовал, если ингибирование роста выше, чем для необработанного образца. Следующие соединения приводили в результате по меньшей мере к 80% ингибированию роста при норме применения 200 ppm:
Р8 и Р5.
Пример В5. Euschistus heros (неотропический коричневый клоп-щитник)
Листья сои на агаре в 24-луночных микротитровальных планшетах опрыскивали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания листья заражали нимфами N2. Через 5 дней после заражения образцы оценивали в отношении смертности.
Следующие соединения приводили в результате по меньшей мере к 80% смертности при норме применения 200 ppm:
Р8, Р9, P11, Р12, Р13, Р30, Р14, Р15, Р16, Р6, Р5, Р4 и Р1.
Пример В6. Euschistus heros (неотропический коричневый клоп-щитник)
Листья сои на агаре в 24-луночных микротитровальных планшетах опрыскивали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания листья заражали нимфами N2. Образцы оценивали в отношении смертности и ингибирования роста по сравнению с необработанными образцами через 5 дней после заражения.
Следующие соединения давали эффект, как минимум, 80%, по меньшей мере в одной из двух категорий (смертность или ингибирование роста) при норме применения 200 ppm:
Р8, Р9, P11, Р12, Р13, Р30, Р14, Р15, Р16, Р6, Р5, Р4 и Р1.
Пример В7. Frankliniella occidentalis (западный цветочный трипе)
Листовые диски подсолнечника помещали на агар в 24-луночные микротитровальные планшеты и опрыскивали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания листовые диски заражали популяцией Frankliniella разного возраста. Через 7 дней после заражения образцы оценивали в отношении смертности.
Следующие соединения приводили в результате по меньшей мере к 80% смертности при норме применения 200 ppm:
Р10, Р11, Р13, Р15, Р16 и Р5.
Пример В8. Myzus persicae (тля персиковая зеленая)
Листовые диски подсолнечника помещали на агар в 24-луночный микротитровальный планшет и опрыскивали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания листовые диски заражали популяцией тли разного возраста. Через 6 дней после заражения образцы оценивали в отношении смертности.
Следующие соединения приводили в результате по меньшей мере к 80% смертности при норме применения 200 ppm:
Р8, Р11, Р13, Р14, Р16 и Р1.
Пример В9. Myzus persicae (тля персиковая зеленая)
Корни проростков гороха, зараженные популяцией тли разного возраста, помещали непосредственно в исследуемые водные растворы, полученные из 10000 ppm исходных растворов в DMSO. Через 6 дней после помещения проростков в исследуемые растворы образцы оценивали в отношении смертности.
Следующие соединения приводили в результате по меньшей мере к 80% смертности при исследуемой норме 24 ppm:
Р30
Пример В10. Plutella xylostella (моль капустная)
24-луночные микротитровальные планшеты с искусственной питанием с помощью пипетки обрабатывали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания планшеты заражали личинками L2 (10-15 на лунку). Образцы оценивали в отношении ингибирования роста по сравнению с необработанными образцами через 5 дней после заражения. Контроль Plutella xylostella исследуемыми образцами присутствовал, если ингибирование роста выше, чем для необработанного образца.
Следующие соединения приводили в результате по меньшей мере к 80% ингибированию роста при норме применения 200 ppm:
Р8, Р9, Р13, Р30, Р14, Р16 и Р1.
Пример В12. Plutella xylostella (моль капустная)
24-луночные микротитровальные планшеты с искусственной питанием с помощью пипетки обрабатывали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания планшеты заражали личинками L2 (10-15 на лунку). Через 5 дней после заражения образцы оценивали в отношении смертности.
Следующие соединения приводили в результате по меньшей мере к 80% смертности при норме применения 200 ppm:
Р8, Р9, Р10, P11, Р12, Р13, Р14, Р15, Р16, Р6, Р5, Р4, Р1 и Р2.
Пример В13. Pluteila xylostella (моль капустная)
24-луночные микротитровальные планшеты с искусственной питанием с помощью пипетки обрабатывали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания планшеты заражали личинками L2 (10-15 на лунку). Образцы оценивали в отношении смертности и ингибирования роста по сравнению с необработанными образцами через 5 дней после заражения.
Следующие соединения давали эффект, как минимум, 80%, по меньшей мере в одной из двух категорий (смертность или ингибирование роста) при норме применения 200 ppm:
Р8, Р9, Р10, P11, Р12, Р13, Р30, Р14, Р15, Р16, Р6, Р5, Р4, Р1 и Р2.
Пример В14. Spodoptera littoralis (египетская хлопчатниковая совка)
Листовые диски хлопка помещали на агар в 24-луночные микротитровальные планшеты и опрыскивали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания листовые диски заражали пятью личинками L1. Образцы оценивали в отношении антифидантного эффекта по сравнению с необработанными образцами через 3 дня после заражения. Контроль Spodoptera littoralis исследуемыми образцами присутствовал, если антифидантный эффект выше, чем для необработанного образца.
Следующие соединения обеспечивали в результате по крайней мере 80% контроль при норме применения 200 ppm.
Р8, Р9, Р10, Р11, Р12, Р13, Р14, Р15, Р16, Р6, Р5, Р4, Р1, Р3 и Р2.
Пример В15. Spodoptera littoralis (египетская хлопчатниковая совка)
Листовые диски хлопка помещали на агар в 24-луночные микротитровальные планшеты и опрыскивали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания листовые диски заражали пятью личинками L1. Образцы оценивали в отношении ингибирования роста по сравнению с необработанными образцами через 3 дня после заражения. Контроль Spodoptera littoralis исследуемыми образцами присутствовал, если ингибирование роста выше, чем для необработанного образца.
Следующие соединения обеспечивали в результате по крайней мере 80% контроль при норме применения 200 ppm.
Р8, Р9, Р10 и Р16.
Пример В16. Spodoptera littoralis (египетская хлопчатниковая совка)
Листовые диски хлопка помещали на агар в 24-луночные микротитровальные планшеты и опрыскивали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания листовые диски заражали пятью личинками L1. Через 3 дня после заражения образцы оценивали в отношении смертности.
Следующие соединения приводили в результате по меньшей мере к 80% смертности при норме применения 200 ppm:
Р8, Р9, Р10, P11, Р12, Р13, Р14, Р15, Р16, Р6, Р5, Р4, P1, Р3 и Р2.
Пример В17. Spodoptera littoralis (египетская хлопчатниковая совка)
Листовые диски хлопка помещали на агар в 24-луночные микротитровальные планшеты и опрыскивали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания листовые диски заражали пятью личинками L1. Образцы оценивали в отношении смертности, антифидантного эффекта и ингибирования роста по сравнению с необработанными образцами через 3 дня после заражения. Контроль Spodoptera littoralis исследуемыми образцами присутствовал, если по меньшей мере одна из категорий смертности, антифидантного эффекта и ингибирования роста выше, чем для необработанного образца.
Следующие соединения обеспечивали в результате по крайней мере 80% контроль при норме применения 200 ppm.
Р8, Р9, Р10, Р11, Р12, Р13, Р14, Р15, Р16, Р6, Р5, Р4, Р1, Р3 и Р2.
Пример В18. Spodoptera littoralis (египетская хлопчатниковая совка)
Испытываемые соединения наносили пипеткой из исходных растворов 10000 ppm DMSO в 24-луночные планшеты и смешивали с агаром. Семена латука помещали на агар, и многолуночный планшет накрывали другим планшетом, который также содержал агар. Через 7 дней корни поглощали соединение, и при этом латук проростал в планшет, расположенный сверху. Затем листья латука нарезали в планшет, расположенный сверху. Яйца Spodoptera помещали с помощью пипетки через пластиковый трафарет на увлажненную бумагу для блоттинга в геле и накрывали ей планшет. Образцы оценивали в отношении смертности, антифидантного эффекта и ингибирования роста по сравнению с необработанными образцами через 6 дней после заражения.
Следующие соединения давали эффект, как минимум, 80% по меньшей мере в одной из трех категорий (смертность, антифидантность или ингибирование роста) при исследуемой норме 12,5 ppm:
P11, Р12, Р13, Р14, Р15, Р6, Р5, Р4 и Р1.
Пример В19. Spodoptera littoralis (египетская хлопчатниковая совка)
Исследуемые соединения, полученные из 10000 ppm исходных растворов в DMSO, наносили с помощью пипетки в 24-луночные планшеты и смешивали с агаром. Семена латука помещали на агар, и многолуночный планшет накрывали другим планшетом, который также содержал агар. Через 7 дней корни поглощали соединение, и при этом латук проростал в планшет, расположенный сверху. Затем листья латука нарезали в планшет, расположенный сверху. Яйца Spodoptera помещали с помощью пипетки через пластиковый трафарет на увлажненную бумагу для блоттинга в геле и накрывали ей планшет. Образцы оценивали в отношении антифидантного эффекта по сравнению с необработанными образцами через 6 дней после заражения.
Следующие соединения давали эффект по меньшей мере 80% антифидантность при исследуемой норме 12,5 ppm:
P11, Р12, Р13, Р14, Р15, Р6, Р5, Р4 и Р1.
Пример В20. Spodoptera littoralis (египетская хлопчатниковая совка)
Исследуемые соединения, полученные из 10000 ppm исходных растворов в DMSO, наносили с помощью пипетки в 24-луночные планшеты и смешивали с агаром. Семена латука помещали на агар, и многолуночный планшет накрывали другим планшетом, который также содержал агар. Через 7 дней корни поглощали соединение, и при этом латук проростал в планшет, расположенный сверху. Затем листья латука нарезали в планшет, расположенный сверху. Яйца Spodoptera помещали с помощью пипетки через пластиковый трафарет на увлажненную бумагу для блоттинга в геле и накрывали ей планшет. Через 6 дней после заражения образцы оценивали в отношении смертности.
Следующие соединения давали эффект по меньшей мере 80% смертности при исследуемой норме 12,5 ppm:
P11, Р12, Р13, Р14, Р15, Р6, Р5, Р4 и Р1.
Пример В21. Tetranychus urticae (клещик паутинный двупятнистый)
Листовые диски боба на агаре в 24-луночных микротитровальных планшетах опрыскивали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания листовые диски заражали популяцией клещей разного возраста. Через 8 дней после заражения на смешанной популяции (подвижные стадии) образцы оценивали в отношении смертности. Следующие соединения приводили в результате по меньшей мере к 80% смертности при норме применения 200 ppm:
Р13 и Р14.
Пример В22. Thrips tabaci (трипс луковый)
Листовые диски подсолнечника помещали на агар в 24-луночные микротитровальные планшеты и опрыскивали исследуемыми водными растворами, полученными из 10000 ppm исходных растворов в DMSO. После высушивания листовые диски заражали популяцией трипса разного возраста. Через 6 дней после заражения образцы оценивали в отношении смертности.
Следующее соединение приводило в результате по меньшей мере к 80% смертности при норме применения 200 ppm:
Р13.
Пример В23. Aedes aegypti (комар желтолихорадочный)
Исследуемые растворы при норме применения 200 ppm в этаноле вносили в 12-луночные планшеты для тканевой культуры. После высушивания отложений пяти-, двух-пятидневную взрослую самку Aedes aegypti добавляли в каждую лунку и поддерживали 10% раствором сахарозы в пробке из хлопковой ваты. Оценку нокдауна осуществляли через один час после введения и смертность оценивали через 24 часа и 48 часов после введения.
Следующие соединения обеспечивали по меньшей мере 80% контроль Aedes aegypti через 48 часов и/или 24 часа:
Р9, Р12, Р13, Р14, Р16, Р6, Р4, Р1 и Р2.
Пример В24. Anopheles stephensi (индийский малярийный комар)
Исследуемые растворы при норме применения 200 ppm в этаноле вносили в 12-луночные планшеты для тканевой культуры. После высушивания отложений пяти-, двух-пятидневную взрослую самку Anopheles stephensi добавляли в каждую лунку и поддерживали 10% раствором сахарозы в пробке из хлопковой ваты. Оценку нокдауна осуществляли через один час после введения и смертность оценивали через 24 часа и 48 часов после введения.
Следующие соединения обеспечивали по меньшей мере 80% контроль Anopheles stephensi через 48 часов и/или 24 часа: Р13, Р14, Р16, Р6, Р4 и Р1.
Реферат
Изобретение относится к пригодным в агропромышленном комплексе соединениям формул Ia-1, Ia-2, Ia-3 или их агрохимически приемлемым солям, композициям на их основе и их применению против вредителей, выбранных из насекомых или представителей отряда Acarina, а также соединению Z0для их получения:где А представляет собой СН или N в соединениях Ia-1, Ia-2, Ia-3 и N в соединении Z0; Х2представляет собой S или SO2; Х4представляет собой SO2; R4и R7представляют собой С1-С4алкил; R6, R8и R9представляют собой С1-С4галогеналкил; R10представляет собой водород или С1-С2алкил; R01представляет собой С1-С4алкил; R1aпредставляет собой С1-С4алкил, гидрокси, С1-С4алкокси или С1-С4галогеналкил; Qaвыбран из заместителей:Qbвыбран из группы, состоящей из заместителей:где в Qaи в QbRx выбран из водорода, галогена, циано, С1-С4алкила, С1-С4галогеналкила, С1-С4галогеналкокси, С1-С4алкокси, С1-С4алкилсульфанила, C1-С4алкилсульфинила, С1-С4алкилсульфонила, -С(O)С1-С4алкила, C1-С4галогеналкилсульфанила, С1-С4галогеналкилсульфинила, C1-С4галогеналкилсульфонила и -С(O)С1-С4галогеналкила, и R001представляет собой водород или С1-С2алкил;Qcвыбран из заместителей:,где в QcRx выбран из водорода, галогена, С1-С4алкила, C1-С4галогеналкила, С1-С4алкокси и С1-С4галогеналкокси. Предложены новые соединения и пестицидные композиции на их основе, эффективные для использования в способе контроля вредителей и способе защиты материала для размножения растений от нападения вредителей, выбранных из насекомых или представителей отряда Acarina. 7 н.п. ф-лы, 6 табл., 60 пр.
Формула











Комментарии