Производные мильбемицина, способ лечения эндо- и эктопаразитарных инфекций, способ борьбы с насекомыми и клещами - RU2070885C1
Код документа: RU2070885C1
Чертежи




Описание
Изобретение относится к некоторым 13-алкил-23-имино- и 13-галоген-23-имино-LL-F28249-соединениям и к их использованию для борьбы с эндо- и эктопаразитарными инфекциями и инвазиями у теплокровных животных. Эти соединения могут также быть применены к широкому кругу агрокультур и сред, в которых эти культуры росли или растут, для защиты культур от вреда, наносимого насекомыми, акаридами и нематодами.
Обозначение LL-F28249 используют для описания соединений, продуцируемых ферментативным бульоном подвида noncyanogenus вида Streptomyces cyaneogrisens, хранящегося в собрании NRRL под депозитным номером 15773.
Предложенные соединения имеют следующую структурную формулу:

в которой R1 представляет собой метил, этил, изопропил; R7 представляет собой водород; R8 представляет собой группу ОR2 или, будучи взятыми вместе с атомом углерода, с которым они соединены, R7 и R8 представляют собой С=О, R2 представляет собой атом водорода или группу

R4 представляет собой: атом водорода, С1-С4-алкильную, С1-С4-галогеналкильную группу, фенил, замещенный нитрогруппой; R3 представляет собой метильную группу, Х представляет собой С1-С4-алкил или атом галогена,
W атом кислорода или группуN-Y,
Y группу OR5; R5 С1-С4-алкильную группу,
и пунктирный треугольник с атомом кислорода в вершине при С26-С27 обозначает, что в этом месте имеется или двойная связь или эпоксидная группа, при условии, что когда Х галоген, то R5 - С1-C4-алкил, когда Х С1-C4-алкил, то С26-C27 двойная связь.
Предпочтительным является соединение 1, где
R1 представляет собой изопропильную группу,
R7 атом водорода;
R8 группу ОR2;
R2 атом водорода или группу

R4 атом водорода, метильную, хлорметильную, дихлорметильную, трихлорметильную группу,
R3 метильную группу,
X атом фтора,
W группуN-Y
Y группу OR5 , и
R5 С1-С4-алкильную группу.
Особенно предпочтительно соединение, в котором:
R1 представляет собой изопропильную группу,
R7 и R8, взятые с атомом углерода, с которым они соединены, С=O,
R3 метильную группу,
Х атом фтора, и
W атом кислорода.
Целью изобретения является способ лечения Trichostrongylus columbriformis у песчанки, Beoroptes cuniculi у кролика путем введения производного мильбемицина, где в качестве производного
мильбемицина используют соединение общей формулы I, где
R1 представляет собой изопропильную группу,
R7 атом водорода, R8 группу ОR2,
R2 атом водорода, или группу
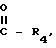
R4 представляет собой атом водорода, дихлорметильную, трихлорметильную группу,
R3 представляет собой метильную группу,
X атом фтора или низший алкил
W группаN-Y,
Y метокси, в количестве, составляющем 0,0156 0,125 мг/кг веса тела песчанки и 0,01 4 мкг/см2 для кролика, а также способ борьбы с насекомыми и клещами вредителями сельскохозяйственных культур, путем обработки мест их обитания соединением формулы I,
где
R1 представляет собой изопропильную группу,
R7 атом водорода, R8 группу OR2,
R2 атом водорода, или группу

R4 атом водорода, дихлорметильную, трихлорметильную группу,
R3 метильную группу,
Х атом фтора или низший алкил,
W группуN-Y,
Y метокси, в количестве 0,01 1000 ч/млн, составляющее 0,5 200 г/га.
Соединения 1 являются эффективными противоэндопаразитарными, противоэктопаразитарными агентами и могут быть использованы для защиты теплокровных животных от инфекции и инвазии вредителей. Их можно также применять к широкому кругу агрокультур и сред, в которых эти культуры росли или растут, для защиты культур от вреда, наносимого насекомыми и акаридами. Они очень эффективны в борьбе с комнатной мухой при применении их к месту обитания, источнику пищи или месту размножения мухи.
Неожиданно было обнаружено, что химическая модификация вышеуказанных соединений LL-F 28249 в положениях 5, 13, 23, 26 и 27 увеличивает противоэндо- и противоэктопаразитарную, инсектицидную, акарицидную, противонематодную активность указанных соединений. Более конкретно, 13-галоген-23-иминопроизводные 5-гидрокси- и 5-0-замещенных LL-F 28249 и 26,27-эпокси-LL-F 28249, а также 13-алкил-23-иминопроизводные 5-гидрокси- и 5-0-замещенных-LL-F 28249 обнаруживают очень высокую активность, являясь высокоэффективными эндо- и эктопаразитарными агентами, которые могут с успехом использоваться для лечения теплокровных животных. Было также найдено, что указанные соединения являются превосходными инсектицидными, акарицидными агентами, которые могут быть использованы для борьбы с указанными вредителями и для защиты агрокультур от вреда, наносимого указанными вредителями.
Далее, соединения 1 являются прекрасными инсектицидными, противонематодными и акарицидными агентами, которые можно использовать для защиты растущих или убранных культур от воздействия вышеназванных вредителей. Заявляемые соединения могут быть оформлены в виде сухих компактных гранул, текучих композиций, смачиваемых порошков, пылевидных препаратов, концентрированных пылевидных препаратов, микроэмульсий и т.п. что позволяет применять их для обработки почвы, воды и/или растительности и обеспечить необходимую защиту растений. Такие композиции включают в себя заявляемые соединения, смешанные с агрономически приемлемыми твердыми или жидкими носителями.
В случае применения к растениям заявляемые соединения могут быть оформлены в виде сухих гранул, текучих композиций, смачиваемых порошков, пылевидных препаратов, концентрированных пылевидных препаратов, микроэмульсий и т. п. что позволяет применять их для обработки почвы, воды и/или растительности и обеспечить необходимую защиту растений. Такие композиции включают в себя заявляемые соединения, смешанные с агрономически приемлемыми твердыми или жидкими носителями.
Для облегчения понимания данного изобретения приведены нижеследующие примеры, главным образом для того, чтобы проиллюстрировать его конкретные детали.
Пример 1.
Получение 5,23-диоксо-LL-F 28249 α
Смесь LL-F 28249 a (10,0 г, 0,016 моля) и диатомита (160 г) в диметилформамиде в атмосфере азота обрабатывают пиридиндихроматом, разделенным на
несколько порций (58,0 г, 0,15 моля), перемешивают в течение 4 ч при комнатной температуре, обрабатывают одним литром диэтилового эфира, перемешивают в течение 15 мин и фильтруют. Фильтрат промывают
водой, затем рассолом, сушат над MgSO4 и концентрируют в вакууме, получая остаток в виде желтого масла. Остаток подвергают флэш-хроматографии (двуокись кремния, элюент смесь хлористый
метилен: изопропанол, 99: 1), получая целевой продукт в виде легкого твердого вещества белого цвета (4,84 г, 49,7%), идентифицирован IНЯМР, 13СЯМР и масс-спектроскопией.
Пример 2.
Получение 13-(формилокси)-5,23-диоксо-LL-F 28249 a
Смесь 5,23-диоксо-LL-F 28249 a (2,6 г, 4,3 ммоля) в 88%-ной муравьиной кислоте в атмосфере азота обрабатывают двуокисью селена
(1,0 г, 9,0 ммолей), перемешивают при 50o в течение 2 ч, охлаждают до комнатной температуры, обрабатывают тремя объемами хлористого метилена, перемешивают в течение 10 мин, и фильтруют
через диатомит. Фильтрат отделяют, и органическую фазу концентрируют в вакууме, получая легкий твердый коричневый остаток. Импульсная колоночная хроматография этого остатка (двуокись кремния, гексан
этилацетат, 2 1, в качестве элюента) дает целевой продукт в виде твердого вещества бежевого цвета (1,3 г, 43%), идентифицирован 1НЯМР и 13СЯМР-спектроскопией.
Пример 3.
Получение 13-гидрокси-5,23-диоксо-LL-F 28249 a
Смесь 13-(формилокси)-5,23-диоксо-LL-F 28249 a (800 мг, 1,1 ммоля), метанола и диоксана при 0 5oС обрабатывают 20 мл 1,2 N НСl,
перемешивают при комнатной температуре 4 часа, выдерживают при 40oС в течение 16 ч и концентрируют в вакууме. Остаток извлекают этилацетатом, промывают бикарбонатом натрия, затем рассолом,
сушат над MgSO4 и концентрируют в вакууме, получая целевое соединение в виде твердого вещества бежевого цвета (700 мг, 91%), идентифицирован 1НЯМР-, 13СЯМР-спектроскопией и
масс-спектрометрией.
Пример 4.
Получение 13-фтор-23-(0-метилокси)-LL-F 28249 a
Cмесь 13-фтор-5,23-диоксо-LL-F 28249 a (30 мг, 0,05 ммоль) в абсолютированном
этаноле при температуре от -10oС до -5oС в атмосфере азота обрабатывают имидазолом (10 мг, 0,15 ммоль) с последующим добавлением солянокислого метоксиламина (12,5 мг, 0,15
ммоля),
перемешивают в течение 2 ч при температуре от -10 до -5oС, обрабатывают натрийборгидридом (12,0 мг, 0,30 ммоля) и перемешивают в течение 1 ч при температуре от -10 до -5o
С.
Реакционную смесь обрабатывают водой, перемешивают в течение 15 мин при температуре окружающей среды и концентрируют в вакууме. Полученный остаток диспергируют в этилацетате и воде, фазы разделяют,
и
органическую фазу промывают водой, затем рассолом, сушат над MgSO4 и концентрируют в вакууме, получая остаток. Остаток хроматографируют на колонке (двуокись кремния, гексаны: простой
эфир,
4: 1, в качестве элюента), получая целевой продукт в виде твердого вещества белого цвета, идентифицирован 1Н-, 13С- и 19 ЯМР-спектроскопией и масс-спектроскопией (см. табл. А).
Пример 5.
Получение 13-фтор-5-(формилокси)-23-(О-метилоксим)-LL-F 28249 a
Смесь 13-фтор-23-(О-метилоксим)-LL-F 28249 a (80 мг, 0,12 ммоль) в сухом пиридине при 0oС
в
атмосфере азота обрабатывают 1,0 мл смешанным ангидридом уксусной и муравьиной кислот, перемешивают при комнатной температуре в течение 1/2 ч, затем выливают на смесь льда и концентрированного
раствора бикарбоната натрия. Реакционную смесь экстрагируют простым эфиром, эфирный экстракт промывают холодным разбавленным раствором соляной кислоты, затем водой и насыщенным раствором бикарбоната
натрия. Органическую фазу сушат над Na2SO4 и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографированию (двуокись кремния, хлористый метилен этилацетат, 40
1
в качестве элюента), получая целевой продукт в виде твердого вещества белого цвета (34,4 мг, 42% ), идентифицирован 1НЯМР- и 13СЯМР-спектроскопией и масс-спектроскопией (см. табл. А).
Пример 6.
Получение 5-(дихлорацетокси)-13-фтор-23-(O-метилоксим)-LL-F 28249 a
Перемешиваемую смесь 13-фтор-23-(О-метилкосим)-LL-F 28249 a (85 мг, 0,12 ммоль) и
диметиламинопиридина (2,9 мг, 0,024 ммоль) в хлористом метилене при 5 10oС в атмосфере азота обрабатывают пиридином (50 мкл, 0,62 ммоль), а затем дихлорацетилхлоридом (0,02 мкл, 0,208
ммоль). После 2 ч выдерживания при 5 10oС реакционную смесь выливают на смесь насыщенного раствора бикарбоната натрия и льда и экстрагируют простым эфиром. Органическую фазу промывают
последовательно разбавленной (0,5%) соляной кислотой, водой и насыщенным раствором бикарбоната натрия, сушат над Na2SO4 и концентрируют в вакууме. Остаток подвергают
флэш-хроматографированию (двуокись кремния, от 0,25 до 0,5% изопропанола в хлористом метилене, градиентное элюирование), получая целевой продукт в виде твердого вещества белого цвета, идентифицирован
1Н- и 13СЯМР-спектроскопией и масс-спектроскопией (см. табл. А).
Пример 7.
Получение 13-фтор-23-(О-метилоксим)-5-(трихлорацетокси)-LL-F 28249 a
Перемешиваемую
смесь 13-фтор-23-(О-метилоксим)-LL-F 28249 a (80 мг, 0,12 ммоль) и диметиламинопиридина (2,9 мг, 0,024 ммоль) в хлористом метилене при 5 10oС в атмосфере азота обрабатывают пиридином (50
мкл, 0,62 ммоль), и затем трихлорацетилхлоридом (20 мкл, 0,18 ммоль). После выдерживания в течение 1,25 ч при 5 10oC реакционную смесь выливают в смесь насыщенного раствора бикарбоната
натрия и льда и экстрагируют простым эфиром. Органическую фазу промывают последовательно разбавленной (0,5%) соляной кислотой, водой и насыщенным раствором бикарбоната натрия, сушат над Na2
SO4 и концентрируют в вакууме, получая белый пенообразный остаток. Остаток подвергают флэш-хроматографированию (двуокись кремния, 0,10% 0,25% изопропанола в хлористом метилене, градиентное
элюирование), получая целевой продукт в виде беловатого твердого вещества (63,4 мг, 66%), идентифицирован 1Н- и 13СЯМР-спектроскопией и масс-спектроскопией (см. табл. А).
Пример 8.
Получение 5-[(n-нитробензоил)окси]-LL-F 28249 a
Смесь LL-F 28249 a (6,36 г, 10,4 ммоль) и пиридина (1,98 г, 25 ммоль) в хлористом метилене при 20 25oС обрабатывают
n-нитробензоилхлоридом (2,45 г, 13 ммоль), перемешивают в течение 4 ч, оставляют стоять на 16 ч и обрабатывают насыщенным раствором бикарбоната натрия и хлористого метилена. Реакционную смесь
перемешивают в течение 5 мин и разделяют фазы. Органическую фазу промывают последовательно насыщенным раствором бикарбоната натрия, 5% -ной соляной кислотой и рассолом, сушат над MgSO4 и
концентрируют в вакууме, получая целевой продукт в виде твердой белой пены (7,9 г, чистота 93,5% по данным анализа методом жидкостной хроматографии), идентифицирован 1НЯМР-спектроскопией,
масс-спектрометрией и микроанализом.
Пример 9.
Получение 5-[(n-нитробензоил)окси]-23-оксо-LL-F 28249 a
Перемешиваемую смесь 5-[(n-нитробензоил)окси]-LL-F
28249
a (6,3 г, 8,4 ммоль) в диметилформамиде обрабатывают пиридиндихроматом (однократно) при 20
25oС. Реакционную смесь перемешивают в течение 6 ч, выливают в воду, перемешивают
в
течение 15 мин и фильтруют. Отфильтрованный осадок промывают водой, сушат на воздухе, переносят в кипящий с обратным холодильником этилацетат, обрабатывают диатомитом и фильтруют. Фильтрат
концентрируют в вакууме, получая красно-коричневый твердый остаток. Остаток перекристаллизовывают из н-пропанола, получая целевой продукт в виде белых кристаллов (3,3 г, 51,7%), идентифицирован
1НЯМР-спектроскопией и масс-спектроскопией.
Пример 10.
Получение 13-гидрокси-5-[(n-нитробензоил)окси]-23-оксо-LL-F 28249 a
Перемешиваемую смесь
5-[(n-нитробензоил)окси]-23-оксо-LL-F 28249 a (1,25 г, 1,36 ммоль) и двуокиси селена (0,78 г, 7,02 ммоль) в 20 мл смеси трифторэтанол вода состава 9 1 нагревают при 40oС в течение 4 ч,
охлаждают до комнатной температуры и фильтруют через диатомит. Фильтрат концентрируют в вакууме; полученный остаток извлекают хлористым метиленом и фильтруют для удаления любых остатков двуокиси
селена, после чего фильтрат концентрируют в вакууме; полученный остаток подвергают флэш-хроматографированию (двуокись кремния, этилацетат гексаны, 1:2, в качестве элюента), получая целевой продукт в
виде твердого вещества белого цвета (0,29 г, 27%), идентифицирован 1Н- и 13СЯМР-спектроскопией и масс-спектроскопией.
Пример 11.
Получение
13-фтор-5-[(n-нитробензоил)окси]-23-оксо-LL-F 28249 a
Смесь 13-гидрокси-5-[(n-нитробензоил)окси] -23-оксо-LL-F 28249 a (0,5 ммоль) в сухом хлористом метилене в атмосфере азота при -70oС обрабатывают добавляемым по каплям из шприца диметиламинотрифторидом серы (80 мкл, 0,60 ммоль). После 20 минут выдерживания при -70oС к реакционной смеси добавляют 0,2 мл воды и 1
мл метанола и перемешивают в течение 15 мин при -78oС 0oС, позволяют нагреться до комнатной температуры и концентрируют в вакууме. Остаток подвергают флэш-хроматографированию
(двуокись кремния, смеси хлористый метилен/этилацетат в качестве элюента), получая целевой продукт в виде твердого вещества белого цвета, (236 мг, 58,7%) идентифицирован 1Н, 13С и
АРТ-ЯМР-спектроскопией и масс-спектроскопией (сигнала А).
Пример 12.
Получение 13-фтор-23-оксо-LL-F 28249 a
Интенсивно перемешиваемую смесь
13-фтор-5-[(n-нитробензоил)-окси]-23-оксо-LL-F 28249 a (187 мг, 0,24 ммоль) в диоксане при 5oС обрабатывают 1N NaOH, добавляемым по каплям (0,35 мл, 0,35 ммоль), перемешивают при 10 15oС в течение 3 ч, разбавляют этилацетатом и водой и хорошо перемешивают. Разделяют фазы, и органическую фазу промывают водой, сушат над Na2SO4 и концентрируют в вакууме.
Остаток подвергают флэш-хроматографированию (двуокись кремния, этилацетат гексан, 1:2 1:1, градиентное элюирование), получая целевой продукт в виде белого порошка (117 мг, 78%), идентифицирован 1Н- и
13СЯМР-спектроскопией и масс-спектроскопией (см. табл. А).
Пример 13.
Получение 26,27-эпокси-13-фтор-23-(О-метилоксим)-LL-F 28249 a
Смесь 26,
27-эпокси-13-фтор-23-оксо-LL-F 28249 a (7,6 мг, 0,12 ммоль), солянокислого гидроксиламина (4,5 мг, 0,05 ммоль) и ацетата натрия (6,6 мг, 0,08 ммоль) в метаноле перемешивают при комнатной температуре
в
течение 6 ч и концентрируют в вакууме. Остаток разделяют между водной фазой и фазой хлористого метилена. Органическую фазу отделяют и концентрируют в вакууме. Полученный остаток хроматографируют
(двуокись кремния, этилацетат гексаны, 1: 1), получая целевой продукт в виде белого порошка (6,0 мг, 76%), идентифицирован 1Н- и 13СЯМР-спектроскопией и масс-спектроскопией (см. табл. А).
Пример 14.
Получение 13-хлор-5,23-диоксо-LL-F 28249 a
Смесь 13-гидрокси-5,23-диоксо-LL-F 28249 a (70 мг, 0,10 ммоля) в хлористом метилене в атмосфере азота при 5
10oС обрабатывают хлористым тионилом, добавляемым по каплям из шприца, перемешивают при 5 10oС в течение 2 ч и при комнатной температуре в течение 16 ч и концентрируют в
вакууме.
Полужидкий остаток подвергают импульсному хроматографированию (двуокись кремния, гексан этилацетат, 75:25), получая целевой продукт в виде твердого вещества бежевого цвета (38,5 мг, 60% ),
идентифицирован 1НЯМР-спектроскопией и масс-спектроскопией.
Пример 15.
Получение 13-бром-5,23-диоксо-LL-F 28249 a
Смесь 13-гидрокси-5,23-диоксо-LL-F 28249 a
(97 мг, 0,15 ммоль) в бензоле в атмосфере аргона при 5 10oС обрабатывают трехбромистым фосфором (20 мкл, 57,6 мг, 0,21 ммоль) с помощью шприца, перемешивают в течение 1 ч при 5 10oС, выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают рассолом, сушат над MgSO4 и концентрируют в вакууме. Полужидкий остаток дважды хроматографируют (двуокись
кремния, гексаны этилацетат, 9 1), получая целевой продукт в виде легкого твердого вещества желтого цвета, идентифицирован масс-спектроскопией.
Пример 16.
Оценка
противопаразитарной активности тестируемых соединений
Противопаразитарную активность заявляемых соединений по отношению к эктопаразитам при различных концентрациях активных ингредиентов
определяли так, как это описано в нижеследующих тестовых примерах. Результаты этих тестов суммированы в табл. 1.
Оценка тестируемых соединений в борьбе против Trichostrongylus
colubriformis в теплокровных животных
В этих тестах активные ингредиенты растворяли в полиэтиленгликоле и диметилсульфоксиде (ПЭГ ДМСО) (объемное соотношение 1:2) в количестве, достаточном
для того, чтобы при лечении животного обеспечить дозу от 0,0156 до 0,1250 мг/кг.
Для оценки эффективности тестируемых соединений самцов песчанки в возрасте 5 недель инфицировали
личинками T. colubriformis овечьего происхождения в количестве 400 600; инфицирование производили в нулевой день. На 7-й день песчанок взвешивали и начинали лечение. Тестируемые соединения вводили
через желудочный зонд. На 11-й день после обработки песчанок умерщвляли и подсчитывали количество оставшихся червей. Эффективность (в процентах) вычисляли, сравнивая количество червей в подвергшихся
лечению (обработанных) животных с количеством червей в инфицированных контрольных (не подвергшихся лечению) животных, используя следующую формулу:

Для каждого акта обработки делали три повтора.
Полученные данные суммированы в табл. 1.
Оценка тестируемых
соединений в борьбе с Psoroptes cuniculi (ушные клещи)
В день, предшествующий тесту, или утром в день проведения теста, тестируемые соединения растворяли в ацетоне и разбавляли до требуемой
концентрации. Концентрация должна быть такова, чтобы 400 мкл содержали количество, которое следует поместить на каждый бумажный фильтр. 400 мкл этого раствора пипеткой переносили на верхний (диаметр
3,
7 см) и нижний (3,5 см в диаметре) кружки фильтровальной бумаги, которые затем помещали на керамическую тарелку и высушивали. (Примечание: Эту процедуру надлежит проводить под колпаком). У
фильтровальной бумаги имеются шершавая и гладкая стороны. Растворы тестируемых соединений следует наносить на шершавую сторону, которая при сушке является верхней стороной. После высушивания два
кружка помещают в чашку Петри таким образом, чтобы их шершавые стороны были обращены друг к другу, разделив их небольшим куском плотной бумаги, сложенной в форме тента. Кружки выдерживают при
комнатной температуре в течение ночи, если вышеописанную процедуру осуществляют накануне дня проведения тестирования. В каждом тесте используют следующие стандарты: 0,01, 0,1 и 1,0 мкмл/см2
.
Струп, содержащий клещей, снимают с ушей инвазированных кроликов утром в день проведения тестирования. Этот материал помещают в большую чашку Петри под освещенное увеличительное стекло. Клещи выползают из струпа, и их без труда собирают на кончик препаровальной иглы или на один зубец небольшого пинцета. Верхнюю фильтровальную бумагу в каждой чашке удаляют и помещают 12 клещей на нижний кружок, после чего верхний кружок возвращают на место. Перед возвращением на место крышки чашки Петри обод чашки смазывают вазелином для того, чтобы ловить убегающих клещей.
При тестировании для каждой дозы, как правило, проводят 4 подсчета: 2 после 4 ч и 2 после 24 ч.
После того как клещи помещены в чашки, их помещают на поддон, который затем помещают в пластиковый мешок с несколькими влажными полотенцами и выдерживают при комнатной температуре.
Спустя 4 или 24 ч чашки осматривают с помощью препаровальной лупы следующим
образом:
1. Осторожно открывают чашку, удаляют верхний кружок фильтровальной бумаги и сохраняют его.
2. На нижнем кружке мягким карандашом рисуют небольшой кружок примерно 0,5 см в диаметре.
3. Пипеткой аккуратно увлажняют площадь внутри кружка и вокруг него.
4. Переносят всех клещей в чашке в этот кружок. Тщательно обследуют крышку, верхний кружок фильтровальной бумаги и область под нижним кружком в поисках клещей.
5. Подсчитывают и записывают число клещей в кружке.
6. Возвращают на место крышку и отставляют чашку в сторону.
7. Спустя минимум 15 мин подсчитывают число клещей, оставшихся в кружке (это мертвые клещи).
8. Подсчитывают и записывают число живых клещей.
9. Вычисляют эффективность (в) по формуле:

Полученные результаты приведены в табл. 1.
Оценка тестируемых соединений в борьбе с Musca domestia
В этом тесте вновь образовавшиеся личинки мухи комнатной выращивают в неопределенной среде,
состоящей из ферментированного цельного молока и высушенной бычьей крови. Тестируемые соединения добавляют к молоку и определяют их активность по утрате личинками способности окукливаться.
Тестирование проводят в 1-унциевых пластмассовых медицинских чашках. Бумажное полотенце (полотенца Scott C-Fold, 150) разрезают на куски размером примерно 3,5х10 см. Три таких куска складывают гармошкой и помещают в каждую пластмассовую чашку. За 24 ч до начала тестирования 0,5 галлона цельного молока делят на 5 однолитровых мензурок и помещают в инкубатор при 39oС. Утром в день тестирования ферментированное молоко достают из инкубатора, перемешивают и выливают в маленькие мензурки (каждая объемом 100 мл). В каждую мензурку добавляют 1 2 г высушенной бычьей крови и перемешивают, чтобы распределить кровь, после чего помещают в инкубатор.
Дозы тестируемых соединений рассчитывают так, чтобы 0,1 мл содержал количество тестируемого соединения, которое следует добавить к 100 мл молока. Соединения должны быть растворены в ацетоне. К каждой контрольной мензурке добавляют 100 мкл ацетона.
Каждую мензурку извлекают из инкубатора и помещают на магнитную мешалку. Добавляют тестируемое соединение и тщательно перемешивают. Затем порции по 20 мл отбирают и добавляют к меченным тестовым чашкам (4 повтора на 1 обработку). Используя тонкую кисточку для рисования, в каждую чашку переносят 20 личинок, затем чашку помещают в пластмассовый мешок с несколькими отверстиями, проделанными булавкой. Мешки с чашками помещают на плоский поддон и переносят этот поддон в инкубатор, где выдерживают одну неделю при 27oС.
Поддоны извлекают из инкубатора, и подсчитывают количество куколок в
каждом мешке. Удаляют
бумажные полотенца и тщательно обследуют чашки в поисках оставшихся куколок. Большинство куколок остается в мешке. Эффективность (в) подсчитывают по формуле:

Конечные результаты, выраженные в виде процента ингибирования окукливания, корректируют, учитывая контрольную смертность, с использованием формулы Эбботта. Полученные данные приведены в табл. 1.
Пример 17.
Оценка инсектицидной и акарицидной активности тестируемых
соединений
Для
нижеследующих определений тестовые растворы приготовляли, растворяли тестируемые соединения в 35% -ном растворе ацетона в воде до концентрации 10.000 ррm. Если требовалось,
осуществляли
последовательные разбавления водой.
Heliothis virescens яйца, листовертка-почкоед табака
Молодой лист хлопка длиной около 6-7 см погружают при перемешивании в
тестовый раствор
на 3 с. Яйца собирают на марлю, и нарезают ее на квадраты размером 10-20 мм, каждый из которых содержит около 50-100 яиц (возраст 6-30 ч). Марлевый квадрат с яйцами также погружают в
тестовый раствор
и помещают на обработанный лист. Эту комбинацию помещают под колпак для высушивания, затем переносят в 8-унциевую бумажную чашку, в которую ранее был помещен влажный зубной тампон
длиной 5 см. На верх
чашки кладут прозрачную пластмассовую крышку, и всю конструкцию выдерживают 3 дня, после чего подсчитывают смертность.
Heliothis virescens третья возрастная
стадия, листовертка-почкоед
табака
Семядоли хлопка погружают в тестовый раствор и высушивают под колпаком. После высушивания каждую семядолю разрезают на 4 части и 10 частей раздельно
помещают в 30-миллилитровые
пластмассовые медицинские чашки, содержащие влажный зубной тампон длиной 5-7 см. В каждую чашку помещают одну гусеницу третьей возрастной стадии, и закрывают чашку
картонной крышкой. Образцы
выдерживают 3 дня, после чего
подсчитывают смертность и оценивают уменьшение степени повреждения, наносимого гусеницами вследствие поедания.
Spondoptera
eridania, личинки третьей
возрастной стадии, южная совка-походный червь
Листья лимы мелкозернистой длиной 7-8 см погружают при перемешивании на 3 секунды в тестовый раствор и помещают под
колпак для сушки. Затем лист
помещают в чашку Петри размером 100 • 10 мм, содержащую на дне влажную фильтровальную бумагу и 10 гусениц третьей возрастной стадии. Определения смертности,
уменьшения поедания и любых
нарушений нормального изменения внешнего вида производят через 3 и 5 дней.
Aphis fabae смешанная возрастная стадия, тля бобовая
В горшки,
содержащие по одной настурции
(Tropaeolum sp.) высотой около 5 см, помещают на 1 день до тестирования около 100 -200 тлей. Каждый горшок опрыскивают тестовым раствором в продолжение 2-х оборотов
вертящегося со скоростью 4 об/мин
столика, находящегося под крышкой, используя пульверизатор 154 Devilbiss. Наконечник распылителя держат на расстоянии около 15 см от растения, и струю направляют так,
чтобы полностью покрыть растения
и тлей. Опрысканные горшки помещают на белые эмалированные поддоны и выдерживают 2 дня, после чего оценивают смертность.
Empoasca abrupta, взрослые
особи, западная цикадка
картофельная
Лист лимы мелкозернистой длиной около 5 см погружают при перемешивании на 3 с в тестовый раствор и помещают под колпак для высушивания. Лист помещают в
чашку Петри размером 100
• 10 мм, содержащую влажную фильтровальную бумагу, расположенную на дне чашки. Около 10 взрослых цикадок вносят в каждую чашку, и выдерживают 3 дня, после чего
подсчитывают смертность.
Tetranychus urticae (Р-резистентный штамм) клещик паутинный двухпятнистый
Растения лимы мелкозернистой, имеющие первичные листья длиной 7-8 см,
обрезают до одного растения в горшке.
От листа, взятого из главной колонии клещей, отрезают небольшой кусочек и помещают на каждый лист тестовых растений. Это делают за 2 ч до обработки, чтобы дать
клещам возможность переместиться на
тестовое растение и отложить яйца. Размер отрезаемого кусочка варьируют таким образом, чтобы получить около 100 клещей на один лист. Во время обработки кусочек
листа, используемый для переноса клещей,
удаляют и выбрасывают. Инвазированные клещами растения погружают при перемешивании на 3 с в тестовый раствор и помещают под колпак для сушки. Растения
выдерживают 2 дня, затем на первом листе
определяют количество убитых взрослых особей. Второй лист оставляют на растении еще на 5 дней, затем обследуют, определяя умерщвление яиц и/или вновь
появившихся нимф (личинок с неполным
превращением).
Оценочная шкала
0 эффект отсутствует
1 10 25% убитых
2 26 35% убитых
3 36 45% убитых
4
46 55% убитых
5 56 65%
убитых
6 66 75% убитых
7 76 85% убитых
8 86 99% убитых
9 100% убитых
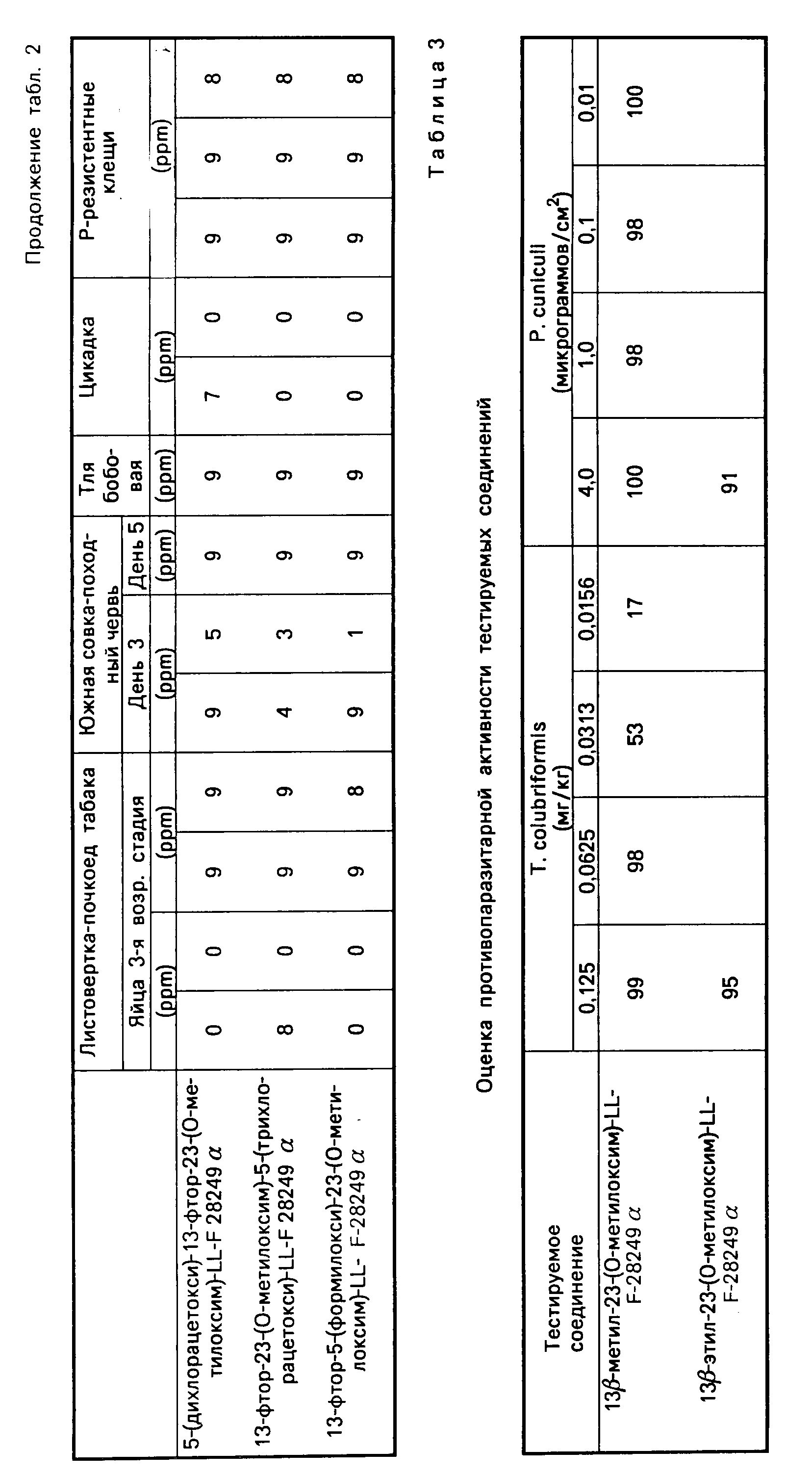
Полученные данные приведены в таблице 2.
Пример 18.
Получение 5-ацетокси-LL-F 28249 α
К раствору LL-F 28249 a (32,57 г. 39,3 ммоль) в пиридине при 0oС добавляют уксусный ангидрид (20 мл,
212 ммоль). Реакционную смесь
перемешивают в течение 3 дней при 0oС. Концентрирование в вакууме реакционной смеси дает остаток желтого цвета. Остаток растворяют в этилацетате, промывают
последовательно водой,
разбавленной соляной кислотой, водой, 10%-ным раствором бикарбоната натрия и рассолом, сушат над безводным сульфатом натрия и концентрируют в вакууме, получая целевое
соединение в виде пены
бледно-желтого цвета (35,47 г), идентифицировано ЯМР-спектроскопией.
Пример 19.
Получение 5-ацетокси-13 b-метил-23-оксо-LL-F28249 a
К
смеси 5-ацетокси-13
b-метил-LL-F28249 a (0,188 г, 0,28 ммоль), некоторого количества молекулярных сит 4А и ацетонитрила добавляют 4-метилморфолин-N-оксид (0,132 г, 1,12 ммоль). После перемешивания в
течение 15 мин при
комнатной температуре к смеси добавляют перрутенат тетрапропиламмония (0,047 г, 0,13 ммоль) и продолжают перемешивать в течение часа. Реакционную смесь фильтруют через диатомит,
разбавляют
этилацетатом и промывают последовательно водой, разбавленной соляной кислотой, водой, 10%-ным раствором бикарбоната натрия и рассолом, сушат над безводным сульфатом натрия и концентрируют
в вакууме,
получая остаток. Остаток хроматографируют, используя силикагель и смесь хлористый метилен/ацетонитрил (19:1) в качестве элюента, получают целевое соединение в виде порошка белого цвета (0,
108 г, 57%),
идентифицировано 1НЯМР-, 13СЯМР-спектроскопией и масс-спектроскопией.
Используя методику, описанную в примере 6, но с заменой 5-ацетокси-13 b-метил-LL-F28249 a нa 5-ацетокси-13 b-этил-LL-F28249 a получают 5-ацетокси-13 b-этил-23-оксо-LL-F28249 a (см. табл. А).
Пример 20.
Получение 5-ацетокси-13
b-метил-23-(О-метилоксим)-LL-F28249 a
Смесь 5-ацетокси-13 b-метил-23-оксо-LL-F28249 a (0,144 г, 0,22 ммоль), ацетата натрия (0,096 г, 1,17 ммоль), солянокислого метоксиламина (0,092 г, 1,1
ммоль) и метанола перемешивают в течение 1 ч при
комнатной температуре. Реакционную смесь разбавляют этилацетатом, промывают последовательно водой и рассолом, сушат над безводным сульфатом натрия и
концентрируют в вакууме, получая остаток. Остаток
хроматографируют, используя силикагель и смесь гексаны/этилацетат (4:1) в качестве элюента; получают целевое соединение в виде твердого вещества
белого цвета (0,125 г, 83%); идентифицировано 1НЯМР-,
13СЯМР-спектроскопией масс-спектроскопией.
Используя методику, описанную в примере 7, но с заменой 5-ацетокси-13 b-метил-23-оксо-LL-F28249 a на 5-ацетокси-13 b-этил-23-оксо-LL-F28249 a получают 5-ацетокси-13 b-этил-23-(О-метилоксим)-LL-F28249 a (cм. табл. А).
Пример 21.
Получение
13 b-метил-23-(О-метилоксим)-LL-F28249 a
К раствору
5-ацетокси-13 b-метил-23-(О-метилоксим)-LL-F28249 a (0,11 г, 0,16 ммоль) в метаноле при 0oС добавляют гидроокись натрия (0,05
мл, 0,50 ммоль). Перемешивают при 0oС в течение 2 ч,
затем разбавляют реакционную смесь этилацетатом, промывают последовательно водой и рассолом, сушат над безводным сульфатом натрия и
концентрируют в вакууме, получая остаток. Остаток хроматографируют,
используя силикагель и смесь гексаны/этилацетат 3:1) в качестве элюента; получают целевое соединение в виде пены белого цвета (0,
079 г, 77%), идентифицировано 1НЯМР-, 13СЯМР-спектроскопией и
масс-спектроскопией.
Используя методику, описанную в примере 8, но с заменой 5-ацетокси-13 b-метил-23-(О-метилоксим)-LL-F28249 a на 5-ацетокси-13 b-метил-23-(О-метилоксим)-LL-F28249 a получают 5-ацетокси-13 b-этил-23-(О-метилоксим)-LL-F28249 a (см. табл. А).
Пример 22.
Оценка противопаразитарной активности тестируемых соединений
Противопаразитарную активность заявляемых соединений при различных концентрациях активных ингредиентов определяли
так, как это описано в нижеследующих тестовых примерах. Результаты этих тестов
суммированы в табл. 3.
Оценка тестируемых соединений в борьбе против Trichostrongylus colubriformis в
теплокровных животных
В этих тестах активные ингредиенты растворяли в
полиэтиленгликоле и диметилсульфоксиде (ПЭГ ДМСО) (объемное соотношение 1:2) в количестве, достаточном для того, чтобы
при лечении животного обеспечить дозу от 0,0156 до 0,1250 мг/кг.
Для оценки эффективности тестируемых соединений самцов песчанки в возрасте 5 недель инфицировали личинками T.
colubriformis овечьего происхождения в количестве 400-600; инфицирование производили в
нулевой день. На 7-й день песчанок взвешивали и начинали лечение. Тестируемые соединения вводили через
желудочный зонд. На 11-й день после обработки песчанок умерщвляли и подсчитывали количество
оставшихся червей. Эффективность (в) вычисляли, сравнивая количество червей в подвергшихся лечению
(обработанных) животных с количеством червей в инфицированных контрольных (не подвергшихся лечению)
животных, используя формулу:

Для каждого акта обработки делали три реплики.
Полученные данные суммированы в табл. 3.
Оценка тестируемых соединений в борьбе
с Psoroptes cuniculi (ушные клещи)
В день, предшествующий тесту, или утром в день проведения
теста, тестируемые соединения растворяли в ацетоне и разбавляли до требуемой концентрации.
Концентрация должна быть такова, чтобы 400 мкл содержали количество, которое следует поместить на каждый
бумажный фильтр. 400 мкл этого раствора пипеткой переносили на верхний (диаметр 3,7 см) и
нижний (диаметр 3,5 см) кружки фильтровальной бумаги, которые затем помещали на керамическую тарелку и
высушивали. (Примечание: Эту процедуру надлежит проводить под колпаком). У фильтровальной бумаги
имеются шершавая и гладкая стороны. Растворы тестируемых соединений следует наносить на шершавую
сторону, которая при сушке является веpхней стороной. После высушивания два кружка помещают в чашку
Петри таким образом, чтобы их шершавые стороны были обращены друг к другу, разделив их небольшим
куском плотной бумаги, сложенной в форме тента. Кружки выдерживают при комнатной температуре в течение
ночи, если вышеописанную процедуру осуществляют накануне дня проведения тестирования. В каждом
тесте используют следующие стандарты: 0,01, 0,1 и 1,0 мкл/см2.
Струп (содержащий клещей) снимают с ушей инвазированных кроликов утром в день тестирования. Этот материал помещают в большую чашку Петри под освещенное увеличительное стекло. Клещи выползают из струпа, и их без труда собирают на кончик препаровальной иглы или на один зубец небольшого пинцета. Верхнюю фильтровальную бумагу в каждой чашке удаляют, и помещают 12 клещей на нижний кружок, после чего верхний кружок возвращают на место. Перед возвращением на место крышки чашки Петри обод чашки смазывают вазелином для улавливания убегающих клещей.
При тестировании для каждой дозы, как правило, проводят 4 подсчета: 2 после 4 ч и 2 после 24 ч.
После того, как клещи помещены в чашки, их помещают на поддон, который затем помещают в пластиковый мешок с несколькими влажными полотенцами, и выдерживают при комнатной температуре.
Спустя 4 или 24 ч чашки
осматривают с помощью препаровальной лупы следующим образом:
1. Осторожно открывают
чашку, удаляют верхний кружок фильтровальной бумаги и сохраняют его.
2. На нижнем кружке мягким карандашом рисуют небольшой круг примерно 0,5 см в диаметре.
3. Пипеткой аккуратно увлажняют площадь внутри круга и вокруг него.
4. Переносят всех клещей в чашке в этот круг. Тщательно обследуют крышку, верхний кружок фильтровальной бумаги и область под нижним кружком в поисках клещей.
5. Подсчитывают и записывают число клещей в круге.
6. Возвращают на место крышку и отставляют чашку в сторону.
7. Спустя минимум 15 мин подсчитывают число клещей, оставшихся в круге (это мертвые клещи).
8. Подсчитывают и записывают число живых клещей.
9. Вычисляют
эффективность (в) по формуле:

Общее число клещей
Полученные результаты приведены в табл. 3.
Пример 23.
Оценка инсектицидной и акарицидной активности тестируемых
соединений
Для нижеследующих определений тестовые растворы приготовляли,
растворяя тестируемые соединения в 35% -ном растворе ацетона в воде до концентрации 10.000 ррm. Если требовалось,
осуществляли последовательные разбавления водой.
Heliothis virescens
яйца, листовертка-почкоед табака
Молодой лист хлопка длиной около 6-7 см погружают при перемешивании в
тестовый раствор на 3 с. Яйца собирают на марлю, и нарезают ее на квадраты размером
10-20 мм, каждый из которых содержит около 50-100 яиц (возраст 6-30 ч). Марлевый раствор помещают на обработанный
лист. Эту комбинацию помещают под колпак для сушки, затем переносят в 8-унциевую
бумажную чашку, в которую ранее был помещен влажный зубной тампон длиной 5 см. На верх чашки кладут прозрачную
пластмассовую крышку, и всю конструкцию выдерживают 3 дня, после чего подсчитывают
смертность.
Aphis fabae смешанная возрастная стадия, тля бобовая
Горшки, содержащие по
одной настурции (Tropaeolum sp.) высотой около 5 см, инвазировали за 1 день до
тестирования около 100-200 тлями. Каждый горшок опрыскивают тестовым раствором в продолжение 2-х оборотов вертящегося со
скоростью 4 об/мин столика, находящегося под крышкой, используя пульверизатор
154 Devilbiss. Наконечник распылителя держат на расстоянии около 15 см от растения, и струю направляют так, чтобы
полностью покрыть растения и тлей. Опрысканные горшки помещают на белые эмалированные
поддоны и выдерживают 2 дня, после чего оценивают смертность.
Tetranychus urticae (Р резистентный
штамм) клещик паутинный двухпятнистый
Выбирают растения лимы мелкозернистой,
имеющие первичные листья длиной 7-8 см, и обрезают до одного растения в горшке. От листа, взятого из главной
колонии клещей, отрезают небольшой кусочек и помещают на каждый лист тестовых растений.
Это делают за 2 ч до обработки, чтобы дать клещам возможность переместиться на тестовое растение и отложить
яйца. Размер отрезаемого кусочка варьируют таким образом, чтобы получить около 100 клещей
на один лист. При обработке кусочек листа, используемый для переноса клещей, удаляют и выбрасывают.
Инвазированные клещами растения погружают при перемешивании на 3 секунды в тестовый раствор и
помещают под колпак для сушки. Растения выдерживают 2 дня, затем на первом листе определяют количество
убитых взрослых особей. Второй лист оставляют на растении еще на 5 дней, затем обследуют,
определяя умерщвление яиц и/или вновь появившихся нимф.
Оценочная шкала
0 эффект
отсутствует
1 10 25% убитых
2 26 35% убитых
3 36 45% убитых
4 46 55% убитых
5 56 65% убитых
6 66 75% убитых
7 76 85% убитых
8 86
99% убитых
9 100 убитых
Полученные данные приведены в табл. 4.
Далее, в таблице В, продемонстрирована эффективность соединений I в сравнении с известным соединением авермектин. Согласно табл. В, заявленные соединения стабильно демонстрируют лучшую инсектицидную и акарицидную активность при эквивалентной или даже более низкой дозах, чем авермектин. Оценочная шкала данных, представленная в табл. В, расшифрована в примере 19.
Реферат
Использование:
сельское хозяйство, химические средства защиты растений и животных. Сущность изобретения: продукт
формулы /1/

R1 - метил, этил, изопропил, R7 - водород, R8 - OR2 или R7 и R8 вместе с атомом углерода, к которому они присоединены образуют С=О R2 - водород,
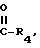
Формула

где R1 метил, этил, изопропил;
R7 водород;
R8 группа ОR2 или, будучи взятыми вместе с атомом углерода, с которым они соединены, R7 и R8 представляют собой C=O;
R2 водород или группа

R4 водород, C1 C4-алкильная, галоген C1 - C4 -алкильная группы, фенил, замещенный нитрогруппой;
R3 метильная группа;
X C1 C4-алкильная группа или галоген;
W кислород или группа N Y;
Y группа OR5, где R5 C1 C4-алкильная группа;
и пунктирный треугольник с атомом кислорода в вершине при C26 C27 обозначает, что в этом месте имеется двойная связь или эпоксидная группа, при условии, что когда X галоген, R5 - C1-C4-алкил и, когда X C1 C4-алкил, C26 C27 двойная связь.

R4 водород, метильная, хлорметильная, дихлорметильная, трихлорметильная группы, R3 метильная группа, X фтор, W группа N Y, Y группа OR5 и R5 C1-C4-алкильная группа.

R4 водород, дихлорметильная, трихлорметильная группы, R3 - метильная группа, X фтор или C1 C4-алкил, W группа N Y, Y метокси, в количестве, составляющем 0,0156 0,125 мг/кг массы тела песчанки и 0,01 4,0 мкг/см2 для кролика.

R4 водород, дихлорметильная, трихлорметильная группы, R3 - метильная группа, X фтор или C1 C4-алкильная группа, W - группа N Y, Y метокси, в количестве 0,01 1000,0 ч/млн-1, соответствующее 0,5 200,0 г/га.
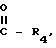
R4 водород, метильная, дихлорметильная, трихлорметильная группы, R3 метильная группа, X фтор или C1 C4-алкильная группа, W группа N Y, Y метокси.
11.09.89. Все заявленные соединения за исключением тех, у которых X - C1 C4-алкильная группа.

Комментарии