Производные дорамектина, способы их получения, способы лечения - RU2120943C1
Код документа: RU2120943C1
Описание
Настоящее изобретение относится к новым интермедиатам в получении
соединения
нижеприведенной формулы (I)

именуемого далее дорамектином, и усовершенствованному способу получения названных интермедиатов. Изобретение также относится к применению названных интермедиатов в качестве антипаразитических соединений. Далее, изобретение относится к усовершенствованному методу получения дорамектина из соединения нижеприведенной формулы (II).
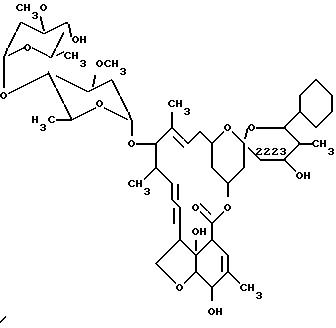
Дорамектин - антипаразитический и противоглистный агент широкого спектра действия, принадлежащий к классу вторичных метаболитов, известных как авермектины. Дорамектин может быть получен ферментацией штамма микроорганизма вида Streptomyces avermitilis, продуцирующего авермектин, такого как ATCC 31267, 31271 или 31272 в аэробных условиях в водной питательной среде, содержащей неорганические соли и усваиваемые источники углерода и азота, как это описано в патенте США N 5089480, на который здесь имеется ссылка. Другим штаммом микроорганизма, продуцирующего авермектин, является Streptomyces avermitilis ATCC 53568, который описан Даттоном с сотр. (Dutton et al., Jornal of Antibiotics, 44, 357-65 (1991). Streptomyces avermitilis ATCC 31267, 31271 и 31272 депонируются в соответствии с условиями Будапештского соглашения в American Type Culture Collection, 12301 Parklawn Drive, Rockvill, Maryland 20852, USA.
Во время процесса ферментации, который дает соединение вышеприведенной формулы (I), могут быть выделены различные побочные продукты. Главный побочный продукт, который может быть выделен во время ферментации определенных выше микроорганизмов, имеет структуру, описанную выше формулой (II). Выделение соединения формулы (II) из ферментационного бульона Streptomyced avermitilis ATCC 53568 описано Даттоном с сотрудниками (см. выше). Соединение формулы (II) является активным антипаразитическим и противоглистным соединением, что было изложено и защищено в патенте США N 5089480. Однако дорамектин является предпочтительным. Способ по настоящему изобретению позволяет использовать побочный продукт формулы (II) путем его превращения в более ценный антипаразитический агент дорамектин формулы (I).
Общим изменением в этом способе является отщепление гидроксигруппы по атому C-23 с образованием в молекуле олефиновой связи между положениями C-22 и C-23. Ранее сообщалось о способе такого же превращения незначительно отличающихся авермектинов, характеризующемся низким выходом. Например, если по атому C-25 вместо втор-бутильной группы находится циклогексильная, то превращение достигается в результате пяти последовательных стадий с общим выходом приблизительно 3,6% (Mrozic et al. , Tetrahedron Letters, 1982, 23, 2377-78). В связи с низким выходом в данном способе желательно изобрести способ, в котором исходный материал более эффективно превращался бы в дорамектин.
Поэтому целью настоящего изобретения является превращение соединения формулы (II) в дорамектин с высоким общим выходом. Дальнейшей целью данного изобретения является получение полезных интермедиатов для данного способа.
Настоящее изобретение обеспечивает получение новых интермедиатов формулы (III)
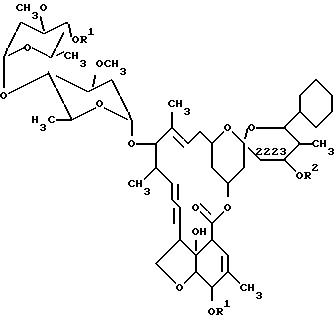
где
R1 - это (C2-C5)алканоил или арилоксиацетил, и
R2 - это водород или арилокситиокарбонил.
Данное изобретение далее обеспечивает получение новых интермедиатов формулы (IV)

где
R1 - это (C2-C5)алканоил или арилоксиацетил.
В частности, предпочтительными соединениями по данному изобретению являются соединения формулы (III), где R1 - это (C2-C5)алканоил, феноксиацетил или (C1-C4 )алкилфеноксиацетил, и R2 - это водород или (C1-C4)алкилфенокситиокарбонил. Особо предпочтительными соединениями в этой группе являются соединения формулы (III), где R1 - это ацетил или феноксиацетил, и R2 - это водород или п-толилоксикарбонил.
Также предпочтительными соединениями по данному изобретению являются соединения формулы (IV), где R1 - это (C2-C5)алканоил, феноксиацетил или (C1-C4)алкилфеноксиацетил. Особо предпочтительными соединениями в этой группе являются соединения формулы (IV), где R1 - это ацетил или феноксиацетил.
Данное изобретение далее обеспечивает способ получения
соединений формулы (I)

включающий последовательные стадии:
(а) взаимодействия соединения формулы (II)

с ацилирующим агентом формулы (R4CO)2O или R4COX, где R4 - это арилоксиметил и X - это Cl или Br, с образованием соединения формулы (III), где R1 - это арилоксиацетил и R2 - это H;
(б) взаимодействия указанного соединения формулы (III), где R1 - это арилоксиацетил и R2 - это H, с соединением формулы R3OC(=S)X, где R3 - это арил и X - это Cl или Br, с образованием соединения формулы (III), где R1 - это арилоксиацетил и R2 - это арилоксикарбонил;
(в) взаимодействия указанного соединения формулы (III), где R1 - это арилоксиацетил и R2 - это арилоксикарбонил, в инертном растворителе при температуре от 150oC до 200oC в течение от 2 до 48 часов с карбонатом кальция при непрерывной подаче инертного газа с образованием соединения формулы (IV), где R1 - это арилоксиацетил; и
(г) взаимодействия указанного соединения формулы (IV), где R1 - это арилоксиацетил с основанием в спирте с образованием соединения формулы (I).
В частности, предпочтительным способом в данном способе является тот, где инертный газ - это азот. Особо предпочтительным способом в данном предлагаемом способе является тот, где основание - это NH3, KOH, KCN, Na2CO3 или NaOAc. Еще более предпочтительными способами в особе предпочтительном способе являются те, в которых используются особо предпочтительные соединения по данному изобретению.
Данное изобретение далее направлено на способ получения соединения формулы (I), включая
последовательные стадии:
(а) взаимодействие соединения формулы (II) с ацилирующим агентом формулы (R4CO)2O или R4COX, где R4 - (C1
-C4)алкил и X - это Cl и Br, с образованием соединения формулы (III), где R1 - это (C1-C4)алканоил и R2 - это H;
(б) взаимодействие
указанного
соединения формулы (III), где R1 - это (C1-C4)алканоил) и R2 - это H, с соединением формулы R3OC(=S)X, где R3 - это арил и
X - это Cl
или Br, с образованием соединения формулы (III), где R1 - это (C1-C4)алканоил и R2 - это арилокситиокарбонил;
(в) взаимодействие
указанного
соединения формулы (III), где R1 - это (C1-C4)алканоил и R2 - это арилокситиокарбонил, в инертном растворителе при температуре от 150o
C до
200oC в течение от 2 до 48 часов с карбонатом кальция при непрерывной подаче инертного газа с образованием соединения формулы (IV), где R1 - это (C1-C4
)алканоил; и
(г) взаимодействие указанного соединения формулы (IV), где R1 - это (C1-C4)алканоил с алюмогидридом лития, цианоборгидридом натрия или
триэтилборгидридом лития в инертном растворителе с образованием соединения формулы (I).
В частности, предпочтительным способом в данном способе является тот, где инертный газ - это азот. Еще более предпочтительными способами в особо предпочтительном способе являются те, в которых используется особо предпочтительные соединения по данному изобретению.
Данное изобретение далее обеспечивает метод лечения млекопитающих от паразитических заболеваний, включающий введение указанным млекопитающим антипаразитически эффективного количества соединения формулы (II) или (IV).
Соединения по данному изобретению легко получают в соответствии со способом данного изобретения, который детально описан ниже.
Соединение формулы (I) в данном изобретении - это дорамектин, полезный антипаразитический и противоглистный агент, который описан в патенте США N 5089480, на который здесь имеются ссылки. Дорамектин по данному изобретению получают из соединения приведенной выше формулы (IV) взаимодействием указанного соединения формулы (IV) с алюмогидридом лития, цианоборгидридом натрия или триэтилборгидридом лития или омылением эфира в зависимости от природы расщепляемого эфира.
В случае, если R2 - это (C2-C5)алканоил, (C2-C5)алканоилоксигруппу превращают в гидроксигруппу путем взаимодействия указанного соединения формулы (IV) где R1 - это (C2-C5)алканоил, с алюмогидридом лития, цианоборгидридом натрия или триэтилборгидридом лития в инертном растворителе при температуре от -100oC до 0oC в течение от 15 минут до 24 часов. Применяют инертные растворители для данной реакции в зависимости от выбора восстанавливающего агента, выбирая, но не ограничиваясь, из таких растворителей, как диэтиловый эфир, диоксан, тетрагидрофуран, 2-метоксиметиловый эфир и 1,2-диметоксиэтан. Особо предпочтительным восстанавливающим агентом для данной реакции является триэтилборгидрид лития, а особенно хорошим растворителем является тетрагидрофуран. В общем случае, температура в ходе смешения реагента с субстратом и в течение небольшого времени после этого, обычно от 15 минут до 1 часа, поддерживается от -78oC до -70oC. Сразу после завершения смешения, обычно в течение от 15 минут до 1 часа, температуру медленно повышают до комнатной. Реакционную смесь гасят и продукт формулы (I) выделяют с использованием известных среднему специалисту в данной области стандартных способов.
В случае, если R1 - это арилоксиацетил, арилоксигруппу превращают в гидроксигруппу путем взаимодействия указанного соединения формулы (IV) где R1 - это арилоксиацетил, с гидроксидом щелочного металла в спирте при температуре от -75oC до 0oC в течение от 15 минут до 24 часов. Особо предпочтительным гидроксидом щелочного металла является гидроксид калия и особо предпочтительным растворителем является метанол. В общем случае, реакцию проводят при температуре -35oC в течение примерно 1 часа, после чего выделяют соединение формулы (I) с использованием известных среднему специалисту в данной области стандартных способов. Альтернативно, реакцию проводят, заменяя гидроксид щелочного металла аммиаком. В случае использования аммиака, реакцию в общем случае проводят при температуре от -35oC до 0oC в течение от 1 до 16 часов. Реакцию предпочтительно проводят в метаноле при -15oC в течение 5-6 часов. Продукт формулы (I) выделяют с использованием стандартных способов органической химии, хорошо известных среднему специалисту в данной области.
Соединение формулы (IV) по данному изобретению легко получают в соответствии со способом данного изобретения взаимодействием соединения формулы (III) по данному изобретению в высококипящем растворителе, таком как 2-метоксиэтиловый эфир или 2-этоксиэтиловый эфир, но не ограничиваясь ими, при температуре от 150oC до 200oC в течение от 2 до 48 часов. Для достижения максимального выхода в реакционную смесь непрерывно подают инертный газ, такой как азот или аргон. В частности, предпочтительно проводить реакцию до 156o-158oC в 2-метоксиэтиловом эфире с непрерывным пропусканием азота в течение 12 часов. По завершении реакции продукт формулы (IV) выделяют с использованием известных среднему специалисту в данной области стандартных способов.
Соединения формулы (III) по данному изобретению, где R2 - это арилокситиокарбонил, получают в соответствии со способом по данному изобретению путем взаимодействия соединения формулы (III) по данному изобретению, где R2 - это водород, с галогентиоформиатом формулы R3OC(=S)X, где R3 определен выше, в инертном растворителе с присутствии акцептора протона, такого как пиридин или 4-диметиламинопиридин, в течение от 30 минут до 12 часов. Подходящие инертные растворители для данной реакции включают этилацетат, 1,2-диметоксиэтан, 2-метоксиметиловый эфир, 2-метоксиэтиловый эфир, ароматические растворители, такие как толуол, ксилол и бензол, и хлорированные растворители, такие как хлороформ и метиленхлорид. Предпочтительными растворителями для данной реакции являются этилацетат или толуол. Предпочтительно проводить реакцию в течение от 2 до 4 часов. Реакционную смесь нагревают до температуры от 40oC до температуры кипения выбранного для данной реакции растворителя. Реакционную смесь гасят, и продукт формулы (III), где R2 - это арилокситиокарбонил, выделяют в соответствии со стандартными методами.
Соединения формулы (III) по данному изобретению, где R2 - это водород и R1 - это (C2-C5)алканоил или арилоксиацетил, легко получают в соответствии со способом данного изобретения. Соединение формулы (II) реагирует с ацилирующим агентом в инертном растворителе в присутствии акцептора протона, такого как пиридин, 4-диметиламинопиридин, пиперидин, пирролидин, триэтиламин, морфолин или ди(изо-пропил)этиламин, но не ограничиваясь ими, при температуре от -75oC до 0oC в течение от 5 минут до 8 часов. Подходящие инертные растворители для данной реакции включают ароматические растворители, такие как толуол, бензол или ксилол, или хлорированные растворители, такие как метиленхлорид, хлороформ или 1,2-дихлорэтан. Подходящими ацилирующими агентами являются как галогенангидриды кислот, обычно - хлорангидриды, так и ангидриды кислот. Если в качестве ацилирующего агента используется хлорангидрид кислоты, то особо предпочтительный органический амин - это пиридин. Если в качестве ацилирующего агента используется ангидрид кислоты, то особо предпочтительный органический амин - это триэтиламин. В общем случае, предпочтительными растворителями для данных реакций, в которых в качестве ацилирующего агента используются хлорангидрид или ангидрид кислоты, являются хлорированные растворители. В частности, предпочтительным является метиленхлорид. По завершении реакции реакционную смесь гасят и продукт формулы (III), где R2 - водород и R1 - это (C2-C5)алканоил или арилоксиацетил, выделяют с использованием стандартных методов органической химии.
Соединение формулы (II) может быть выделено через ферментацию штаммами Streptomyces avermitilis, производящими авермектин, такими как АТСС 31267, 31271 или 31272, как это описано в патенте США N 5089480, на который здесь делаются ссылки. Другие методы получения соединения формулы (II), включая выделение из ферментативного бульона Streptomyces avermitilis АТСС 53568, описаны Даттоном с сотрудниками (Dutton et al., Journal of Antibiotics, 44, 357-65 (I991).
Новые соединения (III)-(IV) по настоящему изобретению используются как интермедиаты в синтезе соединения формулы (I), дорамектина, из соединения формулы (II).
Новые соединения (III)-(IV) по настоящему изобретению используются также как антипаразитические агенты. Применимость указанных соединений (III)-(IV) как антипаразитических агентов продемонстрирована активностью указанных соединений в модельных опытах in vivo на грызунах, как описано Грейшеном с сотрудниками (Gration et al., Veterinary Parasitology, 42, 1992, 273-279.
Соединения формул (III) и (IV) являются высокоактивными антипаразитическими агентами, имеющими применение, в частности, как противоглистные средства, средства против эктопаразитов, инсектициды и акарициды (средства против клещей).
Соединения формул (III) и (IV) эффективны при лечении и профилактике и разнообразных случаях, вызванных эндопаразитами, включая, в частности, гельминтиаз, который чаще всего вызван группой паразитических червей, именуемых нематодами, и который может приводить к серьезным экономическим потерям в свиноводстве, овцеводстве, коневодстве и животноводстве вообще, равно как к поражению домашних животных и птицы. Дорамектин также эффективен против других нематод, которые поражают различные виды животных, включая, например, Dirofilaria у собак, и против различных паразитов, таких как Ancylostoma, Necator, Ascaris, Strongyloides, Trichinella, Capillaria, Trichuris, Enterobius и против других паразитов, найденных в крови или других тканях и органах, таких как нитевидные черви, и против Strongyloides и Trichinella на внекишечных стадиях.
Соединения формул (III) и (IV) также ценны при лечении и профилактике эктопаразитических инфекций, включая, в частности, артроподных эктопаразитов животных и птиц, таких как клещи, вши, блохи, мясные мухи, кусающие насекомые и мигрирующие личинки двукрылых, которые могут поражать домашний скот и лошадей.
Соединения формул (III) и (IV) также проявляют инсектицидную активность против паразитов жилищ, таких как тараканы, платяная моль, ковровый жук и домашняя муха, равно как против насекомых в зернохранилищах и на сельскохозяйственных растениях, таких как пауки, афиды, гусеницы, и против мигрирующих прямокрылых, таких как саранча.
Соединения формул (III) и (IV) вводятся в виде составов, в соответствии с их специфическим назначением, подвергаемым лечению от указанных паразитов или насекомых видам животных-"хозяев". При использовании в качестве противоглистного средства соединение может вводиться перорально в виде капсул, шариков, таблеток или предпочтительно в виде жидкого состава или, альтернативно, может вводиться в виде инъекции, вливания или в виде имплантанта. Такие составы готовят обычным образом в соответствии со стандартной практикой в ветеринарии. Так, капсулы, шарики или таблетки готовят смешением активного ингредиента с подходящим тонкоизмельченным разбавителем или носителем, дополнительно содержащим размельченный агент и/или связующее, такое как крахмал, лактоза, тальк, стеарат магния и т.п. Жидкий состав готовят диспергированием активного ингредиента в водном растворе совместно с диспергаторами или смачивателями и т.п., а состав для инъекций готовят в форме стерильного раствора, который может содержать другие вещества, например достаточные количества солей или глюкозы, для придания раствору свойства изотоничности с кровью. Эти составы могут отличаться в отношении веса активного соединения в зависимости от вида животного-"хозяина", подвергаемого лечению, тяжести и типа инфекции и веса тела "хозяина". В общем случае для перорального введения или инъекции доза примерно от 0,001 до 10 мг/кг веса тела животного как разовая доза или в виде раздельных доз в течение от 1 до 5 дней является достаточной, но могут быть обстоятельства, при которых показаны более высокие или низкие дозы, и таковые входят в рамки данного изобретения. Для перорального введения или инъекции наиболее предпочтительна доза от 0,02 до 2 мг/кг веса тела животного как разовая доза или в виде раздельных доз в течение от 1 до 5 дней.
Альтернативно, соединения могут вводиться с кормом для животных; для этой цели готовят концентрированную кормовую добавку или примесь для смешения с обычным кормом для животных.
Для использования в качестве инсектицида и обработки сельскохозяйственных растений соединения применяют в виде аэрозолей, порошков, эмульсий и им подобных в соответствии со стандартной практикой в сельском хозяйстве.
Использованный выше и в прилагаемой формуле изобретения термин "инертный растворитель" относится к любому растворителю, который не реагирует с исходными материалами, реагентами, интермедиатами или продуктами любым образом, отрицательно влияющим на выход целевого продукта. Термин "инертный газ" относится к любому газу, который не реагирует с исходными материалами, реагентами, интермедиатами или продуктами любым образом, отрицательно влияющим на выход целевого продукта.
Использованный выше и в прилагаемой формуле изобретения термин "арил" означает фенил или фенил, произвольно замещенный одной, двумя или тремя (C1-C4)алкоксильными группами или атомами галогена.
Использованный выше и в прилагаемой формуле изобретения термин "арилокси" означает фенилокси- или фенилоксигруппу, произвольно замещенную одной, двумя или тремя (C1-C4)алкильными, (C1-C4)алкоксильными группами или атомами галогена.
Настоящее изобретение проиллюстрировано следующими примерами. Однако следует понимать, что изобретение не ограничивается специфическими деталями этих примеров.
Пример 1. Соединение формулы (III), где R1 - это фенилоксиацетил и R2
- это водород
Раствор 20 г
соединения формулы (II) в 400 мл метиленхлорида и 10 мл безводного пиридина охлаждают при пропускании азота до -78oC, и в течение 10 минут по каплям
прибавляют 15,1 мл феноксиацетилхлорида.
Реакционную смесь выдерживают при температуре от -70oC до -78oC в течение 1,5 часов, затем гасят 250 мл насыщенного раствора бикарбоната
натрия. Смесь перемешивают 1,5 часа,
органический слой отделяют, повторно экстрагируют 250 мл насыщенного раствора бикарбоната натрия и осушают над безводным MgSO4. Растворитель удаляют в
вакууме, получают 25,7 г 97%-го
продукта, указанного в заголовке, в виде белого твердого вещества (выход 96%). Время удержания 7,9 минут (ВЭЖХ, Ultrasphere ODS 5μ, 25 см х 4,6 мм (Beckman);
метанол:ацетонитрил: вода
559:383:58; 1,5 мл/мин; УФ 245 нм).
Пример 2. Соединение формулы (III), где R1 - это фенилоксиацетил и R2 - это
п-толилокситиокарбонил
Раствор 10 г
соединения, указанного в заголовке примера 1, в 100 мл толуола и 30 мл безводного пиридина нагревают при пропускании азота до 100oC и в течение
5 минут прибавляют 7,7 мл
О-п-толилхлортионоформиата. Реакционную смесь выдерживают при 100±5oC в течение 2 часов до завершения реакции, охлаждают примерно до 50oC и
растворители удаляют в вакууме
с образованием коричневого осадка. Осадок растворяют в 120 мл толуола, раствор экстрагируют 120 мл воды и дважды - 100 мл насыщенного раствора бикарбоната натрия.
Отделяют органический слой, упаривают
до 80 мл, фильтруют и хроматографируют, используя систему Prep-500 (Waters Associates). Элюент имеет состав гексаны: этилацетат 75: 25. Фракции, содержащие
продукт, объединяют, растворитель удаляют в
вакууме, получают 9,8 г 95,7%-го продукта в виде желтовато-коричневого твердого вещества (выход 83,2%). Время удерживания 15,2 минут (ВЭЖХ, Ultrasphere ODS
5μ, 25 см х 4,6 мм (Beckman);
метанол:ацетонитрил:вода 559:383:58; 1,5 мл/мин; УФ 245 нм).
Пример 3. 5,4''-О-дифеноксиацетилдорамектин (соединение формулы (IV), где R1 - это феноксиацетил)
К
раствору 8,5 г соединения, указанного в заголовке примера 2, в 90 мл 2-метоксиэтилового эфира добавляют 4,5 г карбоната кальция. Затем смесь нагревают при
хорошем перемешивании и непрерывном
пропускании тока азота до 156o-158oC. После выдерживания при 156o-158oC в течение 24 часов анализ смеси показывает
наличие 6,68 г продукта (выход 90%).
После фильтрации смеси растворитель удаляют в вакууме; получают продукт в виде желтой смолы. Время удерживания 10,4 минуты (ВЭЖХ, Ultrasphere ODS 5μ, 25 см
х 4,6 мм (Beckman);
метанол:ацетонитрил:вода 559:383:58; 1,5 мл/мин; УФ 245 нм).
Пример 4. 5,4''-О-дифеноксиацетил-дорамектин (соединение формулы (IV), где R1 - это
феноксиацетил)
К
раствору 1 г соединения, указанного в заголовке примера 2, в 20 мл 2-этоксиэтилового эфира добавляют 500 мг карбоната кальция. Затем смесь нагревают при хорошем
перемешивании и непрерывном пропускании
тока азота до 185oC. После выдерживания при 185oC в течение 5 часов реакционную смесь охлаждают до комнатной температуры и фильтруют.
Анализ раствора с помощью ВЭЖХ (Ultrasphere
ODS 5μ, 25 см х 4,6 мм (Beckman); метанол:ацетонитрил:вода 559: 383: 58; 1,5 мл/мин; УФ 245 нм) показывает наличие 796 мг продукта (выход 91%).
Пример 5. Дорамектин (соединение
формулы (I))
Раствор 500 мг соединения, указанного в заголовке примера 3, в 1 мл 2-метоксиэтилового эфира и 3,5 мл метанола охлаждают до -35oC и в течение 1 минуты по каплям
прибавляют 2,1 мл 2 М раствора KOH в метаноле. Реакционную смесь, хорошо перемешивая, выдерживают при -35oC в течение 1 часа до завершения реакции,
затем добавляют 252 мг ледяной уксусной
кислоты, растворенной в 0,5 мл метанола. Прекращают охлаждение и в течение 1 час по каплям прибавляют 2,2 мл воды для инициирования кристаллизации. После
перемешивания при комнатной температуре в
течение 1 часа кристаллы отфильтровывают, промывают двумя порциями по 0,5 мл смеси метанол:вода 7:3 и высушивают в вакуумной печи. После перекристаллизации
из водного метанола получают 272 мг 93,8-го
продукта (выход 70,6%). Время удержания 6,5 минуты (ВЭЖХ, Ultrasphere ODS 5μ, , 25 см х 4,6 мм (Beckman); метанол:ацетонитрил:вода 860:51:89; 1,5
мл/мин; УФ 245 нм).
Пример 6.
Дорамектин (соединение формулы (I))
К раствору 6,6 г соединения, указанного в заголовке примера 3, в 75 мл метанола, охлажденного до -15oC, прибавляют 75 мл насыщенного раствора
аммиака в метаноле. Смесь выдерживают при -15oC в течение 5,5 часов до завершения реакции, затем продувают азотом в течение 30 минут.
Летучие примеси удаляют в вакууме, полученное
желтоватое масло растворяют в 45 мл метанола и раствор очищают фильтрацией. К раствору по каплям прибавляют 5 мл воды для инициирования кристаллизации.
Смесь перемешивают при комнатной температуре в
течение 2 часов, после чего в течение 2,5 часов прибавляют 6,3 мл воды. После дальнейшего перемешивания в течение 1,5 часов твердую фазу отфильтровывают
и промывают двумя порциями по 2,5 мл смеси
метанол:вода (7:3). После высушивания в вакуумной печи при комнатной температуре в течение 24 часов получают 3,75 г 87,7%-го продукта (выход 64%).
Пример 7. Соединение формулы (III),
где R1 - это ацетил и R2 - это водород
К раствору 20 г соединения формулы (II) в 200 мл метиленхлорида при пропускании
азота прибавляют 28,6 г триэтиламина и 1,06 г
4-диметиламинопиридина. Реакционную смесь охлаждают до -5oC...0oC и по каплям в течение 5 минут добавляют 14,5 г уксусного
ангидрида. Смесь выдерживают 20 минут при 0o
C до завершения реакции, затем гасят при 0oC 200 мл насыщенного раствора бикарбоната натрия. Органический слой повторно экстрагируют
дважды насыщенным раствором бикарбоната натрия и осушают
(MgSO4). Растворитель удаляют под вакуумом; получают 22,2 г 95%-го продукта в виде белого твердого вещества (выход 96,7%). (ВЭЖХ,
Ultrasphere ODS 5μ, , 25 см х 4,6 мм (Beckman);
метанол:ацетонитрил:вода 902:36:62; 1,0 мл/мин; УФ 245 нм).
Пример 8. Соединение формулы (III), где R1 - это ацетил и
R2 - это водород
К суспензии 5 г
соединения формулы (II) в 100 мл толуола при пропускании азота прибавляют 7,24 г триэтиламина и 266 мг 4-диметиламинопиридина. Смесь охлаждают до
-15oC и по каплям в течение 5 минут
добавляют 3,58 г уксусного ангидрида. Смесь
перемешивают 30 минут при -10oC...-15oC до завершения реакции, гасят 50 мл
насыщенного раствора бикарбоната натрия и перемешивают 1
час при комнатной температуре. Органический слой повторно экстрагируют дважды по 50 мл насыщенного раствора бикарбоната натрия и осушают
частичной отгонкой растворителя, используя насадку Дина-Старка.
Раствор анализируют методом ВЭЖХ (Ultrasphere ODS 5μ, 25 см х 4,6 мм (Beckman); метанол:ацетонитрил: вода 902:36:62; 1,0 мл/мин;
УФ 245 нм), он содержит 5,27 г продукта (выход 96,5%).
Пример 9. Соединение формулы (III), где R1 - это ацетил и R2 - это водород
К раствору 20 г
соединения, указанного в заголовке примера 7, в 200 мл этилацетата
при пропускании азота прибавляют 60 мл безводного пиридина, затем добавляют 22,2 г О-п-толилхлортионоформиата, после чего выпадает
желтый осадок. Смесь нагревают до температуры кипения и выдерживают 2
часа при хорошем размешивании до завершения реакции и охлаждают до комнатной температуры. Летучие примеси удаляют в вакууме,
осадок распределяют между 150 мл этилацетата и 150 мл воды, органический
слой экстрагируют дважды насыщенным раствором бикарбоната натрия и однократно - водой. Слой этилацетата осушают (MgSO4), растворитель удаляют под вакуумом. Осадок растворяют в 25 мл
этилацетата и 5 мл метиленхлорида, раствор очищают фильтрацией и хроматографируют, используя систему Prep-500 (Waters
Associates), оснащенную двумя картриджами с силикагелем. Элюент имеет состав
гексаны:этилацетат:метиленхлорид 70: 25: 5. Фракции, содержащие продукт, объединяют, растворитель удаляют в вакууме;
получают 19 г продукта в виде желтоватого твердого вещества (выход 82,6%). Время
удерживания 17,1 минуты. (ВЭЖХ, Ultrasphere ODS 5μ, 25 см х 4,6 мм (Beckman); метанол: ацетонитрил:вода
902:36:62; 1,0 мл/мин; УФ 245 нм).
Пример 10. 5,4''-О-диацетил-дорамектин
(соединение формулы (IV), где R1 - это ацетил)
Суспензию 9,5 г карбоната кальция
нагревают до 156o-158oC при непрерывном пропускании тока азота. Затем к этой
смеси добавляют 18,7 г соединения, указанного в заголовке примера 9; нагревание, перемешивание и
пропускание азота продолжают 25 часов. После охлаждения до 50oC смесь фильтруют и
растворитель удаляют в вакууме. Осадок растворяют в 50 мл метиленхлорида, добавляют 25 мл этилацетата и 70
мл гексанов, раствор фильтруют и хроматографируют, используя систему Prep-500 (Water
Associates), оснащенную двумя картриджами с силикагелем. Элюент имеет состав гексаны:этилацетат:метиленхлорид
70:25:5. Фракции, содержащие продукт, объединяют, растворитель удаляют в вакууме; получают
13,7 г 87%-го продукта в виде желтого твердого вещества (выход 74,8%). Время удерживания 11,1 минуты. (ВЭЖХ,
Ultrasphere ODS 5μ, 25 см х 4,6 мм (Beckman); метанол:ацетонитрил:вода 902:36:62; 1,
0 мл/мин; УФ 245 нм).
Пример 11. 5,4''-О-диацетил-дорамектин (соединение формулы (IV), где
R1 - это ацетил)
К раствору 504 мг соединения, указанного в заголовке
примера 9, в 25 мл 2-этоксиэтилового эфира добавляют 250 мг карбоната кальция. Смесь нагревают при хорошем
перемешивании и непрерывном пропускании тока азота до 183o-185oC. После
выдерживания при 183o-185oC в течение 1,5 часов анализ смеси показывает наличие 364,
4 мг (выход 84,7%).
Пример 12. Дорамектин (соединение формулы (I))
К
раствору 7,3 г соединения, указанного в заголовке примера 10, в 145 мл безводного тетрагидрофурана при
пропускании азота охлаждают до -72oC, прибавляют 59,5 мл 0,1 М раствора
триэтилборгидрида лития в тетрагидрофуране. Реакционную смеси перемешивают при -72oC...-70oC в
течение 1 часа и медленно нагревают до комнатной температуры до завершения реакции.
Затем смесь гасят 75 мл воды и 75 мл метиленхлорида и перемешивают 1 час. Слои разделяют, водный слой экстрагируют
75 мл метиленхлорида; объединенные органические слои промывают насыщенным раствором
бикарбоната натрия дважды по 75 мл. Растворители удаляют в вакууме, осадок растворяют в 54 мл метанола и раствор
очищают фильтрацией. К раствору по каплям в течение 20 минут прибавляют 6,9 мл воды
инициирования кристаллизации. Смесь перемешивают при комнатной температуре в течение 15 минут, после чего в течение
30 минут по каплям прибавляют 6,2 мл воды. Смесь перемешивают в течение 18 часов,
твердую фазу отделяют фильтрацией, промывают в вакуумной печи, получают 4,27 г 89,5%-го продукта (выход 57,3%).
Пример 13. Влияние пропускания азота на реакцию термического
отщепления
К раствору 5,3 г соединения, указанного в заголовке примера 2, в 55 мл 2-метоксиэтилового эфира добавляют 2,
5 г карбоната кальция. Смесь нагревают до 157oC при хорошем
перемешивании и непрерывном пропускании тока азота через газораспределительную трубку. После выдерживания при 154o
-157oC в течение 30 часов смесь охлаждают до комнатной
температуры, фильтруют и анализируют с помощью ВЭЖХ Ultrasphere ODS 5μ, 25 см х 4,6 мм (Beckman); метанол: ацетонитрил:вода
559:383:58; 1,5 мл/мин; УФ 245 нм). Анализ показывает наличие 3,93 г
5,4''-О-дифеноксиацетил-дорамектина (выход 84,3%).
Этот опыт повторили при одинаковых условиях, включая одинаковую загрузку соединения, указанного в заголовке примера 2, но без пропускания азота. Выход продукта в этом случае составил 47,5%, показывая положительное действие пропускания азота.
Биологическая активность
Применение соединений в качестве
противоглистных средств продемонстрирована активностью этих соединений на модели in vivo против нематод грызунов, описанной Грэшэном
и др. в литературе Veterinary Parasitology, 1992, 42, 273-279.
Анализ показывает процент очистки от нематод Trichostrongylus colubriformis у крыс, зараженных этими паразитами.
Противоглистная эффективность против T.colubriformis у крыс после
пероральных доз в 1 мг/кг
Соединение - Очистка от червей по сравнению с результатом, достигнутым от лекарственного приема
Пример 7 - 100
Пример 9 - 75
Пример 10
- 62а
Реферат
Производные дорамектина формулы III, где R1 - (C2 - C5) алканоил или феноксиацетил, необязательно замещенный 1 - 3 ( C1 - C4) алкилом, ( C1 - C4) алкокси или галоидом; P2 - водород или фенокситиакарбонил, необязательно замещенный 1 - 3 ( C1 - C4) алкилом, ( C1 - C4) алкокси или галоидом. Дорамектин и интермедиаты, полученные способом по данному изобретению, также могут применяться в качестве антипаразитических агентов. 7 с. и 16 з.п.ф-лы.

Формула
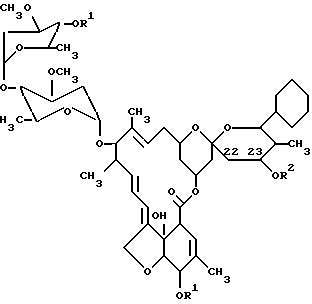
где R1 - (C2-C5)-алканоил или феноксиацетил, необязательно замещенный 1-3 (C1-C4)-алкилом, (C1 -C4)-алкокси или галоидом;
R2 - водород или фенокситиокарбонил, необязательно замещенный 1-3 (C1-C4)-алкилом, (C1-C4)-алкокси или галоидом.

где R1 - (C2-C5)-алканоил или феноксиацетил, необязательно замещенный одним - тремя (C1-C4)-алкилом, (C1-C4)-алкокси или галоидом.

отличающийся тем, что включает следующие последовательные стадии:
(а) взаимодействие соединения формулы II

с ацилирующим агентом общей формулы (R4CO)2O или R4COX, где R4 - феноксиметил, необязательно замещенный одним-тремя (C1-C4)-алкилом, (C1-C4)-алкокси или галоидом и X-Cl или Br, с образованием соединения общей формулы III

где R1 - феноксиацетил, необязательно замещенный одним-тремя (C1 -C4)-алкилом, (C1-C4)-алкокси или галоидом;
R2 - водород;
б) взаимодействие указанного соединения формулы III, где R1 определен выше и R2 - H, с соединением формулы R3OC (=S)X, где R3 - фенил, необязательно замещенный 1-3 (C1-C4)-алкилом, (C1-C4 )-алкокси или галоидом и X-Cl или Br, с образованием соединения формулы III, где R1 определен выше и R2 фенокситиокарбонил, необязательно замещенный одним-тремя (C1 -C4)-алкилом, (C1-C4)-алкокси или галоидом;
в) взаимодействие указанного соединения формулы III, где R1 и R2 определены выше, в инертном растворителе при температуре 150 - 200oC в течение 2 - 48 ч с карбонатом кальция при непрерывной подаче инертного газа с образованием соединения общей формулы

где R1 определен выше и
г) взаимодействие указанного соединения формулы IV, где R1 определен выше, с основанием в спирте с образованием соединения формулы I.

отличающийся тем, что включает следующие последовательные стадии:
а) взаимодействие соединения формулы II

с ацилирующим агентом формулы (R4CO)2O или R4COX, где R4 определен выше, X - Cl или Br, с образованием соединения общей формулы III

где R1 определен выше;
R2 - водород;
б) взаимодействие указанного соединения формулы III, где R1 - (C1-C4)-алканоил и R2 -H, с соединением формулы R3OC (=S)X, где R3 определен выше и X-Cl или Br, с образованием соединения формулы III, где R1 - (C1-C4 )-алканоил и R2 - фенокситиокарбонил, необязательно замещенный 1-3 (C1-C4 )-алкилом, (C1-C4)-алкокси или галоидом.

где R1 - (C1-C4)-алканоил;
г) взаимодействие указанного соединения формулы IV, где R1 - (C1 -C4)-алканоил, с алюмогидридом лития, цианоборгидридом натрия или триэтилборгидридом лития в инертном растворителе с образованием соединения формулы I.

где R1 определен в п. 1, отличающийся тем, что включает взаимодействие соединения формулы III

где R1 определен выше и R2 - фенокситиокарбонил, необязательно замещенный одним - тремя (C1-C4)-алкилом, (C1-C4)-алкокси или галоидом в инертном растворителе при температуре 150 - 200oC в течение примерно 2 ч с карбонатом кальция при непрерывной подаче инертного газа.

Комментарии