Производные (2-имидазолин-2-ил)-тиено или фуро(3,2-в) пиридин карбоновой кислоты, гербицидная композиция, ингредиенты для их получения - RU2058313C1
Код документа: RU2058313C1
Чертежи















Описание
Изобретение относится к новым
(2-имидазолин-2-ил)тиено- фуропиридиновым соединениям,
интермедиатам, используемым для получения указанных соединений, и способу борьбы с помощью этих соединений с нежелательными однолетними и
многолетними растениями, а именно к
6-(2-имидазолин-2-ил)тиено- и фуро[2,3-b] и 5-(2-имидазолин-2-ил)тиено- и фуро[3,2-b]пиридиновым соединениям и соответствующим 2,3-дигидротиено и 2,
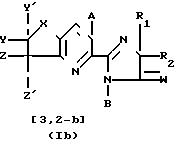
3-дигидрофуросоединениям со структурными формулами
(Ia) и (Ib):

где


-




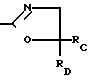
Предпочтительная группа 6-(2-имидазолин-2-ил)тиено- и фуро[2,3-b]пиридиновых и 5-(2-имидазолин-2-ил)тиено- и фуро[3,2-b]пиридиновых соединений имеет формулу, обозначенную как (Ia) и (Ib), где R1 представляет собой метил; R2 представляет собой метил, этил, пропил, изопропил, или взятые весте образуют циклогексильное или метилциклогексильное кольцо; W представляет собой кислород или серу; В представляет собой водород; А представляет собой COOR3, где R3 имеет вышеопределенные значения; Y и Z представляют собой водород, С1-С3 алкил, С1-С3 алкокси, алкилтио, гало, нитро, циано, трифторметил, монофторметил, дифторметил, монофторметокси, дифторметокси, трифторметокси, метилсульфонил, метил- сульфонамидо, метиламино, диметиламино или изопропиламино, когда Y и Z вместе, они образуют группу-(СН2)3, -(СН2)4 или -СН=СН-СН=СН-.
Наиболее предпочтительными (2-имидазолин-2-ил) тиено и фуросоединениями формул (Ia) и (Ib) являются такие соединения, у которых В представляет собой водород, Y и Z представляют собой водород, хлоро, метил или метокси, при условии, что один из радикалов Y или Z представляет собой водород; W представляет собой кислород; А представляет собой COOR3, где R3 представляет собой водород, фурфурил, пропинил, С3 -галоалкенил, Na+ или изопропиниламмоний, и R1 и R2 имеют значения, определенные выше для предпочтительных соединений.
Следует понимать, что, когда В представляет собой водород,
имидазолинилтиено-, фуро[2,3-b] и [3,2-b]пиридины формул (Ia) и (Ib) могут существовать в виде таутомеров. Хотя для удобства их обозначают
едиными структурными формулами (Ia) и (Ib), они могут
существовать в любой из проиллюстрированных ниже таутомерных форм:


Подразумевается, что обе таутомерные формы описываются формулами (Ia) и (Ib).
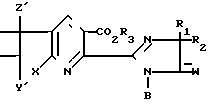
Изобретение также относится к новым
замещенным тиено- и фуроимидазопирролопиридиндионовым соединениям формул (IIa) и (IIb) и способу борьбы с помощью этих соединений с
нежелательными однолетними и многолетними растениями на посевах сои
культурной и некоторых зерновых культур:


где Х, Y, Y', Z, Z', W, R1 и R2 имеют указанные для формул (Ia) и (Ib) значения и где X, Y, Z, W, R1 и R2 в предпочтительных и наиболее предпочтительных соединениях формул (IIa) и (IIb) имеют значения, определенные для предпочтительных и наиболее предпочтительных соединений формул (Ia) и (Ib).
Являющиеся гербицидами замещенные пиридиновые и хинолин-2-имидазолин-2-иловые кислоты, сложные эфиры и соли известны. Изобретение относится к новым тиено- и фуро[2,3-b]пиридинам и тиено- и фуро[3,2-b]пиридинам, которые будучи замещены в 6 или 5 положение имидазолиновым кольцом и в 5 или 6 положение группой А, как описано выше, дают сильные гербициды. Тот факт, что имидазолинил тиено- и -фуропиридины дают сильные гербициды, является неожиданным, так как в литературе нет указаний на то, что такие [2,3-b] или [3,2-b] циклические системы можно использовать для каких-то агрономических целей или в качестве гербицидов. Этот новый класс гербицидов очень эффективен при до- и послевсходовой обработке, и отдельные представители этого класса соединений демонстрируют необычную селективность на посевах сои культурной и зерновых культур, таких как пшеница, овес, рис, рожь и ячмень. Кроме того, было обнаружено, что селективность на зерновых культурах можно усилить, когда А представляет собой СО2Н, путем получения сложных эфиров, в частности фурфурилового, алкинилового и галоалкенилового эфиров.
Кроме того, некоторые соединения этого класса проявляют неожиданное рострегулирующее воздействие на растения, снижают высоту его, усиливают кустистость и противодействуют полеганию зерновых культур.
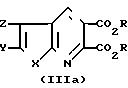
Соединения изобретения можно
удобно получить из соответствующим образом замещенных тиено- и фуро[2,3-b] и [3,2-b]пиридиндикарбоновых кислот и сложных эфиров формулы (IIIa) и
(IIIb):
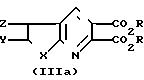

где Х, Y и Z имеют определенные значения и R представляет собой метил или этил.
Способы получения новых ненасыщенных соединений формул (Ia) и (Ib), в которых

Так сложные эфиры двухосновных кислот формул (IIIa) и (IIIb) можно подвергнуть гидролизу до соответствующих теино- и фуро-2,3-пиридиндикарбоновых кислот формул (IVa) и (IVb), осуществив реакцию с сильным основанием, таким как гидроокись калия или гидроокись натрия. Ангидриды кислоты формул (Va) и (Vb) можно затем получить путем обработки пиридинкарбоновых кислот формул (IVa) и (IVb), например, уксусным ангидридом. В результате реакции ангидридов формул (Va) и (Vb) с соответствующим образом замещенным аминокарбоксамидом или аминотиокарбоксамидом формулы (VI) получают карбамоилникотиновые кислоты формул (VIIa) и (VIIb). В результате обработки полученных таким образом карбамоилникиотиновых кислот водным или водно-спиртовым раствором гидроокиси натрия или калия в количестве 2-10 эквивалентов предпочтительно под слоем инертного газа, такого как азот, охлаждения и подкисления до значения рН 2-4 сильной минеральной кислотой, такой как соляная или серная, получают гербицидно эффективные 6-(4,4-дизамещенные-5-оксо- (или тиоксо)-2-имидазолин-2-ил)тиено- и фуро[2,3-b]пиридин-5-карбоновые кислоты и 5-(4,4-дизамещенная-5-оксо-(или тиоксо)-2-имидазолин-2-ил)тиено- и фуро[3,2-b]пиридин-6-карбоновые кислоты, которые охватываются формулами (Ia) и (Ib).
5- или 6-(2-имидазолин-2-ил)тиено- и фуропиридиновые сложные эфиры формул (Ia) и (Ib), где А представляет собой COOR3 и R3 является заместителем, отличным от водорода и сольобразующего катиона, а R1, R2, X, Y и Z имеют определенные значения, можно получить путем осуществления взаимодействия нового тиено- или фуроимидазопирролопиридиндиона формул (IIa) и (IIb) (представлено ниже на технологической схеме II) с подходящим спиртом и соответствующим алкоголятом щелочного металла при температуре от 20 до 50оС.
Новые тиено- и фуроимидазопирролопиридиндионы формул (IIa) и (IIb) можно получить из кислот формул (Ia) и (Ib), где В представляет собой водород, путем обработки одним эквивалентном дициклогексилкарбодиимида в инертном растворителе, таком как хлористый метилен, что проиллюстрировано на технологической схеме II.
Технологическая схема I




Технологическая схема II


где М1 щелочный металл и X, Y, Z, R1, R2 и R3 имеют определенные значения.
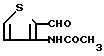
Многие тиено [2,3-b] пиридиндикарбоновые кислоты формулы (IIIa) и тиено [3,2-b] пиридиндикарбоновые кислоты формулы (IIIb) можно удобно получить путем реакции соответствующим образом замещенного 2- или 3-аминотиофена формулы (VIIIa) или (VIIIb), где R представляет собой водород или хлоро-, с С1-С4 алкиловым эфиром (сложным) ацетилендикарбоновой кислоты формулы (IX), как описано Bleckert et al. Chem. Ber. 1978,

Cl-CH N⊕-(R′′′)2Cl⊖ где R''' представляет собой С1-С6 алкил или Cl-CH

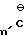
Фуро [3,2-b] пиридиндикарбоновые кислоты формулы (IIIb) можно получить путем реакции 3-амино-2-формилфурана формулы (XI), полученного по способу S. Gronowitz et al. Acta Chemica Scanol В29 224 (1975), с этилоксалацетатом, в результате чего сразу получают фуропиридиновые соединения формулы (IIIb), как показано на технологической схеме IV, в то время как фуро[2,3-b]пиридиновые соединения, где Y и Z представляют собой водород, получают путем бромирования продукта реакции (XII) ацетоацетамида со сложным диэтиловым эфиром этоксиметиленоксалуксусной кислоты с последующей обработкой борогидридом натрия и паратолуолсульфокислотой в нагретом до температуры дефлегмации ксилоле, как показано на технологической схеме V.
2,3-дигидрофуро [3,2-b] и тиено [3,2-b] пиридины формулы (Vb) можно получить в результате реакции диэтилэтоксиметиленоксалацетата со смесью энаминов, полученных из 3-кетотетрагидрофурана или 3-кетотетрагидротиофена с последующей обработкой аммиаком или аммонием, как показано на технологической схеме VI.
Технологическая схема III

Технологическая схема IV

Технологическая схема V
CH

Технологическая схема VI


где каждый из R1 и R2 представляет собой С1-С6 алкил, или взятые вместе с атомом азота, с которым они связаны, образуют 5- или 6-членное насыщенное гетероциклическое кольцо, необязательно содержащее максимум 2 гетероатома.
Фуро [2,3-b] пиридиновые соединения формулы (IIIa), где Z представляет собой водород и Y представляет собой алкил или необязательно замешенный фенил, получают в результате реакции ацетиленового соединения с иодопиридиновым эфиром двухосновной кислоты (VII) (получение соединения формулы VII описано J.Prakt.Chem. 148, 72 (1937), в присутствии медных солей, аминового основания и палладиевого катализатора (II), как показано на технологической схеме VII.
Технологическая схема VII
Y__C≡CH

Заместители, представленные буквами Y и Z в соединениях формул (Ia), (Ib), (IIa) и (IIb) изобретения, можно получить, либо используя соответствующим образом замещенные исходные соединения, взятые для получения сложных эфиров тиено- и фуропиридин-5,6-дикарбоновой кислоты формул (IIIa) или (IIIb), либо путем электрофильного замещения (галоидирование, нитрование, сульфирование и т.д.) сложных эфиров двухосновных кислот формул (IIIa) или (IIIb) или целевых продуктов формул (Ia) или (Ib), где, по меньшей мере, один из радикалов Y или Z представляет собой водород. Эти замещенные соединения формул (IIIa), (IIIb), (Ia) и (Ib) затем можно использовать в качестве исходных материалов для последующего замещения Y и Z путем замены, восстановления, окисления и т.д. Репрезентативные замещенные соединения формул (IIIa) и (IIIb), которые можно получить таким образом, представлены ниже.






O H OC6H5 CH3 O CF3 H CH3 O H NO2 C2H5 O Br Br C2H5 O H C6H5S C2H5 O H CF3 C2H5
Кроме того, новые гербицидно активные 2,3-дигидротиено[2,3-b] и [3,2-b] пиридиновые соединения можно получить по технологической схеме III, исходя из дигидротиофенимин гидрохлорида. Новые гербицидно активные 2, 3-дигидрофуро [2,3-b] и [3,2-b] пиридины можно получить путем каталитического восстановления 2-имидазолин-2-ила формулы (Ia) или (Ib) или фуро [2,3-b] и [3, 2-b] пиридин-5,6-эфиром двухосновных кислот формулы (IIIa) и (IIIb), например, водородом в присутствии палладиевого на подложке из активированного угля катализатора, при условии, что Y и Z представляют собой заместители, которые не были восстановлены с помощью такой процедуры. Другие 2,3-дигидрофуро[2,3-b] пиридины получены путем восстановления бромкетонов борогидридом натрия с последующей обработкой триэтиламином и п-толуолсульфокислотой, как показано на технологической схеме VIII. В результате получают новые гербицидно активные 2,3-дигидросоединения, показанные ниже.

где X, Y, Y', Z, Z', W, B, R1 и R3 имеют значе- ния, указанные для (Ia) и (Ib).
Технологическая схема (VIII)




6-(2-имидазолин-2-ил)тиено- и фуро[2,3-b]пиридины и 5-(2-имидазолин-2-ил)тиено- и фуро[3,2-b] пиридины формул (Ia) и (Ib) и имидазопирролопиридиндионы формул (IIa) и (IIb) изобретения представляют собой очень эффективные гербицидные препараты, пригодные для борьбы с исключительно большим разнообразием травянистых сорных однолетних и многолетних однодольных и двудольных растений. Более того, эти соединения являются гербицидно активными для борьбы с сорняками, произрастающими как в сухих, так и во влажных районах. Они также полезны для борьбы с растениями, произрастающими в воде, и проявляют уникальную активность в подавлении указанных растений при обработке их листьев или почвы, или воды, в которых находятся семена этих растений или их органы размножения, такие как клубни, корневища или столоны, причем доза соединения составляет 0, 016-4,0 кг/га, предпочтительно 0,032-2,0 кг/га. Для эффективной борьбы с нежелательной растительностью можно применять указанные соединения и в дозе выше 4,0 кг/га, однако использование токсиканта в дозе, превышающей необходимую для уничтожения сорняков, нежелательно, так как это приводит к лишним затратам и не оказывает положительного действия на окружающую среду.
С помощью
предлагаемых соединений можно уничтожать следующие растения:
Elatine triandra, Sagittaria pygmaea, Scirpus hotarui, Cyperus serotinus, Eclipta alba, Cyperus difformis, Rotala indica,
Lindernia pyridoria, Echinochloa crus-galli, Digitaria sanguinalis, Setaria viridis, Cyperus rotundus, Convolvulus arvensis, Agropyron repens, Datura stramonium, Alopercurus myosuroides, Ipomoea spp.
Siola spinosa, Ambrosia artemisiifolia, Eichhornia crassipes, Xanthium pensylvanicum, Sesbania exaltata, Avena fatua, Abutilon theophrasti, Bromus tectorum, Sorghum halepense, Lolium spp. Panicum
dichotomiflorum, Matricaria spp. Amaranthus retroflexus, Cirsium arvense and Rumex iaponicus.
Было обнаружено, что (2-имидазолин-2-ил)тиено- и фуропиридины формул (Ia) и (Ib) представляют собой селективные гербициды, особенно эффективные для борьбы с нежелательной растительностью на посевах бобовых растений, таких как соя культурная, и зерновых культур, таких как пшеница, ячмень, овес и рожь. Однако одни из соединений формул (Ia) и (Ib) менее селективны по сравнению с другими на этих культурах.
Было также обнаружено, что некоторые (2-имидазолин-2-ил)пиридины формул (Ia) и (Ib) являются эффективными соединениями для борьбы с полеганием зерновых культур при дозе внесения 0,016-4,0 кг/га. Было также обнаружено, что при использовании в дозе не выше 0,010 кг/га некоторые тиено- и фуропиридины формул (Ia) и (Ib) эффективны для усиления кустистости зерновых культур и образования дополнительных ветвей у бобовых растений.
Поскольку имидазолинилтиено- и фуропиридины формул (Ia) и (Ib) и их производные, в которых R3 представляет собой солеобразующий катион, растворимы в воде, то эти соединения можно легко диспергировать в воде и наносить как разведенный водный спрей на листья растений или на почву, в которой находятся их органы размножения. Эти соли можно также приготовить в виде текучих концентратов.
(2-имидазолин-2-ил)тиено- и фуропиридины формул (Ia) и (Ib) и имидазопирролопиридиндионы формул (IIa) и (IIb) можно также приготовить в виде смачивающихся порошков, текучих концентратов, эмульгирующихся концентратов, гранул и т.п.
Смачивающиеся порошки можно получить путем совместного помола 20-45 мас. тонко измельченного носителя, такого как каолин, бентонит, диатомовая земля, аттапульгит или им подобного, 45-80 мас. активного соединения, 2-5 мас. диспергирующего вещества, такого как лигносульфонат натрия и 2-5 мас. неионного ПАВ, такого как октилфеноксиполиэтоксиэтанол, нонилфеноксиполиэтоксиэтанол или им подобного.
Типичную текучую жидкость можно по- лучить путем смешения 40 мас. активного ингредиента с 2 мас. агента желатинизации, такого как бентонит, 3 мас. диспергирующего агента, такого как лигносульфонат натрия, 1 мас. полиэтиленгликоля и 54 мас. воды.
Типичный эмульгирующийся концентрат можно получить путем растворения 5-25 мас. активного ингредиента в 65-90 мас. N-метилпирролидона, изофорона, бутилцеллозольва, метилацетата или им подобного и диспергирования в этой смеси 5-10 мас. неионного ПАВ, такого как алкилфеноксиполиэтоксиспирт. Этот концентрат диспергируют в воде для использования в виде жидкого спрея.
Если соединения изобретения предполагается использовать в качестве почвенных гербицидов, то их можно приготовить и использовать в виде гранул. Приготовление гранулированного продукта можно осуществить путем растворения активного соединения в растворителе, таком как хлористый метилен, N-метилпирролидон или им подобный, разбрызгивания полученного таким образом раствора на гранулированный носитель, такой как размолотые кукурузные початки, песок, аттапульгит, каолин или им подобные.
Полученный таким образом гранулированный продукт обычно содержит 3-20 мас. активного ингредиента и 97-80 мас. гранулированного носителя.
Для иллюстрации изобретения приводятся примеры, которые не ограничивают, а только иллюстрируют его.
П р и м е р 1. Получение диметилтиено[3,2-b]пиридин-5, 6-дикарбоксилата.

Смесь изопропил-3-тиофенилкарбамата (177 г, 0,975 моль) в метаноле (1,2 л) и воде (2,8 л), содержащую гидроокись натрия (200 г), нагревали при температуре дефлегмации в течение 4 ч. Метанол отогнали при пониженном давлении и охлажденную реакционную смесь экстрагировали простым диэтиловым эфиром (5 л), экстракты промыли водой, водным хлористым натрием и высушили. После выпаривания при пониженном давлении получили 3-аминотиофен в виде масла, выход сырого продукта 57% 3-Аминотиофен повторно растворили в метаноле (500 мл), охладили в ледяной бане и по каплям в смесь добавили диметилацетилендикарбоксилат (80 г, 0,50 моль). Смесь перемешивали при комнатной температуре в течение 15 ч и 30 мин, метанол отогнали при пониженном давлении и добавили 1,2-дихлорэтан. Этот растворитель также отогнали и получили диметил-3-тиениламинобутендиоат в виде масла. Реактив Вильсмейера приготовили, добавив по каплям при перемешивании оксихлорид фосфора (86 г, 0,56 моль) в охлажденный (5oC) раствор диметилформамида (41 г, 0,56 моль) в 1, 2-дихлорэтане (200 мл). Этот реактив перемешивали при комнатной температуре в течение одного часа и 40 мин, разбавили 1,2-дихлорэтаном (100 мл), охлажденным до 5оС, и затем указанный сложный диметиловый эфир, растворенный в 1,2-дихлорэтане (400 мл) добавили в реактив Вильсмейера по каплям при температуре 5оС в течение 25 мин. Температуру реакции повысили до комнатной за 15 мин, затем до температуры дефлегмации в течение следующих 2 ч 25 мин. Охлажденную реакционную смесь хроматографировали на колонке с силикагелем и получили после кристаллизации из смеси гексан-этилацетат 35,7 г (15%) диметилтиено [3,2-b] пиридин-5,6-дикарбоксилата, т. пл. 124-125,5оС. Получили вторую фракцию с т.пл. 121-124оС, общий выход из изопропил-3-тиофенкарбамата составил 19%
По указанной методике, заменив изопропил-3-аминотиофенкарбамат соответствующим образом замещенным аминотиофеном, получили следующие соединения:





П р и м е р 2. Получение диметилтиено [3,2-b]пиридин-5,6-дикарбоксилата
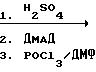

В концентрированную серную кислоту (170 мл), перемешиваемую при комнатной температуре, добавили по частям 3-ацетиламино-2-формилтиофен (17,5 г, 0,103 моль). Смесь нагревали при температуре 50оС в течение 30 мин, охладили и влили в смесь воды со льдом. Смесь нейтрализовали избыточным количеством ацетата натрия и экстрагировали из простого диэтилового эфира (1 х 2 мл). Органический слой обезвоживали над безводным Na2SO4 и отогнали, получив темно-красную смолу, представляющую собой 3-амино-2-формилтиофен. Раствор диметилацетилендикарбоксилата (ДМАД) (13 мл) в смеси уксусной кислоты (5 мл), пиперидина (5 мл), хлористого метилена (100 мл) и толуола (100 мл) добавили в 3-амино-2-формилтиофен и всю смесь перемешивали в течение ночи. Хлористый метилен отогнали и затем смесь нагревали при температуре дефлегмации в течение 24 ч. Смесь охладили и добавили дополнительно 13 мл ДМАД, нагревали реакционную смесь при температуре дефлегмации в течение 7,5 ч. Затем смесь выдержали в течение 60 мин при комнатной температуре, растворители отогнали и с помощью хроматографии получили диметилтиено[3, 2-b]пиридин-5,6-дикарбоксилат, используя в качестве элюента смесь гексана с этилацетатом, т.пл. 124-125оС.
П р и м е р 3. Получение диметил-3-хлор[3,2-b]пиридин-5,
6-дикарбоксилата и диметил-2,3-дихлортиено[3,2-b]пиридин-5, 6-дикарбоксилата
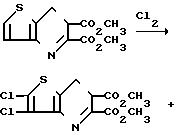

Раствор диметилтиено [3,2-b] пиридин-5,6-дикарбоксилата (15 г, 0,0525 моль) в смеси уксусной кислоты (680 мл) и ацетата натрия (86 г, 0,093 моль) поддерживали при температуре 58оС, одновременно в течение 5 ч 45 мин медленно подавая хлор. После завершения реакции смесь погасили азотом, добавили этилацетат (200 мл), отфильтровали твердый хлористый натрий и промыли этилацетатом. Маточные жидкости и смывки объединили и растворители отогнали при пониженном давлении. Остаток растворили в метиленлориде, раствор промыли водой, подвергли обратному экстрагированию с помощью хлористого метилена, объединенные метиленхлоридные слои промыли водным бикарбонатом натрия, обезводили и отогнали, получив 18 г твердого вещества. После хроматографии на силикагеле с помощью 15% этилацетат-гексана, а затем 20% этилацетатгексана получили 2,3-дихлорсоединение, т. п. 173-178оС, 1,3 г, а затем после кристаллизации из смеси этилацетат-гексан 3-хлортиеносоединение, т.пл. 166-173оС.
П р и м е р 4. Получение диметил-3-бромтиено [3,2-b] пиридин-5,6-дикарбосилата.
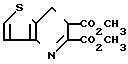

Раствор брома (20 г, 0,125 моль) в уксусной кислоте (50 мл) по каплям в течение 3 ч добавили в раствор диметилтиено[3,2-b]пиридин-5,6-дикарбоксилата (26,3 г, 0,104 моль), содержащего ацетат натрия (17,2 г, 0,2 моль), в уксусной кислоте (300 мл) при температуре 85оС. Дополнительное количество раствора ацетата натрия (18 г) и брома (20 г) в уксусной кислоте (50 мл) добавили в течение 1 ч, смесь перемешивали при температуре 85оС в течение ночи. В смесь в один прием добавили бром (10 г) и затем оставили смесь на 4 ч. Смесь охладили, обработали водным бисульфитом натрия, разбавили этилацетатом и сконцентрировали. Продукт реакции разделили на водный и метиленхлоридный слои и органический слой промыли водным хлористым натрием и отогнали растворитель. Остаток промыли пpостым диэтиловым эфиром и получили 25 г сырого продукта, т.пл. 165-168о С. После рекристаллизации из метанола получили диметил-3-бромтиено[3,2-b]пиридин-5,6-дикарбоксилат в виде игл, т.пл. 168-169оС.
П р и м е р 5. Получение тиено[3,2-b]пиридин-5, 6-дикарбоновой кислоты.



Диметилтиено[3,2-b] пиридин-5,6-дикарбоксилат (3,75 г, 0,0149 моль) добавили в раствор гидроокиси натрия (1,8 г, 0,045 моль) в воде (20 мл) и нагревали смесь пир температуре 60оС в течение 20 ч. Реакционную смесь разбавили водой, охладили ледяной бане и подкислили, добавив концентрированную соляную кислоту. Выпавшую в осадок тиено[3,2-b]пиридин-5,6-дикарбоновую кислоту отфильтровали, обезвоживали в течение ночи и получили 3,1 г (93%) продукта с т.п. > 380оС.


C6H5 H -(CH2)3- -(CH2)4- -(CH)4- Cl Cl H C6H5 C6H5 H H OC6H5 CF3 H C2H5 H H C2H5 H SC6H5 H CF3 H CHO H CH2Cl
Используя указанную процедуру и соответствующим образом замещенные сложные эфиры двухосновных тиено[3,2-b]пиридин-5,6-дикарбоновых кислот, получили следующие соединения:

П р и м е р 6. Получение ангидрида 3-хлортиено[3,2-b] пиридин-5,6-дикарбоновой кислоты.

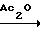

3-Хлортиено [3,2-b] пиридин-5,6-дикарбоновую кислоту (1,45 г) нагревали от 85 до 90оС в течение 30 мин и затем от 90 до 102оС в течение 30 мин в уксусном ангидриде (7 мл). Смесь охладили, твердые частицы отфильтровали, промыли простым диэтиловым эфиром и получили 1,2 г ангидрида 3-хлортиено[3,2-b] пиридин-5,6-дикарбоновой кислоты. Спектр ПМР соответствует структурной формуле.
Используя указанную процедуру и исходя из подходящих пиридин-5,6-дикарбоновых кислот,
получили следующие соединения:




щество т. е. не получили H Br >380 Cl H Cl Cl H NO2 CH3 H H N(CH3)2 H SCH3 H JCH3 H CH3 H F H I CH3 CH3 H CN H OCHF2 H SO2N(CH3)2 -(CH2)3- -(CH2 )4- -(CH)4- H C6H5 C6H5 H H ОC6H5 CF3 H C2H5 H H C2H5 H SC6H5
H CF3 H CHO H CH2Cl
П р и м е р 7. Получение 5-(1-карбамоил-1,2-диметилпропил)-3-хлортиено[3,2-b]пи- ридин-6-карбоновой кислоты.

2-Амино-2,3-диметилбутирамид (0,71 г) в один прием добавили в перемешиваемый раствор ангидрида 3-хлортиено[3,2-b]пиридин-5,6-дикарбоновой кислоты (1,2 г) в ТГФ (1,0 мл). Через 5 мин ледяную баню удалили, и реакционную смесь перемешивали при комнатной температуре в течение 28 ч. Затем добавили ТГФ (5 мл), смесь нагревали при температуре дефлегмации в течение 2 ч и затем отставили на ночь. Охлажденную смесь профильтровали и собранные твердые частицы промыли простым диэтиловым эфиром, получив 1,4 г требуемой 5-[(1-карбамоил-1,2-диметилпропил)карбамоил] -3- хлортиено[3,2-b]пиридин-6-карбоновой кислоты.
По описанной методике, используя вместо ангидрида
3-хлортиено[3,
2-b]пиридин-5,6-дикарбоновой кислоты соответствующие ангидриды пиридин-5,6-дикар- боновых кислот и подходящие аминоамиды, получили следующие соединения:





H H CH3 i-C3H7
H Cl CH3 i-C3H7 не чистый
Cl H CH3 i-C3H7
Cl Cl CH3 i-C3H7
H Br CH3 i-C3H7
H CN3 CH3 i-C3H7
H NO2 CH3 i-C3H7
H N(CH3)2 CH3 i-C3H7
H SCH3 CH3 i-C3H7
H OCH3 CH3 i-C3H7
CH3 H CH3 i-C3H7
H H CH3 C3H7
H H CH3 C2H5
H OCHF2 CH3 i-C3H7
CH3 CH3 CH3 i-C3H7
H CN CH3 i-C3H7
H F CH3 i-C3H7
H I CH3 i-C3H7
H SO2N(CH3)2 CH3 i-C3H7
C6H5 H CH3 i-C3H7
-(CH2)3- CH3 i-C3H7
-(CH2)4- CH3 i-C3H7
-(CH)4- CH3 i-C3H7
H C6H5 CH3 i-C3H7
C2H5 H CH3 i-C3H7
H OC6H5 CH3 i-C3H7
H CH2Cl CH3 i-C3H7
CF3 H CH3 i-C3H7
H C2H5 CH3 i-C3H7
H CHO CH3 i-C3H7
H CF3 CH3 i-C3H7
H SC6H5 CH3 i-C3H7
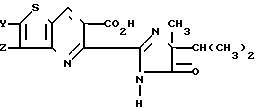
П р и м е р 8. Получение 5-(5-изопропил-5-метил-4-оксо-2-имидазолин-2-ил)- тиено [3,2-b] пиридин-6-карбоновой кислоты.


Тиено [3,2-b] пиридин-5,6-дикарбоновую кислоту (2,5 г, 0,011 моль) медленно нагревали до температуры 85оС в течение 1 ч с уксусным ангидридом (25 мл), затем охладили, профильтровали, промыли простым диэтиловым эфиром и получили ангидрид в виде твердого вещества с т.пл. 266-267о С. Смесь ангидрида и 2-амино-2,3-диметилбутирамида (2,6 г, 0,02 моль) в ТГФ (70 мл) перемешивали при комнатной температуре в течение 15 ч. Смесь нагревали при температуре дефлегмации в течение 2 ч, затем охладили и разбавили ТГФ (50 мл). Твердую 5-[(1-карбамоил-1,2-диметилпропил)карбамоил]тиено [3,2-b] пиридин-6-карбоновую кислоту отфильтровали, промыли простым диэтиловым эфиром и обезводили. Указанное твердое вещество смешали с безводным (60 мл) раствором гидроокиси натрия (6 г, 0,05 моль) и нагревали при температуре 85оС в течение 2,5 ч и затем оставили при комнатной температуре на ночь. Смесь охладили в ледяной бане и подкислили до рН 3 концентрированной соляной кислотой. Твердое вещество (3 г) отфильтровали и обезводили. После кристаллизации из этилацетата получили 5-(5-изопропил-5-метил-4-оксо-2-имидазолин-2-ил)тиено[3,2-b] пиридин-6-карбоновую кислоту, т.пл. 242-244оС, выход 46%
По указанной методике, используя вместо тиено[3,2-b] пиридин-5,6-дикарбоновой кислоты соответствующую пиридин-5,6-дикарбоновую кислоту, получили следующие соединения:



-(CH2)3-
-(CH2)4-
-(CH2)4- H C6H5 H OC6H5 CF3 H C2H5 H H C2H5 H I H F H CHO H CH2Cl H CF3
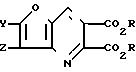
П р и м е р 9. Получение диэтилфуро[3, 2-b]пиридин-5,6-дикарбоксилата


3-Амино-2-формилфуран, полученный из 3-азидо-2-формилфурана (8,9 г, 0,065 моль), растворили в этаноле и в этот раствор добавили диэтилоксалацетат (12,23 г, 0,065 моль) и 10 капель пиперидина. Кроме того, добавили распыленные молекулярные сита 3

Используя указанную методику и соответствующий фуран вместо 3-амино-2-формилфурана,
получили следующие соединения:

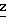


П р и м е р 10. Получение фуро [3,2-b]пиридин-5,6-дикарбоновой кислоты.



Сложный диэтиловый эфир фуро[3,2-b]пиридин-5,6-дикарбоновой кислоты (1,1 г, 0,0042 моль) растворили в 95% этаноле (20 мл), содержащем 10%-ный водный раствор гидроокиси натрия (20 мл), и оставили при температуре 0оС в течение двух дней. Смесь охладили, подкислили и растворитель отогнали при пониженном давлении. Добавили 5 мл воды и после фильтрования получили двухосновную гидратированную кислоту в виде коричневого твердого вещества, 3,31 г (99%), т.пл. 183оС (разлагается).
Анализ для C9H5NO5·2 1/2
H2O
Вычислено, С 42,86; Н 3,99; N 5,55
Найдено, С 42,63; Н 2,63; N 5,46
Используя описанную процедуру и соответствующие сложные эфиры фуро[3,2-b] пиридин-5,
6-дикарбоновой кислоты, получили следующие соединения:




П р и м е р 11. Получение ангидрида фуро[3,2-b]пиридин-5, 6-дикарбоновой кислоты.



Раствор фуро[3,2-b]пиридин-5,6-дикарбоновой кислоты (3,3 г, 0,0159 моль) в уксусном ангидриде (100 мл) нагревали при температуре 70-80оС в течение 6 ч. Реакционную смесь охладили, профильтровали, твердые частицы промыли простым диэтиловым эфиром и получили 3,01 г (100%) сырого ангидрида фуро [3,2-b] пиридин-5,6-дикарбоновой кислоты.
По указанной методике, используя соответствующие фуро [3,2-b] пиридин-5,6-дикарбоновые кислоты,
получили
следующие соединения:



H H
H Cl
CH3 H
H CH3
C2 H5 H
H C2H5
CH3 CH3
П р и м е р 12. Получение 5-[(1-карбамоил-1,2-диметилпропил) карбамоил] фуро[3, 2-b] пиридин-6-карбоновой кислоты и 5-(5-изопропил-5-метил-4-оксо-2-имидазолин-2-ил) фуро[3,2-b]пиридин-6-карбоновой кислоты.

Ангидрид фуро [3,2-b] пиридин-5,6-дикарбоновой кислоты (3,01 г, 0,015 моль) суспендировали в тетрагидрофуране (100 мл), в который добавили 2-амино-2, 3-диметилбутирамид (2,3 г, 0,018 моль). Смесь перемешивали в течение 20 ч, затем отогнали до получения маслянистого твердого вещества, которое растворяется в смеси воды с разбавленным раствором гидроокиси натрия. Щелочной раствор экстрагировали хлористым метиленом, подкислили, повторно экстрагировали хлористым метиленом и при перемешивании выделили лишь следы вещества. Водный слой сконцентрировали до получения твердого маслянистого вещества, которое растворили в этаноле, профильтровали и сконцентрировали до смолы пурпурного цвета, котоpая в основном представляет собой сырой продукт, 5-[(1-карбамоил-1,2-диметилпропил)карбамоил]фуро [3,2-b]пиридин-6-карбоновую кислоту, который используют без дополнительной очистки для получения целевого 2-имидазолин-2-ила путем растворения его в 10%-ном растворе гидроокиси натрия (40 мл) и нагревания при температуре 80оС в течение 3 ч. После охлаждения реакционную смесь подкислили, из нее выпал незначительный твердый осадок, который отфильтровали. После концентрации маточной жидкости получили вторую фракцию, которую собрали и объединили с первой фракцией. Очистку осуществили, взяв половину материала и разделив на препаративных стеклянных пластинах с силикагелем на слои. Медленнее текущий слой в результате элюирования смесью метиленхлорид этилацетат хлороформ метанол 1 1 1 1 дал желаемый 2-имидазолин-2-ил, т.пл. 214-223оС (с разложением). Сложные эфиры можно затем получить, используя методику, описанную в примере 20.
Используя описанную процедуру и
соответствующий ангидрид
фуро[3,2-b]пиридин-5,6-дикарбоновой кислоты, получили следующие соединения:


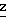

П р и м е р 13. Получение диметилтиено[2,3-b]пиридин-5,6-дикарбоксилата.

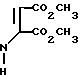


Реактив Вильсмейера приготовили, добавив по каплям при перемешивании оксихлорид фосфора (40,29 г, 0,26 моль) в охлажденный (10оС) раствор ДМФ (19,0 г, 0,26 моль) в 1,2-дихлорэтане (40 мл) в атмосфере азота. Этот реактив перемешивали при комнатной температуре в течение 1 ч 45 мин. В реактив Вильсмейера при температуре 7-10оС по каплям прибавили диметил-2-тиениламинобутендиоат (63,4 г, 0,26 моль), растворенный в 1,2-дихлоэтане (300 мл). Температуру реакции подняли до комнатной температуры за 15 мин и затем до температуры дефлегмации за 12 ч. Охлажденную реакционную смесь сконцентрировали, остаток хроматографировали на силикагеле, используя в качестве элюента смесь этилацетат-гексан, и получили диметилтиено [2,3-b]пиридин-5,6-дикарбосилат (29 г, 45%) в виде твердого вещества.
Используя описанную методику и соответствующий
диметил-2-тиениламинобутендиоат, получили
следующие соединения:




-(CH2)4- 118-121,5
П р и м е р 14. Получение диметил-3-бромтиено [2,3-b]пиридин-5,6-дикарбоксилата.



Раствор брома (0,33 г, 0,00206 моль) в уксусной кислоте (8 мл) добавили в перемешиваемый раствор диметилтиено [2,3-b]пиридин-5,6-дикарбоксилата (0,5 г, 0,00187 моль) в уксусной кислоте, содержащий ацетат натрия (0, 31 г, 0,00377 моль), при температуре 40оС. Реакционную смесь нагревали при температуре 75оС в течение 18 ч. Анализ смеси с помощью ТСХ (силикагель) показал, что реакция не завершилась. Добавили дополнительное количество раствора брома (0,33 г) в уксусной кислоте и ацетатом натрия (0,31 г) и нагревание при температуре 75оС продолжали в течение 6 ч. Реакционную смесь развели водой и экстрагировали этилацетатом. Отделившийся органический слой обезводили над безводным сульфатом магния, профильтровали и фильтрат сконцентрировали до получения масла, которое при выдержке затвердевает. После кристаллизации сырого продукта из смеси этилацетата с гексаном получили диметил-3-бромтиено [2,3-b] пиридин-5, 6-дикарбоксилат в виде игл белого цвета, т.пл. 86-87,5оС.
Это соединение легко можно превратить в целый ряд замещенных тиено [2,3-b] пиридиновых соединений, как показано
ниже, а электрофильное замещение, такое как нитрование или
галоидирование, позволяют получить дополнительный ряд следующих соединений:




C6H5 H H C6H5 H OC6H5 CF3 H H SC6H5 H CF3 C2H5 H H C2H5
П р и м е р 15. Получение тиено[2,3-b]пиридин-5, 6-дикарбоновой кислоты.



Раствор диметилтиено [2,3-b] пиридин-5,6-дикарбоксилата (27,75 г, 0,11 моль) и гидроокиси калия (30,98 г, 0,55 моль) в метаноле (200 мл) нагревали в атмосфере азота при температуре дефлегмации в течение 2 ч. Реакционную смесь охладили, добавили воду в количестве, достаточном для растворения всех имеющихся твердых частиц, и выпарили смесь досуха. Полученное твердое вещество растворили в минимальном объеме воды, охладили в ледяной бане и подкислили с помощью концентрированной серной кислоты до рН ≈ 1. Тиено[2,3-b] пиридин-5, 6-дикарбоновую кислоту отфильтровали и высушивали в течение ночи, получив 23,36 г вещества с т.пл. 272-275оС.
Используя описанную методику и соответствующим образом
замещенный диалкилтиено[2,3-b]пиридин-5,6-дикарбоксилат, получили следующие соединения:
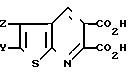



(разлож. ) СH3 H Cl H Cl Cl CH3 CH3 C6H5 H H SO2 N(CH3) -(CH2)3- -(CH2)4- 280-290 -(CH)4 H OC6H5 H C6H5 CF3 H H CF3 H SC6H5 C2H5 H H C2H5
П р и м е р 16. Получение ангидрида тиено[2,3-b]пиридин-5,6-дикарбоновой кислоты.



Уксусный ангидрид (37,4 г, 0,366 моль) добавили в перемешиваемую суспензию тиено[2,3-b]пиридин-5,6-дикарбоновой кислоты (21,52 г, 0,096 моль) в диметоксиэтане (175 моль) в инертной атмосфере азота. При добавлении пиридина (16,78 г, 0,21 моль) при комнатной температуре наблюдалось повышение температуры до 45оС в результате протекания экзотермической реакции и был получен однородный раствор. Реакционную смесь затем перемешивали при комнатной температуре, полученное твердое вещество отфильтровали, промыли простым диэтиловым эфиром, высушили на воздухе и получили 14,8 г (75%) ангидрида тиено[2,3-b]пиридин-5,6-дикарбоновой кислоты.
По описанной методике, используя соответствующим образом
замещенную тиено[2,3-b]пиридин-5,6-дикарбоновую кислоту, получили следующие соединения:




(медленное
разлож.) H H 210-213 H I H F H CN H SCH3 H N(CH3)2 H NO2 H CHO H CH2Cl H CH3 Cl H Cl Cl CH3 CH3 C6H5 H H SO2N(CH3)2 -(CH2)3- -(CH2)4- 220-222
-(CH)4- H C6H5 H OC6H5 CF3 H H CF3 H OCHF2 H SC6H5 H OCH3 C2H5 H H C2H5
П р и м е р 17. Получение 6-[(1-карбамоил-1, 2-диметилпропил)карбамоил] тиено[2,3-b]пиридин-5-карбоновой кислоты.

2-Амино-2, 3-диметилбутирамид (9,84 г, 0,076 моль) добавили в перемешиваемую суспензию ангидрида тиено [2,3-b]пиридин-5,6-дикарбоновой кислоты (14,8 г, 0,072 моль) в ТГФ в инертной атмосфере азота при комнатной температуре. Темный раствор перемешивали при комнатной температуре в течение ночи, полученное твердое вещество отфильтровали, промыли ТГФ, высушили на воздухе и получили 17,35 г (72%) 6-[(1-карбамоил-1,2-диметилпропил)карбамоил]тиено[2,3-b]пиридин-5-кар- боновой кислоты.
По описанной методике,
используя соответствующим образом замещенные ангидриды тиено[2,3-b]
пиридин-5,6-дикарбоновой кислоты, получили следующие соединения:




-(CH)4- H C6H5 H OC6H5 CF3 H H
OCHF2 H CF3 H SC6H5
C2H5 H H C2H5
П р и м е р 18. Получение
6-(5-изопропил-5-метил-4-оксо-2-имидазолин-2-ил)тие- но[2,3-b]пиридин-5-карбоновой кислоты.

6-[(1-Карбамоил-1,2-диметилпропил)кар- бамоил] тиено[2,3-b] пиридин-5-карбоновую кислоту (17,35 г, 0, 052 моль) добавили в воду (225 мл), содержащую гидроокись натрия (10,35 г, 0,26 моль). Полученный основной раствор нагревали при температуре 80оС в течение 2 ч 45 мин, охладили в бане из воды и льда и подкислили с помощью 6 н. серной кислоты. Полученную 6-(5-изопропил-5-метил-4-оксо-2-имидазолин-2-ил)тиено[2,3-b]пиридин-5-карбон овуюкислоту отфильтровали, промыли водой, высушили на воздухе и получили 1,54 г (70,3%) вещества т.пл. 221-223о С.
П р и м е р 19. Получение 2-изопропил-2-метилового эфира 5Н-имидазо [1', 2':1,2]пирроло [3,4-b]тиено[3, 2-e]пиридин-3 (2Н)-5-диона.

Раствор дициклогексилкарбодиимида (1,07 г, 0,005 моль) в метиленхлориде (20 мл) по каплям добавили в перемешиваемую метиленхлоридную (30 мл) суспензию 6-(5-изопропил-5-метил-4-оксо-2-имидазолин-2-ил) тиено[2,3-b] -5-карбоновой кислоты (1,5 г, 0,0047 моль) в атмосфере азота. Реакционную смесь перемешивали в течение 16 ч, профильтровали, сконцентрировали досуха и полученное вещество очистили с помощью хроматографии на силикагеле, используя в качестве элюента смесь ацетонитрил-метиленхлорид (1:2). Твердое вещество подвергли кристаллизации из толуола и получили чистый 3,5-дион в виде белых кристаллов, т.пл. 214,5-216,5оС.
П р и м е р 20. Получение 2-пропинил-6-(5-изопропил-5-метил-4-оксо-2-имидазо- лин-2-ил) тиено[2,3-b]пиридин-5-карбоксилата.

Гидрид натрия (2,4 г, 60% 0,126 моль) добавили в 3,5-дион (0,9 г, 0,003 моль), раствоpенный в пропаргиловом спирте (25 мл) при температуре 10оС в инертной атмосфере азота. Реакционную смесь перемешивали при комнатной температуре в течение 60 ч и затем нейтрализовали с помощью насыщенного раствора хлористого аммония. Полученную смесь сконцентрировали на роторном испарителе, разбавили водой и экстрагировали этилацетатом. Органический слой отделили, обезводили над безводным сеpнокислым магнием и сконцентриовали досуха. Продукт подвергли очистке с помощью колоночной хроматографии на силикагеле (элюент:метиленхлорид ацетонитрил 85:15) и получили 2-пропинил-6-(5-изопропил-5-метил-4-оксо-2-имидазолин-2- ил)пиридин-5-карбоксилат, который после кристаллизации из толуола имел т.пл. 188-189,5оС.
По методике примеров 18, 19 и 20, используя соответствующие тиено [3,2-b] пиридины или тиено [2,3-b]
пиридины, получили
следующие соединения:






-(CH2)3 - H
-(CH2)4- H
-(CH2)4- H H OC6H5 H CF3 H H C2H5 H H H C2H5 H H I H H F H H CHO H H CH2Cl H H CF3 H H SC5H6 H
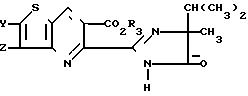


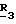


П р и м е р 21. Получение метил-6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)- 3-нитротиено [2,3-b]пиридин-5-карбоксилата.

Метил-6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)тиено[2,3-b] пиридин-5-карбоксилат (3,94 г, 0,0119 моль) растворили в 200 мл концентрированной серной кислоты при комнатной температуре. Реакционную смесь охлаждали до 3оС в ледяной бане, одновременно добавляя в нее 1,5 мл (0,024 моль) концентрированной азотной кислоты. Затем смеси дали нагреться до комнатной температуры. Через 3 ч реакционную смесь влили в лед, нейтрализовали с помощью твердого NaHCO3 до рН 6 и экстрагировали метиленхлоридом. Экстракт профильтровали, обезводили над сульфатом натрия, еще раз профильтровали, сконцентрировали и получили твердое вещество желтого цвета, 4,33 г (97%), которое после кристаллизации из смеси метанол-вода имело т.пл. 201-202,5о С.
П р и м е р 22. Получение 6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)-3- нитротиено [2,3-b]пиридин-5-карбоновой кислоты.


Сложный эфир (1,0 г, 0,00266 моль), полученный в примере 21, перемешивали с раствором 100 мл метанола и 10 мл 10%-ной гидроокиси натрия в течение 24 ч. Затем добавили воду (25 мл) и метанол отогнали в вакууме. Водный слой подкислили, в результате чего выпал коричневый осадок, который отфильтровали, подвергли кристаллизации из смеси метанол-вода и он имел т.п.260оС.
П р и м е р 23. Получение диэтил-5-ацетил-1, 6-дигидро-6-оксо-2,3-пиридиндикар- боксилата.
CH3-

Ацетат натрия добавили в перемешиваемую смесь диэтил (этоксиметилен) оксалацетата (87 г, 0,36 моль) и ацетоацетамида (36 г, 0,36 моль) в абсолютном этаноле (300 мл). Реакционную смесь перемешивали в течение 30 мин, этанол отогнали при пониженном давлении, остаток подкислили до рН 2 с помощью разбавленного водного раствора соляной кислоты и полученное твердое вещество отфильтровали. После кристаллизации из смеси этанол-вода получили диэтил-5-ацетил-1,6-дигидро-6-оксо-2,3-пиридинкарбоксилат в виде кристаллов с т.пл. 101-110оС.
П р и м е р 24. Получение изобутирилацетонитрила.
(CH

NaH (61,55 г 60%-ной дисперсии, 1,54 моль) добавили в 650 мл безводного ТГФ в атмосфере азота. Суспензию нагрели до температуры дефлегмации. Метилизобутират (100 г, 98 моль) и ацетонитрил (63,16 г, 1,54 моль) смешали в 140 мл безводного ТГФ и по каплям в течение 1 ч добавили в нагреваемую до температуры дефлегмации суспензию. Полученный раствор нагревали при температуре дефлегмации в течение 16 ч. В реакционную смесь добавили воду в количестве, достаточном для растворения образовавшейся соли. ТГФ отогнали в вакууме, основной водный раствор экстрагировали простым диэтиловым эфиром, затем подкислили до рН 4 с помощью концентрированной соляной кислоты. Раствор экстрагировали простым диэтиловым эфиром. Экстракты промыли рассолом, обезводили над безводным сульфатом магния, профильтровали, растворитель отогнали в вакууме и получили 97,25 г (89,4%) указанного в названии продукта в виде оранжевого масла.
П р и м е р 25. Получение диэтил-5-(2-метилпропионил)-1,6-дигидро-6-оксо-2,3-пи- ридиндикарбоксилата
(CH

Изобутилацетонитрил (50 г, 0,45 моль) и диэтил (этоксиметилен)-оксалацетат (110 г, 0,45 моль) растворили в абсолютном этаноле и добавили ацетат натрия (36,9 г, 0,45 моль) и одну каплю пиперидина. Через 12 ч смесь сконцентрировали, подкислили разбавленной соляной кислотой и экстрагировали метиленхлоридом. Экстракты сконцентрировали, подвергли рекристаллизации и получили указанный в названии продукт в виде твердого вещества белого цвета, 21,7 г (19,5%), т.пл. 116-118оС.
П р и
м е р 26.
Получение диэтил-5-(бромацетил)1,6-дигидро-6-оксо-2,3-пиридинди- карбоксилата
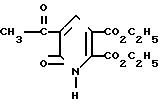

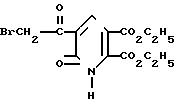
Раствор брома (8, 0 г, 0,050 моль) в 48% HBr по каплям добавили в перемешиваемый раствор диэтил-5-ацетил-1,6-дигидро-6-оксо-2,3-пиридинкарбоксила- та (14,05 г, 0,05 моль) в 48% HBr (200 мл). После завершения прибавления брома реакционную смесь вылили на лед (200 г) и смесь перемешивали до тех пор, пока лед не растаял. Сырой продукт собрали фильтрованием, дважды подвергли кристаллизации из смеси этилацетат-гексан (1:2) и получили диэтил-5-(бромацетил)-1,6-дигидро-6-оксо-2,3-пиридинкарбокси-лат с т.пл. 141-142оС.
По указанной методике, используя диэтил-2-метилпропионил-2-пиридондикарбо- ксилат, получили диэтил-5-(2-бром-2-метилпропионил)-1,6-дигидро-6-оксо-2,3-пири- динкарбоксилат, т.пл. 124-126оС.
П р и м е р 27. Получение диэтил-5-(2-бром-1-оксиэтил)-1, 6-дигидро-6-оксо-2,3- пиридиндикарбоксилата и диэтил-2,3-дигидро-3-окси-фуро[2,3-b]пиридин-5,6-дика- рбоксилата.


Борогидрид натрия (2,54 г, 0,066 моль) по частям добавили в течение 30 мин в перемешиваемую суспензию диэтил-5-(бромацетил)-1,6-дигидро-6-оксо-2,3-пиридинкар- боксилата (57,2 г, 0,159 моль) при температуре 10-20оС. Когда добавили весь борогидрид натрия, реакционную смесь перемешивали до момента достижения ею комнатной температуры. В смесь добавили лед (100 г) и перемешивали ее до тех пор, пока лед не растаял. Затем смесь сконцентрировали в вакууме, остаток дважды подвергли кристаллизации из смеси этилацетат-гексан и получили чистый диэтил-5-(2-бром-1-оксиэтил)-1,6-дигидро-6-оксо-2,3- пиридинкарбоксилат, т. пл. 134-138оС. Этот продукт перемешивали с раствором триэтиламина (1,0 мл/г твердого вещества) в метиленхлориде в течение 1 ч, затем органический слой промыли разбавленной соляной кислотой, водой, рассолом, обезводили над безводным сульфатом магния и получили сырой фуро[2,3-b] пиридин, который после отгонки в вакууме растворителя представлял собой масло. После кристаллизации из смеси циклогексан-толуол получили чистый диэтил-2,3-дигидро-3-окси-фуро[2,3-b] пиридин-5,6-дикарбоксилат, т.пл. 73-77оС.
П р и м е р 28. Получение диэтил-2, 3-дигидро-3-метоксифуро[2,3-b] пиридин-5, 6-дикарбоксилата.

60% -ную дисперсию гидрида натрия в смеси минерального масла (2,05 г, 0,0512 моль) и иодметана (7,9 мл, 0,128 моль) добавили в раствор эфира оксикислоты, полученного в примере 27 (12,00 г, 0,0427 моль), в тетрагидрофуране (400 мл) в атмосфере азота. Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем нагревали при температуре 50оС в атмосфере азота для удаления избыточного количества иодметана. Затем реакционную смесь охладили, профильтровали, перегнали и хроматографировали на силикагеле. Используя в качестве элюента смесь гексан-этилацетат (4:1), получили целевое соединение в виде масла желтого цвета, выход 57,3%
Анализ для C14H17NO6
Вычислено, С 56,94; Н 4,580; N 4,74
Найдено, С 56,93; Н 5,59; N 4,83
П р и м е р 29. Получение диэтилфуро[2,3-b] пиридин-5,6-дикарбоксилата

Раствор в ксилоле оксифуросоединения, полученного в примере 23 (3, 7 г), содержащий п-толуолсульфоксилоту (0,01 г) нагревали при температуре дефлегмации в течение 2 ч. Раствор охладили и ксилоловый раствор слили. Остаток экстрагировали простым диэтиловым эфиром и экстракты объединили с ксилолом. После отгонки растворителей получили твердое вещество желтого цвета, которое подвергли кристаллизации из смеси циклогексантолуол и получили чистый диэтилфуро [2, 3-b]пиридин-5,6-дикарбоксилат, т.пл. 66-77оС.
П р и м е р 30. Получение диметил-2-метилфуро[2,3-b]пиридин-5, 6-дикарбоксила- та.

Пропин (3,0 мл, 0,045 моль) сконденсировали в проградуированном цилиндре в бане со смесью сухой лед-ацетон и добавили в перемешиваемую суспензию диметил-1,6-дигидро-5-иодо-6-оксо-2,3-пиридинди- карбоксилата (13,48 г, 0,04 моль), иодистой меди (0,38 г, 0,002 моль) и бис-(трифенилфосфин) палладия (II) хлорида (2,81 г, 0, 004 моль) в 150 мл ДМСО и 50 мл триэтиламина при температуре 10оС. После добавки пропина реакционную смесь перемешивали при комнатной температуре в течение 60 ч. Воду добавили и смесь экстрагировали этилацетатом. Этилацетатный раствор промыли водой, обезводили над безводным сульфатом магния, сконцентрировали в вакууме и получили смесь веществ. Сырой продукт выделили с помощью испарительной колоночной хроматографии, используя смесь 9:1 метиленхлорид этилацетат. Фракции, содержащие указанное в названии соединение, сконцентрировали в вакууме, остаток рекристаллизовали из циклогексана и получили чистое соединение с т.пл. 115-118оС.
Используя описанную процедуру и соответствующим
образом замещенный ацетилен, получили следующие соединения:



CН5 147-149
Фенил 152-153
П р и м е р 31. Получение диэтил-2,3-дигидро-3, 3-диметилфуро[2,3-b]пиридин-5,6-дикарбоксилата.
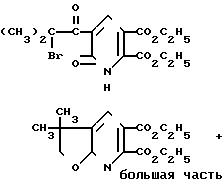

Эфир двухосновной 5-(2-бром-2-метилпропил) кетокислоты, полученный в примере 26 (20 г, 0,052 моль), растворили в 200 мл абсолютного этанола и в смесь добавили 3,0 г борогидрида натрия (0,078 моль) при температуре 0оС, затем температуре дали постепенно повыситься до 15оС. Смесь перемешивали еще 1 ч, и этанол отогнали в вакууме. Отвердевшую массу обработали водой и экстрагировали метиленхлоридом. Затем органический экстракт промыли водой и насыщенным раствором хлористого натрия, обезводили и сконцентрировали. Остаток весом 12 г повторно растворили в ксилоле и в смесь добавили 1,0 г п-толуолсульфокислоты. Раствор нагревали при температуре дефлегмации в течение 12 ч и затем охладили. Ксилоловый раствор слили, остаток промыли несколькими порциями простого диэтилового эфира. Объединенные органические растворы сконцентрировали, затем хроматографировали, используя смесь 9:1 метиленхлорид этилацетат и получили 3,2 г маслянистого эфира двухосновной кислоты (21%).
По данным масс-спектрографии М + + 1/е= 294.
Из последних хроматографических фракций получили 1,4 г 2, 2-диметил-3-оксифуро [2,3-b]пиридин-5,6-дикарбоксилата (11,5%).
П р и м е р 32. Получение диэтил-3-бромфуро [2, 3-b]пиридин-5,6-дикарбоксилата.
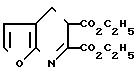


Эфир двухосновной кислоты, полученный в примере 29, (6,0 г, 0,0228 моль) растворили в 200 мл метиленхлорида, содержащих 4,6 г ацетата натрия и при температуре дефлегмации добавили бром (7,3 г, 0,0556 моль). Добавление продолжали, перемешивая смесь при температуре дефлегмации в течение 15 мин, затем смесь охладили, промыли водным бисульфатом натрия, обезводили над сульфатом натрия и профильтровали. Фильтрат отогнали, по- лучив 8,8 г сырого дибромного соединения, которое вторично растворили в метиленхлориде и обработали 3,16 г ДБУ (0,021 моль) при комнатной температуре в течение 30 мин. Затем смесь сконцентрировали в вакууме, хроматографировали на силикагеле, используя смесь гексан-этилацетат, и по- лучили 7,1 г (90%) однобромзамещенного эфира диэтил-3-бромфуро [2,3-b] пиридин-5,6-дикарбоксилата, т.пл. 49,5-52оС.
П р и м е р 33. Получение диэтил-2,3-дибромфуро[2,3-b]пиридин-5, 6-дикарбокси- лата.



Ацетат натрия (2, 40 г, 0,0292 моль) и бром (7,5 мл, 0,146 моль) добавили в раствор диэтил-3-бромфуро [2,3-b] пиридин-5,6-дикарбоксилата (5,00 г, 0,0146 моль) в метиленхлориде (150 мл). Смесь перемешивали при комнатной температуре в течение 4 суток, затем промыли водным раствором бисульфата натрия для удаления непрореагировавшего брома. Водный раствор затем подвергли обратной экстракции из метиленхлорида. Органический раствор объединили, обезводили над сульфатом натрия и профильтровали. К фильтрату добавили 1,8 диазабицикло [5,4,0] ундец-7-ен (4,4 мл, 0,032 моль) и смесь перемешивали при комнатной температуре в течение 1 ч. Затем раствор сконцентрировали в вакууме. Остаток хроматографировали на силикагеле, проэлюировав 20%-ным раствором этилацетата в гексане. Получили сырой 2,3-дибромфуро [2, 3-b] пиридин в виде твердого вещества белого цвета с выходом 95% и после рекристаллизации из смеси метиленхлорид-гексан получили диэтил-2,3-дибромфуро [2,3-b] пиридин-5,6-дикарбоксилат, т.пл. 96-98оС с выходом 75,9%
П р и м е р 34. Получение диэтил-3-трифторметилфуро[2,3-b]пиридин-5,6-дикарбо- ксилата.
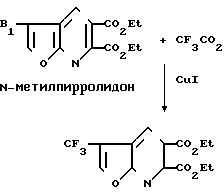
В раствор трифторацетата натрия (0,0234 моль) в N-метилпирролидоне (50 мл) добавили 3-бромфторпиридин, полученный в примере 32 (2,02 г, 0, 00585 моль), и иодид меди (2,2 г, 0,0119 моль). Смесь нагревали при температуре 160оС в течение 3 ч в атмосфере азота, охладили при комнатной температуре, обработали EtOAc (100 мл) и гексаном (100 мл) и профильтровали. Фильтрат промыли водой (4х200 мл), обезводили над сульфатом натрия, отогнали до получения масла, которое хроматографировали на силикагеле, используя в качестве элюента смесь гексан-Et OАс (7:3). Продукт собрали в виде твердого вещества светло-желтого цвета, т.пл. 50-55оС.
П р и м е р 35. Получение фуро[2,3-b]пиридин-5, 6-дикарбоновой кислоты.


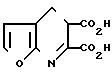
Раствор гидроокиси калия (5,60 г, 85% 0,087 моль) в воде (5 мл) добавили в перемешиваемую суспензию диэтилфуро [2,3-b]пиридин-5,6-дикарбоксилата (9,3 г, 0,035 моль) в абсолютном этаноле (100 мл). Реакционную смесь нагревали при температуре 60оС в течение 1 ч, затем охладили и добавили безводный ацетон. Осадок отфильтровали, обезводили, суспендировали в безводном ацетоне и с помощью хлористого водорода подработали рН до 2. После кристаллизации отделенного твердого вещества из смеси этилацетат-ацетон получили фуро[2,3-b]пиридин-5, 6-дикарбоновую кислоту, т.пл. 189-192оС.
П р и м е р 36. Получение ангидрида фуро[2, 3-b]пиридин-5,6-дикарбоновой кислоты.



Фуро[2,3-b] пиридин-5,6-дикарбооно- вую кислоту (6,7 г, 0,032 моль) нагревали при температуре 60оС в течение 30 мин в уксусном ангидриде (150 мл). Реакционную смесь охладили до комнатной температуры, сконцентрировали в вакууме, остаток растерли со смесью циклогексан-простой диэтиловый эфир (5: 1), отфильтровали, обезводили и получили 5,35 г ангидрида фуро[2,3-b]пиридин-5,6-дикарбоновой кислоты.
П р и м е р 37. Получение 6-[(1-карбамоил-1,2-диметилпропил)карбамоил] фуро[2,3- b]пиридин-5-карбоновой кислоты.



2-Амино-2,3-диметилбутирамид (2,1 г, 0,016 моль) добавили в перемешиваемую суспензию ангидрида фуро[2,3-b]пиридин-5,6-дикарбоновой кислоты (3,0 г, 0,016 моль) в тетрагидрофуране (7,5 мл) и смесь оставили перемешиваться при комнатной температуре в течение 16 ч. Затем реакционную смесь перемешивали при температуре 60оС в течение 1 ч, охладили до комнатной температуры, добавили простой диэтиловый эфир, отфильтровали твердое вещество, обезводили и получили 5 г 6-[(1-карбамоил-1,2-диметилпропил)карбамоил]фуро[2,3-b]пиридин-5,6-карбоново й кислоты, т.пл. 192-196оС (с разложением).
П р и м е р 38. Получение 6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)фу- ро[2,3-b] пиридин-5-карбоновой кислоты.


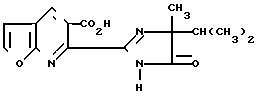
Раствор, содержащий раствор 6-[(1-карбамоил-1,2-диметилпропил)карбамоил] фу- ро[2,3-b] пиридин-5-карбоновой кислоты (3,8 г, 0,012 моль) в водной гидроокиси натрия (2,4 г, 0,06 моль), в воде (40 мл) перемешивали при температуре 65оС в течение 3 ч. Затем реакционную смесь нагревали при температуре 75оС в течение 1 ч, дали ей возможность остыть, вылили на лед, подкислили до рН 2-3, полученное твердое вещество отфильтровали и обезводили. После кристаллизации из смеси ацетон-метанол получили чистую 6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил) фуро[2,3-b]пиридин-5-карбоновую кислоту, т.пл. 237-244оС.
П р и м е р 39. Получение 6-(4-изопропиил-4-метил-5-оксо-2-имидазолин-2-ил)-3- нитрофуро[2,3-b]пиридин-5-карбоновой кислоты.

Нитрилгексафторфосфат (0,75 г, 0,00391 моль) добавили в суспензию 6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2- ил)фуро[2,3-b] пиридин-5-карбоновой кислоты (1, 07 г, 0,00355 моль) в сульфолане (63 мл) в атмосфере азота. Температуру реакционной смеси поддерживали в интервале 64-85оС в течение трех дней, в течение которых растворилось твердое вещество. Смесь охладили до 30оС и хроматографировали на силикагеле. Элюированием смесью 1:1 гексан-этилацетат удалили сульфолан. Затем осуществили элюирование 1-10% раствора метанола в метиленхлориде и рекристаллизацию из смеси ацетон-гексан, получили 6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)-3-нитрофуро[2,3-b]пири- дин-5-карбоновую кислоту, т.пл. 220-237оС.
П р и м е р 40. Получение 2-изопропил-2-метил-5Н-фуро[2,3-b] имидазо [2',1';5,1]пирроло[3,4-e]пиридин-3 (2Н), 5-диона.

В суспензию 6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)фуро [2,3-b] пиридин-5-карбоновой кислоты (11,7 г, 0,039 моль) в 100 мл диметоксиэтана (ДМЭ) добавили 7,3 мл уксусного ангидрида и 3,9 мл пиридина. Смесь перемешивали в течение 24 ч при комнатной температуре, твердые частицы отфильтровали, промыли простым диэтиловым эфиром, маточную жидкость сконцентрировали, добавив ксилол, чтобы способствовать удалению пиридина. Остаток растерли с простым диэтиловым эфиром, получили твердое вещество, которое объединили с твердым веществом, полученным на первой стадии, и получили 11,1 г (100% ) продукта. После рекристаллизации из смеси 2:1 этилацетат-гексан получили образец с т.пл. 193-205оС.
П р и м е р 41. Получение метил-6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)-фуро [2,3-b]пиридин-5-карбоксилата.

Соединение, полученное в примере 40 (10,5 г, 0,037 моль) суспендировали в 150 мл абсолютного метанола и в смесь добавили 4,0 г метилата натрия. Смесь перемешивали при комнатной температуре в течение 72 ч и затем вылили на лед, содержащий уксусную кислоту для поддержания рН 3-4. Образовалось твердое вещество белого цвета, его отфильтровали и получили 9,8 г (84%) указанного в названии продукта с т.пл. 134-137оС.
П р и м е р 42. Получение метил-3-хлоро-6-(4-изопропил-4-метил-5-оксо-2-имидазо- лин-2-ил)фуро [2,3-b]пиридин-5-карбоксилата.

Метиловый эфир, описанный в примере 40, растворили (1,4 г, 4,4 моль) в 20 мл уксусной кислоты и добавили ацетат натрия (1,0 г, 12,2 моль). Через смесь пропускали газообразный хлор, этот раствор перемешивали в течение 2 ч и за это время температура повысилась до 40оС. Смесь охладили, вылили в 50 г льда, экстрагировали этилацетатом, промыли дистиллированной водой и затем насыщенным раствором карбоната натрия. Затем органический слой сконцентрировали до пены, повторно растворили в 20 мл метиленхлорида и обработали 10 мл диазабицикло[5.4.0]ундец-5-ена (ДБУ). Через 10 мин смесь обработали 20 мл холодной соляной кислоты. Метиленхлоридный слой удалили, обезводили над безводным сульфатом магния. Затем смесь пропустили через четвертьдюймовую колонку с силикагелем и сконцентрировали в вакууме. После рекристаллизации из смеси гексан-этилацетат получили 0,85 г (57%) 3-хлоросоединения с т.пл. 150-156оС.
П р и м е р 43. Получение 3-хлоро-6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2- ил)фуро [2,3-b]пиридин-5-карбоновой кислоты.


Эфир, полученный в примере 42 (0,55 г, 1,157 ммоль) растворили в 10 мл 95% -ного этанола и добавили 0,28 г 50%-ного раствора гидроокиси натрия. Через 1 ч смесь обработали 10%-ной соляной кислотой до получения рН 2 и отделили продукт в виде твердого вещества, которое отфильтровали, обезводили, рекристаллизовали из ацетона и получили 0,35 г (67,3%) целевого соединения с т.пл. 239-240о С.
П р и м е р 44. Получение (+) -6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил) фуро [2,3-b]пиридин-5-карбоновой кислоты.

(+)-изомер
Ангидрид фуро [2,3-b] пиридин-5,6-дикарбоновой кислоты (2,50 г, 0,013 моль) суспендировали в 40 мл безводного ТГФ и к смеси добавили (+) -2-амино-2,3-диметилбутирамид (1,72 г, 0,013 моль). Смесь перемешивали в атмосфере азота при комнатной температуре в течение 16 ч. Раствор влили в 150 мл безводного простого диэтилового эфира и собрали полученное твердое вещество (выход сырого продукта 88,6%). Неочищенный аддукт превратили в указанное в названии соединение по способу, описанному в примере 38 для рацемической смеси. (+) -изомер рекристаллизовали из абсолютного этанола и изолировали из аддукта (выход 27,0%), т.пл. 244-245оС, ( α) 44,5о.
П р и м е р 45. Получение 6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)фу- ро [2, 3-b]пиридин-5-карбоксилата натрия.

NaOH (0,13 г, 0,0033 моль) растворили в 50 мл безводного метанола в атмосфере азота. Добавили свободную карбоновую кислоту (1,00 г, 0, 0033 моль) и получили раствор желтого цвета. Растворитель отогнали в вакууме и получили масло желтого цвета. Масло растворили в безводном этаноле, растворитель отогнали в вакууме и получили твердое вещество. Твердое вещество растворили в безводном этаноле, повторно осадили безводным простым этиловым эфиром и получили указанную в названии натриевую соль (0,60 г, 56,1%) в виде твердого вещества желтого цвета, т.пл. 240- >250оС.
П р и м е р 46. Получение 6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)фу- ро [2,3-b]пиридин-5-карбоксилата, соединения с изопропиламином (1: 1).


Изопропиламин (0,25 мл, 0,00266 моль) добавили в суспензию карбоновой кислоты (0,80 г, 0,00266 мл) и метанола (50 мл). Реакционную смесь перемешивали при комнатной температуре в течение получаса, и за это время все твердые частицы растворились. Растворитель отогнали в вакууме, остаток суспендировали в простом диэтиловом эфире, профильтровали и получили изопропиламиновую соль с выходом 78,1% т.пл. 100-220оС, которая медленно разлагается.
П р и м е р 47. Получение имидазолин-2-ил-тиено- и фуропиридинов.
По описанным в предыдущих примерах методикам, используя соответствующие тиено- или фуро[3,2-b]пиридины или тиено- или
фуро[2,3-b]пиридины, получили следующие соединения:






S H H CH3 215-217
S H H H 220-223,5
(разложение)
S H H -CH2C≡C 188-189,5
S H H


S H H -CH
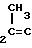
S CH3 H H 225,5-227,5
S H Br H 274-276
S H Cl H 266-267
O H H H 237-244
S H NO2 CH3 201-202,5
S H NO2 H 260 (разложение)
S Cl Cl H
S H N(CH3)2 H
S H SC6H5 H
S H SCH3 H
S H OCH3 H
S H OCHF2 H
S CH3 CH3 H
S H CN H
O H Cl H 239-240
O H H CH3 134-137
O H Br H 239-245
O CH3 H H 174-177
O C2H5 H H 170-172
O C6H5 H H 244-245
S Cl H H 268 (разложение)
O H C CH3 137-141
S H CH3 H 255-257
S -(CH2)4- H 234-237
O H CF3 H
O H SC6H5 H
O H H


O H H -CH2C ≡ CH 150-156
S Cl H +NH3-CH(CH3)2 Анализ на
содержание
S и Cl
S H SO2N(CH3)2 H
S C6H5 H H
S -(CH2)3- H
S -(CH)4- H
S H C6H5 H
S H OC6 H5 H
S CF3 H H
S C2H5 H H
S H C2H5 H
S H I H
S H F H
S H CHO H
S H CH2Cl H
S H CF3 H
O H NO2 H 220-237 (разложение)
O H N(CH3)2 H
O H SCH3 H
O H OCH3 H
O Cl H H
O Cl Cl H
O H CH3 H
O CH3 CH3 H
O H OCHF2 H
O Н CN H
O H SO2 N(CH3)2 H
O -(CH2)4- H
O -(CH2)3- H
O -(CH)4- H
O H C6H5 H
O H OC6H5 H
O CF3 H H
O H C2H5 H
O H I H
O H F H
O H CHO H
O H CH2Cl H
Таким же образом, как описано для фуро[2,3-b]пиридинового соединения, получили 6-(4-изопропил-4-метил-5-тиоксо-2-имидазолин-2-ил)-тиено [2,3-b] пиридин-5-карбоновую кислоту с выходом 37% и т.пл. 242оС.
П р и м е р 48. Получение 6-(4-изопропил-4-метил-5-тиено-2-имидазолин-2-ил-фу- ро [2,3-b]пиридин-5-карбоновой кислоты.

Ангидрид фуро[2,3-b] пиридин-5,6-дикарбоновой кислоты (1,35 г, 0,0071 моль) суспендировали в 25 мл безводного ТГФ и добавили 2-амино-2,3-диметилтиобутирамид (1,04 г, 0,0071 моль). Смесь перемешивали в атмосфере азота при комнатной температуре в течение 3 ч. Суспендированное твердое вещество собрали и фильтрат перегнали до получения твердого вещества. Общий выход составил 2,30 г (96,2% ). Обе порции твердого вещества поместили вместе в раствор КОН (1,91 г, 0,034 моль) в 20 мл воды. Раствор нагревали при температуре 60оС в течение 4 ч, затем перемешивали при комнатной температуре в течение 16 ч. Несколько мутноватый раствор профильтровали, получили прозрачный фильтрат, который подкислили до рН 4 с помощью 10% HCl. Полученное твердое вещество желтого цвета собрали и нагревали при температуре дефлегмации в 100 мл ксилола в течение 16 ч. Указанное в названии соединение получили путем кристаллизации из раствора ксилола, выход 28,0% т.пл. 231-232оС с разложением.
П р и м е р 49. Получение 2,
3-дигидро-6-(4-изопропил-4-метил-5-оксо-2-имидазолин -2-ил) фуро[2,3-b]пиридин-5-карбоновой кислоты

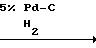
Раствор 6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)фуро [2,3-b] пиридин-5,6-карбоновой кислоты (1,7 г, 0,056 моль) и 1,0 г (0,0072 моль) карбоната калия в 200 мл 9:1 смеси этанол вода добавили к 100 мг 5%-ного палладиевого на активированном угле катализатора в 500 мл толстостенную склянку для реакций под давлением. Склянку подсоединили к аппарату Парра для гидрогенизации, довели давление до 30 фунтов на кв.дюйм с помощью водорода и затем встряхивали при комнатной температуре в течение 10 ч. Катализатор удалили с помощью фильтрования через стеклянную воронку со спеченным фильтром и фильтрат сконцентрировали в вакууме до объема 10 мл. После подкисления остатка до рН 2 получили осадок белого цвета, который удалили фильтрованием, промыли водой, высушили на воздухе и получили 1,0 г (63%) 2,3-дигидро-6-(4-изопропил-4-метил-5-оксо- 2-имидазолин-2-ил)фуро [2,3-b]пиридин-5-карбоновой кислоты в виде твердого вещества неправильного белого цвета, т.пл. 189-192оС.
По описанной методике раствоp 5-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)фуро[3,2-b] пиридина (400 мг) можно превратить в 2,3-дигидро-5-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)фуро [3,2-b]пиридин-6-карбоновую кислоту, т.пл. 205-206оС.
П р и м е р 50. Получение 4-меркаптоацетилбутиронитрила.
CH


Тиолуксусную кислоту (49 мл, 0,69 моль) добавили в карбонат калия (93,4 г, 0,68 моль), растворенный в воде (150 мл). Затем добавили этанол (260 мл) и 4-бромбутиронитрил при температуре 15-28оС и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Полученное неорганическое твердое вещество отфильтровали и фильтрат экстрагировали толуолом. Органический слой отделили, обезводили над безводным Na2SO4, сконцентрировали и получили желаемый 4-меркаптоацетилбутиронитрил в виде масла желтого цвета.
П р и м е р 51. Получение дигидротиофенимина гидрохлорида.
CH3-



Хлористый водород ввели в охлажденный раствор нитрила в метаноле (220 мл) в течение 1 ч и затем смесь перемешивали при комнатной температуре в течение 16 ч. Полученный продукт отфильтровали, промыли простым диэтиловым эфиром, высушили и получили 55,38 г дигидротиофенимина гидрохлорида, т.пл. 189-195оС.
П р и м е р 52. Получение диметил[(тетрагидро-2-тиенилиден)амино]фумарата (и малеата).




Диметилацетилендикарбоксилат (0,45 мл, 0,037 моль) добавили в перемешиваемый раствор дигидротиофенимина гидрохлорида (0,5 г, 0,0036 моль) в метаноле (60 мл), содержащий ацетат натрия (0,3 г, 0,0036 моль) в атмосфере азота при температуре -15оС. Раствор перемешивали в течение 16 ч при комнатной температуре, затем в роторном испарителе удалили растворитель, и полученную смесь разделили с помощью колоночной хроматографии на силикагеле, использовав в качестве элюента смесь метиленхлорид-ацетонитрил (19:1), получили 0,68 г (78% выход) желаемой смеси изомеров эфиров кислот в виде масла желтого цвета.
П р и м е р 53. Получение диметил-2,3-дигидротиено[2,3-b]пиридин-5,6-дикарбо- ксилата




Реактив Вильсмейера приготовили, добавив оксалилхлорид (0,25 мл, 0,0028 моль) в перемешиваемый раствор ДМФ (0,22 мл, 0,0028 моль) в 1,2-дихлорэтане (50 мл) при комнатной температуре и в инертной атмосфере азота. Раствор в 1, 2-дихлорэтане (50 мл) диметил[(-тетрагидро-2-тиенилидин)амино]фумара (и малеата) (0,0028 моль) добавили в реактив Вильсмейера, и реакционную смесь нагревали при температуре дефлегмации в течение 4 ч. Реакционную смесь погасили водой, подщелочили с помощью бикарбоната натрия, органический слой отделили и обезводили над безводным сульфатом натрия. Растворитель отогнали в вакууме и остаток хроматографировали на силикагеле, используя в качестве элюента смесь метиленхлорид-ацетонитрил (19: 1). После кристаллизации из смеси толуол-гексан получили диметил-2,3-дигидротиено [2,3-b]пиридин-5, 6-дикарбоксилат в виде твердого вещества белого цвета с т.пл. 102-103оС.
П р и м е р 54. Получение 2,3-дигидро-6-(5-изопропил-5-метил-4-оксо-2-имидазо- лин-2-ил) тиено[2, 3-b]пиридин-5-карбоновой кислоты 1-оксида.


Мета-хлорнадбензойную кислоту (2,0 г, 0,0094 моль) добавили в раствор дигидротиенопиридина в смеси метиленхлорида (400 мл) и метанола (40 мл) при температуре 0оС в атмосфере азота. Раствор перемешивали в течение 16 ч, поддерживая температуру 18оС, добавили 100 мл воды и 100 мл насыщенного раствора NaHCO3. Водный слой отделили и промыли метиленхлоридом. Смесь подкислили концентрированной HCl, в осадок выпала мета-хлорбензойная кислота, которую удалили фильтрованием, затем рН водного слоя подработали до 1. После экстрагирования этого подкисленного слоя из метиленхлорида и удаления растворителя получили указанный в названии продукт в виде твердого белого вещества с т.пл. 216-218оС с разложением.
П р и м е р 55. Получение диэтилдигидротиено [3,2-b]пиридин-5,6-дикарбоксилата.

В раствор тетрагидротиофен-3-она Maybridge Chem. Со; 20,0 г, 0,196 моль) в бензоле (100 мл), перемешиваемый при комнатной температуре, добавили пиперидин (16,7 г, 0,196 моль) и п-толуолсульфокислоты моногидрат (0,20 г, 0,001 моль). Смесь нагревали при температуре дефлегмации с ловушкой Дина-Старка в течение 4 ч, охладили и отогнали, получив темно-коричневое масло, представляющее собой смесь 1:1 2,3- и 2,5-дигидротиофененамино (I и II, Recl. Trav. Chim.

П р и м е р 56. Получение диэтил-5,7-дигидротиено [3, 4-b]пиридин-2,3-дикарбоксилата и диэтил-2,3-дигидрофуро [3,2-b]пиридин-5,6-дикарбоксилата.

В раствор тетрагидрофуран-3-она (J.Pharm. Sci. 59, 1678 (1970); 46,55 г, 0,540 моль) в бензоле (250 мл), перемешиваемый при комнатной температуре, добавили пиперидин (45,98 г, 0,540 моль) и п-толуолсульфокислоты моногидрат (0,46 г, 0,002 моль). Смесь нагревали при температуре дефлегмации с ловушкой Дина-Старка в течение 4 ч, охладили, отогнали до получения темно-коричневого масла, представляющего собой смесь 1:1 2,3- и 2,5-дигидротиофененаминов. Затем в смесь добавили этанол (500 мл) и диэтилэтоксиметиленоксалацетокарбоксилат (178,79 г, 1,35 моль) и продолжали перемешивать в течение 45 мин. Затем добавили ацетат аммония (124,87 г, 1,62 моль) и смесь нагревали при температуре дефлегмации в течение 45 мин. Смесь охладили, растворители отогнали и желтый маслянистый диэтилдигидрофуро[3,2-b]пиридин-5,6-карбоксилат подвергли очистке с помощью хроматографии на силикагеле, использовав в качестве элюента гексанэтилацетат. На масс-спектрограмме максимальный пик (m+1/2) имеется при 266.
П р и м е р 57. Получение 2,3-дигидро-5 и 6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)фуро- и тиено[2,3-b] и [3,2-b]пиридинов.
По
методикам,
описанным в примерах 8,10,12,15,18,27,35,36,37,38,49,53,54,55 и 56, получили следующие дигидросоединения:




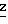



S H H H H H 224-227

O H H H H H 189-192
O H H CH3 CH3 H 193-198
O H H HO H H 170-173
O H H CH3O H H 140-143




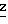



S H H H H H 239-241
O H H H H H 205-206






S H H H 242-244
S H Cl H 238-239
S H Br H 226-227
S H H


O H H H 214-223
S Cl H H 266-267
O H Cl H
O H CH3 H
O CH3 H H
O C2H5 H H
O H C2H5 H
O CH3 CH3 H
S H CN H
S H CH3 H
S CH3 H H
S CH3 CH3 H
S H NO2 H
S H N(CH3)2 H
S H SCH3 H
S H OCH3 H
S H OCHF2 H
S Cl Cl H
S H SO2N(CH3)2 H
S C6H5 H H
S H C6H5 H
S -(CH2)3- H
S -(CH2)4 H
S -(CH)4- H
S H OC6H5 H
S CF3 H H
S C2H5 H H
S H C2H5 H
S H I H
S H F H
S H CHO H
S H CH2Cl H
S H CF3 H
S H SC6H5 H
П р и м е р 58. Оценка гербицидной активности испытываемых соединений при послевсходовой обработке.
Послевсходовая гербицидная активность предлагаемых соединений продемонстрирована с помощью следующих тестов, в которых целый ряд однодольных и двудольных растений обрабатывали испытываемыми соединениями, диспергированными в водных ацетоновых смесях. В опытах рассаду растений выращивали в ящиках для выгонки рассады в течение двух недель. Испытываемые соединения диспергировали в смеси 50:50 ацетон-вода, содержащий 0,5% TWEEN

Система оценки отличия в
росте от контроль-
ной группы
0 эффект отсутствует 0
1 возможен эффект 1-10
2 слабый эффект 11-25
3 средний эффект 26-40
4 ненормальный рост,
что
означает определенную фи-
зиологическую недоразви-
тость, но общий эффект слабее,
чем при оценке 5
5 определенные повреждения
41-60
6
гербицидный эффект 61-75
7 хороший гербицидный эффект 76-90
8 граничит с полным уничтожением 91-99
9 полное уничтожение 100
В большинстве случаев
данные приведены
для одного испытания, но в некоторых случаях они представляют собой среднюю величину по данным более одного испытания.
Использованные виды растений
1
Ежовник (Echinochloa
crusgalli)
2 Щетинник зеленый (Setaria viridis)
3 Осока (Cyperus rotundus L.)
4 Овсюг (Avena fatua)
5 Свинорой (Agropyron repes)
6
Вьюнок полевой
(Convolvulus arvensis L.)
7 Дурнишник (Xanthium pensylvanicum)
8 Ипомея (Ipomoea purpurea)
9 Амброзия (Ambrosia artemisufolia)
10 Канатник Теофраста
(Abutilon
theophrasti)
11 Ячмень двухрядный (Hordeum vulgare)
12 Кукуруза, маис (Zea mays)
13 Рис (Oryza sativa)
14 Соя культурная (Glycine max)
15
Подсолнечник
(Helianthus annus)
16 Пшеница (Triticum aestivum)
П р и м е р 59. Оценка гербицидной активности испытываемых соединений при довсходовой обработке.
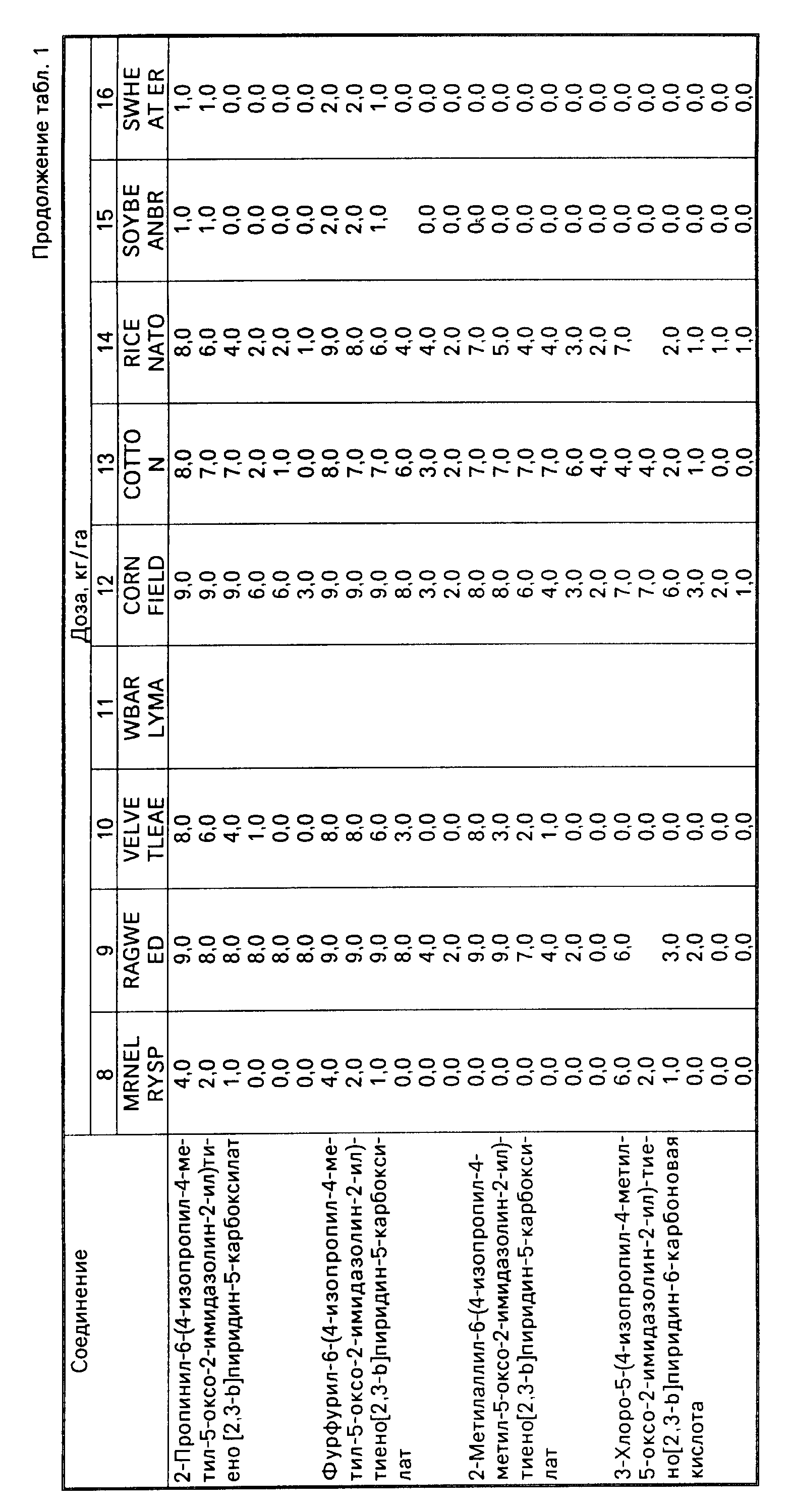
Довсходовая гербицидная активность предлагаемых соединений представлена следующими испытаниями, в которых семена различных одно- и двудольных растений отдельно смешали с почвой для перегнойных горшочков и рассадили на глубину 1 дюйм в отдельные горшочки. После посадки горшочки опрыскали выбранным водно-ацетоновым раствором, содержащим испытываемое соединение в количестве, достаточном для получения эквивалента дозе 0,016-10 кг/га испытываемого соединения на каждый горшок. Обработанные горшочки поместили в теплицу, поливали и ухаживали за ними как обычно. Через 4-5 недель после обработки каждый горшочек осмотрели и оценили по системе, приведенной выше. Гербицидная активность активных ингредиентов изобретения очевидна из результатов испытаний, которые приведены в табл.2. Если для данного соединения проводилось более одного испытания, то приведены средние данные.
Основное название Общее название Научное название
Bornyarolgr Куриное просо
Echinochloa orus-galli
(L) Bear
Bermudagrs Бермудская трава Cynodon Dactylon (L) Pers
Lorhe сrab Росичка кровяная Digitaria Sougninalis (L) Scop
Foxtail sp Лисохвост spp
Setaria spp
Giant
Fox Лисохвост великан Setaria Faberi, HERR4
Green Fox Лисохвост зеленый Setaria viridis (L) Brady
Yellow Fox Лисохвост желтый Setaria Lutescens
(Weige/HUBB)
Johngrs Pr
Джонсонова трава S.Orghum Balepense (Prizames)
(из Ризом)
Millet Pros Просо культурное Panicum Miliacum, L
P.Nutsedgl Осока пурпурная
Cyperus Protundus, L.
Y.Nutsedgl Осока желтая Cyperus Esculantus, L.
Wild Oatd Овсюг Avena Fatua, L.
Anackgrass Пырей ползучий Agrapyron Repens (L).
Beary
Fed BINDWD Вьюнок
полевой Convelsulus arvensis, L.
Nts Had Red Паслен красный Solanum Dulcamara
Шкала оценки гербицида
Результаты исследования
гербицида выражаются в шкале оценки (0
9). Шкала основана на визуальном наблюдении травостоя, силы растений, неправильного формирования, размера, хлороза и общего вида растений по сравнению с
контрольным растением.
Шкала
оценки Значение подавления в сравнении с контрольным
растением
9 Полное уничтожение 100
8 Приближение к полному 91-99
уничтожению
7 Хорошее гербицидное
80-90
действие
6 Гербицидное действие 65-79
5 Определенная степень 45-64
повреждения
4 Повреждение 30-44
3 Умеренное действие 16-29
2
Слабое действие 6-15
1 Следы действия 1-5
0 Отсутствие действия 0
Реферат
Использование: сельское хозяйство, химическое средство защиты растений. Сущность изобретения: производные (2-имидазалин-2-ил)-тиено или фуро [3, 2-b] пиридин, ф-лы I, указанное в тексте описания, в которой

метилфурил, С3-С4-алкил, С3-С4-алкинил, NH3CH3(CH3)2, B-водород, W-кислород, сера или > S=O, Y-водород, С1-С4-алкил, галоген, фенил, Y′ - водород, Z-водород, С1-С4-алкил, гидрокси, нитрогруппа, С1-С4-алкокси, Z′ - водород, метил. Y и Z могут совместно образовать кольцо, включающее цепочку -(CH2)4- и когда R1 - R2 неодинаковы их оптические изомеры, за исключением случая, когда R3-солеобразующий катион, гербицидная композиция на их основе и игредиенты для их получения. 5 с. п. ф-лы, 2 табл.
Формула


где

R1 и R2 С1 С4-алкил;
А СО2R3, где R3 водород, С1 С4-алкил, метилфурил, С3 С4-алкил, С3 С4-алкинил,

В водород;
W кислород;
Х кислород, сера или >S 0;
Y водород, С1 С4-алкил, галоген, фенил;
Y′ водород;
Z водород, С1 С4-алкил, гидрокси, нитрогруппа, С1 - С4-алкокси;
Z′ водород, метил,
или Y и Z могут совместно образовать кольцо, включающее цепочку -(СН2)4-, и когда R1 и R2 неодинаковы, их оптические изомеры, за исключением случая, когда R3 является солеобразующим катионом, проявляющие гербицидное действие.
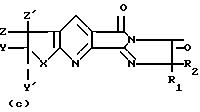

где

R1 и R2 С1 С4-алкил;
Х кислород, сера или >S 0;
Y водород, С1 С4-алкил, галоген, фенил;
Y′ водород;
Z водород, С1 С4-алкил, гидрокси, нитрогруппа, С1 - С4-алкокси;
Z′ водород, метил;
или Y и Z могут совместно образовать кольцо, включающее цепочку -(СН2)4-, и когда R1 и R2 неодинаковы, их оптические изомеры,
и кислотно-аддитивные соли в качестве промежуточных соединений для получения соединений общей формулы I(а) и (в).


где R3 водород, С1 С4-алкил, метилфурил, С3 - С4-алкил, С3 С4-алкинил,

W кислород;

R1 и R2 С1 С4-алкил;
Х кислород, сера или >S 0;
Y водород, С1 С4-алкил, галоген, фенил;
Y′ водород;
Z водород, С1 С4-алкил, гидрокси, нитрогруппа, С1 - С4-алкокси;
Z′ водород, метил,
или Y и Z могут совместно образовать кольцо, включающее цепочку -(СН2)4-, и когда R1 и R2 неодинаковы, их оптические изомеры,
и кислотно-аддитивные соли в качестве промежуточных соединений для получения соединения общей формулы II(с) и (d) по п.3.


где R метил или этил;
Х кислород, сера или >S 0;
Y водород, С1 С4-алкил, галоген, фенил;
Y′ водород;
Z водород, С1 С4-алкил, гидрокси, нитрогруппа;
С1 С4-алкокси;
Z′ водород, метил,
или Y и Z могут совместно образовать кольцо, включающее цепочку -(СН2)4-, и их оптические изомеры,
и кислотно-аддитивные соли в качестве промежуточных соединений для получения соединений общей формулы III(е) и (f) по п.4.

Комментарии