Способ получения авермектина и штаммы streptomyces avermitilis - продуценты авермектина - RU2096462C1
Код документа: RU2096462C1
Чертежи




Описание
Настоящее изобретение относится к штаммам Streptomyces avermitilis, испытывающим недостаток в активности трансаминазы аминокислот с разветвленной цепью и/или активности дегидрогеназы 2-оксокислот с разветвленной цепью, к способам получения упомянутых S. avermitilis, а также к использованию S. avermitilis для получения натуральных и ненатуральных авермектинов.
Патенты США N 4310519 и N 4429042 описывают авермектины, комплекс родственных агентов, проявляющих сильную противопаразитарную активность, и их получение путем аэробного брожения штаммов Streptomyces avermitilis, а именно NN Американской Коллекции Типовых Культур (NN ATCC) 31267, 31271 и 31272 S. avermitilis. Два последних штамма представляют культуру соответственно в замороженной пробирке и лиофилизированной пробирке, полученную облучением ультрафиолетовыми лучами S. avermitilis ATCC 31267.
Заявка на Европатент N 214731, опубликованная 18 марта 1987 года, являющаяся двойником заявки на патент США N 886867, поданной 16 июля 1986 года, раскрывает ряд соединений (упоминаемых здесь как ненатуральные авермектины), относящихся к натуральным или известным авермектинам, однако имеющих новую замещающую группу в положении 25, и способ их получения путем ферментации авермектин-продуцирующего организма в присутствии определенных карбоновых кислот, или их производных, или предшественников. Микроорганизмами S. avermitilis используемыми для получения указанных новых C-25-замещенных авермектинов, являются ATCC 31267, 31271, 31272 и N CIB 12121 S. avermitilis. Последний микроорганизм, описанный в заявке на Европатент N 214731, происходит от АТСС 31271 S. avermitilis. Он приводит к получению повышенных выходов новых C-25-замещенных авермектинов, когда его выращивают в полусинтетической солевой среде. Каждый из ATCC 31267, 31271, 31272 и N CIB 12121 может также продуцировать, кроме нового C-25-замещенного производного, различные количества известных, или натуральных, авермектинов, в которых 25-заместитель представляет собой изопропил или /S/-втор-бутил (1-метил-пропил).
Углеродный скелет авермектинов (изображенный в формуле (I) ниже) происходит от ацетатов и пропионатов, а
C-25-заместитель натуральных авермектинов от L-изолейцина (R /S/-втор-бутил) или L-валина (R изопропил) [Fisher и Mrozik, "Macrolide Antibiotics" Academic Press /1984/, глава 14]
Под
"известными" или "натуральными" авермектинами подразумеваются те авермектины, продуцируемые ATCC 31267, ATCC 31271 и ATCC 31272 S. avermitilis в которых заместитель в положении 25 представляет собой
или изопропил, или /S/-вторбутил (1-метилпропил). Авермектины, в которых заместителем в положении 25 является другой, нежели изопропил или вторбутил (S форма), относятся в настоящем описании к новым
или ненатуральным авермектинам.
Штаммы S. avermitilis приведенные в вышеупомянутых патентах США, продуцируют класс веществ, описываемый здесь как C-076. Класс включает восемь различных, но тесно связанных соединений, описываемых как C-076 A1a, A1b, A2a, A2b, B1a, B1b, B2a и B2b. Ряд "a" соединений относится к натуральным авермектинам, в которых 25-заместитель представляет собой /S/-втор-бутил, и ряд "b" относится к тем соединениям, в которых 25-заместитель представляет собой изопропил. Обозначения "A" и "B" относятся к авермектинам, в которых 5-заместителем являются метокси или гидрокси соответственно. Наконец, цифра "1" относится к авермектинам, в которых двойная связь присутствует в положении 22-23, и цифра "2" относится к авермектинам, в которых в положении 22 присутствует водород, а в положении 23 присутствует гидрокси.
В настоящей заявке ни один такой идентификатор не используется относительно 25-заместителя ненатуральных авермектинов. Идентификаторы A1, A2, B1 и B2 сохранены в отношении ненатуральных авермектинов, имеющих структурные признаки, соответствующие этим признакам натуральных авермектинов, как указано выше.
Поколение мутантов, лишенное активности дегидрогеназы альфа-кетокислот с разветвленной цепью, изложено для Bacillus subtilis, Willecke Pardee, J.Biol.Chem. 246, с. 5264 5272 (1971) и Pseudomonas putida, Martin и др. J.Bacteriology 115, с. 198 204 (1973), однако не для Streptomyces. Agly-1. S. avermitilis мутантный штамм, который продуцирует фактически только агликоны авермектина A1a и A2a, изложен Shulman и др. J.Antibiot 38 (11), стр. 1494 - 1498 (1985). Также изложена ферментация Agly-1 S. avermitilis в присутствии синефунгина, который вызывает возросший выход компонентов агликона B-авермектина. Аналогично, 08 S. avermitilis, высокопродуцирующий штамм для авермектинов при брожении в присутствии синефунгина в качестве ингибитора O-метилтрансфераз, приводит к получению авермектинов, лишенных O-метильных групп на агликоне у C-5 и в части дисахарида олеандрозы.
Патент США N 4378353 раскрывает соединения, связанные с C-076, и их получение культивированием MA-5218, мутантного штамма ATCC 31272 S. avermitilis полученного из него ультрафиолетовым облучением. Мутант идентифицирован как ATCC 31780. Соединения, связанные с C-076, которые получены указанным мутантом, лишены фуранового кольца C-076. Кроме того, в некоторых из описанных соединений одна или обе половины олеандрозного сахара отщеплены, тогда как в других группа в положении 5 окислена до кето-группы.
Три класса мутантов O-метилтрансферазы S. avermitilis, которые продуцируют авермектины, лишенные O-метильных групп, изложены Руби и др. 6-й Международный Симпозиум по "Биологии актиномицетов", Дебрецен, Венгрия, август, 26 30, (1985) и Шулманом и др. Противомикробные агенты и химиотерапия, 31, с. 744 747 (1987). Первый класс продуцирует главным образом авермектины вследствие их неспособности метилировать гидроксил C-5 макроциклического лактонного кольца. Второй класс продуцирует 3'-O,3''-O-бис-деметилавермектины (авермектины, лишенные O-метильного заместителя в положении 3 обоих остатков моносахарида олеандрозы), которые упоминаются как деметилавермектины. Третий класс неспособен метилировать в любом положении.
Шульман и др. Fed.Proc. 44, с. 931 (1985), раскрывают повышенное получение авермектинов B путем ферментации S. avermitilis в присутствии таких веществ, как синефунгин, S-аденозилтионин и S-аденозилгомоцистеин, которые ингибируют метилирование C-5 гидроксигруппы половины агликона посредством фермента вермектин B-O-метилтрансферазы. Мутанты Streptomyces avermitilis, которые испытывают недостаток в активности O-метилтрансферазы и продуцируют повышенные количества компонентов B-авермектина, также раскрыты и упоминаются в работе Шульмана и др. Противомикробные агенты и химиотерапия, 29, с. 620 624 (1986).
Мутагенез S. avermitilis продуцирует мутанты, которые лишены активности дегидрогеназы 2-оксокислоты с разветвленной цепью или активности трансаминазы аминокислоты с разветвленной цепью. Мутагенез полученных таким образом мутантов, защищенных простой связью, приводит к получению мутантов, лишенных как активности дегидрогеназы 2-оксокислот с разветвленной цепью, так и активности трансаминазы аминокислот с разветвленной цепью. Мутанты больше не обладают способностью продуцировать значительные количества натуральных авермектинов в отсутствие добавляемого соединения RCOOH, в котором R обозначает изопропил или /S/ втор-бутил, или соединения, конвертируемого в RCOOH в течение процесса ферментации. Удивительно и неожиданно, однако, то, что мутанты, как обнаружено, продуцируют авермектины, натуральные и ненатуральные, во время брожения в присутствии добавляемого соединения R-COOH, где R обозначает изопропил или /S/-втор-бутил, или другой раскрываемой здесь группы, или предшественника для указанной группы RCOOH. И даже более удивительно то, что описываемые здесь мутанты, лишенные только активности дегидрогеназы 2-оксокислот с разветвленной цепью и не способные разрушать L-изолейцин или L-валин, способны осуществлять ассимиляцию широкого круга соединений в биосинтетический путь обмена авермектина с получением ненатуральных авермектинов, свободных от присутствия натуральных авермектинов.
По меньшей мере, удивительно обнаружение того, что описываемые здесь мутанты, лишенные активности трансаминазы аминокислот с разветвленной цепью, которые не способны разрушать L-изолейцин, L-лейцин или L-валин и нуждаются в этих трех аминокислотах с тем, чтобы расти, также способны ассимилировать другие соединения с получением ненатуральных авермектинов, свободных от присутствия натуральных авермектинов.
Натуральные авермектины, как указано, продуцируются в виде сложной смеси восьми различных, но тесно связанных соединений; формула (I), R изопропил и /S/ втор-бутил. Несмотря на то, что они восстановлены по существу в чистом виде (см. патент США N 4429042), методология является в лучшем случае трудоемкой. Получение ненатуральных авермектинов в соответствии со способом, описанным в заявке на Европатент N 214731, может также привести к получению некоторых натуральных авермектинов в различных количествах, благодаря присутствию дегидрогеназы 2-оксокислоты с разветвленной цепью и аминокислот L-валин и L-изолейцин в клетке микроорганизмов S. avermitilis, используемых при их получении.
Желаемой целью является способность выбора продуцировать либо натуральные, либо ненатуральные авермектины с тем, чтобы свести до минимума количество и сложность продуктов, а тем самым повысить чистоту выбранного авермектина, а также упростить методики разделения.
Штаммы S. avermitilis, лишенные активности дегидрогеназы 2-оксокислот с разветвленной цепью или активности аминокислот с разветвленной цепью, продуцируют мутацией авермектин-продуцирующих штаммов S. avermitilis и, особенно мутацией ATCC 31267, ATCC 31271, ATCC 31272 или N CIB 12121 S. avermitilis. Дальнейшая мутация любого из указанных, лишенных активности штаммов приводит к получению штаммов, нуждающихся в обеих активностях. Мутанты не способны синтезировать натуральные авермектины, за исключением того случая, когда в среду, в которой бродят мутанты, добавляют жирную кислоту или ее предшественник, несущий изопропиловую или вторбутиловую /S-форма/ группу. Они способны продуцировать натуральные и ненатуральные авермектины при ферментации в водных аэробных условиях в питательной среде, содержащей подходящую праймерную кислоту или соединение, конвертируемое в нее, в процессе ферментации.
Те мутанты, которые отличаются отсутствием активности трансаминазы аминокислот, выбирают из мутагенизированных колоний на основании их неспособности расти на среде, которая испытывает недостаток L-изолейцина, L-лейцина и L-валина. На практике колонии, растущие на агаровой среде на основе глюкозы и солей M9, пополненной всеми индивидуальными аминокислотами, обнаруженными в казаминокислоте, переносят к сходной среде, которая, однако, не имеет L-изолейцин, L-лейцин и L-валин. Описанные здесь мутанты, которые лишены только активности трансаминазы аминокислот с разветвленной цепью, способны использовать 2-оксокислоты в качестве предшественников для получения авермектинов.
Было удивительно и неожиданно, что описываемые здесь мутанты, лишенные активности дегидрогеназы 2-оксокислот с разветвленной цепью и/или активности трансаминазы аминокислот с разветвленной цепью, сохраняли способность продуцировать авермектины, особенно ненатуральные авермектины. Неспособность мутантов продуцировать производные ацил-кофермента A жирных кислот, когда они растут на традиционной среде, могла стать летальной мутацией, если бы мутантная целостность зависела от указанных производных, или если бы накопление 2-оксокислоты под действием предшествующего мутанта приводила к цитотоксичности. Кроме того, ожидалось, что ни один из мутантов не был в состоянии синтезировать ацетил-КоА и пропионил-КоА из катаболизма L-изолейцина и L-валина, поскольку это требует наличия ферментативных активностей, которых лишены мутанты. Потребность в этих ацил-КоА-производных для биосинтеза авермектина, отмеченная выше, привела к ожиданию того, что мутанты могут быть серьезно повреждены при получении ненатурального авермектина, что, к удивлению, было не так.
Недостаток в активности дегидрогеназы 2-оксокислот с разветвленной цепью в мутантах, описываемых здесь, приводит к предотвращению ацил-КоА-синтеза жирных кислот с разветвленной цепью из деградации L-изолейцина, L-лейцина и L-валина и тем самым синтеза натуральных авермектинов. Аналогичным образом, мутанты S. avermitilis отрицательные к трансаминазе аминокислот с разветвленной цепью, также обладают этим отличительным недостатком ацил-КоА-синтеза жирных кислот с разветвленной цепью, а, следовательно, неспособностью продуцировать натуральные авермектины. Этот недостаток ацил-КоА жирных кислот обусловлен двумя причинами. Во-первых, такие трансаминазаотрицательные мутанты не способны синтезировать 2-оксокислоты с разветвленной цепью из питающихся в среде изолейцина, лейцина и валина посредством нормального пути трансаминирования. Во-вторых, в этих мутантах трансаминазы производство 2-оксокислот с разветвленной цепью посредством клеточного биосинтетического пути метаболизма аминокислот с разветвленной цепью предотвращено необходимостью включения этих аминокислот в сбраживаемую среду для выращивания. Присутствие этих аминокислот предотвращает функционирование этого биосинтетического пути обмена (и производство промежуточных 2-оксокислот) под действием хорошо известных механизмов репрессии ферментов и торможения по типу обратной связи этими аминокислотными конечными продуктами пути обмена. Неприемлемость этих 2-оксокислот, которые являются субстратами для активного фермента дегидрогеназы 2-оксокислот с разветвленной цепью, эффективно препятствует синтезу ацил-КоА жирных кислот с разветвленной цепью. Таким образом, настоящее изобретение охватывает использование таких 2-оксокислотных дегидрогеназаотрицательных и трансаминазаотрицательных мутантов, а также мутантов, в которых объединены мутации, негативные к трансаминазе кислот с разветвленной цепью, и мутации, негативные к дегидрогеназе 2-оксокислот.
Настоящее изобретение также включает любой организм, невзирая на его внешний вид или физиологическое поведение, который может развиваться под действием трансформации, трансдукции, генетической рекомбинации или какой-либо другой генетической методологии, с использованием нуклеиновой кислоты или эквивалентного вещества, из описываемых здесь видов, посредством чего он приобретает характеристики описываемых здесь мутантов.
Термины "авермектин" или "авермектины", как они используются здесь, относятся к соединениям формулы (I), приведенной ниже, но в которых заместитель в положении 25 (R) может быть любой группой, ассимилируемой в указанном положении S. avermitilis настоящего изобретения.
Описываемые здесь мутанты являются чрезвычайно ценными для продуцирования ненатуральных авермектинов при помощи способов, раскрытых и приведенных примерами в настоящей заявке. Они особенно ценны для производства предпочтительных авермектинов, то есть соединений, в которых заместителем C-25 является C4-C6-циклоалкил или циклоалкенил, необязательно замещенный C1-C4-алкильной группой; 1-метилтиоэтил, или 5 или 6-членная гетероциклическая группа кислорода или серы, главным образом 3-тиенил или 3-фурил.
Мутацию авермектин-продуцирующего члена вида Streptomyces avermitilis осуществляют в соответствии с известными методиками с использованием любого из целого ряда мутирующих агентов, включая облучение ультрафиолетовыми лучами, облучение рентгеновскими лучами, N-метил-N'-нитро-N-нитрозогуанидин, этилметансульфонат, азотистую кислоту и азотистую горчицу, например N-метилбис/2-хлорэтил/амин, или подобные обработки. Мутагенез можно осуществлять на спорах растительной культуры S. avermitilis, способной продуцировать натуральные авермектины, например, ATCC 31272 S. avermitilis.
Вслед за проведением методик, хорошо известных специалистам, мутагенизированные колонии отбирают на отсутствие дегидрогеназы 2-оксокислот с разветвленной цепью на основании метода биохимического анализа, который позволяет осуществить скрининг больших количеств беспорядочно мутагенизированных бактериальных колоний для производства14CO2 из [14C-1]-2-оксокислот (Tabor и др. J.Bact. 128, с. 485 486, 1976).
Методика включает выращивание мутантных колоний в углублении микротитровой чашки на пригодной питательной среде, смачивание клеток толуолом с последующим прибавлением [14C-1]-2-оксокислоты (например, 2-оксоизокапроновой кислоты) в каждое углубление и проверку атмосферы над брожением на14CO2. Альтернативно, [14C-1]-2-оксо-3-метилвалериановую кислоту или [14C-1] -2-оксо-3-метилмасляную кислоту можно использовать вместо [14C-1]-2-оксо-изокапроновой кислоты. Производство14CO2 удобно проверять, поместив влажную, Ba/OH/2-насыщенную фильтровальную бумагу над отдельными углублениями с тем, чтобы уловить любое количество высвободившегося14CO2 и обнаружить Ba14 CO3 если только такое соединение есть, при помощи авторадиографии. Мутанты, лишенные активности дегидрогеназы 2-оксокислот с разветвленной цепью, дают авторадиограммы приблизительно такие же, что и у слепых контрольных проб, то есть мутанты не продуцируют Ba14CO3.
Полученные таким образом мутанты подвергают дальнейшему мутагенезу с использованием любого из числа вышеупомянутых мутирующих агентов. Мутагенизированные колонии отбирают на недостаток активности трансаминазы аминокислот с разветвленной цепью на основе их неспособности расти на чашках с минимальной средой M9/глюкоза, за исключением как в присутствии L-изолейцина, L-лейцина и L-валина (ILV). Все три аминокислоты должны присутствовать для того, чтобы начался рост. Кроме того, продемонстрировано, что указанные трансаминазаотрицательные мутанты не растут на средах, пополненных всеми тремя кетокислотами, которые служат в качестве субстратов для реакций трансаминазы. Единственный фермент трансаминазы поэтому катализирует трансаминирование каждой из трех кетокислот /2-оксо-3-метилвалериановой кислоты, 2-оксоизокапроновой кислоты, 2-оксо-изовалериановой кислоты/.
Особый интерес представляют мутанты, защищенные двойной связью, то есть те, которые лишены и активности дегидрогеназы 2-оксокислот с разветвленной цепью, и активности трансаминазы аминокислот с разветвленной цепью, поскольку вероятность их ревертирования в культуры, которые продуцируют натуральные авермектины, крайне мала. Одноблокированные мутанты могут при определенных обстоятельствах проявлять атавистические признаки культур, которые могли бы продуцировать натуральные авермектины.
Кроме производства желаемых аллелей данного штамма микроорганизма путем мутагенеза протопластное слияние позволяет осуществлять интродукцию желаемых аллелей, полученных/идентифицированных в одном штамме, в хромосому другого штамма. Например, штамм S. avermitilis, лишенный активности дегидрогеназы 2-оксокислот с разветвленной цепью и активности трансаминазы аминокислот с разветвленной цепью, может посредством протопластного слияния со штаммов S. avermitilis, имеющим вышеупомянутые активности, продуцировать штамм S. avermitilis, лишенный только активности трансаминазы аминокислот с разветвленной цепью. Как может признать специалист, технология протопластного слияния дает возможность осуществить объединение желаемых аллелей из дивергентных линий селекции в один штамм. Описываемый здесь JC-923 S. avermitilis (ATCC 53669) штамм, лишенный трансаминазы аминокислот с разветвленной цепью, был получен посредством этой методики.
Морфологические и культуральные характеристики мутантов настоящего изобретения в основном такие же, которые описаны в патенте США N 4429042. Отличительные признаки мутантов настоящего изобретения заключаются в их потребности в активности дегидрогеназы 2-оксокислот с разветвленной цепью и/или активности трансаминазы аминокислот с разветвленной цепью, характеристики которых определены, как описано в настоящей заявке. Отсутствие указанных активностей приводит к неспособности мутантов продуцировать натуральные авермектины при росте на синтетической солевой среде, по существу свободной от жирных кислот RCOOH, где R обозначает изопропил или /S/ - вторбутил, или соединений, конвертируемых в указанную группу RCOOH во время брожения. Таксономическое исследование, проведенное Американской Коллекцией Типовых Культур, подтвердило то, что характеристики двух мутантных штаммов, 1-3 и HL-026, выбранных при помощи вышеуказанного испытания14CO2 тесно взаимосвязаны с характеристиками родительского штамма ATCC 31272, описанного в патенте США N 4429042, но с некоторыми исключениями. Так, мутантный штамм 1-3 (ATCC 53567) образует значительно меньше споровых цепей, чем ATCC 31272, и мутантный штамм HL-026 (ATCC 53568) практически лишен воздушных мицелий и спор, однако очень немного споровых цепей, продуцируемых им, имеют аналогичный характер, что и у ATCC 31272. Кроме того, мутант HL-026 проявляет неопределенную способность к утилизации рафинозы в качестве единственного углеродного источника, тогда как штамм ATCC 31272 и мутантный штамм 1-3 в состоянии использовать рафинозу. (В экспериментах, проведенных заявителями, рафиноза, по-видимому, не поддерживала рост ни одного из этих штаммов). Еще одним отличительным признаком мутантного штамма HL-026 явилась его способность продуцировать меньшее количество меланинового пигмента, чем два других штамма, и, что уникально, вообще не продуцировать этот пигмент на агаре тирозина. Наконец, в противоположность описанию, данному для ATCC 31272 в патенте США N 4429042, заявители не в состоянии обнаружить рост мутантов или штамма ATCC 31272 с сахарозой в качестве единственного источника углерода. Мутанты 1-3 и HL-026 лишены только активности дегидрогеназы 2-оксокислот с разветвленной цепью. Лишенный обеих активностей мутант PGS-119 (ATCC 53670), полученный дальнейшим мутагенезом мутанта 1-3 (ATCC 53567) и JC-922 (ATCC 53669), полученного протопластным слиянием, имеет такое же таксономическое отношение к АТСС 31272, что и мутантный штамм 1-3.
Мутанты 1-3, HL-026, PGS-119 и JC-923 депонированы в соответствии с условиями Будапештского Договора в Американской Коллекции Типовых Культур, Роквилл, Мэриленд, являющейся признанным депозитарием, гарантирующим надежность вкладов и легкую доступность к ним публики, если патент выдан по данной заявке. Им были даны обозначения Streptomyces avermitilis ATCC 53567, ATCC 53568, ATCC 53670 и ATCC 53669 соответственно. Вклады доступны во время нахождения данной заявки на рассмотрении тому лицу, определенному Комиссаром Ведомства США по Патентам и Товарным Знакам, которое имеет полномочия в соответствии с Разделом 37, Пункт 1.14, Свода федеральных правил и Разделом 35, Пункт 122, Кодекса законов США, а также в соответствии с Разделом 37, Пункт 1.14, Свода федеральных правил и Разделом 35, Пункт 122, Кодекса законов США, а также в соответствии с иностранными патентными законодательствами в тех странах, где поданы двойники данной заявки или ее продолжение. Все ограничения в отношении доступности для публики депонированных микроорганизмов будут безвозвратно сняты после выдачи патента.
Каждый из штаммов S. avermitilis ATCC 31267, ATCC 31271, ATCC 31272 и N CIB 12121 продуцирует натуральные авермектины, соединения формулы (I)

где прерывистая линия в положении 22-23 обозначает необязательную двойную связь, R1 представляет собой гидроксил и присутствует только тогда, когда отсутствует двойная связь, R2 представляет собой 4'-/альфа-L-олеандрозил/-альфа-L-олеандрозилокси формулы

R3 представляет собой водород или метил, а R представляет собой изопропил или /S/-втор-бутил. Патент США N 4285963 раскрывает авермектин формулы (I), где положение 25 замещено метильной и этильной группой, R1 означает гидрокси и R3 означает метил.
В упомянутых здесь ненатуральных авермектинах R обозначает заместитель другой, нежели изопропил или /S/-втор-бутил, и имеет нижеприведенные значения.
Соединения, существенные для использования в биосинтезе соединений формулы (I), встречаются в клетке S. avermitilis. Эти соединения, L-валин, L-лейцин и L-изолейцин, как полагают, входят в биосинтез авермектинов через превращение в 2-оксокислоту и декарбоксилирование кислоты дегидрогеназой 2-оксокислоты с разветвленной цепью, сопровождающиеся соединением продукта с коферментом A. Их присутствие отвечает за совместное производство как изопропилового, так и /S/-вторбутилового соединения формулы /I/. Это, конечно, поднимает проблемы отделения изопропила от производных /S/-втор-бутила.
При ферментации в питательной среде, содержащей подходящее праймерное соединение, мутанты настоящего изобретения продуцируют соединение формулы /I/ или, как более часто происходит, смесь двух или более соединений формулы /I/, в которых R соответствует используемому праймерному соединению. Можно получить до четырех продуктов, для удобства упомянутых как R-авермектин A1, A2, B1 и B2, в соответствии с обозначениями, используемыми в патенте США N 4429042. Группа "R-", конечно, относится к заместителю C-25. Например, когда R представляет собой циклопентил, четырьмя возможными авермектинами являются следующие (табл. 1).
В ненатуральных авермектинах C-25-заыеститель "R" формулы (I) является другим, нежели изопропил или /S/-вторбутил.
Соединения формулы /I/, в которых присутствует двойная связь и отсутствует OH, могут быть альтернативно получены из соответствующего соединения формулы /I/, в котором R1 означает OH и отсутствует двойная связь, реакцией дегидратации. Реакцию осуществляют вначале путем селективной защиты гидроксигрупп в положениях 5 и 4'', например, как т-бутилдиметилсилилоксиацетилпроизводного, затем подвергают взаимодействию с замещенным тиокарбонильным галогенидом, таким, как /4-метилфенокси/тиокарбонилхлорид, с последующим нагреванием в растворителе с высокой температурой кипения, например, в трихлорбензоле, с тем, чтобы осуществить дегидратацию. Наконец продукт освобождают от защиты с получением ненасыщенного соединения. Эти стадии вместе с подходящими реагентами и условиями проведения реакции описаны в патенте США N 4328335.
Соединения формулы /I/, в которых R3 представляет собой H, могут быть также получены из соответствующих соединений, в которых R3 обозначает CH3, диметилированием. Эту реакцию осуществляют обработкой 5-метоксисоединения или пригодно защищенного его производного уксуснокислой ртутью и гидролизацией полученного 3-ацетокси-энольного простого эфира разбавленной кислотой с получением 5-кетосоединения. Затем его восстанавливают с использованием, например, борогидрида натрия, получая 5-гидроксипроизводное. Подходящие реагенты и условия проведения реакции для этих стадий описаны в патенте США N 4423209.
Соединения формулы /I/, в которых R1 представляет собой H и отсутствует двойная связь, могут быть получены из соответствующего соединения, в котором двойная связь присутствует и R1 отсутствует, собирательной каталитической гидрогенизацией с использованием подходящего катализатора. Например, восстановление может быть достигнуто с использованием хлористого трис/трифенилфосфин/родия /1/, как описано в заявке на Европатент N 0001689 и ее двойнике, патенте США N 4199569, выданном 22 апреля 1980 года.
Соединения формулы /I/, в которых R2 представляет собой H, получают из соответствующих соединений, в которых R2 обозначает 4'-/альфа-L-олеандрозил/-альфа-L-олеандрозилокси, путем отщепления группы 4'-/альфа-L-олеандрозил/-альфа-L-олеандрозы мягким гидролизом с кислотой в водном органическом растворителе, получая при этом агликон, имеющий гидроксигруппу в положении 13; данное соединение затем галогенируют, например, реакцией с бензолсульфонилгалогенидом, получая при этом 13-дезокси-13-галопроизводное, которое в конце концов селективно восстанавливают, например, с использованием гидрида трибутилолова. Для того, чтобы избежать нежелательные побочные реакции, достаточно защитить любые другие гидроксигруппы, которые могут присутствовать, например, с использованием трет-бутилдиметилсилиловой группы. Затем ее легко отщепляют после осуществления стадии галогенирования или восстановления путем обработки метанолом, содержащим малое количество кислоты. Все эти стадии вместе с подходящими реагентами и условиями проведения реакции описаны в заявке на Европатент N 0002615.
Соединения, способные использоваться предлагаемыми S. avermitilis для
биосинтеза авермектинов, натуральных и ненатуральных, представляют собой соединения формулы /II-A/
R-COOH, (II-A)
включая соединения, конвертируемые в /II-A/ во время осуществления
процесса ферментации. Указанные соединения упоминаются здесь как "праймерные соединения". В формуле /II-A/ R обозначает альфа-группу с разветвленной цепью, атом углерода ее, к которому присоединена
группа -COOH, также присоединен по крайней мере к двум другим атомам или группам, другим, нежели водород. Это определение, конечно, охватывает насыщенные и ненасыщенные ациклические и циклические
группы, включая те, которые необязательно несут гетероатом серы или кислорода как член ациклической цепи или циклического кольца.
Более конкретно, R, который становится заместителем C-25, может быть альфа-разветвленным C3-C8 -алкилом, алкенилом, алкинилом, алкоксиалкилом или алкилтиоалкилом; C5-C8-циклоалкилалкильной группой, в которой алкильная группа представляет собой альфа-разветвленную C2-C5-алкильную группу; C3-C8-циклоалкильной или C5-C8-циклоалкенильной группой, причем та и другая могут быть по выбору замещены метиленом или одной или более C1-C4-алкильными группами или галоатомами (фтор, хлор, иод или бром); или 3-6-членными кислородом или серой, содержащими гетероциклическое кольцо, которое может быть насыщенным или полностью или частично ненасыщенным и которое может быть по выбору замещено одной или более C1 -C4-алкильными группами или галоатомами.
Соединения, конвертируемые в RCOOH, то есть предшественники, в процессе ферментации, представляют собой соединения формулы (II-B),
где R имеет вышеприведенные значения
R-/CH2/n-Z, (II-B)
n равно 0, 2, 4 или 6 и Z обозначает -CH2OH, -CHO, -CH2NH2, -COOR5 или -CONHR6, где R5 обозначает H или /C1-C6/алкил, R6 обозначает водород, /C1-C4/ алкил или остаток аминокислоты,
главным образом, аспарагиновой кислоты, глутаминовой кислоты и метионина, например -CH/COOH/CH2COOH, -CH/COOH//CH2/2-COOH и -CH/COOH//CH2/2
SCH3 соответственно.
В случае использования штаммов S. avermitilis, лишенных только трансаминазы аминокислот с разветвленной цепью, 2-оксокислоты служат также в качестве
предшественников. Так, для указанных штаммов кислоты формулы /II-C/
R-CO-Z, (II-C)
в которой R и Z имеют вышеприведенные значения, способны использоваться указанными S. avermitilis
для биосинтеза авермектинов.
В настоящее изобретение также включены изомерные формы соединений формулы /II-A/ и соединений, конвертируемых в них в течение процесса ферментации, а также изомерные авермектины в положении C-25, получаемые в результате их использования в описываемом здесь способе.
Способ настоящего изобретения осуществляют путем аэробного брожения штаммов S. avermitilis, который лишен активности дегидрогеназы 2-оксокислот с разветвленной цепью и/или активности трансаминазы аминокислот с разветвленной цепью, в водной питательной среде, содержащей усвояемый источник азота, углерода, неорганические соли и соединение формулы RCOOH или соединение, конвертируемое в указанное соединение (то есть предшественник) в течение процесса ферментации. Кислоту или соединение, конвертируемое в нее, прибавляют в ферментацию либо во время инокулирования, либо с интервалами во время ферментации. При использовании трансаминазаотрицательного мутанта среда должна содержать L-изолейцин, L-лейцин и L-валин с тем, чтобы происходил рост мутанта. Производство продуктов авермектина можно контролировать посредством взятия проб из ферментации, экстрагируя органическим растворителем, и слежения за появлением продукта хроматографией, например, используя высокоэффективную жидкостную хроматографию. Инкубирование продолжают до получения максимального выхода продукта, как правило, в течение периода от 4 до 15 дней.
Предпочтительный уровень каждого прибавления праймерных соединении /карбоновой кислоты или соединения, конвертируемого в нее/ составляет от 0,05 до 3,0 г на литр. Праймерное соединение можно прибавлять постоянно, с промежутками или все сразу. Кислоту /RCOOH/ прибавляют как таковую или в виде соли, такой как натриевая, литиевая или аммониевая соль, или в виде соединения, конвертируемого в кислоту, как определено выше. Кислоту, если она представляет собой твердое вещество, предпочтительно растворять в пригодном растворителе, таком как вода или /C1-C4/ спирты.
Среды, используемые для ферментации, особенно, когда заместителем C-25 является изопропил или /S/-втор-бутил, могут быть традиционными средами, содержащими усвояемые источники углерода, азота и микроэлементы. Когда заместителем C-25 должна быть ненатуральная группа, то есть ни изопропил, ни /S/-втор-бутил, сбраживаемой средой является та, в которой выбранные ингредиенты не содержат или содержат только минимальные количества праймерных соединений, в которых часть R представляет собой изопропил или /S/-втор-бутил.
После ферментации в течение нескольких дней при температуре предпочтительно в интервале от 24 до 33oC ферментационный бульон центрифугируют или фильтруют, и мицеллярный осадок экстрагируют предпочтительно ацетоном или метанолом. Экстракт растворителя концентрируют и требуемый продукт затем экстрагируют в несмешивающийся с водой органический растворитель, такой как метиленхлорид, этилацетат, хлороформ, бутанол или метилизобутилкетон. Экстракт растворителя концентрируют и сырой продукт подвергают очистке, как необходимо, хроматографией, например, используя препаративную высокоэффективную жидкостную хроматографию с обращенными фазами.
Продукт обычно получают в виде смеси соединений формулы (I), где R2 обозначает 4'-/альфа-L-олеандрозил/-альфа-L-олеандрозилокси, R1 обозначает OH и двойная связь отсутствует или R1 отсутствует и двойная связь присутствует, и R3 обозначает H или CH3; однако относительные содержания могут варьироваться в зависимости от конкретного мутанта и праймерного соединения и от используемых условий.
Источник группы R, то есть происходит ли она непосредственно из R-COOH или продуцируется от одного из вышеуказанных предшественников или любого другого предшественника, не играет роли для производства авермектинов. Решающим условием способа настоящего изобретения для получения авермектинов является то, что желаемая группа R должна быть приемлемой для штаммов S. avermitilis настоящего изобретения в процессе ферментации.
Пригодные соединения включают следующие:
2,3-диметилмасляная кислота,
2-метилкапроновая кислота,
2-метилпент-4-еновая кислота,
2-циклопропилпропионовая кислота,
Литиевая соль 4,4-дифторциклогексанкарбоновой кислоты,
4-метиленциклогексанкарбоновая кислота,
3-метилциклогексанкарбоновая кислота
/цис/транс/,
1-циклопентенкарбоновая кислота,
1-циклогексенкарбоновая кислота,
Тетрагидропиран-4-карбоновая кислота,
Тиофен-2-карбоновая кислота,
3-фуранкарбоновая кислота,
2-хлортиофен-4-карбоновая кислота,
Циклобутанкарбоновая кислота,
Циклопентанкарбоновая кислота,
Циклогексанкарбоновая кислота,
Циклогептанкарбоновая кислота,
2-метилциклопропанкарбоновая кислота,
3-циклогексен-1-карбоновая кислота,
2-метилтиопропионовая кислота,
2-метил-4-метоксимасляная
кислота,
Тиофен-3-карбоновая кислота,
Гидроксиметилциклопентан,
3-тиофенкарбоксальдегид,
3-циклогексилпропионовая кислота,
3-циклопентилпропионовая кислота,
Гидроксиметилциклобутан,
Тетрагидротиофен-3-карбоновая кислота,
3-циклопентил-1-пропанол,
Литиевая соль 3-метилциклобутанкарбоновой кислоты,
3-Фторциклобутанкарбоновая кислота
Литиевая соль 3-метиленциклобутанкарбоновой кислоты,
2-метил-4-метилтиомасляная кислота,
Тетрагидротиопиран-4-карбоновая кислота,
Циклобутилметиламин,
Этилциклобутанкарбоксилат,
4-гидроксиметилциклопентен,
Сложный этиловый эфир 2-/3-тиофенкарбонил/пропионовой кислоты,
/S/-2-метилпентановая
кислота,
/R/-2-метилпентановая кислота.
Мутанты O-метилтрансферазы могут быть получены из описываемых здесь мутантов, отрицательных к трансаминазе аминокислот с разветвленной цепью и/или мутантов, отрицательных к дегидрогеназе 2-оксокислот с разветвленной цепью. Мутанты, в которых мутация в активности дегидрогеназы 2-оксокислот с разветвленной цепью и/или активности трансаминазы аминокислот с разветвленной цепью объединена с одной или обеими мутациями O-метилтрансферазы, приводят к получению штаммов S. avermitilis, которые при использовании соединений RCOOH или соединений,конвертируемых в RCOOH во время ферментации, будут продуцировать главным образом авермектины B, диметилавермектины или соединения диметилавермектина B. Указанные мутанты получают мутагенезом описываемых здесь мутантов, которые не содержат активность дегидрогеназы 2-оксокислот с разветвленной цепью и/или активность трансаминазы аминокислот с разветвленной цепью, при помощи ультрафиолетового света и/или химических мутагенов, таких как N-метил-N-нитрозоуретан, нитрозогуанидин, этилметансульфонат или другой агент, как, например, из числа перечисленных выше. Альтернативно, мутанты, положительные к дегидрогеназе 2-оксокислот с разветвленной цепью и/или мутанты, положительные к трансаминазе аминокислот с разветвленной цепью, которые не содержат одну или обе O-метилтрансферазы, могут быть мутированы посредством обработки УФ-света, или мутагенизирующим агентом с получением мутантов, отрицательных к дегидрогеназе 2-оксокислот с разветвленной цепью и/или мутантов, отрицательных к трансаминазе аминокислот с разветвленной цепью.
Ненатуральные авермектины, полученные такими мутантами, отличаются присутствием гидроксильных групп в положении C-5 части агликона и/или C-3'- и/или C-3''-положениях частей олеандрозы.
Вышеописанные мутанты идентифицируют в соответствии с методологией, описанной Шульманом и др. Противомикробные агенты и химиотерапия, 29, с. 620 - 624 (1986). Они пригодны для тех же целей и таким же образом, как и известные авермектины.
Альтернативно, повышенные количества авермектинов B, включая те, которые не содержат метильные группы в части дисахарида олеандрозы, получают ферментацией мутантов настоящего изобретения, которые нуждаются в активности дегидрогеназы 2-оксокислот с разветвленной цепью и/или активности трансаминазы аминокислот с разветвленной цепью, в присутствии такого вещества, как синефунгин, S-аденозилэтионин или S-аденозилгомоцистеин, которые ингибируют активность O-метилтрансферазы.
Соединения настоящего изобретения представляют собой чрезвычайно активные противопаразитарные средства, имеющие особенную пригодность в качестве глистогонных средств, эктопаразитицидов, инсектицидов и акарицидов.
Так, соединения эффективны в лечении целого ряда состояний, вызванных эндопаразитами, включая, в частности, гельминтоз, который наиболее часто вызывается группой паразитических червей, описанных как нематоды, и который может стать причиной больших экономических потерь у свиней, овец, лошадей и крупного рогатого скота, а также может поражать домашние животные и домашнюю птицу. Соединения также эффективны против других нематодов, которые поражают различные виды животных, включая, например, Dirofilaria у собак, и различные паразиты, которые могут заражать человека, включая желудочно-кишечные паразиты, такие как Ancylostoma, Necator, Ascaris, Strongyloides, Trinchinella, Capillaria, Trichuris, Enterobius и паразиты, которые обнаружены в крови или других тканях и органах, такие как филяриальные черви и экстра-кишечные стадии Strongyloides и Trinchinella.
Соединения настоящего изобретения также ценны при лечении заражений эктопаразитами, включая, в частности, членистоногие эктопаразиты животных и птиц, такие как клещи, иксодовые клещи, вши, блохи, падальная муха, кусающие насекомые и мигрирующие двукрылые личинки, которые могут поражать крупный рогатый скот и лошадей.
Соединения также представляют собой инсектициды, активные против домашних вредителей, таких как тараканы, моль платяная, антренус и муха комнатная, а также пригодны против насекомых-вредителей хранящегося зерна и сельскохозяйственных растений, таких как клещик паутинный, тля, гусеницы, и против мигрирующих прямокрылых, таких как настоящие саранчовые.
Соединения формулы /I/ вводят в виде состава, подходящего для предусмотренного специфического использования и для определенных видов подлежащего лечению животного-хозяина, а также паразита или насекомого. Для использования в качестве глистогонного средства соединения могут быть введены перорально в форме капсулы, большой пилюли, таблетки или жидкого лекарства, или, альтернативно, они могут быть введены впрыскиванием или в качестве имплантата. Такие составы получают традиционным путем в соответствии со стандартной ветеринарной практикой. Так, капсулы, большие пилюли или таблетки могут быть получены путем смешивания активного компонента с пригодным тонкоизмельченным разбавителем или носителем, дополнительно содержащим дезинтеграционное средство и/или связующее, такое как крахмал, лактоза, тальк, стеарат магния и так далее. Жидкий состав может быть получен диспергированием активного компонента в водном растворе вместе с диспергирующими или смачивающими средствами и так далее; и инъекцируемые составы могут быть получены в форме стерильного раствора, который может содержать другие вещества, например достаточное количество солей или глюкозы, с тем, чтобы раствор был изотоническим с кровью. Эти составы будут варьироваться относительно массы активного соединения в зависимости от вида подлежащего лечению животного-хозяина, тяжести и типа заражения и живого веса хозяина. Обычно для перорального введения удовлетворительной будет доза приблизительно от 0,001 до 10 мг на кг живого веса животного, данная в качестве однократной дозы или в раздельных дозах в течение периода от 1 до 5 дней, однако, конечно, могут быть случаи, когда указываются более высокие или низкие пределы дозировок, и они находятся в пределах объема настоящего изобретения.
Как вариант, соединения могут вводиться с кормом животного, и для этой цели концентрированная кормовая добавка или премикс может быть получена для смешивания с обычным животным кормом.
Для использования в качестве инсектицида и для обработки сельскохозяйственных насекомых-вредителей соединения применяются в виде растворов для опрыскивания, дустов, эмульсий и тому подобного в соответствии со стандартной сельскохозяйственной практикой.
Получение S. avermitilis 1-3 (ATCC 53567),
лишенных дегидрогеназы 2-оксокислот с разветвленной цепью
Стадия 1.
ATCC 31272 S. avermitilis выращивают в виде сходящейся лужайки на агаровой среде New patch в течение 12
дней при температуре 30oC. Среда содержит:
Сок V-8 (примечание 1) 200 мл
CaCO3 3 г
Агар 15 г
H2O До 1000 мл
Питательный
бульон 1,0 г/л
Ацетат натрия•3H2O 1,4 г/л
Изовалериановая кислота 50 мг/л
Изомасляная кислота 50 мг/л
2-метилмасляная кислота 50 мг/л
Изолейцин 250 мг/л
Лейцин 250 мг/л
Валин 250 мг/л
Раствор микроэлементов (примечание 2) 1 мл/л
Примечание 1. Смесь 8 растительных соков (томатного, морковного,
сельдерея корневого, свеклы, петрушки огородной, латука, горчицы полевой и шпината) плюс соль, аскорбиновая и лимонная кислота и натуральные вкусовые вещества. Поставлена Campbell Soup Company, Camden,
NJ.
Примечание 2. Состав раствора микроэлементов:
FeCl3•6H2O 2,7 г
MnSO4•H2O 4,2 г
CuSO4
•5H2O 0,5 г
CaCl2 11,0 г
H3BO3 0,62 г
CoCl2•6H2O 0,24 г
ZnCl2 0,68 г
Na2MoO4 0,24 г
Растворяют все это в одном литре 0,1 н. раствора HCl.
Споры собирают с трех таких чашек и суспендируют в 20 мл 0,05 M буферного раствора трис-малеиновая кислота, pH 9,0.
Стадия 2. 10 мл споровой суспензии прибавляют в пробирку, содержащую 10 мг N-метил-N'-нитро-N-нитрозогуанидина (НТГ). Пробирку инкубируют и встряхивают при температуре 28oC в течение 60 минут, после чего споры промывают обильно 1%-ным раствором NaCl.
Стадия 3. Промытые споры суспендируют в 1%-ном растворе NaCl и смешивают с равным объемом 80%-ного этиленгликоля. Эту суспензию сохраняют при температуре -20oC и используют в качестве источника клеток для скрининга на мутанты. Это приводит к получению приблизительно 104 колоний/мл после зарождения.
Этот споровый раствор наносят на чашки YPD с получением приблизительно 100 колоний на чашку /среда YPD содержит 10 г/л каждого из дрожжевых экстрактов, бакто-пептона* и декстрозы, а также 15 г/л бакто-агара*, доведенного до pH 6,9 перед автоклавированием/. Ингредиенты, помеченные звездочкой, поставляются Дифко Лабораториез, Детройт, Мичиган, 48238.
Стадия 4.
Единичные колонии поднимают с чашек через 2 3 недели роста при температуре 28oC и помещают в отдельные углубления стандартной микротитровой чашки с 96 углублениями. Кроме того, небольшое количество колоний высевают на свежую агаровую среду для того, чтобы служить источником жизнеспособных клеток, когда мутанты идентифицируют.
Стадия 5. В каждое углубление прибавляют приблизительно 75 мкл жидкой среды солей M9, содержащей 1%-ную глюкозу, 0,1%-ные казаминокислоты и 0,01% каждой из изовалериановой, изомасляной и 2-метилмасляной кислот. Через несколько дней инкубирования при температуре 28oC клетки анализируют на присутствие дегидрогеназы 2-оксокислот с разветвленной цепью. (Каждый литр среды солей M9 содержит 6 г Na2HPO4, 3 г KH2PO4, 0,5 г NaCl и 1 г NH4Cl. Среду автоклавируют, после чего асептически прибавляют 1 мл каждого из стерилизованных 1M MgSO4 и 0,1 M CaCl2).
Стадия 6. Микросуспензию 5%-ного толуола в среде солей M9 получают коротким воздействием ультразвука на несмешивающуюся смесь. К 25 мл этой суспензии прибавляют 1,2 мл раствора, содержащего [14C-1]-2-оксоизокапроновую кислоту, 2,5 мкКи/мл и 10, 0 мкКи/мкмоль. 50 мкл этой суммарной смеси прибавляют в каждое углубление микротитровой чашки, содержащей испытуемые колонии.
Стадия 7.14CO2 продуцируемый из каждого углубления, улавливают и визуализируют при помощи методики, описанной Tabor и др. J. Bacteriol 128, с. 485 486 /1976/, под названием "Удобный Метод Обнаружения14CO2 в многократных пробах: применение к быстрому скринингу на мутанты". Мутанты, лишенные активной дегидрогеназы 2-оксокислот с разветвленной цепью, не продуцируют Ba14CO3 кроме того, что наблюдается для контрольных проб.
Более усовершенствованный метод, который повышает контраст между положительным анализом на14CO2, указываемым темным пятном на авторадиограмме как результат образования Ва14CO3, и отрицательным анализом, указываемым там, где нет пятна или есть очень светлое пятно, содержит следующий модифицированный экран.
Одиночные колонии (см. стадию 4 выше) поднимают из агаровой среды через 7 14 дней роста (а не через 2 3 недели, и анализируют непосредственно стадиями 6 и 7 выше). Стадию 5 вышеуказанной методики опускают.
Даже более усовершенствованный анализ, который по природе своей является количественным в отношении высвобождения14CO2, содержит выращивание мутантов, обнаруженных вышеприведенным скринингом, на пригодной среде, содержащей среду солей M9 с глюкозой, 1%-ной, и "Syncasa-bcaa", 0,1%-ной (синтетическая смесь L-аминокислот с приближенным составом коммерческих казаминокислот, однако без наличия L-валина, L-изолейцина и L-лейцина, см. ниже).
После выращивания до высокой плотности клеток последние промывают в среде солей M9 и ресуспендируют в холодной среде солей M9, содержащей 1%-ный толуол, которую подвергли воздействию ультразвука с получением мелочно-белой дисперсии толуола. Суспензию клетка (буфер) толуол инкубируют в течение 40 мин при температуре 30oC с тем, чтобы пропитать клетки. Пропитанные клетки затем промывают в среде солей M9 и наконец ресуспендируют в 1/5 первоначального объема буфера среды M9. 180 мкл этой суспензии используют для каждого анализа.
Реакционный объем 300 мкл содержит толуолизированные клетки, тиаминпирофосфат (ТПФ), 0,4 мМ; кофермент А (КоА), 0,11 мМ; никотинамидадениндинуклеотид (НАД), 0,68 мМ, дитиотрейтол (ДТТ), 2,6 мМ; MgCl2, 4,1 мМ; Трис-HCl, 60 мМ; Трис-HCl, 60 мМ, pH 7,5; а также [14 C-1]-альфа-кетоизокапроат, 6000 отсчетов в минуту, микрокюри на микромоль. Коэффициент полезного действия определения количества составляет 73% Реакцию осуществляют в 15 мл сцинтилляционных пробирках, содержащих 2 x 2 см квадрат ватманской (N 4) бумаги, спрессованный в винтовой колпачок пробирки. Бумага содержит 30 мкл 1М гидроокиси гиамина (1М раствора гидроокиси метилбензетония в метаноле; поставляется Сигма Кемикал Компани, Сент-Луис, Миссури, 63178), который улавливает14CO2, выделенный при реакции. После инкубирования в течение 2 ч бумагу погружают в 10 мл Beckman Aguasol универсальный ЖСС (жидкий сцинтилляционный счетчик), поставляемый из Нью-Ингланд Нуклиа Рисерч Продактс, Бостон, Миннесота, 02118), и радиоактивность измеряют в жидком сцинтилляционном счетчике после уравновешивания в этом растворителе в течение 4 ч или более. Реакция с использованием слепой пробы (т.е. без клеток) приводит к получению приблизительно 50 300 отсчетов в минуту.
Мутант 1-3 и другие, подобные ему, приводят к получению количеств, которые равняются или являются меньшими, чем при реакции со слепой пробой, тогда как родительский штамм дает количества в несколько раз больше контрольных значений.
Выделение производного HL-026 /ATCC 53568/ мутанта 1-3 S. avermitilis /ATCC 53567/.
S. avermitilis 1-3 /ATCC 53567/ подвергают штриховой разводке на чашках с питательной агаровой средой. Возникает относительно высокая повторяемость спонтанных вариантов; некоторые из них теряют воздушный мицелий на 4 день инкубирования при температуре 30oC. Несколько таких вариантов выделяют и испытывают на их способность продуцировать ненатуральные авермектины при ферментации в среде AP-5, в которую прибавляют циклопентанкарбоксильную кислоту. Из изолятов, многие из которых продуцируют ненатуральные авермектины, свободные от натуральных авермектинов, тому штамму, который приводит к получению более высоких титров авермектинов в экспериментах в колбах, чем его родительский штамм 1-3 S. avermitilis /ATCC 53567/, дают идентификационный номер HL-026 /ATCC 53568/.
Получение PGS-119 S. avermitilis /ATCC 55670/, лишенного дегидрогеназы 2-оксокислот с разветвленной цепью и трансаминазы аминокислот с разветвленной цепью.
Стадия 1. Приблизительно 100 мг 1-3 S. avermitilis /ATCC 53567/, выращенного на чашке со свежим агаром SAMM в течение четырех дней, инокулируют в 300 мл колбу, содержащую 50 мл среды SCM /pH 7,2/. Затем колбу встряхивают при 200 об/мин и температуре 30oC в течение 24 ч (конечный pH 8,2).
Стадия 2. Колбу вынимают из качалки и 10 мл всего бульона центрифугируют в стерильной пробирке в течение 5 мин при 2000 об/мин. Клетки затем ресуспендируют в 50 мл среды SCM в стерильных 300 мл колбах Эрленмейера, и колбы встряхивают на круговой качалке в течение 2 ч при температуре 30oC.
Стадия 3. 10 мл суспензии помещают в стерильную пробирку.
Стадия 4. В пробирку (в хорошо вентилируемом колпаке) прибавляют этилметансульфонат (250 мкл), содержимое тщательно перемешивают, затем выливают в стерильную 300 мл колбу, которую встряхивают на круговой качалке в течение 3 ч при температуре 30oC.
Стадия 5. В колбу прибавляют свежую стерильную среду SCM (40 мл) и встряхивание продолжают в течение 70 ч при температуре 30oC.
Стадия 6. Колбу вынимают, содержимое колбы центрифугируют при 8000 об/мин в течение 10 мин при температуре 20oC. Клетки промывают, ресуспендируя в среде SCM, вновь центрифугируют и ресуспендируют в 10 мл среды SCM.
Стадия 7. Клетки извлекают и анализируют посредством получения реплик, приблизительно 150 колоний/чашка, на их способность расти на чашках с минимальной средой M9 /глюкоза в присутствии и отсутствие L-лейцина, L-изолейцина, L-валина и комбинации любых из указанных аминокислот. Представляющие интерес мутантные клетки растут только на средах, пополненных L-лецином, L-изолейцином и L-валином. Эти производные S. avermitilis 1-3 (ATCC 53567), лишенные активности трансаминазы аминокислот с разветвленной цепью, также не способны расти на средах, пополненных одной или более из трех 2-оксокислот /2-оксоизокапроновая кислота, 2-оксо-З-метилвалериановая кислота и 2-оксоизовалериановая кислота/, которые служат в качестве предшественников для L-лецина, L-изолейцина и L-валина. Такое поведение полностью противоположно тому, которое наблюдается у 1-3 S. avermitilis /ATCC 53567/, который хорошо растет на таких средах. Таким образом, единственный фермент трансаминазы катализирует трансаминирование указанных 2-оксо-кислот.
СРЕДА SCM, г/л:
Дрожжевой автолизат 10
Мясной экстракт 5
Казеиновый ферментативный гидролизат 10
IМ MgSO4 3 г/л
IМ K2HPO4; pH 7,0 /HCl/ 100
Чашки с агаровой средой AMM, г/л:
Na2HPO4 6,0
KH2PO4 3,0
NaCl 0,5
NH4Cl 1,0
IМ MgSO4 1,0
0,1 М CaCl2 1,0
Декстроза 8,0
Казаминокислоты 20,0
Агар 20,0
Состав "Syncasa-bcaa"
100-кратный концентрат, г/л: г/л
L-аланин 3
L-аргинин 4
L-аспарагиновая кислота 6
L-цистин 1
L-глутаминовая кислота 20
глицин 1
L-гистидин 2
L-метионин 3
L-лизин 7
L-фенилаланин 6
L-пролин 10
L-серин 6
L-треонин 4
L-тирозин 4
L-триптофан 1
Смесь
доводят до pH 7 и стерилизуют фильтрацией. Один объем концентрата прибавляют к 99 объемам среды с получением концентраций для стандартного использования.
JC-923 S. avermitilis (ATCC
53669), полученный протопластным слиянием спектиномицин-устойчивого штамма S. avermitilis ATCC 31272 и S. avermitilis PGS-119 (ATCC 53670)
Спектиномицин-устойчивый S. avermitilis ATCC 31272
представляет собой спонтанный мутант S. avermitilis АТСС 31272. Его выделяют из популяций вегетативных мицелиев АТСС 31272, произрастающих на чашках с агаровой средой AS-1, содержащих 50 мкг/мл
спектиномицина. Споры мутанта, зародившиеся на богатой среде, устойчивы к 50 мкг/мл спектиномицина, по сравнению ее спорами изогенного родительского штамма, который не в состоянии продуцировать споры
при таких условиях. Этот доминантный селектируемый маркер успешно используется для выделения изолятов ATCC 31272, лишенных трансаминазы аминокислот с разветвленной цепью.
Агар AS-1
(Богатая среда для пластинчатых разводок для Streptomyces), г:
Дрожжевой экстракт 1
L-Аланин 0,2
L-Аргинин 0,2
L-Аспарагин 0,5
Растворимый крахмал
5
NaCl 25
Na2SO4 10
Агар 20
Дистиллированная вода, л 1
Доводят до pH 7,5. Автоклавируют в течение 15 мин при температуре 121oC. Вливают 30 35 мл в стерильные пластмассовые чашки Петри (100 на 15 мм).
Методики получения жизнеспособных протопластов штаммов Streptomyces avermitilis
А. Споры
инокулятов
1. Споровые препараты получают стандартными методами, причем число жизнеспособных спор оценивают пластинчатыми разводками на агаровой среде, и аликвоты замораживают при температуре
-70oC в 40%-ном глицерине.
2. Перед использованием споровые растворы центрифугируют при 1000 г в течение 10 мин и ресуспендируют в равной объеме 0,85%-ного солевого раствора.
Приблизительно 107 спор инокулируют в 30 мл среды с модифицированным бульоном дрожжевой экстракт солодовый экстракт /YEME/, содержащей 0,5% глицин (см. ниже) в 300 мл колбе с 3 или 4 перегородками.
Б. Замороженные мицелии, обработанные ультразвуком, как инокуляты
1. Мицеллярные культуры PGS-119 выращивают в триптиказасоевом бульоне
/ТСБ/ до мутности от 2 до 9 при 600 нм. Культуры гомогенизируют 10 раз стеклянной дробилкой для тканей.
2. Гомогенизированные мицелии дважды разбавляют в ТСБ и 20 мл прибавляют в стерильную полипропиленовую пробирку для центрифуги. Ультразвуковой зонд опускают на глубину от 1 до 2 см в жидкость и пробу подвергают воздействию ультразвука при 50%-ной интенсивности в течение 10 с. Обработка ультразвуком диспергирует мицеллярные массы в одиночные или двойные клеточные единицы, которые продуцируют быстрый экспоненциальный рост при глубинном культивировании.
3. Обработанные ультразвуком мицеллярные препараты разбавляют до конечной концентрации 40% глицерина, отмеривают пипеткой в пробирки и замораживают при температуре -70oC.
4. Аликвоты оттаивают при комнатной температуре, как необходимо для инокулирования в среду YEME, как в стадии А.3 выше.
В. Колонии агаровой среды в качестве инокулятов
1. Шесть
созревших колоний PGS-119, растущих на агарах TSA или YPD-2, интродуцируют петлей в 200 мкл стерильной воды в пробирке.
2. Мицеллярную смесь гомогенизируют свободным пестиком ступки.
3. Гомогенизированные колонии прибавляют к среде EME, как в стадии А.3 выше.
Г. Получение протопластов из мицелиев, выросших в глицине.
1. Культуры инкубируют во встряхиваемой водяной бане при температуре 29oC при установке 8 в течение приблизительно 65 ч.
2. Мицелии наблюдают микроскопически при 40X увеличении фазы 2 и собирают в полипропиленовой пробирке для центрифуги при 1475 г в течение 10 мин при температуре 20oC.
3. Надосадочную жидкость сливают и мицеллярный осадок ресуспендируют в 10 мл протопластного /P/ буфера (см. ниже). Осадок после центрифугирования гомогенизируют 5 10 раз дробилкой для тканей с тем, чтобы диспергировать группировки.
4. Пробу центрифугируют при приблизительно 1000 г в течение 10 мин. Надосадочный слой сливают и осадок осторожно ресуспендируют в 10 мл P-буфера.
5. Повторяют стадию промывки, описанную выше.
6. Мицеллярный осадок ресуспендируют в 10 мл 1,0 мг/мл свежего раствора лизоцима в P-буфере, который стерилизован фильтрацией посредством прохождения через фильтр размером 0,22 мкм.
7. Мицеллярную смесь инкубируют в водяной бане при температуре 37oC при осторожном встряхивании в течение 60 мин. Пробы ресуспендируют в растворе лизоцима каждые 15 мин. Пробы наблюдают микроскопически при 40X фазовой освещенности на наличие протопластов.
8. Мицеллярные препараты порошкуют три раза 5 мл пипеткой до свободных протопластов из их клеточных стенок.
9. Препараты фильтруют через стекловату или непоглощающую хлопчатобумажную ткань.
10. Протопласты осаждают центрифугированием при приблизительно 1000 г в течение 7 мин, осторожно ресуспендируют в 5 мл P-буфере и наблюдают при 40X фазовом усилении.
11. Протопласты осаждают, как описано выше, и ресуспендируют в 1, 0 мл P-буфера. Разведения этой суспензии осуществляют в P-буфере и дистиллированной воде и высевают на регенерационную среду. Колонии, которые поднимаются из протопластных препаратов, разбавленных в дистиллированной воде, как предполагают, происходят от неполно или вовсе непротопластированных мицеллярных единиц.
12. Протопласты замораживают на льду в 200 300 мкл аликвотах при температуре -70oC. Их извлекают изо льда через 18 24 ч.
Слияние протопластов с полиэтиленгликолем (ПЭГ) 1000
1. Все описываемые здесь эксперименты осуществляют с
использованием одной партии ПЭГ 1000 (Сигма Кемикал Компани, Сент-Луис, Миссури, 63178), который продуцирует малую видимую токсичность в руках заявителя.
2. Аликвоты в один (1,0) г ПЭГ автоклавируют в стеклянных пробирках, прибавляют 1,0 мл P-буфера и ПЭГ растворяют, нагревая пробирку до температуры 55oC, или ПЭГ взвешивают, растворяют в P-буфере и стерилизуют фильтрацией непосредственно перед использованием. Растворы ПЭГ применяют при температурах окружающей среды.
3. Протопласты вновь приготавливают или оттаивают от температуры -70oC под струей воды. Приблизительно равные количества протопластов каждого генотипа отмеривают осторожно пипеткой в поликарбонатные пробирки для центрифуги. Для вновь приготовленных протопластных препаратов измеряют мутности и используют несколько различных концентраций. Объем в каждой пробирке доводят до 5,0 мл посредством P-буфера.
4. Смесь для слияния центрифугируют при приблизительно 1000 г в течение 7 мин.
5. Надосадочную жидкость декантируют тщательно. Протопластный осадок после центрифугирования осторожно ресуспендируют до конечного объема 200 мкл при помощи P-буфера.
6. Восемьсот (800) мкл 50%-ного ПЭГ быстро прибавляют к смеси для слияния. Препарат смешивают, пропуская его в пастеровскую пипетку и вновь выталкивая оттуда. Смесь слияния инкубируют в течение 2 мин при комнатной температуре, девять (9) мл P-буфера прибавляют в смесь с тем, чтобы растворить ПЭГ. Дополнительные слияния осуществляют серийно так, чтобы интервалы инкубирования были точными.
7. Смеси слияния центрифугируют, как описано в стадии 4 выше, надосадочный слой декантируют осторожно и слившиеся, промытые протопласты ресуспендируют в 1,0 мл P-буфера.
8. Смесь слияния последовательно разбавляют 10-1 и 10-2 в P-буфере.
9. Слияния каждого штамма осуществляют в каждом эксперименте и высевают на чашки как контрольные пробы.
10. Разведения каждого протопластного препарата (количества жизнеспособных микроорганизмов) высевают с тем, чтобы определить количества жизнеспособных регенерантов каждого штамма, используемого в технологии слияния.
Регенерация протопластов
1. Протопластные суспензии, смеси слияния или
самослияния разбавляют в P-буфере и высевают на чашки в 100 мкл аликвотах на регенерационные агаровые среды, используя методику осторожного распространения. Разброс слившихся протопластов в мягких
агаровых слоях не повышает значительно их регенерацию.
2. Там, где возможно, используют методику, описанную в Г.II выше.
3. Регенерационные чашки инкубируют правым боком в герметичных пластмассовых мешках при температуре 29 30oC и приблизительно 95%-ной влажности.
4. Для протопластных слияний, в которых спектиномицин-устойчивость используют в качестве доминантного селектируемого маркера, регенерирующие протопласты поднимаются вверх через 18 ч с 3,5 мл 100 мкг/мл спектиномицина в мягком агаре (см. ниже), автоклавированном и добавленном при температуре менее 45oC.
5. Протопласты выращивают в течение 7 10 дней.
Питательные среды, регенерационные среды и протопластный буфер
Полная регенерационная среда
/Модифицированная из работы Hopwood и др. 1985. Генетическая манипуляция Streptomyces Лабораторное руководство, с. 235/.
Основной
раствор:
Сахароза 205 г
K2SO4 0,25 г
MgCl2•6H2 10,12 г
Глюкоза 10 г
Казаминокислоты Дифко 0,1 г
Дрожжевой экстракт Дифко 5,0 г
Агар из овсяной муки Дифко 3,0 г
Дифко бакто-агар 22,0 г
Дистиллированная вода До 955 мл
Автоклавируют в течение 25 мин при
температуре 121oC. После автоклавирования прибавляют стерильные растворы:
KH2PO4(0,5) 10 мл
CaCl2•2H2O 5 мл
L-пролин (20%) 15 мл
Буфер MES (1,0 М) 10 мл
Раствор микроэлементовx 2,0 мл
NaOH (1 н. раствор) 3,0 мл
Доводят pH до 6,5; приводят объем к 1 л.
xРаствор микроэлементов (на 1 л):
ZnCl2 40 мг
FeCl3•6H2O 200 мг
CuCl2•2H2O 10 мг
MnCl2•4H2O 10 мг
Na2B4O7•10H2O 10 мг
/NH4/6Mo7O24
•4H2O 10 мг
Спектиномициновые верхние (мягкие) слои агара
Полная регенерационная среда, как выше, за исключением:
Агар 4,10 г
Автоклавируют, как
описано выше. Охлаждают до температуры 55oC. Прибавляют 100 мг спектиномицина. Аликвотная проба в 5 мл объемах в колпачковых пробирках с культурой. Замораживают. Автоклавируют вновь
непосредственно перед использованием.
Модифицированный протопластный (P) буфер
Основной раствор:
Сахароза 205 г
K2SO4 0,25 г
MgCl2•6H2O 0,02 г
Дистиллированная вода До 977 мл
Обрабатывают в автоклаве в течение 25 мин при температуре 121oC. После автоклавирования с
целью стерилизации прибавляют смесь:
KH2PO4 (0,5%) 1 мл
Раствор микроэлементовx 2 мл
CaCl2•2H2O (3,68%) 10
мл
Буфер MES (1,0 М) 10 мл
Доводят pH до 6,5; приводят объем к 1 л.
xРаствор микроэлементов имеет вышеприведенный состав.
Модифицированная
среда дрожжевой экстракт солодовый экстракт (YEME)
Основной раствор:
Дрожжевой экстракт Дифко 3 г
Бакто-пептон Дифко 5 г
Бульон Дифко-Бакто-солодового экстракта 3
г
Глюкоза 10 г
Сахароза 300 г
Дистиллированная вода До 973 мл
Автоклавируют в течение 25 мин при температуре 121oC.
После
автоклавирования прибавляют:
MgCl2•6H2O (2,5 М) 2 мл
Глицин (20%) 25 мл
Приводят объем к 1 л.
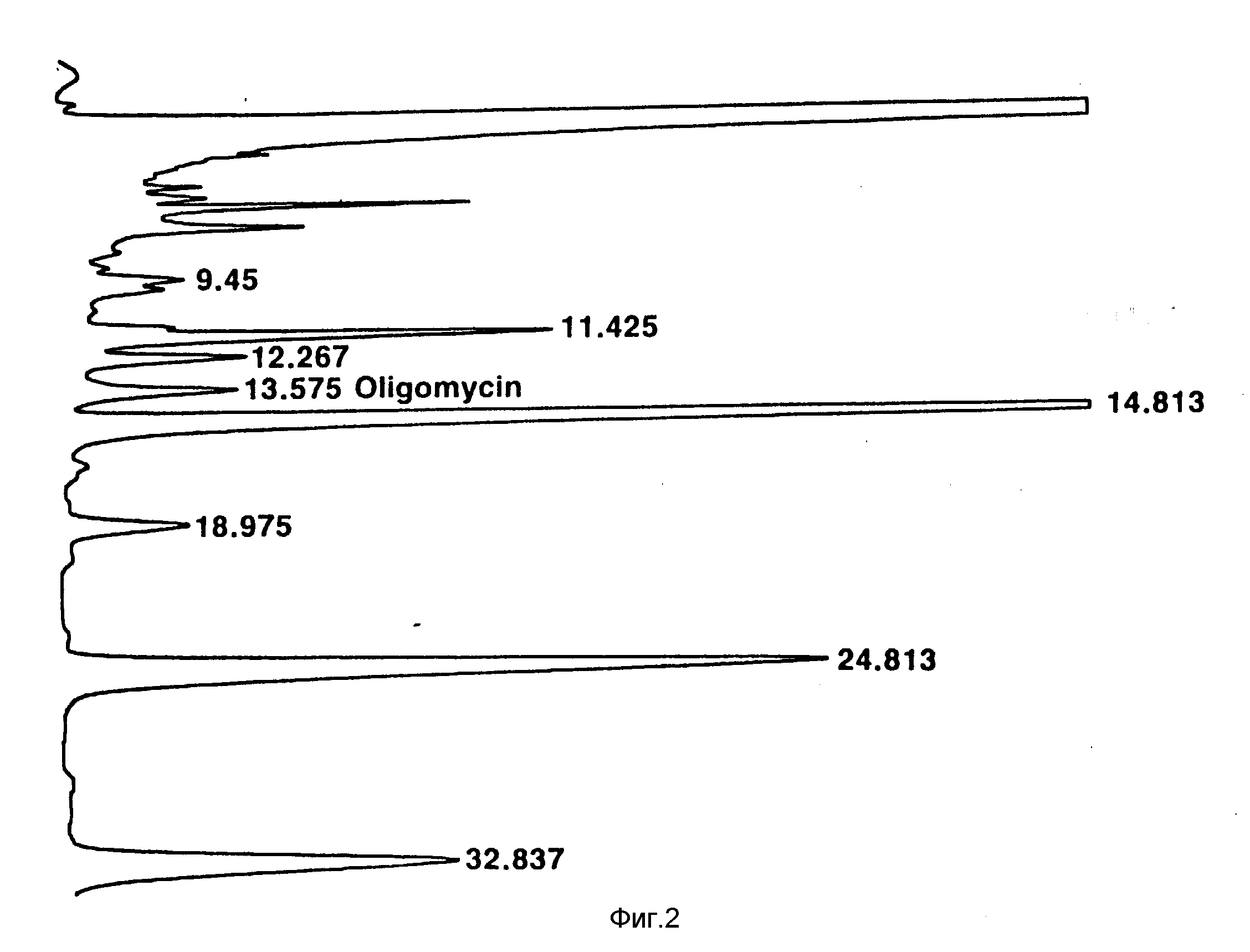
Фиг. 1: УФ-построение (длина волны 240 нм) в зависимости от времени (минуты) хроматографа ВЭЖХ (высокоэффективной жидкостной хроматографии) фракции растворителя из экстракции растворителем клеток S. avermitilis 1-3 (ATCC 53567) после выращивания на среде, свободной от жирных кислот (WPM Syna 40:40). Пик при 13, 12 представляет собой олигомицин А.
Фиг. 2: УФ-построение (длина волны 240 нм) хроматографа ВЭЖХ фракции растворителя из экстракции растворителем клеток S. avermitilis MA 4848 (ATCC 31272) после выращивания на среде, свободной от жирных кислот (WPM Syn A 40: 40). Продукты представляют собой натуральные авермектины.
Фиг. 3: УФ-построение (длина волны 240 нм) хроматографа ВЭЖХ фракции растворителя из экстракции растворителем клеток S. avermitilis 1-3 (ATCC 53567) после выращивания на среде, содержащей циклопентилкарбоксильную кислоту (см. пример 1).
Прилагаемые фигуры являются точными построениями кривых ВЭЖХ указанных соединений.
Составы сред, используемых в следующих примерах, представлены ниже. Все определения молекулярной массы достигнуты масс-спектрометрией с бомбардировкой ускоренными атомами, осуществленной на масс-спектрометре VG Модели 7070E с использованием матрицы для образцов триэтиленгликоля с твердым хлоридом натрия. Определяют (M + Na)+. Масс-спектрометрию с электронным ударом осуществляют с использованием масс-спектрометра VG Модели 7070F, получая значения м/э, единственные зарегистрированные значения для главных фрагментов.
Среда AS-7, г/л:
Разжиженный крахмала 20
Ардамин pHб 5
Фармамедияв 15
CaCO3 2
аПолучен гидролизом крахмала альфаамилазой из
Bacillus licheniformis (поставляется Ново Энзиме, Уилтон, Коннектикут и продается под товарным знаком "Термамил") до эквивалента декстрозы 40% ± 5%
бПоставляется Иист
Продактс, Инк. Клифтон, Нью-Джерси 07012
вПоставляется Трайдерс Протеин, Мемфис, Теннеси 38108.
pH смеси доводят до 7,2 посредством NaOH.
Среда
АР-5, г/л:
Разжиженный крахмал 80
Ардамин pH 5
K2HPO4 4
MgSO4•7H2O 1
NaCl 1
CaCO3
7
FeSO4•7H2O 0,01
MnCl2•7H2O 0,001
ZnSO4•7H2O 0,001
P-2000 (пеногаситель),
мл/л 1
pH смеси доводят до 6,9. посредством 25%-ного раствора NaOH.
WPM Syn A 40:40, г/л дистиллированной воды
Разжиженный крахмал 40
Картофельный
растворимый крахмал 40
Глутаминовая кислота 1,0
Аргинин 0,168
Цистин 0,084
Гистидин 0,069
Лейцин 0,798
Лизин 0,297
Метионин 0,108
Фенилаланин 0,168
Треонин 0,174
Триптофан 0,048
Тирозин 0,192
K2HPO4 1,0
MgSO4•7H2O 1,0
NaCl 1,
0
CaCO3 3,5
FeSO4•7H2O 0,01
MnCl2•4H2O 0,001
ZnSO4•7H2O 0,001
pH смеси доводят до 6,8 7,0; перемешивают в течение 30 мин при температуре 121oC.
WPM Syn B 40:40, г/л дистиллированной воды
Картофельный растворимый крахмал
40
Разжиженный крахмал 40
Глутаминовая кислота 0,390
Аргинин 0,168
Цистин 0,084
Гистидин 0,069
Лизин-HCl 0,297
Метионин 0,108
Фенилаланин 0,168
Треонин 0,174
Триптофан 0,048
Тирозин 0,192
K2HPO4 1
MgSO4•7H2O 1
NaCl 1
CaCO3 3,5
FeSO4•7H2O 0,01
MnCl2•4H2O 0,001
ZnSO4•7H2O 0,001
pH смеси доводят до 6,3 7,0, перемешивают в течение 30 мин при температуре 121oC.
Общие методики высокоэффективной жидкостной хроматографии (ВЭЖХ)
Подвижная фаза:
150 мл воды, 70 мл ацетонитрила, доводят до 1 л метанолом.
Колонка: Ультрасфере ODS 25 см (Бекман Инструментс, Фуллертон, Калифорния 92634-3100).
Расход: 0,75
мл/мин
Обнаружение: УФ при длине волны 240 нм
Затухание: около 6
Разбавитель образца /D/:
35 мл ацетонитрила и 390 мл метанола
Эталоны:
1.
Отвешивают 0,5 мг авермектина A2A в 10 мл колбу и доводят до объема метанолом
2. Отвешивают 0,5 мг испытуемого продукта в 10 мл колбу и доводят до объема метанолом
1 и 2 являются
стандартными основными растворами; для проведения испытания стандартного раствора помещают 100 мкл /1/ и 100 мкл /2/ в пробирку и прибавляют туда 300 мкл подвижной фазы.
Пробы:
1. Берут 1 мл хорошо взболтанного бульона и центрифугируют.
2. Удаляют как можно большее количество надосадочного слоя, не тревожа осадок в пробирке после центрифугирования.
3. Прибавляют 100 мкл воды ВЭЖХ к осадку и завихряют смесь для диспергирования.
4. Прибавляют 2 мл разбавителя /D/ и хорошо смешивают.
5. Фильтруют смесь и осуществляют ВЭЖХ.
Натуральные авермектины подвергают высокоэффективной жидкостной хроматографии, и время удерживания пиков отдельных авермектинов делят на время удерживания, наблюдаемое для присутствующего олигомицина A, и оно служит в качестве внутреннего эталона для определения данной ВЭЖХ. Олигомицин A почти всегда обнаруживается ВЭЖХ в качестве побочного продукта ферментаций S. avermitilis и единственного продукта, видимого при ВЭЖХ, который продуцируется описываемыми здесь мутантами, когда их выращивают в среде, свободной от кислот RCOOH, где R имеет вышеприведенное значение, или в среде, свободной от соединений, конвертируемых в кислоты формулы RCOOH, где R имеет вышеприведенное значение. Обычно время удерживания олигомицина A составляет 12,5 14 мин. Отношение значений времени удерживания /ВУ/ дает более значительное основание для сравнения идентичности и выходов продуктов авермектина. Общий порядок появления продуктов авермектина при ВЭЖХ представляет собой B2, A2, B1 и A1 (Фиг. 2).
Натуральный авермектин ВУ/ВУ /олигомицин A/
B2b 0,70
B2a 0,84
A2b 0,90
A2a 1,09
B1b 1,40
B1a 1,83
A1b 1,83
A1a 2,42
Ненатуральный авермектин ВУ/ВУ /олигомицин A/
Циклопентил B2 0,94
Циклопентил A2 1,23
Циклопентил B1 1,99
Циклопентил A1 2,62
Отношения определяют из фиг. 2 для натуральных авермектинов (следует отметить, что B1a и B1b являются неразделенными) и из фиг. 3 для ненатуральных авермектинов. Значения
времени удерживания варьируются от 1 до 2 мин в различные дни, при этом олигомицин A, как правило, появляется в течение периода времени от 12,5 до 14 мин.
В следующих примерах авермектины определяют с использованием вышеописанной методики высокоэффективной жидкостной хроматографии.
Пример 1
Циклопентилавермектин A2
S. avermitilis A-З (ATCC
53567) культивируют при температуре 28 - 30oC в среде AS-7 со встряхиванием в течение 24 ч. 5 мл порцию используют для инокулирования 500 мл колбы, содержащей 100 мл среды AS-7, и
инкубирование осуществляют при таких же условиях в течение 24 ч. 1 мл этой культуры используют для инокулирования среды AP-5 /40 мл в 300 мл колбе/, к которой позднее прибавляют 0,4 г/л
циклопентанкарбоновой кислоты /натриевую соль/. Колбы с продуктом подвергают обработке со встряхиванием при температуре 28 - 30oC. Через 240 ч получают 35 мг/л циклопентилавермектина A2,
тогда как соответствующий титр натурального A2a составляет 0. Также получают другие циклопентилавермектины.
Пример 2
Циклопентилавермектин A2
Замороженную пробирку
S. avermitilis HL-026 /ATCC 53568/ используют для инокулирования 100 мл среды AS-7 в 500 мл колбе. Рост сопровождает культивирование при температуре 28 30oC при встряхивании в течение 24 ч.
1 мл аликвотную пробу используют для инокулирования двух дополнительных 500 мл колб, содержащих 100 мл среды AS-7, и эти последние колбы по истечении 13 ч культивирования используют для инокулирования
10 л среды AP-5 (меньшее количество NaCl). Через 24 ч культивирования при температуре 28oC к среде прибавляют 0,4 г/л циклопентанкарбоновой кислоты, перемешивание осуществляют так, чтобы
растворившийся кислород поддерживался на уровне выше 20% насыщения. Титры циклопентила A2 при 120, 163, 216, 264 и 312 ч составляют 16, 40, 60, 88 и 110 мг/л соответственно. Посредством контраста
определено, что в этих пробах титр соответствующего натурального авермектина A2a составляет С (то есть не обнаружен).
Пример 3
Циклопентилавермектин A2
В этом
эксперименте осуществляют обогащение продукционной среды и проводят многократные прибавления циклопентанкарбоновой кислоты с тем, чтобы повысить титры циклопентилавермектина. Условия для развития
инокулята и ферментации такие же, как в примере 2, за исключением следующего: прибавляют дополнительно 5 г/л ардамина pH (до полного содержания 10 г/л) в среду AP-5 и 0,4, 0,2 и 0,2 г/л
циклопентанкарбоновой кислоты прибавляют при 30, 172 и 220 соответственно. Титры циклопентилавермектина A2 составляют 1,2, 11,78, 137 и 214 мг/л при 168, 216, 264 и 312 ч соответственно.
Пример 4
Циклопентилавермектины
Замороженную пробирку S. avermitilis HL-026 (ATCC 53568) используют для инокулирования 100 мл среды AS-7 в 500 мл колбе с перегородками,
которую инкубируют в течение 24 28 ч при температуре 28 30oC. Затем 1 мл этой культуры используют для инокулирования 300 мл колбы, содержащей 40 мл среды AP-5 (меньшее количество NaCl, но с
прибавлением 0,6 г/л глутаминовой кислоты). Через 96 ч инкубации при температуре 28 30oC со встряхиванием прибавляют 0,4 г/л циклопентанкарбоновой кислоты (натриевая соль).
Высокоэффективная жидкостная хроматография пробы на 216 ч показывает наличие циклопентилавермектинов B2, A2, B1 и A1 со значениями времени удерживания 12,32, 15,86, 25,28 и 32,96 мин
соответственно.
Пример 5
Циклопентилавермектин A2
В данном примере S. avermitilis 1-3 /ATCC 53567/ и S. avermitilis HL-026 /ATCC 53568/ выращивают при одинаковых
условиях. Используют три среды (AP-5, WPM Syn A 40:40 и WPN Syn B 40:40). Замороженную культуру каждого микроорганизма используют для инокулирования 100 мл среды AS-7 в 500 мл колбах с перегородками,
которые инкубируют последовательно в течение 24 26 ч при температуре 28 30oC. Затем 1 мл каждой культуры используют для инкулирования 300 мл колб, каждая из которых содержит 40 мл одной из
трех сред. Дублеты каждой колбы перегоняют, через 24 ч культивирования при температуре 28oC со встряхиванием в каждую колбу прибавляют 0,4 г/л циклопентилкарбоновой кислоты (натриевая соль)
и через 192 ч культивирования определяют титры основного продукта, циклопентилавермектина A2 (табл. 2).
Пример 6
Циклогексилавермектины
В данном примере 0,2 г/л
циклогексанкарбоновой кислоты прибавляют на 96 ч вместо циклопентанкарбоновой кислоты, и все другие условия остаются такими же, как в примере 4. Четыре циклогексилавермектина идентифицируют на
хроматограмме ВЭЖХ пробы, взятой через 240 ч. Значения времени удерживания для циклогексилавермектинов B2, A2, B1 и A1 составляют 14,84, 19,26, 31,46 и 41,14 мин соответственно.
Пример 7
3-Циклогексениловые авермектины
В данном примере 0,2 г/л 3-циклогексенкарбоновой кислоты прибавляют на 96 ч вместо циклопентанкарбоновой кислоты, и все другие условия
остаются такими же, как в примере 4. Несколько циклогексениловых авермектинов идентифицируют на хроматограмме ВЭЖХ пробы, взятой через с 12 ч. Их значения времени удерживания составляют 12,88 /B2/, 16,
39 /A2/, 27,37 /28,36/ /B1-изомеры/ и 35,80 /37,13/ A1-изомеры/ мин соответственно.
Пример 8
3-Тиениловые авермектины
В данном примере 0,05 г/л тиофен-5-карбоновой
кислоты прибавляют на 96 ч вместо циклопентанкарбоновой кислоты, и все другие условия остаются такими же, как в примере 4. Четыре 3-тиенилавермектина идентифицируют на хроматограмме ВЭЖХ пробы, взятой
через 312 ч. Значения времени удерживания для 3-тиенилавермектинов B2, A2, B1 и A1 составляют 6,96, 8,76, 13,8 и 23,5 мин соответственно.
Пример 9
1-Метилтиоэтиловые
авермектины
В данном примере 0,4 и 0,2 г/л 2-метилтиопропионовой кислоты прибавляют на 24 и 96 ч соответственно вместо циклопентанкарбоновой кислоты, и все другие условия остаются такими же,
как в примере 4. Два 1-метилтиоэтиловых авермектина идентифицируют на хроматограмме ВЭЖХ пробы, взятой через 240 ч. Значения времени удерживания для 3-тиенилавермектинов A2 и B1 составляют 9,30 и 13,
08 мин соответственно. Пик при расчетном времени удерживания около 7,2 мин, появляющийся на переднем плече 7,557-минутного пика, как полагают, является соединением B2, а соединение A1, как полагают,
находится под 17,22-минутным пиком.
Пример 10
2-Пентиловые авермектины
В данном примере 0,2 г/л 2-метилвалериановой кислоты прибавляют на 96 ч вместо
циклопентанкарбоновой кислоты, и все другие условия остаются такими же, как в примере 4. Четыре 2-пентилавермектина идентифицируют на хроматограмме ВЭЖХ пробы, взятой через 312 ч. Значения времени
удерживания для 2-пентилавермектинов B2, A2, B1 и A1 составляют 12,88, 16,58, 31,90 и 41,92 мин соответственно.
Пример 11
1-Метил-3-бутенилавермектины
В данном
примере 0,2 г/л 2-метил-4-пентеновой кислоты прибавляют на 96 ч вместо циклопентанкарбоновой кислоты, и все другие условия остаются такими же, как в примере 4. Четыре 1-метил-3-бутениловых авермектина
идентифицируют на хроматограмме ВЭЖХ пробы, взятой через 312 ч. Значения времени удерживания для 1-метил-3-бутенилавермектинов B2, A2, B1 и A1 составляют 11,13, 14,78, 22,10 и 28,92 мин
соответственно.
Пример 12
1-Метил-1-бутенилавермектины
В данном примере 0,2 г/л 2-метил-2-пентеновой кислоты прибавляют на 96 ч вместо циклопентанкарбоновой кислоты,
и все другие условия остаются такими же, как в примере 4. Четыре 1-метил-1-бутенилавермектина идентифицируют на хроматограмме ВЭЖХ пробы, взятой через 312 ч. Значения времени удерживания для
1-метил-1-бутенилавермектинов B2, A2, B1 и A1 составляют 11,59, 14,93, 25,29 и 33,18 мин соответственно.
Пример 13
В данном примере показано использование мутанта для
получения натуральных авермектинов, происходящих от L-валина в отсутствие авермектинов, происходящих от 1-изолейцина. Содержимое замороженной пробирки, содержащей S. avermitilis 1-3 /ATCC 53567/,
переносят в 500 мл колбу с перегородками, содержащую 100 мл среды АS-7. Приблизительно через 1 день содержания при температуре 28 30oC со встряхиванием (приблизительно 200 об/мин) 1 мл
культуры используют для инокулирования 40 мл среды WPM Syn A 40:40 в 600 мл колбе, которую затем инкубируют при температуре 28 30oC в течение 24 ч с перемешиванием. В это время прибавляют 4
мл стерилизованного фильтрацией раствора изомасляной кислоты (нейтрализованного до pH 6 7 при помощи NaOH/, 4 мг/мл, и культивирование продолжают, как выше, в течение 8 дней. ВЭЖХ-анализ показывает
наличие четырех более значительных пиков (исключая олигомицин). (В аналогичных экспериментах с 2-метилмасляной кислотой вместо изомасляной кислоты видны комплементарные четыре пика авермектинов,
происходящих от L-изолейцина).
Пример 14
Повторяют методику примера 1, но заменяя исходными соединениями, перечисленными ниже, циклопентанкарбоновую кислоту. Также приведены
авермектины (соединения формулы 1, где R2 представляет собой часть дисахарида олеандрозы, a R, R1 и R3 имеют показанные значения), идентифицированные из данной
ферментации (табл. 3).
Другие физико-химические данные для некоторых из вышеприведенных соединений представлены в табл. 4.
Пример 15
Восстановление
циклопентилавермектина A2
Данный пример приведен для демонстрации процесса восстановления A2-подобных авермектинов, образованных из предшественника циклопентанкарбоновой кислоты. Весь бульон
(из ферментации, аналогичной описанной в примере 2) фильтруют и мицеллярную клеточную массу экстрагируют дважды ацетоном (3 объема). Ацетоновый экстракт концентрируют до водного масла, масло
экстрагируют метиленхлоридом и раствор метиленхлорида концентрируют до масла темно-коричневого цвета. Темно-коричневое масло затем растворяют в растворе метанол/вода (4:1), и полученный раствор
экстрагируют гексаном для удаления жирных кислот/липидов. Упаривание смеси метанол/вода позволяет получить масло светло-коричневого цвета, содержащее около 10 мас. циклопентилавермектина A2.
Неочищенное масло авермектина затем разбавляют хлороформом (3 мл CHCl3) на 1 г масла), активированным углем (0,35 г/г масла) и силикагелем (1 г/г масла), и смесь перемешивают в течение 1 ч
и затем фильтруют. Фильтрат концентрируют и полученное масло разбавляют простым изопропиловым эфиром (1 мл ИПЭ на 1 г масла). Полученный раствор затем подают по каплям в большой объем гексана (25 мл
гексана на 1 г масла), после чего осаждается неочищенный порошок авермектина белого цвета. Первую массу выделяют посредством фильтрования и фильтрат затем охлаждают до температуры около 5oC
с тем, чтобы высвободить вторую массу.
Неочищенные продукты в дальнейшем перерабатывают препаративной высокоэффективной жидкостной хроматографией с получением очищенного продукта. Сырье растворяют (4,1 мл растворителя на 1 г неочищенного порошка) в смеси 25/25/25/50/0,125 ИПЭ /CH3CN/этилацетат/гексан/уксусная кислота. Пробы пропускают на 41,4 мм x 25 см препаративную колонку с кремнеземом и элюируют вышеуказанным растворителем со скоростью 30 мл/мин, и продуктсодержащий пик собирают. Собранные фракции концентрируют и разбавляют смесью MeOH /H2O /86/14/ так, что 1 мл содержит приблизительно 50 мг продукта. Пробы затем пропускают на препаративную колонку C-18 (такие же размеры, что и у колонки с кремнеземом) и элюируют при скорости 18 20 мл/мин смесью MeOH/H2O /275 мл воды к 2 л с MeOH/. Фракции вновь концентрируют и пропускают через препаративную колонку C-18 второй раз. Упаривание продуктсодержащих фракций до сухости приводит к получению чистого продукта, указанного в заголовке.
Соответствующие циклопентиловые авермектины B2, A1 и B1 восстанавливают путем отбора подходящих фракций из вышеописанных стадий высокоэффективной жидкостной хроматографии.
Пример 16
Мицелий JC 923 S. avermitilis (ATCC 5S689) с агаровой среды YPD-2 используют для инокулирования 50 мл среды AS-7
в 300 мл колбе с перегородками, которую сохраняют при встряхивании (220 об/мин) при температуре 30oC в течение 24 ч. Затем каждую из двух 300 мл колб (без перегородок), содержащих 50 мл
среды AP-5, инокулируют одним миллилитром культуры. Одна колба содержит 2-метилмасляную кислоту (0,1%-ную), и другая не содержит 2-метилмасляной кислоты. Ферментацию осуществляют при температуре
30oC в течение 11 дней со встряхиванием. Содержимое каждой колбы перерабатывают одним и тем же способом. Весь бульон экстрагируют четырехкратным объемом избытка смеси ацетонитрил:метанол
(810:75). После энергичного встряхивания для промотирования антибиотической экстракции из клеток очищенный надосадочный слой анализируют посредством ВЭЖХ на авермектины. Когда нет прибавления
предшественников жирных кислот, не обнаруживаются (чувствительность ≅ 0,20 мг/л) авермектины (типа "a"). В присутствии 2-метилмасляной кислоты авермектины B2a, A2a, B1a, A1a обнаруживают при 0,
5, 1,3, 1,4 и 1,1 мг/л соответственно.
Пример 17
В данном примере AP-5-продуцирующие ферментации JC 923 S. avermitilis /ATCC 53069/ получают из инокулятов, выросших в среде
AS-7, как описано в примере 16. Праймерное соединение, 2-метилмасляная кислота, присутствует при концентрации 0,05% В данном случае контрольная ферментация без пополнения (нет предшественника жирных
кислот) дает значения 0,3, 0,9, <0,2 и <0,2 мг/л для авермектинов B2a, A2a, B1a и A1a соответственно, тогда как результаты ферментаций при добавлении жирных кислот составляют 2,8, 5,0, 4,
5 и 2,3 мг/л соответственно.
Пример 18
В данном примере AP-5-продуцирующие ферментации JC 923 S. avermitilis /ATCC 53669/ получают из инокулятов, выросших на среде AS-7, как
в примере 17. В данном примере 2-метилмасляную кислоту прибавляют при концентрации 0,05% через 48 ч после инокуляции среды AP-5, и клетки собирают фильтрацией, взвешивают (влажный вес) и экстрагируют
четырехкратным избытком массы экстракционного растворителя. Эта стадия концентрирования обеспечивает более высокую чувствительность при измерениях титров авермектинов по сравнению с предыдущими
случаями, при которых все бульонные массы сразу же экстрагировали. В данном примере уровни B2a, A2a, B1a, A1a, равные 2,5, 8,5, 4,5 и 3,5 мг/л соответственно, определяют для ферментации в присутствии
2-метилмасляной кислоты по сравнению со значениями 0,3, 0,3, 0,3 и 0,1 для непополненной контрольной ферментации. Эти последние, более низкие уровни, по-видимому, можно отнести к более низким уровням
эндогенных соединений жирных кислот в среде продуцирования AP-5.
Пример 19
Ферментации осуществляют, как в примере 18, за исключением того, что циклопентанкарбоновую кислоту
при концентрации 0,045% используют вместо 2-метилмасляной кислоты. Обнаружено, что циклопентилавермектин A2 присутствует при концентрации 4 мг/л.
Пример 20
Ферментации (16)
PGS-119 S. avermitilis (ATCC 53670) осуществляют в 50 мл среды AP-5 в 300 мл колбах (без перегородок), инкубируемых при температуре 30oC. Среду инокулируют 1 мл 24-часовой культуры штамма в
среде AS-7 при температуре инкубирования 30oC, 50 мл среды в 300 мл колбе с перегородками. Через 66 ч роста в среде AP-5 в восемь колб прибавляют изомасляную кислоту при концентрации 0,1% С
использованием методики переработки примера 16 находят, что эти пополненные кислотой колбы дают концентрации B2b, A2b, B1b и A1b, равные (среднее из двух экспериментов) 5,6, 45, 45 и 68 мг/л
соответственно. Непополненные кислотой культуры дают значения, равные 0,5, 4,0, 4,5 и ≅ 8,5 мг/л соответственно. Кроме того, для последней ферментации обнаружены значения 1,1, 1,1, неопределено
и <0,2 мг/л для соответственных авермектинов B2A, A2a, B1a и A1a.
Пример 21
В данном примере четыре AP-5-ферментации PGS-119 S. avermitilis /ATCC 53070/ осуществляют в
2 мл культурах в пластмассовых пробирках (15 мл). Инокуляты получают, как описано в примере 20, в среде AS-7 при температуре 30oC со встряхиванием пробирок, поддерживаемых в положении
наклона под углом 30o. Жирнокислотный предшественник, циклогексанкарбоновую кислоту (ЦКК), при концентрации 0,045% прибавляют на 96 ч после AP-5-инокулирования двух пробирок. Через 400 ч
после AP-5-инокулирования с использованием 0,05 мл культуры AS-7 в каждую пробирку прибавляют 8 мл экстракционного растворителя (ацетонитрил: метанол (810: 75)), и титры авермектинов определяют в
надосадочных слоях посредством ВЭЖХ-анализа, как описано в тексте. Для авермектинов ЦКК-B2, ЦКК-A2, ЦКК-B1, ЦКК-A1, A2b, B1b, A1b, A2b и A1a концентрации равны (среднее из двух пробирок) 3,5, 6,2, 3,0,
1,4, 0,2, 0,2, 0,4, 0,2 <0,2 мг/л соответственно. Соответствующие значения для двух ферментационных пробирок, не получивших никакого кислотного предшественника, составляют <0,2, <
0,2, <0,2, <0,2, 4,2, 2,9; 9,3, 1,2 и 0,3 мг/л соответственно. Все другие натуральные авермектины, по существу, не поддаются обнаружению.
Реферат
Использование: биотехнология, натуральные и ненатуральные авермектины, штамм - продуцент авермектина. Сущность изобретения: для получения натуральных и ненатуральных авермектинов с определенным значением радикала R используют штаммы Streptomyces avermitilis, не обладающие одной или двумя активностями ферментов дегидрогеназы 2-оксо-кислоты с разветвленной цепью и трансаминазы аминокислоты с разветвленной цепью. Штаммы Str. avermitilis депонированы в Американской коллекции типовых культур (ATCC) и имеют коллекционные номера ATCC NN 53567, 53568, 53669 и 53670. Получаемые авермектины проявляют сильную противопаразитарную активность. 5 с. и 7 з.п. ф-лы, 3 ил., 4 табл.
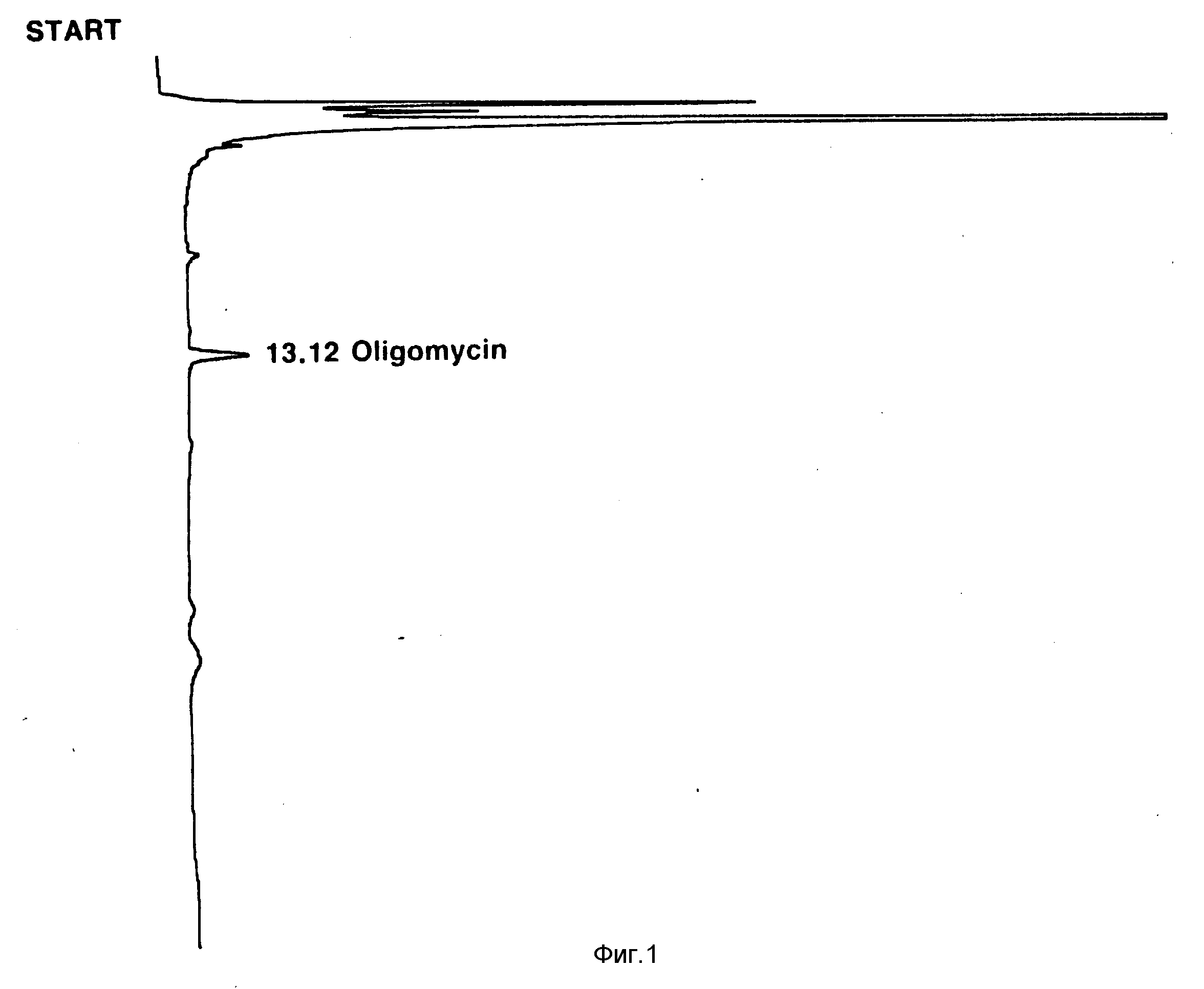
Формула
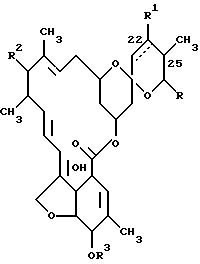
где прерывистая линия в положении 22 23 представляет возможную двойную связь;
R1 гидрокси и присутствует, только когда отсутствует указанная двойная связь;
R2 -4-(альфа-L-олеандрозил)-альфа-L-олеандрозиокси формулы II

где R3 водород или метил;
R альфа-разветвленный C3 C6-алкил, алкенил, C3 - C8-алкоксиалкил или алкилтиоалкил, C3 C8-циклоалкил или C5 C8-циклоалкенил, каждый из которых может быть замещен метиленовой или одной или более C1 C4-алкильными группами или галоген-атомами, или 3 6-членное кислород- или серосодержащее гетероциклическое кольцо, которое может быть насыщенным или полностью или частично ненасыщенным и которое может быть по желанию замещено одной или несколькими C1 C4-алкильными группами путем культивирования продуцента вида Streptomyces avermitilis в аэробных условиях в водной питательной среде, содержащей усваиваемый источник азота, углерода и неорганических солей в присутствии карбоновой кислоты RCOOH, где R имеет вышеприведенные значения, или в присутствии соединения, конвертируемого в RCOOH, с последующим выделением целевого продукта, отличающийся тем, что в качестве продуцента используют штамм Streptomyces avermitilis, не обладающий одной или обеими активностями дегидрогеназы 2-оксокислоты с разветвленной цепью и трансаминазы аминокислоты с разветвленной цепью.

Комментарии