Соединение, композиция для борьбы с насекомыми, способы борьбы с насекомыми - RU2298007C2
Код документа: RU2298007C2
Описание
Данное изобретение относится к некоторым иминобензоксазинам, иминбензтиазинам и иминохиназолинам, их N-оксидам, солям и композициям, подходящим для сельскохозяйственного и несельскохозяйственного применения, включая области применения, перечисленные ниже, и к способам борьбы с беспозвоночными вредителями в сельскохозяйственной и несельскохозяйственной областях применения.
Подавление беспозвоночных вредителей является очень важным для достижения высокой эффективности получения урожая. Урон, наносимый беспозвоночными вредителями сельскохозяйственным зерновым культурам при их выращивании и хранении, может вызывать значительное снижение продуктивности и, таким образом, приводить к повышению стоимости продукции для потребителя. Борьба с беспозвоночными вредителями имеет также большое значение в лесоводстве, при выращивании культурных растений в теплицах, декоративных культур и рассады для питомников, хранении пищевых продуктов и волокнистых продуктов, при разведении домашнего скота, в домашнем хозяйстве, общественном здравоохранении и ветеринарии. Для применения в этих областях доступно большое количество продуктов, однако сохраняется потребность в новых соединениях, которые являются более эффективными, менее дорогостоящими, менее токсичными, более безопасными для окружающей среды или обладающими различными механизмами действия.
В публикации NL 9202078 описываются производные N-ацилантраниловой кислоты формулы i в качестве инсектицидов

где Х представляет прямую связь; Y представляет Н или С1-С6алкил; Z представляет NH2, NH(C1-C3алкил) или N(C1-C3алкил)2 и R1-R9 независимо представляют Н, галоген, С1-С6алкил, фенил, гидрокси, С1-С6 алкокси или С1-С7ацилокси.
В публикации WO 00/31082 описываются пиридин-4-енамины формулы ii в качестве фунгицидов

где А представляет конденсированное бензольное кольцо; R1, R2и R3 представляют Н, галоген, необязательно замещенный алкил, алкенил или алкинил; R4 представляет необязательно замещенный фенил; R5 представляет необязательно замещенный алкил, алкенил или алкинил и R6 представляет Н или необязательно замещенный алкил, алкенил или алкинил.
Данное изобретение относится к способу борьбы с беспозвоночными вредителями, включающему контактирование беспозвоночного вредителя или его среды обитания с биологически эффективным количеством соединения формулы I, его N-оксида или сельскохозяйственно приемлемой соли соединения (например, в виде композиции, описанной в данном изобретении)

где В представляет О, S или NR1;
J представляет фенильное кольцо, нафтильную кольцевую систему, 5- или 6-членное гетероароматическое кольцо или ароматическую 8-, 9- или 10-членную конденсированную гетеробициклическую кольцевую систему, где каждое кольцо или кольцевая система необязательно замещены 1-4 R5;
R1 представляет К;
каждый К независимо представляет G; С1-С6алкил, С2-С6алкенил, С2-С6алкинил, С3-С6циклоалкил, каждый из которых необязательно замещен одним или несколькими заместителями, выбранными из группы, включающей галоген, G, CN, NO2, гидрокси, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С2-С6алкоксикарбонил, С2-С6 алкилкарбонил, С3-С6триалкилсилил, и фенил, фенокси или 5- или 6-членное гетероароматическое кольцо, где каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из R6; гидрокси; С1-С4алкокси; С1-С4алкиламино; С2-С8диалкиламино; С3-С6 циклоалкиламино; С2-С6алкоксикарбонил и С2-С6алкилкарбонил;
R2 представляет Н или К или
R1 и R2, взятые вместе, образуют связывающую цепь из 2-5 членов, включающую, по меньшей мере, один углеродный член, необязательно включающую не более двух углеродных членов вида С(=О), необязательно включающую один дополнительный член, выбранный из азота и кислорода, и необязательно замещенную 1-4 заместителями, выбранными из R3;
каждый R3 независимо представляет С1-С4алкил, галоген, CN, NO2 или С1-С2алкокси;
G представляет 5- или 6-членное неароматическое карбоциклическое или гетероциклическое кольцо, необязательно включающее один или два кольцевых члена, выбранных из группы, состоящей из С(=О), SO и S(O)2, и необязательно замещенное 1-4 заместителями, выбранными из R3;
каждый R4 независимо представляет Н, С1-С6алкил, С2-С6алкенил, С2-С6алкинил, С3-С6циклоалкил, С1-С6галогеналкил, С2-С6галогеналкенил, С2-C6галогеналкинил, С3-С6 галогенциклоалкил, галоген, CN, NO2, гидрокси, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4 алкилсульфинил, С1-С4алкилсульфонил, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинил, С1-С4 галогеналкилсульфонил, С1-С4алкиламино, С2-С8диалкиламино, С3-С6циклоалкиламино, С2-С5алкоксиалкил, С1 -С4гидроксиалкил, С(О)R10, CO2R10, C(O)NR10R11, NR10R11, N(R11)CO2R10 или С3-С6триалкилсилил или
каждый R4 независимо представляет фенил, бензил, фенокси или 5- или 6-членное гетероароматическое кольцо, причем каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из R6;
каждый R5 независимо представляет С1-С6алкил, С2 -С6алкенил, С2-С6алкинил, С3-С6циклоалкил, С1-С6галогеналкил, С2-С6галогеналкенил, С2 -C6галогеналкинил, С3-С6галогенциклоалкил, галоген, CN, CO2Н, CONH2, NO2, гидрокси, С1-С4алкокси, С1 -С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинил, С1-С4галогеналкилсульфонил, С1-С4алкиламино, С2-С8диалкиламино, С3-С6циклоалкиламино, С2-С6алкилкарбонил, С2-С6алкоксикарбонил, С2-С6алкиламинокарбонил, С3-С8 диалкиламинокарбонил, С3-С6триалкилсилил или
каждый R5 независимо представляет фенил, бензил, бензоил, фенокси, 5- или 6-членное гетероароматическое кольцо или ароматическую 8-, 9- или 10-членную конденсированную гетеробициклическую кольцевую систему, причем каждое кольцо или каждая кольцевая система необязательно замещена одним-тремя заместителями, независимо выбранными из R6, или
две группы R5, когда присоединены к соседним атомам углерода, взятые вместе, образуют группу -OCF2O-, -CF2CF2O- или -OCF2CF2O-;
каждый R6 независимо представляет С1-С4алкил, С2-С4алкенил, С2-С4алкинил, С3-С6циклоалкил, С1-С4галогеналкил, С2-С4галогеналкенил, С2-C4галогеналкинил, С3-С6галогенциклоалкил, галоген, CN, NO2, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С1-С4алкиламино, С2-С8диалкиламино, С3-С6 циклоалкиламино, С4-С8алкил(циклоалкил)амино, С2-С4алкилкарбонил, С2-С6алкоксикарбонил, С2-С6алкиламинокарбонил, С3-С8диалкиламинокарбонил или С3-С6триалкилсилил;
R10 представляет Н, С1-С4алкил или С1-С4галогеналкил;
R11 представляет Н или С1-С4алкил и
n представляет целое число от 1 до 4.
Данное изобретение относится также к такому способу, где беспозвоночный вредитель или среда его обитания контактирует с биологически эффективным количеством соединения формулы I или композиции, включающей соединение формулы I и биологически эффективное количество, по меньшей мере, одного дополнительного соединения или агента для подавления беспозвоночных вредителей.
Данное изобретение относится также к соединению формулы Is, его N-оксидам или его солям
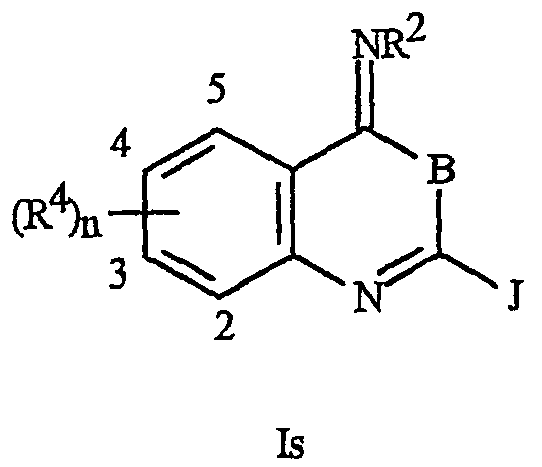
где В представляет О или S;
J представляет фенильное кольцо, нафтильную кольцевую систему, 5- или 6-членное гетероароматическое кольцо или ароматическую 8-, 9- или 10-членную конденсированную гетеробициклическую кольцевую систему, где каждое кольцо или кольцевая система является необязательно замещенным(ой) 1-4 R5;
R2 представляет Н; G; С1 -С6алкил, С2-С6алкенил, С2-С6алкинил, С3-С6циклоалкил, каждый из которых необязательно замещен одним или несколькими заместителями, выбранными из группы, включающей галоген, G, CN, NO2, гидрокси, С1-С4алкокси, С1-С4галогеналкокси, С1-С4 алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С2-С6алкоксикарбонил, С2-С6алкилкарбонил, С3 -С6триалкилсилил; или фенил, фенокси или 5- или 6-членное гетероароматическое кольцо, причем каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из R6; гидрокси; С1-С4алкокси; С1-С4алкиламино; С2-С8диалкиламино; С3-С6циклоалкиламино; С2-С6алкоксикарбонил и С2-С6алкилкарбонил;
G представляет 5- или 6-членное неароматическое карбоциклическое или гетероциклическое кольцо, необязательно включающее один или два кольцевых члена, выбранных из группы, состоящей из С(=О), SO и S(O)2, и необязательно замещенное 1-4 заместителями, выбранными из R3;
каждый R3 независимо представляет С1-С2алкил, галоген, CN, NO2 или С1-С2алкокси;
каждый R4 независимо представляет Н, С1-С6алкил, С2-С6алкенил, С2-С6алкинил, С3-С6циклоалкил, С1-С6галогеналкил, С2-С6галогеналкенил, С2-C6галогеналкинил, С3-С6галогенциклоалкил, галоген, CN, NO2, гидрокси, С1-С4 алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинил, С1-С4галогеналкилсульфонил, С1-С4алкиламино, С2-С8 диалкиламино, С3-С6циклоалкиламино, С2-С5алкоксиалкил, С1-С4гидроксиалкил, С(О)R10, CO2R10, C(O)NR10R11, NR10R11, N(R11)CO2R10 или С3-С6триалкилсилил или
каждый R4 независимо представляет фенил, бензил, фенокси или 5- или 6-членное гетероароматическое кольцо, причем каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из R6;
каждый R5 независимо представляет С1-С6алкил, С2-С6алкенил, С2-С6алкинил, С3-С6циклоалкил, С1-С6галогеналкил, С2-С6галогеналкенил, С2-C6галогеналкинил, С3-С6галогенциклоалкил, галоген, CN, CO2Н, CONH2, NO2, гидрокси, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинил, С1-С4 галогеналкилсульфонил, С1-С4алкиламино, С2-С8диалкиламино, С3-С6циклоалкиламино, С2-С6алкилкарбонил, С2-С6алкоксикарбонил, С2-С6алкиламинокарбонил, С3-С8диалкиламинокарбонил или С3-С6триалкилсилил или
каждый R5 независимо представляет фенил, бензил, бензоил, фенокси, 5- или 6-членное гетероароматическое кольцо или ароматическую 8-, 9- или 10-членную конденсированную гетеробициклическую кольцевую систему, причем каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из R6, или
две группы R5, когда они присоединены к соседним атомам углерода, взятые вместе, образуют группу -OCF2O-, -CF2CF2O- или -OCF2CF2O-;
каждый R6 независимо представляет С1-С4алкил, С2-С4алкенил, С2-С4алкинил, С3-С6циклоалкил, С1-С4галогеналкил, С2-С4галогеналкенил, С2-C4галогеналкинил, С3-С6галогенциклоалкил, галоген, CN, NO2, С1-С4алкокси, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С1-С4 алкиламино, С2-С8диалкиламино, С3-С6циклоалкиламино, С4-С8(алкил)циклоалкиламино, С2-С4алкилкарбонил, С2-С6алкоксикарбонил, С2-С6алкиламинокарбонил, С3-С8диалкиламинокарбонил или С3-С6триалкилсилил;
R10 представляет Н, С1-С4алкил или С1-С4галогеналкил;
R11 представляет Н или С1-С4алкил и
n представляет целое число от 1 до 4.
Данное изобретение относится также к композиции для борьбы с беспозвоночными вредителями, включающей биологически эффективное количество соединения формулы I и, по меньшей мере, один дополнительный компонент, выбранный из группы, состоящей из поверхностно-активных веществ, твердых и жидких разбавителей. Данное изобретение относится также к таким композициям, необязательно дополнительно включающим эффективное количество, по меньшей мере, одного дополнительного биологически активного соединения или агента.
В приведенном выше описании термин «алкил», используемый отдельно или в составных словах, таких как «алкилтио» или «галогеналкил», включает алкил с прямой или разветвленной цепью, такой как метил, этил, н-пропил, изопропил или различные изомеры бутила, пентила или гексила. Термин «алкенил» включает алкены с прямой или разветвленной цепью, такие как 1-пропенил, 2-пропенил, и различные изомеры бутенила, пентенила и гексенила. Термин «алкенил» также включает полиены, такие как 1,2-пропадиенил и 2,4-гексадиенил. Термин «алкинил» включает алкины с прямой или разветвленной цепью, такие как 1-пропинил, 2-пропинил, и различные изомеры бутинила, пентинила и гексинила. Термин «алкинил» может также включать фрагменты, содержащие несколько тройных связей, такие как 2,5-гексадиинил. Термин «алкокси» включает, например, метокси, этокси, н-пропилокси, изопропилокси и различные изомеры бутокси, пентокси и гексилокси. Термин «алкоксиалкил» относится к алкоксизамещению алкила. Примеры алкоксиалкила включают СН3OCH2, CH3OCH2CH2, CH3CH2OCH2, CH3CH2CH2CH2OCH2 и СН3СН2ОСН2СН2. Термин «алкилтио» включает алкилтиофрагменты с прямой или разветвленной цепью, такие как метилтио, этилтио, и различные изомеры пропилтио, бутилтио, пентилтио и гексилтио. Термин «циклоалкил» включает, например, циклопропил, циклобутил, циклопентил и циклогексил. Термин «триалкилсилил» включает (СН3)3Si, (CH3CH2)3Si и [(CH3)3C](CH3)2Si. Термин «(алкил)циклоалкиламино» относится к циклоалкиламиногруппе, в которой атом водорода заменен алкильным радикалом; примеры таких групп включают (метил)циклопропиламино, (этил)циклобутиламино, (изопропил)циклопентиламино и (метил)циклогексиламино. Как указано выше в кратком описании изобретения, циклоалкил в циклоалкиламиногруппе и (алкил)циклоалкиламиногруппе представляет собой С3-С6циклоалкил, в то время как алкил в (алкил)циклоалкиламиногруппе представляет собой С1-С4алкил.
Термин «ароматический» означает, что все атомы кольца по существу находятся в одной плоскости, имеют р-орбиталь, перпендикулярную плоскости кольца, и (4n+2) π-электронов, которые, когда n равно 0 или принимает целое положительное значение, ассоциированы с кольцом в соответствии с правилом Хюккеля (Hückel's rule). Термин «ароматическая кольцевая система» относится к полностью ненасыщенным карбоциклам и гетероциклам, в которых, по меньшей мере, одно кольцо полициклической кольцевой системы является ароматическим. Ароматическое карбоциклическое кольцо или конденсированные карбоциклические кольцевые системы включают полностью ароматические карбоциклы и карбоциклы, в которых, по меньшей мере, одно кольцо полициклической кольцевой системы является ароматическим (например, фенил или нафтил). Термин «неароматическое карбоциклическое кольцо» относится к полностью насыщенным карбоциклам, а также к частично или полностью ненасыщенным карбоциклам, которые не соответствуют правилу Хюккеля. Термин «гетеро», относящийся к кольцам или кольцевым системам, означает кольцо или кольцевую систему, в которых, по меньшей мере, один атом кольца не является углеродом и которые могут содержать от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, кислорода и серы, при условии, что каждое кольцо содержит не более 4 атомов азота, не более 2 атомов кислорода и не более 2 атомов серы. Термины «гетероароматическое кольцо или кольцевая система» и «ароматическая конденсированная гетеробициклическая кольцевая система» включают полностью ароматические гетероциклы и гетероциклы, в которых, по меньшей мере, одно кольцо полициклической кольцевой системы является ароматическим (где термин «ароматическая» показывает, что правило Хюккеля выполняется). Термин «неароматическое гетероциклическое кольцо или неароматическая кольцевая система» означает полностью насыщенные гетероциклы, а также частично или полностью ненасыщенные гетероциклы, где любое кольцо в кольцевой системе не отвечают правилу Хюккеля. Гетероциклическое кольцо или кольцевая система может быть присоединена через любой доступный атом углерода или азота путем замены водорода у указанного атома углерода или азота.
Термин «галоген», используемый отдельно или в сложных словах, таких как «галогеналкил», означает фтор, хлор, бром или йод. Кроме того, при использовании в сложных словах, таких как «галогеналкил», указанный алкил может быть частично или полностью замещен атомами галогенов, которые могут быть одинаковыми или различными. Примеры «галогеналкилов» включают F3C, ClCH2, CF3CH2 и CF3CCl2. Термины «галогеналкенил», «галогеналкинил», «галогеналкокси» и т.п. определяются аналогично термину «галогеналкил». Примеры «галогеналкенила» включают (Cl)2C=CHCH2 и CF3CH2CH=CHCH2. Примеры «галогеналкинила» включают HC≡CCHCl, CF3C≡C, CCl3C≡C и FCH2C≡CH2. Примеры «галогеналкокси» включают CF3O, CCl3CH2O, HCF2CH2CHO и CF3CH2O.
Примеры «алкилкарбонила» включают С(О)СН3, С(О)СН2CH2CH3 и C(O)CH(CH3)2. Примеры «алкоксикарбонила» включают CH3OC(=O), CH3CH2OC(=O), СН3СН2СН2ОС(=О), (СН3)2CHOC(=О) и различные изомеры бутокси- или пентоксикарбонила. Примеры «алкиламинокарбонила» включают CH3NHC(=O), CH3CH2NHC(=O), CH3CH2CH2NHC(=O), (CH3)2CHNHC(=O)и различные изомеры бутиламино- или пентиламинокарбонила. Примеры «диалкиламинокарбонила» включают (CH3)2NC(=O), (CH3CH2)2NC(=O), CH3CH2(CH3)NC(=O), CH3CH2 CH2(CH3)NC(=O) и (CH3)2CHN(CH3)C(=O).
Общее количество атомов углерода в группе заместителя показано префиксом «Сi -Cj», где i и j представляют целые числа от 1 до 8. Например, «С1-С4алкилсульфонил» означает группу от метилсульфонила до бутилсульфонила; «С2алкоксиалкил» представляет собой СН3ОСН2; «С3алкоксиалкил» означает, например, СН3СН(OCH3), СН3ОСН2СН2 или СН3 СН2ОСН2; «С4алкоксиалкил» означает различные изомеры алкильной группы, замещенной алкоксигруппой и содержащей четыре атома углерода, и примеры такой алкильной группы включают СН3СН2СН2ОСН2 и СН3СН2ОСН2СН2. В приведенном выше описании, когда соединение формулы I включает гетероциклическое кольцо, все заместители присоединены к данному кольцу через любой доступный атом углерода или азота путем замены атома водорода у указанного атома углерода или азота.
Когда соединение замещено заместителем с указанным нижним индексом, который показывает, что количество указанных заместителей может превышать 1, указанные заместители (когда их количество превышает 1) независимо выбраны из группы определенных заместителей. Кроме того, когда нижний индекс указывает на некоторый интервал, например (R)i-j, тогда количество заместителей может быть выбрано в интервале целых чисел от i до j включительно.
Термин «необязательно замещенный» показывает, что фрагмент может быть замещенным или незамещенным. Термин «необязательно замещенный одним-тремя заместителями» и т.п. показывает, что фрагмент может быть незамещенным или от одного до трех доступных положений на фрагменте могут быть замещенными. Когда фрагмент содержит заместитель, который может быть водородом, например, R4, когда данный заместитель представляет собой водород, это равнозначно тому, что указанный фрагмент является незамещенным.
Соединения формулы I могут существовать в виде одного или нескольких стереоизомеров. Различные стереоизомеры включают энантиомеры, диастереомеры, атропизомеры и геометрические изомеры. Особый интерес представляют геометрические изомеры, в которых R2 иминофрагмента может находиться в syn- или anti-положении относительно В, или смесь syn- и anti-геометрических изомеров. Квалифицированному специалисту в данной области понятно, что один стереоизомер может быть более активным и/или может проявлять полезное действие при большем его содержании относительно другого(их) стереоизомера(ов) или при отделении от другого(их) стереоизомера(ов). Кроме того, квалифицированному специалисту известно, как разделить, обогатить и/или селективно получить указанные стереоизомеры. Соответственно, соединения формулы I могут также присутствовать в виде смеси стереоизомеров, в виде отдельных стереоизомеров или в виде оптически активной формы. Некоторые соединения формулы I могут также существовать в виде одного или нескольких таутомеров, и все таутомерные формы таких соединений являются частью данного изобретения. Дополнительно соединения данного изобретения могут присутствовать в виде смеси таутомеров или отдельных таутомеров.
Данное изобретение включает соединения, выбранные из соединений формулы I, их N-оксидов и солей. Квалифицированному специалисту в данной области понятно, что не все азотсодержащие гетероциклы могут образовывать N-оксиды, поскольку азоту необходима доступная единственная пара электронов для окисления в оксид; квалифицированный специалист также может определять те азотсодержащие гетероциклы, которые могут образовывать N-оксиды. Квалифицированному специалисту в данной области будет также очевидно, что третичные амины могут образовывать N-оксиды. Синтетические способы получения N-оксидов гетероциклов и третичных аминов хорошо известны квалифицированному специалисту, включая окисление гетероциклов и третичных аминов надкислотами, такими как надуксусная и м-хлорнадбензойная кислота (MCPBA), пероксид водорода, алкильные гидропероксиды, такие как трет-бутилгидропероксид, перборат натрия и диоксираны, такие как диметилдиоксиран. Такие способы получения N-оксидов подробно описаны и рассмотрены в литературе, например в следующих публикациях: T.L. Gilchrist, in Comprehensive Organic Synthesis, Vol. 7, pp. 748-750, S.V. Ley, Ed., Pergamon Press; M. Tisler and B. Stanovnik, in Comprehensive Heterocyclic Chemistry, Vol. 3, pp. 18-19, A.J. Boulton and A. McKillop, Eds., Pergamon Press; M.R. Grimmett and B.R.T. Keene, in Advances in Heterocyclic Chemistry, Vol. 43, pp. 139-151, A.R. Katritzky, Ed., Academic Press; M. Tisler and B. Stanovnik, in Advances in Heterocyclic Chemistry, Vol. 9, pp. 285-291, A.R. Katritzky and A.J. Boulton, Eds., Academic Press; and G.W.H. Cheeseman and E.S.G. Werstiuk, in Advances in Heterocyclic Chemistry, Vol. 22, pp. 390-392, A.R. Katritzky and A.J. Boulton, Eds., Academic Press.
Соли соединений данного изобретения включают соли присоединения неорганических или органических кислот, таких как бромистоводородная, хлористоводородная, азотная, фосфорная, серная, уксусная, масляная, фумаровая, молочная, малеиновая, малоновая, оксалиловая, пропионовая, салициловая, винная, 4-толуолсульфоновая или валериановая кислоты. Соли соединений данного изобретения включают также соли органических оснований (например, пиридина, аммиака или триэтиламина) или неорганических оснований (например, гидриды, гидроксиды или карбонаты натрия, калия, лития, кальция, магния или бария), когда соединение содержит кислотный фрагмент, например группу карбоновой кислоты или фенольную группу.
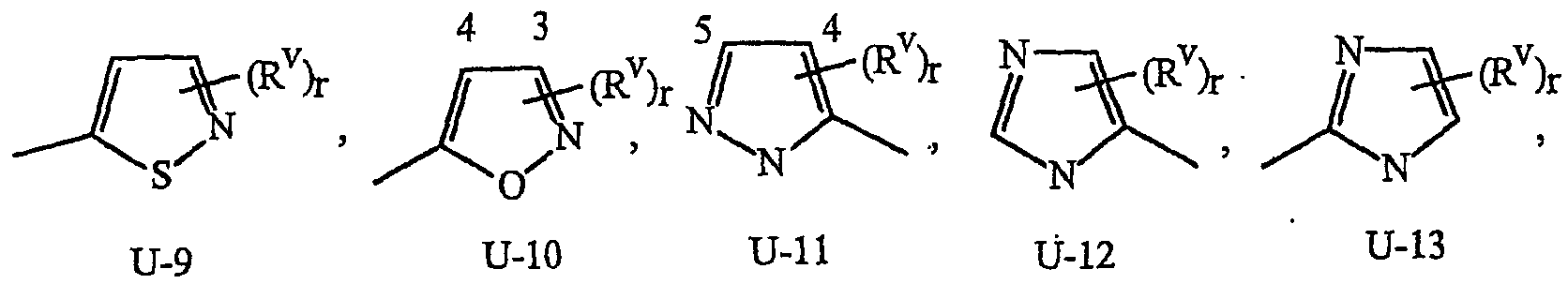
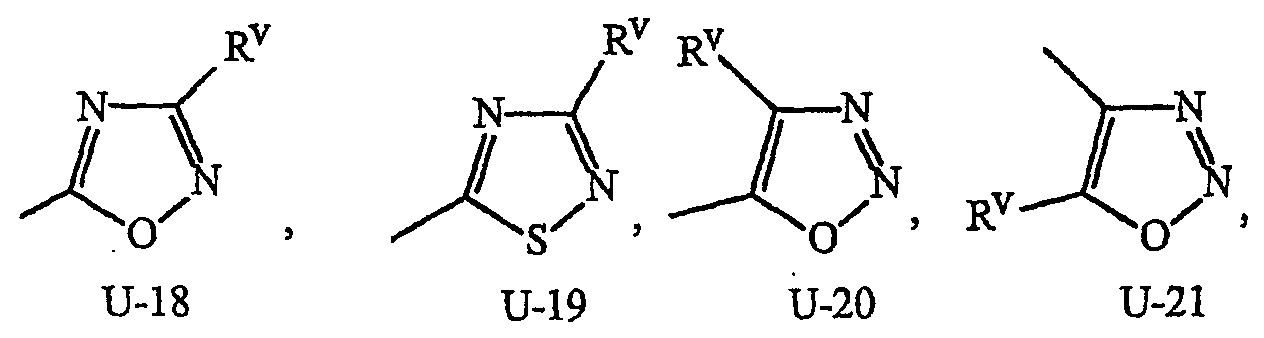
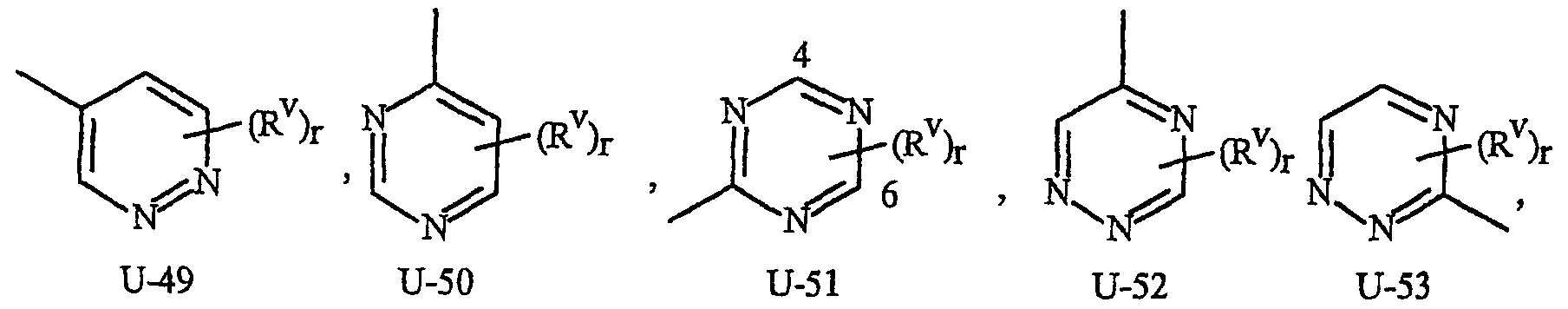
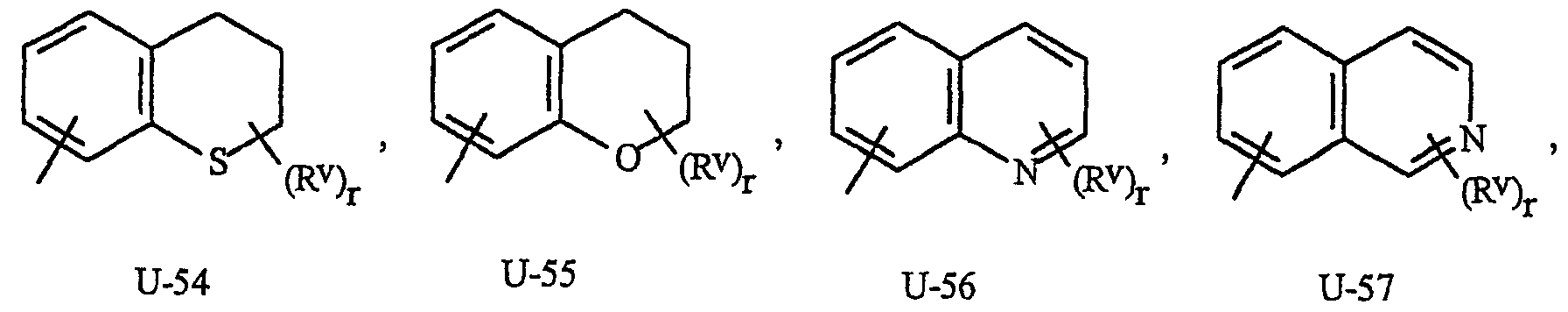
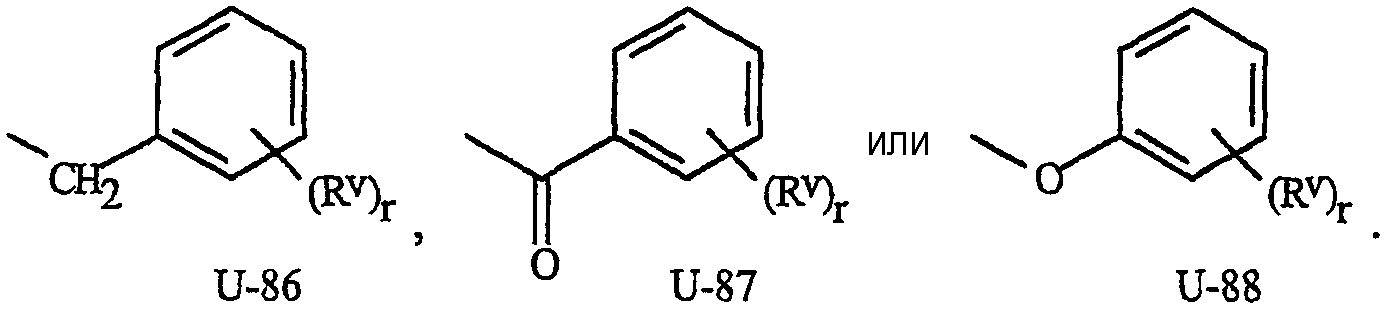
Как указывалось выше, J представляет фенильное кольцо, нафтильную кольцевую систему, 5- или 6-членное гетероароматическое кольцо или ароматическую 8-, 9- или 10-членную конденсированную гетеробициклическую кольцевую систему, где каждое кольцо или кольцевая система является необязательно замещенной 1-4 R5. Термин «необязательно замещенный», относящийся к J группам, означает группы, которые являются незамещенными или содержат, по меньшей мере, один заместитель, отличный от водорода, который не снижает биологической активности, характерной для незамещенного аналога. Примером фенила, необязательно замещенного 1-4 R5, является кольцо, показанное как U-1 на Изображении 1, где Rv представляет R5 и r представляет целое число от 0 до 4. Примером нафтильной группы, необязательно замещенной 1-4 R5, является группа, показанная как U-85 на Изображении 1, где Rv представляет R5 и r представляет целое число от 0 до 4. Примеры 5- или 6-членных гетероароматических колец, необязательно замещенных 1-4 R5, включают кольца (U-2)-(U-53), показанные на Изображении 1, где Rv представляет R5 и r представляет целое число от 0 до 4. Следует обратить внимание на то, что (J-1)-(J-5), представленные ниже, также относятся к 5- или 6-членным гетероароматическим кольцам. Кроме того, (U-2)-(U-20) являются примерами J-1, (U-21)-(U-35) и U-40 являются примерами J-2, (U-36)-(U-39) являются примерами J-3, (U-41)-(U-48) являются примерами J-4 и (U-49)-(U-53) являются примерами J-5. Примеры ароматических 8-, 9- или 10-членных конденсированных гетеробициклических кольцевых систем, необязательно замещенных 1-4 R5, включают (U-54)-(U-84), показанные на Изображении 1, где Rv представляет R5 и r представляет целое число от 0 до 4.
Атомы азота, которым необходимо замещение для заполнения их валентности, замещены Н или Rv. Следует обратить внимание на то, что некоторые группы U могут быть замещены менее чем 4 группами Rv (например, U-14, U-15, (U-18)-(U-21) и (U-32)-(U-43) могут быть замещены только одним Rv). Следует также обратить внимание на то, что когда точка присоединения (RV)r и группы U изображена как плавающая, то группа (RV)rможет быть присоединена к любому доступному атому углерода группы U. Следует обратить внимание на то, что когда точка присоединения группы U изображена как плавающая, то группа U может быть присоединена к остатку формулы I через любой доступный атом углерода группы U путем замены атома водорода.
Изображение 1


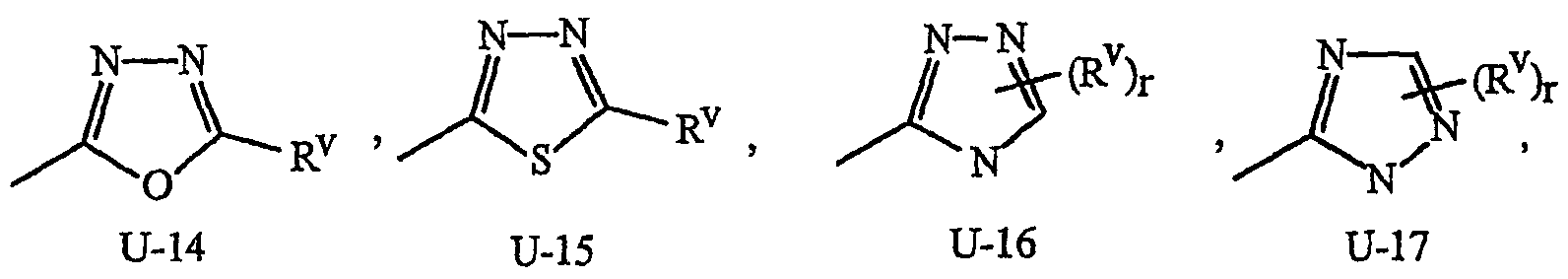













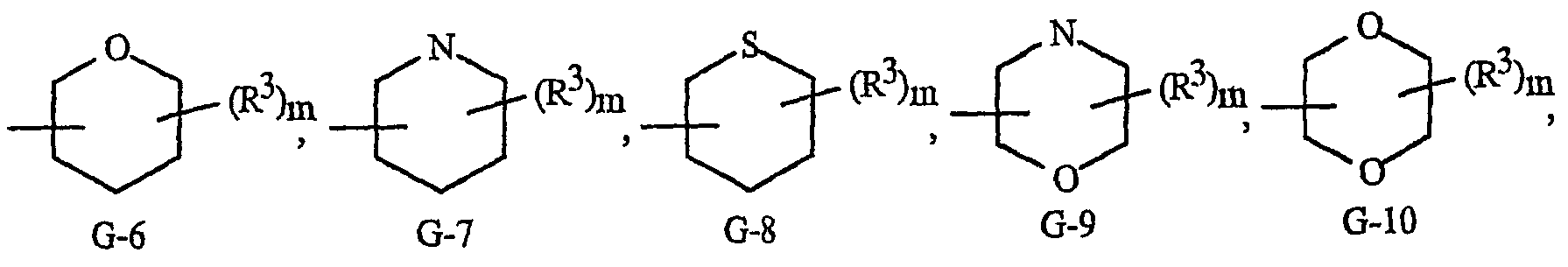
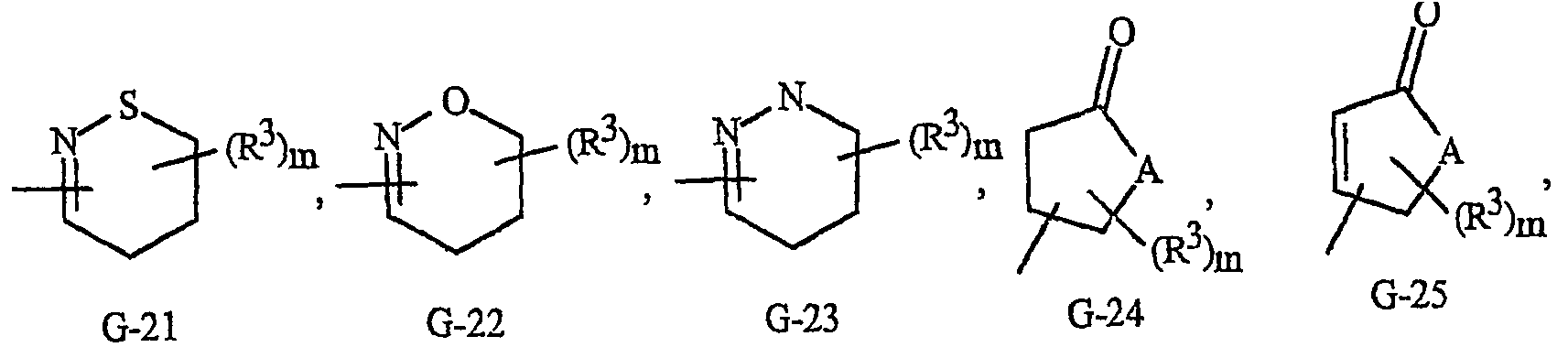
Как отмечалось выше, G представляет 5- или 6-членное неароматическое карбоциклическое или гетероциклическое кольцо, необязательно включающее один или два кольцевых члена, выбранных из группы, состоящей из С(=О), SO и S(O)2, и необязательно замещенное 1-4 заместителями, выбранными из R3. Примеры таких групп G включают группы, показанные как (G-1)-(G-41) на изображении 2, где m представляет целое число от 0 до 4. Термин «необязательно замещенный», относящийся к группам G, означает группы, которые являются незамещенными или содержат, по меньшей мере, один заместитель, отличный от водорода, который не снижает биологической активности, характерной для незамещенного аналога. Следует также обратить внимание на то, что когда точка присоединения группы G изображена как плавающая, группа G может быть присоединена к остатку формулы I через любой доступный атом углерода группы U путем замены атома водорода. Необязательные заместители могут быть присоединены к любому доступному атому углерода или азота путем замены атома водорода. Следует также обратить внимание на то, что когда G включает кольцо, выбранное из (G-24)-(G-29) и (G-32)-(G35), А выбран из O, S или NR3. Кроме того, когда G представляет G-3, G-5, G-7, G-9, (G-16)-(G-18), G-23, (G-24)-(G-29) и (G-32)-(G35) (когда А представляет NR3), атомы азота, которым требуется замещение для заполнения их валентности, замещены Н или R3.
Изображение 2






Как отмечалось выше, некоторые группы R1 и R2 могут быть необязательно замещенными одним или несколькими заместителями. Термин «необязательно замещенный», относящийся к данным группам, означает R1 и/или R2 группы, которые являются незамещенными или содержат, по меньшей мере, один заместитель, отличный от водорода. Примерами необязательно замещенных R1 и/или R2 групп являются группы, которые могут быть необязательно замещены путем замены атома водорода у атома углерода R1 и/или R2 группы одним или несколькими (количество заместителей может равняться общему количеству атомов водорода, которые могут подвергаться замене в любой конкретной R1 и/или R2 группе) заместителями, необязательно выбранными из заместителей, перечисленных выше в кратком описании изобретения. Хотя такие заместители перечислены, следует отметить, что нет необходимости в их присутствии, поскольку они являются необязательными заместителями. Интерес представляют группы R1 и/или R2, которые являются незамещенными. Интерес представляют группы R1 и/или R2, замещенные одним-пятью заместителями. Также представляют интерес группы R1 и/или R2, замещенные одним заместителем.
Как отмечалось выше, каждый из R1 и R2 может независимо (среди прочих) представлять С1-С6алкил, С2-С6алкенил, С2-С6алкинил или С3-С6циклоалкил, каждый независимо замещенный одним или несколькими заместителями, выбранными из (среди прочих) фенила, фенокси или 5- или 6-членного гетероароматического кольца, причем каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из R6. Термин «необязательно замещенный», относящийся к данным группам, означает группы, которые являются незамещенными или содержат, по меньшей мере, один заместитель, отличный от водорода, который не снижает биологической активности, характерной для незамещенного аналога. Примеры таких заместителей включают кольца, представленные как (U-1)-(U-53) и U-88 на изображении 1, за исключением колец, которые необязательно замещены 1-3 заместителями, независимо выбранными из R6, а не из (Rv)r. Следует обратить внимание на то, что нет необходимости в присутствии заместителей R6, поскольку они являются необязательными заместителями.
Как отмечалось выше, каждый R4 независимо представляет (среди прочих) фенил, бензил, фенокси или 5- или 6-членное гетероароматическое кольцо, причем каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из R6. Термин «необязательно замещенный», относящийся к данным R4 группам, означает группы, которые являются незамещенными или содержат, по меньшей мере, один заместитель, отличный от водорода, который не снижает биологической активности, характерной для незамещенного аналога. Примеры таких R4 групп включают кольца, представленные как (U-1)-(U-53), U-86 и U-88, представленные на изображении 1, за исключением таких колец, которые необязательно замещены 1-3 заместителями, независимо выбранными из R6, а не из (Rv)r. Следует обратить внимание на то, что нет необходимости в присутствии заместителей R6, поскольку они являются необязательными заместителями.
Как отмечалось выше, каждый R5 независимо представляет (среди прочих) фенил, бензил, бензоил, фенокси, 5- или 6-членное гетероароматическое кольцо или ароматическую 8-, 9- или 10-членную конденсированную гетеробициклическую кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещена одним-тремя заместителями, независимо выбранными из R6. Примеры таких групп R5 включают кольца и кольцевые системы, представленные как (U-1)-(U-88) на изображении 1, за исключением таких колец и кольцевых систем, которые необязательно замещены 1-3 заместителями, независимо выбранными из R6, а не (Rv)r. Следует обратить внимание на то, что нет необходимости в присутствии заместителей R6, поскольку они являются необязательными заместителями.
Предпочтительными с точки зрения стоимости, простоты синтеза или применения и/или биологической эффективности являются следующие.
1. Способы, включающие соединения формулы I, где
R2 представляет Н; С1-С6алкил, С2-С6алкенил, С2-С6алкинил или С3-С6циклоалкил, каждый из которых необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, CN, С1-С2алкокси, С1-С2алкилтио, С1-С2алкилсульфинила и С1-С2алкилсульфонила;
один R4 присоединен к фенильному кольцу в положении 2 или в положении 5, и указанный R4 представляет С1-С4алкил, С1-С4галогеналкил, галоген, CN, NO2, С1-С4алкокси, С1-С4 галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С1-С4галогеналкилтио, С1 -С4галогеналкилсульфинил или С1-С4галогеналкилсульфонил;
n равно 1 или 2.
2. Способы пункта 1, где J представляет фенильную группу, необязательно замещенную 1-4 R5.
3. Способы пункта 2, где
В представляет О, и
каждый R5независимо представляет галоген, С1-С4алкил, С1-С2алкокси, С1-С4галогеналкил, CN, NO2, С1-С4галогеналкокси, С1-С4 алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинил, С1-С4галогеналкилсульфонил или С2-С4алкоксикарбонил, или
каждый R5 независимо представляет фенил или 5- или 6-членное гетероароматическое кольцо, причем каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из R6, или
две R5 группы, когда присоединены к соседним атомам углерода, вместе образуют группу -OCF2O-, -CF2CF2O- или -OCF2CF2O-.
4. Способы пункта 3, где
R2 представляет С1-С4алкил, необязательно замещенный галогеном, CN, OCH3 или S(O)pCH3;
один R4 присоединен к фенильному кольцу в положении 2 и указанный R4 представляет CH3, CF3, OCF3, OCHF2, S(O)pCF3, S(O)p CHF2, CN или галоген;
второй R4 представляет Н, F, Cl, Br, I, CN или CF3;
каждый R5 независимо представляет галоген, метил, CF3, OCF3, OCHF2, S(O)pCF3, S(O)pCHF2, OCH2CF3, OCF2CHF2, S(O)p CH2CF3 или S(O)pCF2CHF2; фенильное, пиразольное, имидазольное, триазольное, пиридиновое или пиримидиновое кольцо, причем каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из С1-С4алкила, С1-С4галогеналкила, галогена и CN;
р равно 0, 1 или 2.
5. Способы пункта 4, где R2 представляет Н, Ме, Et, изопропил или трет-бутил.
6. Способы пункта 1, где
J представляет 5- или 6-членное гетероароматическое кольцо, выбранное из группы, состоящей из J-1, J-2, J-3, J-4 и J-5, причем каждый J необязательно замещен 1-3 R5
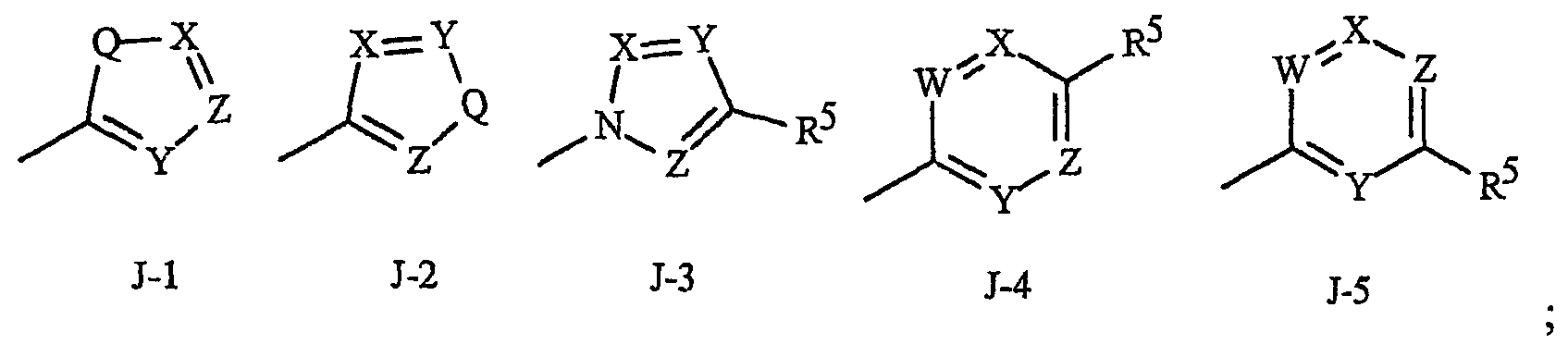
Q представляет О, S, NH или NR5;
W, X, Y и Z независимо представляют N, CH или CR5, при условии, что в J-4 и J-5, по меньшей мере, один из W, X, Y или Z представляет N.
7. Способы пункта 6, где
В представляет О и
каждый R5 независимо представляет С1-С4алкил, С1-С4галогеналкил, галоген, CN, NO2, С1-С4галогеналкокси, С1-С4 алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинил, С1-С4галогеналкилсульфонил или С2-С4алкоксикарбонил; или фенил или 5- или 6-членное гетероароматическое кольцо, причем каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из R6.
8. Способ пункта 7, где
J, замещенный 1-3 R5, выбран из группы, состоящей из J-6, J-7, J-8, J-9, J-10, J-11, J-12 и J-13

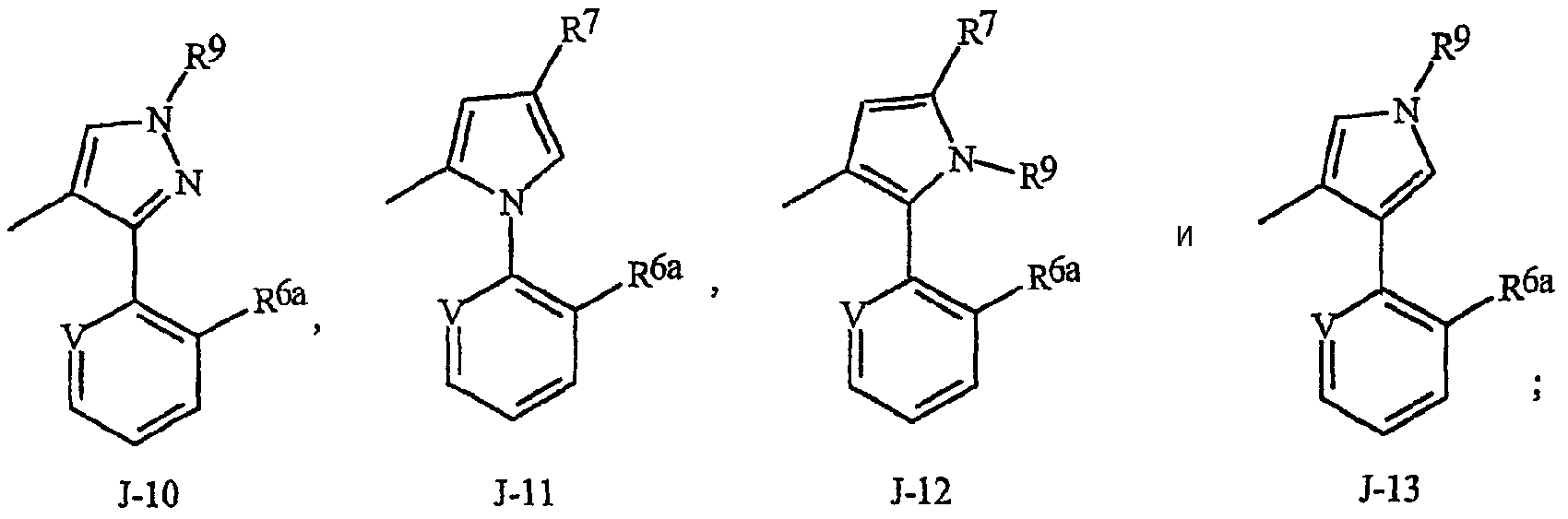
V представляет N, CH, CF, CCl, CBr или CI;
каждый R6a независимо представляет Н или R6;
R6 представляет С1-С6алкил, С3-С6циклоалкил, С1-С6галогеналкил, галоген, CN, С1-С4алкокси, С1-С4галогеналкокси или С1-С4галогеналкилтио;
каждый R7 независимо представляет С1-С6алкил, С1 -С6галогеналкил, галоген, CN, С1-С4алкокси, С1-С4галогеналкокси или С1-С4галогеналкилтио;
R9 представляет С2-С6алкил, С1-С6галогеналкил, С3-С6алкенил, С3-С6галогеналкенил, С3-С6 алкинил или С3-С6галогеналкинил;
R10 представляет С1-С4алкил или С1-С4галогеналкил;
R11 представляет С1-С4алкил и
n равно 1 или 2.
Следует обратить внимание на то, что R7 и R9 представляет подмножества R5. Кроме того, атомы F, Cl, Br или I, входящие в значения V, являются подмножеством R6. Интерес представляют способы пункта 8, где V представляет N. Интерес представляют также способы пункта 8, где V представляет СН, CF, CCl или CBr. Особенно представляют интерес способы пункта 8, где V представляет N или СН.
9. Способы пункта 8, где
R2 представляет С1-С4алкил, необязательно замещенный галогеном, CN, OCH3 или S(O)pCH3; или СН2С≡СН;
один R4 присоединен к фенильному кольцу в положении 2 и указанный R4 представляет CH3, CF3, OCF3, OCHF2, S(O)pCF3, S(O)pCHF2, CN или галоген;
второй R4 представляет Н, F, Cl, Br, I, CN или CF3;
R6a представляет Н, С1 -С4алкил, С1-С4галогеналкил, галоген или CN;
R7 представляет СН3, CF3, OCH2CF3, OCHF2 или галоген;
R9 представляет СН2CF3, CHF2 или CF3 и
p равно 0, 1 или 2.
Интерес представляют способы пункта 9, где одна группа R4 присоединена к фенильному кольцу в положении 2 и указанный R4 представляет СН3, Cl или Br, а второй R4 представляет Н, F, Cl, Br, I, CN или CF3.
10. Способы пункта 9, где J, замещенный 1-3 R5, представляет J-6; V представляет N или СН и R7 представляет СН3, CF3, OCH2CF3, OCHF2 или галоген.
11. Способы пункта 10, где R6a представляет F, Cl или Br и R7 представляет галоген или CF3.
12. Способы пункта 9, где J, замещенный 1-3 R5, представляет J-7 и R9 представляет С2-С6алкил или С1-С6галогеналкил.
Представляют интерес способы пункта 12, где V представляет N или СН; R6a представляет Cl или Br и R9 представляет CF3, CHF2, CH2CF3, CF2CHF2.
13. Способы пункта 9, где J, замещенный 1-3 R5, представляет J-8; V представляет N; R6a представляет Cl или Br и R7 представляет галоген или CF3.
14. Способы пункта 9, где J, замещенный 1-3 R5, представляет J-9; R6a представляет Cl или Br и R7 представляет CF3.
15. Способы пункта 9, где J, замещенный 1-3 R5, представляет J-10; R6aпредставляет Cl или Br и R9 представляет CH2CF3, CHF2 или CF3.
16. Способы пункта 9, где J, замещенный 1-3 R5, представляет J-11; R6a представляет Cl или Br и R7 представляет галоген, OCH2CF3, OCHF2 или CF3.
17. Способы пункта 9, где J, замещенный 1-3 R5, представляет J-12; R6a представляет Cl или Br; R7 представляет галоген, OCH2CF3, OCHF2 или CF3 и R9 представляет CH2CF3, CHF2 или CF3.
18. Способы пункта 9, где J, замещенный 1-3 R5, представляет J-13; R6a представляет Cl или Br и R9 представляет CH2CF3, CHF2 или CF3.
Особенно предпочтительными способами являются способы, включающие соединения, выбранные из следующей группы:
N-[2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-хлор-8-метил-4Н-3,1-бензоксазин-4-илиден]метанамин,
N-[2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-хлор-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-пропанамин,
N-[2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-хлор-8-метил-4Н-3, 1-бензоксазин-4-илиден]этанамин,
N-[6-хлор-2-[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]метанамин,
N-[6-хлор-2-[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-пропанамин,
N-[6-хлор-2-[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-8-метил-4Н-3, 1-бензоксазин-4-илиден]этанамин,
N-[6-хлор-2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]метанамин,
N-[6-хлор-2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-пропанамин,
N-[6-хлор-2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]этанамин,
N-[6-хлор-2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-метил-2-пропанамин,
N-[2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-пропанамин,
N-[2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-8-метил-4Н-3, 1-бензоксазин-4-илиден]-2-метил-2-пропанамин,
N-[2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-пропанамин и
N-[2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-метил-2-пропанамин.
Предпочтительными также являются следующие.
19. Способы пункта 1, где
В представляет NR1;
J, замещенный 1-3 R5, представляет J-6 (как определено выше, в пункте 8);
каждый R1 независимо представляет С1-С6алкил;
R2 представляет Н или С1-С6алкил или
R1 и R2, взятые вместе, образуют связывающую цепь, состоящую из 2-5 членов, содержащую, по меньшей мере, один углеродный член, необязательно включающую не более двух углеродных членов вида С(=О) и необязательно один член, выбранный из атомов азота и кислорода, и необязательно замещенную 1-4 заместителями, выбранными из R3;
каждый R3 независимо представляет С1-С2алкил, галоген, CN, NO2 или С1-С2алкокси; один R4 присоединен к фенильному кольцу в положении 2 и указанный R4 представляет СН3, Cl или Br, а второй R4 представляет Н, F, Cl, Br, I или CF3.
Представляют интерес также способы, включающие соединения пункта 19, где R1 и R2, взятые вместе, могут образовывать связывающую цепь, выбранную из группы, состоящей из -СН2СН2-, -СН2СН2СН2-, -СН2СН2С(=О)-, -СН=С(СН3)-, -С(СН3)=СН- и -CH=N-, так что левый конец фрагмента присоединен в месте расположения R1, а правый конец фрагмента присоединен в месте расположения R2.
Особенно предпочтительным является способ пункта 19, включающий соединение
7, 9-дихлор-5-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-2,5-дигидроимидазо[1,2-c]хиназолин.
Данное изобретение относится также к композициям для борьбы с беспозвоночными вредителями, включающим биологически эффективное количество соединения формулы I. Предпочтительными композициями являются композиции, включающие соединения, описанные в пунктах 1-19 и перечисленные выше в особенно предпочтительных способах.
Предпочтительными соединениями по простоте синтеза и/или биологической эффективности являются следующие.
А. Соединения формулы I, где
В представляет О;
R2 представляет Н или С1-С6алкил, С2-С6алкенил, С2-С6 алкинил или С3-С6циклоалкил, каждый из которых необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, CN, С1-С2алкокси, С1-С2алкилтио, С1-С2алкилсульфинила и С1-С2алкилсульфонила;
одна группа R4 присоединена к фенильному кольцу в положении 2 или в положении 5 и указанный R4 представляет С1-С4алкил, С1-С4галогеналкил, галоген, CN, NO2, C1-C4алкокси, C1-C4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С1-С4галогеналкилтио, С1-С4галогеналкилсульфинил или С1-Сгалогеналкилсульфонил;
каждый R5 независимо представляет галоген, С1-С4алкил, С1-С2алкокси, С1-С4галогеналкил, CN, NO2, С1-С4галогеналкокси, С1 -С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С1-С4галогеналкилтио, С1-С4 галогеналкилсульфинил, С1-С4галогеналкилсульфонил или С2-С4алкоксикарбонил или
каждый R5 независимо представляет фенил или 5- или 6-членное гетероароматическое кольцо, причем каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из R6, или
две группы R5, когда присоединены к соседним атомам углерода, взятые месте, образуют группу -OCF2O-, -CF2CF2O- или -OCF2CF2O-, и
n равно 1 или 2.
В. Соединения А, где
J представляет фенильную группу, необязательно замещенную 1-4 R5;
R2 представляет С1-С4 алкил, необязательно замещенный галогеном, CN, OCH3 или S(O)pCH3;
один R4 присоединен к фенильному кольцу в положении 2 и указанный R4 представляет СН3, CF3, OCF3, OCHF2, S(O)pCF3, S(O)pCHF2, CN или галоген;
второй R4 представляет Н, F, Cl, Br, I или CF3;
каждый R5 независимо представляет галоген, метил, CF3, OCF3, OCHF2, S(O)p CF3, S(O)pCHF2, OCH2CF3, OCF2CHF2, S(O)pCH2CF3 или S(O)pCF2CHF2; или фенильное, пиразольное, имидазольное, триазольное, пиридиновое или пиримидиновое кольцо, где каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из С1-С4алкила, С1-С4галогеналкила, галогена и CN, и
р равно 0, 1 или 2.
С. Соединения В, где R2 представляет Н, Ме, Et, изопропил или трет-бутил.
D. Соединения А, где
J представляет 5- или 6-членное гетероароматическое кольцо, выбранное из группы, состоящей из J-1, J-2, J-3, J-4 и J-5, причем каждый J необязательно замещен 1-3 R5

Q представляет О, S, NH или NR5;
W, X, Y и Z независимо представляют N, CH или CR5, при условии, что в J-5 и J-5, по меньшей мере, один из W, X, Y или Z представляет N и
каждый R5 независимо представляет С1-С4алкил, С1-С4галогеналкил, галоген, CN, NO2, С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С1-С4галогеналкилтио, С1-С4 галогеналкилсульфинил, С1-С4галогеналкилсульфонил или С2-С4алкоксикарбонил; фенил или 5- или 6-членное гетероароматическое кольцо, причем каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из R6.
Е. Соединения D, где
J, замещенный 1-3 R5, выбран из группы, состоящей из J-6, J-7, J-8, J-9, J-10, J-11, J-12 и J-13
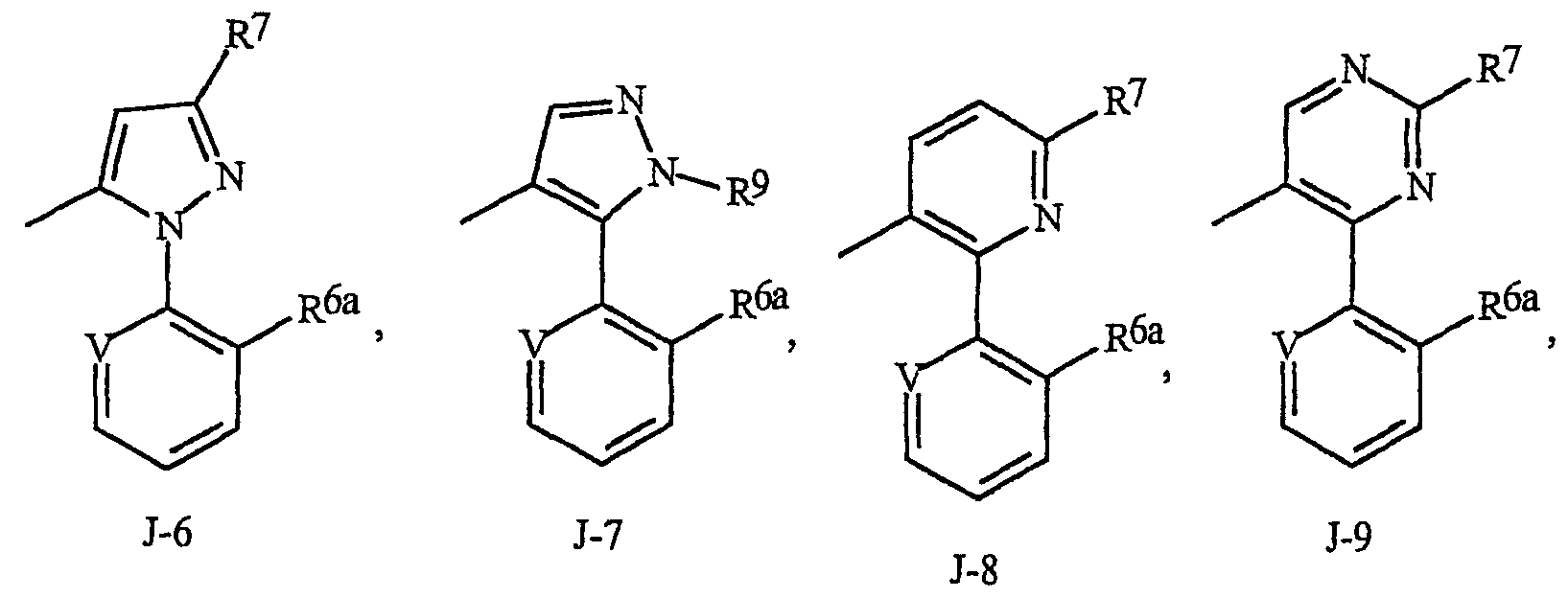

V представляет N, CH, CF, CCl, CBr или CI;
каждый R6a независимо представляет Н или R6;
R6 представляет С1-С6алкил, С3-С6циклоалкил, С1-С6галогеналкил, галоген, CN, С1-С4алкокси, С1-С4галогеналкокси или С1-С4галогеналкилтио;
каждый R7 независимо представляет С1-С6алкил, С1-С6галогеналкил, галоген, CN, С1-С4алкокси, С1-С4галогеналкокси или С1-С4 галогеналкилтио;
R9 представляет С2-С6алкил, С1-С6галогеналкил, С3-С6алкенил, С3-С6 галогеналкенил, С3-С6алкинил или С3-С6галогеналкинил;
R10 представляет С1-С4алкил или С1-С4галогеналкил;
R11 представляет С1-С4алкил и
n равно 1 или 2.
Следует обратить внимание на то, что R7 и R9 представляют подмножество R5. Следует обратить внимание на то, что атомы F, Cl, Br или I, входящие в значения V, являются подмножеством R6. Представляют интерес соединения Е, где V представляет N. Представляют интерес также соединения Е, где V представляет СН, CF, CCl или CBr. Особенно представляют интерес соединения Е, где V представляет N или СН.
F. Соединения Е, где
R2 представляет С1-С4алкил, необязательно замещенный галогеном, CN, OCH3или S(O)pCH3, или СН2С≡СН;
один R4 присоединен к фенильному кольцу в положении 2 и указанный R4 представляет СН3, CF3, OCF3, OCHF2, S(O)pCF3, S(O)pCHF2, CN или галоген;
второй R4 представляет Н, F, Cl, Br, I или CF3;
R6a представляет Н, С1-С4алкил, С1-С4галогеналкил, галоген или CN;
R7 представляет СН3, CF3, OCH2CF3, OCHF2 или галоген;
R9 представляет CH2CF3, CHF2 или CF3 и
р равно 0, 1 или 2.
Представляют интерес соединения F, где один R4 присоединен к фенильному кольцу в положении 2 и указанный R4 представляет CH3, Cl или Br, а второй R4представляет Н, F, Cl, Br, I или CF3.
G. Соединения F, где J, замещенный 1-3 R5, представляет J-6; V представляет N или СН и R7 представляет СН3, CF3, OCH2CF3, OCHF2 или галоген.
Н. Соединения G, где R6a представляет F, Cl или Br и R7 представляет галоген или CF3.
I. Соединения F, где J, замещенный 1-3 R5, представляет J-7 и R9 представляет С2-С6алкил или С1-С6галогеналкил.
Представляют интерес соединения I, где V представляет N или СН; R6a представляет Cl или Br и R9 представляет CF3, CHF2, CH2CF3, CF2CHF2.
J. Соединения F, где J, замещенный 1-3 R5, представляет J-8; V представляет N; R6a представляет Cl или Br и R7 представляет галоген или CF3.
К. Соединения F, где J, замещенный 1-3 R5, представляет J-9; R6a представляет Cl или Br и R7 представляет CF3.
L. Соединения F, где J, замещенный 1-3 R5, представляет J-10; R6a представляет Cl или Br и R9 представляет CH2CF3, CHF2 или CF3.
М. Соединения F, где J, замещенный 1-3 R5, представляет J-11; R6a представляет Cl или Br и R7 представляет галоген, OCH2CF3, OCHF2 или CF3.
N. Соединения F, где J, замещенный 1-3 R5, представляет J-12; R6a представляет Cl или Br; R7 представляет галоген, OCH2CF3, OCHF2 или CF3 и R9 представляет CH2CF3, CHF2 или CF3.
О. Соединения F, где J, замещенный 1-3 R5, представляет J-13; R6a представляет Cl или Br и R9 представляет CH2CF3, CHF2 или CF3.
Особенно предпочтительными являются соединения, выбранные из группы, включающей
N-[2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-хлор-8-метил-4Н-3,1-бензоксазин-4-илиден]метанамин,
N-[2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-хлор-8-метил-4Н-3, 1-бензоксазин-4-илиден]-2-пропанамин,
N-[2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-хлор-8-метил-4Н-3,1-бензоксазин-4-илиден]этанамин,
N-[6-хлор-2-[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]метанамин,
N-[6-хлор-2-[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-8-метил-4Н-3, 1-бензоксазин-4-илиден]-2-пропанамин,
N-[6-хлор-2-[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]этанамин,
N-[6-хлор-2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]метанамин,
N-[6-хлор-2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-пропанамин,
N-[6-хлор-2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]этанамин,
N-[6-хлор-2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-метил-2-пропанамин,
N-[2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-пропанамин,
N-[2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-8-метил-4Н-3, 1-бензоксазин-4-илиден]-2-метил-2-пропанамин,
N-[2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-пропанамин и
N-[2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-метил-2-пропанамин.
Представляют интерес соединения формулы I, где
В представляет NR1;
J, замещенный 1-3 R5, представляет J-6 (как определено выше в пункте 8);
каждый R1 независимо представляет С1-С6алкил;
R2 представляет Н или С1-С6алкил или
R1 и R2, взятые вместе, образуют связывающую цепь из 2-5 членов, включающих, по меньшей мере, один углеродный член, необязательно включающую не более двух углеродных членов вида С(=О) и необязательно один дополнительный член, выбранный из азота и кислорода, необязательно замещенную 1-4 заместителями, выбранными из R3;
каждый R3 независимо представляет С1-С2алкил, галоген, CN, NO2 или С1-С2алкокси; один R4 присоединен к фенильному кольцу в положении 2 и указанный R4 представляет СН3, Cl или Br, а второй R4 представляет Н, F, Cl, Br, I или CF3.
Представляют интерес также соединения, у которых в формуле I R1 и R2, взятые вместе, могут образовывать связывающую цепь, выбранную из группы, состоящей из -СН2СН2-, -СН2СН2СН2-, -СН2СН2С(=О)-, -СН=С(СН3)-, -C(CH3)=CH- и -CH=N-, так что левый конец фрагмента присоединен в месте расположения R1, а правый конец фрагмента присоединен в месте расположения R2.
Особенно предпочтительным является соединение 7,9-дихлор-5-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-2,3-дигидроимидазо[1,2-c]хиназолин.
Для получения соединений формулы I могут использоваться один или несколько способов, представленных далее на схемах 1-35, и их различные варианты. Значения В, J, V, R1-R6 и n в соединениях формул I, II и 2-96 ниже соответствуют значениям, определенным выше в кратком описании изобретения. Соединения формул Ia-f, IIa-c, 3a, 4a-t, 10a, 18a, 19a-c и 20а представляют собой различные подмножества соединений формул I, II, 3, 4, 10, 18, 19 и 20 соответственно.
Соединения формулы Ia или Ib (соединения формулы I, где В представляет О или S соответственно) могут быть получены из соединений формулы IIa или формулы IIb соответственно циклизацией в присутствии дегидратирующих агентов, таких как POCl3, POCl3/PCl5, SOCl2 или оксалилхлорид. Такая циклизация обычно проводится в растворителях, таких как дихлорэтан, дихлорметан, хлороформ, бензол, толуол, ксилолы, гексаны, циклогексан, 1,4-диоксан, тетрагидрофуран и хлорбензол, при температуре в интервале от 0°C до температуры дефлегмации смеси. Альтернативно циклодегидратация может быть осуществлена обработкой соединения формулы IIa или формулы IIb трифенилфосфином и бромом или йодом, необязательно в присутствии третичных аминных оснований, таких как триэтиламин или диизопропилэтиламин. Типичные примеры таких методик см. в Monatsh. Shem. 1989, 120, 973-980, и J. Org. Chem. 2000, 65, 1022-1030.
Схема 1

Сочетание амина формулы 2 с хлорангидридом кислоты формулы 3 в присутствии акцептора кислоты может приводить к получению соединения формулы IIa (схема 2). Обычными акцепторами кислоты являются аминные основания, такие как триэтиламин, диизопропилэтиламин и пиридин; другие акцепторы кислоты включают гидроксиды, такие как гидроксид натрия и гидроксид калия, и карбонаты, такие как карбонат натрия и карбонат калия. В некоторых примерах полезно использовать акцепторы кислоты, нанесенные на полимеры, например, связанный с полимером диизопропилэтиламин и связанный с полимером диметиламинопиридин. Сочетание может быть проведено в подходящем инертном растворителе, таком как тетрагидрофуран, диоксан, диэтиловый эфир или дихлорметан, с получением анилида формулы IIa.
На последующей стадии амиды формулы IIa могут быть превращены в тиоамиды формулы IIb с использованием стандартных реагентов переноса тиогруппы, включая пентасульфид фосфора и реагент Лавессона (Lawesson's reagent).
Схема 2

Альтернативная методика получения соединений формулы IIa включает сочетание амина формулы 2 с кислотой формулы 4 в присутствии дегидратирующего агента, такого как дициклогексилкарбодиимид (DCC), 1, 1'-карбонилдиимидазол, хлорангидрид бис(2-оксо-3-оксазолидинил)фосфиновой кислоты или гексафторфосфат бензотриазол-1-илокси-трис-(диметиламино)фосфония (схема 3). Реагенты, нанесенные на полимер, такие как полимерсвязанный циклогексилкарбодиимид, также полезны в данном синтезе. Реакция сочетания может быть проведена в подходящем инертном растворителе, таком как дихлорметан или N, N-диметилформамид. Методики синтеза, представленные на схемах 2 и 3, являются лишь типичными примерами полезных способов получения соединений формулы II, поскольку в литературе описано большое количество способов осуществления реакции данного типа.
Схема 3

Квалифицированному специалисту в данной области понятно, что хлорангидриды формулы 3 могут быть получены из кислот формулы 4 множеством различных хорошо известных способов. Например, хлорангидриды формулы 3 легко получают из карбоновых кислот формулы 4 взаимодействием карбоновой кислоты 4 с тионилхлоридом или оксалилхлоридом в инертном растворителе, таком как толуол или дихлорметан, в присутствии каталитического количества N,N-диметилформамида.
Амины формулы 2 обычно могут быть получены из соответствующих 2-нитробензамидов формулы 5 каталитическим гидрированием нитрогруппы (схема 4). Типичные методики включают восстановление водородом в присутствии металлического катализатора, такого как палладий на углероде или оксид платины, в гидроксильных растворителях, таких как этанол и изопропанол. Они также могут быть получены восстановлением цинком в уксусной кислоте. Данные методики хорошо описаны в химической литературе.
Схема 4

Промежуточные 2-нитробензамиды формулы 5 легко получают из коммерчески доступных 2-нитробензойных кислот (схема 5). Здесь могут быть использованы обычные способы получения амидов. Типичные примеры таких способов включают прямое дегидративное сочетание кислот формулы 6 с аминами формулы 7 с использованием, например, DDC, превращение кислот в активированные формы, такие как хлорангидриды или ангидриды, и последующее сочетание с аминами с образованием амидов формулы 5. Алкилхлорформиаты, такие как этилхлорформиат или изопропилхлорформиат, являются особенно полезными реагентами для реакций данного типа, включающих активацию кислоты. В химической литературе способы получения амидов достаточно подробно описаны.
Схема 5

Промежуточные амиды антраниловой кислоты формулы 2 могут быть также получены из ангидридов N-карбоксиантраниловой кислоты формулы 8, как показано на схеме 6. Типичные методики включают сочетание эквимолярных количеств амина 7 с ангидридом N-карбоксиантраниловой кислоты в полярных апротонных растворителях, таких как пиридин и N, N-диметилформамид, при температуре в интервале от комнатной температуры до 100°C. Ангидрид N-карбоксиантраниловой кислоты формулы 8 может быть получен способами, описанными в публикации Coppola, Synthesis1980, 505-36.
Схема 6
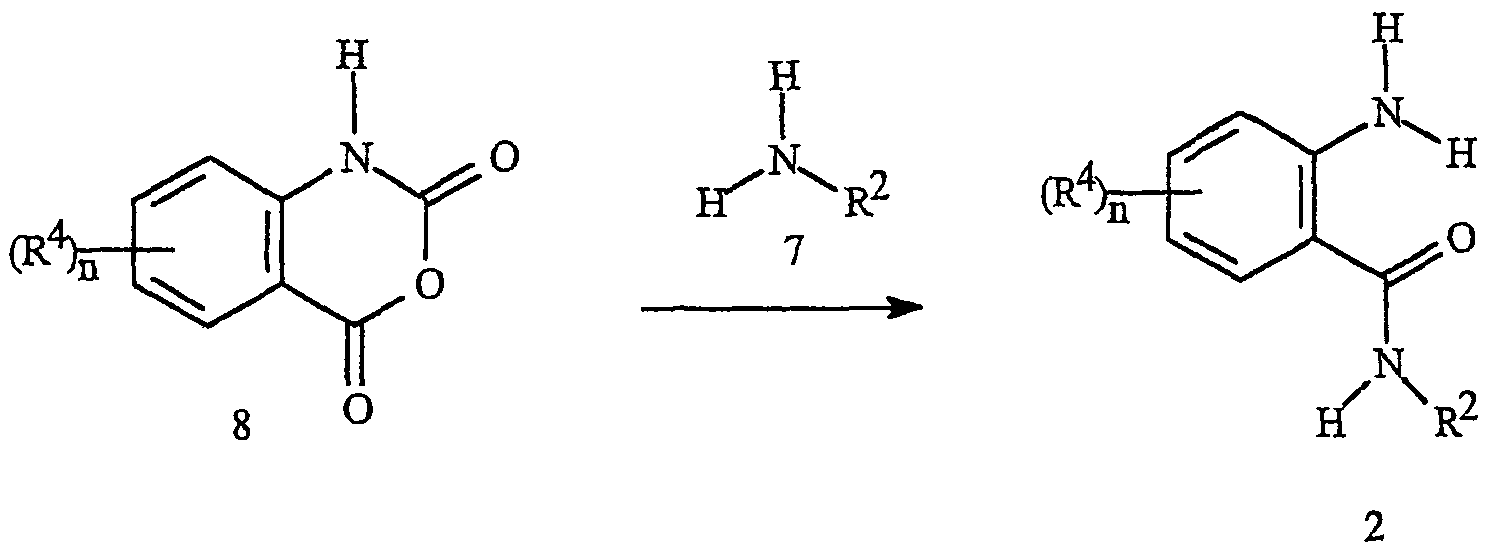
Как показано на схеме 7, альтернативная методика получения соединений формулы IIa включает взаимодействие амина формулы 7 с бензоксазиноном формулы 10. Реакция, представленная на схеме 7, может быть проведена без растворителя или в различных подходящих растворителях, включая тетрагидрофуран, диэтиловый эфир, пиридин, дихлорметан или хлороформ, при оптимальных температурах в интервале от комнатной температуры до температуры дефлегмации растворителя. Обычная реакция бензоксазинонов с аминами с получением антраниламидов хорошо описана в химической литературе. Химические свойства бензоксазинонов см. у Jakobsen et al., Biorganic and Medicinal Chemistry2000, 8, 2095-2103, и в приведенных там ссылках. См. также публикацию Coppola, J. Heterocyclic Chemistry 1999, 36, 563-588.
Схема 7

Бензоксазиноны формулы 10 могут быть получены с помощью различных методик. Две методики, которые особенно полезны, представлены подробно на схемах 8 и 9. На схеме 8 бензоксазинон формулы 10 получен непосредственно сочетанием карбоновой кислоты формулы 4 с антраниловой кислотой формулы 11. Такая методика включает последовательное добавление метансульфонилхлорида к карбоновой кислоте формулы 4 в присутствии аминного основания, такого как триэтиламин или пиридин, с последующим добавлением антраниловой кислоты формулы 11, с последующим вторым добавлением триэтиламина и метансульфонилхлорида. Данная методика обычно приводит к хорошим выходам бензоксазинона и является особенно полезной для получения соединений формулы 10а из пиразолкарбоновых кислот формулы 4а.
Схема 8

На схеме 9 представлен альтернативный способ получения бензоксазинонов формул 10 и 10а, включающий сочетание хлорангидрида формулы 3 с ангидридом N-карбоксиантраниловой кислоты формулы 8 с получением непосредственно бензоксазинона формулы 10. Соединения формулы 10а могут быть получены из хлорангидрида пиразоловой кислоты формулы 3а по аналогичной методике. Для данной реакции подходящими являются такие растворители, как пиридин или пиридин/ацетонитрил. Хлорангидриды формулы 3а могут быть получены из соответствующих кислот формулы 4а известными методами, такими как хлорирование тионилхлоридом или оксалилхлоридом.
Схема 9

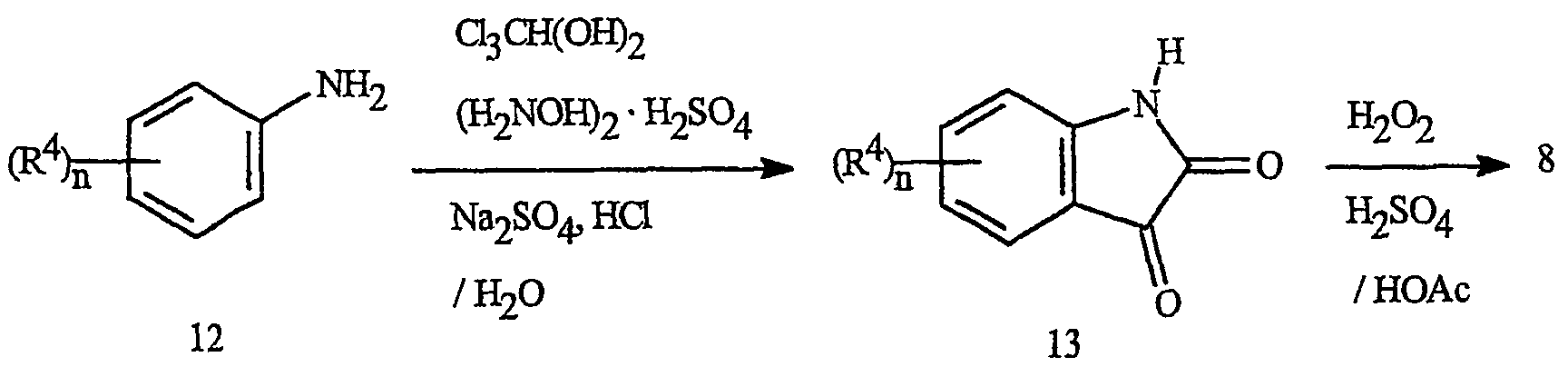
Получение ангидрида N-карбоксиантраниловой кислоты формулы 8 может быть осуществлено из изатинов формулы 13, как показано на схеме 10. Изатины формулы 13 могут быть получены из производных анилина формулы 12 в соответствии с описанными в литературе методиками. Окисление изатина 13 пероксидом водорода обычно приводит к хорошим выходам соответствующего ангидрида N-карбоксиантраниловой кислоты 8 (Angew. Chem. Int. Ed. Engl. 1980, 19, 222-223). Ангидриды N-карбоксиантраниловой кислоты также могут быть получены из антраниловых кислот 11 с помощью многих известных методик, включая взаимодействие соединения 11 с фосгеном или эквивалентом фосгена.
Схема 10
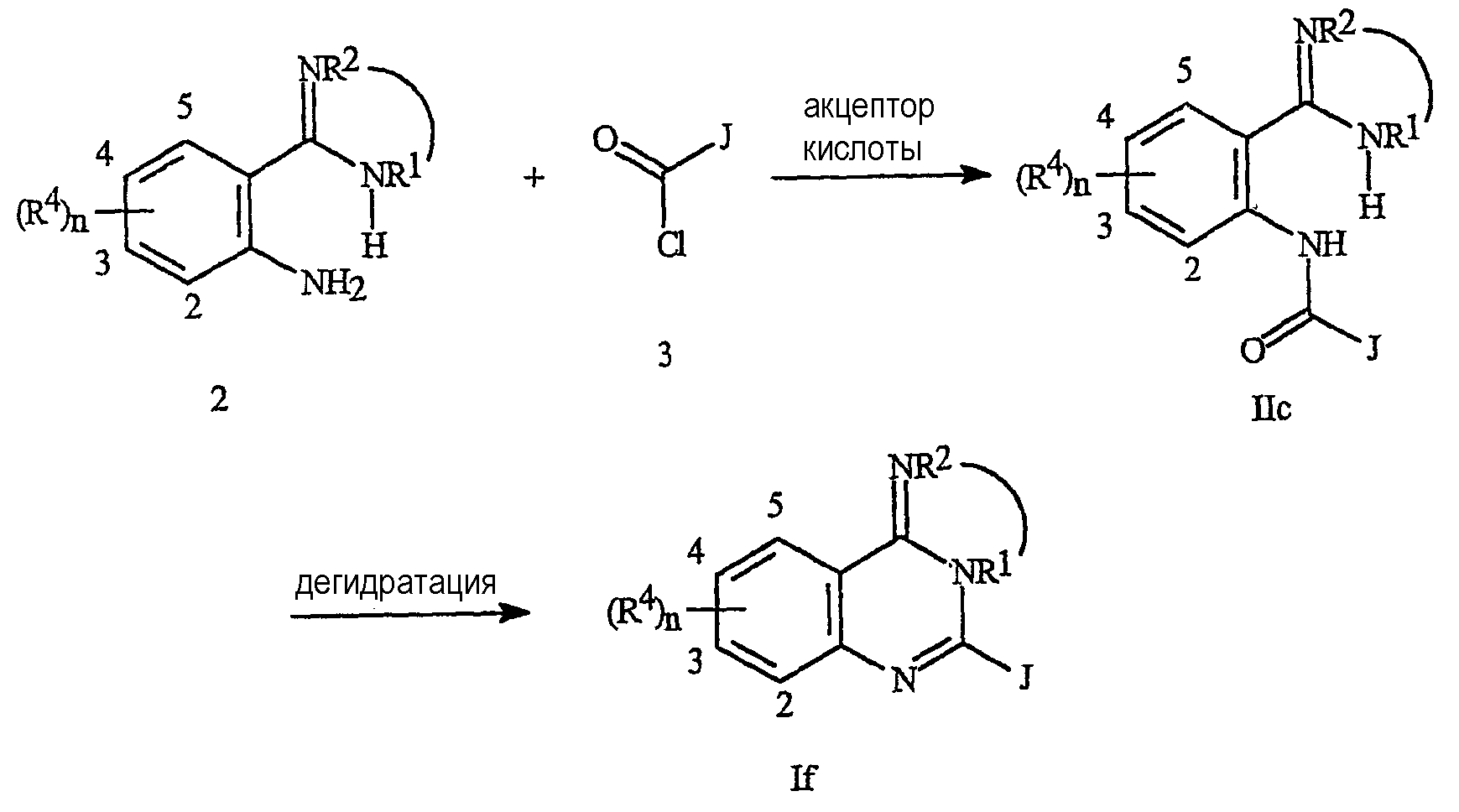
Соединения формулы Ic или Id (соединения формулы I, в которых В представляет NR1) могут быть получены из антранилонитрилов формулы 14 циклизацией с амидом формулы 15 в присутствии дегидратирующих агентов, таких как POCl3, POCl3/PCl5 или SOCl2 (схема 11). Циклизацию обычно проводят в растворителях, таких как дихлорэтан, дихлорметан, хлороформ, бензол, толуол, ксилолы, гексаны, циклогексаны, 1,4-диоксан, тетрагидрофуран и хлорбензол, при температурах в интервале от 0°C до температуры дефлегмации смеси. Полученные соединения формулы Ic (где R2 представляет Н) могут быть обработаны электрофилами формулы 16 (где Lg представляет уходящую группу, такую как галоген и алкил- или арилсульфонаты), необязательно в присутствии акцептора кислоты, с получением соединений формулы Id (где R2 не является Н). Обычные акцепторы кислоты включают аминные основания, такие как триэтиламин, диизопропилэтиламин и пиридин; другие акцепторы кислоты включают гидроксиды, такие как гидроксид натрия и гидроксид калия, и карбонаты, такие как карбонат натрия и карбонат калия. В некоторых примерах полезно использовать акцепторы кислоты, нанесенные на полимеры, такие как полимерсвязанный диизопропилэтиламин и полимерсвязанный диметиламинопиридин. Такие реакции обычно проводят в растворителях, таких как дихлорэтан, дихлорметан, хлороформ, бензол, толуол, ксилолы, гексаны, циклогексан, 1,4-диоксан, тетрагидрофуран, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид и хлорбензол, при температурах в интервале от 0°C до температуры дефлегмации смеси. Соединения формулы Id могут быть получены из соединений формул 14 и 15 (где R1 представляет Н) с помощью аналогичных методик. Алкилирование соединения формулы Id алкилирующим агентом с двумя уходящими группами (например, этилендибромидом или пропилендибромидом) обеспечивает получение соединений формулы Ie, где, например, фрагмент R1-R2 представляет собой СН2СН2 или СН2СН2СН2.
Схема 11

Соединения формулы 14 хорошо известны и являются коммерчески доступными или могут быть получены по известным методикам. Амиды формулы 15 могут быть получены из кислот формулы 4 или хлорангидридов формулы 3 взаимодействием с аминами формулы R1NH2 в соответствии со способами, представленными на схемах 2,3 и 5.
Как показано на схеме 11а, соединения формулы If также могут быть получены дегидратацией соединений формулы IIc. Соединения формулы IIc могут быть получены из анилинов с гетероциклом в орто-положении, содержащим фрагмент NH (формула 16), и соединений формулы 3 в присутствии акцептора кислоты в соответствии со способами, описанными на схеме 2. В некоторых примерах дегидратация IIc может быть осуществлена в условиях сочетания с непосредственным получением соединений формулы If. Подробное описание этой последовательности реакций представлено в примере 3.
Схема 11а
Бензойные кислоты формулы 4, где J представляет необязательно замещенное фенильное кольцо, хорошо известны в данной области техники и являются коммерчески доступными или могут быть получены в соответствии с хорошо известными методиками. Гетероциклические кислоты формулы 4, где J представляет необязательно замещенный гетероцикл, могут быть получены по методикам, представленным на схемах 12-35. Общие и конкретные ссылки на различные гетероциклические кислоты, включая тиофены, фураны, пиридины, пиримидины, триазолы, имидазолы, пиразолы, тиазолы, оксазолы, изотиазолы, тиадиазолы, оксадиазолы, триазины, пиразины, пиридазины и изоксазолы, можно найти в следующих учебниках: Rodd's Chemistry of Chemistry of Carbon Compounds, Vol. IVa-IVl, S.Coffey editor, Elsevier Scientific Publishing, New York, 1973; ComprehensiveHeterocyclic Chemistry, Vol. 1-7, A.R. Katritzky and C.W. Rees editors, Pergamon Press, New York, 1984; ComprehensiveHeterocyclic Chemistry II, Vol. 1-9, A.R. Katritzky, C.W.Rees, and E.F. Scriven editors, Pergamon Press, New York, 1996, и серийных изданиях, например The Chemistry of Heterocyclic Compounds, E.C. Taylor, editor, Wiley, New York. Гетероциклические кислоты, особенно полезные для получения соединений формулы I данного изобретения, включают пиридиновые кислоты, пиримидиновые кислоты и пиразольные кислоты. Методики синтеза типичных примеров кислоты каждого типа подробно показаны на схемах 12-35. Различные гетероциклические кислоты и общие методы их синтеза можно найти в публикации Международной заявки РСТ WO 98/57397.
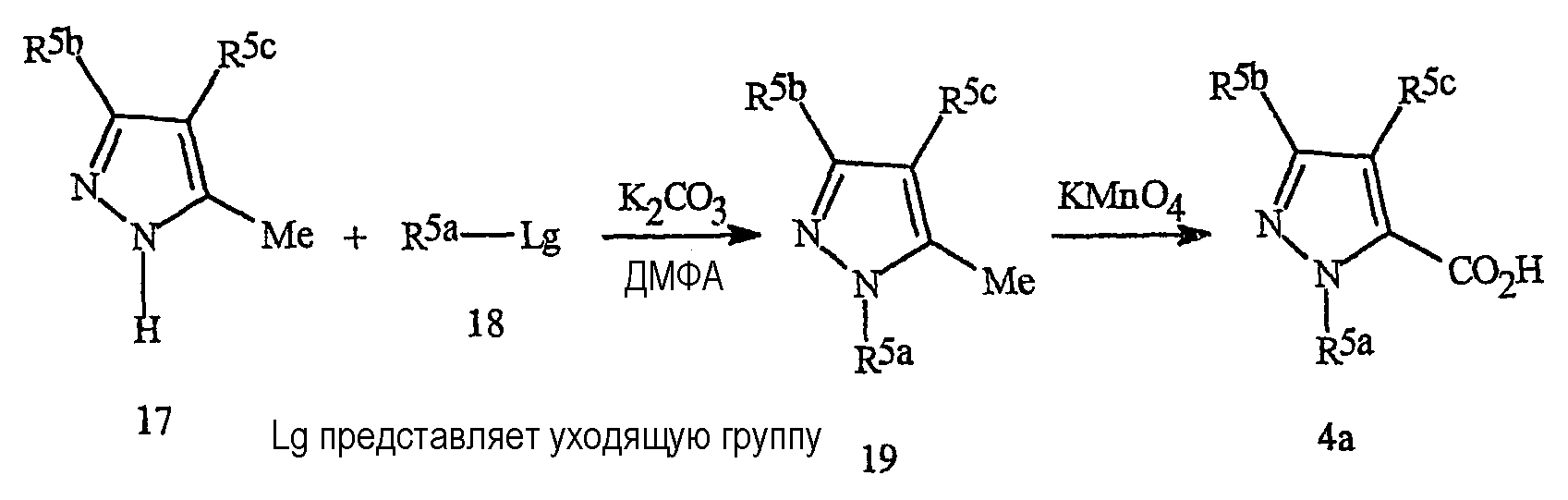
Синтез пиразолов формулы 4а описан на схеме 12. Синтез соединений формулы 4а на схеме 12 включает в качестве ключевой стадии введение R5a заместителя алкилированием или арилированием пиразола формулы 17 соединениями формулы 18 (где Lg представляет уходящую группу, как определено выше). Окисление метильной группы приводит к получению пиразолкарбоновой кислоты. Некоторые из более предпочтительных R5b групп включают галогеналкил.
Схема 12
Синтез пиразолов формулы 4а также описан на схеме 13. Данные кислоты могут быть получены способом, в котором ключевой стадией является металлирование и карбоксилирование соединений формулы 20. Группу R5a вводят способом, аналогичным представленному на схеме 12, то есть алкилированием или арилированием соединением формулы 18. Типичные примеры R5b групп включают, например, цианогруппу, галогеналкил и галоген.
Схема 13
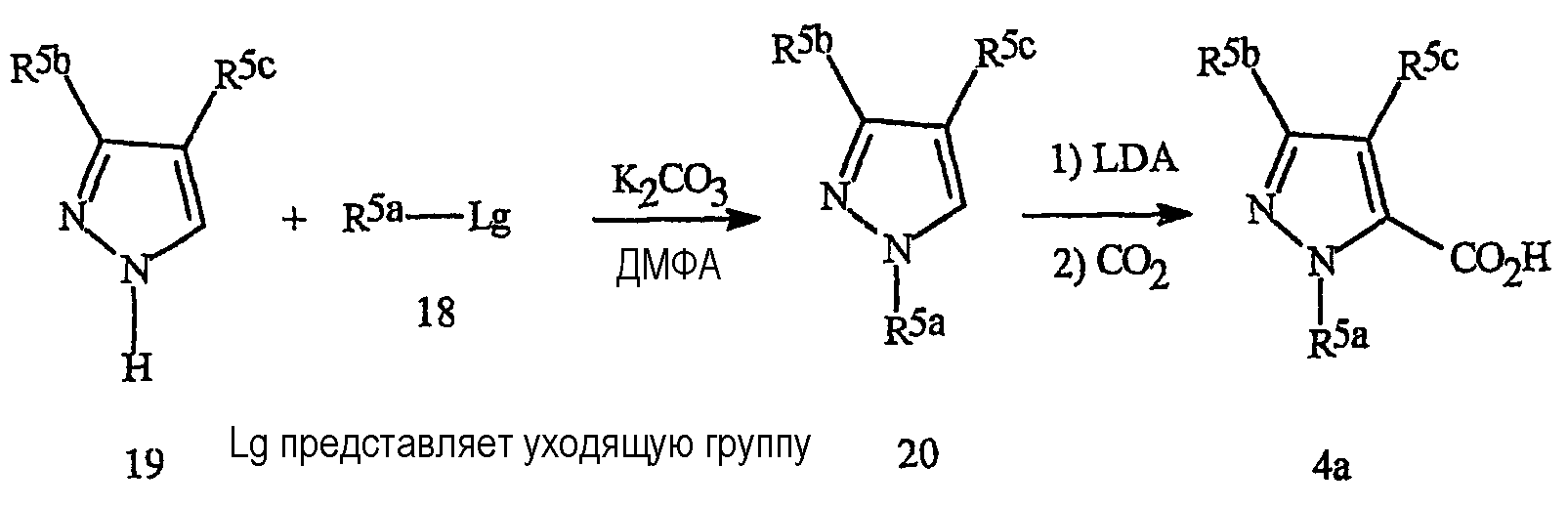
Данная методика особенно полезна для получения 1-(2-пиридинил)пиразолкарбоновых кислот формулы 4b (относятся к предпочтительному фрагменту J-6), как показано на схеме 14. Взаимодействие пиразола формулы 19 с 2,3-дигалогенпиридином формулы 18а приводит к хорошим выходам 1-пиридилпиразола формулы 20а с хорошей специфичностью желаемой региохимии. Металлирование соединения 20а диизопропиламидом лития (LDA) с последующим гашением литиевой соли диоксидом углерода приводит к получению 1-(2-пиридинил)пиразолкарбоновой кислоты формулы 4b (см. пример 1).
Схема 14

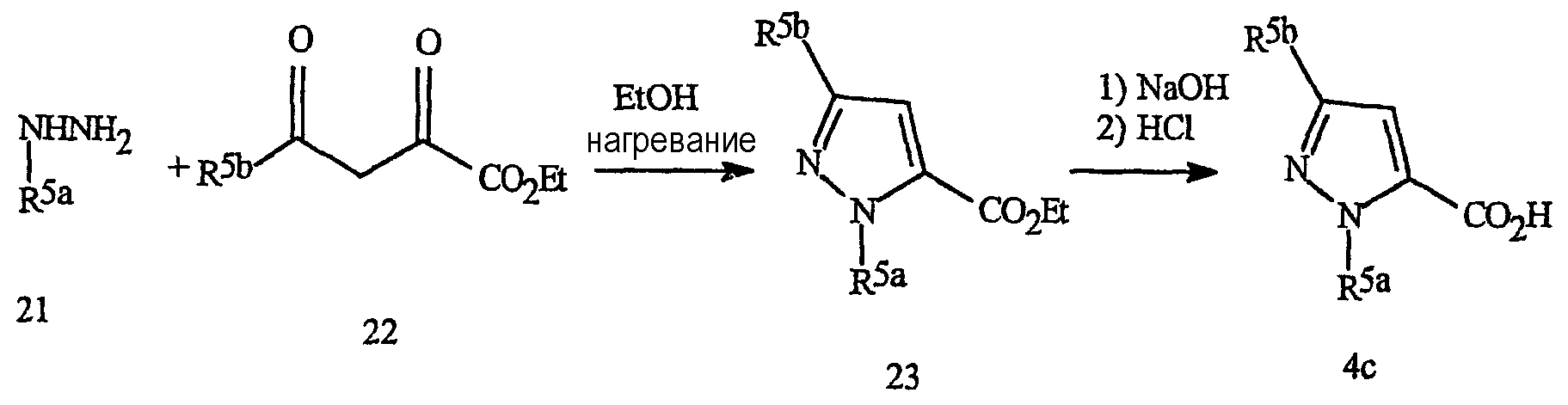
Синтез пиразолов формулы 4с представлен на схеме 15. Они могут быть получены взаимодействием необязательно замещенного фенилгидразина формулы 21 с кетопируватом формулы 22 с получением сложных пиразоловых эфиров формулы 23. Гидролиз сложных эфиров приводит к получению пиразоловых кислот формулы 4с. Данная методика особенно полезна для получения соединений, в которых R5a представляет необязательно замещенный фенил и R5b представляет галогеналкил.
Схема 15
Другая разновидность данной последовательности реакций с использованием фурильной группы в качестве защитной группы карбоновой кислоты описана в примере 2.
Другой способ синтеза пиразоловых кислот формулы 4с описан на схеме 16. Данные кислоты могут быть получены по реакции 3+2 циклоприсоединения соответствующего замещенного нитрилимина формулы 24 либо с замещенными пропиолатами формулы 25, либо с акрилатами формулы 27. Для циклоприсоединения акрилатов необходимо дополнительное окисление промежуточного пиразолина в пиразол. Гидролиз сложных эфиров формулы 28 приводит к получению пиразоловых кислот формулы 4с. Предпочтительные для данной реакции иминогалогениды включают трифторметилиминохлорид формулы 29 и иминодибромид формулы 30. Соединения формулы 29 являются известными соединениями (J. Heterocycl. Chem.1985, 22(2), 565-8). Соединения формулы 30 могут быть получены известными способами (Tetrahedron Letters1999, 40, 2605). Данные методики особенно полезны для получения соединений, в которых R5a представляет необязательно замещенный фенил и R5b представляет галогеналкил или бром.
Исходные пиразолы формулы 19 являются известными соединениями или могут быть получены в соответствии с известными способами. Пиразол формулы 19а (соединение формулы 19, где R5b представляет CF3 и R5cпредставляет Н) коммерчески доступен. Пиразолы формулы 19с (соединения формулы 19, где R5bпредставляет Cl или Br и R5c представляет Н) могут быть получены в соответствии с методиками, описанными в литературе (Chem. Ber. 1966, 99(10), 3350-7). Полезный альтернативный способ получения соединения 19с представлен на схеме 17. Металлирование сульфамоилпиразола формулы 31 н-бутиллитием с последующим прямым галогенированием аниона либо гексахлорэтаном (когда R5b представляет Cl), либо 1,2-дибромтетрахлорэтаном (когда R5b представляет Br) приводит к получению галогенированных производных формулы 32. Удаление сульфамоильной группы трифторуксусной кислотой (ТФУК) при комнатной температуре приводит к получению чистых пиразолов формулы 19с с хорошим выходом. Квалифицированному специалисту понятно, что соединение формулы 19с является таутомером соединения формулы 19b.
Схема 16

Схема 17

Синтез типичных пиридиновых кислот (4d) представлен на схеме 18. Данная методика включает известный синтез пиридинов из сложных β-кетоэфиров формулы 37 и 4-аминобутенонов формулы 36. Группы заместителей R5a и R5b включают, например, алкил и галогеналкил.
Схема 18

Синтез типичных пиримидиновых кислот (4е) представлен на схеме 19. Данная методика включает также известный синтез пиримидинов из сложных енамино-β-кетоэфиров формулы 40 и амидинов формулы 41. Группы заместителей R5a и R5b включают, например, алкил и галогеналкил.
Схема 19

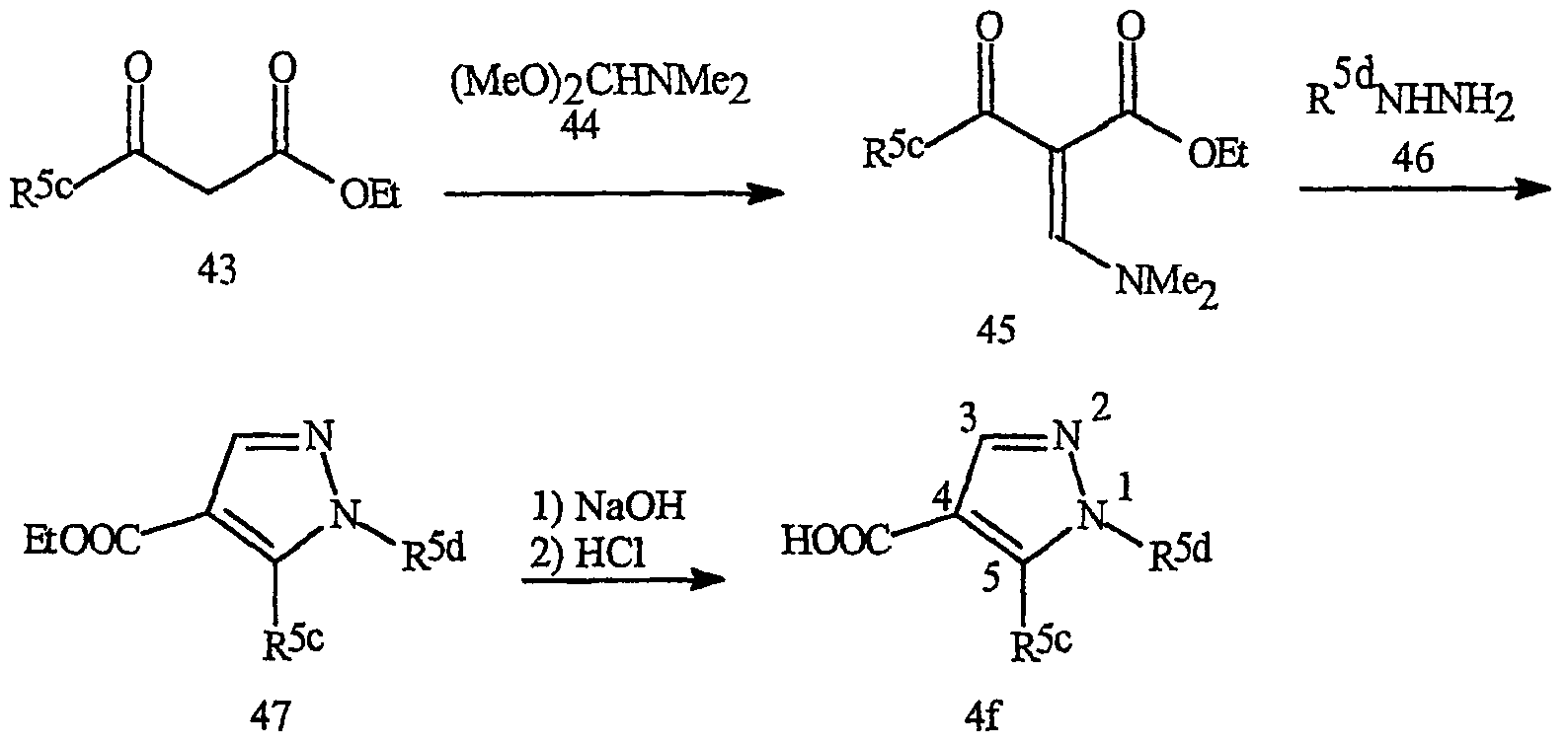
Синтез типичных пиразоловых кислот формулы 4f представлен на схеме 20. Взаимодействие сложного диметиламиноилиденкетоэфира формулы 45 с замещенным гидразином (46) приводит к получению пиразола формулы 47. Предпочтительные заместители R5d включают алкил и галогеналкил, особенно предпочтителен 2,2,2-трифторэтил. Сложные эфиры формулы 47 превращают в кислоты формулы 4f стандартными методами гидролиза.
Схема 20
Синтез пиразоловых кислот формулы 4g, которые относятся к предпочтительному фрагменту J-7, где R5 представляет замещенный 2-пиридильный фрагмент, присоединенный в положении 5 к пиразольному кольцу, представлен на схеме 21. Данный синтез проводят в соответствии с обычной методикой, представленной на схеме 20.
Схема 21

Синтез типичных пиразоловых кислот формулы 4h, а также альтернативный синтез соединений формулы 4f представлен на схеме 22.
Схема 22
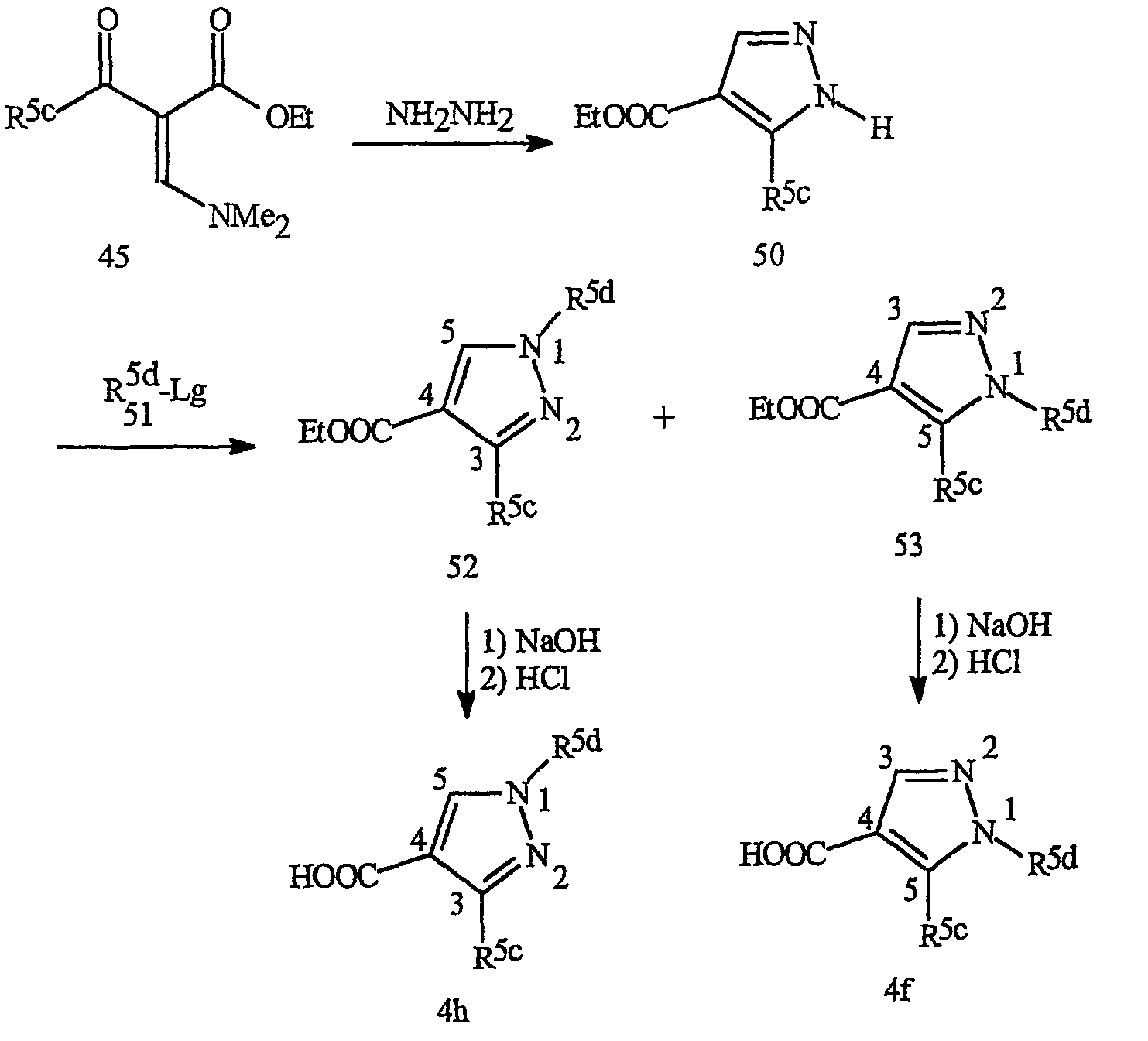
Взаимодействие сложного диметиламиноилиденового кетоэфира формулы 45 с гидразином приводит к получению пиразола формулы 50. Взаимодействие пиразола 50 с алкилирующим агентом формулы 51 приводит к получению смеси пиразолов формул 52 и 53. Данная смесь изомеров пиразола легко разделяется методами хроматографии и подвергается превращению в соответствующие кислоты 4h и 4f соответственно Предпочтительные заместители R5d включают алкильные и галогеналкильные группы.
Синтез пиридинилпиразоловых кислот формулы 4i, которые относятся к предпочтительному фрагменту j-10, где R5 представляет замещенный 2-пиридинил и присоединен в положении 3 пиразольного кольца, а также альтернативный синтез соединений формулы 4g представлен на схеме 23. Синтез проводят в соответствии с общей методикой синтеза, описанной для схемы 22.
Схема 23

Общий синтез пирроловых кислот формулы 4j представлен на схеме 24. Обработка соединения формулы 58 2,5-диметокситетрагидрофураном (59) приводит к получению пиррола формулы 60. Формилирование пиррола 60 с получением альдегида формулы 61 может быть осуществлено с использованием стандартных условий формилирования Вильсмейера-Хаака (Vilsmeier-Haack formylation), таких как обработка N,N-диметилформамидом (ДМФА) и оксихлоридом фосфора. Галогенирование соединения формулы 61 N-галогенсукцинимидами (NXS), такими как N-хлорсукцинимид или N-бромсукцинимид, проводят предпочтительно в положение 4 пиррольного кольца. Окисление гелогенированного альдегида приводит к получению пирроловой кислоты формулы 4j. Окисление может быть проведено с использованием различных условий стандартного окисления.
Схема 24

Синтез некоторых пиридинилпирроловых кислот формулы 4k, которые относятся к предпочтительному фрагменту J-11, где R5 представляет замещенный 2-пиридинил и присоединен к атому азота пиррольного кольца, представлен на схеме 25. Данный синтез проводят в соответствии с общей методикой синтеза, описанной для схемы 24. Соединение формулы 58а, 3-хлор-2-аминопиридин, является известным соединением (см. J.Heterocycl. Chem. 1987, 24(5), 1313-16).
Схема 25

Синтез пирроловых кислот формулы 4m представлен на схеме 26. Циклоприсоединение аллена формулы 69 к фенилсульфонилгидразиду формулы 68 (см. Pavri N.P., Trudell M.L. J. Org. Chem. 1997, 62, 2649-2651) приводит к получению пирролина формулы 70. Обработка пирролина формулы 70 фторидом тетрабутиламмония (TBAF) приводит к получению пиррола формулы 71. Взаимодействие пиррола 71 с алкилирующим агентом R5d-Lg (где Lg представляет уходящую группу, как определено выше) с последующим гидролизом приводит к пирроловой кислоте формулы 4m.
Схема 26
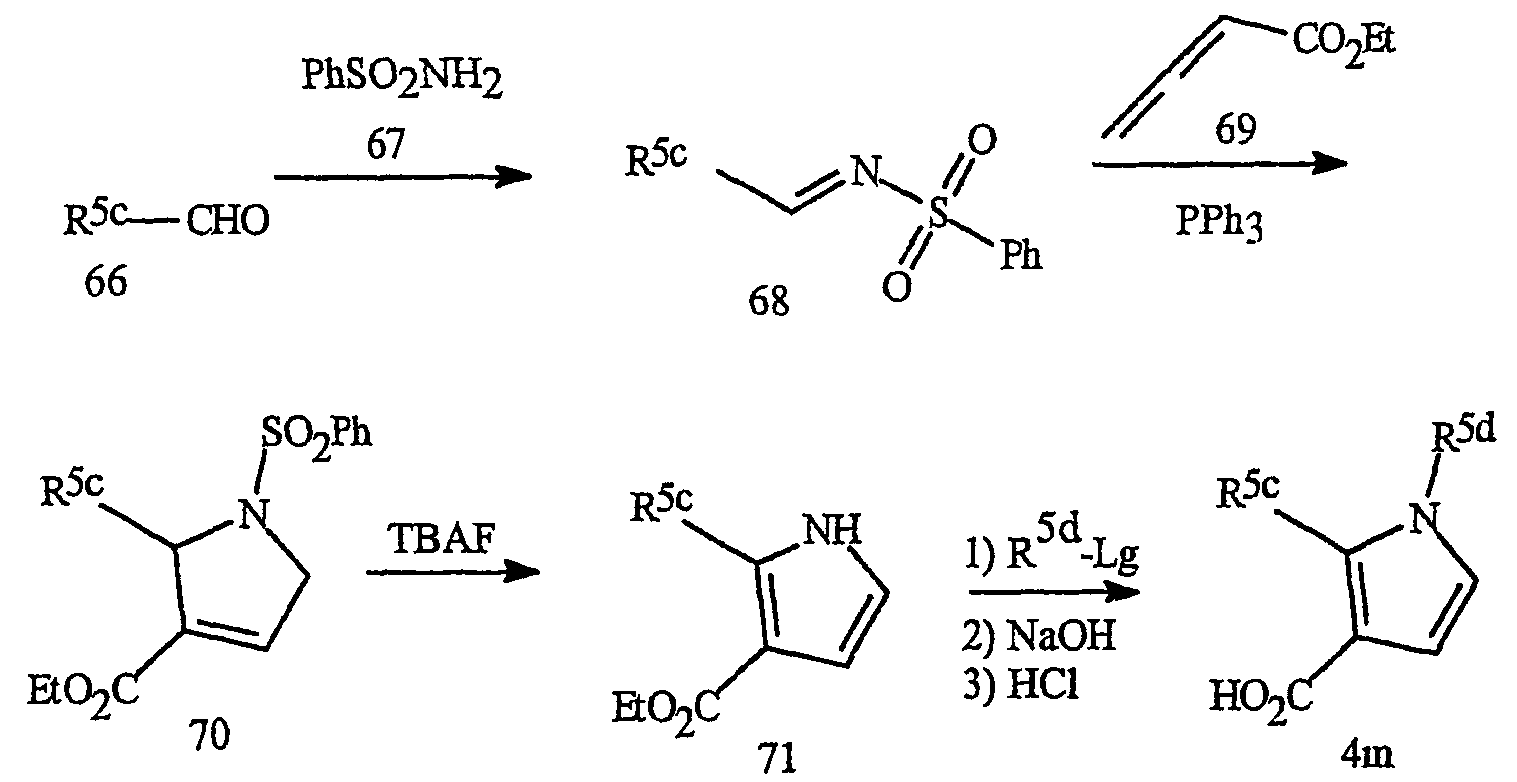
Синтез пирроловых кислот формулы 4n, которые относятся к предпочтительному фрагменту J-12, где R5 представляет замещенный фенил или замещенный 2-пиридил и присоединен в положении 2 пиррольного кольца, представлен на схеме 27. Синтез проводят в соответствии с общим методом, описанным для схемы 26.
Схема 27
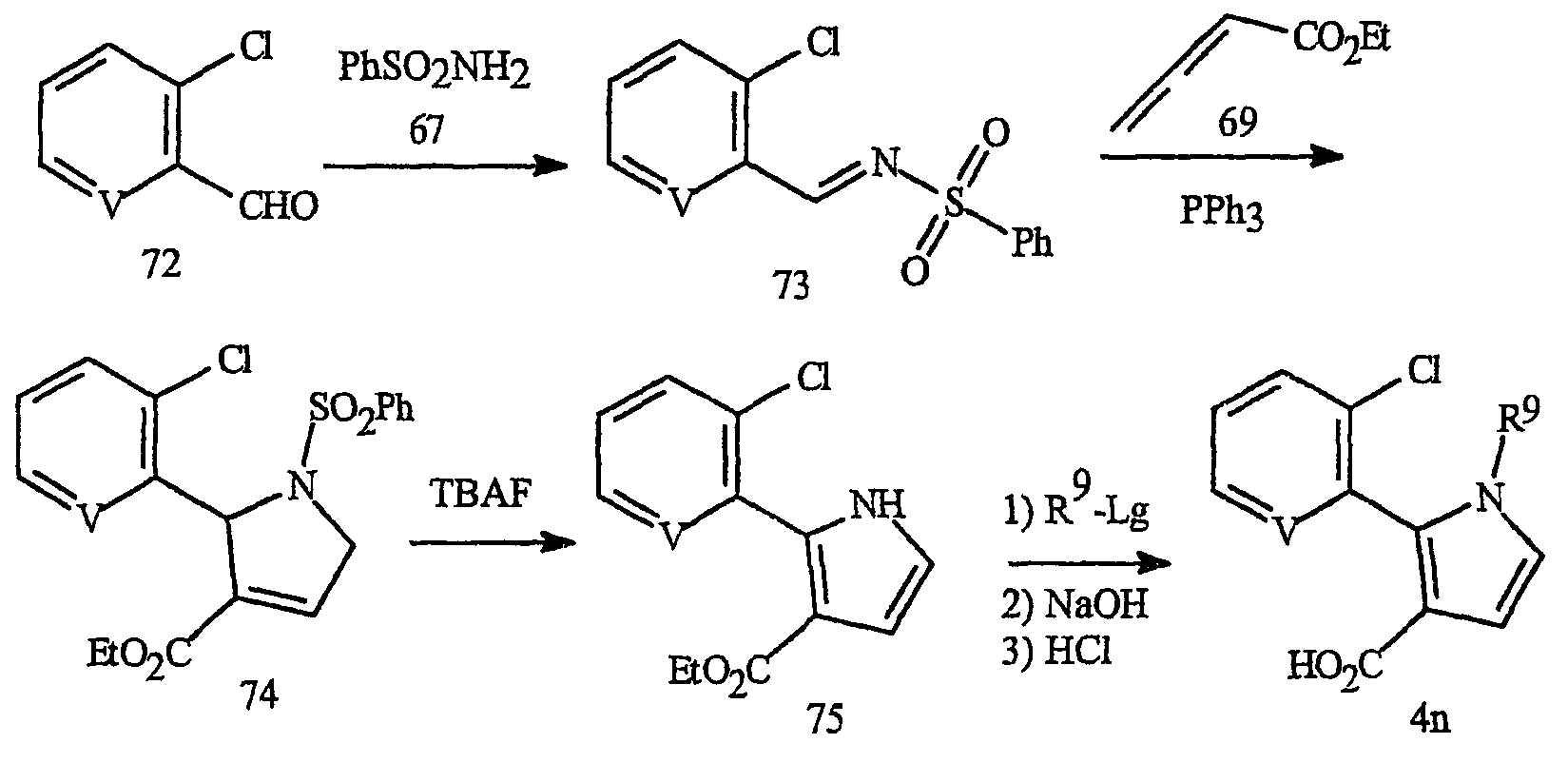
Синтез пирроловых кислот формулы 4о представлен на схеме 28. Взаимодействие сложных α, β-ненасыщенных эфиров формулы 76 с п-толилсульфонилметилизоцианидом (TosMIC) приводит к получению пиррола формулы 78 (в качестве основной ссылки см. Xu Z. et al., J. Org Chem., 1988, 63, 5031-5041). Взаимодействие пиррола формулы 78 с алкилирующим агентом R5d-Lg (где Lg представляет уходящую группу, как определено выше) с последующим гидролизом приводит к получению пирроловой кислоты формулы 4о.
Схема 28
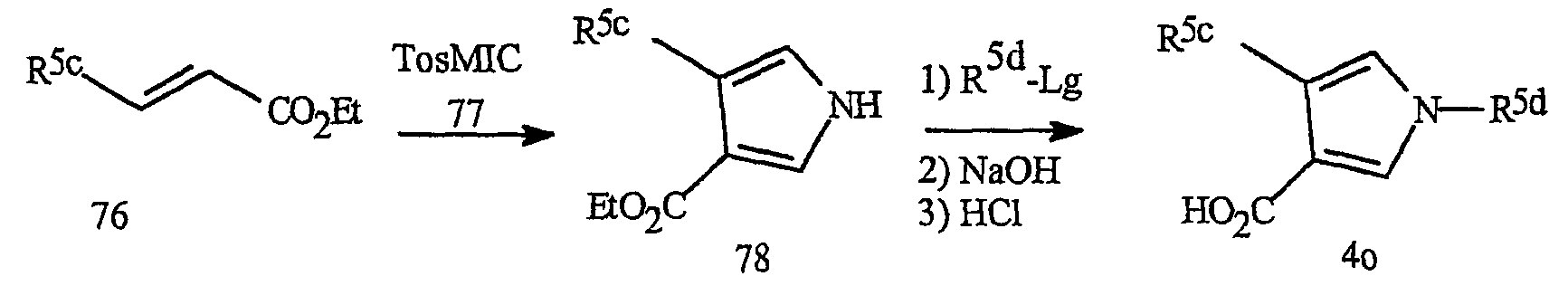
Синтез пирроловых кислот формулы 4р, которые относятся к предпочтительному фрагменту J-13, где R5 представляет замещенный фенил или замещенное 2-пиридинильное кольцо, представлен на схеме 29. Синтез проводят в соответствии с общим методом, описанным для схемы 28.
Схема 29

Пиразолкарбоновые кислоты формулы 4q, где R7 представляет CF3, могут быть получены способом, представленным на схеме 30.
Схема 30
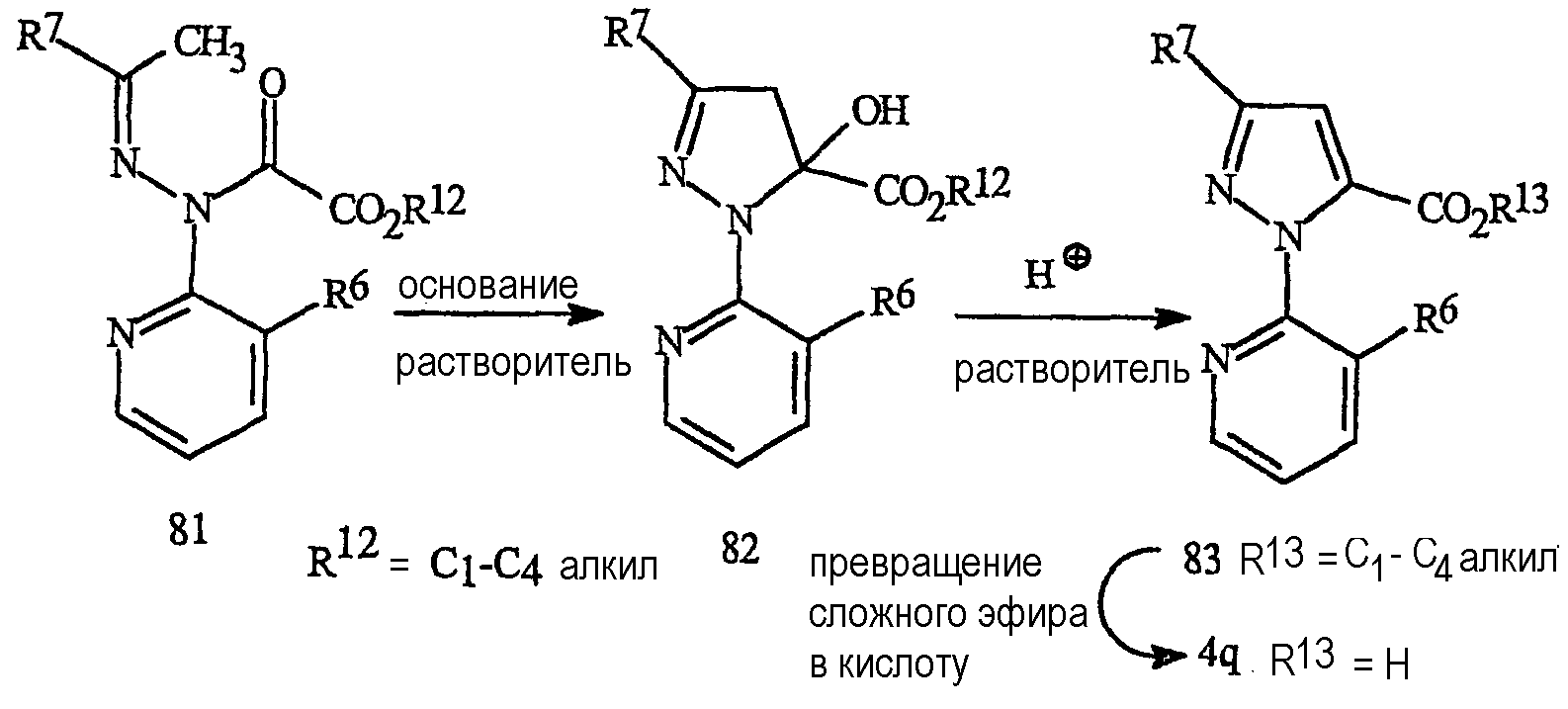
Взаимодействие соединения формулы 81, где R12 представляет С1-С4алкил, с подходящим основанием в подходящем органическом растворителе приводит к продукту циклизации формулы 82 после нейтрализации кислотой, такой как уксусная кислота. Подходящим основанием может быть, например, но без ограничения только ими, гидрид натрия, трет-бутоксид калия, димсилнатрий (CH3 S(O)СН2-Na+), карбонаты или гидроксиды щелочных металлов (таких как литий, натрий или калий), фториды или гидроксиды тетраалкил(такой как метил, этил или бутил)аммония или 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфонин. Подходящим органическим растворителем может быть, например, но без ограничения только ими, ацетон, ацетонитрил, тетрагидрофуран, дихлорметан, диметилсульфоксид или N,N-диметилформамид. Реакцию циклизации обычно проводят при температуре в интервале от примерно 0 до 120°C. Влияния растворителя, основания и времени добавления являются независимыми, и выбор условий реакции важен для сведения к минимуму образования побочных продуктов. Предпочтительным основанием является фторид тетрабутиламмония.
Дегидратация соединения формулы 82 приводит к получению соединения формулы 83 с последующим превращением функциональной группы сложного эфира карбоновой кислоты в группу карбоновой кислоты и получением соединения формулы 4q. На дегидратацию влияет обработка каталитическим количеством подходящей кислоты. Такой каталитической кислотой может быть, например, но без ограничения, серная кислота. Реакцию обычно проводят с использованием органического растворителя. Как понятно квалифицированному специалисту, реакции дегидратации могут быть проведены в различных растворителях при температуре в интервале примерно от 0 до 200°C, более предпочтительно в интервале от 0 до 100°C. Для дегидратации по способу, представленному на схеме 30, предпочтительны растворитель, включающий уксусную кислоту, и температура около 65°C. Сложные эфиры карбоновых кислот могут быть превращены в карбоновые кислоты различными способами, включая нуклеофильное расщепление в безводных условиях или гидролитическими способами с использованием кислот или оснований (обзор данных способов см. в T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 2nd ed., John Wiley & Sons, Inc., New York, 1991, pp. 224-269). Для способа, представленного на схеме 30, предпочтительны гидролитические способы с использованием в качестве катализатора основания. Подходящие основания включают гидроксиды щелочных металлов (таких как литий, натрий или калий). Например, сложный эфир может быть растворен в смеси воды и спирта, такого как этанол. После обработки гидроксидом натрия или гидроксидом калия сложный эфир омыляется с получением натриевой или калиевой соли карбоновой кислоты. Подкисление сильной кислотой, такой как хлористоводородная кислота или серная кислота, приводит к получению карбоновой кислоты формулы 4q. Карбоновая кислота может быть выделена способами, известными квалифицированному специалисту, включая кристаллизацию, экстракцию или отгонку.
Соединения формулы 81 могут быть получены способом, представленным на схеме 31.
Схема 31

где R7 представляет CF3 и R12 представляет С1-С4алкил.
Обработка соединения гидразина формулы 84 кетоном формулы 85 в растворителе, таком как вода, метанол или уксусная кислота, приводит к получению гидразона формулы 86. Квалифицированному специалисту понятно, что для данной реакции может потребоваться катализ кислотой, а также повышенные температуры в зависимости от молекулярной картины замещения гидразона формулы 86. Взаимодействие гидразона формулы 86 с соединением формулы 87 в подходящем органическом растворителе, таком как, например, но без ограничения только ими, дихлорметан или тетрагидрофуран, в присутствии акцептора кислоты, такого как триэтиламин, приводит к получению соединения формулы 81. Реакцию обычно проводят при температуре в интервале примерно от 0 до 100°C. Соединения гидразина формулы 84 могут быть получены стандартными способами, такими как контактирование соответствующего галогенпроизводного формулы 18а (схема 14) с гидразином.
Пиразолкарбоновые кислоты формулы 4r, где R7 представляет Cl или Br, могут быть получены способом, представленным на схеме 32.
Схема 32

где R7 представляет Cl или Br и R12 представляет С1 -С4алкил.
Окисление соединения формулы 88 необязательно в присутствии кислоты приводит к получению соединения формулы 89 с последующим превращением функциональной группы сложного эфира карбоновой кислоты в функциональную группу карбоновой кислоты и получением, таким образом, соединения формулы 4r. Окислителем может быть пероксид водорода, органические пероксиды, персульфат калия, персульфат натрия, персульфат аммония, моноперсульфат калия (например, Oxone®) или перманганат калия. Для получения полного превращения необходимо использовать, по меньшей мере, один эквивалент окислителя на эквивалент соединения формулы 88, предпочтительно примерно от одного до двух эквивалентов. Такое окисление обычно проводят в присутствии растворителя. Растворителем может быть простой эфир, такой как тетрагидрофуран, п-диоксан и т.п., сложный органический эфир, такой как этилацетат, диметилкарбонат и т.п., или полярное апротонное органическое вещество, такое как N,N-диметилформамид, ацетонитрил и т.п. Кислоты, подходящие для применения на стадии окисления, включают неорганические кислоты, такие как серная кислота, фосфорная кислота и т.п., и органические кислоты, такие как уксусная кислота, бензойная кислота и т.п. Если применяется кислота, она должна использоваться в количестве более 0,1 эквивалента относительно соединения формулы 88. Для получения полного превращения можно использовать от одного до пяти эквивалентов кислоты. Предпочтительным окислителем является персульфат калия, и окисление предпочтительно проводят в присутствии серной кислоты. Реакция может быть проведена путем смешивания соединения формулы 88 с нужным растворителем и, если используется, с кислотой. Затем с подходящей скоростью может быть добавлен окислитель. Температура реакции обычно находится в интервале от примерно 0°C до температуры кипения растворителя для получения приемлемого времени реакции для завершения реакции, предпочтительно менее 8 часов. Целевой продукт, соединение формулы 89, может быть выделен способами, известными квалифицированному специалисту, включая кристаллизацию, экстракцию и отгонку. Способы, подходящие для превращения сложного эфира формулы 89 в карбоновую кислоту формулы 4r, описаны для схемы 30.
Соединения формулы 88 могут быть получены из соответствующих соединений формулы 90, как показано на схеме 33.
Схема 33

где R7 представляет Cl или Br и R12 представляет С1-С4алкил.
Обработка соединения формулы 90 галогенирующим агентом, обычно в присутствии растворителя, приводит к получению соответствующего галогенпроизводного формулы 88. Галогенирующие агенты, которые могут быть использованы, включают оксигалогениды фосфора, тригалогениды фосфора, пентагалогениды фосфора, тионилхлорид, дигалогентриалкилфосфораны, дигалогендифенилфосфораны, оксалилхлорид и фосген. Предпочтительными являются оксигалогениды фосфора и пентагалогениды фосфора. Для получения полного превращения следует использовать, по меньшей мере, 0,33 эквивалента оксигалогенида фосфора в расчете на соединение формулы 90, предпочтительно примерно от 0,33 до 1,2 эквивалента. Для получения полного превращения следует использовать, по меньшей мере, 0,20 эквивалента пентагалогенида фосфора относительно соединения формулы 90, предпочтительно примерно от 0,20 до 1,0 эквивалента. Соединения формулы 90, где R12 представляет С1-С4алкил, являются предпочтительными для данной реакции. Обычные растворители для данного галогенирования включают галогенированные алканы, такие как дихлорметан, хлороформ, хлорбутан и т.п., ароматические растворители, такие как бензол, ксилол, хлорбензол и т.п., простые эфиры, такие как тетрагидрофуран, п-диоксан, диэтиловый эфир и т.п., и полярные апротонные растворители, такие как ацетонитрил, N,N-диметилформамид и т.п. Необязательно могут быть добавлены органические основания, такие как триэтиламин, пиридин, N, N-диметиланилин и т.п. Возможно также добавление катализатора, такого как N,N-диметилформамид. Предпочтительным является процесс, в котором растворителем является ацетонитрил и основание отсутствует. Обычно при использовании ацетонитрила в качестве растворителя не требуется ни основания, ни катализатора. Предпочтительный процесс проводят путем смешивания соединения формулы 90 с ацетонитрилом. Затем в течение подходящего времени добавляют галогенирующий агент и после этого смесь выдерживают при определенной температуре для завершения реакции. Температура реакции обычно находится в интервале от 20°C до температуры кипения ацетонитрила, и время реакции обычно составляет менее двух часов. Реакционную массу затем нейтрализуют неорганическим основанием, таким как бикарбонат натрия, гидроксид натрия и т.п., или органическим основанием, таким как ацетат натрия. Целевой продукт, соединение формулы 88, может быть выделен способами, известными квалифицированному специалисту в данной области, включая кристаллизацию, экстракцию и отгонку.
Альтернативно соединения формулы 88, где R7 представляет Br или Cl, могут быть получены обработкой соответствующих соединений формулы 88, где R7представляет другой галоген (например, Cl для получения соединения формулы 88, в котором R7 представляет Br) или сульфонатную группу, такую как п-толуолсульфонат, бромистым водородом или хлористым водородом соответственно. В данном способе галогеновый или сульфонатный заместитель R7 в исходном соединении формулы 88 заменяется атомом Br или Cl бромистого водорода или хлористого водорода соответственно. Реакцию проводят в подходящем растворителе, таком как дибромметан, дихлорметан или ацетонитрил. Реакция может быть проведена при атмосферном давлении или давлении, близком к атмосферному, или при давлении выше атмосферного в емкости, находящейся под давлением. Когда R7 в исходном соединении формулы 88 представляет галоген, такой как Cl, реакцию предпочтительно проводят таким образом, что галогенид водорода, образующийся в ходе реакции, удаляют опрыскиванием или другими подходящими средствами. Реакция может быть проведена при температуре в интервале примерно от 0 до 100°C, наиболее приемлемо при температуре, близкой к комнатной (например, примерно от 10 до 40°C), более предпочтительно в интервале примерно от 20 до 30°C. Добавление кислоты Льюиса в качестве катализатора (такой как трибромид алюминия для получения соединения формулы 88, где R7 представляет Br) может способствовать реакции. Полученное соединение формулы 88 выделяют обычными способами, известными квалифицированному специалисту в данной области, такими как экстракция, отгонка и кристаллизация.
Исходные соединения формулы 88, где R7 представляет Cl или Br, могут быть получены из соответствующих соединений формулы 90, как описано выше. Исходные соединения формулы 88, где R7 представляет сульфонатную группу, могут быть получены аналогичным образом из соответствующих соединений формулы 90 стандартными способами, такими как обработка сульфонилхлоридом (например, п-толуолсульфонилхлоридом) и основанием, таким как третичный амин (например, триэтиламин), в подходящем растворителе, таком как дихлорметан.
Пиразолкарбоновые кислоты формулы 4s, где R7 представляет OCH2CF3, или формулы 4t, где R7 представляет OCHF2, могут быть получены способом, представленным на схеме 34. В данном способе вместо галогенирования, которое показано на схеме 33, соединение формулы 90 окисляют с получением соединения формулы 91. Условия реакции такого окисления уже описаны для превращения соединения формулы 88 в соединение формулы 89, представленного на схеме 32.
Затем соединение формулы 91 алкилируют с образованием соединения формулы 93 (R7 представляет OCH2CF3) контактированием с алкилирующим агентом CF3CH2Lg (92) в присутствии основания. В алкилирующем агенте формулы 92 Lg представляет группу, удаляемую в ходе нуклеофильной реакции, такую как галоген (например, Br, I), OS(O)2CH3 (метансульфонат), OS(O)2CF3, OS(O)2 Ph-p-CH3(п-толуолсульфонат) и т.п.; удобно использовать метансульфонат. Реакцию проводят в присутствии, по меньшей мере, одного эквивалента основания. Подходящие основания включают неорганические основания, такие как карбонаты и гидроксиды щелочных металлов (таких как литий, натрий или калий), и органические основания, такие как триэтиламин, диизопропилэтиламин и 1, 8-диазабицикло[5.4.0]ундец-7-ен. Реакцию обычно проводят в растворителе, который может включать спирты, такие как метанол и этанол, галогенированные алканы, такие как дихлорметан, ароматические растворители, такие как бензол, толуол и хлорбензол, простые эфиры, такие как тетрагидрофуран, и полярные апротонные растворители, такие как ацетонитрил, N,N-диметилформамид и т.п. Спирты и полярные апротонные растворители предпочтительны для применения с неорганическими основаниями. Предпочтительны карбонат калия в качестве основания и ацетонитрил в качестве растворителя. Реакцию обычно проводят при температуре в интервале примерно от 0 до 150°C, причем наиболее типичной является температура в интервале от комнатной температуры до 100°C.
Схема 34

где R12 представляет C1-C4алкил и Lg представляет уходящую группу.
Соединение формулы 91 можно также алкилировать с образованием соединения формулы 95 (R7 представляет OCHF2) контактированием с дифторкарбеном, полученным из CHClF2 в присутствии основания. Реакцию обычно проводят в растворителе, который может включать простые эфиры, такие как тетрагидрофуран или диоксан, и полярные апротонные растворители, такие как ацетонитрил, N,N-диметилформамид и т.п. Основание может быть выбрано из неорганических оснований, таких как карбонат калия, гидроксид натрия или гидрид натрия. Предпочтительно реакцию проводят, используя карбонат калия с N,N-диметилформамидом в качестве растворителя. Сложные эфиры формулы 93 или 95 могут быть выделены традиционными методами, такими как экстракция. Сложные эфиры затем могут быть превращены в карбоновые кислоты формулы 4 или 4t способами, уже описанными для превращения соединений формулы 83 в соединения формулы 4q на схеме 30.
Как представлено на схеме 35, соединения формулы 90 могут быть получены из соединений формулы 84 (см. схему 31).
Схема 35

где R12 представляет C1-C4алкил.
В данном способе соединение гидразина формулы 84 подвергают контактированию с соединением формулы 96 (могут использоваться сложные фумаратные или малеатные эфиры или их смесь) в присутствии основания и растворителя. Основание обычно представляет собой алкоксидную соль металла, такую как метоксид натрия, метоксид калия, этоксид натрия, этоксид калия, трет-бутоксид калия, трет-бутоксид лития и т.п. Следует использовать более 0,5 эквивалента основания из расчета на соединение формулы 84, предпочтительно от 0,9 до 1,3 эквивалента. Следует использовать более 1,0 эквивалента соединения формулы 96, предпочтительно от 1,0 до 1,3 эквивалента. Могут быть использованы полярные протонные и полярные апротонные органические растворители, такие как спирты, ацетонитрил, тетрагидрофуран, N, N-диметилформамид, диметилсульфоксид и т.п. Предпочтительными растворителями являются спирты, такие как метанол и этанол. Особенно предпочтительно, чтобы спирт был тем же самым, который использовался для получения фумаратного или малеатного сложного эфира и алкоксидного основания. Реакцию обычно проводят путем смешивания соединения формулы 84 и основания в растворителе. Смесь можно нагревать или охлаждать до нужной температуры и соединение формулы 96 можно добавлять в течение определенного периода времени. Обычно температура реакции находится в интервале от 0°C до температуры кипения растворителя. Для повышения температуры кипения растворителя реакцию можно проводить при давлении, превышающем атмосферное давление. Обычно предпочтительны температуры в интервале примерно от 30 до 90°C. Время добавления может быть настолько небольшим, насколько позволяет теплопередача. Обычно время добавления составляет от 1 минуты до 2 часов. Оптимальная температура реакции и время добавления изменяются в зависимости от идентичности свойств соединения формулы 84 и соединения формулы 96. После добавления реакционную смесь выдерживают в течение определенного времени при температуре реакции. В зависимости от температуры реакции необходимое время, в течение которого смесь выдерживают при температуре реакции, может составлять от 0 до 2 часов. Обычно такое время составляет от 10 до 60 минут. Реакционную массу затем можно подкислять добавлением органической кислоты, такой как уксусная кислота и т.п., или неорганической кислоты, такой как хлористоводородная кислота, серная кислота и т.п. В зависимости от условий реакции и способов выделения продукта функциональная группа -СО2R12 соединения формулы 90 может быть гидролизована до -СО2Н; например, присутствие воды в реакционной смеси может способствовать такому гидролизу. Если образуется группа карбоновой кислоты (-СО2Н), она может снова превращаться в группу -CO2R12, где R12 представляет С1-С4алкил, методами этерификации, хорошо известными в данной области. Целевой продукт, соединение формулы 90, может быть выделено методами, известными квалифицированному специалисту, такими как кристаллизация, экстракция или отгонка.
Известно, что некоторые реагенты и условия реакции, описанные выше для получения соединений формулы I, могут быть несовместимыми с некоторыми функциональными группами, присутствующими в промежуточных продуктах. В таких случаях для получения целевых продуктов будет использоваться защита/снятие защиты или взаимопревращение функциональных групп в синтезе. Применение и выбор защитных групп будет очевиден для квалифицированного специалиста в области органического синтеза (см., например, Greene, T.W.; Wuts, P.G.M. Protective Groups in Organic Synthesis, 2nd ed.; Wiley: New York, 1991). Квалифицированному специалисту понятно, что в некоторых случаях после введения реагента, приведенного на любой отдельной схеме, возможно потребуется осуществление дополнительных стадий синтеза, не описанных подробно на схеме, для завершения синтеза соединений формулы I. Квалифицированному специалисту также понятно, что может потребоваться осуществление сочетания стадий, представленных на приведенных выше схемах, в порядке, отличном от указанного на схеме, для получения соединений формулы I.
Предполагается, что квалифицированный специалист в данной области может получить соединения формулы I данного изобретения, используя приведенное выше описание во всей его полноте. Таким образом, приведенные далее примеры следует рассматривать только как иллюстративные, а никоим образом не ограничивающие объем данного изобретения. Проценты, приведенные в примерах, являются массовыми процентами, кроме смесей растворителей для хроматографии или кроме тех случаев, когда другое условие оговаривается особо. Части и проценты для смесей хроматографических растворителей приведены из расчета на объем, если не оговорено другое условие.1Н-ЯМР спектры приводятся в миллионных долях в нижнюю область от тетраметилсилана; с означает синглет, д означает дублет, т означает триплет, кв. означает квартет, м означает мультиплет, дд означает двойной дублет, дт означает двойной триплет, уш.с означает уширенный синглет.
ПРИМЕР 1
Получение N-[2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3, 1-бензоксазин-4-илиден]-2-пропанамина
Стадия А: получение 3-хлор-2-[3-(трифторметил)-1Н-пиразол-1-ил]пиридина
К смеси 2,3-дихлорпиридина (99,0 г, 0,67 моль) и 3-трифторметилпиразола (83 г, 0,61 моль) в сухом N,N-диметилформамиде (300 мл) добавляют карбонат калия (166,0 г, 1,2 моль) и затем реакционную смесь нагревают при 110-125°C в течение 48 часов. Реакционную смесь охлаждают до 100°C и фильтруют через диатомовый ускоритель фильтрования Celit® для удаления твердых веществ. N,N-Диметилформамид и избыток дихлорпиридина удаляют отгонкой при атмосферном давлении. Отгонка продукта при пониженном давлении (т.кип. 139-141°C/7 мм рт.ст.) приводит к получению целевого промежуточного продукта в виде прозрачного желтого масла (113,4 г).
1Н-ЯМР (CDCl3): δ 6,78 (с, 1H), 7,36 (т, 1H), 7,93 (д, 1H), 8,15 (с, 1H), 8,45 (д, 1H).
Стадия В: получение 1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-карбоновой кислоты
К раствору пиразольного продукта, полученного на стадии А (105,0 г, 425 ммоль), в сухом тетрагидрофуране (700 мл) при -75°C через каннюлю добавляют раствор диизопропиламида лития (425 ммоль) в сухом тетрагидрофуране (300 мл), охлажденный до -30°C. Полученный раствор насыщенного красного цвета перемешивают в течение 15 минут, после чего через раствор при -63°C барботируют диоксид углерода до тех пор, пока раствор не становится бледно-желтым и не прекращается выделение тепла. Реакционный раствор снова перемешивают в течение 20 минут и затем реакцию гасят водой (20 мл). Растворитель удаляют при пониженном давлении, реакционную смесь распределяют между простым эфиром и 0,5 н. водным раствором гидроксида натрия. Водные экстракты промывают простым эфиром (3х), фильтруют через диатомовый ускоритель фильтрования Celite® для удаления остатков твердых веществ, затем подкисляют до рН приблизительно 4, при котором образуется оранжевое масло. Водную смесь энергично перемешивают и добавляют дополнительное количество кислоты для снижения рН до 2,5-3. Оранжевое масло превращается в гранулированное твердое вещество, которое фильтруют, промывают последовательно водой и 1 н. хлористоводородной кислотой и сушат в вакууме при 50°C, получая указанный в заголовке продукт в виде не совсем белого твердого вещества (130 г). (Продукт другой загрузки, полученный в соответствии с аналогичными методиками, плавится при 175-176°C).
1Н-ЯМР (ДМСО-d6): δ 7,61 (с, 1H), 7,76 (дд, 1H), 8,31 (д, 1H), 8,60 (д, 1H).
Стадия С: получение 8-метил-2Н-3,1-бензоксазин-2,4-(1Н)-диона
К раствору 2-амино-3-метилбензойной кислоты (6 г) в сухом 1,4-диоксане (50 мл) по каплям добавляют раствор трихлорметилхлорформиата (8 мл) в сухом 1,4-диоксане (25 мл), охлаждая реакционную массу на ледяной бане для сохранения температуры реакции ниже 25°C. В процессе добавления образуется белый осадок. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Осажденные твердые вещества удаляют фильтрованием, промывают 1,4-диоксаном (2х20 мл) и гексаном (2х15 мл) и сушат на воздухе, получая 6,51 г не совсем белого твердого вещества.
1Н-ЯМР (ДМСО-d6): δ 2,33 (с, 3H), 7,18 (т, 1H), 7,59 (д, 1H), 7,78 (д, 1H), 11,0 (уш.с, 1H).
Стадия D: получение 1-(3-хлор-2-пиридинил)-N-[2-метил-6-[[(1-метилэтил)амино]карбонил]фенил]-3-(трифторметил)-1Н-пиразол-5-карбоксамида
К раствору карбоновой кислоты, полученной на стадии B (28 г, 96 ммоль), в дихлорметане (240 мл) добавляют N,N-диметилформамид (12 капель) и оксалилхлорид (15,8 г, 124 ммоль). Реакционную смесь перемешивают при комнатной температуре до тех пор, пока не перестанет выделяться газ (приблизительно 1,5 часа). Реакционную смесь концентрируют в вакууме с получением неочищенного хлорангидрида в виде масла, которое используют без дополнительной очистки. Неочищенный хлорангидрид растворяют в ацетонитриле (95 мл) и добавляют к раствору бензоксазин-2,4-диона, полученного как описано на стадии С, в ацетонитриле (95 мл). Полученную смесь перемешивают при комнатной температуре (приблизительно 3 минуты). К смеси добавляют пиридин (95 мл), полученную смесь нагревают примерно при 90°C (приблизительно 1 час). Реакционную смесь охлаждают до примерно 35°C и добавляют изопропиламин (25 мл). Реакционная смесь экзотермически нагревается в процессе добавления и затем выдерживается при температуре примерно 50°C (приблизительно 1 час). Затем реакционную смесь выливают в ледяную воду и перемешивают. Образовавшийся осадок отфильтровывают, промывают водой и сушат в вакууме в течение ночи, получая 37, 5 г указанного в заголовке соединения в виде рыжевато-коричневого твердого вещества.
1Н-ЯМР (CDCl3): δ 1,23 (д, 6H), 2,21 (с, 3H), 4,2 (м, 1H), 5,9 (д, 1H), 7,2 (т, 1H), 7,3 (м, 2H), 7,31 (с, 1H), 7,4 (м, 1H), 7,8 (д, 1H), 8,5 (д, 1H), 10,4 (с, 1H).
Стадия Е: получение N-[2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-пропанамина
Перемешиваемый раствор соединения, полученного на стадии D (1,2 г, 2,6 ммоль), в 8 мл оксихлорида фосфора кипятят с обратным холодильником в течение 8 часов. Теплый реакционный раствор выливают на взятый в большом избытке лед и затем сразу добавляют 100 мл этилацетата (после того как весь лед расплавится). Раствор перемешивают и дают возможность оставшемуся льду расплавиться, этилацетатный слой отделяют, промывают водой, водным насыщенным раствором бикарбоната натрия и насыщенным раствором соли. После сушки над сульфатом магния растворитель удаляют в вакууме, получая неочищенный маслянистый остаток твердого желтого вещества. Очистка флэш-хроматографией на силикагеле (4:1, гексан/этилацетат в качестве элюента) приводит к получению 450 мг указанного в заголовке соединения, соединения данного изобретения, выделенного в виде твердого белого вещества (т.пл. 175-176°C).
1Н-ЯМР (CDCl3): δ 1,23 (д, 6H), 1,75 (с, 3H), 4,07 (м, 1H), 7,15-7,28 (м, 3H), 7,45 (м, 1H), 7,90 (д, 1H), 7,95 (д, 1H), 8,55 (д, 1H).
ПРИМЕР 2
Получение N-[2-[1-(2-хлорфенил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3, 1-бензоксазин-4-илиден-2-пропанамина
Стадия А: получение 1-(2-хлорфенил)-5-(2-фуранил)-3-(трифторметил)-1Н-пиразола
К раствору 1-(2-фурин)-4,4, 4-трифторбутан-1,3-диона (105 г, 0,51 моль) в ледяной уксусной кислоте (220 мл) добавляют ацетат натрия (42 г, 0,51 моль). Температура возрастает примерно до 34°C. К полученному раствору по каплям в течение 10 минут добавляют гидрохлорид 2-хлорфенилгидразина (90 г, 0,5 моль) с получением кремообразной суспензии. Смесь нагревают примерно до 60°C примерно в течение 45 минут. Уксусную кислоту удаляют на роторном испарителе при температуре бани 65°C. Полученный маслянистый остаток добавляют к примерно 800 мл воды при энергичном перемешивании, получая гетерогенную смесь. Спустя 15 минут к смеси добавляют дихлорметан (500 мл) и смесь разделяют на фазы. Водную фазу экстрагируют 300 мл дихлорметана. Объединенные органические фазы промывают водой и насыщенным раствором бикарбоната натрия, затем сушат MgSO4и фильтруют. Летучие компоненты удаляют на роторном испарителе. Неочищенный продукт состоит из 151 г темно-красного масла, которое содержит приблизительно 89% целевого продукта и 11% региоизомерного пиразола (определено по анализу ЯМР).
Стадия В: получение 1-(2-хлорфенил)-3-(трифторметил)-1Н-пиразол-5-карбоновой кислоты
Отобранный неочищенный продукт стадии А (приблизительно 89%, 56,0 г, 0,18 моль) растворяют в ацетонитриле (400 мл) и добавляют раствор NaH2PO4 (120 г, 0,87 моль) в 520 мл воды. К полученной смеси по каплям в течение 10-15 минут добавляют раствор гипохлорита натрия (5,25% в воде, 128 г, 2,6 моль). Полученный раствор оранжевого цвета выдерживают при комнатной температуре в течение 30 минут. Реакционную смесь охлаждают на ледяной бане и по каплям добавляют раствор NaClO2 в 560 мл воды, поддерживая температуру ниже 11°C. При этом происходит выделение газа, и для поглощения выделившегося хлора используют скруббер с водным гидроксидом натрия. После завершения добавления реакционную смесь выдерживают охлажденной в течение часа, затем дают ей нагреться до комнатной температуры в течение ночи. К реакционной смеси по каплям добавляют 80 мл концентрированной хлористоводородной кислоты для достижения значения рН ниже 3. Реакционную смесь дважды экстрагируют этилацетатом и объединенные органические экстракты по каплям при перемешивании добавляют к охлажденному (<15°C) раствору 300 г NaHSO3 в 1300 мл воды. Смесь разделяют на фазы и водную фазу экстрагируют этилацетатом. Объединенные органические фазы промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и концентрируют в вакууме. Остаток переносят в хлорбутан и снова концентрируют (дважды). Полученное твердое вещество коричневого цвета растирают в 100 мл этилового эфира в гексане (1%). Добавляют небольшими порциями хлорбутан, способствуя гранулированию твердого вещества. Продукт отфильтровывают, промывают гексанами и сушат. Продукт состоит из 40,8 г рыжевато-коричневого твердого вещества, которое является по существу чистым, как показывают данные1Н-ЯМР.
Стадия С: получение 1-(2-хлорфенил)-3-(трифторметил)-1Н-пиразол-5-карбонилхлорида
Отобранную неочищенную 1-(2-хлорфенил)-3-(трифторметил)-1Н-пиразол-5-карбоновую кислоту (40,8 г, 0,14 моль) растворяют в метиленхлориде (300 мл). Раствор обрабатывают оксалилхлоридом (15,7 мл, 0,18 моль), затем N,N-диметилформамидом (12 капель). Вскоре после добавления N,N-диметилформамидного катализатора наблюдается выделение газа. Реакционную смесь перемешивают в течение примерно 20 минут при комнатной температуре, затем кипятят с обратным холодильником в течение 35 минут. Летучие компоненты удаляют концентрированием реакционной смеси на роторном испарителе при температуре бани 55°C. Неочищенный продукт, приблизительно 43 г светло-желтого масла, используют на следующей стадии без дополнительной очистки.
Стадия D: получение 1-(2-хлорфенил)-N-[2-метил-6-[[(1-метилэтил)амино]карбонил]фенил]-3-(трифторметил)-1Н-пиразол-5-карбоксамида
К отбранному указанному в заголовке примера 1 стадии С соединению (22,3 г, 0,126 моль), суспендированному в ацетонитриле (100 мл), добавляют неочищенный 1-(2-хлорфенил)-3-(трифторметил)-1Н-пиразол-5-карбонилхлорид (43 г). Смесь разбавляют 350 мл пиридина и нагревают приблизительно при 95°C в течение 2 часов. Смесь охлаждают до 29°C, затем обрабатывают изопропиламином (32,2 мл, 0,38 моль). Реакционная масса самопроизвольно нагревается до 60°C, и ее выдерживают при температуре примерно 50°C в течение часа, затем перемешивают в течение ночи. Реакционную смесь выливают в 1 л воды и перемешивают. Полученное твердое вещество отфильтровывают и промывают водой. Влажный осадок на фильтре переносят в смесь дихлорметана и метанола, воду удаляют и органическую фазу сушат с помощью молекулярных сит и фильтруют. Летучие компоненты удаляют на роторном испарителе. Неочищенный продукт растирают со смесью эфир/гексан (1:1), отфильтровывают и промывают гексанами, получая 42,6 г светло-коричневого твердого вещества (т.пл. 230-231°C).
1Н-ЯМР (ДМСО-d6): δ 10,3 (с, 1H), 7,1-7,5 (м, 8H), 5,9 (д, 1H), 4,2 (м, 1H), 2,21 (с, 3H), 1,21 (д, 6H).
Стадия Е: получение N-[2-[1-(2-хлорфенил)-3-(трифторметил)-1Н-пиразол-5-ил]-8-метил-4Н-3,1-бензоксазин-4-илиден]-2-пропанамина
К указанному в заголовке соединению стадии D (1,2 г, 2,7 ммоль), растворенному в 8 мл дихлорметана, добавляют 5 мл тионилхлорида и раствор кипятят с обратным холодильником в течение 8 часов. Растворитель удаляют в вакууме и остаток распределяют между 70 мл этилацетата и воды. Органический слой отделяют, промывают водой, насыщенным раствором бикарбоната натрия и насыщенным раствором соли. Органическую фазу сушат над сульфатом магния и растворитель удаляют в вакууме, получая неочищенный маслянистый остаток твердого вещества. Очистка флэш-хроматографией на силикагеле (элюирование: гексан/этилацетат, 2:1) и фильтрование из гексана приводят к получению 700 мг указанного в заголовке соединения, соединения данного изобретения, выделенного в виде твердого белого вещества (т.пл. 133-135°C).
1Н-ЯМР (300 МГц, CDCl3): δ 7,90 (д, 1H), 7,57-7,43 (м, 4H), 7,30-7,13 (м, 3H), 4,0 (м, 1H), 1,80 (с, 3H), 1,21 (д, 6H).
ПРИМЕР 3
Получение 7,9-дихлор-5-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-2,3-дигидроимидазо[1,2-c]хиназолина
Стадия А: получение 2, 4-дихлор-6-(4,5-дигидро-1Н-имидазол-2-ил)бензоламина
К раствору этилендиамина (1,2 мл, 18 ммоль) в этиловом эфире (50 мл) при -20°C добавляют н-бутиллитий (6,4 мл, 2,5 М в гексанах, 16 ммоль). Смесь перемешивают при 0°C в течение 0,3 часа, затем добавляют 2,4-дихлор-6-трифторметиланилин (0,92 г,4,2 ммоль). Смесь перемешивают при 0°C в течение дополнительных 1,5 часов, затем добавляют воду (0,36 мл, 20 ммоль) и растворитель удаляют при пониженном давлении. Очистка колоночной флэш-хроматографией (силикагель, 1%-10% метанола в дихлорметане) дает указанное в заголовке стадии А соединение (0,35 г) в виде твердого вещества желтого цвета.
1Н-ЯМР (CDCl3): δ 7,30 (д, 1H), 7,23 (д, 1H), 6,8 (уш.с, 2H), 4,7-4,6 (уш.с, 1H), 3,77 (уш.с, 4H).
Стадия В: получение 7,9-дихлор-5-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-2,3-дигидроимидазо[1, 2-c]хиназолина
К раствору 1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-карбоновой кислоты (0,6 г, 2,02 моль) (см. пример 1, стадия В) в дихлорметане (10 мл), содержащем диметилформамид (1 капля), добавляют оксалилхлорид (198 мкл, 2,22 ммоль). Смесь перемешивают при комнатной температуре в течение двух часов, концентрируют при пониженном давлении и повторно растворяют в дихлорметане (5 мл). Семь десятых этого раствора добавляют к раствору указанного в заголовке стадии А соединению (0,3 г, 1,3 ммоль), триэтиламина (272 мл, 1,95 ммоль) и диметиламинопиридина (16 мг, 0,13 ммоль) в дихлорметане (5 мл) и полученную смесь перемешивают при комнатной температуре в течение ночи. Добавляют насыщенный раствор бикарбоната натрия и затем смесь фильтруют через колонку Celite®. Концентрирование фильтрата приводит к получению вещества, которое очищают колоночной флэш-хроматографией (силикагель, элюирование: 1%, 2%, 5% метанола в дихлорметане, затем 10%, 20% ацетона в хлороформе, затем 5% метанола в дихлорметане). Выделение первого элюируемого вещества дает указанное в заголовке примера 3 соединение, соединение данного изобретения, в виде твердого желтого вещества (62 мг). Второе элюируируемое вещество представляет собой 1-(3-хлор-2-пиридинил)-N-[2,4-дихлор-6-(4,5-дигидро-1Н-имидазол-2-ил)фенил]-3-(трифторметил)-1Н-пиразол-5-карбоксамид, полупродукт примера 3.
1Н-ЯМР (CDCl3): δ 8,5-8,4 (д, 1H), 7,9 (д, 1H), 7,46 (д, 1H), 7,41 (д, 1H), 7,4 (дд, 1H), 7,31 (с, 1H), 3,77 (с, 4H).
По методикам, описанным выше, а также с использованием известных в данной области способов, получают соединения, представленные в таблицах 1-21. В данных таблицах используются следующие аббревиатуры: t означает третичный, s означает вторичный, n означает нормальный, i означает изо, Ме означает метил, Et означает этил, Pr означает пропил, i-Pr означает изопропил, и Bu означает бутил.
Таблица 1

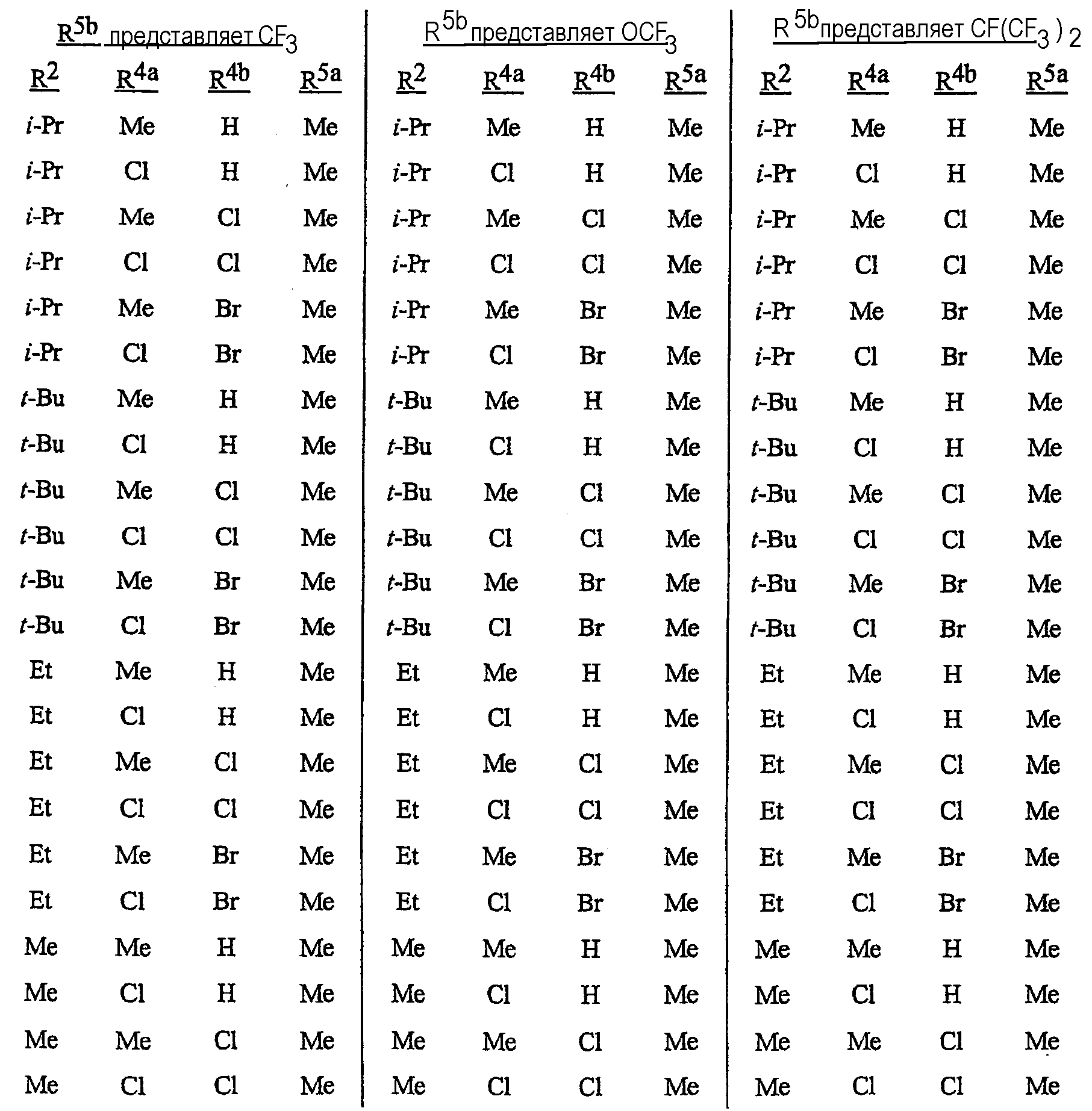

Таблица 2



Таблица 3


Таблица 4

Таблица 5




Таблица 6




Таблица 7




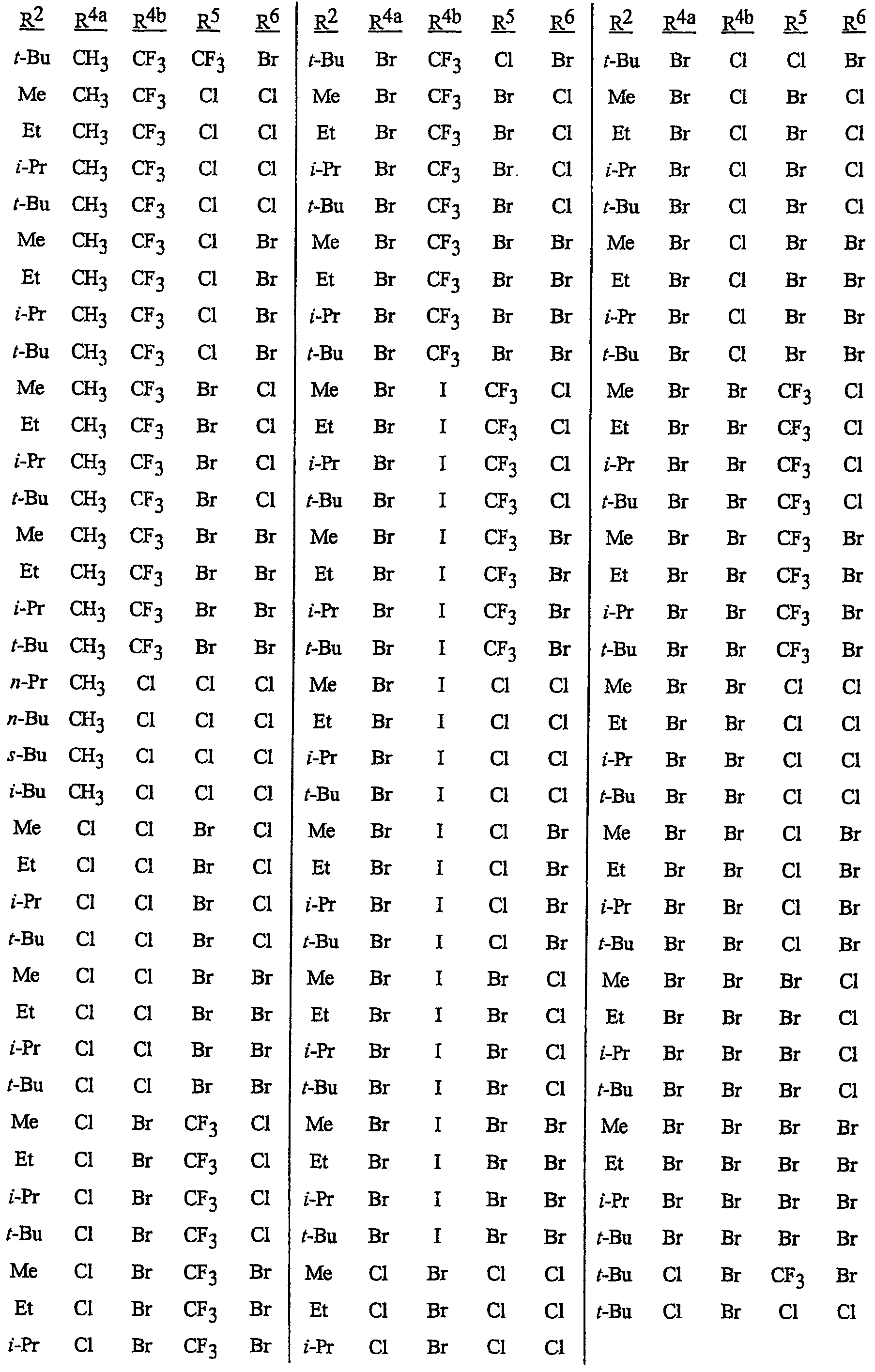
Таблица 8



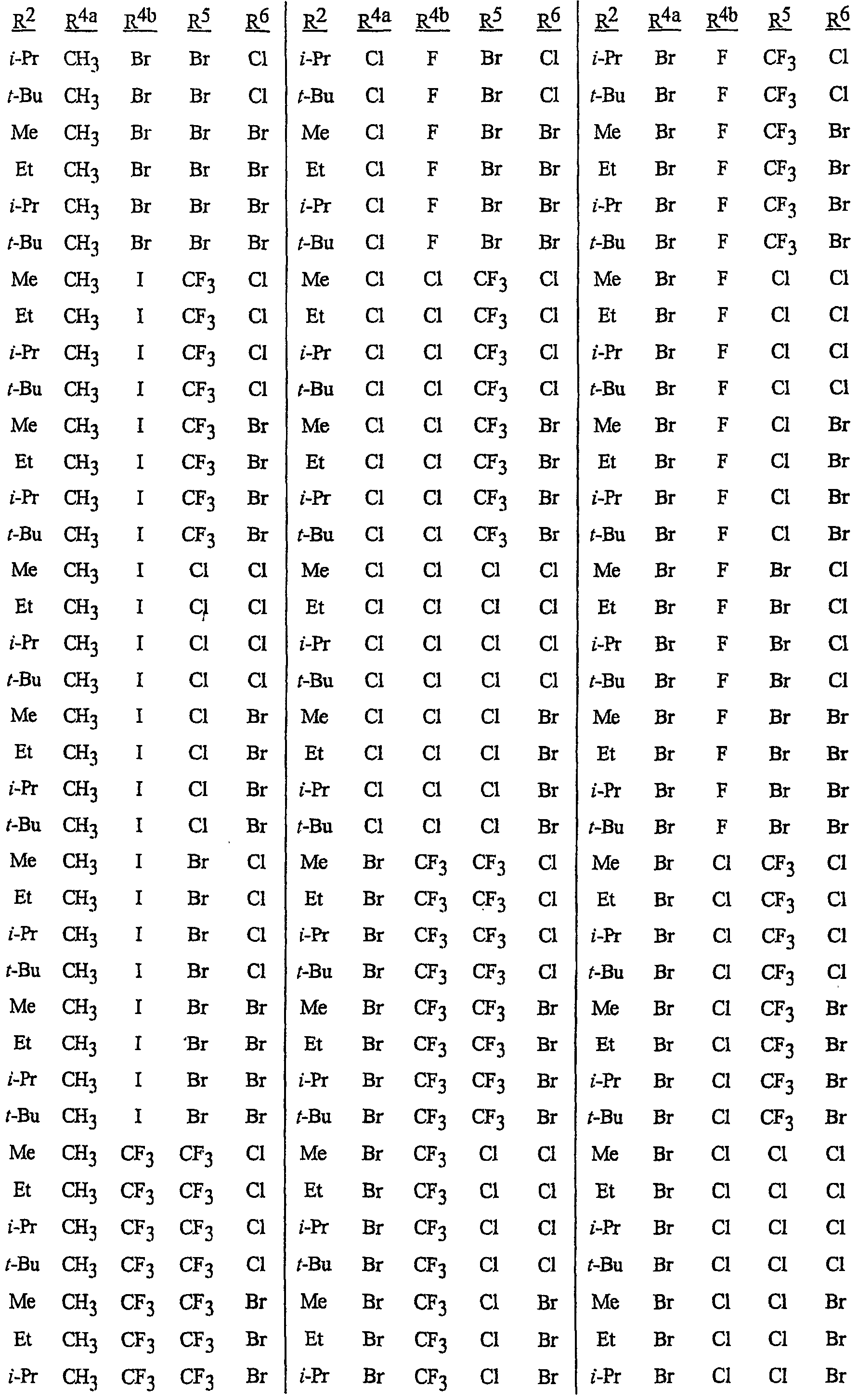

Таблица 9




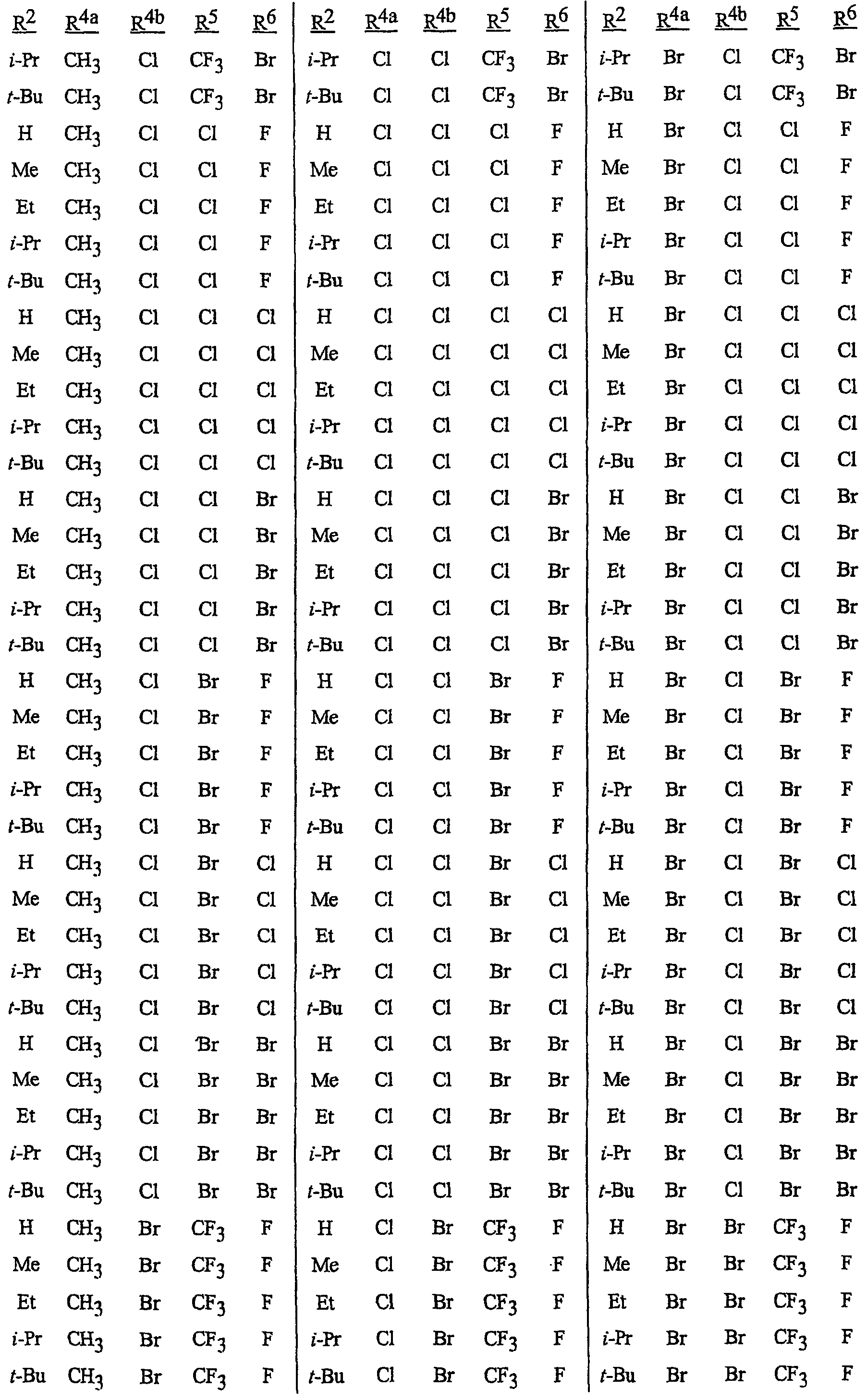


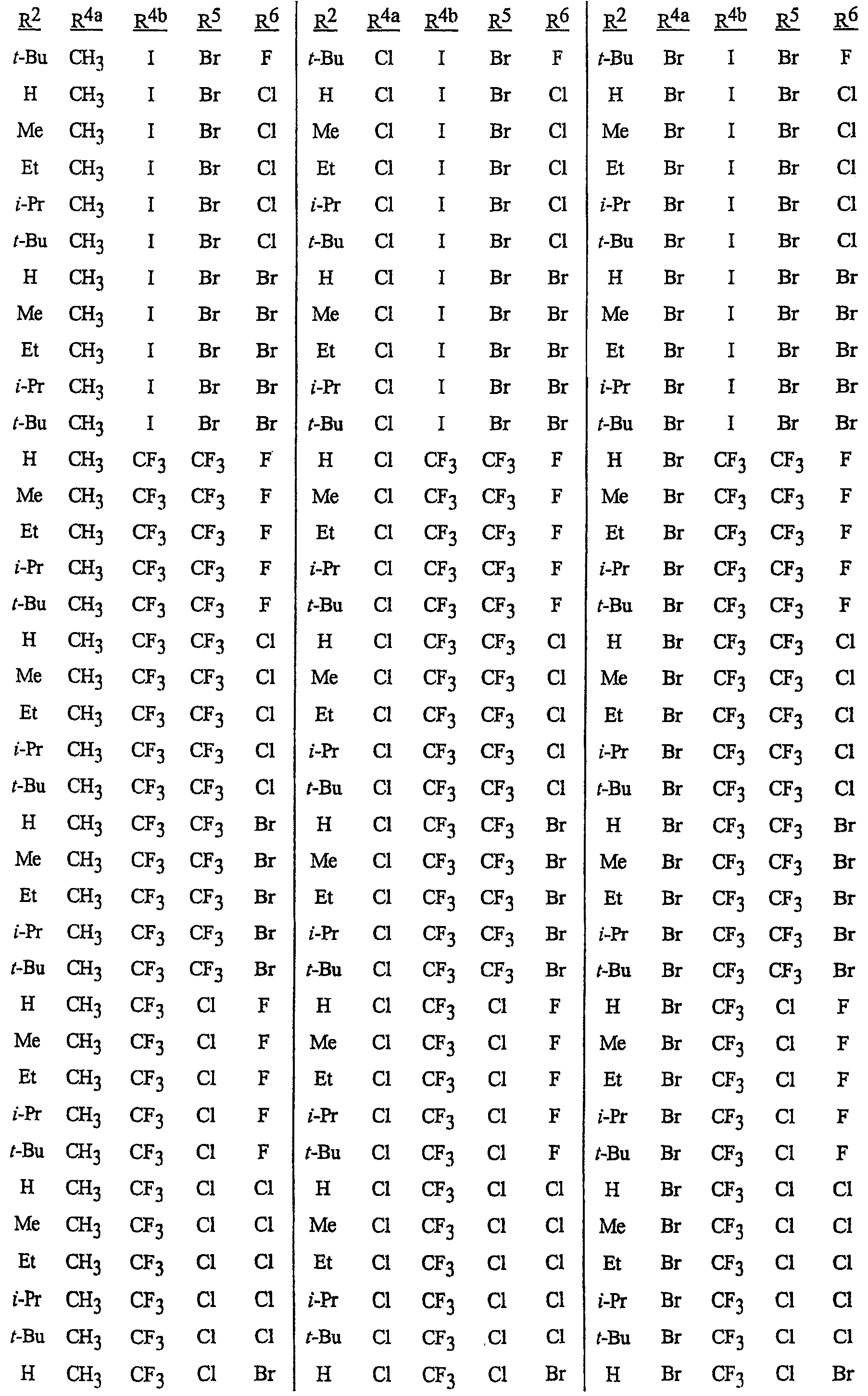

Таблица 10
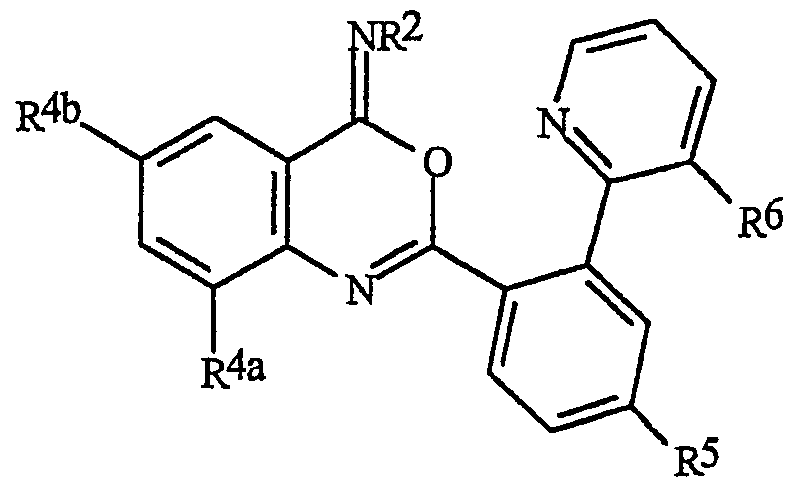




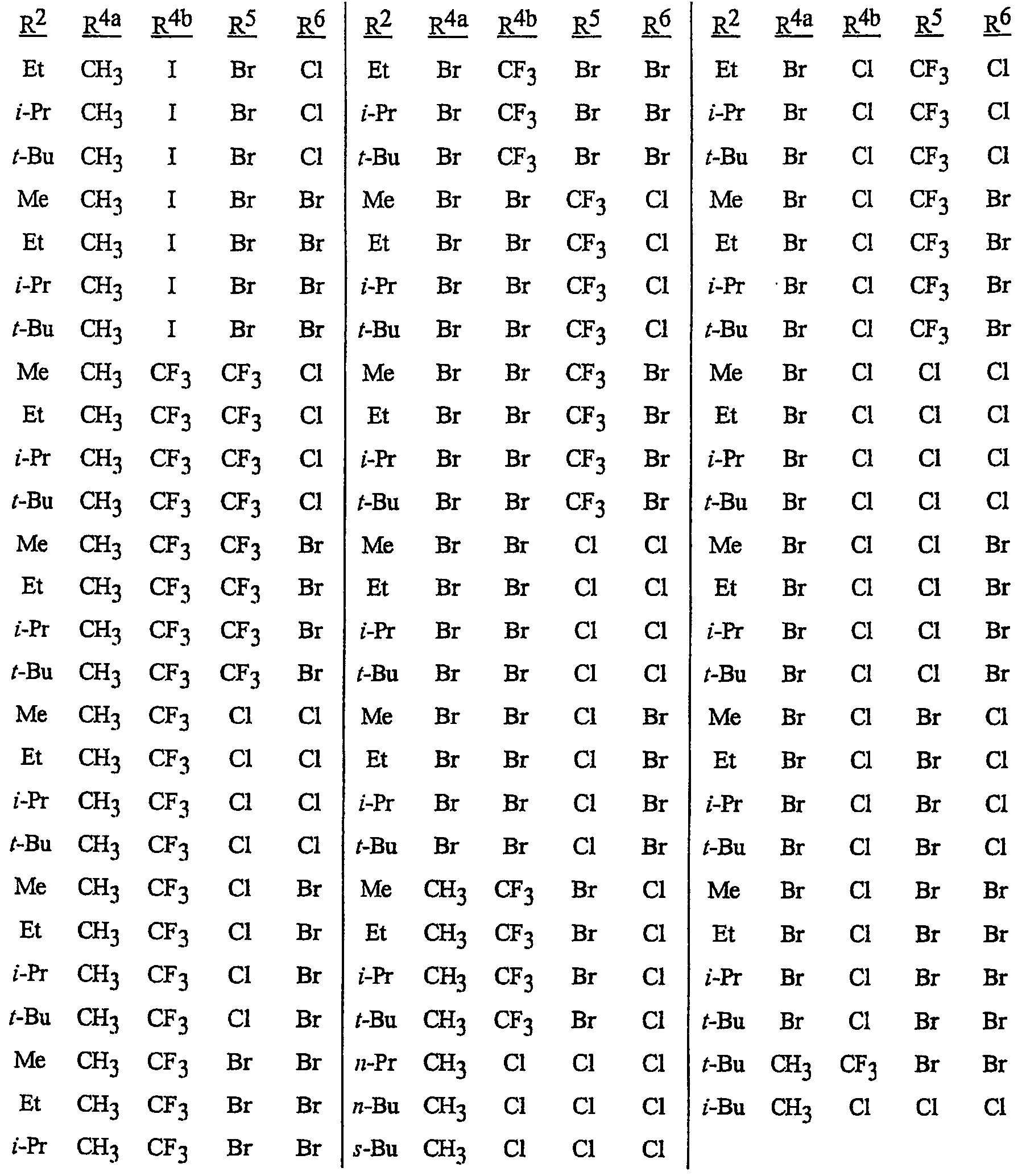
Таблица 11

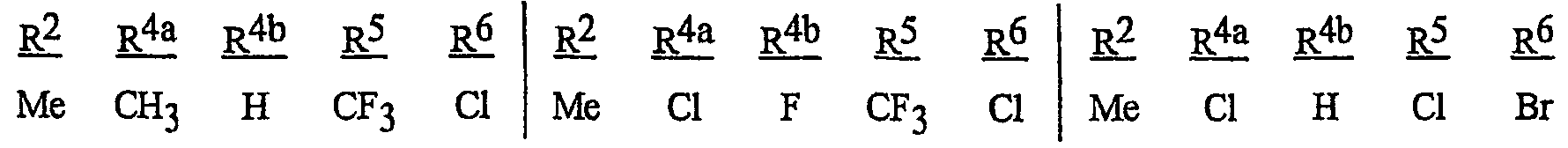


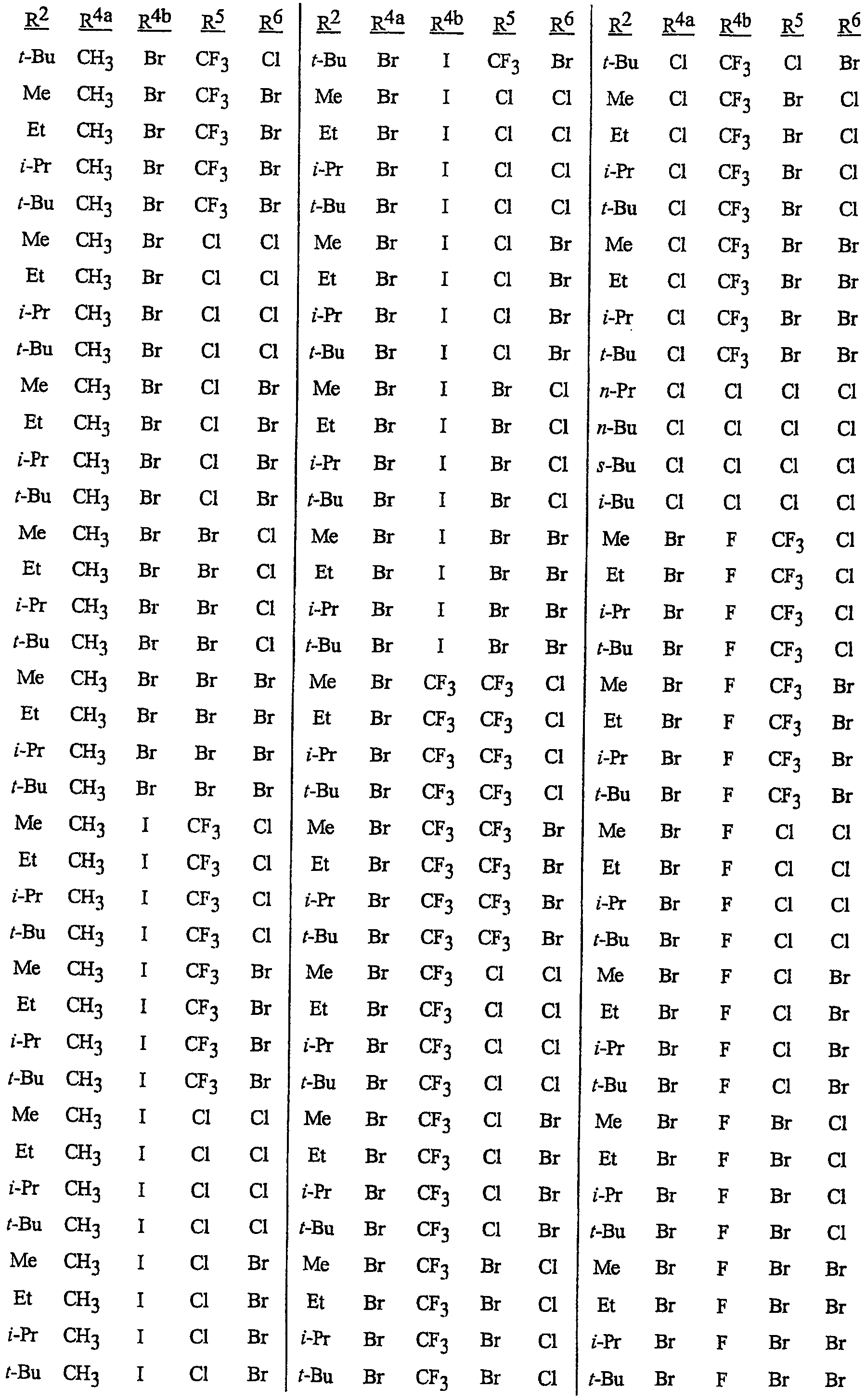
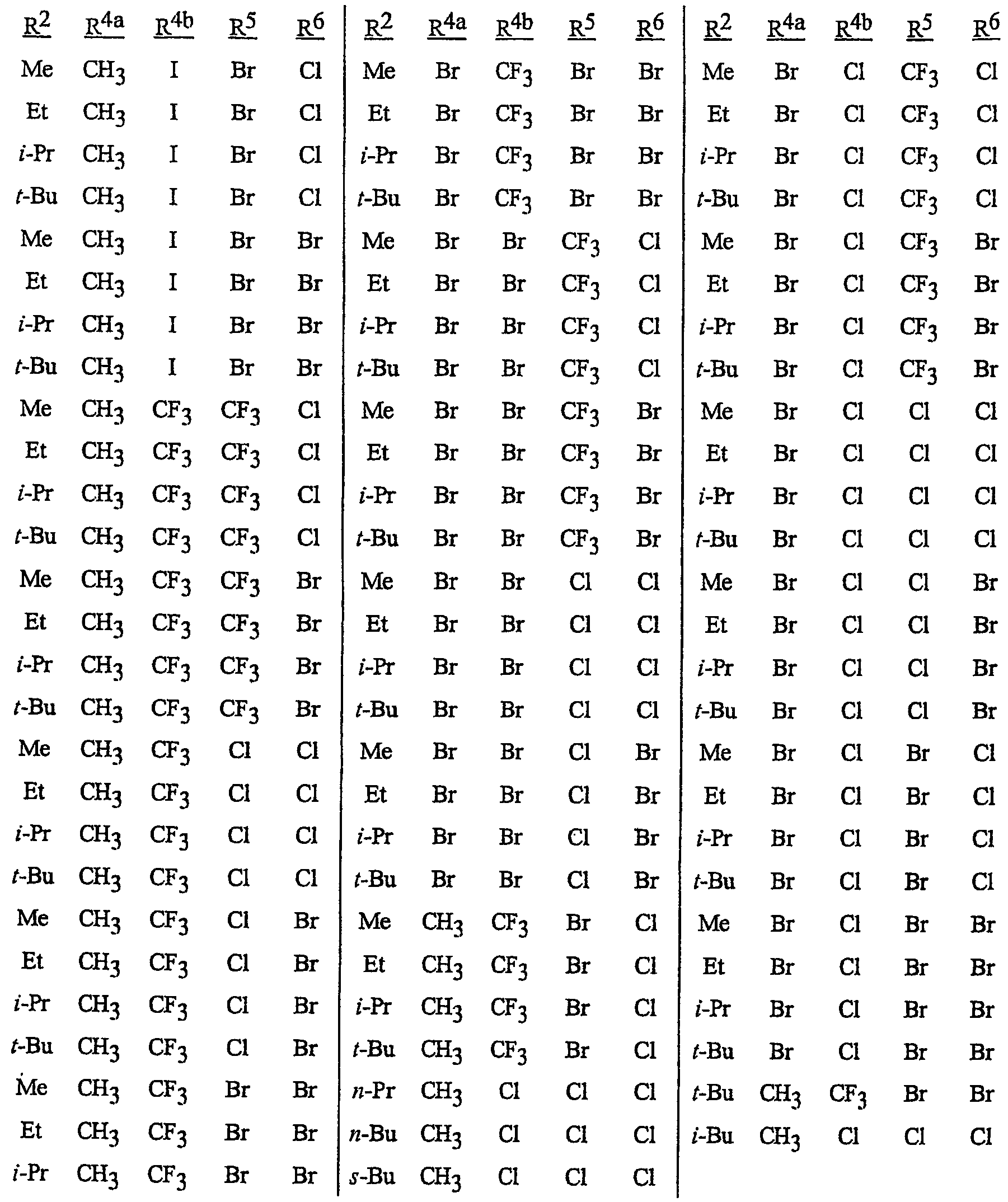
Таблица 12
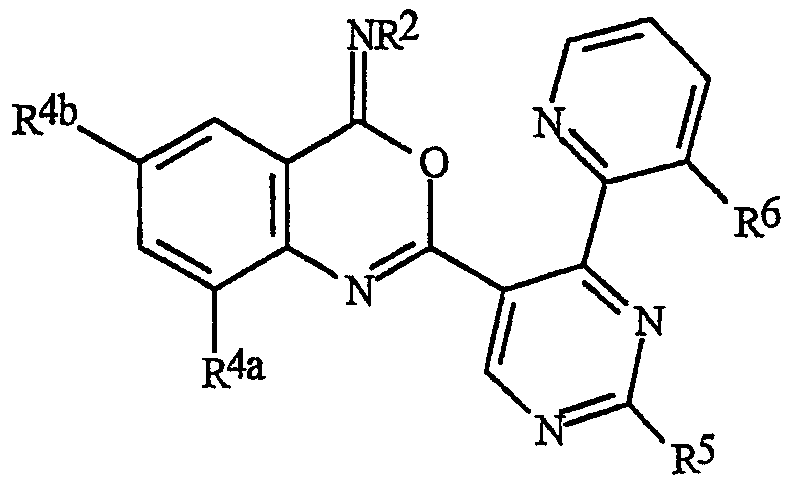




Таблица 13
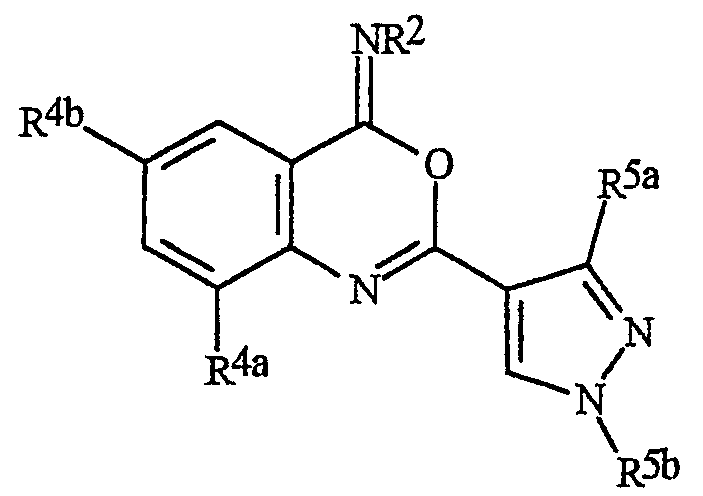
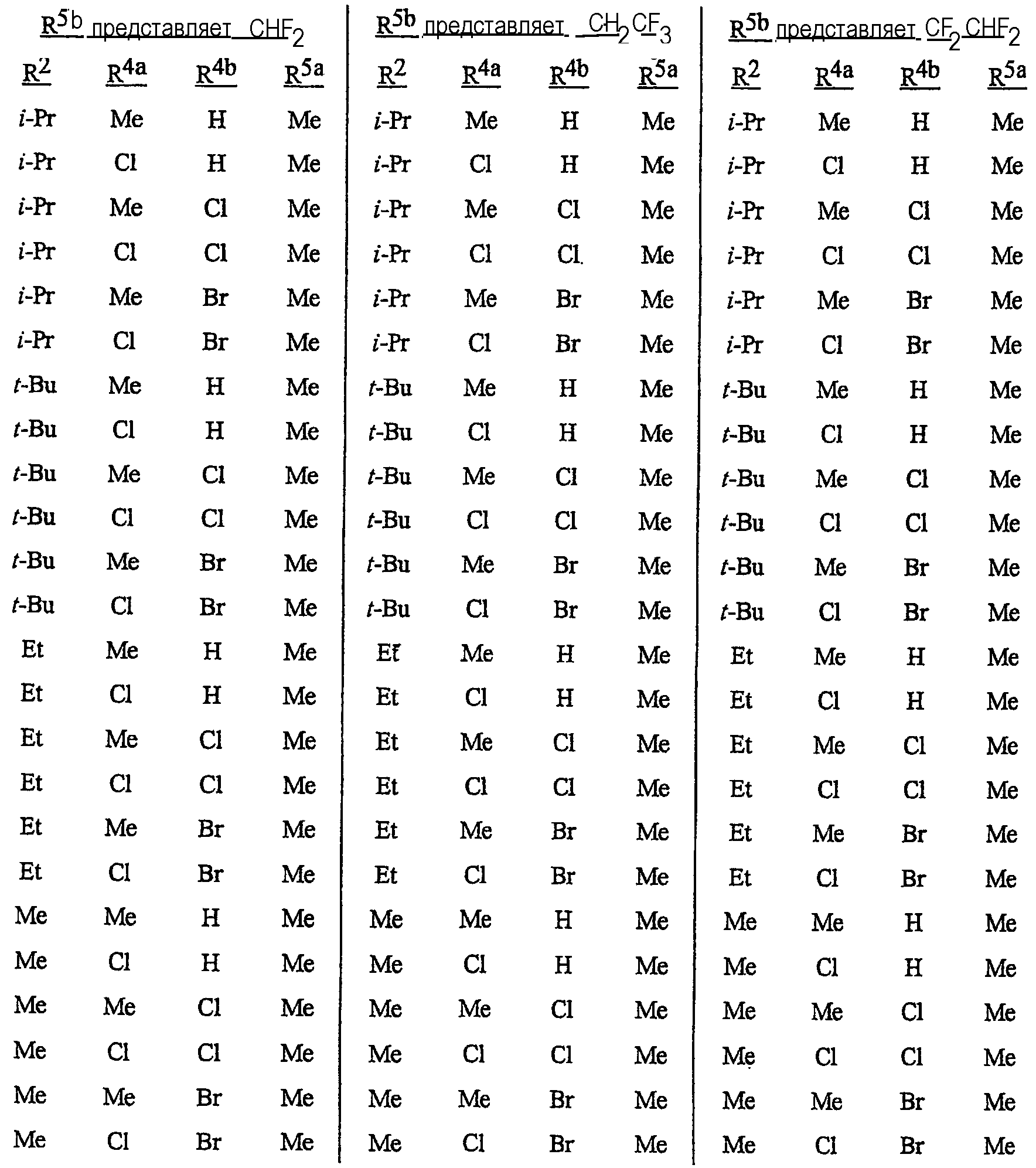
Таблица 14


Таблица 15
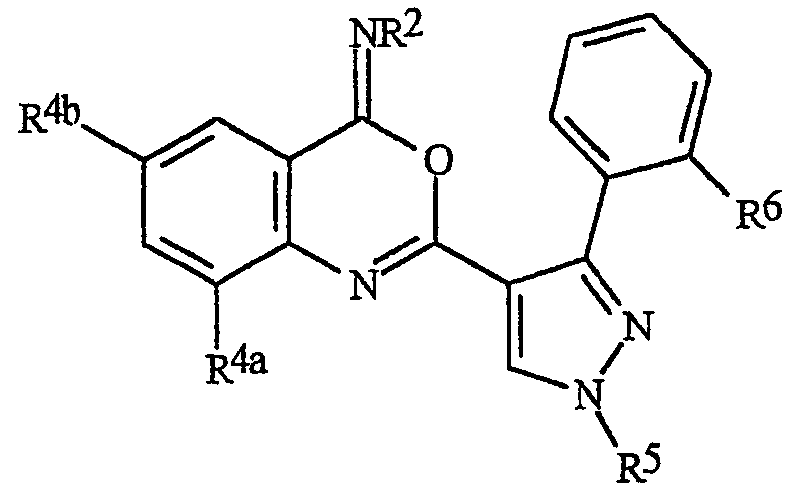



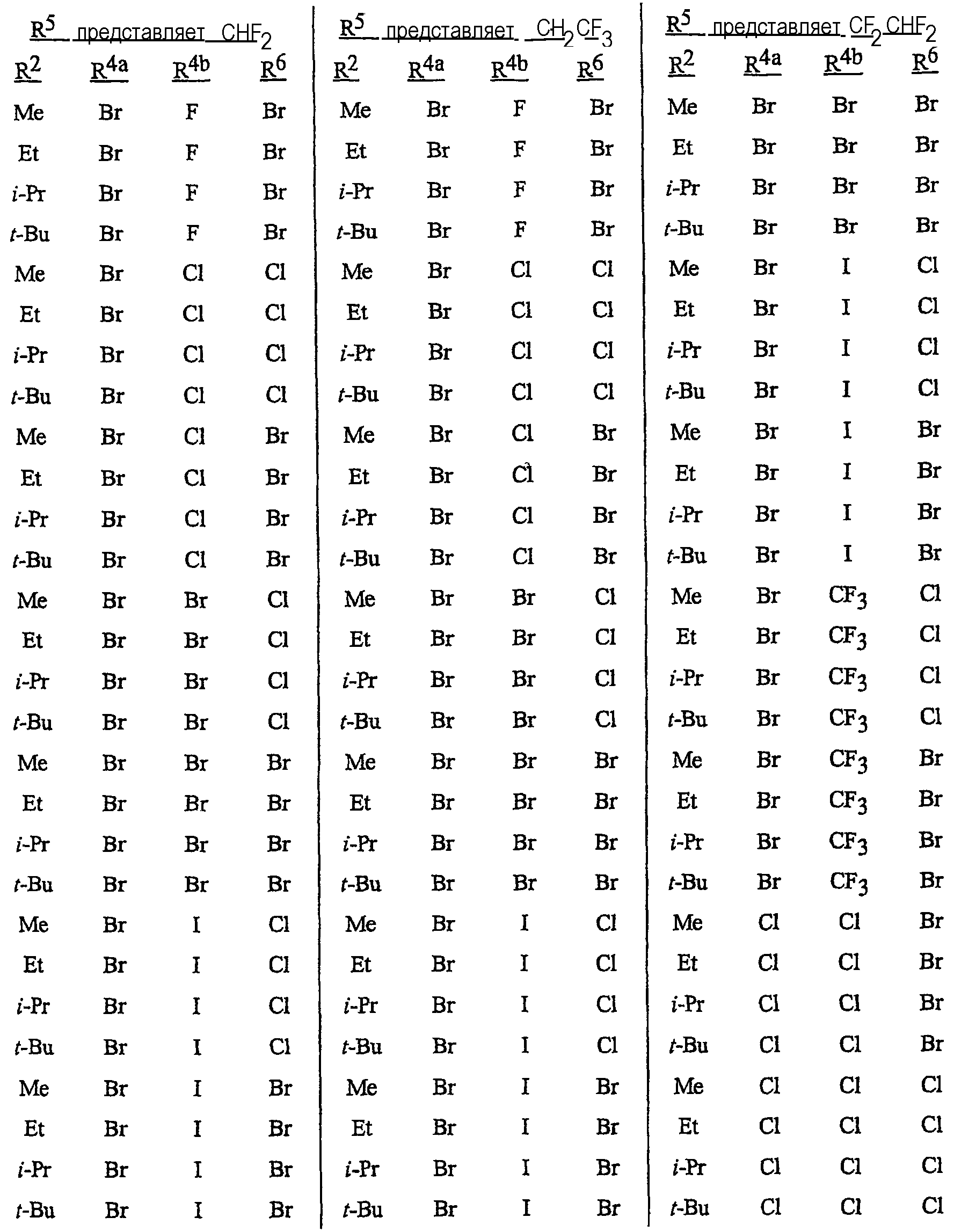
Таблица 16



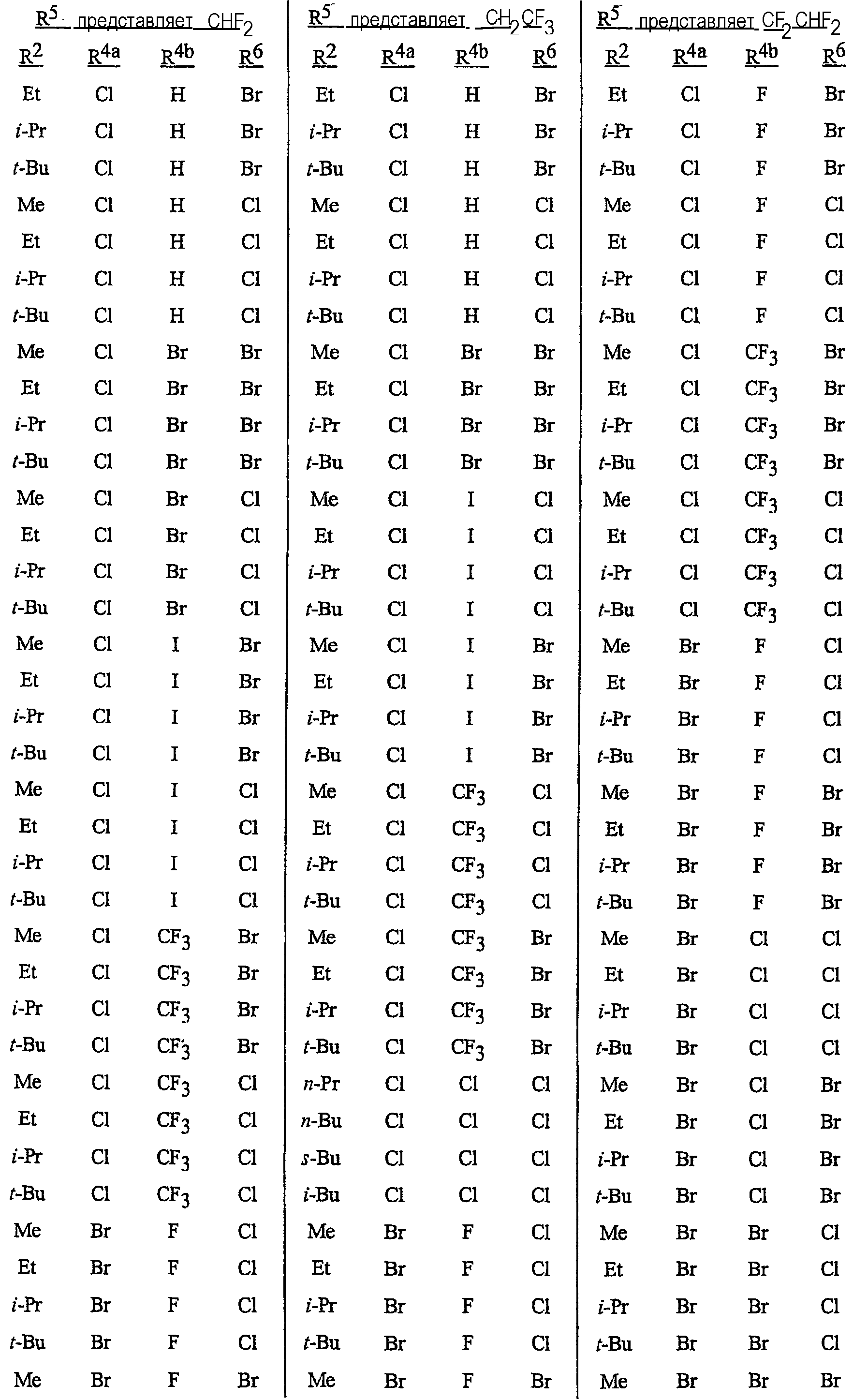
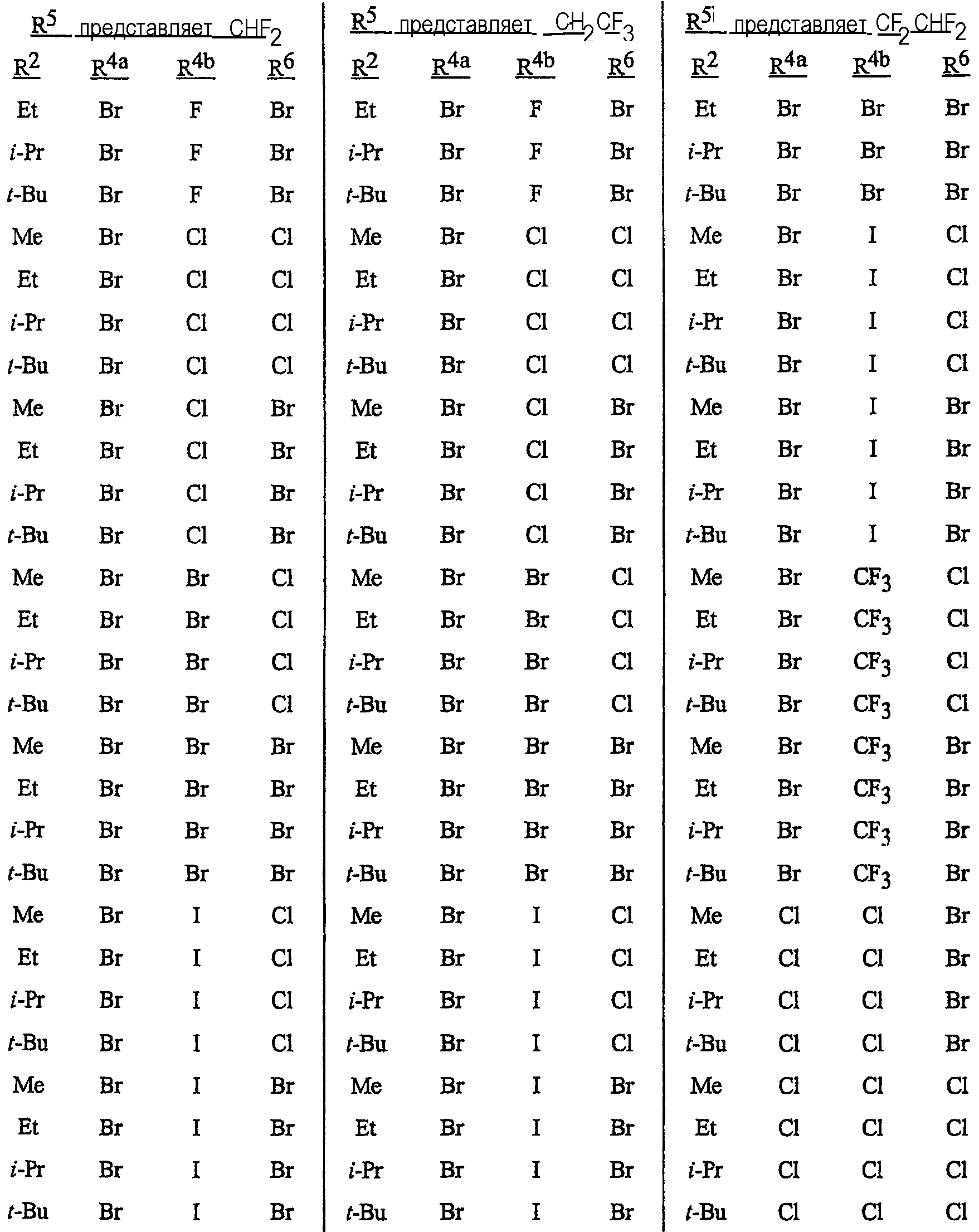
Таблица 17
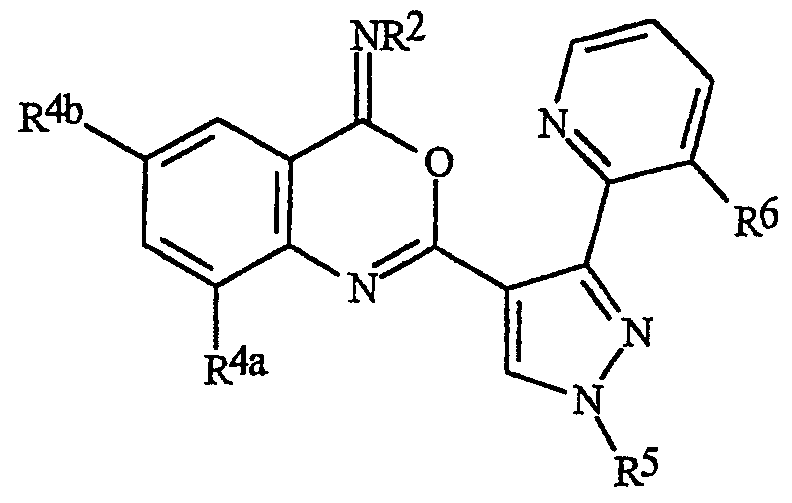
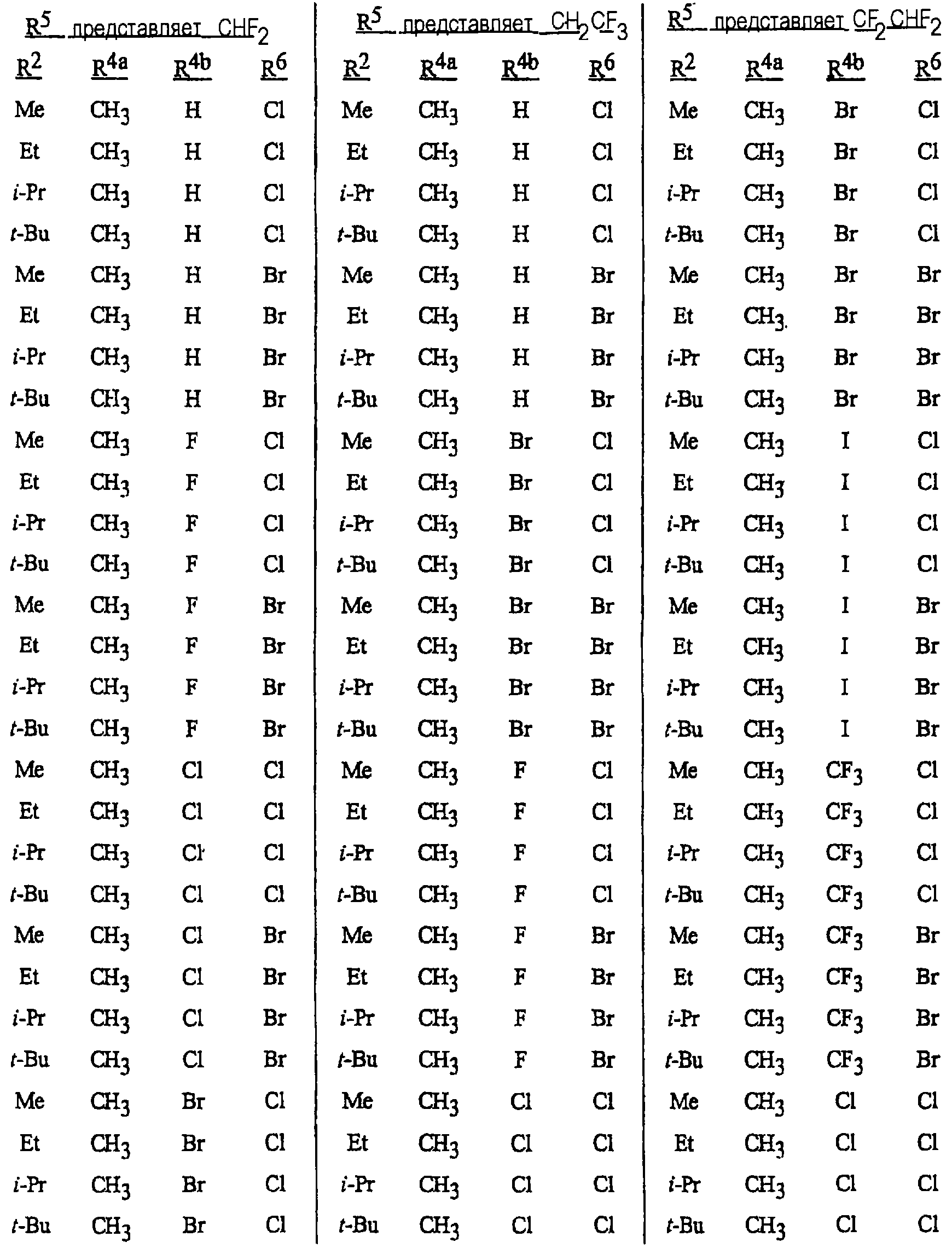


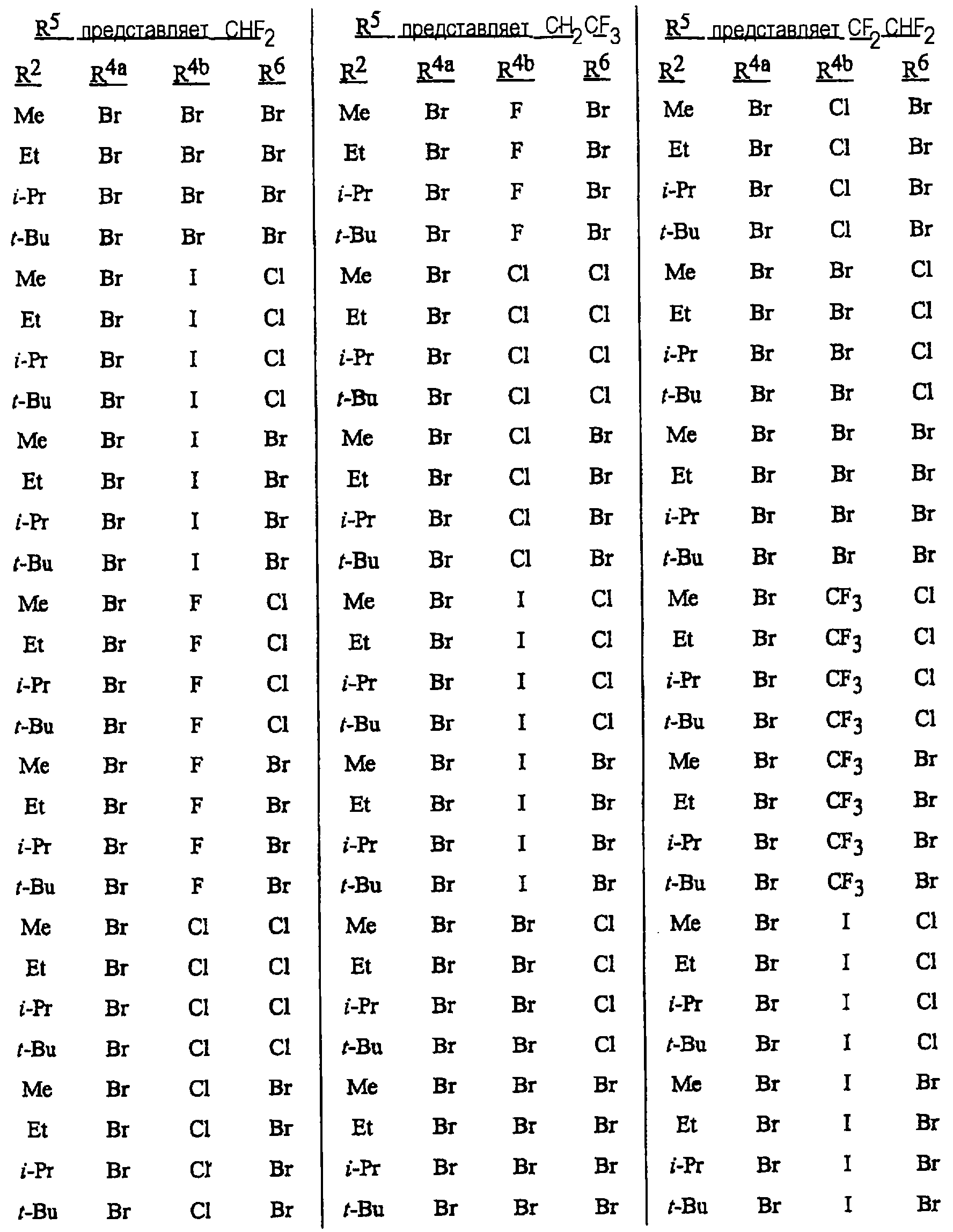
Таблица 18



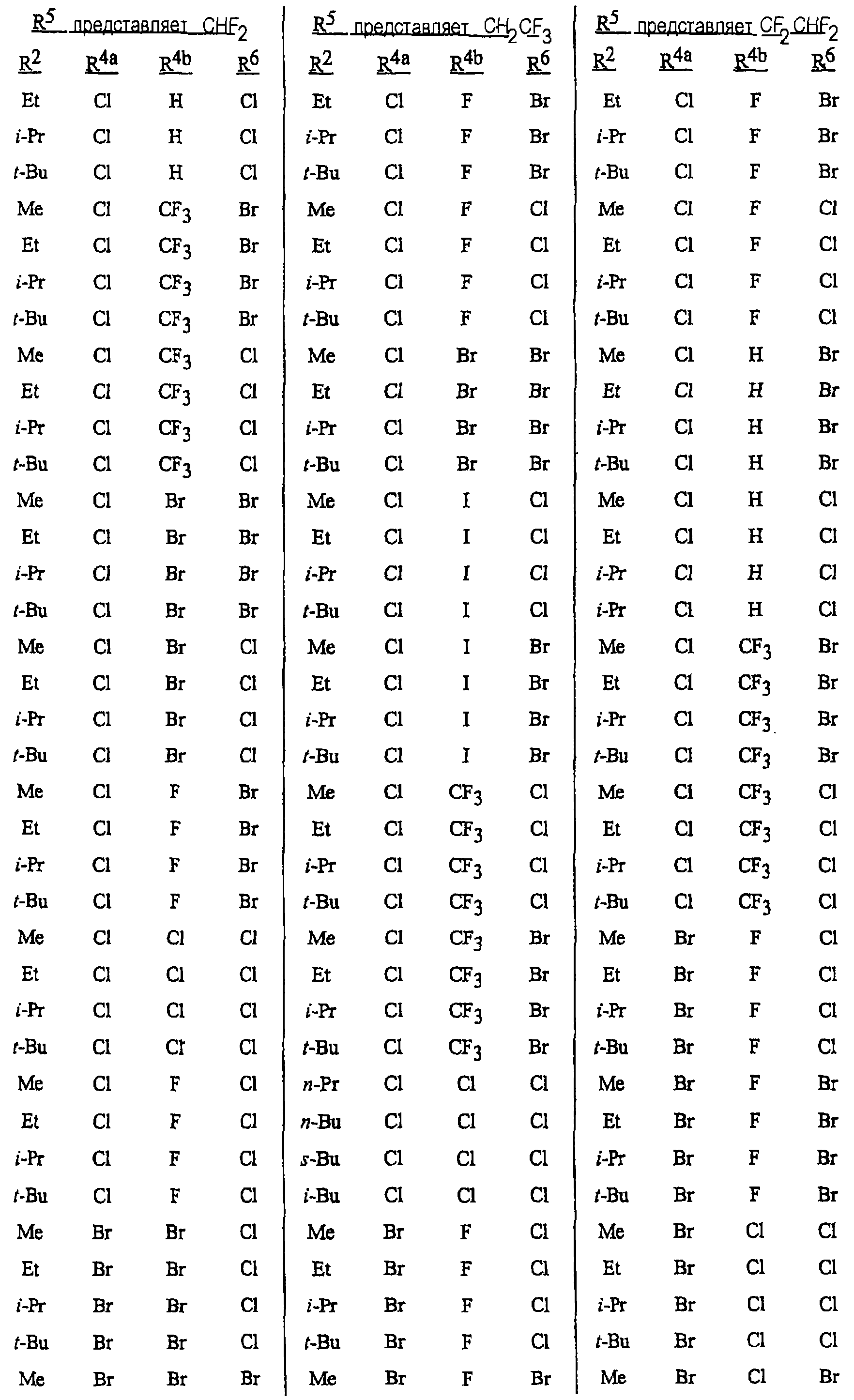

Таблица 19
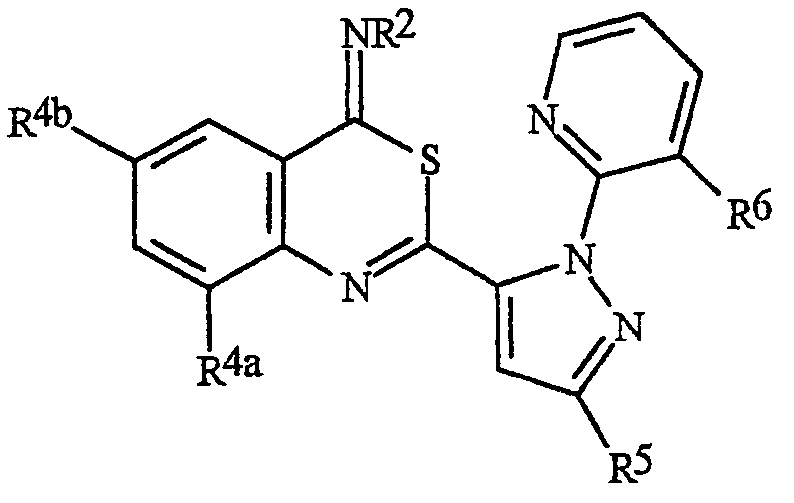
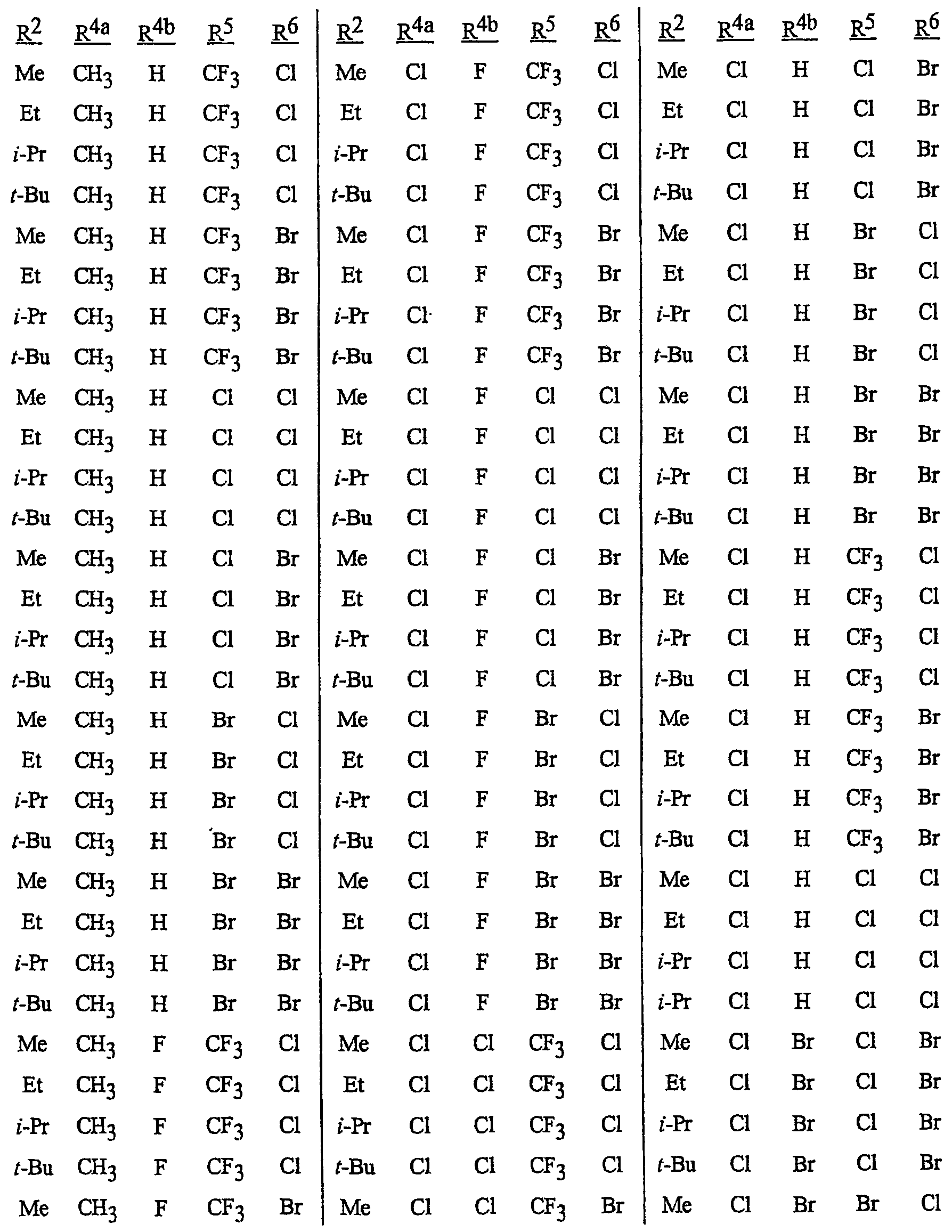

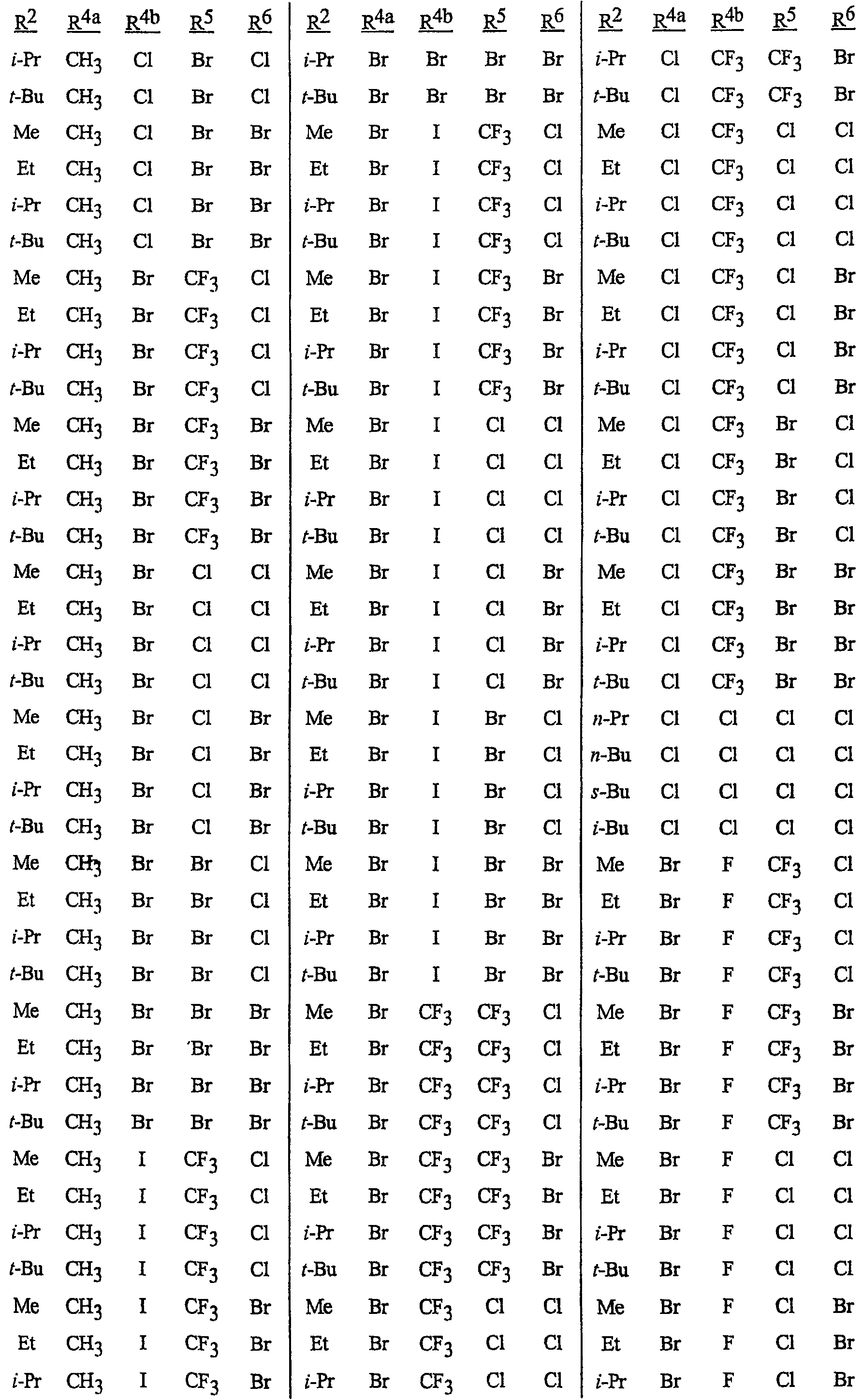
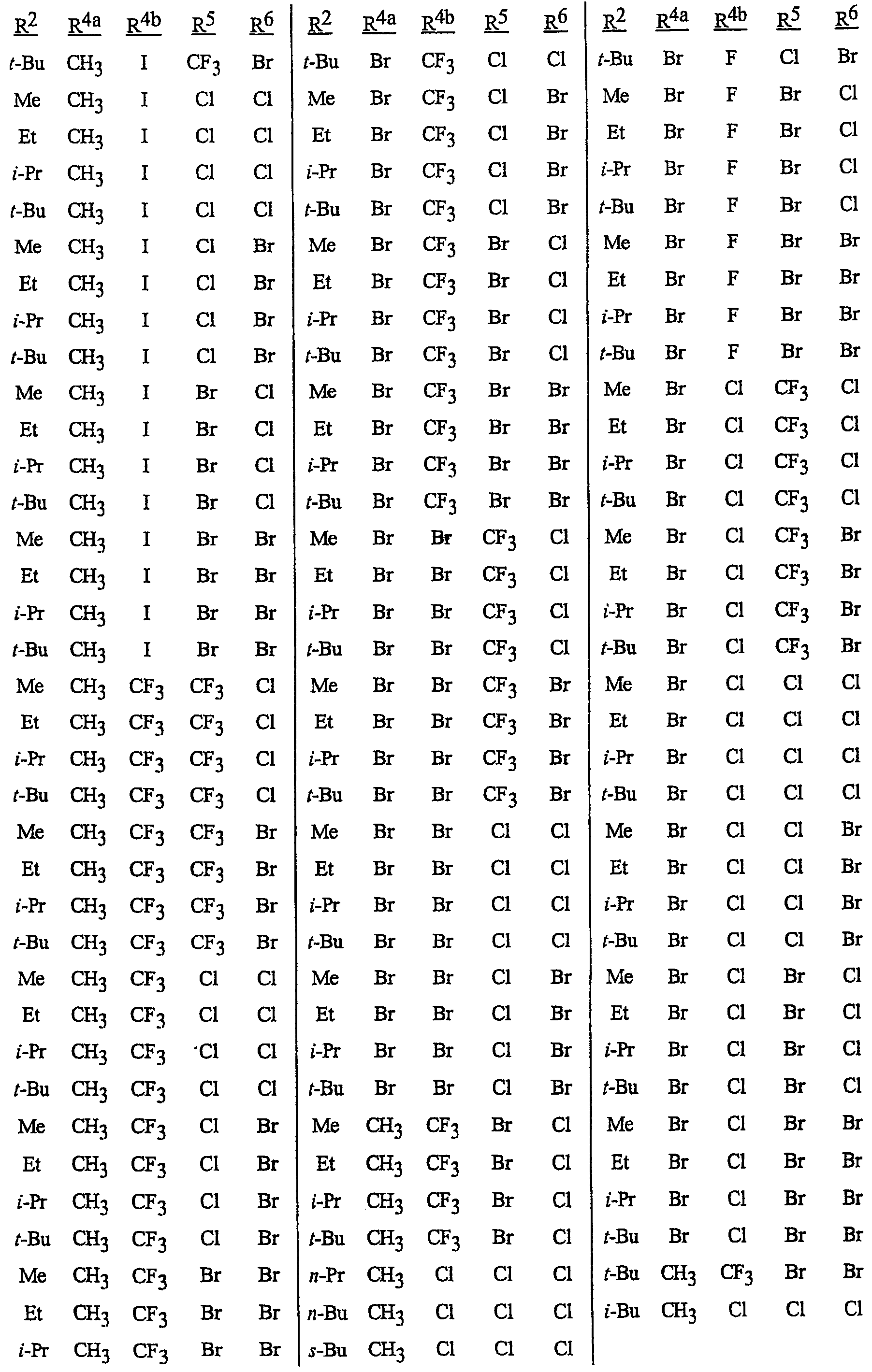
Таблица 20



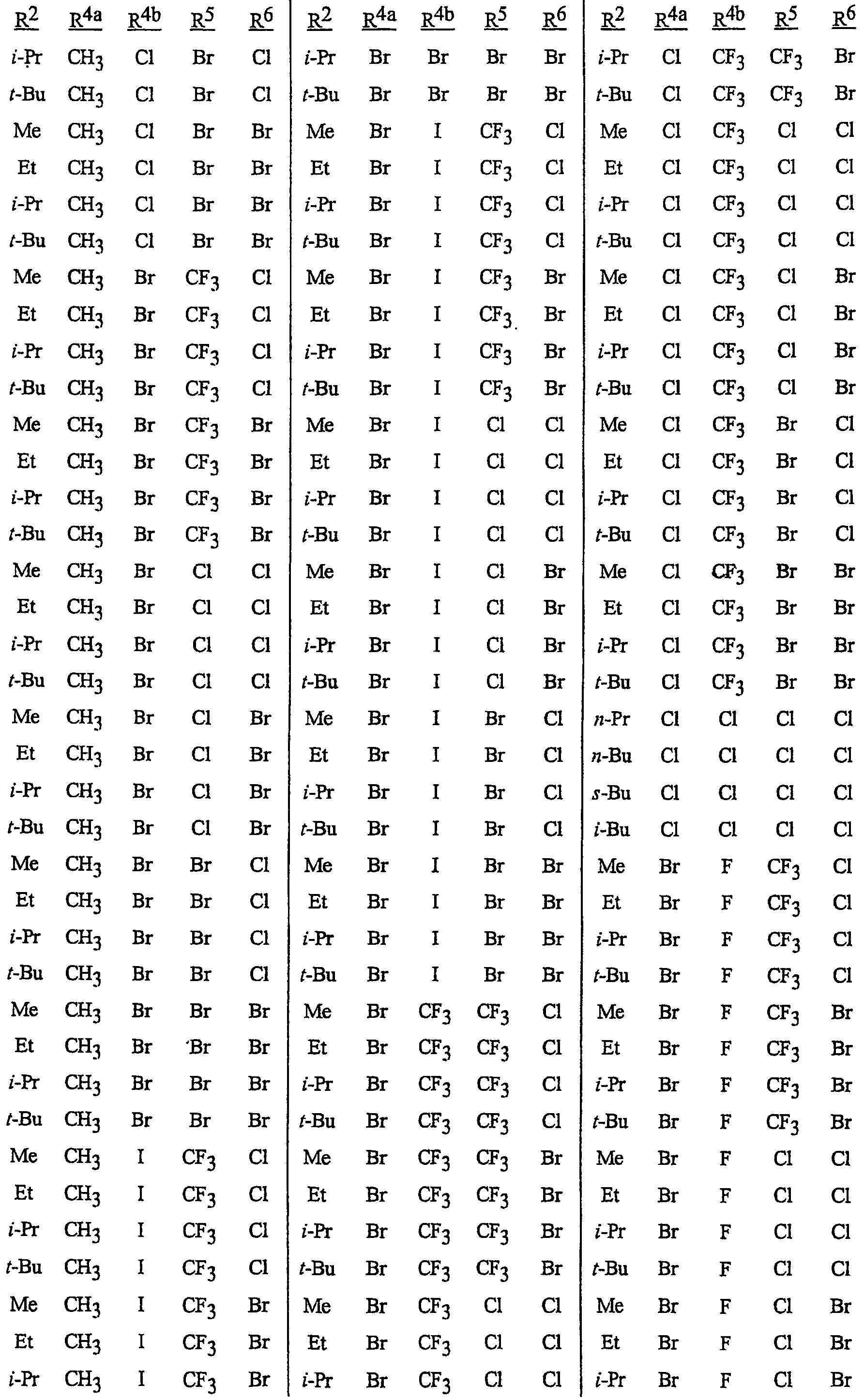

Таблица 21



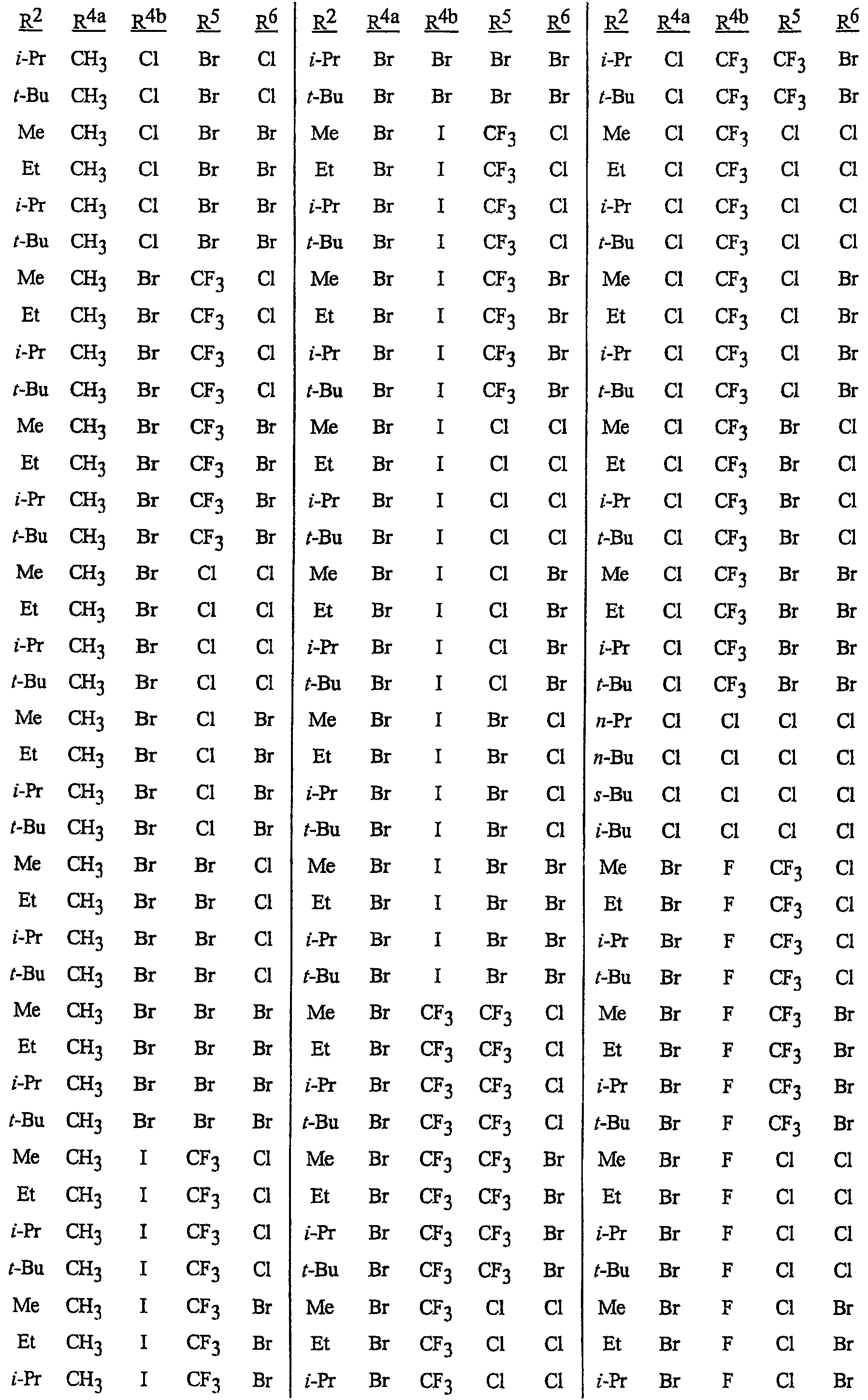

Получение препаратов/применимость
Соединения, используемые в соответствии с данным изобретением, обычно применяют в виде препарата или композиции с сельскохозяйственно приемлемым носителем, включающим, по меньшей мере, один жидкий разбавитель, твердый разбавитель или поверхностно-активное вещество. Ингредиенты препарата или композиции выбирают в соответствии с физическими свойствами активного ингредиента, способа применения и факторов окружающей среды, таких как тип почвы, влажность и температура. Полезные препараты включают жидкости, такие как растворы (включая эмульгируемые концентраты), суспензии, эмульсии (включая микроэмульсии и/или суспоэмульсии) и т.п., которые необязательно могут сгущаться в гели. Полезные препараты включают также твердые вещества, такие как дусты, порошки, гранулы, пеллеты, таблетки, пленки и т.п., которые могут быть вододиспергируемыми («смачивающимися») или водорастворимыми. Активный ингредиент может быть введен в (микро)капсулу и дополнительно введен в суспензию или твердый препарат; альтернативно весь препарат активного ингредиента может быть инкапсулирован (или покрыт оболочкой). Инкапсулирование может регулировать или задерживать высвобождение активного ингредиента. Препараты, которые могут наноситься опрыскиванием или распылением, можно распределять в подходящей среде и использовать в объемных дозах от примерно одного до нескольких сот литров на гектар. Высококонцентрированные композиции используются, главным образом, как полупродукты для последующего приготовления препарата.
Препараты обычно содержат эффективные количества активного ингредиента, разбавителя и поверхностно-активного вещества в приведенных ниже примерных интервалах, которые в сумме составляют 100 мас.%.
Обычные твердые разбавители описаны в публикации Watkins, et al., Handbook of Insecticide Dust Diluents and Carriers, 2nd Ed., Dorland Books, Calwell, New Jersey. Обычные жидкие разбавители описаны в публикации Marsden, Solvents Guide , 2nd Ed., Interscience, New York, 1950, McCutcheon's Detergenys and Emulsifiers Annual, Allured Publ. Corp., Ridgewood, New Jersey; Sisely and Wood, Encyclopedia of Surface Active Agents, Chemical Publ, Co., Inc. New York, 1964, а также приводится перечень поверхностно-активных веществ и рекомендации по применению. Все препараты могут содержать незначительные количества добавок для снижения пенообразования, спекания, коррозии, развития микроорганизмов и т.п. или загустителей для повышения вязкости.
Поверхностно-активные вещества включают, например, полиэтоксилированные спирты, полиэтоксилированные алкилфенолы, полиэтоксилированные сорбитановые эфиры жирных кислот, диалкилсульфосукцинаты, алкилсульфаты, алкилбензолсульфонаты, органосиликоны, N,N-диалкилтаураты, лигнинсульфонаты, продукты конденсации нафталинсульфонатов с формальдегидами, поликарбоксилаты и блок-сополимеры полиоксиэтилена/полиоксипропилена. Твердые разбавители включают, например, глины, такие как бентонит, монтмориллонит, аттапульгит и каолин, крахмал, сахар, диоксид кремния, тальк, диатомовую землю, мочевину, карбонат кальция, карбонат и бикарбонат натрия и сульфат натрия. Жидкие разбавители включают, например, воду, N,N-диметилформамид, диметилсульфоксид, N-алкилпирролидон, этиленгликоль, пропиленгликоль, парафины, алкилбензолы, алкилнафталины, оливковое масло, касторовое масло, льняное масло, тунговое масло, кунжутное масло, арахисовое масло, хлопковое масло, соевое масло, рапсовое масло и кокосовое масло, сложные эфиры жирных кислот, кетоны, такие как циклогексанон, 2-гептанон, изофорон и 4-гидрокси-4-метил-2-пентанон, и спирты, такие как метанол, циклогексанол, деканол и тетрагидрофурфуриловый спирт.
Растворы, включая эмульсионные концентраты, могут быть получены простым смешением ингредиентов. Дусты и порошки могут быть получены смешением и обычно измельчением, например, в молотковой дробилке или струйной мельнице. Суспензии обычно получают влажным смешением (см., например, Патент США № 3060084). Гранулы и пеллеты могут быть получены нанесением активного вещества опрыскиванием на предварительно полученные гранулированные носители или методами агломерации (см. Browing, "Agglomeration", Chemical Engineering, December 4, 1967, pp.147-48, Perry's Chemical Engineer's Handbook, 4th Ed., McGraw-Hill, New York, 1963, pages 8-57 and following; Международная заявка PCT WO 91/13546. Пеллеты могут быть получены в соответствии с методами, описанными в Патенте США № 4172714. Вододиспергируемые и водорастворимые гранулы могут быть получены в соответствии с методами, описанными в Патентах США №№ 4144050 и 3920422 и Заявке Германии 3246493. Таблетки могут быть получены в соответствии с методами, описанными в Патенте США № 5180587, Патенте США № 5232701 и Патенте США № 5208030. Пленки могут быть получены в соответствии с методами, описанными в Заявке Великобритании № 2095558 и в Патенте США № 3299566.
Дополнительную информацию, относящуюся к способам получения препаратов, см. у T.S. Woods, "The Formulator's Toolbox - Product Forms for Modern Agriculture" in Pesticide Chemistry and Bioscience, The Food-Environment Challenge, T. Brooks and T.R. Roberts, Eds., Proceedings of the 9th International Congress on Pesticide Chemistry, The Royal Society of Chemistry, Cambridge, 1999, pp. 120-133. См. также патенты США № 3235361 (колонка 6 строка 16-колонка 7 строка 19 и примеры 10-41); № 3309192 (колонка 5 строка 43 колонка 7 стр. 62 и примеры 8, 12, 15, 39, 41, 52, 53, 58, 132, 138-140, 162-164, 166, 167 и 169-182); №2891855 (колонка 3 строка 66-колонка 5 строка 17 и примеры 1-4), а также у Klingman, Weed Control as a Science, John Wiley and Sons, Inc., New York, 1961, pp.81-96; Hance et al., Weed Control Handbook, 8th Ed., Blackwell Scientific Publications, Oxford, 1989.
В представленных далее примерах все проценты являются процентами из расчета на массу, и все препараты получены традиционными способами. Номера соединений относятся к соединениям в таблице А.
Пример А
Смачивающийся порошок
Пример В
Гранулы
Пример С
Экструдированные пеллеты
Пример D
Эмульсионный концентрат
Пример Е
Гранулы
Соединения, используемые в соответствии с данным изобретением, характеризуются благоприятными метаболическими свойствами и/или характером почвенных остатков и проявляют активность, которая может использоваться для борьбы с сельскохозяйственными и несельскохозяйственными беспозвоночными вредителями в широком спектре. (В контексте данного изобретения термин «борьба с беспозвоночными вредителями» означает подавление развития беспозвоночных вредителей (включая смертность), которое вызывает значительное снижение потребленного ими питания или другого повреждения или ущерба, причиненного вредителем, связанные выражения определяются аналогично).
Термин «беспозвоночный вредитель», который использовался в данном описании выше, включает членистоногих, брюхоногих моллюсков и нематод, представляющих собой вредителей, ущерб от жизнедеятельности которых может иметь экономическое значение.
Термин «членистоногие» включает насекомых, клещей, паукообразных, скорпионов, многоножек, двупарноногих, мокриц и symphylans. Термин «брюхоногие» включает улиток, слизней и других представителей Stylommatophora. Термин «нематода» включает всех гельминтов, таких как круглые черви, heartworms и растительноядные нематоды (Nematoda), трематоды (Trematoda), Acanthocephala, и ленточные черви (Cestoda). Квалифицированному специалисту в данной области понятно, что не все соединения одинаково эффективны в отношении всех вредителей. Соединения, используемые в соответствии с данным изобретением, проявляют активность в отношении экономически важных сельскохозяйственных и несельскохозяйственных вредителей. Термин «сельскохозяйственный» относится к производству полевых культур, таких как пищевые культуры и волокнистые культуры, и включает выращивание зерновых культур (например, пшеницы, овса, ячменя, ржи, риса, кукурузы), сои, овощных культур (например, салата, капусты, помидоров, бобов), картофеля, батата, винограда, хлопчатника и плодов, вызревающих на деревьях (например, семечковые плоды, косточковые плоды и плоды цитрусовых культур). Термин «несельскохозяйственный» относится к другим садовым культурам (например, лесным, тепличным растениям, растениям, выращиваемым в питомниках, или декоративным растениям, которые не растут в полевых условиях) и применению на данных культурах и их вредителях, в общественном здравоохранении и ветеринарии, домашних и коммерческих структурах, в домашнем хозяйстве и продуктах, находящихся на хранении, а также к вредителям, встречающимся в этих областях. Ввиду широкого спектра беспозвоночных вредителей и экономической важности защиты от них (от повреждения или ущерба, наносимого беспозвоночными вредителями) сельскохозяйственных зерновых культур хлопчатника, кукурузы, сои, риса, овощных культур, картофеля, батата, винограда и плодов, выращиваемых на деревьях, применения для борьбы с беспозвоночными вредителями представляют собой предпочтительные воплощения данного изобретения. Сельскохозяйственные и несельскохозяйственные вредители включают личинки насекомых отряда Lepidoptera, таких как походные черви, совки, пяденицы, и heliothines семейства Noctuidae (например, fall armyworm (Spodoptera fugiperda J.E. Smith), свекловичные походные черви (Spodoptera exigua Hübner), совка ипсилон (Agrotis ipsilon Hufnagel), совка ни (Trichoplusia ni Hübner), совка Heliothis virescens Fabricius); бурильщики, чехлоноски, гусеницы, coneworms, мермитиды и вредители, скелетирующие листья семейства Pyralidae (например, мотылек кукурузный (Ostrinia nubilalis Hübner), гусеница, вредящая цитрусовым (Amyelois transitella Walker), огневка (Crambus caligmosellus Clemens), луговые мотыльки (Herpetogramma licarsisalis Walker)); листовертки, листовертки-почкоеды, плодожорки, и гусеницы-вредители плода семейства Tortricidae (например, плодожорка яблонная (Cydia pomonella Linnaeus), листовертка виноградная (Endopiza viteana Clemens), листовертка восточная персиковая (Grapholita molesta Busck)); и много других экономически важных чешуекрылых (например, моль капустная (Plutella xylostella Linnaeus), розовый коробочный червь (Pectinophora gossypiella Saunders), шелкопряд непарный (Lymantria dispar Linnaeus)); личинки и взрослые особи отряда Blattodea, включая тараканов семейств Blattellidae и Blattidae (например, таракан черный (Blatta orientalis Linnaeus), таракан Азиатский (Blatella asahinai Mizukubo), таракан рыжий (Blattella germanica Linnaeus), brownbanded таракан (Supella longipalpa Fabricius), таракан Американский (Periplaneta americana Linnaeus), таракан коричневый (Periplaneta brunnea Burmeister), таракан Мадеры (Leucophaea maderae Fahricius)); личинки, питающиеся листвой, и взрослые особи отряда Coleoptera, включая долгоносики семейств Anthribidae, Bruchidae и Curculionidae (например, долгоносик хлопковый (Anthonomus grandis Boheman), долгоносик рисовый водяной (Lissorhoptrus oryzophilus Kuschel), долгоносик амбарный (Sitophilus granarius Linnaeus), долгоносик рисовый (Sitophilus oryzae Linnaeus)); земляные блошки, жук-блошка картофельная, блошки корневые, листоеды, колорадские жуки, и моли-минеры узкокрылые семейства Chrysomelidae (например, колорадский жук (Leptinotarsa decemlineata Say), листоед корнежил кукурузный (Diabronica virgifera virgifera LeConte)); хрущи и другие блошки семейства Scaribaeidae (например, хрущик японский (Popillia japonica Newman) и хрущик европейский (Rhizotrogus majalis Razoumowsky)); кожееды семейства Dermestidae; проволочники семейства Elateridae; короеды семейства Scolytidae и мучные хрущаки большие семейства Tenebrionidae. Помимо сельскохозяйственных и несельскохозяйственных вредители включают взрослые особи и личинки отряда Dermaptera, включая уховертки семейства Forficulidae (например, уховертка обыкновенная (Forflcula auricularia Linnaeus), уховертка черная (black earwig) (Chelisoches morio Fabricius)); взрослые особи и личинки отрядов Hemiptera и Homoptera, такие как клопы-слепняки семейства Miridae, цикады семейства Cicadidae, цикадки (например, Empoasca spp.) семейства Cicadellidae, дельфациды семейств Fulgoroidae и Delphacidae, горбатки семейства Membracidae, листоблошки семейства Psyllidae, белокрылки семейства Aleyrodidae, тли семейства Aphididae, филлоксера семейства Phylloxeridae, мучнистые червецы семейства Pseudococcidae, чешуйки семейства Coccidae, Diaspididae и Margarodidae, клопы-кружевницы семейства Tingidae, клопы-щитники семейства Pentatomidae, клопы белокрылые (например, Blissus spp.) и другие клопы семейства Lygaeidae, пшенницы семейства Cercopidae, squash bugs семейства Coreidae, и красные клопы и красноклопы семейства Pyrrhocoridae. Кроме того, вредители также включают взрослые особи и личинки отряда Acari (клещи), такие как клещики паутинные и клещи красные семейства Tetranychidae (например, клещик паутинный (Panonychus ulmi Кох), клещик паутинный двупятнистый (Tetranychus urticae Кох), клещик Макданиела (McDaniel) (Tetranychus mcdanieli McGregor)), клещики плоские семейства Tenuipalpidae (например, клещик плоский цитрусовый (citrus flat mite) (Brevipalpus lewisi McGregor)), rust и галлообразующие клещи семейства Eriophyidae и другие клещи, поедающие листву, и клещи, важные для здоровья людей и животних, то есть клещи, содержащиеся в пыли (dust mites) семейства Epidermoptidae, железницы семейства Demodicidae, зерновые клещи (grain mites) семейства Glycyphagidae, иксодовые клещи отряда Ixodidae (например, клещ олений (deer tick) (Ixodes scapularis Say), клещ австралийский (Australian paralysis tick) (Ixodes holocyclus Neumann), иксодовый клещ изменчивый ( Dermacentor variabilis Say), клещ однозвездный (lone star tick) (Amblyomma americanum Linnaeus) и чесоточные (scab and itch mites) клещи семейства Psoroptidae, Pyemotidae и Sarcoptidae; взрослые и недоразвитые особи отряда Orthoptera, включая кобылки (grasshoppers), настоящие саранчовые (locusts) и сверчки (например, кобылки (такие как Melanoplus sanguinipes Fabricius, M. differentialis Thomas), саранча американская (например, Schistocerca americana Drury), desert locust (Schistocercagregaria Forskal), саранча перелетная (Locusta migratoria Linnaeus), сверчок домовой (Acheta domesticus Linnaeus), медведки (Gryllotalpa spp.)); взрослые и недоразвитые особи отряда Diptera, включая моли-минеры узкокрылые, галлицы, пестрокрылки (Tephritidae), мушки шведские (например, Oscinella frit Linnaeus), почвенные личинки насекомых, мухи комнатные (например, Musca domestica Linnaeus), lesser house flies (например, Fannia canicularis Linnaeus, F.femoralis Stein), жигалки осенние (например, Stomoxys calcitrans Linnaeus), face flies, жигалка коровья малая, blow flies (например, Chrysomya spp., Phormia spp.), и другие мухообразные летающие вредители, жигалка лошадиная (например, Tabanus spp.), bot flies (например, Gastrophilus spp., Oestrus spp.), личинки бычьего овода (например, Hypoderma spp.), мушки оленьи (например, Chrysops spp.), рунци овечьи (например, Melophagus ovinus Linnaeus) и другие представители отряда Brachycera, комары (например, Aedes spp., Anopheles spp., Culex spp.), black flies (например, Prosunulium spp., Simuliun spp.), мокрецы, мошки, sciarids и другие представители отряда Nematocera; взрослые и недоразвитые особи отряда Thysanoptera, включая трипс табачный (Thrips tabaci Lindeman) и другие пузереногие, питающиеся листвой; насекомые-вредители отряда Hymenoptera, включая муравьев (например, муровей-древоточец (Camponotus ferrugineus Fabricius), муравей-древоточец пенсильванский (Camponotus pennsylvanicus DeGeer), фараонов муравей (Monomorium pharaonis Linnaeus), васмания (Wasmannia auropunctata Roger), муравей Рихтера (Solenopsis geminata Fabricius), red imported fire ant (Solenopsis invicta Buren), муравей аргентинский (Iridomyrmex humilis Mayr), паратрехина (Paratrechina longicornis Latreille), муравей дерновый (Tetramorium caespitum Linnaeus), cornfield ant (Lasius alienus Forster), муравей Tapinoma sessile (Tapinoma sessile Say)), пчелы (включая пчелы-плотники), шершни, yellow jackets и ocb; насекомые-вредители отряда Isoptera, включая термит желтоногий (Reticulitermes flavipes Kollar), термит Reticulitermes hesperus (Reticulitermes hesperus Banksu), термит Coptotermes formosanus (Coptotermes formosanus Shiraki), West Indian Drywood termit (Incisitermesimmigrans Snydex) и другие термиты, важные с экономической точки зрения; насекомые-вредители отряда Thysanura, такие как чешуйница (Lepismasaccharina Linnaeus) и чешуйница домашняя (Thermobia domestica Packard); насекомые-вредители отряда Mallophaga, включая вошь головную (Pediculus humanus capitis De Geer), вошь тела (body louse) (Pediculus humanus humanus Linnaeus), пухоед (Menacanthus stramineus Nitszch), власоед собачий (Trichodectes canis De Geer), пухоед куриный пестробрюхий (Goniocotes gallinae De Geer), вошь овечья (Bovicola ovis Schrank), Short-nosed cattle louse (Haematopinus eurysternus Nitzsch), long-nosed cattle louse ( Linognathusvituli Linnaeus) и другие сосущие и кусающие вши-паразиты, которые паразитируют на человеке и животных; насекомые-вредители отряда Siphonoptera, включая крысиную блоху (oriental rat flea) (Xenopsylla cheopis Rothschild), блоху кошачью (Ctenocephalidesfelis Bouche), блоху собачью (Ctenocephalldes canis Curtis), блоха куриная (hen flea) ( Ceratophyllus gallinae Schrank), блоха присасывающаяся (Echidnophaga gallinacea Westwood), блоха человеческая (Pulex irritans Linnaeus) и другие блохи, поражающие млекопитающих и птиц. Дополнительные членистоногие вредители, имеющие покрытие, включают паукообразные отряда Araneae, такие как brown recluse spider (Loxosceles reclusa Gertsch & Mulaik), паук-ткач черный (Latrodectusmactans Fabricius), и многоножки отряда Scutigeromorpha, такие как многоножка домашняя (house centipede) (Scutigera coleoptrata Linnaeus).
Соединения данного изобретения обладают также активностью в отношении представителей классов Nematoda, Cestoda, Trematoda и Acanthocephala, включая важных с экономической точки зрения представителей отрядов Strongylida, Ascaridida, Oxyurida, Rhabditida, Spirurida и Enoplida, таких как, но без ограничения только ими, важные с экономической точки зрения сельскохозяйственные вредители (т.е. нематоды корневого нароста рода Meloidogyne, нематоды повреждений (lesion nematodes) рода Pratylenchus, нематоды короткого корня (stubby root nematodes) рода Trichodorus и т.д.) и вредители, наносящие ущерб здоровью животных и человека (т.е. все важные с экономической точки зрения трематоды, ленточные черви и круглые черви, такие как Strongylus vulgaris в организме лошади, Toxocara canis в организме собаки, Haemonchus contortus в организме овцы, Dirofilaria iimnitis Leidy в организме собаки, Anoplocephala perfollata в организме лошади, Fasciola hepatica Linnaeus в организме жвачного животного и т.д.).
Соединения данного изобретения проявляют особенно высокую активность в отношении вредителей отряда Lepidoptera (например, Alabama argillacea Hübner (совка), Archips argyrospila Walker (листовертка), A. rosana Linnaeus (листовертка европейская (European leaf roller) и другие представители видов Archips, Chilo suppressalis Walker (бурильщик ствола риса (rice stem borer), Cnaphalocrosismedinalis Guenee (листовертка рисовая (rice leaf roller)), Crambus caliginosellus Clemens (огневка), Crambus teterrellus Zincken (огневка), Cydia pomonella Linnaeus (плодожорка яблонная), Earias insulana Boisduval (spiny ballworm), Earias vittella Fabricius (spotted bollworm), Helicoverpa armigera Hübner (совка хлопковая), Helicoverpa zea Boddie (коробочный червь), Heliothis virescens Fabricius (совка), Herpetogramma licarsisalis Walker (луговые мотыльки), Lobesia botrana Denis & Schiffermüller (листовертка виноградная), Pectinqphora gossypiella Saunders (розовый коробочный червь), Phyllocnistis citrella Stainton (цитрусовая моль-минер узкокрылая), Pieris brassicae Linnaeus (белянка капустная), Pieris rapae Linnaeus (белянка репная), Plutella xylostella Linnaeus (моль капустная), Spodoptera exigua Hübner (свекловичный походный червь (совка малая)), Spodoptera litura Fabricius (tobacco cutworm, cluster caterpillar), Spodoptera frugiperda J. E. Smith (совка травяная), Trichqplusia ni Hübner (совка ни) и Tuta absoluta Meyrick (моль-минер томатная)).
Соединения данного изобретения обладают также коммерчески значимой активностью в отношении представителей отряда Homoptera, включая Acyrthisiphon pisum Harris (тля гороховая), Aphis craccivora Koch (тля черная люцерновая), Aphis fabae Scopoli (тля бобовая), Aphis gossypii Glover (тля хлопковая), Aphis pomi De Geer (тля яблонная), Aphis spiraecola Patch (тля таволговая), Aulacorthum solani Kaltenbach (foxglove aphid), Chaetosiphon fragaefolii Cockerell (тля земляничная), Diuraphis noxia Kurdjumov/MordviIko (Russian пшеничная тля), Dysaphis plantaginea Paaserini (тля розовая), Eriosoma lanigerum Hausmann (тля кровяная яблонная), Hyalopterus pruni Geoffroy (тля мучнистая сливовая), Lipaphis erysimi Kaltenbach (тля ложнокапустная), Metopolophium dirrhodum Walker (тля хлебная), Macrosipum euphorbiae Thomas (тля картофельная), Myzus persicae Sulzer (тля персиковая), Nasonovia ribisnigri Mosley (тля салатная), Pemphigus spp. (корневая тля и галлообразующая тля), Rhopalosiphum maidis Fitch (тля кукурузная листовая), Rhopalosiphum padi Linnaeus (bird cherry-oat aphid), Schizaphis graminum Rondani (тля злаковая обыкновенная), Sitobion avenae Fabricius (тля злаковая), Therioaphis maculata Buckton (spotted alfalfa aphid), Toxoptera aurantii Boyer Fonscolombe (тля чайная) и Toxoptera citricida Kirkaldy (тля цитрусовая); Adelges spp. (хермес); Phylloxera devastatrix Pergande (филлоксера гикори); Bemisia tabaci Gennadius (белокрылка бататовая), Bemisia argentifolii Bellows & Perring (silverleaf whitefly), Dialeurodes citri Ashmead (белокрылка цитрусовая) и Trialeurodes vaporariorum Westwood (белокрылка тепличная); Empoasca fabae Harris (цикадка картофельная), Laodelphax striatellus Fallen (smaller brown planthopper), Macrolestes quadrilineatus Forbes (aster leafhopper), Nephotettix cinticeps Uhler (green leafhopper), Nephotettix nigropictus Stal (цикадка рисовая (rice leafhopper)), Nilaparvata lugens Stel (browm planthopper), Peregrinus maidis Ashmead (corn planthopper), Sogatella furcifera Horvath (white-backed planthopper), Sogatodesorizicola Muir (rice delphacid), Typhtocyba pomaria McAtee (цикадка яблонная), Erythroneoura spp. (цикадка виноградная); Magicidada septendecim Linnaeus (periodical cicada); Icerya purchasi Maskell (червец австралийский желобчатый), Quadraspidiotus perniciosus Comstock (San Jose scala); Planococcus citri Risso (червец виноградный мучнистый); Pseudococcus spp. (сообщества червецов); Cacopsilla pyricola Foerster (медяница грушевая), Trioza diospyri Ashmead (листоблошка хурмовая).
Данные соединения также обладают активностью против представителей отряда Hemiptera (полужесткокрылые), включая Acrosternum hilare Say (щитник зеленый), Anasa tristis De Geer (клоп-ромбовик печальный), Blissus leucopterusleucopterus Say (клоп белокрылый), Corythuca gossypii Fabricius (клоп-кружевница хлопчатника), Cyrtopeltis modesta Distant (клоп томатный), Dysdercus suturellus Herrish-Schaffer (красноклоп хлопковый), Euchistus servus Say (клоп-щитник коричневый), Euchistus variolarius Palisot de Beuavois (клоп-щитник однопятнистый), Graptosthetus spp. (сообщества клопов-наземников), Leptoglossus corculus Say (клоп-краевик семян сосны), Lygus lineolaris Palisot de Beuavois (клопик луговой), Nesara viridula Linnaeus (клоп хлопково-огородный); Oebalus pugnax Fabricius (клоп-щитник рисовый), Oncopeltus fasciatus Dallas (клоп молочайный), Pseudatomoscelis seriatus Reuter (слепняк хлопковый).
Другими отрядами насекомых, против которых направлены соединения настоящего изобретения, являются насекомые отряда Thysanoptera (трипсы) (например, Frankliniella occidentallis Pergande (трипс западный цветочный), Scirthothrips citri Moulton (трипс цитрусовый), Sericothrips variabilis Beach (трипс соевый) и Thrips tabaci Lindenman (трипс табачный), и отряд Coleoptera (Жесткокрылые) (например, Leptinotarsa decemlineata Say (колорадский жук), Epilachna varivestis Mulsant (зерновка бобовая мексиканская) и личинки щелкунов рода Agriotes, Athous или Limonius).
Соединения настоящего изобретения могут быть также смешаны с одним или несколькими другими биологически активными соединениями или агентами, включая, инсектициды, фунгициды, нематоциды, бактерициды, акарициды, регуляторы роста, такие как стимуляторы образования корней, химические стерилизующие агенты, полухимические соединения, репелленты, атрактанты, феромоны, стимуляторы питания, другие биологически активные соединения или энтомопатогенные бактерии, вирусы или грибки, для получения многокомпонентного пестицида, обладающего более широким спектром применения в сельском хозяйстве. Таким образом, композиции настоящего изобретения могут, кроме того, содержать биологически эффективное количество, по крайней мере, одного дополнительного биологически активного соединения или агента. Примерами таких соединений или агентов, с которым соединения настоящего изобретения могут вводиться в препарат, являются
инсектициды, такие как абамектин, ацефат, ацетамиприд, авермектин, азадирахтин, азинфос-метил, бифентрин, бинфеназат, бупрофезин, карбофуран, хлорфенапир, хлорфлуазурон, хлорпирифос, хлорпирифос-метил, хромафенозид, клотианидин, цифлутрин, бета-цифлутрин, цигалотрин, лямбда-цигалотрин, циперметрин, циромазин, дельта-метрин, диафентиурон, диазинон, дифлубензурон, диметоат, диофенолан, эмамектин, эндосульфан, эсфенвалерат, этипрол, фенотикарб, феноксикарб, фенпропатрин, фенпроксимат, фенвалерат, фипронил, флоникамид, флуцитринат, тау-флувалинат, флуфеноксурон, фонофос, галофенозид, гексафлумурон, имидаклоприд, индоксакарб, изофенфос, луфенурон, малатион, метальдегид, метамидофос, метидатион, метомил, метопрен, метоксихлор, монокротофос, метоксифенозид, нитиазин, новалурон, оксамил, паратион, паратион-метил, перметрин, форат, фозалон, фосмет, фосфамидон, пиримикарб, профенофос, пиметрозин, пиридалил, пирипроксифен, ротенон, спиносад, сульпрофос, тубефенозид, тефлубензурон, тефлутрин, тербуфос, тетрахлорвинфос, тиаклоприд, тиаметоксам, тиодикарб, тиосультап-натрий, тралометрин, трихлорфон и трифлумурон;
фунгициды, такие как ацибензолар, азоксистробин, беномил, бластицидин-S, смесь Бордо (трехосновный сульфат меди), бромуконазол, карпропамид, каптафол, каптан, карбендазим, хлоронеб, хлороталонил, оксихлорид меди, соли меди, цифлуфенамид, цимоксанил, ципроконазол, ципродинил, (S)-3,5-дихлор-N-(3-хлор-1-этил-1-метил-2-оксопропил)-4-метилбензамид (RH 7821), диклоцимет (S-2900), дикломезин, диклоран, дифеноконазол, (S)-3, 5-дигидро-5-метил-2-(метилтио)-5-фенил-3-(фениламино)-4Н-имидазол-4-он (RP 407213), диметоморф, димоксистробин, диниконазол, диниконазол-М, додин, эдифенфос, эпоксиконазол, фамоксадон, фенамидол, фенаримон, фенбуконазол, фенкарамид (SZX0722), фенпиклонил, фенпропидин, фенпропиморф, ацетат фентина, гидроксид фентина, флуазинам, флудиоксонил, флуметовер (RPA 403397), флухинконазол, флузилазол, флутоланил, флутриафол, фольпет, фозетил-алюминий, фуралаксил, фураметапир (S-82658), гексаконазол, ипконазол, ипробенфос, ипродион, изопротиолан, казугамицин, крезоксим-метил, манкоцеб, манеб, мефеноксам, мепронил, металаксил, метконазол, метоминостробин/феноминостробин (SSF-126), миклобутанил, нео-азозин (метанарсонат железа (3)), оксадиксил, пенконазол, пенцикурон, пробеназол, прохлораз, пропамокарб, пропиконазол, пирифенокс, пираклостробин, пириметанил, пирохилон, хиноксифен, спироксамин, сера, тебуконазол, тетраконазол, тиабендазол, тифлузамид, тиофанат-метил, тирам, тиадинил, триадимефон, триадименол, трициклазол, трифлоксистробин, тритиконазол, валидамицин и винклозолин;
нематоциды, такие как алдикарб, оксамил и фенамифос;
бактерициды, такие как стрептомицин;
акарициды, такие как амитраз, хинометионат, хлорбензилат, цигексатин, дикофол, диенохлор, этоксазол, феназахин, оксид фенбутатина, фенпропатрин, фенпироксимат, гекситиазокс, пропаргит, пиридабен и тебуфенпирад и
биологические агенты, такие как Bacillus thuringiensis, включая виды aizawai и kurstaki, дельта-эндотоксин Bacillus thuringiensis, бакуловирусы и энтомопатогенные бактерии, вирусы и грибы.
Соединения, используемые в соответствии с настоящим изобретением, и их композиции могут применяться к трансгенным растениям для экспрессии белков, токсичных для беспозвоночных вредителей (таких как токсин Bacillus thuringiensis). Экзогенные соединения, используемые для борьбы с беспозвоночными вредителями, и их композиции могут оказывать синергическое действие вместе с белками, экспрессирующими токсин.
Общим руководством по указанным защитным агротехническим средствам является The Pesticide Manual, 12th Edition, C.D.S. Tomlin, Ed., British Crop Protection Council, Farnham, Surrey, U.K., 2000.
Предпочтительными инсектицидами и акарицидами для их смешивания с соединениями настоящего изобретения являются пиретроиды, такие как циперметрин, цигалотрин, цифлутрин, бета-цифлутрин, эсфенвалерат, фенвалерат и тралометрин; карбаматы, такие как фенотикарб, метомил, оксамил и тиодикарб; нео-никотиноиды, такие как клотианидин, имидаклоприд и тиаклоприд; блокаторы нейронных натриевых каналов, такие как индоксакарб, инсектицидные макроциклические лактоны, такие как спиносад, абамектин, авермектин и эмамектин; антагонисты γ-аминомасляной кислоты (GABA), такие как эндосульфан, этипрол и фипронил; мочевины, обладающие инсектицидной активностью, такие как флуфеноксурон и трифлумурон; миметики ювенильных гормонов, такие как диофенолан и пирипроксифен; пиметрозин и амитраз. Предпочтительными биологическими агентами для смешивания с соединениями настоящего изобретения являются Bacillus thuringiensis и дельта-эндотоксин Bacillus thuringiensis, а также природные и трансгенные вирусные инсектициды, включая члены семейства Baculoviridae, а также грибки-энтомофаги.
Наиболее предпочтительными смесями являются смесь соединения настоящего изобретения и цигалотрина; смесь соединения настоящего изобретения и бета-цифлутрина; смесь соединения настоящего изобретения и эсфенвалерата; смесь соединения настоящего изобретения и метомила; смесь соединения настоящего изобретения и имидаклоприда; смесь соединения настоящего изобретения и тиаклоприда; смесь соединения настоящего изобретения и индоксакарба; смесь соединения настоящего изобретения и абамектина; смесь соединения настоящего изобретения и эндосульфана; смесь соединения настоящего изобретения и этипрола; смесь соединения настоящего изобретения и фипронила; смесь соединения настоящего изобретения и флуфеноксурона; смесь соединения настоящего изобретения и пирипроксифена; смесь соединения настоящего изобретения и пиметрозина; смесь соединения настоящего изобретения и амитраза; смесь соединения настоящего изобретения и Bacillus thuringiensis и смесь соединения настоящего изобретения и дельта-эндотоксин Bacillus thuringiensis.
В некоторых примерах сочетания с другими соединениями или агентами, проявляющими пестицидную активность в отношении беспозвоночных вредителей, будут особенно преимуществены для устойчивых видов. Таким образом, композиции данного изобретения могут дополнительно включать биологически эффективное количество, по меньшей мере, одного дополнительного соединения, обладающего пестицидной активностью в отношении беспозвоночных вредителей, или средства, обладающего аналогичным спектром контроля, но другим механизмом действия. Контактирование растения, генетически модифицированного для экспрессии соединения, обладающего защитным действием (например, белка) или места произрастания растения с биологически эффективным количеством соединения изобретения, может также обеспечить более широкий спектр защиты растения и быть преимущественным для регулирования сопротивляемости.
Беспозвоночные вредители подавляются в сельскохозяйственных и несельскохозяйственных областях применения нанесением одного или нескольких соединений, используемых в соответствии с данным изобретением, в эффективном количестве на среду обитания вредителей, включая сельскохозяйственный и/или несельскохозяйственный очаг заражения, на площадь, которая подлежит защите, или непосредственно на вредителей, подлежащих подавлению. Следовательно, данное изобретение дополнительно включает способ борьбы с беспозвоночными вредителями в сельскохозяйственных и/или несельскохозяйственных областях применения, включающий контактирование беспозвоночных или среды их обитания с биологически эффективным количеством одного или нескольких соединений данного изобретения, с композицией, включающей, по меньшей мере, одно такое соединение, или с композицией, включающей, по меньшей мере, одно такое соединение и эффективное количество, по меньшей мере, одного дополнительного биологически активного соединения или агента. Примеры подходящих композиций, включающих соединение данного изобретения и, по меньшей мере, одного дополнительного биологически активного соединения или агента, включают гранулированные композиции, в которых дополнительное биологически активное соединение находится в той же грануле, что и соединение данного изобретения, или в отдельных гранулах.
Предпочтительным способом контактирования является опрыскивание. Альтернативно гранулированная композиция, включающая соединение данного изобретения, может наноситься на листву растения или на почву. Соединения, используемые в соответствии с данным изобретением, также эффективно поглощаются растениями при контактировании растения с композицией, включающей соединение, используемое в соответствии с данным изобретением, при орошении почвы жидким препаратом, внесении гранулированного препарата в почву, обработке ящика в питомнике или погружении пересаживаемых растений. Соединения также эффективны при местном нанесении композиции, включающей соединение, используемое в соответствии с данным изобретением, на очаг заражения. Другие способы контактирования включают нанесение соединения или композиции данного изобретения прямым или остаточным опрыскиванием, воздушным опрыскиванием, в виде гелей, покрытий семян, микроинкапсулированием, системным поглощением, в виде приманок, с пищей (eartags), в виде болюсов в виде туманов, окуриваний, аэрозолей, порошков и т.п. Соединения, используемые в соответствии с данным изобретением, могут быть импрегнированы в материалы при изготовлении устройств для борьбы с беспозвоночными вредителями (например, инсектосеток).
Соединения, используемые в соответствии с данным изобретением, можно вводить в приманки, которые поедаются беспозвоночными, или внутрь устройств, таких как ловушки и т.п. Гранулы или приманки, включающие 0,01-5% активного ингредиента, 0,05-10% агента, сохраняющего влагу, и 40-99% растительной флоры, эффективны для борьбы с почвенными насекомыми в очень низких дозах применения, в частности в дозах активного ингредиента, которые являются летальными при съедании, а не при прямом контакте.
Соединения, используемые в соответствии с данным изобретением, можно применять в чистом виде, но наиболее частым применением будет препарат, включающий одно или несколько соединений с подходящими носителями, разбавителями и поверхностно-активными веществами, и, возможно, в сочетании с пищей, в зависимости от предполагаемого конечного применения. Предпочтительный способ применения включает опрыскивание водной дисперсией или очищенным масляным раствором соединений. Сочетания с распыляемыми маслами, распыляемыми масляными концентратами, распределителями-стикерами, адъювантами, другими растворителями и синергистами, такими как пиперонилбутоксид, часто повышает эффективность соединения.
Применяемая доза, необходимая для эффективного подавления (т.е. «биологически эффективное количество») будет зависеть от таких факторов, как вид беспозвоночного, подлежащего подавлению, жизненный цикл вредителя, стадия развития, размер, местоположение, время года, растение- или животное-хозяин, пищевое поведение, поведение спаривания, влажность окружающей среды, температура и т.п. В нормальных условиях применяемые дозы примерно 0,01-2 кг активного ингредиента на гектар являются достаточными для подавления вредителей в сельскохозяйственных экосистемах, но может быть достаточно и 0,0001 кг/гектар, или максимально может потребоваться 8 кг/гектар. Для несельскохозяйственных областей применения эффективные дозы будут находиться в интервале примерно от 1,0 до 50 мг/кв.м, но может быть достаточно и 0,1 мг/кв.м или может потребоваться 150 мг/кв.м. Квалифицированный в данной области специалист легко может определить биологически эффективное количество, необходимое для желаемого уровня подавления беспозвоночных вредителей.
Приведенные далее тесты на биологическую активность соединений данного изобретения показывают эффективность способов данного изобретения, не ограничивается этими видами. Описание соединений представлено в таблицах A-D. В данных таблицах используются следующие аббревиатуры: i означает изо, Me означает метил, Ph представляет фенил и Pr представляет пропил (соответственно i-Pr представляет изопропил). В таблицах В и С приведен такой фрагмент R1-R2, что левый конец фрагмента присоединен к месту расположения R1, а правый конец фрагмента присоединен к месту расположения R2. Аббревиатура «Пр.» означает «пример», и следующий номер показывает, в каком примере получено соединение.
БИОЛОГИЧЕСКИЕ ПРИМЕРЫ ИЗОБРЕТЕНИЯ
ТЕСТ А
Для оценки подавления моли капустной (Phutella xylostella) используют опытный блок, состоящий из небольшого открытого контейнера, внутри которого помещают (12-14)-дневные растения редьки. Растения предварительно заражают 10-15 новорожденными личинками на фрагменте питательной среды насекомого, используя стержневой пробоотборник для выделения образца из листа затвердевшей питательной массы насекомых с множеством выращиваемых на нем личинок и переноса этого образца, содержащего личинки и их питание, в опытный блок. Личинки перемещают на опытное растение, когда образец питательной массы высыхает.
Испытуемые соединения в виде препаратов приготавливают, используя раствор, содержащий 10% ацетона, 90% воды и 300 ч./млн. неионогенного поверхностно-активного препарата X-77®Spreader Lo-Foam Formula, который включает алкиларилполиоксиэтилен, свободные жирные кислоты, гликоли и изопропанол (Loveland Industries, Inc.), если не указано иное. Соединения в виде таких препаратов применяют в виде 1 мл жидкости с помощью распылительного сопла SUJ2 обычной конфигурации 1/8 JJ (Spraying systems Co.), расположенного на расстоянии 1, 27 см (0,5 дюйма) от верхней части каждого опытного блока. Все экспериментальные соединения в данном опыте распыляют в концентрации 250 ч./млн. (или менее) и указанную обработку повторяют три раза. После опрыскивания препаратом испытуемого соединения каждому опытному блоку дают высохнуть в течение 1 часа и затем верхнюю часть закрывают черной решетчатой крышкой. Опытные блоки выдерживают в течение 6 дней в ростовой камере при 25°С и относительной влажности 70%. После этого визуально оценивают повреждение растений, которые для насекомых являются пищей.
Из испытуемых соединений очень хорошие уровни защиты растения (повреждение растения, которое используется насекомыми в качестве пищи, составляет 20% или менее) в дозах, использованных при испытании, проявили следующие соединения: 1*, 2*, 3*, 4*, 5*, 6*, 7**, 8**, 9**, 10**, 11**, 12**, 13**, 14, 15*, 16*, 20**, 21** и 22**.
ТЕСТ В
Для оценки подавления «ратных червей» (fall armyworms) (Spodoptera frugiperda) используют опытный блок, состоящий из небольшого открытого контейнера с помещенными внутри (4-5)-дневными растениями кукурузы. Растения предварительно заражают 10-15 личинками возраста 1 день на куске пищи насекомого с использованием стержневого пробоотборника, как описано для теста А.
Приготавливают препарат испытуемого соединения и наносят опрыскиванием в концентрации 250 ч./млн. (или менее), как описано для теста А. Указанную обработку повторяют три раза. После опрыскивания опытные блоки выдерживают в ростовой камере и затем визуально оценивают повреждение растений, используемых насекомыми в качестве пищи, как описано для теста А.
Из испытуемых соединений очень хорошие уровни защиты растения (повреждение растения, которое используется насекомыми в качестве пищи, составляет 20% или менее) в дозах, использованных при испытании, проявили следующие соединения: 1*, 2*, 3*, 4*, 5*, 6*, 7**, 8**, 9**, 10**, 11**, 12**, 13, 14, 20**, 21** и 22**.
ТЕСТ С
Для оценки подавления совки (Heliothis virescens) используют опытный блок, состоящий из небольшого открытого контейнера с помещенными внутри (6-7)-дневными растениями кукурузы. Растения предварительно заражают личинками в возрасте 2 дней на фрагменте питательной среды насекомого с использованием стержневого пробоотборника, как описано для теста А.
Приготавливают препарат испытуемого соединения и наносят опрыскиванием в концентрации 250 ч./млн. (или менее), как описано для теста А. Указанную обработку повторяют три раза. После опрыскивания опытные блоки выдерживают в ростовой камере и затем визуально оценивают повреждение растений, используемых насекомыми в качестве пищи, как описано для теста А.
Из испытуемых соединений очень хорошие уровни защиты растения (повреждение растения, которое используется насекомыми в качестве пищи, составляет 20% или менее) в дозах, использованных при испытании, проявили следующие соединения: 1*, 2*, 3*, 4*, 5*, 6*, 7*, 8**, 9**, 10**, 11**, 12**.
ТЕСТ D
Для оценки подавления свекловичного ратного червя (beet armyworm) (Spodoptera exiqua) используют опытный блок, состоящий из небольшого открытого контейнера с помещенными внутри (4-5)-дневными растениями кукурузы. Растения предварительно заражают 10-15 личинками возраста 2 дней на фрагменте питательной среды насекомого с использованием стержневого пробоотборника, как описано для теста А.
Приготавливают препарат испытуемого соединения и наносят опрыскиванием в концентрации 250 ч./млн. (или менее), как описано в тесте А. Указанную обработку повторяют три раза. После опрыскивания опытные блоки выдерживают в ростовой камере и затем визуально оценивают повреждение растений, используемых насекомыми в качестве пищи, как описано для теста А.
Из испытуемых соединений очень хорошие уровни защиты растения (повреждение растения, которое используется насекомыми в качестве пищи, составляет 20% или менее) в дозах, использованных при испытании, проявили следующие соединения: 1*, 2*, 3*, 4*, 5*, 6*, 7**, 8**, 9**, 10**, 11**, 12**.
* Соединение испытывалось в концентрации 50 ч./млн.
** Соединение испытывалось в концентрации 10 ч./млн.
Реферат
Описывается соединение формулы I

где В представляет О или NR1; J представляет 5-членное гетероароматическое кольцо, представляющее собой группу J-1, необязательно замещеное 1-2 R5,

Q представляет NR5; X, Y и Z каждый независимо представляет N, СН или CR5; В представляет О и R2 представляет Н или C1-C6алкил, необязательно замещенный одним атомом галогена, или C2-C6алкинил; или R1 и R2, взятые вместе, образуют связывающую цепь из 2-3 членов, включающую, по меньшей мере, один углеродный атом, необязательно включающую один углеродный атом вида C(=O), необязательно замещенную R3; R3 независимо представляет С1-С2алкил; каждый R4 независимо представляет Н, C1-C6алкил, галоген или CN; каждый R5 независимо представляет C1-C6галогеналкил или галоген или каждый R5 независимо представляет фенил или пиридинил, причем каждое кольцо замещено одним R6; каждый R6 независимо представляет галоген и n представляет целое число 1 или 2. Описывается также композиция для борьбы с насекомыми, включающая биологически эффективное количество соединения формулы (I) и, по меньшей мере, один дополнительный компонент, выбранный из группы, включающей поверхностно-активные вещества, твердые и жидкие разбавители, и способы борьбы с насекомыми, использующие композиции на основе соединений формулы (I) и соединения формулы (I). Технический результат - соединения формулы (I) обладают инсектицидной активностью, что позволяет использовать их в сельском хозяйстве. 4 н. и 7 з.п. ф-лы, 26 табл.
Формула

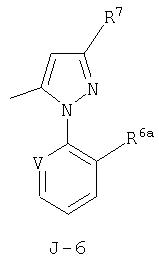

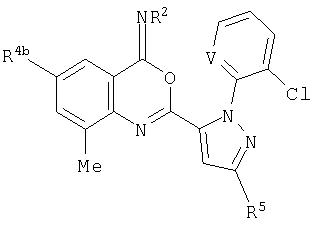
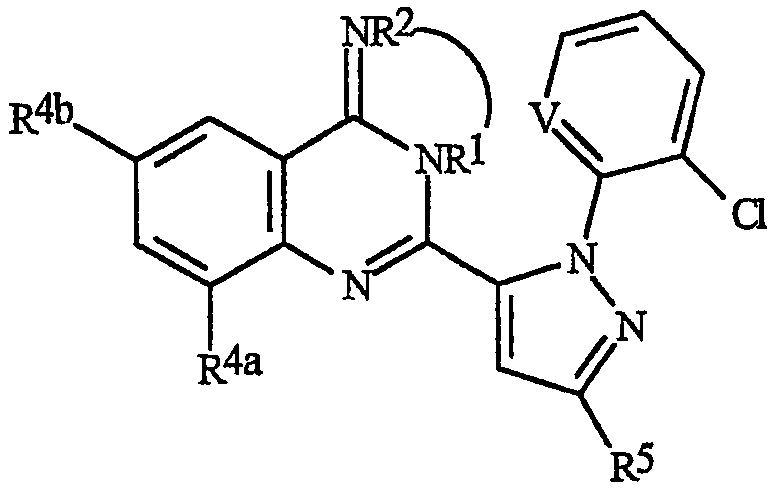
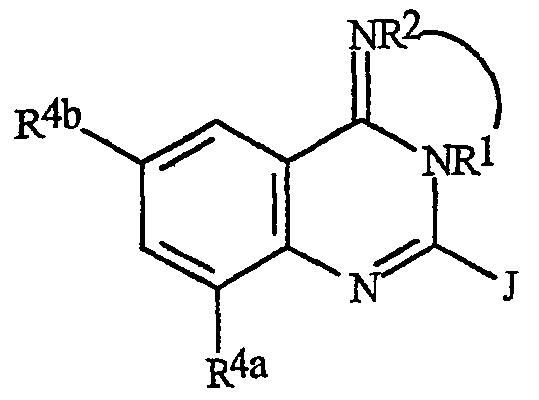


Комментарии