Производные оксима, средство для борьбы с заболеваниями растений, способ получения гидроксииминосоединения, способ получения производного оксима, гидроксииминосоединения - RU2193035C2
Код документа: RU2193035C2
Чертежи




































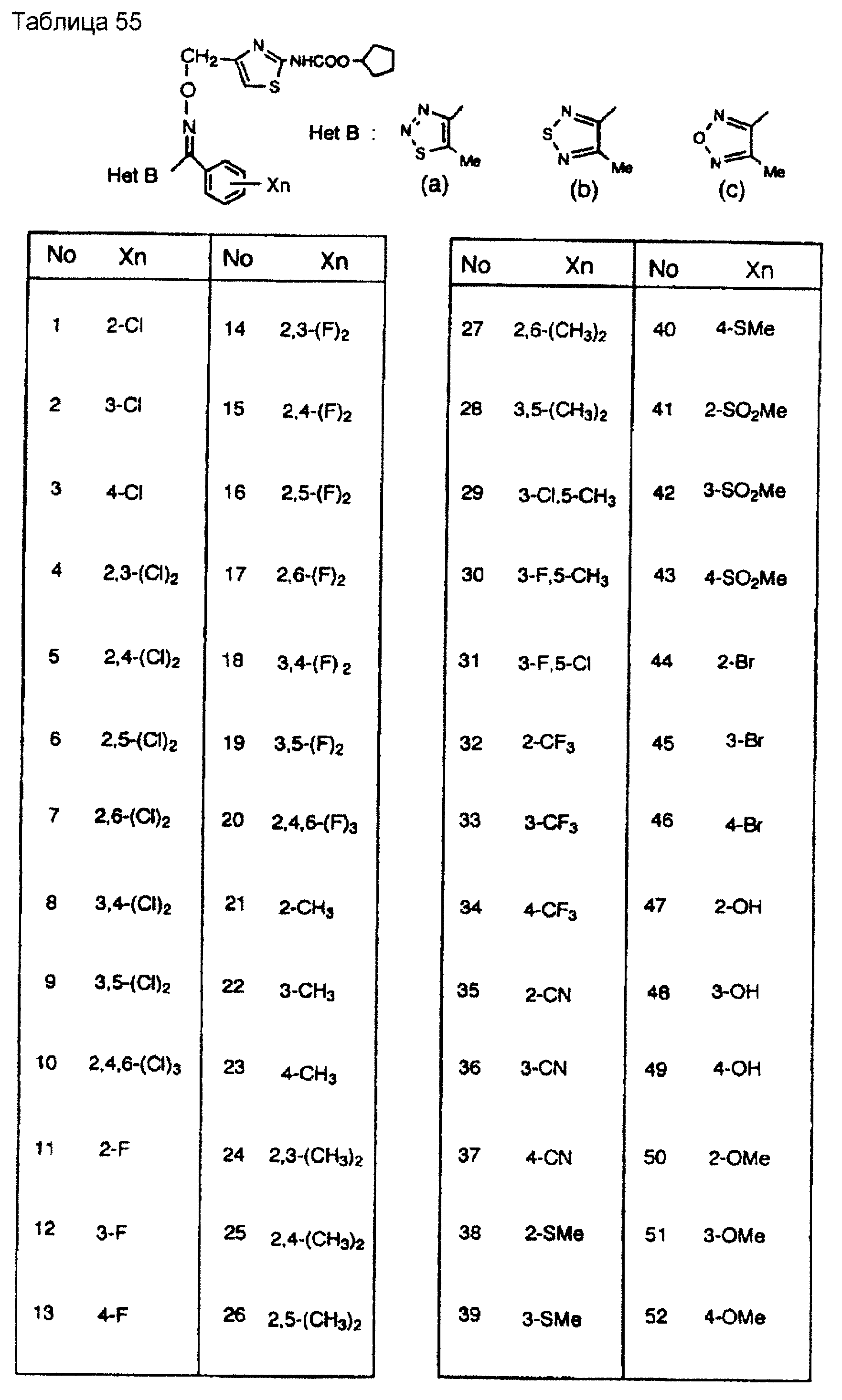




































Описание
Изобретение относится к новым производным оксима и сельскохозяйственным химикатам, содержащим производные оксима в качестве активных ингредиентов, и, в частности, относится к химикатам для борьбы с заболеваниями растений.
Относительно производных оксима, которые являются эффективными в качестве сельскохозяйственных химикатов или пестицидов, японская заявка, первая публикация Hei 7-25224 авторов данного изобретения раскрывает, например, что производные 4, 5-замещенного-1,2,3-тиадиазола эффективны в качестве химикатов для борьбы с болезнями растений.
Хотя указанные производные являются эффективными в качестве агрохимикатов, желательна разработка новых сельскохозяйственных химикатов, которые при использовании в меньших количествах превосходили бы по эффективности указанные производные тиадиазола.
Поэтому задачи, которые должны быть решены данным изобретением, заключаются в том, чтобы обеспечить новое производное оксима, которое является достаточно эффективным для лечения болезней растений в малых количествах, не вызывая повреждений или фитотоксичности у растений, и сельскохозяйственные химикаты или пестициды, содержащие вышеупомянутое производное оксима в качестве активных ингредиентов, в частности в качестве химикатов для борьбы с болезнями растений.
Авторы данного изобретения синтезировали новые производные оксима и исследовали биоактивность этих производных, чтобы решить указанные задачи. После серии исследований это изобретение было завершено открытием того, что производные оксима, представленные общими химическими формулами (1) и (2), являются особенно эффективными, показывающими превосходную активность против различных бактерий, вызывающих болезни растений, не обнаруживая при этом никакой фитотоксичности.
Данное изобретение относится к следующим
производным оксима и сельскохозяйственным химикатам, содержащим указанные производные оксима в качестве эффективных агентов:
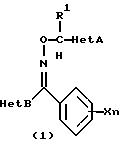
(1) производное оксима, представленное следующей общей химической
формулой (1):
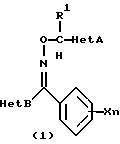
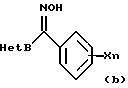
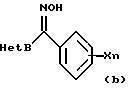
где R1 обозначает атом водорода или низшую алкильную группу; Х обозначает атом галогена, нитрогруппу, гидроксильную группу, цианогруппу, карбоксильную группу, алкоксикарбонильную группу, низшую алкильную группу (которая может быть замещена атомами галогена), низшую алкоксигруппу (которая может быть замещена атомами галогена), низшую алкилтиогруппу (которая может быть замещена атомами галогена), низшую алкилсульфонилгруппу (которая может быть замещена атомом галогена), арилгруппу (которая может быть замещена атомом галогена или низшей алкильной группой), арилоксигруппу (которая может быть замещена атомом галогена или низшей алкильной группой), или аминогруппу (которая может быть замещена низшей алкильной группой), и n обозначает целое число от 0 до 3, и
Het А обозначает 6-членную ароматическую азотсодержащую циклическую структуру, которая содержит один или два атома азота, или бензоконденсированную азотсодержащую ароматическую циклическую структуру, которая может быть замещена одной или двумя замещающими группами, выбранными из группы, состоящей из атома галогена, низшей алкильной группы, низшей алкилтиогруппы, низшей алкилсульфонилгруппы, низшей алкоксигруппы, трифторметилгруппы и цианогруппы, и
Het В обозначает производные оксима каждой циклической структуры, выраженной следующими формулами:

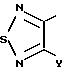

где Y обозначает атом водорода, атом галогена или низшую алкильную группу, которая может быть замещена атомом галогена;
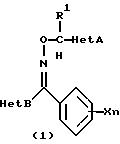
(2) производное оксима, представленное следующей общей химической формулой (2):
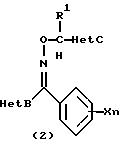
[где R1, X, n, Het В и Y являются такими же, как указано для химической формулы (1), и Het С обозначает 5-членную азотсодержащую ароматическую циклическую структуру или бензоконденсированную азотсодержащую ароматическую циклическую структуру, которая содержит более чем один атом азота или которая может содержать атом серы или атом кислорода и которая может быть замещена более чем одной замещающей группой, и группы, способные замещать атом азота указанной 5-членной азотсодержащей ароматической циклической структуры, являются группами, выбранными из группы, состоящей из низшей алкильной группы, низшей алкилсульфонилгруппы, трифенилметилгруппы, низшей алкоксиметилгруппы и N,N-дизамещенной сульфамоилгруппы, замещенной низшими алкильными группами, и группы, способные замещать атом углерода указанной 5-членной азотсодержащей ароматической циклической структуры, являются группами, выбранными из группы, состоящей из атома галогена, цианогруппы, C1-C6 алкильной группы (которая может быть замещена атомом галогена) и C3 -C6, циклоалкилгруппы, и
С2-С6 алкенилгруппы, С2-С6 алкинилгруппы, C1-C5 алкоксигруппы (которая может быть замещена атомом галогена), низшей алкилтиогруппы (которая может быть замещена атомом галогена), низшей алкилсульфонилгруппы (которая может быть замещена атомом галогена), низшей алкилсульфинилгруппы (которая может быть замещена атомами галогена), аминогруппы (которая может быть замещена низшей алкильной группой или С3-С6 циклоалкинилгруппой) или трифенилметилгруппой, и
низшей алкоксикарбонилгруппы, карбамоилгруппы (которая может быть замещена низшими алкильными группами), аминометилгруппы (которая может быть замещена низшими алкильными группами), ациламинометилгруппы, N-алкоксикарбониламинометилгруппы, алкилтиометилгруппы, арилгруппы (которая может быть замещена атомами галогена) и гетероарилгруппы (которая может быть замещена атомами галогена), и
группы, представленной формулой -N(R2)С(=O)R3 (где R2 обозначает атом водорода или метилгруппу, R3 обозначает атом водорода, C1-С10 алкильную группу (которая может быть замещена атомами галогена), С3-С8 циклоалкилгруппу, С2-С6 алкенилгруппу и C2-C4 алкинилгруппу, аралкилгруппу, низшую алкильную группу (замещенную аминогруппой), аралкилгруппу (замещенную аминогруппой), низшую алкильную группу (замещенную ациламиногруппой), аралкилгруппу (замещенную ациламиногруппой), низшую алкильную группу (замещенную алкоксикарбониламиногруппой), аралкилгруппу (замещенную алкоксикарбониламиногруппой), арилгруппу (которая может быть замещена атомами галогена, низшими алкильными группами (которые могут быть замещенными атомами галогена, низшими алкоксигруппами, низшими алкилтиогруппами, аминогруппами, нитрогруппами или цианогруппами)), гетероарилгруппу, низшую алкоксигруппу, С3-С6 циклоалкоксигруппу, бензилоксигруппу и арилоксигруппу)],
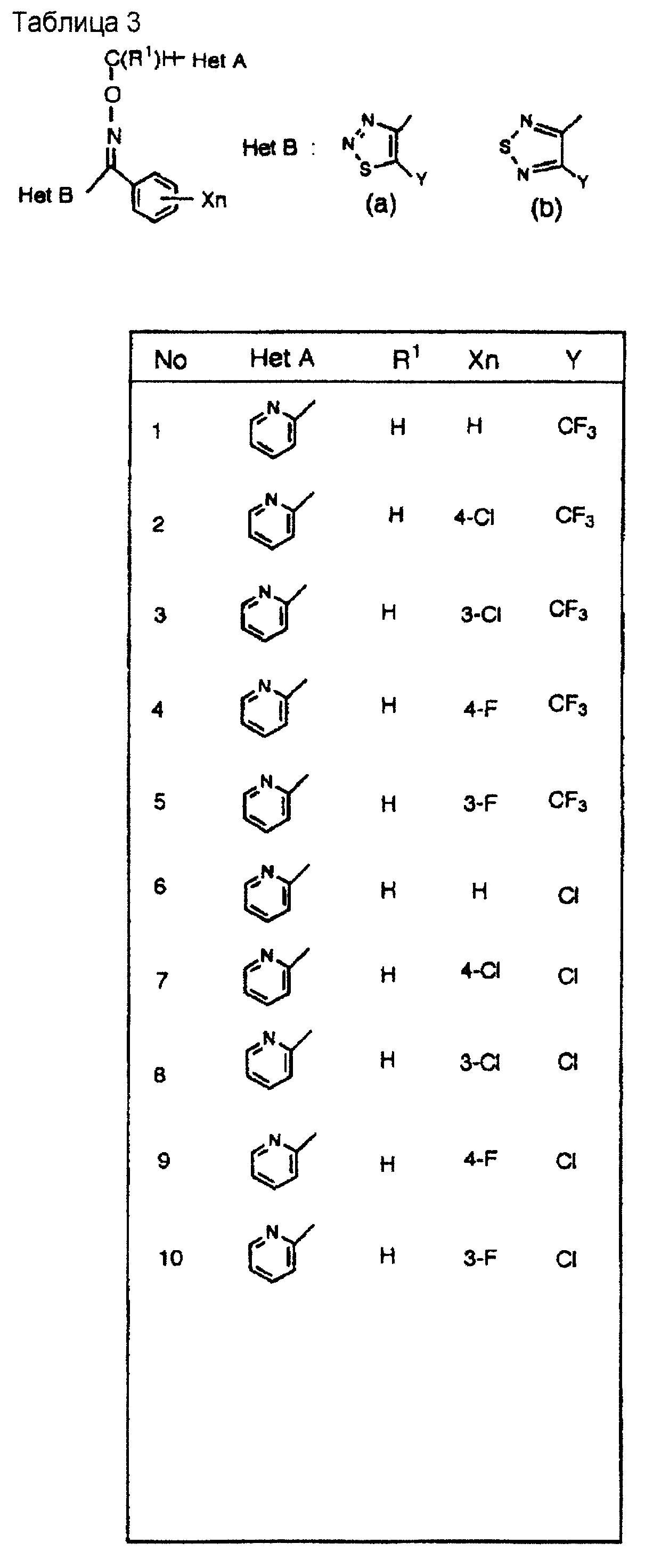
(3) производное оксима формулы (1), где Het А обозначает пиридилгруппу, которая может быть замещена одним атомом галогена или низшей алкильной группой;
(4) производное оксима, формулы (2), где Het С обозначает тиазолилгруппу, которая представлена следующей химической формулой:
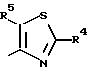
[где R4 обозначает атом водорода, аминогруппу, C1-C5 алкоксигруппу (которая может быть замещена атомами галогена), низшую алкилтиогруппу (которая может быть замещена атомами галогена), низшую алкилсульфонилгруппу (которая может быть замещена атомами галогена), низшую алкилсульфинилгруппу (которая может быть замещена атомами галогена), или
группу формулы -NHC(=O)R3 (где R3 обозначает атом водорода, C1-C10 алкильную группу (которая может быть замещена атомами галогена), С3-С8 циклоалкилгруппу, С2-С6 алкенилгруппу и С2-С4 алкинилгруппу, аралкилгруппу, низшую алкильную группу (замещенную аминогруппой), аралкилгруппу (замещенную аминогруппой), низшую алкильную группу (замещенную ациламиногруппой), аралкилгруппу (замещенную ациламиногруппой),
низшую алкильную группу (замещенную алкоксикарбониламиногруппой), аралкильную группу (замещенную алкоксикарбониламиногруппой), арилгруппу (которая может быть замещена: атомами галогена, низшими алкильными группами (которые могут быть замещены атомами галогена, низшими алкоксигруппами, низшими алкилтиогруппами, аминогруппами, нитрогруппами или цианогруппами)), гетероарилгруппу, низшую алкоксигруппу или C3-C6, циклоалкилоксигруппу, бензилоксигруппу или арилоксигруппу) и
R5 обозначает атом водорода, атом галогена или низшую алкильную группу, которая может быть замещена атомом галогена];
(5) производное оксима, упомянутое выше в (4), в котором R4 обозначает группу, представленную -NHC(= O)R3 (где R3 обозначает атом водорода, C1-C6 алкильную группу (которая может быть замещена атомами галогена), низшую C3 -C6 циклоалкилгруппу, арилгруппу (которая может быть замещена: атомами галогена, низшими алкильными группами (которые могут быть замещены атомами галогена), низшими алкоксигруппами, аминогруппами или цианогруппами), гетероарилгруппу или низшую алкоксигруппу), и R5 обозначает атом водорода;
(6) пестицид, который содержит в качестве активного ингредиента, по меньшей мере, одно из производных оксима из указанных выше компонентов, перечисленных в (1)-(5);
(7) средство для борьбы с болезнями растений, которое содержит в качестве активного ингредиента, по меньшей мере, одно из производных оксима из указанных выше компонентов, перечисленных в (1)-(5);
(8) средство для борьбы с болезнями растений, указанное в (7), которое является эффективным против болезней растений, вызываемых плесневыми грибами.
Наилучший вариант воплощения изобретения
В производных оксима, представленных общими
химическими
формулами (1) и (2), R1 обозначает атом водорода или низшую алкильную группу. Структура низшей алкильной группы может быть линейной или разветвленной, и примеры низшей
алкильной группы
включают, например, метилгруппу, этилгруппу, н-пропилгруппу, изопропилгруппу, н-бутилгруппу, изобутилгруппу, втор-бутилгруппу и циклопропилгруппу, все они в диапазоне от C1
до C4
. Особенно предпочтительными группами являются атом водорода и метилгруппа.
В общих формулах (1) и (2) Х обозначает атомы галогена, нитрогруппу, гидроксильную группу, цианогруппу, карбоксильную группу, алкоксикарбонильную группу, низшую алкильную группу (которая может быть замещена атомами галогена), низшую алкоксигруппу (которая может быть замещена атомами галогена), низшую алкилтиогруппу (которая может быть замещена атомами галогена) низшую алкилсульфонилгруппу (которая может быть замещена атомами галогена), арилгруппу (которая может быть замещена атомами галогена или низшими алкильными группами), арилоксигруппу (которая может быть замещена атомами галогена или низшими алкильными группами), или аминогруппу (которая может быть замещена низшими алкильными группами).
Здесь примеры атомов галогена включают атом хлора, атом брома, атом йода и атом фтора; примеры алкоксикарбонильной группы включают метоксикарбонильную группу, этоксикарбонильную группу и н-пропилоксикарбонильную группу; примеры низших алкильных групп (которые могут быть замещены атомами галогенов) включают линейные или разветвленные низшие C1 -C4 алкильные группы, такие как метилгруппа, этилгруппа, н-пропилгруппа, изопропилгруппа, н-бутилгруппа, изобутилгруппа, втор-бутилгруппа, трет-бутилгруппа, низшие алкильные группы (замещенные галогеном), такие как хлорметилгруппа, дифторметилгруппа, трифторметилгруппа, дифторхлорметилгруппа, пентафторэтилгруппа, 3,3,3-трифтор-н-пропил-группа.
Примеры низших алкоксигрупп (которые могут быть замещены атомами галогенов) включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, циклопропилоксигруппу, дифторметоксигруппу.
Примеры низших алкилтиогрупп (которые могут быть замещены атомами галогенов) включают метилтиогруппу, этилтиогруппу, н-пропилтиогруппу, изопропилтиогруппу, н-бутилтиогруппу, изобутилтиогруппу, втор-бутилтиогруппу, дифторметилтиогруппу, трифторметилтиогруппу и циклопропилтиогруппу.
Примеры низших алкилсульфонилгрупп (которые могут быть замещены атомами галогенов) включают метансульфонилгруппу, этансульфонилгруппу, н-пропансульфонилгруппу, изопропансульфонилгруппу, н-бутансульфонилгруппу, дифторметансульфонилгруппу и трифторметансульфонилгруппу.
Примеры арилгрупп (которые могут быть замещены атомами галогенов или низшими алкильными группами) включают фенилгруппу, 4-хлорфенилгруппу, 4-толилгруппу и 3-фторфенилгруппу.
Примеры арилоксигрупп (которые могут быть замещены атомами галогенов или низшими алкильными группами) включают феноксигруппу и 4-фторфеноксигруппу.
Примеры аминогрупп (которые могут быть замещены низшими алкильными группами) включают аминогруппу, метиламиногруппу, этиламиногруппу, н-пропиламиногруппу, изопропиламиногруппу, н-бутиламиногруппу, изобутиламиногруппу, втор-бутиламиногруппу, трет-бутиламиногруппу, диметиламиногруппу, диэтиламиногруппу, ди-н-пропиламиногруппу, ди-н-бутиламиногруппу, этилметиламиногруппу, метил-н-пропиламиногруппу, этил-н-пропиламиногруппу и циклопропиламиногруппу.
Положение замещения Х не ограничено, и n обозначает целое число в пределах от 0 до 3. Когда n равно 2 или 3, Х могут быть одинаковыми или различными. Предпочтительные примеры Х включают атом водорода, низшую C1-C3 алкильную группу, C1-C2 фторалкилгруппу и атом галогена, и наиболее предпочтительные примеры включают атом водорода, трифторметилгруппу, атом фтора и атом хлора.
Het А в общей формуле (1) обозначает 6-членную азотсодержащую ароматическую циклическую структуру, которая содержит 1 или 2 атома азота, или бензоконденсированную азотсодержащую циклическую структуру, которая может быть замещена 1 или 2 замещающими группами. Примеры 6-членных азотсодержащих ароматических циклических структур включают циклическую структуру пиридина, циклическую структуру пиримидина, циклическую структуру пиразина и циклическую структуру пиридазина; примеры бензоконденсированных азотсодержащих ароматических циклических структур включают циклическую структуру хинолина, циклическую структуру хиназолина и циклическую структуру хиноксалина.
Примеры замещающих групп на Het А включают атом галогена, низшую алкильную группу, низшую алкилтиогруппу, низшую алкилсульфонилгруппу, низшую алкоксигруппу, трифторметилгруппу и цианогруппу, и, более подробно, атомы галогенов могут включать атом хлора, атом брома, атом фтора; низшие алкильные группы могут включать линейные или разветвленные низшие алкильные группы, такие как метилгруппа, этилгруппа, н-пропилгруппа, изопропилгруппа, н-бутилгруппа, изобутилгруппа и втор-бутилгруппа; и примерами низших алкилтиогрупп являются линейные или разветвленные алкилтиогруппы, такие как метилтиогруппа, этилтиогруппа, н-пропилтиогруппа, изопропилтиогруппа, н-бутилтиогруппа, изобутилтиогруппа и втор-бутилтиогруппа.
Примеры низших алкилсульфонилгрупп включают линейные или разветвленные алкилсульфонилгруппы, такие как метансульфонилгруппа, этансульфонилгруппа, пропансульфонилгруппа, изопропансульфонилгруппа, бутансульфонилгруппа, изобутансульфонилгруппа и втор-бутансульфонилгруппа; и примеры низших алкоксигрупп включают линейные или разветвленные низшие алкоксигруппы, такие как метоксигруппа, этоксигруппа, н-бутоксигруппа, изобутоксигруппа и втор-бутоксигруппа.
Предпочтительным примером Het А является пиридин-2-илгруппа, и наиболее предпочтительные примеры Het А включают пиридин-2-илгруппу или 5-метилпиридин-2-илгруппу.
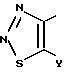
Het В в общих формулах (1) и (2) представлен следующими формулами:



(где Y обозначает атом водорода, атом галогена и низшую алкильную группу (которая может быть замещена атомом галогена)), и где Het В обозначает группу 1,2, 3-тиадиазол-4-ил, группу 1,2, 5-тиадиазол-3-ил или группу 1,2,5-оксадиазол-3-ил или их галогенированные производные, или производные, замещенные низшей алкильной группой (которая является замещенной галогеном или незамещенной).
Примеры атомов галогенов, представленных Y, включают атом фтора, атом хлора, атом брома; и примеры низших алкильных групп (которые могут быть замещены атомами галогенов) включают низшие C1-C4 алкильные группы, такие как метилгруппа, этилгруппа, н-пропилгруппа, изопропилгруппа, дифторметилгруппа и трифторметилгруппа, и наиболее предпочтительной группой является метилгруппа.
Het С в общей формуле (2) обозначает 5-членную азотсодержащую ароматическую циклическую структуру или бензоконденсированную азотсодержащую ароматическую циклическую структуру, которая содержит более чем один атом азота, которая может содержать атом серы или атом кислорода и которая может быть замещена более чем одной замещающей группой.
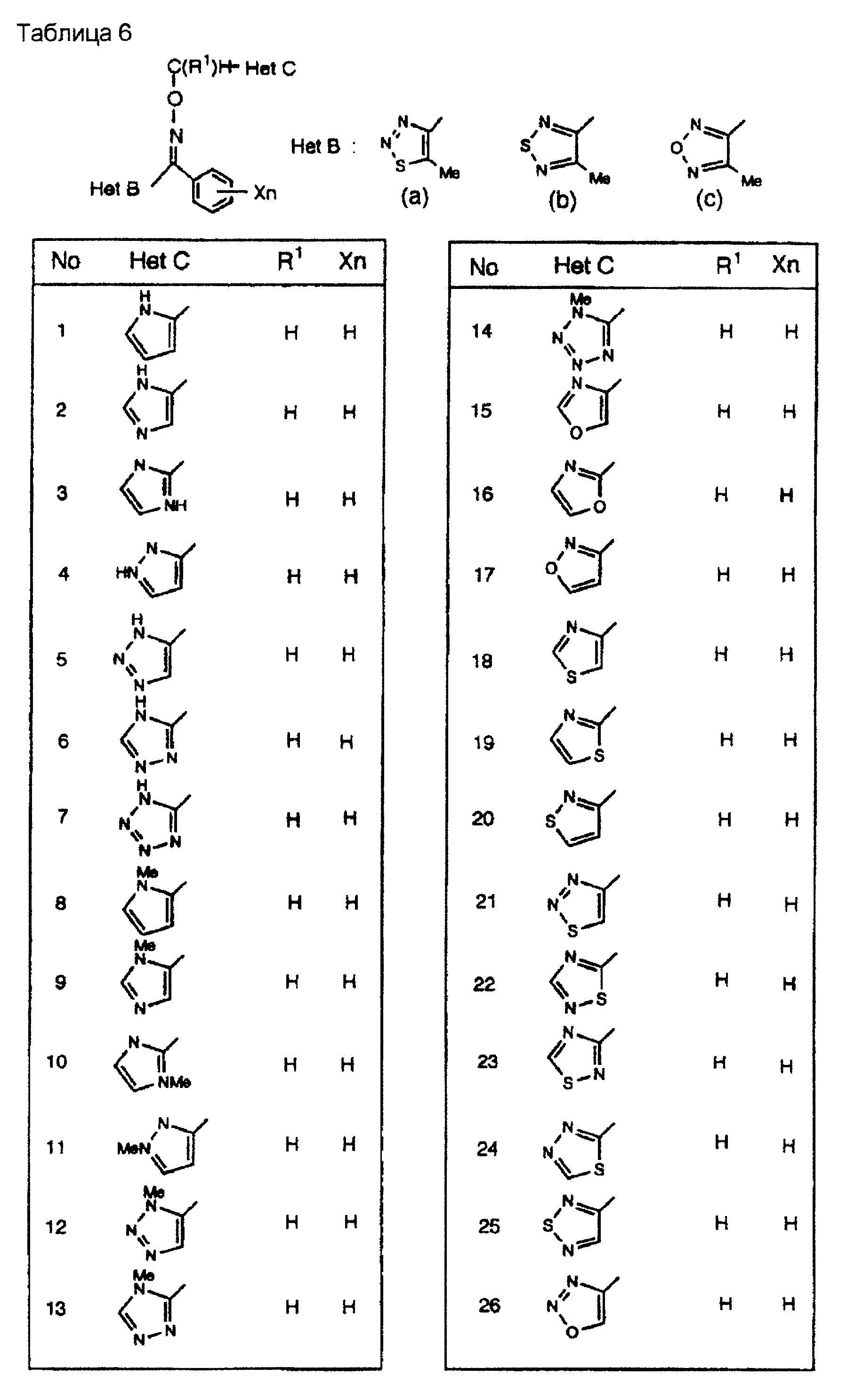
Примеры 5-членных азотсодержащих ароматических циклических структур включают циклическую структуру пиррола, циклическую структуру имидазола, циклическую структуру оксазола, циклическую структуру тиазола, циклическую структуру пиразола, циклическую структуру изоксазола, циклическую структуру изотиазола, циклическую структуру 1,2,3-триазола, циклическую структуру 1,2,4-триазола, циклическую структуру 1, 2,3-оксадиазола, циклическую структуру 1,2,4-оксадиазола, циклическую структуру 1,2,5-оксадиазола, циклическую структуру 1,3,4-оксадиазола, циклическую структуру 1,2,3-тиадиазола, циклическую структуру 1,2,4-тиадиазола, циклическую структуру 1,3,4-тиадиазола и циклическую структуру тетразола; и примеры их бензоконденсированных азотсодержащих ароматических циклических структур включают циклическую структуру бензимидазола, циклическую структуру бензоксазола, бензтиазола, имидазо[1,2-а]пиридина, циклическую структуру [1,2, 4]триазо[1,5-а]пиридина.
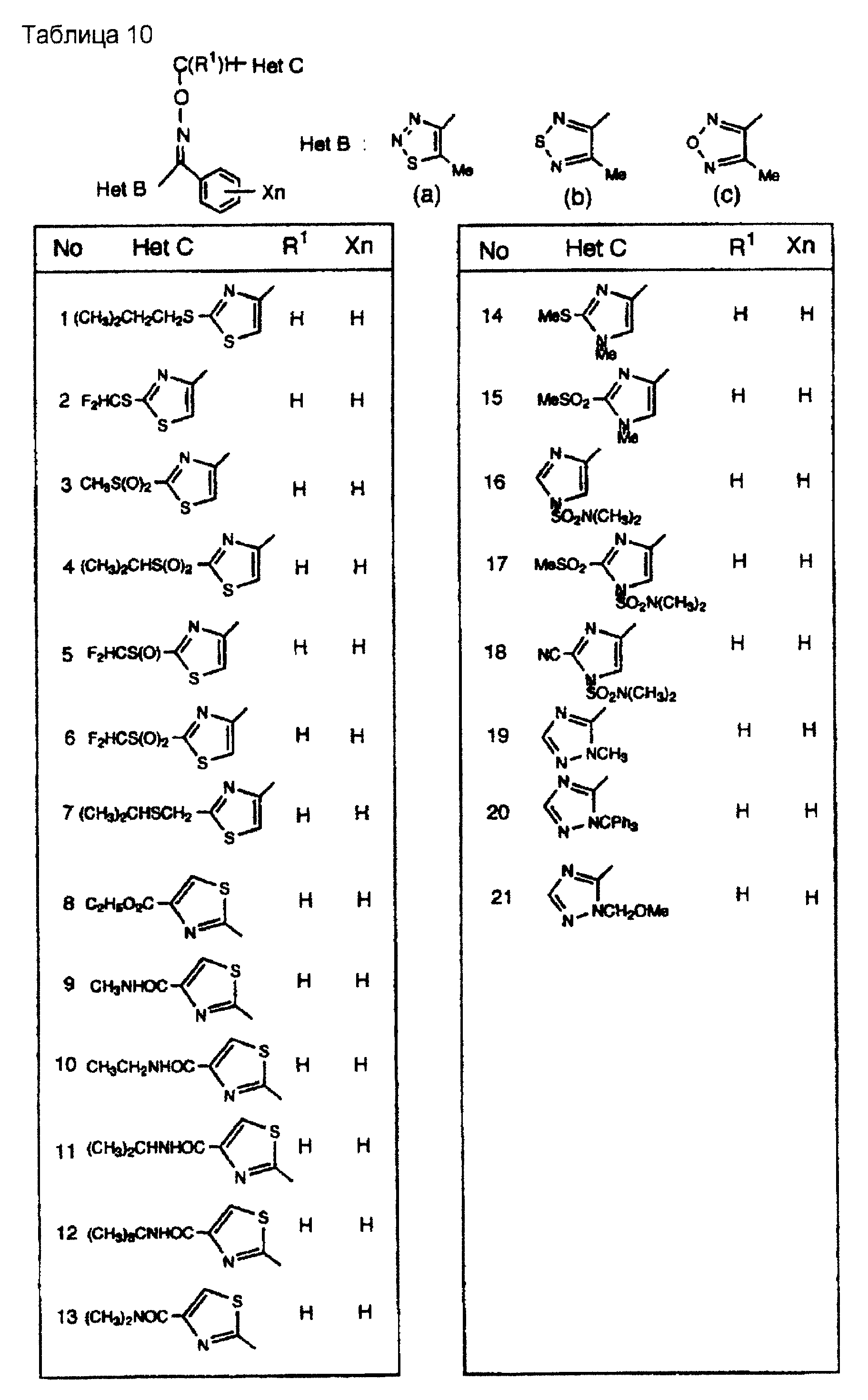
Примеры групп, способных замещать атом азота группы Het С, включают низшую алкильную группу, низшую алкилсульфонилгруппу, трифенилметилгруппу, низшую алкоксиметилгруппу и N,N-дизамещенную сульфамоилгруппу, замещенную низшими алкильными группами, где примеры низших алкильных групп включают метилгруппу, этилгруппу, н-пропилгруппу, изопропилгруппу, н-бутилгруппу, изобутилгруппу и втор-бутилгруппу; и примеры низшей алкилсульфонилгруппы включают метансульфонилгруппу, этансульфонилгруппу, н-пропансульфонилгруппу, изопропансульфонилгруппу, н-бутансульфонилгруппу и изобутансульфонилгруппу; примеры низшей алкоксиметилгруппы включают метоксиметилгруппу и этоксиметилгруппу; примеры N, N-дизамещенной сульфамоилгруппы, замещенной низшими алкильными группами, включают диметилсульфамоилгруппу и диэтилсульфамоилгруппу.
Примеры групп, которые способны замещать атом углерода группы Het С, включают атом галогена,
цианогруппу, C1-C6 алкильную группу (которая
может быть замещена атомами галогена), C3-C6 циклоалкилгруппу, С2-C6 алкенилгруппу,
C2-C6 алкинилгруппу, C1-C5
алкоксигруппу (которая может быть замещена атомами галогена), низшую алкилтиогруппу (которая может быть замещена атомами
галогена), низшую алкилсульфонилгруппу (которая может быть замещана атомами
галогена), низшую алкилсульфинилгруппу (которая может быть замещена атомами галогена) и аминогруппу (которая может быть
замещена низшими алкильными группами или C3-С6
циклоалкилгруппами) или трифторметилгруппой; и
группу, представленную формулой
-N(R2)С(=O)R3 (где R2 обозначает атом водорода или метилгруппу и R3 обозначает атом водорода, C1-С10 алкильную группу (которая может быть замещена атомами
галогена) (предпочтительно от C1 до С8), C3-С8 циклоалкилгруппу (предпочтительно от С3 до C6), С2-С6
алкенилгруппу, аралкилгруппу, низшую алкильную группу (замещенную аминогруппой), аралкилгруппу
(замещенную аминогруппой), низшую алкильную группу (замещенную ациламиногруппой), аралкилгруппу
(замещенную ациламиногруппой), низшую алкильную группу (замещенную алкоксикарбониламиногруппой),
аралкилгруппу (замещенную алкоксикарбониламиногруппой); и
атом галогена и низшую алкильную
группу (которая может быть замещена атомами галогенов, низшей алкоксигруппой, низшей алкилтиогруппой,
аминогруппой), арилгруппу (которая может быть замещена нитрогруппой или цианогруппой);
гетероарилгруппу, низшую алкоксигруппу, циклоалкоксигруппу, бензоилоксигруппу или арилоксигруппу); и
низшую алкоксикарбонилгруппу, карбамоилгруппу (которая может быть замещена низшими
алкильными группами), аминометилгруппу (которая может быть замещена низшими алкильными группами),
ациламинометилгруппу, N-алкоксикарбониламинометилгруппу, алкилтиометилгруппу и арилгруппу или
гетероарилгруппу (которая может быть замещена атомами галогенов).
На практике примеры атомов галогенов включают атом хлора, атом фтора и атом брома; примеры алкильных групп, которые могут быть замещены атомами галогенов, включают метилгруппу, этилгруппу, н-пропилгруппу, изопропилгруппу, н-бутилгруппу, изобутилгруппу, н-гексилгруппу, дифторметилгруппу и трифторметилгруппу; примеры С3-С6 циклоалкилгрупп включают циклопропилгруппу, циклопентилгруппу и циклогексилгруппу; и примеры С2-С6 алкенилгрупп включают винилгруппу, аллилгруппу, бутенилгруппу и гексенилгруппу.
Примеры C2-C6 алкинилгрупп включают этинилгруппу, пропаргилгруппу и бутинилгруппу; и примеры низших C1 -C5 алкоксигрупп (которые могут быть замещены атомами галогенов) включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, н-пентилоксигруппу, дифторметоксигруппу и трифторметоксигруппу.
Примеры низших алкилтиогрупп (которые могут быть замещены атомами галогенов) включают метилтиогруппу, этилтиогруппу, пропилтиогруппу, изопропилтиогруппу, бутилтиогруппу, изобутилтиогруппу, втор-бутилтиогруппу, дифторметилтиогруппу и трифторметилтиогруппу.
Примеры низших алкилсульфонилгрупп (которые могут быть замещены атомами галогенов) включают метансульфонилгруппу, этансульфонилгруппу, пропансульфонилгруппу, изопропансульфонилгруппу, бутансульфонилгруппу, дифторметансульфонилгруппу и трифторметансульфонилгруппу; и примеры низших алкилсульфинилгрупп (которые могут быть замещены атомами галогенов) включают дифторметансульфинилгруппу и трифторметансульфинилгруппу.
Примеры аминогрупп (которые могут быть замещены низшими С3-C6 алкильными группами или циклоалкилгруппами) включают аминогруппу, метиламиногруппу, этиламиногруппу, пропиламиногруппу, изопропиламиногруппу, бутиламиногруппу, изобутиламиногруппу, втор-бутиламиногруппу, диметиламиногруппу, диэтиламиногруппу, дипропиламиногруппу, дибутиламиногруппу, этилметиламиногруппу, метилпропиламиногруппу, этилпропиламиногруппу, циклопропиламиногруппу, циклопентиламиногруппу и циклогексиламиногруппу.
Примеры низших алкоксикарбонилгрупп включают метоксикарбонилгруппу, этоксикарбонилгруппу и пропоксикарбонилгруппу; примеры карбамоилгрупп (которые могут быть замещены низшими алкильными группами) включают N-метилкарбамоилгруппу, N-этилкарбамоилгруппу, N-изопропилкарбамоилгруппу и N,N-диэтилкарбамоилгруппу; и примеры аминометилгруппы (которая может быть замещена низшими алкильными группами) включают аминометилгруппу, N-метиламинометилгруппу, N-этиламинометилгруппу, N-пропиламинометилгруппу, N-изопропиламинометилгруппу, N-бутиламинометилгруппу, N, N-диметиламинометилгруппу и N, N-диэтиламинометилгруппу.
Примеры ациламинометилгрупп включают формиламинометилгруппу, ацетиламинометилгруппу, пропиониламинометилгруппу, бутириламинометилгруппу, изобутириламинометилгруппу, бензоиламинометилгруппу и N-ацетил-N-изопропиламинометилгруппу; примеры N-алкоксикарбониламинометилгрупп включают метоксикарбониламинометилгруппу, этоксикарбониламинометилгруппу, трет-бутоксикарбониламинометилгруппу и N-(трет-бутоксикарбонил)-N-изопропиламинометилгруппу; и примером алкиламинометилгруппы является изопропиламинометилгруппа.
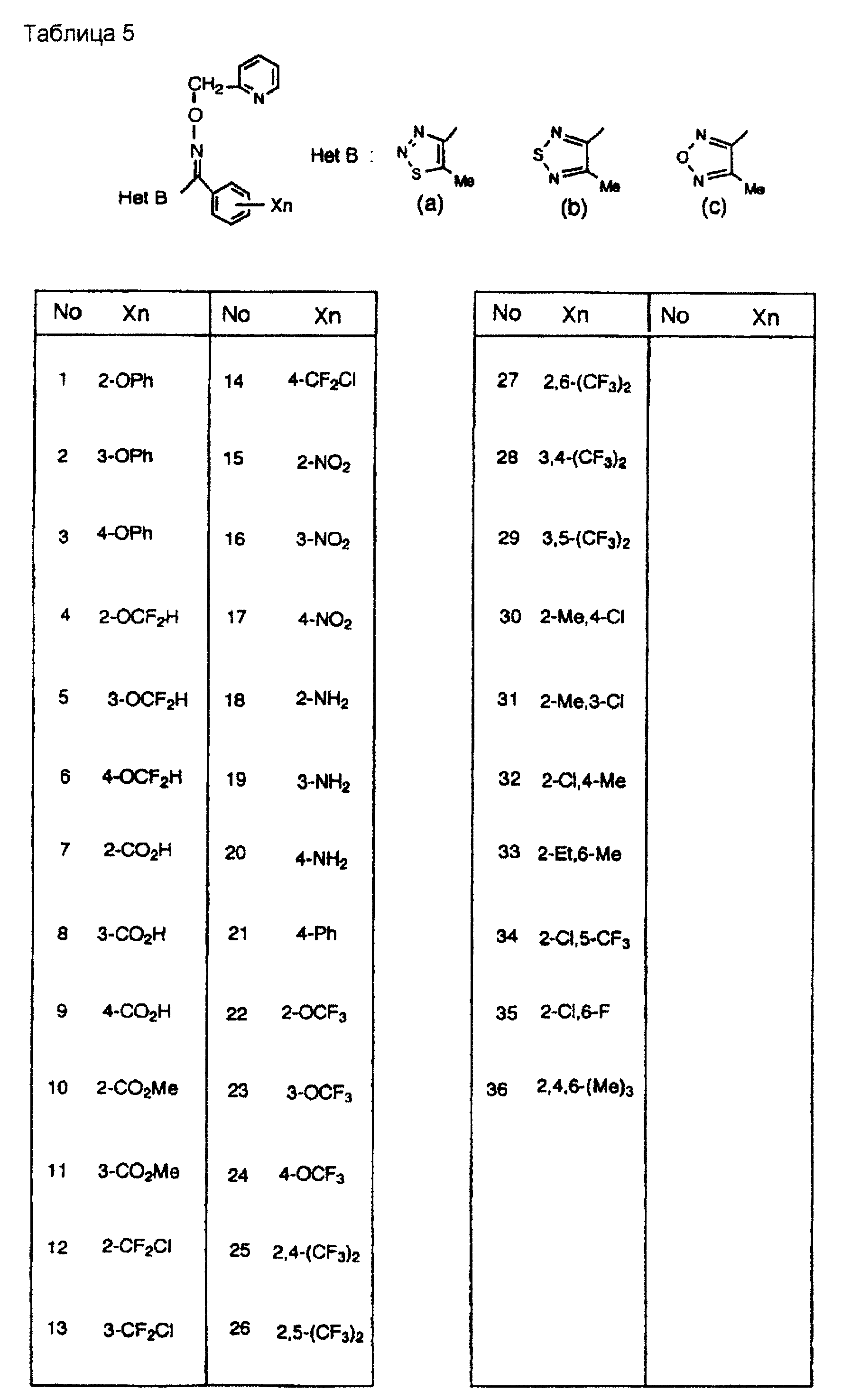
Примеры арилгрупп (которые могут быть замещены атомами галогена) включают фенилгруппу, 2-фторфенилгруппу, 3-фторфенилгруппу, 4-фторфенилгруппу, 2-хлорфенилгруппу, 3-хлорфенилгруппу, 4-хлорфенилгруппу, 2,4-дихлорфенилгруппу, 3,4-дихлорфенилгруппу, 2,6-дихлорфенилгруппу, нафтилгруппу и бифенилгруппу; и примеры гетероарилгрупп включают группу пиридин-2-ил, группу пиридин-4-ил, группу пиридин-3-ил, 2-фурилгруппу, 3-фурилгруппу, 2-тиенилгруппу, 3-тиенилгруппу, хиноилгруппу, индолилгруппу, бензофуранилгруппу, бензтиенилгруппу, бензтиазолилгруппу, бензизоксазолилгруппу и бензизотиазолилгруппу.
На практике примеры R3 в группе -N(R2)С(=O)R3 представляют две группы, одной из которых являются C1 -C10 алкильными группы (которые могут быть замещены атомами галогенов) (предпочтительно от C1 до С8), включая метилгруппу, этилгруппу, н-пропилгруппу, изопропилгруппу, трет-бутилгруппу, н-бутилгруппу, изобутилгруппу, втор-бутилгруппу, н-пентилгруппу, 1-этилпропилгруппу, н-децилгруппу, хлорметилгруппу, трифторметилгруппу, трихлорметилгруппу, 1-бромизопропилгруппу, хлордифторметилгруппу и 1-хлорметил-1-метилэтилгруппу; а другая представлена С3-С8 циклоалкилгруппами (предпочтительно от С3 до C6), включая циклопропилгруппу, циклобутилгруппу, циклопентилгруппу и циклооктилгруппу.
Примеры С2-С6 алкенилгрупп включают винилгруппу, аллилгруппу, бутенилгруппу и гексенилгруппу; примеры C2-C4 алкинилгрупп включают этинилгруппу, пропаргилгруппу и бутинилгруппу; примеры аралкилгрупп включают бензилгруппу, 2-фенилэтилгруппу; низшие алкильные группы (замещенные аминогруппой) включают аминометилгруппу и 1-аминоизобутилгруппу; примером аралкилгрупп (замещенных аминогруппой) является группа 1-амино-2-фенилэтил и т.д.; и примеры низших алкильных групп (замещенных ациламиногруппой) включают ацетиламинометилгруппу и 1-ацетиламиноизобутилгруппу.
Примером аралкилгруппы (замещенной ациламиногруппой) является группа 1-ацетиламино-2-фенил; примеры низших алкильных групп (замещенных алкоксикарбониламиногруппой) включают трет-бутоксикарбониламинометилгруппу и 1-(трет-бутоксикарбониламино)изобутилгруппу; и примером аралкилгруппы (замещенной алкоксикарбониламиногруппой) является 1-(бензилоксикарбониламино)-2-фенилэтилгруппа.
Примеры арилгрупп (которые могут быть замещены атомами галогенов, низшими алкильными группами (которые могут быть замещены атомами галогенов), низшей алкилтиогруппой, аминогруппой, нитрогруппой или цианогруппой) включают фенилгруппу, 2-фторфенилгруппу, 3-фторфенилгруппу, 4-фторфенилгруппу, 2-хлорфенилгруппу, 3-хлорфенилгруппу, 4-хлорфенилгруппу, 2,4-дихлорфенилгруппу, 3,4-дихлорфенилгруппу, 2,6-дихлорфенилгруппу, 4-метилфенилгруппу, 2-метилфенилгруппу, 2, 4-диметилфенилгруппу, 4-трифторметилфенилгруппу, 2-метоксифенилгруппу, 3-метоксифенилгруппу, 4-метоксифенилгруппу, 2-метилтиофенилгруппу, 4-аминофенилгруппу, 4-ацетиламинофенилгруппу, 2-цианофенилгруппу, 3-цианофенилгруппу, 4-цианофенилгруппу, 4-нитрофенилгруппу и нафтилгруппу.
Примеры гетероарилгрупп включают 2-фурилгруппу, 2-тиенилгруппу, группу пиридин-4-ил, группу пиридин-2-ил, группу тиазол-4-ил, группу оксазол-4-ил, группу пиразол-3-ил, группу имидазол-4-ил, группу изотиазол-5-ил, группу изоксиазол-5-ил, пиразинилгруппу, группу пиримидин-2-ил, группу пиридазин-3-ил, группу (1,2,3-тиадиазол)-4-ил, группу (1,2,5-тиадиазол)-3-ил, фуразанил, группу бензотиазол-2-ил, группу бензимидазол-2-ил, группу хинолин-2-ил, группу изохинолин-2-ил и группу хиноксалин-2-ил.
Примеры низших алкоксигрупп включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, бутоксигруппу, трет-бутоксигруппу и 1-этилпропоксигруппу; примеры С3-С6 циклоалкоксигрупп включают циклопропилоксигруппу, циклопентилоксигруппу и циклогексилоксигруппу; и примером арилоксигруппы является феноксигруппа. Замещающих групп, которые способны замещать атом азота и атом углерода на Het С, может быть две или более.
Предпочтительными примерами Het С являются группы, такие как группа тиазол-2-ил (которая может быть замещенной) и группа тиазол-4-ил (которая может быть замещенной). Наиболее предпочтительными примерами являются группы, такие как группа тиазол-2-ил, группа тиазол-4-ил, группа 2-аминотиазол-4-ил, группа 2-ациламинотиазол-4-ил, группа 2-алкоксикарбониламинотиазол-4-ил, группа 2-алкокситиазол-4-ил, группа 2-алкилтиотиазол-4-ил, группа 2-алкилсульфинилтиазол-4-ил, группа 2-алкилсульфонилтиазол-4-ил, группа 2-арилтиазол-4-ил и группа 2-бромтиазол-4-ил.
Существуют две жесткие структуры, т.е. форма "Е" и форма "Z" в оксимных фрагментах производных оксима, представленных общими формулами (1) и (2). Жесткие структуры обеих форм "Е" и "Z" включены в объем данного изобретения. Как правило, синтезированные продукты производных оксима включают обе формы в виде смесей, и их можно выделить путем процессов разделения и очистки.
Хотя форма "Z" производного оксима является более эффективной в качестве химиката для борьбы с болезнью растения, чем форма "Е", форма "Z" постепенно меняется на форму "Е" при обычных условиях, и соотношение между формами "Е" и "Z" стабилизируется на уровне постоянного соотношения. Постоянное соотношение между формами "Е" и "Z" варьируется в зависимости от различных типов производных оксима.
Производные оксима данного изобретения, которые представлены общими формулами (1) и (2), могут быть получены, например, следующими способами (способ получения А см. в конце описания). Однако следует понимать, что способы получения производных оксима данного изобретения не ограничиваются способами, описанными в следующих примерах получения.
Производное оксима, представленное общими химическими формулами (1) или (2), получают путем следующих стадий: получения гидроксииминосоединения (b) путем взаимодействия соединения азол-метанона (а) с гидроксиламином, и взаимодействия полученного гидроксииминосоединения с галогенированными соединениями (с) или (d) в присутствии солей (таких как гидрид натрия, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, карбонат цезия, триэтиламин, пиридин, N, N-диметиламинопиридин). В качестве способа синтеза соединения азол-метанона применим способ, описанный, например, в "Synthesis", с. 976 (1982).
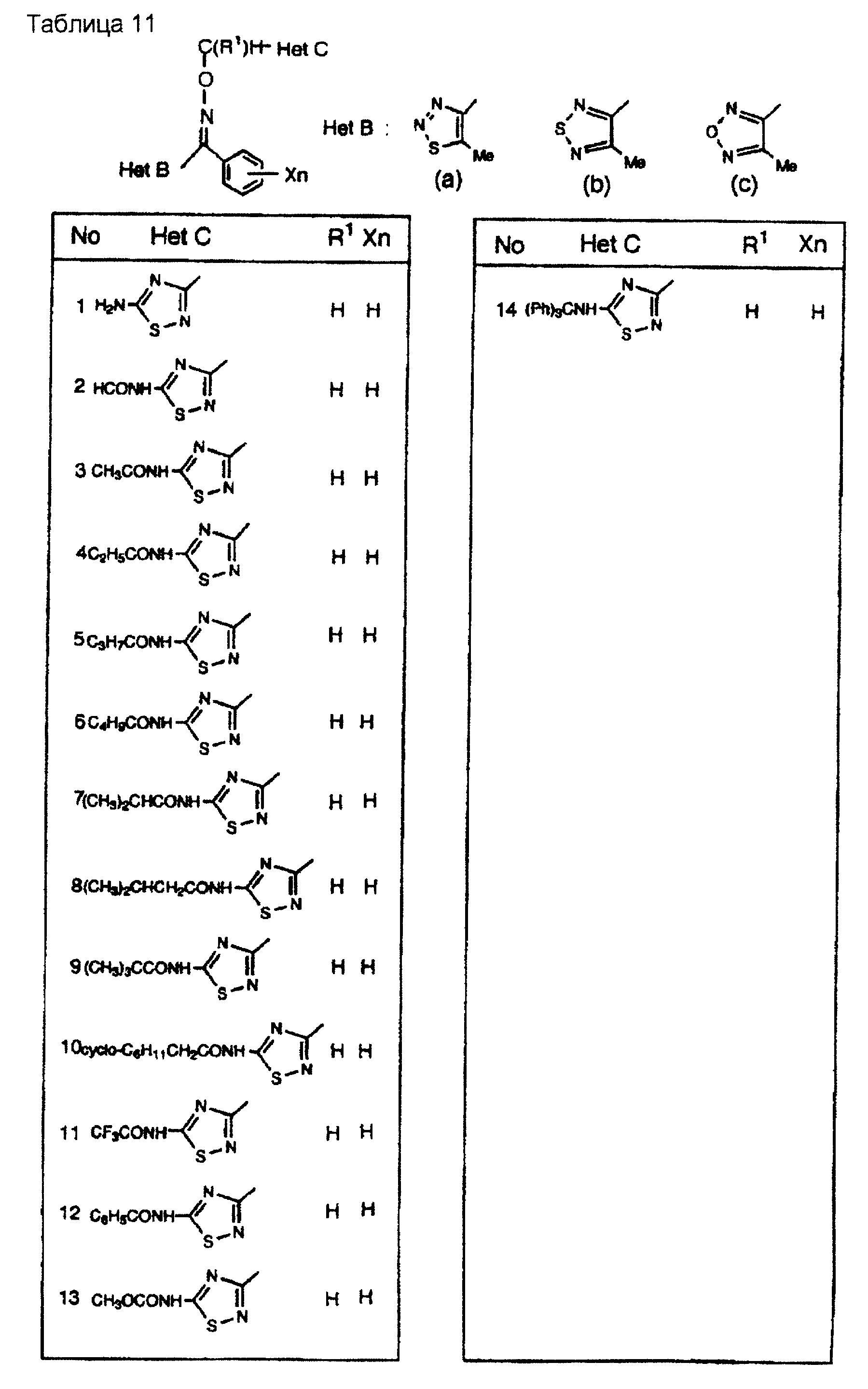
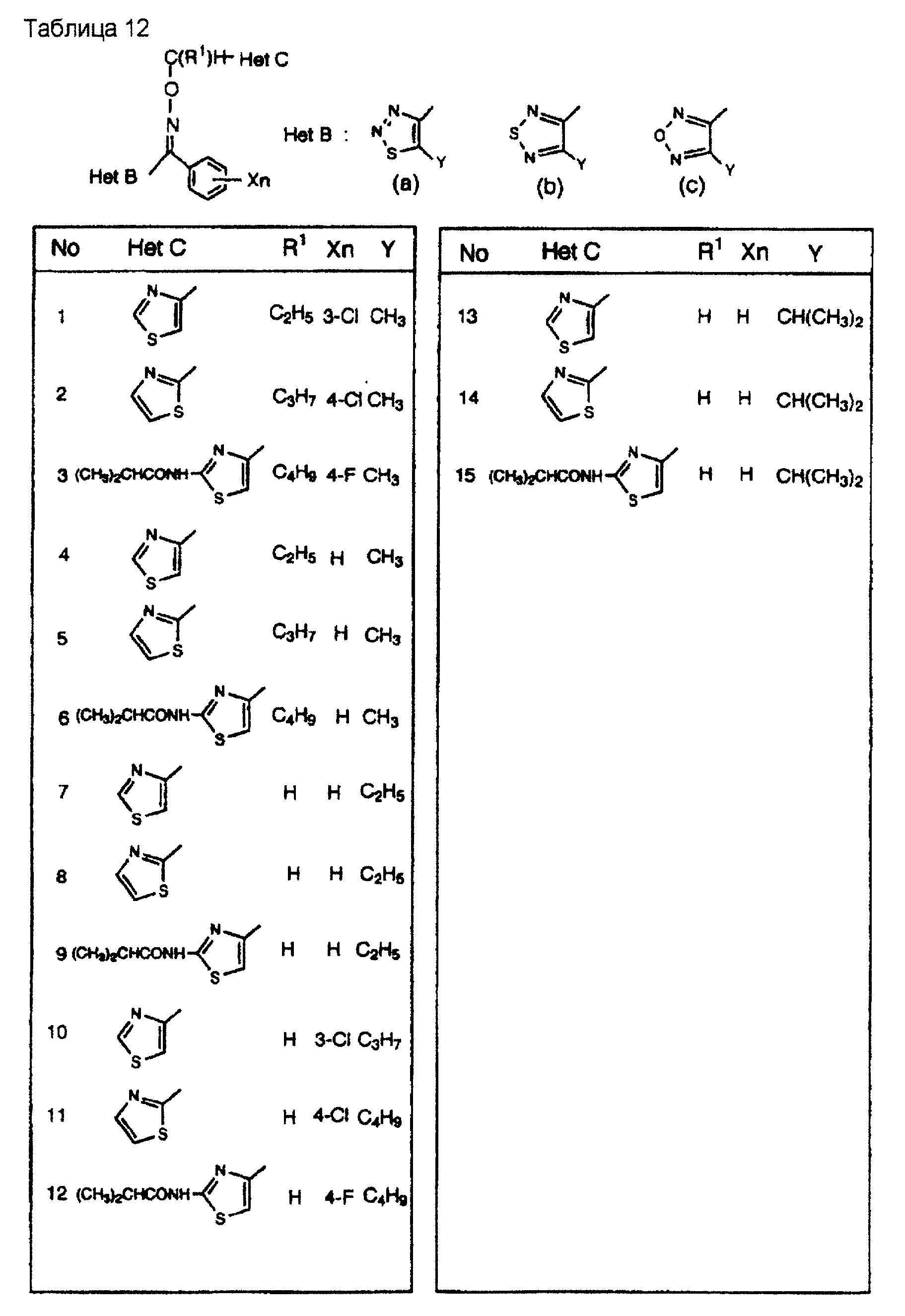
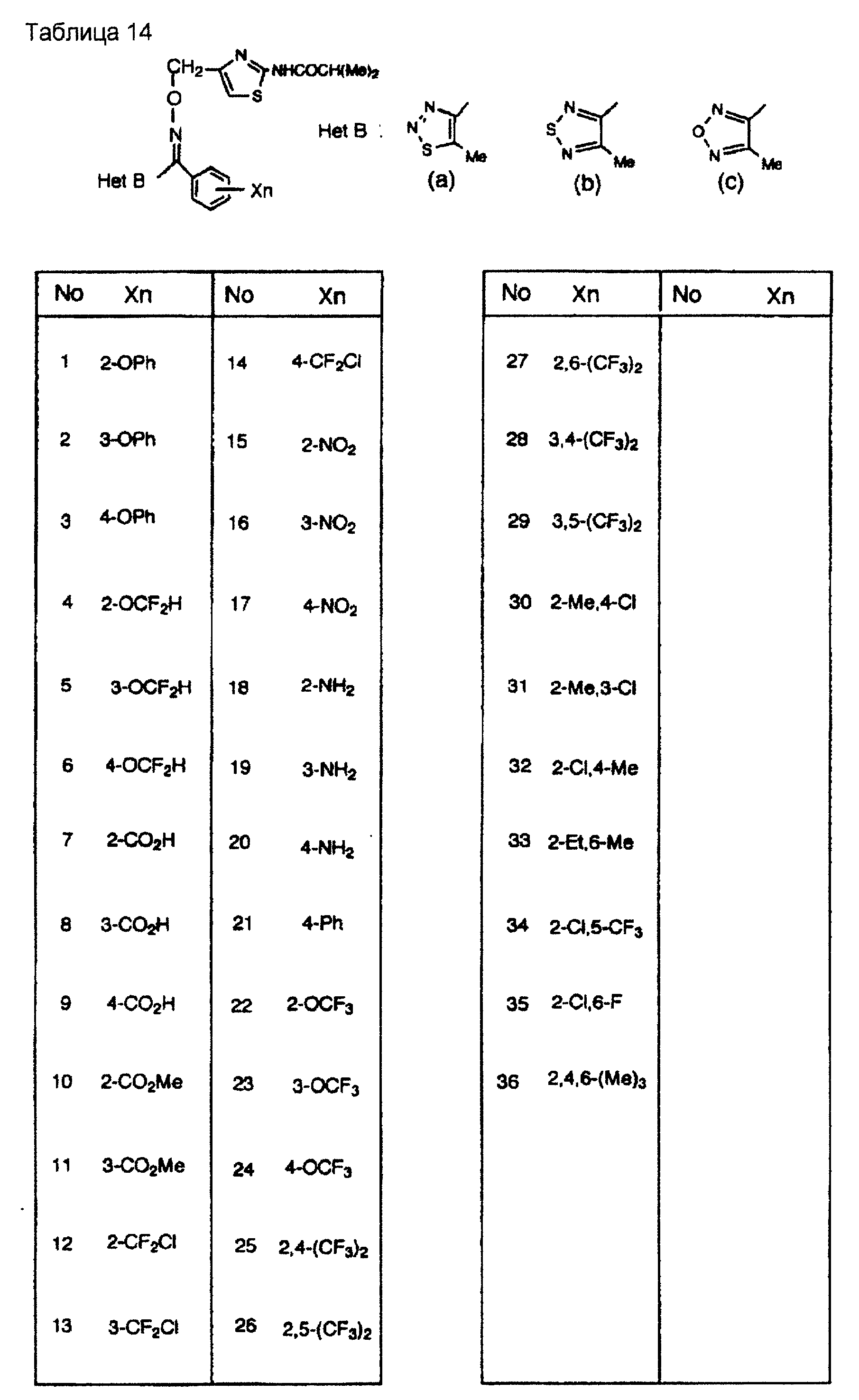
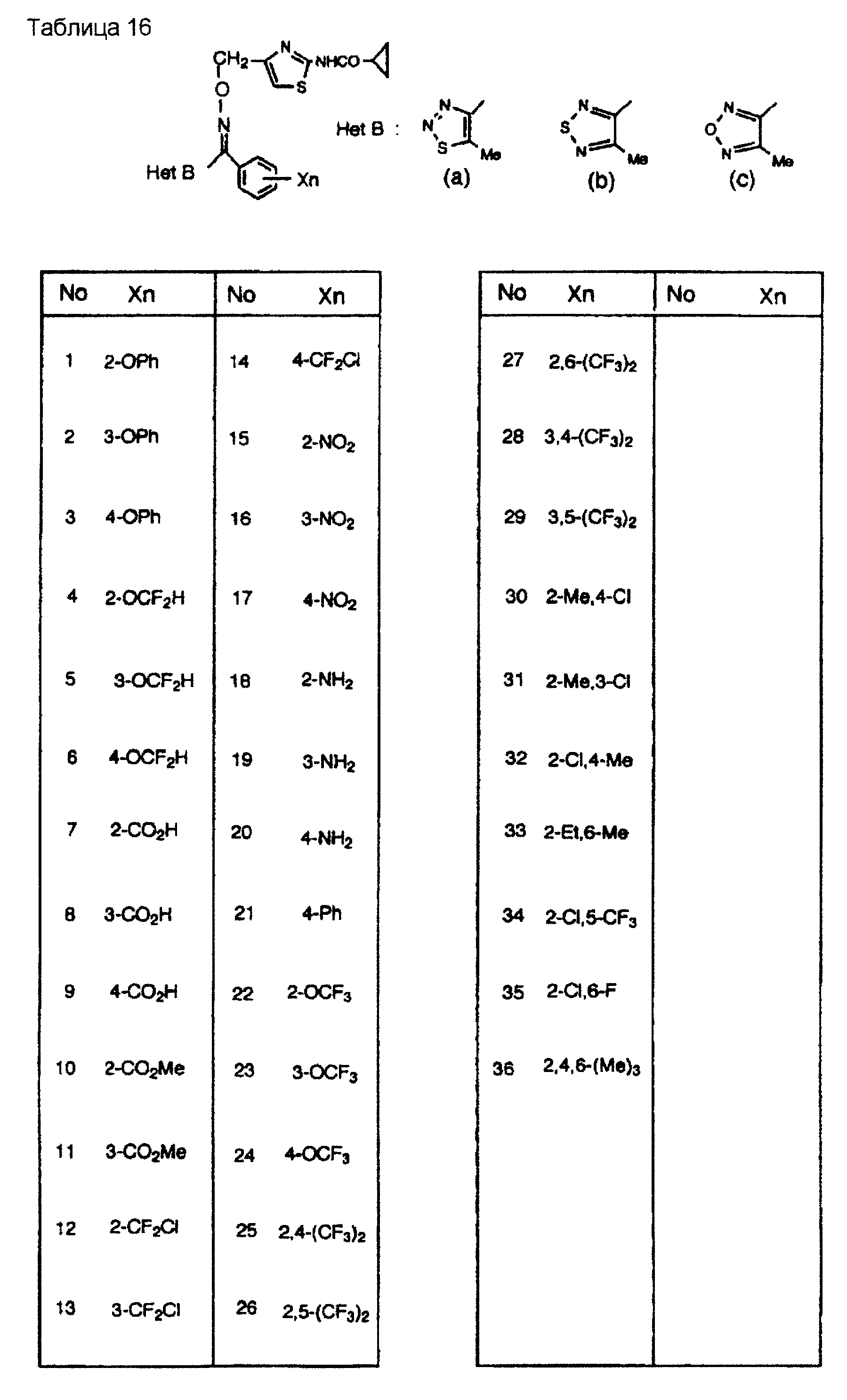
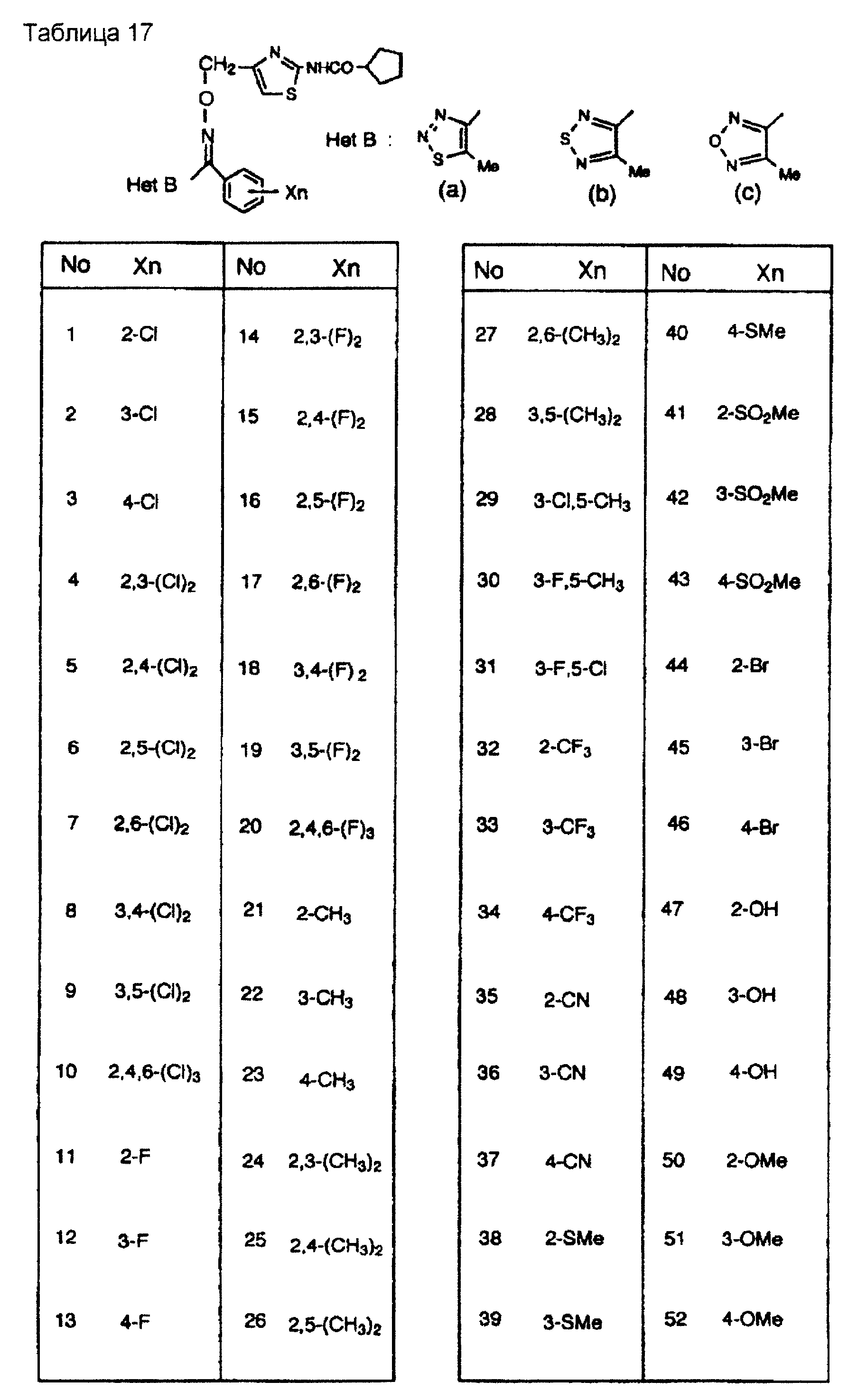
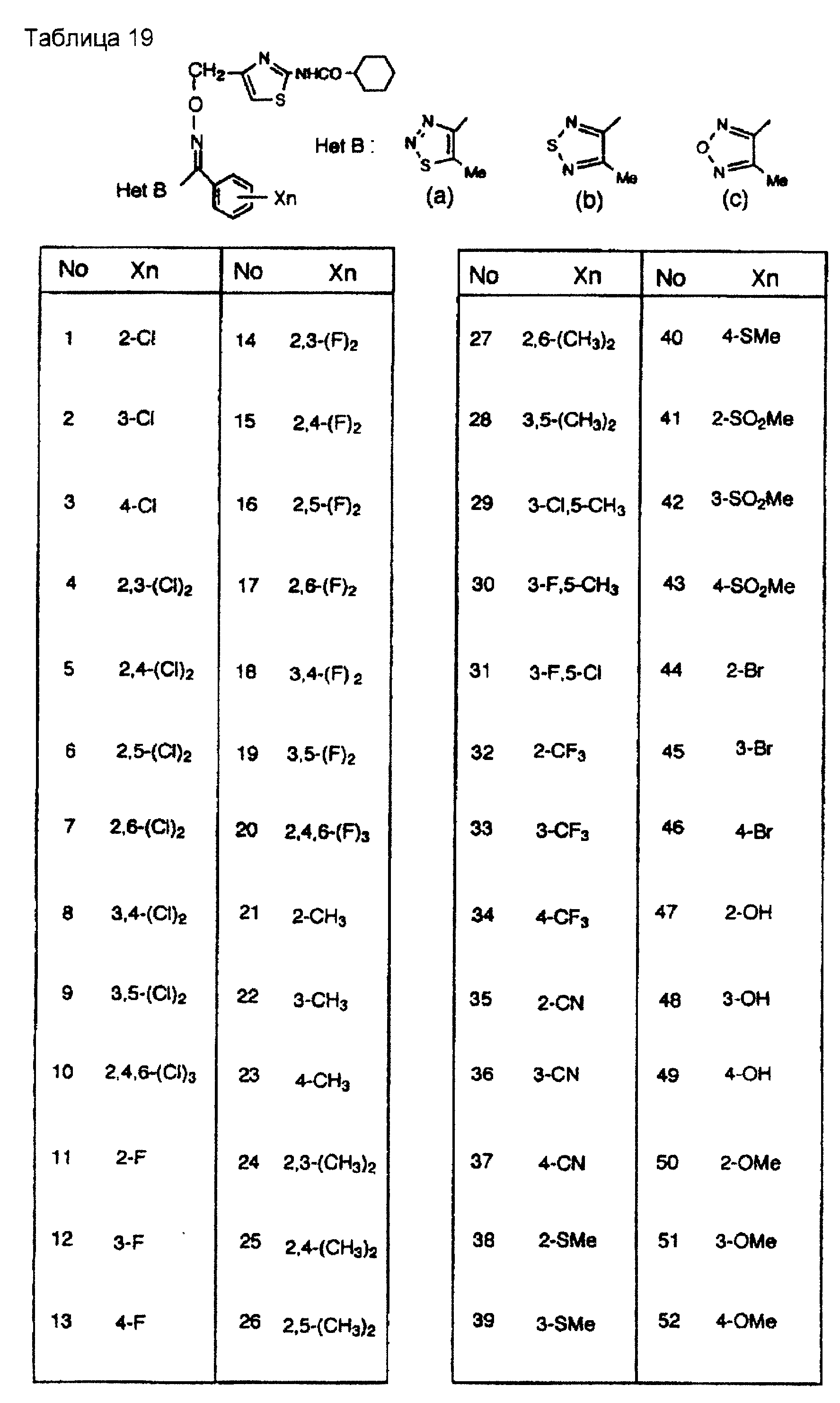
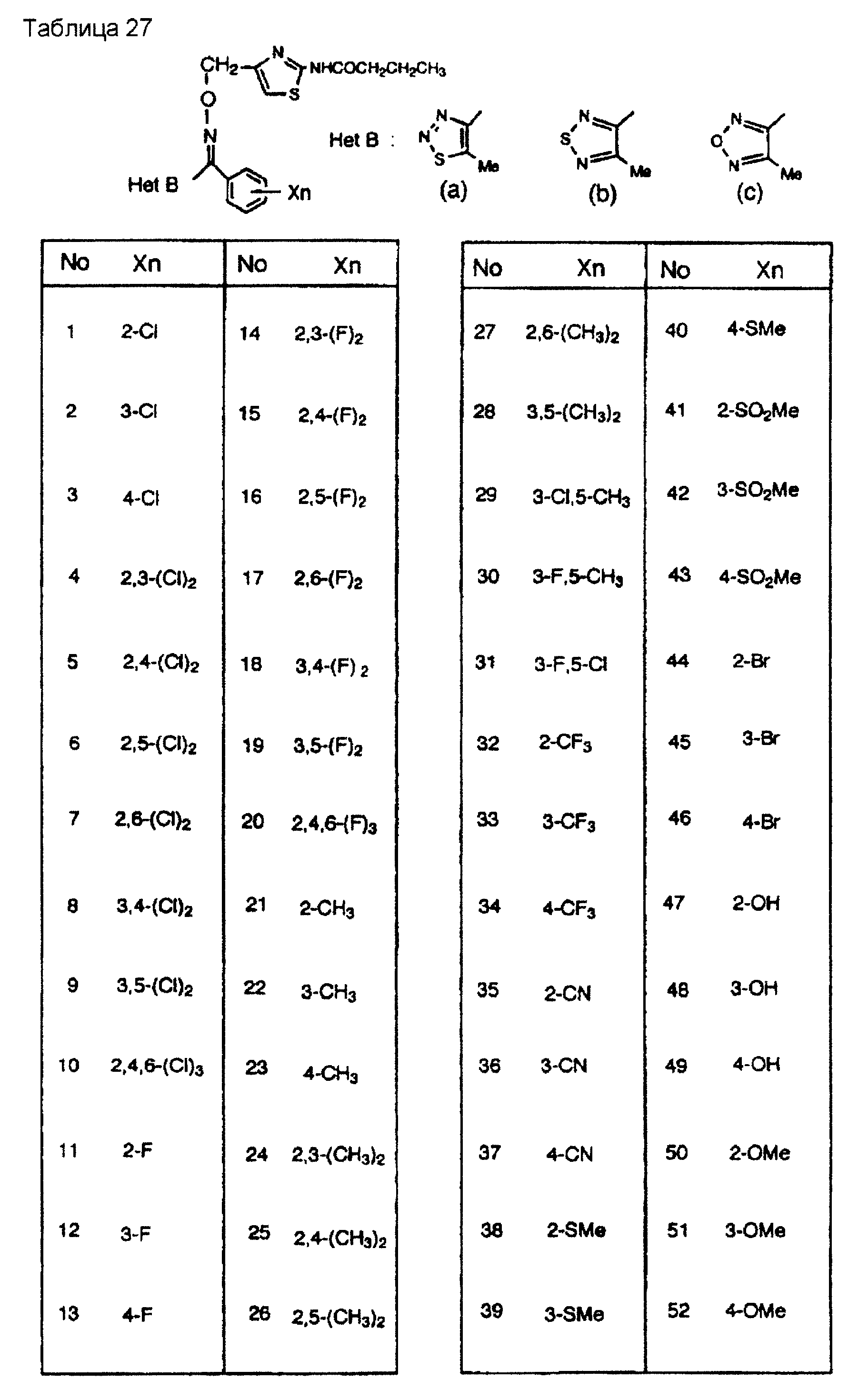
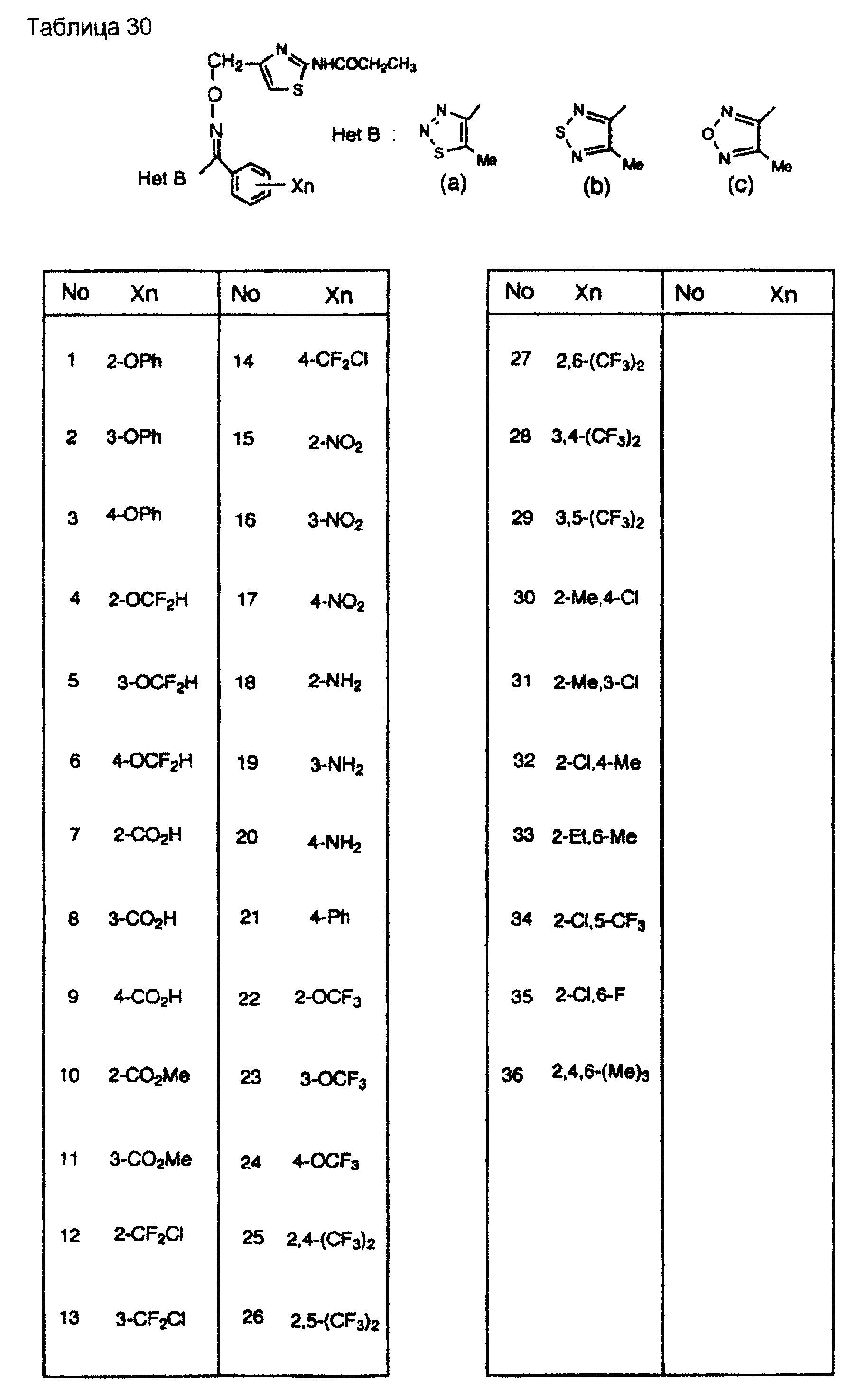
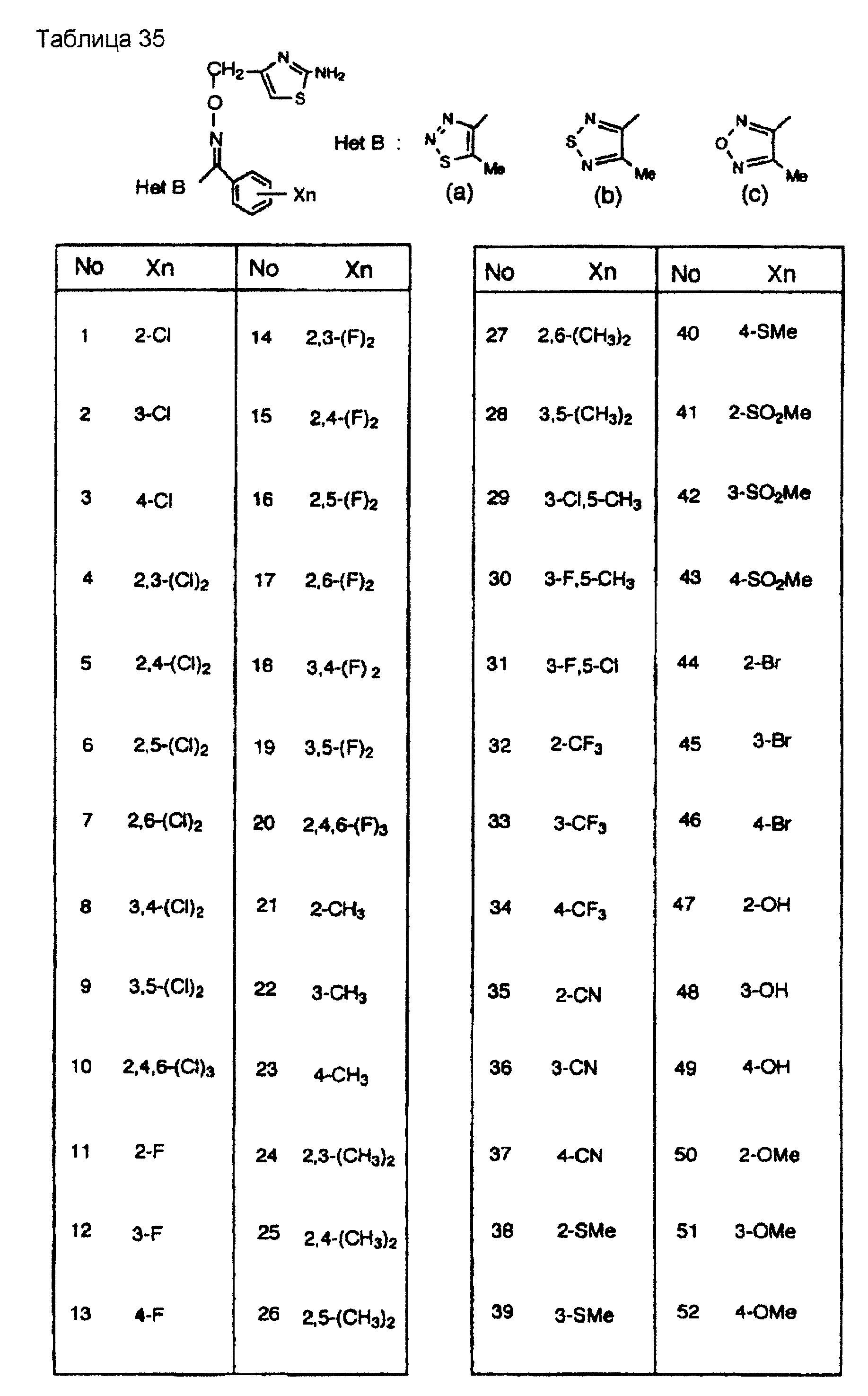
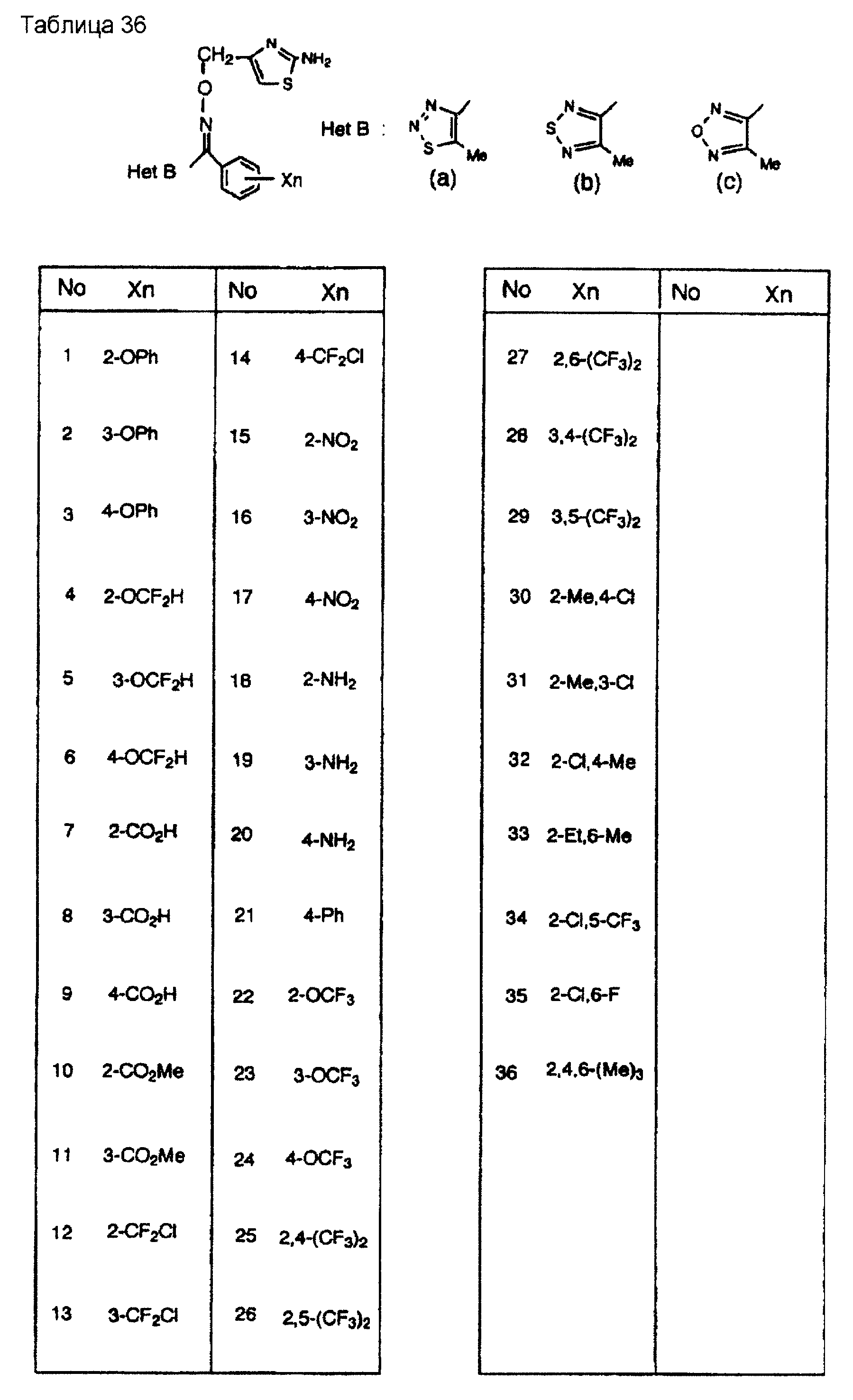
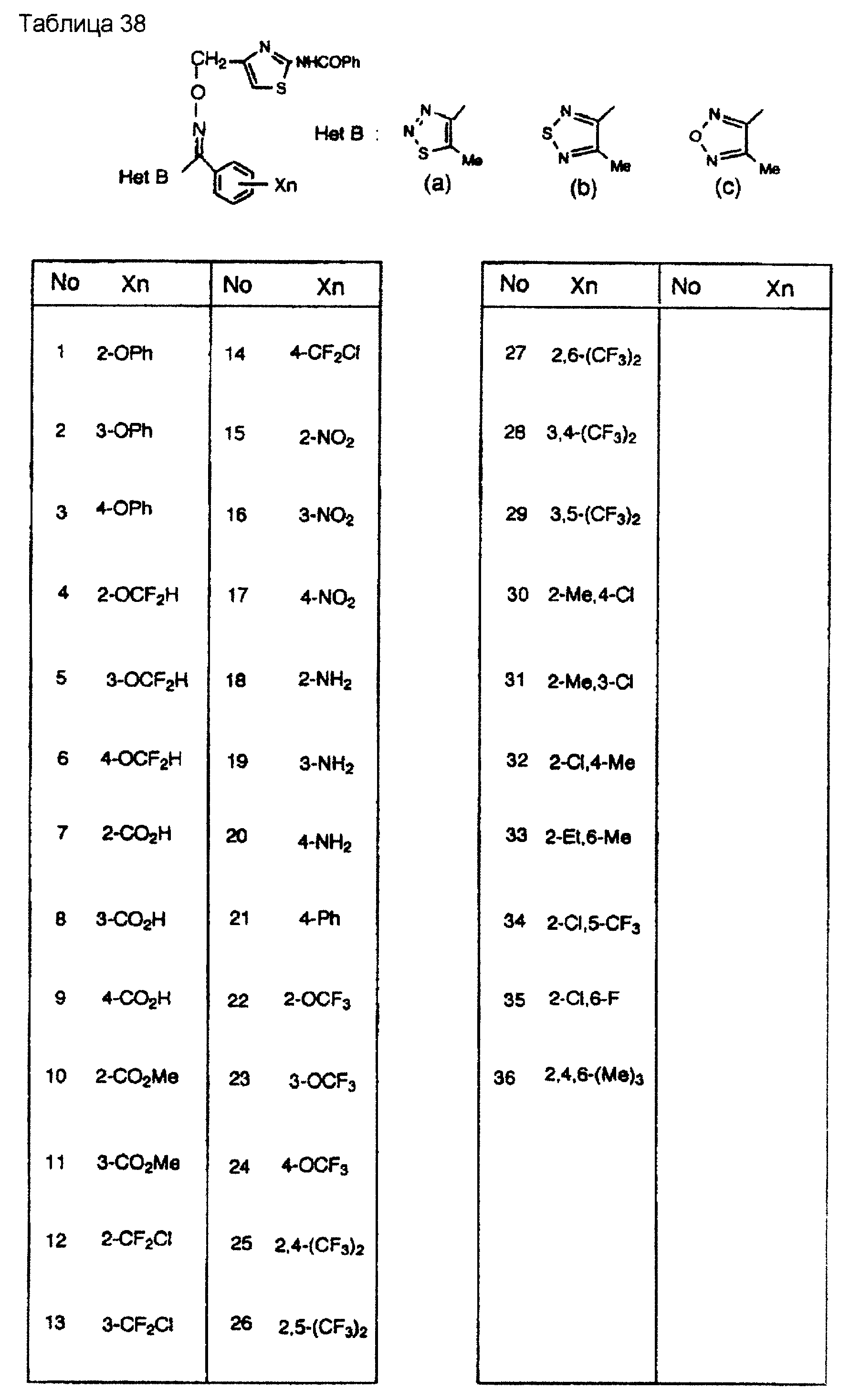
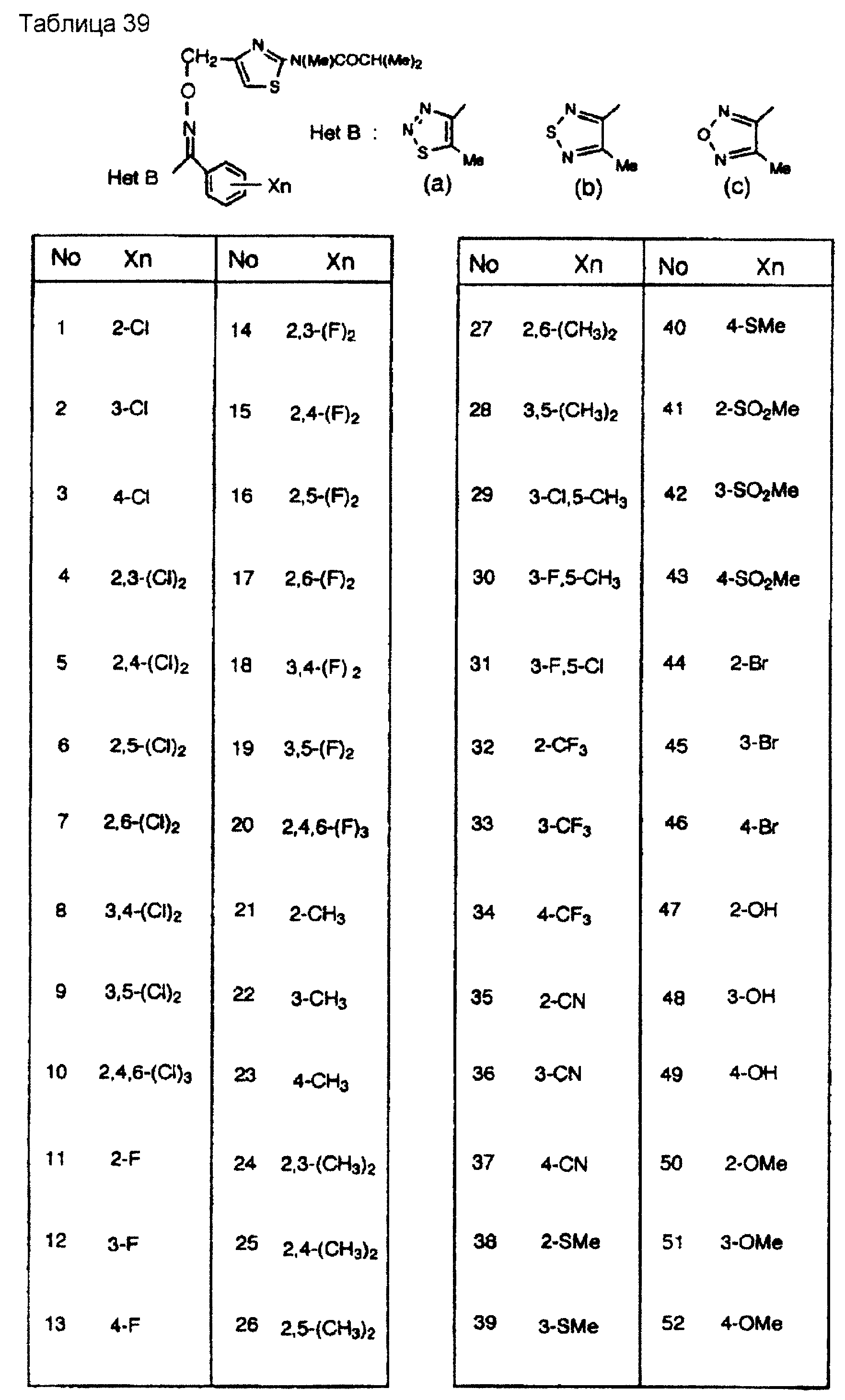
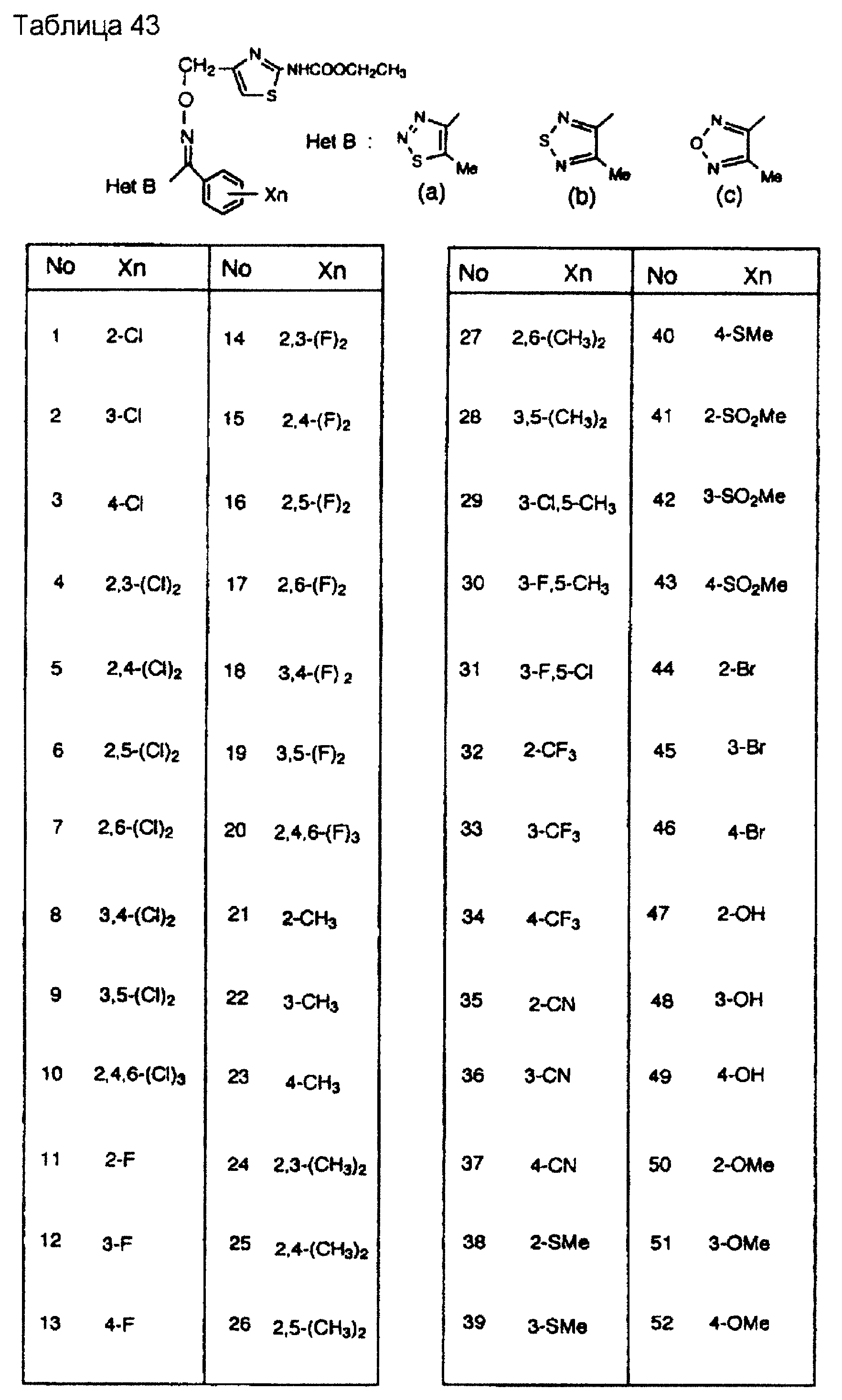
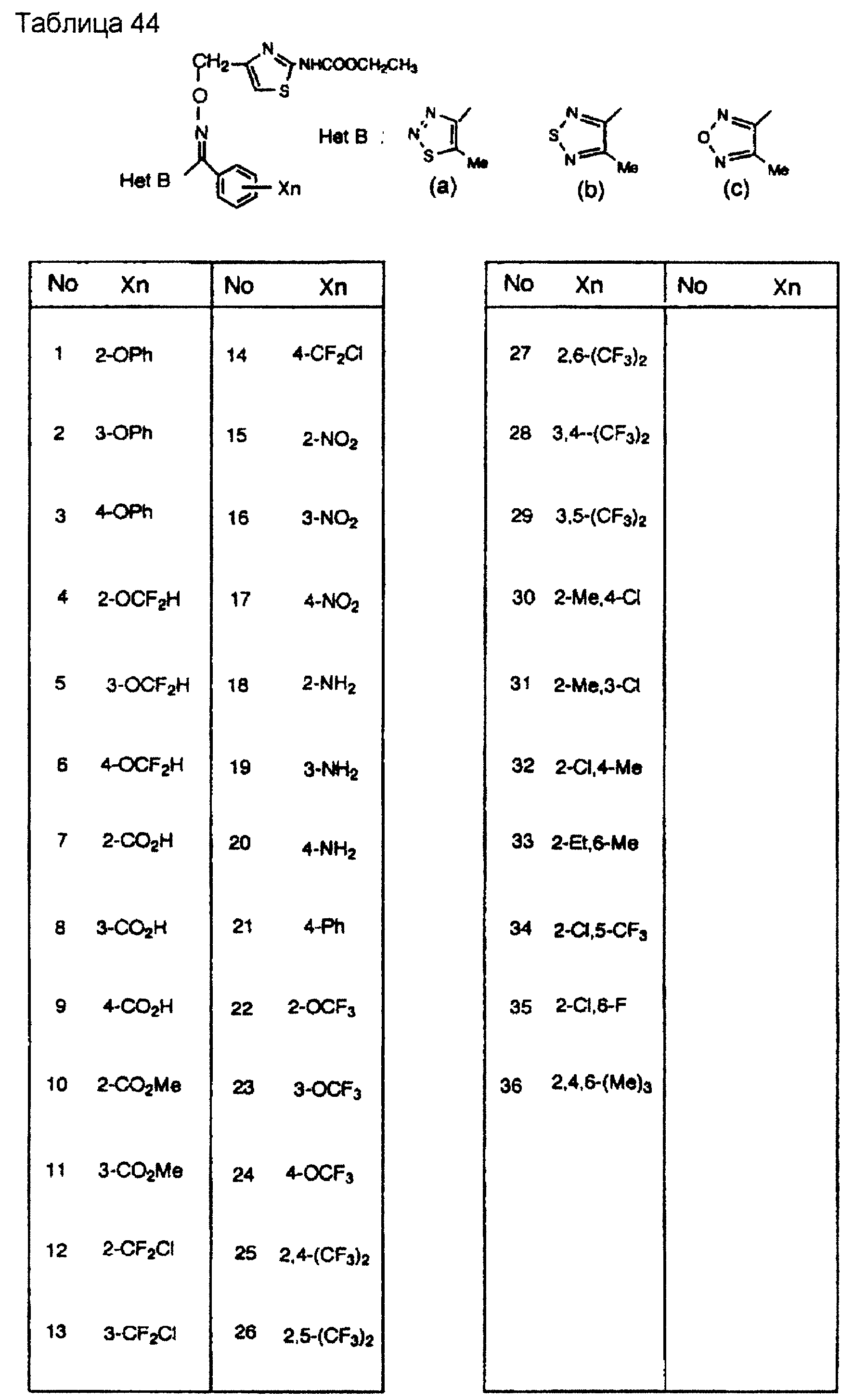
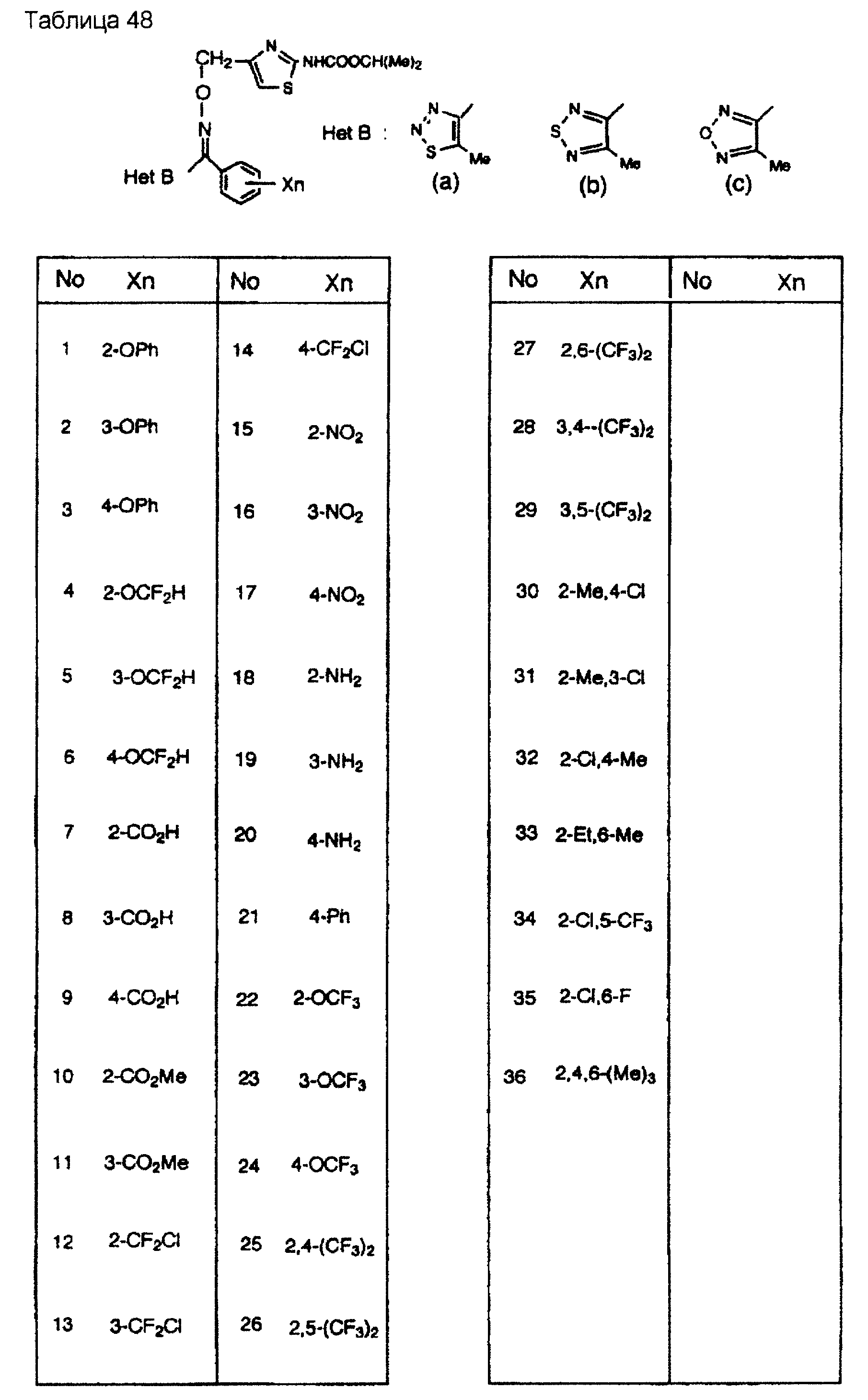
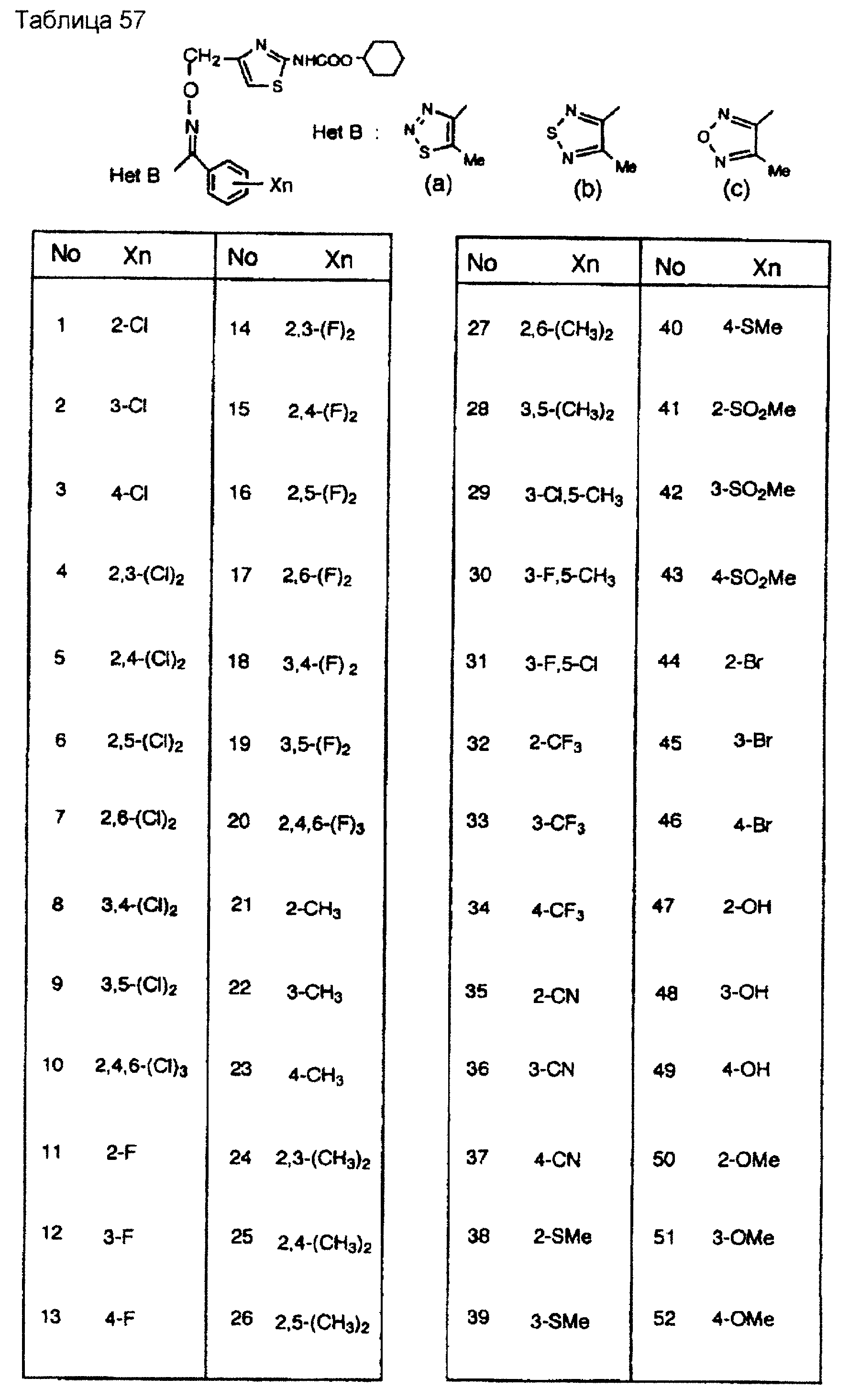
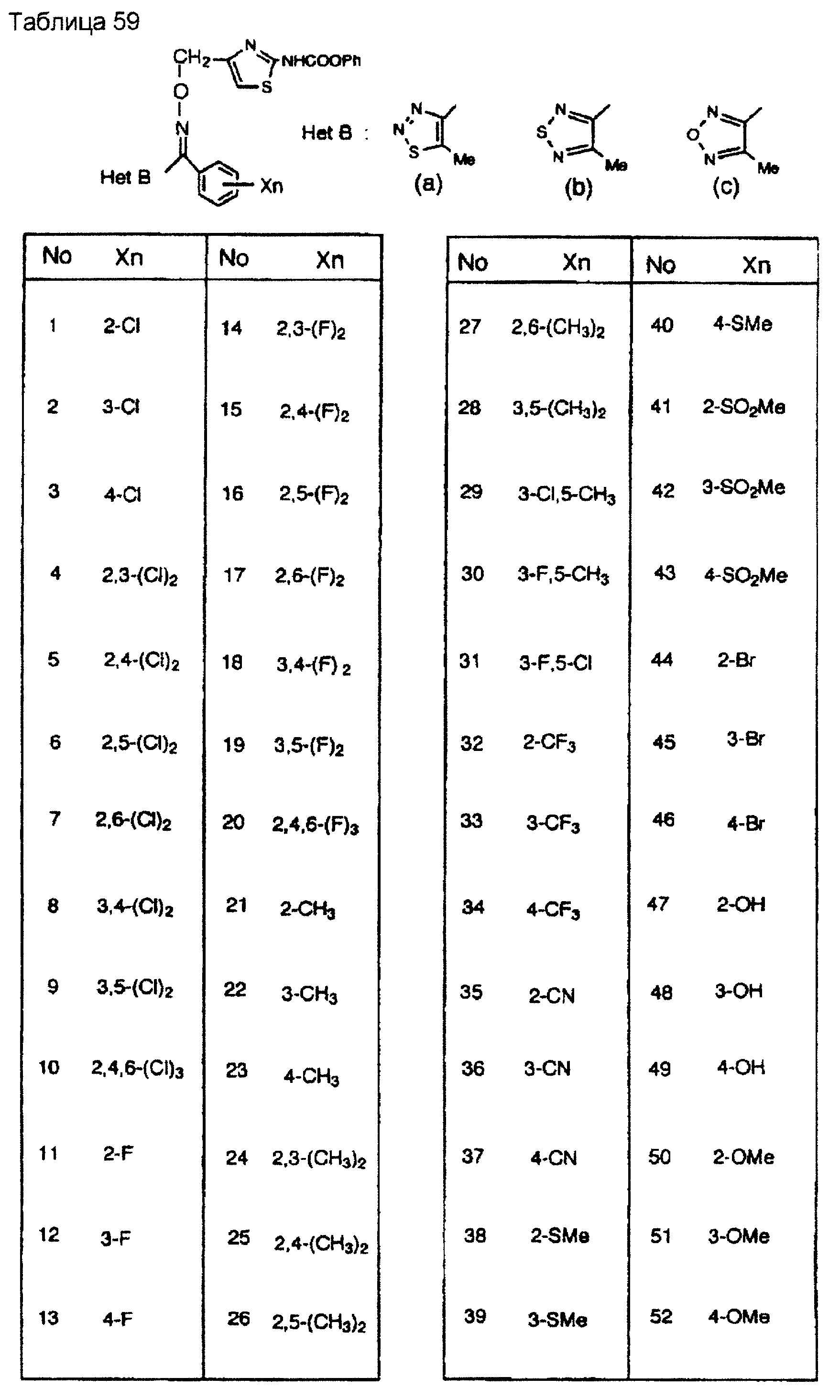
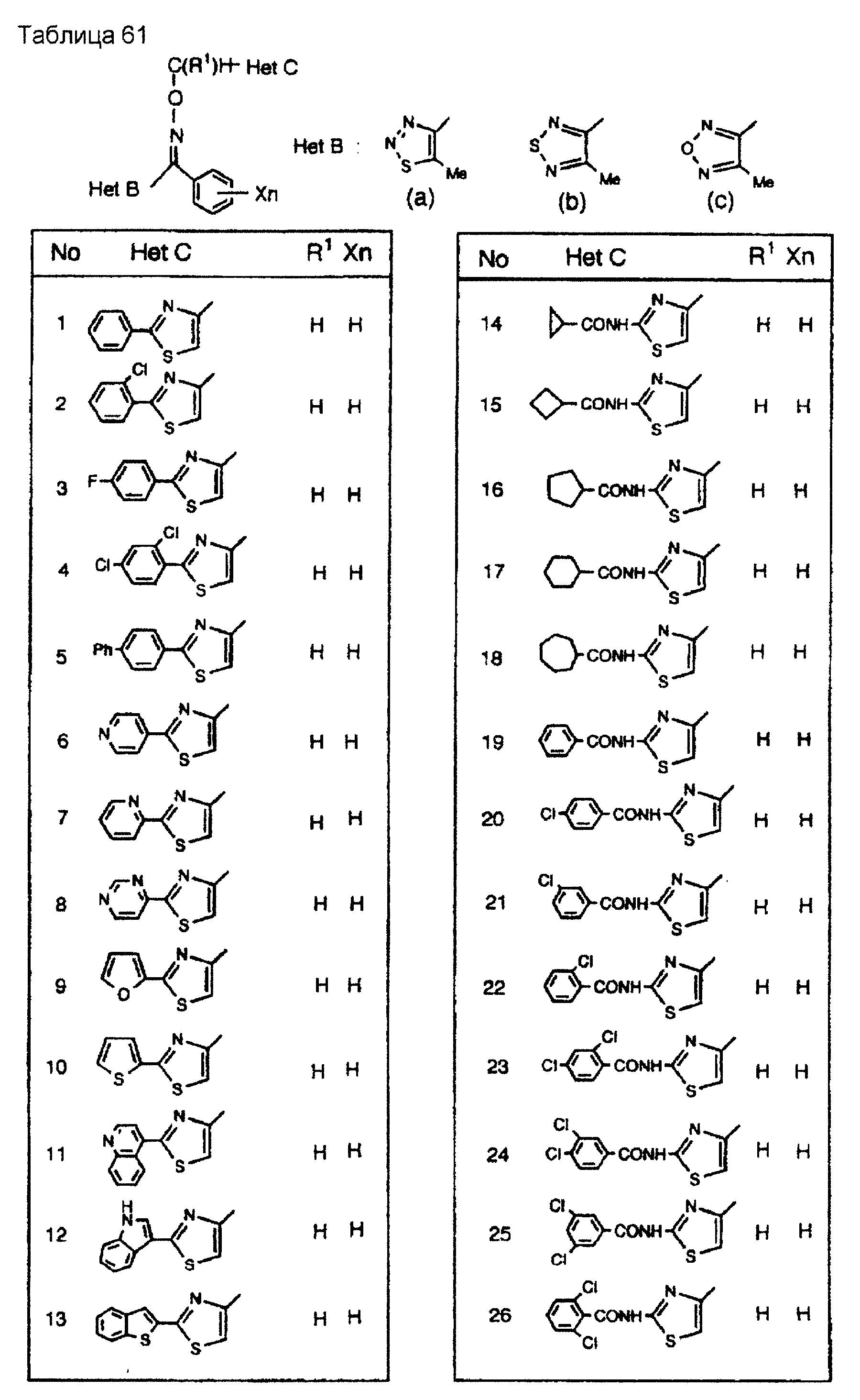
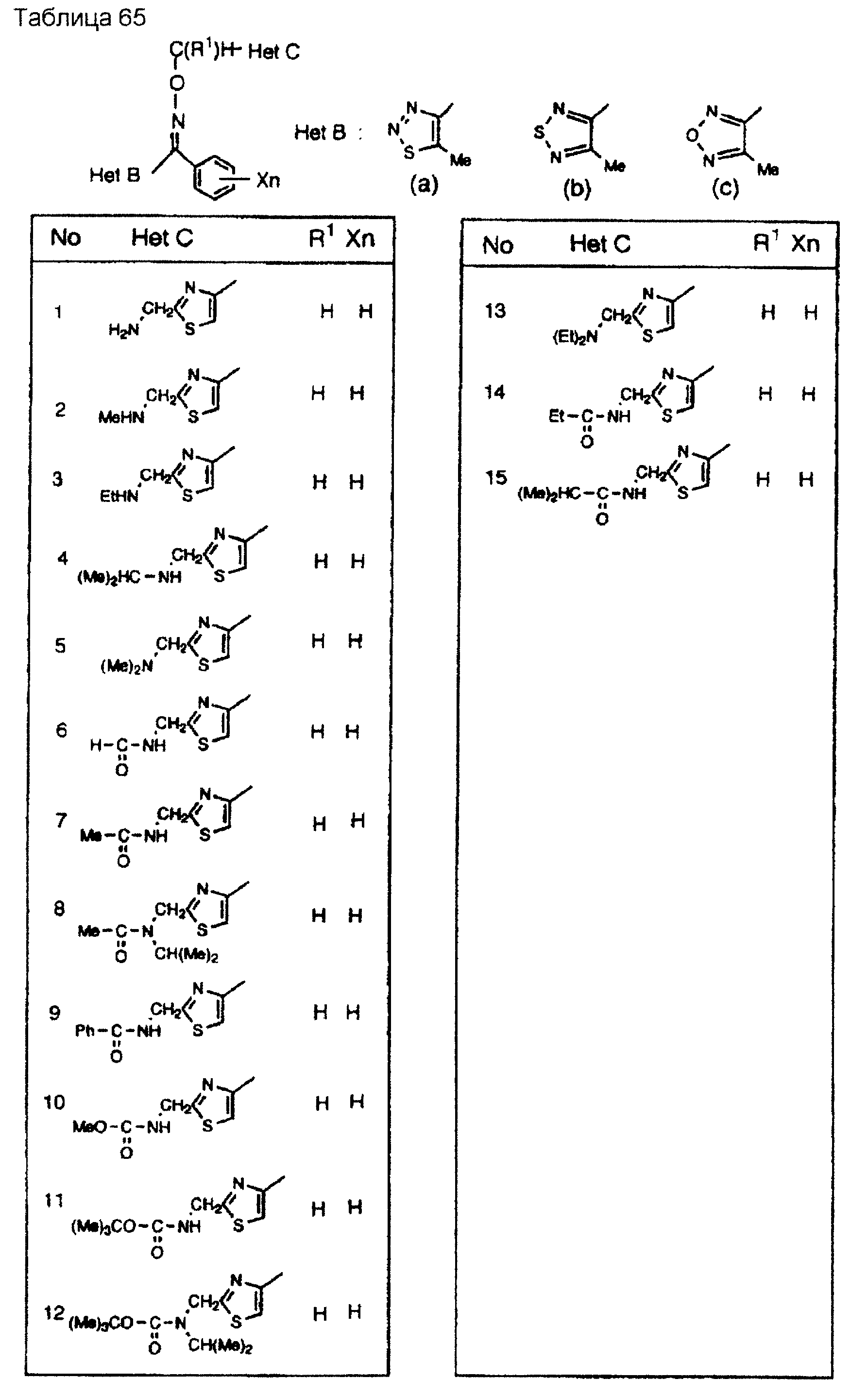
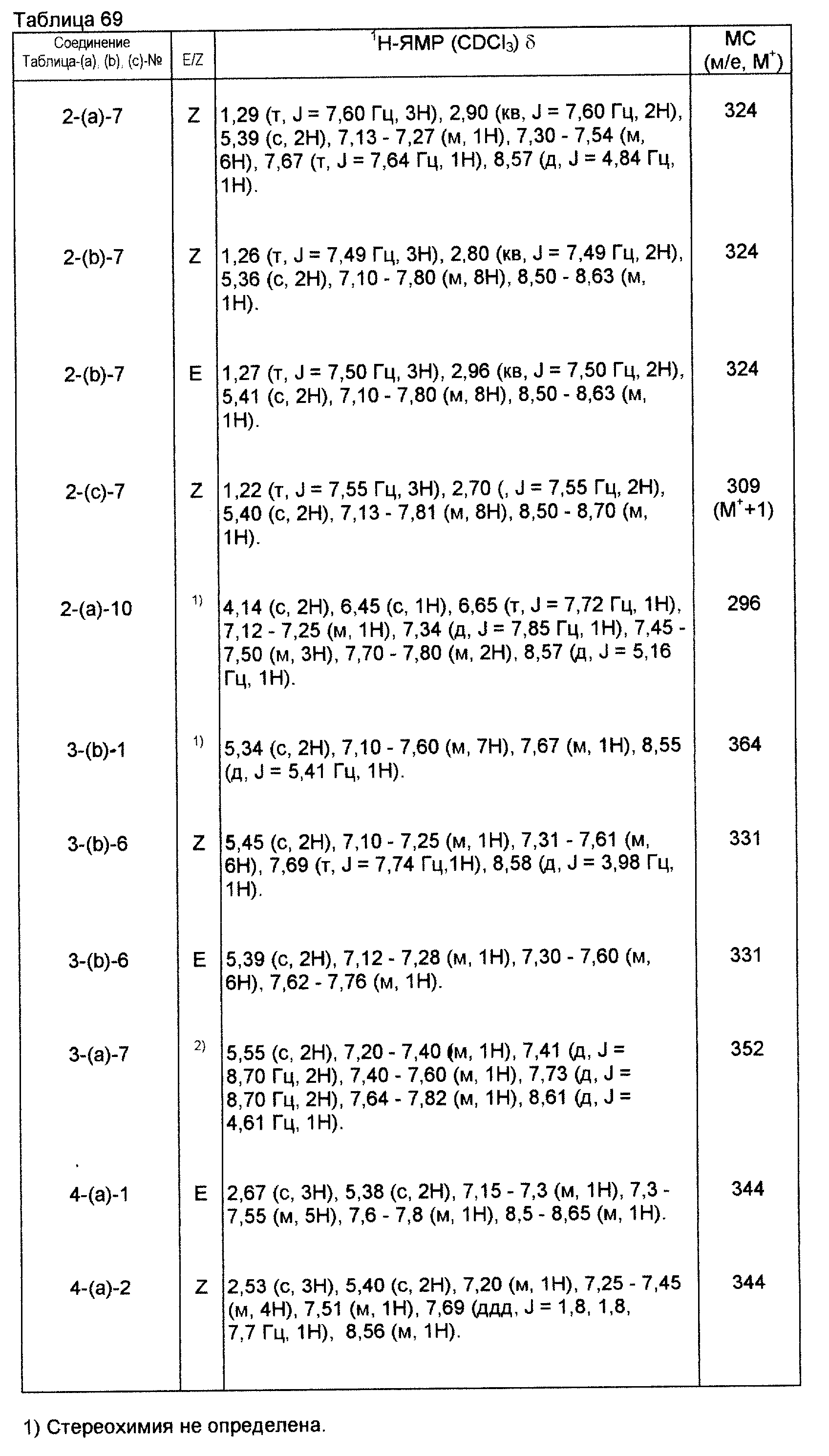
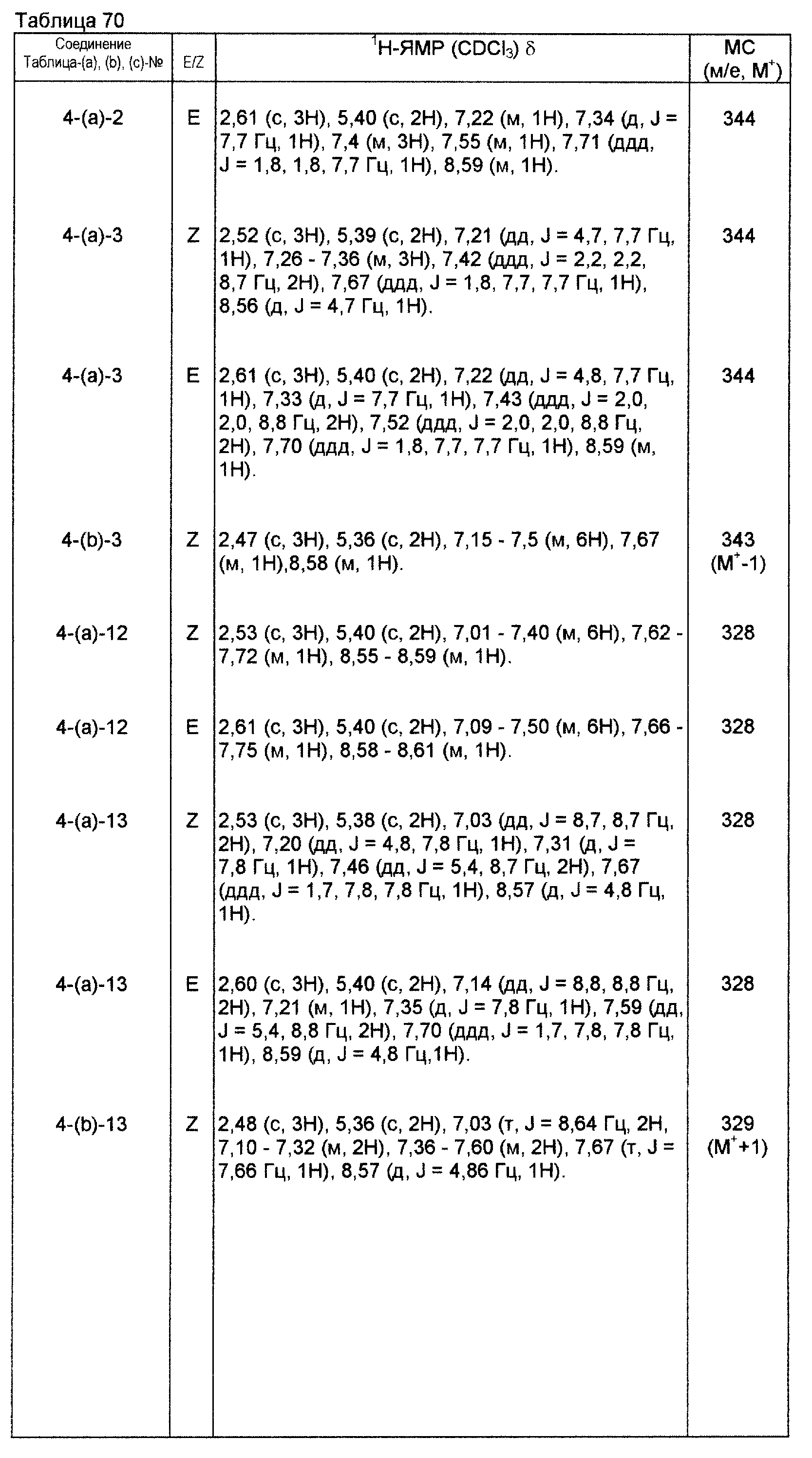
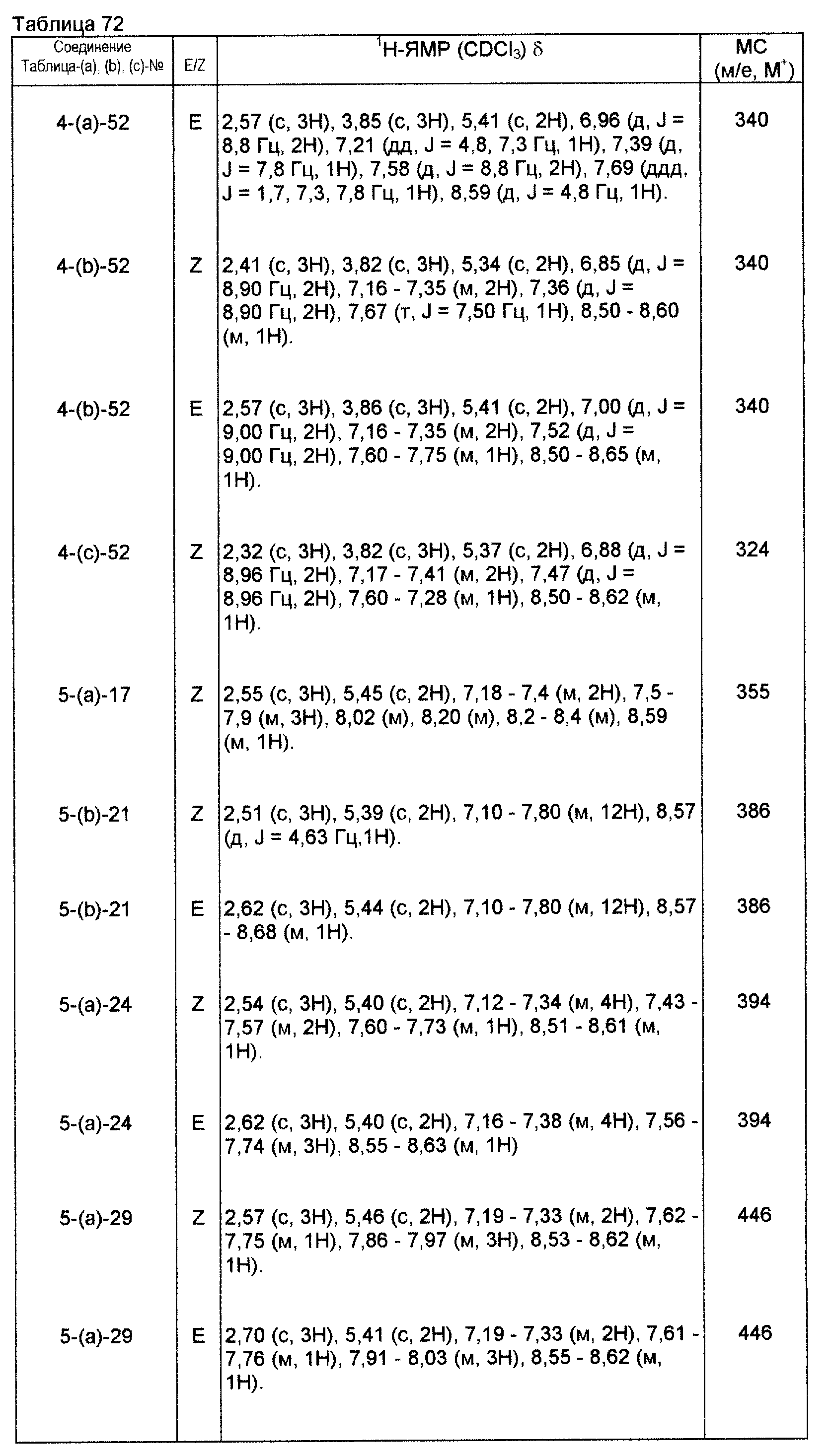
На практике химические структуры соединений, представленных общими формулами (1) и (2), которые получают путем указанных стадий получения, приведены в таблицах 1-66.
Сельскохозяйственные химикаты, особенно агенты для борьбы с болезнями растений, которые содержат производные оксима согласно данному изобретению в качестве активных ингредиентов, являются эффективными в отношении различных заболеваний растений, вызываемых бактериями и плесневыми грибами, и особенно эффективны при болезнях растений, вызываемых плесневыми грибами. Болезни растений, вызываемые плесневыми грибами, включают большое разнообразие типов болезней растений, вызываемых Oomycetes (оомицетами), и болезней растений, вызываемых Pyricularia oryzae.
Сельскохозяйственные агенты данного изобретения особенно эффективны при таких болезнях растений, как ложная мучнистая роса и фитофтороз пасленовых или вызываемая Phytophthora гниль различных растений, которые включают большое разнообразие болезней растений, вызываемых оомицетами, такими как Plasmopara viticola, Pseudoperonospora cubensis, Phytophthora melonis, Phytophthora capsici, Phytophthora infestans, Peronospora brassicae, Peronospora destructor, Peronospora spinaciae и Peronospora manshurica; и Peronospora viciae, Phytophthora nicotianae var. nicotianae, Phytophthora infestans, Pseudoperonospora humuli,Phytophthora cinnamomi, Phytophthora capsici, Phytophthora fragariae, против порчи различных сельскохозяйственных продуктов Pythium bacteria, Pythium aphanidermatum и Pyricularia oryzae.
Сельскохозяйственные агенты данного изобретения могут быть использованы как таковые или обычно могут быть использованы в сочетании с известными вспомогательными веществами, такими как твердые и жидкие носители, диспергаторы, разбавители, эмульгаторы, вещества, способствующие равномерному распределению, загустители. Сельскохозяйственные агенты данного изобретения могут быть использованы путем подбора рецептуры в виде смачиваемого порошка, растворов, масляных растворов, порошка, гранул и в препаратах типа золей.
Примеры твердых и жидких носителей включают, например, тальк, глину, бентонит, каолин, диатомит, монтмориллонит, слюды, вермикулит, гипс, карбонат кальция, белую сажу, древесный порошок, крахмал, оксид алюминия, силикатную соль, полимер гликоля, воски, воду, спирты (такие как метиловый спирт, этиловый спирт, н-пропиловый спирт, изопропиловый спирт, н-бутиловый спирт, этиленгликоль, бензиловый спирт), нефтяные фракции (такие как петролейный эфир, керосин, сольвент-нафта), алифатические и алициклические углеводороды (такие как н-гексан, циклогексан), и ароматические углеводороды (такие как бензол, толуол, ксилол, этилбензол, хлорбензол, кумол и метилнафталин), галогенированные углеводороды (такие как хлороформ, дихлорметан), простые эфиры (такие как изопропиловый простой эфир, этиленоксид и тетрагидрофуран), кетоны (такие как ацетон, метилэтилкетон, циклогексан и метилизобутилкетон), сложные эфиры (такие как этилацетат, бутилацетат, ацетат этиленгликоля и амилацетат), амиды кислот (такие как диметилформамид и диметилацетоанилид), нитрилы (такие как ацетонитрил, пропионитрил, акрилонитрил), сульфоксиды (такие как диметилсульфоксид), простые эфиры спиртов (такие как монометиловый эфир этиленгликоля и моноэтиловый эфир этиленгликоля).
Примеры вспомогательных веществ включают, например, поверхностно-активные вещества неионного типа (такие как простой полиэтилен алкиловый эфир, сложный алкиловый эфир полиэтиленоксида, простой алкилфениловый эфир полиэтиленоксида, полиоксиэтилен сорбитаналкиловый сложный эфир и сорбитаналкиловый сложный эфир), поверхностно-активные вещества анионного типа (такие как алкилбензолсульфонат, алкилсульфосукцинат, алкилсульфат полиэтиленоксида и арилсульфонат), поверхностно-активные вещества катионного типа (такие как алкиламины, полиэтоксиалкиламины и соли четвертичного аммониевого основания), амфотерные поверхностно-активные вещества (такие как алкиламиноэтилглицин и алкилдиметилбетаин), поливиниловый спирт, гидроксипропилцеллюлоза, карбоксиметилцеллюлоза, гуммиарабик, трагакантовая камедь, ксантановая камедь, поливинилацетат, желатин, казеин и альгинат натрия.
Кроме того, данные агенты могут быть использованы в сочетаниях с известными сельскохозяйственными химикатами, такими как сельскохозяйственный и садовый фунгицид, гербициды, регуляторы роста растений, инсектициды, акарициды, и с удобрениями. Хотя содержание данных химикатов изменяется в зависимости от форм агентов, способов применения и других условий, эффективное содержание находится в пределах от 0,5 до 95% по массе и предпочтительно от 2 до 70% по массе.
Могут быть применены различные способы, включая нанесение на листву (обрызгивание листвы), нанесение на садовую почву (обработка почвы), нанесение на водную поверхность поля (обработка водной поверхности) и нанесение на семена (обработка семян).
Количество данных сельскохозяйственных химикатов изменяется в зависимости от типа растений, на которые их наносят, и заболевания. Когда химикаты наносят на листву, тогда предпочтительно наносить их, используя жидкий раствор в количестве 50-300 литров на 10 ар при концентрации 1-10000 ч/млн., предпочтительно 10-1000 ч/млн., в качестве эффективной химической концентрации. Для нанесения на водную поверхность или на почву предпочтительно применять 0,1-100 г на 10 ар. Когда обрабатывают семена, предпочтительно наносить 0,001-50 г данных сельскохозяйственных агентов на 1 кг семян.
Далее данное изобретение будет описано более подробно со ссылкой на следующие примеры, касающиеся способов получения, примеры составов и примеры испытаний. Следует понимать, что данное изобретение не ограничивается следующими примерами.
Пример получения 1
Гидрохлорид гидроксиламина (0,20 г, 2,82 ммоль) и триэтиламин (0,4 мл, 2,8 ммоль) добавляют к раствору в этаноле (20
мл) (5-метил-1,2,3-тиадиазол-4-ил)фенилметанона (0,29 г, 1,41 ммоль) и нагревают с
обратным холодильником в течение 48 часов. После концентрирования таким образом прореагировавшего раствора к остатку
добавляют этилацетат, промывают водой и остаток сушат сульфатом магния.
Растворитель удаляют путем дистилляции и остаток очищают колоночной хроматографией и получают (Z)-(5-метил-1,2,
3-тиадиазол-4-ил)фенилметанон-оксим (0,16 г) и (Е)-(5-метил-1,2,
3-тиадиазол-4-ил)фенилметанон-оксим (0,04 г).
(Z)-(5-метил-1,2,3-тиадиазол-4-ил)фенилметанон-оксим:1Н-ЯМР (CDCl3): δ 2,54 (с, 3Н), 7,30~7,50 (м, 5Н), 8, 30~8,45 (шир.д, 1Н).
МС (m/e): 219 (М+).
(Е)-(5-метил-1,2, 3-тиадиазол-4-ил)фенилметанон-оксим:1Н-ЯМР (CDCl3): δ 2,54 (с, 3Н), 7,35~7,60 (м, 5Н), 8,00~8,20 (шир.д, 1Н).
МС (m/e): 219 (М+).
Пример получения 2
(Z)-(5-метил-1,2,3-тиадиазол-4-ил)фенилметанон-оксим (9,31 г, 0,04
моль) растворяют в ацетонитриле (677 мл), добавляют гидрохлорид 2-пиколилхлорида (10,40 г, 0,07
моль) и нагревают с обратным холодильником в течение 5 часов. После концентрирования таким образом
прореагировавшего раствора остаток экстрагируют этилацетатом и экстрагированное вещество сушат после
промывания водой. Растворитель удаляют путем дистилляции, остаток очищают колоночной
хроматографией и получают (Z)-(5-метил-1,2,3-тиадиазол-4-ил)фенилметанон-O-(2-пиридил)метил-оксим (9,67 г)
(Производное 1-(а)-1(Z)).
1Н-ЯМР (CDCl3): δ 2,53 (с, 3Н), 5,40 (с, 2Н), 7,19 (дд, J=4,9 Гц, J=7,6 Гц, 1Н), 7,30~7,42 (м, 3Н), 7,35 (д, J=7,8 Гц, 1Н), 7,44~7, 50 (м, 2Н), 7,67 (J=7,8 Гц, J=7,6 Гц, 1Н), 8,56 (д, J=4,9 Гц, 1Н).
МС (m/e): 310 (М+).
Пример получения 3
(Е)-(5-метил-1,2,
3-тиадиазол-4-ил)фенилметанон-оксим (0,30 г, 1,4 ммоль) растворяют в ацетоне (20 мл), добавляют карбонат калия
(0,32 г, 2,0 ммоль) и гидрохлорид 2-пиколилхлорида (0,34 г, 2,0 ммоль) и нагревают с
обратным холодильником в течение 3 суток. После концентрирования таким образом прореагировавшего раствора остаток
экстрагируют этилацетатом и после промывания водой остаток сушат сульфатом магния.
Растворитель удаляют дистилляцией, остаток очищают колоночной хроматографией и получают (Е)-(5-метил-1,2,
3-тиадиазол-4-ил)фенилметанон-O-(2-пиридил)метил-оксим.
1Н-ЯМР (CDCl3): δ 2,59 (с, 3Н), 5,40 (с, 2Н), 7,21 (дд, J=4,83 Гц, J= 8,70 Гц, 1Н), 7,31~7,72 (м, 7Н), 8,58 (J=4,88 Гц, 1Н).
МС (m/e): 310 (М+).
Пример получения 4
Гидрохлорид гидроксиламина (4,48 г, 63,1 ммоль) и триэтиламин (8,8 мл, 63,1
ммоль) добавляют к раствору в этаноле (85 мл) (3-метил-1,2,5-тиадиазол-4-ил)фенилметанона (3,22
г, 15,7 ммоль) и нагревают с обратным холодильником в течение 8 часов. Потом прореагировавший раствор
концентрируют, к остатку добавляют этилацетат/воду для экстрагирования. Остаток сушат сульфатом
магния, потом растворитель удаляют дистилляцией. Остаток очищают колоночной хроматографией и получают
(Z)-(3-метил-1,2,5-оксадиазол-4-ил)-фенилметанон-оксим (2,18 г).
1Н-ЯМР (CDCl3): δ 2,53 (с, 3Н), 7,27~7,56 (м, 5Н), 8,52~8,78 (шир.д, 1Н).
МС (m/e): 219 (М+).
Пример получения 5
60%-ный гидрид натрия (2,
41 г, 60,0 ммоль) добавляют к ДМФ (150 мл) (N, N-диметилформамиду) и охлаждают льдом и затем
добавляют (Z)-(3-метил-1,2,5-тиадиазол-4-ил)фенилметанон-оксим и перемешивают в течение 40 минут. К
прореагировавшему таким образом раствору добавляют по каплям раствор в ДМФ (110 мл)
4-хлорметил-2-изопропиониламинотиазола (7,76 г, 35,6 ммоль). После постепенного доведения реакционного раствора до
комнатной температуры его перемешивают в течение 20 часов. Растворитель из
реакционного раствора удаляют при пониженном давлении и к остатку добавляют этил-ацетат/воду для экстрагирования.
Экстрагированный раствор сушат сульфатом магния после промывания водой. Растворитель
удаляют дистилляцией и остаток очищают колоночной хроматографией и получают (Z)-(3-метил-1,2,
5-тиадиазол-4-ил)фенилметан-O-(2-изопропиониламинотиазол-4-ил)метилоксим.
1Н-ЯМР (CDCl3): δ 1,22 (д, J=6,91 Гц, 6Н), 2,41 (с, 3Н), 2,47~2,76 (м, 1Н), 5,21 (с, 2Н), 6,89 (с, 1Н), 7,28~7,60 (м, 5Н), 9,50-9,90 (шир.д, 1Н).
МС (m/e): 401 (М+).
Пример получения 6
Раствор в пиридине (55 мл) гидрохлорида
гидроксиламина (5,19 г, 73,0 ммоль) добавляют к (3-метил-1,2,5-оксадиазол-4-ил)фенилметанону (3,43 г, 18,
0 ммоль) и нагревают до 70oС в течение 21 часа с перемешиванием. Потом
прореагировавший раствор конденсируют, остаток растворяют в этилацетате. После промывания разбавленным гидрохлоридом
и последующего промывания водой остаток сушат карбонатом магния. После удаления
растворителя и очистки остатка колоночной хроматографией
получают (Z)-(3-метил-1,2,
5-оксадиазол-4-ил)фенилметанон-оксим (2,13 г) и (Е)-(3-метил-1,2,5-оксадиазол-4-ил)фенилметанон-оксим (0,79
г).
(Z)-(3-метил-1,2,5-оксадиазол-4-ил)фенилметанон-оксим:1 Н-ЯМР (CDCl3): δ 2,38 (с, 3Н), 7,30~7,62 (м, 2Н), 7,89~8,00 (шир.д, 1Н).
МС (m/e): 219 (М+).
(Е)-(3-метил-1,2, 5-оксадиазол-4-ил)фенилметанон-оксим:1Н-ЯМР (CDCl3): δ 2,55 (с, 3Н), 7,48~7,62 (м, 2Н), 7,89~8,00 (шир.д, 1Н).
МС (m/e): 219 (М+).
Пример получения 7
60%-ный гидрид натрия (0,43 г, 10,6 ммоль) добавляют к ДМФ (16 мл) и охлаждают льдом и к этому раствору
добавляют при перемешивании раствор в ДМФ (20 мл)
(Z)-(3-метил-1,2,5-оксадиазол-4-ил)фенилметанон-оксима (0,94 г, 4,36 ммоль). К указанному прореагировавшему раствору добавляют раствор в ДМФ (15 мл)
4-хлорметил-2-трифенилметиламинотиазола (2,71 г, 6,
94 ммоль). После доведения реакционного раствора до комнатной температуры реакционный раствор перемешивают в течение 4 суток. Растворитель из
раствора затем удаляют при пониженном давлении и к
остатку добавляют этилацетат/воду для экстрагирования. Растворитель удаляют дистилляцией, остаток очищают колоночной хроматографией и получают
(Z)-(3-метил-1,2,
5-оксадиазол-4-ил)фенилметанон-O-(2-трифенилметиламинотиазол-4-ил)метилоксим(0,59 г) (Производное 9-(с)-6(Z)).
1Н-ЯМР (CDCl3): δ 2,23 (с, 3Н), 5,11 (с, 2Н), 6,27 (с, 1Н), 6,80~6,97 (шир.д, 1Н), 7,13~7,60 (м, 20Н).
МС (m/e): 557 (М+).
Пример получения 8
1М гидрохлорид (0,6 мл) добавляют
к раствору в
ацетоне (15 мл) (Z)-(3-метил-1,2,5-оксадиазол-4-ил)фенилметанон-O-(2-трифенилметиламинотиазол-4-ил)метилоксима и нагревают в течение 8 часов с обратным холодильником. Растворитель из
реакционного
раствора удаляют при пониженном давлении и добавляют раствор этилацетата/насыщенного раствора кислого карбоната натрия и экстрагируют, потом раствор доводят до рН=7. Экстрагированный
раствор
промывают водой и остаток сушат сульфатом магния. Растворитель удаляют дистилляцией и остаток очищают колоночной хроматографией и получают (Z)-(3-метил-1,2,
5-оксадиазол-4-ил)фенилметанон-O-(2-аминотиазол-4-ил)метилоксим (0,05 г) (Производное 8-(c)-1(Z)).
1Н-ЯМР (CDCl3): δ 2,31 (с, 3Н), 4,85~5,10 (шир.д, 1Н), 5, 14 (с, 2Н), 6,46 (с, 1Н), 7,32~7,66 (м, 5Н).
МС (m/e): 315 (М+).
Пример получения 9
Ангидрид трифторуксусной кислоты (7 мл) добавляют к
(Z)-(3-метил-1,2,5-оксадиазол-4-ил)фенилметанон-O-(2-аминотиазол-4-ил)метилоксиму (0,053 г, 0,168 ммоль) и нагревают в течение 2 часов при перемешивании. Реакционный раствор концентрируют, остаток
очищают колоночной хроматографией и получают (Z)-(3-метил-1,2,5-оксадиазол-4-ил)фенилметанон-O-(2-трифторацетиламинотиазол-4-ил)метилоксим (0,063 г) (Производное 8-(с)-14(Z)).
1Н-ЯМР (CDCl3): δ 2,26 (с, 3Н), 5,26 (с, 2Н), 7,07 (с, 1Н), 7,28~7,56 (м, 5Н), 7,68~8,10 (шир.д, 1Н).
МС (m/e): 411 (М+).
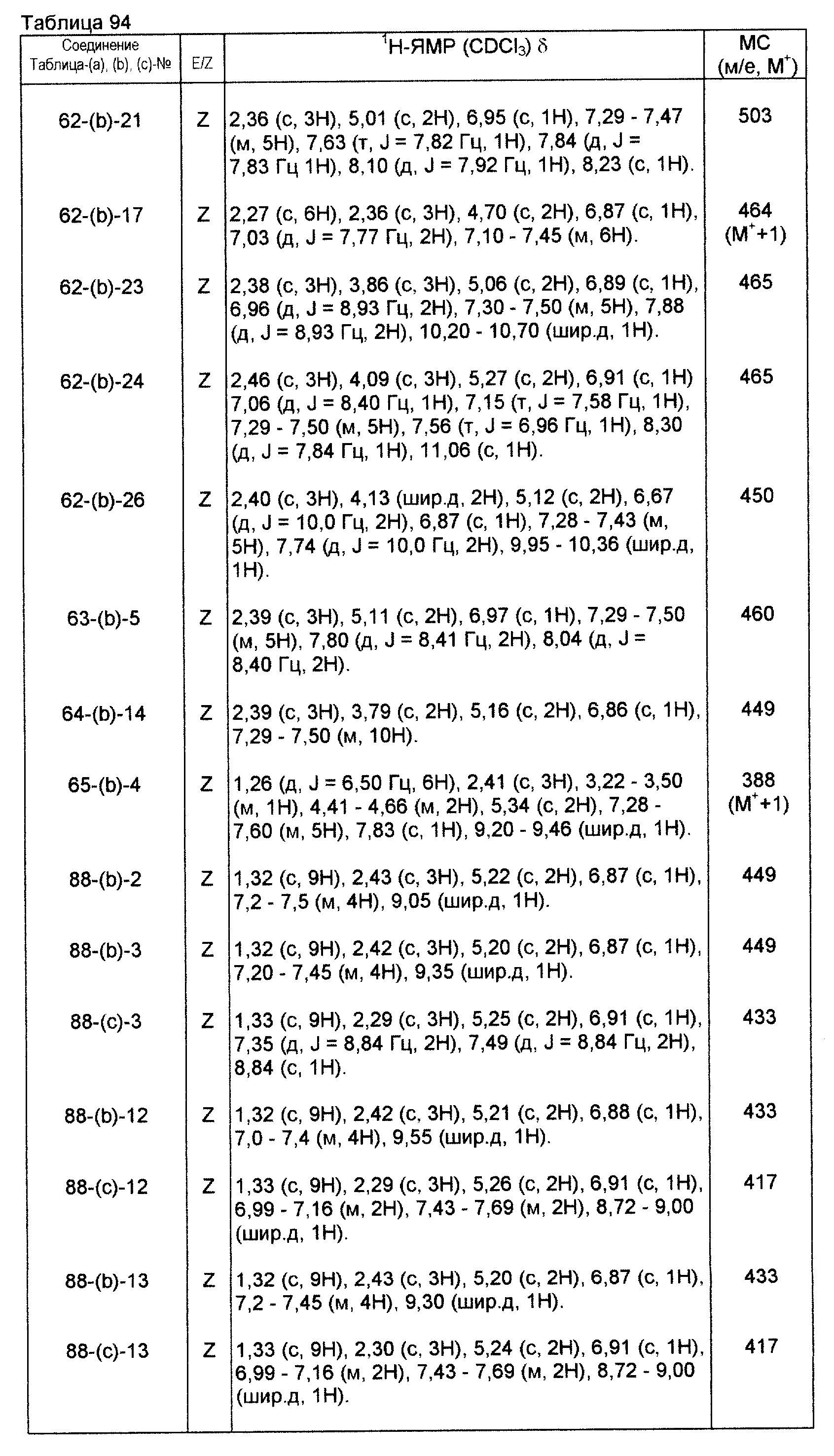
Физические и химические данные, такие как спектр1Н-ЯМР и масс-спектр производных оксима, полученных такими же способами, как и те, которые показаны в приведенных выше примерах получения, приведены в таблицах 67-81.
Далее будут описаны примеры составления сельскохозяйственных агентов с использованием производных оксима, полученных по данному изобретению. Если не указано иначе, соединения являются смесями форм "Z" и "Е".
Пример состава 1: дуст
2 части по массе производных оксима из соединений от соединения N 1-(а)-1 до соединения 66-(b)-10 смешивают
с 98 частями по массе глины и смесь измельчают до получения тонкого порошка - дуста.
Пример состава 2: диспергируемый в воде порошок
20 частей по массе производных оксима из
соединений от соединения 1-(а)-1 до соединения 66-(b)-10 смешивают с 68 частями по массе глины, 8 частями по массе белой сажи и 4 частями по массе простого нонилфенилового эфира полиэтиленоксида и
смесь измельчают с получением диспергируемого в воде порошка.
Пример состава 3: гранулы
5 частей по массе производных оксима из соединений от соединения 1-(а)-1 до соединения
66-(b)-10 смешивают с 90 частями по массе смеси эквивалентных масс бентонита и талька и 5 частями по массе алкилбензолсульфоната натрия и смесь измельчают для формирования гранул.
Эффективность соединений, полученных по изобретению, против различных заболеваний растений будет описана далее со ссылкой на следующие примеры испытаний. Статус испытуемых растений при тестировании эффективности по подавлению заболеваний данных химикатов определяют степенью повреждений, появляющихся на листве, или числом растений, пораженных Phytophthora, наблюдаемых визуально, и результаты оценивают четырьмя степенями "А", "В", "С" и "D". Степень "А" выбирают, когда нет растений с повреждениями или нет увядших растений, и степень "В" выбирают, когда число больных растений, которые включают растения с повреждениями или увядшие растения, составляет около 10% от общего числа растений. Степень "С" выбирают, когда число больных растений составляет около 25%, и степень "D" выбирают, когда число больных растений превышает 50%.
Пример испытания 1: Тест на подавление болезни растения, вызываемой Phytophthora infestans
Диспергируемый в воде порошок,
полученный способом, показанным в примере состава 2, разбавляют водой, содержащей поверхностно-активное вещество (0,02%), так, чтобы концентрация эффективного компонента была 250 ч/млн.
Приготовленный
таким образом раствор разбрызгивают на листву на стадии 3-4 листа томатов (разновидность Toyofuku), которые выращивают в пластмассовых горшках диаметром 9 см. После сушки на воздухе их
заражают путем
обрызгивания дисперсией спор Phytophthora infestans, после выдерживания во влажной камере при 20oС в течение 24 часов спорам дают расти при комнатной температуре. Через 5
суток определяют
степень развития болезни. Результаты испытания в отношении Phytophthora infestans на томатах показаны в таблице 82. В качестве сельскохозяйственного химиката сравнения используют
диспергируемый в воде
порошок манзеба в количествах 1250 ч/млн. и 250 ч/млн.
Пример испытания 2: Тест на подавление болезни растения, вызываемой Pseudoperonospora cubensis
Диспергируемый в воде
порошок, полученный способом, показанным в примере состава 2, разбавляют водой, содержащей поверхностно-активное вещество (0,02%), так, чтобы концентрация эффективного
компонента была 50 ч/млн.
Приготовленный таким образом раствор разбрызгивают на листву на стадии 3 листа огурцов (разновидность: Tokiwa Shinchibai), которые выращивают в пластмассовых горшках
диаметром 9 см. После сушки на
воздухе их заражают путем обрызгивания дисперсией спор Pseudoperonospora cubensis, после выдерживания во влажной камере при 25oС в течение 24 часов спорам
дают расти при комнатной
температуре. Через 5 суток определяют степень развития болезни. Результаты испытания в отношении Pseudoperonospora cubensis на огурцах показаны в таблице 83. В качестве
сельскохозяйственного химиката
сравнения используют диспергируемый в воде порошок манзеба в количествах 1250 ч/млн. и 50 ч/млн.
Пример испытания 3: Тест на подавление болезни растения,
вызываемой Pseudoperonospora
cubensis (испытание на диске листа)
Из первого листа огурца (разновидность: Tokiwa Shinchibai) на стадии 2-3 листа вырезают штампом - диск диаметром 10 мм.
Затем диск погружают на 30 минут в
раствор фармацевтического химиката при концентрации эффективного ингредиента 10 ч/млн. , используя диспергируемый в воде порошок, приготовленный согласно примеру
состава 2. После сушки на воздухе
заражают каплей дисперсии спор Pseudoperonospora cubensis (резистентный к металаксилу штамм грибов). Выдержав во влажной камере, бактерии культивируют в установке
искусственного климата (день - 14
часов; 25oС днем, 18oС ночью) в течение 7 суток и определяют степень развития болезни. Результаты этих испытаний на листе в отношении
Pseudoperonospora cubensis показаны в
таблице 84. В качестве сельскохозяйственного химиката сравнения используют 10 ч/млн. диспергируемого в воде порошка манзеба и металаксила.
Пример
испытания 4: Тест на подавление
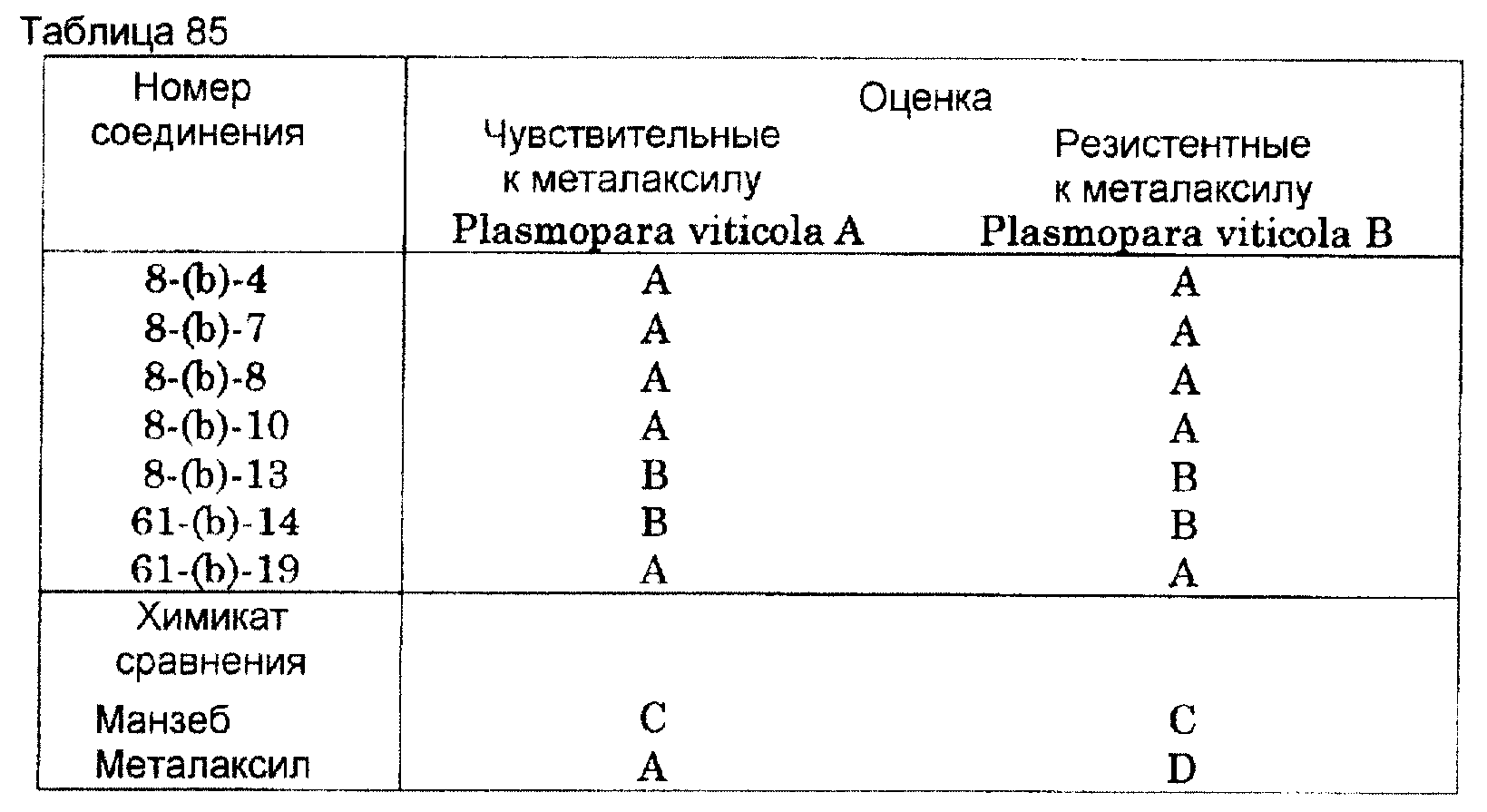
болезни растения, вызываемой Plasmopara viticola (испытание на диске листа)
Диск листа, вырезанный штампом из листа винограда (разновидность: neo masukatto)
погружают на 30 мин в содержащий
химикат раствор, который готовят, используя диспергируемый в воде порошок при концентрации эффективного компонента 10 ч/млн. После сушки на воздухе заражают каплей
дисперсии спор двух грибов,
состоящей из (А) чувствительных к металаксилу Plasmopara viticola и (В) резистентных к металаксилу Plasmopara viticola, и культивируют грибы в течение 7 суток во влажной
камере установки
искусственного климата. Результаты этих испытаний на листе в отношении Plasmopara viticola показаны в таблице 85.
Пример испытания 5: Тест на подавление болезни
растения, вызываемой
Pythium aphanidermatum
Смесь стерилизованной почвы и Pythium aphanidermatum помещают в глубокую чашку Петри с диаметром 15 см. После посева 10 семян огурца
(разновидность: Nouryoku
Shintokiwa) в каждую чашку, почву смачивают разбавленной водой дисперсией водо-диспергируемого порошка, приготовленного согласно примеру состава 2 при концентрации
эффективного компонента 1000 ч/млн.
После смачивания чашку помещают во влажную камеру и в условия установки искусственного климата с долготой дня 14 часов в течение 4 суток. Определяют степень
развития болезни растения. Результаты
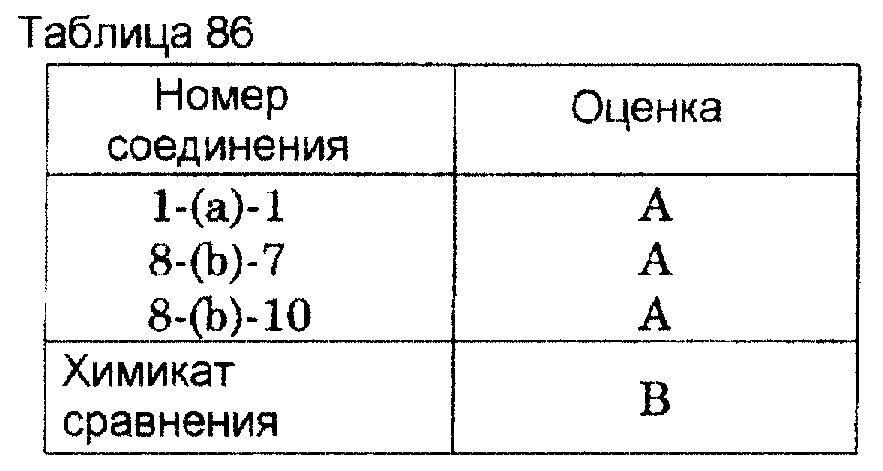
испытания в отношении Pythium aphanidermatum показаны в таблице 86. Сельскохозяйственным химикатом сравнения этого испытания является 1000 ч/млн.
вододиспергируемого порошка каптана.
Пример испытания 6: Тест на подавление болезни растения, вызываемой Pyricularia oryzae
Разбавленный водой раствор вододиспергируемого
порошка, приготовленного согласно примеру состава 2 при
концентрации эффективного компонента 250 ч/млн. , распыляют на листву растения риса (разновидность: Aichi Asahi) на стадии 3-4 листа, которое
выращивают в пластмассовом горшке с диаметром 9 см. После
сушки на воздухе заражают распылением дисперсии спор Pyricularia oryzae и после выдерживания во влажной камере в течение 24 часов болезни
растения дают проявиться в теплице и степень развития болезни
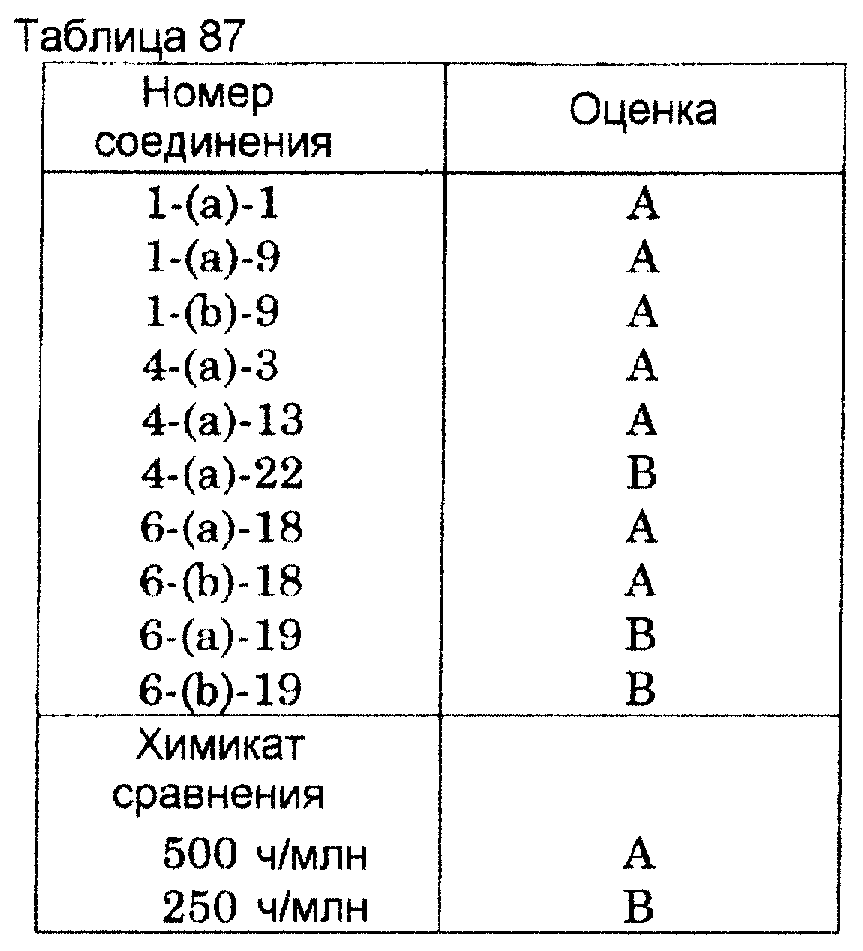
определяют через 7 суток. Результаты испытания в отношении Pyricularia oryzae показаны в таблице 87. Сельскохозяйственным химикатом
сравнения этого испытания является 500 ч/млн вододиспергируемого
порошка фталида.
Кроме того, практические структуры соединений данного изобретения показаны в таблицах 88-90, где Het В, Het С, X, Y и n являются такими же, как определенные в общих формулах (1) и (2), и Me обозначает метилгруппу.
Физические и химические данные, такие как спектр1H-ЯМР и масс-спектр производных оксима, полученных путем таких же способов, как те, которые приведены в примерах получения 1-9, приведены в таблицах 91-97.
Кроме того, примеры испытаний пестицидов согласно данному изобретению будут описаны далее.
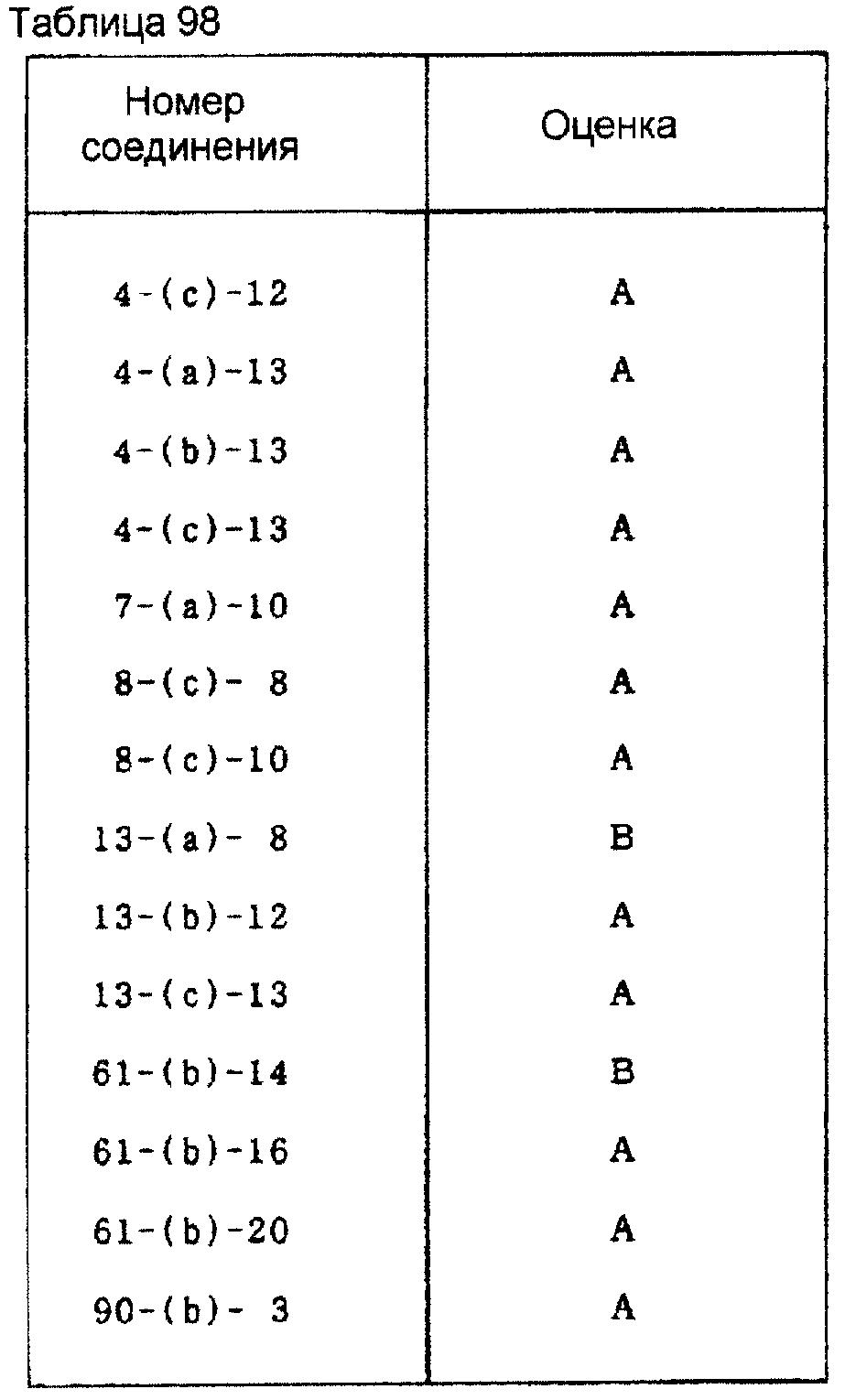
Пример испытания 7: Тест на подавление болезни растения, вызываемой Pseudoperonospora cubensis
Испытание проводят
тем же способом, как показано в примере испытания 2. Результаты
испытания показаны в таблице 98.
Пример испытания 8: Тест на подавление болезни растения, вызываемой Pseudoperonospora cubensis (испытание на диске листа).
Испытание проводят тем же способом, как показано в примере испытания 3. Результаты испытания показаны в таблице 99.
Пример испытания 9: Тест на подавление болезни растения, вызываемой Plasmopara viticola (испытание на диске листа).
Испытание проводят тем же способом, как показано в примере испытания 4. Результаты испытания показаны в табл. 100.
Промышленная применимость
Данное изобретение относится к новым производным оксима, которые не вызывают химического повреждения
растений и имеют достаточную эффективность против различных
болезней растений, а также к пестицидам и средствам для борьбы с болезнями растений, которые содержат такие производные оксима в качестве
активных ингредиентов.
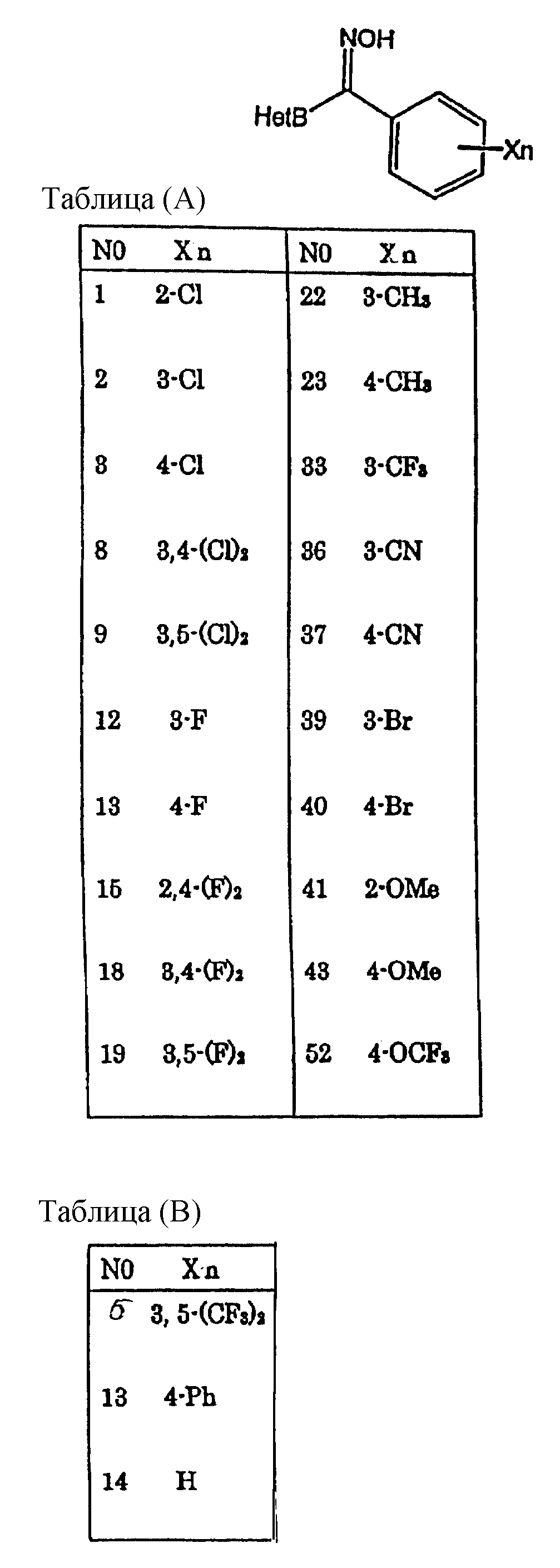
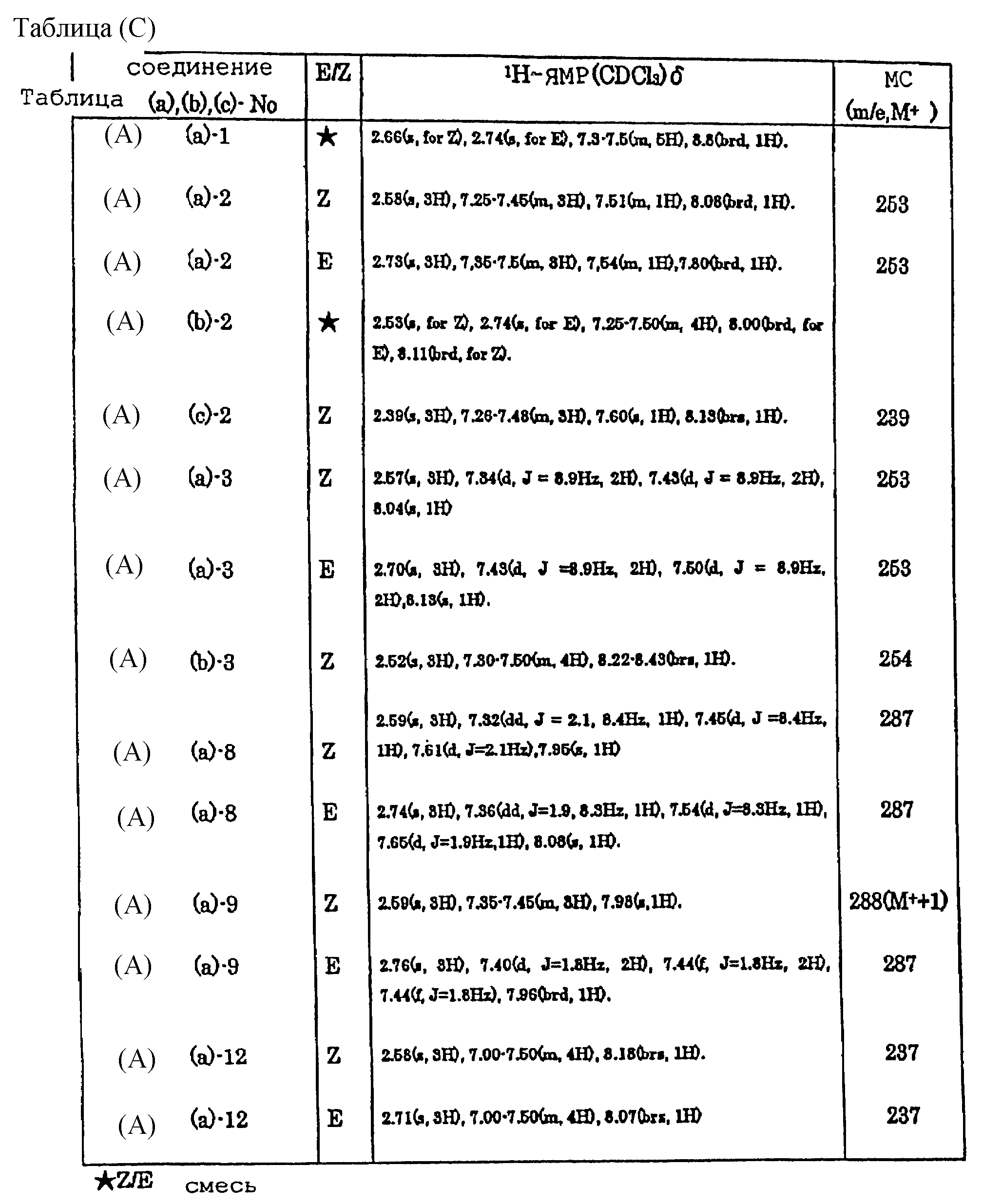
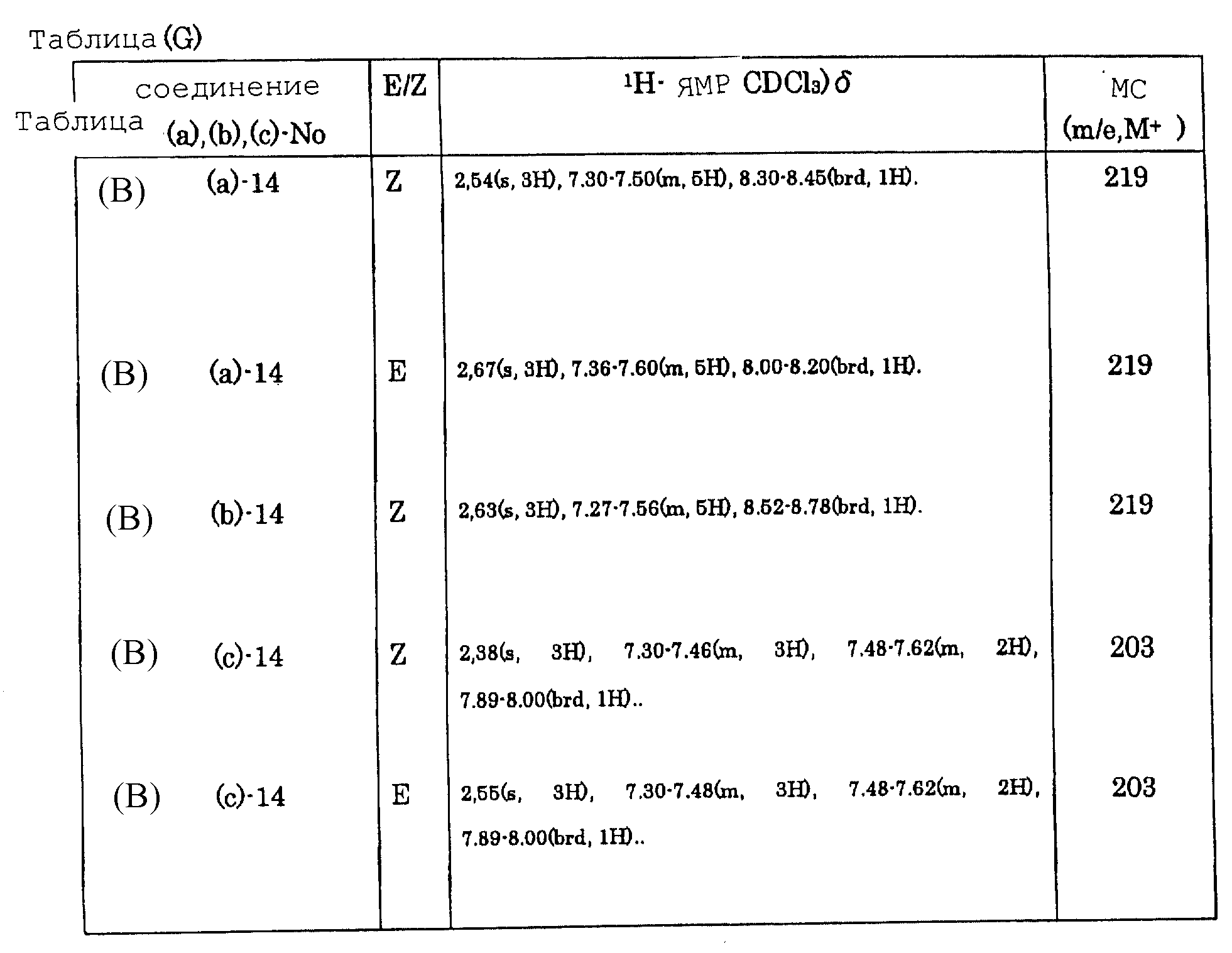
Таблицы (A)-(G) представляют физико-химические данные соединений, раскрытых в пункте 8 формулы.
(А) и (В) представляют заместители, используемые для синтеза этих соединений, а в таблицах (С)-(G) представлены физико-химические свойства, которые характеризуются структурным изомером (E/Z), данными ядерного магнитного резонанса и масс-спектрометрии каждого соединения.
В указанных
таблицах приняты следующие обозначения:
s - синглет,
d - дублет,
dd - дублет дублета,
m
- мультиплет,
br - уширенный,
Hz - Гц,
ddd
- дублет дублета дублета,
tt - триплет триплета.
Реферат
Описываются производные оксима общей формулы (1), где R1 - Н, низший алкил, Х - атом галогена, циано, нитро, низший алкил (который может быть замещен атомами галогена), низший алкокси (который может быть замещен атомами галогена), фенил; n = 0 - 2; Het A - пиридиновое кольцо, которое может быть замещено атомом галогена, низшим алкилом, пиримидиновое, пиразиновое, хинолиновое или хиноксалиновое кольца, Het В - структуры формул (3), (4), (5), Y - Н, атом галогена, низший алкил, который может быть замещен атомом галогена. Описывают производные оксима формулы (2), где R1 - Н; Х - атом галогена, циано, нитро, низший алкил (который может быть замещен атомом галогена), n = 0-2; Het В - формулы (3), (4), (5); Y - низший алкил, Het С - имидазольное, тиазольное, пиразольное, 1,2,4-триазольное, тиадиазольное, бензимидазольное, бензтиазольное, имидазо[1,2-а]-пиридиновое кольцо, которое может быть замещено. Описывается средство для борьбы с заболеваниями растений, содержащее производное оксима, а также способы получения гидроксииминосоединения формулы (b), производного оксима формулы (1) или (2). Описывает гидроксииминосоединение формулы (b). Новые соединения формул (1) и (2) обладают фунгицидной активностью. 7 c. и 6 з.п. ф-лы, 107 табл.




Формула
где R1 обозначает атом водорода или низшую алкильную группу;
Х - атом галогена, цианогруппу, нитрогруппу, низшую алкильную группу (которая может быть замещена атомами галогена), низшую алкоксигруппу (которая может быть замещена атомами галогена) или фенильную группу;
n = 0, 1, 2;
Het А обозначает 6-членную ароматическую азотсодержащую циклическую структуру, которая содержит один или два атома азота, включая пиридиновое кольцо, которое может быть замещено атомом галогена или низшей алкильной группой, пиримидиновое кольцо, пиразиновое кольцо или бензоконденсированную с ним ароматическую азотсодержащую циклическую структуру, включая хинолиновое или хиноксалиновое кольцо;
Het В - циклические структуры следующих формул:



где Y - атом водорода, атом галогена или низшая алкильная группа, которая может быть замещена атомом галогена.

где R1 - атом водорода;
Х - атом галогена, цианогруппа или низшая алкильная группа (которая может быть замещена атомом галогена);
n = 0, 1, 2;
Het В является таким же, как указано для химической формулы (1), где Y обозначает низшую алкильную группу;
Het С обозначает 5-членную азотсодержащую ароматическую структуру или бензоконденсированную с ней азотсодержащую ароматическую структуру, которая содержит один или более атомов азота или которая может содержать атом серы или атом кислорода, включающую имидазольное кольцо, тиазольное кольцо, пиразольное кольцо, 1,2,4-триазольное кольцо, 1,2, 4-тиадиазольное кольцо, 1,2,3-тиадиазольное кольцо, бензимидазольное кольцо, бензтиазольное кольцо или имидазо[1,2-а] пиридиновое кольцо и которая может быть замещена одной или двумя замещающими группами, причем группы, способные замещать атом азота указанной 5-членной азотсодержащей ароматической циклической структуры, являются группами, выбранными из низшей алкильной группы, трифенилметильной группы и N, N-дизамещенной сульфамоильной группы (замещенной низшими алкильными группами); а группы, способные замещать атом углерода указанной 5-членной азотсодержащей ароматической циклической структуры, являются группами, выбранными из атома галогена, C1-C6 алкильной группы (которая может быть замещена атомом галогена), C1 -C5 алкоксигруппы (которая может быть замещена атомом галогена), низшей алкилтиогруппы (которая может быть замещена атомом галогена), низшей алкилсульфонилгруппы (которая может быть замещена атомом галогена), низшей алкилсульфинилгруппы (которая может быть замещена атомом галогена), аминогруппы (которая может быть замещена низшей алкильной группой), низшей алкоксикарбонилгруппы, карбамоильной группы (которая может быть замещена низшими алкильными группами), пиридин-4-ильной группы, аминогруппы, которая может быть замещена трифенилметильной группой, N-(алкоксикарбонил)(алкил)аминометильной группы, алкилтиометильной группы или карбамоильной группы, которая может быть замещена низшими алкильными группами, и группы формулы -N(R2)С(= O)R3, в которой R2 обозначает атом водорода или метилгруппу, а R3 - атом водорода, C1-С10 алкильную группу (которая может быть замещена атомами галогена), С3-С8 циклоалкилгруппу, низшую алкильную группу (замещенную аминогруппой), бензильную группу, низшую алкильную группу (замещенную алкоксикарбониламиногруппой), фенильную группу (которая может быть замещена атомом галогена, низшей алкоксигруппой или цианогруппой), 2-тиенильную группу или низшую алкоксигруппу.

где R4 обозначает атом водорода, аминогруппу, C1-C5 алкоксигруппу (которая может быть замещена атомами галогена), низшую алкилтиогруппу (которая может быть замещена атомами галогена), низшую алкилсульфонилгруппу (которая может быть замещена атомами галогена), низшую алкилсульфинилгруппу (которая может быть замещена атомами галогена) или группу, представленную формулой -NHC(= O)R3, в которой R3 обозначает атом водорода, C1-С10 алкильную группу (которая может быть замещена атомами галогена), С3-С8 циклоалкилгруппу, бензильную группу, низшую алкильную группу, замещенную аминогруппой, низшую алкильную группу, замещенную алкоксикарбониламиногруппой, фенильную группу, (которая может быть замещена атомами галогена, низшими алкоксигруппами, цианогруппой) или 2-тиенильную группу, С2 -С6 алкенильную группу или низшую алкоксигруппу;
R5 - атом водорода или атом галогена.
где X, n и Het B являются такими, как определено далее для общей формулы (а),
включающий стадию взаимодействия производного азолметанона, представленного общей формулой (а),

с гидроксиламином,
где Х обозначает атом галогена, цианогруппу, нитрогруппу, низшую алкильную группу (которая может быть замещена атомами галогена), низшую алкоксигруппу (которая может быть замещена атомами галогена) или фенильную группу;
n = 0, 1, 2;
Het В - производные оксима циклической структуры, представленные следующими формулами:


где Y обозначает низшую алкильную группу.

где Het B, Х и n являются такими, как определено для приведенной далее общей формулы (b);
Het А и R1 являются такими, как определено для приведенной далее общей формулы (с);
или общей формулы (2)

где Het В, Х и n являются такими, как определено для приведенной далее общей формулы (b);
Het С и R1 являются такими, как определено для приведенной далее общей формулы (d),
включающий стадию взаимодействия гидроксииминосоединения, представленного приведенной далее общей формулой (b) с соединением галогена, представленным приведенными далее общими формулами (с) или (d), в присутствии основания
общая формула (b):

где Х обозначает атом галогена, цианогруппу, нитрогруппу, низшую алкильную группу (которая может быть замещена атомами галогена), низшую алкоксигруппу (которая может быть замещена атомами галогена) или фенильную группу;
n = 0-2;
Het В - производные оксима циклической структуры, представленные следующими формулами:


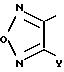
где Y обозначает атом водорода, атом галогена или низшую алкильную группу, которая может быть замещена атомом галогена;
общая формула (с):

где R1 обозначает атом водорода или низшую алкильную группу;
Het А имеет значения указанные в п. 1; и
Z - атом хлора, атом брома или атом йода;
общая формула (d):

где R1 обозначает атом водорода или низшую алкильную группу;
Het С имеет значения, указанные в п. 3. ; и
Z - атом хлора, атом брома или атом йода.

где Х обозначает атом галогена, цианогруппу, нитрогруппу, низшую алкильную группу (которая может быть замещена атомами галогена), низшую алкоксигруппу (которая может быть замещена атомами галогена) или фенильную группу;
n = 0, 1, 2,
Het B - производные оксима циклической структуры, выраженной следующими формулами:



где Y - низшая алкильная группа.

Комментарии